Изобретение относится к медицине, а именно к травматологии и ортопедии, и может быть использовано при закрытии дефекта плоских и трубчатых костей.
Исторически предпочтение закрытию дефекта в кости отдавалось его пломбировке. По данным Т.Я. Арьева и Г.Д. Никитина (1955), первоначально хирурги использовали вещества, которые были абсолютно чужеродные для организма: йодоформ (Moseting-Moorhof, 1880); губки (Hamilton, 1881); салициловую кислоту (Schmidt, 1882); медную амальгаму (Maier, 1893); гипс (Deesman, 1893); стекло (Salzer, 1896); свинец (Lesser, 1896); желатин (Schepelman, 1918); вазелин (Orr, 1919); стеклянную вату и древесный уголь (Kummel, 1920); парафин (Silvestrini, 1920); мазь А.В. Вишневского (A.M. Рыжих, 1943) [5]. Кроме этого, применяли: куриный желток [18]; белую глину, азотнокислый и сернокислый висмут, древесные опилки и торф, гуттаперчу, морской песок, Poultry manure (птичий помет), молотый кофе, смесь сахара и хлорамина, столярный клей, расплавленный парафин, азотнокислый и сернокислый висмут, и еще около 50 разновидностей наполнителей [5]. Результаты применения этих материалов, как пломб для закрытия дефекта кости не оправдывали ожидания хирургов и пациентов. Эти пломбы являлись инородными телами в костной полости, а также обладали токсичным действием на живой организм. Поэтому все перечисленные материалы отторгались и вызывали нагноение раны. Однако некоторые вещества нашли свое применение в медицине и в настоящее время.
Современные способы закрытия дефекта кости включают: санацию дефекта кости ультразвуком, антибиотиками и химическими реагентами, например раствор динатриевой соли этилендиаминтетрауксусной кислоты [3, 20, 26, 29, 37]; стимуляцию регенерации кости; введение в полость сложного полимерного состава, основой которого служил полиакрилат («костный цемент») с антибиотиками [39]; применение резорбируемых пломб, обладающих способностью стимулировать остеогенез и оказывать противовоспалительное и противомикробное действие [11]. В состав современных резорбируемых пломб могут входить как неорганические вещества (гидроксиаппатит), так и полимерные органические соединения (полилактид, биоситалл, гидроксиапол) [17]. В некоторые резорбируемые пломбы могут быть добавлены антибиотики или молекулы, способствующие более выраженному остеогенному эффекту, например коллаген [38].
Одним из самых популярных современных биодеградирующих пломб является комбинированный препарат «КоллапАн» в его состав входит гидроксиапатит, коллаген и комплекс антимикробных средств [8]. Особенностью «КоллапАна» является то, что на его поверхности формируется полноценная костная ткань без формирования соединительно-тканных прослоек между его гранулами [18].
Несмотря на многообразие современных способов пломбировки остаточных полостей костей, процент неудовлетворительных результатов при лечении остается достаточно велик: по данным ряда авторов положительный эффект достигается лишь в 55-65% случаев [6].
Современные исследователи сходятся во мнении, что более физиологичным способом замещения остаточных полостей, в сравнении с пломбировкой, является трансплантация, то есть пластика биологическими тканями [1, 5, 7, 16, 19, 21, 23, 24, 40]; костные «гранулы», использование кожи, мышцы кости, крови, кровяных сгустков и другие замещающие субстанции [22, 42].
Для активизации репаративного остеогенеза используют: кальций-фосфатный материала, например препарат КоллапАн - биокомпозиционный материал на основе синтетического гидроксиапатита, коллагена и антибиотика (производится отечественной фирмой «Интермедапатит»); препарат Остим (Ostim) - синтетический гидроксиапатит ультравысокой дисперсности в виде пасты («Osartis», Германия); препарат Хронос (chronOs) - гранулы β-трикальцийфосфатной керамики («Mathys Medical Ltd» Швейцария); препарат Церосорб (Cerosorb) - гранулы β-трикальцийфосфатной керамики («Curasan», Германия) [8, 9, 15, 31, 32, 34, 35].
Близким к предлагаемому способу является техническое решение, суть которого заключается в применении механически измельченного натурального коралла (НК) до размера частиц 300-600 мкм. Стерилизацию коралла выполняют γ облучением в дозе 25 КГр. Оценку острой цитотоксичности и матриксных свойств поверхности НК проверяют на культуре иммортализованных нормальных фибробластов человека (ФЧ). Для этого за сутки до начала опыта in vitro частицы НК помещают в 96 луночные культуральные планшеты и для насыщения заливают полной ростовой средой (ПРС) следующего состава: среда ДМЕМ («ПанЭко» Россия), 10% эмбриональная телячья сыворотка («HyClone», США), глютамин (292 мг/л), гентамицин (50 мг/л) («ПанЭко» Россия). Затем среду с образцами НК (опыт) декантурируют и вносят суспензию ФЧ в объеме 200 мкл ПРС (плотность посева 70 тыс. клеток на лунку). Контролем служит культура ФЧ на полистирене (культуральный пластик). Культивирование осуществляют при 37°C и атмосфере влажного воздуха, содержащего 5% CO2. Смену ПРС в планшетах осуществляют дважды в неделю [33].
Цитотоксичность НК определяют через 24 ч. Матриксные свойства кораллов оценивают в динамике культивирования на них клеток 3, 7 и 14 сут. Жизнеспособность ФЧ на этапах экспериментов оценивают с помощью МТТ-теста [41], для чего рассчитывают пул жизнеспособных клеток (ПЖК) в каждый конкретный срок по оптической плотности раствора формазана, в сравнении с контролем.
Для исследования биосовместимости образцов НК в экспериментах in vivo используют модель подкожной трансплантации. Для этого крысам-самкам линии Wistar весом 180-200 г - под наркозом делают кожный надрез в области грудного отдела позвоночника и в образованный «карман» имплантируют образец НК весом 120 мг. Рану закрывают узловатыми швами. Животных выводят из эксперимента через 3, 6, 9 и 12 недель. Проводят визуальную и гистологическую оценку (окраска гематоксилином и эозином) фрагмента ткани с НК.
Исследования in vivo остеозамещающих потенций НК проводят на дефекте после краевой резекции большеберцовой кости. У крыс на границе верхней и средней трети кости голени с помощью бора формируют «окончатый дефект» (длина 6-8 мм, ширина 1,5-2 мм, глубина 2,5-3 мм) до нижнего кортикального слоя. Область дефекта заполняют стерильными частицами НК. Операционную рану послойно ушивают. Для проведения морфологических исследований зоны дефекта животных выводят из эксперимента через 3, 6, 9 и 12 нед. (по 2 животных в каждый срок), производят гистологические исследования [33].
На микропрепаратах из периферической части этой зоны выявляли почти полное замещение вещества НК компактной костной тканью с формированием органотипических структур (остеонов). В отдельных полях зрения между остеонами были остатки вещества коралла, зоны скопления остеобластов, активная неоваскуляризация. В центре некоторых остеонов определяли полости с жировой тканью и цепочки остеобластов по периферии полости, по мнению авторов, с зачатками костномозгового матрикса. Авторы полагали, что данные эксперимента при краевой резекции большеберцовой кости крысы при закрытии костного дефекта имплантатом на основе натурального коралла свидетельствуют о выраженных остеорепаративных потенциях скелета коралла из семейства Acropridae [33].
К недостаткам известного технического решения [33] можно отнести: долгосрочность и сложность подготовки коралла для закрытия дефекта в кости, требующей специального дорогостоящего оборудования и реагентов для подготовки пломбировочной массы к имплантации; применение культуры иммортализованных нормальных фибробластов человека, что вызвало необходимость контроля НК на биосовместимость; опасность аллергической реакции на применяемую культуру иммортализованных нормальных фибробластов человека; повышение риска инфекционных осложнений связанного с многочисленными манипуляциями при подготовке коралла к имплантации. Выявленные пустоты на гистологических препаратах, по мнению заявителей предполагаемого изобретения, могло быть связано с большим объемом коралловых грану. Что может являться существенным недостатком прототипа.
Задачей предлагаемого технического решения было: устранение недостатков прототипа путем упрощения методики приготовления пломбировочной массы для закрытия дефекта кости; исключение необходимости выполнять контроль на биосовместимость применяемой пломбировочной массы; сокращение времени ее приготовления к имплантации; повышение качества антибактериальной защиты; исключение использования специального дорогостоящего оборудования и реагентов для приготовления пломбировочной массы к имплантации; определение оптимального размера коралловых гранул для качественного остеорепаративного процесса.
На фиг. 1-10 показана аргументация основных позиций технического решения:
на фиг. 1 - схема желатиновой капсулы с перфорированной стенкой;
на фиг. 2 - вид раны после имплантации желатиновой капсулы с измельченным кораллом семейства Acropridae, пропитанным аутокровью;
на фиг. 3 - 14-е сутки инкубации пломбировочной массы в тканях животного: вид и размеры извлеченного имплантата;
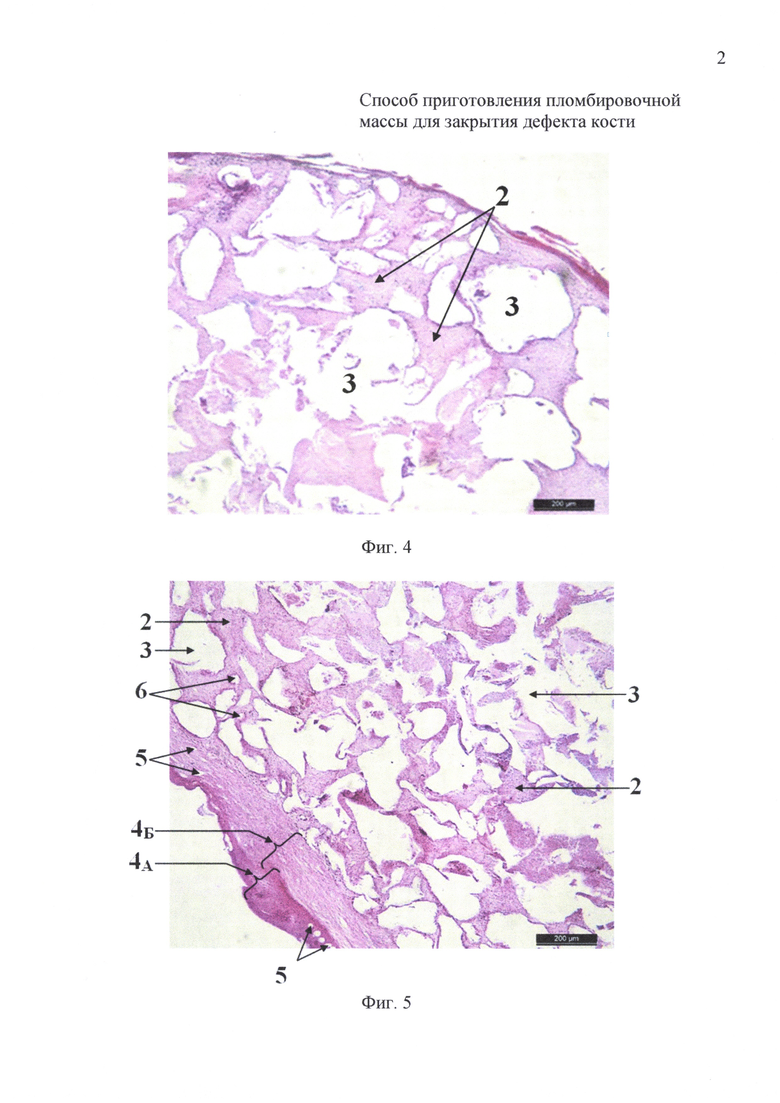
на фиг. 4 - 7-е сутки инкубации: гистологический препарат имплантата на основе измельченного коралла с размером гранул 200-320 мкм и крупнее;
на фиг. 5 - 7-е сутки инкубации: гистологический препарат имплантата на основе измельченного коралла с размером гранул менее 145 мкм;
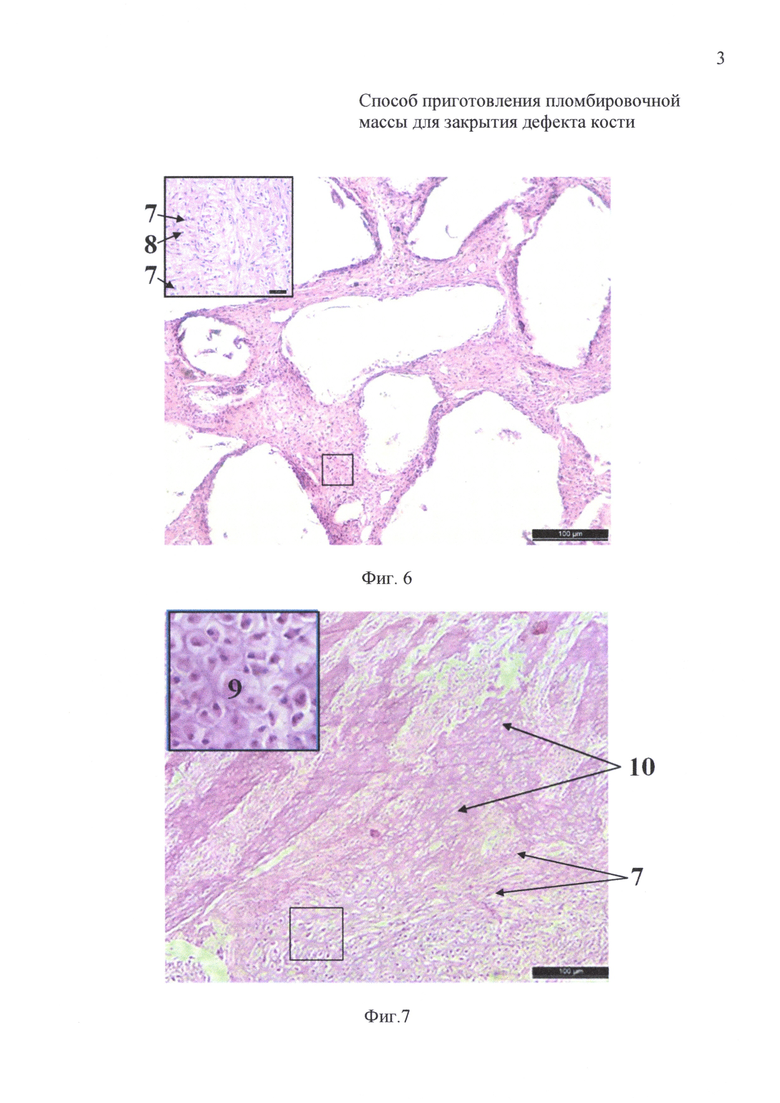
на фиг. 6 - 14-е сутки инкубации: гистологический препарат имплантата на основе измельченного коралла с размером гранул 200-320 мкм и крупнее;
на фиг. 7 - 14-е сутки инкубации: гистологический препарат имплантата на основе измельченного коралла с размером гранул менее 145 мкм;
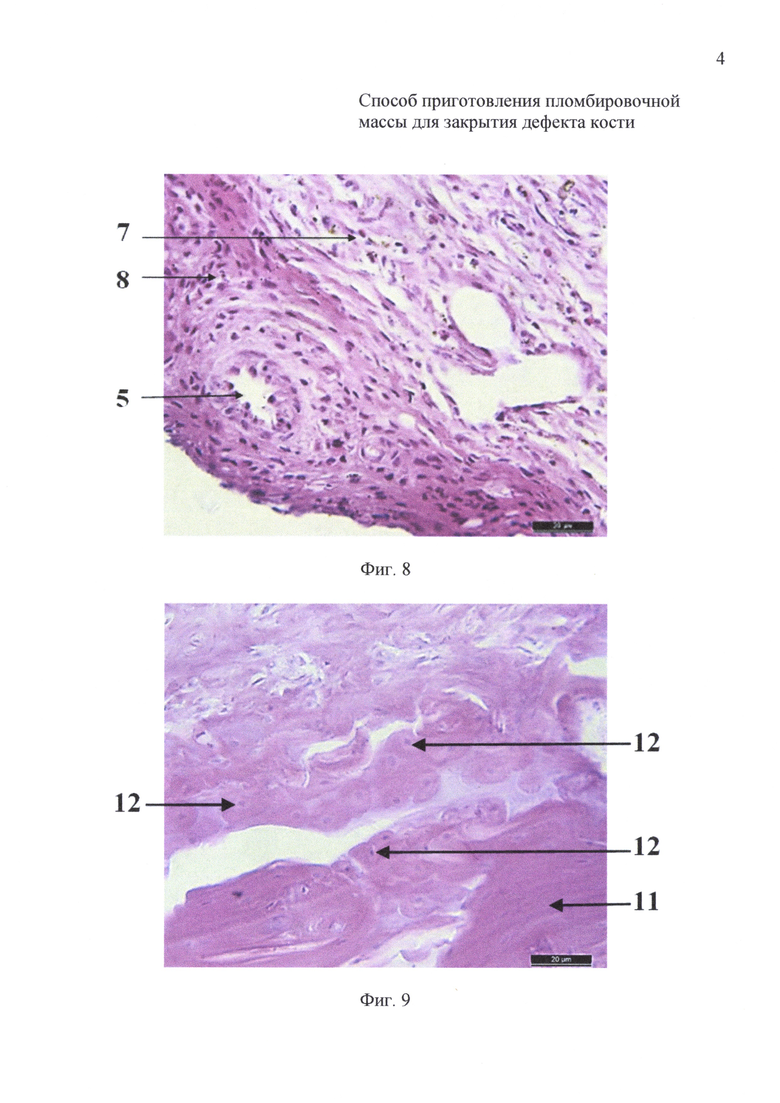
на фиг. 8 - 21-е сутки инкубации: гистологический препарат имплантата на основе измельченного коралла с размером гранул 200-320 мкм и крупнее;
на фиг. 9 - 21-е сутки инкубации: гистологический препарат имплантата на основе измельченного коралла с размером гранул менее 145 мкм;
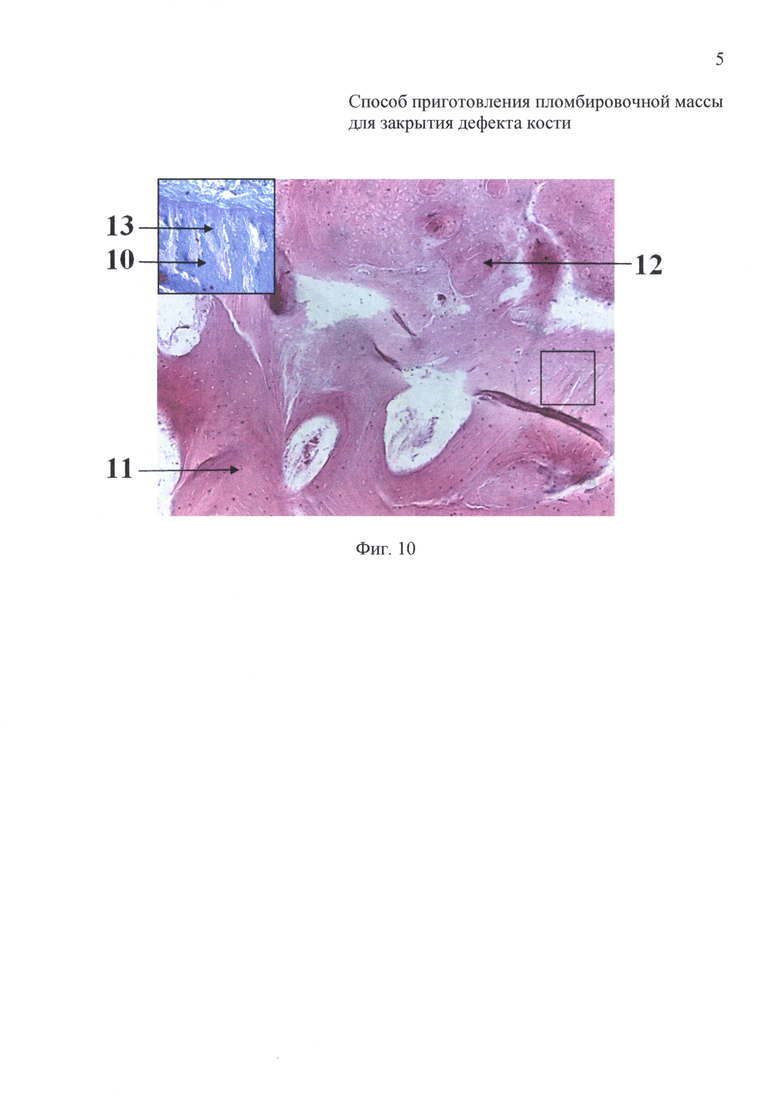
на фиг. 10 - 14-е сутки после закрытия дефекта кости пломбировочной массой: гистологический препарат кости в проекции дефекта.
Для определения оптимального размера коралловых гранул проводили эксперименты на беспородных крысах-самцах с массой 300-340 г, которые были разделены на две группы. На животных первой группы апробировали измельченный коралл с размером гранул 200-320 мкм и крупнее. На животных второй группы апробировали измельченный коралл с размером гранул не более 145 мкм. Порции измельченного коралла помещали в желатиновые капсулы с перфорированной стенкой (фиг. 1), имеющей 4 отверстия на 1 мм2 с диаметром до 0,1 мм. Капсулы с соблюдением правил асептики и антисептики на две трети их объема заполняли коралловой крошкой. Затем из хвостовой вены животных брали кровь, которой заливали коралловую крошку до полного заполнения желатиновой капсулы. Каждому животному под общим обезболиванием под кожу в области грудного отдела позвоночника имплантировали капсулу с измельченным кораллом, обработанным аутокровью. Кожную рану закрывали узловатыми швами (1) наглухо (фиг. 2). Кожный шов обрабатывали жидким антисептиком.
Имплантаты извлекали у четырех крыс из каждой группы на 7, 14 и 21 сутки инкубации. У извлеченного имплантата желатиновая капсула в процессе инкубации рассасывалась и была замещена плотным тканевым формированием с размерами больше, чем была желатиновая капсула (фиг. 3). Имплантат фиксировали в 10% кислом формалине, заключали в парафин и изготовляли серийные срезы толщиной 12-15 мкм. Срезы окрашивали гематоксилином и эозином. Гистологические препараты описывали под микроскопом Leica DM2500 с цифровой обработкой изображения.
На 7-е сутки инкубации в имплантатах животных первой (фиг. 4) и второй (фиг. 5) групп определяли развитие стромы из рыхлой волокнистой соединительной ткани (2) от периферии к центру препарата, которая окружала пустоты (3), оставшиеся от гранул декальцинированного коралла. Размеры пустот от измельченного коралла с размером гранул менее 145 мкм были значительно меньше, чем от гранул с размером 200-320 мкм и крупнее. Кроме этого, у животных второй группы (фиг. 5) имплантат имел капсулу, состоящей из компактной (4А) и рыхлой (4Б) соединительной ткани толщиной 88,86-136,03 мкм, которая была пронизана многочисленными кровеносными сосудами (5), диаметр которых колебался в пределах 21,98-34,92 мкм. В строме из рыхлой волокнистой соединительной ткани (2) проходили единичные стромальные кровеносные сосуды (6), которые были ориентированы ближе к соединительнотканной капсуле (фиг. 5).
После 14-суточной инкубации на гистологических препаратах имплантатов животных первой группы (фиг. 6) выявлено обилие фибробластов (7) и лимфоцитов (8). На гистологических препаратах имплантатов животных второй группы (фиг. 7) по периферии выявлено скопление фибробластов (7), которые окружали крупные очаги формирования хрящеподобной (9) и молодой костной ткани (10).
На 21-е сутки инкубации имплантаты животных первой группы (фиг. 8) были хорошо васкуляризированы, выявлено обилие фибробластов (7) и лимфоцитов (8). На гистологических препаратах имплантатов животных второй группы (фиг. 9) определяли формирование компактной костной ткани (11) с гаверсовыми каналами (12).
Анализ полученных экспериментальных данных дал нам возможность выполнить поставленную задачу путем приготовления пломбировочной массы с применением измельченного коралла семейства Acropridae с размером гранул не более 145 мкм, которым на две трети объема наполняли желатиновую капсулу, а затем вводили аутокровь до полного ее заполнения, причем стенку капсулы предварительно перфорировали отверстиями с диаметром 0,1 мм в количестве 4-х на 1 мм2, а желатин капсулы использовали вместо коллагена, и для завершения процесса приготовления пломбировочной массы желатиновую капсулу с содержимым, с учетом биоэтики [43], правил асептики и антисептики имплантировали под кожу в области грудного отдела позвоночника крысы на 14-ть суток.
С целью оценки эффективности применения пломбировочной массы для закрытия дефекта кости, приготовленной по разработанному способу авторами предложенного способа, был поставлен эксперимент. Под общим обезболиванием с соблюдением асептики и антисептики с помощью шаровидной стоматологической фрезы у крыс в средней трети бедренной кости на ее латеральной стороне формировали дефект размером 8×2×2,5 мм (40 мм3). Сформированный дефект кости заполняли приготовленной пломбировочной массой и прикрывали ее прилежащей мышечной тканью. После гемостаза рану послойно закрывали наглухо. Кожный шов обрабатывали жидким антисептиком.
На 14-е сутки после операции животных выводили из эксперимента. При гистологическом исследовании (окраска гематоксилин-эозином и по Маллори) выявлено формирование костной мозоли, по внутренней поверхности которой происходило проникновение в костную ткань бедренной кости молодой костной (10) и фиброзной (13) тканей. Матрикс костной мозоли был представлен компактной костной тканью (11), имеющей остеоны с кровеносными сосудами, проходящими в гаверсовых каналах (12) (фиг. 10).
Положительный эффект при применении способа заключался: в исключении необходимости выполнять контроль на биосовместимость в связи с применением аутокрови; в сокращении времени и упрощении методики приготовления пломбировочной массы к имплантации, что повысило качество антибактериальной защиты; в том, что не использовалось специальное дорогостоящее оборудование и реагенты для приготовления пломбировочной массы; в формировании костной мозоли уже на 14-е сутки после операции.
Список использованной литературы
1. Агафонов, И.А. Пластика кровоснабжаемыми тканями при лечении хронического остеомиелита: автореф. дис. … канд. мед. наук: 14.00.22 / Агафонов И.А. - Л., 1971. - 26 с.
2. Авторское свидетельство СССР 602179, А61Н 9/00, опубл. 15.04.1974.
3. Авторское свидетельство СССР 1122323, А61К 31/71, опубл. 07.11.84.
4. Авторское свидетельство СССР 1503775, МПК: А61В 17/56, опубл. 30.08.89.
5. Арьев, Т.Я. Мышечная пластика костных полостей / Т.Я. Арьев, Г.Д. Никитин. - М.: Медгиз, 1955. - 175 с.
6. Батаков, В.Е. Применение плазменного аутофибронектина в комплексном лечении хронического остеомиелита: дис. … канд. мед. наук / В.Е. Батаков - Самара, 2010. - 139 с.
7. Барабаш, А.А. Свободная костная пластика в дистракционный регенерат при ортопедической патологии (экспериментально-клиническое исследование): автореф. дис. … канд. мед. наук. - Новосибирск, 1998. - 19 с.
8. Берченко Г.Н., Кесян Г.А. Уразгильдеев Р.З., Арсеньев ИГ., Микелаишвили Д.С. Сравнительное экспериментально-морфологическое исследование влияния некоторых используемых в травматолого-ортопедической практике кальций-фосфатных материалов на активизацию репаративного остеогенеза // Бюллетень Восточно-Сибирского научного центра Сибирского отделения РАМН. - 2006. - №4(50). - 327-333.
9. Бушуев О.М. Использование Коллапана в комплексном лечении хронического остеомиелита: автореф. дис. … канд. мед. наук. - Москва, 1999. - 21 с.
10. Гурин А.В. Роль монооксида азота в центральных механизмах регуляции температуры тела: автореф. дисс. на соиск. уч. степ к.б.н. - Москва, 1995. - 22 с.
11. Глухов А.А., Алексеева Н.Т., Микулич Е.В. Экспериментальное обоснование применения струйной санации и тромбоцитарного концентрата в лечении хронического остеомиелита длинных трубчатых костей // Вестник экспериментальной и клинической хирургии. - 2012. - Т. 5, №1. - С. 131-136.
12. Двужильная Е.Д., Южаков С.Ф. Применение вакуум-терапии при гнойных воспалительных процессах // Клиническая хирургия. - 1967. - №5. С. 32.
13. Ефименко Н.А., Хрупкий В.И., Марахонич Л.А. и др. Воздушно-плазменные потоки и NO-терапия - новая технология в клинической практике военных лечебно-профилактических учреждений // Военно-мед. журнал. - 2005. - №5. - С. 51-54.
14. Исаков Ю.Ф., Долецкий С.Я. Детская хирургия. - М.: Медицина, 1971. - С. 148.
15. Кесян Г.А., Берченко Г.Н., Уразгильдеев Р.З. и др. Сочетанное применение обогащенной тромбоцитами аутоплазмы и биокомпозиционного материала коллапан в комплексном лечении больных с длительно не срастающимися переломами и ложными суставами длинных костей конечностей // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2011, №2. - С. 26-32.
16. Козлов, И.В. Пластическое замещение остеомиелитических дефектов голени и стопы лоскутами с осевым типом кровоснабжения: клинико-анатомическое исследование: автореф. дис. … канд. мед. наук / И.В. Козлов. - СПб., 2008. - 22 с.
17. Котельников Г.П., Сонис А.Г. Влияние гравитационной терапии на репаративный остеогенез у пациентов с остеомиелитом нижних конечностей // Саратовский научно-медицинский журнал. - 2010. - Т. 6. - №3. - С. 695-700.
18. Кузнецов Н.А., Никитин В.Г., Телешова Е.Б., Мильчаков А.А. Антисептики и биодеградирующие импланты в лечении хронического послеоперационного остеомиелита // Хирургия. - 2009. - №5. - С. 31-35.
19. Лубегина, З.П., Штин В.П. Взаимоотношение сосудов остеомиелитической полости и пересаженной мышцы после некрэктомии в эксперименте // Ортопедия, травматология и протезирование. - 1976. - №6. - С. 76-77.
20. Машковский М.Д. Лекарственные средства: Изд. 12-е. - М.: Медицина, 1993. - Т. 2. - С. 227-228.
21. Мельникова, А.В. Замещение клетками пуповинной крови костных полостей экспериментального остеомиелита: экспериментальное исследование: автореф. дис. … канд. мед. наук. - Уфа, 2009. - 21 с.
22. Микулич Е.В. Современные принципы лечения хронического остеомиелита // Вестник новых медицинских технологий - 2012. - Т. XIX, №2 - С. 180-184.
23. Никитин Г.Д., Рак А.В., Линник С.А., Николаев В.Ф., Никитин Д.Г. / Костная мышечно-костная пластика при лечении хронического остеомиелита и гнойных ложных суставов. - СПб: Издательство «ЛИГ», 2002, 185 с. (93-94).
24. Никитин, Г.Д., Рак А.В., Линник С.А. и др. Хирургическое лечение остеомиелита. - СПб: Русская графика, 2000. - 288 с. (90-94).
25. NO терапия: теоретические аспекты, клинический опыт и проблемы применения экзогенного оксида азота в медицине", под ред. Грачева С.В., Шехтера А.Б., Козлова Н.П. - М.: Издательский дом «Русский врач», 2001. - С. 122-124.
26. Охотский В.П. Активное дренирование в лечении больных с хроническим посттравматическим остеомиелитом длинных трубчатых костей // Первый Белорусский международный конгресс хирургов. - Витебск, 1996. - С. 81-82.
27. Патент SU 1140767, А61В 17/56, опубл. 23.02.1985.
28. Патент RU 2221573, A61K 33/08, А61М 25/00, А61Р 19/08, опубл. 20.01.2004.
29. Патент RU 2222324, A61K 31/198, A61N 7/00, А61Р 19/08, опубл. 27.01.2004.
30. Патент RU 2288665, А61В 17/56, опубл. 10.12.2006.
31. Патент RU 2356508, А61В 17/56, опубл. 27.05.2009.
32. Рак А.В. Оперативное лечение ложных суставов длинных трубчатых костей: автореферат дис. на соискание ученой степени кандидата медицинских наук. - Ленинград, 1974. - 17 с.
33. Свиридова И.К., Сергеева Н.С., Франк Г.А., Тепляков В.В., Кирсанова В.А., Ахмедова С.А., Мыслевцов И.В., Шанский Я.Д. Скелет натуральных кораллов сем. Acropora в замещении дефекта костной ткани у мелких и крупных лабораторных животных // Клеточная травматология и тканевая инженерия. - 2010. - Т. 5, №4. - С. 43-48.
34. Терновой К.С., Прокопова Л.В., Алексюк К.П. Лечение остеомиелита у детей. - Киев: Здоровье, 1979. - С. 131-132.
35. Уразгильдеев З.И., Бушуев О.М., Берченко Г.Н. Применение Коллапана для пластики остеомиелитических дефектов костей // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 1998. - №2. - С. 31-35.
36. Хронический остеомиелит. Сборник научных трудов / под ред. проф. Г.Д. Никитина // Труды ЛСГМИ. - Ленинград, 1982. - 134 с. (30 и 79).
37. Cameron J.A. The choice of irrigant during hand instrumentation and ultrasonic irrigation of the root canal: a scanning electron microscope study. // Austral. Dental. Jorn. - 1995. - Vol. 40 (2). - P. 85-90.
38. Carpenter, J., Khang T.J., Webster D. Nanometer polymer surface features: the influence on surface energy, protein adsorption and endothelial cell adhesion // Nanotechnology. - 2008. - Vol. 19 (50). - P. 505-508.
39. Sealy P.I. et al. Delivery of antifungal agents using bioactive and non-bioactive bone cements // Annual of pharmacotherapy. - 2009. - Vol. 43. - P. 1606-1615.
40. Me GRow J.B. et all. Atlas of muscle a musculocuteon fons flaps norflok, - Hampton Press, 1986. - 485 p.
41. Mossman T.J. Rapid colorivetric, assay for cellular growth and cytotoxity assays // Immunol. Methods. - 1983. - Vol. 65. - P. 55-63.
42. Parsons, В., Straus E. Surgical management of chronic osteomyelitis // Am. J. Surg. - 2004. - Vol. 188 Suppl. - P. 57-66.
43. European convention for the protection of vertebral animals used for experimental and other scientific purpose: Council of Europe 18.03.1986. - Strasbourg, 1986. - 52 p.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЗАКРЫТИЯ ДЕФЕКТА В КОСТИ | 2017 |
|
RU2644828C1 |
| БИОМАТЕРИАЛ ДЛЯ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ | 2011 |
|
RU2472516C1 |
| Устройство вакуумного шприц-контейнера | 2020 |
|
RU2750360C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО РЕЦИДИВИРУЮЩЕГО ОСТЕОМИЕЛИТА ДЛИННЫХ КОСТЕЙ С ПРИМЕНЕНИЕМ КОЛЛАПАНА | 1998 |
|
RU2155552C2 |
| БИОСОВМЕСТИМАЯ КОМПОЗИЦИЯ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ И СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОЙ КОМПОЗИЦИИ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ | 2008 |
|
RU2385727C1 |
| Порошкообразная лекарственная форма для ускорения купирования остеомиелита, содержащая хлорид рубидия | 2018 |
|
RU2668692C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСКОЛЬЧАТЫХ ПЕРЕЛОМОВ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ | 2003 |
|
RU2253393C1 |
| КОМПОЗИЦИЯ - ОСТЕОИНДУКТОР И ОСТЕОКОНДУКТОР, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ, И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ - ОСТЕОИНДУКТОРА И ОСТЕОКОНДУКТОРА, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ | 2008 |
|
RU2383564C1 |
| ХИРУРГИЧЕСКИЙ МАТЕРИАЛ (ВАРИАНТЫ) | 2010 |
|
RU2433836C1 |
| Состав для лечения хронического остеомиелита | 2022 |
|
RU2780114C1 |

Изобретение относится к медицине, а именно к травматологии и ортопедии, и может быть использовано при закрытии дефекта плоских и трубчатых костей. Способ приготовления пломбировочной массы для закрытия дефекта кости у крысы в эксперименте включает измельчение коралла семейства Acropridae до размера гранул не более 145 мкм, которым на две трети объема наполняют желатиновую капсулу, затем капсулу заполняют аутокровью до полного ее объема, причем стенку капсулы предварительно перфорируют отверстиями с диаметром 0,1 мм в количестве 4-х на 1 мм2, далее капсулу имплантируют под кожу крысы в области грудного отдела позвоночника на 14-ть суток, затем извлекают пломбировочную массу и применяют для закрытия дефекта кости. Изобретение обеспечивает исключение необходимости выполнять контроль на биосовместимость в связи с применением аутокрови; сокращение времени и упрощение методики приготовления пломбировочной массы к имплантации, что повышает качество антибактериальной защиты; и в том, что не используется специальное дорогостоящее оборудование и реагенты для приготовления пломбировочной массы к имплантации; а также в формировании костной мозоли уже на 14-е сутки после операции. 10 ил.
Способ приготовления пломбировочной массы для закрытия дефекта кости у крысы в эксперименте, включающий измельчение коралла семейства Acropridae до размера гранул не более 145 мкм, которым на две трети объема наполняют желатиновую капсулу, затем капсулу заполняют аутокровью до полного ее объема, причем стенку капсулы предварительно перфорируют отверстиями с диаметром 0,1 мм в количестве 4-х на 1 мм2, далее капсулу имплантируют под кожу крысы в области грудного отдела позвоночника на 14-ть суток, затем извлекают пломбировочную массу и применяют для закрытия дефекта кости.
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИОННОГО МАТЕРИАЛА ДЛЯ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ С ИСПОЛЬЗОВАНИЕМ ГИДРОЛИТИЧЕСКОЙ КОНВЕРСИИ | 2015 |
|
RU2599022C1 |
| БИОМАТЕРИАЛ ДЛЯ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ | 2011 |
|
RU2472516C1 |
| WO 9426283 A1, 24.11.1994 | |||
| WO 2009066283 A2, 28.05.2009 | |||
| US 20150147397 A1, 28.05.2015 | |||
| СВИРИДОВА И.К | |||
| и др | |||
| Скелет натуральных кораллов сем | |||
| Acropora в замещении дефекта костной ткани у мелких и крупных лабораторных животных | |||
| Клеточная трансплантология и тканевая инженерия, 2010, т | |||
| V, N4, 2010, с | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| MANASSERO M et al | |||
| Bone regeneration in sheep using acropora coral, a natural resorbable scaffold, and autologous mesenchymal stem cells | |||
| Tissue Engineering Part A, Vol | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Насос | 1917 |
|
SU13A1 |
| Прибор для производства умножения и деления | 1924 |
|
SU1554A1 |
Авторы
Даты
2018-12-29—Публикация
2017-10-12—Подача