ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к рекомбинантному микроорганизму, полезному для продукции L-метионина и/или его производных и к способу получения L-метионина. Микроорганизм по изобретению модифицируют таким образом, что выход метионина/источник углерода увеличивается путем объединения ослабления системы поглощения L-метионина со сверхэкспрессией специфичной системы экспорта. В частности, в рекомбинатном микроорганизме подвергается делеции оперон metNIQ и сверхэкспрессируются гены ygaZ и ygaH или гомологичные им гены.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Серосодержащие соединения, такие как цистеин, гомоцистеин, метионин или S-аденозилметионин, являются критически важными для клеточного метаболизма. В частности, L-метионин, незаменимая аминокислота, которая не может синтезироваться животными, играет важную роль во многих функциях организма. Большую часть промышленно произведенного метионина широко используют в качестве корма животных и пищевой добавки.
С уменьшением применения белков животного происхождения в результате BSE (губкообразная энцефалопатия крупного рогатого скота) и птичьего гриппа увеличилась потребность в чистом метионине. Обычно D,L-метионин производится химически из акролеина, метилмеркаптана и гидроцианида. Однако данная рацемическая смесь не работает так же хорошо, как чистый L-метионин (Saunderson, 1985). Кроме того, хотя чистый L-метионин и может быть получен из рацемического метионина, например, посредством ацилазной обработки N-ацетил-D,L-метионина, это кардинально увеличивает себестоимость. Соответственно, возрастающая потребность в чистом L-метионине в сочетании с заботой об окружающей среде делают микробную продукцию метионина привлекательной перспективой.
Другие важные аминокислоты, такие как лизин, треонин и триптофан, производятся посредством ферментации для применения в корме животных. Следовательно, данные аминокислоты можно получать с использованием глюкозы и других возобновляемых ресурсов в качестве исходных веществ. Промышленное производство L-метионина посредством фементации еще не было успешным, но разработка данной технологии продолжается.
Ранее были описаны разные подходы для оптимизации получения L-метионина в микроорганизмах (см., например, патенты или патентные заявки US 7790424, US 7611873, WO 2002/10209, WO 2005/059093 и WO 2006/008097); однако, для промышленного производства L-метионина из микроорганизмов требуются дальнейшие улучшения.
При синтезе L-метионина на определенном или более высоком уровне он ингибирует его собственную дальнейшую продукцию посредством петли обратной связи и нарушает физиологию клетки. Следовательно, одним из данных улучшений является уменьшение накопления L-метионина в микроорганизме для обеспечения эффективной продукции путем уменьшения способности к импорту L-метионина микроорганизма при усилении, в то же самое время, оттока L-метионина в рекомбинантном сверхпродуценте L-метионина.
Ранние биохимические и кинетические исследования продемонстрировали то, что поглощение метионина в Escherichia coli включает по меньшей мере два специфичных транспортера: транспортную систему высокой аффинности MetD и низкой аффинности - MetP (Jones & George, 1999; Kadner, 1974). Обе регулируются размером внутреннего пула метионина, и для MetD было сделано заключение о репрессии, опосредованной MetJ (Kadner, 1975; Kadner & Winkler, 1975). Система поглощения метионина MetD была охарактеризована в качестве ABC транспортера. В 2002 году Merlin et al сообщали о том, что metD - локус, кодирующий систему поглощения метионина, составляют гены abc, yaeC и yaeE. Они предложили переименовать abc, yaeE и yaeC в metN, metI и metQ соответственно.
Экспорт метионина в Escherichia coli опосредован комплексом YgaZH, а в Corynebacterium glutamicum - гомологичным комплексом BrnFE ( et al., 2005). YgaZ представляет собой члена семейства экспортера аминокислот с разветвленной цепью (LIV-E), ответственного за экспорт L-валина и L-метионина. YgaZ образует комплекс с YgaH, прогнозируемым белком внутренней мембраны, для экспорта аминокислот при условиях, в которых их уровни были бы токсичными для клетки.
et al., 2005). YgaZ представляет собой члена семейства экспортера аминокислот с разветвленной цепью (LIV-E), ответственного за экспорт L-валина и L-метионина. YgaZ образует комплекс с YgaH, прогнозируемым белком внутренней мембраны, для экспорта аминокислот при условиях, в которых их уровни были бы токсичными для клетки.
Патентные заявки WO 2002/097096 и WO 2005/085463 относятся к уменьшению поглощения L-метионина в Corynebacterium путем ослабления системы поглощения метионина MetD2, особенно посредством делеции одного или более чем одного из генов yaeC, abc и yaeE. У Corynebacterium ослабление системы поглощения метионина MetD2 приводит к улучшенной продукции метионина. Гомологичная MetD система поглощения метионина, кодируемая генами metN, metI и metQ, также была охарактеризована в Escherichia coli (Jones & George, 1999; Kadner 1974, Merlin et al., 2002). В патентной заявке WO 2008/127240 раскрыто то, что в Escherichia coli, так же как и в Corynebacterium, продукция метионина усиливается при ослаблении системы поглощения метионина MetD.
В патентных заявках ЕР 1239041 и WO 2008/082211 описана сверхэкспрессия экспортера аминокислот с разветвленной цепью (YgaZH), ответственного за экспорт L-валина и L-метионина в Escherichia coli. Данная сверхэкспрессия приводит к улучшенной продукции метионина в Е. coli.
 et al. сверхэкспрессировали в Corynebacterium glutamicum гены brnF и brnE, кодирующие экспортер метионина BrnFE, и, в то же самое время, подвергали делеции систему metD (
et al. сверхэкспрессировали в Corynebacterium glutamicum гены brnF и brnE, кодирующие экспортер метионина BrnFE, и, в то же самое время, подвергали делеции систему metD ( et al., 2005). Тем не менее, не было опубликовано какого-либо доказательства влияния данных модификаций на продукцию метионина ни в Corynebacterium glutamicum, ни в Escherichia coli.
et al., 2005). Тем не менее, не было опубликовано какого-либо доказательства влияния данных модификаций на продукцию метионина ни в Corynebacterium glutamicum, ни в Escherichia coli.
В отличие от предшествующего уровня техники по C. glutamicum и по Е. coli, авторы данного изобретения показали то, что делеция только metD в Е. coli (достигаемая либо делецией одного гена из оперона metNIQ, либо делецией всего опрерона, причем делеция любого одного гена данного оперона приводит к устранению высокоаффинного поглощения метионина) является недостаточной для улучшения эффективности продукции метионина. Эта модификация должна быть объединена со сверхэкспрессией системы экспорта L-метионина.
Тогда это является первым разом, когда показано, что комбинация делеции системы поглощения L-метионина со сверхэкспрессией экспорта L-метионина является полезной для продукции метионина.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТНИЯ
Изобретение относится к рекомбинантному штамму Escherichia coli и способу оптимизации продукции метионина и/или его производных, где ослаблен импорт метионина и усилен отток метионина. В данном рекомбинантном микроорганизме импорт метионина ослаблен посредством ослабления экспрессии или делеции по меньшей мере одного гена, выбранного среди metN, metI или metQ, тогда как отток метионина усилен посредством сверхэкспрессии генов ygaZH или гомологичных им генов.
Рекомбинантный микроорганизм также может содержать другие генетические модификации, такие как:
- повышенная экспрессия по меньшей мере одного из следующих генов: ptsG, pyc, pntAB, cysP, cysU, cysW, cysA, cysM, cysJ, cysI, cysH, gcvT, gcvH, gcvP, lpd, serA, serB, serC, cysE, metF, metH, fldA, fpr, metA, аллель metA*, кодирующий фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи, thrA или аллель thrA*, кодирующий фермент с ослабленным ингибированием треонином по механизму обратной связи и/или
- ослабленная экспрессия одного из следующих генов: metJ, pykA, pykF, purU, ybdL, udhA, dgsA, metE или yncA.
В конкретном воплощении настоящее изобретение относится к рекомбинатному микроорганизму, в котором: а) подвергаются делеции гены metN, metI и metQ, в то время как сверхэкспрессируются гены ygaZ и ygaH или гомологичные им гены, происходящие из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii и б) усилена экспрессия генов metA* metH, cysPUWAM, cysJIH, gcvTHP, metF, serA, serB, serC, cysE, thrA* и pyc; и в) ослаблена экспрессия генов metJ, pykA, pykF, purU, ybdL, yncA, dgsA, metE и udhA.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед подробным описанием настоящего изобретения следует понимать, что данное изобретение не ограничивается способами, конкретно проиллюстрированными примерами, и, естественно, они могут варьировать. Также следует понимать, что терминология, используемая в данном документе, служит лишь для цели описания конкретных воплощений изобретения, и они не предназначены для того, чтобы быть ограничивающими, причем изобретение будет ограничиваться только приложенной формулой изобретения.
Все публикации, патенты и патентные заявки, процитированные в данном документе, выше или ниже, являются тем самым включенными посредством ссылки во всей их полноте.
Кроме того, в воплощении настоящего изобретения на практике, если не указано иное, используются традиционные микробиологические и молекулярно-биологические методики, находящиеся в пределах квалификации в данной области. Такие методики хорошо известны квалифицированному сотруднику и полностью объясняются в литературе.
Следует отметить то, что формы единственного числа в том виде, в котором они используются в данном документе и в приложенной формуле изобретения, включают ссылку на множественное число, если контекст явно не диктует иное. Таким образом, например, ссылка на «микроорганизм» включает множество таких микроорганизмов, и ссылка на «эндогенный ген» представляет собой ссылку на один или более чем один эндогенный ген и так далее. Если не определено иначе, все использованные в данном документе технические и научные термины имеют такие значения, которые обычно понятны обычному специалисту в области, к которой принадлежит данное изобретение. Несмотря на то, что в воплощении на практике или в тестировании настоящего изобретения можно использовать любые материалы и методы, аналогичные или эквивалентные описанным в данном документе, сейчас описаны предпочтительные материалы и методы.
В формуле изобретения, которая следует далее, и в последующем описании изобретения, за исключением тех случаев, когда контекст требует иного из-за прямой формулировки или необходимого подтекста, слово «вмещать», «содержать» или «включать» или вариации, такие как «вмещает», «вмещающий», «содержащий», «включенный», «включает», «включающий», используются во включительном смысле, т.е. для определения присутствия утверждаемых характеристик, но не для исключения присутствия или добавления дополнительных характеристик в разных воплощениях изобретения.
Термин «метионин» и «L-метионин» обозначает незаменимую серосодержащую аминокислоту с химической формулой HO2CCH(NH2)CH2CH2SCH3 и номером CAS 59-51-8 или 63-68-3 для специфического L-изомера.
Фраза «производные метионина» относится к молекулам-аналогам метионина, которые имеют такой же химический остов, но отличаются от метионина по меньшей мере одной химической группой. В данном изобретении предпочтительными производными метионина являются N-ацетилметионин (NAM), S-аденозилметионин (SAM) и гидрокси-метионин (или гидрокси аналог метионина, или МНА).
Термин «микроорганизм» в том виде, как он используется в данном документе, относится к бактерии, дрожжам или грибку, которые не являются искусственно модифицированными. Предпочтительно микроорганизм выбран среди Enterobacteriaceae, Bacillaceae, Streptomycetaceae и Corynebacteriaceae. Более предпочтительно микроорганизм представляет собой вид Escherichia, Klebsiella, Pantoea, Salmonella или Corynebacterium. Даже более предпочтительно микроорганизм по изобретению представляет собой либо вид Escherichia coli, либо Corynebacterium glutamicum.
Термин «рекомбинантный микроорганизм» или «генетически модифицированный микроорганизм» в том виде, как он здесь используется, относится к бактерии, дрожжам или грибку, который не встречается в природе и является генетически отличным от его эквивалента, обнаруженного в природе. Это означает то, что он модифицирован либо путем введения, либо делеции, либо модификации генетических элементов. Он также может быть трансформирован путем принуждения к развитию и эволюции новых метаболических путей путем объединения прямого мутагенеза и эволюции под специфичным давлением отбора (см., например, WO 2004/076659 или WO 2007/011939).
Микроорганизм может быть модифицирован для экспрессии экзогенных генов, если данные гены вводятся в микроорганизм со всеми элементами, обеспечивающими их экспрессию в микроорганизме-хозяине. Модификация или «трансформация» микроорганизмов экзогенной ДНК представляет собой рутинную задачу для специалистов в данной области.
Микроорганизм может быть модифицирован для модуляции уровня экспрессии эндогенного гена.
Термин «эндогенный ген» означает то, что ген присутствовал в микроорганизме до какой-либо генетической модификации. Эндогенные гены могут сверхэкспрессироваться путем введения гетерологичных последовательностей, помимо или для того, чтобы заменять эндогенные регуляторные элементы, или путем введения одной или более чем одной дополнительной копии гена в хромосому или плазмиду. Эндогенные гены также могут быть модифицированы для модуляции их экспрессии и/или активности. Например, в кодирующую последовательность могут быть введены мутации для модификации генного продукта, или могут быть введены гетерологичные последовательности, помимо или для замены эндогенных регуляторных элементов. Модуляция эндогенного гена может приводить к повышающей регуляции и/или усилению активности генного продукта, или, в качестве альтернативы, к понижающей регуляции и/или уменьшению активности эндогенного генного продукта.
Другим способом модуляции их экспрессии является замена эндогенного промотора гена (например, промотора дикого типа) на более сильный или более слабый промотор для повышающей или понижающей регуляции экспрессии эдогенного гена. Данные промоторы могут быть гомологичными или гетерологичными. Выбор подходящих промоторов находится целиком в пределах способностей специалиста в данной области.
Наоборот, термин «экзогенный ген» означает то, что ген был введен в микроорганизм способами, хорошо известными специалисту в данной области, в то время как данный ген не встречается в природе в данном микроорганизме. Экзогенные гены могут быть интегрированы в хромосому хозяина, или экспрессируются внехромосомно плазмидами или векторами. В данной области хорошо известен целый ряд плазмид, которые отличаются в отношении их репликатора и числа их копий в клетке. Данные гены могут быть гомологичными.
В контексте данного изобретения термин «гомологичный ген» не ограничивается обозначенными генами, имеющими теоретического общего генетического предка, но и включает гены, которые могут не быть родственными генетически, которые, тем не менее, эволюционировали так, что кодируют белок, который выполняет аналогичные функции и/или имеет аналогичную структуру. Следовательно, термин «функциональный гомолог» для цели настоящего изобретения относится к тому факту, что определенная ферментативная активность может быть не только предоставлена специфическим белком с определенной аминокислотной последовательностью, но также и белками с аналогичной последовательностью из других (не)родственных микроорганизмов.
С использованием ссылок, приведенных в Genbank для известных генов, специалисты в данной области могут определять эквивалентные гены в других организмах, бактериальных штаммах, дрожжах, грибах, млекопитающих, растениях и т.д. Эта рутинная работа преимущественно осуществляется с использованием консенсусных последовательностей, которые могут быть определены путем проведения выравниваний последовательностей с генами, происходящими из других микроорганизмов, и разработки вырожденных зондов для клонирования соответствующего гена в другом организме. Эти традиционные методы молекулярной биологии хорошо известны специалистам в данной области.
Термины «улучшенная продукция метионина», «улучшать продукцию метионина» и их грамматические эквиваленты в том виде, в котором они используются в данном документе, относятся к повышенному выходу метионина/источник углерода (отношение грамм/моль метионина, продуцированного на грамм/моль потребленного источника углерода, которое может быть выражено в процентах). Способы определения количества потребленного источника углерода и продуцированного метионина хорошо известны специалистам в данной области. Выход выше у рекомбинантного микроорганизма по сравнению с соответствующим немодифицированным микроорганизмом.
Фраза «микроорганизм, оптимизированный для ферментативной продукции метионина» относится к микроорганизмам, эволюционировавшим и/или генетически модифицированным для осуществления улучшенной продукции метионина по сравнению с эндогенной продукцией соответствующих микроорганизмов дикого типа. Такие микроорганизмы, «оптимизированные» для продукции метионина, хорошо известны в данной области и были раскрыты, в частности, в патентных заявках WO 2005/111202, WO 2007/077041, WO 2009/043803 и WO 2012/098042.
Согласно данному изобретению термины «ферментативная продукция», «культура» или «ферментация» используются для обозначения роста бактерий. Этот рост обычно проводится в ферментерах с подходящей культуральной средой, адаптированной к используемому микроорганизму и содержащей по меньшей мере один простой источник углерода и, при необходимости, косубстраты.
Фраза «подходящая культуральная среда» обозначает среду (например, стерильные жидкие среды), содержащую незаменимые или полезные питательные вещества для поддержания и/или роста клетки, такие как источники углерода или углеродные субстраты, источники азота, например, пептон, дрожжевые экстракты, мясные экстракты, экстракты солода, мочевина, сульфат аммония, хлорид аммония, нитрат аммония и фосфат аммония; источники фосфора, например, монокалия фосфат или дикалия фосфат; микроэлементы (например, соли металлов), например, соли магния, соли кобальта и/или соли марганца, а также факторы роста, такие как аминокислоты и витамины.
Термин «углеродный источник» или «углеродный субстрат», или «источник углерода» согласно настоящему изобретению обозначает любой источник углерода, который может использоваться специалистами в данной области для поддержки нормального роста микроорганизма, включая моносахариды (такие как глюкоза, галактоза, ксилоза, фруктоза или лактоза), олигосахариды, дисахариды (такие как сахароза, целлобиоза или мальтоза), меласса, крахмал или его производные, гемицеллюлозы и их комбинации. Особенно предпочтительным простым источником углерода является глюкоза. Другим предпочтительным простым источником углерода является сахароза. Источник углерода может происходить из возобновляемого сырья. Возобновляемое сырье определяется как сырье, требующееся для определенных промышленных процессов, которое может быть регенерировано в пределах короткого промежутка времени и в достаточном количестве для обеспечения его превращения в желательный продукт. Растительная биомасса, обработанная или необработанная, является интересным возобновляемым источником углерода.
Термин «источник серы» согласно данному изобретению относится к сульфату, тиосульфату, гидросульфиду, дитионату, дитиониту, сульфиту, метилмеркаптану, диметилсульфиду и другим сульфидам с метильной группой или к комбинации разных источников. Более предпочтительно, источник серы в культуральной среде представляет собой сульфат или тиосульфат, или их смесь.
Термин «источник азота» соответствует либо соли аммония, либо газообразному аммиаку. Источник азота поставляется в форме аммония или аммиака.
Термины «ослабление» или с «ослабленной экспрессией» в данном контексте означают то, что экспрессия гена или продукция фермента уменьшается или подавляется по сравнению с немодифицированным микроорганизмом, приводя к уменьшению внутриклеточной концентрации рибонуклеиновой кислоты, белка или фермента, по сравнению с немодифицированным микроорганизмом. Специалист в данной области знает разные средства и способы для измерения концентрации рибонуклеиновой кислоты или концентрации белка в клетке, включая, например, применение полимеразной цепной реакции, сопряженной с обратной транскрипцией (ПЦР-ОТ) и полимеразной цепной реакции в реальном времени (ПЦР-РВ), для определения концентрации рибонуклеиновой кислоты, и применение специфичного антитела для определения концентрации специфического белка.
Уменьшение или подавление продукции фермента получают путем ослабления экспрессии гена, кодирующего указанный фермент.
Ослабление экспрессии генов может достигаться средствами и способами, известными специалисту в данной области. В общем, ослабление экспрессии гена может достигаться посредством:
- мутирования кодирующей области или промоторной области, или
- удаления всей или части промоторной области, необходимой для экспрессии гена, или
- удаления всей или части кодирующей области гена путем гомологичной рекомбинации или
- вставки в кодирующую область или в промоторную область внешнего элемента или
- проведения экспрессии гена под контролем слабого промотора или индуцибельного промотора.
Специалист в данной области знает целый ряд промоторов, которые демонстрируют разную силу, и какой промотор использовать для слабой или индуцибельной генетической экспрессии.
Термин «активность» фермента используется взаимозаменяемо с термином «функция» и обозначает, в контексте изобретения, реакцию, которая катализируется ферментом. Специалист в данной области знает как измерять ферментативную активность указанного фермента.
Термины «ослабленная активность» или «пониженная активность» фермента означают либо пониженную удельную каталитическую активность белка, полученную мутацией в аминокислотной последовательности, и/или пониженные концентрации белка в клетке, полученные мутацией нуклеотидной последовательности или делецией кодирующей области гена.
Термины «повышенная активность» или «увеличенная активность» фермента обозначают или увеличенную удельную каталитическую активность фермента и/или повышенное количество/доступность фермента в клетке, полученные, например, сверхэкспрессией гена, кодирующего фермент.
Термины «увеличенная экспрессия», «повышенная экспрессия» или «сверхэкспрессия» и их грамматические эквиваленты используются в тексте взаимозаменяемо и имеют аналогичное значение. Данные термины означают то, что экспрессия гена или продукция фермента увеличивается по сравнению с немодифицированным микроорганизмом, приводя к увеличению внутриклеточной концентрации рибонуклеиновой кислоты, белка или фермента по сравнению с немодифицированным микроорганизмом. Специалист в данной области знает разные средства и способы для измерения концентрации рибонуклеиновой кислоты или концентрации белка в клетке, включая, например, применение полимеразной цепной реакции, сопряженной с обратной транскрипцией (ПЦР-ОТ) и полимеразной цепной реакции в реальном времени (ПЦР-РВ), для определения концентрации рибонуклеиновой кислоты, и применение специфичного антитела для определения концентрации специфического белка.
Увеличение продукции фермента получают путем увеличения экспрессии гена, кодирующего указанный фермент.
Для увеличения экспрессии гена специалист в данной области знает разные методики, такие как:
- Увеличение числа копий гена в микроорганизме. Данный ген кодируется хромосомно или внехромосомно. При локализации гена на хромосоме, на хромосому можно вводить несколько копий гена способами рекомбинации, известными эксперту в данной области (включая замену гена). При внехромосомной локализации гена ее (экспрессию) можно проводить разными типами плазмид, которые отличаются в отношении их репликатора и, таким образом, их числа копий в клетке. Данные плазмиды присутствуют в микроорганизме в 1-5 копиях или примерно в 20 копиях или вплоть до 500 копий, в зависимости от природы плазмиды: плазмиды с малым числом копий с ограниченной репликацией (pSC101, RK2), плазмиды с малым числом копий (pACYC, pRSF1010) или плазмиды с большим числом копий (pSK bluescript II).
- Применение промотора, приводящего к высокому уровню экспрессии гена. Специалист в данной области знает, какие промоторы являются самыми удобными, например, широко используются промоторы Ptrc, Ptac, Plac или промотор лямбда cl. Данные промоторы могут быть «индуцибельными» посредством конкретного соединения или посредством конкретного внешнего условия, подобного температуре или свету. Данные промоторы могут быть гомологичными или гетерологичными.
- Ослабление активности или экспрессии репрессора транскрипции, специфического или неспецифического гена.
- Применение элементов, стабилизирующих соответствующую матричную РНК (Carrier and Keasling, 1998), или элементов, стабилизирующих белок (например, GST (глутатион-S-трансфераза) метки, GE Healthcare).
Термины «кодирующий» или «кодирование» относятся к процессу, посредством которого полинуклеотид, посредством механизмов транскрипции и трансляции, продуцирует аминокислотную последовательность. Ген(ны), кодирующий(щие) фермент(ты), может быть экзогенным или эндогенным.
Термины «чувствительность по механизму обратной связи» или «ингибирование по механизму обратной связи» относятся к клеточному механизму контроля, в котором один или несколько ферментов, которые катализируют продукцию определенного вещества в клетке, ингибируются или становятся менее активными при накоплении данного вещества до определенного уровня. Таким образом, термины «пониженная чувствительность по механизму обратной связи» или «ослабленное ингибирование по механизму обратной связи» означают то, что активность такого механизма уменьшается или подавляется по сравнению с немодифицированным микроорганизмом. Специалист в данной области знает как модифицировать фермент для получения данного результата. Такие модификации были описаны в патентной заявке WO 2005/111202 или в патенте US 7611873.
В первом аспекте изобретения рекомбинантный штамм Escherichia coli оптимизирован для ферментативной продукции метионина и/или его производных путем ослабления поглощения метионина и усиления оттока метионина в указанном микроорганизме.
Как описано выше, импорт метионина опосредован системой поглощения метионина MetD, кодируемой генами metN, metI и metQ, которые раньше назывались abc, yaeE и yaeC соответственно. Данные гены были идентифицированы у нескольких микроорганизмов, включая E coli и C. glutamicum. MetNIQ принадлежит к широко известному семейству АВС-транспортеров.
В одном воплощении изобретения в рекомбинантном микроорганизме ослаблена экспрессия по меньшей мере одного гена, выбранного среди metN, metI и metQ. Специалист в данной области знает разные способы ослабления экспрессии генов, подобные клонированию гена, экспрессия которого подлежит ослаблению, под контролем индуцибельного или слабого промотора, делеция всей или части промоторной области или кодирующей области гена, экспрессия которого подлежит ослаблению. Предпочтительно подвергается делеции по меньшей мере один из генов metN, metI и metQ. Более предпочтительно, в рекомбинантном микроорганизме по изобретению подвергаются делеции три гена metN, metI и metQ.
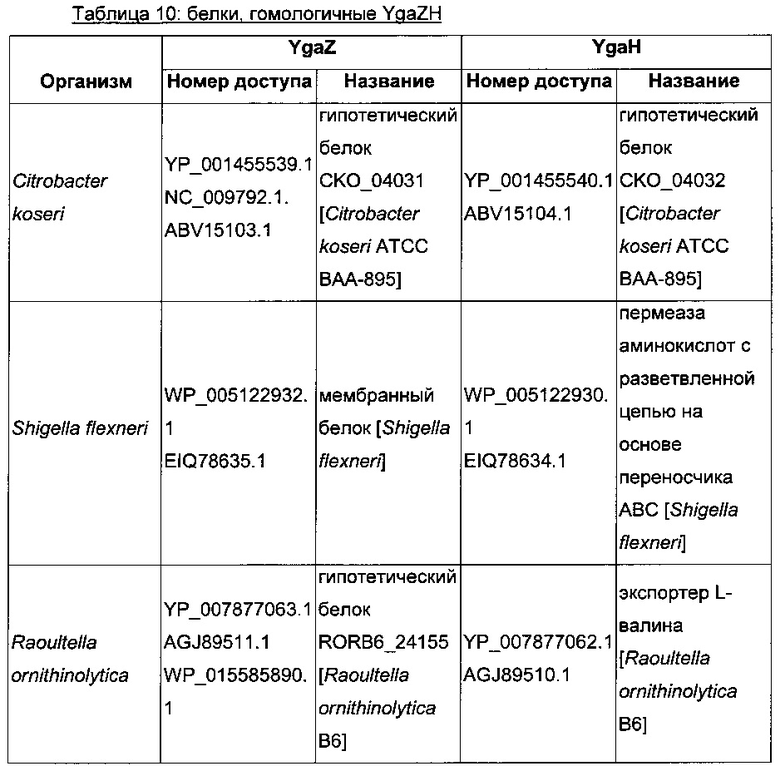
В микроорганизмах-продуцентах аминокислот метионин выводится специфичным экспортирующим переносчиком. Примечательно то, что у E. coli данный переносчик называется YgaZH и кодируется генами ygaZ и ygaH, тогда как у C. glutamicum он называется BrnFE и кодируется генами brnF и brnE. Функциональные гомологи данной системы оттока метионина были идентифицированы у нескольких других микроорганизмов. В качестве альтернативы, рекомбинантный микроорганизм по изобретению может сверхэкспрессировать функциональные гомологи систем YgaZH или BrnFE. Белки, гомологичные YgaZ и YgaH, представлены в Таблице 1 и Таблице 2 соответственно.
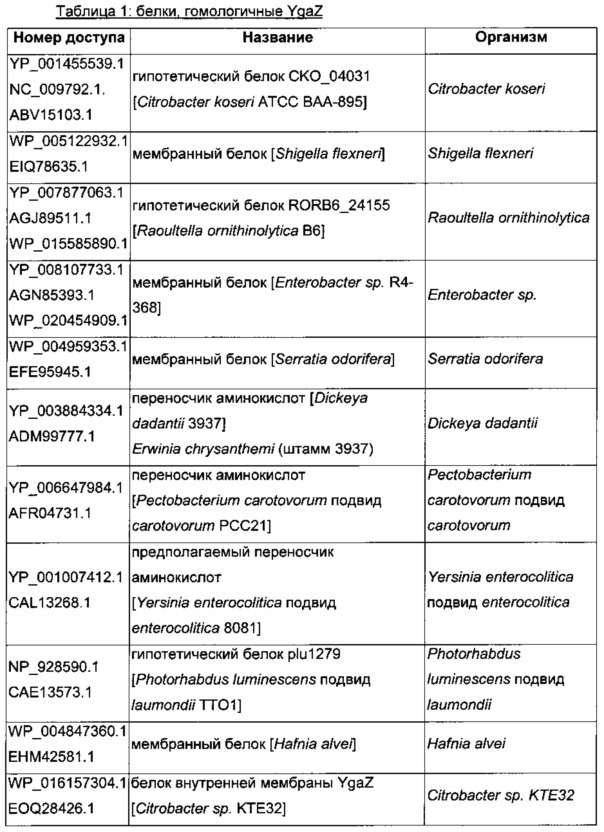
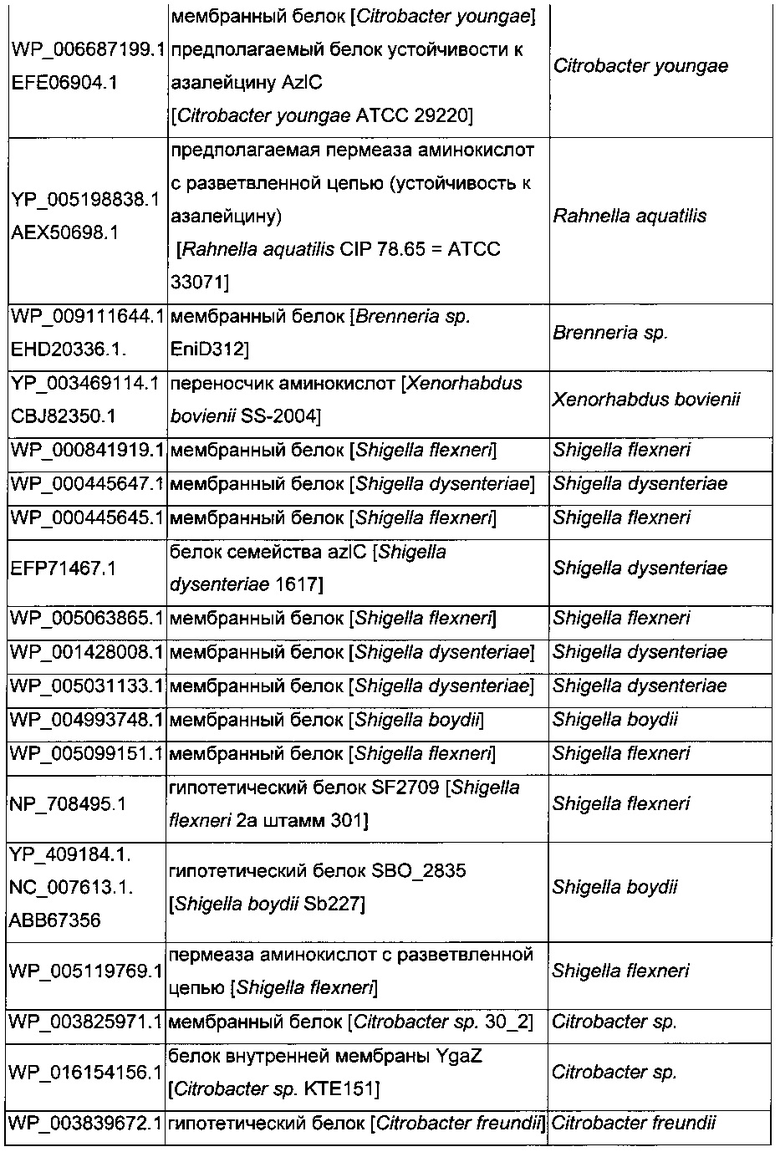
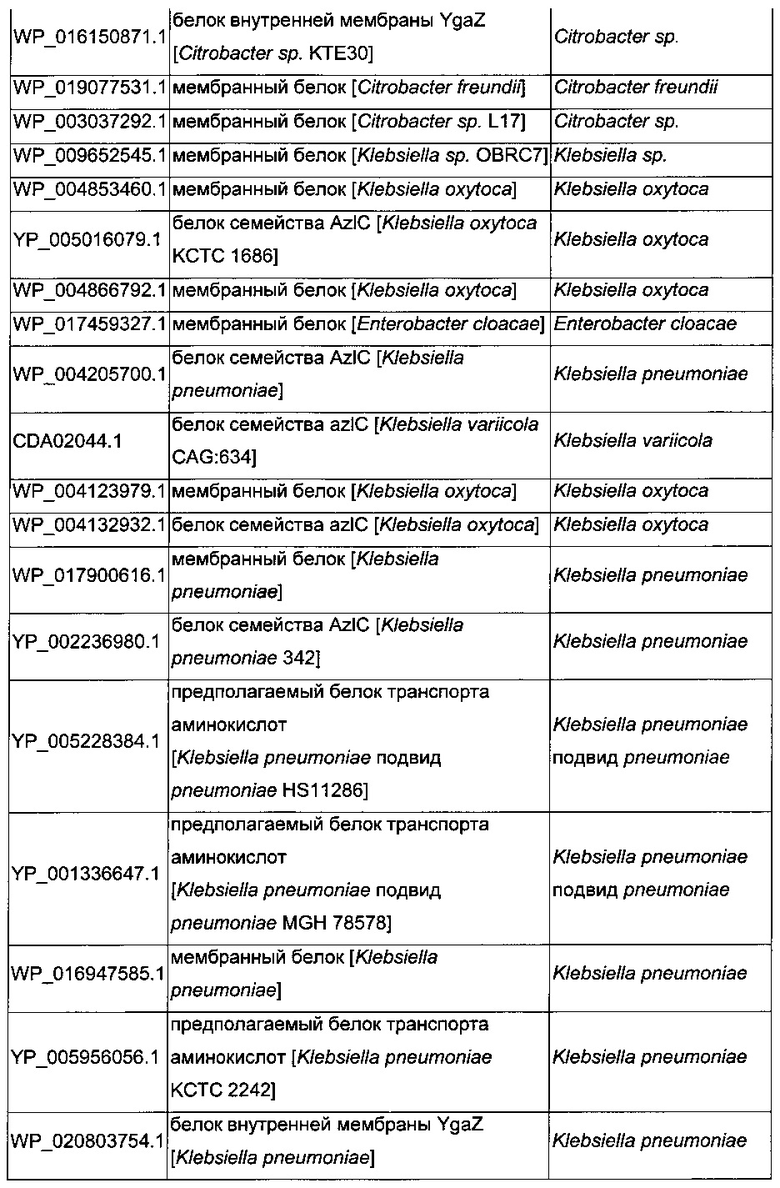
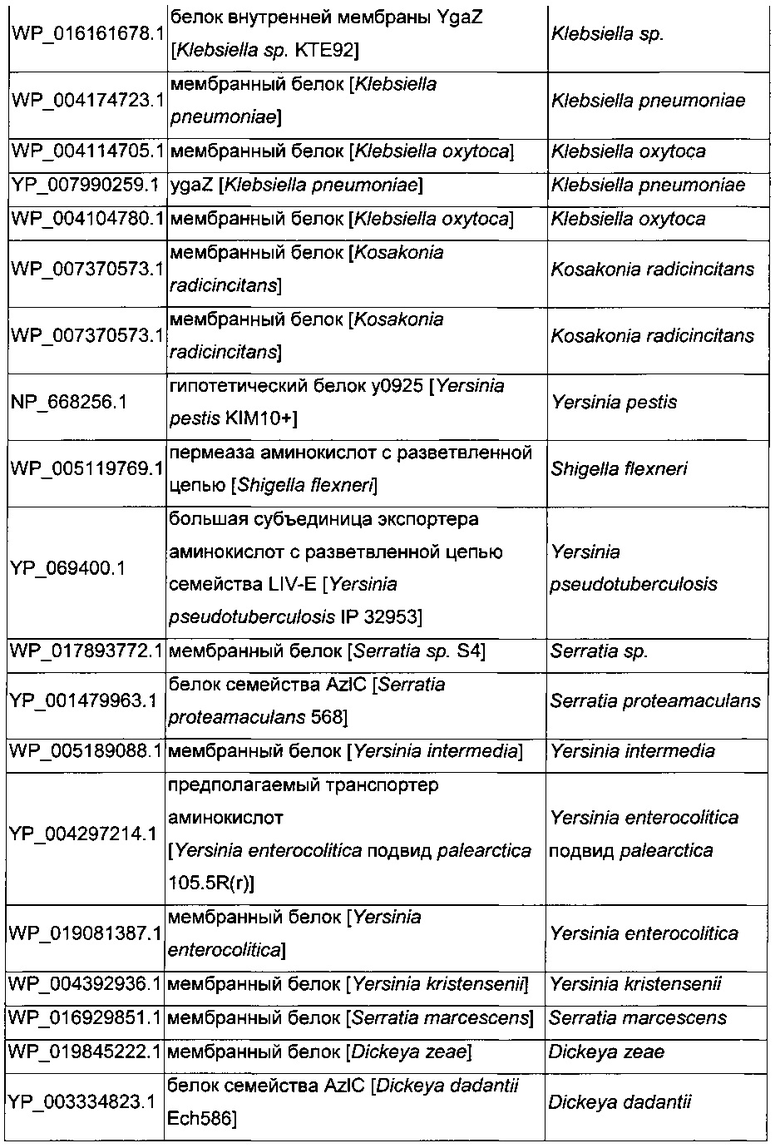
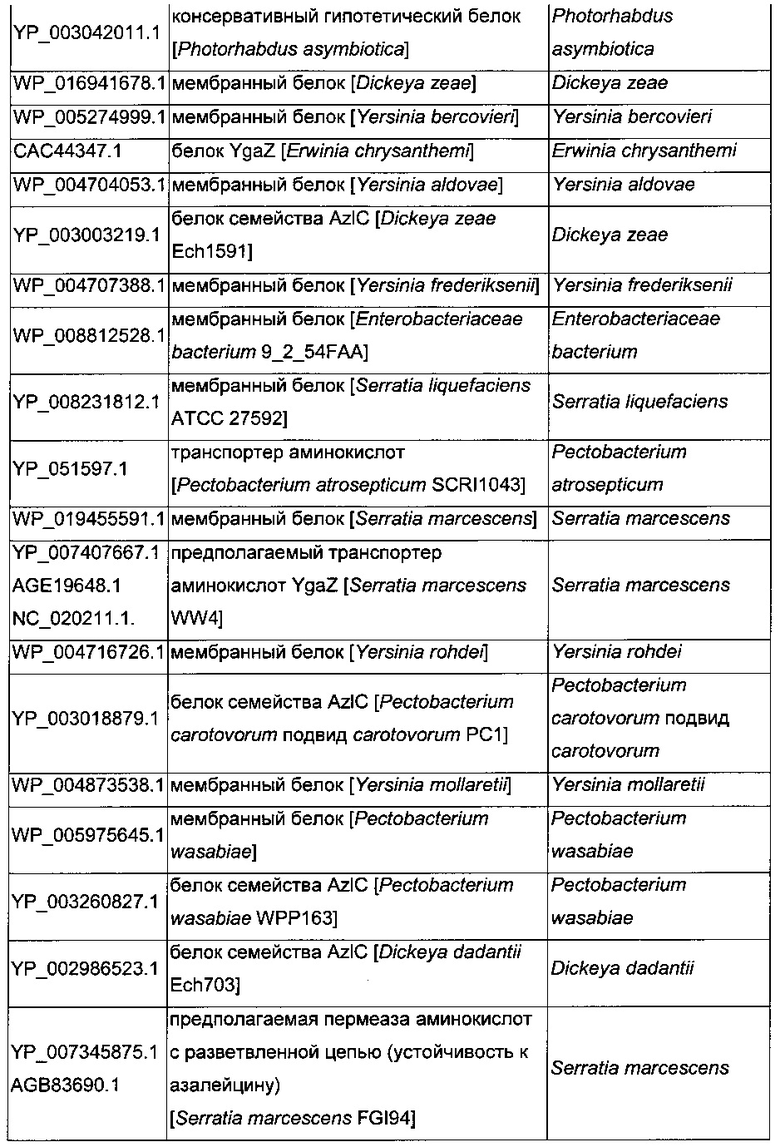
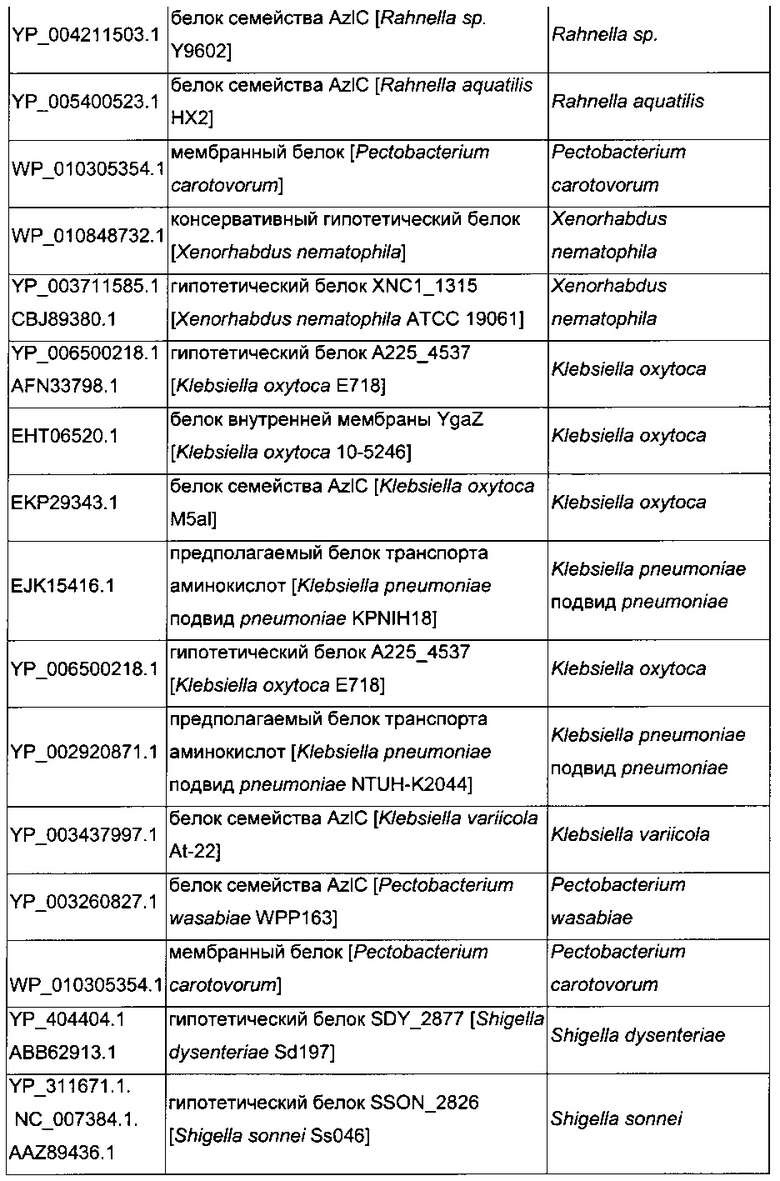
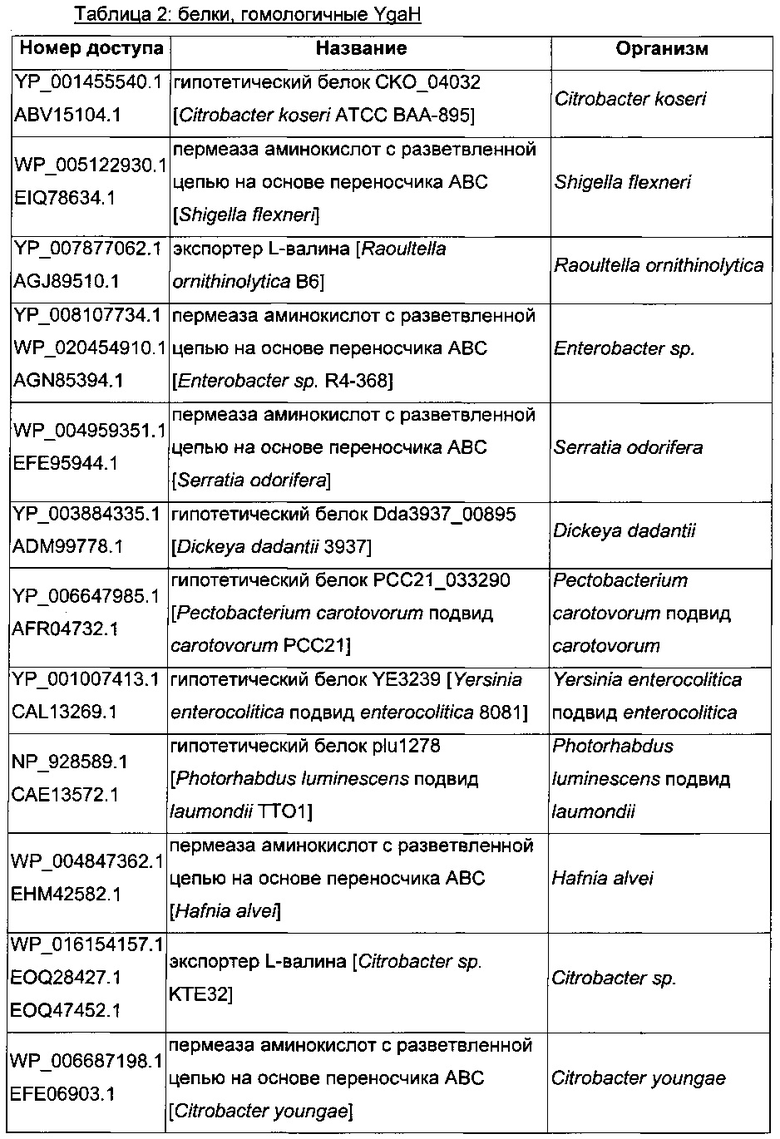
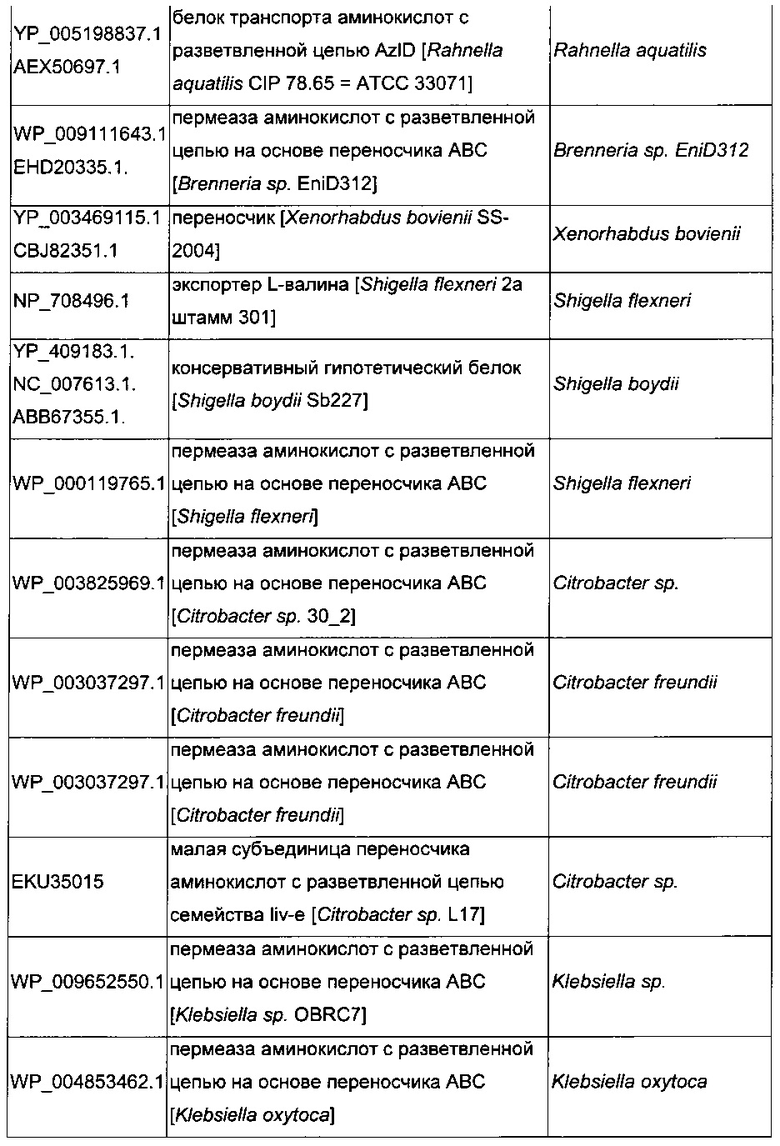
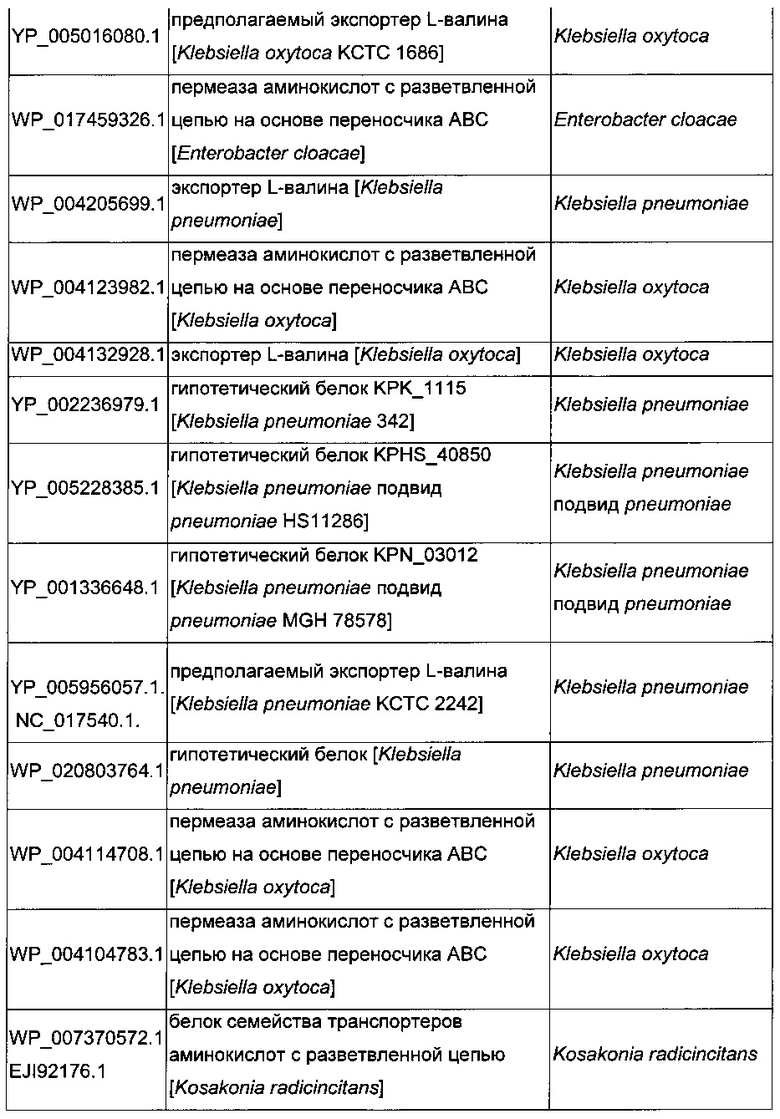
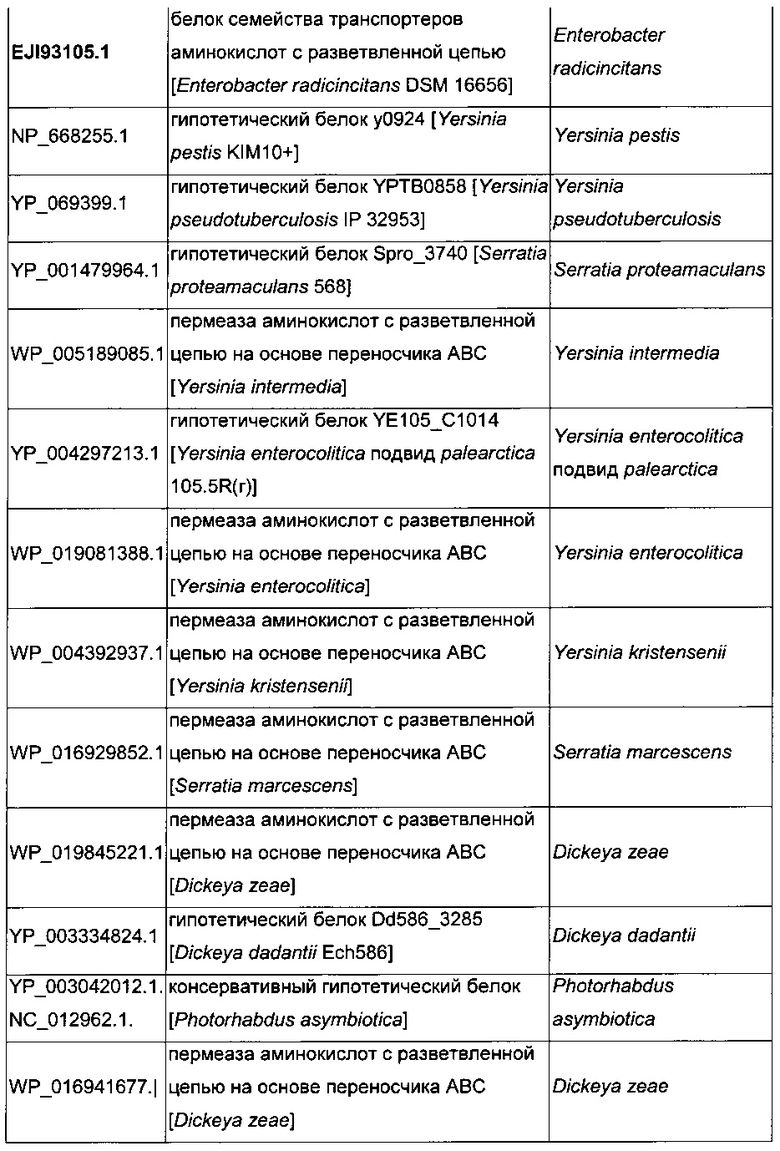
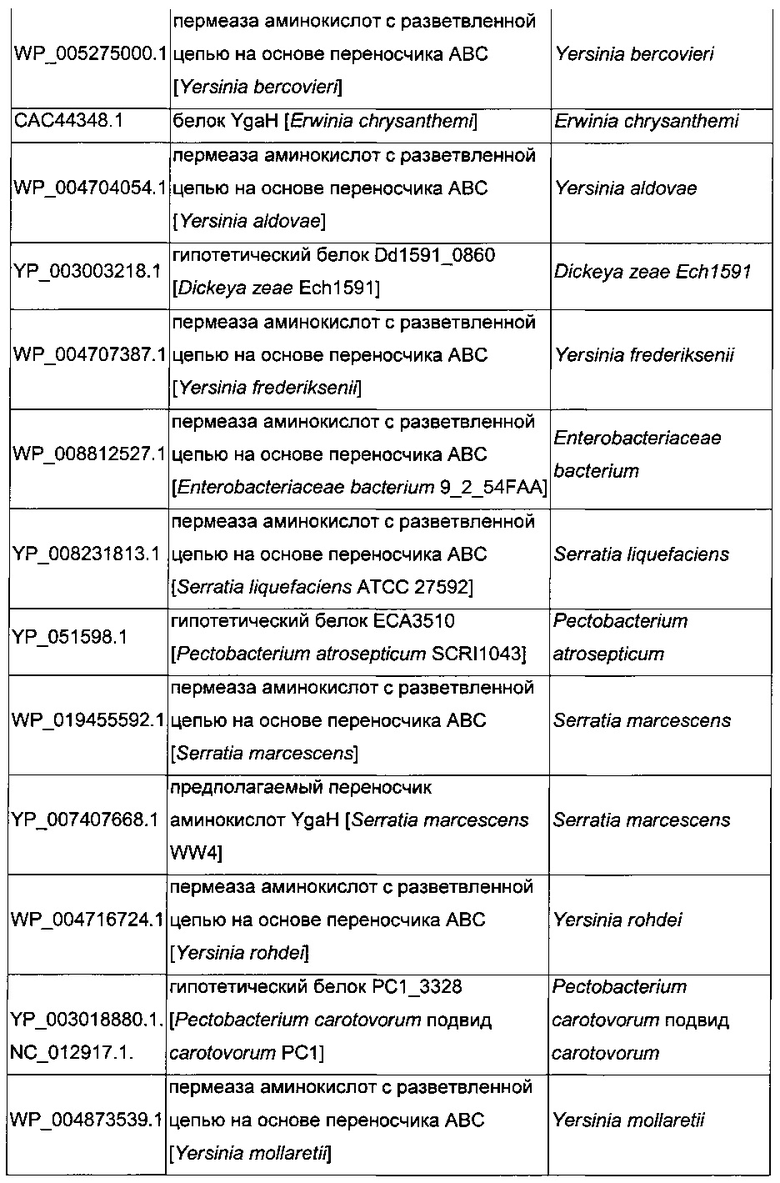
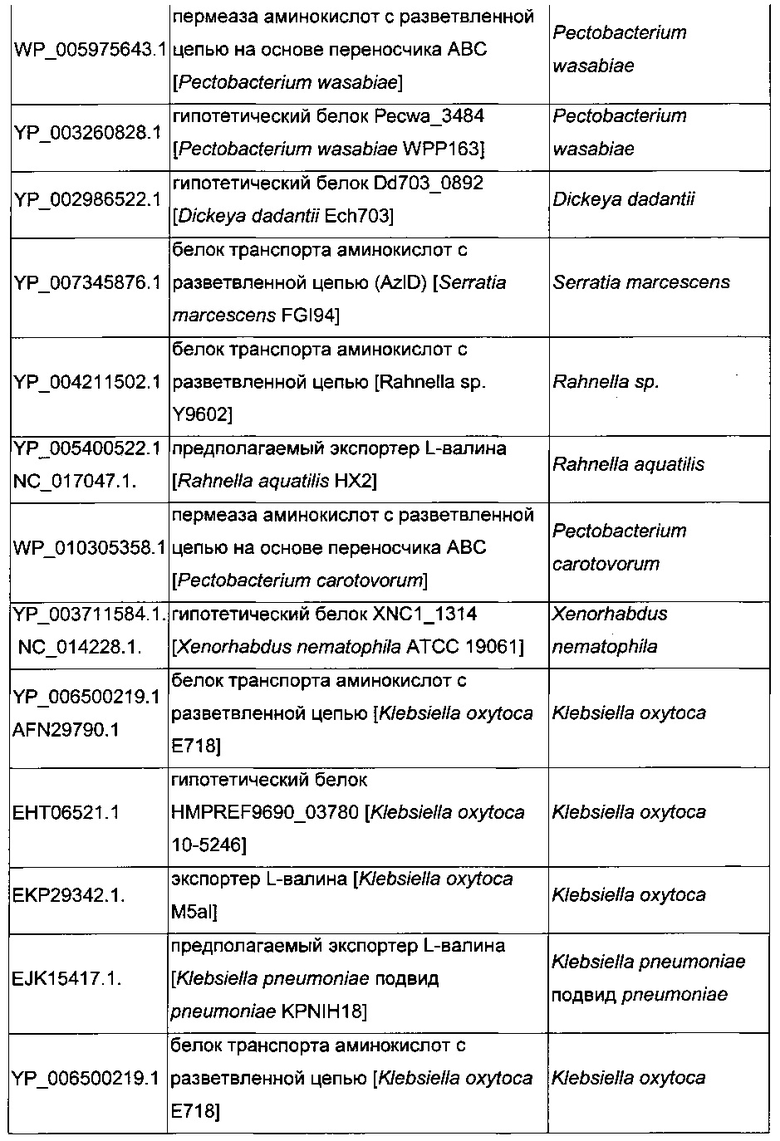
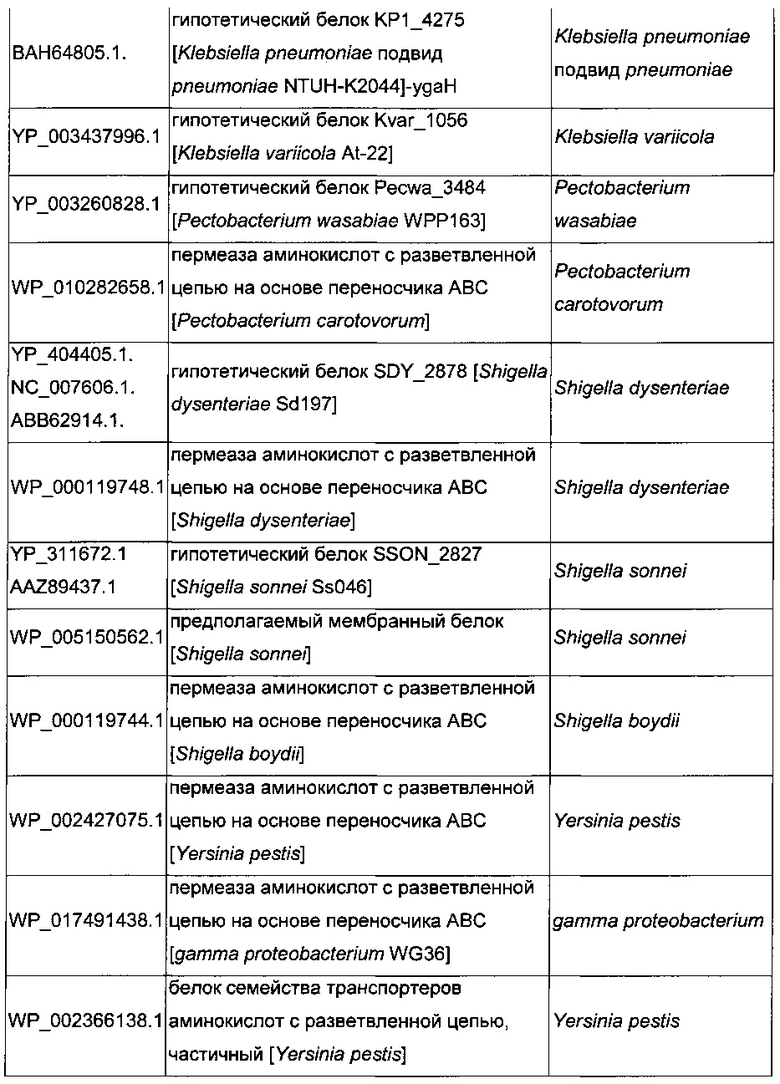
С номером доступа, раскрытым в таблицах для каждого гомолога, специалист в данной области способен получить аминокислотную последовательность и кодирующую ее нуклеотидную последовательность, например, в базах данных NCBI (Национальный центр биотехнологической информации).
Для специалиста в данной области получение генов, кодирующих данные гомологи, из аминокислотной последовательности или нуклеотидной последовательности является рутинной задачей. Это можно сделать либо искусственным синтезом гена, кодирующего интересующий белок, на основе его аминокислотной последовательности, либо посредством ПЦР (полимеразная цепная реакция) амплификации интересующей кодирующей области из соответствующей геномной ДНК. В контексте данного изобретения эти гены называются «генами, гомологичными ygaZ или ygaH». Последовательности данных генов, гомологичных ygaZH, можно корректировать в соответствии с отклонением использования кодонов у микроорганизма-хозяина.
В конкретном воплощении изобретения рекомбинантный микроорганизм сверхэкспрессирует гены ygaZ и ygaH, кодирующие белки, последовательности которых, соответственно, раскрыты в SEQ ID NO: 1 и SEQ ID NO: 2, или гомологичные им гены. Предпочтительно гены, гомологичные ygaZ и ygaH, представлены парой генов, происходящих из того же самого организма, и представлены геном, гомологичным ygaZ, и геном, гомологичным ygaH. Однако можно было бы использовать несоответствующую пару гена, гомологичного ygaZ, из первого организма и гена, гомологичного ygaH, из второго организма.
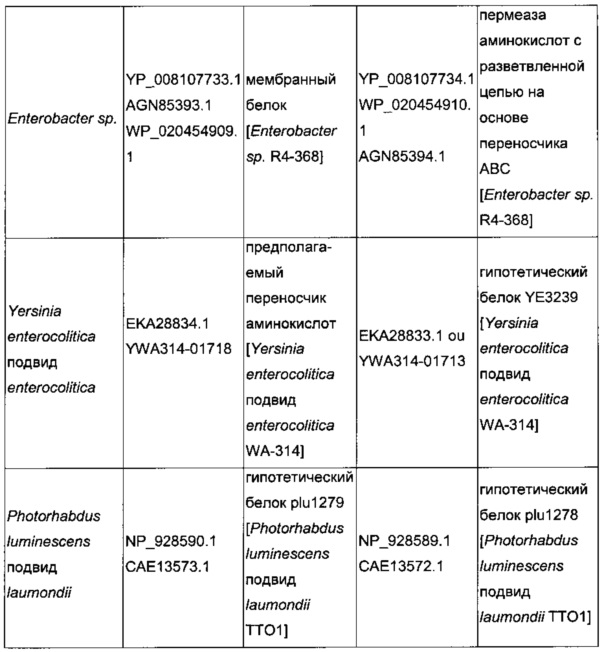
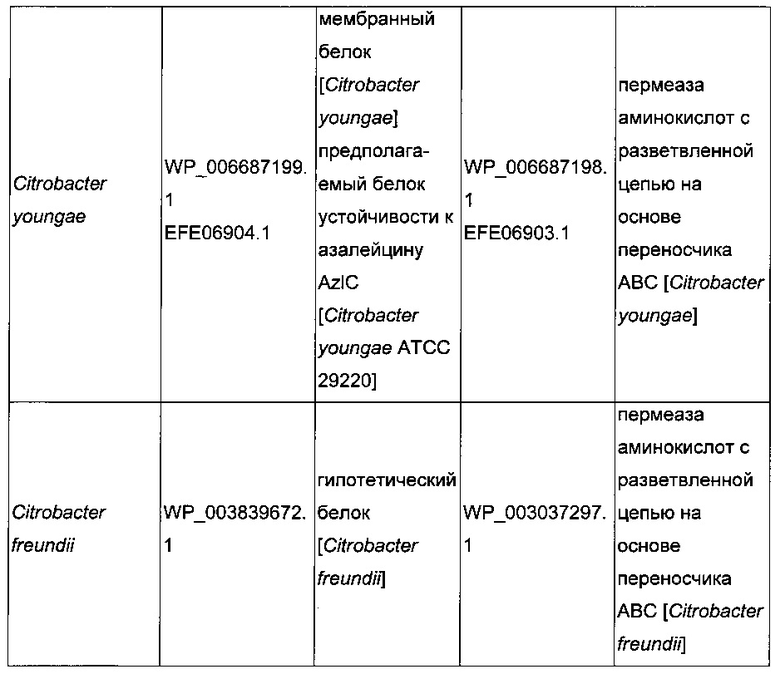
Гены, гомологичные ygaZH, выбраны среди генов, кодирующих гомологи YgaZ и YgaH, раскрытые, соответственно, в таблице 1 и в таблице 2. Предпочтительно гены, гомологичные ygaZH, выбраны среди генов, кодирующих гомологи YgaZH из видов Citrobacter, видов Shigella, видов Raoultella, видов Enterobacter, видов Yersinia и видов Photorhabdus. Более предпочтительно гены, гомологичные ygaZH, происходят из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii. Наиболее предпочтительно, гены, гомологичные ygaZH, происходят из Citrobacter koseri, Citrobacter youngae, Citrobacter freundii или Enterobacter sp.
Следовательно, гены, гомологичные ygaZH, предпочтительно выбраны среди генов, кодирующих пару гомолога YgaZ и гомолога YgaH, определенные, соответственно, SEQ ID NO: 3 и SEQ ID NO: 4 из Citrobacter koseri, SEQ ID NO: 5 и SEQ ID NO: 6 из Shigella flexneri, SEQ ID NO: 7 и SEQ ID NO: 8 из Raoultella ornithinolytica, SEQ ID NO: 9 и SEQ ID NO: 10 из Enterobacter sp. (R4-368), SEQ ID NO: 11 или 12 и SEQ ID NO: 13 или 14 из Yersinia enterocolitica подвид enterocolitica, SEQ ID NO: 15 и SEQ ID NO: 16 из Photorhabdus luminescens подвид laumondii, SEQ ID NO: 17 и SEQ ID NO: 18 из Citrobacter youngae, SEQ ID NO: 19 и SEQ ID NO: 20 из Citrobacter freundii.
В конкретном воплощении рекомбинантный микроорганизм характеризуется:
- ослаблением экспрессии по меньшей мере одного гена metN, metI и metQ; и
- сверхэкспрессией генов ygaZH или гомологичных им генов, происходящих из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii.
В другом конкретном воплощении рекомбинантный микроорганизм характеризуется:
- ослаблением экспрессии гена metN; и
- сверхэкспрессией генов ygaZH или гомологичных им генов Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii.
В другом конкретном воплощении рекомбинантный микроорганизм характеризуется:
- ослаблением экспрессии гена metI; и
- сверхэкспрессией генов ygaZH или гомологичных им генов Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii.
В другом конкретном воплощении рекомбинантный микроорганизм характеризуется:
- ослаблением экспрессии гена metQ; и
- сверхэкспрессией генов ygaZH или гомологичных им генов Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii.
В другом конкретном воплощении рекомбинантный микроорганизм характеризуется:
- ослаблением экспрессии генов metN, metI и metQ; и
- сверхэкспрессией генов ygaZH или гомологичных им генов Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii.
В предпочтительном воплощении изобретения данные гены сверхэкспрессируются под контролем индуцибельного промотора. Специалист в данной области знает такие индуцибельные промоторы. Например, для сверхэкспрессии генов ygaZH или генов, гомологичных ygaZH, происходящих из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii, в рекомбинантном микроорганизме по изобретению могут быть использованы промоторы, подобные λPR или λPL.
Другой целью изобретения является идентификация генов, гомологичных ygaZH, и сверхэкспрессия указанных генов в микроорганизме-продуценте аминокислот, одних или в комбинации с другими генетическими модификациями, как раскрыто ниже.
Оптимизация пути биосинтеза метионина
Рекомбинантный микроорганизм согласно изобретению модифицируется для улучшения продукции метионина. Гены, участвующие в продукции метионина, хорошо известны в данной области и включают гены, участвующие в специфическом пути биосинтеза метионина, а также гены, участвующие в путях, дающих предшественники, и гены, участвующие в путях, потребляющих метионин.
Для эффективной продукции метионина требуется оптимизация специфического пути биосинтеза метионина и нескольких путей, дающих предшественники. Штаммы, продуцирующие метионин, уже были описаны, в частности, в патентных заявках WO 2005/111202, WO 2007/077041 и WO 2009/043803. Данные заявки включены в эту заявку в качестве ссылки.
За исключением случаев, когда утверждается иное, все гены, упомянутые ниже, имеющие отношение к оптимизации пути биосинтеза метионина, относятся к генам из Е. coli.
В конкретном воплощении изобретения рекомбинантный микроорганизм модифицирован, как описано ниже: увеличена экспрессия по меньшей мере одного гена, выбранного среди ptsG, pyc, pntAB, cysP, cysU, cysW, cysA, cysM, cysJ, cysI, cysH, gcvT, gcvH, gcvP, lpd, serA, serB, serC, cysE, metF, metH, fldA, fpr, metA, аллеля metA*, кодирующего фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи, thrA и аллеля thrA*, кодирующего фермент с ослабленным ингибированием треонином по механизму обратной связи.
 ptsG кодирует фермент PTS IICBGlc, как описано в патентной заявке WO 2013/001055,
ptsG кодирует фермент PTS IICBGlc, как описано в патентной заявке WO 2013/001055,
 pyc кодирует пируваткарбоксилазу, как описано в патентной заявке WO 2013/001055. В предпочтительном воплощении ген рус является гетерологичным и выбран из генов рус из Rhizobium etli, Bacillus subtilis, Lactococcus lactis, Pseudomonas fluorescens или видов Corynebacterium,
pyc кодирует пируваткарбоксилазу, как описано в патентной заявке WO 2013/001055. В предпочтительном воплощении ген рус является гетерологичным и выбран из генов рус из Rhizobium etli, Bacillus subtilis, Lactococcus lactis, Pseudomonas fluorescens или видов Corynebacterium,
 pntAB кодирует субъединицы мембраносвязанной трансгидрогеназы, такой как описанная в патентной заявке WO 2012/055798,
pntAB кодирует субъединицы мембраносвязанной трансгидрогеназы, такой как описанная в патентной заявке WO 2012/055798,
 cysP кодирует периплазматический сульфатсвязывающий белок, как описано в WO 2007/077041 и в WO 2009/043803,
cysP кодирует периплазматический сульфатсвязывающий белок, как описано в WO 2007/077041 и в WO 2009/043803,
 cysU кодирует компонент ABC переносчика сульфата, как описано в WO 2007/077041 и в WO 2009/043803,
cysU кодирует компонент ABC переносчика сульфата, как описано в WO 2007/077041 и в WO 2009/043803,
 cysW кодирует мембраносвязанный белок, транспортирующий сульфат, как описано в WO 2007/077041 и в WO 2009/043803,
cysW кодирует мембраносвязанный белок, транспортирующий сульфат, как описано в WO 2007/077041 и в WO 2009/043803,
 cysA кодирует сульфатпермеазу, как описано в WO2007/077041 и в WO 2009/043803,
cysA кодирует сульфатпермеазу, как описано в WO2007/077041 и в WO 2009/043803,
 cysM кодирует О-ацетилсеринсульфгидралазу, как описано в WO 2007/077041 и в WO 2009/043803,
cysM кодирует О-ацетилсеринсульфгидралазу, как описано в WO 2007/077041 и в WO 2009/043803,
 cysI и cysJ кодируют, соответственно, альфа и бета субъединицы сульфитредуктазы, как описано в WO 2007/077041 и в WO 2009/043803. Предпочтительно cysI и cysJ сверхэкспрессируются совместно,
cysI и cysJ кодируют, соответственно, альфа и бета субъединицы сульфитредуктазы, как описано в WO 2007/077041 и в WO 2009/043803. Предпочтительно cysI и cysJ сверхэкспрессируются совместно,
 cysH кодирует аденилилсульфатредуктазу, как описано WO 2007/077041 и в WO 2009/043803.
cysH кодирует аденилилсульфатредуктазу, как описано WO 2007/077041 и в WO 2009/043803.
Усиление С1 метаболизма также представляет собой модификацию, которая приводит к улучшенной продукции метионина. Оно относится к увеличению активности по меньшей мере одного фермента, участвующего в С1 метаболизме, выбранного среди GcvTHP, Lpd, MetF или MetH. В предпочтительном воплощении изобретения одноуглеродный метаболизм усиливается путем увеличения экспрессии и/или активности по меньшей мере одного из следующих:
 gcvT, gcvH, gcvP и lpd, кодирующих комплекс расщепления глицина, как описано в патентной заявке WO 2007/077041. Комплекс расщепления глицина (GCV) представляет собой мультиферментный комплекс, который катализирует окисление глицина, давая диоксид углерода, аммиак, метилен-THF (тетрагидрофолат) и восстановленный пиридиновый нуклеотид. Комплекс GCV состоит из четырех белковых компонентов: указанного Р-белка - глициндегидрогеназы (GcvP), указанного Н-белка - липоил-CcvH-белка (GcvH), указанного Т-белка - аминометилтрансферазы (GcvT) и указанного L-белка - дигидролипоамиддегидрогеназы (GcvL или Lpd). Р-белок катализирует пиридоксальфосфат-зависимое высвобождение CO2 из глицина, оставляя метиламинную группировку. Метиламинная группировка переносится на группу липоевой кислоты Н-белка, который связан с Р-белком до декарбоксилирования глицина. Т-белок катализирует высвобождение NH3 из метиламинной группы и переносит остающееся С1 звено на THF, образуя метилен-THF. L-белок затем окисляет компонент в виде липоевой кислоты Н-белка и переносит электроны на НАД+, образуя НАДН;
gcvT, gcvH, gcvP и lpd, кодирующих комплекс расщепления глицина, как описано в патентной заявке WO 2007/077041. Комплекс расщепления глицина (GCV) представляет собой мультиферментный комплекс, который катализирует окисление глицина, давая диоксид углерода, аммиак, метилен-THF (тетрагидрофолат) и восстановленный пиридиновый нуклеотид. Комплекс GCV состоит из четырех белковых компонентов: указанного Р-белка - глициндегидрогеназы (GcvP), указанного Н-белка - липоил-CcvH-белка (GcvH), указанного Т-белка - аминометилтрансферазы (GcvT) и указанного L-белка - дигидролипоамиддегидрогеназы (GcvL или Lpd). Р-белок катализирует пиридоксальфосфат-зависимое высвобождение CO2 из глицина, оставляя метиламинную группировку. Метиламинная группировка переносится на группу липоевой кислоты Н-белка, который связан с Р-белком до декарбоксилирования глицина. Т-белок катализирует высвобождение NH3 из метиламинной группы и переносит остающееся С1 звено на THF, образуя метилен-THF. L-белок затем окисляет компонент в виде липоевой кислоты Н-белка и переносит электроны на НАД+, образуя НАДН;
 MetF, кодирующей метилентетрагидрофолатредуктазу, как описано в патентной заявке WO 2007/077041;
MetF, кодирующей метилентетрагидрофолатредуктазу, как описано в патентной заявке WO 2007/077041;
 MetH (В12-зависимая гомоцистеин-N5-метилтетрагидрофолаттрансметилаза), кодирующей метилтрансферазы.
MetH (В12-зависимая гомоцистеин-N5-метилтетрагидрофолаттрансметилаза), кодирующей метилтрансферазы.
Сверхэкспрессия по меньшей мере одного из следующих генов, участвующих в биосинтезе серина, также уменьшает продукцию побочного продукта - изолейцина:
 serA, который кодирует фосфоглицератдегидрогеназу, как описано в WO 2007/077041 и в WO 2009/043803,
serA, который кодирует фосфоглицератдегидрогеназу, как описано в WO 2007/077041 и в WO 2009/043803,
 serB, который кодирует фосфосеринфосфатазу, как описано в WO 2007/077041 и в WO 2009/043803,
serB, который кодирует фосфосеринфосфатазу, как описано в WO 2007/077041 и в WO 2009/043803,
 serC, который кодирует фосфосеринаминотрансферазу, как описано в WO 2007/077041 и в WO 2009/043803.
serC, который кодирует фосфосеринаминотрансферазу, как описано в WO 2007/077041 и в WO 2009/043803.
Уже было показано, что сверхэкспрессия следующих генов улучшает продукцию метионина:
 cysE кодирует серинацилтрансферазу; его сверхэкспрессия обеспечивает усиление продукции метионина, как описано в WO 2007/077041;
cysE кодирует серинацилтрансферазу; его сверхэкспрессия обеспечивает усиление продукции метионина, как описано в WO 2007/077041;
 metA кодирует гомосеринсукцинилтрансферазу. Аллель metA* кодирует фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи. Предпочтительно используется аллель metA*, описанный в патентной заявке WO 2005/111202;
metA кодирует гомосеринсукцинилтрансферазу. Аллель metA* кодирует фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи. Предпочтительно используется аллель metA*, описанный в патентной заявке WO 2005/111202;
 thrA кодирует аспартокиназу/гомосериндегидрогеназу; аллель thrA* кодирует фермент с пониженным ингибированием треонином по механизму обратной связи, как описано в WO 2005/111202.
thrA кодирует аспартокиназу/гомосериндегидрогеназу; аллель thrA* кодирует фермент с пониженным ингибированием треонином по механизму обратной связи, как описано в WO 2005/111202.
В конкретном воплощении изобретения гены могут находиться под контролем индуцибельного промотора. В предпочтительном воплощении изобретения по меньшей мере один из данных генов находится под контролем промотора, индуцируемого температурой. Предпочтительно экспрессия по меньшей мере одного из генов: thrA, cysE, metA прямо или опосредованно находится под контролем индуцибельного промотора. Более предпочтительно гены thrA, cysE, metA прямо или опосредованно находятся под контролем индуцибельного промотора. В предпочтительном воплощении изобретения экспрессия гена thrA находится под прямым контролем индуцибельного промотора, и экспрессия гена cysE подвергается полярному влиянию индуцибельной экспрессии гена thrA. В другом предпочтительном воплощении изобретения экспрессия гена thrA находится под прямым контролем индуцибельного промотора, и экспрессия генов cysE и metA подвергается полярному влиянию индуцибельной экспрессии гена thrA.
В наиболее предпочтительном воплощении промотор, индуцируемый температурой, принадлежит к семейству промоторов PR. Штамм, продуцирующий метионин, имеющий гены, находящиеся под контролем индуцибельных промоторов, описан в патентной заявке WO 2011/073122.
В другом конкретном воплощении изобретения микроорганизм был дополнительно модифицирован, и была ослаблена экспрессия по меньшей мере одного из следующих генов: metJ, pykA, pykF, purU, ybdL, yncA, metE, dgsA или udhA.
 Ген metJ кодирует репрессорный белок MetJ (GenBank 1790373), ответственный за понижающую регуляцию метионинового регулона, как было предложено в патентной заявке JP 2000/157267,
Ген metJ кодирует репрессорный белок MetJ (GenBank 1790373), ответственный за понижающую регуляцию метионинового регулона, как было предложено в патентной заявке JP 2000/157267,
 Гены pykA и pykF кодируют ферменты «пируваткиназы». Ослабление экспрессии по меньшей мере одной или обеих пируваткиназ снижает потребление фосфоенолпирувата (PEP). Повышенная доступность PEP может увеличивать продукцию оксалоацетата, важного предшественника аспартата, который, в свою очередь, является предшественником метионина, как описано в WO 2007/077041 и в WO 2009/043803,
Гены pykA и pykF кодируют ферменты «пируваткиназы». Ослабление экспрессии по меньшей мере одной или обеих пируваткиназ снижает потребление фосфоенолпирувата (PEP). Повышенная доступность PEP может увеличивать продукцию оксалоацетата, важного предшественника аспартата, который, в свою очередь, является предшественником метионина, как описано в WO 2007/077041 и в WO 2009/043803,
 purU кодирует формилтетрагидрофолатдеформилазу, фермент, который катализирует формил-THF-деформилазную реакцию. Ослабление деформилазной активности увеличивает продукцию метил-THF, который требуется для метилирования гомоцистеина. Потеря С1 метаболитов посредством деформилирования приводит к повышенной продукции гомоцистеина, который не может превращаться в метионин. Гомоцистеин затем может быть субстратом фермента цистатионин-гамма-синтазы (MetB), который может катализировать реакцию между О-сукцинилгомосерином и гомоцистеином, приводящую к образованию гомолантионина, как описано в WO 2007/077041 и в WO 2009/043803,
purU кодирует формилтетрагидрофолатдеформилазу, фермент, который катализирует формил-THF-деформилазную реакцию. Ослабление деформилазной активности увеличивает продукцию метил-THF, который требуется для метилирования гомоцистеина. Потеря С1 метаболитов посредством деформилирования приводит к повышенной продукции гомоцистеина, который не может превращаться в метионин. Гомоцистеин затем может быть субстратом фермента цистатионин-гамма-синтазы (MetB), который может катализировать реакцию между О-сукцинилгомосерином и гомоцистеином, приводящую к образованию гомолантионина, как описано в WO 2007/077041 и в WO 2009/043803,
 ybdL кодирует аминотрансферазу, как описано в патентной заявке WO 2012/090021,
ybdL кодирует аминотрансферазу, как описано в патентной заявке WO 2012/090021,
 yncA кодирует N-ацилтранеферазу, как описано в патентной заявке WO 2010/020681,
yncA кодирует N-ацилтранеферазу, как описано в патентной заявке WO 2010/020681,
 metE кодирует кобаламин-независимую метионинсинтазу, как описано в патентной заявке PCT/IB2012/001336,
metE кодирует кобаламин-независимую метионинсинтазу, как описано в патентной заявке PCT/IB2012/001336,
 dgsA, лучше известный как Mlc, кодирует двойной транскрипционный регулятор, который контролирует экспрессию генов, кодирующих ферменты систем фосфотрансферазы (PTS) и фосфоенолпирувата (PEP), как описано в патентной заявке WO 2013/001055,
dgsA, лучше известный как Mlc, кодирует двойной транскрипционный регулятор, который контролирует экспрессию генов, кодирующих ферменты систем фосфотрансферазы (PTS) и фосфоенолпирувата (PEP), как описано в патентной заявке WO 2013/001055,
 udhA кодирует растворимую трансгидрогеназу пиридиновых нуклеотидов, как описано в патентной заявке WO 2012/055798.
udhA кодирует растворимую трансгидрогеназу пиридиновых нуклеотидов, как описано в патентной заявке WO 2012/055798.
В более предпочтительном воплощении изобретения ферментативная продукция метионина и/или его производных рекомбинантным микроорганизмом, в котором ослаблен импорт метионина и усилен отток метионина, из глюкозы в качестве главного источника углерода может достигаться посредством комбинации обсуждавшихся выше модификаций в указанном микроорганизме, например:
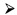 экспрессия гена metJ ослабляется, и экспрессия аллеля metA*, кодирующего фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи (MetA*), усиливается;
экспрессия гена metJ ослабляется, и экспрессия аллеля metA*, кодирующего фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи (MetA*), усиливается;
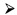 экспрессия гена metJ ослабляется; экспрессия аллеля metA*, кодирующего фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи (MetA*), усиливается; и экспрессия аллеля thrA*, кодирующего фермент с ослабленным ингибированием треонином по механизму обратной связи (thrA*), усиливается;
экспрессия гена metJ ослабляется; экспрессия аллеля metA*, кодирующего фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи (MetA*), усиливается; и экспрессия аллеля thrA*, кодирующего фермент с ослабленным ингибированием треонином по механизму обратной связи (thrA*), усиливается;
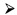 экспрессия гена metJ ослабляется; экспрессия аллеля metA*, кодирующего фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи (MetA*), усиливается; экспрессия аллеля thrA*, кодирующего фермент с ослабленным ингибированием треонином по механизму обратной связи (thrA*), усиливается; и экспрессия гена cysE усиливается;
экспрессия гена metJ ослабляется; экспрессия аллеля metA*, кодирующего фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи (MetA*), усиливается; экспрессия аллеля thrA*, кодирующего фермент с ослабленным ингибированием треонином по механизму обратной связи (thrA*), усиливается; и экспрессия гена cysE усиливается;
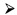 экспрессия гена metJ ослабляется; экспрессия аллеля metA*, кодирующего фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи (MetA*), усиливается; экспрессия аллеля thrA*, кодирующего фермент с ослабленным ингибированием треонином по механизму обратной связи (thrA*), усиливается; экспрессия гена cysE усиливается; и экспрессия генов metF и/или metH усиливается.
экспрессия гена metJ ослабляется; экспрессия аллеля metA*, кодирующего фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи (MetA*), усиливается; экспрессия аллеля thrA*, кодирующего фермент с ослабленным ингибированием треонином по механизму обратной связи (thrA*), усиливается; экспрессия гена cysE усиливается; и экспрессия генов metF и/или metH усиливается.
В конкретном аспекте изобретения рекомбинантный микроорганизм содержит следующие генетические модификации:
 гены metN, metI, metQ подвергаются делеции, и гены ygaZ и ygaH, или гомологичные им гены из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii сверхэкспрессируются,
гены metN, metI, metQ подвергаются делеции, и гены ygaZ и ygaH, или гомологичные им гены из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii сверхэкспрессируются,
 экспрессия генов metA*, metH, cysPUWAM, cysJIH, gcvTHP, metF, serA, serB, serC, cysE, thrA*, ptsG и pyc усиливается и
экспрессия генов metA*, metH, cysPUWAM, cysJIH, gcvTHP, metF, serA, serB, serC, cysE, thrA*, ptsG и pyc усиливается и
 экспрессия генов metJ, pykA, pykF, purU, metE, dgsA и yncA ослабляется.
экспрессия генов metJ, pykA, pykF, purU, metE, dgsA и yncA ослабляется.
В конкретном воплощении изобретения микроорганизм происходит из семейства бактерий Enterobacteriaceae или Corynebacteriaceae.
Предпочтительно данный микроорганизм представляет собой Escherichia coli или Corynebacterium glutamicum. Более предпочтительно микроорганизм по изобретению представляет собой Е. coli.
Культуральные условия
Во втором аспекте изобретения способ оптимизирован для ферментативной продукции метионина и/или его производных. Он включает следующие стадии:
- культивирование рекомбинантного микроорганизма, в котором ослаблен импорт метионина посредством ослабления экспрессии по меньшей мере одного гена среди metN, metI, metQ и усилен отток метионина путем сверхэкспрессии генов ygaZH или гомологичных им генов в подходящей культуральной среде, содержащей ферментируемый источник углерода и источник серы и
- выделение метионина и/или его производных из культуральной среды.
Специалисты в данной области способны определять культуральные условия для микроорганизмов согласно изобретению. В частности бактерии осуществляют ферментацию при температуре от 20°С до 55°С, предпочтительно от 25°С до 40°С и более конкретно - при примерно 30°С для C. glutamicum и примерно 37°С для Е. coli.
Для Е. coli культуральная среда может иметь состав, идентичный или аналогичный среде М9 (Anderson, 1946), среде М63 (Miller, 1992); или такой среде, как определено Schaefer et al., (1999).
Для C. glutamicum культуральная среда может иметь состав, идентичный или аналогичный среде BMCG (Liebl et al., 1989) или такой среде, как описано Riedel et al., (2001).
В способе по изобретению гены, гомологичные ygaZH, которые сверхэкспрессируются в рекомбинантном микроорганизме, предпочительно выбраны среди группы, состоящей из гомологичных генов из видов Citrobacter, видов Shigella, видов Raoultella, видов Enterobacter, видов Yersinia и видов Photorhabdus и более предпочтительно происходят из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii.
Согласно конкретному аспекту изобретения способ осуществляется с использованием рекомбинантного микроорганизма, который имеет:
а. делецию по меньшей мере одного гена, выбранного среди metN, metI или metQ и
б. сверхэкспрессию генов ygaZH или гомологичных им генов.
В данном конкретном аспекте способа по изобретению указанные гены, гомологичные ygaZH, предпочтительно выбраны среди группы, состоящей из гомологичных генов из видов Citrobacter, видов Shigella, видов Raoultella, видов Enterobacter, видов Yersinia и видов Photorhabdus и более предпочтительно выбраны среди групп, состоящих из гомологичных генов из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii.
В способе по изобретению гены, гомологичные ygaZH, которые сверхэкспрессируются в рекомбинантном микроорганизме, наиболее предпочтительно происходят из Citrobacter koseri, Citrobacter youngae, Citrobacter freundii или Enterobacter sp.
В некотором воплощении изобретения рост рекомбинантного микроорганизма подвергают ограничению или голоданию в отношении одного или нескольких неорганических субстратов, в частности, фосфата и/или калия в культуральной среде. Оно относится к условию, при котором рост микроорганизмов управляется количеством поставляемого неорганического химического соединения, которое все еще обеспечивает слабый рост. Такое ограничение роста микроорганизма было описано в патентной заявке WO 2009/043372. В предпочтительном воплощении изобретения культуру подвергают ограничению в отношении количества фосфата. В конкретном воплощении способа по изобретению рекомбинантный микроорганизм происходит из семейства бактерий Enterobacteriaceae или Corynebacteriaceae. Предпочтительно рекомбинантный микроорганизм представляет собой Escherichia coli или Corynebacterium glutamicum, и более предпочтительно рекомбинантный микроорганизм по изобретению представляет собой Е. coli.
Действие «выделение метионина и/или его производных из культуральной среды» обозначает действие по выделению L-метионина и/или одного из его производных, в частности N-ацетилметионина (NAM) и S-аденозилметионина (SAM) и всех других производных, которые могут быть полезными, таких как гидросиметионин (или аналог гидросиметионина, или МНА). Способы выделения и очистки полученных соединений хорошо известны специалистам в данной области (см. в частности WO 2005/007862, WO 2005/059155). Предпочтительно стадия выделения метионина и/или его производных включает стадию концентрирования метионина и/или его производных в ферментационном бульоне.
Количество продукта в ферментационной среде можно определять с использованием целого ряда способов, известных в данной области, например, высокоэффективной жидкостной хроматографии (ВЭЖХ) или газовой хроматографии (ГХ). Например, количество метионина, полученного в среде, измеряют ВЭЖХ после дериватизации OPA/Fmoc с использованием L-метионина (Fluka, Ref 64319) в качестве стандарта. Количество NAM определяется с использованием рефрактометрической ВЭЖХ с использованием NAM (Sigma, Ref 01310) в качестве стандарта.
ПРИМЕРЫ
Настоящее изобретение, кроме того, определено в следующих примерах. Следует понимать, что данные примеры, в то время как они указывают предпочтительные воплощения изобретения, приведены лишь ради иллюстрации. Из приведенного выше раскрытия и данных примеров, специалист в данной области может делать разные изменения изобретения для его адаптации к разным применениям и условиям без модификации существенных способов по изобретению.
В частности, примеры демонстрируют модифицированные штаммы Escherichia coli (Е. coli), но данные модификации можно легко проводить в других микроорганизмах того же самого семейства.
Escherichia coli принадлежит к семейству Enterobacteriaceae, которое содержит членов, которые являются грамотрицательными, палочковидными, неспорообразующими бактериями, типично имеющими длину 1-5 мкм. Большинство членов имеют жгутик, используемый для перемещения, но несколько родов являются неподвижными. Многие члены данного семейства являются нормальным компонентом кишечной флоры, находящимся в кишечнике человека и других животных, тогда как другие встречаются в воде или почве, или представляют собой паразитов на целом ряде разных животных и растений. Б. coli является одним из самых важных модельных организмов, но другие важные члены семейства Enterobacteriaceae включают Klebsiella, в частности Klebsiella terrigena, Klebsiella planticola или Klebsiella oxytoca, и Salmonella.
Кроме того, в нескольких патентных заявках отмечено то, что оптимизацию продукции метионина можно легко применять в E. coli и в Corynebacterium glutamicum без чрезмерного экспериментирования.
ПРОТОКОЛЫ
Для конструирования штаммов, продуцирующих метионин, описанных в следующих примерах, использовали несколько протоколов.
Протокол 1 (хромосомные модификации посредством гомологичной рекомбинации и отбор рекомбинантов) и протокол 2 (трансдукция фага Р1), использованные в данном изобретении, были полностью описаны в патентной заявке WO 2013/001055.
Протокол 3: конструирование рекомбинантных плазмид Генная инженерия хорошо описана и известна специалисту в данной области. Вкратце, фрагменты ДНК ПЦР-амплифицировали с использованием олигонуклеотидов (которые сможет определить специалист в данной области) и геномной ДНК MG1655 в качестве матрицы. Фрагменты ДНК и отобранную плазмиду расщепляли совместимым рестрикционным ферментом (который может определить специалист в данной области), затем лигировали и трансформировали в компетентные клетки. Анализировали трансформантов, и интересующую рекомбинантную плазмиду подтверждали путем секвенирования ДНК.

Протокол 4: излечивание плазмид
Данный способ излечивания плазмид основан на высоковольтной электропорации, которая обычно используется для трансформации ДНК. Для излечивания плазмид принцип является скорее таким же, за исключением того, что перед ударом электрическим разрядом к клетке не добавляют ДНК (Heery et al, 1989).
Методики трансформации ДНК хорошо описаны и известны специалисту в данной области.
Вкратце, штамм, для которого плазмида должна быть удалена, культивировали до экспоненциальной фазы роста. Затем клетки осаждали и промывали три раза в стерильной деионизированной воде. Клетки инкубировали на льду в течение пяти-десяти минут перед проведением через воздействие одного электрического импульса в 2,50 кВ, 25 мкФ (временная константа приблизительно 4,5 мс). Немедленно после воздействия импульса добавляли один мл буфера SOC, и клетки выращивали при подходящей температуре в течение одного-двух часов перед посевом на неселективные среды для избавления от плазмиды (антибиотики добавляют согласно тому, чтобы сохранять в штамме другие плазмиды). После выделения излеченных клеток подтверждали отсутствие плазмиды.
ПРИМЕР 1: сверхэкспрессия системы секреции L-метионина в рекомбинантном штамме Е. coli - сверхпродуценте L-метионина - конструирование штамма 1
Штамм 16, продуцирующий метионин, описанный в патентной заявке WO 2013/001055 (которая включена в данную заявку в виде ссылки), использовали в качестве штамма-реципиента. Данный штамм содержит мутацию в гене metE, раскрытую в патентной заявке WO 2013/190343.
Ген metH, кодирующий кобаламин-зависимую метионинсинтазу, сверхпродуцировали с использованием такого же промотора и сайта связывания рибосомы, которые описаны в патентной заявке WO 2007/077041, и искусственной бактериальной хромосомы (pCC1BAC, Epicentre). Более конкретно, ген metH и искусственный промотор клонировали в плазмиду типа pCC1BAC, содержащуюся в штамме 17, описанном в патентной заявке WO 2013/001055. Данную плазмиду называли рМЕ1109.
Параллельно гены fldA и fpr, кодирующие систему реактивации MetH, сверхэкспрессировали из плазмиды с умеренным числом копий pCL1920 (Lerner & Inouye, 1990) с использованием их природных промоторов. Данную плазмиду называли рМЕ1089.
В третьих, сверхэкспрессировали гены ygaZH, кодирующие экспортер метионина. Их клонировали на плазмиде с умеренным числом копий pCL1920 (Lerner & Inouye, 1990) с применением природного промотора ygaZ. Более конкретно оперон ygaZH и его промотор клонировали в описанную выше рМЕ1089. Данную плазмиду назвали рМЕ1219.
Наконец, плазмиды рМЕ1109 и рМЕ1219 трансформировали в штамм 16, продуцирующий метионин, согласно патентной заявке WO 2013/001055, получая штамм 1.
ПРИМЕР 2: делеция системы поглощения L-метионина в штамме E. coli - сверхпродуценте L-метионина - конструирование штаммов 2, 3, 4 и 5
Штамм 16, продуцирующий метионин, согласно патентной заявке WO 2013/001055, трансформировали плазмидами рМЕ1109 и рМЕ1089 (описанными в Примере 1), получая штамм 2.
Для инактивации импортера метионина, кодируемого в штамме 2 опероном metNIQ, использовали стратегию гомологичной рекомбинации, описанную Datsenko & Wanner, 2000 (согласно Протоколу 1). Таким образом, олигонуклеотиды Ome0233/Ome0232 (SEQ ID No 21 и 22, перечисленные в Таблице 1) использовали для ПЦР-амплификации кассеты устойчивости к хлорамфениколу из плазмиды pKD3. Полученный ПЦР-продукт затем вводили в штамм MG1655 metA*11 (pKD46) посредством электропорации. Затем отбирали трансформантов, устойчивых к хлорамфениколу, и вставку кассеты устойчивости подтверждали посредством анализа ПЦР с подходящими олигонуклеотидами. Сохраненный штамм обозначается MG1655 metA*11 ΔmetNIQ::Cm. Наконец, делецию ΔmetNIQ::Cm переносили посредством трансдукции фагом Р1 (согласно Протоколу 2) из штамма MG1655 metA*11 ΔmetNIQ::Cm в штамм 2. Отбирали трансдуктантов, устойчивых к хлорамфениколу, и присутствие хромосомной делеции ΔmetNIQ::Cm подтверждали посредством ПЦР с подходящими олигонуклеотидами. Сохраненный штамм называли штамм 3.
Таким же образом в штамме 1 подвергали делеции 3 гена - metN, metI и metQ, описанные в патентной заявке WO 2013/001055. Этот штамм 1 из патентной заявки WO 2013/001055 в данном документе переименовали в штамм 4 для того, чтобы он служил в качестве контроля для штамма 5.
Делеция metNIQ, проведенная в штамме 4, как описано выше, дала штамм 5.
ПРИМЕР 3: комбинация сверхэкспрессии системы секреции L-метионина с делецией системы поглощения L-метионина в штамме Е. coli - сверхпродуценте L-метионина - конструирование штамма 6
Для инактивации импортера метионина, кодируемого опероном metNIQ в штамме, сверхпродуцирующем экспортер метионина, кодируемый опероном ygaZH, делецию ΔmetNIQ::Cm переносили посредством трансдукции фагом Р1 (согласно Протоколу 2) из штамма MG1655 metA*11 ΔmetNIQ::Cm в штамм 1, продуцирующий метионин. Отбирали трансдуктанов, устойчивых к хлорамфениколу, и присутствие хромосомной делеции ΔmetNIQ::Cm подтверждали посредством ПЦР с использованием подходящих олигонуклеотдов. Сохраненный штамм называли штамм 6.
ПРИМЕР 4: продукция L-метионина посредством ферментации в биореакторе
Штаммы, которые продуцировали L-метионин, тестировали при условиях продукции в 2,5 л реакторах (Pierre Guerin) с использованием стратегии подпитки.
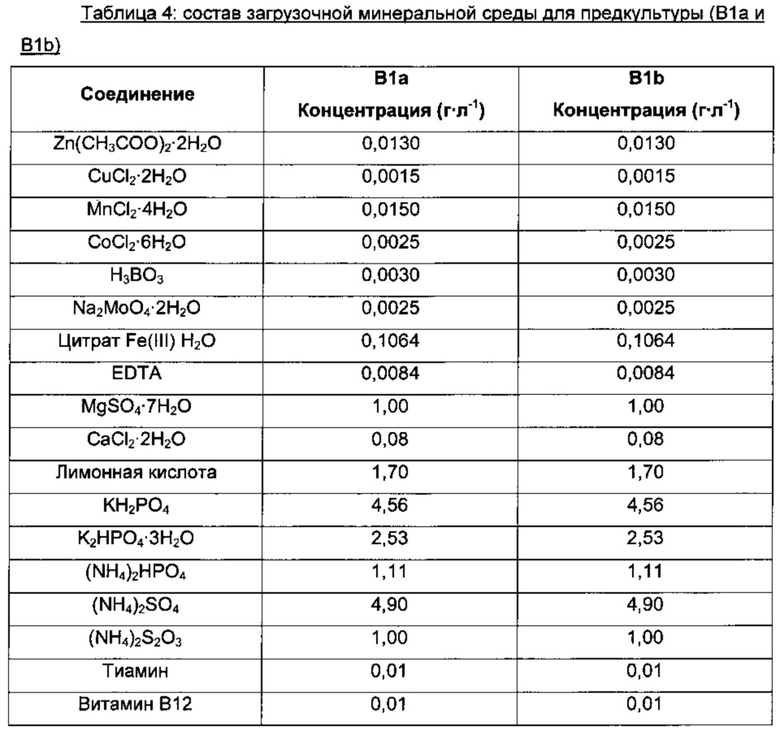
Вкратце, 24-часовую культуру, выращенную в 10 мл среды LB с 2,5 г⋅л-1 глюкозы, использовали для инокуляции 24-часовой предкультуры в минимальной среде (В1а). Данные инкубации проводили в 500 мл колбах с дефлектором, содержащих 50 мл минимальной среды (В1а), на ротационном шейкере (200 об./мин). Первую предкультуру осуществляли при температуре 30°С, вторую предкультуру - при температуре 34°С.
Третью стадию предкультуры проводили в биореакторах (Sixfors), заполненных 200 мл минимальной среды (B1b), инокулированной до концентрации биомассы 1,2 г⋅л-1 5 мл концентрированной предкультуры. Температуру предкультуры поддерживали на постоянном уровне - 34°С, и pH автоматически подводили до значения 6,8 с использованием 10%-ного раствора NH4OH. Концентрацию растворенного кислорода непрерывно подводили до значения 30% насыщения парциального давления воздуха посредством подачи воздуха и/или встряхивания. После исчерпания глюкозы в загрузочной среде начинали подпитку с исходной скоростью тока 0,7 мл⋅ч-1 перед ее экспоненциальным увеличением в течение 26 часов со скоростью увеличения 0,13 ч-1 для того, чтобы получить конечную концентрацию клеток примерно 20 г⋅л-1.

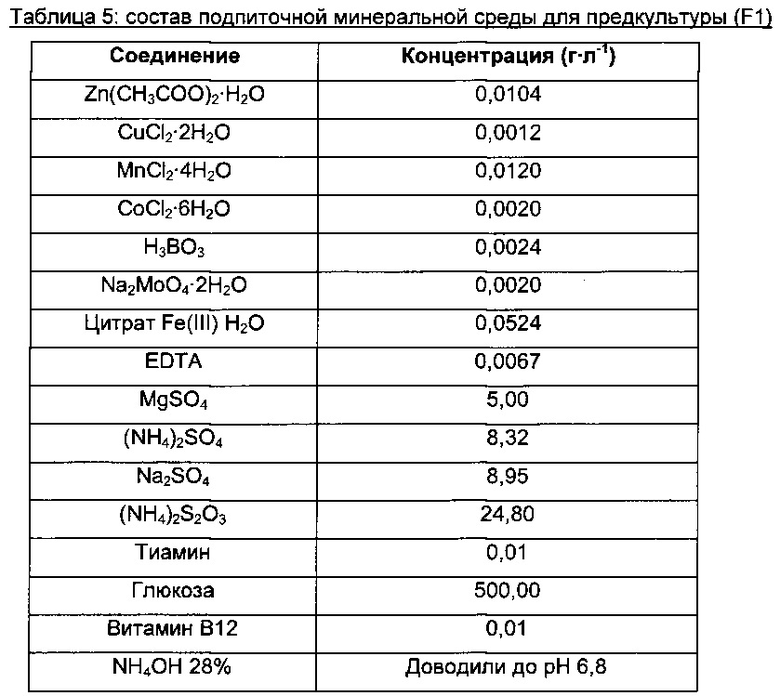
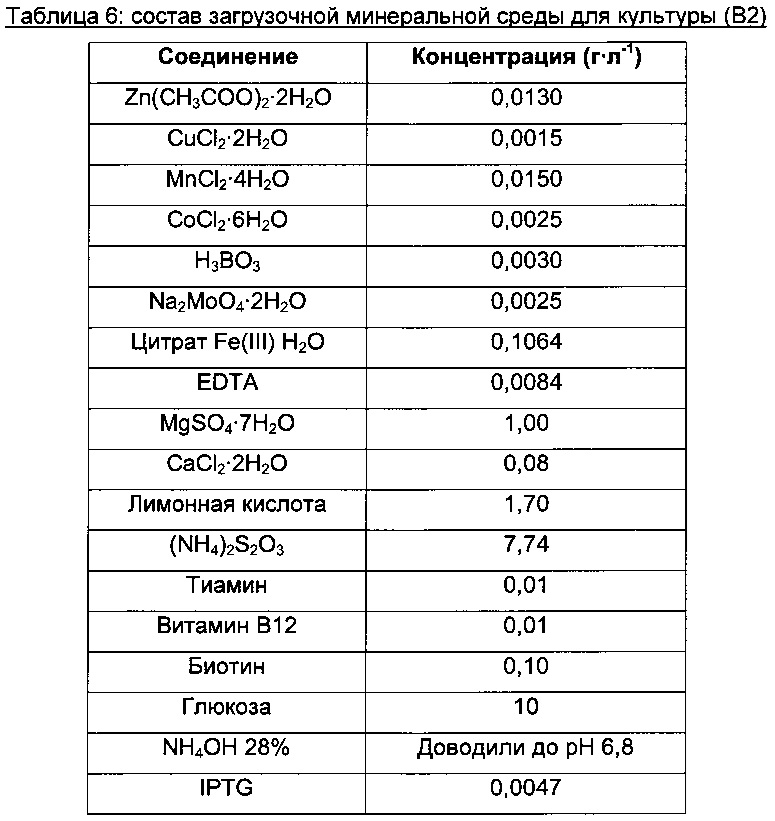
Затем 2,5 л ферментеры (Pierre Guerin) заполняли 600 или 620 мл минимальной среды (В2) и инокулировали до концентрации биомассы 3,2 г⋅л-1 объемом предкультуры, варьирующим от 80 до 100 мл.
Рост клеток контролируется фосфатом, поэтому конечную концентрацию фосфата в загрузочной среде В2 доводили до значения, составляющего от 0 до 20 мМ, путем добавления разных концентраций KH2PO4, K2HPO4 и (NH4)2HPO4. Таким же образом, конечная концентрация фосфата среды F2 была доведена до значения, составляющего от 5 до 30 мМ, путем добавления разных концентраций KH2PO4, K2HPO4 и (NH4)2HPO4. Концентрацию тиосульфата в подпиточной среде можно корректировать для предотвращения голодания по этому соединению во время культуры.
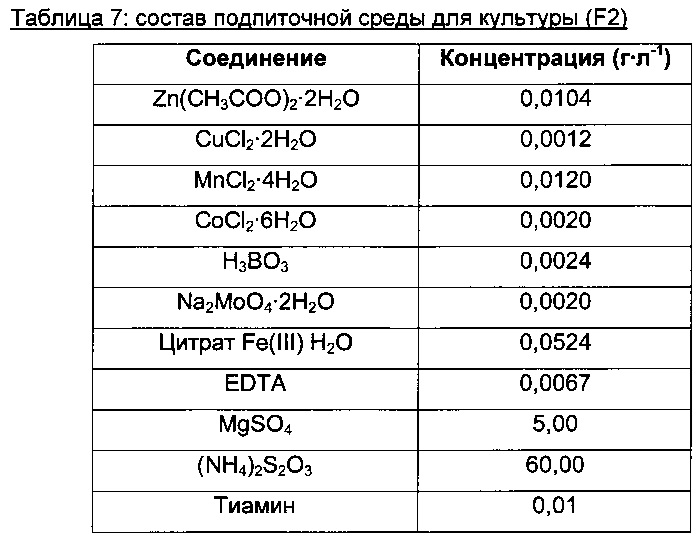
Температуру культуры поддерживали на постоянном уровне - 37°С, и pH поддерживали при рабочем значении (6,8) путем автоматического добавления растворов NH4OH (10% и 28%). На протяжении загрузочной фазы устанавливали исходную скорость встряхивания 200 об./мин, и ее увеличивали вплоть до 1000 об./мин во время подпиточной фазы. На протяжении загрузочной фазы устанавливали исходную скорость тока воздуха 40 л⋅ч-1, и ее увеличивали до 100 л⋅ч-1 в начале подпиточной фазы. Концентрацию растворенного кислорода поддерживали на уровне от 20 до 40%, предпочтительно 30% от насыщения путем усиления встряхивания.
Когда это было необходимо, в загрузочную и подпиточную среды добавляли IPTG в конечной концентрации 20 мкМ. При необходимости добавляли антибиотики в концентрации 50 мг⋅л-1 для спектиномицина, 30 мг⋅л-1 для хлорамфеникола и 100 мг⋅л-1 для ампициллина.
При достижении клеточной массой концентрации, близкой к 5 г⋅л-1, начинали подпитку с исходной скоростью тока 5 мл⋅ч-1. Подпиточный раствор инъецировали с сигмоидным профилем с возрастающей скоростью тока, которая достигала 24 мл⋅ч-1 через 25 часов. Точные условия подпитки были рассчитаны посредством уравнения: 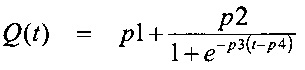 ,
,
где Q(t) представляет собой скорость тока подпитки в мл⋅ч-1 с р1 равным 1,80; р2 равным 22,4; p3 равным 0,27, р4 равным 6,50. Данную скорость тока увеличивали от 10 до 50%, предпочтительно от 20 до 30% на всем протяжении культуры.
После 25 часов подпитки насос с подпиточным раствором останавливали, и культивирование прекращали после исчерпания глюкозы.
Внеклеточные аминокислоты количественно измеряли ВЭЖХ (высокоэффективная жидкостная хроматография) после дериватизации OPA/Fmoc, и другие релевантные метаболиты анализировали с использованием ВЭЖХ с рефрактометрической детекцией (органические кислоты и глюкоза) и ГХ-МС (газовая хроматография-масс-спектрометрия) после силилирования.
Тестировали влияние комбинации делеции оперона metNIQ и/или сверхэкспрессии оперона ygaZH на продукцию метионина. Результаты представлены в Таблице 8 и Таблице 9.
Таблица 8: максимальные и конечные выходы метионина, продуцированного в культурах с подпиткой разными штаммами. Эффективности интересующих штаммов - штаммов 3, 1 и 6, сравниваются с контрольным штаммом - штаммом 2, культивируемыми в одинаковых условиях. Символ ~ показывает то, что отсутствует различие между штаммами, символ + показывает увеличение от 1 до 3%, и символ ++ показывает увеличение, большее чем 3%. Относительно определения выхода метионина/глюкозу, см. ниже.
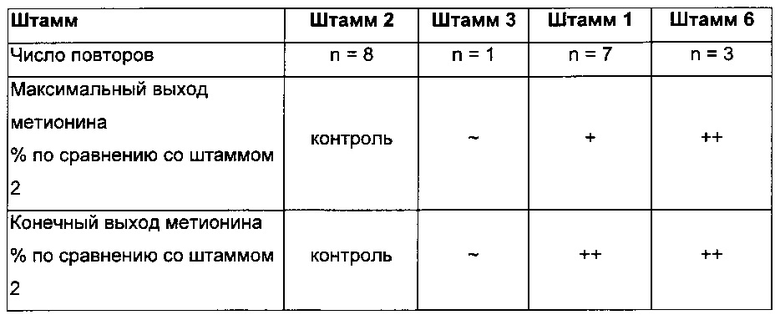
Результаты, представленные в Таблице 8, показывают то, что делеция оперона metNIQ не приносила пользы для продукции метионина (штамм 3) на генетическом фоне штамма 2. Следовательно, данную генетическую модификацию тестировали в штамме 4 с другим генетическим фоном, чем у штамма 2. Данный анализ показывает отрицательное влияние делеции оперона metNIQ на продукцию метионина (см. Таблицу 9 ниже). Штаммы 4 и 5 культивировали в 2 л реакторах, как описано в патентной заявке WO 2013/001055.
Таблица 9: максимальные и конечные выходы метионина, продуцированного в культурах с подпиткой штаммом 5. Эффективности интересующего штамма (штамма 5) сравниваются с контрольным штаммом - штаммом 4, культивируемыми в одинаковых условиях. Символ «-» показывает уменьшение, большее чем 4% по сравнению с контрольным штаммом. Относительно определения выхода метионина/глюкозу, см. ниже.
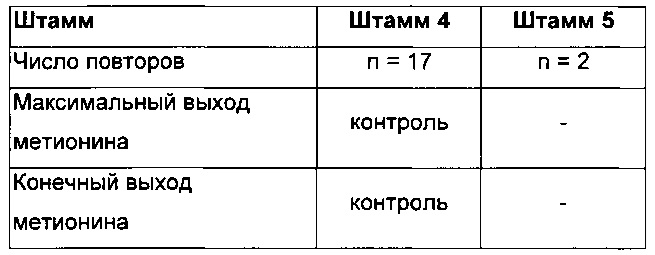
Данные результаты показывают то, что, в отличие от предшествующего уровня техники, описанного для C. glutamicum, делеция одного оперона metNIQ в E. coli не увеличивает продукцию метионина, каким бы ни был генетический фон (штамм 3 и 5). Кроме того, эффективности штамма 5 ниже эффективностей его материнского штамма (штамма 4). Даже если сверхэкспрессия ygaZH приводит к повышенной продукции метионина (штамм 1, Таблица 8) в конце культуры, комбинация делеции оперона metNIQ и сверхэкспрессии ygaZH неожиданно увеличивает общие эффективности продукции метионина из штамма 6. Данный результат не ожидался, так как было показано то, что делеции оперона metNIQ имеет негативный или нейтральный эффект на эффективности продукции L-метионина на разном генетическом фоне, включая материнский штамм.
Определение выхода метионина/глюкозу (Ymet)
Объем реактора рассчитывали путем суммирования исходного объема количества растворов, добавленных для регуляции pH и подпитки культуры, и путем вычитания объема, использованного для отбора образцов и потерянного в результате испарения.
Подпиточный объем непрерывно отслеживали путем взвешивания подпиточного маточного раствора. Затем рассчитывали количество инъецированной глюкозы на основе инъецированной массы, плотности раствора и концентрации глюкозы, определенной способом Brix ([Глюкоза]). Выход метионина выражали следующим образом:
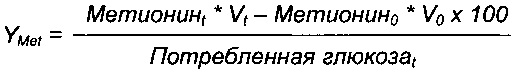
Причем Метионин0 и Метионинt представляют собой исходную и конечную концентрации метионина соответственно, и V0 и Vt представляют собой исходный объем и текущий объем в момент времени t.
Потребленную глюкозу рассчитывали следующим образом:
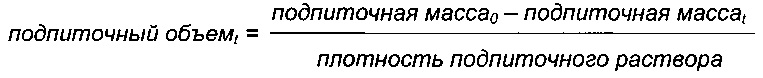
Инъецированная глюкозаt = подпиточный объемt * [Глюкоза]
Потребленная глюкозаt = [Глюкоза]0 * V0 + Инъецированная глюкоза - [Глюкоза]остаточная * Vt, причем [Глюкоза]0, [Глюкоза], [Глюкоза]остаточная представляют собой исходную, подпиточную и остаточную концентрации глюкозы соответственно.
ПРИМЕР 5: комбинация делеции системы поглощения L-метионина со сверхпродукцией разных систем секреции L-метионина из разных микроорганизмов в штамме Е. coli - сверхпродуценте L-метионина - конструирование штаммов 7-15
Гены, гомологичные ygaZH, из видов Citrobacter, видов Raoultella, видов Shigella, видов Enterobacter, видов Yersinia и видов Photorhabdus сверхэкспрессировали на генетическом фоне штамма 3.
Перед применением штамма 3 плазмиду рМЕ1089 удаляли из данного штамма с использованием способа излечивания плазмид, как описано Heery et al, 1989 (согласно Протоколу 4). Отбирали излеченные клетки без плазмиды рМЕ1089, но сохранившие плазмиду рМЕ1109. Образующийся штамм называли штамм 7.
Конструирование штаммов 8-15 - сверхпродукция гомологичных систем секреции L-метионина, сверхэкспрессия yqaZH из родов и видов, перечисленных в таблице 10
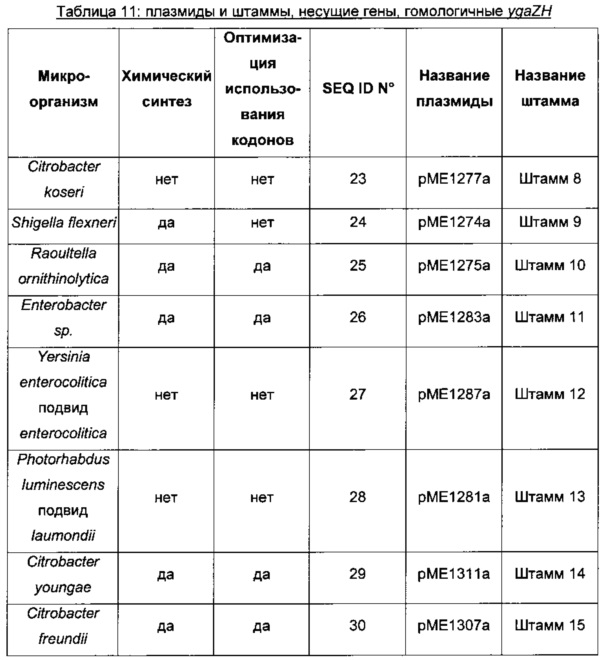
Для сверхэкспрессии генов, гомологичных ygaZH, перечисленных в таблице 10, каждую пару генов клонировали на плазмиде с умеренным числом копий pCL1920 (Lerner & Inouye, 1990) с применением природного промотора и природного сайта связывания рибосомы гена ygaZ Е. coli, как описано ранее для генов ygaZH Е. coli. Более конкретно, гены, гомологичные ygaZH, клонировали в плазмиду рМЕ1089, описанную выше. Как определено в таблице 11, гены, гомологичные ygaZH, либо амплифицировали из геномной ДНК соответствующего штамма, либо синтезировали химически с оптимизацией или без оптимизации использования кодонов до Е. coli (как предложено службой GeneArt® Gene Synthesis с использованием программы GeneOptimizer® - Lifetechnologies). Амплифицированные фрагменты ДНК, содержащие гены, гомологичные ygaZH, раскрыты в SEQ ID, указанных в Таблице 11. Образующиеся плазмиды назвали, как упомянуто в Таблице 11. Наконец, каждую плазмиду трансформировали в штамм 7, получая штаммы 8-15, перечисленные как «название штамма» в Таблице 11.
ПРИМЕР 6: продукция L-метионина посредством ферментации в экспериментах в колбах
Рекомбинантных продуцентов L-метионина, имеющих делецию оперона metNIQ в сочетании со сверхэкспрессией разных систем секреции L-метионина из разных микроорганизмов (гомологичных YgaZH из Е. coli), оценивали в маленьких колбах Эрленмейера.
5,5 мл предкультуры выращивали при 30°С в течение 21 часа в смешанной среде (10% среды LB (Sigma 25%) с 2,5 г⋅л-1 глюкозы и 90% минимальной среды РС1, Таблица 12). Ее использовали для инокуляции 50 мл культуры до ОП600 (оптическая плотность при длине волны 600 нм) 0,2 в среде РС1. Когда это было необходимо, добавляли спектиномицин и канамицин в концентрации 50 мг⋅л-1, хлорамфеникол в концентрации 30 мг⋅л-1 и гентамицин в концентрации 10 мг⋅л-1. Температура культур составляла 37°С. При достижении культурой ОП600 от 5 до 7, внеклеточные аминокислоты количественно измеряли посредством ВЭЖХ после дериватизации OPA/Fmoc, и другие релевантные метаболиты анализировали с использованием ВЭЖХ с рефрактометрическим выявлением (органические кислоты и глюкоза) и ГХ-МС (газовая хроматография-масс-спектрометрия) после силилирования.
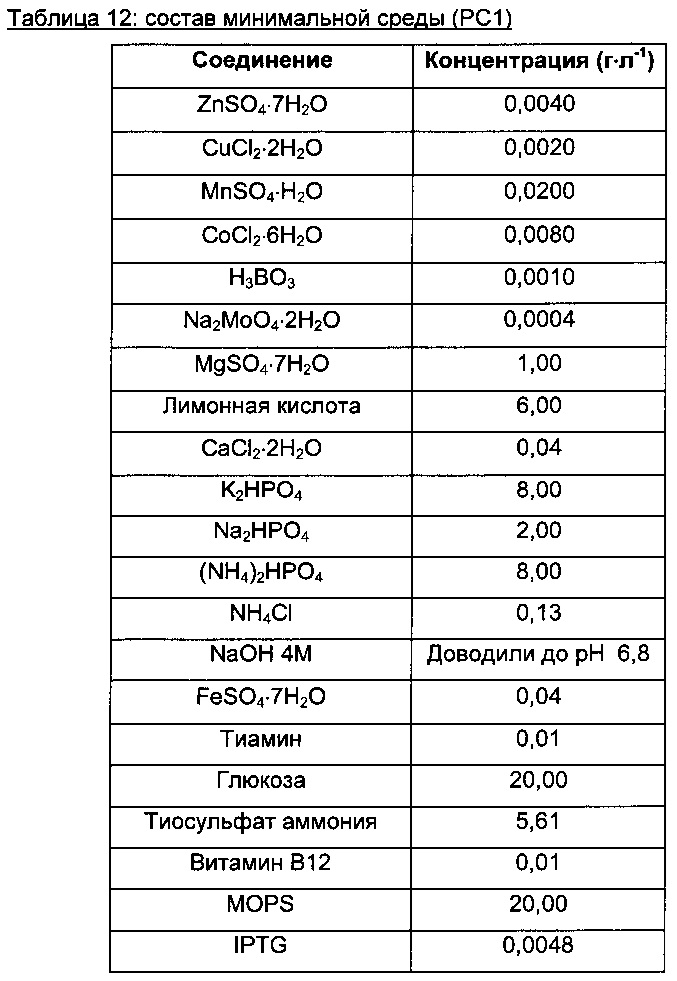
Таблица 13: выход метионина (Ymet) в г метионина / % г глюкозы, продуцированного в культуре в колбе интересующими штаммами, несущими гены, гомологичные ygaZH, и делецию оперона metNIQ. В том, что касается точного определения выхода метионина/глюкозу, см. ниже, «n» указывает число повторов.

Как можно видеть в таблице 13, сверхэкспрессия генов, гомологичных ygaZH, из разных микроорганизмов в продуценте L-метионина, несущем делецию оперона metNIQ, приводит к эквивалентным или лучшим эффективностям, чем эффективности, полученные со штаммом 6, который сверхэкспрессирует ygaZH из Е. coli. Гомологичные системы секреции L-метионина из микроорганизмов, отличных от Е. coli, могут заменять эндогенные белки бактерии. Белки, гомологичные YgaZH, из Citrobacter koseri (штамм 8, Ymet равен 19,6 г/г), Citrobacter youngae (штамм 14, Ymet равен 19,6 г/г), Citrobacter freundii (штамм 15, Ymet равен 19,6 г/г) и Enterobacter sp. (штамм 11, Ymet равен 19,4 г/г) демонстрировали наилучшие выходы продукции L-метионина, по сравнению со штаммом 6 (Ymet равен 18,7 г/г).
Выход метионина выражали следующим образом:
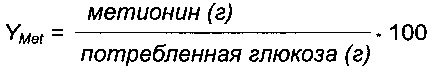
ССЫЛКИ
- Anderson, 1946, Proc. Natl. Acad. Sci. USA 32:120-128.
- Carrier Т., Keasling J.D., 1999, Biotechnology Progress, 15:58-64
- Datsenko K.A., Wanner B.L., 2000, Proceedings of the National Academy of Sciences of the USA, 97:6640-6645
- Heery D.M., Powell R., Gannon F., Dunican L.K., 1989, Nucleic Acids Res. 17(23): 10131
- Jones P.M. and George A.M., 1999, FEMS Microbiol. Lett. 179:187-202
- Kadner R.J. and Winkler H.H., 1975, Journal of Bacteriology. 123(3):985-991
- Kadner R.J., 1974, Journal of Bacteriology. 117(1):232-241
- Kadner R.J., 1975, Journal of Bacteriology. 122(1):110-119
- Lerner C.G. and Inouye M., 1990, Nucleic Acids Research, 18(15):4631
- Liebl et al., 1989, Appl. Microbiol. Biotechnol. 32: 205-210.
- Merlin C., Gardiner G., Durand S., Masters M., 2002, Journal of Bacteriology. 184(19):5513-5517
- Miller, 1992; "A Short Course in Bacterial Genetics: A Laboratory Manual and Handbook for Escherichia coli and Related Bacteria", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Riedel et al., 2001, J. Mol. Microbiol. Biotechnol. 3: 573-583.
- Saunderson C.L., 1985, British Journal of Nutrition, 54:621-633
- Schaefer et al. 1999, Anal. Biochem. 270: 88-96.
-  C., Deutenberg D., Bathe В., Burkovski A.,
C., Deutenberg D., Bathe В., Burkovski A.,  R., 2005, Journal of Bacteriology. 187(11):3786-3794
R., 2005, Journal of Bacteriology. 187(11):3786-3794




























Группа изобретений относится к области биотехнологии. Предложен рекомбинантный штамм Escherichia coli (Е. coli), оптимизированный для ферментативной продукции L-метионина, где в указанном рекомбинантном штамме подвергаются делеции гены metN, metI и metQ, и указанный рекомбинантный штамм включает увеличенное число копий генов ygaZH или гомологичных им генов или включает промотор, ведущий к повышенной экспрессии генов ygaZH или гомологичных им генов, посредством чего сверхэкспрессируются гены ygaZH или гомологичные им гены. Предложен способ оптимизации ферментативной продукции L-метионина, путем культивирования указанного рекомбинантного штамма Е. coli. Группа изобретений позволяет повысить продукцию L-метионина по сравнению с контрольным штаммом. 2 н. и 12 з.п. ф-лы, 13 табл., 6 пр.
1. Рекомбинантный штамм Escherichia coli (Е. coli), оптимизированный для ферментативной продукции L-метионина, где в указанном рекомбинантном штамме подвергаются делеции гены metN, metI и metQ, и указанный рекомбинантный штамм включает увеличенное число копий генов ygaZH или гомологичных им генов или включает промотор, ведущий к повышенной экспрессии генов ygaZH или гомологичных им генов, посредством чего сверхэкспрессируются гены ygaZH или гомологичные им гены.
2. Штамм Е. coli по п. 1, в котором указанные гены, гомологичные ygaZH, выбраны среди группы, состоящей из гомологичных генов из видов Citrobacter, видов Shigella, видов Raoultella, видов Enterobacter, видов Yersinia и видов Photorhabdus.
3. Штамм Е. coli по п. 2, в котором гены, гомологичные ygaZH, происходят из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii.
4. Штамм E. coli по п. 1, в котором ygaZH или гомологичные гены экспрессируются под контролем индуцибельного промотора.
5. Штамм Е. coli по п. 1, в котором также усиливается экспрессия по меньшей мере одного из следующих генов: ptsG, pyc, pntAB, cysP, cysU, cysW, cysA, cysM, cysJ, cysI, cysH, gcvT, gcvH, gcvP, Ipd, serA, serB, serC, cysE, metF, metH, fldA, fpr, metA, аллель metA*, кодирующий фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи, thrA или аллель thrA*, кодирующий фермент с ослабленным ингибированием треонином по механизму обратной связи.
6. Штамм Е. coli по п. 5, в котором по меньшей мере один из указанных генов находится под контролем индуцибельного промотора.
7. Штамм Е. coli по п. 1, в котором также ослабляется экспрессия по меньшей мере одного из следующих генов: metJ, pykA, pykF, purU, ybdL, yncA, metE, dgsA или udhA.
8. Штамм E. coli по п. 1, в котором указанные гены, гомологичные ygaZH, выбраны среди группы, состоящей из гомологичных генов из видов Citrobacter, видов Shigella, видов Raoultella, видов Enterobacter, видов Yersinia и видов Photorhabdus, где также усиливается экспрессия по меньшей мере одного из следующих генов: ptsG, pyc, pntAB, cysP, cysU, cysW, cysA, cysM, cysJ, cysI, cysH, gcvT, gcvH, gcvP, Ipd, serA, serB, serC, cysE, metF, metH, fldA, fpr, metA, аллель metA*, кодирующий фермент с пониженной чувствительностью к S-аденозилметионину и/или метионину по механизму обратной связи, thrA или аллель thrA*, кодирующий фермент с ослабленным ингибированием треонином по механизму обратной связи.
9. Штамм Е. coli по п. 8, в котором также ослабляется экспрессия по меньшей мере одного из следующих генов: metJ, pykA, pykF, purU, ybdL, yncA, metE, dgsA или udhA.
10. Штамм E. coli по любому из пп. 1-9, в котором:
а. гены metN, metI и metQ подвергаются делеции, и гены ygaZ и ygaH или гомологичные им гены сверхэкспрессируются,
б. экспрессия генов metA*, metH, cysPUWAM, cysJIH, gcvTHP, metF, serA, serB, serC, cysE, thrA*, ptsG и pyc усиливается; и
в. экспрессия генов metJ, pykA, pykF, purU, dgsA, metE и yncA ослабляется.
11. Способ оптимизации ферментативной продукции L-метионина, включающий стадии:
а. культивирования рекомбинантного штамма Escherichia coli (Е. coli), где в указанном штамме подвергаются делеции гены metN, metI и metQ, и указанный рекомбинантный штамм включает увеличенное число копий генов ygaZH или гомологичных им генов или включает промотор, ведущий к повышенной экспрессии генов ygaZH или гомологичных им генов, посредством чего сверхэкспрессируются гены ygaZH или гомологичные им гены, в подходящей культуральной среде, содержащей ферментируемый источник углерода и источник серы, и
б. выделения L-метионина из культуральной среды.
12. Способ по п. 11, в котором указанные гены, гомологичные ygaZH, выбраны среди группы, состоящей из гомологичных генов из видов Citrobacter, видов Shigella, видов Raoultella, видов Enterobacter, видов Yersinia и видов Photorhabdus.
13. Способ по п. 12, в котором указанные гены, гомологичные ygaZH, происходят из Citrobacter koseri, Shigella flexneri, Raoultella ornithinolytica, Enterobacter sp., Yersinia enterocolitica, Photorhabdus luminescens, Citrobacter youngae или Citrobacter freundii.
14. Способ по п. 11, в котором рост рекомбинантного штамма подвергается ограничению или недостаточности в отношении одного или нескольких неорганических субстратов, в частности фосфата и/или калия в культуральной среде.
| WO 2008127240 A1, 23.10.2008 | |||
| WO 2007012078 A1, 25.01.2007 | |||
| WO 2008082211 A1, 10.07.2008 | |||
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ, ШТАММ Escherichia coli - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2001 |
|
RU2215784C2 |
| РЕКОМБИНАНТНЫЕ МИКРООРГАНИЗМЫ, ПРОДУЦИРУЮЩИЕ МЕТИОНИН | 2006 |
|
RU2447146C2 |
Авторы
Даты
2019-01-31—Публикация
2014-09-01—Подача