Родственные заявки
Эта заявка заявляет приоритет на основании предварительной патентной заявки США №60/700,699, поданной 18 июля 2005, и предварительной заявки США №60/714,042, поданной 1 сентября 2005, обе озаглавленные «Рекомбинантные микроорганизмы, продуцирующие метионин», полное содержание каждой из которых включено сюда путем ссылки.
Дополнительно, эта заявка является родственной предварительной заявке США №60/700,698, поданной 18 июля 2005, и предварительной заявке США №60/713,907, поданной 1 сентября 2005, обе озаглавленные «Применение диметилдисульфида для продуцирования метионина в микроорганизмах», полное содержание каждой из которых включено сюда путем ссылки.
Эта заявка является также родственной предварительной патентной заявке США №60/700,557, поданной 18 июля 2005, и предварительной заявке США №60/713,905, поданной 1 сентября 2005, обе озаглавленные «Применение гена Bacillus MetI для улучшения продуцирования метионина в микроорганизмах», полное содержание каждой из которых включено сюда путем ссылки.
Полное содержание каждой из этих патентных заявок таким образом определенно включено сюда путем ссылки, включая, без ограничений, их описание, формулу изобретения и реферат, а также их любые рисунки, таблицы или чертежи.
Предшествующий уровень изобретения
Метионин - это аминокислота, используемая во многих областях промышленности, включая, но не ограничиваясь, корма для животных, фармацевтику, пищевые добавки, косметику и добавки к рациону. Метионин можно производить в больших масштабах множеством различных способов. Например, метионин можно производить химически сначала реакцией метилмеркаптана с акролеином, получая промежуточное соединение 3-метилмеркаптопропиональдегид (МРР). Дальнейшая обработка включает реакцию МРР с цианидом водорода, давая 5-(2-метилтиоэтил)гидантоин, который затем гидрализуется при помощи щелочи, такой как NaOH вместе с Na2CO3, NH3 и CO2. Впоследствии DL-метионин натрия нейтрализуется серной кислотой и Na2CO3, давая D, L-метионин, Na2SO4 и CO2. Этот процесс дает большое количество неиспользуемых соединений по сравнению с количеством метионина, что представляет собой экономическую и экологическую проблему.
Дополнительно, ферментация микроорганизмов могла бы также потенциально использоваться для производства метионина в больших масштабах, например, культивированием микроорганизмов с питательными веществами, включая, но не ограничиваясь, источники углеводов, например, сахара, такие как глюкоза, фруктоза или сахароза, гидролизованный крахмал, источники азота, например, аммиак, и источники серы, например, сульфат и/или тиосульфат, наряду с другими необходимыми или дополнительными компонентами среды. Этот процесс давал бы L-метионин и биомассу как побочный продукт без токсически опасных, воспламеняющихся, нестабильных, ядовитых исходных веществ.
Однако существующие процессы дают слишком низкие титр и выход метионина, произведенного с их помощью, чтобы быть коммерчески жизнеспособными. Следовательно, существует необходимость в поиске улучшенных способов производства метионина, которые не давали бы токсические химикаты и вредные побочные продукты, при этом оставаясь коммерчески значимыми.
Было доложено, что высокий уровень производства определенных аминокислот может быть достигнут путем изменения экспрессии всего трех или даже меньше генов и/или белков, кодируемых ими. Например, штамм, продуцирующий 80 г/л лизина, может быть сконструирован просто изменением экспрессии аспартокиназы, пиру-ваткарбоксилазы и гомосериндегидрогеназы (Ohnishi, J. et al., Appl. Microbiol. Biotechnol. 58(2):217-223 (2002)).
Сообщается, что изменение экспрессии следующих генов поодиночке или в комбинации с другими генами в бактериях приводит к продуцированию метионина: metF (См. WO/087386 A2, WO 04/024931 А2 и Публикация США №2002049305); metH (См. WO 04/024933 A2 и Публикация США №2002/0048793); metA (См. WO/024932 А2); metK (WO 03/100072 А2); sahH (См. EP 1507008); metY (См. Публикация США №20050064551); metR и/или metZ (См. Публикация США №2002/0102664); metE (Публикация США №20020110877); metD (См. Публикация США №20050074802), cysQ (См. WO 02/42466A2); cysD, cysN, cysK, cysE и cysH (См. WO 02/0086373); и metZ, metC, и rxa 00657 (См. WO 01/66573). Также сообщалось, что получение аналогичных резистентных штаммов, таких, например, как этионин-резистентные штаммы бактерий, продуцирующих аминокислоты, может приводить к производству метионина. (Kumar and Gomes, Biotechnology advances 23: 41-61 (2005)).
Однако поскольку биосинтез метионина включает введение восстановленного атома серы и считается более сложным, чем биосинтез других аминокислот, неясно, какая комбинация измененных генов и/или использование резистентных штаммов потребуется для производства коммерчески привлекательных уровней метионина.
Краткое содержание изобретения
Настоящее изобретение представляет новые и улучшенные способы повышения продуцирования метионина. В частности, изобретение основано, по меньшей мере частично, на открытии, что изменение определенных генов, например, методами генетической инженерии и классической генетики микроорганизмов, например, Corynebacterium glutamicum, обеспечивает повышенное продуцирование метионина.
Настоящее изобретение также относится к рекомбинантным микроорганизмам, которые продуцируют повышенные уровни метионина по сравнению с метионином, продуцируемым их аналогами дикого типа, способам получения таких микроорганизмов и способам производства метионина, при которых применяются такие микроорганизмы. В некоторых вариантах осуществления изобретения определенные комбинации измененных генов приводят к повышенному продуцированию метионина, значительно более высокому, чем любой титр, приведенный ранее, например, по меньшей мере, 15 г/л или, по меньшей мере, 16 г/л, или, по меньшей мере, 17 г/л или выше.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, включают генетические изменения в каждом из любых двух или более, или трех или более, или четырех или более, или пяти или более, или шести или более, или семи или более, или восьми или более генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии генов, таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии генетических изменений в каждом из любых двух или более, или трех или более, или четырех или более, или пяти или более, или шести или более, или семи или более, или восьми или более генов. В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы имеют генетические изменения в каждом из, по меньшей мере, пяти генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии, по меньшей мере, пяти генов, таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии генетических изменений в каждом из, по меньшей мере, пяти генов. Также здесь описаны рекомбинантные микроорганизмы, включающие генетические изменения в каждом из любых шести, или любых семи, или любых восьми генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии генов, таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии генетических изменений в каждом из любых шести, или любых семи, или любых восьми генов. Рекомбинантные микроорганизмы могут также включать генетические изменения во всех девяти генах askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии девяти генов, таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с про-дуцированием метионина в отсутствии генетических изменений в каждом из девяти генов.
Как здесь описано, повышенная экспрессия может быть достигнута различными способами, включая, но не ограничиваясь, например, увеличение транскрипции/трансляции гена, например, введением промоторных и/или энхансерных последовательностей выше гена, замещение промотора гетерологичным промотором, который увеличивает экспрессию гена или приводит к конститутивной экспрессии гена, увеличение количества копий гена при помощи эписомных плазмид или модификацией последовательности гена, и любые комбинации таких методов, такие что фермент(ы), кодируемые геном, обладают повышенной активностью или повышенной устойчивостью к ингибированию одним или более ингибирующих соединений по сравнению с его аналогом дикого типа. Дополнительно, повышенная экспрессия также может быть достигнута, например, удалением или мутацией гена фактора транскрипции, который в нормальных условиях подавляет экспрессию гена, для которого желательна повышенная экспрессия.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, включают генетические изменения в каждом из любых двух генов, выбранных из mcbR, hsk, metQ, metK и рерСК, где генетические изменения понижают экспрессию любых двух генов и/или активность белка, кодируемого любыми двумя генами (например, ферментативную активность), таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии генетических изменений в каждом из любых двух генов. В других вариантах осуществления изобретения рекомбинантные микроорганизмы, включенные в настоящее изобретение, включают генетические изменения в каждом из любых трех генов, или любых четырех генов, или всех пяти генов, выбранных из mcbR, hsk, metQ, metK и pepCK, где генетические изменения снижают экспрессию любых двух генов и/или активность белка, кодируемого генами, таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии генетических изменений в каждом из любых трех генов, или любых четырех генов, или всех пяти генов. При использовании здесь, снижение экспрессии гена может быть достигнуто множеством различных способов, включая, но не ограничиваясь, например, мутацию промотора гена, замещение промотора гена гетерологичным промотором, который уменьшает экспрессию гена, или модификацию последовательности гена, так что он кодирует белок или фермент(ы) со сниженной активностью по сравнению с его аналогом дикого типа. В определенных примерах снижение экспрессии достигается удалением или мутацией последовательности гена, так что белок или фермент продуцируется меньше или вообще не продуцируется. Дополнительно, снижение экспрессии гена может быть достигнуто, например, повышением экспрессии репрессора транскрипции гена.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, включенные в настоящее изобретение, включают генетические изменения в каждом из любых двух генов, или любых трех генов, или любых четырех генов, или любых пяти генов, или любых шести генов, или любых семи генов, или любых восьми генов, или всех девяти генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии каждого из любых двух генов, или любых трех генов, или любых четырех генов, или любых пяти генов, или любых шести генов, или любых семи генов, или любых восьми генов, или девяти генов, в комбинации с генетическими изменениями в каждом из любого одного гена, любых двух генов, или любых трех генов, или любых четырех генов, или пяти генов, выбранных из mcbR, hsk, metQ, metK и рерСК, где генетические изменения снижают экспрессию любого одного гена, любых двух генов, или любых трех генов, или любых четырех генов, или пяти генов, где комбинация приводит к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии комбинации. В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы включают генетические изменения в каждом из, по меньшей мере, пяти генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии каждого из, по меньшей мере, пяти генов в комбинации с генетическими изменениями, по меньшей мере, в одном гене, выбранном из mcbR, hsk, metQ, metK и рерСК, таким образом, приводя к сниженной экспрессии, по меньшей мере, одного гена, где микроорганизм продуцирует повышенный уровень метионина по сравнению с метионином, продуцируемым в отсутствии комбинации.
Например, в некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, включают генетические изменения в каждом гене, выбранном из группы, состоящей из askfbr, homfbr, metH, и askfbr, homfbr metE, таким образом, приводя к повышенной экспрессии каждого гена, в комбинации с генетическими изменениями в каждом из mcbR и hsk, таким образом, приводя к сниженной экспрессии mcbR и hsk, где микроорганизм продуцирует повышенный уровень метионина по сравнению с метионином, продуцируемым в отсутствии комбинации. В других вариантах осуществления изобретения рекомбинантные микроорганизмы включают генетические изменения в каждом из, по меньшей мере, шести генов, выбранных из группы, состоящей из askfbr, homfbr, metX (также называется metA), metY (также называется metZ), metF, metH, metE и askfbr, homfbr, metX, metY, metF и metE, таким образом, приводя к повышенной экспрессии, по меньшей мере, шести генов, в комбинации с генетическими изменениями в каждом из mcbR и hsk, таким образом, приводя к сниженной экспрессии mcbR и hsk, где микроорганизм продуцирует повышенный уровень метионина по сравнению с метионином, продуцируемым в отсутствии комбинации.
Рекомбинантные микроорганизмы, описанные здесь, могут также включать генетические изменения, приводящие к повышенной экспрессии одного или более генов пути биоситеза цистеина. Например, в некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, включают генетические изменения в каждом из двух или более, или трех или более, или четырех или более, или пяти или более, или шести или более, или семи или более, или восьми или более, или девяти или более, или десяти или более, или одиннадцати или более, или двенадцати или более, или тринадцати или более, или четырнадцати или более, или пятнадцати или более, или шестнадцати или более, или семнадцати или более, или восемнадцати или более, или девятнадцати или более, или двадцати или более, или двадцати одного или более, или двадцати двух или более, или двадцати трех или более, или двадцати четырех или более, или двадцати пяти или более, или двадцати шести или более, или двадцати семи или более, или двадцати восьми или более, или двадцати девяти или более, или тридцати или более, или тридцати одного или более, или тридцати двух или более, или тридцати трех или более, или тридцати четырех генов, выбранных из askfbr, homfbr, metX (также называется metA), metY (также называется metZ), metB, metK, metQ, metH, metE, metF, metC, zwf, frpAl, asd, cysE, cysK, cysN, cysD, cysH, cysl, cysC, cysX, cysM, cysA, cysQ, cysG, cysZ, cysJ, cysY, hsk, mcbR, рус, pepCK и ilvA, таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии генетических изменений.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, включают генетические изменения в каждом из, по меньшей мере, двух, или, по меньшей мере, трех, или, по меньшей мере, четырех, или, по меньшей мере, пяти, или, по меньшей мере, шести, или, по меньшей мере, семи, или, по меньшей мере, восьми, или, по меньшей мере, девяти, или, по меньшей мере, десяти, или, по меньшей мере, одиннадцати, или, по меньшей мере, двенадцати, или, по меньшей мере, тринадцати, или, по меньшей мере, четырнадцати, или, по меньшей мере, пятнадцати, или, по меньшей мере, шестнадцати, или, по меньшей мере, семнадцати, или, по меньшей мере, восемнадцати, или, по меньшей мере, девятнадцати, или, по меньшей мере, двадцати, или, по меньшей мере, двадцати одного, или, по меньшей мере, двадцати двух, или, по меньшей мере, двадцати трех, или, по меньшей мере, двадцати четырех, или, по меньшей мере, двадцати пяти, или двадцати шести генов, выбранных из askfbr, homfbr, metX (также называется metA), metY (также называется metZ), metB, metH, metE, metF, metC, zwf, frpA, asd, cysE, cysK, cysN, cysA, cysD, cysH, cysI, cysC, cysX, cysG, cysM, cysZ, cysJ и рус, где, по меньшей мере, два, или, по меньшей мере, три, или, по меньшей мере, четыре, или, по меньшей мере, пять, или, по меньшей мере, шесть, или, по меньшей мере, семь, или, по меньшей мере, восемь, или, по меньшей мере, девять, или, по меньшей мере, десять, или, по меньшей мере, одиннадцать, или, по меньшей мере, двенадцать, или, по меньшей мере, тринадцать, или, по меньшей мере, четырнадцать, или, по меньшей мере, пятнадцать, или, по меньшей мере, шестнадцать, или, по меньшей мере, семнадцать, или, по меньшей мере, восемнадцать, или, по меньшей мере, девятнадцать, или, по меньшей мере, двадцать, или, по меньшей мере, двадцать один, или, по меньшей мере, двадцать два, или, по меньшей мере, двадцать три, или, по меньшей мере, двадцать четыре, или, по меньшей мере, двадцать пять, или двадцать шесть генов имеют повышенную экспрессию, таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированном метионина в отсутствии генетических изменений. Например, в некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы включают генетические изменения в каждом из, по меньшей мере, восьми генов, выбранных из askfbr, homfbr, metX (также называется metA), metY (также называется metZ), metB, metH, metE, metF, metC, zwf, frpA, asd, cysE, cysK, cysN, cysA, cysD, cysH, cysI, cysC, cysX, cysG, cysM, cysZ, cysJ и рус, где генетические изменения приводят к повышенной экспрессии, по меньшей мере, восьми генов, таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии генетических изменений.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы включают генетические изменения в каждом из, по меньшей мере, пяти генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии каждого из, по меньшей мере, пяти генов, в комбинации с, по меньшей мере, шестью генами, выбранными из cysE, cysK, cysN, cysA, cysD, cysH, cysI, cysC, cysX, cysG, cysM, cysZ, и cysJ, где генетические изменения приводят к повышенной экспрессии, по меньшей мере, шести генов, где комбинация приводит к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии комбинации.
В других вариантах осуществления изобретения рекомбинантные микроорганизмы включают генетические изменения в каждом из, по меньшей мере, двух генов, выбранных из metK, metQ, cysQ, cysY, hsk, mcbR, pepCK и ilvA, где экспрессия, по меньшей мере, двух генов снижена, таким образом, приводя к повышенному продуцированию метионина микроорганизмом по сравнению с продуцированием метионина в отсутствии генетических изменений.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы включают дерегуляцию, по меньшей мере, двух, или, по меньшей мере, трех, или, по меньшей мере, четырех, или, по меньшей мере, пяти, или, по меньшей мере, шести, или, по меньшей мере, семи, или, по меньшей мере, восьми, или, по меньшей мере, девяти, или, по меньшей мере, десяти, или, по меньшей мере, одиннадцати, или, по меньшей мере, двенадцати, или, по меньшей мере, тринадцати, или, по меньшей мере, четырнадцати, или, по меньшей мере, пятнадцати, или, по меньшей мере, шестнадцати, или, по меньшей мере, семнадцати, или, по меньшей мере, восемнадцати, или, по меньшей мере, девятнадцати, или, по меньшей мере, двадцати, или, по меньшей мере, двадцати одного, или, по меньшей мере, двадцати двух, или, по меньшей мере, двадцати трех, или, по меньшей мере, двадцати четырех, или, по меньшей мере, двадцати пяти белков, выбранных из: аспартаткиназы, гомосеринде-гидрогеназы, гомосерин ацетилтрансферазы, гомосерин сукцинилтрансферазы, цис-татионин-γ-синтазы, цистатионин-β-лиазы, O-ацетилгомосерин сульфогидролазы, O-сукцинилгомосерин сульфогидролазы, витамин В12-зависимой метионинсинтазы, витамин В12-независимой метионинсинтазы, N5,10-метилентетрагидрофолат-редуктазы, сульфатаденилилтрансферазы субъединица 1, сульфатаденилилтрансферазы субъединица 2, APS киназы, APS редуктазы, фосфоаденозинфосфосульфат редуктазы, НАДФ-ферредоксинредуктазы, сульфитредуктазы субъединица 1, сульфит-редуктазы субъединица 2, переносчика сульфата, серин-O-ацетилтрансферазы, O-ацетил серин (тиол)-лиазы А, уропорфириноген III синтазы, глюкоза-6-фосфат дегидрогеназы, пируваткарбоксилазы и аспартат-полуальдегид дегидрогеназы, где дерегуляция включает повышенную экспрессию белков, таким образом, приводя к продуцированию метионина в количестве, по меньшей мере, 8 г/л при подходящих условиях. В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы включают дерегуляцию, по меньшей мере, пяти белков, описанных здесь, таким образом, приводя к повышенному продуцированию метионина в количестве, по меньшей мере, 16 г/л при подходящих условиях. Подходящие условия, по данному описанию, это условия, которые приводят к повышенному продуцированию метионина описанными здесь микроорганизмами.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы продуцируют метионин в количестве, по меньшей мере, 8 г/л, или, по меньшей мере, 9 г/л, или, по меньшей мере, 10 г/л, или, по меньшей мере, 11 г/л, или, по меньшей мере, 12 г/л, или, по меньшей мере, 13 г/л, или, по меньшей мере, 14 г/л, или, по меньшей мере, 15 г/л, или, по меньшей мере, 16 г/л при подходящих условиях. В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы продуцируют метионин в количестве, по меньшей мере, 8 г/л. В других вариантах осуществления изобретения рекомбинантные микроорганизмы продуцируют метионин в количестве, по меньшей мере, 16 г/л.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы включают генетические изменения в каждом из, по меньшей мере, пяти генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии каждого из, по меньшей мере, пяти генов, в комбинации с генетическими изменениями, по меньшей мере, в одном гене, выбранном из metK, metQ, hsk, mcbR и рерСК, таким образом приводя к сниженной экспрессии, по меньшей мере, одного гена, где комбинация приводит к продуцированию метионина микроорганизмом, по меньшей мере, 8 г/л при подходящих условиях, например, описанных здесь.
В одном примере варианта осуществления изобретения рекомбинантный микроорганизм по настоящему изобретению содержит генетические изменения в каждом из восьми генов, выбранных из ask, hom, metX, metY, metE, metH, metF и mcbR, где титр метионина, продуцированного микроорганизмом при подходящих условиях, по меньшей мере, 16 г/л.
В некоторых вариантах осуществления изобретения повышенная экспрессия генов включает конститутивную экспрессию гена и/или полипепетида, кодируемого геном.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, являются этионин-резистентными. Поэтому этионин-резистентные микроорганизмы также охватываются настоящим изобретением, включая одну из многих комбинаций генетических изменений, описанных здесь, где комбинация резистентности к этионину и генетических изменений приводит к повышенному продуцированию метионина по сравнению с продуцированием метионина в отсутствии комбинации. В некоторых вариантах осуществления изобретения этионин-резистентные микроорганизмы, включающие комбинацию генетических изменений, описанных здесь, продуцируют метионин в количестве, по меньшей мере, 8 г/л, или, по меньшей мере, 9 г/л, или, по меньшей мере, 10 г/л, или, по меньшей мере, 11 г/л, или, по меньшей мере, 12 г/л, или, по меньшей мере, 13 г/л, или, по меньшей мере, 14 г/л, или, по меньшей мере, 15 г/л, или, по меньшей мере, 16 г/л, или, по меньшей мере, 17 г/л, или, по меньшей мере, 18 г/л, или, по меньшей мере, 19 г/л, или, по меньшей мере, 20 г/л в процессе ферментации.
В некоторых вариантах осуществления изобретения, описанных здесь, рекомбинантные микроорганизмы включают комбинацию: (1) генетических изменений в каждом из, по меньшей мере, шести генов, выбранных из askfbr, homfbr, metX (также называется metA), metY (также называется metZ), metH, metF и askfbr, homfbr, metX (также называется metA), metY (также называется metZ), metH, metF и metE, таким образом, приводя к повышенной экспрессии каждого из, по меньшей мере, шести генов; (2) генетических изменений в каждом из mcbR и hsk, таким образом, приводя к сниженной экспрессии mcbR и hsk; и (3) этионин-резистентной мутации, где микроорганизм продуцирует, по меньшей мере, 16 г/л метионина при подходящих условиях.
Это изобретение также относится к способам генетической инженерии микроорганизмов, продуцирующих повышенные или увеличенные уровни метионина. В некоторых вариантах осуществления настоящее изобретение обеспечивает векторы, которые могут быть введены в микроорганизмы для осуществления различных генетических изменений, охватываемых данным изобретением. Такие генетические изменения могут либо повысить экспрессию гена, либо снизить экспрессию гена. В некоторых вариантах осуществления изобретения векторы используются для введения промоторных и/или энхансерных последовательностей выше гена, таким образом, повышая экспрессию гена.
Рекомбинантные микроорганизмы, описанные здесь, могут быть либо грамположительными, либо грамотрицательными. В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы принадлежат роду, выбранному из Bacillus, Corynebacterium, Lactobacillus, Lactococci и Streptomyces. В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, принадлежат роду Corynebacterium, например, штамму Corynebacterium glutamicum.
В некоторых вариантах осуществления изобретения способ получения метионина включает культивирование штамма Corynebacterium, включающее генетические изменения в каждом из, по меньшей мере, двух или, по меньшей мере, трех, или, по меньшей мере, четырех, или, по меньшей мере, пяти, или, по меньшей мере, шести, или, по меньшей мере, семи, или, по меньшей мере, восьми генов, выбранных из ask, hom, metX, metY, metB, metC, metH, metE, metF, metK, ilvA, metQ, fprA, asd, cysD, cysN, cysC, pyc, cysH, cysI, cysY, cysX, cysZ, cysE, cysK, cysG, zwf, hsk, mcbR и pepCK при таких условиях, что продуцируется метионин, и выделение метионина. В некоторых вариантах осуществления изобретения такой штамм Corynebacterium включает генетические изменения, по меньшей мере, в восьми генах.
В некоторых вариантах осуществления изобретения метод культивирования рекомбинантного микроорганизма, описанный здесь (например, рекомбинантный Corynebacterium glutamicum), приводит к производству метионина в количестве, по меньшей мере, 16 г на литр культуры.
В некоторых вариантах осуществления изобретения векторы включают интеграционные кассеты, применяемые для интеграции последовательностей нуклеиновых кислот в определенные, желаемые локусы внутри микроорганизма. В определенных вариантах осуществления изобретения интеграционные кассеты модифицируют эндогенный ген с помощью введения гетерологичной последовательности нуклеиновой кислоты внутрь последовательности эндогенного гена. Такие гетерологичные последовательности нуклеиновой кислоты могут включать, например, последовательности нуклеиновой кислоты, которые экспрессируют фермент(ы) пути биосинтеза метионина. Гетерологичным геном может быть ген из другого организма, модифицированный эндогенный ген или ген, перемещенный из другого местоположения в хромосоме.
Краткое описание чертежей
Фиг.1 - схема пути биосинтеза метионина, используемого в микроорганизмах, описанных здесь.
Фиг.2 - схема вектора рН273.
Фиг.3 - схема вектора рН373.
Фиг.4 - схема вектора рН304.
Фиг.5 - схема вектора рН399.
Фиг.6 - схема вектора рН484.
Фиг.7 - схема вектора рН491.
Фиг.8 - схема плазмиды рОМ62.
Фиг.9 - схема вектора рН357.
Фиг.10 - схема вектора рН410.
Фиг.11 - схема вектора рН295.
Фиг.12 - схема вектора рН429.
Фиг.13 - схема вектора рН170.
Фиг.14 - схема вектора рН447.
Фиг.15 - схема вектора рН449.
Фиг.16 - схема плазмиды рОМ423.
Подробное описание изобретения
Настоящее изобретение основано, по меньшей мере, частично, на открытии, что определенные генетические изменения в микроорганизмах приводят к повышенному продуцированию метионина микроорганизмами. В другом аспекте настоящее изобретение основано на открытии, что комбинации генетических изменений в определенных генах особенно желательны для продуцирования метионина.
Существует два альтернативных пути введения атомов серы в промежуточные субстраты синтеза метионина в микроорганизмах, как показано на Фиг.1. Например, бактерия Escherichia coli использует путь транссульфурации; тогда как некоторые другие микроорганизмы, такие, например, как Saccharomyces cerevisiae and Corynebacterium glutamicum (С.glutamicum) применяют пути прямого сульфгидри-рования. Несмотря на то, что многие микроорганизмы, судя по всему, применяют либо один, либо другой путь, С.glutamicum использует оба пути для продуцирования метионина.
Это изобретение основано, по меньшей мере частично, на определении генетических изменений, являющихся выгодными для продуцирования метионина в Corynebacterium, в частности, С.glutamicum. Для того чтобы повысить продуцирование метионина до максимума, важно снизить ингибирование по типу обратной связи определенных ключевых ферментов пути, таких, например, как аспартаткиназа (кодируемая геном ask), гомосериндегидрогеназа (кодируемая геном hom), O-ацетилгомосерин-сульфогидролаза (кодируемая геном metY), гомосерин-ацетилтрансфераза (кодируемая геном metX), М5,10-метилентетрагидрофолат-редуктаза (кодируемая геном metF) и метионинсинтазы (кодируемые геном metH и metE). Например, сообщалось, что ферменты аспартаткиназы (такие, например, как Ask), из различных организмов ингибируются лизином и/или треонином. Например, замена аминокислоты в положении 311 с треонина на изолейцин (T311L) уменьшает ингибирование по типу обратной связи Ask в С.glutamicum (См. патент США №6893848, полное содержание которого включено сюда путем ссылки). Похожим образом, гомосериндегидрогеназа (Hom) может ингибироваться треонином, метионином, лизином и изолейцином, как описано в: Sritharan V. Journal of General Microbiology, 136:203-209 (1990); Chassagnole С. et al. Biochemical Journal 356:415-23(2001); Eikmanns В. J. et al. Antonie van Leeuwenhoek 64:145-63 (1993-94); и Cremer J. et al. Journal of General Microbiology 134(12):3221-3229 (1988)), полное содержание которых включено сюда путем ссылки. Дополнительно, замена аминокислоты в положении 393 с серина на фенилаланина (S393F) уменьшает ингибирование по типу обратной связи Hom (также известный как Hsdh) в С.glutamicum, как описано в Sugimoto M et al. Bioscience, Biotechnology & Biochemistry, 61:1760-1762(1997), полное содержание которого включено сюда путем ссылки. Дополнительно, фермент O-ацетилгомосерин-сульфогидролаза (MetY) ингибируется метионином (WO 2004/108894 А2), так же как метионинсинтаза (MetH) (Chen et al. J. Biol. Chem. 269:27193-27197(1994)).
Настоящее изобретение показывает, что выгодно повышать экспрессию (например, транскрипцию и/или трансляцию) определенных генов в пути биосинтеза метионина, таких, например, как ask, hom (также известный как hsd), metX (также известный как metA), metY (также известный как metZ), metB, metff, metE, metF, metC и/или определенных генов пути биосинтеза цистеина, таких как cysJ, cysE, cysK, cysN, cysD, cysH, cysA, cysI, cysG, cysZ, cysX и cysM, для того чтобы повысить продуцирование метионина в микроорганизмах.
Кроме того, также выгодно снижать или разрегулировать экспрессию определенных генов, чьи продукты снижают продуцирование метионина при определенных условиях, таких, например, как mcbR (также называется RXA00655), как описано в Rey D.A., Journal of Biotechnology 103:51-65(2003); и Rey D.A. et al., Molecular Microbiology 56:871-887 (2005), полные содержания которых включены сюда путем ссылки, hsk, cysQ, cysY, ilvA, pepCK, metK и metQ, для увеличения продуцирования метионина. Например, мутация в гене hsk, приводящая к ферменту с заменой аминокислоты в положении 190 с треонина на аланин (Т190А), и/или мутация в гене metK, приводящая к ферменту S-Аденозилметионин синтазе с заменой аминокислоты в положении с цистеина на аланин (С94А), особенно выгодна для повышения продуцирования метионина в С.glutamicum.
Это изобретение также представляет микроорганизмы, содержащие генетические изменения в каждом гене в комбинации любых двух или в комбинации любых трех, или в комбинации любых четырех, или в комбинации любых пяти, или в комбинации любых шести, или в комбинации любых семи, или в комбинации любых восьми из следующих генов: askfbr, homfbr, metX (также называется metA), metY (также называется metZ), metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии любых двух, или любых трех, или любых четырех, или любых пяти, или любых шести, или любых семи, или любых восьми генов, таким образом приводя к повышенному продуцированию метионина по отношению к метионину, продуцируемому в отсутствии генетических изменений. Также в настоящем изобретении представлены микроорганизмы, содержащие генетические изменения в каждом из девяти генов, перечисленных выше, что усиливает экспрессию всех девяти представленных выше генов, таким образом повышая продуцирование метионина.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, содержат генетические изменения в каждом из любых двух, или любых трех, или любых четырех, или любых пяти, или любых шести, или любых семи, или любых восьми, или девяти из следующих генов: askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, в комбинации с генетическими изменениями, по меньшей мере, в одном из следующих генов: mcbR, hsk, metQ, metK и рерСК, таким образом повышая продуцирование метионина. Подразумевается, что усиление или повышение экспрессии включает повышение транскрипции/трансляции гена или повышение активности или уровня белка/фермента, кодируемого геном.
Для того чтобы настоящее изобретение было более понятно, здесь впервые даны определения некоторым терминам.
Фраза «метионин-продуцирующий микроорганизм» при использовании здесь относится к любому микроорганизму, способному продуцировать метионин, например, бактерии, дрожжи, грибы, простейшие и т.д. В некоторых вариантах осуществления изобретения метионин-продуцирующие микроорганизмы принадлежат роду Corynebacterium. В других вариантах осуществления изобретения метионин-продуцирующий микроорганизм представляет собой Corynebacterium glutamicum. В других вариантах осуществления изобретения метионин-продуцирующий микроорганизм выбирается из: микроорганизма, принадлежащего роду Corynebacterium, микроорганизма, принадлежащего роду Enterobacteria, микроорганизма, принадлежащего роду Bacillus, и дрожжей. В некоторых вариантах осуществления изобретения микроорганизм, принадлежащий роду Corynebacterium, представляет собой Corynebacterium glutamicum; микроорганизм, принадлежащий роду Enterobacteria, представляет собой Escherichia coli. В других вариантах осуществления изобретения микроорганизм, принадлежащий роду Bacillus, это Bacillus subtilis. В других вариантах осуществления изобретения дрожжи это Saccharomyces cerevisiae.
При использовании здесь фраза «повышенные уровни продуцирования метионина» относится к титру метионина (например, в г/л при подходящих условиях ферментации), продуцированному микроорганизмом, содержащим генетические изменения в двух или более, или трех или более, или четырех или более, или пяти или более, или шести или более, или семи или более, или восьми или более, или девяти или более, или десяти или более, или одиннадцати или более, или двенадцати или более, или тринадцати или более, или четырнадцати или более, или пятнадцати или более, или шестнадцати или более, или семнадцати или более, или восемнадцати или более, или девятнадцати или более, или двадцати или более, или двадцати одного или более, или двадцати двух или более, или двадцати трех или более, или двадцати четырех или более, или двадцати пяти или более, или двадцати шести или более, или двадцати семи или более, или двадцати восьми или более, или двадцати девяти или более, или тридцати или более, или тридцати одного или более, или тридцати двух или более, или тридцати трех или более, или тридцати четырех или более генах по настоящему описанию, где такой титр больше, чем количество, продуцированное при похожих условиях контрольным микроорганизмом, который обычно является микроорганизмом без таких генетических изменений. Фраза «повышенные уровни метионина» также относится к титру метионина, продуцированного рекомбинантными микроорганизмами, содержащими, по меньшей мере, два дерегулированных белка, описанных здесь. Фраза «повышенные уровни продуцирования метионина» включает значения и включенные границы метионина и/или промежуток значений, приведенных здесь. Предполагается также, что повышенные уровни продуцирования метионина включают титры, продуцированные выше основного уровня, установленного микроорганизмами без генно-инженерных модификаций для экспрессии гетерологичного биосинтетического фермента, нечувствительного к метионину. В некоторых вариантах осуществления изобретения повышенные уровни метионина относятся к титру метионина, продуцированного генно-инженерным (например, модифицированным или измененным) микроорганизмом по сравнению с количеством, продуцированным его диким или родительским аналогом или штаммом, непосредственно предшествующем генно-инженерному штамму во время конструирования штамма, как обсуждается здесь в Примерах.
Термины «путь биосинтеза» и «процесс биосинтеза» при использовании здесь относятся к in vivo или in vitro процессу, по которому продуцируется интересующая молекула или соединение, как результат одной или более биохимических реакций. В основном, начиная с молекулы-предшественника, прототипичный процесс биосинтеза включает действие одного или более ферментов, действующих в постадийной манере, продуцируя интересующее соединение. Интересующие молекулы или соединения включают, например, маленькие органические молекулы, аминокислоты, пептиды, клеточные кофакторы, витамины и похожие химические соединения. Интересующие молекулы или соединения, в частности, включают химические соединения, такие как метионин, гомосерин, S-аденозилметионин, глутатион, цистеин, биотин, тиамин, микотиол, кофермент А, кофермент М и липоевая кислота. В определенных обстоятельствах фермент или ферменты, функционирующие в пути биосинтеза, могут регулироваться химическими продуктами, образованными в процессе. В таких случаях говорится о существовании петли обратной связи, так что увеличение концентраций конечного или промежуточного продукта модифицирует функцию или активность ферментов пути. Например, конечный продукт или промежуточное вещество пути биосинтеза может действовать с целью понизить активность фермента процесса биосинтеза, таким образом снижая скорость, при которой продуцируется желаемый продукт. Ситуации такие, как эта, часто нежелательны, например, в крупномасштабных ферментативных процессах, применяемых в промышленности для производства интересующих соединений. Типичный пример петли обратной связи существует в производстве метионина, описанном здесь.
Термин «путь биосинтеза метионина» относится к пути биосинтеза, включающему ферменты биосинтеза метионина (например, полипептиды, кодированные биосинтетическими фермент-кодирующими генами), соединения (например, предшественники, субстраты, промежуточные соединения или продукты), кофакторы и тому подобное, используемые в образовании или синтезе метионина. Термин «путь биосинтеза метионина» включает путь(пути) биосинтеза, ведущие к синтезу метионина в микроорганизме (например, in vivo), как и путь(пути) биосинтеза, ведущие к синтезу метионина in vitro. Фиг.1 показывает схематическое представление пути биосинтеза метионина.
Термин «фермент биосинтеза метионина» при использовании здесь относится к любому ферменту, используемому в образовании соединения (например, промежуточного соединения или продукта) пути биосинтеза метионина. «Фермент биосинтеза метионина» включает ферменты, включенные, например, в «путь транссульфурирования» и «путь прямого сульфгидрирования», альтернативные пути синтеза метионина. Например, как обсуждалось выше, E.coli применяет путь транссульфурирования, тогда как другие микроорганизмы, такие как Saccharomyces cerevisiae, С.glutamicum, и В. subtilis и родственные микроорганизмы используют путь прямого сульфгидрирования. Несмотря на то, что многие микроорганизмы используют либо путь транссульфурирования, либо путь прямого сульфгидрирования, но не оба, некоторые микроорганизмы, такие, например, как С.glutamicum, используют оба пути для синтеза метионина.
Как показано на Фиг.1, синтез метионина из оксалоацетата (ОАА) проходит через промежуточные соединения, аспартат, аспартат (аспартил) фосфат и аспартат полуальдегид. Аспартат полуальдегид превращается в гомосерин с помощью гомосерин дегидрогеназы (продукта гена hom, также изветного как thrA, metL, hdh, hsd в других организмах). Последующие стадии синтеза метионина могут идти либо по пути транссульфурирования, либо по пути прямого сульфгидрирования.
В пути транссульфурирования гомосерин превращается либо в O-ацетилгомосерин с помощью гомосерин ацетилтрасферазы (продукта гена metX, также называемого metA) и дополнительный субстрат ацетил КоА, либо в O-сукцинилгомосерин с использованием дополнительного субстрата сукцинил КоА и продукта гена metA (гомосерин сукцинилтрансферазы). Перенос сульфо-группы от цистеина либо O-ацетилгомосерину, либо O-сукцинилгомосерину с помощью цистатионин γ-синтазы, продукта гена metB, дает цистатионин. Цистатионин затем превращается в гомоцистеин с помощью цистатионин β-лиазы, продукта гена metC (также в некоторых организмах называется ген aecD).
В пути прямого сульфгидрирования O-гомосерин сульофгидролаза продукт гена metY (также называется ген metZ) катализирует прямое присоединение сульфида к O-ацетилгомосерину, образуя гомоцистеин. Гомоцистеин также может быть образован по варианту пути прямого сульфгидрирования прямым присоединением сульфидной группы к O-сукцинилгомосерину с помощью O-сукцинилгомосерин сульфогидролазы, продукта гена metZ. При использовании здесь metY используется взамозаменяемо с metZ, a metA используется взамозаменяемо с metX.
В отличие от ферментов транссульфурирования/сульфгидрирования, присутствующих только в организмах с синтезом метионина de novo, метионинсинтаза присутствует во многих дополнительных организмах для обеспечения регенерации метилгруппы S-аденозилметионина (SAM). Два типа метионинсинтаз могут выполнять эту функцию в Е. coli, витамин В12-зависимая метионинсинтаза (продукт гена metH) и витамин В12-независимая метионин синтаза (продукт гена metE). Метил-тетрагидрофолат (метил-THF) отдает метилгруппу метионина либо с полиглутаматным хвостом, либо без него, образованным путем восстановления метилен-THF в реакции, катализируемой продуктом гена metF. S-аденозилметионин синтаза, кодируемая геном metK, отвечает за образование SAM из метионина и АТФ.
Дополнительно, цистеин может использоваться как донор серы в биосинтезе метионина в пути транссульфурирования. В бактериях цистеин синтезируется из серина введением сульфида или атома серы из тиосульфата. Генный продукт гена cysK (O-ацетилсерин (тиол)-лиаза А или CysK) синтезирует цистеин из O-ацетилсерина и сульфида, тогда как генный продукт гена cysM (O-ацетилсерин (тиол)-лиаза В или CysM) использует тиосульфат вместо сульфида в синтезе цистеина.
Когда конечным источником серы является сульфат, требуется ряд ферментов для восстановления сульфата до сульфида для биосинтеза цистеина и метионина. Обычно сульфат захватывается клетками с помощью транспортных белков, кодируемых такими генами, как cysZ (переносчик сульфата) или cysP. Сульфат активируется продуктами генов cysD (сульфат аденилилтрансфераза субъединица 2) и cysN (сульфат аденилтрансфераза субъединица 1) для получения аденозил-фосфо-сульфата (также называется APS). Сообщалось, что в некоторых организмах аденозил-фосфо-сульфат затем активируется для следующей стадии белком с аденозил-фосфо-сульфат-киназной активностью, давая фосфоаденозил-фосфо-сульфат (также называется PAPS), который впоследствии восстанавливается ферментом, PAPS-редуктазой, кодируемым геном cysH. Альтернативно, APS может восстанавливаться напрямую, давая сульфит, с помощью фермента APS-редуктазы.
Поскольку до сих пор у С glutamicum не было обнаружено гена, кодирующего белок с активностью аденозил-фосфо-сульфат-киназы, остается неясным является ли субстратом для фермента, кодируемого геном cysH, аденозил-фосфо-сульфат или фос-фоаденилил-фосфо-сульфат. Продуктом стадии восстановления является сульфит, который далее восстанавливается с помощью активности фермента сульфит редукта-зы, кодируемого генами cysI (сульфит редуктаза субъединица 1) и cysJ (сульфит редуктаза субъединица 2).
Предшественник для биосинтеза цистеина обычно происходит от серина, который превращается в O-ацетилсерин с помощью активности серин-ацетилтрансферазы (кодируемой геном cysE). O-ацетилсерин и сульфид действуют как субстраты для фермента О-ацетилсерин-(тиол) лиазы А, кодируемого геном cysK. В случае тиосульфата как источника серы была описана вторая цистеинсинтаза в определенных организмах, включая Е.Coli и S typhimurium (См., например, Neidhardt FC ed. ASM Press Washington (1996)), которые используют O-ацетилсерин и тиосульфат для получения сульфоцистеина. Ген, кодирующий второй фермент цистеинсинтазы, называется cysM (O-ацетилсерин (тиол) лиаза А), также обнаруженный у С.glutamicum.
В Таблице 1а перечислены ферменты пути биосинтеза метионина и соответсвующие гены, кодирующие их. В Таблице 1b перечислены различные ферменты пути биосинтеза цистеина и соответсвующие гены, кодирующие их. В Таблице 1с перечислены дополнительные белки и ферменты, влияющие на биосинтез метионина напрямую или косвенно, и соответствующие гены. В целях удобства каждому представленному здесь гену приписан буквенный код. Следует понимать, что в некоторых микроорганизмах названия генов, кодирующих соответствующие ферменты, могут отличаться от перечисленных здесь названий.
(-): Относится к генам, для которых желательно снижение или уменьшение экспрессии для повышенного продуцирования метионина
Примерные комбинации генов, которые могут быть изменены для повышения продуцирования метионина, приведены в Таблице II. Однако следует понимать, что любая комбинация генов может быть изменена, если эта комбинация приводит к повышенному продуцирования метионина.
Рекомбинантные микроорганизмы, включенные в настоящее изобретение, могут быть генно-инженерно модифицированы, чтобы содержать изменение эндогенных генов, которое ведет к повышению продуцирования метионина, например, путем введения изменений в генах, которые либо повышают экспрессию, либо снижают экспрессию определенных генов. Альтернативно, рекомбинантные микроорганизмы могут быть генетически модифицированы для экспрессии ферментов/белков, кодируемых гетерологичными генами, введенными в такие микроорганизмы. В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы генно-инженерно модифицированы для изменения экспрессии комбинации определенных ферментов/белков, где такая комбинация приводит к повышенному продуцированию метионина по сравнению с продуцированном метионина в отсутствии комбинации. Экспрессия комбинации подходящих ферментов/белков может быть достигнута, например, путем изменения экспрессии эндогенных генов и/или введения гетерологичных генов в микроорганизм.
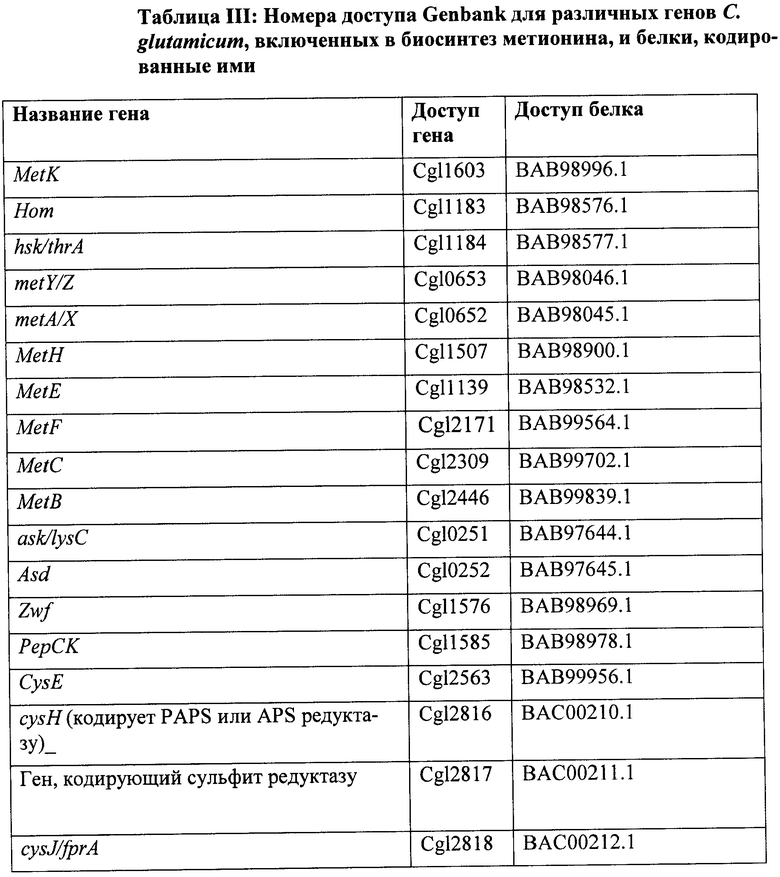
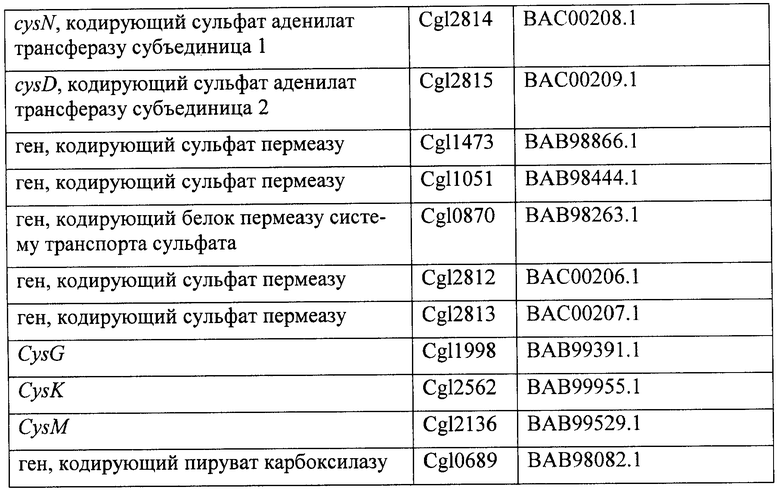
Таблица III ниже включает номера доступа Genbank для различных генов, выделенных из С.glutamicum, и белков, кодированных ими, где различные комбинации генов могут быть изменены, таким образом приводя к повышенному продуцированию метионина.
В некоторых вариантах осуществления изобретения метионин-продуцирующие микроорганизмы, включенные в настоящее изобретение, включают генетические изменения в каждом из любых двух генов, или любых трех генов, или любых четырех генов, или любых пяти генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf. Данное изобретение также представляет микроорганизмы, содержащие генетические изменения, которые включают генетические изменения в каждом из любых шести генов, выбранных из askfbr, homfb, metX, metY, metB, metH, metE, metF и zwf. Дополнительно, настоящее изобретение представляет микроорганизмы, содержащие генетические изменения в каждом из любых семи, или любых восьми, или девяти генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf.
Число возможных комбинаций различных генов, которые могут быть изменены, можно вычислить, например, на основе следующего уравнения:
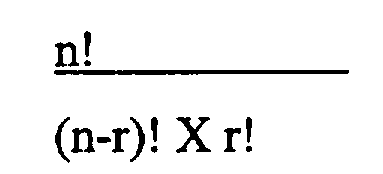
где n - это общее число генов, которые могут быть изменены, а r - это число генов, которые изменены в организме. Следовательно, число возможных комбинаций любых двух генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, которые могут быть изменены, можно вычислить следующим образом:
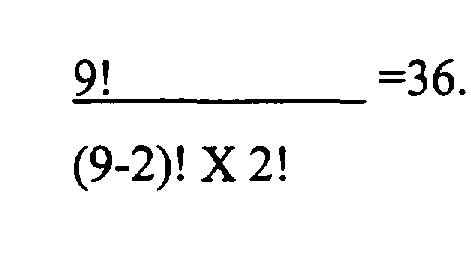
Похожим образом, число возможных комбинаций любых пяти генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, которые могут быть изменены, можно вычислить следующим образом:
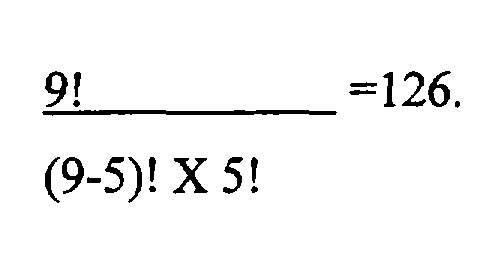
Следовательно, основываясь на формуле выше, число возможных комбинаций любых пяти генов, или любых шести генов, или любых семи генов, или любых восьми генов, или девяти генов, выбранных из askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, которые могут быть изменены, составляет 126, 84, 36, 9 и 1, соответственно.
Похожим образом, число возможных комбинаций любых измененных генов, по настоящему описанию, может быть легко определено, основываясь на формуле выше.
Фраза «нечувствителен к ингибированию по типу обратной связи метионином», при использовании здесь, относится к ферменту, способному к ферментативному функционированию на значительном уровне в присутствии метионина, и имеет удельную активность, по меньшей мере, 20% от активности в отсутствии метионина. Фермент, являющийся нечувствительным к ингибированию по типу обратной связи метионином, может нормально функционировать в присутствии, например, 1-10 µМ, 10-100 µМ или 100 µМ - 1 мМ метионина. В некоторых вариантах осуществления изобретения интересующий фермент способен функционировать при концентрациях метионина 1-10 мМ, 10-100 мМ или даже при более высоких концентрациях. Также в своем нативном состоянии некоторые ферменты биосинтеза метионина чувствительны к ингибированию по типу обратной связи другими аминокислотами, такими как треонин и лизин. Это изобретение представляет, по меньшей мере отчасти, нечувствительные к ингибированию по типу обратной связи метионином, лизином и/или треонином ферменты, которые включены в пути или процессы биосинтеза метионина, которые приводят к продуцированию метионина, такие, например, как Askfbr и Homfbr.
В некоторых вариантах осуществления изобретения микроорганизм, представленный здесь, принадлежит роду Corynebacterium. В других вариантах осуществления изобретения микроорганизм это Corynebacterium glutamicum. В других вариантах осуществления изобретения микроорганизм выбирается из: грамотрицательных бактерий (например, Escherichia coli или родственных Enterobacteria), грамположительных бактерий (например, Bacillus subtilis или родственных Bacillus), дрожжей (например, Saccharomyces cerevisiae или родственных дрожжевых штаммов) и Archaea.
В некоторых вариантах осуществления изобретения микроорганизм, описанный здесь, имеет дерегуляцию, по меньшей мере, двух или, по меньшей мере, трех, или, по меньшей мере, четырех, или, по меньшей мере, пяти ферментов биосинтеза метионина. В других вариантах осуществления изобретения микроорганизм, описанный здесь, имеет дерегуляцию, по меньшей мере, шести ферментов биосинтеза метионина. В некоторых вариантах осуществления изобретения микроорганизм, описанный здесь, имеет дерегуляцию, по меньшей мере, семи или более ферментов биосинтеза метионина. Термин «дерегуляция», при использовании здесь, относится либо к повышению уровня и/или активности, либо к снижению уровня и/или активности, либо к полному ее отсутствию у фермента биосинтеза по сравнению с уровнем и/или специфической активностью его родительского или дикого аналога. В некоторых вариантах осуществления изобретения «дерегулированный» фермент биосинтеза кодируется геном, который был изменен, по настоящему описанию. Например, «дерегулированный» фермент биосинтеза может продуцироваться, например, либо с помощью изменения эндогенного гена, кодирующего фермент, либо с помощью введения гетерологичного гена в микроорганизм, продуцирующий фермент.
В других вариантах осуществления изобретения микроорганизм, описанный здесь, имеет два или более, или три или более, или четыре или более, или пять или более, или шесть или более ферментов из пути биосинтеза цистеина, которые являются дерегулированными. В следующих других вариантах осуществления изобретения микроорганизм, описанный здесь, имеет два или более ферментов из пути биосинтеза метионина и два или более ферментов из пути биосинтеза цистеина, которые являются дерегулированными. Например, в некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы включают пять или более ферментов из пути биосинтеза метионина и шесть или более ферментов из пути биосинтеза цистеина, которые являются дерегулированными. Далее, ферменты/белки, которые напрямую или косвенно влияют на гены в пути биосинтеза метионина и/или пути биосинтеза цистеина, могут также быть дерегулированы, например, снижен уровень и/или активность, таким образом, увеличивая продуцирование метионина. Например, в некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы включают генетические изменения, по меньшей мере, в двух генах, где такие изменения приводят к дерегуляции, по меньшей мере, двух белков, выбранных из: APS фосфатазы; цистатионин-бета-синтазы (обращенный путь), гомосеринкиназы; транскрипционного регулятора метаболизма серы типа TetR; D-метионин связывающего липопротеина, фосфоенолпируват карбоксикиназы, S-аденозилметионин синтазы и треонин дегидратазы, кодируемых этими генами.
В некоторых вариантах осуществления настоящее изобретение представляет новые и улучшенные методы производства метионина при помощи генетически измененных микроорганизмов, в которых был изменен путь биосинтеза метионина, так что микроорганизмы способны продуцировать метионин на повышенном уровне по сравнению с метионином, продуцированным в отсутствии генетических изменений.
Новые и улучшенные методы, описанные здесь, включают способы продуцирования метионина в микроорганизмах, включающих, по меньшей мере, два, или, по меньшей мере, три, или, по меньшей мере, четыре, или, по меньшей мере, пять, или, по меньшей мере, шесть, или, по меньшей мере, семь, или, по меньшей мере, восемь или более ферментов пути биосинтеза метионина, которые являются дерегулированными, так что метионин продуцируется на повышенном уровне по сравнению с микроорганизмом без такой дерегуляции. Например, в некоторых вариантах осуществления изобретения микроорганизмы, описанные здесь, включают генетические изменения в пяти или более генах, что приводит к дерегуляции пяти или более ферментов, кодируемых генами, где ферменты выбраны из: аспартат киназы, гомосерин дегидрогеназы, гомосерин ацетилтрансферазы, цистатионин γ-синтазы, O-ацетилгомосерин сульфогидролазы, O-сукцинилгомосерин сульфогидролазы, витамин В12-зависимой метионин синтазы, N5,10-метилентетрагидрофолат-редуктазы, S-аденозилметионин синтазы, цистатионин-β-лиазы, гомосерин сукцинилтрансферазы и витамин В12-независимой метионин синтазы.
Методы повышения производства метионина, описанные здесь, также включают способы получения микроорганизмов с генетическим(и) изменением (изменениями) в генах пути биосинтеза цистеина, так что метионин производится на повышенном уровне по сравнению с уровнем в отсутствии генетических изменений.
Например, в некоторых вариантах осуществления изобретения микроорганизмы, описанные здесь, включают генетические изменения в двух или более, или трех или более, или четырех или более, или пяти или более, или шести или более, или семи или более генах, что приводит к дерегуляции ферментов, кодируемых генами, где ферменты выбраны из: сульфат-аденилилтрансферазы субъединица 2, сульфат-аденилилтрансферазы субъединица 1, цистатионин-бета-синтетазы, APS киназы, APS редуктазы, PAPS редуктазы, сульфит-редуктазы субъединица 1, сульфит-редуктазы субъединица 2, вспомогательной роли в восстановлении сульфита, переносчика сульфата, серии O-ацетилтрансферазы, O-ацетилсерин (тиол)-лиазы А, уропорфириноген III синтазы, APS фосфатазы и гамма цистатионазы. В некоторых вариантах осуществления изобретения рекомбинантые микроорганизмы включают шесть дерегулированных ферментов пути биосинтеза цистеина.
Методы, описанные здесь, представляют микроорганизмы, например, рекомбинантные микроорганизмы, наряду с векторами и генами (например, дикие и/или мутантные гены) по настоящему описанию и/или культивированные таким образом, что повышается производство метионина.
Термин «рекомбинантный микроорганизм» относится к микроорганизму (например, бактерии, дрожжевой клетке, грибковой клетке и т.д.), который был генетически изменен, модифицирован или сконструирован (например, генетически сконструирован), используя, например, методики манипуляций с ДНК in vitro или классические генетические методики in vivo, таким образом, что он демонстрирует измененный, модифицированный или отличный генотип и/или фенотип (например, когда генетическая модификация влияет на кодирующие последовательностей нуклеиновых кислот микроорганизмов) по сравнению с встречающимся в природе микроорганизмом, из которого он получен.
«Рекомбинантный организм», описанный здесь, может быть генетически сконструирован, чтобы включать генетические изменения, по меньшей мере, в двух, или, по меньшей мере, трех, или, по меньшей мере, четырех, или, по меньшей мере, пяти, или, по меньшей мере, шести, или, по меньшей мере, семи, или, по меньшей мере, восьми, или, по меньшей мере, девяти, или, по меньшей мере, десяти, или, по меньшей мере, одиннадцати, или, по меньшей мере, двенадцати, или, по меньшей мере, тринадцати, или, по меньшей мере, четырнадцати, или, по меньшей мере, пятнадцати, или, по меньшей мере, шестнадцати, или, по меньшей мере, семнадцати, или, по меньшей мере, восемнадцати, или, по меньшей мере, девятнадцати, или, по меньшей мере, двадцати, или, по меньшей мере, двадцати одного, или, по меньшей мере, двадцати двух, или, по меньшей мере, двадцати трех, или, по меньшей мере, двадцати четырех, или, по меньшей мере, двадцати пяти, или во всех двадцати шести генах, выбранных из ask, hom, metX, metB, metC, metY, metH, metE, metF, cysE, cysK, cysM, cysD, cysA, cysN, cysH, cysI, cysJ, cysX, cysZ, cysC, cysG, zwf, pyc, jprA и asd, где генетические изменения приводят к повышенной экспрессии генов. В некоторых вариантах осуществления изобретения «рекомбинантный микроорганизм», описанный здесь, может быть генетически сконструирован, чтобы включать генетические изменения, по меньшей мере, в двух генах, или, по меньшей мере, трех генах, или, по меньшей мере, четырех генах, или, по меньшей мере, пяти генах, или, по меньшей мере, шести генах, или, по меньшей мере, семи генах, или, по меньшей мере, восьми генах, выбранных из metK, metQ, cysY, cysQ, hsk, mcbR, рерСК и ilvA, где генетические изменения приводят к снижению экспрессии генов. В других вариантах осуществления изобретения «рекомбинантные микроорганизмы» включают генетические изменения в некоторых генах, которые повышают экспрессию этих генов, а также генетические изменения в других генах, которые снижают экспрессию таких генов, таким образом, приводя к повышенному продуцированию метионина рекомбинантным микроорганизмом.
Специалист в данной области техники понимает, что микроорганизм, экспрессирующий ген в повышенной степени, продуцирует конечный продукт гена в повышенной степени и/или активности по сравнению с микроорганизмом без повышенной экспрессии гена. Похожим образом, микроорганизм со сниженной экспрессией гена продуцирует конечный продукт гена в пониженной степени и/или активности по сравнению с микроорганизмом без сниженной экспрессии гена.
Термин «рекомбинантный микроорганизм», при использовании здесь, также относится к микроорганизму, который был сконструирован (например, генетически сконструирован) или модифицирован, так что микроорганизм имеет, по меньшей мере, два фермента пути биосинтеза метионина и/или, по меньшей мере, два фермента пути биосинтеза цистеина, дерегулированных так, что метионин продуцируется на повышенных уровнях. В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы включают, по меньшей мере, пять ферментов пути биосинтеза метионина и, по меньшей мере, шесть ферментов пути биосинтеза цистеина, дерегулированных так, что метионин продуцируется на повышенных уровнях. Модификация или конструирование таких микроорганизмов может быть достигнуто с помощью любого метода, описанного здесь или известного в этой области, включая, но не ограничиваясь, изменение гена, кодирующего фермент пути биосинтеза.
Термины «дерегулированный» или «обработанный», при использовании в отношении фермента или белка, применяются здесь взаимозаменяемо и относятся к ферменту или белку, активность или уровень которого был изменен или модифицирован, так что уровень или скорость потока через, по меньшей мере, один расположенный выше или ниже предшественник или промежуточное вещество, субстрат или продукт фермента изменен или модифицирован, например, по сравнению с соответствующим диким или существующим в природе ферментом или белком. «Обработанный» фермент (например, «обработанный» фермент биосинтеза) включает фермент, экспрессия, продуцирование или активность которого была изменена или модифицирована, так что, по меньшей мере, один расположенный выше или ниже предшественник, субстрат или продукт фермента изменен или модифицирован (например, измененены уровень, соотношение и т.д. предшественника, субстрата и/или продукта), например, по сравнению с соответствующим диким или существующим в природе ферментом. «Обработанный» фермент также включает фермент, у которого была усилена резистентность к ингибированию, например, ингибированию по типу обратной связи, одним или более продуктов или промежуточных веществ. Например, фермент, способный к эффективному ферментативному функционированию в присутствии, например, метионина.
Термины «экспрессировать повышенно», «повышенно экспрессирующий», «повышенно экспрессированный» и «повышенная экспрессия» относятся к экспрессии генного продукта (например, фермента биосинтеза метионина или фермента пути восстановления сульфата, фермента биосинтеза цистеина) на уровне, большем, чем уровень до генетического изменения микроорганизма или в сравнимом микроорганизме, который не был генетически изменен. В некоторых вариантах осуществления изобретения микроорганизм может быть генетически изменен (например, генетически сконструирован) для экспрессии генного продукта на повышенном уровне по отношению к уровню, продуцируемому неизмененным микроорганизмом, или сравнимым микроорганизмом, который не был генетически изменен. Генетическое изменение включает, но не ограничено, изменение или модифицирование регуляторных последовательностей или сайтов, связанных с экспрессией определенного гена (например, путем добавления сильных промоторов, индуцибельных промоторов или нескольких промоторов, или путем удаления регуляторных последовательностей, так что экспрессия становится конститутивной), модифицирование расположения определенного гена в хромосоме, изменение последовательностей нуклеиновых кислот, соседних с определенным геном, таких как участок связывания с рибосомой или терминатор транскрипции, увеличения числа копий определенного гена, модификация белков (например, регуляторных белков, суппрессоров, энхансеров, активаторов транскрипции и т.п.), включенных в транскрипцию определенного гена и/или трансляцию определенного генного продукта, или любые другие стандартные способы дерегулирования экспрессии определенного гена, принятые в этой области (включая, но не ограничиваясь этим, применение молекул антисмысловых нуклеиновых кислот, например, для блокирования экспрессии репрессорных белков) и/или применение мутаторов-аллелей, например, бактериальных аллелей, которые усиливают генетическую вариабельность и ускоряют, например, адаптивную эволюцию).
В некоторых вариантах осуществления изобретения микроорганизм может быть физически или под действием окружающей среды изменен для экспрессии генного продукта на повышенном или сниженном уровне по отношению к экспрессии генного продукта неизмененным микроорганизмом или сравнимым микроорганизмом, который не был изменен. Например, микроорганизм может быть обработан или культивирован в присутствии агента, который, как известно или как предполагается, повышает транскрипцию определенного гена и/или трансляцию определенного генного продукта, так что транскрипция и/или трансляция усиливаются или повышаются. Альтернативно, микроорганизм может культивироваться при температуре, выбранной для повышения транскрипции определенного гена и/или трансляции определенного генного продукта, так что транскрипция и/или трансляция усиливаются или повышаются.
Термины «дерегулировать», «дерегулированный» и «дерегуляция» относятся к изменению или модификации, по меньшей мере, одного гена в микроорганизме, где изменение или модификация приводит к повышению продуцирования метионина в микроорганизме по сравнению с продуцированием метионина в отсутствии изменения или модификации. В некоторых вариантах осуществления изобретения измененный или модифицированный ген кодирует фемент пути биосинтеза, так что уровень или активность фермента биосинтеза в микроорганизме изменяется или модифицируется. В некоторых вариантах осуществления изобретения, по меньшей мере, один ген, кодирующий фермент пути биосинтеза, изменен или модифицирован, так что уровень или активность фермента усилена или повышена по отношению к уровню в присутствии неизмененного или дикого гена. В некоторых вариантах осуществления изобретения, по меньшей мере, два, или по меньшей мере, три, или по меньшей мере, четыре, или по меньшей мере, пять генов, кодирующих фермент пути биосинтеза, изменены или модифицированы, так что уровень или активность ферментов, кодируемых генами, снижена по отношению к уровню в присутствии неизмененного или дикого гена. В некоторых вариантах осуществления изобретения путь биосинтеза - это путь биосинтеза метионина. В других вариантах осуществления изобретения путь биосинтеза - это путь биосинтеза цистеина. Дерегуляция также включает изменение кодирующей области одного или более генов для получения, например, фермента, устойчивого к ингибированию по типу обратной связи или имеющего более высокую или более низкую удельную активность. Также дерегуляция включает генетическое изменение генов, кодирующих факторы транскрипции (например, активаторы, репрессоры), которые регулируют экспрессию генов в пути биосинтеза метионина и/или цистеина.
Фраза «дерегулированный путь» относится к пути биосинтеза, в котором, по меньшей мере, один ген, кодирующий фермент пути биосинтеза, изменен или модифицирован, так что уровень или активность, по меньшей мере, одного фермента биосинтеза изменена или модифицирована. Фраза «дерегулированный путь» включает путь биосинтеза, в котором более одного гена было изменено или модифицировано, таким образом, изменяя уровень и/или активность соответствующих генных продуктов/ферментов. В некоторых случаях способность «дерегулировать» путь (например, одновременно дерегулировать более одного гена в данном пути биосинтеза) в микроорганизме происходит от определенного явления в микроорганизмах, когда более одного фермента (например, два или три фермента биосинтеза) кодируется генами, находящимися по соседству друг с другом на смежном участке генетического материала, называемого «оперон». В других случаях, для того чтобы дерегулировать путь, дерегулируется ряд генов в серии последовательных стадий инженерии.
Термин «оперон» относится к координированной единице генетического материала, содержащей промотор и, возможно, регуляторный элемент, связанный с одним или более, предпочтительно, по меньшей мере, двумя, структурными генами (например, генами, кодирующими ферменты, например, ферменты биосинтеза). Экспрессия структурных генов может координационно регулироваться, например, регуляторными белками, связывающимися с регуляторным элементом, или антитерминацией транскрипции. Структурные гены могут транскрибироваться с получением одной мРНК, которая кодирует все структурные белки. Термин «оперон» включает, по меньшей мере, два соседних гена или ORF, необязательно перекрывающих последовательность либо с 5', либо с 3' конца, по меньшей мере, одного гена или ORF. Термин «оперон» включает координированную единицу экспрессии гена, содержащую промотор и, возможно, регуляторный элемент, связанный с одним или более соседних генов или ORF (например, структурными генами, кодирующими ферменты, например, ферменты биосинтеза). Экспрессия генов может координационно регулироваться, например, регуляторными белками, связывающимися с регуляторным элементом, или антитерминацией транскрипции. Гены оперона (например, структурные гены) могут транскрибироваться с получением одной мРНК, которая кодирует все белки. Вследствие координированной регуляции генов, включенных в оперон, изменение или модификация одного промотора и/или регуляторного элемента может привести к изменению или модификации каждого генного продукта, кодируемого опероном. Изменение или модификация регуляторного элемента включает, но не ограничивается этим, удаление эндогенного промотора и/или регуляторного(ых) элемента(ов), добавление сильных промоторов, индуцибельных промоторов или нескольких промоторов, или удаление регуляторных последовательностей, так что экспрессия генного продукта модифицируется, модифицирование хромосомного расположения оперона, изменение последовательностей нуклеиновых кислот, соседних с опероном или внутри оперона, таких как участок связывания рибосомы, использование кодона, увеличение количества копий оперона, модифицирование белков (например, регуляторных белков, суппрессоров, энхансеров, активаторов транскрипции и т.п.), включенных в транскрипцию оперона и/или трансляцию генных продуктов оперона, или любые другие стандартные способы дерегулирования экспрессии генов, принятые в этой области (включая, но не ограничиваясь этим, применение молекул антисмысловых нуклеиновых кислот, например, для блокирования экспрессии репрессорных белков).
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, были генетически сконструированы для повышенной экспрессии гена или генного продукта бактериального происхождения. Термины «бактериального происхождения» или «происходящий от бактерий» относятся к гену, который в природе был обнаружен в бактериях, или генному продукту, кодируемому бактериальным геном.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, включают генетические изменения в каждом гене в комбинации любых двух генов, или комбинации любых трех генов, или комбинации любых четырех генов, или комбинации любых пяти генов, или комбинации любых шести генов, или комбинации любых семи генов, или комбинации любых восьми генов, или комбинации любых девяти генов, или комбинации любых десяти генов, или комбинации любых одиннадцати генов, или комбинации любых двенадцати генов, или комбинации любых тринадцати генов, или комбинации любых четырнадцати генов, или комбинации любых пятнадцати генов, или комбинации любых шестнадцати генов, или комбинации любых семнадцати генов, или комбинации любых восемнадцати генов, или комбинации любых девятнадцати генов, или комбинации любых двадцати генов, или комбинации любых двадцати одного генов, или комбинации любых двадцати двух генов, или комбинации любых двадцати трех генов, или комбинации любых двадцати четырех генов, или комбинации любых двадцати пяти генов, или комбинации любых двадцати шести генов, выбранных из: ask, hom, metX, metY, metB, metH, metE, metF, zwf, metC, fprA, cysE, cysK, cysM, cysD, cysH, cysA, cysN, cysI, cysJ, cysX, cysZ, cysC, cysG, рус и asd, где генетические изменения приводят к повышенной экспрессии генов в комбинации.
В других вариантах осуществления изобретения микроорганизмы, описанные здесь, включают генетические изменения в комбинации любых двух, или любых трех, или любых четырех, или любых пяти, или любых шести, или любых семи, или любых восьми, или любых девяти генов, выбранных из: askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии генов. Например, в некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, включают генетические изменения в комбинации любых пяти генов, выбранных из: askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии или конститутивной экспрессии любых пяти генов. Микроорганизмы, включенные в это изобретение, также включают микроорганизмы, которые включают генетические изменения в любых шести генах, или любых семи генах, или любых восьми генах, или любых девяти генах, выбранных из: askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf, где генетические изменения приводят к повышенной экспрессии любых шести генов, или любых семи генов, или любых восьми генов, или любых девяти генов. Микроорганизмы, описанные здесь, также включают микроорганизмы, которые имеют генетические изменения в двух или более генах, выбранных из mcbR, hsk, pepCK, metK и metQ, или любой их комбинации, где генетические изменения приводят к снижению экспрессии генов. Пониженная экспрессия включает либо снижение экспрессии генного продукта, кодируемого геном (например, мРНК и/или белок), и/или снижение его активности (например, ферментативной активности белка, кодируемого измененным геном), либо удаление/мутацию гена, так что генный продукт не продуцируется. В некоторых вариантах осуществления изобретения микроорганизмы включают как повышенную экспрессию двух или более генов, способствующих продуцированию метионина (например, askfbr, homfbr, metX, metY, metB, metH, metE, metF и zwf), так и снижение экспрессии одного или более генов, отсутствие и/или снижение экспрессии которых способствует продуцированию метионина (например, mcbR, hsk, pepCK, metK и metQ).
Термин «ген», при использовании здесь, включает молекулу нуклеиновой кислоты (например, молекулу ДНК или ее фрагмент), отделенную от другого гена или других генов в организме межгенной ДНК (т.е. интронами или спейсерной ДНК, которая обычно фланкирует ген и/или отделяет гены в хромосомной ДНК организма). Альтернативно, ген может слегка перекрываться другим геном (например, 3' конец первого гена перекрывает 5' конец второго гена), и перекрывающиеся гены отделены от других генов межгенной ДНК. Ген может направлять синтез фермента или другой молекулы белка (например, она может включать кодирующие последовательности, например, соседнюю открытую рамку считывания (ORF), кодирующую белок), или может функционировать в организме сам по себе. Ген в организме может быть кластеризован в оперон, при этом, как здесь определено, оперон отделен от других генов и/или оперонов межгенной ДНК. «Изолированный ген», при использовании здесь, включает ген, по существу, свободный от последовательностей, обычно фланкирующих ген в хромосомной ДНК организма, от которого произошел ген (т.е. свободен от соседних кодирующих последовательностей, которые кодируют второй или отдельный белок, соседние структурные последовательности и т.п.), и при необходимости включает 5' и 3' регуляторные последовательности, например, промоторные последовательности или терминаторные последовательности. В некоторых вариантах осуществления изобретения изолированный ген включает предпочтительно кодирующие последовательности для белка (например, последовательности, кодирующие белки Corynebacterium). В других вариантах осуществления изобретения изолированный ген включает кодирующие последовательности для белка (например, для белка Corynebacterium) и соседние 5' и/или 3' регуляторные последовательности из хромосомной ДНК организма, от которого произошел ген (например, соседние 5' и/или 3' регуляторные последовательности Corynebacterium). В некоторых вариантах осуществления изобретения изолированный ген содержит менее чем около 10 т.п.н., 5 т.п.н., 2 т.п.н., 1 т.п.н., 0,5 т.п.н., 0,2 т.п.н., 0,1 т.п.н., 50 п.н., 25 п.н., 10 п.н. или меньше пар нуклеотидов последовательностей нуклеотидов, которые в природе фланкируют ген в хромосомной ДНК организма, от которого произошел ген.
Термины «измененный ген», «генетическое изменение», «ген, имеющий изменение» и «мутантный ген» при взаимозаменяемом использовании здесь относятся к гену, имеющему нуклеотидную последовательность, которая включает, по меньшей мере, одну модификацию (например, замещение, инсерция, делеция), так что полипептид или белок, кодируемый модифицированным геном, проявляет активность, которая отличается от полипептида или белка, кодируемого молекулой нуклеиновой кислоты или геном дикого типа). В некоторых вариантах осуществления изобретения ген, имеющий изменение, или мутантный ген кодирует полипептид или белок, имеющий повышенный уровень или повышенную активность по сравнению с полипептидом или белком, кодируемым диким геном, например, при измерении или оценке в похожих условиях (например, при оценке в микроорганизмах, культивированных при одинаковой температуре и/или при одинаковой концентрации ингибирующего вещества). В других вариантах осуществления изобретения ген, имеющий изменение, или мутантный ген кодирует полипептид или белок, имеющий пониженный уровень или сниженную активность по сравнению с полипептидом или белком, кодируемым геном дикого типа, например, при измерении или оценке в похожих условиях. В некоторых вариантах осуществления изобретения ген, имеющий изменение, или мутантный ген не может кодировать белок или полипептид, который кодируется его аналогом дикого типа. Термины «измененный ген», «мутантный ген», «ген, имеющий изменение» и «генетическое изменение» также включают модификации в регуляторных последовательностях гена или замены регуляторных последовательностей гетерологичными последовательностями, включая, но не ограничиваясь, промоторы и/или энхансеры, что приводит к повышению или снижению, или отсутствию экспрессии гена.
При использовании здесь термины «повышенная активность» и «повышенная ферментативная активность» относятся к активности, которая, по меньшей мере, на 5% выше, или, по меньшей мере, на 5-10% выше, или, по меньшей мере, на 10-25% выше, или, по меньшей мере, на 25-50% выше, или, по меньшей мере, на 50-75% выше, или, по меньшей мере, на 75-100% выше, чем активность полипептида или белка, кодируемого дикой молекулой нуклеиновой кислоты или геном. Предполагается, что интервалы в промежутках выше приведенных значений, например, 75-85%, 85-90%, 90-95%, также входят в настоящее изобретение. При использовании здесь «повышенная активность» и «повышенная ферментативная активность» также включают активность, которая, по меньше мере, в 1.25 раза, или, по меньше мере, в 1.5 раза, или, по меньше мере, в 2 раза, или, по меньше мере, в 3 раза, или, по меньше мере, в 4 раза, или, по меньше мере, в 5 раз, или, по меньше мере, в 10 раз, или, по меньше мере, в 20 раз, или, по меньше мере, в 50 раз, или, по меньше мере, в 100 раз больше, чем активность полипептида или белка, кодируемого диким геном.
Активность может определяться любым известным способом измерения активности определенного интересующего белка. Активность может быть измерена или оценена напрямую, например, измерением активности белка в неочищенном клеточном экстракте или выделенном, либо очищенном из клетки или микроорганизма. Альтернативно, активность может быть измерена или оценена внутри клетки или микроорганизма или во внеклеточной среде. Например, оценка мутанта может сопровождаться экспрессией мутантного или измененного гена в микроорганизме, например, мутантном микроорганизме, в котором фермент является термочувствительным, и оценкой мутантного гена на способность дополнять термочувствительного (Ts) мутанта ферментативной активностью. Мутантный или измененный ген, кодирующий «повышенную ферментативную активность», может быть геном, который дополняет Ts мутанта более эффективно, чем, например, соответствующий ген дикого типа. Мутантный или измененный ген, кодирующий «сниженную ферментативную активность», может быть геном, который дополняет Ts мутанта менее эффективно, чем, например, соответствующий ген дикого типа.
Не желая связываться с теорией, специалист в данной области техники примет во внимание, что даже одна замена в последовательности нуклеиновой кислоты или гена (например, замена основания, которое кодирует аминокислотную замену в соответствующей аминокислотной последовательности) может сильно повлиять на активность кодируемого полипептида или белка по сравнению с соответствующим полипептидом или белком дикого типа. Мутантный или измененный ген (например, кодирующий мутантный или дерегулированный полипептид или белок), по настоящему описанию, сильно отличается от нуклеиновой кислоты или гена, кодирующего белок тем, что мутантный или измененный ген кодирует белок или полипептид, имеющий измененный уровень или активность, возможно наблюдаемую как другой или особый фенотип в микроорганизме, экспрессирующем мутантный ген или продуцирующем мутантный белок или полипептид (т.е. мутантном или рекомбинантном микроорганизме), по сравнению с соответствующим микроорганизмом, экспрессирующим ген дикого типа. Напротив, белок, кодируемый мутантным геном, может иметь идентичную или, по существу, похожую активность, возможно фенотипически неразличимую при продуцировании в микроорганизме, по сравнению с соответствующим микроорганизмом, экспрессирующим ген дикого типа. Соответственно, не только, например, степень идентичности последовательности между молекулами нуклеиновой кислоты, генами, белком или полипептидами может служить различием между гомологами и мутантами, но и уровень или активность кодируемого белка или полипептида, который отличается между гомологами и мутантами: гомологи, имеющие, например, низкую (например, 30-50% идентичность последовательности) идентичность последовательности, все равно имеют, по существу, эквивалентные функциональные активности, а мутанты, например, имеющие 99% идентичность последовательности, все равно имеют чрезвычайно разные или измененные активности.
В некоторых вариантах осуществления изобретения ген, имеющий мутацию, или мутантный ген кодирует полипептид или белок, имеющий сниженную или повышенную активность по сравнению с полипептидом или белком, кодируемым диким геном, например, при анализе в похожих условиях (например, при анализе в микроорганизмах, культивированных при одинаковой температуре или в присутствии одинаковых концентраций ингибитора). Мутантный ген может также не кодировать полипептид или иметь сниженный уровень продуцирования полипептида дикого типа.
При использовании здесь термины «сниженная активность» и «сниженная ферментативная активность» относятся к активности, которая, по меньшей мере, на 5% меньше, или, по меньшей мере, на 5-10% меньше, или, по меньшей мере, на 10-25% меньше, или, по меньшей мере, на 25-50% меньше, или, по меньшей мере, на 50-75% меньше, или, по меньшей мере, на 75-100% меньше, чем активность полипептида или белка, кодируемого молекулой нуклеиновой кислоты или геном дикого типа. Предполагается, что интервалы в промежутках выше приведенных значений, например, 75-85%, 85-90%, 90-95%, также входят в настоящее изобретение. При использовании здесь «повышенная активность» и «повышенная ферментативная активность» также включают активность, которая была удалена или «выключена» (например, на 100% меньше, чем активность полипептида или белка, кодируемого молекулой нуклеиновой кислоты или геном дикого типа).
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, содержат дерегуляцию, по меньшей мере, двух белков, или, по меньшей мере, трех белков, или, по меньшей мере, четырех белков, или, по меньшей мере, пяти белков, или, по меньшей мере, шести белков, или, по меньшей мере, семи белков, или, по меньшей мере, восьми белков, или, по меньшей мере, девяти белков, или, по меньшей мере, десяти белков, или, по меньшей мере, одиннадцати белков, или, по меньшей мере, двенадцати белков, или, по меньшей мере, тринадцати белков, или, по меньшей мере, четырнадцати белков, или, по меньшей мере, пятнадцати белков, или, по меньшей мере, шестнадцати белков, или, по меньшей мере, семнадцати белков, или, по меньшей мере, восемнадцати белков, или, по меньшей мере, девятнадцати белков, или, по меньшей мере, двадцати белков, или, по меньшей мере, двадцати одного белка, или, по меньшей мере, двадцати двух белков, или, по меньшей мере, двадцати трех белков, или, по меньшей мере, двадцати четырех белков, или, по меньшей мере, двадцати пяти белков, или, по меньшей мере, двадцати шести белков, или, по меньшей мере, двадцати семи белков, или, по меньшей мере, двадцати восьми белков, или, по меньшей мере, двадцати девяти белков, или, по меньшей мере, тридцати белков, или, по меньшей мере, тридцати одного белка, или, по меньшей мере, тридцати двух белков, или, по меньшей мере, тридцать трех белков, или, по меньшей мере, тридцати четырех белков, выбранных из аспартаткиназы, гомосериндегидрогеназы, гомосерин ацетилтрансферазы, O-сукцинилгомосерин сульфогидролазы, цистатионин γ-синтазы, цистатионин-β-лиазы, O-Ацетилгомосерин суль-фогидролазы. Витамин В12-зависимой метионинсинтазы. Витамин В12-независимой метионинсинтазы, N5,10-метилентетрагидрофолат-редуктазы, S-аденозилметионин синтазы, метионин-импортирующего белка, НАДФ-ферредоксин редуктазы, аспартат-полуальдегид-дегидрогеназы, цистатионин-бета-синтетазы, сульфитредуктазы (субъединицы 1 или 2, или обе), серин ацетилтрансферазы, O-ацетилсерин (тиол)-лиазы А, сульфат аденилилтрансферазы (субъединица 1 или 2, или обе), фосфоаденозин фосфосульфат редуктазы, гамма-пистатионазы, APS киназы, APS редуктазы, глюкоза-6-фосфат дегидрогеназы, пируват карбоксилазы, гомосерин киназы, уропорфириноген III синтазы, APS фосфатазы, переносчика сульфата, дополнительной роли в восстановлении сульфита, треонин дегидрогеназы, транскрипционного регулятора метаболизма серы TetR-типа и фосфоенолпируват карбоксикиназы.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, содержат два или более, или три или более, или четыре или более, или пять или более, или шесть или более, или семь или более, или восемь или более, или девять или более, или десять или более, или одиннадцать или более, или двенадцать или более, или тринадцать или более, или четырнадцать или более, или пятнадцать или более, или шестнадцать или более, или семнадцать или более, или восемнадцать или более, или девятнадцать или более, или двадцать или более, или двадцать один или более, или двадцать два или более, или двадцать три или более, или двадцать четыре или более, или двадцать пять или более, или двадцать шесть или более, или двадцать семь или более дерегулированных белков, выбранных из аспартаткиназы, гомосериндегидрогеназы, гомосерин ацетилтрансферазы, O-сукцинилгомосерин сульфогидролазы, цистатионин γ-синтазы, цистатионин-β-лиазы, O-ацетилгомосерин сульфогидролазы, Витамин В12-зависимой метионинсинтазы, Витамин В12-независимой метионинсинтазы, N5,10-метилентетрагидрофолат-редуктазы, НАДФ-ферредоксин редуктазы, аспартат-полуальдегид-дегидрогеназы, сульфит редуктазы (субъединицы 1 или 2, или обе), APS киназы, APS редуктазы, фосфоаденозин фосфосульфат редуктазы, гамма-цистатионазы, уропорфириноген III синтазы, глюкоза-6-фосфат дегидрогеназы, переносчика сульфата, дополнительной роли в восстановлении сульфита и пируват декарбоксилазы, где дерегулированные белки экспрессируются на уровне выше и/или имеют более высокую активность по отношению к экспрессии или активности в микроорганизме, который включает аналог белка дикого типа или который не экспрессирует белок.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, содержат два или более дерегулированных белка, выбранных из метионин-импортирующего белка, S-аденозилметионин синтазы, цистатионин-бета-синтетазы, APS фосфатазы, гомосерин киназы, транскрипционного регулятора метаболизма серы TetR-типа, фосфоенолпируват карбоксикиназы и треонин дегидратазы, где два или более дерегулированных белка экспрессируются на уровне ниже и/или имеют более низкую активность по отношению к экспрессии или активности в микроорганизме, который включает аналог белка дикого типа.
Следует понимать, что дерегулированный белок может экспрессироваться на уровне выше, чем уровень белка дикого типа, и/или он имеет более высокую активность по отношению к белку дикого типа. Альтернативно, он может экспрессироваться на уровне ниже, чем уровень белка дикого типа, и/или иметь менее высокую активность по отношению к дикому белку. В некоторых примерах дерегулированный белок конститутивно экспрессируется, а в других примерах дерегулированный белок вообще не экспрессируется или потерял свою ферментативную активность. В некоторых вариантах осуществления изобретения дерегулированный белок - это фермент пути биосинтеза метионина. В других вариантах осуществления изобретения дерегулированный белок - это фермент пути биосинтеза цистеина. В других вариантах осуществления изобретения дерегулированный белок - это репрессор или активатор транскрипции генов пути биосинтеза метионина и/или пути биосинтеза цистеина. В определенных примерах белок дерегулирован так, что он устойчив к ингибированию по типу обратной связи. Дерегулированный белок обычно экспрессируется генетически измененным или модифицированным геном микроорганизма.
Рекомбинантные микроорганизмы, описанные здесь, включают микроорганизмы, которые были генетически модифицированы или изменены таким образом, что они экспрессируют два или более, или три или более, или четыре или более, или пять или более, или шесть или более, или семь или более, или восемь или более, или девять или более, или десять или более, или одиннадцать или более, или двенадцать или более, или тринадцать или более, или четырнадцать или более, или пятнадцать или более, или шестнадцать или более, или семнадцать или более, или восемнадцать или более, или девятнадцать или более, или двадцать или более, или двадцать один или более, или двадцать два или более, или двадцать три или более, или двадцать четыре или более, или двадцать пять или более, или двадцать шесть или более, или двадцать семь или более, или двадцать восемь или более, или двадцать девять или более, или тридцать или более, или тридцать один или более, или тридцать два или более, или тридцать три или более, или тридцать четыре или более белков на уровне, который выше или ниже, чем уровень белка, продуцированного в микроорганизме, который не был генетически модифицирован или изменен. Например, в некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы продуцируют пять или более белков с активностью (например, ферментативной активностью), которая больше или ниже, чем активность белка в микроорганизме, который не модифицировался или изменялся генетически.
В некоторых вариантах осуществления изобретения рекомбинантные микроорганизмы, описанные здесь, включают, например, комбинацию генов, которые были изменены, где уровень продуцируемого метионина выше, чем сумма уровней метионина, продуцируемого в присутствии каждого отдельного изменения гена в комбинации (т.е. изменение комбинации генов имеет более сильный, чем суммарный или синергетический, эффект в отношении продуцирования метионина). Например, микроорганизмы, охватываемые настоящим изобретением, включают микроорганизмы, содержащие два или более измененных генов, где уровень продуцируемого метионина выше, чем сумма уровней метионина, продуцируемого в присутствии каждого отдельного измененного гена. Таким образом, синергетический эффект измененных двух или более, трех или более, или четырех или более, или пяти или более, или шести или более, или семи или более, или восьми или более, или девяти или более, или десяти или более генов, например, может быть измерен для любой комбинации различных генов, описанных здесь. В некоторых вариантах осуществления изобретения микроорганизмы, включающие комбинацию измененных генов, продуцируют метионин, например, на уровне, который, по меньшей мере, на 1-2% выше, или, по меньшей мере, на 3-5% выше, или, по меньшей мере, на 5-10% выше, или, по меньшей мере, на 10-20% выше, или, по меньшей мере, на 20-30% выше, или, по меньшей мере, на 30-40% выше, или, по меньшей мере, на 40-50% выше, или, по меньшей мере, на 50-60% выше, или, по меньшей мере, на 60-70% выше, или, по меньшей мере, на 70-80% выше, или, по меньшей мере, на 80-90% выше, или, по меньшей мере, на 90-95% выше, чем сумма уровней метионина, продуцируемого в присутствии каждого отдельного измененного гена или в отсутствии изменений.
В некоторых вариантах осуществления изобретения уровень метионина, продуцируемого микроорганизмами, содержащими комбинацию измененных генов, по меньшей мере, в 2 раза, или, по меньшей мере, в 2.5 раза, или, по меньшей мере, в 3 раза, или, по меньшей мере, в 3.5 раза, или, по меньшей мере, в 4 раза, или, по меньшей мере, в 4.5 раза, или, по меньшей мере, в 5 раз, или, по меньшей мере, в 10 раз, или, по меньшей мере, в 15 раз, или, по меньшей мере, в 20 раз, или, по меньшей мере, в 25 раз, или, по меньшей мере, в 30 раз, или, по меньшей мере, в 35 раз, или, по меньшей мере, в 40 раз, или, по меньшей мере, в 45 раз, или, по меньшей мере, в 50 раз, или, по меньшей мере, в 100 раз выше, чем сумма количеств, продуцируемых микроорганизмом в присутствии каждого отдельного измененного гена или в отсутствии генных изменений.
В других вариантах осуществления изобретения количество метионина, продуцируемого микроорганизмом при подходящих условиях ферментирования, содержащим комбинацию измененных генов, по меньшей мере, на 5 г, или, по меньшей мере, на 7 г, или, по меньшей мере, на 8 г, или, по меньшей мере, на 9 г, или, по меньшей мере, на 10 г, или, по меньшей мере, на 11 г, или, по меньшей мере, на 12 г, или, по меньшей мере, на 13 г, или, по меньшей мере, на 14 г, или, по меньшей мере, на 15 г, или, по меньшей мере, на 16 г, или, по меньшей мере, на 17 г, или, по меньшей мере, на 18 г, или, по меньшей мере, на 19 г, или, по меньшей мере, на 20 г, или, по меньшей мере, на 25 г, или, по меньшей мере, на 30 г, или, по меньшей мере, на 40 г, или, по меньшей мере, на 50 г больше на литр по отношению к сумме количеств, продуцируемых микроорганизмом в присутствии каждого отдельного измененного гена или в отсутствии генных изменений.
Уровень метионина, продуцированного микроорганизмами, описанными здесь, может быть легко измерен с использованием одного или более анализов, описанных здесь.
В некоторых вариантах осуществления изобретения «рекомбинантные микроорганизмы», включенные в это изобретение, имеют дерегулированный путь биосинтеза цистеина. Фраза «микроорганизм, имеющий дерегулированный путь биосинтеза цистеина» включает микроорганизм, имеющий изменение или модификацию, по меньшей мере, в двух, или, по меньшей мере, в трех, или, по меньшей мере, в четырех, или, по меньшей мере, в пяти, или, по меньшей мере, в шести, или, по меньшей мере, в семи, или, по меньшей мере, в восьми, или, по меньшей мере, в девяти, или, по меньшей мере, в десяти, или, по меньшей мере, в одиннадцати, или, по меньшей мере, в двенадцати, или, по меньшей мере, в тринадцати генах, кодирующих ферменты пути биосинтеза цистеина или имеющих изменение или модификацию в опероне, включающем гены, кодирующие ферменты пути биосинтеза цистеина. В некоторых вариантах осуществления изобретения микроорганизмы, имеющие дерегулированный путь биосинтеза цистеина, описанный здесь, генетически сконструированы, чтобы включать генетические изменения, по меньшей мере, в двух генах, выбранных из cysJ, cysA, cysE, cysK, cysM, cysD, cysI, cysN, cysG, cysC, cysX, cysZ и cysH, так что эти гены повышенно экспрессированы. В некоторых вариантах осуществления изобретения микроорганизмы, имеющие дерегулированный путь биосинтеза цистеина, описанный здесь, генетически сконструированы, чтобы включать генетическое изменение (генетические изменения) в cysQ и/или cysY, таким образом снижая экспрессию одного или обоих генов. В других вариантах осуществления изобретения рекомбинантные микроорганизмы, имеющие дерегулированный путь биосинтеза цистеина, включают комбинацию генетических изменений, по меньшей мере, в двух, или, по меньшей мере, в трех, или, по меньшей мере, в четырех, или, по меньшей мере, в пяти, или, по меньшей мере, в шести генах, выбранных из cysJ, cysA, cysE, cysK, cysM, cysD, cysI, cysN, cysG, cysC, cysY, cysX, cysZ, cysH и cysQ.
Также здесь представлены мутантные микроорганизмы. При использовании здесь термин «мутантный микроорганизм» включает рекомбинантный микроорганизм, который был генетически сконструирован для экспрессии мутантного или измененного гена или белка, который в нормальных или природных условиях экспрессируется микроорганизмом. Например, в некоторых вариантах осуществления изобретения мутантный микроорганизм экспрессирует мутантный ген или белок, так что микроорганизм проявляет измененный, модифицированный или другой фенотип. В других вариантах осуществления изобретения мутантный микроорганизм изменен или сконструирован, так что ген удален (т.е. белок, кодируемый геном, не продуцируется).
В некоторых вариантах осуществления изобретения рекомбинантный микроорганизм, описанный здесь, является грамположительным организмом (например, микроорганизмом, который удерживает основный краситель, например, кристаллический фиолетовый, вследствие присутствия грамположительной стенки, окружающей микроорганизм). В других вариантах осуществления изобретения рекомбинантный микроорганизм - это микроорганизм, принадлежащий роду, выбранному из Bacillus, Corynebacterium, Lactobacillus, Lactococci и Streptomyces. В других вариантах осуществления изобретения рекомбинантный микроорганизм принадлежит роду Corynebacterium, а в некоторых вариантах осуществления изобретения рекомбинантный микроорганизм выбирается из Corynebacterium glutamicum.
В некоторых вариантах осуществления изобретения рекомбинантный микроорганизм является грамотрицательным (не включает основный краситель) организмом. В других вариантах осуществления изобретения рекомбинантный микроорганизм - это микроорганизм, принадлежащий роду, выбранному из Salmonella, Escherichia, Klebsiella, Serratia и Proteus. В других вариантах осуществления изобретения рекомбинантный микроорганизм - это дрожжи, такие как выбранные из рода Saccharomyces, Kluyveromyces, Pichia, Candida, Schizosaccharomyces и т.д. (например, S. cerevisiae) или Archaea.
Важный объект, охватываемый настоящим изобретением, включает культивирование рекомбинантных микроорганизмов, описанных здесь, при подходящих условиях, таких что продуцируется метионин. Термин «культивирование» включает поддержание и/или выращивание живого микроорганизма, описанного здесь (например, поддержание и/или выращивание культуры или штамма). В некоторых вариантах осуществления изобретения микроорганизм культивируется в жидких средах. В других вариантах осуществления изобретения микроорганизм культивируется в твердых средах или полутвердых средах. В других вариантах осуществления изобретения микроорганизм культивируется в средах (например, стерильная, жидкая среда), содержащих питательные вещества, существенные или полезные для поддержания или роста микроорганизма (например, источники углерода или углеродный субстрат, например, сложные углеводы, такие как бобовая или зерновая пища, крахмалы, сахара, сахарные спирты, углеводороды, масла, жиры, жирные кислоты, органические кислоты и спирты; источники азота, например, растительные белки, пептоны, пептиды и аминокислоты, происходящие из зерновых, бобовых и клубнеплодовых, белки, пептиды и аминокислоты, происходящие из животных источников, таких как мясо, молоко и побочные продукты животных, такие как пептоны, мясные экстракты и гидролизаты казеина; неорганические источники азота, такие как мочевина, сульфат аммония, хлорид аммония, нитрат аммония и фосфат аммония; источники фосфора, например, фосфорная кислота, ее натриевые и калиевые соли; следовые элементы, например, соли магния, железа, марганца, кальция, меди, цинка, бора, никеля, молибдена и/или кобальта; так же как и факторы роста, такие как аминокислоты, витамины, промоторы роста и т.п.).
В некоторых примерах микроорганизмы, описанные здесь, культивируются при контролируемом рН. Термин «контролируемый рН» включает любой рН, который приводит к продуцированию метионина. В некоторых вариантах осуществления изобретения микроорганизмы культивируются при рН около 7. В других вариантах осуществления изобретения микроорганизмы культивируются при рН между 6.0 и 8.5. Желаемый рН может поддерживаться любым набором методов, известным специалисту в данной области.
Также в некоторых примерах микроорганизмы, описанные здесь, культивируются при контролируемой аэрации. Термин «контролируемая аэрация» включает достаточную аэрацию (например, кислород), которая приводит к продуцированию метионина. В некоторых вариантах осуществления изобретения аэрация контролируется регулированием уровней кислорода в культуре, например, регулированием количества кислорода, растворенного в культуральной среде. Например, аэрация культуры может контролироваться встряхиванием культуры. Встряхивание может обеспечиваться пропеллерным или похожим оборудованием для механического встряхивания, путем переворачивания или взбалтывания сосуда для выращивания (например, ферментера) или различным насосным оборудованием. Аэрация может также контролироваться пропусканием стерильного воздуха или кислорода через среду (например, через ферментационную смесь). Также микроорганизмы культивируются без избытка вспенивания (например, путем добавления пеногасителей).
Дополнительно, микроорганизмы, описанные здесь, могут культивироваться при котролируемых температурах. Термин «контролируемая температура» включает любую температуру, которая приводит к продуцированию метионина. В некоторых вариантах осуществления изобретения контролируемая температура устанавливается на определенную температуру, например, между 15°С и 95°С, между 15°С и 70°С, между 20°С и 55°С, между 30°С и 45°С, или между 30°С и 50°С, или между 28°С и 37°С.
Микроорганизмы могут культивироваться (например, поддерживаться и/или выращиваться) в жидких средах и предпочтительно культивируются либо непрерывно, либо периодически стандартными методами культивирования, такими как стационарная культура, культура в пробирке, встряхиваемая культура (например, культура, встряхиваемая ротационно, культура, встряхиваемая в колбе, и т.д.), аэрационная спин-культура или ферментация. В других вариантах осуществления изобретения микроорганизмы культивируются во встряхиваемых колбах. В других вариантах осуществления изобретения микроорганизмы культивируются в ферментере (например, в ферментационном процессе). Ферментационные процессы включают, но не ограничиваются этим, периодические, подпитываемые периодические и непрерывные методы ферментации. Термины «периодический процесс» и «периодическая ферментация» относятся к закрытой системе, в которой состав сред, питательные вещества, дополнительные добавки и т.п. устанавливаются в начале ферментации и не подвергаются изменению в течение ферментации; однако могут быть предприняты попытки контролировать такие факторы, как рН и концентрация кислорода, чтобы предотвратить избыточную кислотность среды и/или гибель микроорганизма. Термины «подпитываемый периодический процесс» и «подпитываемая периодическая» ферментация относятся к периодической ферментации за исключением того, что одна или более добавок или субстратов добавляется (например, порциями или непрерывно) в процессе ферментации. Термины «непрерывный процесс» и «непрерывная ферментация» относятся к системе, в которой определенная ферментационная среда непрерывно добавляется в ферментер и равное количество использованной или «кондиционированной» среды одновременно удаляется, например, для выделения целевого продукта (например, метионина). Был разработан ряд таких поцессов, хорошо известных в этой области.
Микроорганизмы, описанные здесь, могут культивироваться непрерывно или периодически, или в подпитываемом, либо повторно подпитываемом периодическом процессе для получения метионина. Обзор известных методов культивирования можно найти в руководстве Chmiel (Bioprozelitechnik 1. Einfiihrung in die Bioverfahrenstech-nik (Gustav Fischer Verlag, Stuttgart, 1991)) или в руководстве Storhas (Bioreaktoren und periphere Einrichtungen (Vieweg Verlag, Braunschweig/Wiesbaden, 1994)). Культуральная среда, которую следует использовать, должна удовлетворять требованиям определенных штаммов подходящим образом. Описания культуральных сред для различных микроорганизмов содержатся в справочнике "Manual of Methods for General Bacteriology" of the American Society for Bacteriology (Washington D.C., USA, 1981).
Фразы «культивирование в таких условиях, при которых продуцируется целевое соединение (например, метионин)» и «подходящие условия» относятся к поддержанию и/или выращиванию микроорганизмов в условиях (например, температура, давление, рН, продолжительность и т.д.), необходимых или достаточных для получения продуцирования целевого соединения или для получения целевых выходов определенного продуцируемого соединения. Например, микроорганизмы культивируются в подходящих условиях в течение времени, достаточного для продуцирования целевого количества метионина. В некоторых вариантах осуществления изобретения микроорганизмы культивируются в течение времени, достаточного для достижения по существу максимального продуцирования метионина. В некоторых вариантах осуществления изобретения микроорганизмы культивируются в течение около 12-24 часов. В других вариантах осуществления изобретения микроорганизмы культивируются в течение около 24-36 часов, около 36-48 часов, около 48-72 часов, около 72-96 часов, около 96-120 часов, около 120-144 часов или в течение более 144 часов. В других вариантах осуществления изобретения культивирование продолжается в течение времени, достаточного для достижения целевых производственных выходов метионина, например, микроорганизмы культивируются так, что продуцируется, по меньшей мере, около 7-10 г/л, или, по меньшей мере, около 10-15 г/л, или, по меньшей мере, около 15-20 г/л, или, по меньшей мере, около 20-25 г/л, или, по меньшей мере, около 25-30 г/л, или, по меньшей мере, около 30-35 г/л, или, по меньшей мере, около 35-40 г/л, или, по меньшей мере, около 40-50 г/л метионина. В некоторых вариантах осуществления изобретения количество метионина, продуцированного рекомбинантными микроорганизмами, охватываемыми настоящим изобретением, составляет, по меньшей мере, 16 г/л. В других вариантах осуществления изобретения количество метионина, продуцированного в подходящих ферментационных условиях рекомбинантными микроорганизмами, описанными здесь, составляет, по меньшей мере, 17 г/л. В других вариантах осуществления изобретения микроорганизмы культивируются в таких условиях, что предпочтительный выход метионина, например, выход в пределах диапазона, приведенного выше, продуцируется в течение около 24 часов, около 36 часов, около 48 часов, около 72 часов или около 96 часов.
Методы, описанные здесь, могут также включать стадию выделения целевого соединения (например, метионина). Термин «выделение» целевого соединения (например, метионина) относится к экстракции, сбору, выделению или очистке соединения из культуральной среды. Выделение соединения может проводиться по любому стандартному методу выделения или очистки, известному в этой области, включая, но не ограничиваясь этим, центрифугирование, выпаривание, обработку стандартными смолами (например, анионо- или катионообменной смолой, неионной адсорбционной смолой и т.д.), обработку стандартными адсорбентами (например, активированным углем, кремниевой кислотой, силикагелем, целлюлозой, алюминием и т.д.), изменение рН, экстракцию растворителем (например, стандартным растворителем, таким как спирт, этилацетат, гексан и т.п.), диализ, фильтрование, концентрирование, кристаллизацию, рекристаллизацию, изменение рН, лиофилизацию и т.п. Например, метионин может быть выделен из культуральных сред путем первоначального удаления микроорганизмов из культуры.
В некоторых вариантах осуществления изобретения метионин «экстрагируется», «выделяется» или «очищается» так, что он по существу свободен от других компонентов (например, свободен от компонентов среды и/или побочных продуктов ферментации). Фраза «по существу свободен от других компонентов» относится к препаратам целевого соединения, например метионина, в которых метионин отделен (например, очищен или частично очищен) от компонентов среды или побочных продуктов ферментации культуры, в которой он был продуцирован. В некоторых вариантах осуществления изобретения препарат имеет более чем около 80% (по сухой массе) метионина (например, менее чем около 20% других компонентов среды или побочных продуктов ферментации), или более чем около 90% метионина (например, менее чем около 10% других компонентов среды или побочных продуктов ферментации), или более чем около 95% метионина (например, менее чем около 5% других компонентов среды или побочных продуктов ферментации), или более чем около 98-99% метионина (например, менее чем около 1-2% других компонентов среды или побочных продуктов ферментации).
В альтернативном варианте осуществления изобретения метионин не очищается от микроорганизма, например, когда микроорганизм биологически неопасен (например, безопасен). Например, целая культура (или культуральный супернатант) может ис-пользваться как источник продукта (например, неочищенного продукта). В одном варианте осуществления изобретения культура (или культуральный супернатант) используется без модификации. В другом варианте осуществления изобретения культура (или культуральный супернатант) концентрируется. В другом варианте осуществления изобретения культура (или культуральный супернатант) высушивается или лиофилизуется.
Это изобретение также включает процессы биотрансформации, которые затрагивают различные рекомбинантные микроорганизмы, описанные здесь. Термин «процесс биотрансформации», также упоминаемый здесь как «процесс биоконверсии», включает биологические процессы, которые приводят к превращению (например, трансформации или конверсии) подходящих субстратов и/или промежуточных соединений в целевой продукт (например, метионин).
Микроорганизм(ы) и/или ферменты, используемые в реакциях биотрансформации, находятся в форме, которая позволяет осуществлять предназначенную им функцию (например, продуцирование целевого соединения). Такие микроорганизмы могут быть целыми клетками или могут быть только теми частями клетки (например, генами и/или ферментами), необходимыми для получения желательного конечного результата. Эти микроорганизмы могут быть суспендированы (например, в подходящем растворе, таком как буферные растворы или среды), промыты (например, промыты от среды культивирования микроорганизма), высушены ацетоном, иммобилизованы (например, в полиакриламидном геле или k-каррагинане или на синтетических носителях, например, шариках, матрицах и т.п.), фиксированы, сшиты, или им может придаваться проницаемость (например, придают проницаемость мембранам и/или стенкам таким образом, что соединения, например субстраты, промежуточные соединения или продукты, могут легче проникать через вышеупомянутую мембрану или стенку).
Это изобретение также включает молекулы рекомбинантной нуклеиновой кислоты (например, молекулы рекомбинантной ДНК), которые включают гены, описанные здесь (например, изолированные гены), включая гены Corynebacterium такие, например, как гены Corynebacterium glutamicum, а более специфично, гены Corynebacterium glutamicum биосинтеза метионина и гены Corynebacterium glutamicum биосинтеза цистеина. Термин «молекула рекомбинантной нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты (например, молекуле ДНК), которая была изменена, модифицирована или сконструирована так, что она отличается в последовательности нуклеотидов от нативной или природной молекулы нуклеиновой кислоты, от которой произошла молекула рекомбинантной нуклеиновой кислоты (например, путем добавления, делении или замещения одного или более нуклеотидов). В некоторых вариантах осуществления изобретения молекула рекомбинантной нуклеиновой кислоты (например, молекула рекомбинантной ДНК) включает изолированный ген, функционально связанный с регуляторными последовательностями. Фраза «функционально связанный с регуляторной последовательностью (регуляторными последовательностями)» означает, что нуклеотидная последовательность интересующего гена связана с регуляторной последовательностью (регуляторными последовательностями) таким образом, что обеспечивается экспрессия (например, усиленная, повышенная, конститутивная, базальная, аттенуированная, сниженная или подавленная экспрессия) гена, например, экспрессия генного продукта, кодируемого геном (например, когда молекула рекомбинантной нуклеиновой кислоты включена в рекомбинантный вектор, как здесь определено, и введена в микроорганизм).
Термин «гетерологичная нуклеиновая кислота» используется здесь по отношению к последовательностям нуклеиновой кислоты, которые обычно не присутствуют в микроорганизме. Такие последовательности нуклеиновой кислоты также включают последовательности нуклеиновой кислоты, присутствующие в микроорганизме, но не в генетическом положении, где они обычно находятся в микроорганизме. Похожим образом, термин «гетерологичный ген» может включать ген, не присутствующий в микроорганизме дикого типа. Гетерологичные нуклеиновые кислоты и гетерологичные гены в основном содержат молекулы рекомбинантной нуклеиновой кислоты. Гетерологичные нуклеиновые кислоты и гетерологичные гены могут включать или могут не включать модификации (например, путем добавления, удаления или замещения одного или более нуклеотидов).
Также в это изобретение входят гомологи различных генов и белков, описанных здесь. «Гомолог», в отношении гена, относится к нуклеотидной последовательности, которая, по существу, идентична, по меньшей мере, части гена или его комплементарной спирали или ее части при условии, что нуклеотидная последовательность кодирует белок, имеющий, по существу, такую же активность/функцию, как и белок, кодируемый геном, гомологом которого он является. Гомологи генов, описанных здесь, могут быть идентифицированы по проценту идентичности между аминокислотными или нуклеотидными последовательностями для предполагаемых гомологов и последовательностей для генов и белков, кодируемых ими (например, нуклеотидные последовательности для генов Corynebacterium glutamicum ask, hom, metX, metY, metB, metH, metE, metF, zwf, metC, metK, metQ, cysJ, cysE, cysK, cysM, cysD, cysH, cysA, mcbR, hsk и рерСК либо их комплементарные нити). Процент идентичности может быть определен, например, визуальной проверкой, либо при помощи различных компьютерных программ, известных в этой области или описанных здесь. Например, процент идентичности двух нуклеотидных последовательностей можно определить сравнением информации по последовательности при помощи компьютерной программы GAP, описанной Devereux et al. (1984) Nucl. Acids. Res., 12:387 и доступной от Группы Компьютерной Генетики Университета Штата Висконсин (UWGCG). Процент идентичности также можно определить путем выравнивания двух последовательностей с помощью программы Поисковый Инструмент Основного Локального Выравнивания (BLAST™) (как описано Tatusova et al. (1999) FEMS Microbiol. Lett., 174:247). Например, для выравниваний нуклеотидной последовательности при помощи программы BLAST™ установки по умолчанию следующие: награда за совпадение 2, штраф за несовпадение -2, штраф за открытие гэпа и штраф за продолжение гэпа 5 и 2 соответственно, gap.times.dropoff 50, ожидание 10, размер слова 11, а фильтр ВЫКЛЮЧЕН.
При использовании здесь термины «гомология» и «гомологичный» не ограничены для обозначения белков, имеющих теоретически общий генетический предшественник, но включают белки, которые могут быть генетически неродственными, но которые, тем не менее, предназначены для выполнения похожих функций и/или имеют похожие структуры. Функциональная гомология различным белкам, описанным здесь, также включает белки, имеющие активность соответствующего белка, гомолотом которого он является. Чтобы иметь функциональную гомологию, для белков необязательно иметь значительную идентичность своих аминокислотных последовательностей, скорее, белки, имеющие функциональную гомологию, так определены, поскольку имеют похожие или идентичные активности, например, ферментативные активности. Похожим образом, белки со структурной гомологией определяются как белки, имеющие аналогичную третичную (или четвертичную) структуру, и не обязательно имеют аминокислотную идентичность или нуклеотидную идентичность кодирующих их генов. В определенных обстоятельствах структурные гомологи могут включать белки, которые сохраняют структурную гомологию только в активном сайте или связывающем сайте белка.
В добавление к структурной и функциональной гомологии настоящее изобретение также включает белки, имеющие аминокислотную идентичность с различными белками и ферментами, описанными здесь. Для определения процента идентичности двух аминокислотных последовательностей последовательности выравниваются в целях оптимального сравнения (например, могут быть введены гэпы в аминокислотную последовательность одного белка для оптимального выравнивания с аминокислотной последовательностью другого белка). Затем сравниваются аминокислотные остатки в соответствующих положениях аминокислот. Когда положение в одной последовательности занято тем же аминокислотным остатком, что и соответствующее положение в другой последовательности, тогда молекулы идентичны в этом положении. Процент идентичности между двумя последовательностями является функцией количества идентичных положений, разделяемых последовательностями (т.е. % идентичности =# идентичных положений/общее # положений, умноженное на 100).
В некоторых вариантах осуществления изобретения молекулы последовательностей нуклеиновых кислот и аминокислот, описанные здесь, содержат нуклеотидную последовательность или аминокислотную последовательность, которая гибридизуется или является идентичной, по меньшей мере, на около 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более последовательности нуклеиновой кислоты или аминокислот, описанной здесь.
Методы, используемые для генетического конструирования белков, описанных здесь, для получения ферментов с улучшенными или модифицированными характеристиками, также описаны здесь. Например, в пределах методик, доступных в этой области, можно модифицировать белок так, что белок будет иметь повышенное или сниженное сродство к субстрату. Также может быть полезным и в пределах методик этой области сконструировать белок, имеющий повышенные или сниженные скорости ферментативных реакций. Особенно для многофункциональных ферментов может быть полезным тонко дифференцировано настроить различные активности белка для оптимального функционирования в определенных обстоятельствах. Также способность модулировать чувствительность фермента к ингибированию по типу обратной связи (например, метионином) может быть достигнута путем селективой замены аминокислот, вовлеченных в связывание или координацию метионина или других кофакторов, которые могут участвовать в отрицательной или положительной обратной связи. Также генетическая инженерия включает события, связанные с регуляцией экспрессии на уровне как транскрипции, так и трансляции. Например, когда для клонирования и экспрессии используется полный или частичный оперон, регуляторные последовательности, например промоторные или энхансерные последовательности гена, могут быть модифицированы так, что они обеспечат желательные уровни транскрипции.
«Гомолог» любого гена, описанного здесь, также может быть идентифицирован по активности белка, кодируемого гомологом. Например, такой гомолог может дополнять мутацию в гене, гомологом которого он является.
Термин «регуляторная последовательность» относится к последовательностям нуклеиновой кислоты, которые влияют (например, модулируют или регулируют) на экспрессию других последовательностей нуклеиновых кислот (т.е. генов). В некоторых вариантах осуществления изобретения регуляторная последовательность включена в молекулу рекомбинантной нуклеиновой кислоты в похожее или идентичное положение и/или ориентацию по отношению к определенному интересующему гену, как наблюдается для регуляторной последовательности и интересующего гена, как это оказывается в природе, например, в нативном положении и/или ориентации. Например, интересующий ген может быть включен в молекулу рекомбинантной нуклеиновой кислоты, функционально связанной с регуляторной последовательностью, которая сопровождает или соседствует с интересующим геном в природном организме (например, функционально связана с «нативными» регуляторными последовательностями (например, с «нативным» промотором)). Альтернативно, интересующий ген может быть включен в молекулу рекомбинантной нуклеиновой кислоты, функционально связанной с регуляторной последовательностью, которая сопровождает или соседствует с другим (например, отличающимся) геном в природном организме. Альтернативно, интересующий ген может быть включен в молекулу рекомбинантной нуклеиновой кислоты, функционально связанной с регуляторной последовательностью из другого организма. Например, регуляторные последовательности из других микробов (например, бактериальные регуляторные последовательности, регуляторные последовательности бактериофага и т.п.) могут быть функционально связаны с определенным интересующим геном.
В одном варианте осуществления изобретения регуляторная последовательность является ненативной и несуществующей в природе последовательностью (например, последовательностью, которая была модифицирована, мутировала, замещена, было получено ее производное, делегирована, включая последовательности, которые были химически синтезированы). Примеры регуляторных последовательностей включают промоторы, энхансеры, сигналы терминации, сигналы антитерминации и другие элементы, контролирующие экспрессию (например, последовательности, с которыми связываются репрессоры или индукторы, и/или сайты связывания для регуляторных белков транскрипции и/или трансляции, например, в транскрибированной м-РНК). Такие регуляторные последовательности описаны, например, в Sambrook, J., Fritsh, Е.F., and Maniatis, T. Molecular Cloning: A Laboratory Manual. 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, и в Patek, M. et al, (2003) Journal of Biotechnology 104:311-323. Регуляторные последовательности включают последовательности, которые направляют конститутивную экспрессию нуклеотидной последовательности в микроорганизме (например, конститутивные промоторы или сильные конститутивные промоторы), последовательности, которые направляют индуцибельную экспрессию нуклеотидной последовательности в микроорганизме (например, индуцибельные промоторы, например, индуцибельные ксилозные промоторы), и последовательности, которые аттенуируют или подавляют экспрессию нуклеотидной последовательности в микроорганизме (например, сигналы аттенуации или репрессорные последовательности). Также в объем изобретения входит регуляция экспрессии интересующего гена путем удаления или делеции регуляторных последовательностей. Например, последовательности, участвующие в отрицательной регуляции транскрипции, могут быть удалены так, что экспрессия интересующего гена будет усилена.
В некоторых вариантах осуществления изобретения молекула рекомбинантной нуклеиновой кислоты, описанная здесь, включает последовательность нуклеиновой кислоты или ген, который кодирует, по меньшей мере, один бактериальный генный продукт (например, фермент биосинтеза метионина), функционально связанный с промотором или промоторной последовательностью. Промоторы, представленные здесь, включают, но не ограничиваются этим, промоторы Corynebacterium и/или промоторы бактериофага (например, бактериофага, инфицирующего Corynebacterium или другие бактерии). Например, в некоторых вариантах осуществления изобретения промотор является промотором Corynebacterium, таким как сильный промотор Corynebacterium (например, промотор, связанный с геном "домашнего хозяйства" в Corynebacterium). В других вариантах осуществления изобретения промотор является промотором бактериофага. Дополнительные промоторы для использования в грамположительных микроорганизмах включают, но не ограничены, супероксиддисмутазу, groEL, groES, фактор элонгации Tu, amy и SPO1 промоторы, такие как P15 и Р26. Примеры промоторов для использования в грамотрицательных микроорганизмах включают, но не ограничены, cos, tac, trp, tet, trp-tet, lpp, lac, lpp-lac, lacIQ, T7, T5, T3, gal, trc, ara, SP6, λ-PR и λ-PL.
В некоторых вариантах осуществления изобретения рекомбинантная нуклеиновая кислота включает терминаторную последовательность или терминаторные последовательности (например, транскрипционные терминаторные последовательности). Термин «терминаторные последовательности» включает регуляторные последовательности, служащие для терминации транскрипции м-РНК. Терминаторные последовательности (или тандемные терминаторы транскрипции) могут также служить для стабилизации м-РНК (например, путем добавления структуры к м-РНК), например, против нуклеаз.
В некоторых вариантах осуществления изобретения молекула рекомбинантной нуклеиновой кислоты включает последовательности, которые обеспечивают обнаружение вектора, содержащего вышеупомянутые последовательности (т.е. детектируемые и/или селективные маркеры), например, гены, кодирующие последовательности резистентности к антибиотикам, или которые преодолевают ауксотрофные мутации, например, trpC, лекарственные маркеры, флуоресцентные маркеры и/или колориметрические маркеры (например, lacZ/β-галактозидаза). В других вариантах осуществления изобретения молекула рекомбинантной нуклеиновой кислоты включает искусственный сайт связывания с рибосомой (RBS) или последовательность, которая транскрибируется в искусственный RBS.
Термин «искусственный сайт связывания с рибосомой (RBS)» включает сайт внутри молекулы м-РНК (например, кодируемый внутри ДНК), с которым связывается рибосома (например, для инициации трансляции), который отличается от нативного RBS (например, RBS, обнаруженного в гене, существующего в природе), по меньшей мере, одним нуклеотидом. Предпочтительные искусственные RBS включают около 5-6, 7-8, 9-10,11-12, 13-14,15-16, 17-18, 19-20, 21-22, 23-24, 25-26, 27-28, 29-30 или более нуклеотидов, из которых около 1-2, 3-4, 5-6, 7-8, 9-10, 11-12, 13-15 или более отличается от нативного RBS (например, нативного RBS интересующего гена).
Также в это изобретение входят векторы (например, рекомбинантные плазмиды или бактериофаги), которые включают молекулы нуклеиновой кислоты (например, гены или молекулы рекомбинантной нуклеиновой кислоты, содержащие вышеназванные гены) по настоящему описанию. Термин «рекомбинантный вектор» включает вектор (например, плазмиду, фага, фазмиду, вирус, космиду, фосмиду или другой вектор очищенной нуклеиновой кислоты), который был изменен, модифицирован или сконструирован так, что он содержит больше, меньше или другое количество последовательностей нуклеиновой кислоты, чем векторы, включенные в нативную или природную молекулу нуклеиновой кислоты, от которой произошел рекомбинантный вектор. Например, рекомбинантный вектор включает биосинтетический ген, кодирующий фермент или молекулу рекомбинантной нуклеиновой кислоты, включающей вышеназванный ген, функционально связанный с регуляторными последовательностями, например, промоторными последовательностями, терминаторными последовательностями и/или искусственными сайтами связывания с рибосомой (RBS), как здесь определено. В некоторых вариантах осуществления изобретения рекомбинантный вектор включает последовательности, которые усиливают репликацию в бактериях (например, последовательности, усиливающие репликацию). В некоторых вариантах осуществления изобретения последовательности, усиливающие репликацию, функционируют в Е. coli или С.glutamicum. В других вариантах осуществления изобретения последовательности, усиливающие репликацию, происходят от плазмид, включая, но не ограничиваясь этим, pBR322, pACYC177, pACYC184 и pSC101.
В некоторых вариантах осуществления изобретения рекомбинантный вектор настоящего изобретения включает последовательности резистентности к антибиотикам. Термин «последовательности резистентности к антибиотикам» включает последовательности, которые промотируют или обеспечивают устойчивость к антибиотикам у организма хозяина (например, Corynebacterium). В некоторых вариантах осуществления изобретения последовательности резистентности к антибиотикам выбраны из: cat (резистентность к хлорамфениколу) последовательностей, tet (резистентность к тетрациклину) последовательностей, erm (резистентность к эритромицину) последовательностей, neo (резистентность к неомицину) последовательностей, kan (резистентность к канамицину) последовательностей и spec (резистентность к спектиномицину) последовательностей. Рекомбинантные векторы могут также включать гомологичные последовательности рекомбинации (например, последовательности, сконструированные для обеспечения рекомбинации интересующего гена в хромосому организма хозяина). Также специалисту в этой области следует учитывать, что конструкция вектора может быть разработана в зависимости от таких факторов, как выбор микроорганизма, подвергаемого операциям генетической инженерии, уровень экспрессии целевого генного продукта и т.п.
"Campbell in" при использовании здесь относится к трансформанту исходной клетки-хозяина, в которой целая кольцевая двухцепочечная молекула ДНК (например, плазмида) была интегрирована в хромосому при помощи одного акта гомологичной рекомбинации (врезание), и это приводит к эффективной вставке линейной версии вышеупомянутой кольцевой молекулы ДНК в первую последовательность ДНК хромосомы, которая гомологична первой последовательности ДНК вышеупомянутой кольцевой молекулы ДНК. "Campbelled in" относится к линейной последовательности ДНК, которая была интегрирована в хромосому трансформанта "Campbell in". "Campbell in" содержит копию первой гомологичной последовательности ДНК, каждая копия которой включает и окружает копию гомологичной точки рекомбинации кроссовера. Название происходит от профессора Алана Кэмпбелла, кто первым предложил этот тип рекомбинации.
"Campbell out" при использовании здесь относится к клетке, происходящей от "Campbell in" трансформанта, в которой произошло второй акт гомологичной рекомбинации (вырезание) между второй последовательностью ДНК, которая содержится в линейной вставленной ДНК "Campbell in" ДНК, и второй последовательностью ДНК хромосомного происхождения, гомологичной второй последовательности ДНК вышеупомянутой линейной вставки, при этом второй акт гомологичной рекомбинации приводит к делеции (выбрасыванию) участка интегрированной последовательности ДНК, а также, что очень важно, приводит к тому, что участок (по меньшей мере, одно основание) интегрированной Campbelled in ДНК остается в хромосоме, так что по сравнению с исходной клеткой-хозяином, «Campbell out» клетка содержит одно или более преднамеренных изменений в хромосоме (например, замену одного основания, замену нескольких оснований, вставку гетерологичного гена или последовательности ДНК, вставку дополнительной копии или копий гетерологичного гена или модифицированного гомологичного гена, или вставку последовательности ДНК, содержащей более одного из упомянутых ранее примеров, перечисленных выше).
"Campbell out" клетку или штамм обычно, но не обязательно, получают путем контрселекции против гена, содержащегося в участке (участке, который нужно выбросить) последовательности "Campbelled in" ДНК, например, в Bacillus subtilis sacB гене, который является смертельным, когда экспрессируется в клетке, растущей в присутствии около 5 - 10% сахарозы. Целевая "Campbell out" клетка может быть получена или идентифицирована либо с помощью контрселекции, либо без, путем скрининга целевой клетки, с помощью любого скринируемого фенотипа, такого как, но не ограничиваясь, морфология колонии, цвет колонии, присутствие или отсутствие резистентности к антибиотикам, присутствие или отсутствие данной последовательности ДНК по полимеразной цепной реакции, присутствие или отсутствие ауксотрофии, присутствие или отсутствие фермента, гибридизация нуклеиновой кислоты колонии, скрининг антител и т.д. Термины "Campbell in" и "Campbell out" также могут использоваться как глаголы в различных временах по отношению к методу или процессу, описанному выше.
Следует понимать, что акты, приводящие к "Campbell in" и "Campbell out" могут происходить на ряде оснований ДНК в пределах гомологичной последовательности ДНК, а поскольку гомологичные последовательности будут идентичны друг другу, по меньшей мере, частью этого ряда, обычно невозможно точно определить, где произошел акт кроссовера. Другими словами, невозможно точно определить, какая последовательность исходно была из вставленной ДНК, а какая была исходно из хромосомной ДНК. Более того, первая гомологичная последовательность ДНК и вторая гомологичная последовательность ДНК обычно отделены участком частичной негомологии, и этот участок негомологии остается в хромосоме "Campbell out" клетки.
На практике, в С.glutamicum, обычно первая и вторая гомологичная последовательность ДНК имеет длину, по меньшей мере, около 200 пар оснований, а может быть длиной вплоть до нескольких тысяч пар оснований, однако процедура может работать и с более короткими и более длинными последовательностями. Например, длина первой и второй гомологичных последовательностей может находиться в пределах от около 500 до 2000 оснований, и получение "Campbell out" из "Campbell in" облегчается путем подгонки первой и второй гомологичных последовательностей так, чтобы они были приблизительно одной длины, предпочтительно с разницей менее 200 пар оснований, а наиболее предпочтительно, чтобы более короткая из двух имела, по меньшей мере, 70% длины более длинной по парам оснований.
Настоящее изобретение также проиллюстрировано следующими примерами, которые не следует понимать как ограничивающие. Содержания всех ссылок, патентов и опубликованных патентных заявок, цитируемых в данной заявке, включены сюда путем ссылки.
Примеры
Пример 1: Получение штамма М2014
Штамм С.glutamicum ATCC 13032 трансформировали ДНК А (также обозначается как рН273) (SEQ ID NO:1) и "Campbelled in" с получением "Campbell in" штамма. На Фиг.2 показана схема плазмиды рН273. Затем "Campbell in" штамм "Campbelled out" с получением "Campbell out" штамма, М440, содержащего ген, кодирующий фермент, устойчивый к ингибированию по типу обратной связи, гомосерин-дегидрогеназу, (homfbr). Полученный белок гомосерин-дегидрогеназа включал аминокислотную замену, где S393 был заменен на F393 (обозначается как Hsdh S393F).
Штамм М440 затем трансформировали ДНК В (также обозначается как рН373) (SEQ ID NO:2) и получали "Campbell in" штамм. На Фиг.3 показана схема плазмиды рН373. Затем "Campbell in" штамм "Campbelled out" с получением "Campbell out" штамма, М603, содержащего ген, кодирующий фермент, устойчивый к ингибированию по типу обратной связи, аспартаткиназу (Askfbr) (кодируемый lysC). В полученном белке, аспартаткиназе, Т311 был заменен на T311 (обозначается как LysC T311I).
Было обнаружено, что штамм М603 продуцирует около 17.4 мМ лизина, тогда как АТСС 13032 штамм продуцировал не поддающееся измерению количество лизина. Дополнительно, М603 штамм продуцировал около 0.5 мМ гомосерина по сравнению с не поддающимся измерению количеством, продуцируемым АТСС 13032 штаммом, как показано в Таблице III.
Штамм М603 трансформировали ДНК С (также обозначается как рН304, схема которой показана на Фиг.4) (SEQ ID NO:3), получали "Campbell in" штамм, затем "Campbelled out" с получением "Campbell out" штамма М690. Штамм М690 содержал PgroES промотор выше гена metH (обозначается как P497 metH). Последовательность промотора Р497 показана на SEQ ID NO:4. Штамм М690 продуцировал около 77.2 мМ лизина и около 41.6 мМ гомосерина, как показано в Таблице IV ниже.
Штамм М690 подвергали мутагенному воздействию следующим образом: ночную культуру М603, выращенную на среде BHI (BECTON DICKINSON), промывали 50 мМ нитратным буфером рН 5.5, обрабатывали в течение 20 мин при 30°С N-метил-N-нитрозогуанидином (10 мг/мл в 50 мМ цитрате рН 5.5). После обработки клетки снова промывали 50 мМ нитратным буфером рН 5.5 и высевали на чашки со средой, содержащей следующие ингредиенты: (все упомянутые количества вычислены для 500 мл среды) 10 г (NH4)2SO4; 0.5 г KH2PO4; 0.5 г K2HPO4; 0.125 г MgSO4·7H2O; 21 г MOPS; 50 мг CaCl2; 15 мг протокатеховой кислоты; 0.5 мг биотина; 1 мг тиамина и 5 г/л D,L-этионина (SIGMA CHEMICALS, CATALOG #Е5139), с доведением до рН 7.0 при помощи КОН. В добавление среда содержала 0.5 мл раствора следовых количеств металла, состоящего из: 10 г/л FeSO4·7H2O; 1 г/л MnSO4·H2O; 0.1 г/л ZnSO4·7H2O; 0.02 г/л CuSO4; и 0.002 г/л NiCl2·6H2O, все растворенные в 0.1 М HCl. Конечную среду стерилизовали фильтрованием и к среде добавляли 40 мл стерильного 50% раствора глюкозы (40 мл) и стерильного агара до конечной концентрации 1.5%. Конечную агар-содержащую среду выливали на агаровые чашки и помечали как среду с минимальным этионином. Мутантные штаммы распределяли по чашкам (минимальный этионин) и инкубировали в течение 3-7 дней при 30°С. Клоны, которые выросли на среде, выделяли и пересевали штрихом на такую же среду с минимальным этионином. Несколько клонов отбирали для анализа на продуцирование метионина.
Продуцирование метионина анализировали следующим образом. Штаммы выращивали на полной агаровой среде в течение двух дней при 30°С, которая содержала: 10 г/л D-глюкозы, 2.5 г/л NaCl; 2 г/л мочевины; 10 г/л бактопептона (DIFCO); 5 г/л дрожжевого экстракта (DIFCO); 5 г/л мясного экстракта (DIFCO); 22 г/л агара (DIFCO); и который автоклавировали в течение 20 мин при около 121°С.
После того как штаммы выросли, клетки соскабливали и ресуспендировали в 0.15 М NaCl. Для главной культуры суспензию соскобленных клеток добавляли при начальной оптической плотности (ОП) 600 нм к около 1.5-10 мл Среды II (см. ниже) вместе с 0.5 г твердого и автоклавированного СаСО3 (RIEDEL DE HAEN), и клетки инкубировались в 100 мл встряхиваемой колбе без перегородок в течение 72 ч на орбитальной встряхивающей платформе при около 200 об/мин при 30°С. Среда II содержала: 40 г/л сахарозы; 60 г/л общего сахара из мелассы (вычислено для содержания сахара); 10 г/л (NH4)2SO4; 0.4 г/л MgSO4·7H2O; 0.6 г/л KH2PO4; 0.3 мг/л тиамин·HCl; 1 мг/л биотина; 2 мг/л FeSO4; и 2 мг/л MnSO4. Среду доводили до рН 7.8 при помощи NH4OH и автоклавировали при около 121°С в течение около 20 мин. После автоклавирования и охлаждения добавляли витамин B12 (цианокобаламин) (SIGMA CHEMICALS) из фильтрованного стерильного стокового раствора (200 мкг/мл) до конечной концентрации 100 мкг/л.
Образцы вынимали из среды и анализировали содержание аминокислот. Продуцированные аминокислоты, включая метионин, определяли при помощи аминокислотного метода Agilent на Agilent 1100 Series LC System HPLC. (AGILENT). Предколоночная обработка образца с получением производных орто-фталальдегидом позволяла количественное определение продуцированных аминокислот после разделения на Hypersil АА-колонке (AGILENT).
Были выделены клоны, показавшие титр метионина, по меньшей мере, в два раза превышающий титр в М690. Один такой клон, используемый в дальнейших экспериментах, назвали M1197 и депонировали 18 мая 2005 г. в коллекции штаммов DSMZ под номером штамма DSM 17322. Продуцирование аминокислот этим штаммом сравнивали с продуцированием аминокислот штаммом М690, как представлено в Таблице V.
Штамм M1197 трансформировали с ДНК F (также обозначается как рН399, схема которой показана на Фиг.5) (SEQ ID NO:5), получая "Campbell in" штамм, который затем "Campbelled out" с получением штамма M1494. Этот штамм содержит мутацию в гене фермента гомосеринкиназы, что приводит к аминокислотной замене в полученном ферменте гомосеринкиназе с Т190 на А190 (обозначается как HskT190A). Продуцирование аминокислот штаммом M1494 сравнивали с продуцированием аминокислот штаммом M1197, как представлено в Таблице VI.
Штамм М1494 трансформировали с ДНК D (также обозначается как рН484, схема которой показана на Фиг.6) (SEQ ID N0:6), получая "Campbell in" штамм, затем "Campbelled out" с получением штамма М1990. Штамм М1990 повышенно экспрессирует metY аллель при помощи как groES-промотора, так и EFTU (фактор элонгации Tu)-промотора (обозначается как Р497 P1284 metY). Последовательность промотора Р497 P1284 приведена в SEQ ID NO:7. Продуцирование аминокислот штаммом М1494 сравнивали с продуцированном аминокислот штаммом М1990, как представлено в Таблице VII.
Штамм М1990 трансформировали с ДНК Е (также обозначается как рН 491, схема которой показана на Фиг.7) (SEQ ID NO:8), получая "Campbell in" штамм, затем "Campbelled out" с получением штамма М2014. Штамм М2014 повышенно экспрессирует metA аллель при помощи промотора супероксиддисмутазы (обозначается как Р3119 metA). Последовательность промотора Р3119 приведена в SEQ ID NO:9. Продуцирование аминокислот штаммом М2014 сравнивали с продуцированном аминокислот штаммом М2014, как представлено в Таблице VIII.
Пример 2: Усиление экспрессии metF in М2014
Метилентетрагидрофолат-редуктаза (MetF) катализирует восстановление 5,10-метилентетрагидрофолата до 5-метилтетрагидрофолата (5-MTF). 5-MTF является донором метила при метилировании гомоцистеина до метионина. Либо фермент MetE, либо MetH катализирует это метилирование. Эта последняя стадия биосинтеза метионина может быть ограничена, если подача 5-MTF будет ниже оптимальной. Поэтому ген metF модифицировали для конститутивной экспрессии. Нативный про-мотор metF заменили промотором groES (P497) (SEQ ID NO:4) и ввели в штамм С.glutamicum М2014 в локус bioAD.
Ген С.glutamicum metF получали с помощью ПЦР и лигировали между сайтами XbaI и BamHI плазмиды рОМ35, получая рОМ62 (SEQ ID NO:10). Схема плазмиды рОМ62 приведена на Фиг.8. Кассета P497 metF была введена в М2014 в хромосомном локусе bioAD сначала селекцией трансформантов, устойчивых к канамицину (Camp-belling in), а затем применением sacB контрселекции для выделения производных, чувствительных к канамицину, которые потеряли интегрирующий плазмидный каркас (Campbelling out). Полученные колонии скринировали с помощью ПЦР в поиске М2014 с кассетой P497 metF в локусе bioAD. Один такой С.glutamicum изолят назвали ОМ41.
Для определения продуцирования метионина и других аминокислот культуры из встряхиваемой колбы выращивали на стандартной мелассовой среде, как описано в Примере 3, с штаммами М2014 в двухкратном повторении и штаммами ОМ41 в четырехкратном повторении. Как показано в Таблице IX, штамм ОМ41 продуцирует метионин на более высоких уровнях, чем штамм М2014.
Пример 3: Эксперименты во встряхиваемой колбе и ВЭЖХ анализ
Эксперименты во встряхиваемой колбе со стандартной мелассовой средой проводились со штаммами в двукратном или четырехкратном повторении. Мелассовая среда содержала в одном литре среды: 40 г глюкозы; 60 г мелассы; 20 г (NH4)2SO4; 0.4 г MgSO4·7H2O; 0.6 г KH2PO4; 10 г дрожжевого экстракта (DIFCO); 5 мл 400 мМ треонина; 2 мг FeSO4·7H2O; 2 мг MnSO4·H2O и 50 г СаСО3 (Riedel-de Haen), с объемом, доведенным ddH2O. pH доводили до 7.8 20% NH4OH, 20 мл непрерывно перемешиваемой среды (для поддержания СаСО3 в суспендированном состоянии) добавляли в 250 мл встряхиваемые колбы с перегородками Bellco, и колбы автоклавировали в течение 20 мин. После автоклавирования 4 мл "4В раствора" добавляли на литр основной среды (или 80 мкл/колба). "4В Раствор" содержал в литре: 0.25 г тиамина гидрохлорида (витамин В1), 50 мг цианокобаламина (витамин В 12), 25 мг биотина, 1.25 г пиридоксина гидрохлорида (витамин В6) и был доведен до pH 7.0 12.5 мМ KPO4 для растворения биотина, и раствор стерилизовали фильтрованием. Культуры выращивали в колбах с перегородками, накрытыми бумагой Bioshield, закрепленной резиновой лентой, в течение 48 часов при 28°С или 30°С и при 200 или 300 об/мин на напольном шейкере New Brunswick Scientific. Образцы брали при 24 часах и/или 48 часах. Клетки удаляли центрифугированием, затем супернатант разбавляли равным объемом 60% ацетонитрила и раствор фильтровали через мембрану при помощи 0.45 мкм спин-колонок Centricon. Фильтраты анализировали при помощи ВЭЖХ на концентрации метионина, глицина плюс гомосерин, O-ацетилгомосерина, треонина, изолейцина, лизина и других указанных аминокислот.
Для ВЭЖХ анализа фильтрованные супернатанты разбавляли в соотношении 1:100 фильтрованным через 0.45 мкм 1 мМ Na2EDTA и 1 мкл раствора подвергали воздействию ОРА реагента с целью получения производного (AGILENT) в боратном буфере (80 мМ NaBO3, 2.5 мМ EDTA, рН 10.2) и инжектировали в колонку 200×4.1 мм Hypersil 5µ AA-ODS на Agilent 1100 series HPLC, оборудованном флуоресцентным детектором G 1321 A (AGILENT). Длина волны возбуждения была 338 им, а мониторируемая длина волны испускания была 425 нм. Стандатные растворы аминокислот хроматографировали и использовали для определения времен удерживания и стандартных площадей пиков для различных аминокислот. Chem Station, прилагаемый программный пакет, предоставляемый Agilent, использовали для инструментального контроля, сбора и обработки данных. Аппаратные средства представляли собой компьютер HP Pentium 4, поддерживающий Microsoft Windows NT 4.0, обновленный Microsoft Service Pack (SP6a).
Пример 4: Усиление активности MetA и MetZ в М2014 увеличивает продуцирование метионина ОМ41
Штаммы М2014 и ОМ41 трансформировали репликантной плазмидой рН357, схема которой показана на Фиг.9 (SEQ ID:11), содержащей кассету P497 metZ, Р3119 metA. Полученные штаммы, названные М2014(Н357) и ОМ41 (Н357), сравнивали с родительскими штаммами для определения, является ли дополнительная экспрессия metZ и/или metA выгодной для продуцирования метионина. В обоих штаммах присутствие плазмиды Н357 повысило продуцирование метионина. Как показано в Таблице X, на стандартной мелассовой среде титр метионина ОМ41 (Н357) был приблизительно на 75% выше, чем титр ОМ41, показывая, что дополнительные MetA и/или MetZ активности полезны для повышения титров метионина (1.4 г/л против 0.8 г/л). Более того, добавление 1% дрожжевого экстракта (YE) к среде также повышает титры на дополнительные 30-40%.
Пример 5: Внедрение Р497 homfbr кассеты в рерСК локус штамма М2014 приводит к повышенному продуцированию метионина
В хромосоме М2014 присутствует ген гомосериндегидрогеназы (homfbr), устойчивой к ингибированию по типу обратной связи. Однако этот ген использует свой нативный промотор для экспрессии, который, как сообщается, подавляется метионином. (Rey D.A. et al., J.Molecular Microbiology. 56:871-887 (2005)). Для того чтобы получить штамм М2014, содержащий ген hom, без регуляции посредством McbR, кассета P497homfbr из плазмиды рН410, схема которой показана на Фиг.10 (SEQ ID NO:12), была вставлена в pepCK локус штамма М2014 с помощью процедуры Campbell in и Campbell out и впоследствии верифицирована ПЦР. Полученный штамм назвали ОМ224.
Со штаммами М2014 и ОМ224 проводили стандартные исследовании во встряхиваемой колбе, описанные ранее. Как показано в Таблице XI, ОМ224 проявил повышенные титры глицина плюс гомосерина (Gly+Hse), O-ацетилгомосерина (O-AcHse) и метионина по сравнению с М2014; однако было обнаружено снижение титра лизина по сравнению с М2014. Аминокислоты измеряли в г/л.
Кассета P497 metF была внедрена в ОМ224 штамм в bioAD локусе при помощи плазмиды рОМб2, как описано в Примере 2, таким образом получая штамм ОМ89. Затем ОМ89 модифицировали при помощи внедрения мутантного гена SAM синтазы, metK*(C94A), кодирующего фермент со значительно сниженной активностью по сравнению с ферментом дикого типа (Reczkowski, R.S. and G.D.Markham, J. Biol. Chem., 270:18484-18490 (1995)), в нативный локус MetK. Ожидалось, что более низкая активность MetK должна уменьшить продуцирование S-аденозил метионина. Плазмида рН295 (SEQ ID NO:13), схема которой показана на Фиг.11, была подвергнута процедуре Campbell in и out с ОМ89 для замещения metK дикого типа в ОМ89 геном metK* с получением штамма ОМ99. Аллель metK* является определимым, поскольку он вводит сайт рестрикции PshAI в продукт ПЦР, произошедший от хромосомы штамма ОМ99. Штамм ОМ99 затем трансформировали с реплицирующей плазмидой Н357, содержащей кассеты Р497 metZ и Р3119 metA, с получением штамма ОМ99(Н357).
Со штаммами ОМ89, ОМ99, ОМ99(Н357) и родительскими штаммами проводили стандартные исследовании во встряхиваемой колбе. Как показано в Таблице XII, и ОМ41, и ОМ224 продуцировали приблизительно на 20% больше метионина, чем их родительский штамм, М2014. В этом эксперименте ОМ89 вел себя похожим с М2014 образом. Оказалось, что интегрирование гена metK* в ОМ89 (штамм ОМ99) повышает титры метионина по сравнению с родительским штаммом. Наконец, ОМ99(Н357) дал титр 1.7 г/л метионина, около 70% повышение по сравнению с родительским штаммом ОМ99. Аминокислоты измеряли в г/л.
Штамм ОМ99 (Н357) также хорошо себя проявил в лабораторных ферментациях, продуцируя 8.5 г/л метионина после около 78 часов (см. Пример 11).
Пример 6: Делеция mcbR из М2014 повышает продуцирование метионина
Плазмиду рН429, содержащую делецию RXA00655, (SEQ ID NO:14), схема которой показана на Фиг.12, использовали для введения делеции mcbR в С.glutamicum посредством интеграции и эксцизии. (См. WO 2004/050694 А1). Плазмиду рН429 трансформировали в штамм М2014 с селекцией на резистентность к канамицину (Campbell in). С помощью контрселекции по sacB прозводные, чувствительные к канамицину, выделяли, при этом они предположительно потеряли интегрированную плазмиду вследствии эксцизии (Campbell out). Трансформированный штамм давал прозводные, чувствительные к канамицину, которые составляли маленькие колонии и большие колонии. Колонии обоих размеров скринировали при помощи ПЦР для обнаружения mcbR делеции. Ни одна из больших колоний не содержала делеции, тогда как 60-70% меньших колоний имели ожидаемую mcbR делецию.
Когда исходный изолят высеяли штрихом по одной колонии на BHI чашки, появилась смесь крошечных и маленьких колоний. Когда крошечные колонии пересеяли штрихом на BHI, снова появилась смесь крошечных и маленьких колоний. Когда пересевали маленькие колонии штрихами на BHI, размер колонии обычно оставался небольшим и однородным. Две изолята отдельных маленьких колоний, названных ОМ403-4 и ОМ403-8, отобрали для дальнейших исследований.
Эксперименты во встряхиваемой колбе (Таблица XIII) показали, что ОМ403-8 продуцирует, по меньшей мере, в два раза большее количество метионина, чем родительский штамм М2014. Штамм также продуцировал менее одной пятой количества лизина по сравнению с М2014, предполагая отклонения потока углерода от аспартат полуальдегида к гомосерину. Третьим поразительным отличием явилось повышение более чем в 10 раз накопления изолейцина штаммом ОМ403 по отношению к М2014. Культуры выращивали в течение 48 на стандартной мелассовой среде.
Также наблюдалось более чем 15-кратное снижение накопления O-ацетилгомосерина штаммом ОМ403 по отношению к М2014, как показано в Таблице XIV. Наиболее вероятное объяснение данному результату заключается в том, что большая часть O-ацетилгомосерина, накапливающегося в М2014, превращается в метионин, гомоцистеин и изолейцин в ОМ403. Культуры выращивали в течение 48 часов на стандартной мелассовой среде.
Для улучшения конверсии гомоцистеина в метионин в ОМ403, ОМ403-8 трансформировали с реплицирующими плазмидами, что вызвало повышенную экспрессию metH(pH170) (схема плазмиды рН170 представлена на Фиг.13 и последовательности SEQ ID NO: 15) или metE (pH447) (схема плазмиды рН447 представлена на Фиг.14 и последовательности SEQ ID NO:16) генов в С.glutamicum. Новые штаммы (ОМ418 и ОМ419, соответственно) продуцировали больше метионина в экспериментах во встяхиваемой колбе, чем ОМ403-8 (Таблица XV).
Культуры выращивали в течение 48 часов на стандартной мелассовой среде с канамицином 25 мкг/мл или без него. Эти штаммы тестировали в ферментере, где ОМ419 продуцировал значительно больше метионина, чем ОМ403-8.
Пример 7: Повышение экспрессии metF в ОМ419 повышает продуцирование метионина
Для того чтобы повысить экспессию metF в ОМ403-8, нативный промотор metF замещали промотором PR фага лямбда Е. coli. Это было осуществлено при помощи стандартной процедуры Campbell in и Campbell out с плазмидой рОМ427 (SEQ ID NO:17). Полученный штамм, названный ОМ428-2, трансформировали вектором экспрессии metE H447. Четыре изолята полученного штамма, названного ОМ448, анализировали на продуцирование метионина в анализах во встяхиваемой колбе, наряду с ОМ403-8 и ОМ428-2. Результаты этого эксперимента, приведенные в Таблице XVI, показывают, что ОМ428-2 и все четыре изолята ОМ448 продуцируют значительно больше метионина, чем ОМ403-8, но только один из четырех изолятов ОМ448 продуцирует больше метионина, чем ОМ428-2.
Пример 8: Получение микроорганизма с дерегулированным путем восстановления сульфата
Плазмиду рОМ423 (SEQ ID NO:18) применяли для получения штаммов с дерегулированным путем восстановления сульфата. Схема плазмиды рОМ423 представлена на Фиг.16. В частности, конструкцию дивергентного промотора фага лямбда Е. coli PL и PR использовали для замещения нативных дивергентных промотеров регулона восстановления сульфата. Штамм ОМ41 трансформировали с рОМ423 и отбирали на устойчивость к канамицину (Campbell in). После sacB контрселекции производные, чувствительные к канамицину, выделяли из трансформантов (Campbell out). Впоследствии они анализировались при помощи ПЦР для определения промоторных структур регулона восстановления сульфата. Изоляты, содержащие дивергентные промоторы PL-PR, назвали ОМ429. Четыре изолята ОМ429 анализировали на восстановление сульфата при помощи DTNB теста-полоски, а на продуцирование метионина в опытах встряхиваемой колбы. Для оценки относительного продуцирования сульфида при помощи DTNB теста-полоски полоску фильтровальной бумаги пропитывали раствором реагента Эллмана (DTNB) и вешали над культурой во встряхиваемой колбе штамма, который нужно тестировать. Сероводород, продуцированный растущей культурой, восстанавливает DTNB, давая желтое окрашивание, которое приблизительно пропорционально количеству образованного H2S. Таким образом, интенсивность полученного окрашивания может использоваться для грубой оценки относительной активности различных штаммов по восстановлению сульфата. Результаты (Таблица XVII) показывают, что два из четырех изолятов проявили относительно высокие уровни восстановления сульфата. Эти же два изолята также проявили наиболее высокие уровни метионина. Культуры выращивали в течение 48 часов на стандартной мелассовой среде.
Пример 9: Снижение экспрессии metQ снижало импорт метионина
Для того чтобы снизить импорт метионина в ОМ403-8, удаляли промотор и 5'-участок гена metQ. Ген metQ кодирует субъединицу метионин-импортирующего комплекса, которая требуется для функционирования комплекса. Это было осуществлено при помощи стандартной процедуры Campbell in и Campbell out с плазмидой рН449, схема которой показана на Фиг.15 (SEQ ID NO:19). Полученный штамм, названный ОМ456-2, трансформировали с metE вектором экспрессии Н447 или metF экспрессионной плазмидой рОМ436 (SEQ ID NO:20). Четыре изолята каждого из полученных штаммов, названных ОМ464 и ОМ465, соответственно, анализировали на продуцирование метионина в анализах во встряхиваемой колбе, наряду с ОМ403-8 и ОМ456-2. Результаты (Таблица XVIII) показывают, что ОМ456-2 продуцирует немного больше метионина, чем ОМ403-8, а все четыре изолята ОМ464 и ОМ465 продуцируют больше метионина, чем ОМ403-8. Культуры выращивали в течение 48 часов на стандартной мелассовой среде.
Пример 10: Конструирование ОМ469 и ОМ508
Поскольку и делеция metQ, и дерегулирование metF повышают продуцирование метионина, был сконструирован штамм, названный ОМ469, содержащий обе эти характеристики. Штамм ОМ469 сконструировали из штамма ОМ456-2 замещением metF промотора дикого типа промотором фага лямбда PR. Это было осуществлено при помощи стандартной процедуры Campbell in и Campbell out с плазмидой рОМ427 (SEQ ID NO:17). Четыре изолята ОМ469 анализировали на продуцирование метионина в анализах культур во встряхиваемой колбе, где все они продуцировали больше метионина, чем ОМ456-2, как показано в Таблице XIX.
Для того чтобы сконструировать штамм ОМ508, штамм ОМ469-2 трансформировали реплицирующей плазмидой рН357 (SEQ ID NO: 11). Четыре изолята ОМ508 анализировали на продуцирование метионина в анализах культур во встряхиваемой колбе. Три из четырех изолятов продуцировали меньше метионина, чем ОМ469, а один изолят продуцировал примерно такое же количество метионина, что и ОМ469-2, как показано в Таблице XX. Все четыре изолята потребляли меньше глюкозы, чем ОМ469-2, предполагая более высокий выход метионина на моль глюкозы.
Пример 11: Ферментация в 7.5-литровых сосудах NBS BioFlo 110
Периодические ферментации с подпиткой проводили в 7-литровых сосудах New Brunswick Scientific (NBS) BioFlo с 5-литровыми рабочими объемами. Стерильная сырьевая среда для цикла M111 включала: мелассу 150 г/л; глюкозу 10 г/л; дрожжевой экстракт Difco 10 г/л; (NH4)2SO4 30 г/л; MgSO4·7H2O 1 г/л; KH2PO4·3H2O 5 г/л; Mazu DF204C 1.5 г/л (пеногаситель); 25 мМ треонина; 25 мг/л канамицина; IX Met Минералы; IX Met Витамины и dH2O до 2.0 литров. К этой среде добавляли 150 мл инокулята ОМ99(Н357), который выращивали 18 часов при 28°С в BHI-10 (среда с сердечно-мозговым экстрактом (Becton Dickinson) с добавкой 10 г/л глюкозы). Раствор IX Met Минералы имел конечную концентрацию 10 мг/л FeSO4·7H2O, 10 мг/л MnSO4·H2O, 1 мг/л Н3ВО3·4H2O, 2 мг/л ZnSO4·7H2O, 0.25 мг/л CuSO4 и 0.02 мг/л Na2MoO4·2H2O. Раствор IX Met Витамины имеет конечную концентрацию 6 мг/л никотиновой кислоты, 9.2 мг/л тиамина, 0.8 мг/л биотина, 0.4 мг/л пиридоксаля и 0.4 мг/л цианокобаламина (витамин В12) из 250-кратного фильтрованного стерильного исходного раствора, который содержит 12.5 мМ фосфата калия, рН 7.0, для растворения биотина.
В ферментер подавали 400 мл 12.5 мМ треонина и 12.5 мМ изолейцина при постоянной скорости в течение 32-часового периода. Отдельная подача глюкозы содержала глюкозу 750 г/л, MgSO4·7H2O 2 г/л, (NH4)2SO4 20 г/л и 10Х Met Витамины в dH2O. К ферментации ОМ99 (H357) подавали глюкозу, а аминокислоты подавали отдельно, но обе подачи начинали, когда начальный уровень глюкозы падал до 10 г/л.
Первоначально введенный углеводород в мелассе и глюкоза потреблялись в течение первых 16-24 часов после инокуляции. После потребления начальной глюкозы клетками концентрации глюкозы поддерживали между 10 и 15 г/л подачей вышеописанного раствора глюкозы, содержащего витамины, сульфат магния и сульфат аммония.
Первоначально встряхивание устанавливали на 200-300 об/мин. Когда концентрация растворенного кислорода падает до 25%, компьютерное управление автоматически доводит скорость встряхивания для поддержания концентрации растворенного кислорода 20±5% [pO2]. Максимальная скорость встряхивания, достижимая оборудованием, составляла 1200 об/мин. Если скорости 1200 об/мин было недостаточно для поддержания концентрации растворенного кислорода 20±5% [pO2], то в воздуховод подавали чистый кислород. Ферментации поддерживали при рН 7.0±0.1 и 28°±0.5°С. Компьютерный контроль и сбор данных осуществлялись при помощи программного обеспечения New Brunswick Scientific Biocommand.
Ферментация M111 давала 8.5 г/л метионина за 72 часа и 11.5 г/л метионина за 96 часов. При 96 часах лизина было 16.5 г/л, а O-ацетилгомосерина было 8.5 г/л. Следовательно, существует запас предшественников, которые при конверсии в метионин могут повысить продуцирование метионина на дополнительные 20 г/л.
Пример 12: Периодическая ферментация с подпиткой М448-1, Ферментация М190
ОМ448-1 ферментировали, как описано в Примере 11, но начинали со следующей начальной сырьевой среды для цикла М190: меласса 150 г/л, глюкоза 10 г/л, дрожжевой экстракт Difco 20 г/л, (NH4)2SO4 30 г/л, MgSO4·7H2O 1 г/л, KH2PO4·3H2O 12 г/л, HySoyT 20 г/л, Mazu DF204C 1.5 г/л, 25 мМ треонина, 25 мг/л канамицина, 1X Met Минералы, 10Х Met Витамины и dH2O до 1.5 литров. К этой среде добавляли 500 мл ОМ448-2 инокулята, который выращивали 24 часа при 30°С в BHI-10 (среда с сердечно-мозговым экстрактом (Becton Dickinson) с добавкой 10 г/л глюкозы и 10 г/л HySoy) для получения начального объема 2 литра.
К ферментации подавали 400 мл 30 мМ треонина со скоростью 12.5 мл/ч. Отдельная подача глюкозы содержала глюкозу 750 г/л, MgSO4·7H2O 2 г/л, (NH4)2SO4 30 г/л, 1X Met Минералы и 25Х Met Витамины.
Ферментация ОМ448-2 в вышеописанной среде давала 16.6 г/л метионина за 72 часа и 17.1 г/л метионина за 76 часов.
Пример 13: Периодическая ферментация с подпиткой ОМ508-4, Цикл Ферментации М322
ОМ508-4 ферментировали, как описано в Примере, но начинали со следующей начальной сырьевой среды для цикла М322: меласса 150 г/л, дрожжевой экстракт Difco 20 г/л, (NH4)2SO4 30 г/л, MgSO4·7H2O 1 г/л, KH2PO4·3H2O 20 г/л, HySoyT 20 г/л, Mazu DF204C 1.5 г/л, треонин 6 г/л, серин 10 г/л, 25 мг/л канамицина, 1X Met Минералы, сырьевые Витамины, и dH2O до 1.5 литров. К первоначальной сырьевой среде добавляли витамины, давая конечную концентрацию 15 мг/л никотиновой кислоты, 23 мг/л тиамина, 2 мг/л биотина, 1 мг/л пиридоксаля и 1 мг/л цианокобаламина. К 1.5 л этой среды добавляли 500 мл ОМ508-4 инокулята, который выращивали 24 часов при 30°С в BHySoy-15 (среда с сердечно-мозговым экстрактом (Becton Dickinson) с добавкой 15 г/л глюкозы и 10 г/л HySoy) для получения начального объема 2 литра.
Подача содержала глюкозу 750 г/л, MgSO4·7H2O 2 г/л, (NH4)2SO4 40 г/л, серии 10 г/л, треонин 3.6 г/л, 1X Met Минералы и Витамины.
Витамины добавляли к подаче глюкозы, давая конечную концентрацию 75 мг/л никотиновой кислоты, 115 мг/л тиамина, 10 мг/л биотина, 5 мг/л пиридоксаля и 5 мг/л цианокобаламина в растворе для подачи. Ферментация ОМ508-4 в вышеописанной среде давала 25.8 г/л метионина за 56 часов.
Описание изобретения наиболее полно воспринимается в свете содержания ссылок, приведенных в описании изобретения, которые включены сюда путем ссылки. Варианты осуществления изобретения в описании изобретения дают иллюстрацию вариантов осуществления, включенных в настоящее изобретение, и не должны быть истолкованы как ограничение его объема. Специалист в данной области хорошо понимает, что многие другие варианты осуществления включены в это изобретение. Все цитируемые публикации и патенты, а также последовательности, идентифицируемые по их инвентарным номерам или номерам баз данных, описанные здесь, включены сюда путем ссылки во всей своей полноте. Если материал, включенный ссылкой, в какой-либо мере противоречит или не соответствует настоящему описанию изобретения, то настоящее описание изобретения заменяет любой такой материал. Цитирование здесь любых ссылок не является признанием того, что эти ссылки являются предшествующим уровнем техники настоящего изобретения.
Если не указано обратное, все числа, выражающие количества ингредиентов, клеточную культуру, условия обработки и т.д., используемые в описании изобретения, включая формулу изобретения, следует воспринимать во всех примерах с термином «около». Таким образом, если не указано обратное, числовые параметры являются приближенными и могут варьировать в зависимости от желаемых свойств, которые необходимо получить в настоящем изобретении. Если не указано обратное, то следует понимать, что если термин «по меньшей мере» предшествует ряду элементов, то он относится к каждому элементу ряда. Специалисты в данной области могут идентифицировать или способны обнаружить, используя не более чем обычное экспериментирование, множество эквивалентов отдельных вариантов осуществления изобретения, описанным здесь. Предполагается, что такие эквиваленты включены в следующую формулу изобретения.



































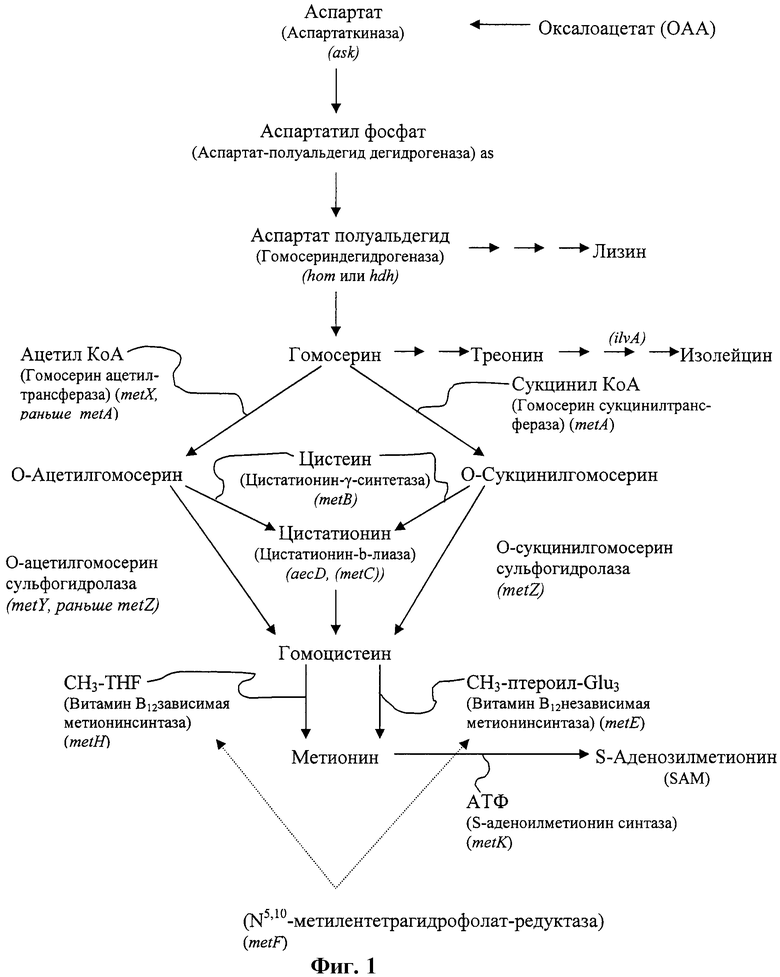
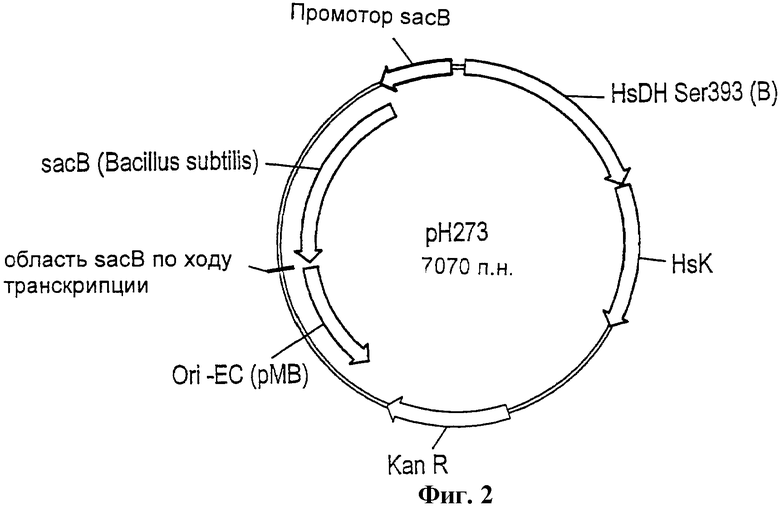
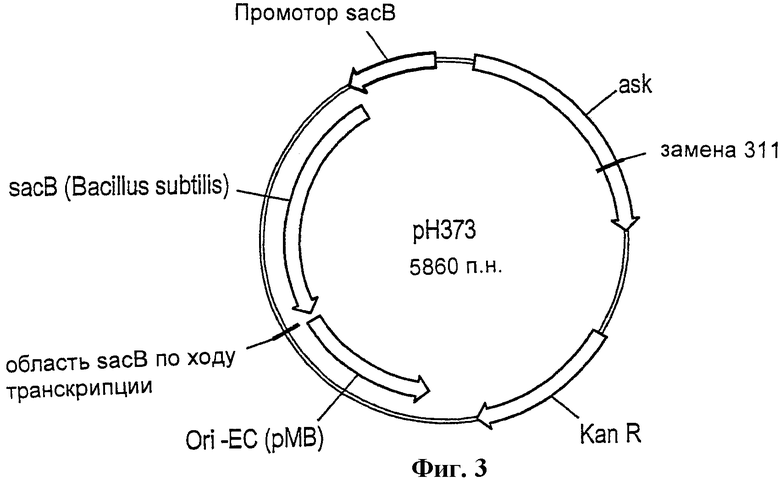
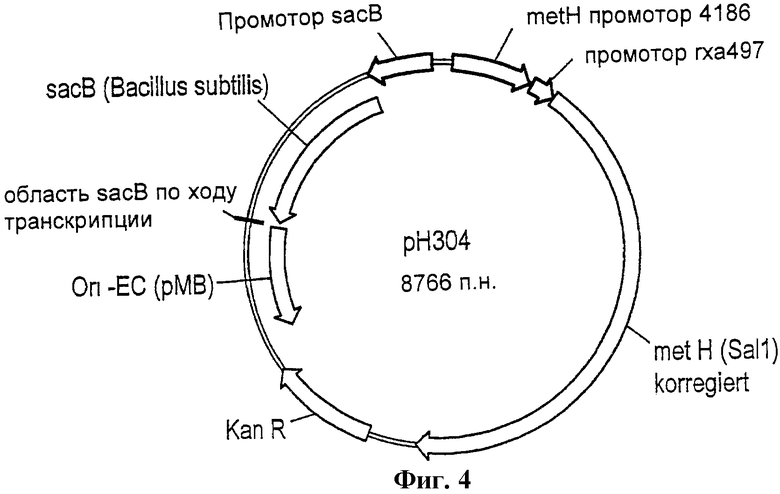
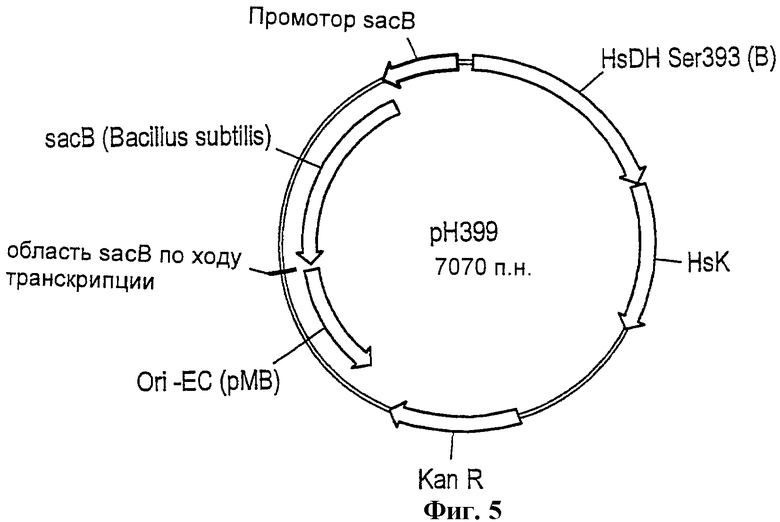
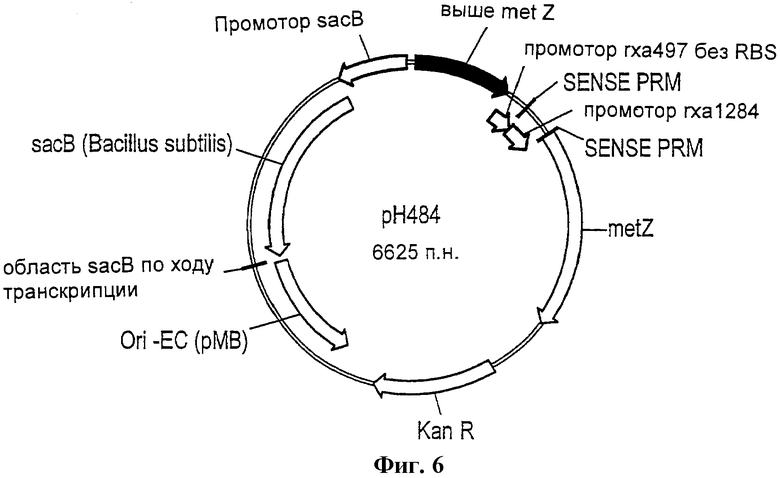
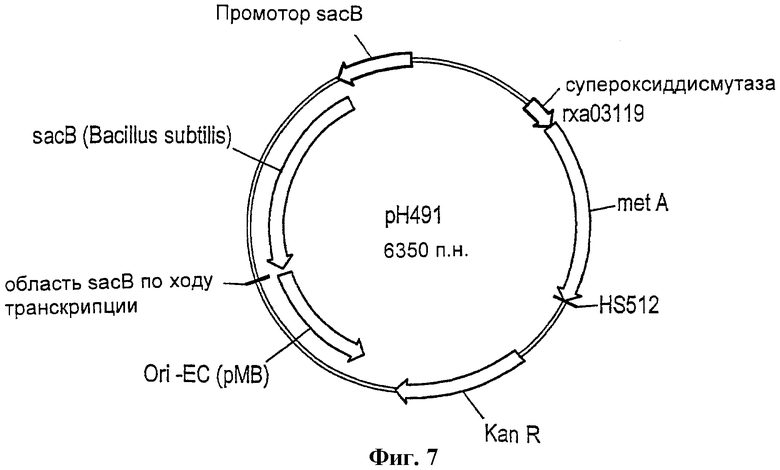
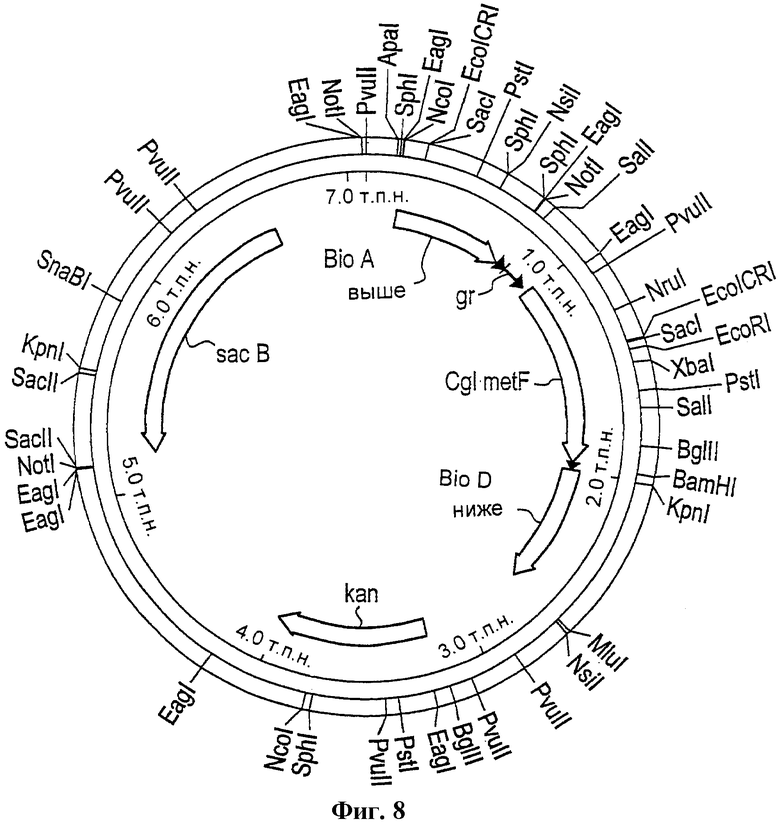
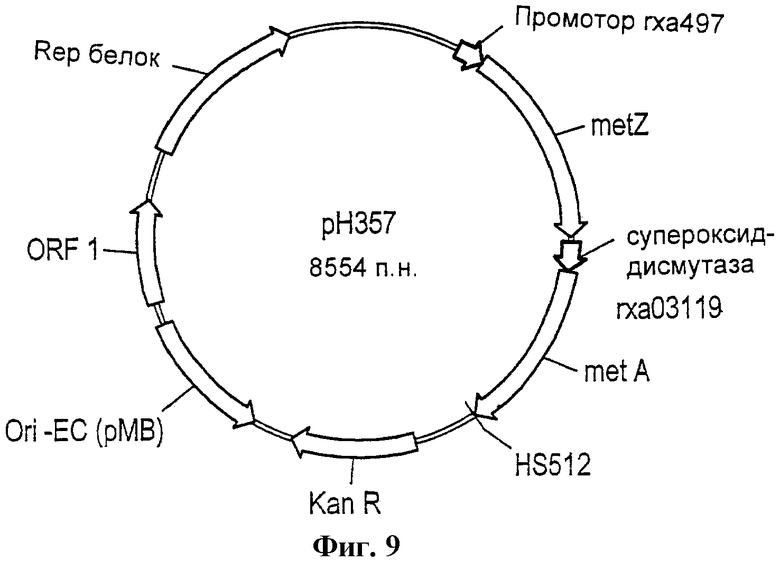
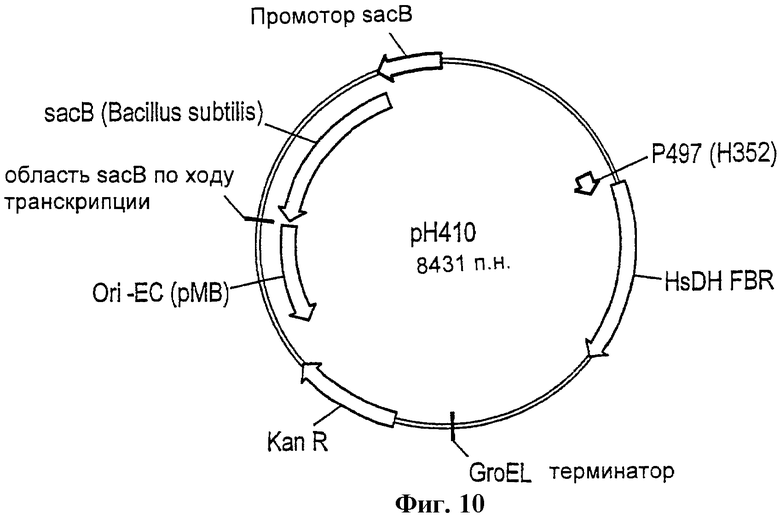
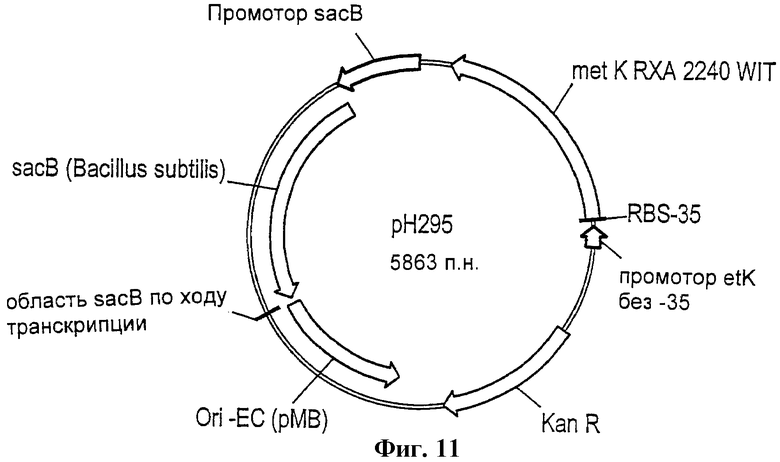
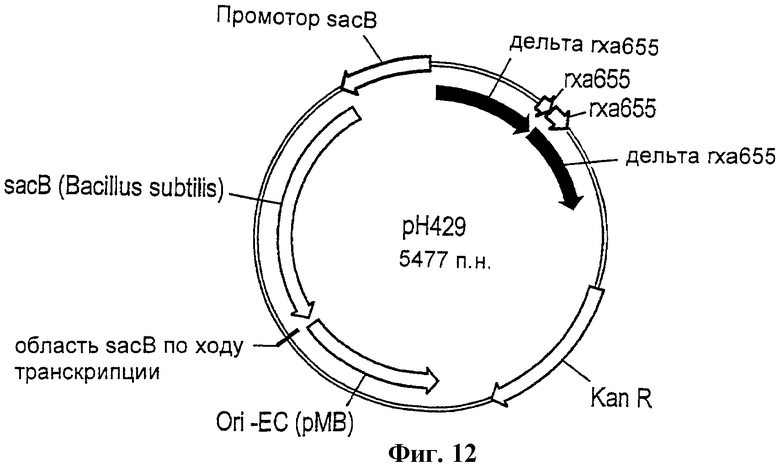
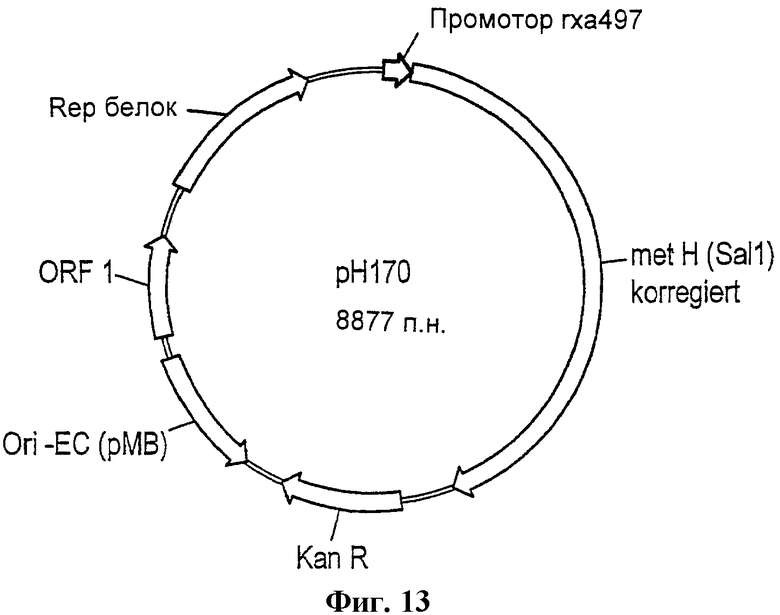
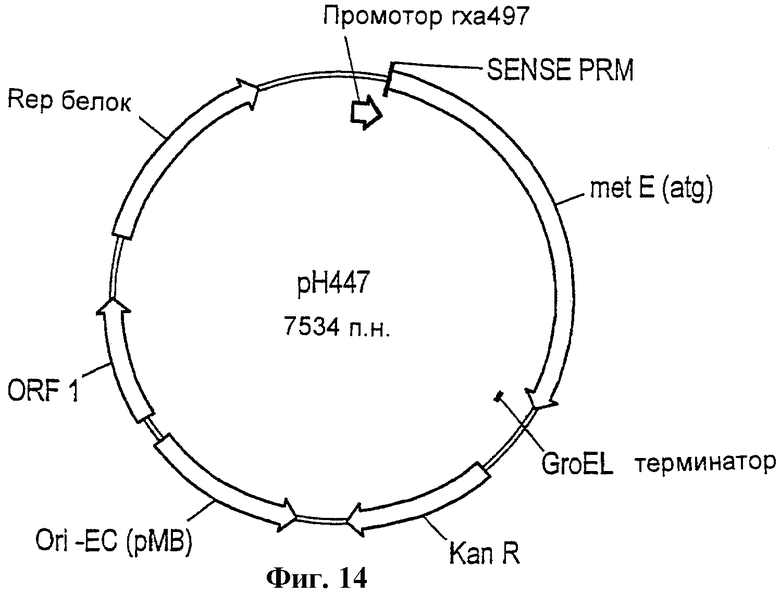
Настоящее изобретение относится к области биохимии и представляет собой способ получения метионина. Предложенный способ получения метионина включает: а) культивирование рекомбинантного микроорганизма С.Glutamicum, депонированного в Немецкой коллекции микроорганизмов и клеточных структур DSMZ под номером №DSM 17322, в соответствующих условиях, и б) выделение метионина. Изобретение позволяет получить метионин в количестве, по меньшей мере, 8 г/л. 1 з.п. ф-лы, 16 ил., 19 табл., 13 пр.
1. Способ получения метионина, включающий
а) культивирование рекомбинантного микроорганизма С.Glutamicum, депонированного в Немецкой коллекции микроорганизмов и клеточных культур DSMZ под номером №DSM 17322, и
б) выделение метионина.
2. Способ по п.1, включающий культивирование рекомбинантного микроорганизма, указанного в п.1, в условиях, при которых метионин продуцируется в количестве, по меньшей мере, 8 г/л.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ МЕТОДОМ ФЕРМЕНТАЦИИ, ШТАММ БАКТЕРИИ ESCHERICHIA COLI - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 1999 |
|
RU2207376C2 |
| H.-S | |||
| LEE, B.-J | |||
| HWANG "Methionine biosynthesis and its regulation in Corynebacterium glutamicum: parallel pathways of transsulfuration and direct sulfhydrylation", Microbiol Biotechnol, 04.07.2003, 62:459-467 | |||
| DHARMENDRA KUMARA, JAMES GOMES "Methionine production by fermentation", Biotechnology Advances, Volume 23, 1, January 2005, Pages 41-61. | |||
Авторы
Даты
2012-04-10—Публикация
2006-07-18—Подача