ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым солям 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, которая в тексте настоящей заявки может быть названа соединением A. Более конкретно, изобретение относится к гидрохлоридной (HCl-соль), гидробромидной (HBr-соль), п-толуолсульфонатной соли (pTSA-соль) и этандисульфонатной соли (EDSA-соль). Изобретение также относится к способам получения солей, композициям, содержащим соли, и применению этих солей.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновая кислота описана в ПЛ 1 как агонист рецептора 5-HT4, полезный для лечения или облегчения болезненных состояний, опосредованных активностью рецептора 5-HT4; в частности, активностью агониста рецептора 5-HT4, таких как гастроэзофагеальная рефлюксная болезнь (ГЭРБ), желудочно-кишечное заболевание, нарушение моторики желудка, неязвенная диспепсия, функциональная диспепсия (ФД), синдром раздраженного кишечника (СРК), запор, диспепсия, эзофагит, гастроэзофагеальная болезнь, гастрит, тошнота, заболевание центральной нервной системы, болезнь Альцгеймера, когнитивное нарушение, рвота, мигрень, неврологическое заболевание, боль, сердечно-сосудистые заболевания, сердечная недостаточность, аритмия сердца, диабет и синдром апноэ (смотри НПЛ 1-13 и ПЛ 2-7).
Ранее известными способами получения 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанными в ПЛ 1, было получено просто белое твердое вещество. Общее описание фармацевтически приемлемых солей 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты по настоящей заявке приведено, и свободное основание соединения по настоящему изобретению описано и заявлено в ПЛ 1, имеющей дату подачи международной заявки 6 декабря 2006 г. и переданной правопреемнику настоящего документа. Таким образом, какие-либо соли соединения ранее не были ни конкретно описаны, ни синтезированы.
Установлено, что HCl-соль, HBr-соль, pTSA-соль и EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, приведенные ниже, можно выделять в кристаллической форме, которая обладает такими полезными свойствами, как легкость формулирования препарата, высокая растворимость и хорошая стабильность. Кроме того, соли по настоящему изобретению гораздо легче поддаются очищению, чем некристаллическая форма, описанная в ПЛ 1 (WO 2006/090224), и кристаллическая форма, описанная в ПЛ 3 (WO 2012/157288).
СПИСОК ЛИТЕРАТУРЫ
Патентная литература
{ПЛ 1} WO 2006/090224.
{ПЛ 2} Патент США № 6106864.
{ПЛ 3} WO 2012/157288.
{ПЛ 4} WO 00/35298.
{ПЛ 5} WO 91/11172.
{ПЛ 6} WO 94/02518.
{PL 7} WO 98/55148.
Непатентная литература
{НПЛ 1} Bockaert J. et al., TiPs 13; 141-145, 1992.
{НПЛ 2} Ford A. P. et al., Med. Res. Rev. 13: 633-662, 1993.
{НПЛ 3} Gullikson G. W. et al., Drug Dev. Res. 26; 405-417, 1992.
{НПЛ 4} Richard M. Eglen et al., TiPs 16; 391-398, 1995.
{НПЛ 5} Bockaert J. et al., CNS Drugs 1; 6-15, 1994.
{НПЛ 6} Romanelli M. N. et al., Arzheim Forsch./Drug Res., 43; 913-918, 1993.
{НПЛ 7} Kaumann A. J. et al., Naunyn-Schmiedebergs Arch Pharmacol., 344; 150-159, 1991.
{НПЛ 8} Remington's Pharmaceutical Sciences, 19е издание (Mack Publishing Company, 1995).
{НПЛ 9} Expert Opinion in Therapeutic Patents, H (6), 981-986, авторы Liang и Chen (2001).
{НПЛ 10} Tablets, Vol. 1, авторы H. Lieberman и L. Lachman (Marcel Dekker, New York, 1980).
{НПЛ 11} Pharmaceutical Technology On-line, 25(2), 1-14, авторы Verma et al. (2001).
{НПЛ 12} J Pharm Sci, 88 (10), 955-958, авторы Finnin и Morgan (октябрь 1999).
{НПЛ 13} Evrard, B., et al., Journal of Controlled Release 96 (3), pp. 403-410, 2004.
{NPL 14} Byrn S. R. et al., Solid-State Chemistry of Drugs 2е издание, pp. 3-43 и 461-503, 1999, SSCI, Inc.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая проблема
Как хорошо известно специалистам в данной области, с разных точек зрения, включая формулирование и производство лекарственного средства, желаемой целью при разработке лекарственного средства является обнаружение или получение солевой формы. Это является наиболее часто используемым подходом для повышения растворимости слабо кислых или щелочных НХС (новых химических соединений). (Смотри, например, Wadke, D. A. et al, Pharmaceutical Dosage Forms: Tablets, Vol. 1, 1989, pp. 1-73). Преимущества соли, как правило, объясняются наличием противоиона, и выбор противоиона основан на многих параметрах, таких как растворимость, гигроскопичность и стабильность физической формы. Несмотря на многочисленные преимущества, связанные с солевыми формами, создание стабильной соли не всегда осуществимо. Во многих случаях повышения скорости растворения бывает трудно достичь из-за обратного превращения солей в соответствующие формы кислоты или основания.
По официальной версии, большие усилия были предприняты для обнаружения или получения солевой формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты с тех пор, как указанное соединение было раскрыто в 2006 г. (WO 2006/090224), однако до настоящего времени не было идентифицировано никаких фармацевтически приемлемых солевых форм указанного соединения.
Как описано в рабочем примере по настоящему изобретению, белое твердое вещество указанного соединения растворяют в н-BuOH при температуре 70°C и добавляют концентрированную HCl (37 масс%, 35,5 мкл, 0,425 ммоль). Смесь перемешивают при температуре 70°C в течение ночи, затем постепенно охлаждают до комнатной температуры. Полученный осадок собирают фильтрованием, промывают EtOH и высушивают в вакууме, с получением HCl-соли.
Как описано в рабочем примере по настоящему изобретению, белое твердое вещество указанного соединения растворяют в н-BuOH при температуре 65°C и добавляют раствор HBr в EtOH. Смесь перемешивают при температуре 65°C в течение ночи, затем постепенно охлаждают до комнатной температуры. Полученный осадок собирают фильтрованием, промывают EtOH и высушивают в вакууме, с получением HBr-соли.
Как описано в рабочем примере по настоящему изобретению, белое твердое вещество указанного соединения растворяют в н-BuOH при температуре 65°C и добавляют раствор моногидрата п-толуолсульфоновой кислоты в CH3CN. Смесь перемешивают при температуре 65°C в течение 3 минут, затем постепенно охлаждают до комнатной температуры. Полученный осадок собирают фильтрованием, промывают AcOEt и высушивают в вакууме, с получением pTSA-соли.
Как описано в рабочем примере по настоящему изобретению, белое твердое вещество указанного соединения растворяют в н-BuOH при температуре 65°C и добавляют раствор дигидрата этандисульфоновой кислоты в EtOH. Смесь перемешивают при температуре 65°C в течение 3 минут, затем постепенно охлаждают до комнатной температуры. Полученный осадок собирают фильтрованием, промывают AcOEt и высушивают в вакууме, с получением EDSA-соли.
Различные соли, включая соль фосфорной кислоты, соль серной кислоты, соль метансульфоновой кислоты, соль этансульфоновой кислоты, соль бензолсульфоновой кислоты, соль (+)-(1S)-камфор-10-сульфоновой кислоты, соль нафталин-2-сульфоновой кислоты, соль нафталин-1,5-дисульфоновой кислоты, соль малеиновой кислоты, натриевую соль, калиевую соль, кальциевую соль, магниевую соль, цинковую соль, бетаиновую соль, холиновую соль, диэтиламиновую соль, пиперазиновую соль и бензатиновую соль, в отличие от HCl-соли, HBr-соли, pTSA-соли и EDSA-соли, получают следующим образом, а именно: белое твердое вещество указанного соединения растворяют в соответствующем растворителе, который включает EtOH, н-BuOH, AcOEt, MEK, CH3CN или THF, при температуре 55°C - 70°C и добавляют раствор источника противоиона в соответствующем растворителе, который включает MeOH, EtOH, i-PrOH, диоксан и/или воду. Смесь перемешивают при температуре от комнатной до температуры кипения растворителя, предпочтительно при температуре 55°C - 70°C, в течение периода времени от 3 минут до всей ночи, затем постепенно охлаждают до комнатной температуры. Полученный осадок собирают фильтрованием, промывают соответствующим растворителем, который включает EtOH, н-BuOH, AcOEt, MEK, CH3CN или THF, и высушивают в вакууме, с получением соответствующей соли.
Однако в результате некоторых экспериментов получают масла, например, в случае бензолсульфоновой кислоты как в EtOH, так и в CH3CN, pTSA в EtOH и ацетата цинка в EtOH.
В результате некоторых экспериментов получают только соединение в свободной форме, например, в случае (+)-(1S)-камфор-10-сульфоновой кислоты как в EtOH, так и в AcOEt, нафталин-2-сульфоновой кислоты как в EtOH, так и в AcOEt, ацетата натрия в CH3CN, бетаина в MEK и диэтиламина как в н-BuOH, так и в CH3CN.
В результате некоторых экспериментов получают твердые вещества, например, в случае серной кислоты как в н-BuOH, так и в MEK, соли фосфорной кислоты как в н-BuOH, так и в CH3CN, гидроксида натрия как в EtOH, так и в CH3CN, и ацетата калия в н-BuOH и в MEK.
Однако они не имеют практического применения в качестве фармацевтически приемлемой соли. Кроме того, после получения затравочных кристаллов соли, в соответствующих случаях, ту же соль, как правило, можно с легкостью получать в мелкомасштабном синтезе. В крупномасштабном синтезе для получения фармацевтически приемлемой соли важное значение имеет контроль температуры.
Настоящее изобретение относится к получению фармацевтически приемлемой соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, которую можно легко, экономично и воспроизводимо получать для использования в фармацевтическом препарате, которая имеет устойчивые превосходные технические характеристики, например, стабильность и негигроскопичность. Данное изобретению также относится к способам получения композиций, содержащих такую соль, и к вариантам применения такой соли.
Решение проблемы
Таким образом, по изобретению предложены:
[1] HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 5,9, 9,4, 11,1, 11,9, 13,2, 18,2, 18,6, 22,1, 25,2 и 26,5 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°);
[2] HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4392, 3393, 2953, 2517, 1942, 1705, 1618, 1541, 1508, 1439, 1377, 1288, 1261, 1223, 1155, 1111, 1059, 1040, 1011, 966, 941, 878, 856, 787, 754, 733, 654, 625, 590, 573, 557, 529, 503, и 478 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1;
[3] HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в пункте [1] или [2], дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 232°C, при этом температура имеет предел погрешности +/- 1°C;
[4] HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 9,4, 13,3, 18,4, 18,7, 22,2, 23,2, 23,8, 24,8, 25,2, 25,9 и 26,6 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°);
[5] HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4405, 3397, 2941, 2693, 2122, 1942, 1717, 1618, 1545, 1508, 1441, 1410, 1377, 1352, 1287, 1261, 1225, 1157, 1111, 1059, 1040, 1011, 968, 941, 874, 856, 787, 754, 735, 652, 621, 590, 571, 557, 525, 503 и 478 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1;
[6] HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в пункте [4] или [5], дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 256°C, при этом температура имеет предел погрешности +/- 1°C;
[7] pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 5,3, 11,9, 14,6, 16,0, 18,5, 18,7, 20,1, 20,6, 21,1, 22,7 и 23,0 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°);
[8] pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4438, 4369, 3397, 3017, 2868, 2768, 1902, 1701, 1616, 1541, 1508, 1466, 1436, 1422, 1371, 1290, 1267, 1206, 1180, 1150, 1117, 1038, 1013, 972, 918, 881, 860, 847, 812, 783, 738, 708, 677, 650, 611, 565 и 492 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1;
[9] pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в пункте [7] или [8], дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 207°C, при этом температура имеет предел погрешности +/- 1°C;
[10] EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 11,3, 13,8, 15,1, 15,9, 18,8, 19,5, 20,2, 20,4, 20,7, 24,0, 24,7 и 26,2 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°);
[11] EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4388, 3948, 3422, 2741, 1937, 1717, 1616, 1539, 1506, 1435, 1373, 1285, 1244, 1204, 1169, 1146, 1107, 1030, 989, 972, 951, 901, 854, 789, 772, 756, 741, 729, 652, 615, 546, 532 и 490 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1;
[12] EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в пункте [10] или [11], дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 246°C, при этом температура имеет предел погрешности +/- 1°C;
[13] Фармацевтическая композиция, содержащая солевую форму 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанную в любом из пунктов [1]-[12], в сочетании с одним или более фармацевтически приемлемыми эксципиентами;
[14] Соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в любом из пунктов [1]-[12], для применения в качестве лекарственного средства;
[15] Применение солевой формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пунктов [1]-[12], или фармацевтической композиции, описанной в пункте [13], в изготовлении лекарственного средства для радикального, паллиативного или профилактического лечения болезненных состояний, опосредованных активностью рецептора 5-HT4;
[16] Способ лечения болезненных состояний, опосредованных активностью рецептора 5-HT4, включающий введение эффективного количества солевой формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пунктов[1] - [12], или фармацевтической композиции, описанной в пункте [13], животному, включая человека, нуждающемуся в таком лечении;
[17] Способ получения HCl-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пунктов [1] - [3], включающий стадию воздействия на соединение HCl;
[18] Способ получения HBr-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пунктов [4] - [6], включающий стадию воздействия на соединение HBr;
[19] Способ получения pTSA-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пунктов [7] - [9], включающий стадию воздействия на соединение п-толуолсульфоновой кислотой;
[20] Способ получения EDSA-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пунктов [10] - [12], включающий стадию воздействия на соединение этандисульфоновой кислотой.
Полезные эффекты изобретения
Как упомянуто выше, целью настоящего изобретения является обнаружение или получение солевой формы, полезной при разработке лекарственного средства с разных точек зрения, включая формулирование и производство лекарственного средства. Неожиданно было обнаружено, что данная цель достигается с помощью настоящего изобретения, которое позволяет получать солевые формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, известные как HCl-соль, HBr-соль, pTSA-соль и EDSA-соль. 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновая кислота в тексте данной спецификации для краткости может называться «указанным соединением».
Никакие фармацевтически приемлемые солевые формы указанного соединения, кроме вышеперечисленных солей, не были идентифицированы, несмотря на большие усилия специалистов в данной области.
Свободная форма 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты описана в WO 2006/090224 как белый порошок и, кроме того, также описана в WO 2012/157288 как полиморфная форма I и полиморфная форма II.
Все соли по настоящему изобретению имеют большое и неожиданное преимущество по сравнению со свободными формами, описанными в документах предшествующего уровня техники, WO 2006/090224 и WO 2012/157288. Установлено, что HCl-соль, HBr-соль, pTSA-соль и EDSA-соль более стабильны, чем общеизвестные свободные формы.
Кроме того, что касается гигроскопичности, соли по настоящему изобретению имеют большое и неожиданное преимущество по сравнению со свободными формами соединения, описанными в документах предшествующего уровня техники.
Как упомянуто выше, HCl-соль, HBr-соль, pTSA-соль и EDSA-соль обладают хорошей стабильностью в твердом состоянии в отношении поглощения воды за 5-дневный срок, по сравнению со свободными формами соединения, описанными в документах предшествующего уровня техники, и в частности, HBr-соль и pTSA-соль являются предпочтительными с точки зрения стабильности в твердом состоянии.
Как упомянуто выше, HCl-соль, HBr-соль, pTSA-соль и EDSA-соль обладают хорошей стабильностью в твердом состоянии в условиях 40°C/75% RH по сравнению со свободными формами соединения, описанными в документах предшествующего уровня техники, и в частности, HBr-соль, pTSA-соль и EDSA-соль являются предпочтительными с точки зрения стабильности в твердом состоянии.
Установлено, что HCl-соль, HBr-соль, pTSA-соль и EDSA-соль по настоящему изобретению подходят для крупномасштабного синтеза. В твердом состоянии они обладают приемлемыми свойствами для разработки твердых лекарственных форм.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1
На фигуре 1 приведена картина РПД полиморфной формы I, полученной способом получения 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]-метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанным в примере 2 в WO 2012/157288.
Фиг. 2
На фигуре 2 приведена картина РПД HCl-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты.
Фиг. 3
На фигуре 3 приведена картина РПД HBr-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты.
Фиг. 4
На фигуре 4 приведена картина РПД pTSA-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты.
Фиг. 5
На фигуре 5 приведена картина РПД EDSA-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты.
Фиг. 6
На фигуре 6 приведены ИК-спектры (диффузное отражение) полиморфной формы I 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты.
Фиг. 7
На фигуре 7 приведены ИК-спектры (диффузное отражение) HCl-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты.
Фиг. 8
На фигуре 8 приведены ИК-спектры (диффузное отражение) HBr-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты.
Фиг. 9
На фигуре 9 приведены ИК-спектры (диффузное отражение) pTSA-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты.
Фиг. 10
На фигуре 10 приведены ИК-спектры (диффузное отражение) EDSA-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты.
Описание вариантов осуществления
Соответственно, по настоящему изобретению предложена HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 5,9, 9,4, 11,1, 11,9, 13,2, 18,2, 18,6, 22,1, 25,2 и 26,5 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°);
HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4392, 3393, 2953, 2517, 1942, 1705, 1618, 1541, 1508, 1439, 1377, 1288, 1261, 1223, 1155, 1111, 1059, 1040, 1011, 966, 941, 878, 856, 787, 754, 733, 654, 625, 590, 573, 557, 529, 503 и 478 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1;
HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в пункте [1] или [2], дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 232°C, при этом температура имеет предел погрешности +/- 1°C;
HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 9,4, 13,3, 18,4, 18,7, 22,2, 23,2, 23,8, 24,8, 25,2, 25,9 и 26,6 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°);
HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4405, 3397, 2941, 2693, 2122, 1942, 1717, 1618, 1545, 1508, 1441, 1410, 1377, 1352, 1287, 1261, 1225, 1157, 1111, 1059, 1040, 1011, 968, 941, 874, 856, 787, 754, 735, 652, 621, 590, 571, 557, 525, 503 и 478 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1;
HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная выше, дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 256°C, при этом температура имеет предел погрешности +/- 1°C;
pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 5,3, 11,9, 14,6, 16,0, 18,5, 18,7, 20,1, 20,6, 21,1, 22,7 и 23,0 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°);
pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4438, 4369, 3397, 3017, 2868, 2768, 1902, 1701, 1616, 1541, 1508, 1466, 1436, 1422, 1371, 1290, 1267, 1206, 1180, 1150, 1117, 1038, 1013, 972, 918, 881, 860, 847, 812, 783, 738, 708, 677, 650, 611, 565 и 492 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1;
pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная выше, дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 207°C, при этом температура имеет предел погрешности +/- 1°C;
EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 11,3, 13,8, 15,1, 15,9, 18,8, 19,5, 20,2, 20,4, 20,7, 24,0, 24,7 и 26,2 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°);
EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4388, 3948, 3422, 2741, 1937, 1717, 1616, 1539, 1506, 1435, 1373, 1285, 1244, 1204, 1169, 1146, 1107, 1030, 989, 972, 951, 901, 854, 789, 772, 756, 741, 729, 652, 615, 546, 532 и 490 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1;
EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная выше, дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 246°C, при этом температура имеет предел погрешности +/- 1°C.
В одном варианте осуществления настоящего изобретения предложена фармацевтическая композиция, содержащая солевую форму 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты по настоящему изобретению в совокупности с одним или более фармацевтически приемлемыми эксципиентами;
В качестве следующего аспекта изобретения предложена солевая форма 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты по настоящему изобретению для применения в качестве лекарственного средства.
В качестве следующего аспекта изобретения предложено применение солевой формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты по настоящему изобретению в производстве лекарственного средства для лечения любого заболевания, которое опосредовано активностью рецептора 5-HT4, в частности, для радикального, профилактического или паллиативного лечения гастроэзофагеальной рефлюксной болезни (ГЭРБ), желудочно-кишечного заболевания, нарушения моторики желудка, неязвенной диспепсии, функциональной диспепсии (ФД), синдрома раздраженного кишечника (СРК), запора, диспепсии, эзофагита, гастроэзофагеальной болезни, гастрита, тошноты, заболевания центральной нервной системы, болезни Альцгеймера, когнитивного нарушения, рвоты, мигрени, неврологического заболевания, боли, сердечно-сосудистых заболеваний, сердечной недостаточности, аритмии сердца, диабета и синдрома апноэ.
В качестве альтернативного аспекта предложен способ лечения любого заболевания, которое опосредовано активностью рецептора 5-HT4, в частности, радикального, профилактического или паллиативного лечения гастроэзофагеальной рефлюксной болезни (ГЭРБ), желудочно-кишечного заболевания, нарушения моторики желудка, неязвенной диспепсии, функциональной диспепсии (ФД), синдрома раздраженного кишечника (СРК), запора, диспепсии, эзофагита, гастроэзофагеальной болезни, гастрита, тошноты, заболевания центральной нервной системы, болезни Альцгеймера, когнитивного нарушения, рвоты, мигрени, неврологического заболевания, боли, сердечно-сосудистых заболеваний, сердечной недостаточности, аритмии сердца, диабета и синдрома апноэ, включающий введение терапевтически эффективного количества солевой формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты по настоящему изобретению животному, включая человека, нуждающемуся в таком лечении.
Солевая форма 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]-метил}тетрагидро-2H-пиран-4-карбоновой кислоты по настоящему изобретению полезна для общего лечения болезненных состояний, опосредованных активностью рецептора 5-HT4.
Солевая форма 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]-метил}тетрагидро-2H-пиран-4-карбоновой кислоты по настоящему изобретению также может быть полезна для лечения заболевания или состояния, выбранного из группы, состоящей из гастроэзофагеальной рефлюксной болезни (ГЭРБ), желудочно-кишечного заболевания, нарушения моторики желудка, неязвенной диспепсии, функциональной диспепсии (ФД), синдрома раздраженного кишечника (СРК), запора, диспепсии, эзофагита, гастроэзофагеальной болезни, гастрита, тошноты, заболевания центральной нервной системы, болезни Альцгеймера, когнитивного нарушения, рвоты, мигрени, неврологического заболевания, боли, сердечно-сосудистых заболеваний, сердечной недостаточности, аритмии сердца, диабета и синдрома апноэ.
Способы синтеза для получения свободной формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты описаны в WO 2006/090224 и в WO 2012/157288.
HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты можно получать, подвергая соединение действию раствора HCl.
В зависимости от концентрации соединения скорость снижения температуры при кристаллизации, как правило, составляет менее 70°C/час при концентрации от примерно 0,1 мг/мл до примерно 200 мг/мл. Для кристаллизации можно использовать скорость предпочтительно менее 50°C/час, более предпочтительно менее 20°C/час и наиболее предпочтительно менее 5°C/час.
Предпочтительный растворитель для получения соли включает EtOH, н-BuOH, MEK или CH3CN, и более предпочтительно н-BuOH и MEK.
HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты можно получать, подвергая соединение действию раствора HBr.
В зависимости от концентрации соединения скорость снижения температуры при кристаллизации, как правило, составляет менее 65°C/час при концентрации от примерно 0,1 мг/мл до примерно 200 мг/мл. Для кристаллизации можно использовать скорость предпочтительно менее 50°C/час, более предпочтительно менее 20°C/час и наиболее предпочтительно менее 5°C/час.
Предпочтительный растворитель для получения соли включает EtOH, AcOEt, MEK, CH3CN или THF, и более предпочтительно н-BuOH, AcOEt и MEK.
pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты можно получать, подвергая соединение действию раствора п-толуолсульфоновой кислоты.
В зависимости от концентрации соединения скорость снижения температуры при кристаллизации, как правило, составляет менее 65°C/час при концентрации от примерно 0,1 мг/мл до примерно 200 мг/мл. Для кристаллизации можно использовать скорость предпочтительно менее 50°C/час, более предпочтительно менее 20°C/час и наиболее предпочтительно менее 5°C/час.
Предпочтительный растворитель для получения соли включает AcOEt.
EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты можно получать, подвергая соединение действию раствора этандисульфоновой кислоты.
В зависимости от концентрации соединения скорость снижения температуры при кристаллизации, как правило, составляет менее 65°C/час при концентрации от примерно 0,1 мг/мл до примерно 200 мг/мл. Для кристаллизации можно использовать скорость предпочтительно менее 50°C/час, более предпочтительно менее 20°C/час и наиболее предпочтительно менее 5°C/час.
Предпочтительный растворитель для получения соли включает н-BuOH или AcOEt.
Солевую форму 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]-метил}тетрагидро-2H-пиран-4-карбоновой кислоты по настоящему изобретению можно вводить отдельно или в сочетании с одним или более другими лекарственными средствами (или с любым их сочетанием). Как правило, они будут введены в виде препарата в сочетании с одним или более фармацевтически приемлемыми эксципиентами. Термин «эксципиент» используют в настоящем документе для обозначения любого ингредиента, отличного от соединения по изобретению. Выбор эксципиента будет в значительной степени зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность, а также характер лекарственной формы.
Таким образом, следующий аспект настоящего изобретения относится к фармацевтической композиции, содержащей солевую форму 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)-пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты и один или более соответствующих эксципиентов. Композиция подходит для лечения болезненных состояний, опосредованных активностью рецептора 5-HT4.
Используемый в настоящем документе термин «солевая форма(ы)» включает HCl-соль, HBr-соль, pTSA-соль и/или EDSA-соль.
Массовая чистота солевой формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты по настоящему изобретению не ограничена, однако, предпочтительно, для конкретных вариантов осуществления данного изобретения можно использовать по существу чистую солевую форму.
Ссылка на «лечение» включает ссылку на радикальное, паллиативное и профилактическое лечение.
При введении животному, отличному от человека, используемый в настоящем документе термин «фармацевтические» может быть заменен на «ветеринарные».
Фармацевтические композиции, подходящие для доставки солевой формы по изобретению, и способы получения будут легко понятны для специалистов в данной области. Информацию о таких композициях и способах получения можно найти, например, в сборнике Remington's Pharmaceutical Sciences, 19е издание (Mack Publishing Company, 1995).
ПЕРОРАЛЬНОЕ ВВЕДЕНИЕ
Солевую форму по изобретению можно вводить перорально. Пероральное введение может включать проглатывание, так что соединение поступает в желудочно-кишечный тракт, и/или трансбуккальное, лингвальное или сублингвальное введение, при котором соединение поступает в кровоток непосредственно из полости рта.
Препараты, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; пастилки (в том числе заполненные жидкостью); жевательные таблетки; гели; быстро диспергирующие лекарственные формы; пленки; суппозитории; спреи; а также трансбуккальные или мукоадгезивные пластыри.
Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие препараты можно использовать как наполнители в мягких или твердых капсулах (выполненных, например, из желатина или гидроксипропилметилцеллюлозы) и они, как правило, содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло и один или более эмульгаторов и/или суспендирующих средств. Жидкие препараты также можно получать путем восстановления твердого препарата, извлеченного из саше, и так далее.
Солевую форму по настоящему изобретению также можно использовать в быстрорастворимых, быстро распадающихся лекарственных формах, таких как те, которые описаны в сборнике Wermuth, C.G. and Stahl, P.H. (Eds.), Handbook of Pharmaceutical Salts: Properties, Selection, and Use, PP19-39 and 83-116, Wiley-Verlag Helvetica Acta, (2002).
Для таблетированных лекарственных форм, в зависимости от дозы, лекарственное средство может составлять от 1 массового % до 80 массовых % от массы лекарственной формы, более конкретно, от 5 массовых % до 60 массовых % от массы лекарственной формы. Помимо лекарственного средства таблетки, как правило, содержат разрыхлитель. Примеры разрыхлителей включают натриевую соль гликолята крахмала, натрий-карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, кроскармеллозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, низший алкил-замещенную гидроксипропилцеллюлозу, крахмал, прежелатинизированный крахмал и альгинат натрия. Как правило, разрыхлитель составляет от 1 массового % до 25 массовых %, предпочтительно от 5 массовых % до 20 массовых % от массы лекарственной формы.
Связывающие вещества, как правило, используют для придания таблетированному препарату когезионных свойств. Подходящие связывающие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические камеди, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводная и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и двухосновный фосфат кальция дигидрат.
Таблетки, необязательно, также могут содержать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, а также вещества, способствующие скольжению, такие как диоксид кремния и тальк. В случае их присутствия, поверхностно-активные вещества могут составлять от 0,2 массовых % до 5 массовых % от массы таблетки, и вещества, способствующие скольжению, могут составлять от 0,2 массовых % до 1 массового % от массы таблетки.
Кроме того, таблетки, как правило, содержат смазывающие средства, такие как стеарат магния, стеарат кальция, стеарат цинка, натрия стеарилфумарат, а также смеси стеарата магния с лаурилсульфатом натрия. Смазывающие средства, как правило, составляют от 0,25 массовых % до 10 массовых %, предпочтительно от 0,5 массовых % до 3 массовых % от массы таблетки.
Другие возможные ингредиенты включают антиокислители, красители, вкусо-ароматические добавки, консерванты и вещества, маскирующие вкус лекарственного средства.
Иллюстративные таблетки содержат до примерно 80% лекарственного средства, от примерно 10 массовых % до примерно 90 массовых % связывающего вещества, от примерно 0 массовых % до примерно 85 массовых % разбавителя, от примерно 2 массовых % до примерно 10 массовых % разрыхлителя и от примерно 0,25 массовых % до примерно 10 массовых % смазывающего вещества.
Таблеточные смеси можно прессовать непосредственно или путем вальцевания, получая таблетки. Альтернативно, таблеточные смеси или части смесей можно подвергать влажной, сухой грануляции или грануляции из расплава, отверждать из расплава, или экструдировать перед таблетированием. Конечный препарат может иметь один или более слоев и может иметь или не иметь покрытие; он даже может быть инкапсулирован.
Препараты в форме таблеток описаны в сборнике Pharmaceutical Dosage Forms: Tablets, Vol. 1, авторов H. Lieberman и L. Lachman (Marcel Dekker, New York, 1980).
Годные к употреблению пероральные пленки для применения в медицине или ветеринарии, как правило, представляют собой лекарственные формы в виде гибкой водорастворимой или набухающей в воде тонкой пленки, которая может быть быстрорастворимой или мукоадгезивной и, как правило, содержит солевую форму по изобретению, пленкообразующий полимер, связывающее вещество, растворитель, увлажнитель, пластификатор, стабилизатор или эмульгатор, изменяющее вязкость средство и растворитель. Некоторые компоненты препарата могут выполнять более чем одну функцию.
Солевые формы по изобретению могут быть водорастворимыми или нерастворимыми в воде, в зависимости от обстоятельств или условий. Водорастворимое соединение, как правило, может составлять от 1 массового % до 80 массовых %, более конкретно, от 20 массовых % до 50 массовых %, от массы растворенных веществ. Менее растворимые соединения могут содержаться в композиции в большей пропорции, как правило, вплоть до 88 массовых % от массы растворенных веществ. Альтернативно, солевые формы по изобретению могут находиться в виде множества мелких гранул.
Пленкообразующий полимер можно выбирать из природных полисахаридов, белков или синтетических гидроколлоидов и, как правило, он присутствует в диапазоне от 0,01 до 99 массовых %, более конкретно, в диапазоне от 30 до 80 массовых %.
Другие возможные ингредиенты включают антиокислители, красители, вкусо-ароматические добавки и усилители вкуса, консерванты, стимулирующие слюноотделение средства, охлаждающие средства, сорастворители (включая масла), смягчающие вещества, наполнители, вещества, препятствующие пенообразованию, сурфактанты и вещества, маскирующие вкус лекарственного средства.
Пленки в соответствии с изобретением, как правило, получают путем испарительной сушки тонких водных пленок, нанесенных на отслаивающуюся подложку или бумагу.
Это можно выполнять в сушильной печи или туннеле, как правило, в комбинированной сушилке для нанесения покрытий, либо путем лиофилизации или вакуумирования.
Твердые препараты для перорального введения можно формулировать для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают препараты с отсроченным, замедленным, импульсным, контролируемым, направленным и программируемым высвобождением.
Подходящие для целей изобретения препараты с модифицированным высвобождением описаны в патенте США № 6106864. Подробное описание других подходящих технологий высвобождения, таких как высокоэнергетические дисперсии, а также осмотические и покрытые частицы, можно найти в публикации Pharmaceutical Technology On-line, 25(2), 1-14, авторов Verma et al. (2001). Использование жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298.
ПАРЕНТЕРАЛЬНОЕ ВВЕДЕНИЕ
Солевую форму по изобретению также можно вводить непосредственно в кровоток, в мышцы или во внутренние органы. Подходящие способы парентерального введения включают внутривенный, внутриартериальный, внутрибрюшинный, интратекальный, интравентрикулярный, интрауретральный, интрастернальный, интракраниальный, внутримышечный, внутрисуставной и подкожный. Соответствующие устройства для парентерального введения включают игольные (в том числе микроигольные) инъекторы, безыгольные инъекторы и инфузионные устройства.
Парентеральные препараты, как правило, представляют собой водные растворы, которые могут содержать эксципиенты, такие как углеводы и буферные средства (предпочтительно, поддерживающие pH на уровне от 3 до 9), однако для некоторых вариантов применения они могут быть соответствующим образом сформулированы в виде стерильного неводного раствора или в сухой форме, предназначенной для использования в сочетании с соответствующим растворителем, таким как стерильная апирогенная вода.
Получение парентеральных препаратов в стерильных условиях, например, путем лиофилизации, можно легко осуществлять с использованием стандартных фармацевтических методов, хорошо известных специалистам в данной области.
Препараты для парентерального введения могут быть сформулированы для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают препараты с отсроченным, замедленным, импульсным, контролируемым, направленным и программируемым высвобождением. Таким образом, солевая форма по изобретению может быть сформулирована в виде суспензии или в виде твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в виде имплантированного депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких препаратов включают стенты, покрытые лекарственным средством, а также полутвердые вещества и суспензии, содержащие покрытые лекарственным средством микросферы из полимера молочной-со-гликолевой кислоты (PLGA).
ТОПИЧЕСКОЕ ВВЕДЕНИЕ
Солевую форму по изобретению также можно вводить топически, (внутри)кожно или чрескожно на кожу или слизистую оболочку. Типичные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, перевязочные материалы, пены, пленки, кожные пластыри, облатки, имплантаты, тампоны, волокна, бандажи и микроэмульсии. Можно также использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Можно включать вещества, способствующие проникновению - смотри, например, J Pharm Sci, 88 (10), 955-958, авторов Finnin и Morgan (October 1999).
Другие способы топического введения включают доставку путем электропорации, ионофореза, фонофореза, сонофореза, а также путем микроигольной или безыгольной (например, Powderject (торговая марка), Bioject (торговая марка), и так далее) инъекции. Топическое введение также можно осуществлять с использованием пластыря, такого как чрескожный ионофоретический пластырь.
Препараты для топического введения могут быть сформулированы для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают препараты с отсроченным, замедленным, импульсным, контролируемым, направленным и программируемым высвобождением.
Солевую форму по изобретению также можно вводить интраназально или путем ингаляции, как правило, в форме сухого порошка (либо самостоятельно, в виде смеси, например, в сухой смеси с лактозой, либо в виде смешанных частиц компонентов, например, смешанных с фосфолипидами, такими как фосфатидилхолин) через ингалятор сухого порошка, в виде спрея из аэрозольного контейнера, насоса, спрея, пульверизатора (предпочтительно пульверизатора, в котором используется электрогидродинамика для создания мелкодисперсного тумана) или небулайзера, с использованием или без использования соответствующего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или в виде назальных капель. В случае интраназального использования порошок может содержать биоадгезивное средство, например, хитозан или циклодекстрин.
Аэрозольный контейнер, насос, спрей, пульверизатор или небулайзер содержит раствор или суспензию солевой формы по изобретению, содержащие, например, этанол, водный раствор этанола или подходящее альтернативное средство для диспергирования, солюбилизации или пролонгированного высвобождения активного вещества, пропеллент(ы) в качестве растворителя и, необязательно, сурфактант, такой как сорбитан триолеат, олеиновая кислота или олигомолочная кислота.
Перед использованием в сухом порошковом или суспензионном препарате лекарственное средство измельчают до размера частиц, подходящих для доставки путем ингаляции (как правило, менее 5 микрон). Это может быть достигнуто с помощью любого подходящего метода измельчения, такого как размол на спиральной струйной мельнице, размол на струйной мельнице с кипящим слоем, обработка сверхкритической жидкостью для получения наночастиц, гомогенизация высокого давления или сушка распылением.
Капсулы (выполненные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для использования в ингаляторе или инсуффляторе могут быть сформулированы для содержания порошковой смеси соединения по изобретению, подходящей порошковой основы, такой как лактоза или крахмал, и модификатора характеристик, такого как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, последнее предпочтительнее. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Подходящий раствор препарата для пульверизатора, в котором используется электрогидродинамика для создания мелкодисперсного тумана, может содержать от 1 мкг до 20 мг соединения по изобретению на одно впрыскивание, и объем впрыска может варьироваться от 1 мкл до 100 мкл. Типичный препарат может содержать солевую форму по изобретению, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
В препараты по изобретению, предназначенные для ингаляционного/интраназального введения, можно добавлять подходящие вкусо-ароматические добавки, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия.
Препараты для ингаляционного/интраназального введения могут быть сформулированы для немедленного и/или модифицированного высвобождения с использованием, например, PLGA. Препараты с модифицированным высвобождением включают препараты с отсроченным, замедленным, импульсным, контролируемым, направленным и программируемым высвобождением.
В случае ингаляторов сухого порошка и аэрозолей единица дозы определяется за счет использования клапана, доставляющего отмеренное количество препарата. Единицы дозы в соответствии с изобретением, как правило, соответствуют вводимой отмеренной дозе, или «впрыску», содержащей от 1 мкг до 20 мг соединения A. Общая суточная доза, как правило, будет находиться в диапазоне от 1 мкг до 100 мг, ее можно вводить одной дозой или, чаще, в виде разделенных доз в течение дня.
РЕКТАЛЬНОЕ/ИНТРАВАГИНАЛЬНОЕ ВВЕДЕНИЕ
Солевую форму по изобретению можно вводить ректально или вагинально, например, с использованием суппозитория, пессария или спринцовки. Масло какао является традиционной основой для суппозитория, однако по мере необходимости можно использовать различные альтернативные варианты.
Препараты по изобретению для ректального/вагинального введения могут быть сформулированы для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают препараты с отсроченным, замедленным, импульсным, контролируемым, направленным и программируемым высвобождением.
ВВЕДЕНИЕ ПРЕПАРАТА В ГЛАЗ/УХО
Солевую форму по изобретению также можно вводить непосредственно в глаз или ухо, как правило, в форме капель тонкодисперсной суспензии или раствора в изотоническом, pH-скорректированном, стерильном солевом растворе. Другие препараты, подходящие для введения в глаз и ухо, включают мази, гели, биоразлагаемые (например, рассасывающиеся гелевые губки, коллаген) и не биоразлагаемые (например, силиконовые) имплантаты, облатки, линзы, а также системы в форме частиц и везикул, такие как ниосомы или липосомы. Можно включать полимер, такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, либо гетерополисахаридный полимер, например, геллановая камедь, наряду с консервантом, таким как бензалкония хлорид. Такие препараты также могут быть доставлены при помощи ионофореза.
Препараты, содержащие соль по изобретению, для введения в глаз/ухо могут быть сформулированы для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают препараты с отсроченным, замедленным, импульсным, контролируемым, направленным и программируемым высвобождением.
ДРУГИЕ ТЕХНОЛОГИИ
Солевую форму по изобретению можно комбинировать с растворимыми макромолекулярными соединениями, такими как циклодекстрин и соответствующие его производные или полиэтиленгликоль-содержащие полимеры, с целью повышения ее растворимости, скорости растворения, улучшения вкусовых качеств, повышения биодоступности и/или стабильности при использовании в любом вышеуказанном способе введения.
Установлено, например, что комплексы лекарственное средство-циклодекстрин, как правило, могут быть использованы для большинства лекарственных форм и способов введения. Можно использовать как комплексы включения, так и комплексы невключения. В качестве альтернативы прямому образованию комплекса с лекарственным средством можно использовать циклодекстрин в качестве вспомогательной добавки, то есть, в качестве носителя, разбавителя или солюбилизатора. Наиболее часто для этих целей используют альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в международных публикациях патентов №№ WO 91/11172, WO 94/02518, WO 98/55148, а также публикации Evrard, B., et al., Journal of Controlled Release 96 (3), pp. 403-410, 2004.
ДОЗИРОВКА
Для лечения или предотвращения болезненных состояний, опосредованных активностью рецептора 5-HT4, таких как желудочно-кишечные заболевания, подходящий уровень доз солевой формы по данному изобретению составляет примерно от 0,0001 до 1000 мг в сутки, предпочтительно примерно от 0,001 до 100 мг в сутки, и более предпочтительно примерно от 0,005 до 50 мг в сутки, и наиболее предпочтительно от 1 до 50 мг в сутки активного соединения. Соединения можно вводить в режиме 1-4 раз в сутки. Однако в некоторых случаях можно использовать дозы за пределами данных диапазонов.
Данные дозировки основаны на том, что средний человек имеет массу тела примерно от 60 кг до 70 кг. Врач может легко определять дозы для субъектов, масса тела которых находится за пределами данного диапазона, например, для детей и пожилых людей. Во избежание сомнений, ссылка в настоящем документе на «лечение» включает ссылки на радикальное, паллиативное и профилактическое лечение.
Солевую форму по настоящему изобретению (соединение A) можно также, необязательно, комбинировать с другим фармакологически активным соединением, или с двумя или более другими фармакологически активными соединениями, в частности, для лечения болезненных состояний, опосредованных активностью рецептора 5-HT4. Например, солевую форму по настоящему изобретению, описанную выше, можно вводить одновременно, последовательно или раздельно в сочетании с одним или более средствами, выбранными из:
- опиоидного анальгетического средства, например, морфина, героина, гидроморфона, оксиморфона, леворфанола, леваллорфана, метадона, меперидина, фентанила, кокаина, кодеина, дигидрокодеина, оксикодона, гидрокодона, пропоксифена, налмефена, налорфина, налоксона, налтрексона, бупренорфина, буторфанола, нальбуфина или пентазоцина;
- нестероидного противовоспалительного средства (НПВС), например, аспирина, диклофенака, дифлунизала, этодолака, фенбуфена, фенопрофена, флуфенисала, флубипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, меклофенамовой кислоты, мефенамовой кислоты, мелоксикама, набуметона, напроксена, нимесулида, нитрофлурбипрофена, олсалазина, оксапрозина, фенилбутазона, пироксикама, сульфасалазина, сулиндака, толметина или зомепирака;
- барбитуратного седативного средства, например, амобарбитала, апробарбитала, бутабарбитала, буталбитала, мефобарбитала, метарбитала, метогекситала, пентобарбитала, фенобарбитала, секобарбитала, талбутала, тиамилала или тиопентала;
- бензодиазепина, имеющего седативное действие, например, хлордиазепоксида, клоразепата, диазепама, флуразепама, лоразепама, оксазепама, темазепама или триазолама;
- антагониста H1, имеющего седативное действие, например, дифенгидрамина, пириламина, прометазина, хлорфенирамина или хлорциклизина;
- седативного средства, такого как глютетимид, мепробамат, метаквалон или дихлоралфеназон;
- релаксанта скелетных мышц, например, баклофена, карисопродола, хлорзоксазона, циклобензаприна, метокарбамола или орфенадрина;
- антагониста NMDA-рецепторов, например, декстрометорфана ((+)-3-гидрокси-N-метилморфинана) или его метаболита декстрорфана ((+)-3-гидрокси-N-метилморфинана), кетамина, мемантина, пирроло-хинолин-хинона, цис-4-(фосфонометил)-2-пиперидинкарбоновой кислоты, будипина, EN-3231 (морфидекс (зарегистрированная торговая марка), комбинированный препарат морфина и декстрометорфана), топирамата, нерамексана или перзинфотела, включая антагонист NR2B, например, ифенпродила, траксопродила или (-)-(R)-6-{2-[4-(3-фторфенил)-4-гидрокси-1-пиперидинил]-1-гидроксиэтил-3,4-дигидро-2(1H)-хинолинона;
- альфа-адренергического средства, например, доксазозина, тамсулозина, клонидина, гуанфацина, дексмедетомидина, модафинила или 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолина;
- трициклического антидепрессанта, например, дезипрамина, имипрамина, амитриптилина или нортриптилина;
- противосудорожного средства, например, карбамазепина, ламотригина, топирамата или вальпроата;
- антагониста рецепторов тахикинина (NK), в частности, антагониста NK-3, NK-2 или NK-1, например, альфа-R,9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7H-[1,4]диазоцино[2,1-g][1,7]-нафтиридин-6,13-диона (TAK-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]-метил]-1,2-дигидро-3H-1,2,4-триазол-3-она (MK-869), апрепитанта, ланепитанта, дапитанта или 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенилпиперидина (2S,3S);
- антагониста мускариновых рецепторов, например, оксибутинина, толтеродина, пропиверина, троспий хлорида, дарифенацина, солифенацина, темиверина и ипратропиума;
- избирательного ингибитора COX-2, например, целекоксиба, рофекоксиба, парекоксиба, вальдекоксиба, деракоксиба, эторикоксиба или люмиракоксиба;
- анальгетика, являющегося производным анилина, в частности, парацетамола;
- нейролептика, такого как дроперидол, хлорпромазин, галоперидол, перфеназин, тиоридазин, мезоридазин, трифлуоперазин, флуфеназин, клозапин, оланзапин, рисперидон, зипрасидон, кветиапин, сертиндол, арипипразол, сонепипразол, блонансерин, илоперидон, пероспирон, раклоприд, зотепин, бифепрунокс, азенапин, луразидон, амисульприд, балаперидон, палиндор, эпливансерин, озанетант, римонабант, меклинертант, мираксион (зарегистрированная торговая марка) или саризотан;
- агониста (например, резинифератоксина) или антагониста (например, капсазепина) ваниллоидных рецепторов;
- агониста или антагониста катионного канала с транзиторным рецепторным потенциалом подтипа (V1, V2, V3, V4, M8, A1);
- бета-адренергического средства, такого как пропранолол;
- местного анестетика, такого как мексилетин;
- кортикостероида, такого как дексаметазон;
- агониста или антагониста рецептора 5-HT, в частности, агониста 5-HT1B/1D, такого как элетриптан, суматриптан, наратриптан, золмитриптан или ризатриптан;
- антагониста рецептора 5-HT2A, такого как R(+)-альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенилэтил)]-4-пиперидинметанол (MDL-100907);
- холинэргического (никотинового) анальгетика, такого как испрониклин (TC-1734), (E)-N-метил-4-(3-пиридинил)-3-бутен-1-амин (RJR-2403), (R)-5-(2-азетидинилметокси)-2-хлорпиридин (ABT-594) или никотин;
- трамадола (зарегистрированная торговая марка);
- ингибитора PDEV, такого как 5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7H-пиразолo[4,3-d]пиримидин-7-он (силденафил), (6R,12aR)-2,3,6,7,12,12a-гексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразинo[2',1':6,1]-пиридо[3,4-b]индол-1,4-дион (IC-351 или тадалафил), 2-[2-этокси-5-(4-этилпиперазин-1-ил-1-сульфонил)фенил]-5-метил-7-пропил-3H-имидазо[5,1-f][1,2,4]триазин-4-он (варденафил), 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7H-пиразолo[4,3-d]пиримидин-7-он, 5-(5-ацетил-2-пропокси-3-пиридинил)-3-этил-2-(1-изопропил-3-азетидинил)-2,6-дигидро-7H-пиразолo[4,3-d]пиримидин-7-он, 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7H-пиразолo[4,3-d]пиримидин-7-он, 4-[(3-хлор-4-метоксибензил)амино]-2-[(2S)-2-(гидроксиметил)пирролидин-1-ил]-N-(пиримидин-2-илметил)пиримидин-5-карбоксамид, 3-(1-метил-7-оксо-3-пропил-6,7-дигидро-1H-пиразолo[4,3-d]пиримидин-5-ил)-N-[2-(1-метилпирролидин-2-ил)этил]-4-пропоксибензолсульфонамид;
- лиганда альфа-2-дельта, такого как габапентин, прегабалин, 3-метилгабапентин, (1-альфа,3-альфа,5-альфа)(3-аминометилбицикло[3,2,0]гепт-3-ил)-уксусная кислота, (3S,5R)-3-аминометил-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилоктановая кислота, (2S,4S)-4-(3-хлорфенокси)пролин, (2S,4S)-4-(3-фторбензил)пролин, [(1R,5R,6S)-6-(аминометил)бицикло[3,2,0]гепт-6-ил]уксусная кислота, 3-(1-аминометилциклогексилметил)-4H-[1,2,4]оксадиазол-5-он, C-[1-(1H-тетразол-5-илметил)циклогептил]метиламин, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота, (3S,5R)-3-аминометил-5-метилоктановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота, (3S,5R)-3-амино-5-метилоктановая кислота, (3R,4R,5R)-3-амино-4,5-диметилгептановая кислота и (3R,4R,5R)-3-амино-4,5-диметилоктановая кислота;
- каннабиноида;
- антагониста метаботропного глутаматного рецептора подтипа 1 (mGluR1);
- ингибитора обратного захвата серотонина, такого как сертралин, метаболит сертралина десметилсертралин, флуоксетин, норфлуоксетин (десметил-метаболит флуоксетина), флувоксамин, пароксетин, циталопрам, метаболит циталопрама десметилциталопрам, эсциталопрам, D,L-фенфлурамин, фемоксетин, ифоксетин, цианодотиепин, литоксетин, дапоксетин, нефадозон, церикламин и тразодон;
- ингибитора обратного захвата норадреналина (норэпинефрина), такого как мапротилин, лофепрамин, миртазапин, оксапротилин, фезоламин, томоксетин, миансерин, бупропион, метаболит бупропиона гидроксибупропион, номифенсин и вилоксазин (вивалан (зарегистрированная торговая марка)), особенно избирательного ингибитора обратного захвата норадреналина, такого как ребоксетин, в частности (S,S)-ребоксетин;
- двойного ингибитора обратного захвата серотонина-норадреналина, такого как венлафаксин, метаболит венлафаксина O-десметилвенлафаксин, клопирамин, метаболит клопирамина десметилклопирамин, дулоксетин, милнаципран и имипрамин;
- ингибитора индуцируемой NO-синтазы (iNOS), такого как S-[2-[(1-иминоэтил)амино]этил]-L-гомоцистеин, S-[2-[(1-иминоэтил)амино]этил]-4,4-диоксо-L-цистеин, S-[2-[(1-иминоэтил)амино]этил]-2-метил-L-цистеин, (2S,5Z)-2-амино-2-метил-7-[(1-иминоэтил)амино]-5-гептеновая кислота, 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлор-3-пиридинкарбонитрил; 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-4-хлорбензонитрил, (2S,4R)-2-амино-4-[[2-хлор-5-(трифторметил)фенил]тио]-5-тиазолбутанол, 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-6-(трифторметил)-3-пиридинкарбонитрил, 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлорбензонитрил, N-[4-[2-(3-хлорбензиламино)этил]фенил]тиофен-2-карбоксамидин или гуанидинoэтилдисульфид;
- ингибитора ацетилхолинэстеразы, такого как донепезил;
- антагониста рецепторов простагландина E2 подтипа 4 (EP4), такого как N-[({2-[4-(2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил)фенил]этил}амино)карбонил]-4-метилбензолсульфонамид или 4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойная кислота;
- антагониста рецепторов лейкотриена B4; такого как 1-(3-бифенил-4-илметил-4-гидроксихроман-7-ил)циклопентанкарбоновая кислота (CP-105696), 5-[2-(2-карбоксиэтил)-3-[6-(4-метоксифенил)-5E-гексенил]оксифенокси]валериановая кислота (ONO-4057) или DPC-11870,
- ингибитора 5-липоксигеназы, такого как зилеутон, 6-[(3-фтор-5-[4-метокси-3,4,5,6-тетрагидро-2H-пиран-4-ил])феноксиметил]-1-метил-2-хинолон (ZD-2138) или 2,3,5-триметил-6-(3-пиридилметил),1,4-бензохинон (CV-6504);
- блокатора натриевых каналов, такого как лидокаин;
- блокатора кальциевых каналов, такого как зиконотид, зонисамид, мибефрадил;
- антагониста 5-HT3, такого как ондансетрон;
- химиотерапевтического лекарственного средства, такого как оксалиплатин, 5-фторурацил, лейковорин, паклитаксел;
- антагониста рецепторов пептида, связанного с геном кальцитонина (CGRP);
- антагониста рецепторов брадикинина (BK1 и BK2);
- блокатора потенциал-зависимых натриевых каналов (Nav1.3, Nav1.7, Nav1.8);
- блокатора потенциал-зависимых кальциевых каналов (N-типа, T-типа);
- антагониста P2X (рецептора АТФ канального типа);
- антагониста кислото-чувствительных канальных рецепторов (ASIC1a, ASIC3);
- антагониста рецепторов ангиотензина AT2;
- антагониста рецепторов хемокина CCR2B;
- ингибитора катепсина (B, S, K);
- агониста или антагониста рецепторов сигма1;
а также их фармацевтически приемлемых солей и сольватов.
Такие комбинации в терапии имеют значительные преимущества, включая синергетическую активность.
КОМБИНИРОВАННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО и НАБОР
Один вариант осуществления настоящего изобретения относится к комбинации солевой формы по настоящему изобретению и лекарственного средства от желудочно-кишечных заболеваний, которое отличается от солевой формы по настоящему изобретению. «Комбинация» по изобретению может представлять собой «фиксированную комбинацию» или «комбинацию в виде набора частей». «Фиксированную комбинацию» определяют, как комбинацию, в которой (i) по меньшей мере одно лекарственное средство от желудочно-кишечных заболеваний, отличное от солевой формы по настоящему изобретению, и (ii) солевая форма присутствуют в одном модуле. «Комбинацию в виде набора частей» определяют, как комбинацию, в которой (i) по меньшей мере одно лекарственное средство от желудочно-кишечных заболеваний, отличное от солевой формы по настоящему изобретению, и (ii) солевая форма присутствуют в более чем одном модуле. Компоненты «комбинации в виде набора частей» можно вводить одновременно, последовательно или раздельно. Молярное соотношение лекарственного средства от желудочно-кишечных заболеваний, отличного от солевой формы по настоящему изобретению, и солевой формы, используемой в соответствии с изобретением, находится в пределах диапазона от 1:100 до 100:1, например, от 1:50 до 50:1 или от 1:20 до 20:1, или от 1:10 до 10:1. Два лекарственных средства можно вводить раздельно в том же соотношении. Примерами средств, ингибирующих секрецию кислоты, являются другие агонисты 5-HT4, ингибиторы протонного насоса, антагонисты рецепторов H2 и лекарственные средства от СРК или запоров. Такими примерами являются блокаторы H2, такие как циметидин, ранитидин; а также ингибиторы протонного насоса, такие как пиридинилметилсульфинил-бензимидазолы, например, омепразол, эзомепразол, ланзопразол, пантопразол, рабепразол или родственные субстанции, такие как леминопразол.
Настоящее изобретение относится к комбинации, включающей солевую форму 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты и одно или более лекарственных средств, таких как те, которые перечислены выше, для одновременного, раздельного или последовательного использования в радикальном, профилактическом или паллиативном лечении болезненных состояний, опосредованных активностью рецептора 5-HT4.
ПРИМЕРЫ
Следующие примеры служат исключительно для ознакомления.
АНАЛИЗ
Ядерный магнитный резонанс (ЯМР)
Данные ЯМР получали при 270 МГц (спектрометр JEOL JNM-LA 270) или 300 МГц (спектрометр JEOL JNM-LA300) с использованием дейтерированного диметилсульфоксида (99,9% D) в качестве растворителя относительно тетраметилсилана (TMS) в качестве внутреннего стандарта, в частях на миллион (ppm); используемые общепринятые аббревиатуры: с=синглет, д=дублет, т=триплет, к=квартет, м=мультиплет, уш=уширенный и так далее.
Рентгеновская порошковая дифракция (РПД)
РПД анализы выполняли на рентгеновском порошковом дифрактометре Rigaku RINT-TTR с использованием Cu-K-альфа излучения. Образцы также можно измерять в условиях высокой/низкой температуры за счет присоединения держателя для образцов с регулируемой температурой. Прибор был оборудован рентгеновской трубкой точной фокусировки. Параметры напряжения и силы тока трубки были установлены на 50 кВ и 300 мА, соответственно. Щели расходимости и рассеивания были установлены на 0,5°, и приемная щель была установлена на 0,15 мм. Дифрагированное излучение детектировали с помощью сцинтилляционного детектора NaI. Использовали непрерывное сканирование по оси тета в градусах 2-тета со скоростью 4°/мин (размер шага 0,02°) в диапазоне от 3 до 40 2-тета (°). Анализировали кремниевые стандарты для проверки точности установок параметров машины. Данные собирали и анализировали с использованием рентгеновской системы Rigaku. Образцы готовили для анализа, помещая их в алюминиевый держатель для образцов, который горизонтально вращался со скоростью 60 об/мин во время сбора данных.
ИК-Фурье спектроскопия
Инфракрасные спектры получали на инфракрасном спектрометре с преобразованием Фурье (ИК-Фурье) (FT-IR) Shimadzu IRPrestige-21, оборудованном высокоэнергетическим керамическим источником света с воздушным охлаждением, расщепителем пучка из покрытого германием бромида калия (KBr), высокочувствительным пироэлектрическим детектором (DLATGS) и вспомогательным устройством для диффузного отражения DRS-8000. Каждый спектр представлял собой 40 объединенных сканограмм, полученных при спектральном разрешении 4 см-1. Небольшое количество образца помещали на пластину (диаметр 6 мм и глубина 1,5 мм) автодозатора. Набор данных в фоновом режиме получали с использованием пустой пластины для образца. Представленные значения округлены и, вследствие этого, их следует считать приблизительными.
Дифференциальная сканирующая калориметрия (ДСК)
ДСК анализ выполняли с использованием прибора Mettler Toledo DSC822. Образец помещали в алюминиевый тигель для ДСК, и массу точно регистрировали. Тигель накрывали крышкой с проколотым отверстием и затем обжимали. Каждый образец нагревали при продувке азотом со скоростью 5°C/мин до конечной температуры 220-290°C. В качестве калибровочного стандарта использовали металлический индий. Представленные значения округлены и, вследствие этого, их следует считать приблизительными.
Измерения методом высокоэффективной жидкостной хроматографии (ВЭЖХ)
Данные ВЭЖХ получали с использованием ВЭЖХ-системы Waters Alliance 2695 с детектором 2996 PDA, используя следующие условия:
Колонка: Inertsil ODS-3 (3 мкм, 4,6×150 мм),
Элюент: ацетонитрил/10 мМ ацетат аммония=32/68,
Детектирование: УФ при 215 нм,
Скорость потока: 1 мл/мин, и
Температура колонки: 40°C.
Обработку данных производили при помощи программы Empower 2, предоставленной компанией Waters Corporation.
Термогравиметрия/дифференциальный термографический анализ (ТГ/ДТА)
ТГ/ДТА выполняли с использованием системы Seiko 6200R. Образец помещали в алюминиевый тигель для ТГ/ДТА. Каждый образец нагревали при продувке азотом со скоростью 5°C/мин до конечной температуры 300°C. В качестве калибровочного стандарта использовали металлический индий. Представленные значения округлены и, вследствие этого, их следует считать приблизительными.
Комнатная температура соответствует температуре 15-35°C, но без ограничения, при условии, что цель достигнута.
Химические символы имеют их обычные значения во всем тексте описания; M (моль(и) на литр), л (литр(ы)), мл (миллилитр(ы)), г (грамм(ы)), мг (миллиграмм(ы)), моль (моли), ммоль (миллимоли), Н (нормальная концентрация), н-BuOH (нормальный бутиловый спирт), EtOH (этиловый спирт), AcOEt (этилацетат), MEK (метилэтилкетон), THF (тетрагидрофуран), i-PrOH (изопропиловый спирт).
ПРИМЕР 1
Получение 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты общепринятым методом
Густую суспензию 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]-метил}тетрагидро-2H-пиран-4-карбоновой кислоты (1,326 кг, 2,807 моль, белое твердое вещество) в этилацетате (18,564 л) растворяли при 70°C. Раствор охлаждали до 64°C в течение 35 минут, и в смесь добавляли 200 мг затравочного кристалла (0,423 ммоль). Смесь охлаждали до 40°C в течение 5 часов и перемешивали при данной температуре в течение 14,5 часов. Густую суспензию постепенно охлаждали до 19°C в течение 6 часов, и смесь перемешивали при данной температуре в течение 46 часов. Образовавшийся осадок собирали фильтрованием и отфильтрованный осадок промывали 2,0 л этилацетата. Отфильтрованный осадок высушивали при пониженном давлении и температуре 50°C, с получением 1,140 кг нужной кристаллической формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]-метил}тетрагидро-2H-пиран-4-карбоновой кислоты (86%).
В данной спецификации символы «α», «θ», «δ» и «ν» пишутся как «альфа», «тета», «дельта» и «ню».
1H-ЯМР (ДМСО-d6) дельта: 7,59 (1 H, дд, J=8,1, 8,4 Гц), 7,25 (1 H, д, J=8,4 Гц), 6,94 (1 H, д, J=8,1 Гц), 4,93 (2 H, к, J=8,7 Гц), 4,19 (2 H, д, J=5,9 Гц), 3,75-3,62 (2 H, м), 3,48-3,30 (2 H, м), 2,90-2,74 (2 H, м), 2,50 (2 H, с), 2,29-2,13 (2 H, м), 1,94-1,23 (9 H, м).
Сигнал за счет CO2H отсутствовал.
т.п. (начало ДСК): 169°C.
Температура имеет предел погрешности +/- 1°C.
Кристалличность методом РПД: кристалл (фигура 1): основные пики при градусах 2-тета: 5,9, 9,3, 9,8, 11,9, 13,7, 14,3, 15,0, 17,8, 18,2-19,3, 19,7, 22,6, 23,4-24,5 и 24,9 (°). Каждый пик имеет предел погрешности +/- 0,2.
ИК ню (диффузное отражение) (фигура 6): 4389-4383, 3426, 2943-2937, 2120, 1904, 1724, 1614, 1535, 1508, 1437, 1420, 1287, 1261, 1221, 1180, 1121, 1094, 1059, 1022, 991, 974, 957, 934, 918, 868, 827, 783, 746, 731, 654, 638, 615, 588, 554, 542 и 507 см-1. Каждый пик имеет предел погрешности +/- 2 см-1.
Аналитически вычислено для C22H27N2O6F3: C, 55,93; H, 5,76; N, 5,93. Найдено: C, 55,76; H, 5,74; N, 5,85.
ПРИМЕР 2
Получение гидрохлоридной соли (HCl-соли) 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновую кислоту (244 мг, 0,516 ммоль) растворяли в н-BuOH (4,5 мл) при температуре 70°C и добавляли конц. HCl (37 масс%, 35,5 мкл, 0,425 ммоль). Смесь перемешивали при температуре 70°C в течение ночи, затем постепенно охлаждали до комнатной температуры.
Полученный осадок собирали фильтрованием, промывали EtOH и высушивали в вакууме, с получением 178 мг (0,350 ммоль) гидрохлорида (HCl-соли) 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты в виде белого твердого вещества (выход 82%).
1H-ЯМР дельта: 7,61 (т, 1 H, J=8,4 Гц), 7,27 (д, 1 H, J=8,8 Гц), 6,96 (д, 1 H, J=8,0 Гц), 4,96 (к, 2 H, J=8,5 Гц), 4,35-4,15 (м, 2 H), 3,80-3,65 (м, 2 H), 3,65-3,30 (м, 4 H), 3,41 (с, 2 H), 3,25-3,00 (м, 2 H), 2,30-2,05 (м, 1 H), 2,05-1,85 (м, 4 H), 1,85-1,55 (м, 4 H).
РПД (фигура 2): Основные пики при градусах 2-тета: 5,9, 9,4, 11,1, 11,9, 13,2, 18,2, 18,6, 22,1, 25,2 и 26,5 (°). Каждый пик имеет предел погрешности +/- 0,2.
ИК ню (диффузное отражение) (фигура 7): 4392, 3393, 2953, 2517, 1942, 1705, 1618, 1541, 1508, 1439, 1377, 1288, 1261, 1223, 1155, 1111, 1059, 1040, 1011, 966, 941, 878, 856, 787, 754, 733, 654, 625, 590, 573, 557, 529, 503 и 478 см-1. Каждый пик имеет предел погрешности +/- 2 см-1.
т.п. (начало ДСК): 232°C.
Температура имеет предел погрешности +/- 1°C.
Аналитически вычислено для C22H28ClF3N2O6: C, 51,92; H, 5,55; N, 5,50; F, 11,20; Cl, 6,97. Найдено: C, 51,92; H, 5,55; N, 5,45; F, 11,11; Cl, 6,98.
ПРИМЕР 3
Получение гидробромидной соли (HBr-соли) 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновую кислоту (351 мг, 0,744 ммоль) растворяли в н-BuOH (14 мл) при температуре 65°C и добавляли раствор HBr в EtOH (0,5 M, 1,51 мл, 0,759 ммоль). Смесь перемешивали при температуре 65°C в течение ночи, затем постепенно охлаждали до комнатной температуры.
Полученный осадок собирали фильтрованием, промывали EtOH и высушивали в вакууме, с получением 254 мг (0,459 ммоль) гидробромида (HBr-соли) 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты в виде белого твердого вещества (выход 62%).
1H-ЯМР дельта: 7,61 (т, 1 H, J=8,1 Гц), 7,27 (д, 1 H, J=8,8 Гц), 6,97 (д, 1 H, J=8,0 Гц), 4,96 (к, 2 H, J=8,8 Гц), 4,40-4,15 (м, 2 H), 3,80-3,65 (м, 2 H), 3,65-3,30 (м, 4 H), 3,43 (с, 2 H), 3,30-3,05 (м, 2 H), 2,30-2,10 (м, 1 H), 2,05-1,85 (м, 4 H), 1,85-1,55 (м, 4 H).
РПД (фигура 3): Основные пики при градусах 2-тета: 9,4, 13,3, 18,4, 18,7, 22,2, 23,2, 23,8, 24,8, 25,2, 25,9 и 26,6 (°). Каждый пик имеет предел погрешности +/- 0,2.
ИК ню (диффузное отражение) (фигура 8): 4405, 3397, 2941, 2693, 2122, 1942, 1717, 1618, 1545, 1508, 1441, 1410, 1377, 1352, 1287, 1261, 1225, 1157, 1111, 1059, 1040, 1011, 968, 941, 874, 856, 787, 754, 735, 652, 621, 590, 571, 557, 525, 503 и 478 см-1. Каждый пик имеет предел погрешности +/- 2 см-1.
т.п. (начало ДСК): 256°C.
Температура имеет предел погрешности +/- 1°C.
Аналитически вычислено для C22H28BrF3N2O6: C, 47,75; H, 5,10; N, 5,06; F, 10,30; Br, 14,44. Найдено: C, 47,88; H, 5,21; N, 4,98; F, 10,15; Br, 14,13.
ПРИМЕР 4
Получение п-толуолсульфонатной соли (pTSA-соли) 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновую кислоту (211 мг, 0,477 ммоль) растворяли в AcOEt (6,33 мл) при температуре 65°C и добавляли раствор моногидрата п-толуолсульфоновой кислоты (85,0 мг, 0,447 ммоль) в CH3CN (1,48 мл). Смесь перемешивали при температуре 65°C в течение 3 минут, затем постепенно охлаждали до комнатной температуры.
Полученный осадок собирали фильтрованием, промывали AcOEt и высушивали в вакууме, с получением 249 мг (0,387 ммоль) п-толуолсульфонатной соли (pTSA-соли) 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты в виде белого твердого вещества (выход 87%).
1H-ЯМР дельта: 7,61 (т, 1 H, J=8,2 Гц), 7,47 (д, 2 H, J=7,9 Гц), 7,27 (д, 1 H, J=8,6 Гц), 7,11 (д, 2 H, J=7,9 Гц), 6,96 (д, 1 H, J=8,6 Гц), 4,95 (к, 2 H, J=8,6 Гц), 4,40-4,15 (м, 2 H), 3,80-3,65 (м, 2 H), 3,65-3,30 (м, 4 H), 3,42 (с, 2 H), 3,30-3,05 (м, 2 H), 2,28 (с, 3 H), 2,40-2,05 (м, 1 H), 2,05-1,85 (м, 4 H), 1,80-1,55 (м, 4 H).
РПД (фигура 4): Основные пики при градусах 2-тета: 5,3, 11,9, 14,6, 16,0, 18,5, 18,7, 20,1, 20,6, 21,1, 22,7 и 23,0 (°). Каждый пик имеет предел погрешности +/- 0,2.
ИК ню (диффузное отражение) (фигура 9): 4438, 4369, 3397, 3017, 2868, 2768 1902, 1701, 1616, 1541, 1508, 1466, 1436, 1422, 1371, 1290, 1267, 1206, 1180, 1150, 1117, 1038, 1013, 972, 918, 881, 860, 847, 812, 783, 738, 708, 677, 650, 611, 565 и 492 см-1. Каждый пик имеет предел погрешности +/- 2 см-1.
т.п. (начало ДСК): 207°C.
Температура имеет предел погрешности +/- 1°C.
Аналитически вычислено для C25H35F3N2O9S: C, 54,03; H, 5,47; N, 4,35; F, 8,84; S, 4,97. Найдено: C, 54,00; H, 5,49; N, 4,39; F, 8,85; S, 4,79.
ПРИМЕР 5
Получение геми-этандисульфонатной соли (EDSA-соли) 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновую кислоту (207 мг, 0,438 ммоль) растворяли в AcOEt (6,21 мл) при температуре 65°C и добавляли раствор дигидрата этандисульфоновой кислоты (49,6 мг, 0,219 ммоль) в EtOH (0,311 мл). Смесь перемешивали при температуре 65°C в течение 3 минут, затем постепенно охлаждали до комнатной температуры.
Полученный осадок собирали фильтрованием, промывали AcOEt и высушивали в вакууме, с получением 223 мг (0,394 ммоль) геми-этандисульфонатной соли (EDSA-соли) 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты в виде белого твердого вещества (выход 90%).
1H-ЯМР дельта: 7,61 (т, 1 H, J=8,2 Гц), 7,27 (д, 1 H, J=7,9 Гц), 6,96 (д, 1 H, J=8,6 Гц), 4,95 (к, 2 H, J=8,6 Гц), 4,40-4,15 (м, 2 H), 3,80-3,65 (м, 2 H), 3,65-3,30 (м, 4 H), 3,39 (с, 2 H), 3,25-3,00 (м, 2 H), 2,61 (с, 2 H), 2,30-2,05 (м, 1 H), 2,05-1,85 (м, 4 H), 1,80-1,55 (м, 4 H).
РПД (фигура 5): Основные пики при градусах 2-тета: 11,3, 13,8, 15,1, 15,9, 18,8, 19,5, 20,2, 20,4, 20,7, 24,0, 24,7 и 26,2 (°). Каждый пик имеет предел погрешности +/- 0,2.
ИК ню (диффузное отражение) (фигура 10): 4388, 3948, 3422, 2741, 1937, 1717, 1616, 1539, 1506, 1435, 1373, 1285, 1244, 1204, 1169, 1146, 1107, 1030, 989, 972, 951, 901, 854, 789, 772, 756, 741, 729, 652, 615, 546, 532 и 490 см-1. Каждый пик имеет предел погрешности +/- 2 см-1.
т.п. (начало ДСК): 246°C.
Температура имеет предел погрешности +/- 1°C.
Аналитически вычислено для C23H30F3N2O9S: C, 48,67; H, 5,33; N, 4,94; F, 10,04; S, 5,65. Найдено: C, 48,59; H, 5,35; N, 4,94; F, 9,80; S, 5,50.
ПРИМЕР 6
Исследование гигроскопичности
Образцы соли взвешивали в алюминиевых тиглях, помещали в держатель для образцов и хранили в камере влажности при 90%RH (BaCl2-2H2O). Через пять дней образцы визуально осматривали с ручной лупой и взвешивали на аналитических весах. Образцы анализировали методом РПД через пять дней, затем оставляли уравновешиваться при температуре окружающей среды в течение ночи и повторно анализировали методом РПД для оценки стабильности предполагаемых гидратов в условиях окружающей среды.
Никакого расплывания за счет атмосферной влаги не наблюдали при визуальном осмотре через пять дней, однако наблюдали значительное увеличение массы (>15 масс%) в случае свободной формы, умеренное увеличение массы (примерно 5 масс%) наблюдали в случае EDSA-соли, в то время как HCl-соль, HBr-соль и pTSA-соль демонстрировали очень незначительное приращение массы.
Никаких изменений кристаллической формы не наблюдали методом РПД как через 5 дней, так и после уравновешивания при температуре окружающей среды, для всех четырех образцов солей, однако картина РПД свободной формы отличалась от картины исходной основной массы, что свидетельствовало об образовании гидрата.
Данные результаты обобщенно представлены в таблице 1.
Таблица 1.
ПРИМЕР 7
Исследование стабильности в твердом состоянии
Исследование стабильности в твердом состоянии проводили с использованием камеры с контролируемой постоянной температурой/влажностью Nagano Science LH-20-11M или LH-21-11M. Образец помещали в камеру и подвергали воздействию условий 40°C/75% RH. Кристаллическую форму и термические характеристики полученного образца после воздействия оценивали методами РПД и ТГ/ДТА, соответственно. % остатка и чистоту определяли методом ВЭЖХ.
% остатка HCl-соли, HBr-соли, pTSA-соли и EDSA-соли после хранения при 40°C/75% RH в течение 6 месяцев составлял 97%, 99%, 98% и 99%, соответственно, в то время как остаток свободной формы составлял 87% (таблица 2). Кроме того, чистота свободной формы (95,6%) была явно ниже, чем чистота этих четырех солей (98,8-100,0%) и множество продуктов распада наблюдали в случае свободной формы. EDSA-соль была наиболее стабильной среди данных четырех солей.
Таблица 2
Результат исследования стабильности в твердом состоянии в условиях хранения при 40°C/75% RH в течение 6 месяцев
Шесть основных продуктов распада 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты наблюдали при исследовании стабильности в твердом состоянии. № означает № каждого продукта распада.
«н/о» означает «не определено».
Область противоиона в каждом образце соли исключена из расчетов.
ССЫЛОЧНЫЙ ПРИМЕР 1
Общий способ получения солей 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, за исключением HCl-соли, HBr-соли, pTSA-соли и EDSA-соли:
Раствор 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты (примерно 20 мг) в EtOH, н-BuOH, AcOEt, MEK, CH3CN или THF (1,0 мл) оставляли уравновешиваться при повышенной температуре (65°C для EtOH, н-BuOH, EtOAc, MEK и CH3CN, 60°C для THF) в течение примерно пяти минут перед добавлением раствора противоиона. Добавляли раствор противоиона в MeOH, EtOH, i-PrOH, диоксане и/или воде (1,05 молярных эквивалентов), затем полученную смесь медленно охлаждали со скоростью 20°C/час до температуры окружающей среды и оставляли для уравновешивания на ночь. Любой осадок отделяли вакуумным фильтрованием и высушивали в течение ночи в вакууме при температуре окружающей среды.
ССЫЛОЧНЫЙ ПРИМЕР 1(a)
Получение бензолсульфонатной соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с бензолсульфоновой кислотой пытались получать общим способом с использованием указанного соединения в EtOH и раствора бензолсульфоновой кислоты в диоксане. Смесь была прозрачной после добавления противоиона и никакого твердого вещества не наблюдали после охлаждения. Раствор концентрировали на роторном испарителе, с получением масла, и не было получено никакой твердой соли.
При попытке использования CH3CN вместо EtOH для получения соли с бензолсульфоновой кислотой также было получено масло и не было получено никакой твердой соли.
ССЫЛОЧНЫЙ ПРИМЕР 1(b)
Получение п-толуолсульфонатной соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с п-толуолсульфоновой кислотой пытались получать общим способом с использованием указанного соединения в EtOH и раствора п-толуолсульфоновой кислоты в диоксане. Смесь была прозрачной после добавления противоиона и никакого твердого вещества не наблюдали после охлаждения. Раствор концентрировали на роторном испарителе, с получением масла, и не было получено никакой твердой соли.
Было получено только масло. При использовании общего способа с EtOH не было получено никакой кристаллической соли. Таким образом, способ, описанный в примере 4, является предпочтительным для получения п-толуолсульфонатной соли для практического применения в качестве фармацевтически приемлемой соли.
ССЫЛОЧНЫЙ ПРИМЕР 1(c)
Получение цинковой соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с ацетатом цинка пытались получать общим способом с использованием указанного соединения в EtOH и раствора ацетата цинка в воде. Смесь была прозрачной после добавления противоиона и никакого твердого вещества не наблюдали после охлаждения. Раствор концентрировали на роторном испарителе, с получением масла, и не было получено никакой твердой соли.
ССЫЛОЧНЫЙ ПРИМЕР 1(d)
Получение (+)-(1S)-камфор-10-сульфонатной соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с (+)-(1S)-камфор-10-сульфоновой кислотой пытались получать общим способом с использованием указанного соединения в EtOH и раствора (+)-(1S)-камфор-10-сульфоновой кислоты в EtOH. Было получено твердое вещество, картина РПД которого совпадала с таковой для свободной формы указанного соединения. Была получена только свободная форма.
При попытке использования AcOEt вместо EtOH для получения соли с (+)-(1S)-камфор-10-сульфоновой кислотой была получена только свободная форма.
ССЫЛОЧНЫЙ ПРИМЕР 1(e)
Получение нафталин-2-сульфонатной соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с нафталин-2-сульфоновой кислотой пытались получать общим способом с использованием указанного соединения в EtOH и раствора нафталин-2-сульфоновой кислоты в EtOH. Было получено твердое вещество, картина РПД которого совпадала с таковой для свободной формы указанного соединения. Была получена только свободная форма.
При попытке использования AcOEt вместо EtOH для получения соли с нафталин-2-сульфоновой кислотой была получена только свободная форма.
ССЫЛОЧНЫЙ ПРИМЕР 1(f)
Получение натриевой соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с ацетатом натрия пытались получать общим способом с использованием указанного соединения в CH3CN и раствора ацетата натрия в MeOH. Было получено твердое вещество, картина РПД которого совпадала с таковой для свободной формы указанного соединения. Была получена только свободная форма.
ССЫЛОЧНЫЙ ПРИМЕР 1(g)
Получение бетаиновой соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с бетаином пытались получать общим способом с использованием указанного соединения в MEK и раствора бетаина в MeOH. Было получено твердое вещество, картина РПД которого совпадала с таковой для свободной формы указанного соединения. Была получена только свободная форма.
ССЫЛОЧНЫЙ ПРИМЕР 1(h)
Получение диэтиламиновой соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с диэтиламином пытались получать общим способом с использованием указанного соединения в н-BuOH и раствора диэтиламина в EtOH. Было получено твердое вещество, картина РПД которого совпадала с таковой для свободной формы указанного соединения. Была получена только свободная форма.
При попытке использования CH3CN вместо н-BuOH для получения соли с диэтиламином была получена только свободная форма.
ССЫЛОЧНЫЙ ПРИМЕР 1(i)
Получение сульфатной соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с серной кислотой получали общим способом с использованием указанного соединения в н-BuOH и раствора серной кислоты в EtOH. Было получено соединение с необычной РПД картиной по сравнению с таковой для свободной формы указанного соединения, однако 1H-ЯМР анализ показал наличие 14,0 масс% н-BuOH, что соответствует моносольватам. Соединение не имеет практического применения в качестве фармацевтически приемлемой соли.
При использовании MEK вместо н-BuOH для получения соли с серной кислотой 1H-ЯМР анализ показал наличие 8,5 масс% EtOH, что соответствует моносольватам. Соединение не имеет практического применения в качестве фармацевтически приемлемой соли.
ССЫЛОЧНЫЙ ПРИМЕР 1(j)
Получение фосфатной соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с фосфорной кислотой получали общим способом с использованием указанного соединения в н-BuOH и раствора фосфорной кислоты в EtOH. Было получено соединение с необычной РПД картиной по сравнению с таковой для свободной формы указанного соединения, однако 1H-ЯМР анализ показал наличие 0,1 масс% EtOH и 0,3 масс% н-BuOH. Соединение не имеет практического применения в качестве фармацевтически приемлемой соли.
При использовании CH3CN вместо н-BuOH для получения соли с фосфорной кислотой 1H-ЯМР анализ показал наличие 0,2 масс% CH3CN. Соединение не имеет практического применения в качестве фармацевтически приемлемой соли.
ССЫЛОЧНЫЙ ПРИМЕР 1(k)
Получение натриевой соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с гидроксидом натрия получали общим способом с использованием указанного соединения в EtOH и раствора гидроксида натрия в смеси EtOH/вода. Было получено соединение с необычной РПД картиной по сравнению с таковой для свободной формы указанного соединения и его 1H-ЯМР спектры не показывали наличия существенного количества органического растворителя, однако в исследовании гигроскопичности наблюдали поглощение более 40 масс% воды через пять дней при 90%RH.
При использовании CH3CN вместо EtOH для получения соли с гидроксидом натрия было получено соединение с необычной РПД картиной по сравнению с таковой для свободной формы указанного соединения, его 1H-ЯМР спектры соответствовали структуре и не показывали наличия существенного количества органического растворителя, однако в исследовании гигроскопичности наблюдали поглощение более 40 масс% воды через пять дней при 90%RH.
Таким образом, натриевая соль не имеет практического применения в качестве фармацевтически приемлемой соли.
ССЫЛОЧНЫЙ ПРИМЕР 1(l)
Получение калиевой соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты
Соль с ацетатом калия получали общим способом с использованием указанного соединения в н-BuOH и раствора ацетата калия в MeOH. Было получено соединение с необычной РПД картиной по сравнению с таковой для свободной формы указанного соединения. 1H-ЯМР анализ соединения показал отсутствие существенного остаточного количества органического растворителя и наличие 0,8 эквивалента ацетата, свидетельствуя о возможном образовании двойной соли как с калием, так и с ацетатом.
При использовании MEK вместо н-BuOH для получения соли с ацетатом калия было получено соединение с необычной РПД картиной по сравнению с таковой для свободной формы указанного соединения. Его 1H-ЯМР анализ показал отсутствие существенного остаточного количества органического растворителя и наличие 0,8 эквивалента ацетата, свидетельствуя о возможном образовании двойной соли как с калием, так и с ацетатом.
В этом случае калиевая соль отсутствовала, однако наблюдали соль ацетат калия, которая не подходит для практического использования в качестве фармацевтически приемлемой соли.
ССЫЛОЧНЫЙ ПРИМЕР 2
Исследование гигроскопичности
Соли, за исключением HCl-соли, HBr-соли, pTSA-соли и EDSA-соли, которые включают соли, описанные в ССЫЛОЧНЫХ ПРИМЕРАХ 1(a)-1(l), не годились для исследований гигроскопичности в ПРИМЕРЕ 6.
Исследование стабильности в твердом состоянии
Соли, за исключением HCl-соли, HBr-соли, pTSA-соли и EDSA-соли, которые включают соли, описанные в ССЫЛОЧНЫХ ПРИМЕРАХ 1(a)-1(l), не годились для исследований стабильности в твердом состоянии в ПРИМЕРЕ 7.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМОРФНЫЕ ФОРМЫ | 2013 |
|
RU2659036C2 |
| ПОЛИМОРФНАЯ ФОРМА 4-{ [4-({ [4-(2,2,2-ТРИФТОРЭТОКСИ)-1,2-БЕНЗИЗОКСАЗОЛ-3-ИЛ]ОКСИ} МЕТИЛ)ПИПЕРИДИН-1-ИЛ]МЕТИЛ} -ТЕТРАГИДРО-2Н-ПИРАН-4-КАРБОНОВОЙ КИСЛОТЫ | 2012 |
|
RU2616978C2 |
| АГОНИСТ РЕЦЕПТОРА 5-НТ4 В КАЧЕСТВЕ ПРОКИНЕТИЧЕСКОГО АГЕНТА | 2012 |
|
RU2597766C2 |
| АГОНИСТ 5-HT4-РЕЦЕПТОРА ДЛЯ ГАСТРОПАРЕЗА | 2015 |
|
RU2708686C2 |
| N-(2-ЦИАНОГЕТЕРОЦИКЛИЛ)ПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗЫ | 2014 |
|
RU2669922C2 |
| ГЕМИНАЛЬНО-ЗАМЕЩЕННЫЕ ЦИАНОЭТИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ JANUS КИНАЗ | 2014 |
|
RU2664533C2 |
| ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ СПИРОПИПЕРИДИНИЛА И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2021 |
|
RU2839891C1 |
| ИНДАЗОЛЫ, БЕНЗИЗОКСАЗОЛЫ И БЕНЗИЗОТИАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЭСТРОГЕННЫХ СРЕДСТВ | 2005 |
|
RU2402536C2 |
| ЦИКЛОАЛКИЛНИТРИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗЫ | 2014 |
|
RU2655380C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОХИНОЛИНОНА, ИХ ПОЛУЧЕНИЕ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2012 |
|
RU2621037C2 |
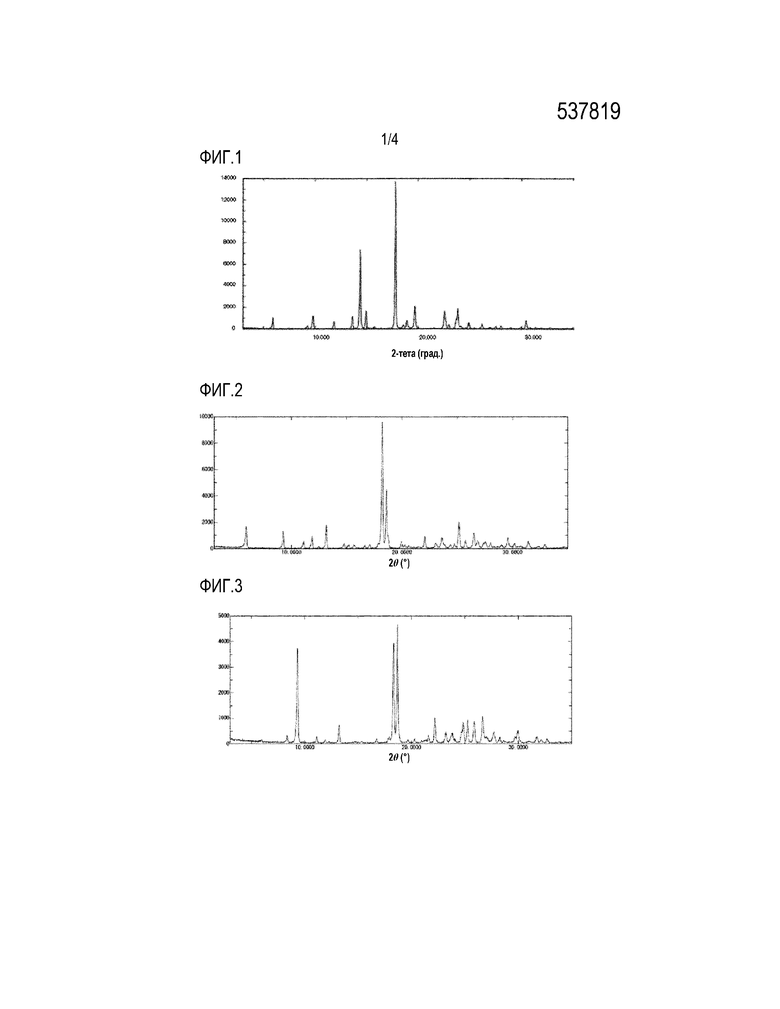
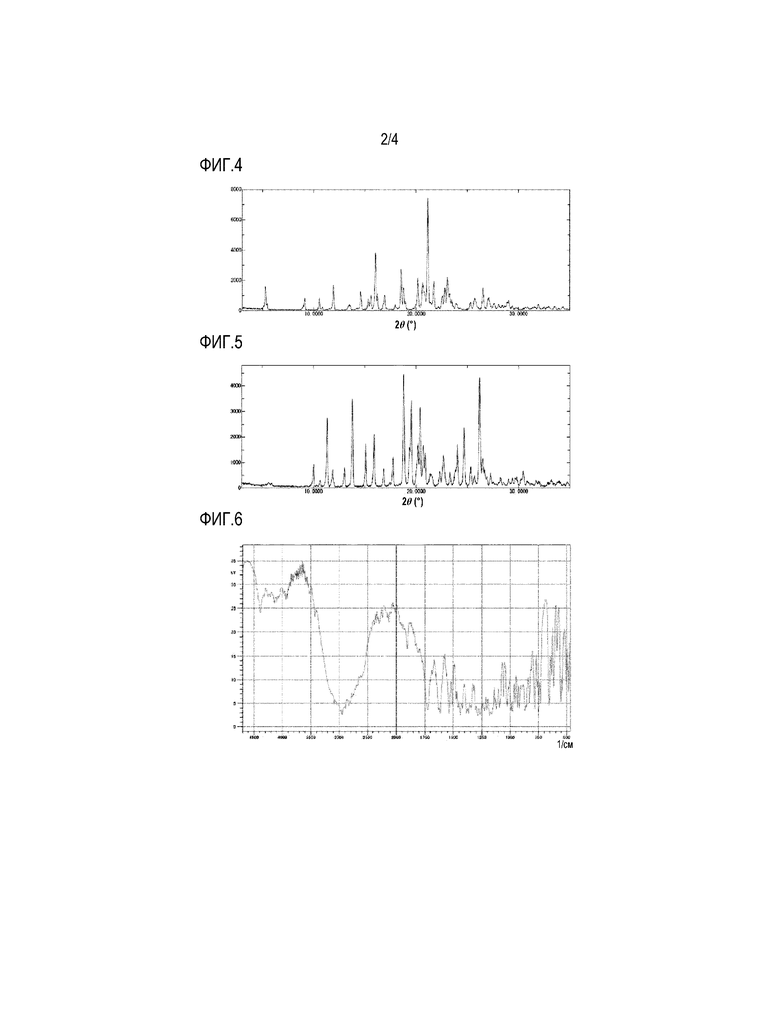
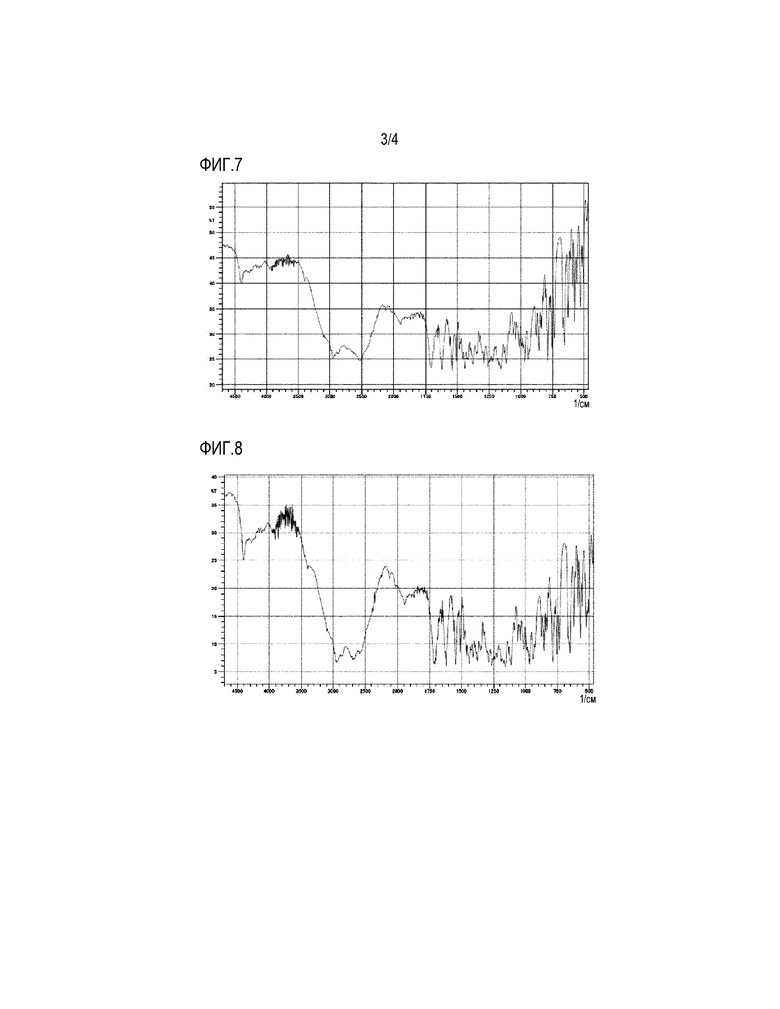
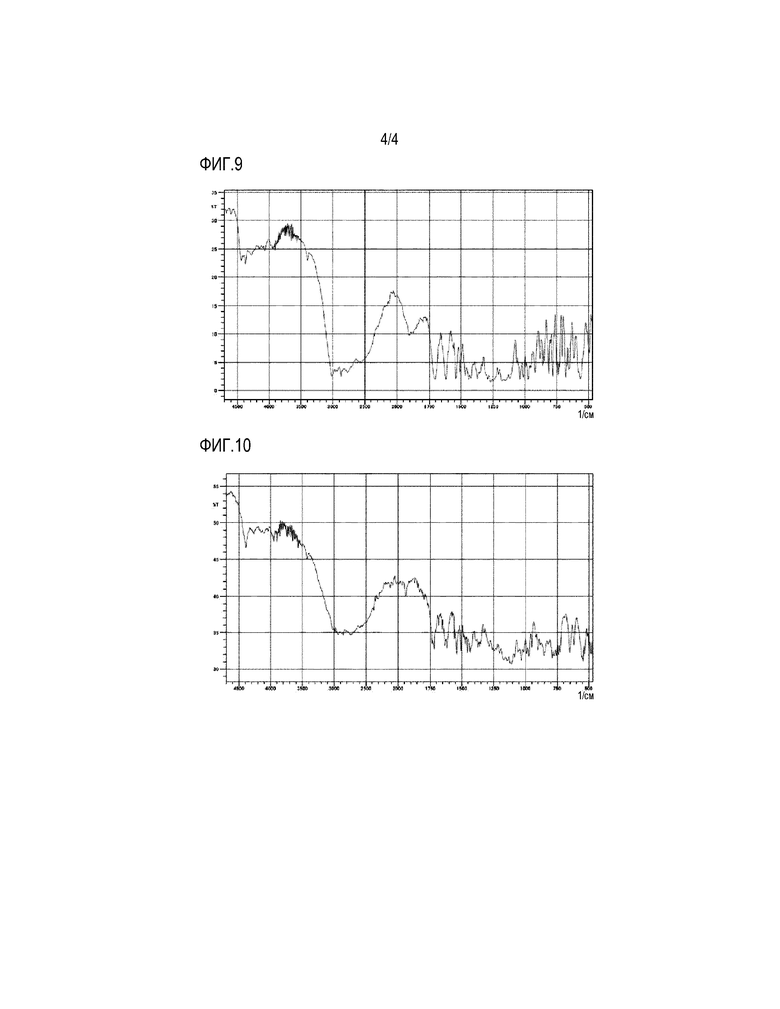
Изобретение относится к новым солям 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, а также к способам получения таких солевых форм, фармацевтическим композициям, содержащим их, их применению для лечения болезненных состояний, опосредованных активностью рецептора 5-HT4. Технический результат: получены новые солевые формы (HCl-соль, HBr-соль, п-толуолсульфонатная соль и этандисульфонатная соль), обладающие лучшей стабильностью и низкой гигроскопичностью. 15 н. и 5 з.п. ф-лы, 10 ил., 2 табл., 2 пр.
1. HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа-излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 5,9, 9,4, 11,1, 11,9, 13,2, 18,2, 18,6, 22,1, 25,2 и 26,5 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°).
2. HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4392, 3393, 2953, 2517, 1942, 1705, 1618, 1541, 1508, 1439, 1377, 1288, 1261, 1223, 1155, 1111, 1059, 1040, 1011, 966, 941, 878, 856, 787, 754, 733, 654, 625, 590, 573, 557, 529, 503 и 478 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1.
3. HCl-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в п. 1, дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 232°C, при этом температура имеет предел погрешности +/- 1°C.
4. HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа-излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 9,4, 13,3, 18,4, 18,7, 22,2, 23,2, 23,8, 24,8, 25,2, 25,9 и 26,6 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°).
5. HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4405, 3397, 2941, 2693, 2122, 1942, 1717, 1618, 1545, 1508, 1441, 1410, 1377, 1352, 1287, 1261, 1225, 1157, 1111, 1059, 1040, 1011, 968, 941, 874, 856, 787, 754, 735, 652, 621, 590, 571, 557, 525, 503 и 478 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1.
6. HBr-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в п. 4, дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 256°C, при этом температура имеет предел погрешности +/- 1°C.
7. pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа-излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 5,3, 11,9, 14,6, 16,0, 18,5, 18,7, 20,1, 20,6, 21,1, 22,7 и 23,0 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°).
8. pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4438, 4369, 3397, 3017, 2868, 2768, 1902, 1701, 1616, 1541, 1508, 1466, 1436, 1422, 1371, 1290, 1267, 1206, 1180, 1150, 1117, 1038, 1013, 972, 918, 881, 860, 847, 812, 783, 738, 708, 677, 650, 611, 565 и 492 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1.
9. pTSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в п. 7, дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 207°C, при этом температура имеет предел погрешности +/- 1°C.
10. EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся картиной рентгеновской порошковой дифракции (РПД), полученной при облучении Cu-K-альфа-излучением, которая имеет основные пики, выраженные в градусах 2-тета, при 11,3, 13,8, 15,1, 15,9, 18,8, 19,5, 20,2, 20,4, 20,7, 24,0, 24,7 и 26,2 (°), при этом каждый пик имеет предел погрешности +/- 0,2 (°).
11. EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, характеризующаяся спектром инфракрасного (ИК) излучения (диффузное отражение), имеющим полосы поглощения при 4388, 3948, 3422, 2741, 1937, 1717, 1616, 1539, 1506, 1435, 1373, 1285, 1244, 1204, 1169, 1146, 1107, 1030, 989, 972, 951, 901, 854, 789, 772, 756, 741, 729, 652, 615, 546, 532 и 490 см-1, при этом каждый пик имеет предел погрешности +/- 2 см-1.
12. EDSA-соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в п. 10, дополнительно характеризующаяся профилем дифференциальной сканирующей калориметрии (ДСК), имеющим эндотермическое событие при 246°C, при этом температура имеет предел погрешности +/- 1°C.
13. Фармацевтическая композиция, содержащая солевую форму 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанную в любом из пп. 1-12, в сочетании с одним или более фармацевтически приемлемыми эксципиентами.
14. Соль 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанная в любом из пп. 1-12, для применения в качестве лекарственного средства.
15. Применение солевой формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пп. 1-12, или фармацевтической композиции, описанной в п. 13, в изготовлении лекарственного средства для радикального, паллиативного или профилактического лечения болезненных состояний, опосредованных активностью рецептора 5-HT4.
16. Способ лечения болезненных состояний, опосредованных активностью рецептора 5-HT4, включающий введение эффективного количества солевой формы 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пп. 1-12, или фармацевтической композиции, описанной в п. 13, животному, включая человека, нуждающемуся в таком лечении.
17. Способ получения HCl-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пп. 1-3, включающий стадию воздействия на соединение HCl.
18. Способ получения HBr-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пп. 4-6, включающий стадию воздействия на соединение HBr.
19. Способ получения pTSA-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пп. 7-9, включающий стадию воздействия на соединение п-толуолсульфоновой кислотой.
20. Способ получения EDSA-соли 4-{[4-({[4-(2,2,2-трифторэтокси)-1,2-бензизоксазол-3-ил]окси}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты, описанной в любом из пп. 10-12, включающий стадию воздействия на соединение этандисульфоновой кислотой.
| WO 2012157288 A1, 22.11.2012 | |||
| WO 2006090224 A1, 31.08.2006 | |||
| Philip L | |||
| Gould, Salt selection for basic drugs, Iniernatronal Journal of Pharmaceutics, 33, 201-217, 1986 | |||
| RU 2005108668 A, 27.08.2005. |
Авторы
Даты
2019-02-12—Публикация
2015-05-20—Подача