Изобретения относятся к биотехнологии растений и могут быть использованы для воспроизводства редких и исчезающих видов растений в целях сохранения биологического разнообразия при клональном микроразмножении видов рода Rhododendron L.
Сегодня для решения задач сохранения и восстановления генофонда редких и исчезающих видов растений широкое применение получил метод культуры клеток и ткани in vitro. Этот метод позволяет массово размножать растения с перспективой их дальнейшей интродукции и реинтродукции.
Метод микроклонального размножения растений основан на активации развития существующих в растении меристем. Он позволяет получать генетически однородные растения-регенеранты в промышленных масштабах.
Исследования по микроклональному размножению некоторых видов рода рододендрон Rhododendron L. ведутся во многих странах мира, но получаемые результаты не всегда воспроизводимы и чаще всего противоречивы, так как индукция морфогенеза рододендрона in vitro зависит от многих факторов, наиболее важными из которых являются исходный генотип растения и соотношение концентраций фитогормонов в питательных средах.
Известна питательная среда для размножения видов рода Rhododendron L., содержащая макро- и микросоли по прописи Андерсона (Anderson, 1984), N6-(2-изопентил)аденин (2- iP) в концентрации 15.0 мг/л, индолилуксусную кислоту (ИУК) в концентрации 4.0 мг/л. (Е.М. Ветчинкина, И.В. Ширнина, С.Ю. Ширнин, О.И. Молканова. Сохранение редких видов растений в генетических коллекциях in vitro // Вестник Балтийского федерального университета им. И. Канта. 2012. Вып. 7. С. 109—118.)
Недостатком данной среды является низкое содержание минеральных солей (нитрата аммония, сульфата калия и др.), не обеспечивает получения высокого коэффициента размножения, а введение в питательную среду высоких доз цитокининов, в частности 2-iP, может приводить к усилению образования каллуса и развитию аномальных побегов.
Известна питательная среда, используемая Филипеня В.Л. для размножения гибридов рода Rhododendron L., содержащая макро- и микросоли по прописи WPM (Lloyd, G. and В.H. McCown, 1980), N6-(2-изопентил)аденин (2-iP) в концентрации 15.0 мг/л, индолилуксусную кислоту (ИУК) в концентрации 4.0 мг/л, сахарозу 30 г/л, агара 8 г/л. (Филипеня В.Л. Микроклональное размножение Rhododendron х hybrydum hort / В. Л. Филипеня, В. И. Горбацевич, Т. В. Антипова // Физиология и биохимия культурных растений. - 2009. - № 6. - С. 516–522).
К недостатку данной питательной среды следует отнести высокую концентрация фитогормонов, которая приводит к активному каллусообразованию и регенерации из каллусных клеток адвентивных побегов, большинство из которых было витрифицировано. При культивировании растений на указанной среде не удается достичь полноценного развития побегов. В конечном результате, это приводит к уменьшению количества посадочного материала, удлинению технологического цикла производства, и, как следствие, к возрастанию материальных и трудовых затрат.
Наиболее близким техническим решением по количеству существенных признаков, является питательная среда для микроклонирования (микроклонального размножения) листопадных видов рода Rhododendron, которая содержит половинную концентрацию макро- и микросолей WPM, N6-(2-изопентил)аденин (2-iP) в концентрации 2.0 мг/л, индолилуксусную кислоту (ИУК) в концентрации 0.5 мг/л, сахарозу в концентрации 30 г/л, инозитола в концентрации 100 мг/л, пиридоксина в концентрации 0.1 мг/л, тиамина в концентрации 0.1 мг/л, никотиновой кислоты в концентрации 0.5 мг/л (Патент РФ № 2619177, МПК A01H 4/00, A01H 5/00, опубл. 12.05.2017).
Недостатком данной среды является то, что обедненная по содержанию минеральных солей, витаминов и фитогормонов питательная среда для культивирования in vitro подходит не для всех видов рода Rhododendron L., кроме того, при этом наблюдается низкий коэффициент мультипликации. К недостатку данного технического решения следует также отнести длительность и многоэтапность приготовления питательной среды, вследствие чего, удлиняется процесс получения полноценных микропобегов.
Технической проблемой, поставленной при создании изобретений, является повышение коэффициента мультипликации и жизнеспособности получаемых микропобегов листопадных видов рода рододендрона и сокращение периода субкультивирования.
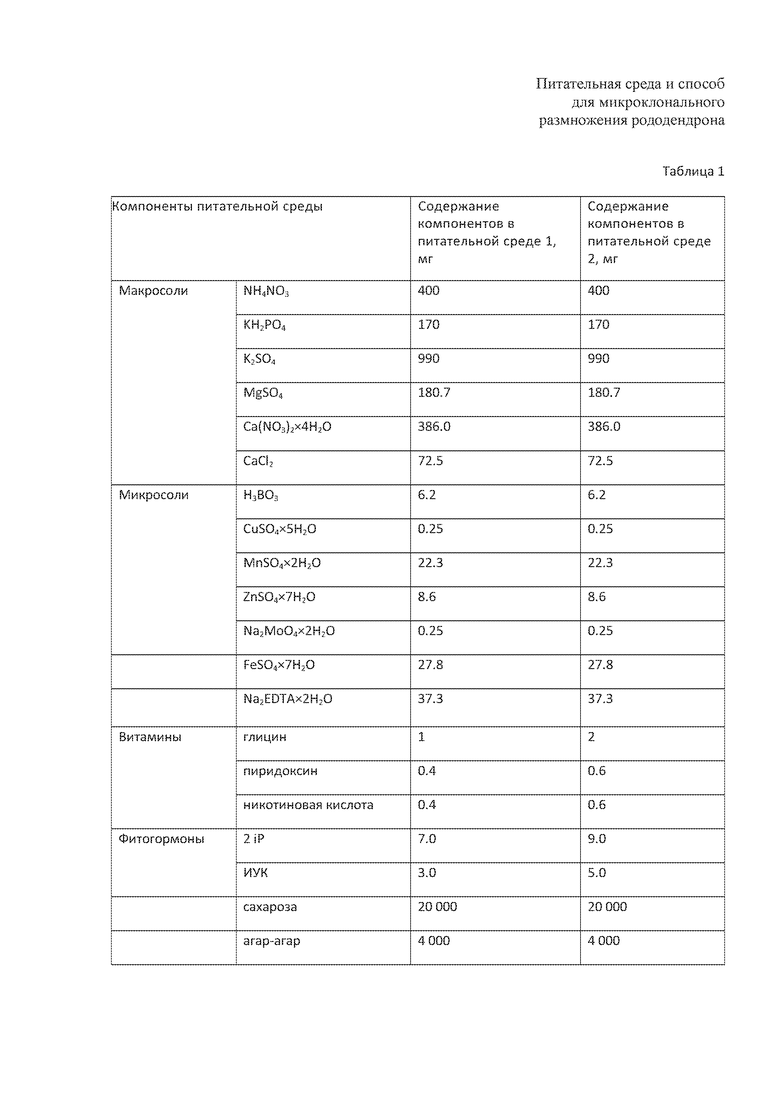
Указанная техническая проблема решается тем, что в известной питательной среде для микроклонирования листопадных видов рода Rhododendron, содержащей растворенные в дистиллированной воде аммоний нитрат, калий дигидрофосфат, магний сульфат, кальций хлорид, тетрагидрат нитрата кальция, калий сульфат, борную кислоту, дигидрат сульфата марганца, калия иодид, пентагидрат сульфата меди, дигидрат молибдата натрия, гептагидрат сульфата цинка, гептагидрат сульфата железа (II), 2-водная динатриевая соль этилендиаминтетрауксусной кислоты, пиридоксин, никотиновую кислоту, индолуксусную кислоту, N6-(2-изопентил)аденин и сахарозу, согласно изобретению, в питательную смесь дополнительно вводят глицин и агар-агар, при следующем соотношении ингредиентов, мг/л:
Заявляемая питательная среда позволяет получить побеги различных видов рододендрона, в частности, Rh. sichotense Pojark., Rh. dauricum L., Rh. japonicum (A. Gray) Suring, Rh luteum Sweet., Rh. viscosum (L.) Torr.
Введение в питательную среду такой аминокислоты, как глицин в заявленных количествах, позволяет повысить стрессоустойчивость микрорастений при культивировании, что, в конечном результате, повышает коэффициент мильтипликации и жизнеспособность получаемых микропобегов. Однако введение глицина в концентрации менее 1,0 мг/л практически не влияет на рост и развитие микропробегов in vitro; а повышение концентрации более 2,0 мг/л может вызывать угнетение роста и развития микрорастений.
Использование содержания полных концентраций минеральных солей по прописи WPM позволяет улучшить рост и развитие эксплантов, получить нормально сформированные корнесобственные микрорастения.
Введение в питательную среду цитокинона 2-iP в диапазоне 7.0-9.0 мг/л приводит к образованию множественных микропобегов рододендрона in vitro и позволяет увеличить коэффициент мультипликации посредством активации существующих меристем без ущерба качеству регенерантов. Использование 2-iP в концентрации более 9.0 мг/л может спровоцировать витрификацию микропобегов с низким коэффициентом мильтипликации. Также, в связи с высокой стоимостью этого цитокинина, увеличивается и себестоимость конечного продукта. При снижении концентрации менее 7,0 мг/л не наблюдается мультипликации микропобегов у данных видов рододендрона.
Введение в питательную среду регулятора роста ИУК в диапазоне 3.0-5.0 мг/л позволяет поддерживать рост клетки растяжением и инициировать образование адвентивных почек. Увеличение концентрации ИУК более 5.0 мг/л приводит к обводнению микропобегов и может приводить к чрезмерному вытягиванию междоузлий микрорастений, а использование ИУК в концентрации менее 3.0 г/л не обеспечивает получение полноценных микропобегов листопадных видов рода рододендрона.
Добавление в состав среды 4000 мг/л агар-агара придает питательной среде желеобразное состояние. В таком виде питательная среда выдерживает на своей поверхности растения и не препятствует свободному передвижению питательных веществ к поглощающим зонам, т.е. улучшает рост и развитие эксплантов.
Указанная техническая проблема решается также микроклонированием листопадных видов рододендронов на выше указанной питательной среде методом, предлагаемым заявителем.
Известен способ культивирования рододендрона in vitro, включающий приготовление питательной среды путем смешивания в нестерильных условиях необходимых количеств макро-, микроэлементов, хелата железа, инозитола, доведение объема питательной среды дистиллированной водой до 1 л, рН 4.2-4.5. В колбы добавляются навески агара. Среда разливается по колбам и автоклавируется. В остывшую до 55°С среду в ламинар-боксе добавляются стерильные растворы витаминов, регуляторов роста. Полученный раствор разливается по стерильным культуральным сосудам. В сосуды для культивирования помещаются экспланты и культивируются в стерильных условиях. Через 3 недели производится срезка побегов для последующего укоренения, а оставшиеся нижние части растений пересаживаются на свежую питательную среду (Патент РФ № 2619177, МПК A01H 4/00, A01H 5/00, опубл. 12.05.2017).
Недостатком данного способ культивирования рододендрона является поэтапное добавление компонентов при приготовлении питательной среды до и после автоклавирования, что в свою очередь приводит не только к удлинению технологического цикла производства, но может также привести к снижению коэффициента мильтипликации и к возрастанию материальных и трудовых затрат. Кроме того, культивирование рододендрона ведется в два этапа: 1) первоначально культивирование на питательной среде в течение 3 недель; 2) изъятие эксплантов и помещение их для дальнейшего культивирования на свежую питательную среду. После переноса таких растений на свежую питательную среду им требуется определенное время, чтобы выйти из состояния покоя, что приводит к замедлению процесса размножения. В конечном результате, это отрицательно сказывается на жизнеспособности получаемых микропобегов листопадных видов рода рододендрона.
Наиболее близким техническим решением к заявляемому является способ микроклонального размножения листопадных видов рода Rhododendron, включающий стерилизацию первичных эксплантов, которую проводят последовательным погружением растительного материала на 1 ч в 0.4 %-й раствор фунгицида Дитан М-45 с добавлением 0.01 % Tween 20 и на 30 мин — в 8 %-й раствор Са(СlO)2 с добавлением 0.01 % Tween 20. После стерилизации эксплантаты промываются трижды (по 5 мин) стерильной дистиллированной водой и помещаются на среду WPM для культивирования (инициации асептической культуры). Длительность первого субкультивирования составляла 3 мес., последующих – 8 недель. Длительность субкультивирования на второй питательной среде для пролиферации составила 8 недель (Филипеня В.Л., Горбацевич В.И., Антипова Т.В. Микроклональное размножение Rhododendron×Hybrydum Hort // Физиол. и биохим. культ. раст. 2009. Т. 41 (6). С. 516-522.)
К недостатком данного способа следует отнести:
- длительную и многоэтапную стерилизацию, которая может приводить к ожогу почек первичного экспланта, вследствие чего, значительно снижается жизнеспособность получаемых микропобегов листопадных видов рода рододендрон и уменьшается коэффициент мультипликации;
- использование нескольких питательных сред для получения микропобегов рододендрона с периодом субкультивирования до 8 недель на каждой среде не только приводит к удлинению технологического цикла производства.
Указанная техническая проблема решается методом микроклонального размножения рододендрона, включающим стерилизацию первичных эксплантов, в качестве которых используют черенки растущих побегов с 1-2 пазушными почками, стерилизацию питательной среды и культивирование, отличающийся тем, что стерилизацию ведут последовательной обработкой мыльно-щелочным раствором в течение 15 мин., 0.1 – 0.2 %-м раствором диацида в течение 3 – 5 мин. с трехкратным отмыванием стерильной дистиллированной водой, после чего эксплант помещают на стерильную питательную среду и культивируют в течение 3-5 недель, при этом в качестве стерильной питательной среды используют питательную среду по п. 1.
Использование для стерилизации эксплантов 0.1 – 0.2 % раствора диацида обеспечивает качественную поверхностную стерилизацию даже сильно инфицированного материала и, соответственно, приводит к получению качественных полноценно развитых микропобегов. Стерилизация первичных эксплантов диацидом в концентрации раствора менее 0.1% является мало эффективной и приводит к получению некачественного посадочного материала или полному его инфицированию и гибели эксплантов. Стерилизация раствором диацида в концентрации раствора более 0.2 % приводит к ожогу и некрозу почек на первичном экспланте.
Использование для культивирования предлагаемой питательной среды, по сравнению с прототипом, позволило отказаться от использования нескольких питательных сред для инициации и пролиферации, что, в конечном результате, не только позволило достичь заявленного технического результата по повышению коэффициента мультипликации и жизнеспособности получаемых микропобегов листопадных видов рододендрона, но и значительно сократить процесс микроклонирования с пяти этапов до трех, что ведет к снижению материальных и трудовых затрат.
Субкультивирование менее трех недель не позволяет получить достаточного количества полноценно развитых микропобегов, в то время как субкультивирование более пяти недель приводит к обеднению питательной среды и, следовательно, к замедлению роста микропобегов, их старению и некрозу. Вследствие этого не удается достичь достаточно высокого коэффициента мультипликации и происходит удлинение технологического цикла производства.
Использование заявленной питательной среды позволило снизить срок субкультивирования до 3 – 5 недель, что приводит к скорейшему переходу к этапу мультипликации побегов. Это приводит к повышению коэффициента мильтипликации и увеличению выхода посадочного материала, сокращению технологического цикла производства, и, следовательно, к снижению материальных и трудовых затрат.
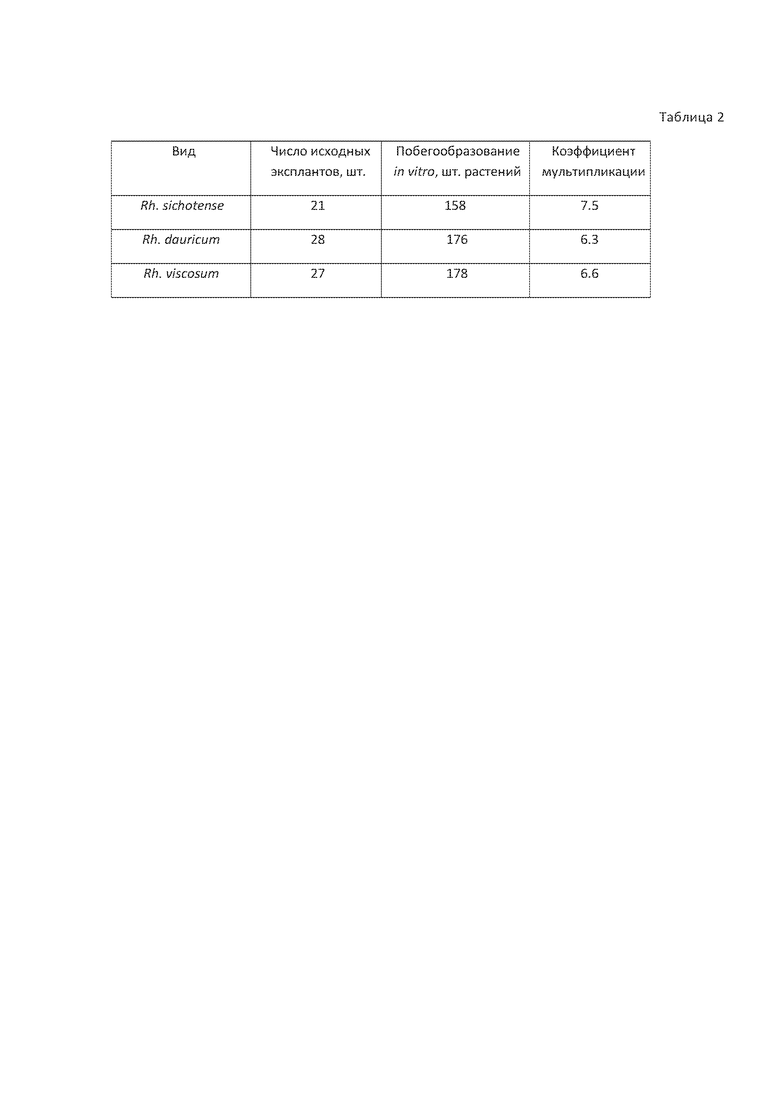
Изобретения демонстрируются следующими таблицами: табл. 1 - состав питательных сред, табл. 2 - выход посадочного материала при микроклонировании листопадных видов рода Rhododendron.
Заявленные изобретения осуществляются следующим образом.
Пример 1. Питательная среда 1 (содержание компонентов приведены в таблице 1) готовится следующим образом:
для приготовления 1 литра питательной среды в первый мерный стакан наливают 50 мл маточного раствора, содержащего макросоли по прописи WPM: аммоний нитрат, калий дигидрофосфат, сульфат магния, кальций хлорид, тетрагидрат нитрата кальция, калия сульфат и 5 мл маточного раствора, содержащего микросоли по прописи WPM: борная кислота, дигидрат сульфата марганца, пентагидрат сульфата меди, дигидрат молибдата натрия, гептагидрат сульфата цинка. Затем добавляют гептагидрат сульфата железа (II), 2-водную динатриевую соль этилендиаминтетрауксусной кислоты, витамины: глицин, пиридоксин и никотиновую кислоту; фитогормоны: 2-iP и ИУК, все перемешивают. В отдельном мерном стакане смешивают навеску агар-агара с 500 мл дистиллированной воды и нагревают до полного его растворения. В другом мерном стакане растворяют сахарозу при перемешивании. Подготовленные растворы сахарозы и агар-агара вносят в первый мерный стакан и доводят общий объем до литра дистиллированной водой, рН питательной среды доводят до 4.6-4.8.
Подготовленную питательную среду разливают по пробиркам, автоклавируют при 0.8 атм 20 мин. После автоклавирования питательной среде дают остыть и отстояться 1-2 дня. Перед посадкой проводят стерилизацию первичных эксплантов – побегов с 1–2 пазушными почками рододендрона сихотинского (Rh. sichotense) последовательной обработкой мыльно-щелочным раствором в течение 15 мин., 0.2 % раствором диацида в течение 3 мин. с трехкратным отмыванием стерильной дистиллированной водой, после чего эксплант помещают вертикально на питательную среду 1. Культивируют в течение 3 недель при 25 ± 1 °С под лампами дневного света и 16-часовом фотопериоде, при 60 %-й относительной влажности воздуха.
Результаты культивирования представлены в таблице 2.
Пример 2.
Приготовление питательной среды 2 проводят аналогично примеру 1. Содержание питательных веществ приведено в таблице 1.
Подготовленную питательную среду разливают по пробиркам и автоклавируют при 0.8 атм 20 мин. После автоклавирования питательной среде дают остыть и отстояться 1-2 дня. Перед посадкой проводят стерилизацию первичных эксплантов – побегов с 1–2 пазушными почками рододендрона даурского (Rh. dauricum) последовательной обработкой мыльно-щелочным раствором в течение 15 мин., 0.1 % раствором диацида в течение 5 мин. с трехкратным отмыванием стерильной дистиллированной водой, после чего их помещают вертикально на питательную среду 1. Культивируют в течении 5 недель при 25 ± 1 °С под лампами дневного света и 16-часовом фотопериоде, при 60 %-й относительной влажности воздуха.
Результаты культивирования представлены в таблице 2.
Пример 3. Культивирование рододендрона клейкого (Rh. viscosum) ведут аналогично примеру 1.
Результаты культивирования представлены в таблице 2. При условии, что коэффициент мультипликации – кратность увеличения объема растительного материала за один месячный пассаж (Шестибратов К.А., Мирошников А.И. Перспективы использования технологии клонального микроразмножения в лесном хозяйстве для массового производства посадочного материала ценных генотипов древесных растений. Журнал Интеграл, № 1(33), январь - февраль 2007).
Как видно из данных представленной таблицы 2 заявленные изобретения позволяют достичь заявленного технического результата – значительно повысить коэффициент мультипликации по сравнению с прототипом, до 7.5, и снизить период субкультивирования до 3–5 недель, обеспечивая при этом получение жизнеспособных микрорастений листопадных видов рододендронов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ микроклонального размножения кирказона маньчжурского (Aristolochia manshuriensis Kom.) | 2023 |
|
RU2807740C1 |
| Питательная среда для микроклонального размножения аралии континентальной Aralia continentalis Kitag | 2020 |
|
RU2751913C1 |
| Способ повышения эффективности клонального микроразмножения вечнозеленых сортов Рододендрона | 2020 |
|
RU2759451C1 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ И ПОЛУЧЕНИЯ ПОСАДОЧНОГО МАТЕРИАЛА ВЕЙГЕЛЫ ПРИЯТНОЙ (WEIGELA SUAVIS (КОМ.) L.H.BAILEY) И ВЕЙГЕЛЫ ЦВЕТУЩЕЙ "ВАРИЕГАТА" (WEIGELA FLORIDA "VARIEGATA" BUNGE A. DC.) | 2016 |
|
RU2634431C1 |
| Способ микроклонального размножения абрикоса | 1988 |
|
SU1664201A1 |
| Способ микроклонального размножения гибридов осины | 1988 |
|
SU1581741A1 |
| Способ повышения эффективности культивирования in vitro Березы повислой, Лимонника китайского, Рододендрона и Сирени | 2015 |
|
RU2619177C1 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ КАРТОФЕЛЯ IN VITRO СОРТА КАРТОФЕЛЯ АЛЕНА | 2016 |
|
RU2637361C1 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ КАРТОФЕЛЯ IN VITRO СОРТА ХОЗЯЮШКА | 2022 |
|
RU2789460C1 |
| Способ клонального микроразмножения тополя корейского (Populus koreana Render) | 2019 |
|
RU2704839C1 |
Изобретения относятся к области биотехнологии. Изобретение представляет собой питательную среду, содержащую макро- и микросоли, готовящуюся по прописи WPM, но с дополнительным введением глицина и агар-агара, а также отличным содержанием микро- и макрокомпонентов, N6-(2-изопентил)аденина и индолилуксусной кислоты. Кроме того, предлагаемая питательная среда привела к разработке нового способа микроклонального размножения рододендрона, включающего стерилизацию первичных эксплантов, в качестве которых используют черенки растущих побегов с 1-2 пазушными почками, стерилизацию питательной среды и культивирование, при этом стерилизацию ведут последовательной обработкой мыльно-щелочным раствором в течение 15 мин, 0.1 – 0.2%-ным раствором диацида в течение 3 – 5 мин с трехкратным отмыванием стерильной дистиллированной водой, после чего эксплант помещают на стерильную питательную среду и культивируют в течение 3-5 недель. Заявленные изобретения позволяют значительно повысить коэффициент мультипликации по сравнению с прототипом, снизить период субкультивирования до 3–5 недель, обеспечивая при этом получение жизнеспособных микрорастений листопадных видов рододендронов. 2 н.п. ф-лы, 2 табл.
1. Питательная среда для микроклонального размножения листопадных видов рода Rhododendron, содержащая растворенные в дистиллированной воде аммоний нитрат, калий дигидрофосфат, сульфат магния, кальций хлорид, тетрагидрат нитрата кальция, калий сульфат, борную кислоту, дигидрат сульфата марганца, калий иодид, пентагидрат сульфата меди, дигидрат молибдата натрия, гептагидрат сульфата цинка, гептагидрат сульфата железа (II), 2-водную динатриевую соль этилендиаминтетрауксусной кислоты, пиридоксин, никотиновую кислоту, индолуксусную кислоту, N6-(2-изопентил)аденин и сахарозу, отличающаяся тем, что питательная смесь дополнительно содержит глицин и агар-агар, при следующем соотношении ингредиентов, мг/л:
2. Способ микроклонального размножения листопадных видов рода рододендрона, включающий стерилизацию первичных эксплантов, в качестве которых используют черенки растущих побегов с 1–2 пазушными почками, стерилизацию питательной среды и культивирование, отличающийся тем, что стеризизацию первичных эксплантов ведут последовательной обработкой мыльно-щелочным раствором в течение 15 мин, 0.1 – 0.2%-ном раствором диацида в течение 3 – 5 мин с трехкратным отмыванием стерильной дистиллированной водой, после чего эксплант помещают на стерильную питательную среду и культивируют в течение 3-5 недель, при этом в качестве стерильной питательной среды используют питательную среду по п. 1.
| ФИЛИПЕНЯ В.Л | |||
| и др | |||
| Микроклональное размножение Rhododendron Hybrydum hort, Физиология и биохимия кудьтурных растений, 2009, т.41, N 6, с.516-522 | |||
| GREGORY LLOYD et al | |||
| Commercially-feasible micropropagation of Mountain laurel, Kalmia latifolia, by use of shoot-tip culture, The international plant propagators society, Combined Proceedings, v | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Способ повышения эффективности культивирования in vitro Березы повислой, Лимонника китайского, Рододендрона и Сирени | 2015 |
|
RU2619177C1 |
| КУТАС Е.Н | |||
| и др | |||
| Влияние стерилизующих соединений на выход жизнеспособных эксплантов рододендронов (Rhododendron L.) при введении в культуру in vitro, BECЦI НАЦЫЯНАЛЬНАЙ АКАДЭМII НАВУК БЕЛАРУСI СЕРЫЯ БIЯЛАГIЧНЫХ НАВУК, N2, 2015, с.13-17. | |||
Авторы
Даты
2019-02-13—Публикация
2018-06-07—Подача