Изобретение относится к биотехнологии растений и может быть использовано для воспроизводства редких и исчезающих видов растений в целях сохранения биологического разнообразия, в частности, при клональном микроразмножении аралии континентальной Aralia continentalis Kitag.
Аралия континентальная (Aralia continentalis Kitag.) - многолетнее травянистое растение; представитель рода Аралия семейства Аралиевые. Естественный ареал - Дальний Восток. Уязвимый вид на границе ареала. Вид внесен в Красные книги СССР (1975), РСФСР (1988), Российской Федерации (2008), Приморского края (2002) и Приморского края (2008).
Учеными многих стран, и в частности Кореи, доказано, что аралия континентальная оказывает стимулирующее иммунную систему, защитное и противовоспалительное действие на человеческий организм (Anti-inflammatory effects of the combined extracts of Achyranthes japonica nakai and Aralia continentalis kitagawa in vitro and in vivo / Young Min Woo, Ok Ju Kim, Eun Sol Jo, Su Jin Kim, Young-Ho Lee, Mee Young Ahn, Sang-Hyeon Lee, Jong-Myung Ha, Andre Kim / J Data in brief 25, 2019. -104088. - P.1-7).
В странах Восточной Азии аралию континентальную специально культивируют и используют при заболеваниях кишечника, печени, мочевого пузыря, она обладает спазмолитическим действием и улучшает свертываемость крови. Спиртовая настойка корней используется при лечении радикулита. В России лекарственные свойства Аралии континентальной почти не изучались. Показано, что настойка корней оказывает более сильное возбуждающее действие, чем настойка женьшеня. Кумарины, содержащиеся в ней, проявляют противоопухолевую активность (Журавлев Ю.Н., Коляда А. С. Araliaceae: женьшень и другие. Владивосток: Дальнаука, 1996. 280 с.). Также аралия континентальная обладает декоративными свойствами и может использоваться в зеленом строительстве.
В связи с активным использованием аралии континентальной в традиционной народной медицине, необходим поиск путей для сохранения и восстановления данного вида в естественных условиях произрастания. Одним из таких путей является клональное микроразмножение на питательных средах.
Этим методом можно получать генетически однородные растения-регенеранты в промышленных масштабах с перспективой их дальнейшей интродукции и реинтродукции. Лучшими эксплантами для клонального размножения видов растений являются апексы и пазушные почки стебля, так как они более устойчивы к генетическим изменениям, чем дифференцированные ткани, способные образовывать адвентивные почки (Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. - М.: ФБК-ПРЕСС, 1999. - 160 с). В литературе данных о питательных средах по клональному микроразмножению Aralia continentalis нами не обнаружено.
Известна питательная среда для размножения видов семействам Araliаceae (Eleuterococcus senticosus Maxim. и E. Sessiliflorus (Rupr. & Maxim.) S.Y.Hu.) содержащая макро- и микросоли по прописи MS (Murashige T. and Skoog F. A revised medium for rapid growth and bio-assays with tobacco tissue cultures // Physiologia Plantarum. 1962. Vol. 15. P. 473-497), 6-бензиламинопурин (6-БАП) в концентрации 1.5 мг/л и индолилуксусную кислоту (ИУК) в концентрации 0.2 мг/л. (Клональное микроразмножение некоторых лекарственных растений из семейства Schizandraceae и Araliaceae в культуре in vitro / Э. В. Марамохин // Ростовский научный журнал, 2017. - Вып.7. - С. 179-187.)
Недостатком данной среды является то, что питательная среда с содержанием фитогормонов в большей или меньшей мере усиливает генетическую (в том числе и хромосомную) изменчивость клеток растений, что является недопустимым при микроразмножении и при дальнейшем применении в лекарственных целях полученных растений-регенерантов.
Известна питательная среда, используемая Karim M.Z. для размножения Aralia elata Seem, содержащая макро- и микросоли по прописи BT (Chalupa, V. In vitro propagation of oak (Quercus robur L.) and linden (Tilia cordata Mill.). Biol. Plant, 1984, 26: 374-377) 6-бензиламинопурин (6-БАП) в концентрации 1.0 μM, кинетин (Кн) в концентрации 0.50 μM (M.Z. Karim, S. Yokota, M.M. Rahman, J. et all, Efficient Adventitious Shoot Regeneration from Root Explants of Aralia elata Seem. International Journal of Botany, 2007, 3: 390-393).
К недостатку данной питательной среды следует отнести содержание гормонов и образование каллуса (недифференцированной ткани) при культивировании первичных эксплантов с дальнейшим образованием побегов из него. Этот процесс сопровождается прохождением клеток первичного экспланта этапа дедифференциации с последующей вторичной дифференциацией. Это ведет к образованию сомаклональных вариаций и генетических изменений, что является недопустимым при микроклонировании и возможном дальнейшем применении полученных растений-регенерантов в лекарственных целях.
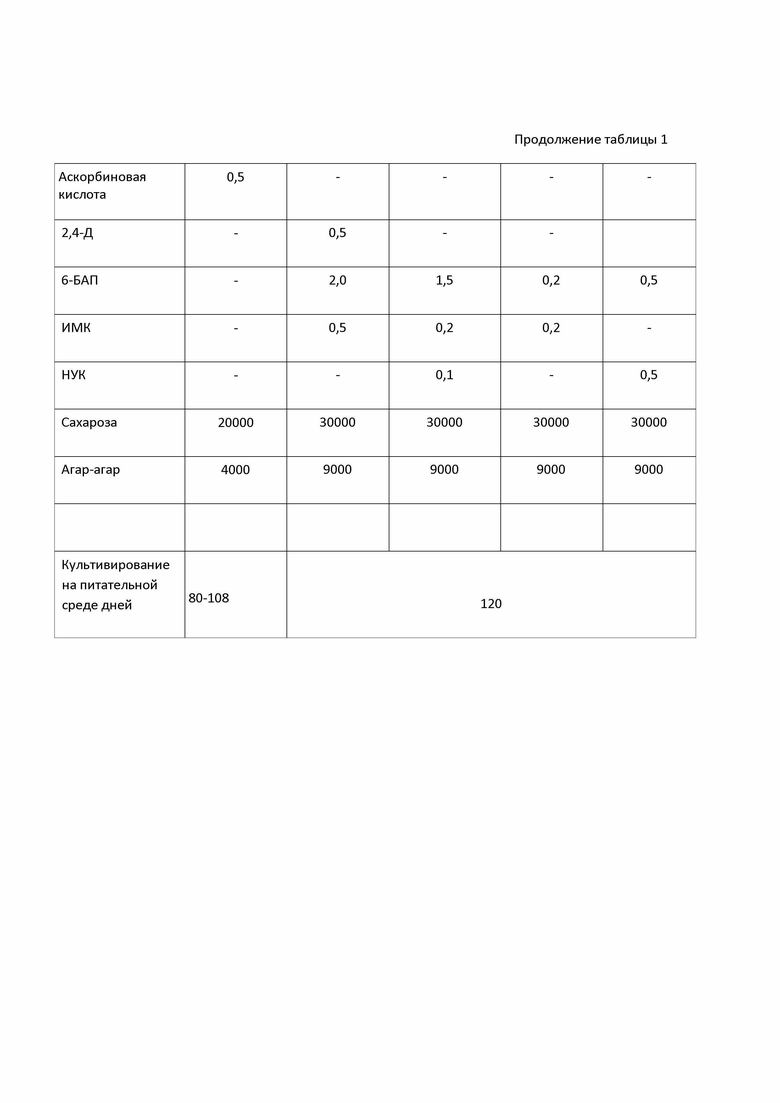
Наиболее близким техническим решением по микроклонированию А. сontinentalis Kitag. является работа Yang Zhen-Guo и Du Feng-Guo (Yang Zhen-Guo, Du Feng-Guo. Tissue Culture and Plantlet Regeneration of Aralia continentalis Kitag. Plant physiology commun, 2005, 41, (2): 194). Для получения готового целевого продукта авторы используют четыре варианта питательных сред. Первоначально используют среду для индукции каллусообразования. Культивирование на ней проводят в течение 40 дней, со сменой свежей питательной среды каждые 10 дней. Через 40 дней сформированный каллус с дифференцированными почками пересаживают на среду для размножения. Культивирование эксплантов на этой питательной среде ведут в течение 30 дней для увеличения числа почек в каллусе и роста побегов из почек. Затем переносят побеги на питатательную среду для интенсивного роста побега и размножения, а через 20 дней переносят на питатательную среду для укоренения. Состав используемых в прототипе сред приведен в таблице 1. Все среды, содержат макро- и микросоли по прописи MS с содержанием 2,4-дихлорфеноксиуксусную кислоту (2,4-Д) в концентрации 0.5 мг/л, 6-бензиламинопурин в концентрации 2.0 мг/л, 1.5 мг/л, 0.2 и 0.5 мг/л, индолил-З-масляную кислоту (ИМК) в концентрации 0.5 мг/л и 0.2 мг/л, 1-нафтилуксусную кислоту в концентрации 0.1 мг/л и 0.5 мг/л, сахарозы в концентрации 30 000 мг/л и агар-агара в концентрации 9000 мг/л.
Недостатком данной работы является использование разных питательных сред для индукции каллусогенеза и формирования адвентивных почек, роста побегов и укоренения микрорастений, вследствие чего удлиняется процесс получения полноценных микропобегов и возрастают материальные и трудовые затраты. Многовариантность используемых фитогормонов ведет к усложнению процесса получения растений-регенерантов аралии.
Более того, включение в состав сред фитогормонов способствует образованию каллуса, что ведет к образованию сомаклональных вариаций и генетических изменений. Это является недопустимым при микроклональном размножении, где целью является получение генетически однородного посадочного материала, которое можно использовать в качестве сырья для получения лекарственных препаратов.
Технической проблемой, поставленной при создании изобретения, является расширение ассортимента питательных сред, позволяющих сохранить генотип исходных растений и в дальнейшем использовать их как фармакологическое сырье, сокращение длительности полного цикла получения растений-регенерантов Aralia continentalis Kitag, и, как следствие, уменьшение материальных и трудовых затрат.
Указанная техническая проблема решается тем, что в известной питательной среде для микроклонирования аралии континентальной содержащей растворенные в дистиллированной воде соли по прописи MS: аммоний нитрат, калий нитрат, кальций хлорид, калий дигидрофосфат, магний сульфат, борную кислоту, дигидрат сульфата марганца, кобальт хлорид, пентагидрат сульфата меди, дигидрат молибдата натрия, гептагидрат сульфата цинка, калий иодид, гептагидрат сульфата железа (II), 2-водную динатриевую соль этилендиаминтетрауксусной кислоты, витамины пиридоксин и тиамин, а также сахарозу и агар, согласно изобретению, в питательную среду, содержащую половинную концентрацию растворенных в дистиллированной воде солей по прописи MS дополнительно вводят аскорбиновую кислоту, при следующем соотношении ингредиентов, мг/л:
Заявляемая питательная среда позволяет получить укорененные микрорастения Aralia continentalis Kitag в промышленных масштабах с перспективой их дальнейшей интродукции и реинтродукции. Использование единой питательной среды для полного цикла получения корнесобственных растений-регенерантов уменьшает длительность этого цикла и снижает материальные и трудовые затраты. От момента помещения экспланта (черенка с почкой) на питательную среду для индукции побегообразования, рост побегов, размножение микрорастений и укоренение происходит на одной питательной среде весь период культивирования.
Витамины группы В (тиамин, пиридоксин) являются коферментами, улучшают адаптацию тканей и их рост, увеличивают иммунитет растений, стимулируют биохимические реакции, что позволяет получать полноценные растения-регенеранты которые можно в дальнейшем использовать для получения фармокологических средств. Введение в питательную среду тиамина в заявляемом диапазоне усиливает рост и дифференциацию клеток растений. Однако экспериментально установлено, что введение тиамина в концентрации менее 0.4 мг/л практически не влияет на рост и развитие микропробегов in vitro, при повышении концентрации более 0.6 мг/л может происходить замедление роста и скручивание листьев у растений-регенерантов.
Введение в питательную среду витамина С (аскорбиновой кислоты) являющегося антиоксидантом и принимающего участие в процессах деления и фотосинтеза обеспечило получение полноценных растений-регенерантов с сохранением генотипа исходных растений. Вследствие чего, полученные растения могут быть использованы в качестве медицинского сырья. Введение в питательную среду аскорбиновой кислоты в концентрации менее 0.4 мг/л практически не влияет на рост и развитие микропробегов in vitro. Введение ее в концентрации более 0.6 мг/л нецелесообразно, т.к. при этом отмечалось угнетение ростовых процессов у микрорастений.
Использование содержания половинной концентрации минеральных солей по прописи MS позволяет уменьшить материальные трудозатраты при приготовлении питательной среды без ущерба качеству растений-регенерантов.
При введение агар-агара в концентрации 4000 мг/л в состав питательной среды приводит к образованию желеобразной консистенции раствора, не только способствует нормальному усвоению питательных веществ поглощающими зонами первичного экспланта или микрорастения, но и позволяет получать полноценные микрорастения. В конечном результате, длительность цикла получения корнесобственных растений-регенерантов сокращается. При увеличении концентрации агар-агара плотность питательной среды увеличивается, что приводит к затруднению поглощения питательных веществ и недостаточной влажности для микропобегов.
Присутствие в составе питательной среды сахарозы необходимо, поскольку у растений, выращиваемых in vitro в пробирочной культуре на искусственной питательной среде, лимитирован процесс фотосинтеза из-за недостатка углекислого газа, в связи с чем, они вынуждены потреблять сахара из культуральной среды. В условиях лимитирования фотосинтеза сахароза является незаменимым источником энергии и строительным материалом для образования новых клеток.
Экспериментально установлено, что снижение концентрации сахарозы до 20 г/л в составе питательной среды не только уменьшает материальные и трудозатраты, но и позволяет улучшить поглощение питательных веществ из среды клетками экспланта, в результате чего вырастают полноценные микрорастения, пригодные для получения фармокологических средств, а также сократить длительность цикла получения корнесобственных растений-регенерантов.
Предлагаемая питательная среда, не имеющая в своем составе фитогормонов (2,4-Д, 6-БАП, ИМК и НУК), позволяет получать микропобеги, и микрорастения, непосредственно из почек первичного экспланта, что позволяет уйти от этапа формирования каллуса и проявления сомаклональной и генетической изменчивости. Это, в конечном результате, позволит использовать выращенные растения в качестве фармакологического сырья. И, как следствие, ведет к сокращению материальных и трудовых затрат.
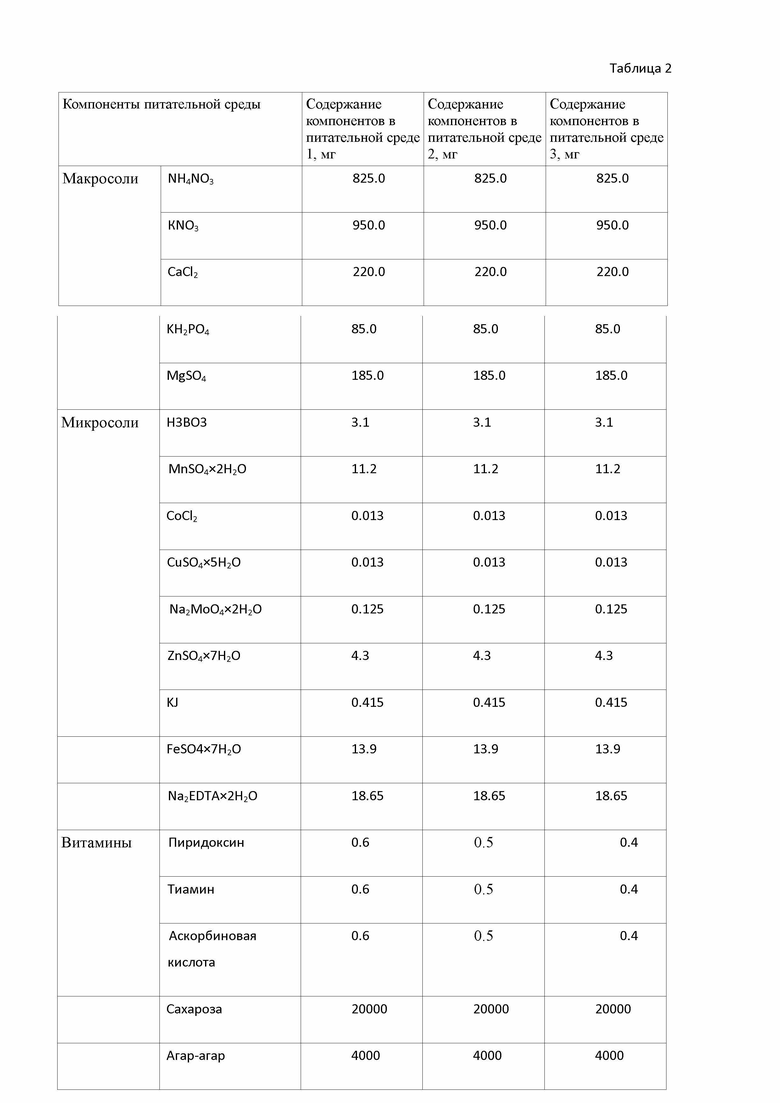
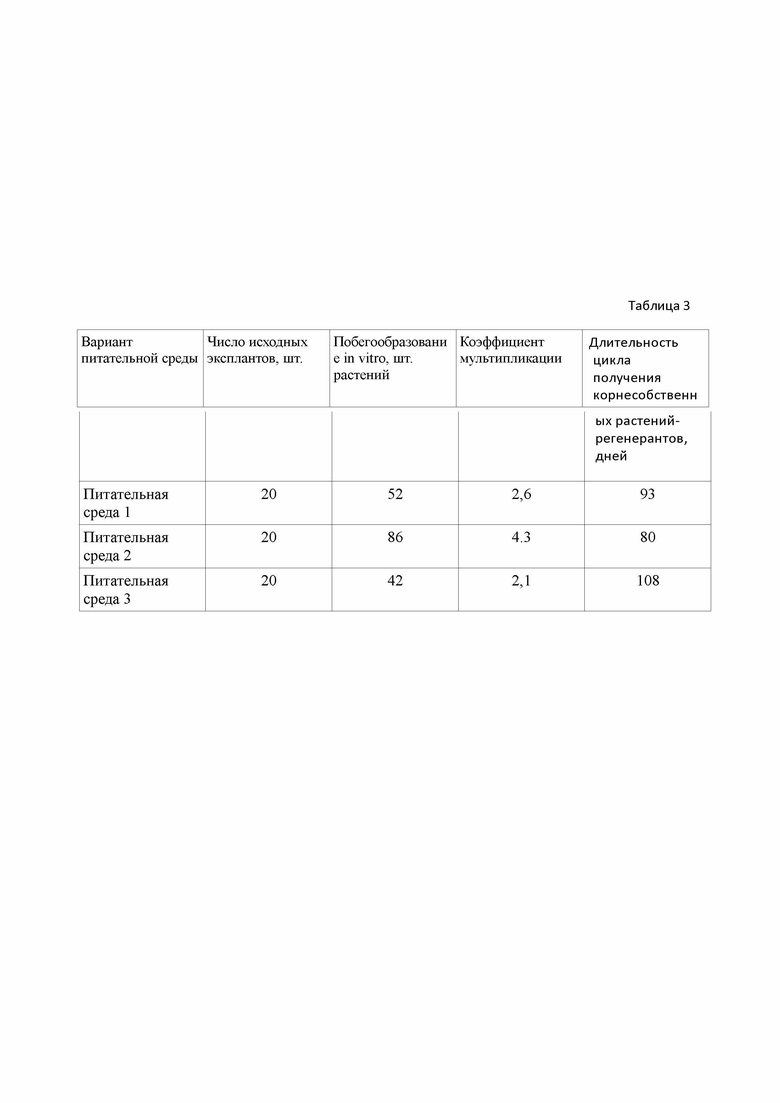
Изобретения демонстрируются следующими таблицами: В таблице 1. - приведен состав заявляемой питательной среды и состав питательных сред, используемых в прототипе; в табл. 2 представлен состав питательных сред, используемых в примерах осуществления изобретения; в табл. 3 - приведен выход посадочного материала при микроклонировании Aralia continentalis Kitag
Изобретение осуществляют следующим образом.
Пример 1. Питательная среда 1 (содержание компонентов приведены в таблице 2) готовится следующим образом:
для приготовления 1 литра питательной среды в первый мерный стакан наливают 25 мл маточного раствора, содержащего макросоли по прописи MS: аммоний нитрат, калий дигидрофосфат, сульфат магния, кальций хлорид, тетрагидрат нитрата кальция, калия сульфат и 2,5 мл маточного раствора, содержащего микросоли по прописи MS: борная кислота, дигидрат сульфата марганца, пентагидрат сульфата меди, дигидрат молибдата натрия, гептагидрат сульфата цинка. Затем добавляют гептагидрат сульфата железа (II), 2-водную динатриевую соль этилендиаминтетрауксусной кислоты, витамины: аскорбиновую кислоту, пиридоксин и тиамин все перемешивают.
В отдельном мерном стакане смешивают навеску агар-агара с 500 мл дистиллированной воды и нагревают до полного его растворения. В другом мерном стакане растворяют сахарозу при перемешивании. Подготовленные растворы сахарозы и агар-агара вносят в первый мерный стакан и доводят общий объем до литра дистиллированной водой, рН питательной среды доводят до 5.6-5.8.
Подготовленную питательную среду разливают по пробиркам, автоклавируют при 0.8 атм 20 мин. После автоклавирования питательной среде дают остыть и отстояться 1-2 дня. Перед посадкой проводят стерилизацию первичных эксплантов - побегов с 1-2 пазушными почками A. continentalis последовательной обработкой мыльно-щелочным раствором в течение 15 мин., 0.1 % раствором диацида в течение 3 мин. с трехкратным отмыванием стерильной дистиллированной водой, после чего эксплант помещают вертикально на питательную среду 1. Культивируют при 25 ± 1°С под лампами дневного света и 16-часовом фотопериоде, при 60 %-й относительной влажности воздуха.
Из представленных в таблице 3 результатов видно, что на предложенной питательной среде длительность периода для получении корнесобственных растений-регенерантов составляет 93 дня при коэффициенте размножения 2,6.
Пример 2.
Приготовление питательной среды 2 проводят аналогично примеру 1. Содержание питательных веществ приведено в таблице 2.
Как видно из таблицы 3, на разработанной среде отмечается увеличение побегообразования и, следовательно, коэффициента мультипликации при сокращении до 80 дней длительности цикла получении корнесобственных растений-регенерантов Aralia continentalis Kitag,
Пример 3.
Приготовление питательной среды 3 и культивирование аралии континентальной на ней ведут аналогично примеру 1. Результаты культивирования представлены в таблице 3. Предложенная среда характеризуется наименьшим коэффициентом размножения при самом длительном периоде получения корнесобственных растений-регенерантов.
При условии, что коэффициент мультипликации - кратность увеличения объема растительного материала за один месячный пассаж (Шестибратов К.А., Мирошников А.И. Перспективы использования технологии клонального микроразмножения в лесном хозяйстве для массового производства посадочного материала ценных генотипов древесных растений. Журнал Интеграл, № 1(33), январь - февраль 2007).
Как видно из данных, представленных в таблицы 3, заявленные изобретения позволяют достичь заявленного технического результата, расширить ассортимент питательных сред, позволяющих значительно сократить длительность цикла получения корнесобственных растений-регенерантов Aralia continentalis Kitag. с сохранением исходного генотипа, уменьшить материальные и трудовые затраты. Следует отметить, что изобретение позволяет получить коэффициент размножения 3-4 посредством активации верхушечных меристем первичного экспланта без ущерба качеству регенерантов, см. табл. 3.
Таким образом, результаты, приведенные заявителем подтверждают, что заявленная техническая проблема, поставленная при создании изобретения, решена. Предлагаемая питательная среда расширяет ассортимент питательных сред, позволяющих сохранить генотип исходных растений и, в дальнейшем, использовать их как фармакологическое сырье, обеспечивает сокращение длительности полного цикла получения растений-регенерантов Aralia continentalis Kitag, и, как следствие, уменьшение материальных и трудовых затрат.
Питательная среда для
микроклонального размножения
аралии континентальной
Таблица 1
на основе ½ MS
Питательная среда для
микроклонального размножения
аралии континентальной
Продолжение таблицы 1
Таблица 2
Таблица 3
| название | год | авторы | номер документа |
|---|---|---|---|
| Питательная среда для микроклонального размножения рододендрона и способ микроклонального размножения рододендрона | 2018 |
|
RU2679835C1 |
| Способ получения микрорастений лекарственного растения Stephania glabra (Roxb.) Miers | 2021 |
|
RU2757318C1 |
| Способ микроклонального размножения кирказона маньчжурского (Aristolochia manshuriensis Kom.) | 2023 |
|
RU2807740C1 |
| Способ клонального микроразмножения тополя корейского (Populus koreana Render) | 2019 |
|
RU2704839C1 |
| Способ микроклонального размножения in vitro микрорастений картофеля сорта СОЛНЕЧНЫЙ | 2023 |
|
RU2814473C1 |
| Оптимизированная питательная среда для укоренения побегов винограда в культуре in vitro, сорт "Надежда АЗОС" | 2020 |
|
RU2746067C1 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ КАРТОФЕЛЯ IN VITRO СОРТА ХОЗЯЮШКА | 2022 |
|
RU2789460C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ УКОРЕНЕНИЯ ПОБЕГОВ ВИНОГРАДА В КУЛЬТУРЕ IN VITRO | 2017 |
|
RU2676127C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ ЧЕРЕШНИ | 1996 |
|
RU2128430C1 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ КАРТОФЕЛЯ IN VITRO СОРТА КАРТОФЕЛЯ "ЕРМАК" | 2016 |
|
RU2632938C2 |


Изобретение относится к области биотехнологии. Заявляемая питательная среда содержит половинную концентрацию растворенных в дистиллированной воде солей по прописи MS: аммоний нитрат, калий нитрат, кальций хлорид, калий дигидрофосфат, магний сульфат, борную кислоту, дигидрат сульфата марганца, кобальт хлорид, пентагидрат сульфата меди, дигидрат молибдата натрия, гептагидрат сульфата цинка, калий иодид, гептагидрат сульфата железа (II), 2-водную динатриевую соль этилендиаминтетрауксусной кислоты, витамины пиридоксин и тиамин, а также сахарозу и агар. Кроме того, в неё дополнительно вводят аскорбиновую кислоту при следующем соотношении ингредиентов, мг/л: NH4NO3 825,0; КNО3 950,0; CaCl2 166,1; KH2PO4 85,0; MgSO4 90,35; H3BO3 3,1; MnSO4×2H2O 8,45; CoCl2 0,0125; CuSO4×5H2O 0,0125; Na2MoO4×2H2O 0,125; ZnSO4×7H2O 4,3; KI 0,415; FeSO4×7H2O 13,9; Na2EDTA×2H2O 18,63; пиридоксин 0,4-0,6; тиамин 0,4-0,6; аскорбиновая кислота 0,4-0,6; сахароза 20000; агар-агар 4000; дистиллированная вода - до 1 л. Предлагаемая питательная среда расширяет ассортимент питательных сред, позволяющих сохранить генотип исходных растений и в дальнейшем использовать их как фармакологическое сырье, обеспечивает сокращение длительности полного цикла получения растений-регенерантов Aralia continentalis Kitag и, как следствие, уменьшение материальных и трудовых затрат. 3 табл.
Питательная среда для микроклонирования аралии континентальной, содержащая растворенные в дистиллированной воде соли по прописи MS: аммоний нитрат, калий нитрат, кальций хлорид, калий дигидрофосфат, магний сульфат, борную кислоту, дигидрат сульфата марганца, кобальт хлорид, пентагидрат сульфата меди, дигидрат молибдата натрия, гептагидрат сульфата цинка, калий иодид, гептагидрат сульфата железа (II), 2-водную динатриевую соль этилендиаминтетрауксусной кислоты, витамины пиридоксин и тиамин, а также сахарозу и агар-агар, отличающаяся тем, что питательная смесь содержит половинную концентрацию растворенных в дистиллированной воде солей по прописи MS, а также в неё дополнительно вводят аскорбиновую кислоту при следующем содержании исходных ингредиентов, мг/л:
| YANG ZHEN-GOO, et al., Tissue Culture and Plantlet Regeneration of Aralia continentalis Kitag | |||
| Plant physiology commun, 2005, 41, (2): 194 | |||
| CHALUPA, V., In vitro propagation of oak (Quercus robur L.) and linden (Tilia cordata Mill.) | |||
| Biol | |||
| Plant, 1984, 26: 374-377 | |||
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ ПОДВОЕВ ЯБЛОНИ | 1996 |
|
RU2111652C1 |
Авторы
Даты
2021-07-20—Публикация
2020-11-16—Подача