Изобретение относится к ветеринарной микробиологии, в частности к лабораторной диагностике возбудителей инфекционных заболеваний, а именно к средствам диагностики инфекции у животных.
Также известно использование ПЦР для диагностики лептоспироза у сельскохозяйственных животных для этого проводили две амплификации: первая - с внешней парой праймеров (LepF и LepR), вторая - с внутренней (16LNF и 16LNR). Использовали универсальные праймеры, позволяющие определять участок генома, кодирующий 16S рРНК. Выявление продуктов реакции проводили методом горизонтального электрофореза в агарозном геле. Гели анализировали, используя ультрафиолетовый трансиллюминатор ( - 254 нм).
- 254 нм).
Исследуемые пробы считали отрицательными, если на электрофоре-граммах не было четких полос или полосы не соответствовали по размеру фрагменту в контрольной пробе (т.е. располагались на другом расстоянии от старта) (Викторова Е.В. Автореферат диссертации по ветеринарии на тему «Полимеразная цепная реакция при диагностике лептоспироза и изучение органотропности лептоспир у сельскохозяйственных животных», Москва, 2006 г.)
Недостатком известного технического решения является не достаточная чувствительность из-за проведения ПЦР в агарозном геле.
Наиболее близким аналогом является техническое решение (Инструкция по применению набора реагентов для выявления 16S РНК патогенных геновидов лептоспир в клиническом, аутопсийном и биологическом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс Leptospira-FL», Москва, 2018 г. - прототип) в котором использовали буфер для проведения полимеразной цепной реакции, смесь для ее проведения состоящая из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов специфичные для возбудителя лептоспироза и для внутреннего контрольного образца; смесь ферментов из ДНК полимеразы с антителами, ингибирующих активность фермента, TAQ POLYMERASE, внутренний контрольный образец, отрицательный контрольный образец, положительный контрольный образец,
Недостатком является увеличение трудозатрат, времени и использование дополнительных реагентов для процесса выделения РНК для получения кДНК.
Техническим результатом является уменьшение трудозатрат, времени и расходного материала при проведении ПЦР.
Технический результат достигается тем, что в тест-системе для выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных, включающем буфер для проведения полимеразной цепной реакции, смесь для ее проведения состоящая из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов специфичные для возбудителя лептоспироза (Leptospira spp.) и для внутреннего контрольного образца; смесь ферментов из ДНК полимеразы с антителами, ингибирующих активность фермента, TAQ POLYMERASE, внутренний контрольный образец, отрицательный контрольный образец, положительный контрольный образец, согласно изобретению для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома возбудителя лептоспироза (Leptospira spp. Lpts) и фрагмент генома бактериофага Т4 взятых в соотношении 1:1 со следующими нуклеотидными последовательностями:
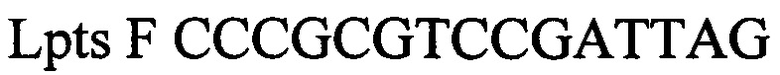 прямой праймер
прямой праймер
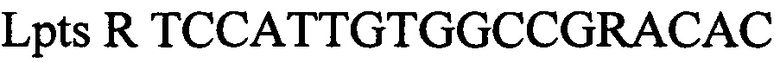 обратный праймер
обратный праймер
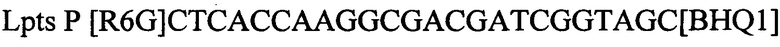 зонд
зонд
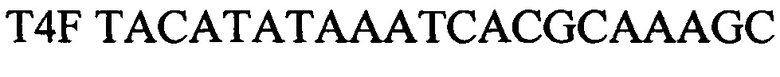
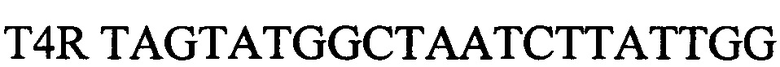
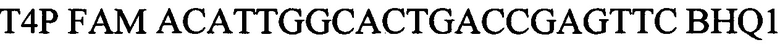 зонд.
зонд.
Новизна заявляемого технического решения заключается в том, что для уменьшения трудозатрат, времени и расходного материала при проведении ПЦР выделяют ДНК из биологического материала от инфицированных животных и используют для внутреннего и положительного контрольных образцов различные формы материала бактериофага Т4: суспензия и фрагмент генома со специфическими к нему праймерами и зондом. Такая постановка ПЦР в реальном времени сокращает и упрощает процедуру анализа, снижает риск контаминации. Кроме того, флуоресцентная детекция продуктов амплификации осуществляется с использованием принципа выщепления флуоресцентной метки на 5' конце олигонуклеотидного зонда.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ рекомендовано использовать в ветеринарной вирусологии, так как относится к средствам выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных, что соответствует критерию «промышленная применимость».
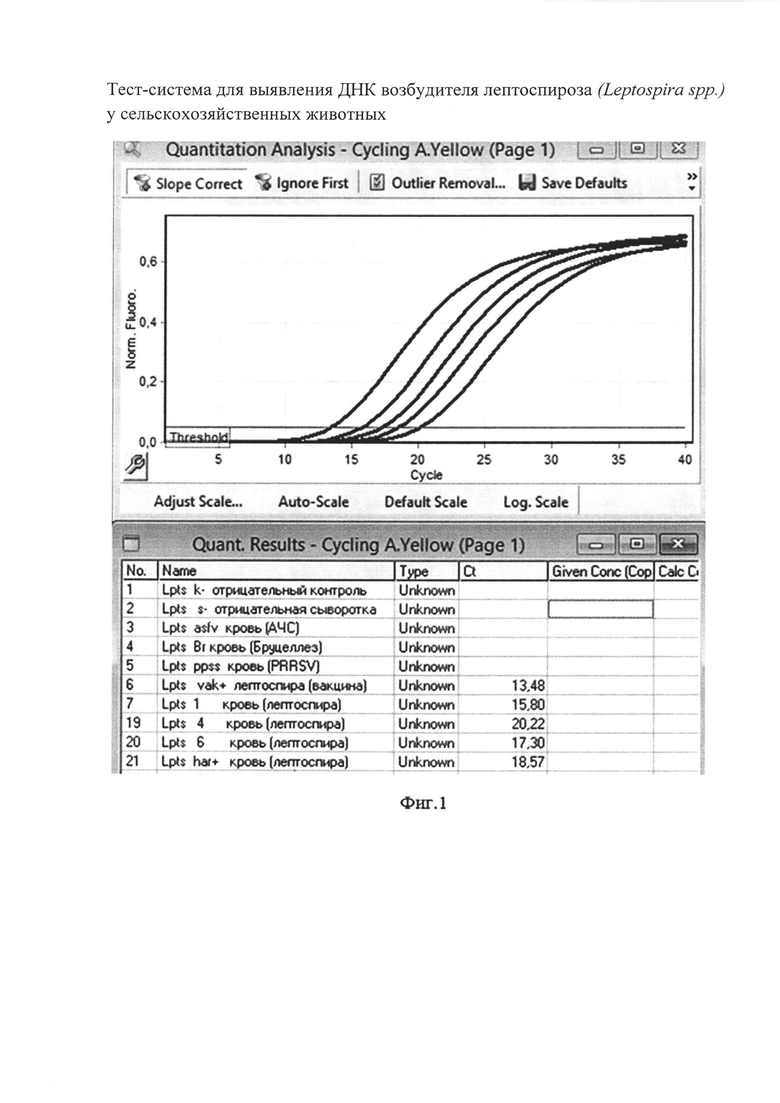
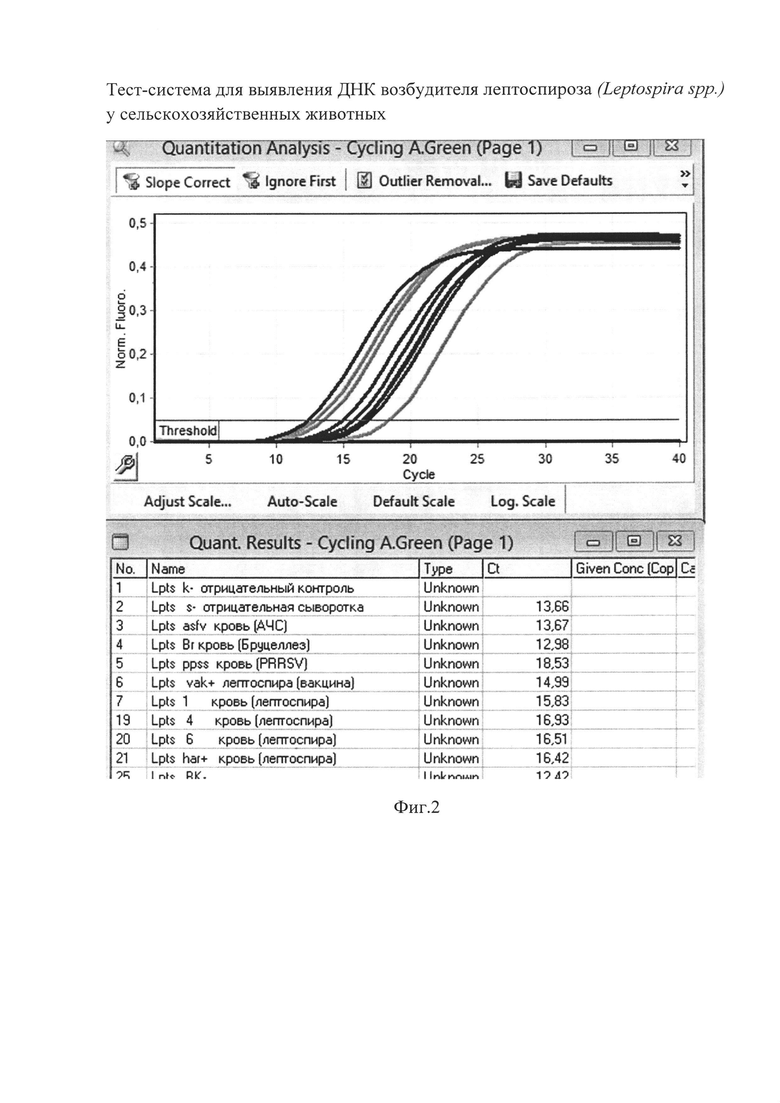
Сущность изобретения поясняется чертежами, где представлены скриншоты графиков, на фиг. 1 - представлен канал FAM/Green - для тестирования сигнала от внутреннего контрольного образца - ВКО; на фиг. 2 канал JOE(HEX)/Yellow накопление флуоресцентного сигнала для специфического сигнала тестирования наличия генома возбудителя лептоспироза (Leptospira spp. Lpts) Тест-система для выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных используется следующим образом.
Выделяют ДНК из биологического материала от инфицированных животных. В качестве биологического материала используют по выбору: цельную кровь (от животных с острой формой инфекции), фрагменты тканей и органов от павших животных (мозг, легкие, почки) и мочу. Для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома возбудителя лептоспироза (Leptospira spp. Lpts) и фрагмент генома бактериофага Т4 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
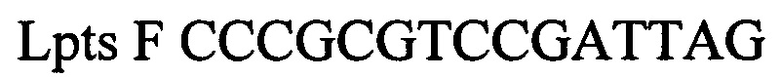 прямой праймер
прямой праймер
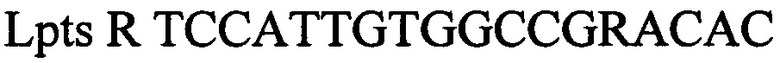 обратный праймер
обратный праймер
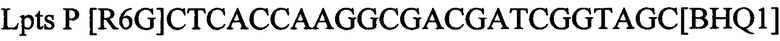 зонд
зонд
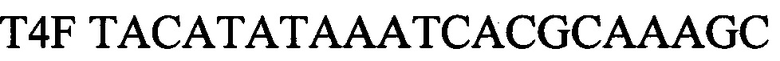
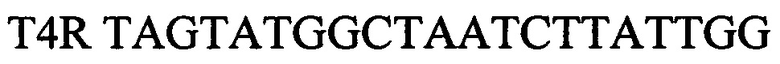
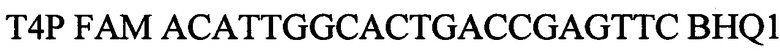 зонд.
зонд.
Осуществляют постановку одноэтапной полимеразной цепной реакции - с одновременным проведением не более 40 циклов амплификации с флуоресцентной детекцией с использованием специфичных для участка генома ДНК возбудителя лептоспироза (Leptospira spp.) олигонуклеотидных праймеров, зондов, красителей и контрольных образцов в виде внутреннего и положительного, измеряют по каналу JOE(HEX)/Yellow (фиг. 2) накопление флуоресцентного сигнала для специфического сигнала тестирования наличия генома ДНК возбудителя лептоспироза (Leptospira spp.), а по каналу FAM/Green - накопление сигнала внутреннего контрольного образца (фиг. 1), проведят интерпретацию результатов на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то ДНК возбудителя лептоспироза (Leptospira spp.) присутствует и результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то ДНК возбудителя лептоспироза (Leptospira spp.) отсутствует и результат реакции - отрицательный.
Пример конкретного использования тест-системы для выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных. Для тест системы используют набор «ПЦР-ЛЕПТОСПИРОЗ-ФАКТОР» в соответствии с инструкцией по применению набора реагентов «ПЦР-ЛЕПТОСПИРОЗ-ФАКТОР» для выявления ДНК возбудителя лептоспироза (Leptospira spp.) в биологическом материале методом полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени ТУ 21.10.60-129-51062356-2017, для диагностики in vitro, (http://www. vetfaktor.ru/.).
Набор состоит из комплекта реагентов для проведения мультиплексной ПЦР (комплект №1) и комплекта контрольных образцов (комплект №2). Состав набора приведен в Таблицах 1 и 2.
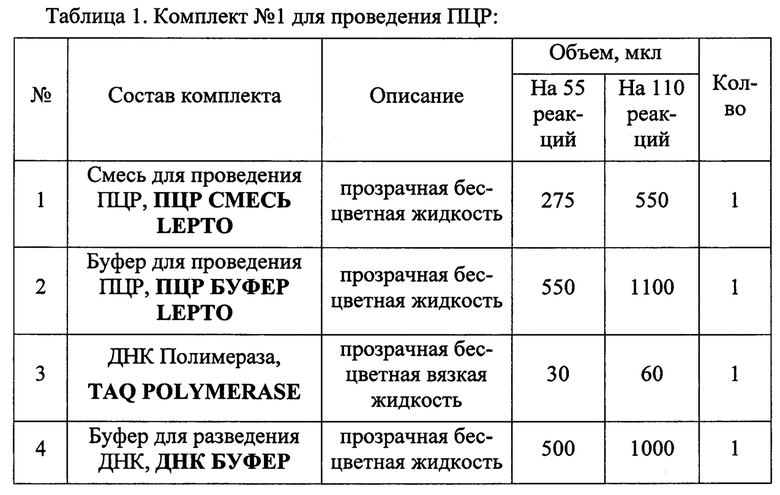
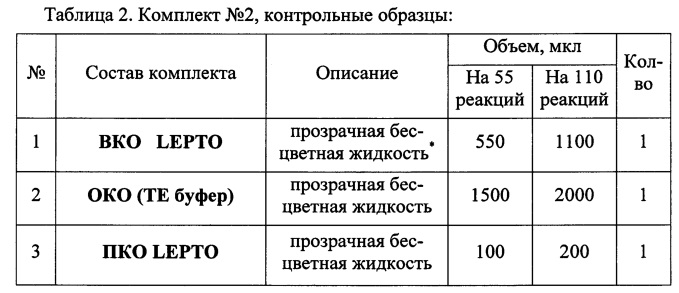
Для исследования используют следующий биологический материал:
- Цельная кровь (от животных с острой формой инфекции). Кровь забирается в пробирку с 3-6% ЭДТА из расчета 50 мкл раствора ЭДТА на 1 мл крови, закрытую пробирку с кровью несколько раз переворачивают.
- Фрагменты тканей и органов от павших животных (мозг, легкие, почки) отбирают в стерильный контейнер.
- Мочу отбирают в количестве 15-25 мл в специальный сухой стерильный флакон или контейнер. Если нет возможности исследовать материал в течение суток вносят глицерин до 10% от объема, перемешивают и хранят при температуре не выше 16°С.
Подготовка исследуемого биологического материала:
Кровь. Пробирку с кровью аккуратно несколько раз переворачивают для равномерного перемешивания. Затем готовят плазму центрифугированием в течение 6-10 мин при 1000 g. Отбирают плазму в пробирки по 1 мл и центрифугируют на микроцентрифуге при 13 тыс об/мин в течение 10 мин для концентрирования бактериальных клеток. Удаляют 900 мкл надосадочной плазмы, оставшиеся 100 мкл надосадка используют для экстракции ДНК.
Исследуемые пробы фрагментов тканей и органов от павших животных гомогенизируют с использованием стерильных фарфоровых ступок и пестиков, добавляют десятикратный объем стерильного физиологического раствора или фосфатного буфера и тщательно перемешивают. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 600-1600 g (2000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 2-5 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции ДНК.
Мочу после сбора отстаивают в течение 1 часа, затем осторожно сливают, оставляя придонную часть - около 10 мл. Центрифугируют остаток при 5000-6000 g 10 мин, удаляют надосадочную жидкость (не полностью), осадок с 100 мкл надосадочной жидкости переносят в пробирку объемом 1,5 мл и используют для экстракции ДНК.
Проведение анализа, который состоит из трех этапов:
- экстракция нуклеиновой кислоты (НК), на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»);
- проведение ПЦР с флуоресцентной детекцией в режиме реального времени;
- учет результатов анализа.
Для экстракции (выделения) НК из биологического материала отбирают необходимое количество одноразовых пробирок объемом 1,5 мл, включая отрицательный контроль выделения. Вносят во все пробирки с исследуемыми образцами, включая пробирку для отрицательного контрольного образца (ОКО), по 10 мкл внутреннего контрольного образца (ВКО) LEPTO.
Вносят исследуемые пробы в объеме согласно инструкции к набору для выделения НК, в пробирку отрицательного контроля выделения вместо исследуемой пробы вносят ОКО (пробирку обозначить как ВК-).
Выделяют НК из анализируемых и контрольных образцов согласно протоколу инструкции производителя набора для выделения НК.
Выделенную ДНК можно хранить в течение одной недели при температуре от 2°С до 8°С или в течение года при температуре не выше минус 16°С.
Подготовку образцов к проведению ПЦР проводят с помощью комплектов входящих набор «ПЦР-ЛЕПТОСПИРОЗ-ФАКТОР». Общий объем реакционной смеси - 25 мкл, объем ДНК-пробы - 10 мкл.
Успешное прохождение реакции контролируют использованием положительный контрольный образец (ПКО) LEPTO, ВКО LEPTO и ДНК буфера, где для внутреннего контрольного образца (ВКО) используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца (ПКО) используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома возбудителя лептоспироза (Leptospira spp.) и фрагмент генома бактериофага T4 взятых в объемном соотношении 1:1.
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию ПЦР:
5 мкл ПЦР СМЕСЬ LEPTO
10 мкл смеси ПЦР БУФЕР LEPTO
0,5 мкл TAQ POLYMERASE
Перемешивают смесь на вортексе и сбрасывают капли кратковременным центрифугированием.
Отбирают необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб. Вносят по 15 мкл приготовленной реакционной смеси.
Используя наконечники с фильтром в подготовленные пробирки вносят:
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл ДНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую вносят по 10 мкл ДНК соответствующей пробы;
в) в пробирку положительный контроль ПЦР (К+) 10 мкл ПКО LEPTO ПЦР РВ с флуоресцентной детекцией проводят с помощью прибора «Rotor-Gene Q», подготовленные для проведения ПЦР пробирки помещают в его ячейки. Далее программируют прибор согласно инструкции производителя.

Интерпретацию результатов анализа проводят по полученным кривым накопления флуоресцентного сигнала, которые анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в режиме «реального времени» в соответствии с инструкцией производителя к прибору.
Учет результатов ПЦР-анализа проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца).
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции ДНК в соответствии с таблицей 4.
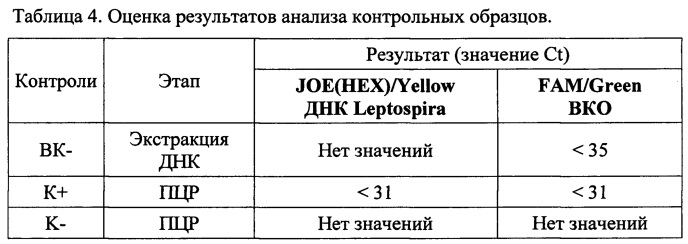
Появление любого значения Ct в таблице результатов для отрицательного контроля этапа экстракции ВК- (на канале JOE(HEX)/Yellow) и для отрицательного контроля этапа ПЦР К- (на любом из каналов) свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа для всех проб считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
Образцы, для которых по каналу FAM/Green (фиг. 1) значение Ct отсутствует или превышает 35 цикл (и при этом по каналу JOE(HEX)/Yellow отсутствует значение Ct) требуют повторного проведения исследования с этапа ПЦР. Задержка в значениях пороговых циклов для исследуемых образцов на канале FAM/Green указывает на присутствие ингибиторов в пробе(ах) или на ошибки при экстракции ДНК или при постановке реакции. Требуется провести исследование, начиная с этапа экстракции ДНК.
Образец считается положительным (ДНК бактерий рода Leptospira присутствует) если наблюдается экспоненциальный рост сигнала на канале JOE(HEX)/Yellow (фиг 2), при этом значения Ct контрольных образцов находятся в пределах нормы (табл. 4). Если для исследуемого образца по каналу JOE(HEX)/Yellow значение Ct определяется позднее 35 цикла при корректном прохождении положительных и отрицательных контролей - он считается спорным и исследуется повторно с этапа выделения ДНК. Если при повторной постановке наблюдается схожий результат (Ct на канале JOE(HEX)/Yellow более 35), требуется повторное взятие материала от того же животного для проведения ПЦР-исследования и (или) использование альтернативных методов диагностики. В случае получения значения Ct на канале JOE(HEX)/Yellow менее 35 при исследовании повторно взятого от животного материала - образец считать положительным.
Эффективность заявляемого технического решения по сравнению с прототипом подтверждается сравнительным анализом по части расходного материала, трудозатрат и времени. В прототипе необходимо использовать набор реагентов в 4 формах комплектации, а в заявляемом же всего 2 формы комплектов. Что касается сокращения трудозатрат и времени, то исключение выделения РНК из биологического материал и проведения реакции обратной транскрипции, уже влечет за собой сокращение трудозатрат и времени.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных | 2018 |
|
RU2700478C1 |
| Тест-система для выявления ДНК возбудителя криптоспоридиоза (Cryptosporidiosis) в биологическом материале животных и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2021 |
|
RU2785381C1 |
| Способ выявления ДНК хламидий у сельскохозяйственных животных и птиц | 2018 |
|
RU2700381C1 |
| Тест-система для обнаружения генома возбудителя ДНК Bordetella bronchiseptica инфекции у сельскохозяйственных животных | 2018 |
|
RU2700477C1 |
| Способ выявления генома возбудителя бруцеллезной инфекции (Brucella spp.) у сельскохозяйственных животных | 2018 |
|
RU2703400C1 |
| Способ выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале животных, продуктах питания и кормах животного и растительного происхождения | 2018 |
|
RU2700476C1 |
| Способ выявления ДНК возбудителя криптоспоридиоза (Cryptosporidiosis) в биологическом материале животных и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2021 |
|
RU2782427C1 |
| Тест-система для выявления генома возбудителя бруцеллезной инфекции (Brucella spp.) у сельскохозяйственных животных | 2018 |
|
RU2700255C1 |
| Тест-система для выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале животных, продуктах питания и кормах животного и растительного происхождения | 2018 |
|
RU2700247C1 |
| Способ обнаружения ДНК генома возбудителя бордетеллеза (Bordetella bronchiseptica) у сельскохозяйственных животных | 2018 |
|
RU2703405C1 |
Изобретение относится к ветеринарной микробиологии, в частности к лабораторной диагностике возбудителей инфекционных заболеваний, а именно к средствам диагностики инфекции у животных. Описан тест-система для выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных, включающий буфер для проведения полимеразной цепной реакции, смесь для ее проведения состоящая из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов специфичные для возбудителя лептоспироза Leptospira spp. и для внутреннего контрольного образца; смесь ферментов из ДНК полимеразы с антителами, ингибирующих активность фермента, TAQ POLYMERASE, внутренний контрольный образец, отрицательный контрольный образец, положительный контрольный образец. Для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл. Для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома возбудителя лептоспироза (Leptospira spp. Lpts) и фрагмент генома бактериофага Т4, взятых в объемном соотношении 1:1. Технический результат - уменьшение трудозатрат, времени и расходного материала при проведении полимеразной цепной реакции. 2 ил., 4 табл., 1 пр.
1. Тест-система для выявления ДНК возбудителя лептоспироза Leptospira spp. у сельскохозяйственных животных, включающий буфер для проведения полимеразной цепной реакции, смесь для ее проведения, состоящую из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов, специфичных для возбудителя лептоспироза Leptospira spp. и для внутреннего контрольного образца; смесь ферментов из ДНК полимеразы с антителами, ингибирующими активность фермента, TAQ POLYMERASE, внутренний контрольный образец, отрицательный контрольный образец, положительный контрольный образец, отличающийся тем, что для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома возбудителя лептоспироза Leptospira spp. Lpts и фрагмент генома бактериофага T4, взятых в объемном соотношении 1:1 со следующими нуклеотидными последовательностями:
Lpts F CCCGCGTCCGATTAG прямой праймер
Lpts R TCCATTGTGGCCGRACAC обратный праймер
Lpts Р [R6G]CTCACCAAGGCGACGATCGGTAGC[BHQ1]зонд
T4F TACATATAAATCACGCAAAGC
T4R TAGTATGGCTAATCTTATTGG
Т4Р FAM ACATTGGCACTGACCGAGTTC BHQ1зонд.
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Викторова Е.В | |||
| Автореферат диссертации по ветеринарии на тему "Полимеразная цепная реакция при диагностике лептоспироза и изучение органотропности лептоспир у сельскохозяйственных животных", Москва, 2006 г | |||
| Способ усиления фототоков большой частоты | 1936 |
|
SU48561A1 |
Авторы
Даты
2019-02-15—Публикация
2018-10-01—Подача