Изобретение относится к ветеринарной микробиологии, в частности к лабораторной диагностике возбудителей инфекционных заболеваний а именно к средствам диагностики инфекции у животных, как в практике ветеринарной службы, так и для научных исследований.
Известен набор для включающий пластиковые флаконы и пробирки, термостабильный фермент Tag-полимеразу, буфер для постановки реакции, смесь четырех дезоксинуклеотидтрифосфатов, внутренний контрольный образец, положительный контроль - рекомбинантную плазмиду, содержащую фрагмент гена возбудителя рода Salmonella, синтетические олигонуклеотидные праймеры и зонды, (патент RU 2360004, кл. C12Q 1/68, G01N 33/569, 2009 г.).
Наиболее близким является тест-система для молекулярно-генетической идентификации генома возбудителя ДНК сальмонелл с помощью полимеразной цепной реакции включающий пластиковые флаконы и пробирки, термостабильный фермент Tag-полимеразу, буфер для постановки реакции, смесь четырех дезоксинуклеотидтрифосфатов, внутренний контрольный образец, положительный контроль - рекомбинантную плазмиду, содержащую фрагмент гена возбудителя сальмонеллы, синтетические олигонуклеотидные праймеры и зонды, (патент RU 2410440, кл. C12Q 1/68, G01N 33/569, 2011 г., стр. 28).
Однако в известном тест-системе последовательность непосредственно читается по электрофореграмме. Длина фрагмента, который может быть расшифрован этим методом, ограничивается разрешающей способностью метода гель-электрофореза, кроме того - ограниченные функциональные возможности.
Общим недостатком известных технических решений является отсутствие возможности получения достоверной диагностики выявления генома возбудителя сальмонелл (Salmonella spp.)
Техническим результатом является получение достоверной диагностики возбудителя ДНК сальмонелл (Salmonella spp.) в биологическом материале, продуктах питания и кормах животного и растительного происхождения.
Технический результат достигается тем, что в тест-системе для выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале, продуктах питания и кормах животного и растительного происхождения, включающем пластиковые флаконы и пробирки, термостабильный фермент Tag-полимеразу, буфер для постановки реакции, смесь четырех дезоксинуклеотидтрифосфатов, внутренний контрольный образец, положительный контроль - рекомбинантную плазмиду, содержащую фрагмент гена возбудителя сальмонелл (Salmonella spp.), синтетические олигонуклеотидные праймеры и зонды, согласно изобретению для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца - смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК сальмонелл (Salmonella spp.)n фрагмент генома бактериофага Т4, взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
 - прямой праймер
- прямой праймер
 - обратный праймер
- обратный праймер
 - зонд
- зонд
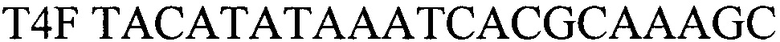 - прямой праймер
- прямой праймер
 - обратный праймер
- обратный праймер
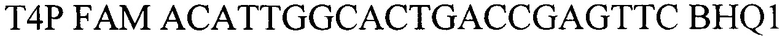 - зонд.
- зонд.
Новизна заявляемого технического решения заключается в том, что для получения достоверной диагностики возбудителя ДНК сальмонеллы в биологическом материале, продуктах питания и кормах животного и растительного происхождения проводят реакцию в одной ПЦР-пробирке (one-tube) с использованием специфичных для участка генома сальмонелл (Salmonella spp.) олигонуклеотидных праймеров флуоресцентно-меченного зонда и разных видов контроля для которых используют различные формы материала бактериофага Т4: суспензия и фрагмент генома со специфическими к нему праймерами и зондом. Такая постановка ПЦР в реальном времени сокращает и упрощает процедуру анализа, снижает риск контаминации. Кроме того, флуоресцентная детекция продуктов амплификации осуществляется с использованием принципа выщепления флуоресцентной метки на 5' конце олигонуклеотидного зонда.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый тест-систему рекомендовано использовать в ветеринарной вирусологии, а именно к средствам диагностики сальмонелл (Salmonella spp.) как в практике ветеринарной службы, так и для научных исследований, что соответствует критерию «промышленная применимость».
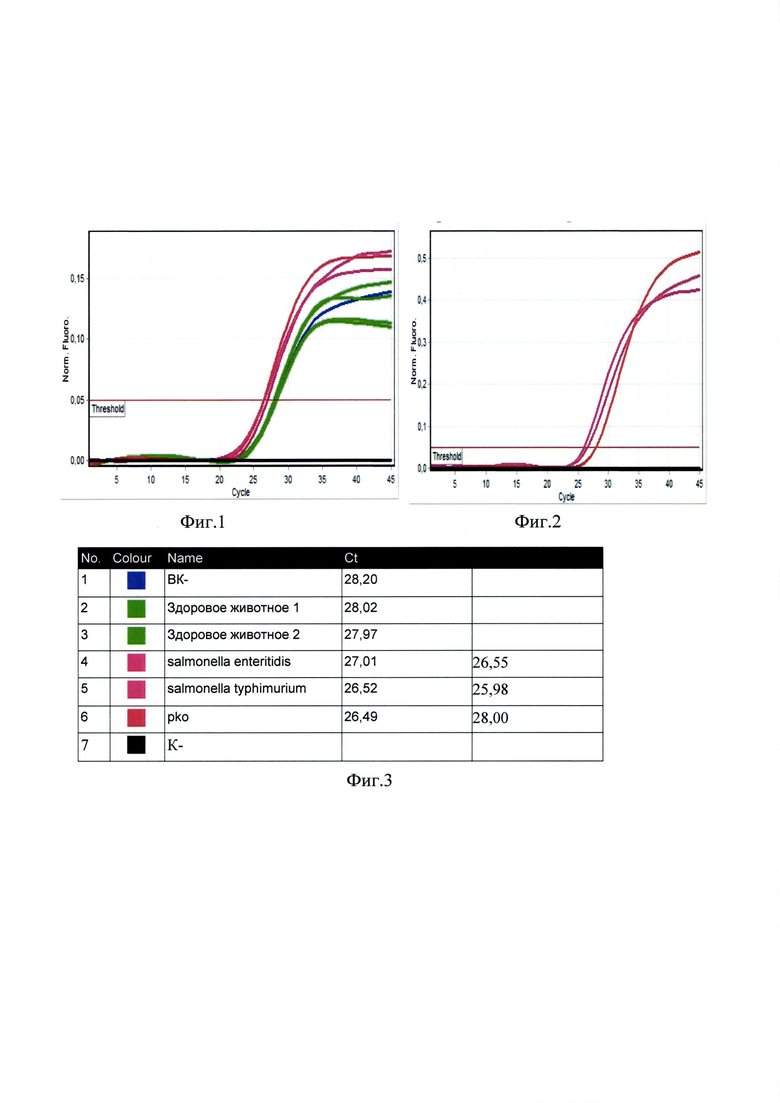
Сущность изобретения поясняется чертежами, где представлены скриншоты графиков, на фиг. 1 - представлен канал FAM/Green сигнал внутреннего контроля, на фиг. 2 - канал JOE(HEX)/Yellow накопление флуоресцентного сигнала для специфического сигнала ДНК сальмонелл (Salmonella spp.), фиг. 3 - количественные данные таблица количественных данных для Cycling A. Yellow (Salmonella spp.) и A. Green (ВКО).
Тест-систему для выявления генома возбудителя сальмонелл (Salmonella spp.) в биологическом материале, продуктах питания и кормах животного и растительного происхождения осуществляется следующим образом.
Предварительно сорбционным методом выделяют ДНК генома возбудителя сальмонелл (Salmonella spp.) и для исследования используют следующий материал:
 Цельная кровь. Кровь забирается в пробирку с 6% ЭДТА из расчета 50 мкл раствора ЭДТА на 1 мл крови, закрытую пробирку с кровью несколько раз переворачивают.
Цельная кровь. Кровь забирается в пробирку с 6% ЭДТА из расчета 50 мкл раствора ЭДТА на 1 мл крови, закрытую пробирку с кровью несколько раз переворачивают.
 Фрагменты паренхиматозных органов отбирают в стерильный контейнер;
Фрагменты паренхиматозных органов отбирают в стерильный контейнер;
 Фекалии весом 5 г отбирают в стерильный пластиковый контейнер;
Фекалии весом 5 г отбирают в стерильный пластиковый контейнер;
 Плацента и плодовые оболочки от абортировавших животных отбирают в стерильный контейнер;
Плацента и плодовые оболочки от абортировавших животных отбирают в стерильный контейнер;
 Молоко, отбирают в объеме 10-30 мл в стерильную посуду;
Молоко, отбирают в объеме 10-30 мл в стерильную посуду;
 Продукты питания отбирают в стерильные контейнеры;
Продукты питания отбирают в стерильные контейнеры;
 Куриные эмбрионы, яйца;
Куриные эмбрионы, яйца;
 Мясо птицы, свинина, продукты переработки, субпродукты;
Мясо птицы, свинина, продукты переработки, субпродукты;
 Корма животного и растительного происхождения;
Корма животного и растительного происхождения;
 Клеточные культуры.
Клеточные культуры.
Затем проводят постановку одноэтапной полимеразной цепной реакции с добавлением внутреннего положительного контроля, в качестве которого используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл и проводят 45 циклов амплификации с флуоресцентной детекцией в реальном времени с использованием специфичных для участка генома возбудителя олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов. Для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК сальмонелл (Salmonella spp.) и фрагмент генома бактериофага Т4 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
 - прямой праймер
- прямой праймер
 - обратный праймер
- обратный праймер
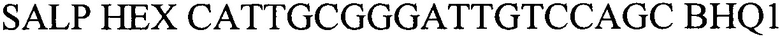 - зонд
- зонд
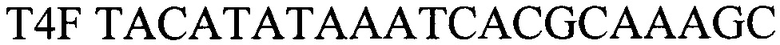 - прямой праймер
- прямой праймер
 - обратный праймер
- обратный праймер
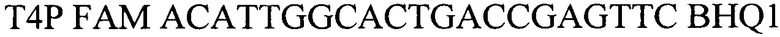 - зонд.
- зонд.
Далее накопление флуоресцентного сигнала измеряют по каналам: JOE(HEX)/Yellow для специфического сигнала; FAM/Green для сигнала внутреннего контроля, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Использование для разных видов контроля различные формы материала бактериофага Т4: суспензии и фрагмента генома со специфическими к нему праймерами и зондом обусловлено тем, что это позволяет контролировать корректное прохождение реакции в каждой пробирки, а также контролируется этап выделения ДНК из образцов.
Выбор последовательности и расчет первичной структуры олигонуклеотидных праймеров и зондов.
Праймеры, специфичные для сальмонелл (Salmonella spp.) были отобраны на основе митохондриальной последовательности ДНК генома сальмонелл (Salmonella spp.) (Salmonella enterica strain DA34833 chromosome, complete genome, код доступа: CP029595.1, участок между 1313797 и 1313904). Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность. Для детекции продуктов амплификации был подобран олигонуклеотидный флуоресцентно-меченный зонд SalP (комплементарный участку нуклеотидиой последовательности, ограниченной позициями отжига праймеров BBrF1 и BBrR1). Для гашения самопроизвольной флуоресценции на 3'-конце олигонуклеотидного зонда прикреплен гаситель BHQ-1 Зонд был помечен красителем HEX. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
В качестве внутреннего контроля использовался бактериофаг Т4, имеющий геномную ДНК порядка 169-170 тысяч пар нуклеотидов (Enterobacteria phage Т4Т, complete genome GenBank: HM137666.1). В результате анализа был выбран участок между 400 и 500 нуклеотидами, содержащий уникальные нуклеотидные последовательности, рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность.
Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд Т4Р, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров T4F и T4R. Зонд был помечен красителем Fam. Используя программу «Oligo 6.0» описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
Пример конкретного применения тест-системы для выявления генома возбудителя сальмонелл (Salmonella spp.) в биологическом материале, продуктах питания и кормах животного и растительного происхождения состоит из нескольких этапов.
1. Подготовка исследуемых проб
- Пробы цельной крови, консервированной ЭДТА, культуры клеток используют для выделения ДНК без предварительной подготовки.
- Из фекалий (1-5 г) готовят 10% суспензию на стерильном физиологическом растворе. Взвесь фекалий декантируют в течении 5-10 минут. Отбирают 1 мл надосадочной жидкости и переносят в чистую пробирку 1,5 мл, центрифугируют при 5000 об./мин на центрифуге «MiniSpin», Eppendorf, в течение 5 мин. Экстракцию РНК из осветленного экстракта фекалий проводят по возможности, сразу. При необходимости хранения замораживают.
- Исследуемые пробы тканей, органов и продуктов (небольшие кусочки до 1 г весом) гомогенизируют с использованием стерильных фарфоровых ступок и пестиков или автоматических гомогенизаторов. Затем готовят 10% суспензию на стерильном физиологическом растворе или фосфатном буфере. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 600-1600 g (3000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 2 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции ДНК.
- При исследовании куриных эмбрионов в скорлупе прокалывают отверстие и отбирают стерильным шприцем в пробирку объемом 1,5 мл 1,0-1,5 мл аллантоисной жидкости.
- Молоко в объеме до 10 мл центрифугируют при 3 тыс об/мин в течение 10-15 мин. Надосадочную жидкость осторожно отбирают, оставив над осадком примерно 0,2 мл жидкости. Осадок ресуспендируют в оставшейся надосадочной жидкости и 0,1 мл суспензии используют для выделения ДНК.
- Корм и пищевую продукцию тщательно гомогенизируют, готовят 10% суспензию на стерильном физиологическом растворе. Декантируют в течение 10 минут. Отбирают 1 мл надосадочной жидкости и переносят в чистую пробирку 1,5 мл, центрифугируют при 5000 об./мин на центрифуге «MiniSpin» (Eppendorf, Германия) в течение 5 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции ДНК.
2. Проведение анализа
Исследование осуществляют с помощью набора реагентов «ПЦР-САЛЬМОНЕЛЛЕЗ-ФАКТОР».
Анализ состоит из трех этапов:
 экстракция НК (на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»);
экстракция НК (на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»);
 проведение ПЦР РВ;
проведение ПЦР РВ;
 учет результатов анализа.
учет результатов анализа.
Экстракцию (выделение) НК из исследуемых проб проводят следующим образом.
Отбирают необходимое количество одноразовых пробирок объемом 1,5 мл, включая отрицательный контроль выделения. Вносят во все пробирки с исследуемыми образцами, включая пробирку для отрицательный контрольный образец (ОКО), по 10 мкл внутренний контрольный образец (ВКО) SALMONELLA в качестве которого используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл.
Вносят исследуемые пробы в объеме согласно инструкции к набору для выделения НК, в пробирку отрицательного контроля выделения вместо исследуемой пробы вносят ОКО (пробирку обозначить как ВК-).
Выделяют ДНК из анализируемых и контрольных образцов согласно протоколу инструкции производителя набора для выделения НК.
Выделенную ДНК можно хранить в течение одной недели при температуре от 2°С до 8°С или в течение года при температуре не выше минус 16°С.
Проводят одноэтапную ПЦР РВ в одной пробирке.
Набор состоит из комплекта реагентов для проведения мультиплексной ПНР (комплект №1) и комплекта контрольных образцов (комплект №2). Набор выпускается в двух вариантах:
1) Для анализа 55 образцов (включая контрольные образцы);
2) Для анализа 110 образцов (включая контрольные образцы).
Составы наборов приведены в Таблицах 1 и 2.
Наборы используют в соответствии инструкцией по применению набора реагентов «ПЦР-САЛЬМОНЕЛЛЕЗ-ФАКТОР» для выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале, продуктах питания и кормах животного и растительного происхождения методом полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени ТУ 21.10.60-144-51062356-2017 (http://www.vetfaktor.ru/.).
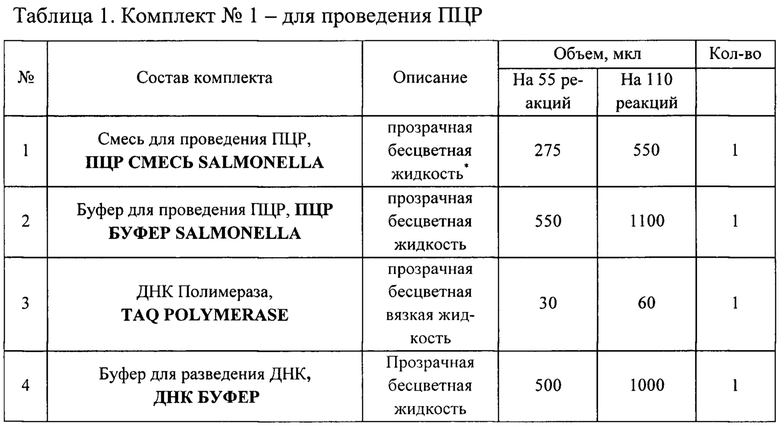
* Возможна легкая опалесценция

Подготавливают образцы к проведению ПЦР следующим образом.
Общий объем реакционной смеси - 25 мкл, объем ДНК-пробы - 10 мкл.
Успешное прохождение реакции контролируют, используя положительный контрольный образец (ПКО) сальмонелл (Salmonella spp.), внутренний контрольный образец (ВКО) сальмонелл (Salmonella spp.) и ДНК БУФЕР, где для внутреннего контрольного образца (ВКО) используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, если концентрация копий нуклеотидных последовательностей отклоняется в большую или меньшую сторону, то наблюдаются повторности сомнительных образцов, а для положительного контрольного образца (ПКО) используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК сальмонелл (Salmonella spp.) и фрагмент генома бактериофага Т4, взятых в соотношении 1:1, взятых по 5000 копий специфического фрагмента в 10 мкл (в соотношении 1:1).
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
5 мкл ПЦР смесь сальмонелл (Salmonella spp.)
10 мкл смеси ПЦР БУФЕР сальмонелл (Salmonella spp.)
0,5 мкл TAQ POLYMERASE
Затем перемешивают смесь на вортексе и сбрасывают капли кратковременным центрифугированием. Отбирают необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб. Вносят по 15 мкл приготовленной реакционной смеси. Используя наконечники с фильтром в подготовленные пробирки вносят:
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл ДНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую вносят по 10 мкл ДНК соответствующей пробы;
в) в пробирку положительный контроль ПЦР (К+) - 10 мкл ПКО сальмонелл (Salmonella spp.)
Проводят реакцию ПЦР РВ с флуоресцентной детекцией.
Параметры температурно-временного режима амплификации на приборах «Rotor-Gene Q», «ДТ-96», «CFX96» и LightCycIer® 96 указаны в Приложениях 1, 2, 3 и 4 Инструкции соответственно.
Для проведения амплификации был использован прибор «Rotor Gene».

Помещают подготовленные для проведения ПЦР пробирки в ячейки амплификатора. Программируют прибор согласно инструкции производителя и в соответствии с Приложениями 1, 2, 3 и 4 Инструкции.
Далее проводят интерпретацию результатов анализа. Во всех пробах за исключением пробы - отрицательный образец - (К-) наблюдается кривая роста флуоресценции (фигура 1). В четырех пробах, включая клинический образец k88_3668 и положительный контрольный образец (+) в двух повторах, наблюдается кривая роста флуоресценции. В пробирке - отрицательный образец - (К-) - кривая роста флуоресценции отсутствует (фигура 2).
Полученные данные - кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в режиме «реального времени» в соответствии с инструкцией производителя к прибору и в соответствии с Приложениями 1, 2, 3 и 4 Инструкции.
Учет результатов ПЦР-анализа проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца).

Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции ДНК в соответствии с таблицей 4.
Для доказательства эффективности использования ПЦР с флуоресцентной детекцией в режиме реального времени проводился сравнительный анализ чувствительности заявляемого технического решения с прототипом, в котором использовался метод ПЦР с электрофоретической детекцией. Оказалось чувствительность ПЦР с флуоресцентной детекцией при обнаружении ДНК сальмонелл на 3,5-4,3% выше, чем ПЦР с электрофоретической детекцией.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале животных, продуктах питания и кормах животного и растительного происхождения | 2018 |
|
RU2700476C1 |
| Тест-система для выявления генома возбудителя бруцеллезной инфекции (Brucella spp.) у сельскохозяйственных животных | 2018 |
|
RU2700255C1 |
| Способ выявления генома возбудителя бруцеллезной инфекции (Brucella spp.) у сельскохозяйственных животных | 2018 |
|
RU2703400C1 |
| Тест-система для выявления ДНК возбудителя криптоспоридиоза (Cryptosporidiosis) в биологическом материале животных и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2021 |
|
RU2785381C1 |
| Способ выявления ДНК хламидий у сельскохозяйственных животных и птиц | 2018 |
|
RU2700381C1 |
| Тест-система для обнаружения генома возбудителя ДНК Bordetella bronchiseptica инфекции у сельскохозяйственных животных | 2018 |
|
RU2700477C1 |
| Тест-система для выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных | 2018 |
|
RU2680094C1 |
| Способ выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных | 2018 |
|
RU2700478C1 |
| Тест-система для выявления ДНК хламидий у сельскохозяйственных животных и птиц | 2018 |
|
RU2701332C1 |
| Тест-система для выявления ДНК возбудителя пастереллеза (Pasteurella multocida) в биологическом материале животных и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2023 |
|
RU2814556C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой тест-систему для выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале, продуктах питания и кормах животного и растительного происхождения, включающую пластиковые флаконы и пробирки, термостабильный фермент Tag-полимеразу, буфер для постановки реакции, смесь четырех дезоксинуклеотидтрифосфатов, внутренний контрольный образец, положительный контроль - рекомбинантную плазмиду, содержащую фрагмент гена возбудителя сальмонелл (Salmonella spp.), синтетические олигонуклеотидные праймеры и зонды, согласно изобретению для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца - смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК сальмонелл (Salmonella spp.) и фрагмент генома бактериофага Т4, взятые в соотношении 1:1. Изобретение позволяет достоверно диагностировать ДНК возбудителя сальмонелл (Salmonella spp.) в биологическом материале, продуктах питания и кормах животного и растительного происхождения. 3 ил., 4 табл.
Тест-система для выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале, продуктах питания и кормах животного и растительного происхождения, включающая пластиковые флаконы и пробирки, термостабильный фермент Tag-полимеразу, буфер для постановки реакции, смесь четырех дезоксинуклеотидтрифосфатов, внутренний контрольный образец, положительный контроль - рекомбинантную плазмиду, содержащую фрагмент гена возбудителя сальмонелл (Salmonella spp.), синтетические олигонуклеотидные праймеры и зонды, отличающаяся тем, что для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца - смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК сальмонелл (Salmonella spp.) и фрагмент генома бактериофага Т4, взятые в соотношении 1:1, со следующими нуклеотидными последовательностями:
SALF CTACGGGAAGGTGATACGCC - прямой праймер
SALR TTATGCCAAGTCAGGGGCTG - обратный праймер
SALP HEX CATTGCGGGATTGTCCAGC BHQ1 - зонд
T4F TACATATAAATCACGCAAAGC - прямой праймер
T4R TAGTATGGCTAATCTTATTGG - обратный праймер
Т4Р FAM ACATTGGCACTGACCGAGTTC BHQ1 - зонд.
| СПОСОБ И НАБОР ДЛЯ ДЕТЕКТИРОВАНИЯ МИКРООРГАНИЗМА | 2008 |
|
RU2410440C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИКРООРГАНИЗМОВ РОДА SALMONELLA | 2008 |
|
RU2360004C1 |
Авторы
Даты
2019-09-13—Публикация
2018-10-01—Подача