Изобретение относится к биологии, медицине, а именно к фундаментальной и клинической биохимии, и позволяет выявлять влияние низкомолекулярных биологически активных веществ на взаимодействие белков с лигандами.
В настоящее время исследование роли малых молекул в регуляции белок-белковых и белок-лигандных взаимодействий представляется актуальной задачей. Нами были показаны особенности влияния некоторых малых молекул на белок-белковые взаимодействия [1-3], однако в литературе отсутствуют данные о влиянии низкомолекулярных соединений на аффинитет связи белок-лиганд.
Известен метод определения лиганда в образце [4], суть которого заключается в определении содержания одного типа лиганда в образце на выбранном носителе, имеющего блокируемый объект, не способный специфически взаимодействовать с выявляемым лигандом и участвующий в произведении детектируемого сигнала, по которому определяют лиганд в образце.
Недостатком данного метода является трудоемкость выполнения, отсутствие стандартной методики выполнения и интерпретации результата, методика варьирует в зависимости от типа лиганда и исследуемого объекта.
Известен способ определения адренореактивности эритроцитов по их адренозависимой агглютинации у женщин на различных этапах репродуктивного процесса [5] при этом определяется изменение времени начала агглютинации эритроцитов женщин, имеющих II, III или IV группу крови под влиянием адреналина.
Недостатком способа является субъективная визуальная оценка времени начала агглютинации эритроцитов, что делает данный метод не стандартизированным. Способ подразумевает оценку антиген-антительных взаимодействий только по системе АВ0. Помимо этого изучается влияние адреналина только на антигены.
Известен способ лабораторной диагностики вирусного гепатита С, в основе которого лежит белок-белковое взаимодействие [6]. Проводят выявление антител и специфических иммунных комплексов, при этом в иммуноферментном тесте определяют антитела к неструктурным белкам (NS4) как в свободном виде, так и в составе иммунных комплексов. Результаты реакции учитывают на иммуноферментном анализаторе и сравнивают показатели оптической плотности (ОП) растворов в лунках 2-х параллельных рядов, отмытых 6М мочевиной и фосфатно-солевым раствором (ФСР) соответственно. При увеличении показателя ОП в лунках, промытых 6М мочевиной, по сравнению с ОП в лунках, промытых только ФСР, на 12% и более результат считают положительным. Данный способ выбран в качестве прототипа.
Недостатком метода является то, что воздействие оказывается на сформированный комплекс антиген-антитело, а также то, что запрещено применение реагентов, содержащих в качестве субстрата ортофенилендиамин, в виду его высокой степени канцерогенности и необходимости специальной технологии утилизации (Приказ Минздрава РФ №322 от 21.10.2002 "О применении в практике здравоохранения иммуноферментных тест-систем для выявления поверхностного антигена вируса гепатита В (HBsAg) и антител к вирусу гепатита С (анти-ВГС) в сыворотке крови человека").
Целью является создание способа для выявления влияния низкомолекулярных биологически активных веществ на аффинитет белок-лигандной связи.
Эта цель достигается тем, что биологически активное соединение низкомолекулярной массы вносят в лунку планшета с иммобилизованными антителами к антигену вируса гепатита перед этапом внесения сыворотки для определения воздействия на антитела или в сыворотку перед внесением в лунку планшета для определения воздействия на антигены; в контрольные образцы вносят раствор для разведения сыворотки, входящий в состав набора, в эквивалентном объеме, после чего производят инкубацию в течение 5 минут в темном месте; проводят иммуноферментный анализ, строят калибровочный график зависимости оптической плотности от концентрации антигена вирусного гепатита; по полученному калибровочному графику рассчитывают титр антигенов в контрольных и опытных образцах, производят статистическую обработку полученных результатов, рассчитывая среднее арифметическое, ошибку среднего, стандартную ошибку, изменение концентрации антигена в опытном образце по сравнению с контрольным образцом в абсолютных числах и процентах, при изменении концентрации антигена на ≥±10% по сравнению с контрольным образцом делают вывод о наличии влияния исследуемого низкомолекулярного биологически активного вещества на аффинитет белок-лигандной связи, а при изменении концентрации антигена на <±10% - об отсутствии влияния выбранного низкомолекулярного биологически активного вещества на аффинитет белок-лигандной связи.
Предложенный способ является простым и удобным, так как сопоставим с любой методикой иммуноферментного анализа; недорогим, поскольку не требует привлечения дополнительных реактивов, кроме тех, что входят в стандартный набор иммуноферментного анализа; быстрым - результаты опыта возможно получить через 3-4 часа; объективным, так как заключение о влиянии биологически активного вещества выдается на основании проведения статистических расчетов и нахождении изменения концентрации антигена в опытном образце по сравнению с контрольным образцом в процентах; безопасным, так как не содержит канцерогенных веществ; кроме того данный способ позволяет изолированно выявлять влияние низкомолекулярных веществ как на антигены, так и на антитела.
Способ выявления влияния низкомолекулярных биологически активных веществ на аффинитет белок-лигандной связи реализуют следующим образом:
Для определения влияния исследуемого низкомолекулярного биологически активного вещества на антитело к антигену гепатита вирусной этиологии цельную кровь пациента носителя выбранного антигена без добавления консервантов центрифугируют для отделения форменных элементов от сыворотки. Готовят раствор биологически активного вещества требуемой концентрации. Исследуемое вещество добавляют в лунку планшета с последующей инкубацией в течение 5 минут. Соотношение сыворотки и исследуемого низкомолекулярного вещества составляет 9:1 с сохранением общего объема пробы, вносимой в лунку на первом этапе иммуноферментного анализа, заявленной в инструкции производителя. В контрольные образцы вносят раствор для разведения сыворотки, входящий в состав набора, в эквивалентном объеме. Далее постановку иммуноферментного анализа производят согласно методике производителя.
Учет результата производят путем измерения оптической плотности образцов при заданной длине волны. На основании полученной оптической плотности производят расчет титра антигенов по калибровочному графику. График строят в системе линейных координат СИ, график представляет собой линейную зависимость оптической плотности (о.е.) от концентрации выбранного антигена вируса гепатита (МЕ/мл) в калибровочных образцах, содержащих известный титр указанного антигена (МЕ/мл), входящих в состав набора.
Для определения влияния низкомолекулярного биологически активного вещества на антиген гепатита вирусной этиологии цельную кровь пациента без добавления консервантов центрифугируют для отделения форменных элементов от плазмы. Исследуемое вещество добавляют непосредственно в сыворотку с последующей инкубацией в течение 5 минут. Соотношение сыворотки и исследуемого низкомолекулярного вещества составляет 9:1 с сохранением общего объема пробы, вносимой в лунку на первом этапе иммуноферментного анализа, заявленной в инструкции производителя. В контрольные образцы вносят раствор для разведения сыворотки, входящий в состав набора, в эквивалентном объеме. Дальнейшее исследование производят в соответствии с приведенным выше методом.
Учет результата производят путем измерения оптической плотности образцов при заданной длине волны и расчета титра антигенов в контрольных и опытных образцах по калибровочному графику. Калибровочный график строят в системе линейных координат СИ, график представляет собой линейную зависимость оптической плотности (о.е.) от концентрации выбранного антигена вируса гепатита (МЕ/мл) в калибровочных образцах, содержащих известный титр указанного антигена (МЕ/мл), входящих в состав набора.
Производят статистическую обработку полученных результатов, рассчитывая среднее арифметическое, ошибку среднего, стандартную ошибку, изменение концентрации антигена в опытном образце по сравнению с контрольным образцом в абсолютных числах и процентах. При изменении концентрации антигена на ≥±10% по сравнению с контрольным образцом делают вывод о наличии влияния исследуемого низкомолекулярного биологически активного вещества на аффинитет белок-лигандной связи, а при изменении концентрации антигена на <±10% - об отсутствии влияния выбранного низкомолекулярного биологически активного вещества на аффинитет белок-лигандной связи.
Способ сопровождается лабораторными примерами.
Лабораторный пример №1
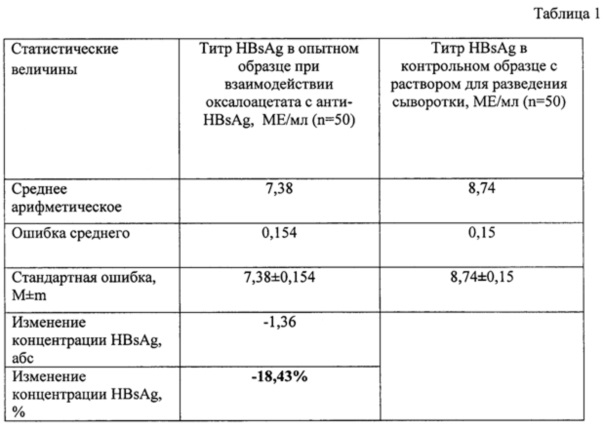
Исследуемым низкомолекулярным биологически активным соединением был выбран оксалоацетат, исследовали влияние оксалоацетата на аффинитет связи HBsAg-антиHBsAg. Исследование проводилось в тест-системе «HBsAg-ИФА-БЕСТ-количественный» производства Вектор-Бест. Опытный образец содержал 10 мкл раствора оксалоацетата, внесенных в лунку планшета перед этапом внесения сыворотки с последующей инкубацией в темном месте в течение 5 мин, и 90 мкл сыворотки пациента носителя HBsAg. Контрольный образец содержал 10 мкл раствора для разведения сыворотки из набора «HBsAg-ИФА-БЕСТ-количественный» производства Вектор-Бест, внесенных в лунку планшета перед этапом внесения сыворотки с последующей инкубацией в темном месте в течение 5 мин, и 90 мкл сыворотки пациента носителя HBsAg.
Была приготовлена навеска оксалоацетата 24 мг, которую затем растворили в 1 л дистиллированной воды, что соответствует физиологической концентрации оксалоацетата в организме.
Для определения влияния исследуемого вещества на анти HBsAg цельную кровь пациента носителя HBsAg без добавления консервантов центрифугировали для отделения форменных элементов от сыворотки. 10 мкл полученного раствора добавляли в лунки планшета и инкубировали 5 минут в темном месте. После инкубации в лунки добавили по 90 мкл сыворотки. Далее следовали инструкции «HBsAg-ИФА-БЕСТ-количественный», утвержденной 07.06.2012 приказом Росздравнадзора №2753-пр/12.
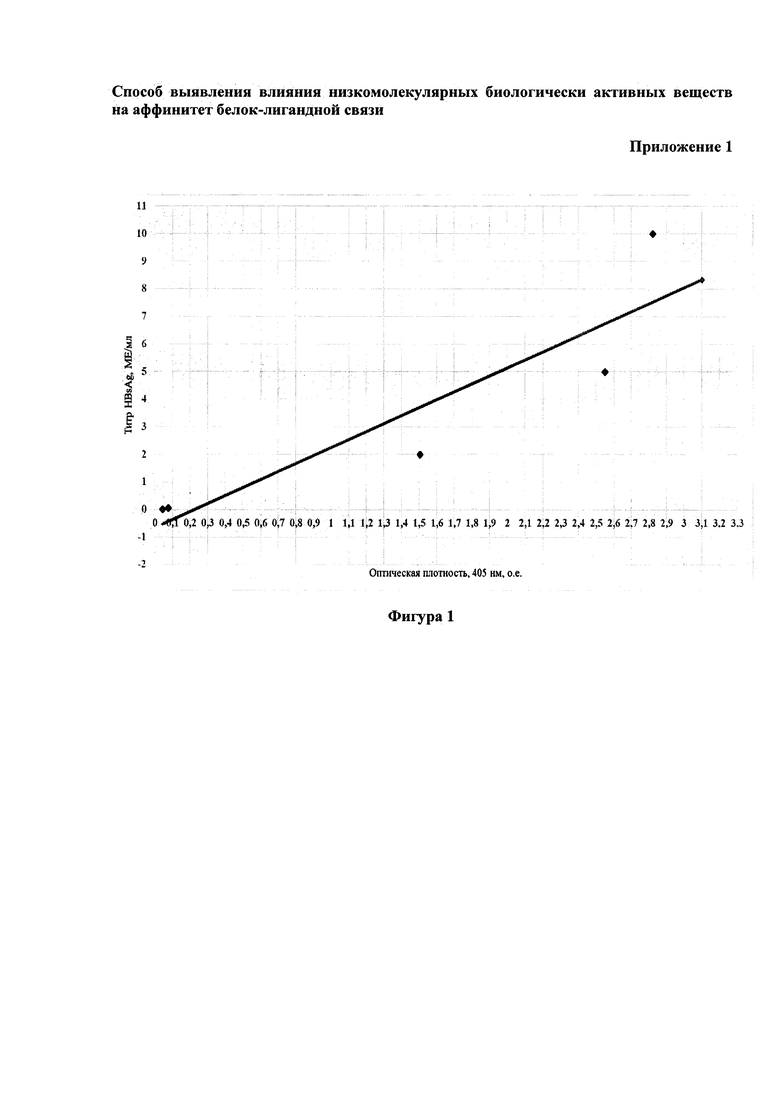
График линейной зависимости оптической плотности от концентрации HBsAg (МЕ/мл) в калибровочных образцах, содержащих известный титр HBsAg (МЕ/мл), входящих в состав набора, строили в системе линейных координат СИ. В приложении 1 на фигуре 1 представлен калибровочный график для определения концентрации HBsAg (МЕ/мл).
Производили статистическую обработку полученных результатов, рассчитывая среднее арифметическое, ошибку среднего, стандартную ошибку, изменение концентрации антигена в опытном образце по сравнению с контрольным образцом в абсолютных числах и процентах. Полученные результаты выявления влияния оксалоацетата на взаимодействие HBsAg и анти-HBsAg представлены в Приложении 2 Таблице 1.
Концентрация HBsAg при взаимодействии оксалоацетата с анти-HBsAg по сравнению с контрольным образцом изменилась на 18,43%, что больше 10%. На основании полученных данных делаем вывод о том, что низкомолекулярное биологически активное вещество оксалоацетат влияет на аффинитет связи HBsAg-антиHBsAg.
Лабораторный пример №2
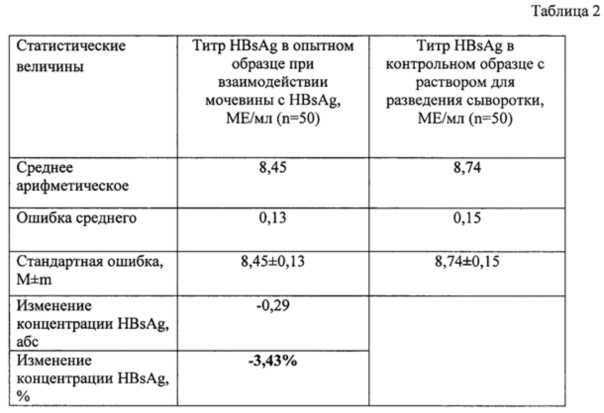
Исследуемым низкомолекулярным биологически активным соединением была выбрана мочевина, исследовали влияние мочевины на аффинитет связи HBsAg-антиHBsAg. Исследование проводилось в тест-системе «HBsAg-ИФА-БЕСТ-количественный» производства Вектор-Бест. Опытный образец содержал 10 мкл раствора мочевины и 90 мкл сыворотки пациента носителя HBsAg, инкубированные в темном месте в течение 5 мин. Контрольный образец содержал 10 мкл раствора для разведения сыворотки из набора «HBsAg-ИФА-БЕСТ-количественный» производства Вектор-Бест и 90 мкл сыворотки пациента носителя HBsAg, инкубированные в темном месте в течение 5 мин.
Была приготовлена навеска мочевины 36 мг, которую затем растворили в 1 л дистиллированной воды, что соответствует физиологической концентрации мочевины в организме.
Для определения влияния исследуемого вещества на HBsAg цельную кровь пациента без добавления консервантов центрифугировали для отделения форменных элементов от плазмы. 10 мкл раствора мочевины добавили к 90 мкл сыворотки и инкубировали 5 минут при комнатной температуре в темном месте. Далее следовали инструкции «HBsAg-ИФА-БЕСТ-количественный», утвержденной 07.06.2012 приказом Росздравнадзора №2753-пр/12.
График линейной зависимости оптической плотности от концентрации HBsAg (МЕ/мл) в калибровочных образцах, содержащих известный титр HBsAg (МЕ/мл), входящих в состав набора, строили в системе линейных координат СИ аналогичным образом.
Производили статистическую обработку полученных результатов, рассчитывая среднее арифметическое, ошибку среднего, стандартную ошибку, изменение концентрации антигена в опытном образце по сравнению с контрольным образцом в абсолютных числах и процентах. Полученные результаты выявления влияния мочевины на взаимодействие HBsAg и анти-HBsAg представлены в Приложении 3 Таблице 2.
Концентрация HBsAg при взаимодействии мочевины с HBsAg по сравнению с контрольным образцом изменилась на 3,43%, что меньше 10%. На основании полученных данных делаем вывод о том, что низкомолекулярное биологически активное вещество мочевина не влияет на аффинитет связи HBsAg-антиHBsAg.
Способ выявления влияния низкомолекулярных биологически активных веществ на аффинитет белок-лигандной связи может быть использован в фундаментальных исследованиях в области протеомики: изучение действий гормонов, нейромедиаторов, токсинов на белок-белковые взаимодействия; в разработке методов персонифицированной медицины; в фармакологии при разработке и испытании лекарственных средств, таргетных препаратов, биологических добавок.
Источники информации
1. Гильмиярова ФН, Рыскина ЕА, Колотьева НА, Потехина ВИ, Горбачева ИВ. Белок-лигандные взаимодействия: влияние минорных компонентов метаболизма. Сибирское медицинское обозрение. 2017; (6); 12-21. DOI: 10.20333/2500136-2017-6-12-21.
2. Gilmiyarova F. Kolotyeva N., Radomskaya V., Gusyakova О., Gorbacheva I., Potekhina V. Role of the Metabolic Minor Components in the Regulation of Intermolecular Interaction // Journal of Biosciences and Medicines. 2016. Vol. 4. pp. 28-35. doi:10.4236/jbm.2016.47004.
3. Gylmiyarova, F.N., Radomskaya, V.M., Gusyakova, O.A. et al. The effect of Pyruvate on Antibody Interaction with Group-Specific Erythrocyte Antigens // Biochem. Moscow Suppl. Ser. B. 2014. Vol. 8. pp. 260-265 doi:10.1134/S1990750814030056.
4. Nikitin M.P., Shipunova V.O, Deyev S.M, Nikitin P.I Biocomputing based on particle disassembly // Nat Nanotechnol. 2014. Vol. 9. pp. 716-22.
5. Володченко A.M., Циркин В.И., Хлыбова С.В., Дмитриева С.Л.. Адренореактивность эритроцитов, определяемая по их адренозависимой агглютинации, у женщин на различных этапах репродуктивного процесса. Вятский медицинский вестник, №1, 2013. С 25-30.
6. Аксенов О.А., Мукомоловачева А.Л., Горячева Л.Г., Рогозина Н.В., Колобов А.А., патент RU 2226694 С2, 2004 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕСТ-СИСТЕМА ДЛЯ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АНТИ-HBS В БИОЛОГИЧЕСКОМ ОБРАЗЦЕ | 2005 |
|
RU2290642C2 |
| ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В И СПОСОБ ОПРЕДЕЛЕНИЯ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСНОГО ГЕПАТИТА В | 2006 |
|
RU2325655C9 |
| Способ оценки уровня антител, специфичных к различным вариантам HBsAg вируса гепатита В | 2016 |
|
RU2616236C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К HBs-АНТИГЕНУ И БЛОКАТОР В ТЕСТ-СИСТЕМЕ | 2001 |
|
RU2206095C1 |
| СПОСОБ КОМПЛЕКСНОЙ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА ПУТЕМ ТВЕРДОФАЗНОГО ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2012 |
|
RU2488832C1 |
| СПОСОБ ДИАГНОСТИКИ АУТОИММУННЫХ ПОРАЖЕНИЙ ПЕЧЕНИ У БОЛЬНЫХ ХРОНИЧЕСКИМИ ГЕПАТИТАМИ | 2003 |
|
RU2247387C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ПАНЕЛИ СЫВОРОТОК ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ГЕПАТИТА В | 2007 |
|
RU2367960C2 |
| СПОСОБ ВЫЯВЛЕНИЯ АНТИТЕЛ К АНТИГЕНАМ ВИРУСОВ ГЕПАТИТОВ | 2006 |
|
RU2360253C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pBM И СПОСОБ ПОЛУЧЕНИЯ С ЕЕ ИСПОЛЬЗОВАНИЕМ БЕЗМАРКЕРНЫХ ТРАНСГЕННЫХ РАСТЕНИЙ, СИНТЕЗИРУЮЩИХ ЦЕЛЕВЫЕ ПРОДУКТЫ | 2009 |
|
RU2410433C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕФЕРЕНС-ПАНЕЛИ СЫВОРОТОК ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ И ИММУНОБЛОТОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ СЕРОЛОГИЧЕСКОЙ ДИАГНОСТИКИ МАРКЕРОВ ВИЧ-1 | 2015 |
|
RU2603483C2 |
Изобретение относится к медицине, а именно к клинической биохимии, и может быть использовано для выявления влияния низкомолекулярных биологически активных веществ на аффинитет белок-лигандной связи. Для этого осуществляют количественное определение титра антигенов гепатита вирусной этиологии в сыворотке пациентов методом иммуноферментного анализа. При этом биологически активное соединение низкомолекулярной массы вносят в лунку планшета с иммобилизованными антителами к антигену вируса гепатита перед этапом внесения сыворотки для определения воздействия на антитела или антигены. После чего инкубируют в течение 5 минут в темном месте и проводят иммуноферментный анализ. Строят калибровочный график зависимости оптической плотности от концентрации антигена вирусного гепатита. По полученному калибровочному графику рассчитывают титр антигенов в контрольных и опытных образцах. При изменении концентрации антигена на ≥±10% по сравнению с контрольным образцом делают вывод о наличии влияния исследуемого низкомолекулярного биологически активного вещества на аффинитет белок-лигандной связи. А при изменении концентрации антигена на <±10% - об отсутствии влияния выбранного низкомолекулярного биологически активного вещества на аффинитет белок-лигандной связи. Изобретение позволяет выявлять влияние низкомолекулярных биологически активных веществ на взаимодействие белков с лигандами путем определения титра антигенов гепатита вирусной этиологии в сыворотке пациентов. 1 ил., 2 табл., 2 пр.
Способ выявления влияния низкомолекулярных биологически активных веществ на аффинитет белок-лигандной связи, заключающийся в количественном определении титра антигенов гепатита вирусной этиологии в сыворотке пациентов методом иммуноферментного анализа, отличающийся тем, что биологически активное соединение низкомолекулярной массы вносят в лунку планшета с иммобилизованными антителами к антигену вируса гепатита перед этапом внесения сыворотки для определения воздействия на антитела или в сыворотку перед внесением в лунку планшета для определения воздействия на антигены; в контрольные образцы вносят раствор для разведения сыворотки, входящий в состав набора для иммуноферментного анализа «HBsAg-ИФА-БЕСТ-количественный», в эквивалентном объеме, после чего производят инкубацию в течение 5 минут в темном месте; проводят иммуноферментный анализ, строят калибровочный график зависимости оптической плотности от концентрации антигена вирусного гепатита; по полученному калибровочному графику рассчитывают титр антигенов в контрольных и опытных образцах, производят статистическую обработку полученных результатов, рассчитывая среднее арифметическое, ошибку среднего, стандартную ошибку, изменение концентрации антигена в опытном образце по сравнению с контрольным образцом в абсолютных числах и процентах, при изменении концентрации антигена на ≥±10% по сравнению с контрольным образцом делают вывод о наличии влияния исследуемого низкомолекулярного биологически активного вещества на аффинитет белок-лигандной связи, а при изменении концентрации антигена на <±10% - об отсутствии влияния выбранного низкомолекулярного биологически активного вещества на аффинитет белок-лигандной связи.
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ВИРУСНОГО ГЕПАТИТА С | 2002 |
|
RU2226694C2 |
| WO 2016210009 A2, 29.12.2016 | |||
| ГИЛЬМИЯРОВА Ф | |||
| Н | |||
| и др., Влияние малых молекул на процессы межмолекулярного взаимодействия, лежащие в основе лигандных технологий лабораторной диагностики, Клиническая лабораторная диагностика, 2010, N 7, С | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| GAO P.J | |||
| et al., Studies on specific interaction of beta-2-glycoprotein I with HBsAg, World J Gastroenterol | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2019-02-21—Публикация
2018-03-19—Подача