Изобретение относится к медицине, конкретно к фармакологии, и касается нейропротекторных средств, обладающих свойствами антиоксиданта и донатора оксида азота.
Имеются нейропротекторные средства, обладающие антиоксидантными свойствами: тирилазад [1, 2], эбселен [3, 4, 5, 10, 11], эмоксипин [6, 7, 11, 12], мексидол [8, 11, 12], афобазол [9].
Имеются нейропротекторные средства, обладающие свойствами донатора оксида азота: препарат L-аргинина тивортин [13, 14, 15, 16].
Задачей изобретения является расширение номенклатуры нейропротекторных средств, обладающих свойствами антиоксиданта и донатора оксида азота.
Поставленная задача достигается использованием натриевой соли 11Н-индено[1,2-b]хиноксалин-11-он-оксима в качестве нейропротекторного средства, обладающего свойствами антиоксиданта и донатора оксида азота.
Известно, что соединение обладает свойствами специфического ингибитора c-JunN-терминальной киназы [17, 18], противовоспалительной активностью на модели коллаген-индуцированного артрита [18]. Исследование нейропротекторных свойств соединения при острых нарушениях мозгового кровообращения, а также его антиоксидантных свойств и свойств донатора оксида азота в литературе не описано.
Принципиально новым в предлагаемом изобретении является то, что в качестве нейропротекторного средства, обладающего свойствами антиоксиданта и донатора оксида азота, используется натриевая соль 11H-индено[1,2-b]хиноксалин-11-он-оксима:
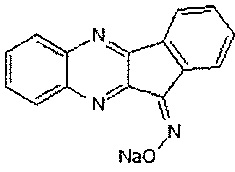
Нейропротекторная активность, свойства антиоксиданта и донатора оксида азота у соединения явным образом не вытекают для специалиста из уровня техники. Соединение может использоваться для лечения цереброваскулярных болезней.
Таким образом, данное техническое решение соответствует критериям изобретения: "новизна", "изобретательский уровень", "промышленная применимость".
Эксперименты по изучению нейропротекторной активности соединения были выполнены на 36 мышах-самцах C57BL6 возраста 10-12 недель.
Нейропротекторную активность соединения исследовали на модели интралюминальной окклюзии средней мозговой артерии у мышей. Для воспроизведения модели в левую внутреннюю сонную артерию вводили силиконизированный нейлоновый филамент Doccol до начала отхождения средней мозговой артерии, перекрывая кровоток в ней на 30 мин, после чего филамент извлекали и проводили реперфузию в течение 48 ч. Температуру тела мышей поддерживали на уровне 36,5-37,5°С. Состоятельность модели оценивали, регистрируя мозговой кровоток методом лазер-Допплеровской флоуметрии в области кровоснабжения левой средней мозговой артерии до, во время и в течение 30 мин после реперфузии. Для этого после скальпирования черепа непосредственно на черепную кость приклеивали оптоволоконный датчик флоуметра. После завершения регистрации мозгового кровотока датчик снимали и кожу ушивали.
Животные были разделены на 3 группы. Мышам контрольной группы I (нелеченые животные, n=11) воспроизводили интралюминальную окклюзию средней мозговой артерии. Мыши контрольной группы II (n=11) получали внутрибрюшинно 100 мкл носителя (10% Solutol HS15, Sigma-Aldrich) за 30 мин до и через 24 ч после окклюзии средней мозговой артерии. Мыши опытной группы (n=10) получали внутрибрюшинно соединение в дозе 25 мг/кг в 100 мкл 10%) Solutol HS15 за 30 мин до и через 24 ч после интралюминальной окклюзии средней мозговой артерии.
Оценку функционального состояния высшей нервной деятельности проводили через 48 ч после реперфузии с использованием 4-балльной шкалы неврологического дефицита. Нормальная двигательная активность оценивалась как 0 баллов, контралатеральное сгибание туловища и предплечья при подъеме мыши за хвост - 1 балл, движение по кругу в контралатеральную сторону - 2 балла, сгибание туловища в контралатеральную сторону в покое - 3 балла, отсутствие спонтанной двигательной активности - 4 балла.
После оценки неврологического статуса проводили эвтаназию мышей передозировкой наркоза, головной мозг извлекали и определяли размер зоны некроза. Для этого мозг нарезали на поперечные (коронарные) сегменты толщиной 2 мм и проводили прижизненную окраску 2% раствором 2,3,5-трифенилтетразолия хлорида в течение 1 ч при 37°С. Окрашенные срезы сканировали и оценивали размер зоны некроза с использованием программы Image NIH. Объем зоны инфаркта (неокрашенная зона) вычисляли в мм, вычитая из объема контралатеральной гемисферы объем жизнеспособной ткани (окрашенной 2,3,5-трифенилтетразолия хлоридом в розовый цвет).
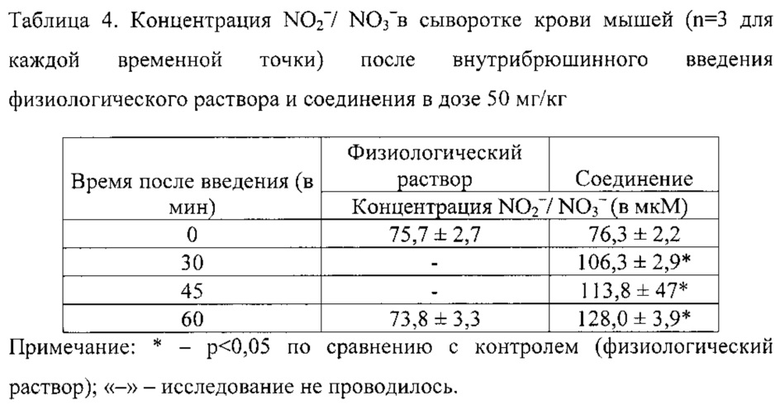
Влияние соединения на уровень оксида азота в сыворотке крови исследовали на мышах мышах-самцах C57BL6 (n=12) до и через 30, 45 и 60 мин после однократного внутрибрюшинного введения соединения в дозе 50 мг/кг в форме суспензии в физиологическом растворе. Уровень оксида азота оценивали с помощью реактива Грисса [19] по суммарному содержанию нитрита и нитрата после перевода последнего в нитрит нитратредуктазой. Для получения сыворотки мышей (по 3 животных на точку) декапитировали, собирали кровь и после ее свертывания отделяли сыворотку центрифугированием. Для перевода нитрата в нитрит использовали набор Nitrate/Nitrite Colorimetric Assay Kit (Cayman Chemical, Ann Arbor, USA).
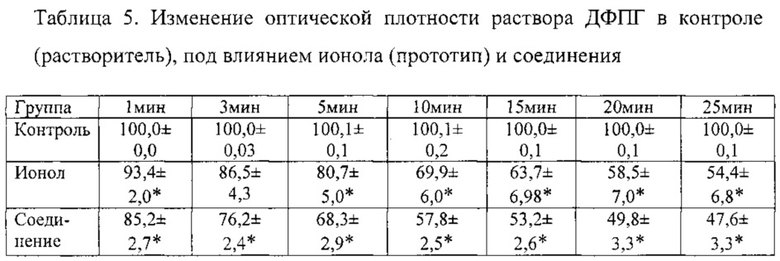
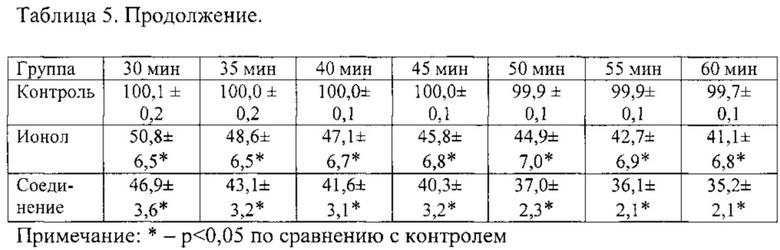
Антиоксидантные свойства соединения исследовали с использованием реакции с 1,1-дифенил-2-пикрилгидразилом (ДФПГ) (Sigma, США), являющимся стабильным свободным радикалом. ДФПГ легко окисляет соединения, обладающие подвижным протоном, оставаясь при этом устойчивым к действию молекулярного кислорода [20]. В качестве препарата сравнения был использован классический антиоксидант 3,5-дибутил-4-гидрокситолуол (ионол, дибунол, ВНТ) (Sigma, США). Активность соединения в отношении радикалов, возникающих в липидной фазе, оценивали, используя в качестве растворителя неполярный этилацетат. Опытные пробы содержали 1 мл раствора ДФПГ с концентрацией 0,25 мМ и 1 мл 0,25 мМ раствора натриевой соли 11H-индено[1,2b]хиноксалин-11-он-оксима или 1 мл 0,25 мМ раствора ионола. Контрольная проба содержала 1 мл раствора ДФПГ с концентрацией 0,25 мМ и 1 мл растворителя (этилацетат). Таким образом, конечные концентрации ДФПГ, натриевой соли 11H-индено[1,2b]хиноксалин-11-он-оксима и ионола в пробах составили 0,125 мМ. Измерение оптической плотности контрольной и опытных проб проводили на спектрофотометре Сагу 50 (Varian, США) сразу после смешивания раствора ДФПГ с растворителем (контрольная проба) или раствором соединения или ионола (опытные пробы), а также через 1, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 и 60 мин. Измеренное значение оптической плотности контрольной пробы сразу после смешивания далее в расчетах принимали за 100%. Антиоксидантную активность оценивали по времени восстановления 50% свободных радикалов ДФПГ (ЕТ50%).
Результаты исследований выражали как среднее±стандартное отклонение. Статистическую обработку результатов проводили стандартными методами с применением t-критерия Стьюдента и критерия Краскела-Уоллеса. При р<0,05 различия считали достоверными.
Результаты исследований нейропротекторной активности соединения представлены в примерах 1, 2 и 3. Результаты исследования соединения, как донатора оксида азота в сыворотке крови приведены в примерах 4 и 5. Результаты исследования антиоксидантной активности соединения представлены в примерах 6, 7 и 8.
Пример 1. В контрольной группе I (нелеченые животные) в первые сутки после реперфузии погибло 3 мыши (табл. 1). Эти животные были исключены из оценки неврологического статуса и размера зоны некроза. Оценка функционального состояния центральной нервной системы через 48 ч после реперфузии показала, что у 75% животных уровень неврологического дефицита составил 2-3 балла, у одного животного - 1 балл, у одного - 0 баллов (табл. 1). Зона некроза составляла 63±18 мм3 (табл. 2).
Пример 2. В контрольной группе II животных с введением 10% солутола в первые сутки после реперфузии погибло 3 мыши (табл. 1). Эти животные были исключены из оценки неврологического статуса и размера зоны некроза. Оценка неврологического статуса через 48 ч после реперфузии показала, что у 75% животных уровень неврологического дефицита составил 2-3 балла, у остальных 25% животных - 1 балл (табл. 1). Зона некроза составляла 82±23% (табл. 2).



Пример 3. В опытной группе III животных с внутрибрюшинным введением соединения в первые сутки после реперфузии погибло 2 мыши (табл. 1). Эти животные были исключены из оценки неврологического статуса и размера зоны некроза. Оценка функционального состояния центральной нервной системы через 48 ч после реперфузии показала, что у 25% животных уровень неврологического дефицита составил 2 балла, у 50% животных - 1 балл, у 25% - 0 баллов (табл. 1). Достоверные различия выявлены при сравнении с группами I и II. Зона некроза составляла 35±24%, что достоверно отличалось от показателя в группах I и II (табл. 2).
Пример 4. Однократное внутрибрюшинное введение физиологического раствора (0.95% раствор хлорида натрия) мышам контрольной группы не приводило к существенному изменению концентрации нитрита + нитрата в сыворотке крови через 60 мин после введения (табл. 4).
Пример 5. Однократное внутрибрюшинное введение мышам соединения в дозе 50 мг/кг приводило к существенному повышению концентрации нитрита + нитрата на 39,3%, 49,2% и 67,8% через 30, 45 и 60 мин после введения, соответственно (табл. 4).
Пример 6. Определение изменения оптической плотности раствора ДФПГ в контроле. К 1 мл 0,25 мМ раствора ДФПГ прибавляли 1 мл этилацетата. Измерение оптической плотности проводили против этилацетата. Оптическая плотность 0,125 мМ раствора не изменялась в течение 60 мин, что свидетельствует о стабильности свободного радикала ДФПГ (табл.5).
Пример 7. Определение изменения оптической плотности раствора ДФПГ под действием ионола. Снижение значения оптической плотности на 60 минуте составило 58,9% относительно исходного значения, время снижения оптической плотности на 50% (ЕТ50%) составило 34,8±10,8 мин (табл. 5).
Пример 8. Определение изменения оптической плотности раствора ДФПГ под действием соединения. Снижение значения оптической плотности на 60 минуте составило 64,9% относительно исходного значения, ЕТ50% составило 23,1±5,7 мин. Соединение вызвало снижение значения оптической плотности к 60 минуте на 14% больше, чем прототип, 50% снижение концентрации радикалов ДФПГ достигалось на 11,7 минут раньше, чем у прототипа. Полученные данные свидетельствуют о наличии высокой антирадикальной активности соединения, не уступающей прототипу ионолу (табл. 5).
Таким образом, соединение натриевая соль 11H-индено[1,2-b]хинокса-лин-11-он-оксима обладает нейропротекторной активностью, снижая размер очага некроза у мышей при экспериментальном ишемическом инсульте в бассейне средней мозговой артерии, уменьшает степень выраженности неврологического дефицита, увеличивает уровень оксида азота в крови мышей и обладает антиоксидантной активностью за счет связывания свободных радикалов.
Источники литературы, принятые во внимание
1. Xue D., Slivka A., Buchan A.M. Tirilazad reduces cortical infarction after transient but not permanent focal cerebral ischemia in rats // Stroke. - 1992. - Vol. 23, Suppl. 6. - P. 894-899.
2. Devuyst G., Bogousslavsky J. Recent progress in drug treatment for acute stroke // J. Neurol. Neurosurg. Psychiatry. - 1999. - Vol. 67, №4. - P. 420-425.
3. Dawson D.A., Masayasu H., Graham D.I., Macrae I.M. The neuroprotective efficacy of ebselen (a glutathione peroxidase mimic) on brain damage induced by transient focal cerebral ischaemia in the rat // Neurosci. Lett. - 1995. - Vol. 185, Suppl. 1. - P. 65-69.
4. Takasago Т., Peters E.E., Graham D.I. et al. Neuroprotective efficacy of ebselen, an anti-oxidant with anti-inflammatory actions, in a rodent model of permanent middle cerebral artery occlusion // Br. J. Pharmacol. - 1997. - Vol. 122, Suppl. 6. - P. 1251-1256.
5. Yamaguchi Т., Sano K., Takakura K. et al. Ebselen in acute ischemic stroke: a placebo-controlled, double-blind clinical trial. Ebselen Study Group // Stroke. - 1998. - Vol. 29, Suppl. 1. - P. 12-17.
6. Шишкина M.B. Хохлова Т.Ю., Шмырев В.И., Стеснилов Г.Е. Применение эмоксипина и эйконола для коррекции гиперлипидемии и процессов перекисного окисления липидов у больных ишемическим инсультом // Интенсивная терапия острых нарушений мозгового кровообращения. - Орел, 1997. - С. 53-58.
7. Гуськова Т.А. Опыт применения антиоксиданта эмоксипина в неврологии // Интенсивная терапия острых нарушений мозгового кровообращения. - Орел, 1997. - С. 257-262.
8. Поварова О.В., Гарибова Т.Л., Каленикова Е.И. Влияние фенил-т-бутилнитрона, мексидола и нооглютила на зону ишемического повреждения и память у крыс после окклюзии средней мозговой артерии // Эксперим. и клин, фармакол. - 2004. - Т. 67, №1 - С. 3-6.
9. Силкина И.В., Зенина Т.А., Середенина С.Б., Мирзоян Р.С. Влияние афобазола на содержание продуктов свободно радикального окисления и активность каталазы у крыс с ишемией головного мозга // Эксперим. и клин, фармакол. - 2006. - Т. 69, №4. - С. 47-50.
10. Daiber A., Zou М.Н., Bashschmid М., Ulrich V.U. Ebselen asperoxynitrite scavenger in vitro and in vivo // Biochem. Pharmacol. - 2000. - Vol. 59, №2. - P. 153-160.
11. Городецкая Е.И.. Медведев О.С. Антиоксиданты как нейропротекторы при ишемическом инсульте // Эксперим. и клин, фармакол - 2003. - Т. 66, №3. - С. 69-73.
12. Клебанов Г.И., Любицкий О.Б., Васильева О.В. и др. Антиоксидантные свойства производных 3-оксипиридина: мексидола, эмоксипина и проксипина // Вопр. мед. химии. - 2001. - Т. 47. - С. 288-300.
13. Xiao Х.М., Li L.P. L-Arginine treatment for asymmetric fetal growth restriction // Int. J. Gynaecol. Obstet. - 2005. - Vol. 88, №1. - P. 15-18.
14. Лисицына H.B. Медикаментозные средства, влияющие на синтез азота и их место в патогенетической терапии преэклампсии // Научные ведомости БелГУ. Сер. Медицина. Фармация. - 2010. - Т. 81, вып. 10. - С. 46-54.
15. Халимова Х.М., Рашидов Н.С. Опыт применения L-аргинина в лечении больных с ишемическим инсультом. Укр. химиотер. журн. - 2012. - Т. 26, №3. - С. 247-249.
16. Беленичев И.Ф., Павлов С.В., Бухтиярова Н.В. и др. Фармакологическая модуляция соотношений NO и тиол-дисульфидной системы - новое направление нейропротекции. Медицина неотложных состояний. - 2010. - Т. 27, №2. С. 65-71.
17. Schepetkin I.A., Kirpotina I.N, Khlebnikov A.I. et al. Identification and characterization of a novel class of c-Jun N-terminal kinase inhibitors // Mol. Pharmacol. - 2012. - Vol. 81. - P. 832-845.
18. Schepetkin I.A., Kirpotina I.N, Hammaker D.et al. Anti-inflammatory effects and joint protection in collagen-induced arthritis following treatment with IQ-1S, a selective c-Jun N-terminal kinase inhibitor // J. Pharmacol. Exp.Ther. - 2015. - Vol. 353. - P. 505-516.
19. Caro A.A., Cederbaum A.I., Stoyanovsky D.A. Oxidation of the ketoximeacetoxime to nitric oxide radical-generating systems // Nitric Oxide. - 2001. - Vol. 5. - P. 413-424.
20. Blois M.S. Antioxidant determination by the use of a stable freeradical //Nature. - 1958. - Vol. 26. - P. 1198-1200.
| название | год | авторы | номер документа |
|---|---|---|---|
| Антигипертензивное средство | 2020 |
|
RU2740379C1 |
| Средство, увеличивающее мозговой кровоток | 2019 |
|
RU2791639C2 |
| НЕЙРОПРОТЕКТОРНОЕ СРЕДСТВО | 2009 |
|
RU2406488C1 |
| Средство, обладающее антиагрегантной активностью | 2019 |
|
RU2696583C1 |
| Микроэмульсионная лекарственная форма для перорального введения | 2023 |
|
RU2839882C1 |
| ПРИМЕНЕНИЕ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ, СОДЕРЖАЩЕЙ ХОЛИНА АЛЬФОСЦЕРАТ И 2-ЭТИЛ-6-МЕТИЛ-3-ГИДРОКСИПИРИДИНА СУКЦИНАТ, В КАЧЕСТВА НЕЙРОПРОТЕКТОРНОГО СРЕДСТВА ПРИ ИШЕМИИ ГОЛОВНОГО МОЗГА | 2023 |
|
RU2819828C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ НЕЙРОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2701739C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИРАДИКАЛЬНЫМИ, ЦЕРЕБРОПРОТЕКТОРНЫМИ И ПРОТИВОИШЕМИЧЕСКИМИ СВОЙСТВАМИ | 2010 |
|
RU2445090C1 |
| Средство, обладающее нейропротекторной активностью | 2019 |
|
RU2800955C2 |
| БИЦИКЛИЧЕСКИЕ ПИРИМИДИНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ-АКТИВАТОРЫ АНТИОКСИДАНТНОЙ ПРОГРАММЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЦИТОПРОТЕКТОРОВ | 2014 |
|
RU2545758C1 |
Изобретение относится к медицине, конкретно к фармакологии. Предложено применение натриевой соли 11H-индено[1,2-b]хиноксалин-11-он-оксима в качестве нейропротекторного средства, обладающего свойствами антиоксиданта и донатора оксида азота. Технический результат: использование натриевой соли 11H-индено[1,2-b]хиноксалин-11-он-оксима у мышей с ишемией/реперфузией головного мозга уменьшает размер очага некроза и степень неврологического дефицита, увеличивает содержание в крови оксида азота; по антиоксидантной активности соединение не уступает эталонному препарату ионолу. Изобретение может использоваться для лечения цереброваскулярных болезней. 4 табл., 8 пр.
Применение натриевой соли 11H-индено[1,2-b]хиноксалин-11-он-оксима в качестве нейропротекторного средства, обладающего свойствами антиоксиданта и донатора оксида азота.
| ПРИМЕНЕНИЕ (2-ИМИДАЗОЛИН-2-ИЛАМИНО) ХИНОКСАЛИНОВ ДЛЯ ЛЕЧЕНИЯ ДЕМЕНЦИИ И БОЛЕЗНИ ПАРКИНСОНА | 2003 |
|
RU2332218C2 |
| СРЕДСТВО ДЛЯ МЕДИКАМЕНТОЗНОЙ КОРРЕКЦИИ НАРУШЕНИЙ НИТРОКСИДЕРГИЧЕСКОЙ СИСТЕМЫ | 2012 |
|
RU2505297C1 |
| FR 2861074 A1, 22.04.2005 | |||
| CN 103800337 A, 21.05.2014 | |||
| SCHEPETKIN I.A | |||
| et al | |||
| Identification and characterization of a novel class of c-Jun N-terminal kinase inhibitors | |||
| Mol | |||
| Pharmacol | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| GHALIB R.M | |||
| et al | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Acta Cryst | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2019-02-22—Публикация
2016-07-05—Подача