ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтической комбинации, включающей ингибитор CDK и антигормональный агент, для лечения рака; применению таких комбинаций в лечении рака; а также к способу лечения теплокровных животных, включая людей, страдающих от рака, включающему введение указанному животному при необходимости такого лечения, эффективной дозы ингибитора CDK и антигормонального агента. Кроме того, упомянутая комбинация необязательно может включать агент, который регулирует сигнальный путь PI3K/Akt/mTOR.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Ингибиторы CDK
Развитие опухоли тесно связано с генетическими изменениями и разрегулированием CDKs и их регуляторов, и это позволяет предположить, что ингибиторы CDKs могут найти применение в качестве противораковых лекарственных средств. Действительно, предварительные результаты показывают, что измененные и нормальные клетки различаются по их потребностям, например, в циклине D/CDK4/6, и что имеется возможность разработки новых антинеопластических агентов, лишенных токсичности в отношении организма хозяина, которая наблюдается у цитотоксичных и цитостатических средств известного уровня техники.
Функция CDKs заключается в фосфорилировании и за счет этого активации или дезактивации некоторых белков, в т.ч., например, белков ретинобластомы, ламинов, гистона H1 и компонентов митотического веретена. Каталитическая стадия, опосредуемая CDKs, включает реакцию переноса фосфатной группы от АТФ к макромолекулярному ферментному субстрату. Было обнаружено, что несколько групп соединений (обзор которых можно найти, например, в Fisher, P.M. Curr. Opin. Drug Discovery Dev. 2001, 4, 623-634), обладают антипролиферативными свойствами за счет CDK-специфичного антагонизма АТФ.
На молекулярном уровне опосредование активности комплекса CDK/циклин требует ряда последовательных стимулирующих и ингибирующих актов фосфорилирования или дефосфорилирования. Фосфорилирование CDK осуществляется группой CDK-активирующих киназ (CAKs) и/или таких киназ, как wee1, Myt1 и Mik1. Дефосфорилирование осуществляется фосфатазами, такими как cadc25 (a и c), pp2a или KAP.
Активность комплекса CDK/циклин может дополнительно регулироваться двумя семействами эндогенных клеточных белковоподобных ингибиторов: семейством Kip/Cip или семейством INK. Белки INK специфично связывают CDK4 и CDK6. Ген p16ink4 (известный также, как MTS1) является потенциальным супрессорным геном опухолей, который подвергается мутации или делеции в большом числе первичных раковых опухолей. Семейство Kip/Cip включает такие белки, как p21Cip1, Waf1, p27Kip1 и p57kip2, где p21 индуцируется p53 и способен инактивировать комплекс CDK2/циклин (E/A). Атипично низкие уровни экспрессии p27 наблюдались при раке груди, ободочной кишки и простаты. С другой стороны, было показано, что избыточная экспрессия циклина E в солидных опухолях коррелирует с плохим прогнозом для пациента. Избыточная экспрессия циклина D1 связана с раковыми заболеваниями пищевода, груди, сквамозной и немелкоклеточной карциномой легких.
Ключевая роль CDKs и связанных с ними белков в координировании и развитии клеточного цикла в пролиферирующих клетках была обозначена выше. Также были описаны некоторые из биохимических путей, в которых ключевую роль играют CDKs. Следовательно, потенциально очень желательной является разработка способов монотерапии для лечения пролиферативных расстройств, например, раковых заболеваний, с использованием методик, нацеленных на представителей семейства CDK или на конкретные CDKs. Таким образом, существует постоянная потребность в обнаружении новых терапевтических агентов для лечения заболеваний у людей.
Антигормональный агент
Антигормональный агент действует двумя путями: (1) снижая количество гормона в организме или (2) блокируя действие гормона на клетки.
Известны различные типы антигормональных агентов.
Одним из известных типов антигормональных агентов являются ингибиторы ароматазы. Ингибиторы ароматазы действуют за счет подавления деятельности фермента ароматаза, которая превращает андрогены в эстрогены в ходе процесса, именуемого ароматризацией. Поскольку ткани груди подвергаются стимулированию под действием эстрогенов, уменьшение их выработки является способом подавления рецидивов опухолей груди. У женщин предклимактерического возраста основной источник эстрогена находится в яичниках, тогда как у женщин постклимактерического возраста большинство эстрогена в организме вырабатывается в периферических тканях (вне ЦНС), а также в отдельных участках ЦНС в различных областях мозга. Эстроген в этих тканях продуцируется и действует местно, но любой циркулирующий в организме эстроген, который оказывает системное эстрогенное действие у мужчин и женщин, появляется в результате того, что эстроген избегает локального метаболизма и распространяется по кровеносной системе. Существует два типа ингибиторов ароматазы: (1) стероидные ингибиторы, как, например, экземестан (аромазин), которые образуют постоянную и дезактивирующую связь с ферментом ароматазой; и (2) не стероидные ингибиторы, как, например, анастрозол (аримидекс) или летрозол (фемара), которые подавляют синтез эстрогена за счет обратимой конкуренции за фермент ароматазу.
Другим типом антигормональных агентов являются антагонисты рецептора эстрогена. Примером антагониста рецептора эстрогена является фульвестрант (фазлодекс). Рецепторы эстрогена находятся в и на клетках тканей груди. Эстроген связывается с рецепторами эстрогена, как ключ, подходящий к замку. Это может активировать рецептор и вызвать рост гормон рецептор-положительных опухолей. Фульвестрант связывается с рецепторами эстрогена, блокирует их и уменьшает количество рецепторов эстрогена в клетках груди.
Еще одним типом антигормональных агентов являются селективные модуляторы рецепторов эстрогена (SERMs), которые представляют собой класс соединений, действующих на рецепторы эстрогена. Характеристика, которая отличает эти вещества от чистых агонистов и антагонистов рецепторов, заключается в том, что их действие является различным в разных тканях, за счет чего у них имеется возможность селективно ингибировать или стимулировать эстроген-подобное действие в различных тканях. Примером SERM является тамоксифен. Тамоксифен является агонистом рецепторов эстрогена в тканях костей и матки, но антагонистом в тканях груди.
Агенты, которые регулируют сигнальный путь PI3K/Akt/mTOR
Сигнальный путь PI3K/Akt/mTOR является важным, жестко регулируемым путем выживания нормальных клеток. Фосфатидилинозит 3-киназы (PI3Ks) представляют собой липидкиназы, которые катализируют перенос фосфатной группы в D-3’ положение инозитсодержащих липидов с образованием фосфоинозит-3-фосфата (PIP), фосфоинозит-3,4-дифосфата (PIP2) и фосфоинозит-3,4,5-трифосфата (PIP3). Эти продукты реакций, катализируемых PI3K, действуют в качестве вторичных мессенджеров и играют центральные роли в ключевых клеточных процессах, в т.ч. росте, дифференцировке, подвижности, пролиферации и выживании клеток.
Из двух представителей PI3Ks класса 1, PI3Ks класса 1A являются гетеродимерами, состоящими из каталитической субъединицы p110 (изоформы α,β,γ) конститутивно связанной с регулирующей субъединицей, которая может представлять собой p85α, p55α, p50α, p85β или p55γ. Подкласс 1B этого класса включает один член семейства, а именно гетеродимер, состоящий из каталитической субъединицы p110γ, связанной с одной или двумя регулирующими субъединицами p101 или p84 (Fruman et al., Annu Rev. Biochem. 67:481 (1998); Suire et al., Curr.Biol. 15:566 (2005)).
Во многих случаях, PIP2 и PIP3 приводят к переносу AKT на цитоплазматическую мембрану, где AKT действует в качестве узловой точки для многих внутриклеточных сигнальных путей, важных для роста и выживания (Fantl et al., Cell 69:413-423(1992); Bader et al., Nature Rev. Cancer 5:921 (2005); Vivanco and Sawyer, Nature Rev. Cancer 2:489 (2002)). Нарушенное регулирование PI3K, которое часто усиливает выживание за счет активации AKT, является одним из наиболее распространенных явлений при раке у человека, причем было показано, что оно происходит на нескольких уровнях. Ген-супрессор роста опухоли PTEN, который вызывает дефосфорилирование фосфоинозитидов по положению 3’ цикла инозита и из-за этого противодействует активности PI3K, подвергается функциональной делеции в целом ряде опухолей. Как было показано для нескольких человеческих опухолей, в других опухолях гены, кодирующие изоформу p110α, PIK3CA и AKT, амплифицированы и наблюдается повышенная экспрессия белковых продуктов этих генов. Кроме того было описано, что соматические миссенс-мутации в PIK3CA, которые активируют нисходящие сигнальные пути, со значительной частотой возникают в целом ряде раковых опухолей человека (Kang et al., Proc. Natl. Acad. Sci. USA 102:802 (2005); Samuels et al., Science 304:554 (2004); Samuels et al., Cancer Cell 7:561-573 (2005)). Так, например, известно, что ингибиторы PI3K альфа имеют определенную ценность при лечении рака и других расстройств.
mTOR представляет собой белковую киназу, преимущественно находящуюся в цитоплазме клетки. mTOR действует в качестве основного регулятора многих биологических процессов, связанных с клеточной пролиферацией, ангиогенезом и клеточным метаболизмом. mTOR действует главным образом за счет включения и выключения аппарата клеточной трансляции, в который входят рибосомы, и отвечает за синтез белков. mTOR является ключевой внутриклеточной точкой схождения для целого ряда путей передачи сигналов в клетках. mTOR осуществляет свою регулирующую функцию в ответ на активирующие или ингибирующие сигналы, передаваемые через эти сигнальные пути, которые расположены выше по пути передачи клеточного сигнала относительно mTOR. Эти разнообразные сигнальные пути активируются за счет целого ряда факторов роста (включая сосудистые эндотелиальные факторы роста (VEGFs), тромбоцитарный фактор роста (PDGF), эпидермальный фактор роста (EGF), инсулиноподобный фактор роста 1 (IGF-1)), гормонов (эстрогена, прогестерона), а также наличия или отсутствия нутриентов (глюкозы, аминокислот) или кислорода. Один или несколько из этих сигнальных путей может подвергаться аномальной активации у пациентов при многих различных типах раковых заболеваний, приводя к разрегулированию клеточной пролиферации, ангиогенезу в опухоли и аномальному клеточному метаболизму.
Несмотря на наличие многочисленные способов лечения раковых пациентов, остается потребность в эффективных и безопасных терапевтических агентах и необходимость в их предпочтительном применении в комбинированной терапии.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической комбинации, включающей (1) первый агент, который является ингибитором CDK или его фармацевтически приемлемой солью, и (2) второй агент, который является антигормональным агентом или его фармацевтически приемлемой солью.
Кроме того, настоящее изобретение относится к фармацевтической комбинации, включающей (1) первый агент, который является ингибитором CDK или его фармацевтически приемлемой солью, (2) второй агент, который является антигормональным агентом или его фармацевтически приемлемой солью, и (3) третий агент, который является агентом, регулирующим сигнальный путь PI3K/Akt/mTOR, или его фармацевтически приемлемой солью.
Такая комбинация может быть предназначена для одновременного, раздельного или последовательного применения в лечении рака.
В одном из вариантов осуществления, ингибитор CDK является ингибитором CDK4/6.
Ингибитор CDK4/6 может представлять собой, например,
Соединение A1, представленное приведенной ниже формулой A1:
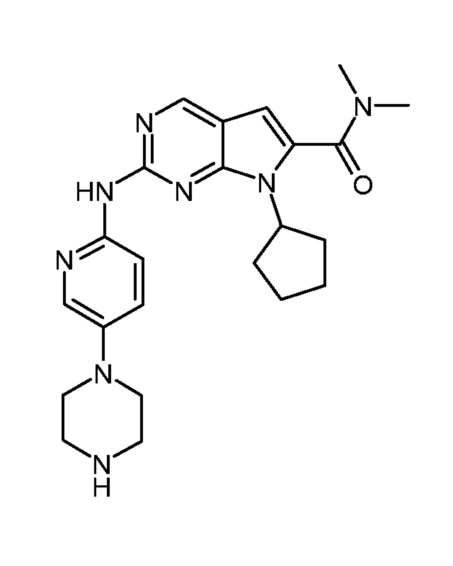
(A1)
или
Соединение A2, представленное приведенной ниже формулой A2:
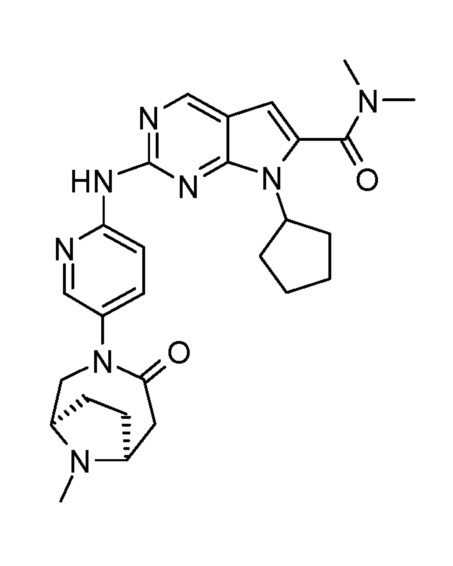
(A2)
или
палбоциклиб (далее по тексту именуемый соединением A3, также известный как PD-0332991).
Соединение A1 описано также под химическим наименованием диметиламид 7-циклопентил-2-(5-пиперазин-1-ил-пиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты.
Соединение A2 описано также под химическим наименованием 7-циклопентил-N,N-диметил-2-(5-((1R,6S)-9-метил-4-оксо-3,9-диазабицикло[4.2.1]нонан-3-ил)пиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоксамид.
Соединение A3 описано также под химическим наименованием 6-ацетил-8-циклопентил-5-метил-2-{[5-(1-пиперазинил)-2-пиридинил]амино}пиридо[2,3-d]пиримидин-7(8H)-он.
В одном из вариантов осуществления, антигормональный агент представляет собой ингибитор ароматазы. Этот ингибитор ароматазы может быть либо нестероидным ингибитором ароматазы, либо стероидным ингибитором ароматазы.
Летрозол (далее по тексту именуемый соединением B1) является примером нестероидного ингибитора ароматазы.
Экземестан (далее по тексту именуемый соединением B2) является примером стероидного ингибитора ароматазы.
В другом варианте осуществления, антигормональный агент представляет собой антагонист рецептора эстрогена.
Фульвестрант (далее по тексту именуемый соединением B3) представляет собой пример антагониста рецептора эстрогена.
В еще одном варианте осуществления, антигормональный агент представляет собой селективный модулятор рецептора эстрогена.
Тамокисфен (далее по тексту именуемый соединением B4) является примером селективного модулятора рецептора эстрогена.
В одном из вариантов осуществления, агент, который регулирует сигнальный путь PI3K/Akt/mTOR, представляет собой ингибитор PI3K.
Ингибитор PI3K может представлять собой, например,
соединение C1, представленное приведенной ниже формулой C1:
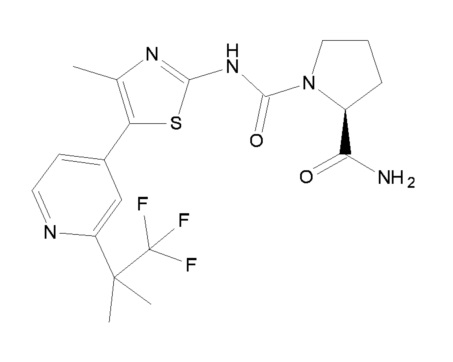
(C1)
или
соединение C2, представленное приведенной ниже формулой C2:
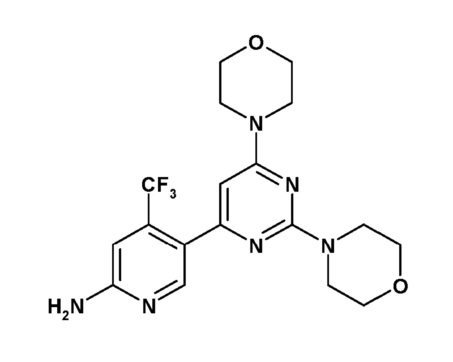
(C2)
Соединение C1 также описано под химическим наименованием (S)-пирролидин-1,2-дикарбоновой кислоты 2-амида 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметил-этил)пиридин-4-ил]тиазол-2-ил}амид).
Соединение C2 также описано под химическим наименованием 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-(трифторметил)-2-пиридинамин.
В другом варианте осуществления, агент, который регулирует сигнальный путь PI3K/Akt/mTOR, представляет собой ингибитор mTOR.
Эверолимус (далее по тексту именуемый соединением C3) является примером ингибитора mTOR.
Далее, настоящее изобретение относится к описанной выше фармацевтической комбинации (комбинациям) для применения в лечении рака.
Далее, настоящее изобретение относится к способу лечения рака, включающему введение описанной выше фармацевтической комбинации (комбинаций) в совместно терапевтически эффективном количестве, теплокровному животному, предпочтительно человеку, которому это необходимо.
Согласно настоящему изобретению, соединения в фармацевтической комбинации (комбинациях) могут вводиться либо в виде единой фармацевтической композиции, либо в виде отдельных композиций или последовательно.
В конкретном варианте осуществления, изобретение относится к фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
и (2) второй агент, который представляет собой летрозол.
В другом конкретном варианте осуществления, изобретение относится к фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой летрозол, и
(3) третий агент, который является соединением C1, представленным приведенной ниже формулой C1, или его фармацевтически приемлемой солью:

(C1)
В другом конкретном варианте осуществления, изобретение относится к фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой тетразол, и
(3) третий агент, который является соединением C2, представленным приведенной ниже формулой C2, или его фармацевтически приемлемой солью:

(C2).
В другом конкретном варианте осуществления, изобретение относится к фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
и (2) второй агент, который представляет собой фульвестрант.
В следующем конкретном варианте осуществления, изобретение относится к фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой фульвестрант, и
(3) третий агент, который является соединением C1, представленным приведенной ниже формулой C1, или его фармацевтически приемлемой солью:

(C1)
В следующем конкретном варианте осуществления, изобретение относится к фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой фульвестрант, и
(3) третий агент, который является соединением C2, представленным приведенной ниже формулой C2, или его фармацевтически приемлемой солью:

(C2)
В другом конкретном варианте осуществления, изобретение относится к фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой эверолимус, и
(3) третий агент, который представляет собой экземестан.
В другом конкретном варианте осуществления, изобретение относится к способу лечения HR+, HER2- рака груди, включающему введение субъекту фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
и (2) второй агент, который представляет собой летрозол.
В следующем конкретном варианте осуществления, изобретение относится к способу лечения ER+, HER2- распространенного рака груди, включающему введение субъекту фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
и (2) второй агент, который представляет собой летрозол.
В другом конкретном варианте осуществления, изобретение относится к способу лечения ER+ распространенного рака груди, включающему введение субъекту фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой летрозол, и
(3) третий агент, который является соединением C1, представленным приведенной ниже формулой C1, или его фармацевтически приемлемой солью:

(С1).
В следующем конкретном варианте осуществления, изобретение относится к способу лечения ER+ распространенного рака груди, включающему введение субъекту фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой летрозол, и
(3) третий агент, который является соединением C2, представленным приведенной ниже формулой C2, или его фармацевтически приемлемой солью:

(C2).
В следующем конкретном варианте осуществления, изобретение относится к способу лечения женщин постклимактерического возраста с ER+, HER2- раком груди, включающему введение субъекту фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
и (2) второй агент, который представляет собой фульвестрант.
В другом конкретном варианте осуществления, изобретение относится к способу лечения женщин постклимактерического возраста с ER+, HER2- раком груди, включающему введение субъекту фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой фульвестрант, и
(3) третий агент, который является соединением C1, представленным приведенной ниже формулой C1, или его фармацевтически приемлемой солью:

(C1).
В следующем конкретном варианте осуществления, изобретение относится к способу лечения женщин постклимактерического возраста с ER+, HER2-раком груди, включающему введение субъекту фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой фульвестрант, и
(3) третий агент, который является соединением C2, представленным приведенной ниже формулой C2, или его фармацевтически приемлемой солью:

(C2).
В еще одном конкретном варианте осуществления, изобретение относится к способу лечения ER+ рака груди, включающему введение субъекту фармацевтической комбинации, включающей (1) первый агент, который является соединением A1, представленным приведенной ниже формулой A1, или его фармацевтически приемлемой солью:

(A1)
(2) второй агент, который представляет собой эверолимус, и
(3) третий агент, который представляет собой экземестан.
Кроме того, настоящее изобретение относится к набору, включающему фармацевтическую комбинацию по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
На Фиг.1 показана матрица длительного дозирования и изоболограмма, демонстрирующая действие комбинированных доз соединения A1 и соединения B1 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.2 показана матрица длительного дозирования и изоболограмма, демонстрирующая действие комбинированных доз соединения A1 и соединения B2 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.3 показана матрица длительного дозирования и изоболограмма, демонстрирующая действие комбинированных доз соединения A1 и соединения B3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.4 показана матрица длительного дозирования, демонстрирующая действие комбинации соединения A1 и соединения B1 в присутствии или в отсутствии соединения C1, соединения C2 или соединения C3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.5 показана матрица длительного дозирования, демонстрирующая действие комбинации соединения A1 и соединения B2 в присутствии или в отсутствии соединения C1, соединения C2 или соединения C3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.6 показана матрица длительного дозирования, демонстрирующая действие комбинации соединения A1 и соединения B3 в присутствии или в отсутствии соединения C1, соединения C2 или соединения C3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.7 показан рост клеток MCF7/Aro под действием Δ4A в течение 6 дней по данным анализа CTG.
На Фиг.8 показана матрица длительного дозирования и изоболограмма, демонстрирующая действие комбинированных доз соединения A3 и соединения B1 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.9 показана матрица длительного дозирования и изоболограмма, демонстрирующая действие комбинированных доз соединения A2 и соединения B1 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.10 показана матрица длительного дозирования, демонстрирующая действие комбинации соединения A3 и соединения B1 в присутствии или в отсутствии соединения C1 или соединения C3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.11 показана матрица длительного дозирования, демонстрирующая действие комбинации соединения A2 и соединения B1 в присутствии или в отсутствии соединения C1 или соединения C3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.12 показана матрица длительного дозирования и изоболограмма, демонстрирующая действие комбинированных доз соединения A3 и соединения B2 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.13 показана матрица длительного дозирования и изоболограмма, демонстрирующая действие комбинированных доз соединения A2 и соединения B2 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.14 показана матрица длительного дозирования, демонстрирующая действие комбинации соединения A3 и соединения B2 в присутствии или в отсутствии соединения C1 или соединения C3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.15 показана матрица длительного дозирования, демонстрирующая действие комбинации соединения A2 и соединения B2 в присутствии или в отсутствии соединения C1 или соединения C3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.16 показана матрица длительного дозирования и изоболограмма, демонстрирующая действие комбинированных доз соединения A3 и соединения B3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.17 показана матрица длительного дозирования и изоболограмма, демонстрирующая действие комбинированных доз соединения A2 и соединения B3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.18 показана матрица длительного дозирования, демонстрирующая действие комбинации соединения A3 и соединения B3 в присутствии или в отсутствии соединения C1 или соединения C3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.19 показана матрица длительного дозирования, демонстрирующая действие комбинации соединения A2 и соединения B3 в присутствии или в отсутствии соединения C1 или соединения C3 на пролиферацию клеток карциномы груди человека MCF7/ARO под действием Δ4A.
На Фиг.20-22 показана противоопухолевая эффективность различных соединений, применяемых в качестве индивидуальных агентов, в виде комбинаций двух или трех агентов в модели ксенотрансплантата HBCx-34, полученного из груди человека.
На Фиг.23 показан план клинического исследования, описанного в примере 3.
На Фиг. 24 и 25 показана продолжительность лечения в группе 1 и группе 2 клинического исследования, описанного в примере 3 (предварительные результаты).
На Фиг.26 показана частичная реакция на терапию, наблюдаемая у пациентов с метастатическим раком груди, подвергавшихся воздействию соединения A1 и летрозола.
На Фиг.27 показан план клинического исследования, описанного в примере 5.
На Фиг. 28 и 29 показаны профили зависимости средней концентрация в плазме от времени для соединения A1 и EVE у пациентов, получавших соединение A1 + EVE + EXE в C1D15.
На Фиг.30 показана продолжительность лечения в клиническом исследовании, описанном в примере 5 (предварительные результаты).
На Фиг.31 показано ослабление метастазов в мягких тканях у пациента с метастазами в лимфатических узлах, плевре, легких и мягких тканях, который получал курс лечения предыдущей линии анастрозолом и курс лечения предыдущей линии фульвестрантом при распространенном/метастатическом раке.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующие далее по тексту общие определения приведены для лучшего понимания описания изобретения.
Термин «ингибитор ароматазы» в настоящем описании относится к соединениям, которые ингибируют выработку эстрогена, т.е. превращение субстратов андростендиона и тестостерона в эстрон и эстрадиол, соответственно. Такие соединения будут именоваться в тексте «ингибиторами ароматазы».
Термин «селективный модулятор рецептора эстрогена (SERM)» относится к соединению (соединениям), которые действуют на рецептор эстрогена. Характеристика, которая отличает SERMs от чистых агонистов и антагонистов рецептора, заключается в том, что их действие в разных тканях является различным, что предоставляет возможность селективно ингибировать или стимулировать эстроген-подобное действие в разных тканях.
Термин «ингибитор PI3K» в настоящей заявке относится к соединению, которое нацеливает, понижает активность или ингибирует фосфатидилинозит 3-киназу. Было показано, что активность фосфатидилинозит 3-киназы возрастает в ответ на стимулирующее действие ряда гормонов и факторов роста, включая инсулин, тромбоцитарный фактор роста, инсулиноподобный фактор роста, эпидермальный фактор роста, колониестимулирующий фактор и фактор роста гепатоцитов, и данная киназа вовлечена в процессы, относящиеся к росту и превращению клеток.
Термин «комбинация» относится либо к фиксированной комбинации в составе одной дозированной форы, либо к не фиксированной комбинации (или набору, состоящему из компонентов) для комбинированного введения, где соединение и его партнера по комбинации (например, другое лекарственное средство, описанное ниже, также именуемое «терапевтическим агентом» или «ко-агентом») можно вводить независимо в одно и то же время или отдельно в течение определенного промежутка времени, в частности, когда эти промежутки времени позволяют партнерам по комбинации проявить совместное, например, синергетическое действие. Имеется в виду, что при использовании в настоящей заявке термин «комбинированное введение» или подобные охватывает введение указанного партнера по комбинации тому же самому субъекту, которому это необходимо (например, пациенту), причем этот термин включает схемы лечения, в которых агенты необязательно вводят одним и тем же путем или в одно и то же время. Термин «фиксированная комбинация» означает, что действующие ингредиенты, например, соединение формулы A1 и его партнер по комбинации, вводятся пациенту одновременно в форме единого целого или одной единицы дозированной формы. Термины «не фиксированная комбинация» или «набор составных частей» означают, что действующие ингредиенты, например, соединение формулы A1 и его партнер по комбинации, вводятся пациенту по отдельности одновременно или последовательно без конкретных временных ограничений, где такое введение обеспечивает терапевтически эффективные уровни двух указанных соединений в организме пациента.
Термин «лечение» включает профилактическое и терапевтическое лечение (в т.ч., но не ограничиваясь этим, паллиативное лечение, лечение, направленное на выздоровление, лечение, облегчающее симптомы, лечение, уменьшающее симптомы), а также отсрочку прогрессирования ракового заболевания или расстройства. Термин «профилактический» означает предотвращение начала или рецидива рака. Термин «отсрочка прогрессирования» в настоящей заявке означает введение комбинации по настоящему изобретению пациенту, который находится на ранней или начальной стадии ракового заболевания, подвергаемого лечению, у которого диагностирована ранняя форма соответствующего ракового заболевания и/или у пациента диагностировано состояние, при котором вероятно развитие соответствующего ракового заболевания.
Термины «фармацевтический препарат» или «фармацевтическая композиция» относятся к смеси или раствору, содержащему по крайней мере один терапевтический агент, которые предназначены для введения теплокровному животному, например, человеку.
Имеется в виду, что термины «совместное введение», «комбинированное введение» или подобные охватывают введение указанных терапевтических агентов одному и тому же пациенту, и предполагается, что эти термины включают схемы лечения в которых эти агенты необязательно вводятся одним и тем же путем или в одно и то же время.
Термин «фармацевтически приемлемый» относится к соединениям, материалам, композициям и/или дозированным формам, которые в рамках обоснованной медицинской точки зрения подходят для контакта с тканями млекопитающих, в т.ч. людей, без слишком высокой токсичности, раздражающего действия, аллергических реакций и других осложнений, и соответствуют разумному соотношению польза/риск.
Термин «терапевтически эффективный» предпочтительно относится к количеству терапевтического агента, которое терапевтически или, в более широком смысле, также и профилактически эффективно против прогрессирования рака.
Термин «терапевтически эффективный при совместном введении (совместно терапевтически эффективный)» означает, что терапевтические агенты могут вводиться отдельно (со смещением по времени, в т.ч. в определенной последовательности) с такими временными интервалами, что они по-прежнему демонстрируют взаимодействие (предпочтительно синергетическое) у теплокровных животных, в т.ч. у людей, которые подвергаются лечению. Имеется ли наличие подобного взаимодействия можно определить, в том числе, осуществляя наблюдение за уровнями терапевтических агентов в крови, которое демонстрирует, что оба соединения присутствуют в крови человека, подвергаемого лечению, по крайней мере в течение определенных промежутков времени.
Термин «единая фармацевтическая композиция» относится к единой лекарственной форме или средству доставки, предназначенным для введения пациенту эффективных количеств обоих терапевтических агентов. Единая лекарственная форма предназначена для доставки эффективного количества каждого из действующих агентов, и наряду с ними содержит любые фармацевтически приемлемые носители или эксципиенты. В некоторых вариантах осуществления, упомянутая лекарственная форма представляет собой таблетку, капсулу, пилюлю или пластырь. В других вариантах осуществления, лекарственная форма представляет собой раствор или суспензию.
Термин «диапазон дозировок» относится к верхней и нижней границе приемлемого изменения количества указанного терапевтического агента. Как правило, пациентам, которые подвергаются лечению, может вводиться любая доза агента в пределах указанного диапазона.
Имеется в виду, что термины «субъект», «пациент» или «теплокровное животное» охватывают животных. Примеры субъектов включают млекопитающих, например, людей, собак, коров, лошадей, свиней, овец, коз, кошек, мышей, кроликов, крыс, а также трансгенных животных, не являющихся людьми. В некоторых вариантах осуществления, субъект является человеком, например, человеком, который страдает от опухолевого заболевания мозга, находится под риском такого заболевания или потенциально способен страдать от опухолевого заболевания мозга. Особенно предпочтительно, субъект или теплокровное животное является человеком.
Термины «примерно» или «приблизительно», как правило, означают в пределах 20%, более предпочтительно, в пределах 10% и наиболее предпочтительно в пределах 5% от данной величины или диапазона. В качестве альтернативы, особенно в биологических системах, термин «примерно» означает примерно в пределах единицы десятичного логарифма (т.е. порядка величины), предпочтительно, в пределах двукратного изменения относительно данной величины.
Настоящее изобретение относится к фармацевтической комбинации, включающей (1) ингибитор CDK или его фармацевтически приемлемую соль и (2) антигормональный агент или его фармацевтически приемлемую соль.
Кроме того, настоящее изобретение относится к фармацевтической комбинации, включающей (1) ингибитор CDK или его фармацевтически приемлемую соль, (2) антигормональный агент или его фармацевтически приемлемую соль и (3) агент, который регулирует сигнальный путь PI3K/Akt/mTOR, или его фармацевтически приемлемую соль.
Такая комбинация может быть предназначена для одновременного, раздельного или последовательного применения для лечения рака.
В одном из вариантов осуществления, ингибитор CDK является ингибитором CDK4/6.
Ингибитор CDK4/6 может представлять собой, например,
Соединение A1, представленное приведенной ниже формулой A1:

(A1)
или соединение A2, представленное приведенной ниже формулой A2:

(A2)
или
палбоциклиб (далее по тексту именуемый соединением A3, известный также как PD-0332991).
Соединение A1 описано также под химическим наименованием диметиламид 7-циклопентил-2-(5-пиперазин-1-ил-пиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты.
Соединение A2 описано также под химическим наименованием 7-циклопентил-N,N-диметил-2-(5-((1R,6S)-9-метил-4-оксо-3,9-диазабицикло[4.2.1]нонан-3-ил)пиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоксамид.
Соединение A3 описано также под химическим наименованием 6-ацетил-8-циклопентил-5-метил-2-{[5-(1-пиперазинил)-2-пиридинил]амино}пиридо[2,3-d]пиримидин-7(8H)-он.
В одном из вариантов осуществления, антигормональный агент представляет собой ингибитор ароматазы. Этот ингибитор ароматазы может быть либо нестероидным ингибитором ароматазы, либо стероидным ингибитором ароматазы.
Летрозол (далее по тексту именуемый соединением B1) является примером нестероидного ингибитора ароматазы.
Экземестан (далее по тексту именуемый соединением B2) является примером стероидного ингибитора ароматазы.
В другом варианте осуществления, антигормональный агент представляет собой антагонист рецептора эстрогена.
Фульвестрант (далее по тексту именуемый соединением B3) представляет собой пример антагониста рецептора эстрогена.
В еще одном варианте осуществления, антигормональный агент представляет собой селективный модулятор рецептора эстрогена.
Тамокисфен (далее по тексту именуемый соединением B4) является примером селективного модулятора рецептора эстрогена.
В одном из вариантов осуществления, агент, который регулирует сигнальный путь PI3K/Akt/mTOR, представляет собой ингибитор PI3K.
Ингибитор PI3K может представлять собой, например,
соединение C1, представленное приведенной ниже формулой C1:

(C1)
или
соединение C2, представленное приведенной ниже формулой C2:

(C2)
Соединение C1 также описано под химическим наименованием (S)-пирролидин-1,2-дикарбоновой кислоты 2-амида 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметил-этил)пиридин-4-ил]тиазол-2-ил}амид).
Соединение C2 также описано под химическим наименованием 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-(трифторметил)-2-пиридинамин.
В другом варианте осуществления, агент, который регулирует сигнальный путь PI3K/Akt/mTOR, представляет собой ингибитор mTOR.
Эверолимус (далее по тексту именуемый соединением C3) является примером ингибитора mTOR.
Конкретные варианты осуществления включают следующие комбинации:
(1) Комбинацию, включающую соединение A1 и соединение B1;
(2) Комбинацию, включающую соединение A1 и соединение B2;
(3) Комбинацию, включающую соединение A1 и соединение B3;
(4) Комбинацию, включающую соединение A1 и соединение B4;
(5) Комбинацию, включающую соединение A2 и соединение B1;
(6) Комбинацию, включающую соединение A2 и соединение B2;
(7) Комбинацию, включающую соединение A2 и соединение B3;
(8) Комбинацию, включающую соединение A2 и соединение B4;
(9) Комбинацию, включающую соединение A3 и соединение B1;
(10) Комбинацию, включающую соединение A3 и соединение B2;
(11) Комбинацию, включающую соединение A3 и соединение B3;
(12) Комбинацию, включающую соединение A3 и соединение B4;
(13) Комбинацию, включающую соединение A1, соединение B1 и соединение C1;
(14) Комбинацию, включающую соединение A1, соединение B1 и соединение C2;
(15) Комбинацию, включающую соединение A1, соединение B1 и соединение C3;
(16) Комбинацию, включающую соединение A1, соединение B2 и соединение C1;
(17) Комбинацию, включающую соединение A1, соединение B2 и соединение C2;
(18) Комбинацию, включающую соединение A1, соединение B2 и соединение C3;
(19) Комбинацию, включающую соединение A1, соединение B3 и соединение C1;
(20) Комбинацию, включающую соединение A1, соединение B3 и соединение C2;
(21) Комбинацию, включающую соединение A1, соединение B3 и соединение C3;
(22) Комбинацию, включающую соединение A1, соединение B4 и соединение C1;
(23) Комбинацию, включающую соединение A1, соединение B4 и соединение C2;
(24) Комбинацию, включающую соединение A1, соединение B4 и соединение C3;
(25) Комбинацию, включающую соединение A2, соединение B1 и соединение C1;
(26) Комбинацию, включающую соединение A2, соединение B1 и соединение C2;
(27) Комбинацию, включающую соединение A2, соединение B1 и соединение C3;
(28) Комбинацию, включающую соединение A2, соединение B2 и соединение C1;
(29) Комбинацию, включающую соединение A2, соединение B2 и соединение C2;
(30) Комбинацию, включающую соединение A2, соединение B2 и соединение C3;
(31) Комбинацию, включающую соединение A2, соединение B3 и соединение C1;
(32) Комбинацию, включающую соединение A2, соединение B3 и соединение C2;
(33) Комбинацию, включающую соединение A2, соединение B3 и соединение C3;
(34) Комбинацию, включающую соединение A2, соединение B4 и соединение C1;
(35) Комбинацию, включающую соединение A2, соединение B4 и соединение C2;
(36) Комбинацию, включающую соединение A2, соединение B4 и соединение C3;
(37) Комбинацию, включающую соединение A3, соединение B1 и соединение C1;
(38) Комбинацию, включающую соединение A3, соединение B1 и соединение C2;
(39) Комбинацию, включающую соединение A3, соединение B1 и соединение C3;
(40) Комбинацию, включающую соединение A3, соединение B2 и соединение C1;
(41) Комбинацию, включающую соединение A3, соединение B2 и соединение C2;
(42) Комбинацию, включающую соединение A3, соединение B2 и соединение C3;
(43) Комбинацию, включающую соединение A3, соединение B3 и соединение C1;
(44) Комбинацию, включающую соединение A3, соединение B3 и соединение C2;
(45) Комбинацию, включающую соединение A3, соединение B3 и соединение C3;
(46) Комбинацию, включающую соединение A3, соединение B4 и соединение C1;
(47) Комбинацию, включающую соединение A3, соединение B4 и соединение C2; и
(48) Комбинацию, включающую соединение A3, соединение B4 и соединение C3.
Кроме того, настоящее изобретение относится к перечисленным выше фармацевтическим комбинациям для применения в лечении рака.
Далее, настоящее изобретение относится к способу лечения рака, включающему введение описанной выше фармацевтической комбинации (комбинаций) в совместно терапевтически эффективном количестве, теплокровному животному, предпочтительно человеку, которому это необходимо.
Согласно настоящему изобретению, соединения, входящие в фармацевтическую комбинацию (комбинации), могут вводиться либо в составе единой фармацевтической композиции, либо в составе отдельных композиций, либо последовательно.
Далее, настоящее изобретение относится к набору, включающему фармацевтическую комбинацию по настоящему изобретению.
Соединения A1-A3, B1-B4, C1-C3 могут быть включены в комбинацию по настоящему изобретению либо в форме свободного основания, либо в форме любой его соли. Соли могут присутствовать в чистом виде, либо в смеси со свободным соединением, например, соединением формулы A1, и предпочтительно являются фармацевтически приемлемыми солями. Такие соли соединений формулы A1 формируются, например, в виде кислотно-аддитивных солей, предпочтительно с органическими или неорганическими кислотами, из соединений формулы A1, включающих основный атом азота. Подходящими неорганическими кислотами являются, например, галогенсодержащие кислоты, например, хлористоводородная кислота, серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например, янтарная кислота, карбоновые кислоты или сульфоновые кислоты, такие как фумаровая кислота или метансульфоновая кислота. С целью выделения или очистки могут также применяться фармацевтически неприемлемые соли, например, пикраты или перхлораты. Для терапевтических целей применяются только фармацевтически приемлемые соли или свободные соединения (если они применимы в форме фармацевтических препаратов), и поэтому указанные формы являются предпочтительными.
Соединения A1-A3, B1-B4, C1-C3 могут быть синтезированы специалистом в данной области техники. Конкретно, соединение A1 раскрыто в качестве примера 74 в заявке WO 2010/020675; соединение A2 раскрыто в заявке WO 2011.101409; соединение C1 раскрыто в качестве примера 15 в заявке WO 2010/029082; и соединение C2 раскрыто в качестве примера 10 в заявке WO 2007/084786.
Подходящие ингибиторы ароматазы включают, не ограничиваясь этим,
(a) стероиды, например, экземестан и форместан; и
(b) нестероидные соединения, например, аминоглутетимид, ворозол, фадрозол, анастрозол и, в первую очередь, летрозол.
Экземестан можно вводить, например, в той форме, в которой он имеется на рынке, например, под торговой маркой AROMASIN®. Форметсан можно вводить, например, в той форме, в которой он имеется на рынке, например, под торговой маркой LENTARON®. Фадрозол можно вводить, например, в той форме, в которой он имеется на рынке, например, под торговой маркой AFEMA®. Анастрозол можно вводить, например, в той форме, в которой он имеется на рынке, например под торговой маркой ARIMIDEX®. Летрозол можно вводить, например, в той форме, в которой он присутствует на рынке, например, под торговой маркой FEMARA® или FEMAR®. Летрозол был конкретно описан в Европейском патенте № 0236940, опубликованном 16 Сентября 1987, в патенте США № 4978672, опубликованном 18 Декабря 1990, а также в патенте Японии № 2018112, где все указанные патенты выданы заявителям. Аминоглютенимид можно вводить, например, в той форме, в которой он имеется на рынке, например, под торговой маркой ORIMETEN®.
Структуры действующих агентов, идентифицированных по кодовым номерам, международным непатентованным или торговым наименованиям, можно взять из последнего издания стандартного справочника “The Merck Index” или из базы данных, например Patent International (например, IMS World Publications). Соответствующее содержание указанных источников включено в настоящую заявку посредством ссылки.
Аналогичным образом, настоящее изобретение охватывает фармацевтически приемлемые соли, соответствующие рацематы, диастереоизомеры, энантиомеры, таутомеры, а также соответствующие кристаллические модификации раскрытых выше соединений в случае их наличия, например, сольваты, гидраты и полиморфы, которые раскрыты в настоящей заявке. Эти соединения, применяемые в качестве действующих ингредиентов в комбинациях по настоящему изобретению, можно получать и вводить, как описано в цитированных выше документах, соответственно. Кроме того, в объем настоящего изобретения входят комбинации более чем двух отдельных действующих ингредиентов, которые указаны выше, т.е. фармацевтическая комбинация, входящая в объем настоящего изобретения, могла бы включать три действующих ингредиента или больше.
Считается, что комбинация (комбинации) по настоящему изобретению обладает полезными терапевтическими свойствами, например, синергетическим взаимодействием, сильной in vitro или in vivo антипролиферативной активностью и/или сильной in vitro или in vivo противоопухолевой реакцией, которые делают эту комбинацию (комбинации) особенно применимыми для лечения рака.
Соответствующие раковые заболевания, которые можно лечить комбинацией по настоящему изобретению, включают, не ограничиваясь этим, саркому, лимфомы, рак легких, бронхов, простаты, груди (включая спорадические раковые заболевания груди и пациентов с болезнью Кауден), поджелудочной железы, желудочно-кишечного тракта, ободочной кишки, прямой кишки, колоректальную аденому, рак щитовидной железы, печени, внутрипеченочных желчных протоков, гепатоклеточный рак, рак надпочечников, желудка, глиому, глиобластому, рак эндометрия, меланому, рак почек, почечной лоханки, мочевого пузыря, тела матки, шейки матки, влагалища, яичников, множественную миелому, рак пищевода, лейкемию, острую миелогенную лейкемию, хроническую миелогенную лейкемию, лимфоцитарную лейкемию, миелоидную лейкемию, рак мозга, карциному мозга, рак полости рта и глотки, гортани, тонкого кишечника, не ходжкинскую лимфому, меланому, ворсинчатую аденому толстой кишки, неоплазию, неоплазию эпителиального характера, карциному молочной железы, базально-клеточную карциному, плоскоклеточную карциному, актинический кератоз, опухолевые заболевания (включая солидные опухоли), опухоль органов шеи и головы, истинную полицитемию, эссенциальную тромбоцитемию, миелофиброз с миелоидной метаплазией и болезнь Вальденстрема. При упоминании рака, опухоли, опухолевого заболевания, саркомы или ракового заболевания, в качестве альтернативы или дополнительно подразумеваются также метастазы в исходном органе или ткани и/или в любом другом месте, независимо от местонахождения опухоли и/или метастаза.
Комбинация по настоящему изобретению особенно подходит для лечения раковых заболеваний, опосредованных фосфатидилинозит 3-киназой (PI3K), в т.ч. альфа-субъединицей PI3K. Пролиферативные заболевания могут включать заболевания, при которых происходит избыточная экспрессия или амплификация PI3K альфа, соматическая мутация PIK3CA или гаметные мутации или соматическая мутация PTEN, или мутации и транслокации p85α, которые приводят к повышающему регулированию комплекса p85-p110. В предпочтительном варианте осуществления, рак представляет собой опухоль и/или раковую опухоль, опосредованную альфа изоформой PI3K. Заболевания в настоящем изобретении могут включать такие заболевания, при которых наблюдается избыточная экспрессия или амплификация альфа-изоформы PI3K и/или соматическая мутация PIK3CA.
Комбинация по настоящему изобретению также особенно подходит для лечения гормон-чувствительных и/или гормон рецептор-положительных раковых опухолей. Гормон-чувствительные раковые опухоли могут включать, не ограничиваясь этим, рак груди, рак эндометрия, рак яичников и/или рак шейки матки. Гормон рецептор-положительные раковые опухоли могут включать опухоли, положительные по рецептору эстрогена (т.е. раковые опухоли, которые растут в ответ на гормон эстроген) или опухоли, положительные по рецептору прогестерона (т.е. раковые опухоли, которые растут в ответ на гормон прогестерон). Предпочтительно, гормон рецептор-положительный рак является эстроген рецептор-положительным раком груди.
В одном из вариантов осуществления, рак является солидной опухолью.
В другом варианте осуществления, рак выбран из группы, состоящей из рака груди, эндометрия, яичника и шейки матки.
В следующем варианте осуществления, раковое заболевание представляет собой рак при котором наблюдается как (a) избыточная экспрессия или амплификация альфа-изоформы PI3K и/или соматическая мутация PIK3CA, так и (b) гормон рецептор-положительный статус.
В следующем варианте осуществления, рак является раком груди. Предпочтительно, рак является раком груди, имеющим либо гормон рецептор-положительный статус, либо мутацию в PIK3CA, либо комбинацию этих признаков. Более предпочтительно, рак представляет собой рецептор эстрогена-положительный (+) рак груди.
В следующем варианте осуществления, рак представляет собой гормон рецептор-положительный (+) рак груди, невосприимчивый к лечению гормональной терапией (например, нацеленной на эстроген или прогестерон). Термин «рак, невосприимчивый к лечению гормональной терапией» относится к раковому заболеванию или опухоли, которые или не проявляют благоприятной реакции на лечение предшествующей гормональной терапией, или, в качестве альтернативы, повторно появляются или рецидивируют после благоприятной реакции на гормональную терапию. Предполагается, что указанная гормональная терапия осуществляется в отсутствии ингибитора PI3K. Рак или опухоль может быть невосприимчивой или рефрактерной в начале лечения, или же она может стать невосприимчивой или рефрактерной во время лечения.
Одна из целей настоящего изобретения заключается в разработке фармацевтической композиции, включающей такое количество каждого из терапевтических агентов по настоящему изобретению, которое является совместно терапевтически эффективным при лечении или профилактике рака.
Согласно настоящему изобретению, агенты в композиции по настоящему изобретению могут вводиться совместно в одной фармацевтической композиции, раздельно в составе двух или нескольких отдельных дозированных форм, или последовательно. Дозированная лекарственная форма может также являться фиксированной комбинацией.
Фармацевтические композиции для раздельного введения агентов или для введения фиксированной комбинации (например, единая галенова композиция, включающая как минимум два терапевтических агента по настоящему изобретению, может быть получена способом, известным по существу, и представляет собой композицию, подходящую для энтерального, например, перорального или ректального, местного и парентерального введения субъектам, в т.ч. млекопитающим (теплокровным животным), таким как люди), включающей терапевтически эффективное количество как минимум одного партнера фармакологически активной комбинации самого по себе, например, как показано выше, или в комбинации с одним или несколькими фармацевтически приемлемыми носителями или разбавителями, в том числе подходящими для энтерального или парентерального применения. Подходящие фармацевтические композиции содержат, например, от примерно 0,1% до примерно 99,9%, предпочтительно, от примерно 1% до примерно 60% действующего ингредиента (ингредиентов).
Фармацевтические композиции для комбинированной терапии, предназначенные для энтерального или парентерального введения являются, например, композициями в виде дозированных лекарственных форм, например, таблеток с сахарным покрытием, таблеток, капсул или суппозиториев, ампул, растворов для инъекций или суспензий для инъекций. Местное введение, например, нанесение на кожу или на глаза, например, в форме лосьонов, гелей, мазей или кремов, или в назальной форме или форме суппозитория. Если не указано иное, такие лекарственные формы получают способами, известными по существу, например, с применением стандартных операций смешивания, гранулирования, нанесения сахарного покрытия, растворения или лиофилизации. Следует понять, что содержание каждого из агентов в индивидуальной дозе каждой дозированной формы не должно само по себе составлять эффективного количества, поскольку введения необходимого эффективного количества можно добиться введением нескольких единиц дозированной формы.
Фармацевтические композиции могут содержать один или несколько фармацевтически приемлемых носителей или разбавителей и могут производиться традиционными способами путем смешивания одного или нескольких партнеров комбинации с фармацевтически приемлемым носителем или разбавителем. Примеры фармацевтически приемлемых разбавителей включают, не ограничиваясь этим, лактозу, декстрозу, маннит и/или глицерин, и/или смазывающие компоненты, и/или полиэтиленгликоль. Примеры фармацевтически приемлемых связующих компонентов включают, не ограничиваясь этим, алюмосиликат магния, крахмалы, например, кукурузный, пшеничный или рисовый крахмал, желатин, метилцеллюлозу, натрий карбоксиметилцеллюлозу и/или поливинилпирролидон и, если их применение желательно, фармацевтически приемлемые дезинтегрирующие средства включают, не ограничиваясь этим, крахмалы, агар, альгиновую кислоту или ее соль, например, альгинат натрия и/или шипучие смеси, или адсорбенты, красители, вкусоароматические добавки и подсластители. Кроме того, можно применять соединения по настоящему изобретению в форме композиций для парентерального введения или в форме растворов для инфузии. Фармацевтические композиции могут быть стерилизованными и/или могут включать эксципиенты, например, консерванты, стабилизаторы, смачивающие соединения и/или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы.
В частности, терапевтически эффективное количество каждого из партнеров по комбинации согласно настоящему изобретению можно вводить одновременно или последовательно и в любом порядке, и компоненты могут вводиться раздельно или в виде фиксированной комбинации. Например, способ профилактики или лечения рака по настоящему изобретению может включать: (i) введение первого агента в свободной форме или форме фармацевтически приемлемой соли; и (ii) введение второго агента в свободной форме или форме фармацевтически приемлемой соли, одновременно или последовательно в любом порядке в совместно фармацевтически эффективных количествах, предпочтительно, в синергетически эффективных количествах, например, ежедневно или попеременно в количествах, указанных в тексте настоящей заявки. Индивидуальные партнеры по комбинации согласно настоящему изобретению можно вводить раздельно в разное время на протяжении курса терапии, или одновременно в составе отдельных лекарственных форм или единой лекарственной формы. Кроме того, термин «введение» охватывает применение пролекарства партнера по комбинации, которое in vivo превращается непосредственно в партнера по комбинации. Таким образом, предполагается, что настоящее изобретение охватывает все указанные схемы одновременного или попеременного лечения, и термин «введение» следует интерпретировать соответствующим образом.
Эффективная дозировка каждого из действующих агентов, применяемых в комбинации по настоящему изобретению, может меняться в зависимости от конкретного соединения или применяемой фармацевтической композиции, способа введения, состояния, которое подвергается лечению, а также тяжести этого состояния. Таким образом, схему введения комбинации по настоящему изобретению выбирают в соответствии с целым рядом факторов, включая тип, вид, возраст, массу, пол и медицинское состояние пациента; тяжесть состояния, подвергаемого лечению; путь введения; функцию почек и печени пациента; и конкретного применяемого соединения. Рядовой врач, клиницист или ветеринар может легко определить и назначить эффективное количество лекарственного средства, для профилактики, противодействия или остановки прогрессирования состояния. Оптимальная точность в достижении концентрации лекарственного средства, которая позволяет добиться желаемого эффекта, требует схемы введения, основанной на кинетике доступности лекарственных средств для целевых сайтов. Это включает учет распределения, равновесия и выведения лекарственного препарата.
Дополнительный эффект настоящего изобретения заключается в том, что могут применяться более низкие дозировки действующих ингредиентов в комбинации, например, что необходимые дозировки часто не только меньше, но и могут вводиться реже, или могут применяться с целью уменьшения частоты появления побочных эффектов. Это соответствует желаниям и потребностям пациентов, подвергаемых лечению.
Комбинация действующих агентов по настоящему изобретению может быть реализована в форме одного фармацевтического препарата или в форме комбинированных препаратов «набора компонентов» в смысле, что партнеры по комбинации могут вводиться независимо, или за счет применения различных фиксированных комбинаций с различными количествами партнеров по комбинации, т.е. одновременно или в различные моменты времени. В этом случае, компоненты набора могут вводиться, например, одновременно или попеременно, т.е. в различные моменты времени, через равные или различные промежутки времени для любого компонента набора.
Далее, настоящее изобретение относится к набору, включающему первое соединение, выбранное из группы, состоящей из соединений A1-A3 или их фармацевтически приемлемых солей, второго соединения, выбранного из группы, состоящей из соединений B1-B4 или их фармацевтически приемлемых солей, а также листок-вкладыш в упаковку или другую этикетку, содержащую указания по лечению рака.
Кроме того, настоящее изобретение относится к набору, включающему первое соединение, выбранное из группы, состоящей из соединений A1-A3 или их фармацевтически приемлемых солей, второго соединения, выбранного из группы, состоящей из соединений B1-B4 или их фармацевтически приемлемых солей, третье соединение, выбранное из группы, состоящей из соединений C1-C3 или их фармацевтически приемлемых солей, а также листок-вкладыш в упаковку или другую этикетку, содержащую указания по лечению рака.
Приведенные ниже примеры иллюстрируют описанное выше изобретение; однако они не предназначены для ограничения объема изобретения каким-либо образом. Полезные эффекты фармацевтических комбинаций по настоящему изобретению можно также определить на других тестовых моделях, известных по существу специалисту в области техники, к которой относится данная заявка.
ПРИМЕРЫ
Пример 1
Описанные ниже эксперименты проводились для демонстрации эффективности и антипролиферативной активности соединения A1 в комбинации двух или трех препаратов при лечении рака груди.
Получение растворов соединений/реагентов
Соединение A1 (ингибитор CDK4/6, 10 мМ), соединение B1 (летрозол, Sigma, 10 мМ), соединение B3 (фульвестрант, Sigma, 10 мМ), соединение B2 (экземестан, Sigma, 10 мМ), соединение C1 (ингибитор PI3K, 10 мМ), соединение C3 (ингибитор mTor, 10 мМ) и соединение C2 (ингибитор PI3K, 10 мМ) растворяли в ДМСО. Δ4A (прекурсор андростендион, 10 мМ) растворяли в этаноле. Все эти реагенты хранили в виде аликвот при -20°C.
Клеточная культура
Доктор Chen Shiuan (City of Hope National Medical Center, CA, USA) получал клетки карциномы груди человека MCF7, которые были устойчиво трансфецированы вектором экспрессии ароматазы, несущим ген устойчивости к неомицину (G418) (также именуемые MCF7/Aro). Ароматаза превращает прекурсор андростендион (Δ4A) в 17β-эстрадиол (E2), который необходим для пролиферации линии клеток-хозяев. Если не указано иное, все реагенты для клеточных культур получали у компании Invitrogen. Клетки содержали в среде MEM (#11095-080) с добавкой 10% объем/объем сыворотки телят (FBS, #1099-141), 1мМ пирувата натрия (#11360-070), 1% объем/объем неэссенциальных аминокислот (#11140-050) и G418 (генетицин, #10131), в увлажненном инкубаторе при 37°C в атмосфере 5% CO2. Пассирование клеток осуществляли дважды в неделю, и среду меняли каждые 2-3 дня. Для оценки клеточной пролиферации под действием эстрогена, было необходимо освободить среду от стероидов. Для этого использовали среду, обедненную стероидами (SD), а именно MEM (#51200-038 без фенолового красного и без глутамина) с добавкой FBS, очищенной активированным углем (#12676-029) и Glutamax (#35050-061). Среду без фенолового красного (индикатора pH) применяли потому, что этот краситель является структурным гомологом эстрогена. Кроме того, было необходимо заменить нормальную FBS, средой FBS, очищенной активированным углем, для удаления стероидов. Для диссоциации клеток при обработке SD использовали TryPLE Express (12604-013, без фенолового красного).
Исследование выживаемости клеток и клеточной пролиферации
Клетки MCF7/Aro освобождали от стероидов за 3 дня до трипсинизации с использованием TryPLE Express (#12604-013, без фенолового красного) и распределяли по 384-луночным черным планшетам с прозрачным дном (Greiner, #781091) в количестве 1500 клеток/лунку в трех экземплярах на анализ в 30 мкл/лунку ростовой среды, клеткам давали прикрепиться к стенкам в течение ночи и затем инкубировали в течение 6 дней с 10 нМ Δ4A и различными концентрациями лекарственных средств и комбинаций лекарственных средств (10 мкл/лунку). Выживаемость клеток определяли путем измерения содержания АТФ в клетках, используя набор для люминесцентного анализа выживаемости клеток CellTiter-Glo® (CTG) (Promega). Действие каждого из индивидуальных агентов и их комбинаций на клетки сравнивали с контрольными образцами (клетками обработанными эквивалентным объемом среды). После обработки исследуемыми соединениями, в каждую лунку добавляли 30 мкл/лунку реагентов CTG и регистрировали люминесценцию на приборе для считывания планшетов Envision (Perkin Elmer). Вычисляли величины ослабления и усиления люминесцентного сигнала (ответа) по отношению к необработанным (контрольным) клеткам.
Исследованные комбинации
Тестированию подвергали следующие комбинации:
(a) соединение A1/соединение B1 (летрозол);
(b) соединение A1/соединение B1 (летрозол)/соединение C1 (1 мкМ или 500 нМ);
(c) соединение A1/соединение B1 (летрозол)/соединение C3 (20 нМ или 2 нМ);
(d) соединение A1/соединение B1 (летрозол)/соединение C2 (333 нМ);
(e) соединение A1/соединение B3 (фульвестрант);
(f) соединение A1/соединение B3 (фульвестрант)/соединение C1 (1 мкМ или 500 нМ);
(g) соединение A1/соединение B3 (фульвестрант)/соединение C3 (20 нМ или 2 нМ);
(h) соединение A1/соединение B3 (фульвестрант)/соединение C2 (333 нМ);
(i) соединение A1/соединение B2 (экземестан);
(j) соединение A1/соединение B2 (экземестан)/соединение C1 (1 мкМ или 500 нМ);
(k) соединение A1/соединение B2 (экземестан)/соединение C3 (20 нМ или 2 нМ); и
(l) соединение A1/соединение B2 (экземестан)/соединение C2 (333 нМ);
Соединение A1, соединение B1 (летрозол), соединение B2 (экземестан) и соединение B3 (фульвестрант) вводили в виде нескольких доз, и соединение C1, соединение C2 и соединение C3 вводили в виде одной дозы в качестве сопутствующих соединений (дозировки указаны соответствуют указанным выше) во всех тройных комбинациях.
Для оценки антипролиферативной активности всех комбинаций без систематической ошибки, а также для выявления синергетического эффекта во всех возможных концентрациях, проводили исследования в формате «матрицы дозировок». В этой методике использовались все возможные сочетания последовательных разбавлений соединения A1/соединения B1 (летрозола), соединения A1/соединения B3 (фульвестранта) и соединения A1/соединения B2 (экземестана) (с одной дозой сопутствующего соединения). При исследовании всех комбинаций, агенты применялись одновременно.
«Матрицы дозировок соединения A1/соединения B1, соединения A1/соединения B3 и соединения A1/ соединения B2» состояли из следующих дозировок:
(a) соединение A1 (в комбинации соединение A1/соединение B1 и соединение A1/соединение B2), из которого получали 6 дозировок путем 3Х последовательных разбавлений, при максимальной дозировке 10 мкМ и минимальной дозировке примерно 41 нМ;
(b) соединение A1 (в комбинации соединение A1/соединение B3), из которого получали 5 или 6 дозировок путем 3Х последовательных разбавлений, при максимальной дозировке 1 или 3 мкМ и минимальной дозировке примерно 12 нМ;
(c) соединение B1 из которого получали 7 дозировок путем 3Х последовательных разбавлений, при максимальной дозировке 5 мкМ и минимальной дозировке примерно 7 нМ;
(d) соединение B3 из которого получали 6 дозировок путем 3Х последовательных разбавлений, при максимальной дозировке 800 нМ и минимальной дозировке примерно 3 нМ;
(e) соединение B2 из которого получали 7 дозировок путем последовательных 3Х разбавлений при максимальной дозировке 10 мкМ и минимальной дозировке приблизительно 14 нМ.
Вычисление эффекта от применения комбинаций:
Синергетическое взаимодействие (анализ осуществлялся с использованием программы Chalice [CombinatoRx, Cambridge MA]) рассчитывали путем сравнения реакции, вызванной комбинацией, по сравнению с реакцией, вызванной агентом, действующим индивидуально, относительно базовой модели аддитивного действия лекарственных средств в тех же дозировках. Отклонения от аддитивного действия препаратов в тех же дозировках можно численно оценить с помощью коэффициента аддитивности (CI), который количественно отражает суммарную силу действия комбинации. Этот расчет (главным образом, в объемных показателях) производился по следующей формуле:
V HSA=ΣX,YlnfXlnfY(Idata-IHSA).
Кроме того, вычислялся CI между данными и поверхностью для наивысшей концентрации индивидуального агента, нормализованной для факторов разбавления индивидуального агента (Lehar et al, 2009):
Анализ данных
Оценку данных и построение графиков осуществляли с использованием программы Microsoft Excel и программы Chalice.
Результаты
Для исследования активности двойных или тройных комбинаций соединения A1 с антиэстрогенными терапевтическими препаратами, такими как фульвестрант (соединение B3), летрозол (соединение B1) и экземестан (соединение B2), в присутствии или в отсутствии ингибитора PI3K или mTOR, т.е. соединения C1, соединения C2 или соединения C3, против клеточной пролиферации, были протестированы различные комбинации, которые описаны в разделе методики проведения эксперимента, в отношении клеток MCF7 с избыточной экспрессией ароматазы, которые развиваются в присутствии андростендиона. Синергия наблюдалась между соединением A1 и всеми тремя антигормональными препаратами в формате комбинированной матрицы дозировок 7×8 с коэффициентом синергии 4,12, 2,41 и 1,43 для летрозола (соединения B1), экземестана (соединения B2) и фульвестранта (соединения B3), соответственно. В том же самом формате матрицы дозировок 7×8 различные дозировки ингибитора PI3K и mTOR также добавлялись в качестве вспомогательных соединений для тестирования тройных комбинаций, и во всех случаях эти тройные комбинации значительно повышали максимальный уровень ингибирования, достигаемый при применении одного препарата или комбинации двух препаратов, и существенно понижали дозировки, необходимые для достижения аналогичных уровней подавления клеточной пролиферации. Эти результаты надежно подтверждают идею применения комбинаций двух или трех агентов, которые нацелены на клеточный цикл, т.е. mTOR/PI3K и сигнальный путь эстрогена в ER-положительных раковых заболеваниях груди.
Результаты, полученные в примере 1, показаны на Фиг. 1-7.
Пример 2
Описанные ниже эксперименты проводились для демонстрации эффективности и антипролиферативной активности соединения A2 или соединения A3 в комбинации двух или трех препаратов при лечении рака груди.
Получение растворов соединений/реагентов
Соединение A2 (ингибитор CDK4/6, 10 мМ), соединение A3 (ингибитор CDK4/6, 10 мМ), соединение B1 (летрозол, Sigma, 10 мМ), соединение B3 (фульвестрант, Sigma, 10 мМ), соединение B2 (экземестан, Sigma, 10 мМ), соединение C1 (ингибитор PI3K, 10 мМ) и соединение C3 (ингибитор mTor, 10 мМ) растворяли в ДМСО. Δ4A (прекурсор андростендион, 10 мМ) растворяли в этаноле. Все эти реагенты хранили в виде аликвот при -20ºC.
Клеточная культура
Доктор Chen Shiuan (City of Hope National Medical Center, CA, USA) получал клетки карциномы груди человека MCF7, которые были устойчиво трансфецированы вектором экспрессии ароматазы, несущим ген устойчивости к неомицину (G418) (также именуемые MCF7/Aro). Ароматаза превращает прекурсор андростендион (Δ4A) в 17β-эстрадиол (E2), который необходим для пролиферации линии клеток-хозяев. Если не указано иное, все реагенты для клеточных культур получали у компании Invitrogen. Клетки содержали в среде MEM (#11095-080) с добавкой 10% объем/объем сыворотки телят (FBS, #1099-141), 1мМ пирувата натрия (#11360-070), 1% объем/объем неэссенциальных аминокислот (#11140-050) и G418 (генетицин, #10131), в увлажненном инкубаторе при 37°C в атмосфере 5% CO2. Пассирование клеток осуществляли дважды в неделю, и меняли среду каждые 2-3 дня. Для оценки клеточной пролиферации под действием эстрогена, было необходимо освободить среду от стероидов. Для этого использовали среду, обедненную стероидами (SD), а именно MEM (#51200-038 без фенолового красного и без глутамина) с добавкой FBS, очищенной активированным углем (#12676-029) и Glutamax (#35050-061). Среду без фенолового красного (индикатора pH) применяли потому, что этот краситель является структурным гомологом эстрогена. Кроме того, для удаления стероидов было необходимо заменить нормальную FBS, сывороткой FBS, очищенной активированным углем. Для диссоциации клеток при обработке SD использовали TryPLE Express (12604-013, без фенолового красного).
Исследование выживаемости клеток и клеточной пролиферации
Клетки MCF7/Aro освобождали от стероидов за 3 дня до трипсинизации с использованием TryPLE Express (#12604-013, без фенолового красного) и распределяли по 384-луночным черным планшетам с прозрачным дном (Greiner, #781091) в количестве 1500 клеток/лунку в трех экземплярах на анализ в 30 мкл/лунку ростовой среды, клеткам давали прикрепиться к стенкам в течение ночи и затем инкубировали в течение 6 дней с 10 нМ Δ4A и различными концентрациями лекарственных средств и комбинаций лекарственных средств (10 мкл/лунку). Выживаемость клеток определяли путем измерения содержания АТФ в клетках, используя набор для люминесцентного анализа выживаемости клеток CellTiter-Glo® (CTG) (Promega). Действие на клетки каждого из индивидуальных агентов и их комбинаций сравнивали с контрольными образцами (клетками обработанными эквивалентным объемом среды). После обработки исследуемыми соединениями, в каждую лунку добавляли 30 мкл/лунку реагентов набора CTG и регистрировали люминесценцию на приборе для считывания планшетов Envision (Perkin Elmer). Вычисляли величины ослабления и усиления люминесцентного сигнала (ответа) по отношению к необработанным (контрольным) клеткам.
Исследованные комбинации
Тестированию подвергали следующие комбинации:
(a) соединение A2/соединение B1 (летрозол);
(b) соединение A2/соединение B1 (летрозол)/соединение C1;
(c) соединение A2/соединение B1 (летрозол)/соединение C3;
(d) соединение A2/соединение B3 (фульвестрант);
(e) соединение A2/соединение B3 (фульвестрант)/соединение C1;
(f) соединение A2/соединение B3 (фульвестрант)/соединение C3;
(g) соединение A2/соединение B3 (экземестан);
(h) соединение A2/соединение B3 (экземестан)/соединение C1;
(i) соединение A2/соединение B3 (экземестан)/соединение C3;
(j) соединение A3/соединение B1 (летрозол);
(k) соединение A3/соединение B1 (летрозол)/соединение C1;
(l) соединение A3/соединение B1 (летрозол)/соединение C3;
(m) соединение A3/соединение B3 (фульвестрант);
(n) соединение A3/соединение B3 (фульвестрант)/соединение C1;
(o) соединение A3/соединение B3 (фульвестрант)/соединение C3;
(p) соединение A3/соединение B3 (экземестан);
(q) соединение A3/соединение B3 (экземестан)/соединение C1; и
(r) соединение A3/соединение B3 (экземестан)/соединение C3.
Соединение A2, соединение A3, летрозол (соединение B1), экземестан (соединение B2) и фульвестрант (соединение B3) вводили в виде нескольких доз, и соединение C1 (1 мкМ) и соединение C2 (20 нМ) вводили в виде одной дозы в качестве сопутствующих соединений во всех тройных комбинациях.
Для оценки антипролиферативной активности всех комбинаций без систематической ошибки, а также для выявления синергетического эффекта во всех возможных концентрациях, проводили исследования в формате «матрицы дозировок». В этой методике использовались все возможные сочетания последовательных разбавлений соединения A2/соединения B1 (летрозола), соединения A2/соединения B3 (фульвестранта), соединения A2/соединения B2 (экземестана), соединения A3/соединения B1 (летрозола), соединения A3/соединения B3 (фульвестранта) и соединения A3/соединения B2 (экземестана) (с одной дозой сопутствующего соединения). При исследовании всех комбинаций, агенты применялись одновременно.
«Матрицы дозировок соединения A2/соединения B1, соединения A2/соединения B3, соединения A2/ соединения B2, соединения A3/соединения B1, соединения A3/соединения B3, соединения A3/ соединения B2» состояли из следующих дозировок:
(a) соединение A2, из которого получали 7 дозировок путем 3Х последовательных разбавлений, при максимальной дозировке 3 мкМ и минимальной дозировке примерно 4,1 нМ;
(b) соединение A3, из которого получали 7 дозировок путем 3Х последовательных разбавлений, при максимальной дозировке 3 мкМ и минимальной дозировке примерно 4,1 нМ;
(c) соединение B1, из которого получали 6 дозировок путем 3Х последовательных разбавлений, при максимальной дозировке 5 мкМ и минимальной дозировке примерно 20,6 нМ;
(d) соединение B3, из которого получали 6 дозировок путем 3Х последовательных разбавлений, при максимальной дозировке 100 нМ и минимальной дозировке примерно 0,4 нМ;
(e) соединение B2, из которого получали 6 дозировок путем последовательных 3Х разбавлений при максимальной дозировке 10 мкМ и минимальной дозировке приблизительно 41,2 нМ.
Вычисление эффекта от применения комбинаций:
Синергетическое взаимодействие (анализ осуществлялся с использованием программы Chalice [CombinatoRx, Cambridge MA]) рассчитывали путем сравнения реакции, вызванной комбинацией с реакцией, вызванной агентом, действующим индивидуально, относительно базовой модели аддитивного действия лекарственных средств в тех же дозировках. Отклонения от аддитивного действия препаратов в тех же дозировках можно численно оценить с помощью коэффициента аддитивности (CI), который количественно отражает суммарную силу действия комбинации. Этот расчет (главным образом в объемных показателях) производился по следующей формуле:
V HSA=ΣX,YlnfXlnfY(Idata-IHSA).
Кроме того, вычислялся CI между данными и поверхностью для наивысшей концентрации индивидуального агента, нормализованной для факторов разбавления индивидуального агента (Lehar et al, 2009):
Анализ данных
Оценку данных и построение графиков осуществляли с использованием программы Microsoft Excel и программы Chalice.
Результаты
Для исследования активности двойных или тройных комбинаций соединения A2 и соединения A3 с антиэстрогенными терапевтическими препаратами, такими как фульвестрант (соединение B3), летрозол (соединение B1) и экземестан (соединение B2), в присутствии или в отсутствии ингибитора PI3K или mTOR, т.е. соединения C1 или соединения C3, против клеточной пролиферации, было исследовано действие различных комбинаций, которые описаны в разделе методики проведения эксперимента, на клетки MCF7 с избыточной экспрессией ароматазы, которые развиваются в присутствии андростендиона. Синергия наблюдалась между соединением A3 и всеми тремя антигормональными препаратами в формате комбинированной матрицы дозировок 7×8 с коэффициентом синергии 3,7, 1,2 и 1,7 для летрозола, экземестана и фульвестранта, соответственно. Кроме того, синергия наблюдалась в комбинациях соединение A2/летрозол и соединение A2/фульвестрант с коэффициентами синергии 3,2 и 1,4. Одиночную дозу ингибитора PI3K и mTOR также добавляли к комбинациям в формате матрицы дозировок 7×8 в качестве вспомогательных соединений для тестирования тройных комбинаций, и во всех случаях эти тройные комбинации значительно повышали максимальный уровень ингибирования, достигаемый при применении одного препарата или комбинации двух препаратов, и существенно понижали дозировки, необходимые для достижения аналогичных уровней подавления клеточной пролиферации. Эти результаты надежно подтверждают идею применения комбинаций двух или трех агентов, которые нацелены на клеточный цикл, т.е. mTOR/PI3K и сигнальный путь эстрогена при ER-положительных раковых заболеваниях груди.
Результаты, полученные в примере 2, показаны на Фиг. 8-19.
В приведенной ниже таблице суммированы результаты по синергии для различных комбинаций, протестированных в примере 2.
Пример 3
В настоящее время проводится клиническое исследование для дополнительной разработки в клинической практике комбинации двух агентов, а именно соединения A1 (ингибитора CDK4/6) и соединения C1 (ингибитора PI3K), при ER+ раке груди. Это исследование является многоцентровым, открытым, с подбором оптимальных дозировок клиническим исследованием фазы Ib/II. Часть исследования, соответствующая фазе Ib, представляет собой исследование с повышением дозировок в три этапа, для определения MTD (максимальной переносимой дозы) и/или RP2D (рекомендуемой дозы для 2 фазы) для двух двойных комбинаций: соединения A1 с летрозолом и соединения C1 с летрозолом, с последующей оценкой MTD и/или RP2D тройной комбинации соединение A1 + соединение C1 с летрозолом.
За фазой Ib, включавшей три этапа, последует рандомизированное исследование фазы II для предварительной оценки противоопухолевой активности двух комбинированных схем лечения, включающих по два препарата (соединение A1 + летрозол и соединение C1 + летрозол) относительно тройной комбинации (соединение A1 + соединение C1 с летрозолом) и для дальнейшей оценки их безопасности для пациентов с ER+/HER2- местно распространенным или метастатическим раком груди.
В исследовании примет участие примерно 290 взрослых женщин с ER+/HER2- местно распространенным или метастатическим раком груди.
Ниже приведены начальные дозировки для исследования комбинаций двух или трех препаратов. В ходе исследования будут применяться стандартные дозировки летрозола (2,5 мг/день).
Исходные дозы для каждой исследуемой группы:
Часть исследования фазы Ib имеет следующие цели:
Основные цели:
- оценить максимальную переносимую дозу (MTD) и/или рекомендованную дозу для фазы II (RP2D) для следующих комбинаций:
- группа 1: соединение A1 + летрозол (2,5 мг)
- группа 2: соединение C1 + летрозол (2,5 мг)
- группа 3: соединение A1 + соединение C1 + летрозол (2,5 мг).
Дополнительные цели:
- охарактеризовать фармакокинетические профили (PK) соединения A1, соединения C1 и летрозола при их применении в комбинации.
- охарактеризовать безопасность и переносимость в группах 1, 2 и 3.
- получить предварительную оценку клинической противоопухолевой активности в группах 1, 2 и 3.
План исследования (Фиг.23)
Во время части данного многоцентрового, открытого исследования, соответствующего фазе Ib, женщинам постклимактерического возраста с ER+/отрицательным по рецептору эпидермального фактора роста человека (HER2-) распространенным раком груди (BC) осуществляли ежедневное введение комбинации соединение A1 (3 недели введения/1 неделя перерыва)+летрозол (2,5 мг) или комбинации соединение C1 + летрозол (2,5 мг).
Повышение дозировок соответствовало адаптивной Байесовской модели логистической регрессии (BLRM) наряду с принципом повышения дозировок с контролем передозировки.
Исследование фармакокинетики (PK) проводили перед принятием решений о повышении дозировки для наблюдения за действием препарата и оценки возможности взаимодействия препаратов друг с другом, опосредованных цитохромом P450.
После определения MTD/RP2D в группах 1 и 2, BLRM будет обновляться последними данными по наращиванию дозировок в группах 1 и 2, и эти данные будут использоваться для определения начальной дозировки для группы 3.
Основные критерии включения в исследование
Женщины постклимактерического возраста с метастатическим или местно распространенным ER+/HER2- BC.
Любое количество предшествующих курсов эндокринной терапии.
Не более 1 проведенного ранее курса лечения метастатического или местно распространенного рака цитотоксическими препаратами.
Наличие репрезентативного образца опухоли (архивного или нового), который можно подвергнуть молекулярному исследованию (если не согласовано иное).
Вновь полученные парные образцы опухолей до начала и во время лечения служат для принятия решений во время части исследования с повышением дозировок фазы Ib.
Основные критерии исключения из исследования
Проведенное ранее лечение ингибиторами CDK4/6, AKT, mTOR или PI3K, которое не принесло благоприятного результата.
Наличие метастазов в мозге, дающих клинические симптомы.
Сахарный диабет с клиническими проявлениями, наличие в прошлом сахарного диабета беременных, или документированного стероид-индуцированного сахарного диабета.
Корригированный интервал QT, рассчитанный по формуле Фредерика (QTcF)>470 мс.
Оценка результатов
Текущие оценки безопасности проводили в начале исследования и через равные промежутки времени по ходу исследования, и постоянно проводили оценку нежелательных явлений (AEs) согласно Общим Терминологическим Критериям Нежелательных Явлений v4.03.
Реакцию опухоли оценивали исследователи на месте исследования, используя компьютерную томографию и магнитно-резонансную томографию, на основании Критериев Оценки Реакции Солидных Опухолей v 1.1. Оценки проводили до начала исследования, один раз в 8 недель до цикла 6, затем один раз в 12 недель (или ранее, если имелись клинические признаки прогрессирования заболевания) и в конце введения препаратов.
Образцы для исследования PK отбирали в дни 1, 2, 8, 15, 21 и 22 цикла 1 и в день 15 циклов 2-6. Оценки PK в режиме реального времени проводили для управления наращиванием дозировок (в дополнение к BLRM).
Промежуточные результаты
Характеристики и распределение пациентов
10 пациентам вводили соединение A1 и летрозол (группа 1) и 7 пациентам вводили соединение C1 и летрозол (группа 2). Более подробные сведения о пациентах показаны в таблице 1.
Таблица 1
Характеристики и распределение пациентов
Во время включения в исследование, у всех пациентов имелась стадия IV ER+/HER2- BC.
Введение препаратов прекращали у 2 (20%) пациентов группы 1 вследствие прогрессирования заболевания. В момент окончания сбора данных, введение препаратов продолжалось у всех 7 (100%) пациентов в группе 2.
Безопасность
Среди 12 пациентов, которых можно было оценивать в составе подгруппы для определения дозировок (6 в каждой группе), наблюдалось 3 случая токсичности, ограничивающей дозировку (DLTs): 1 случай нейтропении 4-й степени в группе 1 и 2 случая гипергликемии 2-й степени в группе 2.
Наиболее частыми (>30% пациентов) нежелательными явлениями всех степеней, который, как предполагалось, связаны с исследуемыми препаратами, являлись (см. таблицу 2):
- группа 1: нейтропения (90%) и рвота (40%)
- группа 2: гипергликемия (57%), рвота (43%), ослабление аппетита (43%) и диарея (43%).
Таблица 2
Нежелательные явления всех степеней≥10% и все нежелательные явления степеней 3/4
Удлинение QTcF (>470 мс) не наблюдалось в группе 1.
Включены нежелательные явления степеней 3/4, которые, как предполагалось, связаны с исследуемыми препаратами (таблица 2):
- группа 1: нейтропения (50%)
- группа 2: лимфопения (14%), слабость (14%) и гипергликемия (14%);
Уменьшение дозировок производилось у 5 пациентов: 1 пациент в группе 1 и 4 пациента в группе 2.
Фармакокинетика
Предварительные данные по PK для соединения A1, соединения C1 и летрозола приведены ниже (Таблица 3):
- PK для соединения A1 и соединения C1 в дни 1 и 21 сравнимы с историческими данными для индивидуальных агентов.
- PK для летрозола в день 1 сравнимы с данными, наблюдавшимися в исследованиях при введении индивидуального агента.
- Для пациентов, включенных в исследование в настоящее время, собираются дополнительные данные для дополнительной оценки PK летрозола в комбинации с соединением A1.
Таблица 3
Параметры фармакокинетики соединения A1, соединения C1 и летрозола
Клиническая активность
Длительность введения препаратов показана на Фиг. 24 и 25.
В группе 1 имелся 1 пациент с подтвержденной частичной реакцией (Фиг.26), 2 пациента со стабилизацией заболевания (SD) и у 1 пациента без измеряемых проявлений заболевания не было ни полной реакции, ни прогрессирования заболевания (NCRNPD; Фиг.24).
В группе 2 было 2 пациента с SD и 3 пациента с NCRNPD (Фиг.25).
Выводы (на основании промежуточных результатов)
Обе группы исследования продемонстрировали приемлемый профиль безопасности и предварительные признаки клинической активности у женщин постклимактерического возраста с ER+/HER2- распространенным раком груди (BC).
Нейтропения является ожидаемым побочным эффектом соединения A1, по-видимому из-за подавления пролиферации за счет ингибирования CDK4/6.
Гипергликемия, наблюдаемая в группе 2 (соединение C1+летрозол), может являться однозначным последствием ингибирования PI3K.
Продолжается наращивание дозировок для определения MTD/RP2D.
После определения MTD/RP2D в группах 1 и 2, начнется набор пациентов в группу 3. После части исследования фазы Ib, последует рандомизированная фаза II, посвященная сравнению комбинаций соединение A1 + летрозол и соединение C1 + летрозол с комбинацией соединение A1 + соединение C1 + летрозол.
Пример 4
Запланировано многоцентровое, дооперационное, рандомизированное исследование фазы II для оценки биологической активности соединения A1 в ежедневной дозировке 400 мг или 600 мг, в комбинации с летрозолом 2,5 мг ежедневно, по сравнению с ежедневным индивидуальным введением летрозола, у пациентов постклимактерического возраста с только что диагностированным HR+, HER2-отрицательным раком груди на ранней стадии. Предполагается рандомизировать в общей сложности примерно 120 пациентов. Пациенты будут получать исследуемую терапию в течение 14 дней (± 3 дня) и затем подвергаться хирургической операции. Пациенты будут случайно распределяться по группам, которым будет вводиться:
a. летрозол (2,5 мг один раз в день); OR
b. летрозол (2,5 мг один раз в день)+соединение A1 400 мг ежедневно; или
c. летрозол (2,5 мг один раз в день)+соединение A1 600 мг ежедневно.
Основной целью данного исследования является оценка воздействия препаратов на клеточный цикл, которое будет определяться, как процентная доля пациентов, у которых будет достигнуто уменьшение экспрессии Ki67 до такой величины, чтобы значение натурального логарифма процентной доли позитивных Ki67 составляло менее 1 (Baselga 2009). Хотя исследование планируется проводить в открытом формате, все результаты, относящиеся к фармакодинамике и клинической фармакологии, будут оцениваться экспертами, у которых не будет сведений о рандомизированном введении препаратов.
Пример 5
В настоящее время проводится исследование фазы Ib/II комбинаций соединения A1 с эверолимусом и экземестаном в лечении ER+Her2 - распространенного рака груди. Цель этого исследования заключается в определении MTD(s) и/или RP2D соединения A1 в комбинации с эверолимусом + экземестаном, и соединения A1 в комбинации с экземестаном, а также в получении характеристик безопасности и переносимости комбинаций эверолимус + экземестан + соединение A1 и соединение A1 + экземестан у пациентов с ER+ Her2 - распространенным раком груди. Данное исследование включает 3 группы:
Экземестан принимается перорально один раз в день.
Эверолимус принимается перорально один раз в день.
Экземестан принимается перорально один раз в день.
Эверолимус принимается перорально один раз в день.
Соединение A1 поставляется в 50 мг и 200 мг капсулах. Экземестан поставляется в 25 мг таблетках. Эверолимус поставляется в 2,5 мг, 5 мг и 7,5 мг таблетках.
В части исследования фазы Ib ставились следующие цели:
Основная цель
Определить максимальную переносимую дозу (MTD)/ рекомендованную дозу для фазы II (RP2D) для комбинаций соединение A1 + эверолимус (EVE) + экземестан (EXE) у пациентов с ER+/ отрицательным по рецептору эпидермального фактора роста человека 2 (HER2-) распространенным BC.
Дополнительные цели
Определить безопасность и переносимость комбинаций соединение A1 + EVE + EXE и соединение A1 + EXE.
Охарактеризовать фармакокинетику (PK) соединения A1 и/или EVE при введении в комбинации с EXE.
Дать предварительную оценку противоопухолевой активности комбинаций соединение A1 + EVE + EXE и соединение A1 + EXE.
Оценить взаимосвязь между противоопухолевой активностью и молекулярными аберрациями в сигнальных путях циклин D-CDK4/6-INK-Rb, PI3K/AKT/mTOR и других сигнальных путях, связанных с раком.
План исследования
В части, соответствующей фазе Ib, данного многоцентрового, открытого исследования фаз Ib/II, женщинам постклимактерического возраста с ER+/HER2- распространенным BC, невосприимчивым к летрозолу или анастрозолу, осуществляют введение возрастающих доз комбинации соединение A1 + EVE + EXE (25 мг/день) или введение комбинации соединение A1 (600 мг/день) + EXE (25 мг/день; Фиг.27) для подтверждения ее безопасности.
Повышение дозировок соответствует адаптивной Байесовской модели логистической регрессии, наряду с принципом повышения дозировок с контролем передозировки, и перед принятием решений о повышении дозировки производили оценку PK.
После определения MTD/RP2D, в части исследования фазы II, будет осуществляться сравнение тройной комбинации соединение A1 + EVE + EXE и двойной комбинации соединение A1 + EXE c EVE + EXE.
Основные критерии включения в исследование
Женщины постклимактерического возраста с ER+/HER2- местно распространенным или метастатическим BC.
Рецидив во время или в течение 12 месяцев с момента окончания вспомогательного лечения летрозолом или анастрозолом, или прогрессирование опухоли во время или в течение 1 месяца с момента окончания лечения летрозолом или анастрозолом для местно распространенного или метастатического BC. Необязательно, чтобы летрозол или анастрозол являлись последним лечением перед началом исследования.
Допускается предшествующее лечение ингибитором CDK4/6, EXE или ингибитором mTOR (для фазы Ib, но не для фазы II).
Имеется репрезентативный образец опухоли (архивный или новый) для молекулярного тестирования.
Основные критерии исключения из исследования
>2 курсов химиотерапии для распространенного BC.
Абсолютное число нейтрофилов≤1,5×109/л
Корригированный по формуле Фредерика интервал QT>470 мс.
Оценка результатов
Текущие оценки безопасности проводили в начале исследования и через равные промежутки времени по ходу исследования, и постоянно проводили оценку нежелательных явлений (AEs) согласно Общим Терминологическим Критериям Нежелательных Явлений v4.03.
Реакцию опухоли оценивали исследователи на месте исследования, используя компьютерную томографию и магнитно-резонансную томографию, на основании Критериев Оценки Реакции Солидных Опухолей v 1.1., до начала исследования, в день (D) 1 циклов (C) 3, 5 и 7, в D1 каждого4-го из последующих циклов (или ранее при наличии клинических показаний) и в конце введения препаратов.
Оценку PK для соединения A1 и EVE проводили у пациентов, получавших комбинацию соединение A1 + EVE + EXE во время C1 в D 1, 2, 8, 15, 16 и 21 и D1 каждого последующего цикла, до C6 включительно.
Образцы опухоли анализировали с помощью секвенирования нового поколения для определения любых изменений в интересующих генах.
Промежуточные результаты
Характеристики и распределение пациентов
На момент промежуточного прекращения сбора данных, 16 пациентов получали: 3 пациента комбинацию соединение A1 600 мг + EXE 25 мг и 13 пациентов комбинацию соединение A1 (200 мг [6 пациентов]; 300 мг [6 пациентов]; 250 мг [1 пациент]) + EVE 2,5 мг + EXE 25 мг.
Введение препаратов было прекращено у 5 пациентов (31%). Основной причиной прекращения являлось прогрессирование заболевания (4 пациента) и смерть (1 пациент).
В случае распространенного/метастатического заболевания о предшествующем лечении летрозолом или анастрозолом сообщили 10 (63%) и 5 (31%) пациентов, соответственно, тогда как 6 (38%) и 3 (19%) пациентов ранее получали EXE и EVE, соответственно (таблица 4).
Таблица 4
Характеристики пациентов и заболеваний
Безопасность
Среди 13 пациентов, у которых можно было оценить токсичность, ограничивающую дозировки (DLTs), наблюдалось 3 случая DLTs, все для комбинации Соединение A1 300 мг + EVE 2,5 мг + EXE 25 мг: 1 фебрильная нейтропения 3-й степени и 2 повышение уровня аланин аминотрансферазы (ALT) 3-й степени.
Гематологические AEs являлись наиболее обычными проявлениями токсичности во всех группах (таблица 5).
Наиболее обычными (≥10%) AEs степени 3/4, связанными с лекарственными препаратами, во время исследования являлись нейтропения (50%), лейкопения (31%), повышение ALT (13%) и гипофосфатемия (13%).
Таблица 5
Нежелательные явления (всех степеней > 15% у всех пациентов) предположительно связанные с вводимыми препаратами
*Токсичность, ограничивающая дозировку, включала 1 случай фебрильной нейтропении степени 3 и 2 случая повышения ALT степени 3.
Фармакокинетика
Профили зависимости средней концентрации в плазме от времени для соединения A1 и EVE у пациентов, получавших комбинацию соединение A1 + EVE + EXE в C1D15, показаны на Фиг.28 и 29.
Как соединение A1, так и EVE быстро абсорбировались в стационарном состоянии (C1D15); медианное значение Tmax соединения A1 и EVE составляли 2 и 1 час, соответственно, в исследованных диапазонах дозировок.
В стационарном состоянии, введение соединения A1 (200 и 300 мг) + EVE 2,5 мг + EXE 25 мг, приводило к концентрациям соединения A1, сходных с концентрациями, которые достигаются при индивидуальном введении соединения A1, тогда как концентрация EVE была примерно в 1,5-2 и 2-3 раза выше, чем в исторических данных по индивидуальному введению EVE, при совместном введении с соединением A1 в дозировке 200 и 300 мг, соответственно.
Клиническая активность
Из 13 пациентов, у которых можно было оценить реакцию, у 1 пациента имелась подтвержденная частичная реакция (соединение A1 300 мг + EVE 2,5 мг + EXE 25 мг), у 7 пациентов наблюдалась стабилизация заболевания (SD; соединение A1 600 мг + EXE 25 мг: 1 пациент; соединение A1 200 мг + EVE 2,5 мг + EXE 25 мг: 2 пациента; соединение A1 300 мг + EVE 2,5 мг + EXE 25 мг: 4 пациента), и у 1 пациента не наблюдалось ни полной реакции ни прогрессирования заболевания (соединение A1 300 мг + EVE 2,5 мг + EXE 25 мг: 2 пациента; Фиг.30 и Фиг.31).
У одного пациента с делецией p16 (CDKN2A) и амплификацией циклина D1 (CCND1) и рецептора инсулиноподобного фактора роста 1 (IGFR1), которому вводили соединение A1 200 мг + EVE 2,5 мг + EXE 25, имелась SD > 6 месяцев (Фиг.30).
Выводы (на основании промежуточных результатов)
Предварительные данные дают основание предположить, что комбинации соединение A1 + EXE и соединение A1 + EVE + EXE являются целесообразными, и клинические признаки их активности наблюдались в обеих группах исследования.
Предварительное исследование фармакокинетики позволяет предположить, что 300-мг дозировка соединения A1 приводит к возрастанию концентрации EVE в стационарном состоянии, но EVE не влияет на концентрации соединения A1.
Наиболее распространенными AEs являлись гематологические явления, как можно ожидать для ингибиторов CDK4/6, и эти явления имели степень от слабой до умеренной.
Пример 8
Планируется клиническое исследование фазы Ib/II. Это исследование будет включать три группы, как показано ниже:
Фульвестрант: 500 мг IM день 1 и 15, затем ежемесячно
Соединение C2: 20 мг ежедневно без перерывов;
Фульвестрант: 500 мг IM день 1 и 15, затем ежемесячно
Соединение C1: 100 мг ежедневно без перерывов;
Фульвестрант: 500 мг IM день 1 и 15, затем ежемесячно
Пример 7
Целью этого исследования, проходящего в настоящее время, является определение противоопухолевой эффективности различных соединений, применяемых в качестве индивидуальных агентов, а также в составе двойных или тройных комбинаций, в модели ксенотрансплантата рака груди человека HBCx-34.
Модель ксенотрансплантата, предложенная для этого исследования, представляет собой HBCx-34. HBCx-34 является карциномой протоков с P53 дикого типа, без избыточной экспрессии HER2 и избыточной экспрессии PR и ERα. Опухоль хорошо откликается на лечение адриамицином/циклофосфамидом и реагирует на доцетаксел и капецитабин. HBCx-34 не приводит к истощению, но у мышей, несущих HBCx-34 не происходит увеличения массы тела.
Мышам с опухолью груди HBCx-34 будет вводиться эстроген, разбавленный питьевой водой (β-эстрадиол, 8,5 мг/л), с момента имплантации опухоли до даты включения в исследование. В оставшееся время исследования эстроген вводиться не будет.
Самки «голых» бестимусных мышей (Hsd: Athymic Nude-Fox1nu) в возрасте 6-9-недель к началу эксперимента, будут получены у Harlan Laboratories (Gannat, France). Животные будут содержаться в специфических условиях без доступа патогенов в центре содержания животных Center for Exploration and Experimental Functional Research (CERFE, Evry, France). Животных планируется доставлять в лабораторию по крайней мере за 7 дней до эксперимента, и за это время они будут проходить акклиматизацию к лабораторным условиям. Мышей будут размещать в группах максимум по 7 животных на период акклиматизации и по 5 животных во время фазы эксперимента. Мыши будут жить внутри индивидуально вентилируемых клеток (IVC), изготовленных из полисульфоновой (PSU) пластмассы (размеры в мм 213-ширина×362-глубина×185-высота, Allentown, USA) со стерилизованными и очищенными от пыли стержнями кукурузных початков в качестве подстилки. Пища и вода для животных будут подергаться стерилизации. Животные будут жить в условиях цикла свет-темнота (14-часовой циркадный цикл искусственного света) и регулируемой комнатной температуры и влажности.
Соединение A1: 75 мг/кг свободного основания, перорально (p.o.)
Соединение C2: 30 и 20 мг/кг свободного основания, p.o.
4 мг/мл свободного основания=4,356 мг/мл солевой формы основания
Соединение C1: 35 мг/кг, p.o.
Носитель: NaCl 0,9%
Сравнение соединений: стандартные способы лечения
Летрозол (соединение B1) 2,5 мг/кг (Femara®, Novartis)
Экземестан 25 мг/кг (соединение B2, Aromasine®, Pharmacia)
Исследовательские группы и схемы введения препаратов
(*) qd×56: с D0 до D55;
(**) qd×26-30: с D0 до D25 в дозировке 30 мг/кг, затем с D26 до D56 в дозировке 20 мг/кг;
В группах, получавших комбинации препаратов, 2 или 3 соединения будут вводиться непосредственно друг за другом;
Вводимые объемы будут регулироваться индивидуально в соответствии с массой тела. В каждой из экспериментальных групп, указанная дозировка будет вводиться всем мышам.
Инициирование модели опухолевого трансплантата
Опухоли одного и того же пассажа, будут трансплантированы подкожно 5-10 мышам (от мыши донора, пассаж (n-1)). Когда опухоли достигнут объема от 1000 до 2000 мм3, мыши доноры будут умерщвляться путем смещения шейных позвонков, опухоли будут извлекаться в асептических условиях и рассекаться на части. После удаления омертвевших участков, опухоли будут разделяться на фрагменты объемом примерно 20 мм3, переноситься в культуральную среду и затем трансплантироваться.
Мыши будут подвергаться анестезии смесью кетамин/ксилазан, затем кожа будет подвергнута асептизации раствором хлоргексидина, разрезана на уровне межлопаточной области, и фрагмент опухоли объемом 20 мм3 будет помещаться в подкожные ткани. Кожа будет соединяться скобами.
Имплантация всем мышам, задействованным в одном и том же эксперименте, будет осуществляться в один день.
Критерии включения
В исследование будут включаться здоровые мыши в возрасте от 6 до 9 недель и массой как минимум 20 г. Мыши будут распределены по различным группам в соответствии с объемом опухоли, чтобы обеспечить однородные средние и медианные значения объема опухоли в каждой группе исследования. Препараты будут случайным образом приписаны к клеткам, в которых будет размещено до 5 мышей.
В каждую исследуемую группу будет включено до 10 мышей с прижившейся опухолью и средним объемом опухоли от 108 (6×6) до 288 (9×8) мм3. В случае, если рост опухолей будет неравномерным, размер групп может быть уменьшен (до 8 мышей/группу) и/или включения могут быть распределены по группам.
Наблюдение за животными
С момента пересадки опухоли и до окончания исследования, животных будут осматривать каждый день, с целью определения их физического состояния, поведения и клинических изменений.
Определение размеров опухоли и наблюдение за массой тела
Оценка объема опухоли будет производиться измерением диаметров опухоли с помощью штангенциркуля раз в две недели во время введения препаратов и один раз в неделю во время периода последующего наблюдения. Будет использоваться формула TV(мм3)=[длина(мм)×ширина(мм)2]/2, где длина и ширина представляют собой наибольший и наименьший диаметры опухоли, соответственно.
В конце экспериментальной фазы взвешивание опухолей производиться не будет.
Все животные будут подвергаться взвешиванию раз в две недели во время введения препарата и один раз в неделю во время периода последующего наблюдения.
Если спонсор исследования не укажет иное, в случае, если потеря массы тела достигнет 15% по сравнению с 1-м днем введения препаратов, всей группе, в которой наблюдается потеря массы тела, будет даваться корм DietGel Recovery®.
Критерии этичного умерщвления животных
Каждое животное будет умерщвлено, если будет выполнен один из следующих критериев:
Потеря массы тела (BWL) ≥ 20% по сравнению с 1 днем введения препарата в течение 3 последовательных измерений (2 дня или 48 часов).
Общее изменение поведения или клинические симптомы.
Объем опухоли ≥ 2000 мм3.
Если не указано иное, вскрытие при умерщвлении проводиться не будет.
Конечные точки исследования (смотря по тому, что наступит раньше)
Каждая группа животных будет умерщвлена, если будут удовлетворены два следующих условия:
Как минимум у одного животного объем опухоли достигнет 2000 мм3.
И исходный медианный объем опухоли возрастет в 3-5 раз.
Конечными точками эксперимента являются:
Фаза введения препарата 8 недель*
Фаза последующего наблюдения 57 дней.
(*) Фаза введения препарата могла бы увеличена на 2 или 3 недели, если не наблюдается токсического действия и если это требуется согласно разделу «инициирование модели опухолевого трансплантата».
Анализ данных
Днем 0 во всех случаях будет считаться первый день введения препарата. Дни эксперимента будет нумероваться последовательно с учетом этого. Данные будут выражаться в виде: среднее значение +/- стандартная ошибка среднего (среднее +/- sem) и медианное значение +/- интерквартильный размах (медианное значение +/- IQR).
Статистический анализ будет произведен для каждого измерения с использованием непараметрического критерия сравнения Манна-Уитни в программе GraphPad Prism. Будет проводиться сравнение каждой экспериментальной группы с контрольной группой.
На Фиг. 20-22 показаны некоторые результаты данного исследования.
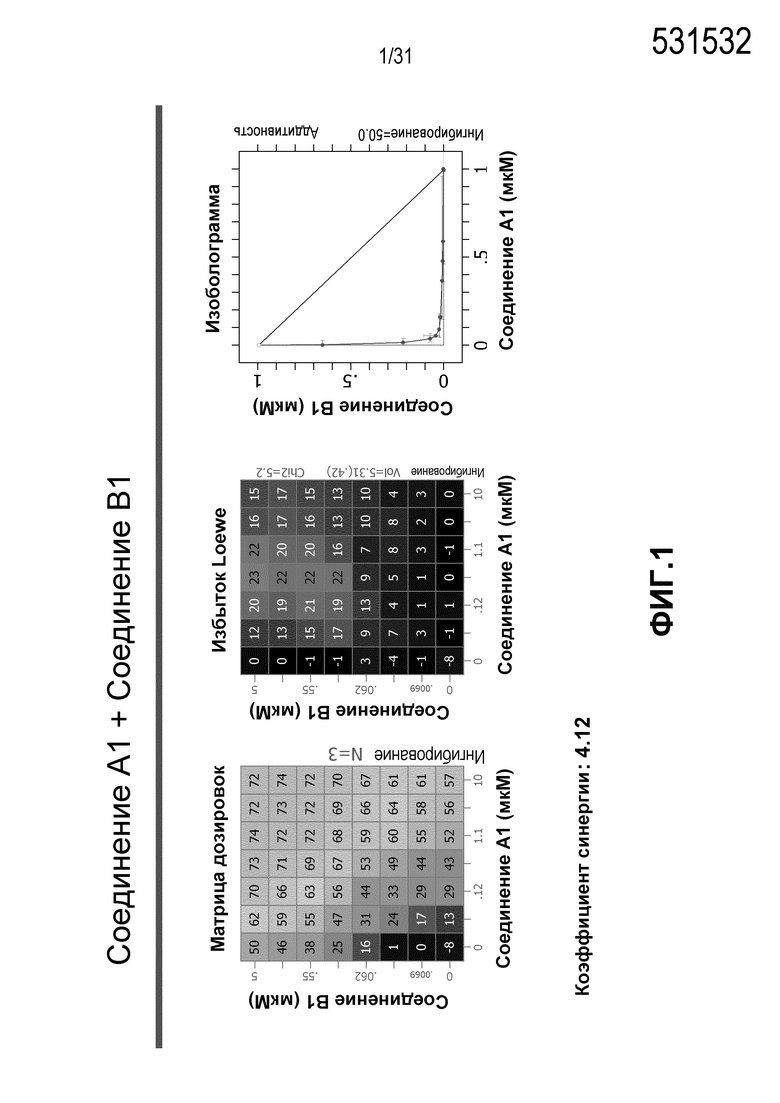
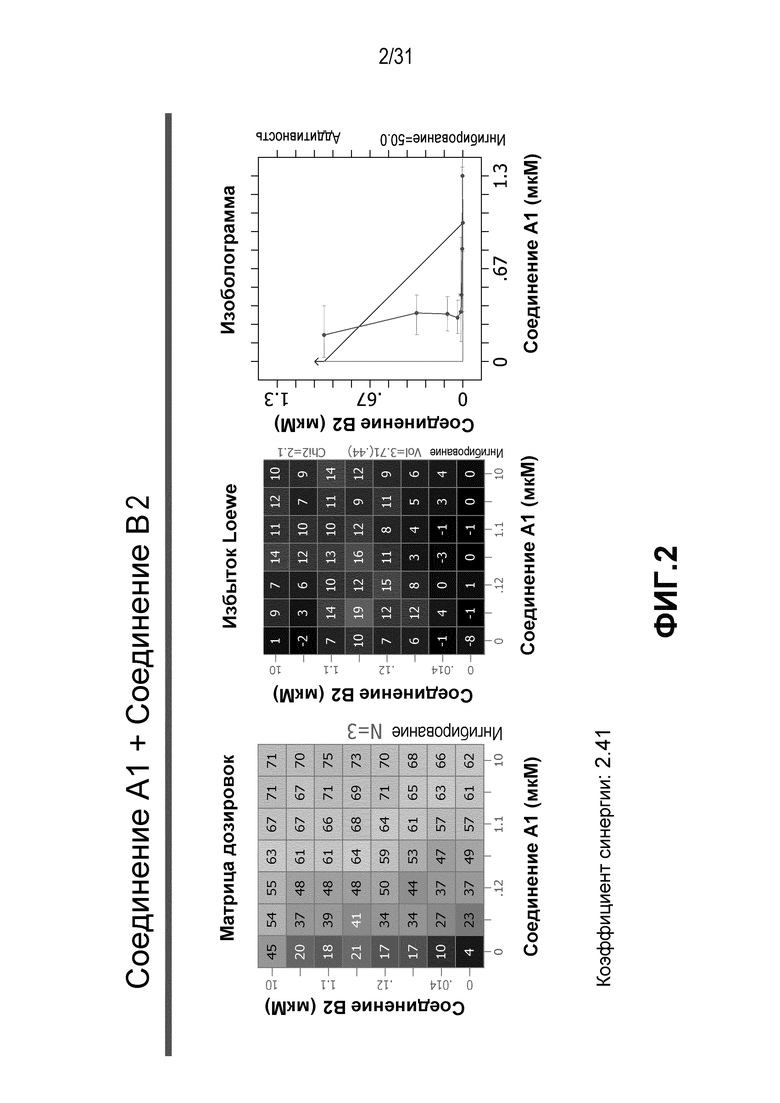
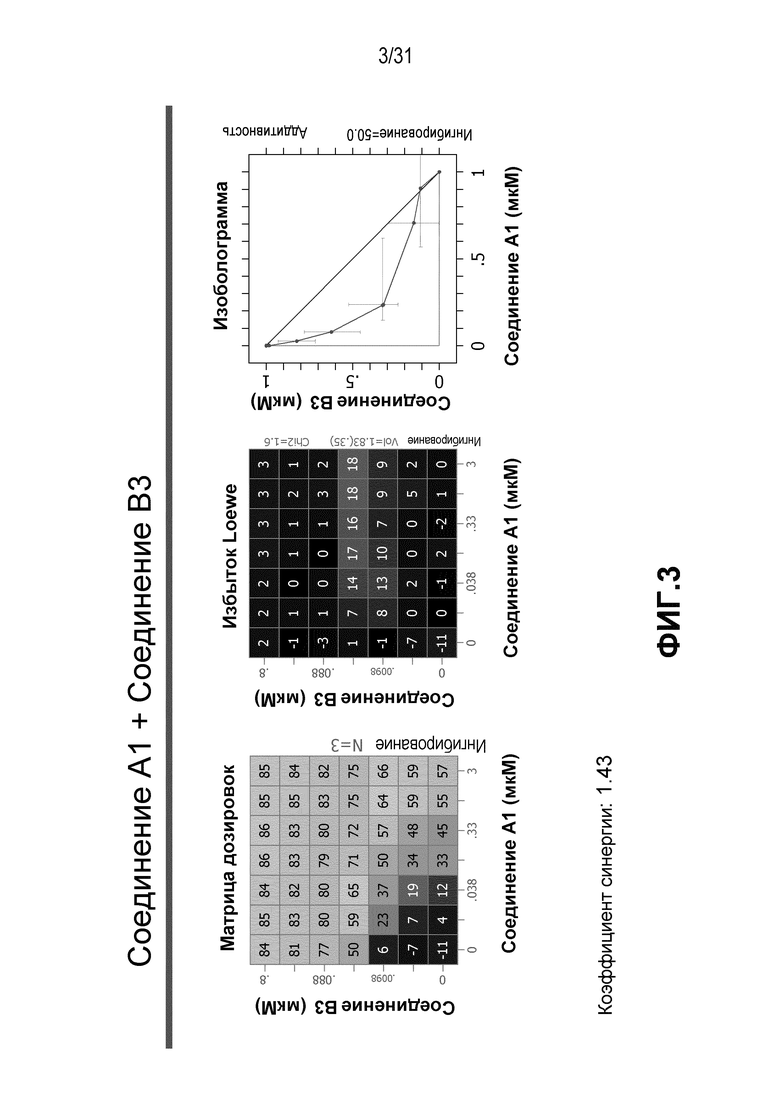
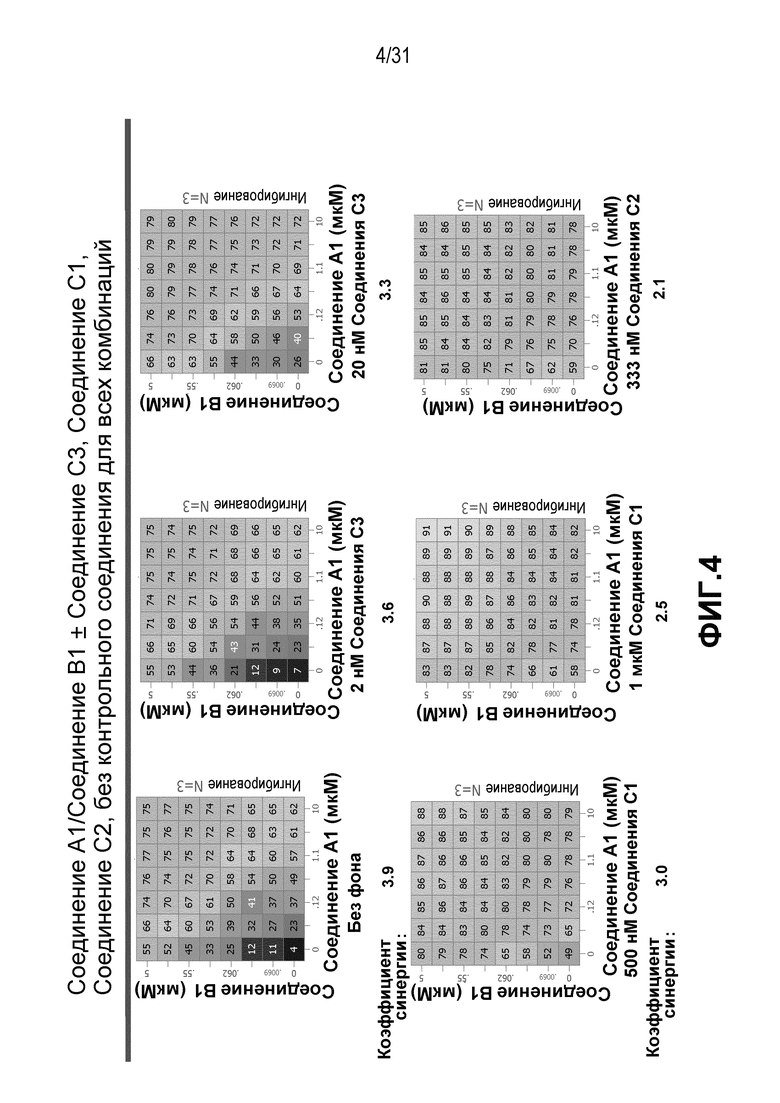
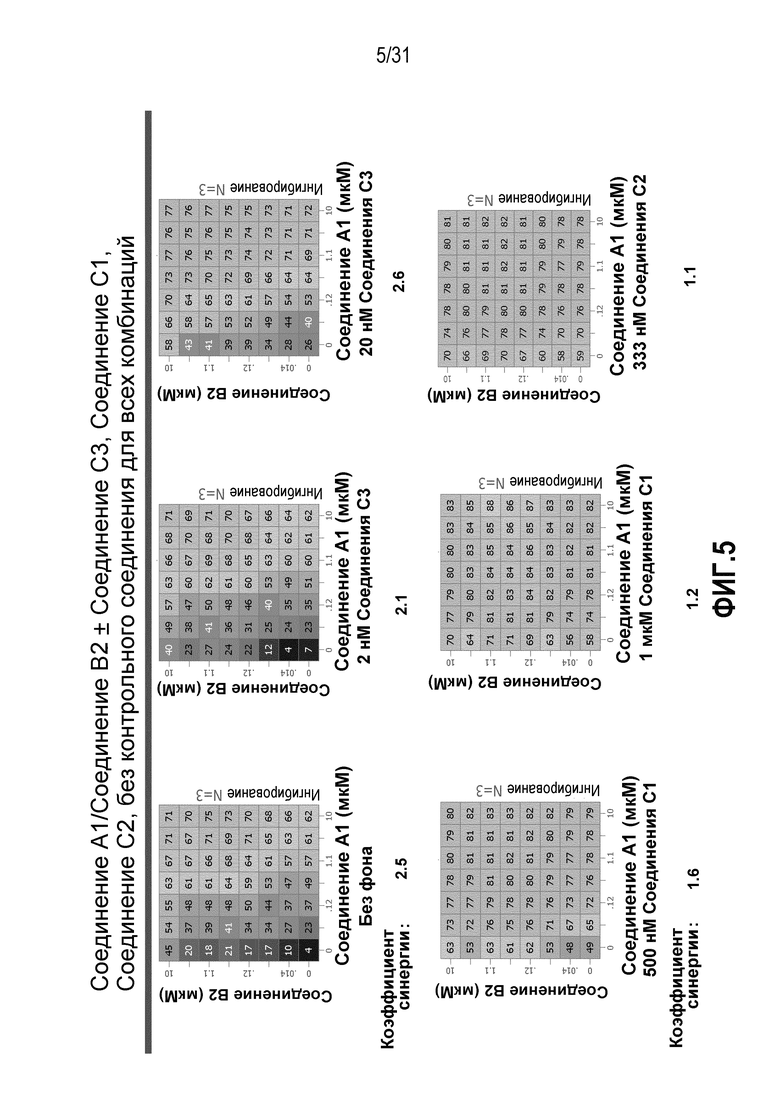
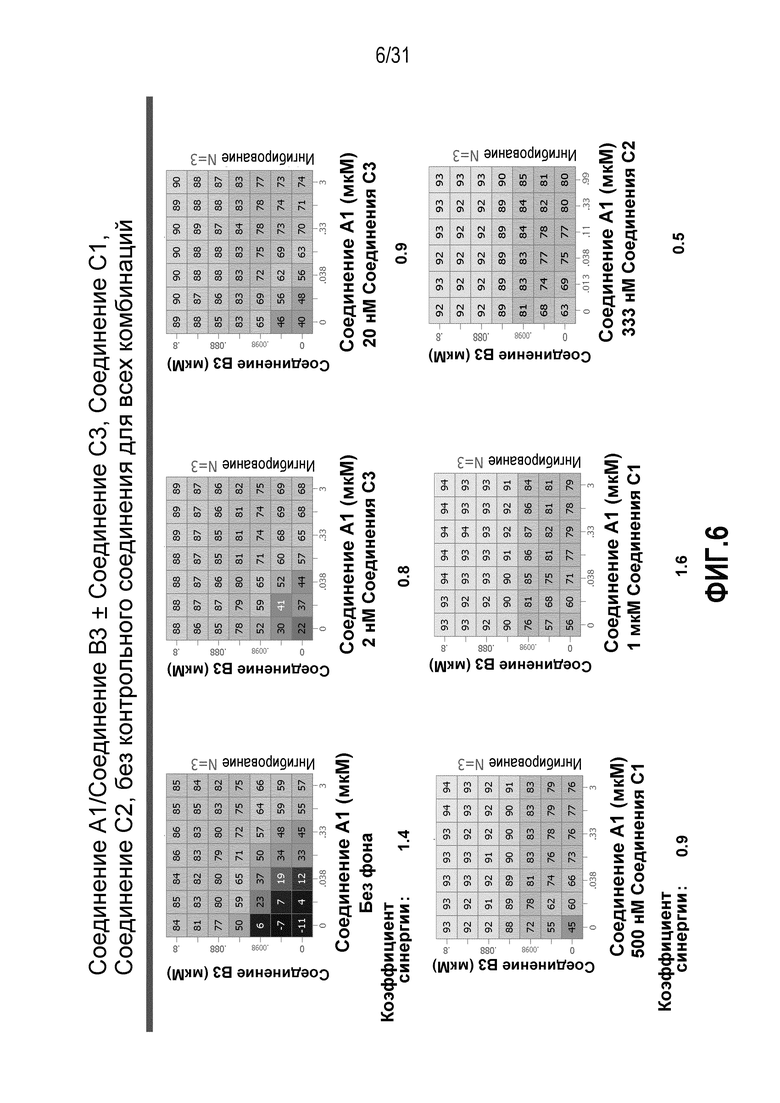
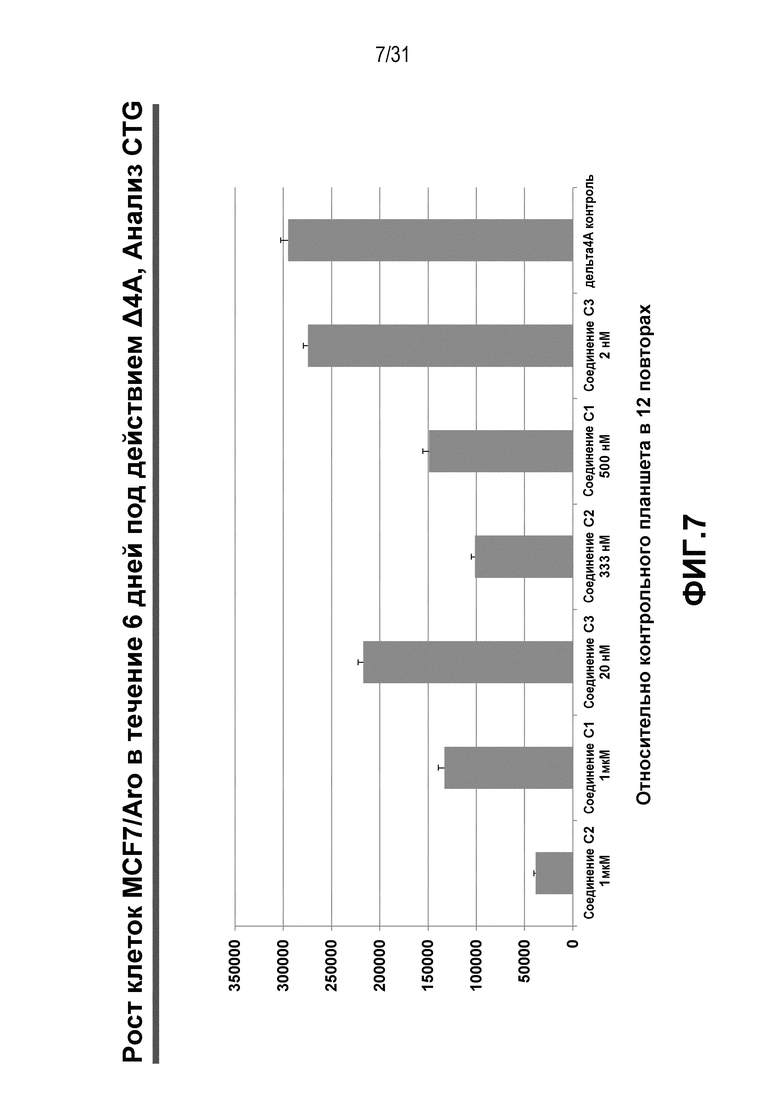
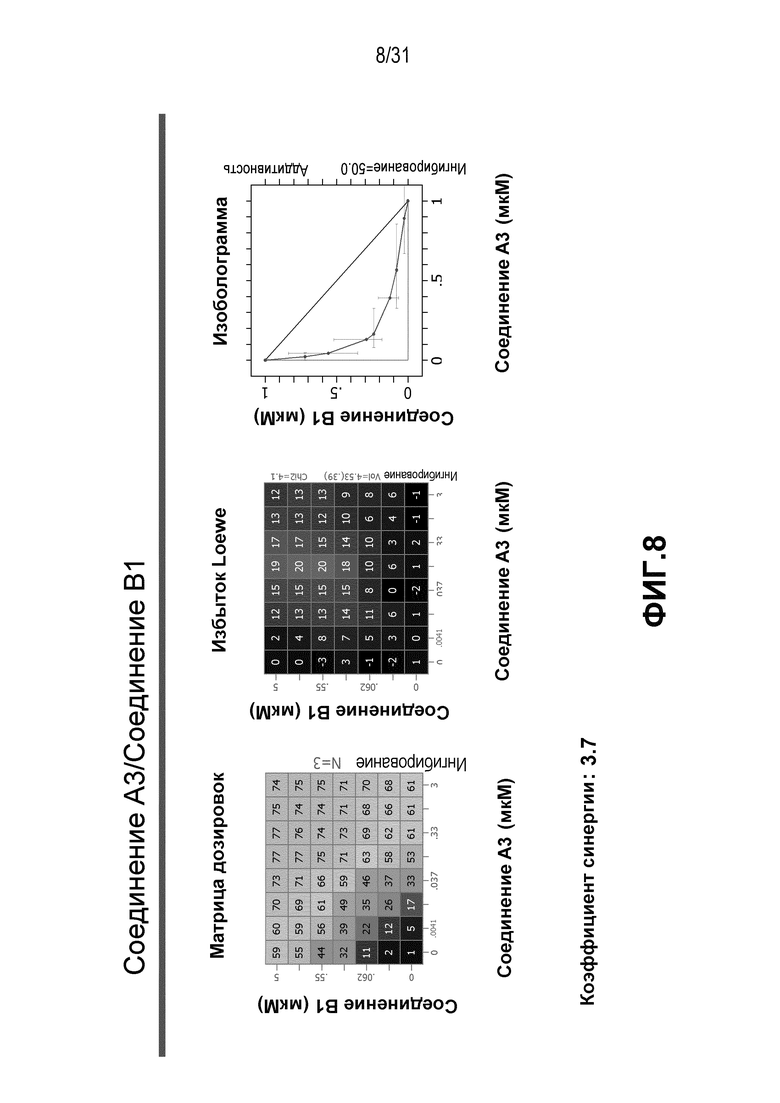
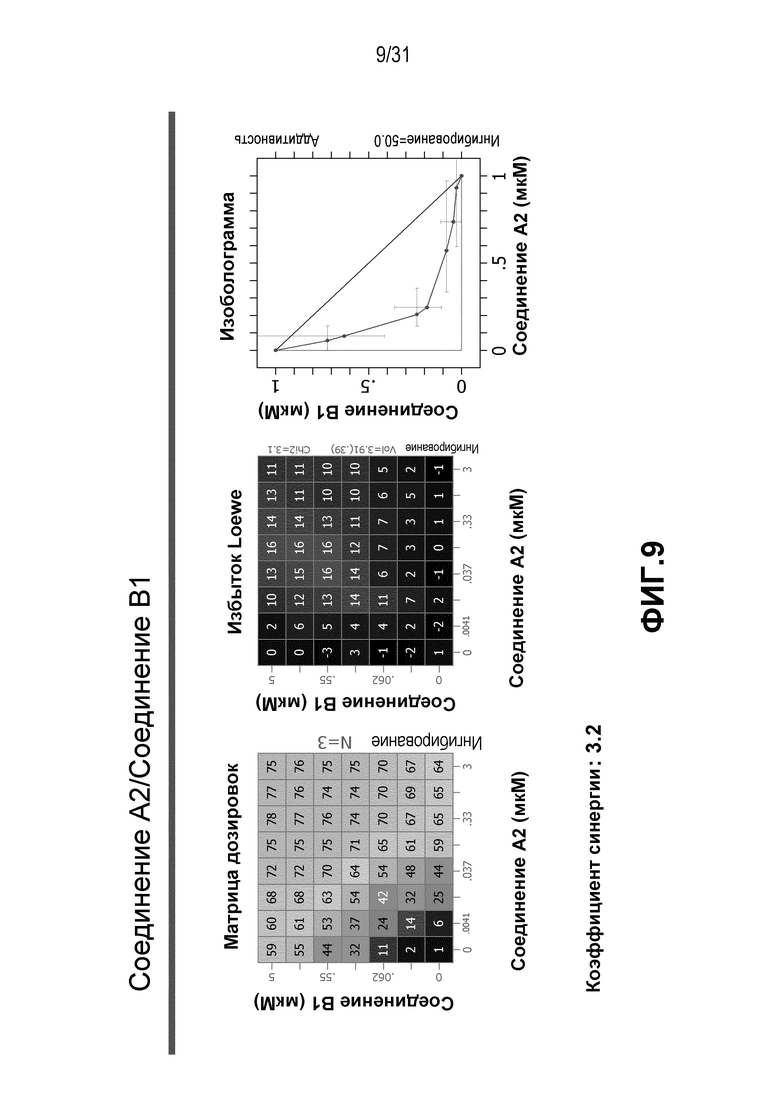
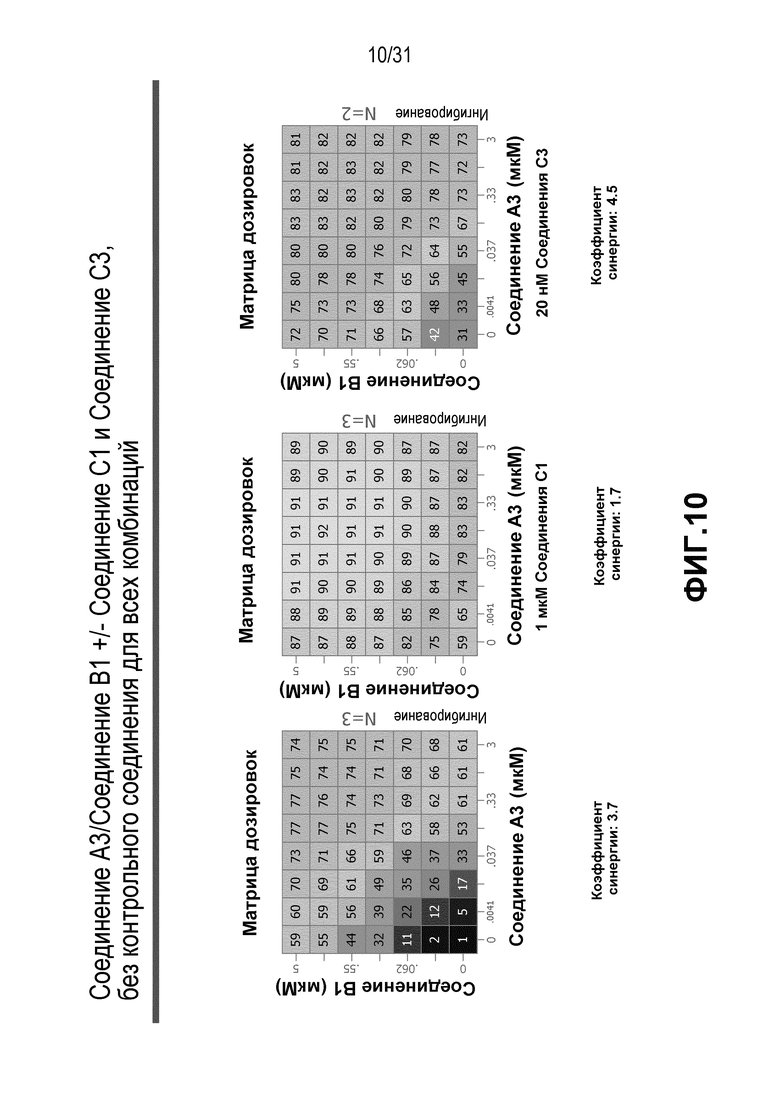
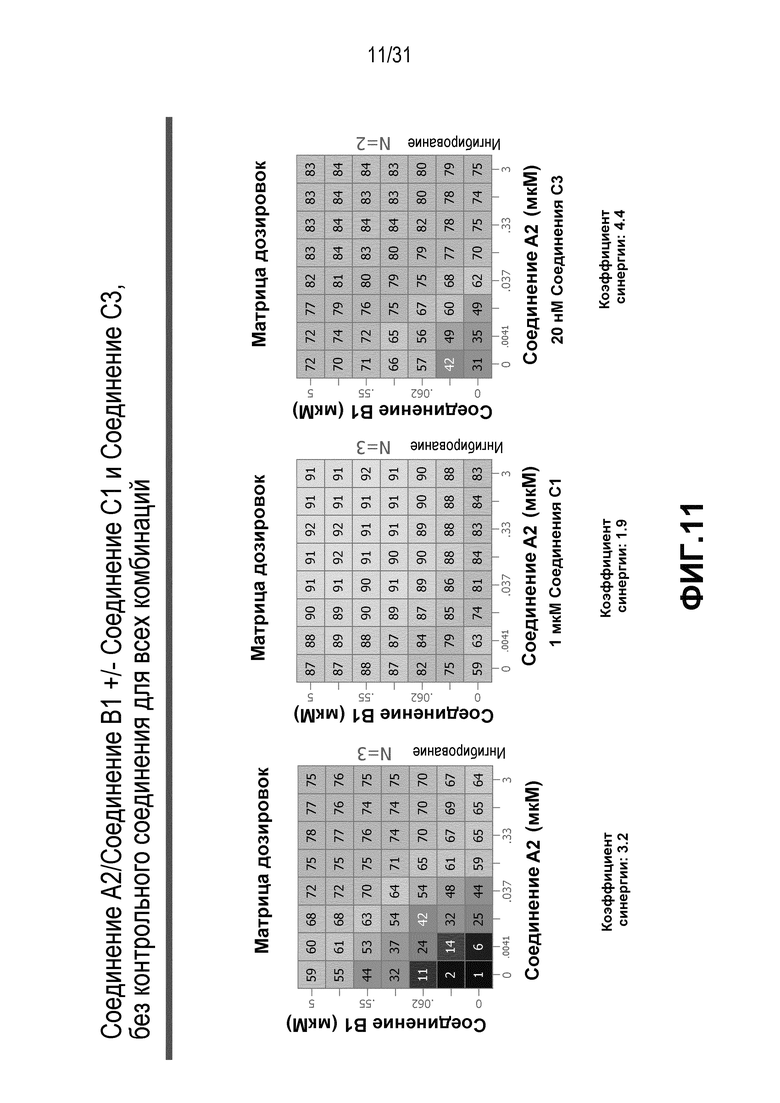
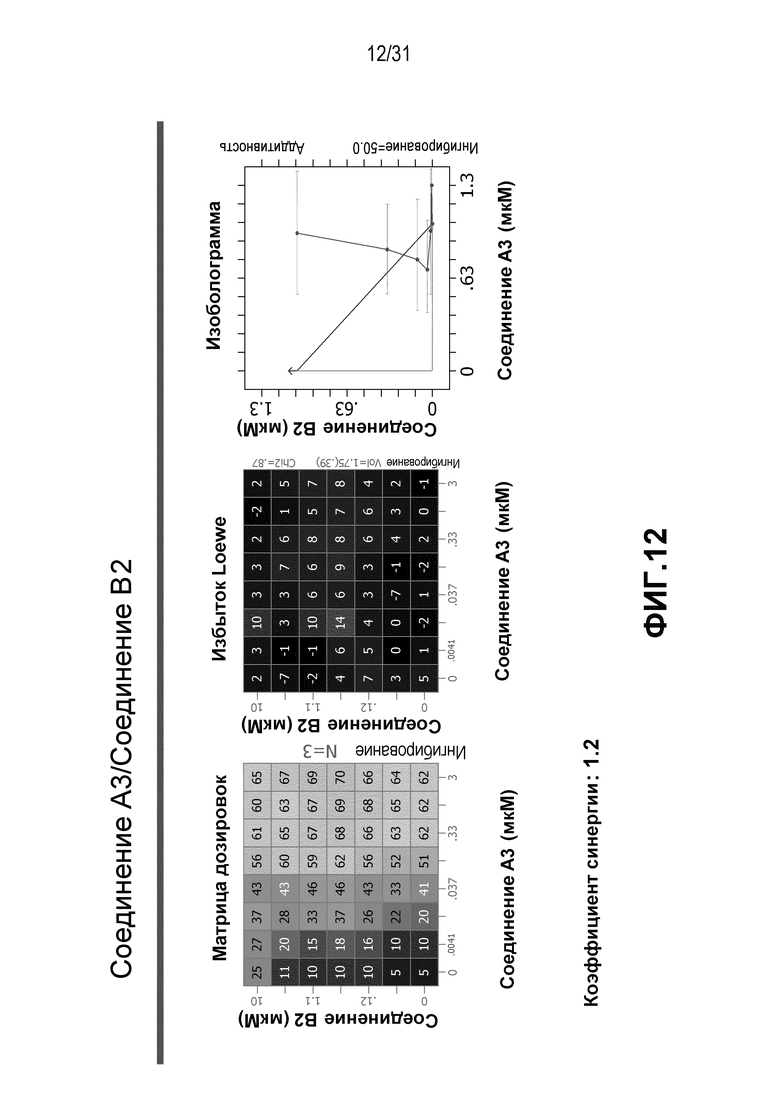
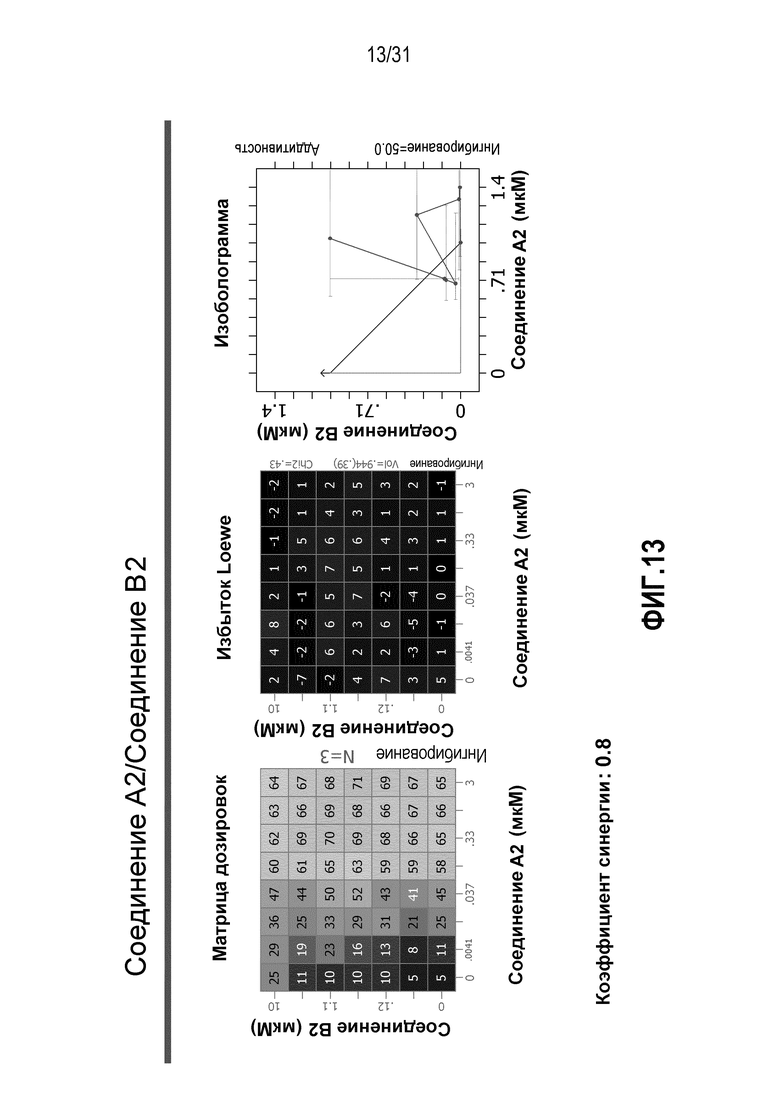


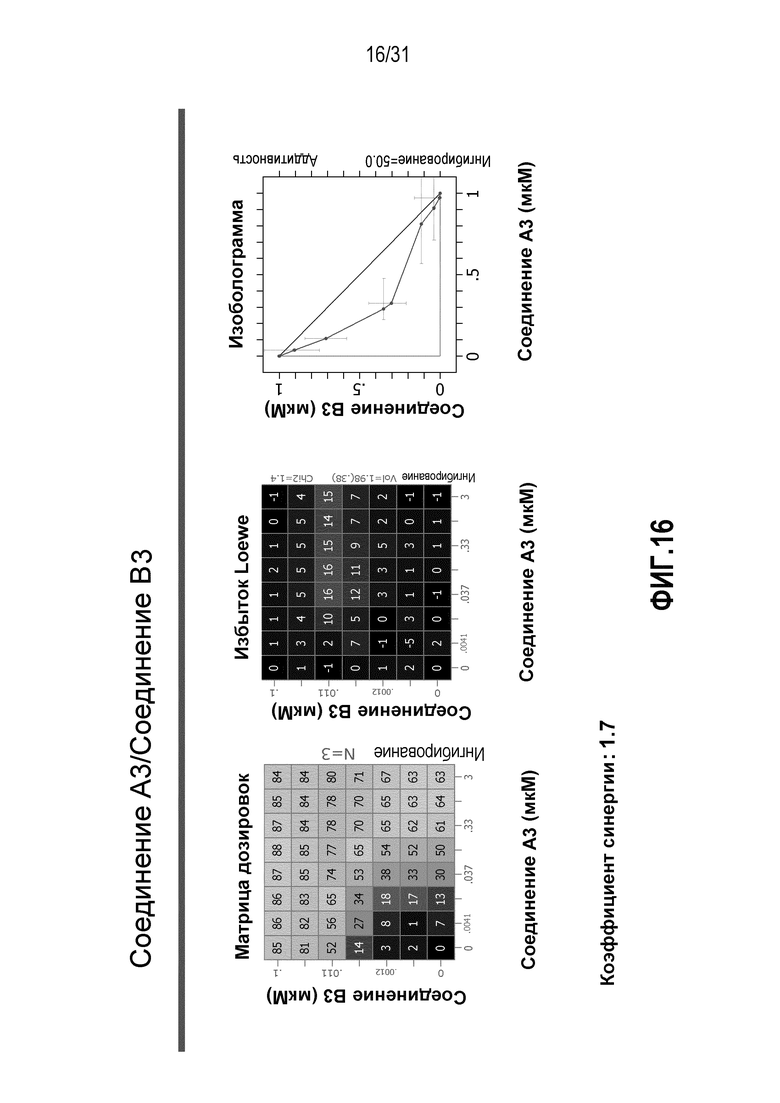
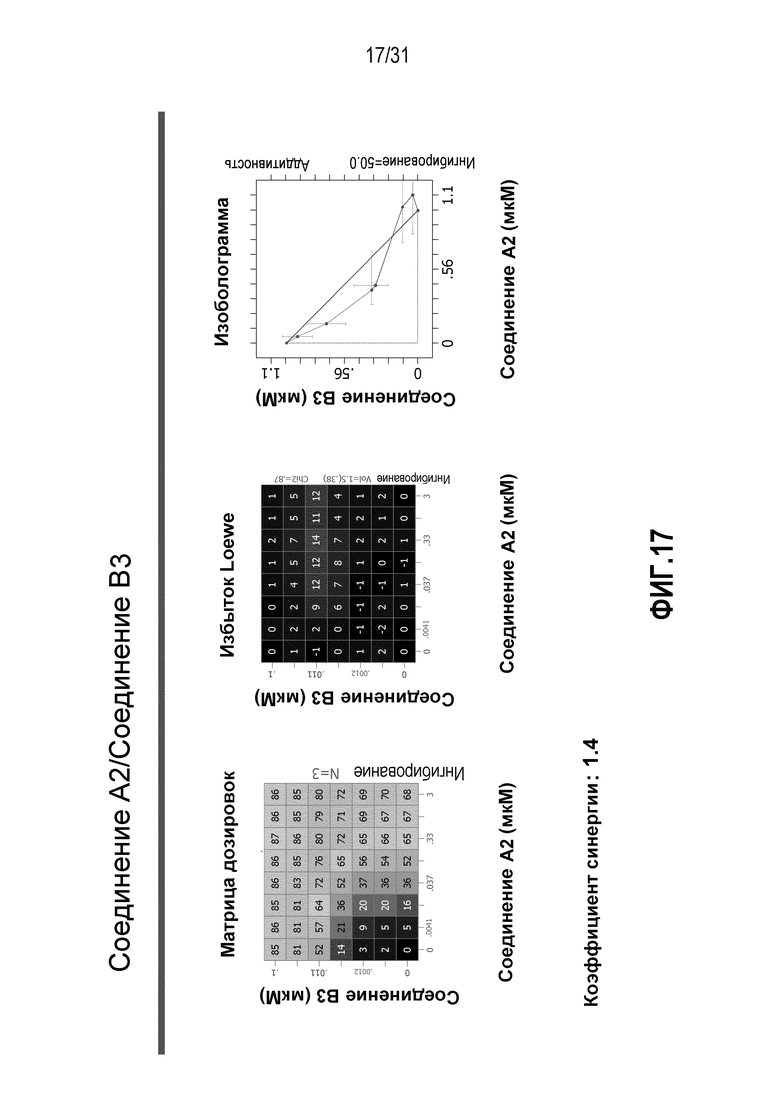
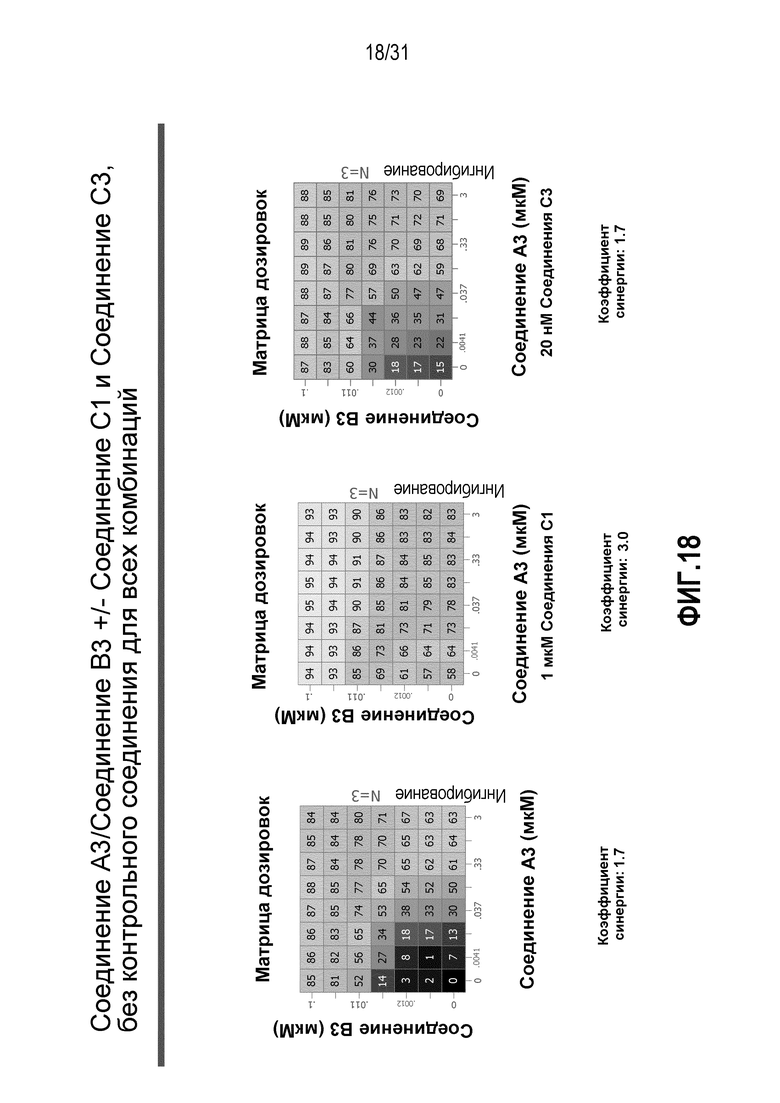
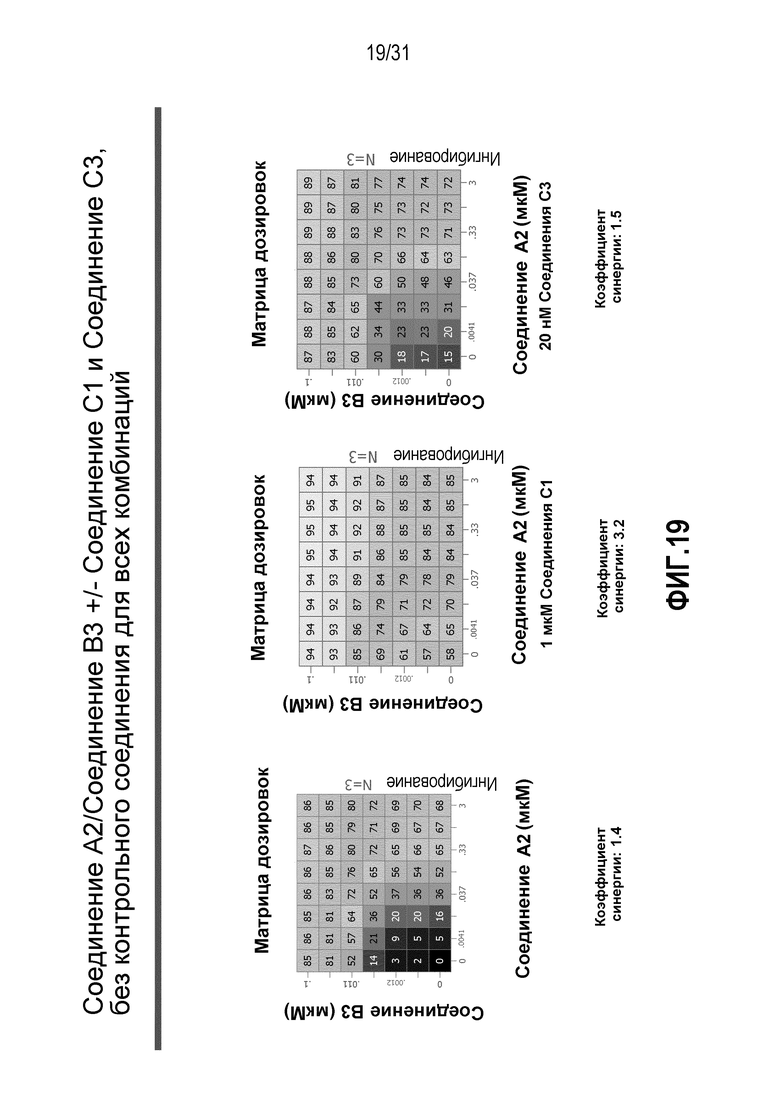
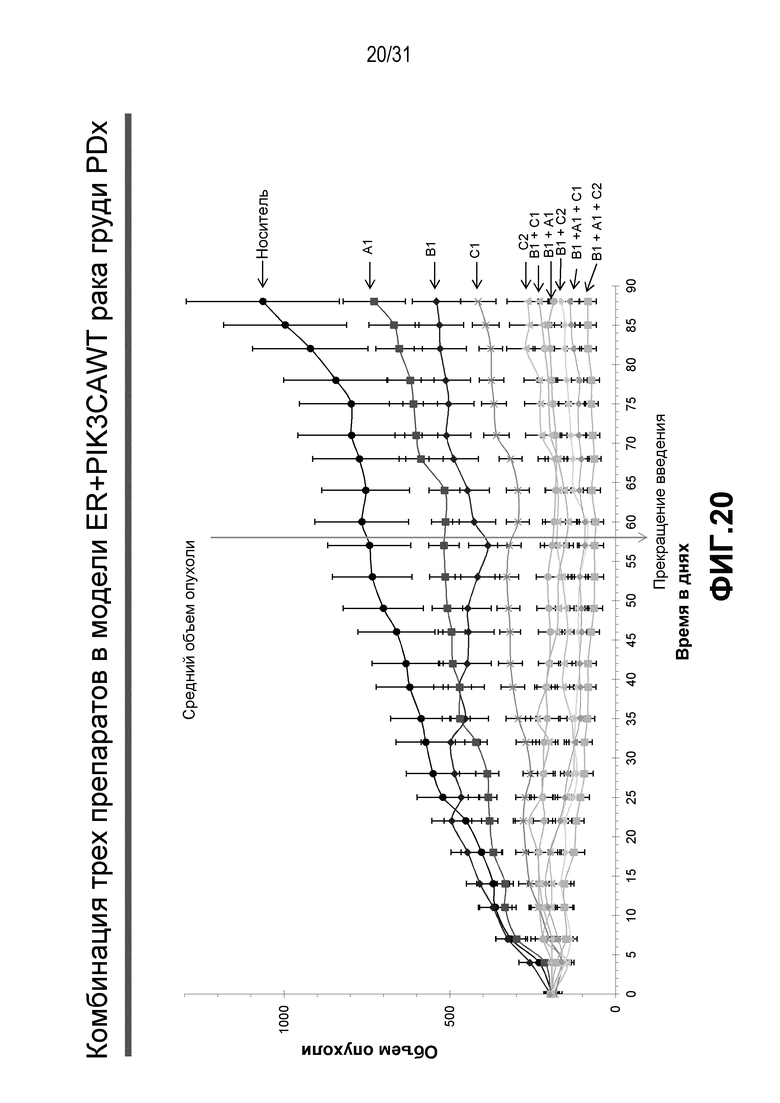
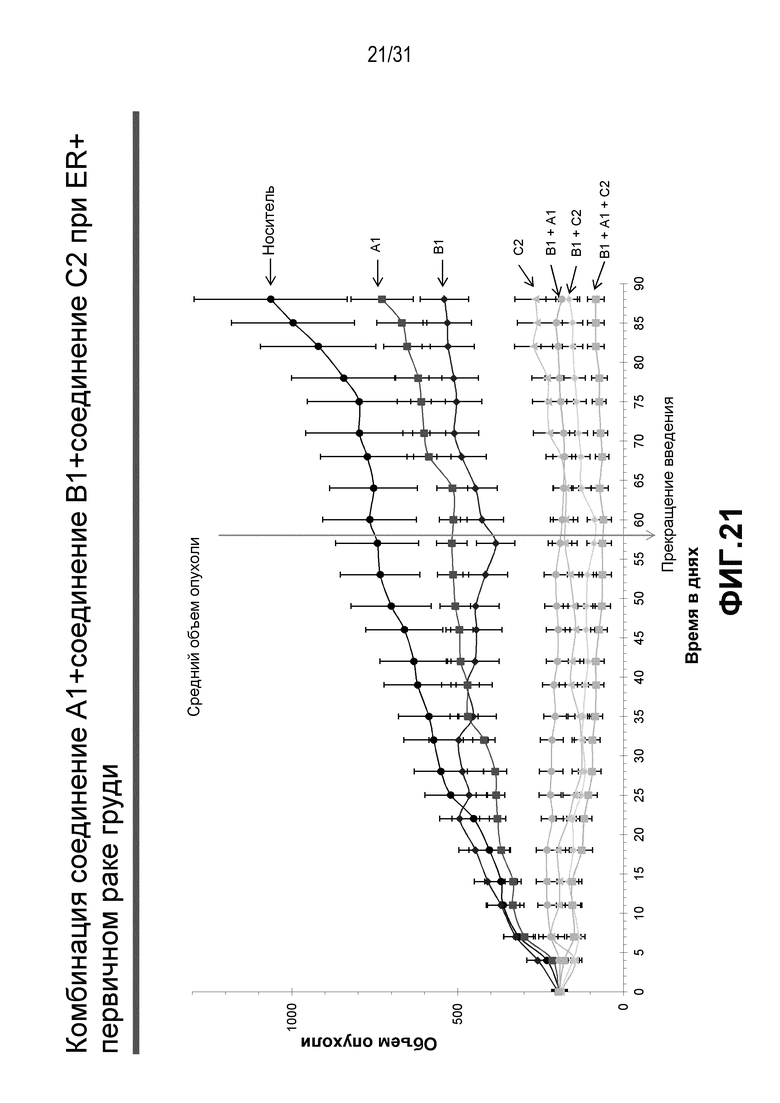
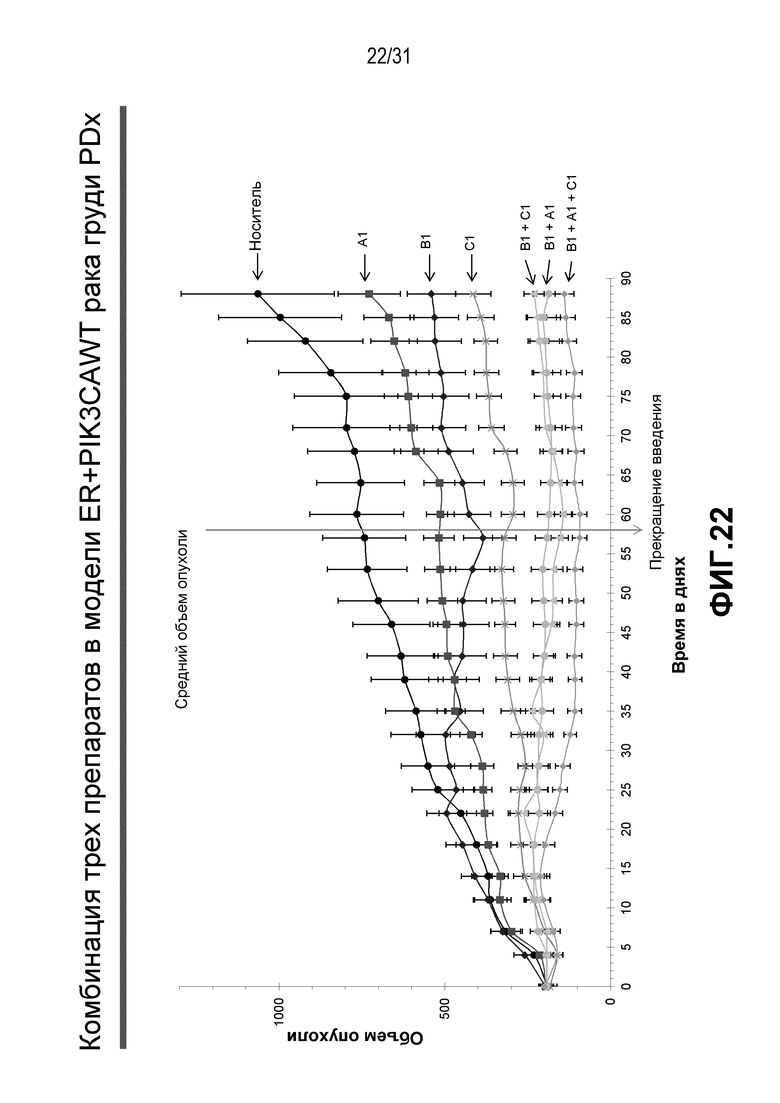
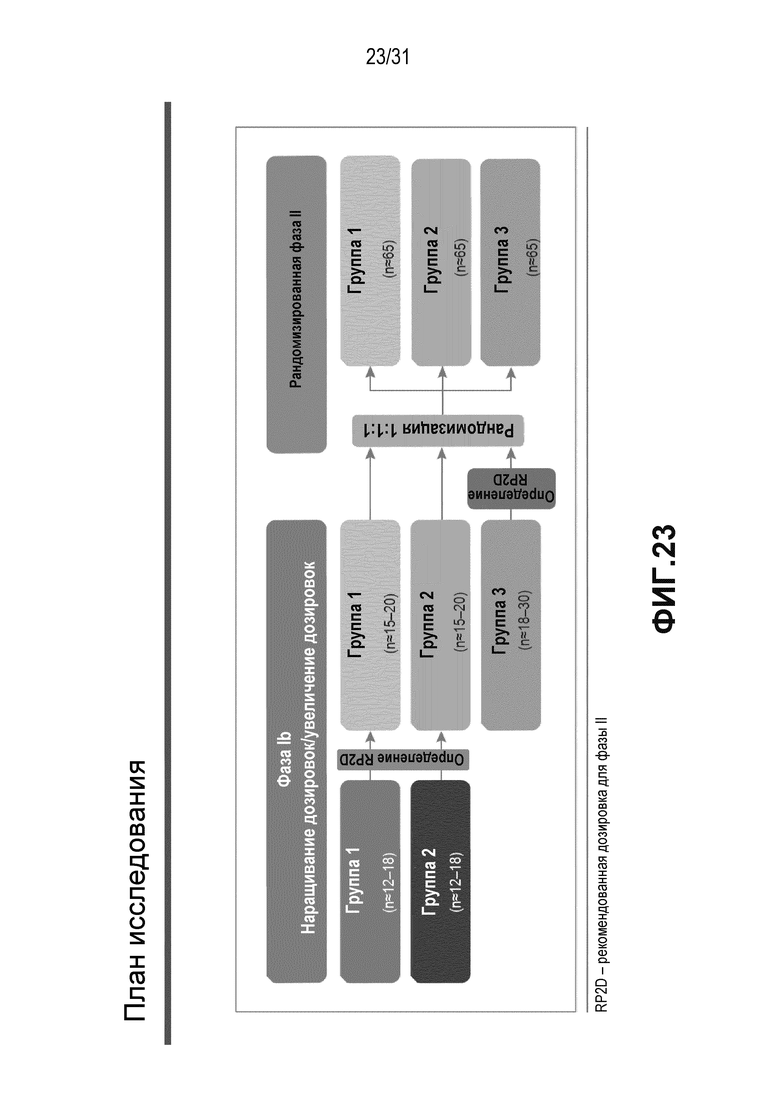
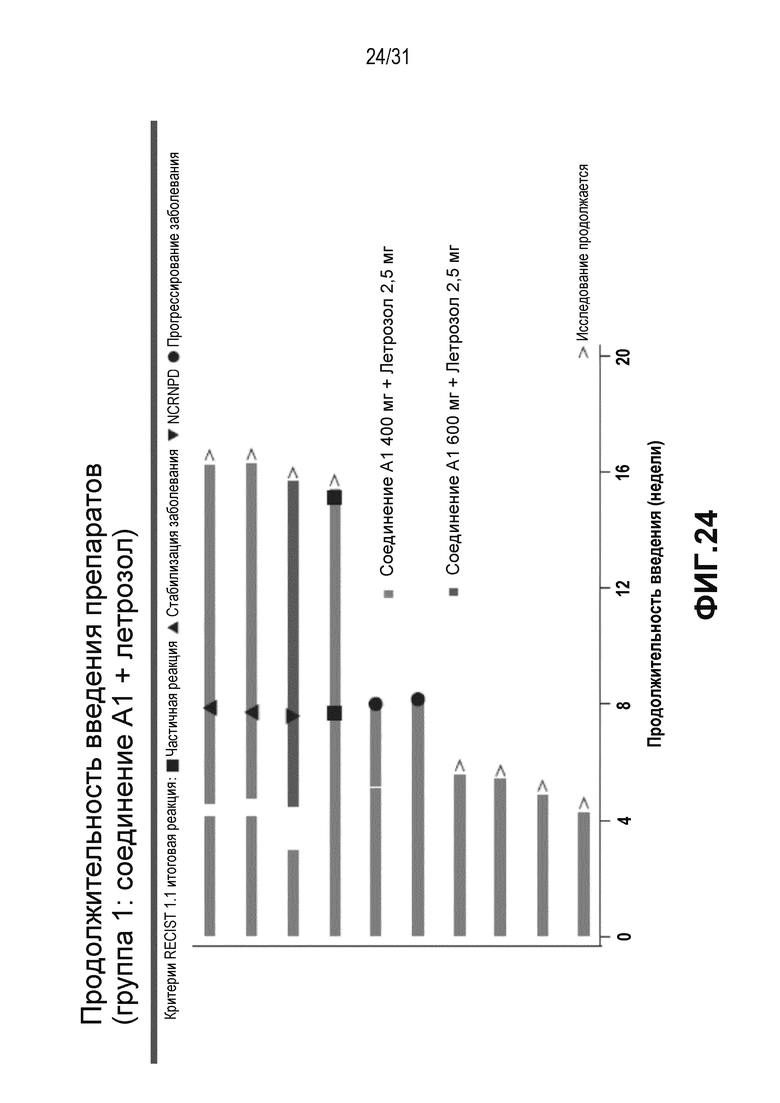
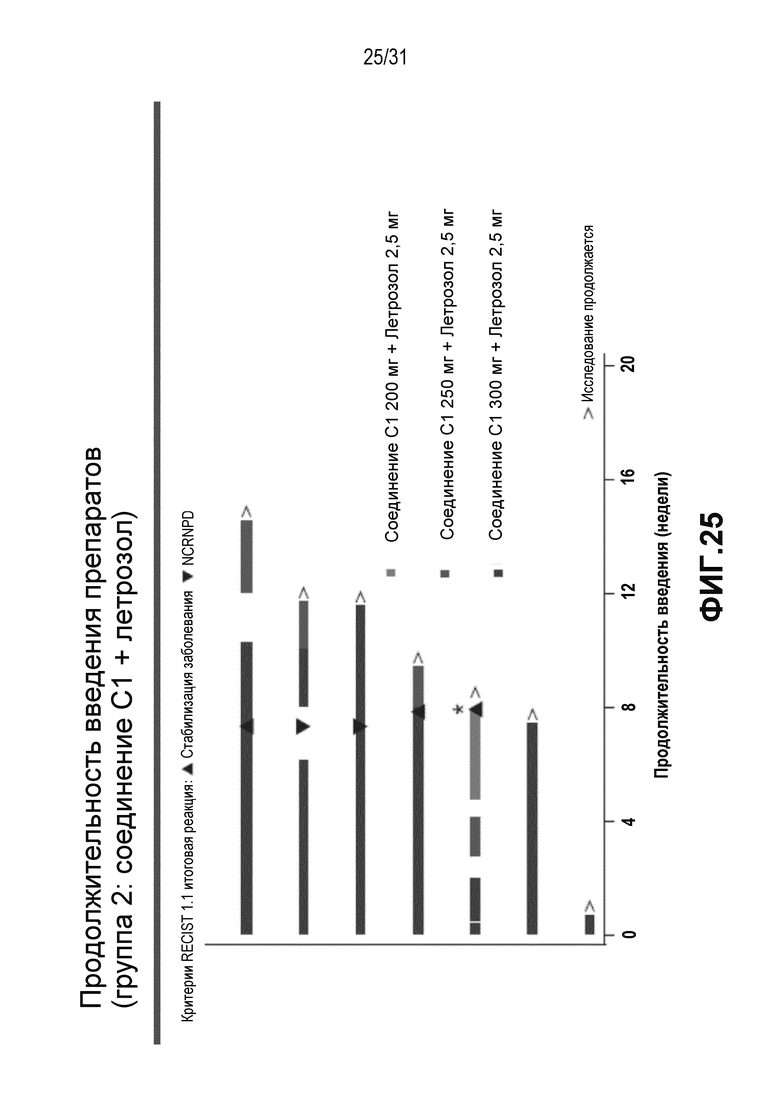
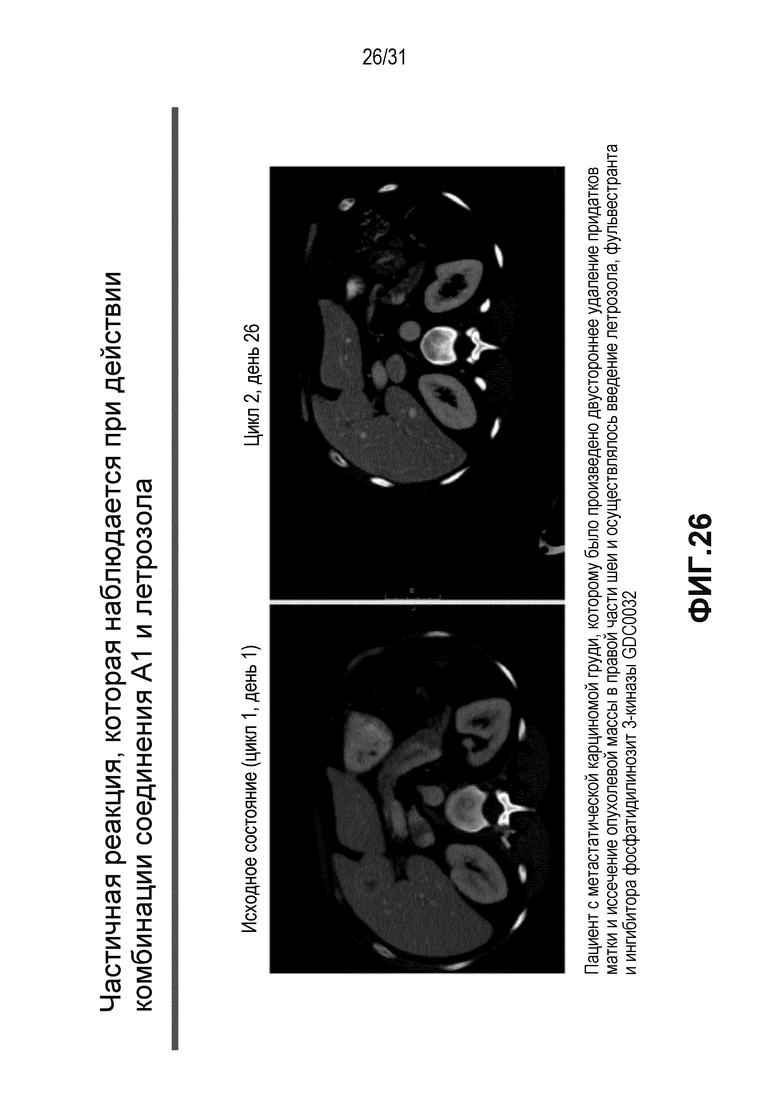
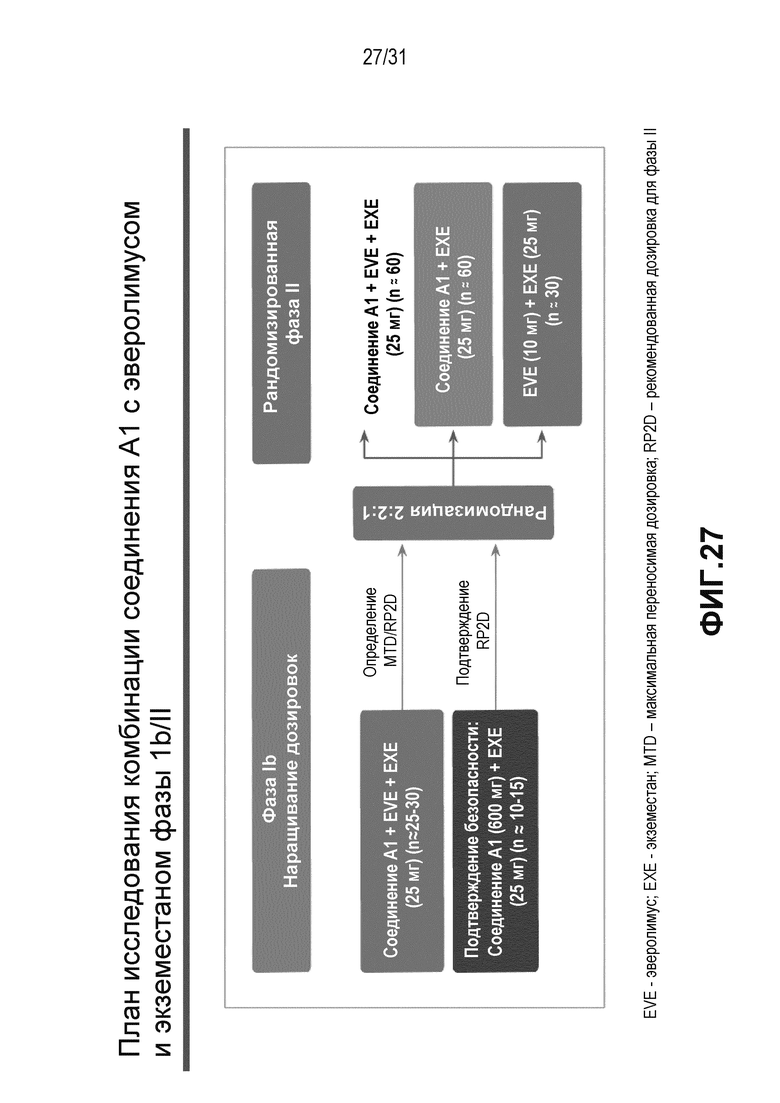
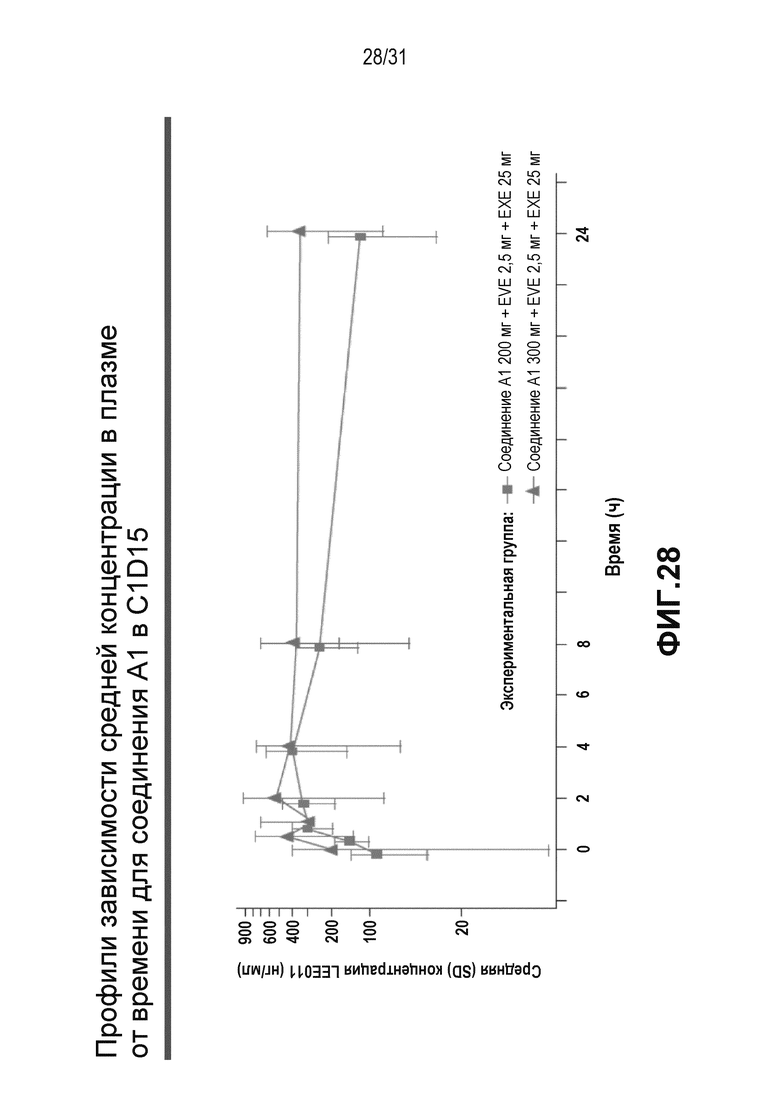
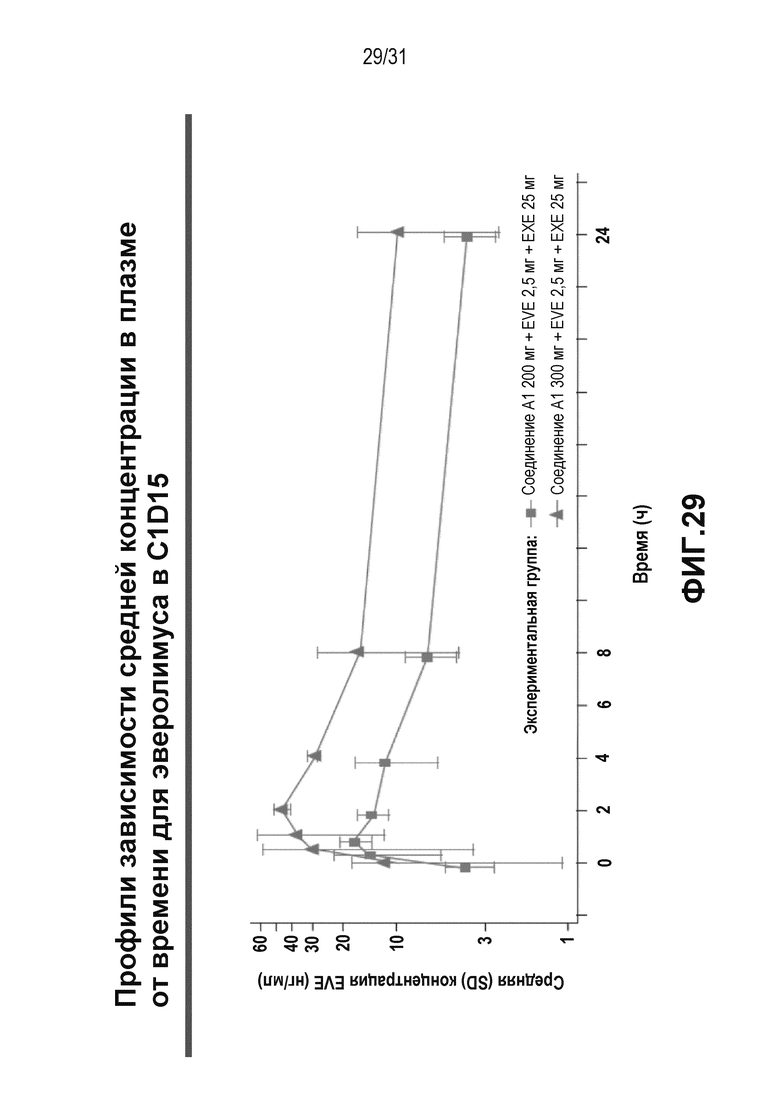
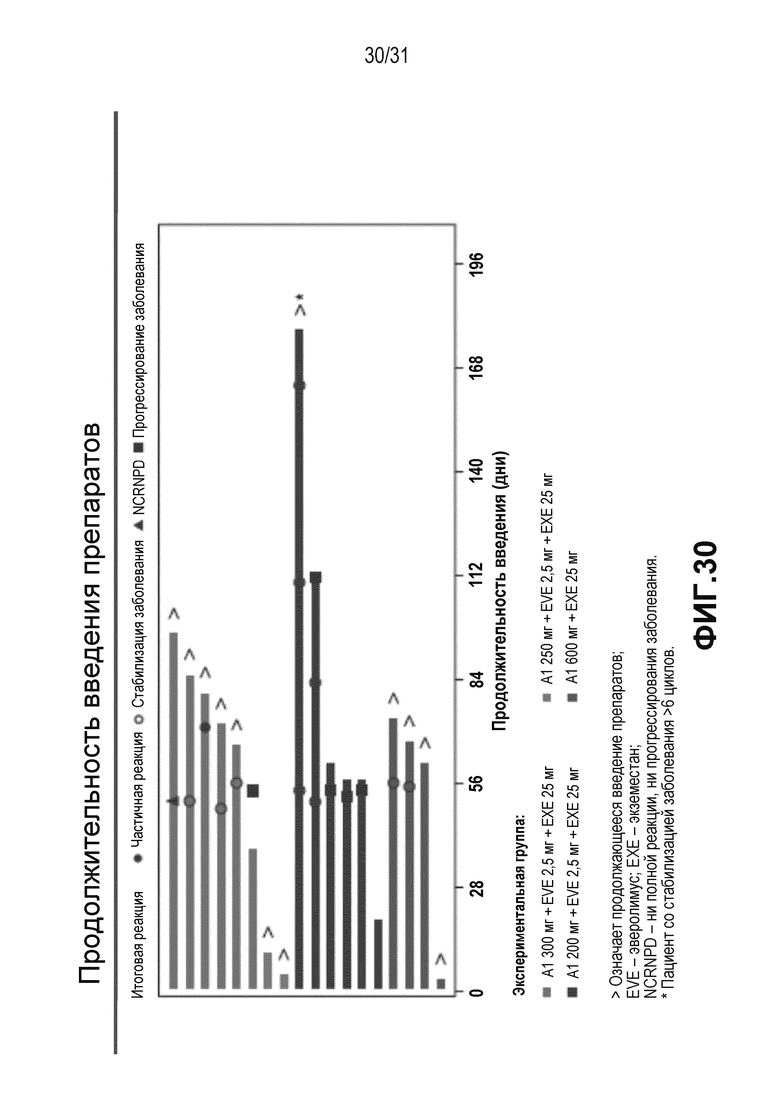
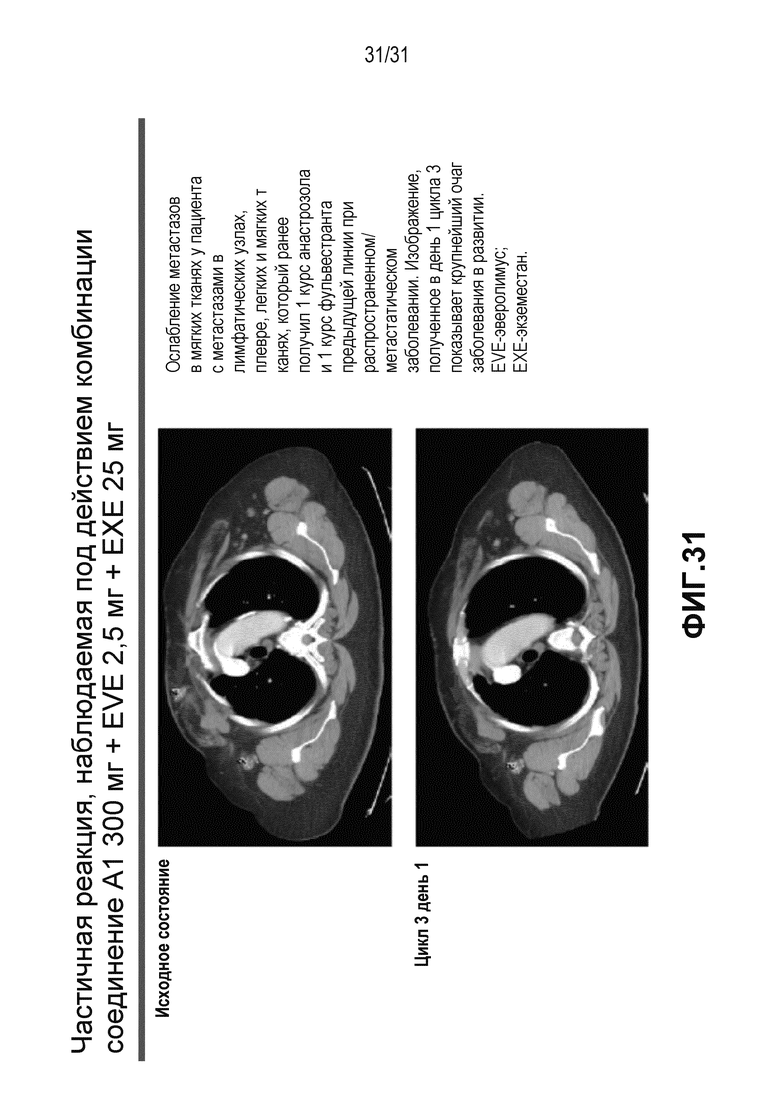
Изобретение относится к области фармацевтической промышленности, а именно к фармацевтической комбинации для лечения рака, включающей (1) соединение A1: 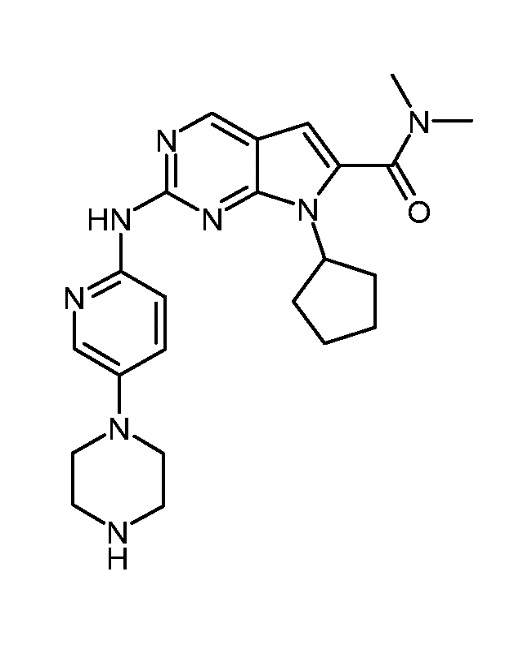 или его фармацевтически приемлемую соль и (2) летрозол или его фармацевтически приемлемую соль. Изобретение обеспечивает синергетический эффект при терапии рака. 7 з.п. ф-лы, 7 пр., 10 табл., 31 ил.
или его фармацевтически приемлемую соль и (2) летрозол или его фармацевтически приемлемую соль. Изобретение обеспечивает синергетический эффект при терапии рака. 7 з.п. ф-лы, 7 пр., 10 табл., 31 ил.
1. Фармацевтическая комбинация для лечения рака, включающая (1) соединение A1, описанное приведенной ниже формулой A1:
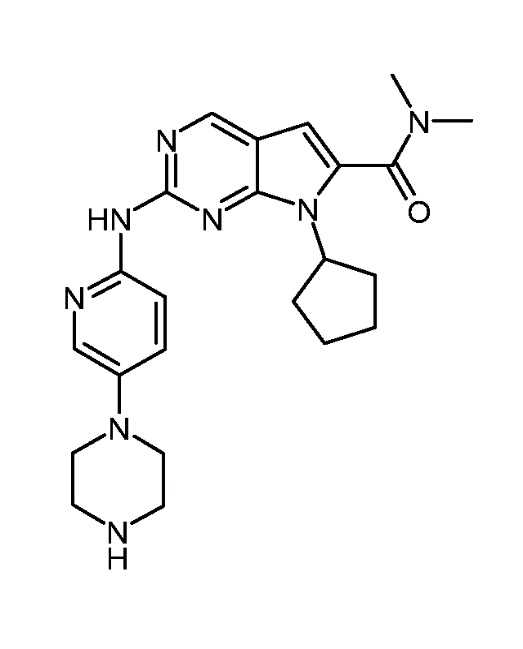
(A1),
или его фармацевтически приемлемую соль и (2) летрозол или его фармацевтически приемлемую соль.
2. Комбинация по п. 1, где агенты вводят одновременно, раздельно или последовательно.
3. Комбинация по п. 1 или 2, где рак выбран из группы, состоящей рака груди, рака эндометрия, рака яичников и рака шейки матки.
4. Комбинация по п. 3, где рак представляет собой рак груди.
5. Комбинация по п. 1, где рак представляет собой рак, положительный по рецептору эстрогена.
6. Комбинация по п. 4, где рак груди представляет собой рак груди, положительный по рецептору эстрогена.
7. Комбинация по п. 1, где рак представляет собой HR+, HER2- рак груди.
8. Комбинация по п. 1, где рак представляет собой HR+, HER2- распространенный рак груди.
| ПЛУГ ДЛЯ РАЗГРУЗКИ БАЛЛАСТНЫХ ПЛАТФОРМ | 1923 |
|
SU1008A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO 2013006532 A1, 10.01.2013 | |||
| WO 2011101409 A1, 25.08.2011 | |||
| José Baselga et al | |||
| Everolimus in Postmenopausal Hormone-Receptor-Positive Advanced Breast Cancer / The NEW ENGLAND JOURNAL of MEDICINE, 2012, V.366, N.6, pp.520-529 | |||
| Todd W | |||
| Miller et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Richard S Finn et al | |||
| УСТАНОВКА ДЛЯ ИЗГОТОВЛЕНИЯ СПИРАЛЬНО НАВИТЫХ АСБЕСТОМЕТАЛЛИЧЕСКИХ ПРОКЛАДОК | 0 |
|
SU332991A1 |
| ПРОТИВООПУХОЛЕВЫЕ КОМБИНАЦИИ С ИНГИБИТОРАМИ MTOR, ГЕРЦЕПТИНОМ И/ИЛИ HKI-272 | 2006 |
|
RU2451524C2 |
Авторы
Даты
2019-02-26—Публикация
2014-08-07—Подача