Настоящее изобретение касается новой соли 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона формулы (I)
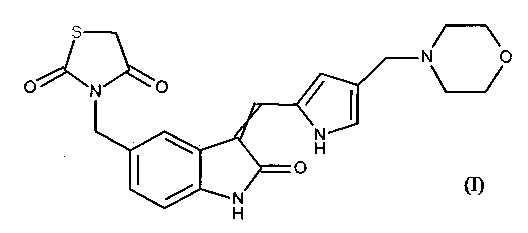
способа ее получения, а также содержащих ее фармацевтических композиций.
3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион обладает очень ценными фармакологическими свойствами в области онкологии. Было фактически продемонстрировано, что 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион способен ингибировать миграцию раковых клеток, что делает его особенно подходящим для лечения рака, более конкретно - солидных метастатических опухолей. Среди видов рака, поддающихся лечению, можно упомянуть, помимо прочих, рак толстой кишки, молочной железы, печени, почек, головного мозга и пищевода, меланомы, миеломы, рак яичников, немелкоклеточный рак легких, мелкоклеточный рак легких, рак предстательной железы и поджелудочной железы и саркомы.
Получение и терапевтическое применение 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона и его аддитивных солей с фармацевтически приемлемой кислотой, более конкретно - ее гидрохлоридом, было описано, например, в описании Европейского патента EP 2281822.
С учетом фармацевтической ценности этого соединения важной представляется возможность получения активного соединения в отличном выходном количестве, с высокой чистотой и отличной воспроизводимостью. Часто обнаруживается, что применяемый гидрохлорид создает проблемы очистки и рекристаллизации, а также значительные трудности в оптимизации выхода. Кроме того, наблюдались проблемы воспроизводимости и устойчивости полученного активного соединения. После многочисленных исследований была получена возможность распознавания новой соли, сочетающей различные преимущества, в частности, касающиеся очистки, воспроизводимости процесса получения и выхода, а также неожиданно обладающей преимуществом очень значительного улучшения растворимости активного соединения. Эта новая соль, соответственно, обладает всеми качествами, необходимыми для ее применения в качестве медикамента, как с физико-химической, так и с фармакокинетической точки зрения.
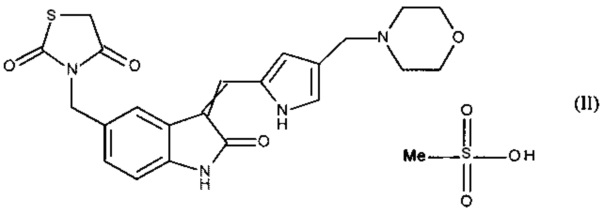
Настоящее изобретение соответственно касается новой соли 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, более конкретно - метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона формулы (II):
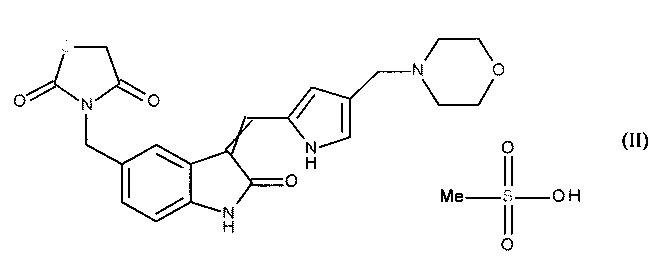
где обозначение  означает, что двойная связь имеет конфигурацию Z или E.
означает, что двойная связь имеет конфигурацию Z или E.
Изобретение предпочтительно касается Z-изомера метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона.
Эта новая соль обладает следующими преимуществами:
- простой и воспроизводимый процесс ее получения с отличным выходом;
- повышенная растворимость в воде и органических растворителях, что позволяет предусматривать стадии очистки, такие, как осветление, с целью повышения чистоты.
Изобретение также касается способа получения метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, более конкретно - его Z-изомера, характеризующегося тем, что в качестве исходного материала применяют 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион, получаемый, например, в соответствии со способом, представленным в описании патента EP 2281822. Дион растворяют в бинарной системе растворителя/воды, затем добавляют от 1 до 2 молярных эквивалентов метансульфоновой кислоты и смесь перемешивают до выпадения в осадок метансульфоната.
Растворитель предпочтительно является полярным растворителем, таким, как, например, ацетонитрил, ацетон, 1,4-диоксан, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, спирты, такие, как метанол, этанол и изопропанол, вода, а также водные/органические смеси этих растворителей. Предпочтительно соотношение растворителя/воды составляет от 0/100 до 100/0.
Вариант способа согласно изобретению состоит из использования в качестве исходного материала гидрохлорида 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона; способ получения этого соединения представлен, например, в описании патента EP 2281822. Гидрохлорид растворяют в бинарной системе растворителя/воды, и уровень pH смеси доводят до 8 путем добавления основания. Образовавшуюся соль удаляют путем фильтрации. Фильтрат нагревают, а затем добавляют метансульфоновую кислоту. Затем температура медленно возвращается к окружающей температуре, и полученный метансульфонат отфильтровывают. Более конкретно, применяемым растворителем является полярным растворителем, таким, как ацетонитрил, ацетон, 1,4-диоксан, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, или спирты, такие, как метанол, этанол и изопропанол. Предпочтительно соотношение растворителя/воды составляет 70/30, более предпочтительно - 90/10. Метансульфоновую кислоту используют в избытке, более конкретно - от 1 до 2 эквивалентов.
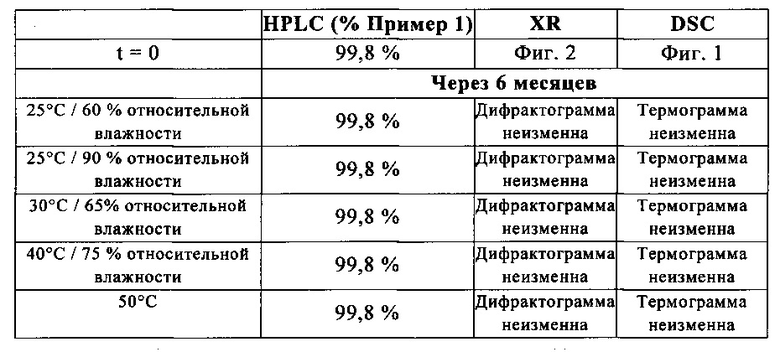
Соединение формулы (II) согласно изобретению обладает отличной стойкостью во времени даже в условиях денатурирования: при 25°C/60% относительной влажности, при 25°C/90% относительной влажности, при 30°C/65% относительной влажности, при 40°C/75% относительной влажности или при 50°C соединение формулы (II) остается неизменным после 6 месяцев хранения.
Изобретение также касается фармацевтических композиций, включающих в качестве активного ингредиента соединение формулы (II) согласно изобретению, более конкретно - его Z-изомер, вместе с одним или несколькими соответствующими инертными, нетоксичными вспомогательными веществами. Среди фармацевтических композиций согласно изобретению более конкретно можно упомянуть те, которые являются подходящими для перорального, парентерального (внутривенного или подкожного) или назального введения, таблетки или драже, гранулы, сублингвальные таблетки, капсулы, пастилки, суппозитории, кремы, мази, кожные гели, инъекционные препараты, пригодные для питья суспензии и жевательные резинки.
Фармацевтические формы, включающие соединение формулы (II) согласно изобретению, более конкретно - его Z-изомер, предназначаются для применения в лечении рака, более конкретно - солидных метастатических опухолей. Среди видов рака, поддающихся лечению, можно упомянуть, помимо прочих, рак толстой кишки, молочной железы, печени, почек, головного мозга и пищевода, меланомы, миеломы, рак яичников, немелкоклеточный рак легких, мелкоклеточный рак легких, рак предстательной железы и поджелудочной железы и саркомы.
Эффективная доза может колебаться в зависимости от характера и тяжести нарушения, пути введения и возраста и массы пациента. Доза колеблется от 1 мг до 1 г в день как эквивалент в чистом основании, за один или несколько приемов.
Представленные ниже примеры поясняют изобретение, никоим образом его не ограничивая.
Пример 1: 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион метансульфонат, Z-изомер
1,26 г 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона помещают в 100 мл колбу. После добавления 20 мл раствора ацетонитрила/воды (90/10) смесь нагревают при 70°C. Приготавливают раствор, содержащий 2 мл метансульфоновой кислоты и 50 мл смеси ацетонитрила/воды (90/10). 5 мл полученного в результате раствора добавляют в реакционную смесь, которая становится прозрачной. Раствор охлаждают до 20°C (0,5°C/мин, перемешивание при 200 об/мин). После перемешивания в течение суток при окружающей температуре указанный продукт отделяют путем фильтрации и высушивают при 40°C in vacuo (10 мбар).
Точка плавления: 270-274°C (плавление/распад)
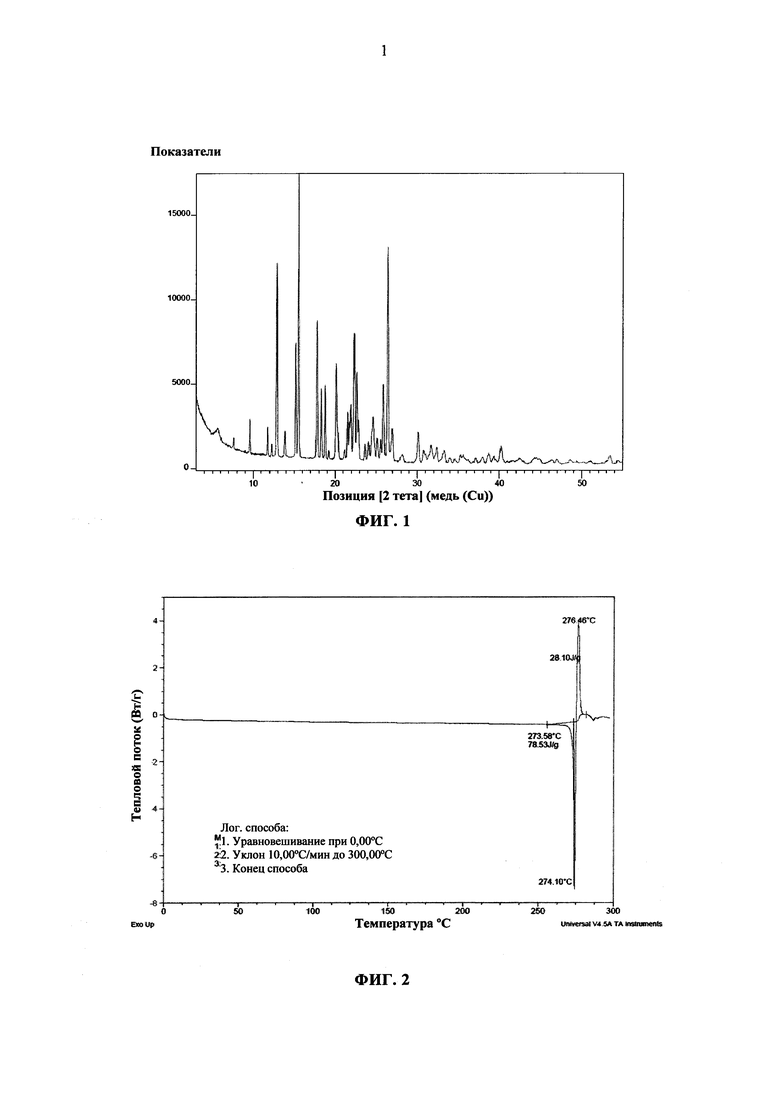
Указанный продукт характеризуется путем порошковой дифрактографии, которую осуществляют на 50 мг соединения согласно Примеру 1, помещенного между пленками 2 Kapton® или на подложку и загружают в дифрактометр Panalytical Xpert-Pro MPD (медный антикатод) в режиме передачи с угловым диапазоном 3-55° в выражении 2θ, шагом 0,017° и 35,5 с на шаг, что позволяет распознать следующие кристаллические параметры:
- параметры элементарной ячейки: a=15,0958(5) Å, b=18,4586(6) Å, c=8,8269(2) Å, β=94,074(1)°, γ=90°
- пространственная группа: C 1 с 1 (9)
- объем элементарной ячейки: Vunit cell = 2453,37600 Å3
Указанный продукт также характеризовался путем рентгеновской дифракции отдельного кристалла соединения по Примеру 1, которую осуществляли при помощи устройства Rigaku XtaLAB с применением графитового монохроматического излучения Mo-Ka. Наблюдали следующие кристаллические параметры:
- параметры кристаллической ячейки: a=14,995(4) Å, b=18,302(4) Å, c=8,850(2) Å, β=93,528(7)°, γ=90°
- пространственная группа: C 1 с 1 (9)
- объем одиночной ячейки: Vunit cell = 2424,0 Å3
Небольшие различия, наблюдаемые в параметрах, получаемых с применением порошка, обусловлены температурой, применяемой для получения параметров с монокристаллом (-100°C), что вызывает сокращение вдоль осей a и b.
Указанный продукт также характеризовался рентгеновской порошковой дифрактограммой, показанной на Фигуре 1 и измеряемой при помощи дифрактометра Panalytical XPert Pro MPD (медный антикатод) и выражаемой как межплоскостное расстояние d, угол Брэгга 2 тета (выражаемый в °±0,2) и относительная интенсивность (выражаемая как процент относительно наиболее интенсивной линии):
-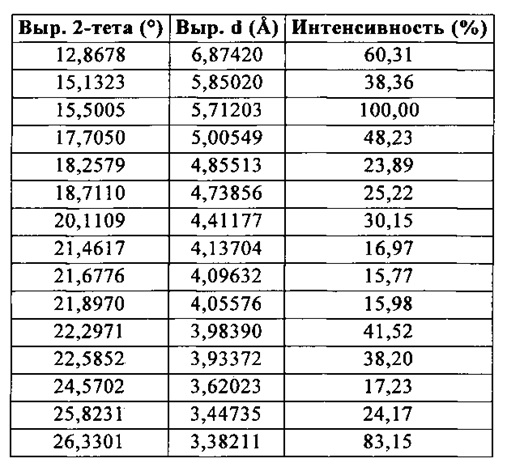
Углы Брэгга 2-тета (выражаемые в °±0,2), характерные для рентгеновской порошковой дифрактограммы: 12,86; 15,13; 15,50; 17,70; 18,25; 18,71; 20,11; 21,46; 21,67; 21,89; 22,29; 22,58; 24,57; 25,82; 26,33.
Соединение по Примеру 1 также характеризовалось его DSC-диаграммой для образца 5-10 мг, загруженного в устройство ТА Instruments DSC Q1000 и охлажденного до 0°C. Затем образец нагревают до 300°C при скорости 10°C/мин. Полученный график показан на Фигуре 2.
Пример 2: Чистота и стойкость метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, Z-изомера, в условиях денатурирования
Пример 3: Растворимость метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион, Z-изомера
Раствор, содержащий 140 мг соединения, полученного в Примере 1, в 7 мл воды перемешивают в течение 24 часов при окружающей температуре. После фильтрации с применением фильтра Acrodisc GHP 0,45° мкм раствор анализируют путем HPLC. Растворимость соединения согласно Примеру 1 составляет 14,7 мг/мл (или 12,1 мг/мл как эквивалент в чистом основании).
В тех же условиях растворимость гидрохлорида 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, Z-изомера, составляет 4,3 мг/мл (или 4 мг/мл как эквивалент в чистом основании).
Пример 4: Кинетика растворения при pH 2 (желудочный уровень pH) метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, Z-изомера
Кинетику растворения при неизменной площади поверхности (или собственную кинетику растворения) продукта согласно Примеру 1 определяли при окружающей температуре при pH 2 (10 мл 0,01N HCl) с применением устройства для определения скорости растворения μDiss и шариков 0,075 см2, изготовленных путем сжатия при 90 бар, в течение 2 минут при скорости перемешивания 100 об/мин.
Продукт согласно Примеру 1 растворяется с кинетикой 23 мкг⋅с-1⋅см-2 +/-11%. Для сравнения, кинетика растворения соответствующего гидрохлорида составляет 1,6 мкг⋅с-1⋅см-2. Таким образом, метансульфонат растворяется приблизительно в 14 раз быстрее, чем соответствующий гидрохлорид.
Пример 5: Фармацевтические композиции
1000 таблеток, каждая из которых содержала дозу 5 мг метансульфоната 3-[3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, Z-изомера
Изобретение относится к метансульфонату 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона формулы (II), где обозначение  означает, что двойная связь имеет конфигурацию Z или Е. Соединение по изобретению, являющееся Z-изомером метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, характеризуется рентгеновской порошковой дифрактограммой с углами Брэгга 2 тета (выражаемых в °±0,2) 12,86; 15,13; 15,50; 17,70; 18,25; 18,71; 20,11; 21,46; 21,67; 21,89; 22,29; 22,58; 24,57; 25,82; 26,33. Соединения формулы (II) получают путем применения в качестве исходного материала 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион, который растворяют в бинарной системе растворителя/воды, а затем добавляют от 1 до 2 молярных эквивалентов метансульфоновой кислоты, перемешивают до выпадения в осадок метансульфоната, который отфильтровывают. Метансульфонат 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона формулы (II) предназначен для применения в производстве медикаментов для применения в лечении рака и обладает улучшенной растворимостью. 3 н. и 5 з.п. ф-лы, 2 ил., 2 табл., 5 пр.
означает, что двойная связь имеет конфигурацию Z или Е. Соединение по изобретению, являющееся Z-изомером метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, характеризуется рентгеновской порошковой дифрактограммой с углами Брэгга 2 тета (выражаемых в °±0,2) 12,86; 15,13; 15,50; 17,70; 18,25; 18,71; 20,11; 21,46; 21,67; 21,89; 22,29; 22,58; 24,57; 25,82; 26,33. Соединения формулы (II) получают путем применения в качестве исходного материала 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион, который растворяют в бинарной системе растворителя/воды, а затем добавляют от 1 до 2 молярных эквивалентов метансульфоновой кислоты, перемешивают до выпадения в осадок метансульфоната, который отфильтровывают. Метансульфонат 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона формулы (II) предназначен для применения в производстве медикаментов для применения в лечении рака и обладает улучшенной растворимостью. 3 н. и 5 з.п. ф-лы, 2 ил., 2 табл., 5 пр.
1. Метансульфонат 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона формулы (II)
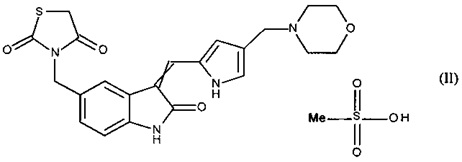 ,
,
где обозначение  означает, что двойная связь имеет конфигурацию Z или Е.
означает, что двойная связь имеет конфигурацию Z или Е.
2. Соединение по п.1, отличающееся тем, что является Z-изомером метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона.
3. Соединение по п. 1 или 2, отличающееся тем, что характеризуется рентгеновской порошковой дифрактограммой с углами Брэгга 2 тета (выражаемых в °±0,2) 12,86; 15,13; 15,50; 17,70; 18,25; 18,71; 20,11; 21,46; 21,67; 21,89; 22,29; 22,58; 24,57; 25,82; 26,33.
4. Соединение по п. 1 или 2, отличающееся тем, что характеризуется следующими параметрами, полученными согласно порошковой дифрактограмме, осуществляемой на дифрактометре Panalytical Xpert-Pro MPD (медный антикатод) в режиме передачи с угловым диапазоном 3-55° в выражении 2θ, шагом 0,017° и 35,5 с на шаг, что позволяет распознать следующие кристаллические параметры:
- параметры элементарной ячейки: a=15,0958(5) Å, b=18,4586(6) Å, c=8,8269(2) Å, β=94,074(1)°, γ=90°
- пространственная группа: C 1 с 1 (9)
- объем элементарной ячейки: Vunit cell = 2453,37600 Å3
5. Способ получения соединения формулы (II) по п. 1, характеризующийся тем, что в качестве исходного материала применяют 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион, который растворяют в бинарной системе растворителя/воды, а затем добавляют от 1 до 2 молярных эквивалентов метансульфоновой кислоты, перемешивают до выпадения в осадок метансульфоната, который отфильтровывают.
6. Фармацевтическая композиция для лечения рака, включающая эффективное количество соединения формулы (II) по одному из пп. 1-4 в комбинации с одним или несколькими фармацевтически приемлемыми вспомогательными веществами.
7. Фармацевтическая композиция по п. 6, отличающаяся тем, что соединение формулы (II) является Z-изомером метансульфоната 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона.
8. Фармацевтические композиции по п. 6 или 7 для применения в производстве медикаментов для применения в лечении рака толстой кишки, молочной железы, печени, почек, головного мозга и пищевода, меланом, миелом, рака яичников, немелкоклеточного рака легких, мелкоклеточного рака легких, рака предстательной железы и поджелудочной железы или сарком.
| СПОСОБ ИЗГОТОВЛЕНИЯ КОРПУСНЫХ ДЕТАЛЕЙ ТРУБОПРОВОДНОЙ АРМАТУРЫ | 2005 |
|
RU2281822C1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| ПРОИЗВОДНЫЕ ИНДОЛИНА, ИСПОЛЬЗУЕМЫЕ КАК ИНГИБИТОРЫ ПРОТЕИНКИНАЗЫ | 2002 |
|
RU2316554C2 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2019-02-28—Публикация
2014-07-11—Подача