Область техники
[1] Настоящее изобретение относится к фармацевтической композиции для перорального приема, содержащей таксан в качестве противоопухолевого средства. В частности, настоящее изобретение относится к фармацевтической композиции, содержащей таксан, для перорального приема, содержащей олеоилглицериновый комплекс и в некоторых случаях эфир полиоксила глицерина жирной кислоты.
Уровень техники
[2] Известно, что таксаны, являющиеся противоопухолевыми средствами, демонстрирующими антипролиферативное действие за счет воздействия на структуру микротрубочек в клеточной цитоскелетной системе (Huizing М.Т. et al., Cancer Inv., 1995, 13: 381-404), характеризуются превосходной цитотоксичностью против различных видов опухоли, такой как рак яичников, рак груди, рак пищевода, меланома, лейкемия. Парентеральные лекарственные формы, такие как паклитаксел и доцетаксел, доступны на рынке под торговой маркой Taxol™ и Taxotere™ соответственно. Поскольку известно, что таксан очень плохо растворяется в воде, доступные в настоящее время рецептуры, содержащие паклитаксел, например, Taxol™, выполнены в форме эмульсионного предконцентрата, который растворяют перед использованием инъекции. Однако чтобы преодолеть недостатки, относящиеся к соблюдению режима лечения, связанные с использованием формы для инъекции, стабильности рецептуры, безопасности для организма и т.д., выполняются исследования рецептур, пригодных для перорального приема.
[3] В то же время сообщалось, что при приеме таксана перорально, например, паклитаксела, отмечена очень низкая биодоступность из-за действия эффлюксного насоса, направленного наружу (Walle et al, Drug Metabo. Disp. 26(4): 343-346 (1998)). Также сообщалось, что пероральный прием паклитаксела характеризуется очень низкой усвояемостью (менее 1%) (Eiseman et al, Second NCI Workshop on Taxol and Taxus (sept. 1992), Suffhess (ed.) et al, Taxol™ Science and Applications, CRC Press (1995)). В попытке улучшить эту низкую степень пероральной биодоступности в патентной публикации Кореи №10-2004-0009015 раскрыта солюбилизированная таксан-содержащая композиция для перорального приема, в рецептуре которого использован среднецепочечный триглицерид, такой как триацетин, моноглицерид, такой как моноолеин, и поверхностно-активное вещество, такое как Tween. Эта композиция представляет собой солюбилизированную таксан-содержащую композицию для перорального приема, биодоступность которой увеличена благодаря улучшенным мукоадгезивным свойствам в кишечном тракте за счет моноглицерида, такого как моноолеин. Также в патентной публикации Кореи №10-2007-0058776 раскрыт улучшенный способ для приготовления солюбилизированной таксан-содержащей композиции для перорального приема, при этом способ содержит растворение паклитаксела со среднецепочечным триглицеридом, моноглицеридом и поверхностно-активным веществом в органическом растворителе.
[4] Твердые рецептуры, такие как мягкие капсулы, обладают преимуществами в части удобства использования по сравнению с формой липидного раствора. С учетом режима лечения необходимо использовать мягкие капсулы соответствующего размера. Поэтому для приготовления мягкой капсулы, содержащей терапевтически эффективное количество таксана, требуется приготовление липидного раствора с высокой концентрацией таксана. Однако при высокой концентрации таксана (например, 4 весовых % или более) в соответствии с традиционными способами приготовления рецептуры (например, патентная публикация Кореи №10-2004-0009015 и 10-2007-0058776), таксан выпадает в осадок из липидного раствора, что приводит к невозможности получения полностью солюбилизированного липидного раствора, что, в свою очередь, приводит к проблеме сниженной биодоступности.
Раскрытие
Техническая задача
[5] Традиционные солюбилизированные паклитаксел-содержащие композиции для перорального приема, например, композиции, приготовленные в соответствии с патентными публикациями Кореи №10-2004-0009015 и 10-2007-0058776, хранятся охлажденными в полутвердой форме, которая преобразуется в форму раствора перед использованием и затем вводится пациенту перорально. Однако композиция, которая хранится в полутвердой форме в охлажденных условиях, не преобразуется в раствор при комнатной температуре, и все еще остается в полутвердой форме, даже после продолжительной выдержки. Поэтому при преобразовании в форму раствора, пригодную для перорального приема, возникает проблема, состоящая в необходимости дополнительной обработки с использованием нагрева.
[6] Авторы настоящего изобретения выполнили ряд исследований, чтобы преодолеть этот недостаток. Авторам настоящего изобретения удалось обнаружить, что при осуществлении технологических процессов с использованием определенного олеоилглицеринового комплекса вместо моноглицерида полученные рецептуры присутствуют в форме раствора при комнатной температуре и, таким образом, могут быть введены перорально без дополнительной обработки, такой как нагрев. Кроме того, авторы настоящего изобретения обнаружили, что композиции, созданные с использованием олеоилглицеринового комплекса, эффективны для увеличения степени всасывания in vivo в организме по сравнению с традиционными композициями, полученными с использованием моноглицерида, такого как моноолеин.
[7] Кроме того, авторы настоящего изобретения обнаружили, что при осуществлении технологических процессов с дополнительным добавлением эфира полиоксила глицерила жирной кислоты может быть получен прозрачный раствор с высокой концентрацией таксана, позволяющий использовать его в форме мягкой капсулы, без образования осадка. Кроме того, обнаружено, что эти мягкие капсулы характеризуются быстрым всасыванием с самого начала и демонстрирует значительно увеличенную in vivo скорость всасывания.
[8] Поэтому цель настоящего изобретения состоит в том, чтобы предложить таксан-содержащую фармацевтическую композицию для перорального приема, созданную с использованием олеоилглицеринового комплекса и, в некоторых случаях, эфира полиоксила глицерила жирной кислоты.
[9] Кроме того, другая цель настоящего изобретения состоит в том, чтобы предложить способ приготовления фармацевтической композиции для перорального приема.
Техническое решение
[10] В соответствии с одним из аспектов настоящего изобретения предложена фармацевтическая композиция для перорального приема, содержащая (а) таксан, (b) среднецепочечный триглицерид, (с) олеоилглицериновый комплекс, содержащий 30-65 весовых % моноолеоилглицерина, 15-50 весовых % диолеоилглицерина и 2-20 весовых % триолеоилглицерина, и (d) поверхностно-активное вещество.
[11] В одном из вариантов осуществления изобретения олеоилглицериновый комплекс содержит 32-52 весовых % моноолеоилглицерина, 30-50 весовых % диолеоилглицерина и 5-20 весовых % триолеоилглицерина. В другом варианте осуществления изобретения олеоилглицериновый комплекс содержит 55-65 весовых % моноолеоилглицерина, 15-35 весовых % диолеоилглицерина и 2-10 весовых % триолеоилглицерина. В еще одном варианте изобретения осуществления фармацевтическая композиция для перорального приема может дополнительно содержать эфир полиоксила глицерила жирной кислоты в сочетании с высокой концентрацией таксана.
[12] В соответствии с другим аспектом настоящего изобретения предложен способ приготовления фармацевтической композиции для перорального приема, включающий (i) растворение таксана и среднецепочечного триглицерида в органическом растворителе и (ii) удаление органического растворителя из раствора, полученного на этапе (i), с последующим смешиванием с олеоилглицериновым комплексом, содержащим 30-65 весовых % моноолеоилглицерина, 15-50 весовых % диолеоилглицерина и 2-20 весовых % триолеоилглицерина, и с поверхностно-активным веществом.
[13] В соответствии с другим аспектом настоящего изобретения предложен способ приготовления фармацевтической композиции для перорального приема, содержащий (i’) растворение таксана, среднецепочечного триглицерида, олеоилглицеринового комплекса, содержащего 30-65 весовых % моноолеоилглицерина, 15-50 весовых % диолеоилглицерина и 2-20 весовых % триолеоилглицерина, а также поверхностно-активного вещества в органическом растворителе, и (ii’) удаление органического растворителя из раствора, полученного на этапе (i’).
[14] В соответствии с другим аспектом настоящего изобретения предложен способ приготовления фармацевтической композиции для перорального приема, содержащий (i") растворение таксана и эфира полиоксила глицерила жирной кислоты в органическом растворителе, и (ii") удаление органического растворителя из раствора, полученного на этапе (i"), с последующим смешиванием со среднецепочечным триглицеридом, с олеоилглицериновым комплексом, содержащим 30-65 весовых % моноолеоилглицерина; 15-50 весовых % диолеоилглицерина и 2-20 весовых % триолеоилглицерина, а также с поверхностно-активным веществом для получения следующего раствора, и (iii"), в некоторых случаях, заполнения мягкой капсулы тем раствором, который был получен на этапе (ii").
[15] В соответствии с другим аспектом настоящего изобретения предложен способ приготовления фармацевтической композиции для перорального приема, содержащий (i”’) растворение в органическом растворителе таксана, среднецепочечного триглицерида, олеоилглицеринового комплекса, содержащего 30-65 весовых % моноолеоилглицерина, 15-50 весовых % диолеоилглицерина и 2-20 весовых % триолеоилглицерина, а также поверхностно-активного вещества и эфира полиоксила глицерила жирной кислоты, (ii'”) удаление органического растворителя из раствора, полученного на этапе (i”’), и (iii'"), в некоторых случаях, заполнения мягкой капсулы тем раствором, который был получен на этапе (ii'”).
Технический результат изобретения
[16] Авторы настоящего изобретения обнаружили, что солюбилизированная таксан-содержащая композиция для перорального приема значительно отличается по своей форме и/или внешнему виду в зависимости от типа и/или свойств используемого липида. В частности, авторам настоящего изобретения удалось обнаружить, что при осуществлении технологических процессов с использованием определенного олеоилглицеринового комплекса полученные рецептуры находятся в форме раствора при комнатной температуре и, таким образом, могут быть введены перорально без дополнительной обработки, такой как нагрев. Кроме того, авторы настоящего изобретения обнаружили, что композиции, созданные с использованием этого олеоилглицеринового комплекса, эффективны для увеличения in vivo степени всасывания в организм по сравнению с традиционными композициями, полученными с использованием моноглицерида, такого как моноолеин. Кроме того, авторы настоящего изобретения обнаружили, что при осуществлении технологических процессов с добавлением эфира полиоксила глицерила жирной кислоты может быть получен прозрачный раствор с высокой концентрацией таксана, позволяющий использовать его в форме мягкой капсулы, без образования осадка. В частности, авторы настоящего изобретения обнаружили, что эти мягкие капсулы характеризуются быстрым всасыванием с самого начала и демонстрирует значительно увеличенную in vivo скорость всасывания. Таким образом, фармацевтическая композиция для перорального приема в соответствии с настоящим изобретением может устранить недостатки, присущие традиционным рецептурам, при использовании которых требуется дополнительная обработка в форме солюбилизации перед использованием; и эффективно повышает in vivo скорость всасывания.
Описание чертежей
[17] Фиг. 1 представляет собой изображения паклитаксел-содержащих фармацевтических композиций для перорального приема, приготовленных в соответствии с примером 1, примером 2 и сравнительным примером 1, после хранения при температуре 4 градуса С в течение 8 ч с последующей выдержкой при температуре 25 градусов С в течение 72 ч.
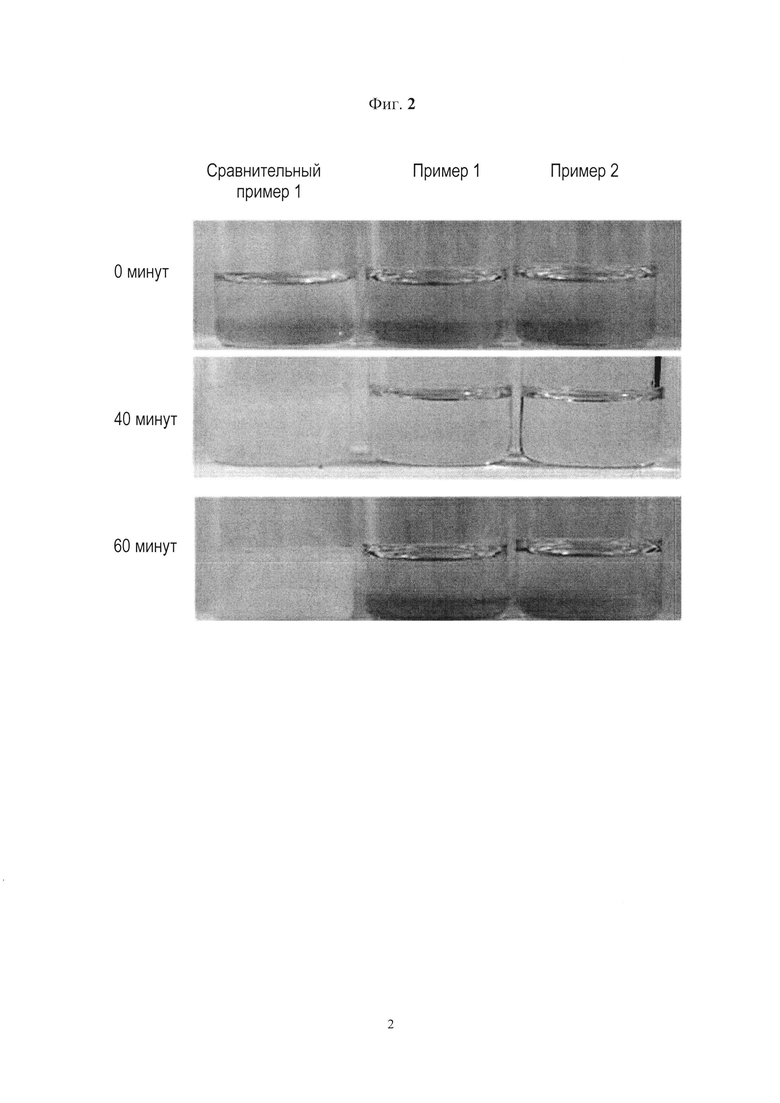
[18] Фиг. 2 представляет собой изображения паклитаксел-содержащих фармацевтических композиций для перорального приема, приготовленных в соответствии с примером 1, примером 2 и сравнительным примером 1, после хранения при температуре 4 градуса С в течение 8 ч, таяния рецептуры при температуре 50 градусов С с последующей выдержкой при температуре 15 градусов С в течение 1 ч.
[19] Фиг. 3 представляет собой изображение доцетаксел-содержащего липидного раствора, приготовленного в соответствии с примером 27 и сравнительным примером 2. А: доцетаксел-содержащий липидный раствор, приготовленный в соответствии с примером 27, В: доцетаксел-содержащий липидный раствор, приготовленный в соответствии со сравнительным примером 2.
[20] Фиг. 4 представляет собой изображение паклитаксел-содержащего липидного раствора, приготовленного в соответствии с примером 48 и сравнительным примером 3. А: паклитаксел-содержащий липидный раствор, приготовленный в соответствии с примером 48, В: паклитаксел-содержащий липидный раствор, приготовленный в соответствии со сравнительным примером 3.
Лучший вариант осуществления изобретения
[21] В настоящем изобретении предложена фармацевтическая композиция для перорального приема, содержащая (а) таксан, (b) среднецепочечный триглицерид, (с) олеоилглицериновый комплекс, содержащий 30-65 весовых % моноолеоилглицерина, 15-50 весовых % диолеоилглицерина и 2-20 весовых % триолеоилглицерина, и (d) поверхностно-активное вещество.
[22] Авторы настоящего изобретения обнаружили, что солюбилизированная таксан-содержащая композиция для перорального приема значительно отличается по своей форме и/или внешнему виду в зависимости от типов и/или свойств используемого липида. В частности, авторам настоящего изобретения удалось обнаружить, что при осуществлении технологических процессов с использованием определенного олеоилглицеринового комплекса полученные рецептуры находятся в форме раствора при комнатной температуре и, таким образом, могут быть введены перорально без дополнительной обработки, такой как нагрев. Кроме того, авторы настоящего изобретения обнаружили, что композиции, созданные с использованием олеоилглицеринового комплекса, эффективны для увеличения in vivo скорости всасывания в организм по сравнению с традиционными композициями, полученными с использованием моноглицерида, такого как моноолеин.
[23] В данном случае термин «олеоилглицериновый комплекс» относится к смеси, полученной частичным глицеролизом растительных масел, в основном, содержащих триглицериды олеиновой кислоты, или эстерификацией глицерина олеиновой кислотой. Соответствующее содержание моноолеоилглицерина, диолеоилглицерина и триолеоилглицерина в этой смеси может варьироваться в соответствии с частичным глицеролизом и/или эстерификацией. Олеоилглицериновый комплекс с определенным отношением содержаний использован в настоящем изобретении. То есть в настоящем изобретении использован олеоилглицериновый комплекс с содержанием моноолеоилглицерина 30-65 весовых %, содержанием диолеоилглицерина 15-50 весовых % и содержанием триолеоилглицерина 2-20 весовых %. В одном из вариантов осуществления изобретения олеоилглицериновый комплекс содержит 32-52 весовых % моноолеоилглицерина; 30-50 весовых % диолеоилглицерина; и 5-20 весовых % триолеоилглицерина. В другом варианте осуществления изобретения олеоилглицериновый комплекс содержит 55-65 весовых % моноолеоилглицерина; 15-35 весовых % диолеоилглицерина и 2-10 весовых % триолеоилглицерина. Кроме того, может быть использован олеоилглицериновый комплекс, доступный на рынке, с вышеуказанным отношением содержаний, например, PECEOL™ (Gattefosse) или CAPMULTM (Abitec).
[24] В фармацевтической композиции для перорального приема в соответствии с настоящим изобретением таксан включает в себя один или более из компонентов, выбранных из группы, содержащей паклитаксел, доцетаксел, 7-эпипаклитаксел, t-ацетилпаклитаксел, 10-дезацетилпаклитаксел, 10-дезацетил-7-эпипаклитаксел, 7-ксилозилпаклитаксел, 10-дезацетил-7-глутарилпаклитаксел, 7-N,N-диметилглицилпаклитаксел, 7-L-аланилпаклитаксел и т.д. Например, таксаном может быть паклитаксел и/или доцетаксел.
[25] Сред нецепочечный триглицерид означает вещество, в котором три молекулы насыщенной или ненасыщенной жирной кислоты С2-С20 и одна молекула глицерина связаны эфирной связью. Например, сред нецепочечный триглицерид может представлять собой триацетин, трипропионин, трибутирин, тривалерин, трикапроин, трикаприлин (например, Captex™ 8000 и т.д.), трикаприн, тригептаноин, тринонаноин, триундеканоин, трилаурин, тритридеканоин, тримиристин, трипентадеканоин, трипальмитин, глицерил тригептадеканоат, триолеин и т.д.
[26] Поверхностно-активным веществом может быть блок-сополимер полиоксиэтилена-полиоксипропилена (например, Poloxamer™), эфир сорбитана (например, Span™), полиоксиэтилен сорбитан (например, Tween™), полиоксиэтиленовый эфир (например, Brij™) и т.д.
[27] В одном из вариантов осуществления изобретения фармацевтическая композиция в соответствии с настоящим изобретением может содержать 0,5-1,5 весовых % таксана, 20-35 весовых % среднецепочечного триглицерида, 45-60 весовых % олеоилглицеринового комплекса и 15-25 весовых % поверхностно-активного вещества. Предпочтительно, фармацевтическая композиция в соответствии с настоящим изобретением может содержать 0,8-1,2 весовых % таксана, 25-30 весовых % среднецепочечного триглицерида, 50-55 весовых % олеоилглицеринового комплекса и 15-20 весовых % поверхностно-активного вещества.
[28] Авторы настоящего изобретения обнаружили, что при осуществлении технологических процессов с добавлением эфира полиоксила глицерила жирной кислоты может быть получен прозрачный раствор с высокой концентрацией таксана, позволяющий использовать его в форме мягкой капсулы, без образования осадка. В частности, авторы настоящего изобретения обнаружили, что эти мягкие капсулы характеризуются быстрым всасыванием с самого начала и демонстрирует значительно увеличенную in vivo скорость всасывания.
[29] Таким образом, фармацевтическая композиция для перорального приема в соответствии с настоящим изобретением может дополнительно содержать эфир полиоксила глицерила жирной кислоты. Эфир полиоксила глицерила жирной кислоты может быть одним или более компонентом из группы компонентов, содержащей каприлокапроил полиоксилглицерид, лауроил полиоксилглицерид и стеароил полиоксилглицерид. Предпочтительно, эфир полиоксила глицерила жирной кислоты может быть одним или более компонентом из компонентов группы, содержащей каприлокапроил полиоксил-32 глицерид (например, LABRASOL™ и т.д.), лауроил полиоксил-32 глицерид (например, Gelucire™ 44/14 и т.д.) и стеароил полиоксил-32 глицерид (например, Gelucire™ 50/13 и т.д.). В одном из примеров осуществления изобретения фармацевтическая композиция для перорального приема в соответствии с настоящим изобретением может содержать 4-40 весовых % таксана, 10-30 весовых % среднецепочечного триглицерида, 30-70 весовых % олеоилглицеринового комплекса, 5-30 весовых % поверхностно-активного вещества и 10-30 весовых % эфира полиоксила глицерила жирной кислоты. В другом примере осуществления фармацевтическая композиция для перорального приема в соответствии с настоящим изобретением может содержать 4-25 весовых % таксана, 10-20 весовых % среднецепочечного триглицерида, 40-60 весовых % олеоилглицеринового комплекса, 10-25 весовых % поверхностно-активного вещества и 10-20 весовых % эфира полиоксила глицерила жирной кислоты. Фармацевтическая композиция для перорального приема предпочтительно осуществлена в форме наполнителя мягкой капсулы.
[30] В соответствии с другим аспектом настоящего изобретения предложен способ приготовления фармацевтической композиции для перорального приема, включающий (i) растворение таксана и среднецепочечного триглицерида в органическом растворителе и (ii) удаление органического растворителя из раствора, полученного на этапе (i), с последующим смешиванием с олеоилглицериновым комплексом, содержащим 30-65 весовых % моноолеоилглицерина; 15-50 весовых % диолеоилглицерина и 2-20 весовых % триолеоилглицерина, и с поверхностно-активным веществом.
[31] В соответствии с другим аспектом настоящего изобретения предложен способ приготовления фармацевтической композиции для перорального приема, включающий (i’) растворение таксана, среднецепочечного триглицерида, олеоилглицеринового комплекса, содержащего 30-65 весовых % моноолеоилглицерина; 15-50 весовых % диолеоилглицерина и 2-20 весовых % триолеоилглицерина, и поверхностно-активного вещества в органическом растворителе, и (ii’) удаление органического растворителя из раствора, полученного на этапе (i’).
[32] В соответствии с другим аспектом настоящего изобретения предложен способ приготовления фармацевтической композиции для перорального приема, включающий (i") растворение таксана и эфира полиоксила глицерила жирной кислоты в органическом растворителе, и (ii") удаление органического растворителя из раствора, полученного на этапе (i"), с последующим смешиванием со среднецепочечным триглицеридом, олеоилглицериновым комплексом, содержащим 30-65 весовых % моноолеоилглицерина; 15-50 весовых % диолеоилглицерина; и 2-20 весовых % триолеоилглицерина, и с поверхностно-активным веществом для получения следующего раствора, и (iii"), в некоторых случаях, использование раствора, полученного на этапе (ii"), для заполнения мягкой капсулы.
[33] В соответствии с другим аспектом настоящего изобретения предложен способ приготовления фармацевтической композиции для перорального приема, включающий (i'") растворение в органическом растворителе таксана, среднецепочечного триглицерида, олеоилглицеринового комплекса, содержащего 30-65 весовых % моноолеоилглицерина; 15-50 весовых % диолеоилглицерина и 2-20 весовых % триолеоилглицерина, поверхностно-активного вещества и эфира полиоксила глицерила жирной кислоты, (ii"') удаление органического растворителя из раствора, полученного на этапе (i'"), и (iii'”), в некоторых случаях, использование раствора, полученного на этапе (ii'"), для заполнения мягкой капсулы.
[34] В способах, предложенных в соответствии с настоящим изобретением, олеоилглицериновый комплекс, таксан, среднецепочечный триглицерид, поверхностно-активное вещество и эфир полиоксила глицерила жирной кислоты раскрыты выше.
[35] В способах, предложенных в соответствии с настоящим изобретением, органический растворитель может быть одним растворителем или более из растворителей, выбранных из группы растворителей, содержащей галогенированное алкильное соединение, спирт и кетон. Галогенированное алкильное соединение может быть одним или более из соединенный, выбранных из группы соединений, содержащей галогенированные алкильные соединения С1-С5, предпочтительно метиленхлорид или хлороформ, в более предпочтительном варианте - метиленхлорид. Спирт может быть одним или более из спиртов, выбранных из группы спиртов, содержащей низшие спирты С1-С5, предпочтительно метанол, этанол или изопропиловый спирт, в более предпочтительном варианте - этанол. Кетоном может быть ацетон.
[36] Органический растворитель может быть использован в количестве, способном растворить таксан и среднецепочечный триглицерид, предпочтительно в количестве в 0,4-20 раз от объема среднецепочечного триглицерида, предпочтительно - в объеме, равном объему среднецепочечного триглицерида, но не ограничивается этим. Указанные количества органического растворителя, которые позволяют в достаточной степени растворить таксан, такой как паклитаксел и доцетаксел, могут уменьшить количество отходов, образуемых от использования чрезмерных количеств растворителя и ненужных усилий, направленных на удаление органического растворителя. В способах, предложенных в соответствии с настоящим изобретением, этап удаления органического растворителя может быть осуществлен в соответствии с традиционными методами сушки, например, сушка в условиях пониженного давления при температуре от 15 до 50 градусов С, предпочтительно - при комнатной температуре. Посредством осуществления этапа растворения с вышеописанным использованием органического растворителя и этапа удаления органического растворителя стало возможным равномерное смешивание соответствующих компонентов в получаемой композиции.
[37] Настоящее изобретение будет более подробно раскрыто со ссылкой на следующие примеры и экспериментальные примеры. Эти примеры и экспериментальные примеры приведены только для наглядности и не предназначены для ограничения объема настоящего изобретения.
[38] Пример 1
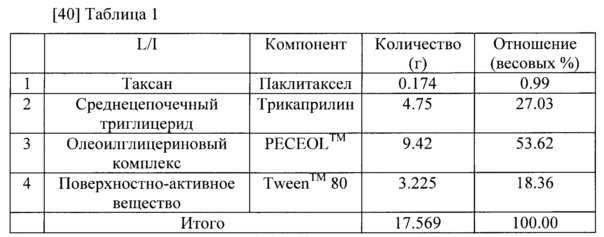
[39] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с компонентами и количествами, указанными в таблице 1. Паклитаксел (0,174 г) и трикаприлин (4,75 г) были растворены в метиленхлориде (2,18 мл). Полученный раствор был высушен в условиях пониженного давления при температуре 40 градусов С, чтобы удалить метиленхлорид. К полученной смеси добавили PECEOL™ (Gattefosse) (9,42 г) и Tween™ 80 (3,225 г). Полученную смесь размешали при температуре около 40 градусов С, чтобы получить фармацевтическую композицию в форме прозрачного вязкого раствора.
[41]
[42] Пример 2
[43] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием безводного этанола (3,49 мл) вместо метиленхлорида.
[44]
[45] Пример 3
[46] Паклитаксел (0,174 г), трикаприлин (4,75 г), PECEOL™ (9,42 г) и Tween™ 80 (3,225 г) были растворены в метиленхлориде (2,18 мл). Полученный раствор высушили в условиях пониженного давления при температуре 40 градусов С, чтобы удалить метиленхлорид. Полученную смесь размешали при температуре ок. 40 градусов С, чтобы получить фармацевтическую композицию в форме прозрачного вязкого раствора.
[47]
[48] Пример 4
[49] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 3, с использованием безводного этанола (3,49 мл) вместо метиленхлорида.
[50]
[51] Пример 5
[52] Доцетаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием доцетаксела (0,174 г) вместо паклитаксела.
[53]
[54] Пример 6
[55] Доцетаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 5, с использованием безводного этанола (3,49 мл) вместо метиленхлорида.
[56]
[57] Пример 7
[58] Доцетаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 3, с использованием доцетаксела (0,174 г) вместо паклитаксела.
[59]
[60] Пример 8
[61] Доцетаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 7, с использованием безводного этанола (3,49 мл) вместо метиленхлорида.
[62]
[63] Пример 9
[64] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием Capmul™ GMO-50 EP/NF (Abitec) (9,42 г) вместо PECEOL™.
[65]
[66] Пример 10
[67] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 9, с использованием безводного этанола (3,49 мл) вместо метиленхлорида.
[68]
[69] Пример 11
[70] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием триацетина (Sigma) вместо трикаприлина.
[71]
[72] Пример 12
[73] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием трипропионина (Sigma) вместо трикаприлина.
[74]
[75] Пример 13
[76] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием трибутирина (Sigma) вместо трикаприлина.
[77]
[78] Пример 14
[79] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием тривалерина (Sigma) вместо трикаприлина.
[80]
[81] Пример 15
[82] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием трикапроина (Sigma) вместо трикаприлина.
[83]
[84] Пример 16
[85] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием тригептаноина (Sigma) вместо трикаприлина.
[86]
[87] Пример 17
[88] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием тринонаноина (Sigma) вместо трикаприлина.
[89]
[90] Пример 18
[91] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием трикаприна (Sigma) вместо трикаприлина.
[92]
[93] Пример 19
[94] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием триундеканоина (Sigma) вместо трикаприлина.
[95]
[96] Пример 20
[97] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием трилаурина (Sigma) вместо трикаприлина.
[98]
[99] Пример 21
[100] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием тритридеканоина (Sigma) вместо трикаприлина.
[101]
[102] Пример 22
[103] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием тримиристина (Sigma) вместо трикаприлина.
[104]
[105] Пример 23
[106] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием трипентадеканоина (Sigma) вместо трикаприлина.
[107]
[108] Пример 24
[109] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием трипальмитина (Sigma) вместо трикаприлина.
[110]
[111] Пример 25
[112] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием глицерил тригептадеканоата (Sigma) вместо трикаприлина.
[113]
[114] Пример 26
[115] Паклитаксел-содержащая фармацевтическая композиция для перорального приема приготовлена в соответствии с такими же процедурами, что и в Примере 1, с использованием триолеина (Sigma) вместо трикаприлина.
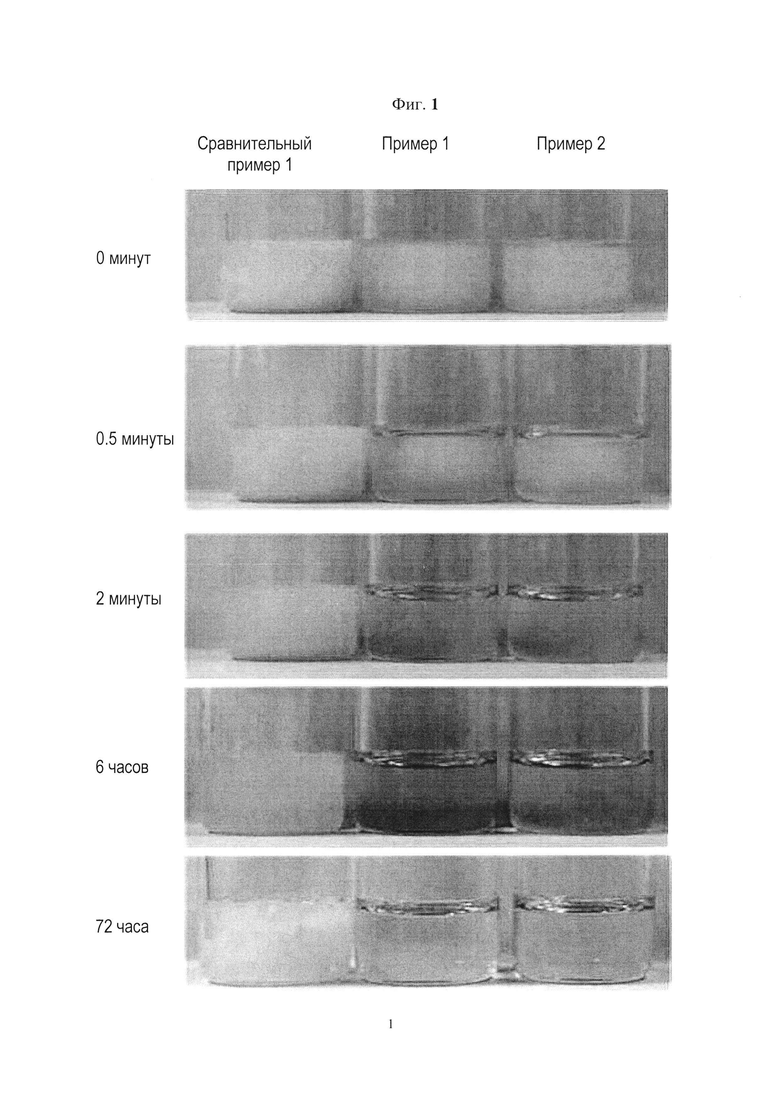
[116]
[117] Сравнительный пример 1. Приготовление паклитаксел-содержандей фармацевтической композиции для перорального приема, которая содержит моноолеин
[118] В соответствии с патентной публикацией Кореи №10-2007-0058776 паклитаксел-содержащая фармацевтическая композиция для перорального приема была приготовлена с использованием моноолеина в качестве липида. Т.е. паклитаксел (0,174 г) и трикаприлин (4,75 г) были растворены в метиленхлориде (2,18 мл). Полученный раствор высушили в условиях пониженного давления при температуре 40 градусов С, чтобы удалить метиленхлорид. В полученную смесь добавили моноолеин (9,4 г) и Tween™ 80 (3,225 г). Полученную смесь размешали при температуре около 40 градусов С, чтобы получить фармацевтическую композицию в форме прозрачного вязкого раствора. Моноолеин содержит 96,12 весовых % моноолеоилглицерина и 3,88 весовых % диолеоилглицерина.
[119]
[120] Экспериментальный пример 1: Оценка внешнего вида рецептур в соответствии с температурными условиями
[121] (1) Оценка при температуре 25 градусов С после хранения в охлажденном состоянии
[122] Паклитаксел-содержащие фармацевтические композиции для перорального приема, приготовленные в Примере 1, Примере 2 и Сравнительном примере 1, хранили при температуре 4 градуса С в течение 8 ч, затем выдержали при температуре 25 градусов С в течение 72 ч. Полученный внешний вид показан на Фиг. 1. Как показано на Фиг. 1, рецептуры Примера 1 и Примера 2 изменились до прозрачного раствора, который может быть использован для приема пациентом, при температуре 25 градусов С в течение 2 мин. В отличие от них рецептура Сравнительного примера 1 не изменилась до состояния раствора при комнатной температуре (около 25 градусов С). Даже когда рецептуру Сравнительного примера 1 выдержали в течение 72 ч, внешний вид полутвердой формы все еще сохранялся.
[123] (2) Оценка состояния при температуре 15 градусов С после расплавления
[124] Паклитаксел-содержащие фармацевтические композиции для перорального прием, приготовленные в Примере 1, Примере 2 и Сравнительном примере 1, хранили при температуре 4 градуса С в течение 8 ч, а затем перевели в полностью жидкое состояние при температуре 50 градусов С.Когда соответствующие рецептуры выдержали при температуре 15 градусов в течение 1 ч, они приобрели вид, показанный на Фиг. 2. Как показано на Фиг. 2, рецептуры Примера 1 и Примера 2 представляли собой прозрачный раствор, готовый к приему пациентом, даже после выдержки в течение 1 ч при температуре 15 градусов С. В отличие от них рецептура Сравнительного примера 1 стала твердеть.
[125]
[126] Экспериментальный пример 2. Оценка in vivo скорости всасывания
[127] Паклитаксел-содержащие фармацевтические композиции для перорального приема, приготовленные в соответствии с Примером 1 и Сравнительным примером 1, были введены перорально с дозировкой 50 мг/кг мышам КУИ (возраст 6 недель, самки, Orient Bio, Республика Корея) с использованием гастрального зонда. Рецептура Сравнительного примера 1 была полностью переведена в жидкое состояние при температуре 50 градусов С после ее приготовления, после чего сразу же была введена. Через 0 мин., 30 мин., 1 ч, 2 ч, 4 ч, 6 ч, и 8 ч после введения лекарственного препарата кровь была взята из надглазничной вены мышей, обработана в центрифуге 8000×g в течение 20 мин., чтобы получить пробы плазмы, которые хранили при температуре минус 70 градусов С.
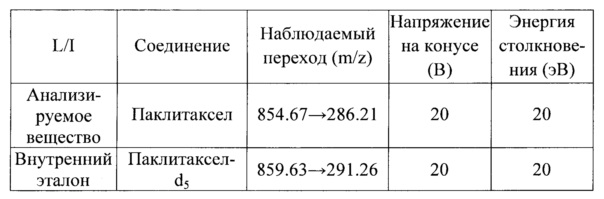
[128] Пробы плазмы перевели в жидкое состояние, выдержав их при комнатной температуре, затем размешали вихревым смесителем в течение 1 мин. Внутренний эталонный раствор (паклитаксел-d5 2,50 мкг/мл, в метаноле) (10,0 мкл) добавили к пробам плазмы (50,0 мкл), которые размешивали в течение 3 мин. и затем обработали в центрифуге 4000×g в течение ок. 1 мин. Ацетонитрил (200 мкл) добавили к пробам, который размешивали в течение 3 мин. и затем обработали в центрифуге 4000×g в течение 1 мин. В каждом случае взяли надосадочную жидкость (100 мкл) и к ней добавили дистиллированную воду (100 мкл) с 0,1 объемных % муравьиной кислоты. Каждую полученную смесь размешивали в течение 3 мин. и обрабатывали в центрифуге 4000×g при комнатной температуре в течение около 1 мин. В каждом случае взяли надосадочную жидкость (20,0 мкл) и подвергли ее анализу с использованием СВЭЖХ (сверх-высокоэффективной жидкостной хроматографии) и ТМС (тандемной масс-спектроскопии) (UPLC-MS/MS).
[129] Условия анализа с использованием СВЭЖХ и ТМС указаны ниже.
[130] СВЭЖХ: СВЭЖХ, Waters ACQUITY UPLC™ System, Waters
[131] Детектор: Waters Xevo™TQMS, Waters
[132] Колонна: Waters ACQUITY UPLC™ BEHC 18, 1,7 мкм (2,1 мм ID x 50 ммл)
[133] Процессор для обработки данных: MassLynx V4.1, Waters
[134] Мобильная фаза: 0,1 объемных % МК в ДВ: 0,1 объемных % МК в АЦН (50:50, об.)
[135] где МК - муравьиная кислота, ДВ - дистиллированная вода, АЦН - ацетонитрил.
[136] Расход: 0,4 мл/мин.
[137] Состояние детектора ESI+, режим MRM
[138]
[139] Фармакокинетические параметры, рассчитанные из концентрации паклитаксела в крови, приведены в таблице 2.
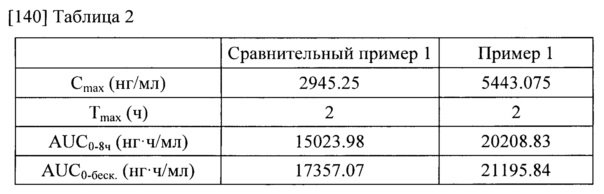
[141] Результаты, приведенные в таблице 2, свидетельствуют о том, что фармацевтическая композиция для перорального приема в соответствии с настоящим изобретением демонстрирует значительно увеличенную in vivo скорость всасывания по сравнению с традиционной рецептурой.
[142]
[143] Пример 27. Мягкие капсулы, содержащие доцетаксел
[144] Доцетаксел-содержащая фармацевтическая композиция для перорального приема была приготовлена в соответствии с компонентами и количествами, указанными в таблице 3. Доцетаксел и LABRASOL™ (Gattefosse) полностью растворили в этаноле (около 14 объемов трикаприлина). Полученный раствор высушили в условиях пониженного давления при температуре 40 градусов С, чтобы удалить этанол. В полученную смесь добавили трикаприлин (Captex™ 8000, ABITEC), PECEOL™ (Gattefosse) и Tween™ 80. Полученную смесь размешали при температуре 40 градусов С, чтобы получить прозрачный маслянистый раствор. Полученный прозрачный маслянистый раствор поместили в мягкую капсулу. Внешний вид прозрачного маслянистого раствора показан на Фиг. 3 (слева, А).

[146]
[147] Пример 28
[148] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием Gelucire™ 44/14 (Gettafosse) вместо LABRASOL.
[149]
[150] Пример 29
[151] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием Gelucire™ 50/13 (Gettafosse) вместо LABRASOL.
[152]
[153] Пример 30
[154] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием триацетина (Sigma) вместо трикаприлина.
[155]
[156] Пример 31
[157] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием трипропионина (Sigma) вместо трикаприлина.
[158]
[159] Пример 32
[160] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием трибутирина (Sigma) вместо трикаприлина.
[161]
[162] Пример 33
[163] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием тривалерина (Sigma) вместо трикаприлина.
[164]
[165] Пример 34
[166] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием трикапроина (Sigma) вместо трикаприлина.
[167]
[168] Пример 35
[169] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием тригептаноина (Sigma) вместо трикаприлина.
[170]
[171] Пример 36
[172] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием тринонаноина (Sigma) вместо трикаприлина.
[173]
[174] Пример 37
[175] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием трикаприна (Sigma) вместо трикаприлина.
[176]
[177] Пример 38
[178] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием триундеканоина (Sigma) вместо трикаприлина.
[179]
[180] Пример 39
[181] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием трилаурина (Sigma) вместо трикаприлина.
[182]
[183] Пример 40
[184] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием тритридеканоина (Sigma) вместо трикаприлина.
[185]
[186] Пример 41
[187] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием тримиристина (Sigma) вместо трикаприлина.
[188]
[189] Пример 42
[190] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием трипентадеканоина (Sigma) вместо трикаприлина.
[191]
[192] Пример 43
[193] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием трипальмитина (Sigma) вместо трикаприлина.
[194]
[195] Пример 44
[196] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием глицерил тригептадеканоата (Sigma) вместо трикаприлина.
[197]
[198] Пример 45
[199] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием триолеина (Sigma) вместо трикаприлина.
[200]
[201] Пример 46
[202] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием Capmul™ GMO-50 EP/NF (Abitec) вместо PECEOL™.
[203]
[204] Пример 47
[205] Доцетаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 27, с использованием метиленхлорида вместо безводного этанола.
[206]
[207] Пример 48. Мягкие капсулы, содержащие паклитаксел
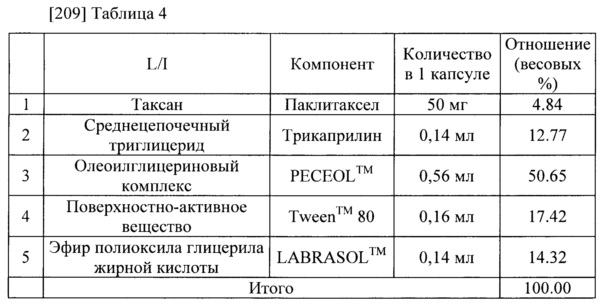
[208] Паклитаксел-содержащая фармацевтическая композиция для перорального приема была приготовлена в соответствии с компонентами и количествами, указанными в таблице 4. Паклитаксел и LABRASOL™ (Gattefosse) были полностью растворены в метиленхлориде (около 14 объемов трикаприлина). Полученный раствор высушили в условиях пониженного давления при температуре 40 градусов С, чтобы удалить метиленхлорид. В полученную смесь добавили трикаприлин (Captex™ 8000, ABITEC), PECEOL™ (Gattefosse) и Tween™ 80. Полученную смесь размешали при температуре 40 градусов С, чтобы получить прозрачный маслянистый раствор. Полученный прозрачный маслянистый раствор поместили в мягкую капсулу. Внешний вид прозрачного маслянистого раствора показан на Фиг. 4 (слева, А).
[210]
[211] Пример 49
[212] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием Gelucire™ 44/14 (Gettafosse) вместо LABRASOL.
[213]
[214] Пример 50
[215] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием Gelucire™ 50/13 (Gettafosse) вместо LABRASOL.
[216]
[217] Пример 51
[218] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием Capmul™ GMO-50 EP/NF (Abitec) вместо PECEOL™.
[219]
[220] Пример 52
[221] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием безводного этанола вместо метиленхлорида.
[222]
[223] Пример 53
[224] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием триацетина (Sigma) вместо трикаприлина.
[225]
[226] Пример 54
[227] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием трипропионина (Sigma) вместо трикаприлина.
[228]
[229] Пример 55
[230] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием трибутирина (Sigma) вместо трикаприлина.
[231]
[232] Пример 56
[233] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием тривалерина (Sigma) вместо трикаприлина.
[234]
[235] Пример 57
[236] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием трикапроина (Sigma) вместо трикаприлина.
[237]
[238] Пример 58
[239] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием тригептаноина (Sigma) вместо трикаприлина.
[240]
[241] Пример 59
[242] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием тринонаноина (Sigma) вместо трикаприлина.
[243]
[244] Пример 60
[245] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием трикаприна (Sigma) вместо трикаприлина.
[246]
[247] Пример 61
[248] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием триундеканоина (Sigma) вместо трикаприлина.
[249]
[250] Пример 62
[251] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием трилаурина (Sigma) вместо трикаприлина.
[252]
[253] Пример 63
[254] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием тритридеканоина (Sigma) вместо трикаприлина.
[255]
[256] Пример 64
[257] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием тримиристина (Sigma) вместо трикаприлина.
[258]
[259] Пример 65
[260] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием трипентадеканоина (Sigma) вместо трикаприлина.
[261]
[262] Пример 66
[263] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием трипальмитина (Sigma) вместо трикаприлина.
[264]
[265] Пример 67
[266] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием глицерил тригептадеканоата (Sigma) вместо трикаприлина.
[267]
[268] Пример 68
[269] Паклитаксел-содержащая фармацевтическая композиция для перорального приема в форме мягких капсул была приготовлена в соответствии с теми же самыми процедурами, что и в Примере 48, с использованием триолеина (Sigma) вместо трикаприлина.
[270]
[271] Пример 69. Фармацевтическая композиция, содержащая паклитаксел, для перорального приема
[272] Паклитаксел-содержащая фармацевтическая композиция для перорального приема была приготовлена в соответствии с компонентами и количествами, указанными в таблице 5. Паклитаксел и LABRASOL™ (Gattefosse) были полностью растворены в метиленхлориде (ок. 14 объемов трикаприлина). Полученный раствор высушили в условиях пониженного давления при температуре 40 градусов С, чтобы удалить метиленхлорид. В полученную смесь добавили трикаприлин (Captex™ 8000, ABITEC), PECEOL™ (Gattefosse) и Tween™ 80. Полученную смесь размешали при температуре 40 градусов С, чтобы получить прозрачный маслянистый раствор. Полученный прозрачный маслянистый раствор поместили в мягкую капсулу.
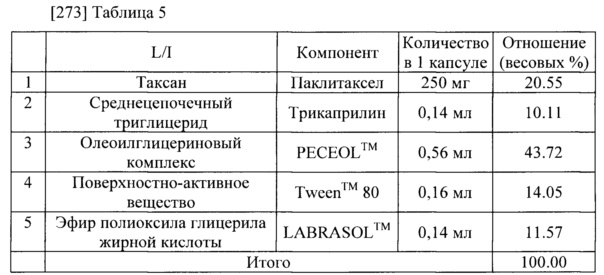
[274]
[275] Сравнительный пример 2
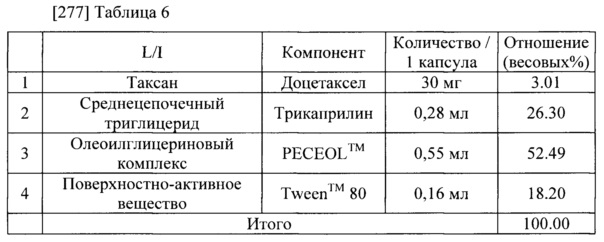
[276] Доцетаксел-содержащая композиция была приготовлена в соответствии с компонентами и количествами, указанными в Таблице 6. Доцетаксел и трикаприлин (Captex™ 8000, ABITEC полностью растворили в этаноле (около 8000 объемов трикаприлина). Полученный раствор высушили в условиях пониженного давления при температуре 40 градусов С, чтобы удалить этанол. К полученной смеси добавили PECEOL™ (Gattefosse) и Tween™ 80. Полученную смесь размешали при температуре 40 градусов С, чтобы получить маслянистый раствор. Полученный маслянистый раствор представлял собой непрозрачную дисперсию с белым осадком. Внешний вид показан на Фиг. 3 (справа, В).
[278]
[279] Сравнительный пример 3
[280] Паклитаксел-содержащая композиция была приготовлена в соответствии с компонентами и количествами, указанными в Таблице 7. Паклитаксел и трикаприлин (Captex™ 8000, ABITEC полностью растворили в метиленхлориде (ок. 8000 объемов трикаприлина). Полученный раствор высушили в условиях пониженного давления при температуре 40 градусов С, чтобы удалить метиленхлорид. К полученной смеси добавили PECEOL™ (Gattefosse) и Tween™ 80. Полученную смесь размешали при температуре 40 градусов С, чтобы получить маслянистый раствор. Полученный маслянистый раствор представлял собой непрозрачную дисперсию с белым осадком. Внешний вид показан на Фиг. 4 (справа, В).
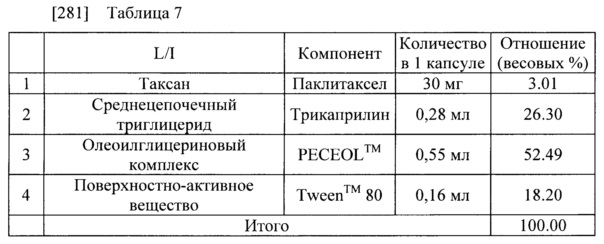
[282]
[283] Экспериментальный пример 3. Оценка стабильности желатиновых капсул
[284] Мягкие капсулы, приготовленные в Примере 27 и Примере 48, помещены в емкость из ПЭНД (полиэтилен низкого давления), которую затем хранили при температуре 25 градусов С и относительной влажности 60% в течение 6 месяцев с целью оценки стабильности желатиновых капсул. Стабильность желатиновых капсул была оценена посредством наблюдения за их внешним видом и за утечкой содержимого из капсул. Результаты показаны в Таблице 8.

[286] Результаты, приведенные в Таблице 8, свидетельствуют о том, что мягкие капсулы, приготовленные в соответствии с настоящим изобретением, обладают превосходной стабильностью.
[287]
[288] Экспериментальный пример 4. Оценка in vivo скорости всасывания
[289] Маслянистый раствор, содержащий доцетаксел, приготовленный в Примере 27, был введен перорально с дозировкой 125 мг/кг мышам ICR (возраст 6 недель, самки, Orient Bio, Республика Корея) с использованием гастрального зонда. Через 0 мин., 15 мин., 30 мин., 1 ч, 2 ч, 4 ч, и 6 ч после введения лекарственного препарата кровь была взята из надглазничной вены мышей, обработана в центрифуге 8000×g при температуре 4 градуса С в течение 20 мин., чтобы получить пробы плазмы, которые хранили при температуре минус 70 градусов С.
[290] Пробы плазмы перевели в жидкое состояние, затем размешали вихревым смесителем в течение 1 мин. Внутренний эталонный раствор (паклитаксел 10 мкг/мл в ацетонитриле) (200,0 мкл) и ацетонитрил (400,0 мкл добавили в пробы плазмы (200,0 мкл), которые затем размешали вихревым смесителем, 3000 об. в мин. в течение 5 мин. Каждую пробу обработали в центрифуге 14000×g при температуре 8 градусов С в течение 20 мин. В каждом случае взяли надосадочную жидкость (300 мкл) и профильтровали через шприцевой фильтр (фторопласт, Chromdisc, 13 мм, размер пор 0,20 мм). В каждом случае взяли фильтрат (200,0 мкл) и подвергли его анализу с использованием ВЭЖХ (высокоэффективной жидкостной хроматографии).
[291] Условия анализа с использованием ВЭЖХ указаны ниже.
[292] ВЭЖХ: Shimadzu LC-20AD
[293] Детектор: Shimadzu SPD-20A
[294] Колонна: Shim-pack GIS, 5 мкм ODS, 250 х 4,6 мм ID.
[295] Процессор для обработки данных: Labsolutions, Shimadzu
[296] Объем впрыска: 100,0 мкл
[297] Расход: 1,0 мл/мин.
[298] Температура колонны: 40 градусов С
[299] Длина волны: 227 нм
[300] Мобильная фаза: (А) АЦН, (В) ДВ (где АЦН: ацетонитрил, ДВ: дистиллированная вода)
[301]

[302] Фармакокинетические параметры, рассчитанные из концентрации доцетаксела в крови, приведены в таблице 9.

[304] Результаты, приведенные в Таблице 9, свидетельствуют о том, что фармацевтическая композиция в соответствии с настоящим изобретением характеризуется быстрой усвояемостью с самого начала и демонстрирует значительно более высокую in vivo скорость всасывания.
[305]
[306] Экспериментальный пример 5. Оценка in vivo скорости всасывания
[307] Маслянистый раствор, содержащий паклитаксел, приготовленный в Примере 48, был введен перорально с дозировкой 250 мг/кг мышам ICR (возраст 6 недель, самки, Orient Bio, Республика Корея) с использованием гастрального зонда. Через 0 мин., 15 мин., 30 мин., 1 ч, 2 ч, 4 ч и 6 ч после введения лекарственного препарата кровь была взята из надглазничной вены мышей, обработана в центрифуге 8000×g при температуре 4 градуса С в течение 20 мин., чтобы получить пробы плазмы, которые хранили при температуре минус 70 градусов С.
[308] Пробы плазмы перевели в жидкое состояние, затем размешали вихревым смесителем в течение 1 мин. Внутренний эталонный раствор (доцетаксел 10 мкг/мл в ацетонитриле) (200,0 мкл) и ацетонитрил (400,0 мкл добавили в пробы плазмы (200,0 мкл), которые затем размешали вихревым смесителем, 3000 оборотов в мин. в течение 5 мин. Каждую пробу обработали в центрифуге 14000×g при температуре 8 градусов С в течение 20 мин. В каждом случае взяли надосадочную жидкость (300 мкл) и профильтровали через шприцевой фильтр (фторопласт, Chromdisc, 13 мм, размер пор 0,20 мм). В каждом случае взяли фильтрат (200,0 мкл) и подвергли его анализу с использованием ВЭЖХ в тех же самых условиях, что и ВЭЖХ в Экспериментальном примере 1.
[309] Фармакокинетические параметры, рассчитанные из концентрации паклитаксела в крови, приведены в таблице 10.

[311] Результаты, приведенные в Таблице 10, свидетельствуют о том, что фармацевтическая композиция в соответствии с настоящим изобретением характеризуется быстрой усвояемостью с самого начала и демонстрирует значительно более высокую степень всасывания в организме.


В настоящем изобретении предложена фармацевтическая композиция для перорального приема, содержащая (а) таксан в виде паклитаксела или доцетаксела, (b) среднецепочечный триглицерид, (с) олеоилглицериновый комплекс с содержанием 30-65 вес.% моноолеоилглицерина, 15-50 вес.% диолеоилглицерина и 2-20 вес.% триолеоилглицерина, (d) поверхностно-активное вещество и (е) в некоторых случаях эфир полиоксила глицерила жирной кислоты, и способ ее получения. Поверхностно-активное вещество выбрано из группы компонентов, содержащей блоксополимер полиоксиэтилена-полиоксипропилена, эфир сорбитана, полиоксиэтилен сорбитан и полиоксиэтиленовый эфир. Композиции по изобретению присутствуют в форме раствора при комнатной температуре и могут быть введены перорально без дополнительной обработки, такой как нагрев. Также композиции с использованием олеоилглицеринового комплекса характеризуются высокой степенью всасывания in vivo в организме. 5 н. и 15 з.п. ф-лы, 4 ил., 10 табл., 69 пр.
1. Фармацевтическая композиция для перорального приема, содержащая
(a) таксан в виде паклитаксела или доцетаксела,
(b) среднецепочечный триглицерид, представляющий собой один или более из компонентов, выбранных из группы компонентов, содержащей триацетин, трипропионин, трибутирин, тривалерин, трикапроин, трикаприлин, трикаприн, тригептаноин, тринонаноин, триундеканоин, трилаурин, тритридеканоин, тримиристин, трипентадеканоин, трипальмитин, глицерил тригептадеканоат и триолеин,
(c) олеоилглицериновый комплекс, содержащий 30-65 вес.% моноолеоилглицерина; 15-50 вес.% диолеоилглицерина и 2-20 вес.% триолеоилглицерина, и
(d) поверхностно-активное вещество, представляющее собой один или более из компонентов, выбранных из группы компонентов, содержащей блоксополимер полиоксиэтилена-полиоксипропилена, эфир сорбитана, полиоксиэтилен сорбитан и полиоксиэтиленовый эфир.
2. Фармацевтическая композиция для перорального приема по п. 1, в которой олеоилглицериновый комплекс содержит 32-52 вес.% моноолеоилглицерина; 30-50 вес.% диолеоилглицерина и 5-20 вес.% триолеоилглицерина.
3. Фармацевтическая композиция для перорального приема по п. 1, в которой олеоилглицериновый комплекс содержит 55-65 вес.% моноолеоилглицерина; 15-35 вес.% диолеоилглицерина и 2-10 вес.% триолеоилглицерина.
4. Фармацевтическая композиция для перорального приема по любому из пп. 1-3, содержащая 0,5-1,5 вес.% таксана, 20-35 вес.% среднецепочечного триглицерида, 45-60 вес.% олеоилглицеринового комплекса и 15-25 вес.% поверхностно-активного вещества.
5. Фармацевтическая композиция для перорального приема по п. 4, содержащая 0,8-1,2 вес.% таксана, 25-30 вес.% среднецепочечного триглицерида, 50-55 вес.% олеоилглицеринового комплекса и 15-20 вес.% поверхностно-активного вещества.
6. Фармацевтическая композиция для перорального приема по любому из пп. 1-3, дополнительно содержащая эфир полиоксила глицерила жирной кислоты.
7. Фармацевтическая композиция для перорального приема по п. 6, в которой эфир полиоксила глицерила жирной кислоты представляет собой один или более из компонентов, выбранных из группы компонентов, содержащей каприлкапроил полиоксилглицерид, лауроил полиоксилглицерид и стеароил полиоксилглицерид.
8. Фармацевтическая композиция для перорального приема по п. 7, в которой эфир полиоксила глицерила жирной кислоты представляет собой один или более из компонентов, выбранных из группы компонентов, содержащей каприлокапроил полиоксил-32 глицерид, лауроил полиоксил-32 глицерид и стеароил полиоксил-32 глицерид.
9. Фармацевтическая композиция для перорального приема по п. 6, содержащая 4-40 вес.% таксана, 10-30 вес.% среднецепочечного триглицерида, 30-70 вес.% олеоилглицеринового комплекса, 5-30 вес.% поверхностно-активного вещества и 10-30 вес.% эфира полиоксила глицерила жирной кислоты.
10. Фармацевтическая композиция для перорального приема по п. 6, содержащая 4-25 вес.% таксана, 10-20 вес.% среднецепочечного триглицерида, 40-60 вес.% олеоилглицеринового комплекса, 10-25 вес.% поверхностно-активного вещества и 10-20 вес.% эфира полиоксила глицерила жирной кислоты.
11. Способ приготовления фармацевтической композиции для перорального приема по п. 1, включающий
(i) растворение таксана и среднецепочечного триглицерида в органическом растворителе и
(ii) удаление органического растворителя из раствора, полученного на этапе (i), с последующим смешиванием с олеоилглицериновым комплексом, содержащим 30-65 вес.% моноолеоилглицерина, 15-50 вес.% диолеоилглицерина и 2-20 вес.% триолеоилглицерина, и с поверхностно-активным веществом.
12. Способ приготовления фармацевтической композиции для перорального приема по п. 1, включающий
(i') растворение таксана, среднецепочечного триглицерида, олеоилглицеринового комплекса, содержащего 30-65 вес.% моноолеоилглицерина, 15-50 вес.% диолеоилглицерина и 2-20 вес.% триолеоилглицерина, а также поверхностно-активного вещества в органическом растворителе и
(ii') удаление органического растворителя из раствора, полученного на этапе (i').
13. Способ приготовления фармацевтической композиции для перорального приема по п. 6, включающий
(i'') растворение таксана и эфира полиоксила глицерила жирной кислоты в органическом растворителе,
(ii'') удаление органического растворителя из раствора, полученного на этапе (i''), с последующим смешиванием со среднецепочечным триглицеридом, олеоилглицериновым комплексом, содержащим 30-65 вес.% моноолеоилглицерина, 15-50 вес.% диолеоилглицерина и 2-20 вес.% триолеоилглицерина, а также с поверхностно-активным веществом, чтобы получить следующий раствор, и
(iii'') в некоторых случаях заполнение мягкой капсулы тем раствором, который был получен на этапе (ii'').
14. Способ приготовления фармацевтической композиции для перорального приема по п. 6, включающий
(i''') растворение в органическом растворителе таксана, среднецепочечного триглицерида, олеоилглицеринового комплекса, содержащего 30-65 вес.% моноолеоилглицерина, 15-50 вес.% диолеоилглицерина и 2-20 вес.% триолеоилглицерина, а также поверхностно-активного вещества и эфира полиоксила глицерила жирной кислоты,
(ii''') удаление органического растворителя из раствора, полученного на этапе (i'''), и
(iii''') в некоторых случаях заполнение мягкой капсулы тем раствором, который был получен на этапе (ii''').
15. Способ по любому из пп. 11-14, в котором олеоилглицериновый комплекс содержит 32-52 вес.% моноолеоилглицерина, 30-50 вес.% диолеоилглицерина и 5-20 вес.% триолеоилглицерина.
16. Способ по любому из пп. 11-14, в котором олеоилглицериновый комплекс содержит 55-65 вес.% моноолеоилглицерина, 15-35 вес.% диолеоилглицерина и 2-10 вес.% триолеоилглицерина.
17. Способ по любому из пп. 13 или 14, в котором эфир полиоксила глицерила жирной кислоты представляет собой один или более из компонентов, выбранных из группы компонентов, содержащей каприлокапроил полиоксилглицерид, лауроил полиоксилглицерид и стеароил полиоксилглицерид.
18. Способ по п. 17, в котором эфир полиоксила глицерила жирной кислоты представляет собой один или более из компонентов, выбранных из группы компонентов, содержащей каприлокапроил полиоксил-32 глицерид, лауроил полиоксил-32 глицерид и стеароил полиоксил-32 глицерид.
19. Способ по любому из пп. 11-14, в котором органический растворитель представляет собой один или более из компонентов, выбранных из группы компонентов, содержащей галогенированное алкильное соединение, спирт и кетон.
20. Способ по п. 19, в котором органический растворитель представляет собой один или более из компонентов, выбранных из группы компонентов, содержащей метиленхлорид и этанол.
Авторы
Даты
2019-03-28—Публикация
2015-07-30—Подача