Изобретение относится к ветеринарии, а именно к способам для выявления специфических антител к вирусу гепатита утят типа I.
Вирусный гепатит утят типа I (ВГУ-1) - высококонтагиозная, сверхостро протекающая среди утят и латентно среди уток болезнь, с преимущественным поражением печени и большой смертностью молодняка. ВГУ-1 наносит значительный экономический ущерб утководческим хозяйствам, особенно промышленного типа, поскольку вызывает массовую гибель утят 1-30 - суточного возраста 30-95% и снижение продуктивности уток. Переболевшие утята отстают в росте и развитии, что ведет к частичной потере мясной продуктивности, нарушению племенной работы. Ущерб от ВГУ-1 усугубляется затратами на ограничительные мероприятия, нарушающие экономику хозяйства, особенно когда болезнь принимает стационарный характер [1, 2, 3].
Поэтому исключительно важное значение приобретает диагностика данной болезни, основанная на эпизоотологических данных, клиническо-патологоанатомической картины, результатах лабораторных исследований (выделение вируса и его идентификация в реакции нейтрализации, биопроба), а также обнаружение специфических антител в сыворотке крови птиц методом иммуноферментного анализа.
В настоящее время для определения антител в пробах сыворотки крови утят (уток) к вирусу гепатита используют, как правило, реакцию нейтрализации, заключающейся в том, что к двукратным разведениям сыворотки добавляют равный объем вируссодержащей суспензии, содержащей 100 или 1000 ТЦД50 антигена. Смеси инкубируют при комнатной температуре 1 час и заражают культуру клеток. Титр вируснейтрализующих антител выражают в log2 (4).
Недостатком данного способа является его длительность - (5-6 суток), что недопустимо в разгар эпизоотии, а также способ дорогостоящий и трудоемкий.
Известен способ определения антител к экзотоксину коклюшных бактерий путем иммуноферментного анализа, включающий в себя адсорбцию экзотоксина на поверхности полистирола, внесение исследуемых антител, конъюгатаантивидовых антител с ферментом субстрата, причем перед адсорбцией токсина поверхность полистирола обрабатывают частично денатурированным церулоплазмином человека (5).
Однако, указанный способ не позволяет проводить диагностику вирусного гепатита утят типа I.
Наиболее близким по технической сущности к заявляемому способу является известный способ определения антител к антигену вирусного энтерита гусей (6).
Согласно способу, вируссодержащий материал получают с использованием штамма "П-75". Очистку полученного биосырья осуществляют путем вирусной гельхроматографии на макропористом стекле с диаметром пор, соответствующим диаметру очищаемого вируса. Разведение очищенного антигена вируса энтерита гусей проводят фосфатно-солевым буфером (ФСБ) до концентрации 5,0 - 10,0 мкг/0,1 см3. Адсорбцию разведенного антигена проводят на поверхности полистироловых планшет, затем на планшеты наносят исследуемые сыворотки крови гусей. Детекцию комплекса антиген- антитело осуществляют с использованием антивидового иммунопероксидазного конъюгата против IgG гуся и учитывают результаты реакции ИФА.
Учет результатов реакции ИФА исследуемых сывороток крови гусят (гусей) проводят, как визуально путем сравнения цветового окрашивания содержимого лунок исследуемой сыворотки с интенсивностью окраски продукта пероксидазной реакции титруемого контроля, так и используя математическую формулу.
Однако данный способ также не позволяет проводить диагностику вирусного гепатита утят.
Задачей, решаемой в рамках данного изобретения, является создание способа определения антител к вирусу гепатита утят типа I, обладающего высокой чувствительностью и специфичностью, а также позволяющего сократить время исследования и снизить экономические затраты.
Указанная задача была решена в результате создания способа определения специфических антител к вирусу гепатита утят типа I путем проведения ИФА, включающего получение антигена, его инактивацию и очистку способом вирусной гельхроматографии на активированном макропористом стекле, его иммобилизацию (адсорбцию) на поверхности полистироловых планшет, внесение контрольных и исследуемых сывороток крови и детекцию комплекса антиген-антитело с помощью антивидового иммунопероксидазного конъюгата, специфичного к IgG уток в присутствии субстратно-индикаторной смеси, причем в качестве антигена используют вирус, полученный в результате введения в организм штамма «ВН-3» вируса гепатита утят типа I, при очистке инактивированного вируссодержащего материала используют активированное макропористое стекло 1000 ВГХ, а в качестве антивидового иммунопероксидазного конъюгата используют специфичный к IgG уток, а результаты ИФА учитывают по формуле: титр = antilg (1.36 (lg S/P) +3.53), где S - значение оптической плотности исследуемой сыворотки; Р - значение оптической плотности положительного контроля, и пробу сыворотки S/P - отношением ниже 0,2 расценивают как отрицательную, S/P - отношением равно 0,21 - 0,23 - сомнительную, больше или равными 0,24 - положительную.
Заявляемые свойства способа обусловлены, прежде всего, использованием штамма «ВН-3» вируса гепатита утят типа I, инфекционный титр которого составляет 7,0±0,25 lg ЭЛД50/см3. Полученный штамм вируса депонирован в Государственной коллекции вирусов НИИ вирусологии им.
Д.И. Ивановского ФГБНУ «ФНИЦЭМ им. Н.Ф. Гамалеи» Минздрава России под №2859.
Установлено, что оптимальной дозой антигена вируса гепатита утят для сорбции на полистироловом планшете по белку является 5-9 мкг /0,1 см3, поскольку увеличение ее выше 9 мкг /0,1 см3 не приводило к возрастанию емкости твердофазного иммуносорбента. При концентрации белка менее 5 мкг/см3 имело место значительное снижение величины экстинкции и, как следствие, уменьшение чувствительности анализа. Кроме того, на последующих этапах ИФА это могло привести к повышению фонового сигнала вследствие неспецифической сорбции молекул конъюгата на свободных поверхностях полистирола.
Специфический комплекс - антиген - немеченное антитело выявляют использованием антивидового иммунопероксидазного конъюгата, специфичного к lg G уток, поскольку это определяется его биологическими свойствами.
Способ осуществляют следующим образом.
Вирус гепатита утят типа I штамма "ВН-3" хранится в ФГБНУ «ФНИЦЭМ им. Н.Ф. Гамалеи» и выдается по требованию предприятия не реже 1 раза в год с паспортом, характеризующим свойства штамма. Для получения вируссодержащего материала используют общепринятые методики (4). Инфекционный титр вируссодержащей жидкости должен быть не ниже 7,0 lg ЭЛД50в 1,0 см3. Активный и специфичный антиген вируса гепатита утят получают путем очистки вируссодержащей эмбриональной жидкости методом колоночной хроматографии на активированном макропористом стекле 1000 ВГХ, обработанном 4% раствором ПВП. В очищенном препарате вируса количество белка определяют методом Лоури, и оно, как правило, составляет от 60 до 90 мкг / см3. Затем очищенный препарат вируса, разводят 0,01 М ФСБ с содержанием 0,15 М хлорида натрия, рН 7,3-7,5, до конечной концентрации 6-9 мкг / 0,1 см3. Эта концентрация является оптимальной для адсорбции очищенного антигена
вируса в лунках планшета, поскольку увеличение концентрации антигена свыше 9 мкг/0,1 см3 и уменьшение ее ниже 5 мкг/0,1 см3 снижает чувствительность реакции.
После определения активности и специфичности очищенный антиген вируса разделяют на две партии (части), одну из которых используют для иммунизации утят с целью получения штамма специфической сыворотки крови, а вторую для сорбции в лунках планшета для ИФА.
Твердофазный иммуносорбент получают посредством сорбции в лунках планшета для ИФА по 0,1 см3 разведенного в 0,01 М ФСБ до оптимальной концентрации очищенного антигена в течение 16-18 часов при 4-8°С. Затем содержимое лунок планшета удаляют резким встряхиванием и трехкратно промывают буфером следующего состава: 0,01 М калий-фосфатный буфер, содержащий 0,5 М хлорида натрия с 0,1% конечной концентрацией детергента твина-20, рН 7,3-7,5. После чего лунки планшета подсушивают путем постукивания по фильтровальной бумаге.
Для постановки иммуноферментного анализа используют: одно - и восьмиканальные автоматические пипетки со сменными наконечниками разных объемов, термостат с температурой нагрева (37±0,5)°С, бытовой холодильник, спектрофотометр любой конструкции вертикальным лучом света при длине волны 492 нм.
Для исследования в лабораторию доставляют по 20-25 проб в объеме 0,1-0,2 см3 сыворотки крови утят разных возрастных групп из утководческих хозяйств, где имеется подозрение на данное заболевание. Затем готовят иммуноспецифические и неспецифические компоненты и рабочие растворы:
Иммуноспецифические компоненты:
К.1 - положительная сыворотка крови утят, содержащая антитела к вирусу гепатита утят типа I(положительный контроль), разведенная 1:100 0,15М хлорида натрия с содержанием 1% фетальной сыворотки, лиофилизированная, 1,0 см3 - 1 ампула или флакон;
К.2 - нормальная сыворотка крови утят, не содержащая антител к вирусу гепатита утят (отрицательный контроль), разведенная 1:100 0,15М раствором хлорида натрия с содержанием 1% фетальной сыворотки, лиофилизированная, объем 1,0 см3 - 1 ампула или флакон;
К.3 - полистироловые 96-луночные планшеты с адсорбированным в лунках очищенным инактивированным антигеном вируса гепатита утят типа I- 2 планшета;
К.4 - антивидовой (кроличий) иммунопероксидазный конъюгат против IgG уток, жидкий, объем 0,1 см3 - 1 флакон;
Неспецифические компоненты:
К.5 - буферный раствор (концентрированный) для разведения контрольных и испытуемых сывороток, антивидового конъюгата и межэтапных промывок, объем 5,0 см3 - 1 флакон;
К.6 - набор солей для приготовления фосфатно-цитратного буферного раствора, таблетка 0,63 г, - 2 шт.
К.7 - детергент твина-20, объем 5,0 см3 - 1 флакон;
К.8 -субстрат ортофенилендиамин (ОФД), таблетка 5 мг, 2 шт.;
К.9 - гидроперит, таблетка 1,5 г - 1 шт.;
К. 10 - натрий хлористый, кристаллический порошок 22,0 г - 1 флакон.
1. Приготовление рабочих растворов осуществляют следующим образом.
Раствор №1 - буферный раствор для разведения контрольных и испытуемых сывороток, антивидового конъюгата и межэтапных промывок. Содержимое флаконов К.5 и К.10 растворить в 750,0 см3 дистиллированной воды и измерить величину рН, которая должна быть в пределах 7,3-7,5. Затем в этот раствор добавить содержимое флакона К.7. Раствор рекомендуется хранить при температуре 4-8°С не более 10 суток.
Раствор №2 - фосфатно-цитратный буферный раствор.
Содержимое флакона К.6 (1 таблетку) растворить в 10,0 см3 дистиллированной воды. Полученный раствор должен иметь рН в пределах 4,9-5,0. Готовить перед использованием.
Раствор №3. 1 таблетку гидроперита (К.9) растворить в 45,0 см3 дистиллированной воды. Раствор хранить в защищенном от света месте при температуре 4-8°С не более 10 сут.
Раствор №4 - субстратно-индикаторная смесь. 1 таблетку ОФД (К.8) растворить в 10,0 см3 раствора №2, перемешать до полного растворения и добавить 0,4 см3 раствора №3.
Раствор №4 готовить непосредственно перед использованием. Хранению не подлежит.
Раствор №5 - стоп - раствор. 1,0 см3 концентрированной серной кислоты (в наборе отсутствует) растворить в 10,0 см3 дистиллированной воды. Раствор рекомендуется хранить во флаконе из темного стекла при температуре 18-25°С не более одного месяца.
В связи с высокой токсичностью ОФД и серной кислоты приготовление субстратно-индикаторной смеси и стоп-раствора проводить в резиновых перчатках, избегая попадания на кожу и слизистые оболочки.
2. Подготовка иммуноспецифических компонентов.
2.1. К содержимому ампулы (флакона) с лиофилизированной положительной сывороткой крови утят (К.1) добавить 1,0 см3 раствора №1. Готовят перед использованием. Подготовленную сыворотку рекомендуется хранить при температуре минус 10°С и ниже не более 15 сут. В течение срока годности размораживание допускается один раз.
2.2. К содержимому ампулы (флакона) с лиофилизированной нормальной сывороткой крови утят (К.2) добавить 1,0 см3 раствора №1. Готовят перед использованием. Подготовленную сыворотку рекомендуется хранить при температуре минус 10°С и ниже не более 15 сут. В течение срока годности размораживание допускается один раз.
2.3. Рабочий раствор конъюгата. К содержимому флакона с антивидовым конъюгатом (К.4) добавить 10,0 см3 раствора №1. Раствор готовить непосредственно перед использованием. Хранению не подлежит.
3. Разведение испытуемых и контрольных сывороток крови.
1. При постановке ИФА в одном разведении все испытуемые и контрольные сыворотки (положительную и нормальную) развести 1:400 раствором №1.
Для контрольных к 0,3 см3 раствора №1 добавить 0,1 см3 сыворотки крови уток, для испытуемых к 1,0 см3 раствора №1 добавить 0,0025 см3 сыворотки крови уток и трижды пипетировать, используя для каждой пробы новый наконечник.
2. При постановке ИФА методом раститровки контрольные пробы сывороток (положительная и нормальная), приготовленные по п.п. 2.1, 2.2. разведены 1:100. Готовы к использованию. Все испытуемые пробы сыворотки крови уток развести 1:100 раствором №1. Для чего к 1,0 см3 раствора №1 добавить 0,01 см3 сыворотки крови и трижды пипетировать, используя для каждой пробы новый наконечник.
4. Постановка реакции
1.1. При постановке ИФА в одном разведении в лунки вертикальных рядов планшета А1,В1,С1 внести положительную сыворотку, подготовленную по п. 1 в объеме 0,1 см3. В лунки планшета D1,E1,F1 внести нормальную сыворотку (отрицательный контроль), подготовленную по п. 1 в объеме 0,1 см3. Лунки G1-H1 служат контролем конъюгата и заполняются раствором №1 по 0,1 см3. В остальные лунки планшета внести испытуемые пробы, подготовленные по п. 1 в объеме 0,1 см3.
1.2. Планшет осторожно встряхнуть для перемешивания содержимого, накрыть крышкой и инкубировать в термостате при температуре 37±0,5°С в течение 30 мин. По окончании инкубации лунки планшета освободить от содержимого резким встряхиванием и трехкратно промыть раствором №1 (по 0,2 см3 в каждую лунку). Затем жидкость окончательно удалить и планшет подсушить, постукивая по сложенной в несколько слоев фильтровальной бумаге.
1.3. Во все используемые лунки планшета внести по 0,1 см3 рабочего раствора конъюгата, накрыть крышкой и инкубировать 30 минут при температуре 37±0,5°С. По окончании инкубации лунки планшета
освободить от содержимого резким встряхиванием и трехкратно промыть раствором №1 (по 0,2 см3 в каждую лунку). Затем жидкость окончательно удалить и планшет подсушить, постукивая по сложенной в несколько слоев фильтровальной бумаге.
1.4. Во все используемые лунки планшета внести по 0,1 см3 раствора №4, накрыть крышкой и выдержать 3-5 мин при температуре 18-25°С в темном месте.
1.5. Реакцию остановить добавлением в каждую используемую лунку по 0,05 см3 (50 мкл) раствора №5.
2.1. При постановке ИФА методом раститровки во все лунки рядов планшета В1-В12…H1-H12 внести по 0,1 см3 раствора №1. В лунку планшета А1 внести нормальную сыворотку (отрицательный контроль), подготовленную по п. 1 в объеме 0,2 см3. В лунку планшета А2 внести положительную сыворотку, подготовленную по п. 1 в объеме 0,2 см3. В остальные лунки планшета А3-А12 внести испытуемые пробы, подготовленные по п. 2 в объеме 0,2 см3. Провести раститровку по вертикальным рядам А1-Н1…А12-Н12 с разведения 1:100 до 1:12800, перенося 0,1 см3 в очередную лунку вертикального ряда. Из последних лунок H1-H12 удалить по 0,1 см3. Дальнейшую постановку ИФА проводят аналогично по п. 1.2 - 1.5.
После остановки реакции учет результатов ИФА проводят визуально - по интенсивности окрашивания содержимого лунок планшета или инструментально - с помощью спектрофотометра (ридера) с вертикальным лучом света при длине волны 492 нм.
5.1. При визуальном способе учета первоначально оценивают контрольные лунки: положительный контроль (положительная сыворотка) при раститровке окрашивается в желтый цвет различной интенсивности, отрицательный контроль (нормальная сыворотка) остается неокрашенным или незначительно желтеет. Затем сравнивают окраску содержимого лунок планшета испытуемых проб с окраской лунок отрицательного контроля.
Титром испытуемой сыворотки считается ее предельное разведение, при котором наблюдают видимое глазом цветовое окрашивание, более интенсивное по сравнению с отрицательным контролем. Титр контрольной положительной сыворотки должен быть не менее 1:800.
5.2. Инструментальный спектрофотометрический способ учета результатов может быть использован как при постановке ИФА в одном разведении, так и при раститровке сыворотки крови. Он позволяет количественно оценить титры специфических антител в исследуемых пробах путем измерения значений оптической плотности (ОП 492 нм).
При правильной постановке ИФА и использовании качественных компонентов набора среднее значение ОП отрицательного контроля в разведении 1:400 не должно превышать 0,200.
Разница показателей средних значений оптических плотностей положительного и отрицательного контролей в разведении 1:400 должна быть в диапазоне 0,340-0,980. Если полученные данные выходят за пределы этих значений, результаты считаются недостоверными и реакцию повторяют.
Наличие или отсутствие антител к вирусу гепатита утят устанавливается сравнением значений оптической плотности тестируемой сыворотки (S) с положительным контролем (Р). Проба сыворотки с S/P -отношением ниже 0,2 должна расцениваться как отрицательная. Если S/P - отношение равно 0,21 - 0,23 - сомнительными, больше или равными 0,24 - положительными.
При определении конечного титра исследуемой пробы по одному разведению 1:400, используют формулу Tитр=antilg [1,36 (lgs/p) + 3,53], где
S - значение оптической плотности исследуемой сыворотки;
Р - значение оптической плотности положительного контроля.
При выявлении в сыворотках крови утят разных возрастных групп, невакцинированных против вирусного гепатита, специфических антител в титрах 1:100 и выше у более, чем 50% исследуемых проб дает основание
считать хозяйство стационарно неблагополучное по вирусному гепатиту утят типа I. Для подтверждения диагноза проводят вирусологические исследования по выделению вируса из патологического материала (сердце, почки, селезенка, печень, головной мозг). Оценкой эффективности применения вакцины является выявление в сыворотке крови привитых уток специфических антител в титрах не ниже, чем 1:400 у 80% вакцинированной птицы.
Пример 1. Был проведен сравнительный анализ результатов исследования проб сыворотки крови уток с помощью реакции нейтрализации (РН) и с использованием заявляемого способа. Сыворотки, проверяли на наличие антител к вирусу гепатита утят типа I в РН. Тест нейтрализации является классическим тестом для выявления специфических антител при вирусных заболеваниях, в том числе и при вирусном гепатите утят типа I. Результаты сравнительного изучения чувствительности ИФА и реакции нейтрализации при выявлении специфических антител к вирусу гепатита представлены в табл. 1.
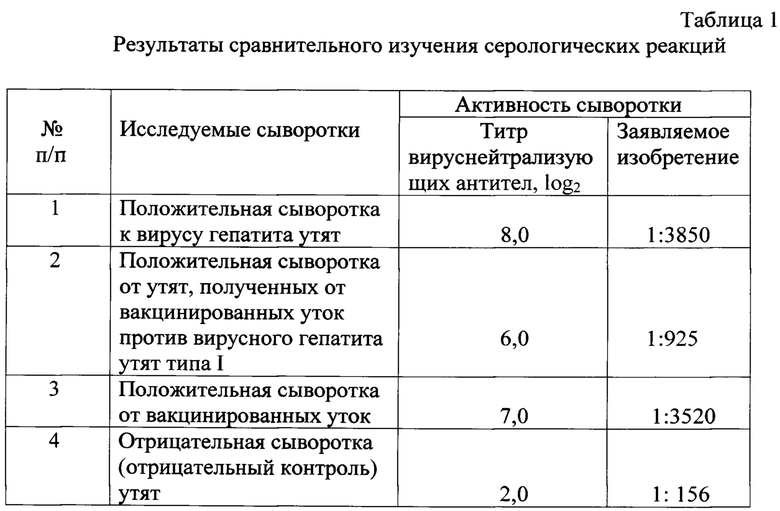
Результаты проведенных исследований показали, что предлагаемый способ обладает высокой чувствительностью и специфичностью и позволяет выявлять специфические антитела к вирусу гепатита утят в пробах сыворотки крови.
Между двумя сравниваемыми способами коэффициент корреляции составил (r=-1,0), (р<0.05). Время проведения исследования с использованием заявляемого изобретения составило 3 часа, а в случае РН -5-6 суток.
Пример 2.
Были проведены испытания на активность и специфичность предложенного способа в шифрованном опыте. На испытание были представлены:
Положительные сыворотки крови утят (положительный контроль);
Отрицательные сыворотки крови утят (отрицательный контроль);
Сыворотка крови утят-реконвалесцентов - 10 проб;
Сыворотка крови уток, вакцинированных против вирусного гепатита утят типа 1-20 проб;
Сыворотка крови уток из хозяйств, благополучных по вирусному гепатиту утят типа 1-25 проб;
Специфические (гетерологичные) сыворотки крови уток к парвовирусу гусей и реовирусу - по 2 пробы.
Для исследований было зашифровано 7 проб сыворотки крови уток. Исследуемые сыворотки разводили ФСБ 1:100 и вносили в лунки планшета с адсорбированным очищенным антигеном вируса гепатита утят типа I в объеме 0,1 см3, по 2 лунки на каждую сыворотку. Иммуноферментную реакцию проводили аналогичным образом как указано ранее. Результаты испытаний представлены в табл. 2.
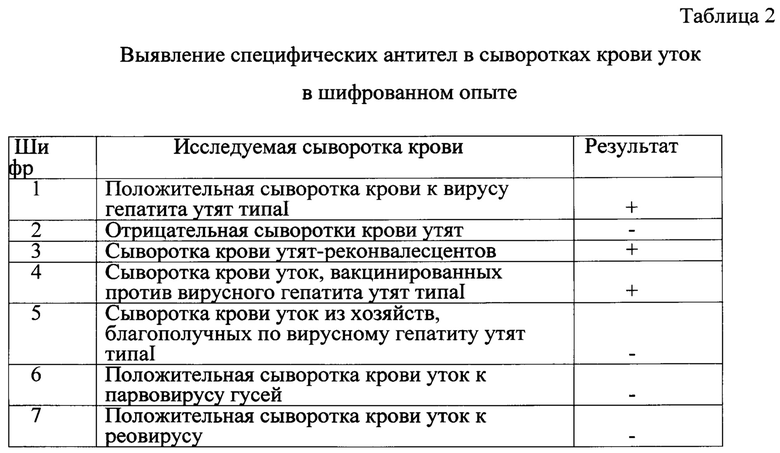
Примечание: "+" - наличие антител к вирусу гепатита в ИФА;
"-"- отсутствие антител в ИФА
Результаты шифрованного опыта показали, что ИФА при выявлении специфических антител в сыворотке крови к вирусу гепатита утят типа I обладает высокой чувствительностью и специфичностью.
Таким образом, заявляемый способ может быть использован для качественного и количественного определения специфических антител к вирусу гепатита в сыворотке крови утят и уток при проведении серологического мониторинга птицепоголовья, а также для определения уровня поствакцинального иммунитета при вирусном гепатите утят типа I.
Источники информации
1. Князев В.П. Болезни водоплавающих птиц: монография. Владимир, 2010; 160 с.
2. Gough R.E., McNulty M.S. Picornaviridae. In Poultry Diseases, 6th Edition. Eds Pattison M, McMullin PF, Bradbury JM, Alexander DJ. Elsevier. Butterworth-Heineman, 2008; 350-358.
3. Kim M.C., Kwon Y.K., Joh S.J. [et al]. Differential diagnosis between type-specific duck hepatitis virus type 1 (DHV-1) and resent Korean DHV-1 like isolates using multiplex polymerase chain reaction. AvianPathology. 2008; 37: 171-177.
4. Белоусова P.B. Практикум по ветеринарной вирусологии: 3-е изд., перераб. и доп./ Р.В. Белоусова, Н.И. Троценко, Э.А. Преображенская. - М.: Колос. - 2013.-248 с.
5. Патент №1475331, SU. 1999.
6. Патент №2323743, RU, 2006.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К ВИРУСУ ЭНТЕРИТА ГУСЕЙ | 2006 |
|
RU2323743C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К АНТИГЕНУ РЕОВИРУСНОГО ТЕНОСИНОВИТА КУР | 2000 |
|
RU2192012C2 |
| НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ИНФЕКЦИОННОГО БРОНХИТА КУР | 2001 |
|
RU2189042C1 |
| НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 2001 |
|
RU2192014C1 |
| НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ЭНЦЕФАЛОМИЕЛИТА ПТИЦ | 2001 |
|
RU2199126C2 |
| НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 КУР | 2000 |
|
RU2167673C1 |
| КОМПЛЕКСНАЯ ТЕСТ-СИСТЕМА ИММУНОФЕРМЕНТНОГО АНАЛИЗА (ИФА) ДЛЯ ОПРЕДЕЛЕНИЯ УРОВНЯ АНТИТЕЛ К ВИРУСНЫМ РЕСПИРАТОРНЫМ ЗАБОЛЕВАНИЯМ КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2371726C1 |
| НАБОР ДЛЯ РАННЕЙ ИММУНОФЕРМЕНТНОЙ ДИАГНОСТИКИ ИНФЕКЦИОННОГО РИНОТРАХЕИТА ЖИВОТНЫХ | 2001 |
|
RU2196336C2 |
| НАБОР ДЛЯ РЕТРОСПЕКТИВНОЙ ИММУНОФЕРМЕНТНОЙ ДИАГНОСТИКИ ИНФЕКЦИОННОГО РИНОТРАХЕИТА ЖИВОТНЫХ | 2001 |
|
RU2196609C2 |
| Тест-система ИФА для серологической диагностики нодулярного дерматита крупного рогатого скота - Dermatitis nodularis bovum | 2016 |
|
RU2640192C1 |
Изобретение относится к области ветеринарии. Предложен способ определения специфических антител к вирусу гепатита утят типа I путем проведения ИФА, включающий получение антигена. В качестве антигена используют вирус, полученный в результате введения в организм штамма "ВН-3" вируса гепатита утят типа I. При очистке инактивированного вируссодержащего материала используют активированное макропористое стекло 1000 ВГХ. В качестве антивидового иммунопероксидазного конъюгата используют специфичный к IgG уток. Результаты ИФА учитывают по формуле: титр = antilg [1.36 (lg S/P) +3.53]. Пробы сыворотки с S/P-отношением ниже 0,2 расцениваются как отрицательные, с S/P-отношением, равным 0,21 - 0,23 - сомнительными, больше или равными 0,24 - положительными. Изобретение обеспечивает эффективное определение специфических антител к вирусу гепатита утят типа I. 2 табл., 2 пр.
Способ определения специфических антител к вирусу гепатита утят типа I путем проведения ИФА, включающий получение антигена, его инактивацию и очистку способом вирусной гельхроматографии на активированном макропористом стекле, его иммобилизацию (адсорбцию) на поверхности полистироловых планшет, внесение контрольных и исследуемых сывороток крови и детекцию комплекса антиген-антитело с помощью антивидового иммунопероксидазного конъюгата, специфичного к IgG уток в присутствии субстратно-индикаторной смеси, характеризующийся тем, что в качестве антигена используют вирус, полученный в результате введения в организм штамма "ВН-3" вируса гепатита утят типа I, при очистке инактивированного вируссодержащего материала используют активированное макропористое стекло 1000 ВГХ, в качестве антивидового иммунопероксидазного конъюгата используют специфичный к IgG уток, а результаты ИФА учитывают по формуле: титр = antilg [1.36 (lg S/P) +3.53], где S - значение оптической плотности исследуемой сыворотки; Р - значение оптической плотности положительного контроля, и пробу сыворотки с S/P-отношением ниже 0,2 расценивают как отрицательную, с S/P-отношением, равным 0,21 - 0, 23 - сомнительную, больше или равным 0,24 - положительную.
| WOOLCOCK P.R | |||
| Duck Virus Hepatitis | |||
| Manual of Diagnostic Tests and Vaccines for Terrestrial Animals | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| KIM M.C | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Avian Pathol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К ВИРУСУ ЭНТЕРИТА ГУСЕЙ | 2006 |
|
RU2323743C2 |
Авторы
Даты
2019-04-09—Публикация
2018-05-08—Подача