Изобретение относится к медицине, а именно цитохимической лабораторной диагностике, и может быть использовано для подбора in vitro оптимального (наилучшего, наиболее благоприятного в данных условиях) криопротектора на доклиническом этапе гемотрансфузионной терапии и предупреждения постгрансфузионных осложнений криопротекторного генеза. Для осуществления способа у больного до начала криогемотрансфузионной терапии получают порцию венозной крови, делят на равные части в пробирки, в одной из которых контрольная проба (КП) крови не содержит криопротектора, в другие добавляют по одной равной дозе тестируемых криопротекторов - опытные пробы (ОП); пробирки герметизируют пробками, содержимое перемешивают на шейкере при температуре плюс 37°C в течение 4 ч, капли ОП и КП наносят в объеме 4 мкл на предметные стекла, делают 2-3 мазка, быстро высушивают на воздухе при комнатной температуре, фиксируют в 10% спирт - формалиновой смеси, окрашивают на гликоген по методу Шабадаша, лейкоциты микроскопируют в проходящем свете, проводят сравнительное исследование среднего цитохимического коэффициента (СЦК) сегментоядерных (с/я) нейтрофилов и лимфоцитов ОП и КП по Кэплоу (1955) в модификации Астальди и Верга (1957); при равности показателей СЦК ОП и СЦК КП тестируемый криопротектор оценивают как оптимальный для конкретного больного и пригодным к использованию (ПКИ); при значениях СЦК ОП, отличных от СЦК КП, делают заключение как о непригодном к использованию криопротекторе. Способ прост и доступен врачу по клинической лабораторной диагностике современного лечебно-профилактического учреждения (ЛПУ).
Изобретение относится к медицине, а именно к лабораторной диагностике по подбору оптимального криопротектора на доклиническом этапе гемотрансфузионной терапии и предупреждению посттрансфузионных осложнений криопротекторного генеза.
Уровень техники.
В современной клинической медицине посттрансфузионные реакции и осложнения рассматривают как один из универсальных механизмов патогенеза различных заболеваний, характеризующихся накоплением в тканях организма избытка токсических продуктов обмена веществ или клеточного реагирования, маркерами которых служат качественные и полуколичественные характеристики определенных цитохимических ферментативных реакций в лейкоцитах крови до и после смешивания с криопротекторами. Эти процессы могут развиваться как по типу яркой многосимптомной реакции, так и скрытно развивающихся труднокупируемых в последующем посттрансфузионных осложнений (Цитохимия замороженной клетки / Обозная Э.И., Пушкарь Н.С.. Маркова О.П.. Панков Е.Я. - Киев: Наук. Думка, 1981. - 176 с.). Поэтому возникает проблема выявления ранних признаков вредного влияния токсичных криопротекторов на организм и эффективного предупреждения посттрансфузионных осложнений криопротекторного генеза.
Известные методы биологического и биохимического исследования сыворотки крови (определение концентрации молекул средней массы, продуктов перекисного окисления липидов, билирубина и т.д.) имеют ряд недостатков:
- необходимость вводить криопротектор или гемоконсервант на его основе в сосудистое русло больного, то есть производить инвазивную манипуляцию, которая может быть сопряжена с техническими трудностями, осложнениями технического характера или непереносимостью субъектом лекарственного препарата;
- необходимость использования лабораторных технологий и специальной биохимической лаборатории, оснащенной сложным оборудованием и реактивами, что делает анализы не всегда доступными и дорогими как для лечебно-профилактических учреждений, так и для пациентов.
Эти недостатки ограничивают количество и частоту необходимых исследований.
На основании предложенных в литературе лабораторных модификаций для оценки полноценности ядерных клеток крови на этапах низкотемпературного консервирования и прогнозирования предполагаемых результатов криогемотрансфузионной терапии широко используются методы клинической и полуколичественной оценки цитохимических показателей активаторов жизненно важных клеточных ферментов в периферической крови пациентов.
Известен метод цитохимического обнаружения гликогена для оценки нормальных и патологических процессов (Углеводы и углеводный обмен: Материалы Второй Всесоюз. конф. по пробл. «Химия и обмен углеводов». 24-27 янв. 1961 г. М.: Изд-во АН СССР, 1962. - С. 157-163).
За прототип предлагаемого изобретения выбран способ, позволяющий выявить содержание гликогена в лейкоцитах высушенных мазков донорской крови (Архагов Ю.Ф. Изменение морфологии и функционально-метаболической активности лейкоцитов в процессе хранения донорской крови и под влиянием различных лучей: Автореф. дис. … канд. мед. наук. М., 2003. - 155 с.). Основным недостатком способа - прототипа является отсутствие сравнительных исследований СЦК лейкоцитов на гликоген в мазках проб венозной крови, смешанных с 15% раствором гексаметиленбистетра-оксиэтилмочевины (15% ГМБТОЭМ). 3,3% раствором глицерола (3,3% Гл). 10% раствором диметилсульфоксида (10% ДМСО), гемоконсервантом Тромбокриодмац (ТКД) или гемоконсервантом на основе 55% раствора диметилацетамида (ДМАЦ) с 5% раствором гидроксиэтилкрахмал (ГЭК) (55% ДМАЦ+5% ГЭК). со значениями СЦК КП. Вместе с тем, подбор оптимального криопротектора на этапе. предшествующем криогемотрансфузионной терапии, очень важен для больного, так как позволяет снизить риск посттрансфузионных осложнений криопротекгорного генеза.
Целью изобретения является устранение отмеченного недостатка и создание такого способа, который бы позволял подобрать in vitro для конкретного больного оптимальный криопротектор на этапе, предшествующем плановой криогемотрансфузионной терапии.
Раскрытие изобретения.
Техническим результатом изобретения является доступность, простота подбора оптимального криопротектора на доклиническом этапе криогемотрансфузионной терапии.
Технический результат в заявляемом способе подбора оптимального криопротектора по содержанию гликогена в лейкоцитах консервированной крови достигается тем, что, как и в способе-прототипе, анализ содержания гликогена в лейкоцитах осуществляют по методу Шабодаша.
Новым в способе является то, что подбор оптимального криопротектора проводят путем сравнительных исследований СЦК ОП на гликоген с 15% ГМБТОЭМ, 3,3 Гл, 10% ДМСО, гемоконсервантом ТКД или комбинированным гемоконсервантом 55% ДМАЦ с 5% ГЭК со значениями СЦК КП. При этом: об оптимальности криопротектора и его пригодности к использованию судят в случаях аналогичности значений показателей СЦК ОП и СЦК КП.
Необходимое оборудование:
1. Предметные стекла.
2. Пробирки для крови на 20 мл с винтовой герметичной пробкой.
3. Световой микроскоп с проходящим светом.
4. Набор тест-доз различных криопротекторов или гемоконсервантов на их основе, разрешенных к клиническому применению М3 России.
5. Набор реагентов для цитохимического определения гликогена в лейкоцитах.
Заявляемый способ имеет основное преимущество в сравнении с прототипом - проведение подбора оптимального криопротектора путем сравнительных исследований значений СЦК ОП аутологичной крови на гликоген, смешанных с тест-дозами 15% ГМБТОЭМ, 3.3% Гл, ТКД. 10% ДМСО или 55% ДМАЦ +5% ГЭК, со значениями СЦК КП.
Заявляемый способ осуществляют следующим образом. У обследуемого натощак до начала внутривенных трансфузий криоконсервированных компонентов крови (криогемотрансфузионной терапии) готовят в пробирках «линейку» из тест-доз с 15% ГМБТОЭМ, 3,3% глицерола, гемоконсервантом ТКД, 10% ДМСО или комбинированным гемоконсервантом на основе 55% ДМАЦ и 5% ГЭК по 1,5 мл в каждой; эксфузируют 25 мл аутологичной венозной крови на стабилизирующем растворе цитрата натрия и фасуют с помощью дозаторной пипетки в 6 помеченных маркером пробирок по 4,0 мл в каждую; затем в пробирку №1 вносят 0,25 мл тест-дозы 15% ГМБТОЭМ, в пробирку №2 - 0,25 мл тест-дозы 3,3% Гл, в пробирку №3 - 0,25 мл тест-дозы ТКД, в пробирку №4 - 0,25 мл тест-дозы 10% ДМСО, в пробирку №5 - 0,25 мл тест-дозы гемоконсерванта на основе 55% ДМАЦ +5% ГЭК, в пробирку №6 с контрольной пробой крови (КП) криопротектор не вносят; компоненты в пробирках №№1-6 герметизируют пробками, содержимое перемешивают на шейкере при температуре плюс 37°C в течение 4 ч (модель трансфузии); из каждой пробирки биопробы раскапывают с помощью дозаторной пипетки на чистые предметные стекла, из них готовят по 2-3 тонких мазка, высушивают на воздухе при комнатной температуре, фиксируют в 10% растворе спирт-формалина и окрашивают по методу Шабодаша (Справочник по клиническим лабораторным методам исследования под ред. Е.А. Кост. Москва "Медицина" 1975 г.); окрашенные и высушенные мазки микроскопируют в проходящем свете, производят качественный и полуколичественный анализ содержания гликогена в с/я нейтрифилах и лимфоцитах с подсчетом значений СЦК лимфоцитов по Кэплоу (1955) в модификации Астальди и Верга (1957). При этом: об оптимальности криопротектора и его пригодности к использованию с лечебной целью конкретному пациенту судят в случаях аналогичности значений показателей СЦК ОП и СЦК КП. При значениях СЦК ОП, отличающихся от СЦК КП, делают заключение о биопробах с высоким клиническим риском и непригодными для криогемотрансфузии.
Необходимое оборудование: предметные стекла, пробирки для крови на 5 и 20 мл с винтовой герметичной пробкой, световой микроскоп с проходящим светом, набор тест- доз различных криопротекторов или гемоконеервантов на их основе, разрешенных к клиническому применению М3 России, набор реагентов для цитохимического определения гликогена в лейкоцитах in vitro диагностики фирмы Диахим-ЦитоСтейн - ПАС (Россия).
В качестве иллюстрации работоспособности заявляемого способа подбора оптимального криопротектора по содержанию гликогена в лейкоцитах консервированной крови приводим 3 примера (Табл. 1), которые подтверждают практическое применение данного способа.
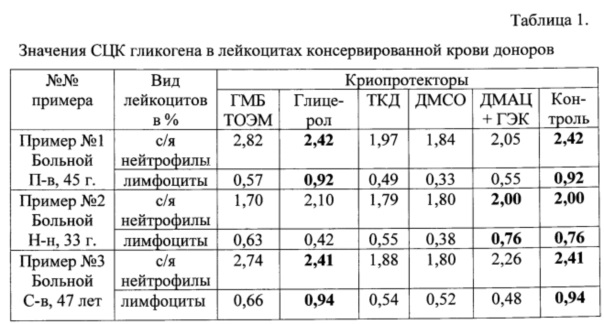
Примечание: жирным шрифтом обозначены оптимальные значения СЦК ОП и СЦК КП.
Пример №1. Результаты исследования крови донора П-ва 45 лет показывают, что из числа исследованных тест-доз криопротекторов оптимальным является 3,3% раствор Глицерола (СЦК с/я нейтрофилов 2,42% (в КП 2,42%); СЦК лимфоцитов 0,92% (в КП 0,92%). Заключение: ПКИ является криопротектор 3,3% Глицерол, а НКИ являются 15% ГМБТОЭМ, ТКД, 10% ДМСО и комбинированный криопротектор на основе 55% ДМАЦ и 5% ГЭК, которые несут риски посттрансфузионных осложнений.
Пример №2. Результаты исследования крови донора Н-н 33 лет показывают, что из числа исследованных тест-доз криопротекторов оптимальными являются комбинированный криопротектор, содержащий 55% ДМАЦ +5% ГЭК и 3,3% Глицерол, у которых СЦК с/я нейтрофилов 2,00% (в КП 2,00%). Согласно СЦК лимфоцитов в ОП и КП оптимальным также является криопротектор, содержащий 55% ДМАЦ +5% ГЭК 0,76%. Заключение: ПКИ является криопротектор на основе 55% ДМАЦ +5% ГЭК и 3,3% Глицерола, а НКИ являются 15% ГМБТОЭМ, ТКД и 10% ДМСО, которые несут риски посттрансфузионных осложнений.
Пример №3. Результаты исследования крови донора С-ва 47 лет показывают, что из числа исследованных тест-доз криопротекторов оптимальным является 3,3% раствор Глицерола (СЦК с/я нейтрофилов в КП и ОП составляет 2,41%, а СЦК лимфоцитов - по 0,94%. Заключение: ПКИ является криопротектор 3,3% Глицерол, а НКИ являются 15% ГМБТОЭМ, ТКД, 10% ДМСО и комбинированный криопротектор на основе 55% ДМАЦ и 5% ГЭК, которые несут риски посттрансфузионных осложнений.
Представленные примеры иллюстрируют применимость предлагаемого способа подбора оптимального криопротектора по содержанию гликогена в лейкоцитах консервированной крови. Способ дешев и может быть внедрен в практику гематологического центра, использующего трансфузии криоконсервированных компонентов крови или костного мозга.
Таким образом, благодаря использованию более чувствительного способа диагностики оптимального криопротектора по содержанию гликогена в лейкоцитах консервированной крови удается оценить эффективность и снизить риски планируемой криогемотрансфузионной терапии криопротекторного генеза.
Предлагаемое изобретение отвечает критериям «новизна» и «изобретательский уровень», так как проведенные патентно-информационные исследования не выявили источников патентной и научно-технической литературы, которые бы порочили новизну предлагаемого способа, равно как и известных способов с существенными признаками предлагаемого технического решения. Техническим результатом использования является возможность проведения индивидуального скрининга криопротекторов на доклиническом этапе их применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения оптимального криопротектора по цитохимическому показателю содержания сукцинатдегидрогеназы в лейкоцитах ауто-крови | 2017 |
|
RU2689328C1 |
| Способ выявления эффективного криопротектора по цитохимическому показателю содержания лейкоцитарной щелочной фосфатазы аутокрови | 2018 |
|
RU2676674C1 |
| Способ определения персонифицированного криопротектора по лейкоцитарной кислой фосфатазе консервированной крови | 2017 |
|
RU2689334C1 |
| Способ определения оптимального моноэндоцеллюлярного криоконсерванта для хранения клеток при -80 С | 2016 |
|
RU2624243C1 |
| Способ диагностики лекарственной аллергии | 1988 |
|
SU1601584A1 |
| КРИОПРОТЕКТОРНЫЙ РАСТВОР ДЛЯ КОНСЕРВИРОВАНИЯ ЛЕЙКОЦИТОВ ПРИ УМЕРЕННО-НИЗКОЙ ТЕМПЕРАТУРЕ (-40°C) | 2009 |
|
RU2439877C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ЛЕПРОЗНОГО ПРОЦЕССА | 2002 |
|
RU2231065C2 |
| КОМБИНИРОВАННЫЙ КРИОПРОТЕКТОРНЫЙ РАСТВОР ДЛЯ ЗАМОРАЖИВАНИЯ ТРОМБОЦИТОВ | 2012 |
|
RU2477953C1 |
| Криопротектор для цельной крови при низкотемпературной заморозке | 2024 |
|
RU2837538C1 |
| Способ определения резистентности организма | 1982 |
|
SU1121004A1 |
Изобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано для подбора оптимального криопротектора по содержанию гликогена в лейкоцитах консервированной крови. Для этого у больного до начала криогемотрансфузионной терапии получают порцию венозной крови, делят на равные части в пробирки, в одной из которых контрольная проба (КП) крови не содержит криопротектора, в другие добавляют по одной равной дозе тестируемых криопротекторов - опытные пробы (ОП). Пробирки герметизируют пробками, содержимое перемешивают на шейкере при температуре плюс 37°C в течение 4 ч, капли ОП и КП наносят в объеме 4 мкл на предметные стекла, делают 2-3 мазка, быстро высушивают на воздухе при комнатной температуре, фиксируют в 10% спирт-формалиновой смеси, окрашивают на гликоген по методу Шабадаша, лейкоциты микроскопируют в проходящем свете. Проводят сравнительное исследование среднего цитохимического коэффициента (СЦК) сегментоядерных (с/я) нейтрофилов и лимфоцитов ОП и КП; при равности показателей СЦК ОП и СЦК КП тестируемый криопротектор оценивают как оптимальный для конкретного больного и пригодный к использованию; при значениях СЦК ОП, отличных от СЦК КП, делают заключение как о непригодном к использованию криопротекторе. Изобретение обеспечивает возможность индивидуального подбора оптимального криопротектора на доклиническом этапе криогемотрансфузионной терапии. 1 табл., 3 пр.
Способ подбора оптимального криопротектора по содержанию гликогена в лейкоцитах консервированной крови, отличающийся тем, что у больного до начала криогемотрансфузионной терапии получают порцию венозной крови, делят на равные части в пробирки, в одной из которых контрольная проба (КП) крови не содержит криопротектора, в другие добавляют по одной равной дозе тестируемых криопротекторов - опытные пробы (ОП), пробирки герметизируют пробками, содержимое перемешивают на шейкере при температуре плюс 37°C в течение 4 ч, капли ОП и КП наносят в объеме 4 мкл на предметные стекла, делают 2-3 мазка, быстро высушивают на воздухе при комнатной температуре, фиксируют в 10% спирт-формалиновой смеси, окрашивают на гликоген по методу Шабадаша, лейкоциты микроскопируют в проходящем свете, проводят сравнительное исследование среднего цитохимического коэффициента (СЦК) сегментоядерных (с/я) нейтрофилов и лимфоцитов ОП и КП; при равности показателей СЦК ОП и СЦК КП тестируемый криопротектор оценивают как оптимальный для конкретного больного и пригодный к использованию; при значениях СЦК ОП, отличных от СЦК КП, делают заключение как о непригодном к использованию криопротекторе.
| СПОСОБ ПОДБОРА КРИОПРОТЕКТОРОВ ДЛЯ КРИОКОНСЕРВАЦИИ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ (ВАРИАНТЫ) | 2002 |
|
RU2236466C2 |
| КОМБИНИРОВАННЫЙ КРИОПРОТЕКТОР "ДИМЕТИЛСУЛЬФОКСИД/РЕОПОЛИГЛЮКИН" ДЛЯ КРИОКОНСЕРВАЦИИ СТВОЛОВЫХ КЛЕТОК И СПОСОБ ИХ КРИОКОНСЕРВАЦИИ ДЛЯ КЛИНИЧЕСКОГО ПРИМЕНЕНИЯ | 2014 |
|
RU2563117C1 |
| US 20180185081 A1, 05.07.2018 | |||
| KOZLOWSKA-SKRZYPCZAK M., et al.Analysis of the effect of cryoprotectant medium composition to viability of autologous hematopoietic cells collected by leukapheresis//Transplantation Proceedings 2014 46:8 (2535-2538). | |||
Авторы
Даты
2019-04-24—Публикация
2018-01-16—Подача