Изобретение относится к области биотехнологии, а именно к способу получения протеолитических ферментов - активаторов X фактора плазмы крови человека.
Активаторы X фактора используются в медицине для диагностики содержания X фактора в плазме крови человека. В свертывания крови активный фактор X - Ха является одним из компонентов протромбиназы, превращающей протромбин в тромбин. При недостатке X фактора в крови снижается активность его активированной формы, что обусловливает возникновение кровотечений с возможным летальным исходом (Shapiro, 2017). В связи с этим актуальным является диагностика содержания X фактора в крови, которую осуществляют с использованием в диагностических препаратах специфических протеиназ - активаторов X фактора, как, например, в препарате RVV-X® фирмы PENTHAPHARM (Швейцария) (Sajevic et al., 2011).
Известен способ получения активатора X фактора из яда гадюки Рассела Daboia russellii (Sajevic et al., 2011). Его недостатком является крайняя сложность получения и ограниченность яда гадюки Рассела как источника активатора X фактора.
Известны способы получения протеиназ, активирующих белки свертывания крови, в которых их продуцентами являются штаммы микромицетов Aspergillus ochraceus HP-19, Aspergillus terreus 2, Acremonium sp.(Клечковская и др., 1979; Liu et al., 2007). Недостаток этих способов состоит в том, что используемые в них штаммы не продуцируют протеиназы, обладающие активностью активаторов X фактора.
Наиболее близким к предлагаемому способу, который следует принять за ближайший аналог, является способ получения протеиназы - активатора X фактора путем засева 6-8 суточного инокулята с сусла-агара штамма Aspergillus terreus 2 - продуцента активатора X фактора и культивирования на посевной жидкой среде, содержащей сусло, глюкозу и пептон в течение 5 суток и на ферментационной среде, содержащей (в %) - глюкозу - 3,0, глицерин - 7,0, гидролизат рыбной муки - 0,5, NaNCO3 - 0,2, KH2PO4 - 0,05, MgSO4⋅7H2O - 0,05, начальный рН 5,5 в течение 5 суток, что позволяет получить культуральную жидкость, содержащую протеиназу - активатор X фактора с активностью 43,4 ед/мл, определенную по хромогенному пептидному субстрату Z-D-Arg-Gly-Arg-pNA (S-2765), где за единицу активности активатора X фактора принимают то количество фермента, которое отщепляет от Z-D-Arg-Gly-Arg-pNA (S-2765) 1 мкмоль 10-3 п-нитроанилина (pNA) за 1 мин в 1 мл при рН 8,2 и 37°С (Осмоловский и др., 2014).
Недостатками этого ближайшего аналога являются низкая активность активатора X фактора в культуральной жидкости.
Задачей настоящего изобретения является повышение выхода активатора X фактора, сокращение времени культивирования штамма-продуцента и разработка стандартных условий для его получения. Задача решается:
1. с помощью использования штамма Aspergillus ochraceus BKM F-4104D - продуцента активатора X фактора;
2. разработкой нового способа получения внеклеточных протеиназ - активаторов X фактора, предусматривающего двухстадийное культивирование продуцирующих его штаммов микроскопического гриба Aspergillus ochraceus - на посевной среде, содержащей сусло, глюкозу и пептон и ферментационной среде, содержащей глюкозу, крахмал, пептон, гидролизат рыбной муки, хлорид натрия, дигидрофосфат калия и сульфат магния, отличающуюся тем, что культивирование в посевной и в ферментационной среде проводят по 2-ое суток, и в ферментационной среде источники углерода и азота -глицерин и нитрат натрия заменяют на крахмал, пептон, добавляют хлорид натрия и в качестве источника витаминов вносят дрожжевой экстракт и устанавливают более высокое значение начального рН среды, при следующем соотношении компонентов (%):
Начальный рН 6,5.
Выделение внеклеточных ферментов с активаторным к X фактору действием из культуральной жидкости проводят известным приемом осаждения белков сульфатом аммония до степени насыщения 80%. Сформированные осадки центрифугируют, растворяют в 0,005 М Трис-HCl буфере (рН 8,2) или дистилированной воде, удаляют нерастворимую часть осадков, а для удаления солей аммония раствор диализуют при 4°С против того же буфера или проводят гель-фильтрацию на колонках с сефадексом G-25. Полученный раствор протеиназы - активатора X фактора хранят в холодильнике при 4°С или лиофилизируют для длительного хранения.
Штамм Aspergillus ochraceus BKM F-4104D выделен Кураковым А.В. на среду Чапек-агар, из образцов погребенной почвы, отобранной в Краснодарском крае (п.Сенной, раскоп древнегреческого города Фанагории).
Штамм Aspergillus ochraceus депонирован во Всероссийской Коллекции Микроорганизмов под номером BKM F-4104D.
Штамм Aspergillus ochraceus BKM F-4104D относится к митоспоровым грибам -анаморфам аскомицетного аффинитета: рода Emericella, семейства Trichocomaceae, порядка Eurotiales, класса Eurotiomycetes, отдела Ascomycota.
Культурально-морфологические признаки.
Штамм Aspergillus ochraceus BKM F-4104D имеет типичные для этого вида культурально-морфологические признаки. Колонии на средах Чапека и сусло-агаре достигают среднем 3,5 см в диаметре на 10 сут, плоские, бархатистые, ярко-охристого цвета, с мелкими каплями эксудата. Обратная сторона красновато-коричневых тонов. Конидиальные головки шаровидные, при старении распадаются на 2-4 компактные колонки светло-охристо-коричневого цвета. Конидиеносец двуярусный с плотно расположенными по всей везикуле метулами (15-20×5-6 мкм) и фиалидами размером (7-13×2-3) мкм. Конидиеносцы диаметром 7-9 мкм, гладкие, неокрашенные до желтоватых тонов, расширение конидиеносца округлое, конидии округлые, гладкие, 3,0-3,5 мкм.
Физиолого-биохимические признаки.
Штамм хорошо растет на стандартных средах: сусло-агаре, среде Чапека, среде Гетчинсона, глюкозо-пептонной среде при температуре 25°С.Спороношение штамм начинает на 4-5 сут, обильно спороносящие колонии формирует к 10 суткам. Штамм термотолерантный, способен расти в интервале температур 8°С - 42°С.Споры сохраняют жизнеспособность при прогревании в почве в течение нескольких часов при температуре 60°С.На питательных средах растет в широком диапазоне рН, включая кислую (до рН 2,5-3,0) и слабощелочную область (рН 7-9) Штамм обладает протеолитической (казеннолитической), целлюлозолитической и ксиланазной (гидролизует целлюлозу, гемицеллюлозу) и липолитической активностью. Штамм BKM F-4104D является продуцентом активатора протеина С (патент РФ 2461614).
Штамм поддерживают на косяках с сусло-агаром 4-5°Б с начальным рН 6,0-6,2 или стандартной среде Чапек-агар при комнатной температуре с пересевом через 1-3 месяца, а при хранении при 5°С с пересевом через 6-12 месяцев.
Штамм Aspergillus ochraceus BKM F-4104D является непатогенным и нетоксичным микроорганизмом. При внутривенном заражении кроликов не проявляет зоопатогенных свойств. При нанесении экстракта культуры штамма на кожу кролика не вызывает токсической реакции.
Пример 1.
Инокулят Aspergillus ochraceus BKM F-4104D выращивают в пробирках скошенного сусло-агара 4-5° Балинга. Для засева посевной среды используют хорошо заспоровавшуюся культуру 6-8-ми суточного возраста. Споры смывают с поверхности агара стерильной посевной средой, содержащей сусло, глюкозу и пептон в эту же среду. Засеянные колбы выращивают на качалке с 200 об/мин при 28°С.Спустя 2 суток часть выращенного материала (10% от объема) переносят в колбы объемом 750 мл со 100 мл ферментационной среды следующего состава (в %):
Начальный рН 6,5
По истечении 2-х суток культивирования, мицелий отделяют от среды фильтрованием через бумажный фильтр.
Далее проводят осаждение ферментов культуральной жидкости сульфатом аммония до степени насыщения 80%. Сформированные осадки центрифугируют, растворяют в 0,005 М Трис-HCl буфере (рН 8,2) и диализуют при 4°С против этого же буфера.
Активаторную активность полученного раствора белков культуральной жидкости к фактору X определяют по рекомендуемым методом с использованием хромогенного субстрата Z-D-Arg-Gly-Arg-pNA (S-2765) (Осмоловский и др., 2014). Инкубируют 200 мкл пробы A. ochraceus F-4104D с 50 мкл разведенной в 2 раза 0.05М Трис-HCl буфером рН 8,2 донорской плазмы крови в течение 5 мин на термошейкере при температуре 37±0.1°С.По истечении 5 мин в смесь вносили 100 мкл хромогенного субстрата Z-D-Arg-Gly-Arg-pNA (S-2765), с концентрацией 0,5 мг/ мл и продолжали инкубацию еще в течение 5 мин. Реакцию останавливали добавлением 200 мкл 50% уксусной кислоты. Количество высвободившегося n-нитроанилина определяли спектрофотометрически. В контроле вместо испытуемого раствора используют эквивалентное количество физиологического раствора (0,86%-ный раствор хлорида натрия). Повторность - 3-х кратная. За единицу активности активатора X фактора принимают то количество фермента, которое отщепляет 1 мкмоль⋅10-3 п-нитроанилина (pNA) от Z-D-Arg-Gly-Arg-pNA (S-2765) за 1 мин в 1 мл при рН 8,2 и 37°С.
Активность раствора белков культуральной жидкости штамма Aspergillus ochraceus BKM F-4104D 45,2 ед/ мл. Коэффициент вариации данных в измерениях активности в примере 1 и последующих примерах не превышает 3%.
Пример 2
Культуральную жидкость штамма Aspergillus ochraceus BKM F-4104D получают по примеру 1, но используют питательную среду следующего состава (в %):
Начальный рН 6,5
В культуральной жидкости обнаруживают активаторную к X фактору активность 44,3 ед/мл.
Пример 3
Культуральную жидкость штамма Aspergillus ochraceus BKM F-4104D получают по примеру 1, но используют питательную среду следующего состава (в %):
Начальный рН 5,5
В культуральной жидкости обнаруживают активаторную к X фактору активность 42,9 ед/мл.
Пример 4
Культуральную жидкость штамма Aspergillus ochraceus BKM F-4104D получают по примеру 1, но используют питательную среду следующего состава (в %):
Начальный рН 7,0
В культуральной жидкости обнаруживают активаторную к X фактору активность 43,2 ед/мл.
Данные по активаторной к X фактору активности культуральной жидкости штамма А. ochraceus BKM F-4104D в примерах 2, 3 и 4 показывают, что она максимальна при начальном рН 6,5 ферментационной среды.
Пример 5.
Культуральную жидкость штамма Aspergillus ochraceus BKM F-4104D получают по примеру 1, но используют питательную среду следующего состава (в %):
Начальный рН 6,5
В культуральной жидкости обнаруживают активаторную к X фактору активность 51,6 ед/мл.
Пример 6.
Культуральную жидкость штамма Aspergillus ochraceus BKM F-4104D получают по примеру 1, но используют питательную среду следующего состава (в %):
Начальный рН 6,5
В культуральной жидкости обнаруживают активаторную к X фактору активность 47,8 ед/мл.
В таблице 1 приводятся данные примеров 1, 2, 5 и 6 и последующих определений активаторной к X фактору активности культуральной жидкости штамма A. ochraceus BKM F-4104D при различной концентрации компонентов в ферментационной среде и начальном значении рН 6,5.
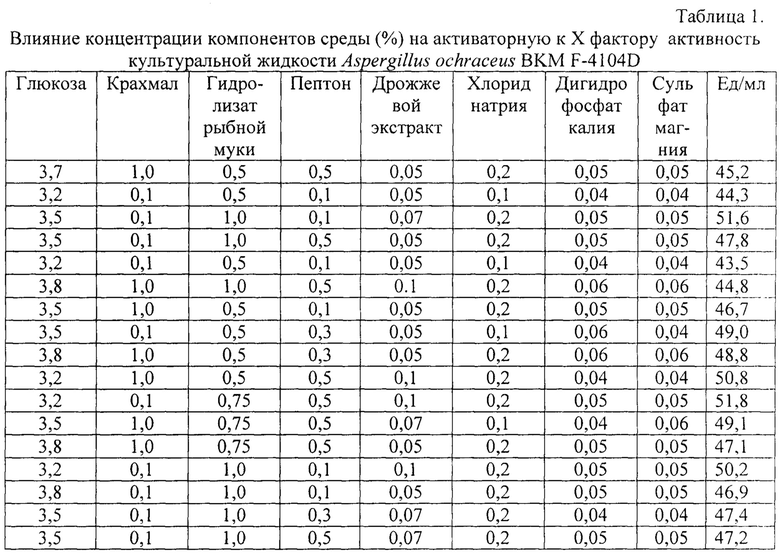
- коэффициент вариации данных - 3%.
Пример 7.
Сравнение предлагаемого способа и ближайшего аналога
Сравнение активаторной к X фактору активности в культуральной жидкости (КЖ) по предлагаемому способу с использованием штамма Aspergillus ochraceus BKM F-4104D и ферментационной среде с начальным рН 6,5, содержащей (в %)
и в культуральной жидкости полученной по способу аналогу со штаммом Aspergillus terreus 2, показывает, что по предлагаемому способу получают более высокую активаторную к X фактору активность (на 25%). Определение активности проводят согласно примеру 1. При других соотношениях компонентов среды (табл. 1) получают также более высокую активность (в среднем на 8-12%) культуральной жидкости при выращивании штамма в ферментационной среде уже на 2 сут, а не на 5 сут как по способу аналогу (табл. 2).

Коэффициент вариации данных - 2%.
Таким образом, предлагаемый способ позволяет получить культуральную жидкость с более высокой активностью протеиназы - активатора X фактора и сократить в несколько раз (до 3 раз) продолжительность ферментации.
Литература:
1. Sajevic Т, Leonardi A,  I. Haemostatically active proteins in snake venoms. Toxicon, 2011, v. 57, №5, p. 627-45. DOI: 10.1016/j.toxicon.2011.01.006
I. Haemostatically active proteins in snake venoms. Toxicon, 2011, v. 57, №5, p. 627-45. DOI: 10.1016/j.toxicon.2011.01.006
2. Shapiro A. Plasma-derived human factor X concentrate for on-demand and perioperative treatment in factor X-deficient patients: pharmacology, pharmacokinetics, efficacy, and safety. Expert Opin. Drug Metab. Toxicol., 2017, v. 13, №l, p. 97-104.
3. Осмоловский А.А., Кураков А.В., Крейер В.Г., Баранова Н.А., Егоров Н.С.Штамм Aspergillus ochraceus Wilhelm - продуцент протеиназы - активатора протеина С плазмы крови. Патент РФ №2461614. Приоритет от 9.03.2011, выдан 20.09.2012.
4. Осмоловский А.А., Звонарева Е.С., Крейер В.Г, Баранова Н.А., Егоров Н.С. Воздействие внеклеточных протеаз микромицетов рода Aspergillus на белки системы гемостаза. Биоорганическая химия, 2014, т. 40, №6, с. 688-694.
5. Клечковская В.В., Отрошко Т.А., Егоров Н.С. Протеолитические ферменты, образуемые Aspergillus ochraceus в связи с их плазмокоагулирующей и фибринолитической активностями. Микробиология, 1979, т. 47, №5, с. 820-826.
6. Liu Ch., Matsushita Ya., Shimizu К., Makimura К., Hasumi К. Activation of prothrombin by two subtilisin-like serine proteases from Acremonium sp.. Biochemical and Byophisical Research Communication, 2007, v. 358, p. 356-362.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ТВЕРДОФАЗНОГО КУЛЬТИВИРОВАНИЯ Aspergillus ochraceus ДЛЯ ПОЛУЧЕНИЯ ПРОТЕИНАЗЫ - АКТИВАТОРА ПРОТЕИНА С ПЛАЗМЫ КРОВИ | 2013 |
|
RU2535872C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТЕИНАЗЫ - АКТИВАТОРА ПРОТЕИНА С ПЛАЗМЫ КРОВИ | 2011 |
|
RU2468081C2 |
| ШТАММ ASPERGILLUS OCHRACEUS - ПРОДУЦЕНТ ПРОТЕИНАЗЫ - АКТИВАТОРА ПРОТЕИНА С ПЛАЗМЫ КРОВИ ЧЕЛОВЕКА | 2011 |
|
RU2461614C2 |
| ШТАММ ASPERGILLUS OCHRACEUS - ПРОДУЦЕНТ ПРОТЕИНАЗЫ - АКТИВАТОРА ПРОТЕИНА С ПЛАЗМЫ КРОВИ ЧЕЛОВЕКА | 2011 |
|
RU2460772C2 |
| ШТАММ ASPERGILLUS OCHRACEUS - ПРОДУЦЕНТ ПРОТЕИНАЗЫ - АКТИВАТОРА ПРОТЕИНА С ПЛАЗМЫ КРОВИ ЧЕЛОВЕКА | 2011 |
|
RU2461615C2 |
| Способ получения протеиназ с фибринолитической и фибриногенолитической активностями | 2016 |
|
RU2664468C2 |
| ШТАММ ASPERGILLUS OCHRACEUS - ПРОДУЦЕНТ ПРОТЕИНАЗЫ - АКТИВАТОРА ПРОТЕИНА С ПЛАЗМЫ КРОВИ ЧЕЛОВЕКА | 2011 |
|
RU2461616C2 |
| ШТАММ SAROCLADIUM STRICTUM - ПРОДУЦЕНТ ФИБРИНОЛИТИЧЕСКИХ ФЕРМЕНТОВ С АКТИВАТОРНОЙ К ПЛАЗМИНОГЕНУ АКТИВНОСТЬЮ | 2019 |
|
RU2728456C1 |
| ШТАММ ASPERGILLUS CLAVATUS - ПРОДУЦЕНТ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ С КЕРАТИНОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 2021 |
|
RU2774366C1 |
| Способ лечения катарального мастита у коров | 2021 |
|
RU2768608C1 |
Изобретение относится к биотехнологии, а именно к способу получения протеолитических ферментов - активатора X фактора плазмы крови человека. Способ получения протеиназы - активатора X фактора плазмы крови предусматривает культивирование штамма микроскопического гриба Aspergillus ochraceus BKM F-4104D, продуцирующего активатор X фактора на питательной среде при начальном значении рН 6,5, содержащей глюкозу, крахмал, гидролизат рыбной муки, пептон, дрожжевой экстракт, NaCl, KH2PO4, MgSO4⋅7H2O и воду при заданном соотношении компонентов, с последующим выделением протеиназы с активатором к X фактору путем осаждения белков сульфатом аммония из культуральной жидкости. Полученный осадок центрифугируют, растворяют в буфере (рН 8,2) или дистиллированной воде и удаляют нерастворимую часть осадка. Осуществляют диализ при 4°С против того же буфера или проводят гель-фильтрацию на колонках с сефадексом G-25 с получением раствора протеиназы с последующей лиофильной сушкой при необходимости. Изобретение позволяет повысить выход активатора Х фактора. 2 табл., 7 пр.
Способ получения протеиназы - активатора X фактора плазмы крови путем культивирования штамма микроскопического гриба рода Aspergillus, отличающийся тем, что используют штамм Aspergillus ochraceus BKM F-4104D, продуцирующий активатор X фактора, и процесс ферментации ведут на питательной среде при начальном значении pH 6,5 и следующем составе компонентов (%):
| ОСМОЛОВСКИЙ А.А., ЗВОНАРЕВА Е.С., КРЕЙЕР В.Г | |||
| и др | |||
| Воздействие внеклеточных протеаз микромицетов рода Aspergillus на белки системы гемостаза, Биоорганическая химия, 2014, т | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Колосниковая решетка с охлажденными водой колосниками | 1925 |
|
SU688A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТЕИНАЗЫ - АКТИВАТОРА ПРОТЕИНА С ПЛАЗМЫ КРОВИ | 2011 |
|
RU2468081C2 |
| ОСМОЛОВСКИЙ А.А., КРЕЙЕР В.Г | |||
| и др | |||
| Микромицеты Aspergillus ochraceus - продуценты внеклеточных протеиназ - активаторов протеина С плазмы крови, Прикладная биохимия и микробиология, 2012, т | |||
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
| Кухонный очаг | 1922 |
|
SU537A1 |
| ШТАММ ASPERGILLUS OCHRACEUS - ПРОДУЦЕНТ ПРОТЕИНАЗЫ - АКТИВАТОРА ПРОТЕИНА С ПЛАЗМЫ КРОВИ ЧЕЛОВЕКА | 2011 |
|
RU2461614C2 |
| ОСМОЛОВСКИЙ А.А | |||
| Антикоагуляторная протеиназа (активатор протеина С) микромицета Aspergillus ochraceus: получение и свойства, Автреф | |||
| дисс | |||
| на соискание ученой степени кандидата биологических наук, М., 2013, с | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Способ получения экзогенного активатора протеина С | 1988 |
|
SU1565889A1 |
Авторы
Даты
2019-05-13—Публикация
2017-11-21—Подача