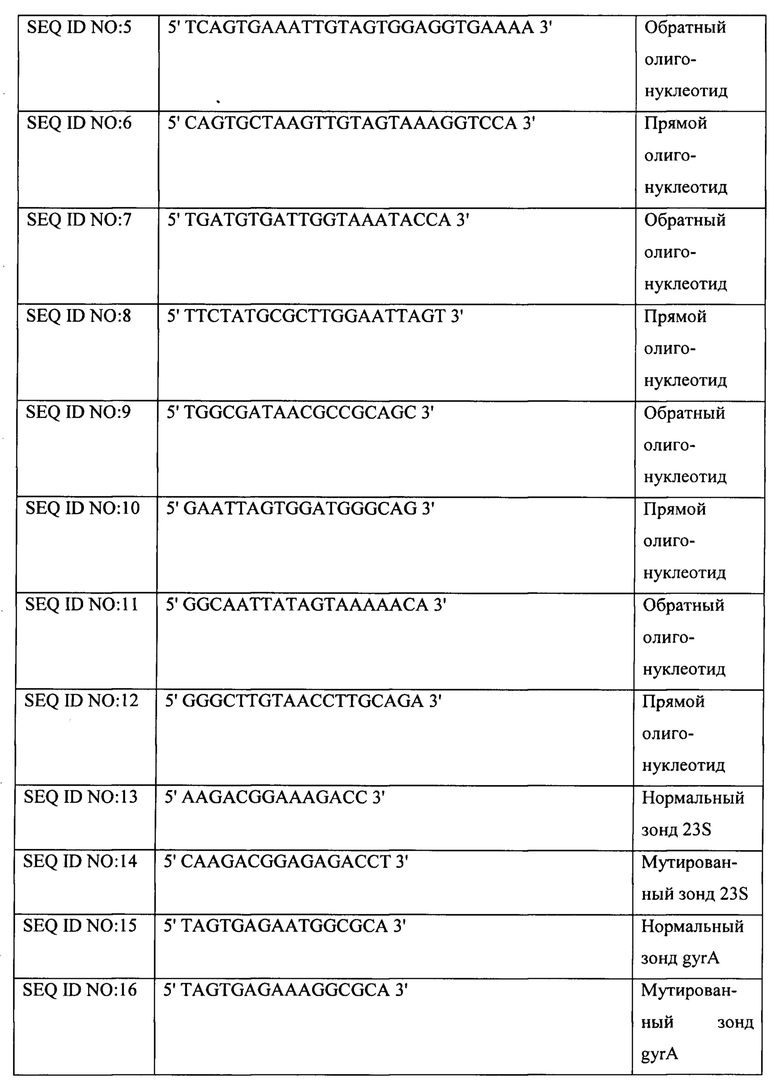
Область изобретения
Настоящее изобретение относится к способу определения Helicobacter pylori in vitro в биологическом образце, выделенном от индивида. Кроме того, способ по настоящему изобретению также позволяет определять резистентность Helicobacter pylori к антибиотикам.
Еще один аспект настоящего изобретения относится к набору для осуществления указанного способа.
Предшествующий уровень техники
Helicobacter pylori (Hp) представляет собой микроаэрофильную ацидофильную грамотрицательную бактерию со жгутиками, принадлежащую к роду Helicobacter.
В настоящее время Hp является бактерией, колонизирующей желудок приблизительно у половины людей во всем мире, и ее рассматривают как этиопатогенетический фактор при пептических язвах и MALT-лимфоме (лимфома, развивающаяся из лимфоидной ткани, ассоциированной со слизистыми оболочками (mucosa-associated lymphoid tissue)), фактор риска развития аденокарциномы желудка и фактор, ассоциированный с прочими заболеваниями желудка и других органов.
Хорошо известно, что инфекция Hp коррелирует в большей степени с низким социально-экономическим положением, а не с расовой принадлежностью. Фактически, инфекция Hp очень широко распространена в развивающихся странах. Пути передачи этой бактерии до сих пор не известны; тем не менее, наиболее вероятным представляется оральный или фекально-оральный путь.
Способы диагностики инфекции Hp можно классифицировать следующим образом: (1) инвазивные способы, в частности эндоскопия с биопсией и последующим анализом слизистой оболочки желудка; и (2) неинвазивные способы, например, дыхательный тест, определение антигена в кале или определение антител в крови.
Одним из наиболее распространенных неинвазивных способов является уреазный дыхательный тест (UBT). Способ включает прием пациентом напитка, содержащего мочевину, меченную радиоактивным изотопом углерода. В присутствии Hp уреаза катализирует распад мочевины, в результате которого происходит образование и высвобождение аммиака и меченого диоксида углерода с выдыхаемым воздухом. Если анализ воздуха, выдыхаемого индивидом, подтверждает присутствие меченого СО2, тест положителен и, таким образом, индивида считают Нр-инфицированным.
Серологические анализы включают поиск антител IgG, направленных против Hp. Тем не менее, эти анализы не позволяют отличить активную инфекцию от предшествующей инфекции Hp. Поэтому они не идеальны для мониторинга эффективности терапии или даже в качестве последующего анализа для подтверждения эрадикации.
Еще один минимально инвазивный способ основан на анализе антигена в кале (HpSA). В данном случае проводят иммуноферментный анализ образца кала индивида.
Этот способ действительно является альтернативой дыхательному тесту, но характеризуется низкой чувствительностью и специфичностью, особенно в тех случаях, когда желательно оценить эффективность терапии.
Что касается терапии, направленной на эрадикацию инфекции Hp, наиболее распространенные варианты включают прием ингибиторов протонной помпы (PPI) вместе с антибиотиками.
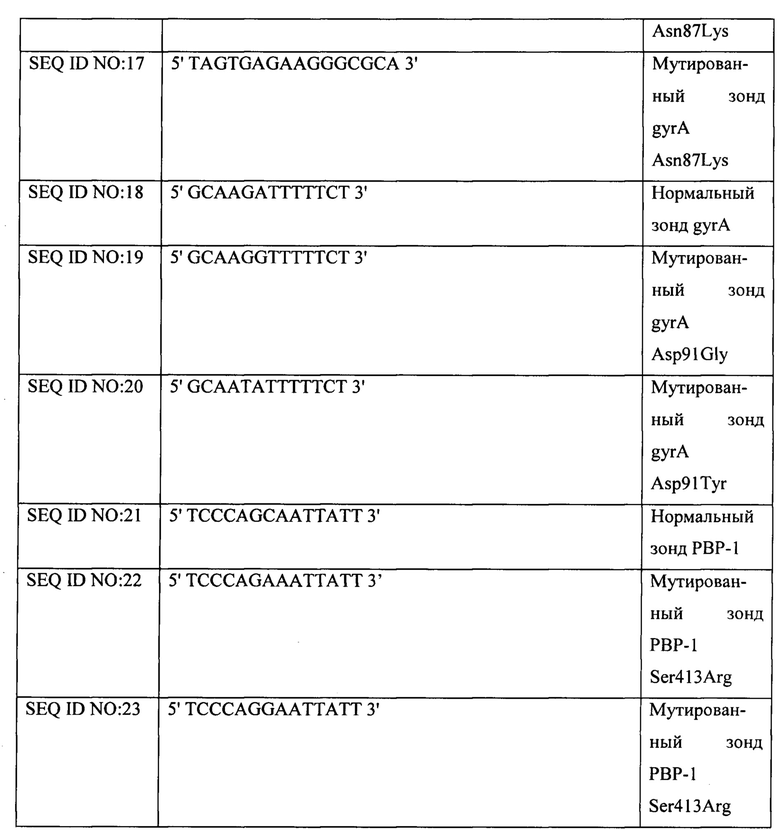
В частности, терапия первой линии (линия I) фактически состоит в тройной терапии, предусматривающей прием PPI и кларитромицина в течение 14 суток с последующим приемом PPI, кларитромицина и амоксициллина или левофлоксацина и метронидазола в течение 7-10 суток. Альтернативно есть последовательная терапия; она предусматривает прием амоксициллина, 1 грамм, х2, и PPI в течение 5 суток и затем, в течение последующих 5 суток, прием кларитромицина, 500 мг, х2, PPI и тинидазола, 500 мг, х2.
К сожалению, резистентность к антибиотикам является наиболее важным фактором, снижающим эффективность этих способов терапии. В частности, широкое применение кларитромицина для лечения респираторных заболеваний, а также гинекологических и паразитарных инфекций повысило первичную резистентность к этому антибиотику.
Кларитромицин, как и все макролиды, оказывает свое антибактериальное действие, связываясь с 50S-субъединицей бактериальной рибосомы. Это связывание препятствует перемещению пептида из А-сайта в Р-сайт рибосомы (блокируя фермент транслоказу) и ингибирует элонгацию пептидной цепи (блокируя фермент трансферазу).
Резистентность к левофлоксацину и амоксициллину встречается также довольно часто.
Левофлоксацин часто применяют для эрадикации Hp ввиду его роли в схемах «терапии второй линии» в случаях неэффективности лечения на основе кларитромицина. Фторхинолоны оказывают дозозависимый антибактериальный эффект, связываясь с А-субъединицей ДНК-гиразы (топоизомеразы II), фермента, необходимого для поддержания спиральной структуры ДНК. У чувствительных штаммов левофлоксацин блокирует синтез ДНК, а в высоких дозах также синтез РНК.
Амоксициллин представляет собой аминопенициллин, активность которого сходна с ампициллином, характеризующийся хорошей стабильностью в кислых условиях желудка и большей, чем у пенициллина и ампициллина, биодоступностью при пероральном приеме. Как и пенициллины, амоксициллин действует на клеточную стенку бактерий, препятствуя образованию перекрестных сшивок (транспептидации), необходимых для придания клеточной стенке жесткости. Он образует стабильный неактивный комплекс с транспептидазой, ферментом, обеспечивающим транспептидацию. Спектр действия амоксициллина включает как грамположительных, так и грамотрицательных бактерий, у которых существует три основных механизма резистентности:
(1) образование ферментов бета-лактамаз, которые инактивируют антибиотик, размыкая его бета-лактамное кольцо;
(2) снижение проницаемости бактерий для молекул антибиотика; и
(3) модификация белков, связывающихся с амоксициллином, или пенициллин-связывающих белков (РВР).
Амоксициллин был первым антибиотиком, использованным для эрадикации Hp, и в настоящее время его все еще применяют в распространенных схемах терапии благодаря относительно низкой частоте резистентности к нему.
В свете изложенного выше, сохраняется острая потребность в методиках, позволяющих определять Helicobacter pylori, то есть методиках, позволяющих диагностировать инфекцию, вызванную этой бактерией, у индивида, являющихся неинвазивными, экономически эффективными, быстрыми и диагностически точными. В частности, есть острая потребность в способах, позволяющих определять присутствие Helicobacter pylori в образце и одновременно оценивать резистентность этой бактерии к антибиотикам.
Заявитель нашел решение, позволяющее удовлетворить описанные выше потребности, в виде способа, осуществляемого in vitro с использованием биологического образца, выделенного от индивида, и обеспечивающего молекулярный анализ, предпочтительно генотипирование, области, содержащей сайты мутаций генов Helicobacter pylori, которые при мутировании ответственны за резистентность к антибиотикам, обычно используемым в терапии, направленной на борьбу с инфекцией, вызванной этой бактерией, предпочтительно кларитромицину, левофлоксацину и амоксициллину.
Действительно, заявитель неожиданно обнаружил, что способ, описанный ниже, очень надежен по сравнению с доступными в настоящее время неинвазивными способами, которые характеризуются низкой специфичностью из-за большого числа ложноположительных результатов.
Особенным преимуществом способа по настоящему изобретению является то, что помимо определения присутствия Hp в биологическом образце, то есть наличия инфекции, вызванной данной бактерией, он одновременно позволяет определять наличие у выявленного штамма Hp мутации, ответственной за резистентность к одному из антибиотиков, используемых в эрадикационной терапии. Таким образом, применение способа, разработанного заявителем, позволяет посредством одного неинвазивного, быстрого, высокочувствительного и специфичного анализа определить как наличие инфекции Hp, так и резистентность этой бактерии к антибиотикам, предпочтительно ее резистентность к кларитромицину, левофлоксацину и амоксициллину.
Таким образом, способ по настоящему изобретению обладает серьезными преимуществами с терапевтической точки зрения, поскольку, начиная с самых ранних стадий, позволяет проводить пациенту наиболее подходящее лечение с целью эрадикации рассматриваемой бактерии. Иными словами, начиная с самых ранних стадий, пациент будет получать индивидуальную терапию с большей терапевтической эффективностью.
Способ по настоящему изобретению также обладает преимуществами с точки зрения организации здравоохранения, поскольку позволит избежать неоправданных расходов, связанных со способами лечения, применяемыми для эрадикации рассматриваемой бактерии в настоящее время, которые основаны на фактически предпринятых попытках эрадикации с применением различных доступных вариантов лекарственной терапии.
Таким образом, объект настоящего изобретения относится к способу определения/мониторинга Helicobacter pylori и/или, в частности, определения резистентности Helicobacter pylori к антибиотикам, обычно используемым в терапевтических целях, определенному в независимых пунктах приложенной формулы изобретения.
Кроме того, объект настоящего изобретения также относится к набору для осуществления способа, определенного в независимых пунктах приложенной формулы изобретения.
Предпочтительные аспекты способа и набора по настоящему изобретению определены в зависимых пунктах приложенной формулы изобретения.
Дополнительные признаки и преимущества изобретения станут более очевидны из последующего подробного описания и следующих за ним наглядных неограничивающих примеров, которые также ссылаются на приложенные графические материалы, где:
на Фиг. 1 представлена диаграмма проведения стадии амплификации способа по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу, осуществляемому in vitro с использованием биологического образца, выделенного от индивида, для определения или также для мониторинга, присутствия Helicobacter pylori (Hp) в указанном образце и/или для определения резистентности Hp по меньшей мере к одному антибиотику, где указанный способ включает следующие стадии:
(1) получение биологического образца, выделенного от индивида;
(2) очистку (выделение) ДНК из указанного образца; и
(3) амплификацию по меньшей мере одной части гена Hp, содержащей по меньшей мере один нуклеотидный сайт, который, когда мутирован, ответственен за резистентность к указанному антибиотику, где указанную амплификацию проводят посредством полимеразной цепной реакции (PCR), предпочтительно PCR в реальном времени, с использованием по меньшей мере одной пары олигонуклеотидов (пары праймеров) и по меньшей мере двух олигонуклеотидных зондов, где пара праймеров гибридизуется с областью нуклеиновой кислоты, охватывая указанный сайт мутации с двух сторон, где указанные олигонуклеотидные зонды мечены двумя разными маркерами, и где по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении по меньшей мере одной части гена Hp, содержащей по меньшей мере один нормальный сайт (то есть комплементарен нормальному/немутантному аллелю указанного гена) и по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении по меньшей мере одной части гена Hp, содержащей по меньшей мере один мутированный сайт, ответственный за резистентность к указанному антибиотику (то есть комплементарен мутантному аллелю указанного гена) (см. Фиг. 1);
(4) количественное определение амплифицированной нормальной и/или мутированной ДНК посредством измерения уровней двух маркеров, где:
- отсутствие амплифицировалнной ДНК указывает на отсутствие Hp в образце;
- присутствие только маркера, которым мечен зонд, комплементарный и специфичный в отношении аллеля дикого типа указанного гена, указывает на нормальный гомозиготный генотип и, таким образом, присутствие указанной Hp, нерезистентной к указанному антибиотику;
- присутствие только маркера, которым мечен зонд, комплементарный и специфичный в отношении мутированного аллеля указанного гена, указывает на мутированный гомозиготный генотип и, следовательно, присутствие указанной Hp, резистентной к указанному антибиотику; и
- присутствие обоих маркеров указывает на гетерозиготный генотип с аллелем дикого типа и мутированным аллелем указанного гена и, таким образом, присутствие указанной Hp, резистентной к указанному антибиотику.
На Фиг. 1 представлена схема стадии (3); фактически, пара из прямого и обратного праймеров охватывает сайт, ответственный, когда мутирован, за резистентность к антибиотику, с двух сторон (на каждой цепи ДНК). Эта пара позволяет амплифицировать область гена Hp, содержащую сайт мутации, являющейся причиной резистентности к антибиотику. Пару зондов выбирают таким образом, что один из них специфично гибридизуется с областью нормального, то есть немутированного гена (дикого типа), а другой гибридизуется с областью гена, содержащей мутацию. Эти два зонда мечены двумя разными маркерами таким образом, что выявление одного маркера или обоих маркеров позволяет определить генотип Hp. Очевидно, что при отсутствии бактерии в образце амплификации не будет, поскольку праймеры не найдут ДНК для гибридизации. Выявление, проводимое на стадии (4), позволяет определять генотип любой Hp, присутствующей в указанном образце, при этом указанный генотип является нормальным гомозиготным при отсутствии мутации в амплифицированной части гена, мутантным гомозиготным при наличии мутации в амплифицированной части гена или гетерозиготным, если амплифицированная часть гена является наполовину немутированной и наполовину мутированной.
Таким образом, присутствие амплифицированного продукта указывает на присутствие Hp в указанном биологическом образце и, таким образом, на наличие инфекции Hp, в то время как генотипирование, описанное выше, позволяет определить, является ли бактерия резистентной к по меньшей мере одному антибиотику.
Антибиотики, рассматриваемые в настоящем изобретении, представляют собой антибиотики, обычно используемые, по отдельности или в комбинации, с целью терапевтического лечения инфекции Hp. Предпочтительно антибиотик выбран из группы, состоящей из кларитромицина, левофлоксацина, амоксициллина, метронидазола, тинидазола, тетрациклина, рифабутина и их комбинаций. Для задач настоящего изобретения предпочтительные антибиотики выбраны из кларитромицина, левофлоксацина, амоксициллина и их комбинаций, наиболее предпочтительно кларитромицина.
В контексте настоящего изобретения резистентность к антибиотикам обозначает механизм, посредством которого бактерия, в данном случае Hp, становится резистентной к антибиотику или группе антибиотиков, используемых в эрадикационной терапии. Рассматриваемые антибиотики представляют собой антибиотики, указанные выше.
Таким образом, способ по настоящему изобретению позволяет проводить определение/мониторинг инфекции Hp у индивида и одновременно определять резистентность любого определенного/мониторируемого штамма Hp к антибиотикам. Соответственно, способ по настоящему изобретению также позволяет определять патологии, связанные с инфекцией Hp, в первую очередь патологии, поражающие желудочную систему, предпочтительно гастрит, пептическую язву, рак желудка или MALT-лимфому, диспепсию, железодефицитную анемию, идиопатическую тромбоцитопеническую пурпуру и патологии других, помимо желудка и двенадцатиперстной кишки, органов.
В предпочтительном воплощении изобретения способ осуществляют с использованием образца кала, выделенного от индивида.
Забор образца кала может быть произведен самим индивидом, то есть, стадия (1) способа может быть проведена индивидом самостоятельно.
Обычно забор образца кала может быть произведен с использованием любого устройства, подходящего для сбора кала. Предпочтительно устройство включает часть, предназначенную для сбора кала и его солюбилизации в солюбилизационной камере, содержащей солюбилизатор. Солюбилизатор предпочтительно представляет собой солевой раствор, такой как PBS (забуференный фосфатом физиологический раствор). Солюбилизация позволяет гомогенизировать образец кала, и ее предпочтительно проводят/осуществляют посредством интенсивного встряхивания образца, например, на вихревой мешалке, на протяжении нескольких секунд (приблизительно 30 секунд).
Кал обычно собирают щеткой, подходящей для сбора нужного количества кала для осуществления способа по настоящему изобретению. В частности, количество, которое необходимо собрать для осуществления способа по изобретению (то есть количество исходного материала для данного способа) составляет от 150 до 250 миллиграмм (мг); предпочтительно оно составляет приблизительно 200 мг кала.
Для осуществления способа по настоящему изобретению рекомендуется солюбилизировать от 150 до 250 мг, предпочтительно приблизительно 200 мг кала приблизительно в 1 мл солюбилизатора.
Солюбилизационная камера отделена от сборной камеры, предпочтительно посредством фильтрующего элемента. При этом солюбилизированный кал может проходить, например, под действием гравитации, через фильтр в сборную камеру. Часть солюбилизированного кала, частицы которого больше пор фильтра, не будет проходить в сборную камеру. Профильтрованный кал можно собрать из сборной камеры, предпочтительно через проницаемую мембрану, например, с использованием шприца.
Для задач настоящего изобретения размер пор фильтрующего элемента предпочтительно составляет от 100 до 200 микрон (мкм), более предпочтительно от 100 до 150 мкм, еще более предпочтительно от 105 до 120 мкм, и, еще более предпочтительно, он составляет приблизительно 106 мкм. Таким образом, размер частиц в солюбилизированной/профильтрованной фракции кала, которая будет проходить через фильтр, будет составлять 100-200 мкм или менее, предпочтительно 100-150 мкм или менее, более предпочтительно 105-120 мкм или менее, более предпочтительно приблизительно 106 мкм или менее.
После получения биологического образца от индивида или после солюбилизации и/или фильтрования кала, как описано выше, биологический образец или солюбилизированный/профильтрованный кал (далее - образец) будут подвергать стадии (2) рассматриваемого способа.
ДНК экстрагируют из образца с применением способов, которые обычно известны каждому специалисту в данной области применительно к данной конкретной задаче. Для задач настоящего изобретения предпочтительный способ экстрагирования включает использование фенол-хлороформного раствора, предпочтительно в отношении 1:1 с образцом, подлежащим обработке.
В частности, способ экстрагирования по настоящему изобретению включает стадию добавления тризола к образцу. Предпочтительно соотношение тризола и образца составляет 1:1. Затем смесь тризола и образца предпочтительно равномерно перемешивают в течение нескольких секунд, например, на вихревой мешалке.
Затем к смеси тризола и образца предпочтительно добавляют хлороформ. Предпочтительно добавление хлороформа в количестве, равном 1/10 объема смеси тризола и образца.
Предпочтительно смесь тризола, образца и хлороформа равномерно перемешивают в течение нескольких секунд, например, на вихревой мешалке.
Предпочтительно, после равномерного перемешивания смесь тризола, образца и хлороформа разделяют на слои, предпочтительно центрифугированием. Центрифугирование рекомендуется проводить при 10000-14000 g, предпочтительно приблизительно при 2000 g, предпочтительно на протяжении приблизительно 10 минут. Предпочтительно разделение на слои проводят при низкой температуре, более предпочтительно при приблизительно 4°С.
В конце разделения смеси тризола, образца и хлороформа на слои обычно получают 3 фазы: водную фазу, промежуточную фазу и фенольную фазу.
Для задач настоящего изобретения водную фазу предпочтительно удалить.
Таким образом, осаждение ДНК проводят из оставшейся части смеси, то есть из промежуточной фазы и фенольной фазы, представляющих органическую фазу.
Осаждение предпочтительно проводят, добавляя в органическую фазу спирт, такой как этанол, более предпочтительно 100%-ный этанол.
Затем предпочтительно получают осадок из осажденной ДНК, например, центрифугированием. Предпочтительными условиями центрифугирования являются приблизительно 2000 g на протяжении нескольких минут, предпочтительно при низкой температуре, например при приблизительно 4°С.
Поле осаждения ДНК (фактически образования осадка ДНК) предпочтительно удалить поверхностную фазу и осажденную ДНК обрабатывают, предпочтительно по меньшей мере один раз, более предпочтительно 2-3 раза, раствором соли, такой как цитрат натрия (эта стадия является своего рода отмывкой осадка ДНК). Эту стадию предпочтительно проводят при комнатной температуре, более предпочтительно на протяжении приблизительно 30 минут.
После каждой обработки раствором соли проводят стадию получения осадка из осажденной ДНК, предпочтительно центрифугированием, например при приблизительно 2000 g на протяжении нескольких минут, предпочтительно при низкой температуре (например, приблизительно 4°С).
Затем осажденную ДНК предпочтительно обрабатывают спиртом, таким как этанол, предпочтительно 75%-ным этанолом. Указанную обработку предпочтительно проводят на протяжении приблизительно 20-30 минут, более предпочтительно при комнатной температуре.
По завершении обработки спиртом предпочтительно получают осадок из осажденной ДНК, например, центрифугированием при приблизительно 2000 g на протяжении нескольких минут, предпочтительно при низкой температуре (например, приблизительно 4°С).
Затем осажденную ДНК предпочтительно высушивают, позволяя спирту полностью испариться.
Высушенную ДНК предпочтительно ресуспендируют в щелочном растворе, более предпочтительно в NaOH (например, 8 мМ NaOH).
В конце стадии (I) предпочтительно провести завершающую стадию центрифугирования на максимальной скорости (приблизительно 14000 g) на протяжении приблизительно десяти минут, предпочтительно при комнатной температуре. Отбирают супернатант (то есть неосажденную часть) и добавляют в нее буфер, например, HEPES-EDTA (2-[4-(2-гидроксиэтил)пиперазин-1-ил]этансульфоновая кислота -этилендиаминтетрауксусная кислота) предпочтительно при рН 7-8.
Перед использованием ДНК на последующей стадии (III) рекомендуется провести количественную и/или качественную оценку ДНК, очищенной, как описано выше, например, с применением методик, известных каждому специалисту в данной области (спектрофотометрический анализ при 260/280 нм, визуализация образца ДНК в агарозном геле и так далее).
Стадию амплификации по меньшей мере одной части гена Hp, содержащей по меньшей мере один нуклеотидный сайт, который, когда мутирован, ответственен за резистентность к указанному антибиотику, проводят посредством PCR, предпочтительно PCR в реальном времени, более предпочтительно PCR в реальном времени по методике TaqMan.
В системе PCR в реальном времени возможность мониторинга накопления (амплифицированного) продукта амплификации обеспечивают меченные олигонуклеотидные зонды.
Каждый олигонуклеотидный зонд, используемый на стадии (3) рассматриваемого способа, мечен по меньшей мере двумя разными маркерами, предпочтительно флуоресцентными. В частности, высокоинтенсивным флуоресцентным маркером, называемым «репортер», например модифицированным флуоресцеином, и вторым маркером, предпочтительно низкоинтенсивным или нефлуоресцентным маркером, называемым «тушитель», например, модифицированным родамином.
Предпочтительно репортер связан с 5'-концом зонда, и/или предпочтительно тушитель связан с 3'-концом зонда.
Благодаря нефлуоресцентной природе тушителя, системы PCR в реальном времени могут измерять входные сигналы репортерных флуорохромов с большей точностью. Когда репортер и тушитель расположены близко (рядом) друг к другу в самом зонде, тушитель поглощает флуоресценцию репортера, в результате чего она не поддается измерению. Фактически, в этих условиях может быть измерена только низкая флуоресценция тушителя.
В ходе PCR каждый зонд проходит специфичный отжиг (гибридизацию) на комплементарной ему последовательности в области, заключенной между парой праймеров (прямым праймером и обратным праймером, см. Фиг. 1).
ДНК-полимераза не только удваивает целевую ДНК, но также, благодаря ее 5'-3'-эндонуклеазной активности, расщепляет олигонуклеотидый зонд, гибридизованный с целевой ДНК, разделяя два флуоресцентных маркера, что позволяет полностью выявить излучение репортера. С учетом того, что в ходе PCR в реальном времени высвобождение репортера (флуоресцентного маркера) происходит при каждом удвоении ДНК, относительная флуоресценция, накапливаемая в процессе амплификации, в каждый момент времени пропорциональна количеству амплифицированной ДНК. На всем протяжении PCR в реальном времени программа анализа спектра излучения, например, Sequence Detection System (SDS), позволяет преобразовывать изменения флуоресценции репортера, измеренные программой, в отображение кинетики амплификации в реальном времени.
PCR-цикл, во время которого происходит достижение пороговой интенсивности флуоресценции репортера, превышающей «фоновый шум» в системе и свидетельствующей о специфичной амплификации, определяют как пороговый цикл (Ct) реакции. В способе по настоящему изобретению количество целевой ДНК определяют во время порогового цикла, то есть в экспоненциальной фазе PCR.
Поскольку два олигонуклеотидных зонда, один для нормального аллеля гена Hp, а другой для мутированного аллеля (то есть аллеля, несущего мутацию, ответственную за резистентность Hp к антибиотику), мечены двумя разными репортерами (с разными флуоресцентными сигналами), можно определить, какие именно аллели амплифицированы, и, таким образом, определить генотип бактерии.
Таким образом, стадия амплификации позволяет генотипировать бактериальный штамм, то есть позволяет определять неизвестный генотип в образце. Предпочтительно, амплификация по настоящему изобретению позволит различать полиморфизм, связанный с мутацией одного нуклеотида, то есть, точечную мутацию или SNP (однонуклеотидный полиморфизм). В данном случае SNP присутствует в гене Hp, ответственном, когда мутирован, за резистентность к антибиотику. Альтернативно, амплификация по настоящему изобретению позволит различать мутацию одного нуклеотида, определяющего трансляцию триплета, где указанный нуклеотид приводит к аминокислоте, отличающейся от аминокислоты, присутствующей в нормальном белке.
Предпочтительно, в контексте настоящего изобретения однонуклеотидный полиморфизм (SNP) представляет собой такой полиморфизм, то есть (генетическое) изменение генетического материала (ДНК), который затрагивает один нуклеотид, при этом доля полиморфного аллеля в популяции превышает 1%. Ниже этого порога обычно говорят о редком варианте.
Предпочтительно, генетическое изменение может быть вызвано заменами, делециями или вставками оснований в ДНК и может затрагивать кодирующие и некодирующие области. Полиморфными являются те локусы, по которым гетерозиготны по меньшей мере 2% популяции. Последствия этих полиморфизмов могут быть «молчащими», когда изменение белка на меняет функцию или структуру белка. Альтернативно, указанные полиморфизмы могут иметь не «молчащие» последствия, в частности, когда наблюдается изменение фенотипа, например, при изменении функций белка.
Стадию генотипирования проводят посредством амплификации по меньшей мере одной части последовательности гена Hp, содержащей сайт, который, когда мутирован, ответственен за резистентность к антибиотику, с по меньшей мере одной парой олигонуклеотидов (пары праймеров), комплементарных области указанной части последовательности. Фактически по меньшей мере один сайт мутации, ответственной за резистентность к антибиотику, расположен между парой праймеров, то есть, область, амплифицируемая с использованием пары праймеров, содержит часть последовательности гена Hp, содержащей по меньшей мере один сайт мутации, ответственной за резистентность к антибиотику.
Указанный ген предпочтительно выбран из 23 S rRNA, gyrA и РВР-1.
Ген 23S rRNA ответственен, если мутирован, за резистентность к кларитромицину. В частности, в данном случае способ по настоящему изобретению позволяет определять по меньшей мере одну из наиболее распространенных мутаций в гене 23S rRNA, которыми обусловлено большинство случаев резистентности к кларитромицину. Предпочтительно, указанные мутации, ответственные за резистентность к кларитромицину, выбраны из мутации A2143G (то есть замены аденина в положении 2143 на гуанин), мутации А2142С и мутации A2142G.
Ген gyrA ответственен, когда мутирован, за резистентность к левофлоксацину. В частности, в данном случае способ по настоящему изобретению позволяет определять по меньшей мере одну из мутаций, затрагивающих аминокислоту аспарагин в положении 87 с ее заменой, в результате мутации, на лизин. Конкретно, в положении 87 может быть два нормальных варианта (дикого типа), триплет ААС или триплет ААТ, которые кодируют аминокислоту аспарагин. Мутации, затрагивающие третье основание этих триплетов и преобразующие их в AAA или AAG, приводят к замене аспарагина на лизин. Таким образом, указанные мутации, ответственные за резистентность к левофлоксацину, предпочтительно выбраны из мутаций С261А и C261G.
Кроме того, способ по настоящему изобретению позволяет определять мутации, затрагивающие аспарагиновую кислоту в положении 91 с ее заменой, в результате мутации, на глицин, аспарагин, аланин или тирозин.
Конкретно, происходит замена триплета в положении 91, то есть последовательности GAT (кодирующей аспарагиновую кислоту), по сайту первого нуклеотидного основания с образованием триплета GGT (кодирующего глицин) или триплета ТАТ (кодирующего тирозин).
Таким образом, мутации, ответственные за резистентность к левофлоксацину, определяемые способом по настоящему изобретению, предпочтительно выбраны из G271A,G271ThA272G.
Ген РВР-1 ответственен, если мутирован, за резистентность к амоксициллину. В частности, мутация вызывает замену аминокислоты серина в положении 413 на аргинин (Ser413Arg). Возможна мутация триплета AGC, кодирующего серии, по третьему основанию с образованием триплета AGA или AGG, кодирующего аргинин.
Предпочтительно мутации, ответственные за резистентность к амоксициллину, определяемые способом по настоящему изобретению, выбраны из С413А и C413G.
В частности, указанная амплифицированная часть последовательности гена Hp выбрана из SEQ ID NO: 1-4, где SEQ ID NO: 1 и/или 2 относятся к гену 23S, SEQ ID NO: 3 относится к гену gyrA, a SEQ ID NO: 4 относится к гену РВР-1.
Предпочтительно пара праймеров включает SEQ ID NO: 5 и SEQ ID NO: 6. Указанная пара праймеров позволяет амплифицировать последовательность SEQ ID NO: 1 и/или 2, то есть часть последовательности гена 23S рРНК Hp, содержащую по меньшей мере один сайт мутации, ответственной за резистентность Hp к кларитромицину.
Альтернативно, пара праймеров включает SEQ ID NO: 9 и SEQ ID NO: 10. Указанная пара праймеров позволяет амплифицировать последовательность SEQ ID NO: 3, то есть часть последовательности гена gyrA Hp, содержащую по меньшей мере один сайт мутации, ответственной за резистентность Hp к левофлокацину.
Альтернативно, пара праймеров включает SEQ ID NO: 13 и SEQ ID NO: 14. Указанная пара праймеров позволяет амплифицировать последовательность SEQ ID NO: 4, то есть часть последовательности гена РВР-1 Hp, содержащую по меньшей мере один сайт мутации, ответственной за резистентность Hp к амоксициллину.
Возможно, в одной реакции амплификации может быть использована более чем одна пара праймеров для одновременного определения/мониторинга резистентности Hp к более чем одному антибиотику, в частности, для определения/мониторинга резистентности штамма Hp к кларитромицину, и/или левофлоксацину, и/или амоксициллину.
Амплификацию проводят с использованием, помимо пары праймеров, по меньшей мере двух олигонуклеотидных зондов. Каждый олигонуклеотидный зонд мечен высокоинтенсивным маркером (репортером) на одном конце, предпочтительно на 5'-конце, и нефлуоресцентным или низкоинтенсивным маркером (тушителем) на другом конце, предпочтительно 3'-конце. Кроме того, из этих двух олигонуклеотидных зондов один комплементарен и специфичен в отношении нормального аллеля указанного гена и один комплементарен и специфичен в отношении мутированного аллеля, ответственного за резистентность к указанному антибиотику (см. Фиг. 1).
Олигонуклеотидные зонды предпочтительно мечены маркером, выбранным из FAM (с красной флуоресценцией), VIC (с зеленой флуоресценцией), HEX, JOE, NED, SYBER, TAMRA, TET и ROX.
Как подробно объяснено выше, когда эти два флуоресцентных маркера присутствуют на одном и том же олигонуклеотидном зонде, тушитель секвестрирует (поглощает) флуоресценцию репортера, в то время как при их разделении, как это происходит, например, в результате расщепления ДНК-полимеразой, флуоресценция репортера не поглощается тушителем и поэтому может быть выявлена/измерена.
Таким образом, в контексте настоящего изобретения тушитель означает низкоэнергетический флуоресцентный маркер (флуорофор, например, модифицированный родамин), устраняющий флуоресценцию репортера, и поэтому, когда зонд интактен, измерению поддается только его собственная флуоресценция. Предпочтительно, зонд представляет собой зонд TaqMan, включающий фрагмент, связывающийся с малой бороздкой ДНК (minor groove binder, MGB). Зонд с фрагментом, связывающимся с малой бороздкой ДНК, означает систему, в которой зонд мечен по меньшей мере двумя разными флуоресцентными веществами, например, VIC и FAM. Это позволяет повысить температуру плавления зонда без увеличения его длины и, таким образом, позволяет делать короткие зонды.
Предпочтительно, зонд выбран из SEQ ID NO:13-23.
В частности, SEQ ID NO: 13 и/или SEQ ID NO: 14 используют с парой праймеров SEQ ID NO: 5 и SEQ ID NO: 6, где SEQ ID NO: 13 комплементарна по меньшей мере одной части гена 23S rRNA, предпочтительно SEQ ID NO: 1 и/или 2, без мутации, ответственной за резистентность к антибиотику, a SEQ ID NO: 14 комплементарна по меньшей мере одной части гена 23S рРНК, предпочтительно SEQ ID NO: l и/или 2, несущей мутацию, ответственную за резистентность к антибиотику, предпочтительно выбранную из группы, состоящей из мутации A2143G, мутации А2142С и мутации A2142G. Или SEQ ID NO: 3 специфична в отношении нормального аллеля, a SEQ ID NO: 4 - в отношении аллеля, несущего мутацию, ответственную за резистентность к кларитромицину.
Предпочтительно, по меньшей мере один зонд, выбранный из SEQ ID NO: 15, 16, 17 и их комбинаций, используют с парой праймеров SEQ ID NO: 7 и 8. В частности, SEQ ID NO: 15-17 комплементарны и специфичны в отношении части последовательности SEQ ID NO: 3, содержащей по меньшей мере один из сайтов мутации, ответственной за резистентность к левофлокацину. SEQ ID NO: 15 специфична в отношении нормального аллеля гена gyrA, a SEQ ID NO: 16 и 17 специфичны в отношении мутаций Asn87Lys.
Предпочтительно по меньшей мере один зонд, выбранный из SEQ ID NO: 18, 19, 20 и их комбинаций, используют с парой праймеров SEQ ID NO: 9 и 10. В частности, SEQ ID NO: 18-20 комплементарны и специфичны в отношении части последовательности SEQ ID NO: 3, содержащей по меньшей мере один из сайтов мутации, ответственной за резистентность к левофлокацину. SEQ ID NO: 18 специфична в отношении нормального аллеля гена gyrA, a SEQ ID NO: 19 и 20 специфичны в отношении мутации Asp91Gly и мутации Asp91Tyr, соответственно.
Предпочтительно по меньшей мере один зонд, выбранный из SEQ ID NO: 21, 22, 23 и их комбинаций, используют с парой праймеров SEQ ID NO: 11 и 12. В частности, SEQ ID NO: 21-23 комплементарны и специфичны в отношении части последовательности SEQ ID NO: 4, содержащей по меньшей мере один из сайтов мутации, ответственной за резистентность к амоксициллину. SEQ ID NO: 21 специфична в отношении нормального аллеля гена РВР-1, a SEQ ID NO: 22 и 23 специфичны в отношении мутации Ser413Arg.
Последовательности, используемые в способе по настоящему изобретению, показаны в Таблице I. В частности, в таблице показан SEQ ID NO последовательности, название последовательности с учетом ее функции в способе по изобретению и с учетом самой последовательности.
Последовательности по настоящему изобретению представлены в приложенном Перечне последовательностей. Следует понимать, что настоящее описание включает последовательности, содержащиеся в приложенном Перечне последовательностей.
Следует также понимать, что объект настоящего изобретения включает последовательности, характеризующиеся по меньшей мере 70%-й, 80%-й, 85%-й, 90%-й или 95%-й идентичностью с SEQ ID NO: 1-23, приведенным в Таблице I и полностью описанным в приложенном Перечне последовательностей.





Согласно способу по настоящему изобретению, в одной реакции амплификации будет по меньшей мере два разных меченных зонда, каждый из которых будет содержать разные флуорофоры и будет комплементарен одному из аллелей, которые, при их мутации, приводят к резистентности к антибиотику. Таким образом, повышение флуоресценции на определенной длине волны одного из двух флуорофоров соответствует состоянию гомозиготности по данному аллелю, в то время как флуоресценция на обоих длинах волн соответствует состоянию гетерозиготности.
Объект настоящего изобретения также относится к набору для осуществления способа по настоящему изобретению, то есть набору для определения/мониторинга инфекции Hp у индивида и одновременного определения резистентности штамма Hp к антибиотикам. Соответственно, набор также позволяет определять патологии, связанные с инфекцией Hp, в первую очередь патологии, поражающие желудочную систему, предпочтительно гастрит, пептическую язву, рак желудка или MALT-лимфому, диспепсию, железодефицитную анемию, идиопатическую тромбоцитопеническую пурпуру и патологии других, помимо желудка и двенадцатиперстной кишки, органов.
В одном воплощении изобретения набор по изобретению содержит по меньшей мере одну пару олигонуклеотидов (пару праймеров) и по меньшей мере два олигонуклеотидных зонда, где пара праймеров гибридизуется в области ДНК по меньшей мере одного гена Hp, содержащего по меньшей мере один сайт мутации, ответственной за резистентность к антибиотику, в частности, охватывая указанный по меньшей мере один сайт мутации с двух сторон, где указанные олигонуклеотидные зонды мечены двумя разными маркерами и где по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении части области гена в нормальном аллеле указанного гена и по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении части области гена в мутантном аллеле указанного гена, придающем резистентность к указанному антибиотику.
В предпочтительном воплощении изобретения набор для определения Hp в биологическом образце, выделенном от индивида, и/или определения резистентности указанной Hp к кларитромицину, вызванной мутацией гена 23S рРНК, выбранной из группы, состоящей из A2143G, А2142С и A2142G, и/или к левофлоксацину, вызванной мутацией гена gyrA, выбранной из группы, состоящей из С261А, C261G, G271A, G271T, A272G, и/или к амоксициллину, вызванной мутацией гена РВР-1, выбранной из группы, состоящей из С413А и C413G, содержит:
- по меньшей мере одну пару праймеров для амплификации, посредством ПЦР в реальном времени, по меньшей мере одной части по меньшей мере одного гена Hp, содержащей по меньшей мере один сайт мутации, ответственной за резистентность к указанному антибиотику, где указанная пара праймеров выбрана из: SEQ ID NO: 5 и 6 для гена 23S рРНК; SEQ ID NO: 9 и 10 для гена gyrA; и SEQ ID NO: 13 и 14 для гена pbp-1; и
- по меньшей мере два олигонуклеотидных зонда, меченные двумя разными маркерами, и где по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении по меньшей мере одной части нормального аллеля по меньшей мере одного гена Hp, содержащего по меньшей мере один сайт мутации, ответственной за резистентность к указанному антибиотику, и по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении по меньшей мере одной части мутантного аллеля по меньшей мере одного гена Hp, содержащей по меньшей мере один сайт мутации, ответственной за резистентность к указанному антибиотику, при этом указанные олигонуклеотидные зонды выбраны из группы, состоящей из SEQ ID NO: 13-23, где:
- SEQ ID NO: 13 и/или 14 используют с парой праймеров SEQ ID NO: 5 и 6, SEQ ID NO: 13 комплементарна по меньшей мере одной части гена 23S рРНК, предпочтительно SEQ ID NO: 1 и/или 2, без мутации, ответственной за резистентность к кларитромицину, a SEQ ID NO: 14 комплементарна по меньшей мере одной части гена 23S рРНК, предпочтительно SEQ ID NO: 1 и/или 2, с мутацией, ответственной за резистентность к кларитромицину, выбранной из группы, состоящей из A2143G, А2142С и A2142G;
- SEQ ID NO: 15, 16 и 17 используют с парой праймеров SEQ ID NO: 7 и 8, SEQ ID NO: 15 комплементарна по меньшей мере одной части гена gyrA, предпочтительно SEQ ID NO: 3, без мутации, ответственной за резистентность к левофлоксацину, а SEQ ID NO: 16 и/или 17 комплементарны по меньшей мере одной части гена gyrA, предпочтительно SEQ ID NO: 3, с мутацией Asn87Lys, ответственной за резистентность к левофлоксацину;
- SEQ ID NO: 18, 19 и 20 используют с парой праймеров SEQ ID NO: 9 и 10, SEQ ID NO: 18 комплементарна по меньшей мере одной части гена gyrA, предпочтительно SEQ ID NO: 3, без мутации, ответственной за резистентность к левофлоксацину,SEQ ID NO: 19 комплементарна по меньшей мере одной части гена gyrA с мутацией Asp91Gly, и/или SEQ ID NO: 20 комплементарна по меньшей мере одной части гена gyrA, предпочтительно SEQ ID NO: 3, с мутацией Asp91Ty, ответственной за резистентность к левофлоксацину;
- SEQ ID NO: 21, 22 и 23 используют с парой праймеров SEQ ID NO: 11 и 12, SEQ ID NO: 21 комплементарна по меньшей мере одной части гена pbp-1, предпочтительно SEQ ID NO: 4, без мутации, ответственной за резистентность к амоксициллину, a SEQ ID NO: 22 и/или 23 комплементарны по меньшей мере одной части гена pbp-1 с мутацией Ser413Arg, ответственной за резистентность к амоксициллину.
Возможно, в наборе также присутствуют по меньшей мере один фермент и по меньшей мере один буфер, например, такие ферменты, как ДНК-полимераза, нуклеотиды, последовательности положительного контроля, последовательности отрицательного контроля и так далее.
ПРИМЕР Выделение бактериальной ДНК
Приблизительно 200 мг кала солюбилизировали в 2 мл забуференного фосфатом физиологического раствора (PBS).
Затем солюбилизированный кал гомогенизировали перемешиванием на вихревой мешалке на протяжении приблизительно 30 секунд.
Затем 500 мкл гомогената отбирали в стерильный шприц и переносили в новую пробирку объемом 1,5 мл. К гомогенату добавляли 500 мкл тризола и проводили интенсивное перемешивание на протяжении нескольких секунд.
Затем в смесь гомогената и тризола добавляли 100 мкл хлороформа и проводили интенсивное перемешивание на протяжении 15 секунд и центрифугирование при 12000 g на протяжении 15 минут при 4°С.
Эта обработка приводит к образованию трех раздельных фаз: водной фазы (сверху), промежуточной фазы (посередине) и феноловой фазы (снизу).
Водную фазу удаляют.
К оставшимся фазам (промежуточной фазе и феноловой фазе), содержащим ДНК, добавляют 150 мкл 100%-ного этанола. Образец перемешивают переворачиванием и инкубируют при комнатной температуре на протяжении 2-3 минут.
Затем ДНК осаждают центрифугированием при 2000 g на протяжении 2 минут при 4°С.
Затем поверхностную фазу, содержащую белок, удаляют, к осажденной ДНК добавляют 1 мл цитрата натрия и инкубируют при комнатной температуре на протяжении 30 минут. После этой обработки образец центрифугируют при 2000 g на протяжении 5 минут при 4°С и удаляют супернатант.
Стадию с цитратом натрия повторяют 2 раза.
Затем к осадку добавляют 2 мл 75%-ного этанола, инкубируют на протяжении 20 минут при комнатной температуре и центрифугирование при 2000 g на протяжении 5 минут при 4°С. Этанол полностью удаляют и осажденную ДНК оставляют сушиться на 15-20 минут.
Осажденную ДНК растворяют в 500 мкл 8 мМ NaOH. Затем растворенный образец центрифугируют при 14000 g на протяжении 10 минут при комнатной температуре для удаления нерастворенных веществ. По окончании стадии центрифугирования супернатант переносят в новую пробирку и ДНК ресуспендируют в 60 мкл 0,1 М HEPES и 5,5 мкл 100 мМ EDTA (этилендиаминтетрауксусная кислота). Первичная сборка последовательности 23S rRNA Helicobacter pylori (нуклеотидная
последовательность) SEQ ID NO: 1 представляет собой нуклеотидную последовательность гена 23S rRNA Helicobacter pylori.
Эта последовательность является сайтом точечных мутаций, ответственных за резистентность к кларитромицину.
Эксперимент по генотипированию представляет собой эксперимент по конечным результатам, используемый для определения генотипа неизвестных образцов. Эксперимент этого типа позволяет различить полиморфизм, обусловленный мутацией одного нуклеотида (SNP), как в случае с Helicobacter pylori.
В частности, в случае резистентности к кларитромицину целью эксперимента по генотипированию является определение того, какими являются неизвестные образцы:
 гомозиготными по А (образцы, имеющие нуклеотидную последовательность без мутации);
гомозиготными по А (образцы, имеющие нуклеотидную последовательность без мутации);
 гомозиготными по G (образцы, имеющие нуклеотидную последовательность с мутацией);
гомозиготными по G (образцы, имеющие нуклеотидную последовательность с мутацией);
 гетерозиготными (образцы, имеющие нуклеотидную последовательность с мутацией в одном аллеле и без мутации в другом аллеле).
гетерозиготными (образцы, имеющие нуклеотидную последовательность с мутацией в одном аллеле и без мутации в другом аллеле).
PCR реакции для экспериментов по генотипированию включают следующие компоненты:
 отрицательные контроли - пробы, содержащие воду или буфер вместо образца (также называемые безматричными контролями (no template controls, NTC); отрицательные контроли не должны проходить амплификацию;
отрицательные контроли - пробы, содержащие воду или буфер вместо образца (также называемые безматричными контролями (no template controls, NTC); отрицательные контроли не должны проходить амплификацию;
 положительные контроли - пробы с известными генотипами;
положительные контроли - пробы с известными генотипами;
 образец - проба, целевой генотип которой неизвестен;
образец - проба, целевой генотип которой неизвестен;
 повторы - идентичные реакции с идентичными компонентами и объемами. Эксперименты по генотипированию включают две стадии:
повторы - идентичные реакции с идентичными компонентами и объемами. Эксперименты по генотипированию включают две стадии:
(1) темрмический цикл (PCR-амплификация); и
(2) выявление конечных значений сигналов.
Для крупномасштабного генотипирования мутаций применяли PCR в реальном времени по методике TaqMan®. Целевая последовательность должна быть предварительно амплифицирована с использованием подходящих праймеров. Зонд, расположенный между двух праймеров, используют для идентификации последовательности, содержащей представляющую интерес мутацию.
Ниже показана SEQ ID NO: 2, то есть часть последовательности ДНК гена 23S rRNA, содержащая положение мутации A/G, ответственной за Hp резистентность к кларитромицину.
Расположение праймеров показано жирным шрифтом, а расположение зонда выделено серым цветом. Видно, что праймеры охватывают область, содержащую сайт возможной мутации, ответственной за резистентность к кларитромицину, с двух сторон, а зонд комплементарен именно той части этой области, в которой расположен сайт возможной мутации (то есть гибридизуется именно с этой частью).

Таким образом, праймеры, используемые для PCR, представляют собой следующее.

Используемые зонды представляют собой следующее.
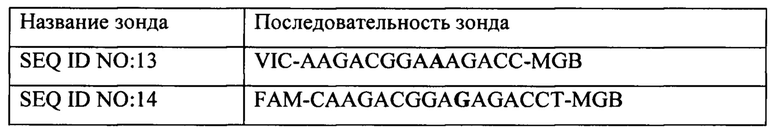
В частности, зонд, меченный флуорофором VIC, использовали для выявления основания А, в то время как зонд, меченный флуорофором FAM, использовали для выявления основания G (в случае мутации).
В системе с двумя аллелями, как в рассматриваемом случае, в одной реакционной смеси присутствуют два разных зонда, меченные разными флуорофорами (в данном случае, FAM™ для нормального аллеля и VIC™ для мутантного аллеля), каждый из которых комплементарен одному аллелю анализируемого SNP. В фазе гибридизации (отжига) каждый зонд будет гибридизоваться со специфичной для него цепью. Результатом будет повышение флуоресценции на определенной длине волны одного из двух флуоресцентных маркеров (флуорофоров), соответствующее состоянию гомозиготности по данному аллелю, в то время как флуоресценция на обоих длинах волн соответствует состоянию гетерозиготности.
Обычно аллельные дискриминационные анализы производятся только после успешного прохождения тестов контроля качества:
 каждый праймер и каждый олигонуклеотидный зонд по отдельности проходят масс-спектроскопический анализ для подтверждения правильности синтеза;
каждый праймер и каждый олигонуклеотидный зонд по отдельности проходят масс-спектроскопический анализ для подтверждения правильности синтеза;
 должен быть получен по меньшей мере один легко интерпретируемый аллельный дискриминационный кластер, то есть по меньшей мере одна группа единиц, сходных или близких друг другу с точки зрения их состава и/или расположения; например, в данном случае это кластер генов или группа сходных или близких продуктов, имеющих одинаковый генетический состав (например, группа образцов с мутантными Helicobacter р. и/или группа образцов с нормальными Helicobacter р. дикого типа);
должен быть получен по меньшей мере один легко интерпретируемый аллельный дискриминационный кластер, то есть по меньшей мере одна группа единиц, сходных или близких друг другу с точки зрения их состава и/или расположения; например, в данном случае это кластер генов или группа сходных или близких продуктов, имеющих одинаковый генетический состав (например, группа образцов с мутантными Helicobacter р. и/или группа образцов с нормальными Helicobacter р. дикого типа);
 анализы, в которых праймеры и олигонуклеотидные зонды не соответствуют стандартным показателям, не пройдут тесты контроля качества;
анализы, в которых праймеры и олигонуклеотидные зонды не соответствуют стандартным показателям, не пройдут тесты контроля качества;
 необходимо определить и подтвердить последовательности, расположенные рядом с рассматриваемыми SNP.
необходимо определить и подтвердить последовательности, расположенные рядом с рассматриваемыми SNP.
Как указано ранее, в экспериментах по генотипированию PCR включает специфичный зонд (короткую нуклеотидную последовательность, содержащую сайт полиморфизма), меченный флуоресцентным маркером (флуорофором), для каждого аллеля. Зонды содержат разные высокоинтенсивные флуоресцентные маркеры (флуоресцентные репортеры) для различения каждого аллеля.
Возможно использование зондов TaqMan®, связывающихся с малой бороздкой ДНК (MGB), в системе Applied Biosystems 7900НТ, имеющейся у авторов изобретения. Каждый зонд MGB TaqMan® содержит:
 флуорохром-репортер на 5'-конце каждого зонда:
флуорохром-репортер на 5'-конце каждого зонда:
- в данном случае, с 5'-концом зонда для аллеля дикого типа связан флуорохром VIC®,
- с 5'-концом зонда для мутантного аллеля связан флуорохром FAM™;
 элемент, связывающийся с малой бороздкой ДНК (MGB).
элемент, связывающийся с малой бороздкой ДНК (MGB).
Использование MGB повышает температуру плавления (Tm) зондов без увеличения их длины (Afonina et al., 1997; Kutyavin et al., 1997), что позволяет делать более короткие зонды; соответственно, зонды TaqMan MGB демонстрируют более выраженное различие значений Tm гибридизованных и негибридизованных зондов; более выраженные различия значений Tm позволяют проводить более точное генотипирование;
 нефлуоресцентный тушитель (NFQ) на 3'-конце зонда.
нефлуоресцентный тушитель (NFQ) на 3'-конце зонда.
В рассматриваемом случае PCR в реальном времени проводили в 96-луночном планшете для оптических измерений, внося в каждую лунку следующее количество образцов.
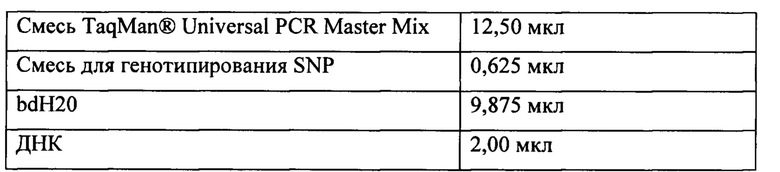
Смесь TaqMan® Universal PCR Master Mix (Applied Biosystems, Фостер-Сити, штат Калифорния, США) содержит буфер, dNTP и полимеразу Taq Gold.
Смесь для генотипирования SNP содержит два праймера (прямой и обратный) и два зонда, специфичных в отношении каждого аллеля, один из которых мечен на 5'-конце флуоресцентным маркером FAM™ с красной флуоресценцией, а другой -флуоресцентным маркером VIC® с зеленой флуоресценцией.
ДНК амплифицировали в следующих экспериментальных условиях:
- предварительное измерение на протяжении 1 мин при 60°С для определения исходной флуоресценции;
- 2 мин при 50°С;
- 10 мин при 95°С;
- 15 сек при 95°С;
- 1 мин при 60°С: 40 циклов;
- завершающее измерение на протяжении 1 мин при 60°С для определения кластера трех разных генотипов.
Эти результаты считывали и анализировали с применением имевшегося программного обеспечения SDS.
Чувствительность и специфичность данного способа оценивали, сравнивая описанный выше тест с инвазивными и неинвазивными обследованиями, доступными в настоящее время для диагностики инфекции Hp.
Анализировали группу пациентов с положительным результатом гистологического исследования на Hp.
Для этого, описанный выше способ сравнивали с тестом, признанным в настоящее время золотым стандартом диагностики Hp, а именно с гистологическим исследованием, и с ДНК, выделенной из ткани. Были проанализированы 72 Hp-положительных пациента.
Бактериальную ДНК выделяли из ткани, заключенной в парафин, и подвергали молекулярному анализу, описанному выше, для определения мутации, ответственной за резистентность.
Результаты двух молекулярных анализов совпали на 100%.
Результаты гистологической диагностики совпали с результатами молекулярных анализов на 92%, с учетом небольшого числа ложноотрицательных результатов, когда Hp можно было выявить только посредством молекулярного анализа.
При сравнении теста по изобретению с анализом на антиген (Ag) в кале результаты совпали на 68%.
Таким образом, молекулярный способ по настоящему изобретению также позволил выявить небольшое, но существенное число ложноотрицательных результатов, полученных при гистологическом исследовании и применении других методов (Ag в кале).

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ диагностики инфекции Хеликобактер пилори и ее устойчивости к кларитромицину и левофлоксацину | 2022 |
|
RU2806581C1 |
| ОЛИГОНУКЛЕОТИДНЫЙ БИОЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ РЕЗИСТЕНТНОСТИ Neisseria gonorrhoeae К АНТИМИКРОБНЫМ ПРЕПАРАТАМ, НАБОР ОЛИГОНУКЛЕОТИДОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ ИММОБИЛИЗАЦИИ НА БИОЧИПЕ | 2016 |
|
RU2636457C2 |
| Способ выявления наличия мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам | 2019 |
|
RU2725477C1 |
| СПОСОБ ВЫЯВЛЕНИЯ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ К РИФАМПИЦИНУ С ВОЗМОЖНОЙ ИХ ИДЕНТИФИКАЦИЕЙ, СПОСОБ ГИБРИДИЗАЦИИ, ЗОНД И КОМПОЗИЦИЯ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ, НАБОР ПРАЙМЕРОВ (ВАРИАНТЫ) | 1995 |
|
RU2204608C2 |
| ДНК-ЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ, ПРИВОДЯЩИХ К НАРУШЕНИЮ РЕПРОДУКТИВНЫХ ФУНКЦИЙ ЧЕЛОВЕКА, НАБОР ОЛИГОНУКЛЕОТИДОВ ДЛЯ ИММОБИЛИЗАЦИИ НА ДНК-ЧИПЕ | 2016 |
|
RU2685188C2 |
| НОВЫЕ ПРАЙМЕРЫ ДЛЯ СКРИНИРОВАНИЯ ШИЗОФРЕНИИ И СПОСОБ ЕЕ СКРИНИРОВАНИЯ | 2002 |
|
RU2338788C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ МУТАЦИЙ В ГЕНЕ ПЕНИЦИЛЛИНСВЯЗЫВАЮЩЕГО БЕЛКА 2 penA NEISSERIA GONORRHOEAE, ПРИВОДЯЩИХ К УСТОЙЧИВОСТИ К БЕТА-ЛАКТАМНЫМ АНТИБИОТИКАМ, НА БИОЛОГИЧЕСКИХ МИКРОЧИПАХ | 2020 |
|
RU2741099C1 |
| НУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ, УЧАСТВУЮЩИЕ В УВЕЛИЧЕНИИ ИЛИ УМЕНЬШЕНИИ СКОРОСТИ ОВУЛЯЦИИ У МЛЕКОПИТАЮЩИХ | 2001 |
|
RU2283866C2 |
| ГЕН И ВАРИАЦИИ, СВЯЗАННЫЕ С ФЕНОТИПОМ BM1, МОЛЕКУЛЯРНЫЕ МАРКЕРЫ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2617958C2 |
| СПОСОБ ОБНАРУЖЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2004 |
|
RU2380423C2 |

Предложенная группа изобретений относится к области медицины. Предложен способ in vitro определения Helicobacter pylori (Hp) в биологическом образце, выделенном от индивида, и определения резистентности указанной Hp к кларитромицину, включающий амплификацию по меньшей мере одной части по меньшей мере одного гена Hp, содержащей по меньшей мере один сайт мутации, ответственной за резистентность к кларитромицину, где указанная мутация выбрана из A2143G, А2142С и A2142G для гена 23S рРНК. Предложен набор для определения Hp в образце кала, выделенном от индивида, и определения резистентности указанной Hp к кларитромицину, вызванной мутацией гена 23S рРНК, выбранной из группы, состоящей из A2143G, А2142С и A2142G. Предложенная группа изобретений обеспечивает специфичное определение наличия инфекции Hp и резистентности Hp к кларитромицину. 2 н. и 4 з.п. ф-лы, 1 ил., 5 табл., 1 пр.
1. Способ in vitro определения Helicobacter pylori (Hp) в биологическом образце, выделенном от индивида, и определения резистентности указанной Helicobacter pylori к кларитромицину, включающий стадии:
(1) очистки (выделения) ДНК из образца кала, выделенного от индивида; и
(2) амплификации по меньшей мере одной части по меньшей мере одного гена Helicobacter pylori, содержащей по меньшей мере один сайт мутации, ответственной за резистентность к кларитромицину, где указанную амплификацию проводят посредством полимеразной цепной реакции (PCR) в реальном времени с использованием пары олигонуклеотидов (пары праймеров) и по меньшей мере двух олигонуклеотидных зондов, где пара праймеров гибридизуется с областью ДНК, охватывая указанный сайт мутации с двух сторон, и где каждый олигонуклеотидный зонд мечен на 5'- и 3'-концах двумя разными маркерами, и где по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении по меньшей мере одной части гена в аллеле дикого типа указанного гена и по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении по меньшей мере одной части гена в мутантном аллеле указанного гена, ответственной за резистентность к указанному антибиотику;
(3) количественного определения амплифицированной ДНК дикого типа и/или мутантной ДНК посредством измерения, во время порогового цикла PCR, уровней маркера, которым мечены указанные олигонуклеотидные зонды, где присутствие только маркера, которым мечен зонд, комплементарный и специфичный в отношении по меньшей мере одной части гена в аллеле дикого типа, указывает на нормальный гомозиготный генотип и, таким образом, присутствие указанной Hp, нерезистентной к кларитромицину; присутствие только маркера, которым мечен зонд, комплементарный и специфичный в отношении по меньшей мере одной части гена в мутантном аллеле указанного гена, указывает на мутантный гомозиготный генотип и, следовательно, присутствие указанной Hp, резистентной к кларитромицину; и присутствие обоих маркеров указывает на гетерозиготный генотип с аллелем дикого типа и мутантным аллелем указанного гена и, таким образом, присутствие указанной Hp, резистентной к кларитромицину, где указанная мутация выбрана из A2143G, А2142С и A2142G для гена 23S рРНК, и где указанная одна пара праймеров представляет собой SEQ ID NO: 5 и 6 для амплификации SEQ ID NO: 1 или 2.
2. Способ по п. 1, где каждый олигонуклеотидный зонд мечен на 5'-конце высокоинтенсивным флуоресцентным маркером (репортером), а на 3'-конце нефлуоресцентным или низкоинтенсивным маркером (тушителем).
3. Способ по п. 1, где указанный маркер выбран из VIC, FAM, HEX, JOE, NED, SYBER, TAMRA, TET и ROX.
4. Способ по п. 1, где указанный олигонуклеотидный зонд модифицирован для связывания с малой бороздкой ДНК.
5. Способ по п. 1, где указанный олигонуклеотидный зонд представляет собой SEQ ID NO: 13 и/или 14 и его используют с парой праймеров SEQ ID NO: 5 и 6, причем SEQ ID NO: 13 комплементарна SEQ ID NO: 1 и/или 2 гена 23S рРНК, без мутации, ответственной за резистентность к антибиотику, a SEQ ID NO: 14 комплементарна SEQ ID NO: 1 и/или 2 гена 23S рРНК, с мутацией, ответственной за резистентность к кларитромицину, выбранной из A2143G, А2142С и A2142G.
6. Набор для определения Helicobacter pylori в образце кала, выделенном от индивида, и определения резистентности указанной Helicobacter pylori к кларитромицину, вызванной мутацией гена 23S rRNA, выбранной из группы, состоящей из A2143G, А2142С и A2142G, где указанный набор содержит:
- одну пару праймеров для амплификации посредством PCR в реальном времени по меньшей мере одной части по меньшей мере одного гена Helicobacter pylori, содержащей по меньшей мере один сайт мутации, ответственной за резистентность к кларитромицину, где указанная пара праймеров представляет собой SEQ ID NO: 5 и 6 для гена 23S rRNA;
- по меньшей мере два олигонуклеотидных зонда, меченных двумя разными маркерами, и где по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении по меньшей мере одной части аллеля дикого типа по меньшей мере одного гена Helicobacter pylori, содержащей по меньшей мере один сайт мутации, ответственной за резистентность к кларитромицину, и по меньшей мере один олигонуклеотидный зонд комплементарен и специфичен в отношении по меньшей мере одной части мутантного аллеля по меньшей мере одного гена Helicobacter pylori, содержащей по меньшей мере один сайт мутации, ответственной за резистентность к кларитромицину, при этом указанные олигонуклеотидные зонды представляют собой SEQ ID NO: 13 и/или 14 и их используют с парой праймеров SEQ ID NO: 5 и 6, где SEQ ID NO: 13 комплементарна SEQ ID NO: 1 и/или 2 гена 23S рРНК, без мутации, ответственной за резистентность к кларитромицину, a SEQ ID NO: 14 SEQ ID NO: 1 и/или 2 гена 23S рРНК, с мутацией, ответственной за резистентность к кларитромицину, выбранной из группы, состоящей из A2143G, А2142С и A2142G.
| RU 2012113773 A, 20.10.2013 | |||
| WO 2014087055 A1, 12.06.2014 | |||
| ИСАЕВА Г.Ш | |||
| Резистентность H | |||
| pylori к антибактериальным препаратам и методы ее определения | |||
| КМАХ | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| DE FRANCESCO V | |||
| et al | |||
| Primary clarithromycin resistance in Italy assessed on Helicobacter pylori DNA sequences by TaqMan real-time polymerase chain reaction | |||
| Aliment | |||
Авторы
Даты
2021-03-03—Публикация
2017-02-03—Подача