Предлагаемое изобретение относится к области медицинской микробиологии, а именно к способам молекулярно-генетического типирования штаммов возбудителей инфекционных заболеваний, которые используются при микробиологическом и молекулярно-генетическом мониторинге штаммов H.pylori, циркулирующих на различных территориях, с целью их дифференциации.
В настоящее время существует проблема распространенности хеликобактериоза среди различных групп населения, а пути его передачи позволяют рассматривать хеликобактериоз как инфекционное заболевание, носящее характер эпидемии. Инфицированность взрослого населения России, по результатам выборочных исследований, колеблется от 50 до 80%, а в некоторых регионах она приближается к 100%, в связи с чем на федеральном и региональном уровнях уделяется большое внимание внедрению современных методов диагностики Н. pylori-ассоциированных заболеваний и мониторинга инфекции.
Эрадикация Н. pylori является одним из основных направлений в терапии язвенной болезни желудка и двенадцатиперстной кишки, однако даже после интенсивной терапии, Н. pylori вновь обнаруживается в биоптатах слизистой оболочки желудка. По данным [1], частота повторного выявления Н. pylori в течение года после успешной эрадикационной терапии варьирует от 0 до 41.5%. Повторное выявление Н. pylori, как полагают, происходит посредством двух различных механизмов: реинфекции и рецидивирования. Подтверждением факта реинфекции является наличие геномных различий между прежним и новым штаммами Н. pylori. Для изучения путей передачи хеликобактериоза также необходим простой, надежный и воспроизводимый способ молекулярного генотипирования Н. pylori.
Известны способы молекулярного типирования Н. pylori, а именно, гель-электрофорез в пульсирующем поле (PFGE) [2], полиморфизм длины рестрикционных фрагментов (RFLP) [3], приемы, направленные на определение межгенных повторяющихся (ERIC-PCR) и внегенных палиндромных последовательностей у энтеробактерий (REP-PCR) [4, 5], применение универсальных (случайных) праймеров в системе RAPD-PCR [6] и методы VNTR-анализа [7, 8].
Однако практическое использование многих из них ограничивается как сложностью методического характера, так и проблемами с воспроизводимостью и оценкой результатов [9].
Известен способ анализа вариабельных тандемных повторов - VNTR-анализ [7, 8], позволяющий определять уникальную аллельную формулу для каждой культуры и тем самым четко дифференцировать штаммы самых различных возбудителей. VNTR-анализ заключается в том, что проводят амплификацию ДНК исследуемого штамма с набором специфических праймеров к индивидуальному VNRT-локусу. Полученные специфические фрагменты исследуют различными методами с целью точного определения молекулярной массы амплифицированного фрагмента ДНК. В зависимости от установленной массы каждого фрагмента вычисляют число тандемных повторов для исследуемого локуса. Подобное исследование проводят для нескольких локусов. Сочетание чисел, характеризующих число повторов каждого из изученных локусов, составляет уникальную аллельную VNTR-формулу для анализируемого штамма H.pylori.
Однако данный способ имеет ряд существенных недостатков. Индивидуальные амплифицированные VNTR-фрагменты обладают большой молекулярной массой, и соседние аллели отличаются весьма незначительно: обычно всего шесть нуклеотидов, что и делает весьма затруднительным определение их истинного веса с точностью до нуклеотида. Для точного определения размера аллелей необходимы сложные и трудоемкие методики определения молекулярной массы амплифицированного фрагмента.
Известны исследования, которые показали наличие в генах различных живых организмов особых стабильно наследуемых генетических характеристик, заключающихся во вставках-делециях (insertions/deletions) коротких фрагментов ДНК, при этом такие гены обозначают как INDEL-гены. Изучение полиморфизма INDEL-генов в настоящее время широко используется при молекулярном типировании [10].
За прототип выбран способ мультилокусного секвенирования-типирования (MLST) генов "домашнего хозяйства" [11], который заключается в выделении ДНК из исследуемой культуры с с помощью набора Instagene Matrix Kit (Bio-Rad Cat. No. 732-6030), постановки ПЦР со специфическими праймерами к семи генам Н. pylori (ureI, mutY, efp, ppa, yphC, atpA, and trpC), затем проводят секвенирование всех семи амплифицированных фрагментов, определяют позиции всех нуклеотидных замен и с помощью сложного программного обеспечения определяют генотип каждого штамма.
Недостатком способа является то, что для проведения исследования необходим сложный и дорогостоящий импортный ДНК-секвенатор, а само проведение анализа требует использования дорогостоящих импортных расходных материалов, и сложной процедуры интерпретации полученных результатов с помощью дорогостоящего программного обеспечения. Эти обстоятельства приводит к крайне высокой стоимости анализа, его большой продолжительности во времени (от нескольких дней до нескольких недель) и полной зависимости исследователя от поставок производителем расходных материалов из-за рубежа.
Технической задачей настоящего изобретения является разработка нового способа позволяющего достоверно, быстро и с невысокой себестоимостью осуществлять дифференциацию штаммов Н. pylori, выделенных в различных регионах, областях и странах.
Поставленная задача достигается тем, что в известном способе дифференциации штаммов Helicobacter pylori путем молекулярно-генетического типирования, включающем выделение ДНК из исследуемого штамма Н. pylori, постановку ПНР со специфическими праймерами и учет реакции с помощью электрофореза, из ДНК исследуемого штамма Н. pylori выявляют пять общих INDEL-генов, имеющих делеции определенного размера а именно IND-3330, 5605, 6405, 340 и 1390, с последующей их амплификацией с помощью сконструированных специфических праймеров, выявляющих два альтернативных аллеля:
к гену IND-3330 - праймеры  и
и
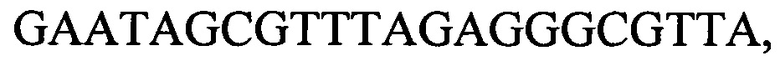 с длиной амплифицированного фрагмента 60 п. н. или 69 п. н.,
с длиной амплифицированного фрагмента 60 п. н. или 69 п. н.,
к гену IND-5605 - праймеры 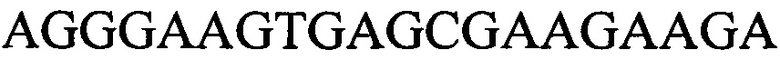 и
и
 с длиной амплифицированного фрагмента 93 п. н. или 102 п. н.,
с длиной амплифицированного фрагмента 93 п. н. или 102 п. н.,
к гену IND-6405 - праймеры 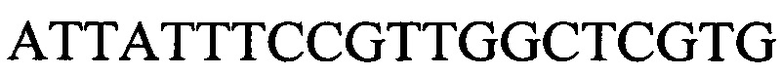 и
и
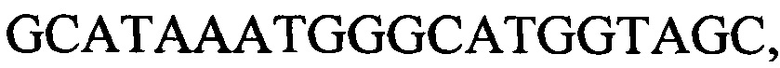 с длиной амплифицированного фрагмента 100 п. н. или 106 п. н.,
с длиной амплифицированного фрагмента 100 п. н. или 106 п. н.,
к гену IND-340 - праймеры  и
и
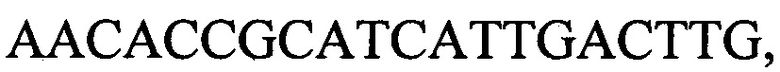 с длиной амплифицированного фрагмента 79 п. н. или 85 п. н.,
с длиной амплифицированного фрагмента 79 п. н. или 85 п. н.,
к гену IND-13 90 - праймеры 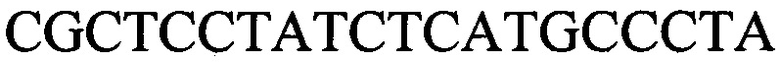 и
и
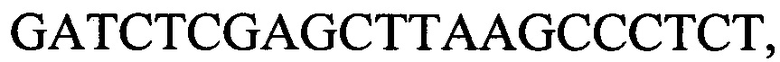 с длиной амплифицированного фрагмента 64 п. н. или 76 п. н.,
с длиной амплифицированного фрагмента 64 п. н. или 76 п. н.,
при этом учет результатов дифференциации проводят визуально после электрофореза в 8% полиакриламидном геле в присутствии маркера молекулярных масс ДНК, причем для каждого штамма устанавливают уникальный INDEL-генотип по пяти INDEL-генам, а путем сравнения выявленных INDEL-генотипов между собой и с известными генотипами идентификационной таблицы, устанавливают общее или различное происхождение исследуемых штаммов Н. pylori.
При этом ПИР проводят в объеме 25 мкл и реакционная смесь содержит:
1,5 мМ Mg-буфер,
0,2 мМ смеси дНТФ, 1,0 мкМ смеси праймеров (по 0,5 мкМ каждого праймера),
25 нг ДНК-матрицы,
1 ед.. ДНК-полимеразы, оставшийся объем - вода, при этом в качестве матрицы используют геномную ДНК, объемом 5 мкл, которую получают из разных штаммов Н. pylori.
Кроме того ПНР проводят с соблюдением режимов:
1 этап - денатурация при 95°С - 3 мин (1 цикл);
2 этап - денатурация при 95°С - 20 с, отжиг при 55°С - 20 с, синтез при 72°С - 20 с (35 циклов);
3 этап - досинтез при 72°С - 7 мин (1 цикл).
Обоснование выбора праймеров.
С помощью программного обеспечения, разработанного авторами ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора, было проанализировано более 3000 генов Н. pylori в базе данных GenBank. В процессе компьютерного анализа нуклеотидных последовательностей штаммов Н. pylori в базе данных GenBank авторы идентифицировали ряд INDEL-генов, отличающихся по размеру у штаммов Н. pylori различного происхождения, и имеющих только два альтернативных варианта размера ампликона. В результате было выделено 5 общих генов, имеющих делеции определенного размера, а именно:
IND - 3330, 5605, 6405, 340 и 1390 (см. таблицу 1).
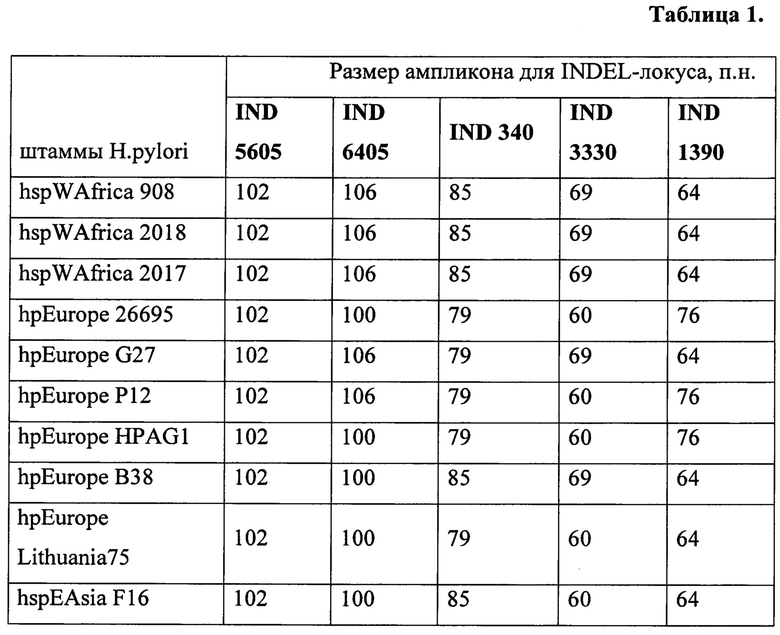
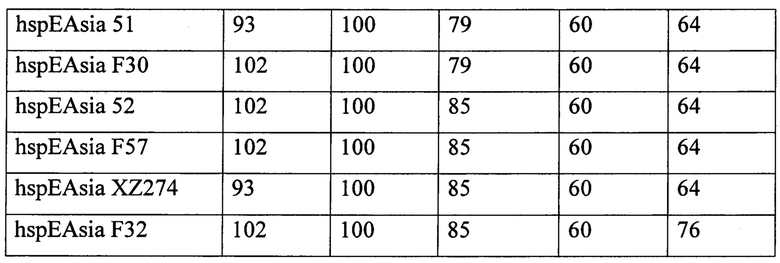
С помощью программного обеспечения Primer М и BLAST NCBI к варьирующим участкам указанных генов 5605, 6405, 340, 3330,1390 были сконструированы специфические праймеры.
Набор значений размера фрагментов для каждого штамма по каждому из пяти INDEL-генов является его индивидуальной характеристикой и позволяет дифференцировать один штамм от другого и определять их происхождение с помощью кластерного анализа.
Способ осуществляется следующим образом.
Перед постановкой способа дифференциации штаммов Helicobacter pylori выделяют ДНК исследуемой культуры. Бактериальную суспензию исследуемого штамма в дистиллированной воде вносят в микропробирку объемом 1,5 мл, после чего проводят обеззараживание материала и выделение ДНК согласно МУ 1.3.2569-09 [12]. Затем в ПЦР проводят амплификацию выделенной ДНК со специфическими праймерами:
к гену 3330,
- 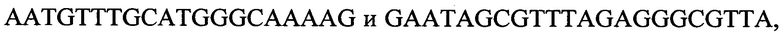
с длиной амплифицированного фрагмента 60 п. н. или 69 п. н.,
к гену 5605,
- 
с длиной амплифицированного фрагмента 93 п. н. или 102 п. н.,
к гену 6405,
- 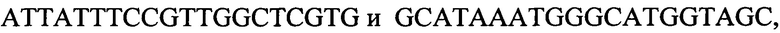
с длиной амплифицированного фрагмента 100 п. н. или 106 п. н.,
к гену 340,
- 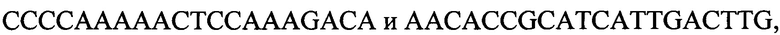
с длиной амплифицированного фрагмента 79 п. н. или 85 п. н.,
к гену 1390,
- 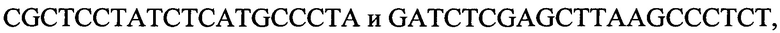
с длиной амплифицированного фрагмента 64 п. н. или 76 п. н.
Условия проведения реакции амлификации.
Амплификацию проводят по следующей схеме: денатурация при 95°С - 3 мин (1 цикл); затем 35 циклов: денатурация при 95°С - 20 с, отжиг при 55°С - 20 с, синтез при 72°С - 20 с; синтез при 72°С - 7 мин (1 цикл).
Реакционную смесь объемом 25 мкл готовят из расчета: 1,5 мМ Mg-буфер, 0,2 мМ смеси дНТФ, 1,0 мкМ смеси праймеров (по 0,5 мкМ каждого праймера) 25 нг ДНК-матрицы, 1 ед.. ДНК-полимеразы, оставшийся объем - вода. В качестве матрицы используют геномную ДНК (объемом 5 мкл), полученную из разных штаммов Н. pylori. Учет результатов амплификации проводят с помощью электрофореза в 8% полиакриламидном геле в присутствии маркера молекулярных масс ДНК.
При этом учет результатов типирования проводят визуально после электрофореза, причем для каждого штамма устанавливают уникальный INDEL-генотип по пяти INDEL-генам, а путем сравнения выявленных INDEL-генотипов между собой и с известными генотипами идентификационной таблицы, устанавливают общее или различное происхождение исследуемых штаммов Н. Pylori (hp Europe, hspEAsiahsp, WAfrica). что дает возможность дифференцировать один штамм от другого.
Проведенные исследования доказывают, что использование разработанного способа молекулярно-генетического типирования штаммов Н. pylori по структуре INDEL-генов позволяет выявлять штаммы с различными аллельными вариантами INDEL-генов.
Пример 1.
В эксперименте использованы штаммы Н. pylori из коллекции Ростовского-на-Дону научно-исследовательского противочумного института, выделенные в Ростовской области. Бактерии Н. pylori (штаммы №30, 48, 53, 59, 88, 90, 115, 124 и R) суспендируют 150 мкл деионизованной воды, не содержащей нуклеаз. Далее проводят выделение ДНК согласно МУ 1.3.2569-09 [12]. Для постановки полимеразной цепной реакции используют праймеры к гену 3330  и
и  с длиной амплифицированного фрагмента 60 п. н. или 69 п. н.; и праймеры к гену 5605
с длиной амплифицированного фрагмента 60 п. н. или 69 п. н.; и праймеры к гену 5605 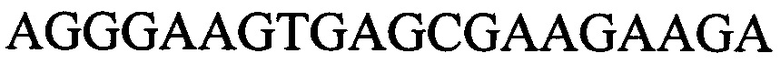 и
и  с длиной амплифицированного фрагмента 93 п. н. или 102 п. н.
с длиной амплифицированного фрагмента 93 п. н. или 102 п. н.
В реакционную ПЦР смесь добавляют по 1 микролитру специфических праймеров, 1 микролитр термостабильной ДНК-полимеразы и вносили 5 микролитров супернатанта ДНК. Общий объем реакционной смеси составляет 25 микролитров. Смесь перемешивают на вортексе и амплифицируют при условиях: 95°С - 3 мин (1 цикл); 95°С - 20 сек, 55°С - 20 сек, 72°С - 20 сек (35 циклов), 72°С - 7 мин. Учет результатов амплификации проводят с помощью электрофореза в 8% полиакриламидном геле в присутствии маркера молекулярных масс ДНК (фото 1). На фото 1 отражен: электрофорез продуктов амплификации INDEL-генов 3330 и 5605.
А - продукты амплификации INDEL-гена 3330; стрелки указывают позиции аллелей 60 и 69 п. н., М-маркерная ДНК.
В - продукты амплификации INDEL-гена 5605; стрелки указывают позиции аллеля 102 п. н., М-маркерная ДНК.
Таким образом анализ продуктов амплификации INDEL-гена 3330 (А) показывает, что два из шести изученных штаммов (№30 и 53) имеют аллель 69 п. н., а четыре(48,59,88,90) - аллель 60 п. н. Анализ продуктов амплификации INDEL-гена 5605 (В) показывает, что все три изученных, штамма имеют одинаковый аллель 102 п. н. Данные по размерам аллелей для каждого штамма заносят в таблицу и сравнивают величины аллелей между собой и с идентификационной таблицей 1 для штаммов Н. Pylori из базы данных GenBank.
Вывод:исследуемые штаммы можно отличить друг от друга по одному локусу, но недостаточно дифференцировать так как они могут быть как Европейские так и Азиатские, в связи с этим потребуются дополнительные исследования к другим INDEL-генам.
Пример 2.
Из коллекции Ростовского-на-Дону научно-исследовательского противочумного института были взяты штаммы Н. pylori (№R, 134, 146, 155, 157, 206, 70, 77, 115, 124). Бактерии Н. pylori суспендируют в 150 мкл деионизованной воды, не содержащей нуклеаз. Далее проводят выделение ДНК согласно МУ 1.3.2569-09 [12].
Для постановки полимеразной цепной реакции используют праймеры к гену 6405  и
и  с длиной амплифицированного фрагмента 100 п. н. или 106 п. н.; праймеры к гену 340
с длиной амплифицированного фрагмента 100 п. н. или 106 п. н.; праймеры к гену 340 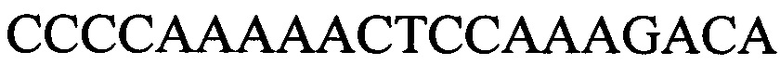 и
и 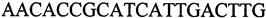 , с длиной амплифицированного фрагмента 79 п. н. или 85 п. н.; праймеры к гену 1390
, с длиной амплифицированного фрагмента 79 п. н. или 85 п. н.; праймеры к гену 1390 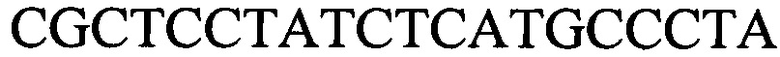 и
и 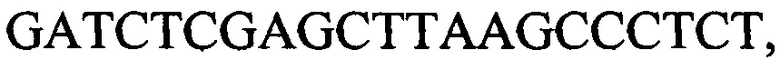 с длиной амплифицированного фрагмента 64 п. н. или 76 п. н.
с длиной амплифицированного фрагмента 64 п. н. или 76 п. н.
В реакционную ПЦР смесь добавляют по 1 микролитру специфических праймеров, 1 микролитр термостабильной ДНК-полимеразы и вносят 5 микролитров супернатанта ДНК. Общий объем реакционной смеси составляет 25 микролитров. Смесь перемешивают на вортексе и амплифицируют при условиях: 95°С - 3 мин (1 цикл); 95°С - 20 сек, 55°С - 20 сек, 72°С - 20 сек (35 циклов), 72°С - 7 мин.
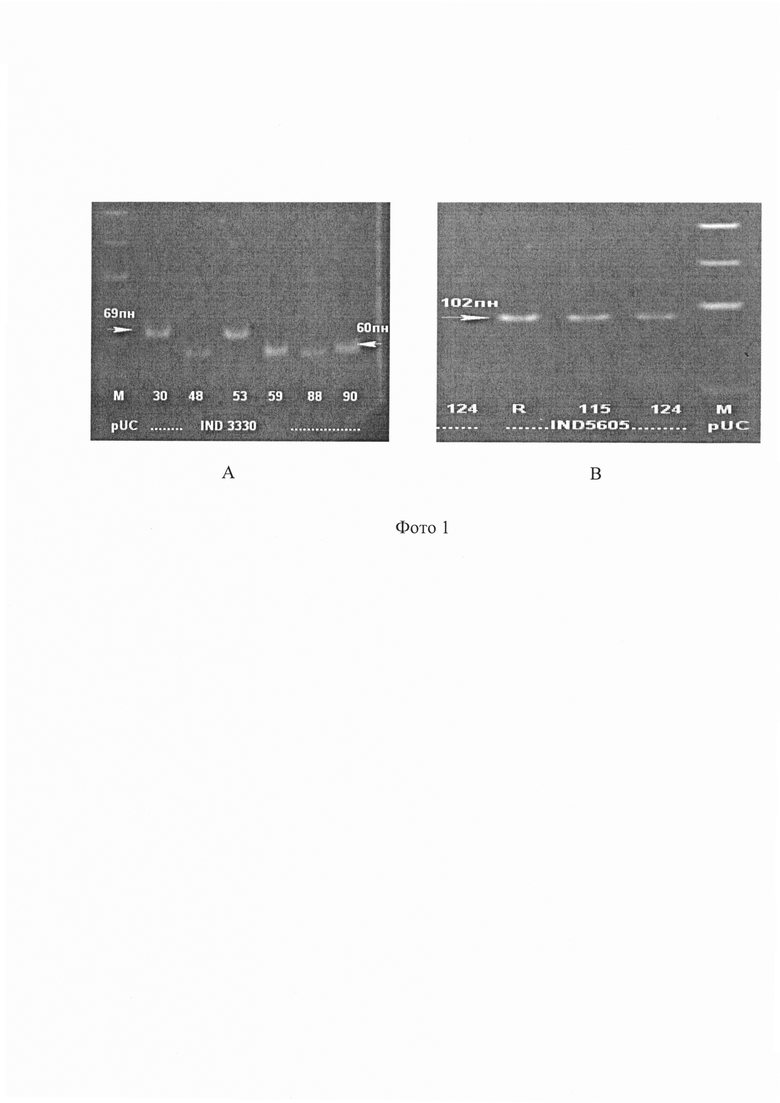
Учет результатов амплификации проводят с помощью электрофореза в 8% полиакриламидном геле в присутствии маркера молекулярных масс ДНК (см. фото 2).
А - продукты амплификации INDEL-генов 6405, 340; стрелки указывают позиции аллелей 100,106 п. н. и 79, 85 п. н., М-маркерная ДНК.
В - продукты амплификации INDEL-гена 1390; стрелки указывают позиции аллелей 64 и 76 п. н., М-маркерная ДНК.
Анализ продуктов амплификации INDEL-гена 6405 (А) показывает, что два из шести изученных штаммов (157,206) имеют аллель 106 п. н., а четыре (R,134,146,155) - аллель 100 п. н. Анализ продуктов амплификации INDEL-гена 340 (А) показывает, что пять из шести изученных штаммов (134,146,155,157,206) имеют аллель 79 п. н., а один (R) - аллель 85 п. н. Анализ продуктов амплификации INDEL-гена 1390 (В) показывает, что два из шести (R,134) изученных штаммов имеют аллель 64 п. н., а четыре (70,77,115,124) - аллель76 п. н. Данные по размерам аллелей для каждого штамма заносят в таблицу, и проводят сравнительный анализ выявленных INDEL-генов между собой и с идентификационной таблицей 1.
Следовательно для дифференциации указанных штаммов необходимо провести дополнительные исследования к другим INDEL-генам.
Пример 3. Расследование случая семейного хеликобактериоза.
У семьи из трех человек (отец, мать и ребенок) был диагностирован хронический гастрит. После взятия биопсийного материала из каждого образца была выделена культура Н. pylori. Для выяснения происхождения штамма Н. pylori у ребенка был проведен анализ всех выделенных культур, как описано в примерах 1 и 2. Результаты определения аллелей 5 INDEL-генов приведены в таблице 2.
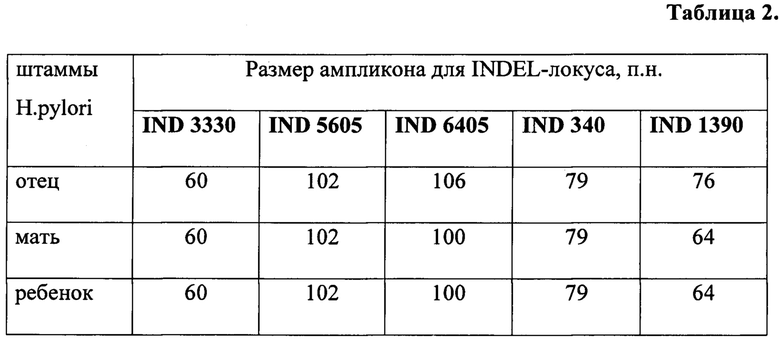
Результаты показывают совпадение генотипов штаммов Н. pylori, выделенных от матери и ребенка по всем пяти INDEL-генам и их отличие от генотипа штамма Н. pylori, выделенного от отца.
Вывод: передача штамма Н. pylori ребенку могла произойти только от матери.
Пример 4.
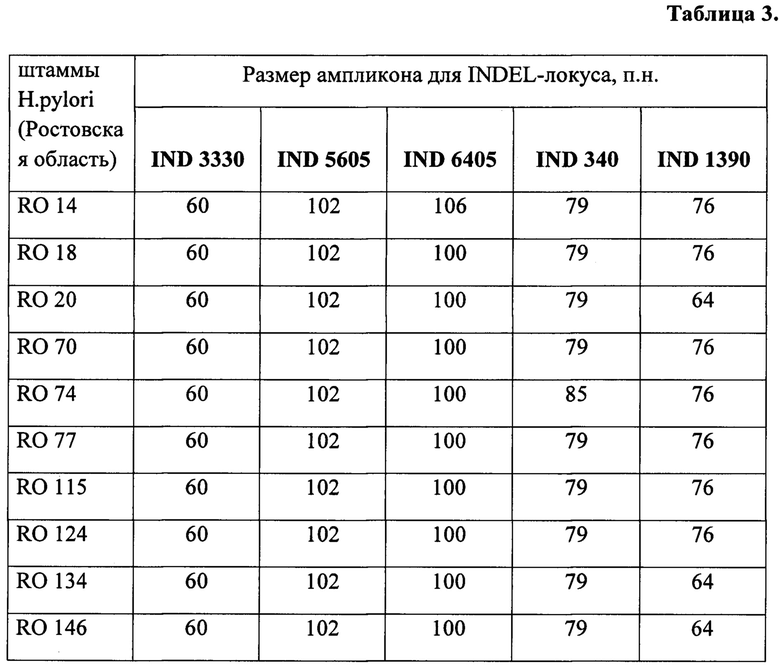
Из коллекции Ростовского-на-Дону научно-исследовательского противочумного института выбраны 14 штаммов Н. pylori, выделенных в Ростовской области. Последние дифференцированы методом молекулярно-генетического типирования с помощью предложенного способа (см. табл. 3). Полученные результаты свидетельствуют о возможности дифференциации штаммов Н. pylori по указанным пяти INDEL-генам.
Анализ коллекции штаммов Н. pylori, выделенных в Ростовской области, подтвердил существование полиморфизма длин указанных генов. Обнаружено существование всего двух четко дискриминируемых по электрофоретической подвижности аллелей для каждого из INDEL-генов (см. таблицу 3).
Вывод: Набор значений размера фрагментов аллелей для каждого штамма по каждому из пяти INDEL-генов является его индивидуальной характеристикой и позволяет дифференцировать один штамм от другого и определять их происхождение путем сравнения с идентификационной таблицей 1.

Использование предполагаемого изобретения позволяет достоверно и быстро за счет подбора праймеров унифицировать и создать набор значений размера фрагментов аллелей для каждого штамма Н. pylori по каждому из пяти INDEL-генов, которые являются его индивидуальной характеристикой и позволяют дифференцировать один штамм от другого и определять их происхождение.
Источники информации
1. Xia Н.Х., Talley N.J, Keane СТ.,  C.F. Reccurence of Helicobacter pylori infection after successful eradication: nature and possible causes // Dig. Dis. Sci. - 1997. - Vol. 42. - №9. - P. 1821-1834.
C.F. Reccurence of Helicobacter pylori infection after successful eradication: nature and possible causes // Dig. Dis. Sci. - 1997. - Vol. 42. - №9. - P. 1821-1834.
2. Takami, S., T. Hayashi, H. Akashi, T. Shimoyama, and T. Tamura. 1994. Genetic heterogeneity of Helicobacter pylori by pulse-field gel electrophoresis and re-evaluation of DNA homology. Eur. J. Gastroenterol. Hepatol. Suppl. 1:S53-S60
3. Salaun, L., C. Audibert, G. Le Ley, C. Burucoa, J.L. Fauchere, and B. Picard. 1998. Panmictic structure of Helicobacter pylori demonstrated by the comparative study of six genetic markers. FEMS Microbiol. Lett. 161:231-239.
4. Ann-Catrin, E.Т., N. Hosseini, A.M. Svennerholm, and I. Bo  . 2000. Different Helicobacter pylori strains colonize the antral and duodenal mucosa of duodenal ulcer patients. Helicobacter 5:69-78.
. 2000. Different Helicobacter pylori strains colonize the antral and duodenal mucosa of duodenal ulcer patients. Helicobacter 5:69-78.
5. Miehlke, S., R. Thomas, O. Gutierrez, D.Y. Graham, and M.F. Go. 1999. DNA fingerprinting of single colonies of Helicobacter pylori from gastric cancer patients suggests infection with a single predominant strain. J. Clin. Microbiol. 37:245-247.
6. Akopyantz, N., N. O. Bukanov, T. U.Westblom, S. Kresovich, and D. E. Berg. 1992. DNA diversity among clinical isolates of Helicobacter pylori detected by PCR-based RAPD fingerprinting. Nucleic Acids Res. 20:5137-5142.
7. Guo. Genotyping analysis of Helicobacter pylori using multiple-locus variable-number tandem-repeats analysis in five regions of China and Japan/. Guo et al. // BMC Microbiology 2011, 11:197.
8. Vladimir M. Sorokin*, Ruslan V. Pisanov, Elena A. Bereznyak, Lubov A. Prozorova. Development of a Multiple-Locus Variable number of tandem repeat Analysis (MLVA) for Helicobacter pylori and its application to Helicobacter pylori isolates from Rostov Region, Russia. Electron. J. Biomed. - 2012, 3:32-9. (www.biomed.uninet.edu.06.2013.)
9. Van Belkum A., Struelens M., de Visser H. et al. Role the genomic typing in taxonomy, evolutionary genetics and microbial epidemiology // J. Clin. Microbiol.Rev. - 2001. - Vol. 14(3). - P. 547-560.
10. Larsson P., Svensson K., Karlsson L., Guala D., Granberg M., Forsman M., and Johansson A. Canonical insertion-deletion markers for rapid DNA typing of Francisella tularensis. // Emerging Infectious Diseases 2007. Vol. 13, No. 11, P. 1725-1732.
11. Silvia E Molina-Castro, Dayana Herrera, Wendy 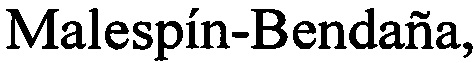 Vanessa
Vanessa  & Clas Une (2014) The geographic origin of Helicobacter pylori isolated from Costa Rican patients, Gut Microbes, 5:4, 517-521, DOI: 10.4161/gmic.32148
& Clas Une (2014) The geographic origin of Helicobacter pylori isolated from Costa Rican patients, Gut Microbes, 5:4, 517-521, DOI: 10.4161/gmic.32148
12. Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности: Методические указания. МУ 1.3.2569-09. - М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2009. - 35 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дифференциации штаммов Pseudomonas aeruginosa с помощью молекулярно-генетического типирования | 2023 |
|
RU2816184C1 |
| Способ дифференциации штаммов Legionella pneumophila путем молекулярно-генетического типирования | 2019 |
|
RU2709174C1 |
| СПОСОБ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОГО ВНУТРИВИДОВОГО ТИПИРОВАНИЯ V. cholerae О1 И О139 СЕРОГРУПП | 2014 |
|
RU2575046C2 |
| Способ дифференциации штаммов Francisella tularensis путем молекулярно-генетического типирования | 2020 |
|
RU2756854C1 |
| Способ молекулярно-генетического типирования штаммов Klebsiella pneumoniae с использованием INDEL-маркеров | 2022 |
|
RU2796431C1 |
| Способ генетической дифференциации штаммов Yersinia pseudotuberculosis путем молекулярно-генетического типирования | 2019 |
|
RU2736649C1 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ШТАММОВ Helicobacter pylori МЕТОДОМ МУЛЬТИЛОКУСНОГО VNTR-ТИПИРОВАНИЯ | 2011 |
|
RU2482191C1 |
| Способ определения подвидов Francisella tularensis методом мультипраймерной ПЦР | 2021 |
|
RU2765495C1 |
| СПОСОБ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОГО ТИПИРОВАНИЯ ШТАММОВ САЛЬМОНЕЛЛ ПО INDEL-МАРКЕРАМ | 2022 |
|
RU2786577C1 |
| СПОСОБ ГЕНЕТИЧЕСКОГО INDEL-ТИПИРОВАНИЯ ШТАММОВ BRUCELLA MELITENSIS | 2019 |
|
RU2732425C1 |
Изобретение относится к области медицинской микробиологии, а именно к способам молекулярно-генетического типирования штаммов возбудителей инфекционных заболеваний, которые используются при микробиологическом и молекулярно-генетическом мониторинге штаммов H.pylori, циркулирующих на различных территориях, с целью их дифференциации. Из ДНК Н. pylori исследуемой пробы выявляют пять общих INDEL-генов, имеющих делеции определенного размера, а именно IND-3330, 5605, 6405, 340 и 1390, с последующей их амплификацией с помощью сконструированных специфических праймеров, выявляющих два альтернативных аллеля: к гену IND-3330 - праймеры  и
и  с длиной амплифицированного фрагмента 60 п. н. или 69 п. н., к гену IND-5605 - праймеры
с длиной амплифицированного фрагмента 60 п. н. или 69 п. н., к гену IND-5605 - праймеры 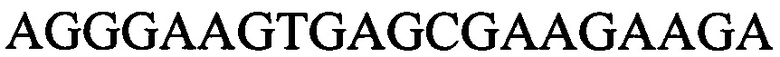 и
и с длиной амплифицированного фрагмента 93 п. н. или 102 п. н., к гену IND-6405 - праймеры
с длиной амплифицированного фрагмента 93 п. н. или 102 п. н., к гену IND-6405 - праймеры 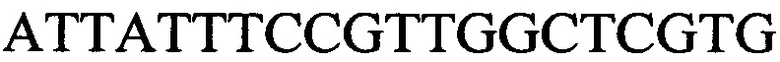 и
и  с длиной амплифицированного фрагмента 100 п. н. или 106 п. н. к гену IND-340 - праймеры
с длиной амплифицированного фрагмента 100 п. н. или 106 п. н. к гену IND-340 - праймеры  и
и  с длиной амплифицированного фрагмента 79 п. н. или 85 п. н., к гену IND-13 90 - праймеры
с длиной амплифицированного фрагмента 79 п. н. или 85 п. н., к гену IND-13 90 - праймеры 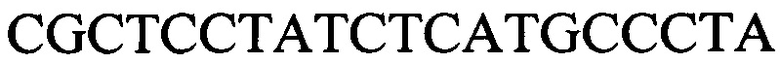 и
и 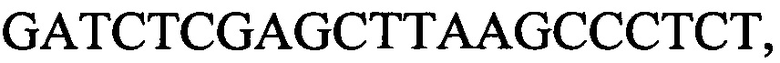 с длиной амплифицированного фрагмента 64 п. н. или 76 п. н., при этом учет результатов дифференциации проводят визуально после электрофореза в 8% полиакриламидном геле в присутствии маркера молекулярных масс ДНК, причем для каждого штамма устанавливают уникальный INDEL-генотип по пяти INDEL-генам, а путем сравнения выявленных INDEL-генотипов между собой и с известными генотипами идентификационной таблицы устанавливают общее или различное происхождение исследуемых штаммов Н. pylori. При этом ПЦР проводят в объеме 25 мкл и реакционная смесь содержит: 1,5 мМ Mg-буфер, 0,2 мМ смеси дНТФ, 1,0 мкМ смеси праймеров (по 0,5 мкМ каждого праймера), 25 нг ДНК-матрицы,1 ед. ДНК-полимеразы, оставшийся объем - вода, при этом в качестве матрицы используют геномную ДНК, объемом 5 мкл, которую получают из разных штаммов Н. pylori. ПЦР проводят с соблюдением режимов: 1 этап - денатурация при 95°С - 3 мин (1 цикл); 2 этап - денатурация при 95°С - 20 с, отжиг при 55°С - 20 с, синтез при 72°С - 20 с (35 циклов); 3 этап - досинтез при 72°С - 7 мин (1 цикл). Способ позволяет достоверно и быстро дифференцировать один штамм от другого и определить их происхождение. 2 з.п. ф-лы, 2 ил., 3 табл., 4 пр.
с длиной амплифицированного фрагмента 64 п. н. или 76 п. н., при этом учет результатов дифференциации проводят визуально после электрофореза в 8% полиакриламидном геле в присутствии маркера молекулярных масс ДНК, причем для каждого штамма устанавливают уникальный INDEL-генотип по пяти INDEL-генам, а путем сравнения выявленных INDEL-генотипов между собой и с известными генотипами идентификационной таблицы устанавливают общее или различное происхождение исследуемых штаммов Н. pylori. При этом ПЦР проводят в объеме 25 мкл и реакционная смесь содержит: 1,5 мМ Mg-буфер, 0,2 мМ смеси дНТФ, 1,0 мкМ смеси праймеров (по 0,5 мкМ каждого праймера), 25 нг ДНК-матрицы,1 ед. ДНК-полимеразы, оставшийся объем - вода, при этом в качестве матрицы используют геномную ДНК, объемом 5 мкл, которую получают из разных штаммов Н. pylori. ПЦР проводят с соблюдением режимов: 1 этап - денатурация при 95°С - 3 мин (1 цикл); 2 этап - денатурация при 95°С - 20 с, отжиг при 55°С - 20 с, синтез при 72°С - 20 с (35 циклов); 3 этап - досинтез при 72°С - 7 мин (1 цикл). Способ позволяет достоверно и быстро дифференцировать один штамм от другого и определить их происхождение. 2 з.п. ф-лы, 2 ил., 3 табл., 4 пр.
1. Способ дифференциации штаммов Helicobacter pylori путем молекулярно-генетического типирования, включающий выделение ДНК из исследуемого штамма Н. pylori, постановку ПЦР со специфическими праймерами и учет реакции с помощью электрофореза, отличающийся тем, что из ДНК исследуемого штамма Н. pylori выявляют пять общих INDEL-генов, имеющих делеции определенного размера, а именно IND-3330, 5605, 6405, 340 и 1390, с последующей их амплификацией с помощью сконструированных специфических праймеров, выявляющих два альтернативных аллеля:
к гену IND-3330 - праймеры 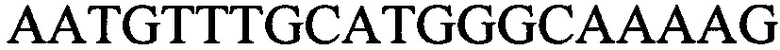 и
и
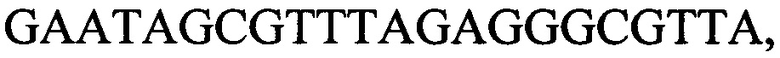 с длиной амплифицированного фрагмента 60 п. н. или 69 п. н.,
с длиной амплифицированного фрагмента 60 п. н. или 69 п. н.,
к гену IND-5605 - праймеры 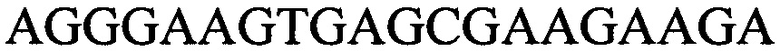 и
и
 с длиной амплифицированного фрагмента 93 п. н. или 102 п. н.,
с длиной амплифицированного фрагмента 93 п. н. или 102 п. н.,
к гену IND-6405 - праймеры 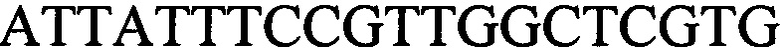 и
и
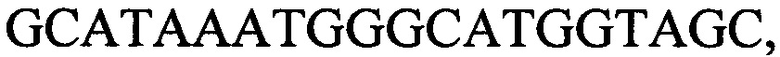 с длиной амплифицированного фрагмента 100 п. н. или 106 п. н.,
с длиной амплифицированного фрагмента 100 п. н. или 106 п. н.,
к гену IND-340 - праймеры  и
и
 с длиной амплифицированного фрагмента 79 п. н. или 85 п. н.,
с длиной амплифицированного фрагмента 79 п. н. или 85 п. н.,
к гену IND-1390 - праймеры 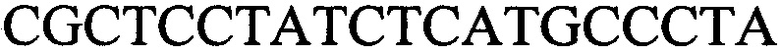 и
и
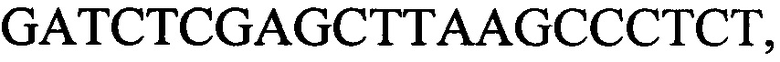 с длиной амплифицированного фрагмента 64 п. н. или 76 п. н.,
с длиной амплифицированного фрагмента 64 п. н. или 76 п. н.,
при этом учет результатов дифференциации проводят визуально после электрофореза в 8% полиакриламидном геле в присутствии маркера молекулярных масс ДНК, причем для каждого штамма устанавливают уникальный INDEL-генотип по пяти INDEL-генам, а путем сравнения выявленных INDEL-генотипов между собой и с известными генотипами идентификационной таблицы устанавливают общее или различное происхождение исследуемых штаммов Н. pylori.
2. Способ по п. 1, отличающийся тем, что ПНР проводят в объеме 25 мкл и реакционная смесь содержит:
1,5 мМ Mg-буфер,
0,2 мМ смеси дНТФ, 1,0 мкМ смеси праймеров (по 0,5 мкМ каждого праймера),
25 нг ДНК-матрицы,
1 ед. ДНК-полимеразы, оставшийся объем - вода, при этом в качестве матрицы используют геномную ДНК объемом 5 мкл, которую получают из разных штаммов Н. pylori.
3. Способ по п. 1, отличающийся тем, что ПЦР проводят с соблюдением режимов:
1 этап - денатурация при 95°С - 3 мин (1 цикл);
2 этап - денатурация при 95°С - 20 с, отжиг при 55°С - 20 с, синтез при 72°С - 20 с (35 циклов);
3 этап - досинтез при 72°С - 7 мин (1 цикл).
| СПОСОБ ДИФФЕРЕНЦИРОВАНИЯ ПОДВИДОВ ТУЛЯРЕМИЙНОГО МИКРОБА | 2011 |
|
RU2478717C1 |
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ, СПОСОБ ВЫЯВЛЕНИЯ И ДИФФЕРЕНЦИАЦИИ ШТАММОВ ВИРУСА ЛИХОРАДКИ ДОЛИНЫ РИФТ НА ОСНОВЕ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ И РЕСТРИКЦИОННОГО АНАЛИЗА | 2010 |
|
RU2457255C2 |
| СПОСОБ И НАБОР ДЛЯ УСКОРЕННОЙ ДИАГНОСТИКИ КОКЛЮША | 2007 |
|
RU2346987C2 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ТОКСИГЕННЫХ И АТОКСИГЕННЫХ ШТАММОВ ХОЛЕРНЫХ ВИБРИОНОВ 01 СЕРОГРУППЫ ПО ИНГИБИРУЮЩЕЙ АКТИВНОСТИ | 2015 |
|
RU2596401C1 |
Авторы
Даты
2019-05-21—Публикация
2018-10-05—Подача