ЗАЯВЛЕНИЕ ПРИОРИТЕТА
[0001] Настоящее изобретение испрашивает приоритет, в соответствии с 35 USC § 119 (е), предварительной заявки США № 61/778998, поданной 13 марта 2013 года, полное содержание которой включено в данное описание путем ссылки.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к способу лечения катаплексии у субъекта, который в этом нуждается, содержащему введение субъекту терапевтически эффективного количества определенных карбаматов.
УРОВЕНЬ ТЕХНИКИ
[0003] Катаплексия - это внезапный и преходящий эпизод потери мышечного тонуса, вызываемого часто эмоциями, такими как смех, страх, гнев, неудовлетворенность, раздражение, повышенная возбудимость, душевный дискомфорт и печаль. Внезапная потеря мышечного тонуса при катаплексии похожа на мышечную атонию, связанную с быстрым движением глаз во время сна, но она происходит во время бодрствования. Катаплектическая вспышка является внезапной по своему началу и локализована на специфических группах мышц или частях тела. Может произойти резко выраженная вспышка и привести к полному параличу мышц с постуральным коллапсом и возможной травмой. Тем не менее, наиболее часто пациенты с постуральным коллапсом способны избежать травмы, поскольку падение происходит медленно и прогрессивно. Наиболее часто ограниченные катаплектические вспышки охватывают голову и лицо, шею, верхние конечности, и реже нижние конечности, известные как "устойчивость колена". Вспышки могут длиться от нескольких секунд до десяти минут и могут происходить до нескольких раз в неделю. У некоторых пациентов возникает состояние катаплексии или периоды повторяющейся потери мышечного тонуса и могут продолжаться несколько часов или дней.
[0004] Катаплексия - это достаточно редкое заболевание (заболеваемость несколько меньше 5 случаев на 10000 в привычной социальной среде), но она воздействует примерно на 70% людей, у которых имеется наркоплексия. Однако в некоторых случаях катаплексия происходит без совместного проявления наркоплексии. Кроме того, свыше 30% пациентов с наркоплексией могут никогда не сталкиваться с катоплексией. Точная причина катаплексии неизвестна, но состояние определенно связано с проявлениями сильных эмоций и снижением уровня нейротрансмиттерного гипокретина. Каталепсия считается вторичной, если она происходит благодаря конкретным поражениям головного мозга, которое вызывает уменьшение гипокретинового трансмиттера. Катаплексия также может присутствовать как побочный эффект преждевременной отмены конкретных лекарств, таких как антидепрессанты, селективные ингибиторы повторного поглощения серотонина (SSRI).
[0005] Катаплексия, связанная с наркоплексией или с другими причинами, является причиной нетрудоспособности и потенциально опасна. Независимо от причины катаплексия связана с транспортными и промышленными травмами, и является причиной сниженной профессиональной деятельности и существенного личного дистресса. Терапевтический агент, который уменьшает или устраняет катаплексию, имел бы важное значение не только для отдельных пациентов, но и для общественного здоровья и безопасности.
РАСКРЫТИЕ СУЩНОСТИ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0006] Настоящее изобретение относится к способу лечения катаплексии у пациента, нуждающегося в таком лечении, содержащему введение терапевтически эффективного количества соединения формулы (I):
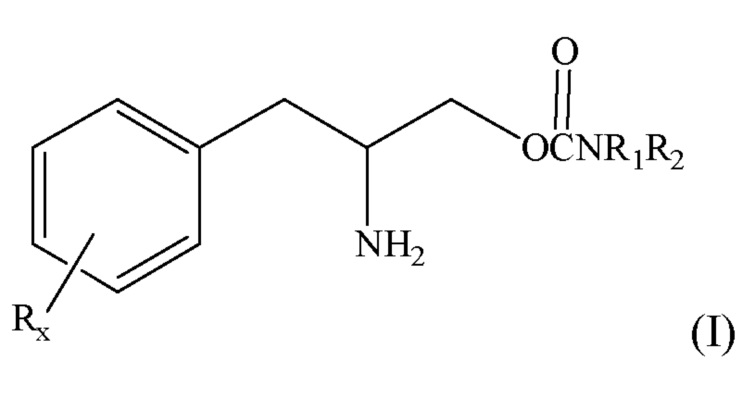
или его фармацевтически приемлемой соли или сложного эфира, где R является элементом, выбранным из группы, состоящей из алкила с количеством углеродных атомов от 1 до 8, галогена, алкокси с количеством атомов углерода от 1 до 3, нитро, гидрокси, трифторметила и тиоалкокси с количеством атомов углерода от 1 до 3; х является целым числом от 0 до 3, при условии, что R может быть таким же или другим, когда х равен 2 или 3; R1 и R2 могут быть одинаковыми или отличаться друг от друга и независимо выбраны из группы, содержащей водород, низший алкил с числом атомов углерода от 1 до 8, арил, арилалкил, циклоалкил с числом атомов углерода от 3 до 7; или R1 и R2 могут быть соединены с целью образования 5-7-членного гетероцикла, необязательно замещенного элементом, выбранным из группы, состоящей из, алкильной и арильной группы, при этом гетероцикл может содержать 1-2 атома азота и 0-1 атом кислорода, в котором атомы азота непосредственно не связаны друг с другом или с атомом кислорода.
[0007] Варианты осуществления настоящего изобретения включают способ лечения катаплексии у субъекта, нуждающегося в таком лечении, включающий в себя стадию введения субъекту терапевтически эффективного количества энантиомера формулы (I), практически не содержащего других энантиомеров, или энантиомерной смеси, в которой преобладает один энантиомер формулы (I).
[0008] В некоторых вариантах осуществления соединение формулы (I) является соединением формулы (Ia)
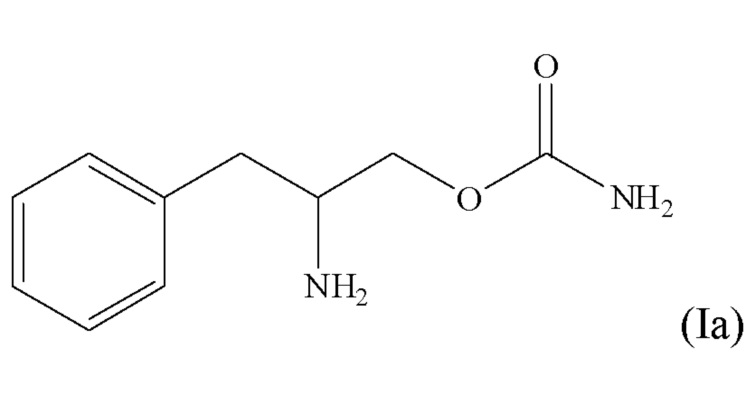
или его фармацевтически приемлемой солью или сложным эфиром.
[0009] В некоторых вариантах осуществления соединение формулы (I) является соединением формулы (Ib)
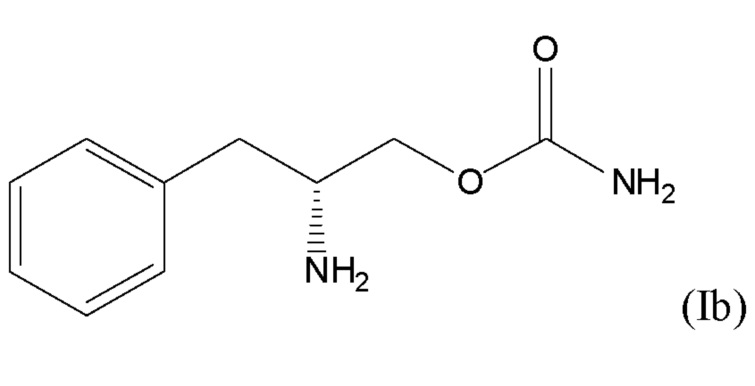
или его фармацевтически приемлемой солью или сложным эфиром. Это соединение называется (R)-(бета-аминобензопропил)карбамат или О-карбамоил-(D)-фенилаланинол, и его альтернативно назвали ADX-N05, SKL-N05, YKP10A и R228060.
[0010] Варианты осуществления изобретения включают применение, для получения лекарственного средства для лечения катаплексии, энантиомера формулы (I), практически не содержащего других энантиомеров, или энантиомерной смеси, в которой преобладает один энантиомер формулы (I).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0011] Далее настоящее изобретение будет описано со ссылкой на прилагаемые чертежи и примеры, в которых показаны варианты осуществления изобретения. Однако, настоящее изобретение можно реализовать с помощью многих различных форм и не должно быть истолковано как ограниченное вариантами осуществления, раскрытыми здесь. Скорее, эти варианты осуществления предложены для того, чтобы сделать раскрытие полным и всесторонним и полностью донести объем изобретения до квалифицированного специалиста в данной области техники.
[0012] Если не определено иначе, то все технические и научные термины, используемые здесь, имеют одинаковые значения, обычно понятные среднему специалисту в области техники, к которой принадлежит настоящее изобретение. Терминология, используемая при описании изобретения в данном документе, дана только с целью описания отдельных вариантов осуществления и не предназначается для ограничения изобретения.
[0013] Если из контекста не следует иначе, терминология предназначается специально для того, чтобы различные признаки изобретения, описанные здесь, можно было использовать в любой комбинации. Более того настоящее изобретение предполагает также, что в некоторых вариантах осуществления изобретения любой признак изобретения или комбинация признаков изобретения, установленных в настоящем изобретении, могут быть исключены или пропущены. Для иллюстрации, если в описании изобретения устанавливается, что композиция содержит компоненты A, B и C, специально предназначено, что любой из A, B или C, или их комбинации можно пропустить или вывести по отдельности или в любом сочетании.
Определения
[0014] Термины, представленные в единственном числе, относятся к одному или нескольким из перечисленных элементов. Например, секция может означать одну секцию или многообразие секций.
[0015] Кроме того, используемый здесь "и/или" относится к и охватывает любое или все возможные сочетания одного или более из связанных перечисленных пунктов, а также отсутствие сочетаний, если интерпретированы в альтернативе ("или").
[0016] Термин "примерно, около", используемый здесь ссылаясь на измеряемую величину, такой как количество дозы (например, количество соединения) и т.п., означает охватывание вариаций ±20%, ±10%, ±5%, ±1%, ±0,5% или даже ±0,1% из указанного количества.
[0017] Выражения "содержать", "содержит" и "содержащий", используемые здесь, указывают на наличие установленных признаков изобретения, целых чисел, стадий, операций, элементов и/или компонентов, но не исключает наличия или добавления одного или более других признаков изобретения, целых чисел, стадий, операций, элементов, компонентов и/или их групп.
[0018] Используемая здесь переходная фраза "состоящий, по сути, из" означает, что объем притязания должен быть интерпретирован для того, чтобы охватить указанные материалы или стадии, указанные в пункте формулы изобретения "и те, которые не оказывают существенного воздействия на основную и новую характеристику (характеристики)" заявленного изобретения. Смотрите In re Herz, 537 F.2d 549, 551-52, 190 U.S.P.Q. 461, 463 (CCPA 1976) (акцент в оригинале); смотрите также MPEP § 2111.03. Таким образом, выражение "состоящий, по сути, из" при использовании в пункте изобретения или описании изобретения не должен быть интерпретирован как эквивалент "содержащий".
[0019] Используемые здесь выражения "увеличить", "увеличивает", "увеличенный", "увеличение" и аналогичные выражения означают повышение по меньшей мере примерно на 25%, 50%, 75%, 100%, 150%, 200%, 300%, 400%, 500% или больше.
[0020] Используемые здесь выражения "снижать", "снижает", "сниженный", "снижение" и аналогичные выражения означают снижение по меньшей мере примерно на 5%, 10%, 15%, 20%, 25%, 35%, 50%, 75%, 80%, 85%, 90%, 95%, 97% или больше. В особых вариантах осуществления изобретения снижение не является результатом или, по сути, не является результатом (т.е. незначительное количество, например, меньше, чем примерно 10% или даже 5%) определяемой активности или количества.
[0021] Используемое здесь "эффективное количество" относится к количеству соединения, композиции и/или составу изобретения, которое является достаточным для произведения требуемого эффекта, который может быть терапевтическим и/или благоприятным. Эффективное количество будет изменяться в зависимости от возраста, общего состояния субъекта, степени тяжести состояния, которое нужно лечить, определенного вводимого агента, продолжительности лечения, природы любого сопутствующего лечения, используемого фармацевтически приемлемый носитель, и аналогичных факторов в рамках знаний и клинического опыта квалифицированного специалиста. В случае необходимости "эффективное количество" в любом отдельном случае может быть определено квалифицированным специалистом с помощью ссылок на соответствующие тексты и литературу и/или используя рутинный эксперимент.
[0022] Выражение "лечить", "лечение" или "лечение (терапия)" (и его грамматические вариации) означает, что уменьшается тяжесть состояния субъекта, по меньшей мере частично улучшается или улучшается (стабилизируется) и/или, что достигнуты некоторое улучшение, смягчение или снижение по меньшей мере одного из клинических симптомов и/или имеется задержка развития заболевания, снижение продолжительности атак или патологии. Относительно катаплексии выражение относится к уменьшению количества вспышек, снижению продолжительности вспышек и/или уменьшению тяжести вспышек. Например, лечение может давать уменьшение количества катаплектических явлений в неделю по меньшей мере примерно на 20%, например по меньшей мере 30%, 40%, 50%, 60%, 70%, 80% или больше.
[0023] Используемое здесь "лечебное эффективное" количество является количеством, которое является достаточным для лечения субъекта (как определено здесь). Квалифицированный специалист в области техники будет учитывать, что терапевтические эффекты не должны быть законченными или целительными, как только субъекту предоставлена некоторая польза.
[0024] "Субъект" изобретения включает в себя любой животный организм, который имеет или у которого предполагается наличие катаплексии. Таким субъектом является, в большинстве случаев, млекопитающий субъект (например лабораторное животное, такое как крыса, мышь, морская свинка, кролик, примат и т.д.), сельскохозяйственное или промышленное животное (например корова, лошадь коза, осел, овца и т.д.) или домашнее животное (например кошка, собака, хорек и т.д.). В определенных вариантах осуществления субъектом является примат, нечеловекоподобный примат (например шимпанзе, павиан бабуин, мартышка, горилла и т.д.) или человек. В определенных вариантах осуществления субъектом изобретения может быть субъект, у которого имеется или предполагается наличие катаплексии. Субъектом изобретения может быть субъект, у которого имеется или предполагается риск развития катаплексии. Альтернативно субъект согласно изобретению может также включать субъекта, у которого не известна ранее катаплексия или не предполагалось наличие катаплексии. В вариантах воплощения изобретения у субъекта имеется наркоплексия или предполагается ее наличие. Субъекты включают мужчин и/или женщин любого возраста, включая новорожденных, малолетних, зрелых и гериартрических субъектов.
[0025] "Пациентом, нуждающимся в лечении" для способа изобретения может быть любой субъект или пациент, который имеет катаплексию, у которого предполагается катаплексия или у которого повышенный риск развития катаплексии. В некоторых вариантах осуществления "пациентом, нуждающимся в лечении" является пациент, у которого умеренная или серьезная катаплексия, например, пациент, у которого 3 или более катаплектических явления в неделю, например 4, 5, 6, 7, 8, 9 или 10 или больше катаплектических явлений в неделю
[0026] Термин "фармацевтически приемлемые соли или эфиры" будет означать нетоксичные соли или эфиры соединений, использованных в настоящем изобретении, которые обычно получаются путем взаимодействия свободной кислоты с приемлемым органическим или неорганическим основанием или свободного основания с приемлемой органической или неорганической кислотой. Примеры таких солей включают, но не ограничены ими, ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, кальций, кальциевую соль этилендиаминтетрауксусной кислоты, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, соль этилендиаминтетрауксусной кислоты, эдисилат, эстолат, эсилат, фумарат, глуцептат, глюконат, глютамат, гликоллиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат, памоат, пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, калий, соль салициловой кислоты, натрий, стеарат, основную уксуснокислую соль, соль янтарной кислоты, таннат, тартрат, теоклат, тозилат, триэтиодид и валерат.
[0027] Использованный здесь термин "сопутствующее введение" или "комбинированное введение" соединения, терапевтического агента или известного лекарственного средства вместе с соединением по настоящему изобретению означает введение известного препарата или лекарственного средства и в дополнение одного или более соединений по настоящему изобретению в такой момент, когда и известное лекарственное средство, и это соединение обеспечит терапевтический эффект. В некоторых случаях терапевтический эффект будет синергическим. Такое сопутствующее введение может включать одновременное (т.е. в то же самое время), предварительное или последующее введение известного лекарственного средства по отношению к введению соединения по настоящему изобретению. Специалист с обычной квалификацией в этой области не будет иметь трудностей в определении соответствующего времени, последовательности и доз введения для конкретных лекарственных средств и соединений по настоящему изобретению.
[0028] Кроме того, в некоторых вариантах осуществления соединения настоящего изобретения будут использоваться и по отдельности, и в сочетании друг с другом или в сочетании с одним или более другими терапевтическими лекарственными средствами, описанными выше, или другими солями или сложными эфирами для получения лекарственного средства с целью предоставления лечения катаплексии пациенту или субъекту, который в этом нуждается.
[0029] Настоящее изобретение основано в некоторой степени на открытии, что фенилалкиламинокарбаматы формулы I имеют новые и уникальные свойства. Было показано, что эти соединения оказывают благоприятное действие на DREM и катаплексию. Хотя точный механизм действия понятен не полностью, предполагают, что эти соединения не работают для получения их воздействий посредством таких же механизмов, как большинство других известных стимулирующих лекарственных средств. По этой причине соединения формулы I особенно пригодны для использования для лечения катаплексии. Таким образом, эти соединения безопасно могут быть использованы с целью предоставления эффективного лечения катаплексии, независимо от точной этиологии расстройства.
[0030] Один аспект изобретения относится к способу лечения катаплексии, у субъекта, который нуждается в этом, содержащему введение субъекту терапевтически эффективного количества соединения формулы I:
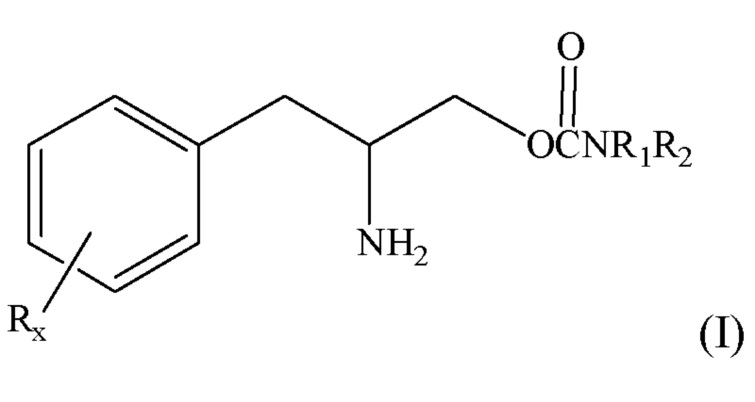
или его фармацевтически приемлемой соли или сложного эфира; где R является элементом, который выбран из группы, состоящей из низшего алкила с количеством углеродных атомов от 1 до 8, галогена, алкокси с количеством атомов углерода от 1 до 3, нитро, гидрокси, трифторметила и тиоалкокси с количеством атомов углерода от 1 до 3; х является целым числом от 0 до 3, при условии, что R может быть таким же или другим, когда х равен 2 или 3; R1 и R2 могут независимо выбираться из группы, содержащей водород, низший алкил с числом атомов углерода от 1 до 8, арил, арилалкил, циклоалкил с числом атомов углерода от 3 до 7; или R1 и R2 могут быть соединены с целью образования 5-7-членного гетероцикла, необязательно замещенного элементом, выбранным из группы, состоящей из алкильной и арильной групп, при этом гетероцикл (циклическое соединение) может содержать 1-2 атома азота и 0-1 атом кислорода, в котором атомы азота непосредственно не связаны друг с другом или с атомом кислорода; при том что субъекту проводят лечение катаплексии.
[0031] Понятно, что заместители и схемы замещения на соединениях настоящего изобретения могут быть выбраны специалистом в области техники с целью предоставления соединений, которые являются химически устойчивыми и которые можно легко синтезировать с помощью технологических процессов, известных из уровня техники, а также способов, предложенных в данном документе.
[0032] В одном варианте осуществления соединением формулы I является соединение формулы Ia:

или его фармацевтически приемлемая соль или сложный эфир.
[0033] В одном варианте осуществления соединением формулы I является (D)-энантиомер, у которого R1 и R2 являются водородом и x равен 0 (соединение Ib).

или его фармацевтически приемлемая соль или сложный эфир. Таким соединением является (R)-энантиомер, если называют по структуре, и является, таким образом, (R)-(бета-аминобензопропил)карбаматом. Это соединение является правовращающим энантиомером, и следовательно, его можно назвать O-карбамоил-(D)-фенилаланинол. Это соединение называют также ADX-N05. В данной спецификации эти наименования могут быть взаимозаменяемыми.
[0034] Настоящее изобретение включает в себя использование выделенных энантиомеров соединения формулы I (например соединений формулы Ia или Ib). В одном варианте осуществления для предоставления лечения субъекту используют фармацевтическую композицию, содержащую выделенный S-энантиомер формулы I. В другом варианте осуществления для предоставления лечения субъекту используют фармацевтическую композицию, содержащую выделенный R-энантиомер формулы I.
[0035] Настоящее изобретение включает также использование смеси энантиомеров формулы I. В одном аспекте настоящего изобретения один энантиомер будет преобладать. Энантиомером, который преобладает в смеси, является энантиомер, который присутствует в смеси в количестве большем, чем любой из других энантиомеров, присутствующих в смеси, например, в количестве больше чем 50%. В одном аспекте один энантиомер будет преобладать в количестве примерно вплоть до 90% или до 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% или больше. В одном варианте осуществления энантиомером, который преобладает в композиции, содержащей соединение формулы I, является S-энантиомер формулы I.
[0036] Настоящее изобретение предоставляет способы использования энантиомеров или энантиомерных смесей, представленных формулой I. Энантиомер карбамата формулы I содержит асимметричный хиральный углерод в положении бензила, который является вторым алифатическим углеродом, примыкающим к фенильному кольцу.
[0037] Энантиомером, который выделяют (в чистом виде), является энантиомер, по существу свободный от соответствующего энантиомера. Таким образом, выделенный энантиомер относится к соединению, которое отделяют методами разделения или подготовленный свободным от соответствующего энантиомера.
[0038] Использованный здесь термин "по существу свободный" означает, что соединение получено со значительно большим количеством одного энантиомера. В предпочтительных вариантах соединение включает по меньшей мере около 90 масс. % одного энантиомера. В других вариантах настоящего изобретения соединение включает по меньшей мере около 99 масс. % одного энантиомера.
[0039] Соединения формулы 1 можно синтезировать способами, известными специалисту в данной области. Соли и сложные эфиры соединений формулы I могут быть получены путем обработки соединения в соответствующем растворителе с помощью соответствующей минеральной или органической кислоты или с помощью других способов, хорошо известных квалифицированному специалисту в данной области.
[0040] Подробные схемы реакций синтеза соединений формулы Iа, а также типичные примеры по приготовлению конкретных соединений были описаны в патентной заявке США № 5705640, в патентной заявке США № 5756817, патентной заявке США № 5955499, патентной заявке США № 6140532, все включенные здесь по ссылке во всей их полноте.
[0041] Из формулы I очевидно, что некоторые из соединений изобретения имеют по меньшей мере один и возможно больше ассиметричных углеродных атомов. Предполагается, что настоящее изобретение включает в рамках его объема стехиометрически чистые изомерные формы соединений, а также их рацематы. Стехиометрически чистые изомерные формы могут быть получены путем применения известных в данной области принципов. Диастереоизомеры могут быть выделены путем применения методов физического разделения, таких как фракционная кристаллизация и хроматографические способы, а энантиомеры могут быть отделены один от другого путем селективной кристаллизации диастереомерных солей с оптически активными кислотами или основаниями или путем хиральной хроматографии. Чистые стереоизомеры также могут быть получены синтетически из соответствующих стереохимически чистых исходных материалов или с применением стереоселективных реакций.
[0042] Во время любых процессов получения соединений по настоящему изобретению может быть необходимо и/или желательно защитить чувствительные или реакционноспособные группы в любых молекулах. Это может быть достигнуто путем применения стандартных защитных групп, подобных тем, которые описаны в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; и Т.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, Third Edition, John Wiley & Sons, 1999. Защитные группы могут быть удалены на стандартной соответствующей стадии с применением методов, известных в этой области.
[0043] Соединения могут вводиться субъекту любым известным способом введения, который включает, но не ограничивается, пероральный, трансбукальный, местный, общий (например трансдермальный, интраназальный или в виде суппозитория) или парентеральный (например внутримышечная, подкожная или внутривенная инъекция). Введение соединений непосредственно в нервную систему может включать, например, внутримозговой, интравентрикулярный, интрацеребровентрикулярный, подоболочечный, интрацистернальный, интраспинальный или периспинальный пути введения посредством доставки через внутричерепные или интравертебральные иглы или катетеры с насосом или без насоса. В зависимости от способа введения соединения формулы I могут быть приготовлены в любой форме. Например, формы, приемлемые для перорального введения, включают твердые формы, такие как пилюли, гелевые капсулы, таблетки, каплеты, капсулы, гранулы и порошки (включающие составы для немедленного высвобождения, высвобождения во времени и для пролонгированного высвобождения). Формы, приемлемые для перорального введения, также включают жидкие формы, такие как растворы, сиропы, эликсиры, эмульсии и суспензии. Кроме того, формы, приемлемые для парентерального введения, включают стерильные растворы, эмульсии и суспензии.
[0044] В определенных вариантах осуществления фармацевтические композиции настоящего изобретения содержат одно или больше соединений формулы I или его соль или сложный эфир без какого-нибудь носителя или вспомогательного вещества для придания массы. В других вариантах осуществления фармацевтические композиции настоящего изобретения содержат одно или более соединений формулы I или его соль или сложный эфир, равномерно перемешанные с фармацевтическим носителем согласно обычным методам приготовления фармацевтических составов. Для того чтобы приготовить фармацевтические композиции по настоящему изобретению, одно или более соединений формулы I или их соли, в качестве активного ингредиента, тщательно смешиваются с фармацевтическим носителем в соответствии с известными методами приготовления фармацевтических составов. Носителями являются инертные фармацевтические вспомогательные вещества, включающие, но не ограниченные ими, связующие, суспендирующие агенты, смазки, отдушки, подсластители, консерванты, красители и покрытия. Для приготовления композиций для пероральных дозированных форм может быть использован любой из обычных фармацевтических носителей. Например, для приготовления жидких пероральных форм приемлемые носители и добавки включают воду, гликоли, масла, спирты, отдушки, консерванты, красители и т.п.; для приготовления твердых пероральных форм приемлемые носители и добавки включают крахмалы, сахара, разбавители, гранулирующие агенты, смазки, связующие, дезинтегрирующие агенты и т.п.
[0045] Композиции могут иметь форму таблеток, пилюль, капсул, мягких лекарственных форм, порошков, составов с замедленным высвобождением, растворов, суспензий, эмульсий, сиропов, эликсиров, аэрозолей или любых других соответствующих составов; и могут содержать по меньшей мере одно соединение изобретения, необязательно в сочетании с по меньшей мере одним фармацевтически приемлемым вспомогательным веществом. Соответствующие вспомогательные вещества хорошо известны среднему специалистам в этой области, и эти вспомогательные вещества и способы составления композиций можно найти в таких стандартных ссылках, как Alfonso AR: Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton Pa., 1985, раскрытие которых включено здесь по ссылке во всей полноте и для всех целей. Соответствующие жидкие носители, особенно для растворов для инъекций, включают воду, водный изотонический раствор, водный раствор декстрозы и гликоли.
[0046] Карбаматы могут быть предоставлены в виде водных суспензий. Водные суспензии по настоящему изобретению могут содержать карбамат в смеси с подходящими вспомогательными веществами для получения водных суспензий. Такие вспомогательные вещества могут включать, например, суспендирующий агент, такой как карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, смола трагаканта, смола акации, и диспергирующие или увлажняющие агенты, такие как встречающийся в природе фосфатид (например лецитин), продукт конденсации окиси алкилена с жирной кислотой (например полиоксиэтиленстеарат), продукты конденсации окиси этилена с алифатическим спиртом с длинной цепочкой (например оксицетанол гептадекаэтилена), продукт конденсации окиси этилена с частичным эфиром, полученным из жирной кислоты и гекситола (например моноолеат полиоксиэтиленсорбита) или продукт конденсации окиси этилена с частичным эфиром, полученным из жирной кислоты и ангидрида гекситола (например полиоксиэтилен сорбитан моноолеат).
[0047] Водные суспензии могут также содержать один или более консервантов, таких как этил- или н-пропил-п-гидроксибензоат, один или более окрашивающих агентов, одну или более отдушек, один или более подсластителей, таких как сахароза, аспартам или сахарин. В составах может быть отрегулирована осмолярность.
[0048] Масляные суспензии могут быть приготовлены путем суспендирования карбамата в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин, или в их смеси. Масляные суспензии могут содержать загущающий агент, такой как пчелиный воск, твердый парафин или цетиловый спирт. Для получения съедобного перорального продукта могут быть добавлены подсластители, такие как глицерин, сорбит или сахароза. Эти продукты могут быть защищены путем добавления антиоксиданта, такого как аскорбиновая кислота. Пример масляного носителя для инъекций смотрите в публикации Minto, J. Pharmacol. Exp. Ther. 281: 93, (1997). Фармацевтические составы по настоящему изобретению могут быть также в виде масляно-водных эмульсий. Масляная фаза может быть растительным маслом или минеральным маслом, как было описано выше, или их смесью.
[0049] Приемлемые эмульгирующие агенты включают встречающиеся в природе смолы, такие как смола акации и смола трагаканта, встречающиеся в природе фосфатиды, такие как соевый лецитин, эфиры или частичные эфиры, полученные из жирных кислот и ангидридов гекситола, такие как моноолеат сорбитана, и продукты конденсации таких частичных эфиров с окисью этилена, такие как моноолеат полиоксиэтиленсорбитана. Эмульсия может также содержать подсластители и отдушки как при приготовлении сиропов, так и эликсиров. Такие композиции также могут содержать антиэмульгатор, консервант или окрашивающий агент.
[0050] Выбор соединения одного или в сочетании с другими приемлемыми компонентами может быть сделан при составлении аэрозолей (то есть они могут быть "распылены") при введении путем ингаляции. Аэрозольные композиции могут быть помещены в приемлемые сжатые пропелленты, такие как дихлордифторметан, пропан, азот и т.п.
[0051] Композиции по настоящему изобретению, которые приемлемы для парентерального введения, такого как, например, введение в сочленения (в суставы), внутривенное, внутримышечное, подкожное введение, введение через брюшину и через кожу, могут включать водные и неводные, изотонические стерильные инъекционные растворы, которые могут содержать антиокислители, буферные агенты, антибактериальные агенты и растворенные вещества, что делает композицию изотонической с кровью предполагаемого субъекта, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, растворяющие и загущающие агенты, стабилизаторы и консерванты. Среди приемлемых носителей и растворителей, которые могут быть применены, могут быть вода и раствор Рингера, изотонический хлорид натрия. Кроме того, стерильные нелетучие масла могут стандартно применяться в качестве растворителя или суспендирующей среды. Для этой цели может быть использовано любое жидкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, могут применяться жирные кислоты, такие как олеиновая кислота, для приготовления препарата для инъекции. Эти растворы являются стерильными и обычно свободными от нежелательных веществ.
[0052] Когда соединения являются достаточно растворимыми, они могут непосредственно растворяться в нормальном физиологическом растворе с растворителями и без применения приемлемых органических растворителей, таких как пропиленгликоль или полиэтиленгликоль. Дисперсии хорошо диспергированных соединений могут быть приготовлены в водном крахмале или растворе карбоксиметилцеллюлозы натрия, или в приемлемом масле, таком как арахисовое масло. Эти составы могут быть стерилизованными посредством стандартных хорошо известных методов стерилизации. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, которые требуются для приближения к физиологическим условиям, такие как агенты для регулирования рН и буферные агенты, агенты для регулирования токсичности, например ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.п.
[0053] Концентрация карбамата в этих композициях может лежать в широких пределах и будет определяться исходя из объемов жидкости, вязкостей, массы тела и т.п. в соответствии с конкретным выбранным способом введения и состоянием пациента. Для IV введения композиция может быть приготовлена стерильной для инъекций, например стерильная впрыскиваемая водная или масляная суспензия. Эта суспензия может быть приготовлена в соответствии с известной практикой использования таких приемлемых диспергирующих или увлажняющих и суспендирующих агентов. Стерильной впрыскиваемой композицией также может быть стерильный впрыскиваемый раствор или суспензия в нетоксичном парентерально приемлемом разбавителе или растворителе, таком как 1,3-бутандиол. Рекомендуемые композиции могут быть представлены в единичной дозе или в виде герметичных контейнеров с многократной дозой, таких как ампулы и пузырьки. Растворы для инъекции и суспензии могут быть приготовлены из стерильных порошков, гранул и таблеток описанным выше способом.
[0054] Карбамат, приемлемый для применения настоящего изобретения на практике, может и предпочтительно должен вводиться перорально. Количество соединения в композиции по настоящему изобретению может лежать в широких пределах в зависимости от типа композиции, размера единичной дозы, вида вспомогательного вещества и других факторов, хорошо известных специалистам в данной области. В целом, конечная композиция может содержать, например, от 0,000001 массового процента (масс. %) до 100 массовых процентов карбамата, например, от 0,00001 масс. % до 50 масс. %, остальное является вспомогательным веществом или вспомогательными веществами.
[0055] Фармацевтические композиции для перорального введения могут быть образованы с использованием фармацевтически приемлемых носителей, которые хорошо известны в области форм, приемлемых для перорального введения. Такие носители приспособлены к фармацевтическим композициям, которые вводятся в единичные лекарственные формы, такие как таблетки, пилюли, порошки, драже, капсулы, жидкости, лепешки, гели, сиропы, кашицы, суспензии и т.д., приемлемые для проглатывания пациентом. В других вариантах осуществления фармацевтические композиции для перорального введения могут быть приготовлены без использования любых фармацевтически приемлемых носителей.
[0056] Композиции, приемлемые для перорального введения, могут состоять из: (а) жидких растворов, таких как эффективное количество фармацевтической композиции, суспендированное в разбавителях, таких как вода, физиологический раствор или PEG 400; (b) капсул, пакетиков или таблеток, каждый из которых содержит предварительно определенное количество активного ингредиента в виде жидкостей, твердых веществ, гранул или в желатине; (c) суспензии в соответствующей жидкости и (d) приемлемых эмульсий.
[0057] Фармацевтические композиции для перорального применения могут быть получены через комбинацию соединений по настоящему изобретению с твердым вспомогательным веществом, выборочного измельчения образующейся смеси и переработки смеси гранул после добавления приемлемых дополнительных соединений, по желанию с целью получения ядер таблеток и драже. Приемлемыми твердыми вспомогательными веществами являются углеводы или белковые наполнители, которые включают, но не ограничены ими, сахара, включая лактозу, сахарозу, маннит или сорбит; крахмал из кукурузы, пшеницы, риса, картофеля или других растений; целлюлозу, такую как метилцеллюлоза или гидроксиметилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза натрия; и смолы, включающие гуммиарабик и смолу трагаканта; а также белки, такие как желатин и коллаген.
[0058] По желанию могут быть добавлены размягчающие или растворяющие агенты, такие как поперечносшитый поливинилпирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия. Таблеточные формы могут включать одно или более соединений, таких как лактоза, сахароза, маннит, сорбит, фосфаты кальция, кукурузный крахмал, картофельный крахмал, микрокристаллическую целлюлозу, желатин, коллоидную двуокись кремния, тальк, стеарат магния, стеариновую кислоту и другие вспомогательные вещества, красящие вещества, наполнители, связующие, разбавители, буферные агенты, увлажнители, консерванты, отдушки, красители, дезинтегрирующие агенты и фармацевтически совместимые носители. Формы лепешек могут содержать активный ингредиент со вкусовой добавкой, например сахарозой, а также пастилки, содержащие активный ингредиент на инертной основе, такой как желатин и глицерин или сахарозу и эмульсии акации, гели и т.п., содержащие в дополнение к активному ингредиенту носители, известные в этой области.
[0059] Соединения по настоящему изобретению могут также вводиться в виде свечей для введения лекарственных средств через прямую кишку. Эти композиции могут быть приготовлены путем смешения лекарственного средства с приемлемым нераздражающим вспомогательным веществом, которое при обычной температуре является твердым веществом и жидким при температуре прямой кишки и будет плавиться в кишечнике для высвобождения лекарственного средства. Такими материалами являются масло какао и полиэтиленгликоли.
[0060] Соединения по настоящему изобретению могут также вводиться через нос, глаза, влагалище и прямую кишку, включая свечи, составы для вдыхания, порошки и аэрозольные составы (например, стероидные вещества для ингаляции, смотрите публикацию Rohatagi, J. Clin. Pharmacol. 35: 1187, (1995); Tjwa, Ann. Allergy Asthma Immunol. 75: 107, (1995)).
[0061] Соединения по настоящему изобретению могут доставляться через кожу топическим способом, приготовленные в виде наклеек, растворов, суспензий, эмульсий, гелей, кремов, мазей, паст, желе, красок, порошков и аэрозолей.
[0062] Инкапсулирующие материалы могут также применяться с соединениями по настоящему изобретению, и термин "композиция" может включать активный ингредиент в сочетании с инкапсулирующим материалом, таким как композиция с другими или без других носителей. Например, соединения по настоящему изобретению могут также доставляться в виде микросфер для медленного высвобождения в организме. В одном варианте микросферы могут вводиться путем подкожных инъекций лекарственного средства (например мифепристон), содержащего микросферы, которые медленно подкожно высвобождают лекарственное средство (смотрите, например, публикацию Rao, J. Biomater. Sci. Polym. Ed. 7: 623 (1995); в виде биоразлагаемых и инъецируемых гелевых композиций (смотрите, например, публикацию Gao, Pharm. Res. 12: 857 (1995)); или в виде микросфер для перорального введения (смотрите, например, публикацию Eyies, J. Pharm. Pharmacol. 49: 669, (1997)). Как подкожный способ введения, так и способ введения в кожу позволяют обеспечить постоянную доставку в течение недель или месяцев. Облатка также может быть использована для доставки соединений по настоящему изобретению.
[0063] В другом варианте осуществления соединения по настоящему изобретению могут доставляться путем использования липосом, которые сливаются с клеточной мембраной или эндоцитозируются, то есть посредством применения лигандов, присоединенных к липосомам, которые присоединяются к поверхности белковых рецепторов мембраны клетки, что приводит к эндоцитозу. Активное лекарственное средство может быть также введено в форме систем доставки липосом, таких как маленькие униламеллярные пузырьки, большие униламеллярные пузырьки и мультиламеллярные пузырьки. Липосомы могут быть получены из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины.
[0064] При использовании липосом, особенно, когда поверхность липосомы несет лиганды специально для целевых клеток или другим способом, предпочтительно направлена на специальный орган, можно нацелить доставку карбамата к целевым клеткам in vivo (смотрите, например, Al-Muhammed, J. Microencapsul. 13: 293, (1996); Chonn, Curr. Opin. Biotechnol. 6: 698, (1995); Ostro, Аm. J. Hosp. Phann. 46: 1576, (1989)).
[0065] Активное лекарственное средство может также быть поставлено посредством моноклональных антител в виде отдельных носителей, с которыми соединены молекулы соединения. Активное лекарственное средство можно соединить с растворимыми полимерами в виде способных к наведению носителей лекарственного средства. Такие полимеры могут включать поливинилл-пирролидон, сополимер пирана, полигидрокси-пропил-метакриламид-фенол, полигидрокси-этил-аспартамид-фенол или полиэтиленоксид-полилизин, замещенный пальмитиловыми остатками. Дополнительно активное лекарственное средство может быть соединено с классом биоразрушаемых полимеров, пригодных для получения управляемого освобождения лекарственного средства, например, полимолочной кислотой, полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислот, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами, сшитыми или амфипатическими блок-сополимерами гидрогелей.
[0066] В некоторых вариантах осуществления композиции находятся в виде стандартных лекарственных форм, таких как таблетки, пилюли, капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозированные аэрозоли или жидкие спреи, капли, ампулы, шприцы-ручки или суппозитории, для перорального, парентерального, интраназального, сублингвального или ректального введения, или для введения путем ингаляции или инсуффляции.
[0067] Альтернативно композиция может быть представлена в форме, приемлемой для введения один раз в неделю или один раз в месяц, например, нерастворимая соль активного соединения, такая как деканоат, может быть применена с целью получения депо для внутримышечной инъекции.
[0068] Фармацевтические композиции по настоящему изобретению будут содержать в каждой стандартной дозе, например таблетке, капсуле, порошке, инъекции, чайной ложке, свече и т.п., такое количество активного ингредиента, которое необходимо для доставки эффективной дозы, как было описано выше. Например, фармацевтические композиции по настоящему изобретению могут содержать на единицу лекарственной формы от приблизительно 10 до приблизительно 1000 мг активного вещества, например, от приблизительно 25 до приблизительно 600 мг активного вещества, например от приблизительно 75 до приблизительно 400 мг активного вещества, например, приблизительно 25, 50, 75, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575 или 600 мг или больше или любой диапазон в указанном.
[0069] В некоторых вариантах по настоящему изобретению карбаматы, которые приемлемы для использования на практике по настоящему изобретению, будут вводиться либо самостоятельно, либо в сочетании с по меньшей мере одним или более другими соединениями или терапевтическими агентами, например с другими агентами, которые лечат катаплексию и/или другие расстройства или симптомы, связанные с катаплексией или наркоплексией (например, чрезмерная дневная сонливость, гипнагогические галлюцинации, паралич сна). Примеры терапевтических агентов для лечения катаплексии включают, без ограничения, антидепрессанты (например трициклы (такие как ломипрамин, имипрамин и протриптилин) и селективные ингибиторы обратного захвата серотонина (такие как флуокцетин, парокцетин, цетралин, циталопам), и оксибат натрия (гамма-гидроксибутират [ГГБ]). Терапевтические агенты для лечения чрезмерной дневной сонливости и других симптомов наркоплексии включают без ограничения амфетамины (такие как дексамфетамин, метамфетамин и метилфенидат), модафинил, армодафинил, атомоксетин и селигилин. Оксибат натрия является единственным известным лекарственным средством для улучшения как катаплексии, так и чрезмерной дневной сонливости.
[0070]Способ включает стадию введение пациенту, нуждающемуся в лечении, эффективного количество одного из карбаматов, описанных здесь в сочетании с эффективным количеством одного или больше других соединений или терапевтических агентов, которые обладают способностью обеспечить выгодные объединенные эффекты, такие как способность усиливать действие соединений по изобретению.
[0071] Фармацевтически приемлемые соли и эфиры относятся к солям и эфирам, которые фармацевтически приемлемы и обладают желаемыми фармакологическими свойствами. Такие соли включают соли, которые могут быть образованы, когда протоны кислот, присутствующие в соединениях, способны к взаимодействию с неорганическими или органическими основаниями. Приемлемые неорганические соли включают соли, образованные со щелочными металлами, например с натрием и калием, магнием, кальцием и алюминием. Приемлемые органические соли включают соли, образованные с органическими основаниями, такими как аминовые основания, например этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п. Фармацевтически приемлемые соли могут также включать соли присоединения кислот, образованные путем взаимодействия аминогрупп в родительском соединении с неорганическими кислотами (например хлористоводородной и бромистоводородной кислотами) и органическими кислотами (например уксусной, лимонной, малеиновой кислотами, и алкан- и арен-сульфокислотами, такими как метансульфоновая кислота и бензолсульфоновая кислота). Фармацевтически приемлемые эфиры включают эфиры, образованные из карбокси-, сульфонилокси- и фосфоноксигрупп, присутствующих в соединениях. Когда присутствуют две кислотные группы, фармацевтически приемлемая соль или эфир может быть монокислотой-моносолью или эфиром, или дисолью, или диэфиром; и также, когда присутствуют более двух кислотных групп, несколько или все такие группы могут образовывать соль или этерифицироваться.
[0072] Соединения, указанные в настоящем изобретении, могут присутствовать в несолевой или неэтерифицированной форме, или в солевой и/или этерифицированной форме, и наименование таких соединений, как подразумевается, включает как оригинальное (несолевое или неэтерифицированное) соединение, так и его фармацевтически приемлемые соли и эфиры. Настоящее изобретение включает фармацевтически приемлемую солевую и эфирную формы формулы I. Более чем одна кристаллическая форма энантиомера формулы I может существовать и как таковая также быть включена в настоящее изобретение.
[0073] Фармацевтическая композиция по настоящему изобретению может необязательно содержать в добавление к карбамату по меньшей мере один другой терапевтический агент, полезный при лечении катаплексии. Например, карбаматы формулы I могут быть физически объединены с другими соединениями в фиксированных комбинациях доз с целью упрощения их введения.
[0074] Методы образования фармацевтических композиций описаны в многочисленных публикациях, таких как Pharmaceutical Dosage Forms: Tablets. Second Edition. Revised and Expanded. Volumes 1-3, edited by Lieberman et al; Pharmaceutical Dosage Forms: Parenteral Medications. Volumes 1-2, edited by Avis et al.; и Pharmaceutical Dosage Forms: Disperse Systems. Volumes 1-2, edited by Lieberman et al; опубликованные Marcel Dekker, Inc., описание каждого из которых включено здесь по ссылке полностью и для всех целей.
[0075] Фармацевтические композиции обычно производятся стерильными, фактически изотоническими и в полном соответствии со всеми правилами Good Manufacturing Practice (GMP) of The US Food and Drug Administration.
[0076] Настоящее изобретение предлагает способы обеспечения лечения катаплексии у млекопитающих, используя карбаматы. Количество карбамата, необходимое для обеспечения лечения катаплексии, определяют как терапевтически или фармацевтически эффективную дозу. Схема определения дозы и эффективных величин для данного применения, т.е. дозирование или режим применения, будет зависеть от различных факторов, включая стадию заболевания, физическое состояние пациента, возраст и т.п. При вычислении режима применения для пациента принимается во внимание также способ введения.
[0077] Специалист в этой области будет иметь возможность без ненужного исследования, имея опыт и данное описание, определить терапевтически эффективное количество конкретного замещенного карбамата для практического применения настоящего изобретения, (смотрите, например, Lieberman, Pharmaceutical Dosage Forms: (Vols 1-3, 1992); Lloyd, 1999, The art, Science and Technology of Pharmaceutical Compounding; и Pickar, 1999, Dosage Calculations). Терапевтически активная доза является той дозой, при которой любые токсические или приносящие вред побочные эффекты активного агента, перекрываются в клинических условиях терапевтически полезными эффектами. Кроме того, должно быть отмечено, что для каждого конкретного субъекта должны быть оценены и подобраны во времени специальные схемы приема в соответствии с индивидуальной потребностью и профессиональной оценкой лица, осуществляющего введение или контроль введения соединения.
[0078] В целях лечения композиции или соединения, описанные в настоящей заявке, могут вводиться субъекту путем доставки в виде единичного болюса, через непрерывную доставку в течение продолжительного периода времени или в режиме повторяющегося введения (например ежечасно, ежедневно или еженедельно повторяющиеся схемы введения). Фармацевтические композиции по настоящему изобретению могут вводиться, например, один или более раз в день, 3 раза в неделю или еженедельно. В одном варианте настоящего изобретения фармацевтические композиции по настоящему изобретению вводятся перорально один или два раза в день.
[079] В этом контексте терапевтически эффективная доза биологически активного (активных) агента(-ов) может включать повторные дозы в рамках пролонгированной схемы лечения, что принесет клинически значимые результаты лечения катаплексии. Определение эффективных доз в этом контексте обычно основано на опытах на моделях животных и последующих клинических испытаниях на людях и руководствуется расчетом эффективных доз и протоколом введения, которые значительно уменьшают возникновение или тяжесть целевых выявленных симптомов или состояний у субъекта. Приемлемые модели в этом контексте включают, например, модели мышей, крыс, свиней, кошек, нечеловекоподобых приматов и другие допустимые модели животных, известные в этой области. Альтернативно, эффективные дозы могут определяться с использованием моделей in vitro (например иммунологические и гистопатологические анализы).
[0080] Используя такие модели, требуются только обычные расчеты и подбор для того, чтобы определить подходящую концентрацию и дозу для введения терапевтически эффективного количества биологически активного агента (агентов), (например, количества, которые эффективны для достижения желаемой реакции при введении перорально, введении через нос, через кожу, внутривенно или внутримышечно). Однако эффективное количество может изменяться в зависимости от используемого конкретного соединения, вида введения, активности лекарственного препарата, вида введения и прогресса в состоянии заболевания. Кроме того, факторы, связанные с конкретным пациентом, нуждающимся в лечении, включающие возраст, массу, режим питания и время введения могут вызывать необходимость регулирования дозировки.
[0081] В приведенном варианте по настоящему изобретению единичные лекарственные формы приготавливаются для стандартных схем введения. В этом случае композиция может быть легко физически разделена на более мелкие дозы. Например, единичные дозы могут быть приготовлены в виде пакетиков порошков, пузырьков или ампул, а предпочтительно в форме капсул или таблеток.
[0082] Эффективное введение карбамата по изобретению может быть, например, в пероральной или парентеральной дозе от примерно 0,01 мг/кг/доза до примерно 150 мг/кг/доза. Например, введение может быть от примерно 0,1 мг/кг/доза до примерно 25 мг/кг/доза, например, от примерно 0,2 мг/кг/доза до примерно 18 мг/кг/доза, например, от примерно 0,5 мг/кг/доза до примерно 10 мг/кг/доза. Следовательно, терапевтически эффективное количество активного ингредиента может быть, например, от примерно 1 мг/день до примерно 7000 мг/день для субъекта, имеющего, например, среднюю массу тела 70 кг, например, от примерно 10 до примерно 2000 мг/день, например, от примерно 50 до примерно 600 мг/день, например, приблизительно 10, 25, 50, 75, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575 или 600 мг/день или больше или любой диапазон в указанном. В одном варианте осуществления соединение формулы I вводится в виде капсулы с дозой от примерно 150 мг до примерно 300 мг без любых вспомогательных веществ.
[0083] Способы настоящего изобретения предоставляет также наборы (комплекты) для применения при лечении катаплексии. После того как фармацевтическая композиция, содержащая один или более карбаматов по изобретению, с возможным добавлением одного или более других соединений терапевтического благоприятного действия была приготовлена в соответствующем носителе, она может быть помещена в подходящий контейнер и прикреплена этикетка для предоставления лечения катаплексии. Дополнительно еще один фармацевтический препарат, который содержит по меньшей мере один другой терапевтический агент, можно также поместить в контейнер и прикрепить этикетку для лечения указанного заболевания. Такое прикрепление этикетки может включать, например, инструкцию, касающуюся количества, периодичности и способа введения каждого лекарственного препарата.
[0084] Варианты осуществления по настоящему изобретению описывают ниже в неограничивающих примерах.
ПРИМЕР 1
Клинические исследования пациентов с катаплексией
[0085] Исследование безопасности и эффективности ADX-N05 проводили при лечении чрезмерной дневной сонливости у пациентов с наркоплексией. Исследование включало поисковый анализ возможной эффективности ADX-N05 у подмножества пациентов с наркоплексией, у которых также имеется катоплексия. Оценивали фактический результат ADX-N05 для первичной и вторичной переменных эффективности в подмножестве пациентов с катаплексией. Кроме того, оценивали также влияние ADX-N05 на снижение количества катаплектических явлений.
[0086] Исследование было двойным слепым, с гибкой целевой дозой, плацебо-контролируемым, многоцентровым, рандомизированным, с параллельной группой. После успешного завершения скрининга и исходного этапа пациенты были назначены безвыборочным методом в одну из двух групп лечения и получали ADX-N05 или плацебо в период лечения 12 недель (группа лечения № 1: недели 1-4: ADX-N05 150 мг/день; недели 5-12: ADX-N05 300 мг/день; группа лечения № 2: недели 1-12: плацебо) как показано в таблице 1.
Схема лечения
[0087] Перед началом 12-недельного периода лечения пациенты выполняли стадию скрининга до 28 дней, во время которой выполняли все скрининговые оценки и любое текущее лечение наркоплексии приостанавливали, также как и исходную стадию, включающую ночное состояние в исследовательской области, в течение которой получали оценки эффективности и безопасности. В течение стадии лечения пациенты возвращались в область исследования для завершения оценок эффективности и безопасности в конце недель 1, 2, 4, 6, 8 и 12; визиты на 4 неделе и 12 неделе включали также ночное состояние в области исследования. Пациенты получали свою окончательную дозу изучаемого лекарственного средства при посещении на 12 неделе, перед оценками посещения на 12 неделе. Пациенты возвращались в конце 13 недели для отслеживания оценок, и если не происходило каких-либо выдающихся проблем безопасности, которые требовали отслеживания, то с этого посещения пациенты освобождались от исследования.
[0088] Конечными точками исследования были: (1) изменение от исходного состояния среднего количества катаплектических вспышек в неделю для подмножества пациентов с катаплексией при ADX-N05 относительно плацебо на 4 неделе и при последней оценке; и (2) первичная и вторичная эффективность конечных точек для подмножества пациентов с катаплексией. Пациенты вели дневник катаплексии для отслеживания количества эпизодов. Для подмножества пациентов с катаплексией в каждой из групп лечения рассчитывали изменение от исходного состояния среднего количества катаплектических вспышек в неделю для подмножества пациентов с катаплексией для ADX-N05 относительно плацебо на 4 неделе и для последней доступной оценки. Для сравнения двух групп лечения использовали критерий суммы рангов Вилкоксона.
[0089] Общее количество из 32 пациентов в популяции имело диагноз катаплексия и были включены в "катаплектическую популяцию". Один пациент (2002 в группе с плацебо) не заполнял исходный катаплектический дневник и не был включен в катаплектический анализ с использованием дневника.
[0090] Воздействие ADX-N05 на вариации первичной и вторичной эффективности для катаплектической популяции представлены в таблице 2 (испытание на сохранение бодрствования (MWT)), таблице 3 (шкала сонливости Эпворса (ESS)), таблице 4 (клиническое общее впечатление (CGI-C)) и таблице 5 (общее впечатление пациента (PGI-C)).
[0091] Подмножество пациентов с катаплексией показало результаты, аналогичные всей популяции для изменения от исходного результата латентного периода сна в среднем для первых четырех исследований на сохранение бодрствования (MWT), а также для пяти индивидуальных исследований на сохранение бодрствования (MWT) в обоих 4-недельной и 12-недельной/последней оценке. Кроме того, большая часть пациентов в группе ADX-N05 относительно группы плацебо испытывала улучшение при каждой неделе исследования как на общее клиническое воздействие (CGI), так и на общее воздействие на пациента (PGI-C). Различие между группами лечения было статистически значимым при 12-недельной/последней оценке как для общего клинического воздействия (CGI) (94,1% пациентов для ADX-N05 по сравнению с 53,3% для пациентов плацебо; p=0,0133), так и для общего воздействия на пациента (PGI-C) (94,1% пациентов для ADX-N05 по сравнению с 53,3% для пациентов плацебо; p=0,0133). Общее уменьшения значения итогового показателя шкалы сонливости Эпворса на каждой неделе исследования наблюдали постоянно у пациентов с лечением ADX-N05 по сравнению с пациентами с плацебо. Разница была статистически значимой на 1 неделе и на 12 неделе/последней оценке (снижение на 1 неделе 6,8 относительно 2,4 пункта, p=0,0170; и снижение на 12 неделе/последняя оценка 9,8 относительно 2,5, p=0,0010).
[0092] Таблица 6 предлагает обобщение количества еженедельных катаплектических вспышек, отмеченное наряду с вычисленным изменением, начиная от исходного состояния и соответствующее p-значениям в течение следующих периодов исследования: исходное состояние, недели 1-4, только неделя 4, недели 5-12 и только неделя 12/последняя оценка. Таблица 7 предлагает обобщение этих данных для подмножества пациентов, у которых отмечали возникновение 3 или более катаплектических вспышек еженедельно во время исходного периода.
[0093] Если включены все пациенты с катаплексией (N=31), то лечение ADX-N05 не приводит к заметным отличиям от плацебо для среднего изменения от исходного уровня в еженедельных катаплектических событиях (таблица 6). Данное исследование не набирает пациентов с катаплексией специально, тем не менее, и как результат, катаплектическая популяция была преимущественно не тяжелых больных (среднее изменение 4 катаплектических явления в неделю при исходном уровне). При проведении post-hoc анализа, включающего только пациентов с 3 или более катаплектическими событиями в неделю при исходном уровне, он показал тенденцию уменьшения катаплектических событий, что благоприятствует группе с лечением ADX-N05 (среднее значение уменьшения еженедельных катаплекических событий 7 для ADX-N05 относительно 1,5 для плацебо при 12-недельной/последней оценке) (таблица 7). Более половины пациентов с лечением ADX-N05 (6/11; 55%) имели уменьшение еженедельных катаплектических явлений более чем на 50% по сравнению с 0% (0/6) для группы с плацебо.
[0094] Вышеизложенное является иллюстрацией настоящего изобретения и не должно быть истолковано ограничивающе его. Изобретение определяют следующей формулой изобретения с эквивалентами формулы изобретения, которые должны быть в нее включены.
Все публикации, заявки на патент, патенты и другие ссылки, цитированные здесь, включены путем ссылки полностью для идей, относящихся к высказыванию и/или абзацу, в которых эти ссылки присутствуют.
Испытание на сохранение (поддержание) бодрствования: итоговая таблица - катаплектическая популяция
[2] t-проверка, основанная на двойной выборке.
Общая оценка по шкале сонливости Эпворса: итоговая таблица -катаплектическая популяция
[2] t-проверка, основанная на двойной выборке.
Общее клиническое впечатление (CGI): итоговая таблица - катаплектическая популяция
[1] 12-недельная/последняя оценка является анализом конечных результатов, представляющим последние наблюдения, собранные после исходного (т.е. 12-недельная/оценка при посещении для преждевременного прекращения лечения или, если 12-недельная/оценка при посещении для преждевременного прекращения лечения не были проведены, то последние перенесенные наблюдения, собранные после исходного).
Общее впечатление пациента - изменения: итоговая таблица - катаплектическая популяция
[1] 12-недельная/последняя оценка является анализом конечных результатов, представляющим последние наблюдения, собранные после исходного (т.е. 12-недельная/оценка при посещении для преждевременного прекращения лечения или, если 12-недельная/оценка при посещении для преждевременного прекращения лечения не были проведены, то последние перенесенные наблюдения, собранные после исходного).
Итоги катаплектических дневников - катаплектическая популяция
[1] Оценка 12 неделя/последняя оценка является анализом конечных результатов, представляющим последние собранные наблюдения после исходной недели (т.е. 7-дневные данные дневника перед и включая посещение 12 недели/посещение для преждевременного прекращения лечения, или, если посещение 12 недели/посещение для преждевременного прекращения лечения не были проведены, то последние 7-дневные отмеченные данные дневника после исходных).
[2] p-значение критерия суммы рангов Уилкоксона, оценивающее нулевую гипотезу не имеющего значения различия среднего изменения между лечебными группами.
Краткий обзор дневника катаплексии для пациентов с ≥3 еженедельными вспышками в исходном состоянии - катаплектическая популяция
[1] Оценка 12 неделя/последняя оценка является анализом конечных результатов, представляющим последние собранные наблюдения после исходной недели (т.е. 7-дневные данные дневника перед и включая посещение 12 недели/посещение для преждевременного прекращения лечения, или, если посещение 12 недели/посещение для преждевременного прекращения лечения не были проведены, то последние 7-дневные отмеченные данные дневника после исходных).
[2] p-значение критерия суммы рангов Уилкоксона, оценивающее нулевую гипотезу не имеющего значения различия среднего изменения между лечебными группами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ЧРЕЗМЕРНОЙ ДНЕВНОЙ СОНЛИВОСТИ (ВАРИАНТЫ) | 2006 |
|
RU2417077C2 |
| Способы лечения биполярного расстройства | 2011 |
|
RU2653408C2 |
| ПРОИЗВОДНЫЕ 1-АМИНОАЛКИЛЦИКЛОГЕКСАНА ДЛЯ ЛЕЧЕНИЯ КОХЛЕАРНОГО ТИННИТУСА | 2008 |
|
RU2438658C2 |
| ТЕРАПИЯ С ИНТЕРВАЛАМИ ДЛЯ ЛЕЧЕНИЯ ТИННИТУСА | 2008 |
|
RU2446794C2 |
| СПОСОБЫ ЛЕЧЕНИЯ СИНДРОМА ФИБРОМИАЛГИИ | 2010 |
|
RU2557533C2 |
| ПРОИЗВОДНЫЕ 1-АМИНОАЛКИЛЦИКЛОГЕКСАНА ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ПОТЕРИ СЛУХА | 2008 |
|
RU2452476C2 |
| ТИТРАЦИОННЫЙ КОМПЛЕКТ НЕРАМЕКСАНА И ЕГО ПРИМЕНЕНИЕ В ЛЕЧЕНИИ РАССТРОЙСТВ ВНУТРЕННЕГО УХА | 2008 |
|
RU2459618C2 |
| ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ | 2006 |
|
RU2435610C2 |
| КОМБИНАЦИЯ ИНГИБИТОРА PI3 КИНАЗЫ С ПАКЛИТАКСЕЛОМ ДЛЯ ИСПОЛЬЗОВАНИЯ ПРИ ЛЕЧЕНИИ ИЛИ ПРЕДОТВРАЩЕНИИ РАКА ГОЛОВЫ И ШЕИ | 2014 |
|
RU2672555C2 |
| ЛЕЧЕНИЕ АЛЛЕРГИЧЕСКОГО РИНИТА С ИСПОЛЬЗОВАНИЕМ КОМБИНАЦИИ МОМЕТАЗОНА И ОЛОПАТАДИНА | 2014 |
|
RU2799761C2 |
Изобретение относится к медицине, а именно к неврологии, и может быть использовано при лечении катаплексии. Способ по изобретению включает введение субъекту терапевтически эффективного количества соединения формулы 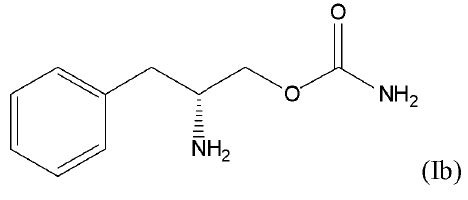 . Использование изобретения позволяет улучшить состояние пациентов за счет уменьшения количества еженедельных катаплектических явлений. 11 з.п. ф-лы, 7 табл., 1 пр.
. Использование изобретения позволяет улучшить состояние пациентов за счет уменьшения количества еженедельных катаплектических явлений. 11 з.п. ф-лы, 7 табл., 1 пр.
1. Способ лечения катаплексии у субъекта, который нуждается в этом, который содержит введение субъекту терапевтически эффективного количества соединения формулы (I)
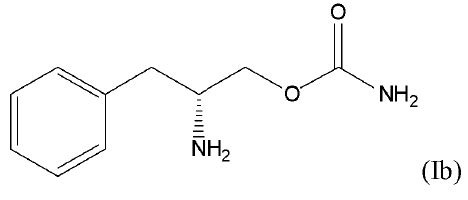
или его фармацевтически приемлемую соль, или его сложный эфир.
2. Способ по п.1, в котором соединение формулы (Ib) является энантиомером формулы (Ib), практически свободным от других энантиомеров, или энатиомерной смесью, в которой преобладает один энантиомер формулы (Ib).
3. Способ по п.2, в котором энантиомер формулы (Ib) преобладает в количестве вплоть до примерно 90% или больше.
4. Способ по п.2, в котором энантиомер формулы (Ib) преобладает в количестве вплоть до примерно 98% или больше.
5. Способ по любому из пп.1-4, в котором катаплексия связана с наркоплексией.
6. Способ по любому из пп.1-4, в котором катаплексия является вторичной по отношению к состоянию, которое снижает уровни гипокретина у субъекта.
7. Способ по п.6, в котором состояние выбрано из группы, состоящей из опухоли головного мозга, астроцитомы, глиобластомы, глиомы, субэпендимомы, краниофарингиомы, артериовенозной мальформации, ишемической патологии, рассеянного склероза, травмы головы, операции на головном мозге, паранеопластических синдромов, болезни Ниманна-Пика типа С и энцефалита.
8. Способ по любому из пп.1-4, в котором терапевтически эффективное количество соединения формулы (Ib) составляет примерно от 0,01 мг/кг/доза до примерно 150 мг/кг/доза.
9. Способ по любому из пп.1-4, в котором терапевтически эффективное количество соединения формулы (Ib) составляет примерно от 1 мг/день до примерно 7000 мг/день.
10. Способ по любому из пп.1-4, в котором соединение формулы (Ib) вводят перорально.
11. Способ по любому из пп.1-4, в котором соединение формулы (Ib) вводят в виде капсулы или таблетки.
12. Способ по любому из пп.1-4, где соединение формулы (Ib) вводят в виде капсулы в дозе от примерно 150 мг до примерно 300 мг без каких-либо вспомогательных веществ.
| US 6204245 B1, 20.03.2001 | |||
| WO 2006133393, 14.12.2006 | |||
| WO 2011005473, 13.01.2011 | |||
| ГРОМОВА Д | |||
| О | |||
| и др | |||
| Нарколепсия с катаплексией с дебютом в препубертатном возрасте//Неврологический журнал, - 2012, N4, C.22-27 [он лайн] [найдено 20.03.2018] Найдено в Интернет: https://cyberleninka.ru/article/v/narkolepsiya-s-katapleksiey-s-debyutom-v-prepubertatnom-vozraste. |
Авторы
Даты
2019-05-30—Публикация
2014-03-12—Подача