Изобретение относится к фармацевтической химии, к способам получения производного мочевины с хелатным центром, тройного к простат-специфичному мембранному антигену для связывания технеция-99м/рения и может быть использовано для диагностики рака предстательной железы (РПЖ).
Рак предстательной железы (РПЖ) является одной из наиболее частых форм злокачественных образований у мужчин Северной Америки, Европы и некоторых регионов Африки: в общемировой структуре онкологической заболеваемости он занимает шестое место, а среди мужчин - третье. В России рак простаты занимает 4-е место, при этом, у 60-80% пациентов при первичном обследовании выявляются местно-распространенные формы рака или метастатическое поражение отдаленных органов и тканей. Наиболее часто используемым радионуклидом для создания радиодиагностических препаратов выступает технеций-99м (99mTc), проведение исследования с которым доступно на территории всей Российской Федерации (более 250 радиодиагностических подразделений). Главным достоинством радиофармпрепарата на основе меченной 99mTc малой высокоспецифичной синтетической молекулы является то, что визуализация опухоли предстательной железы с их использованием может быть произведена с помощью гамма-камеры, что исключает инвазивный характер исследования, значительно снижает стоимость диагностической процедуры, позволяет не только оценить распространенность опухолевого процесса (состояние первичного опухолевого узла, регионарных лимфатических узлов, а так же выявление отдаленных метастазов), но и выполнять многократные обследования с целью оценки динамики на фоне проводимого лечения.
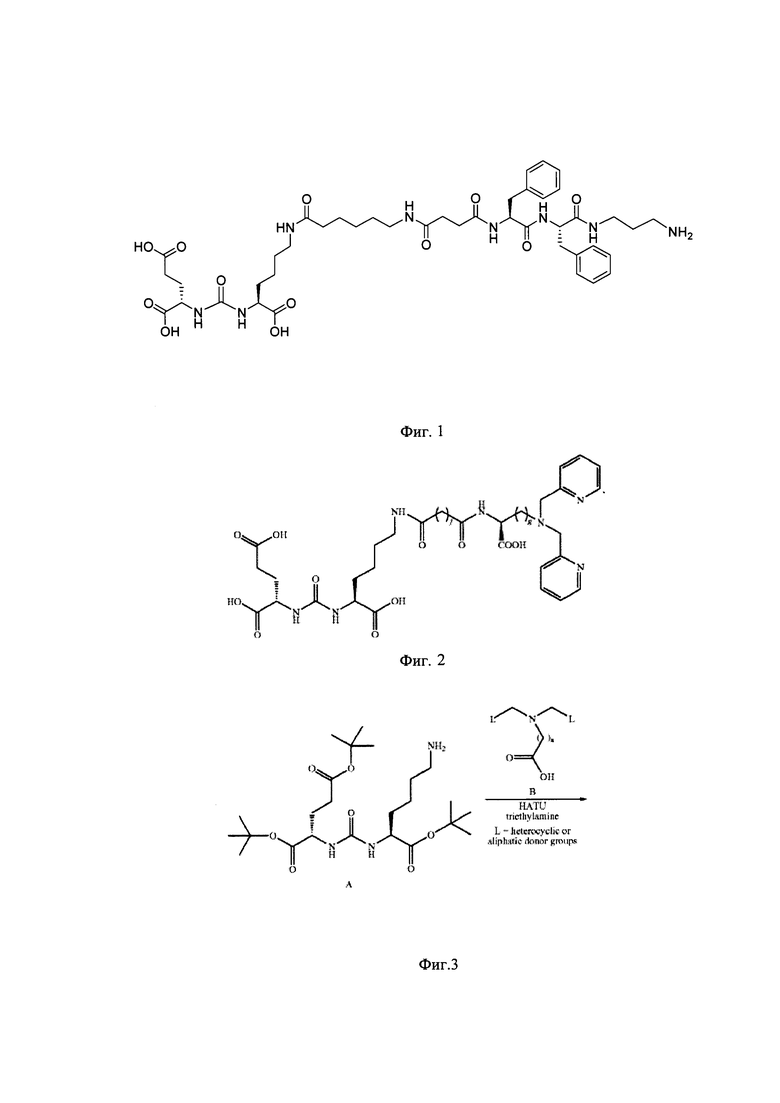
Главной мишенью в диагностике РПЖ является ПСМА - мембранный гликопротеин II типа с глутамат-карбоксипептидазной активностью, гиперэкспрессия которого отмечается на поверхности опухолевых клеток при различных стадиях рака предстательной железы. Одним из перспективных ингибиторов ПСМА на основе коньюгатов карбамида (мочевины) с аминокислотами является соединение с химическим названием (3S,7S,25S,28S)-33-амино-25,28-дибензил-5,13,20,23,26,29-гексаоксо-4,6,12,29,24,27,30-гептаазатриоктан-1,3,7-трикарбоновая кислота (например, в виде трифторацетата) (фиг. 1). Далее по тексту данное соединение будет обозначено как Glu-urea-Lys-дифенил-ПСМА-лиганд. Ввиду своей недостаточной реакционной способности описываемый ингибитор ПСМА способен связывать 99mTc/186/188Re только путем предварительного присоединения к нему хелатирующего агента [1, 2].
В настоящее время активно разрабатываются способы получения и технологии мечения ингибиторов ПСМА технецием-99м [3, 4].
Известны способы получения производных мочевины с хелатными центрами на основе производных пиридина, тропных к ПСМА [5].
Представлены в патенте меченые ингибиторы ПСМА, их биологическое распределение и использование в качестве диагностических агентов [6]. Описание меченых ингибиторов ПСМА включает в себе изложение способов получения ингибиторов ПСМА и их коньюгатов с хелатными центрами, в том числе и с производными пиридина. Получение таких конъюгатов проводят с применением сукциимидных эфиров различных биспиридил хелаторов, которые получают в избытке дисукцимидил суберата (DSS) в диметилформамиде. К раствору ингибитора ПСМА (0,035 г, 0,107 ммоль в 0,5 мл метанола) добавляют при перемешивании при комнатной температуре в течение 10 ч сукциимидный эфир биспиридил хелатора (0,100 г, 0,107 ммоль в 6 мл диметилформамида) и 0,2 мл триэтиламина. Реакционную смесь упаривают при пониженном давлении, продукт выделяют экстракцией метиленхлоридом из водного слоя с последующей очисткой флэш-хроматографией (50/50 метанол/метиленхлорид). Далее проводят гидролиз для снятия зашиты с карбоксильных групп, используя трифторуксусную кислоту 7 мл и анизола 0,3 мл при перемешивании 10 мин, раствор выпаривают под вакуумом, промывают диэтиловым эфиром и водой. Затем грубый продукт очищают ВЭЖХ (75/25 вода (0,1% TFA)/ ацетонитрил (0,1%TFA), скорость потока 2 мл/мин). Выход составляет 65%. Данный способ получения характеризуется сложной схемой, применением токсичных растворителей, длительностью процесса, а также требует тщательную очистку от побочных продуктов и непрореагировавших реагентов. Также, в способе не предложены условия получения на основе молекулы Glu-urea-Lys-дифенил-ПСМА-лиганда.
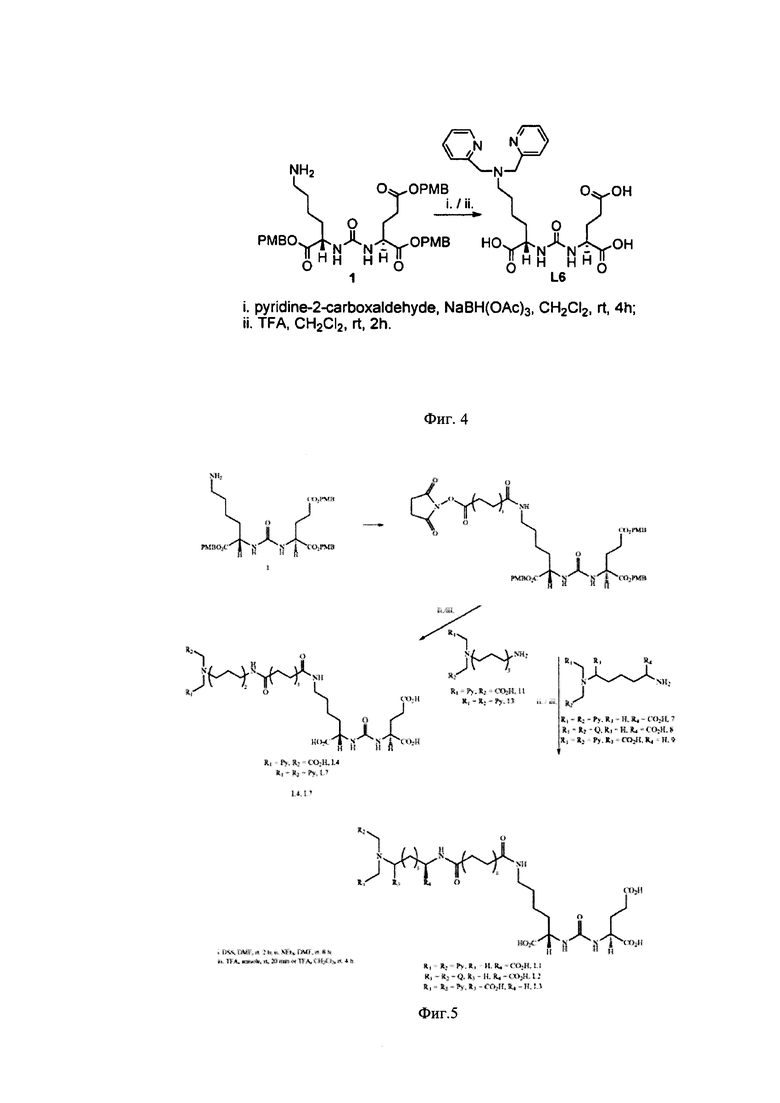
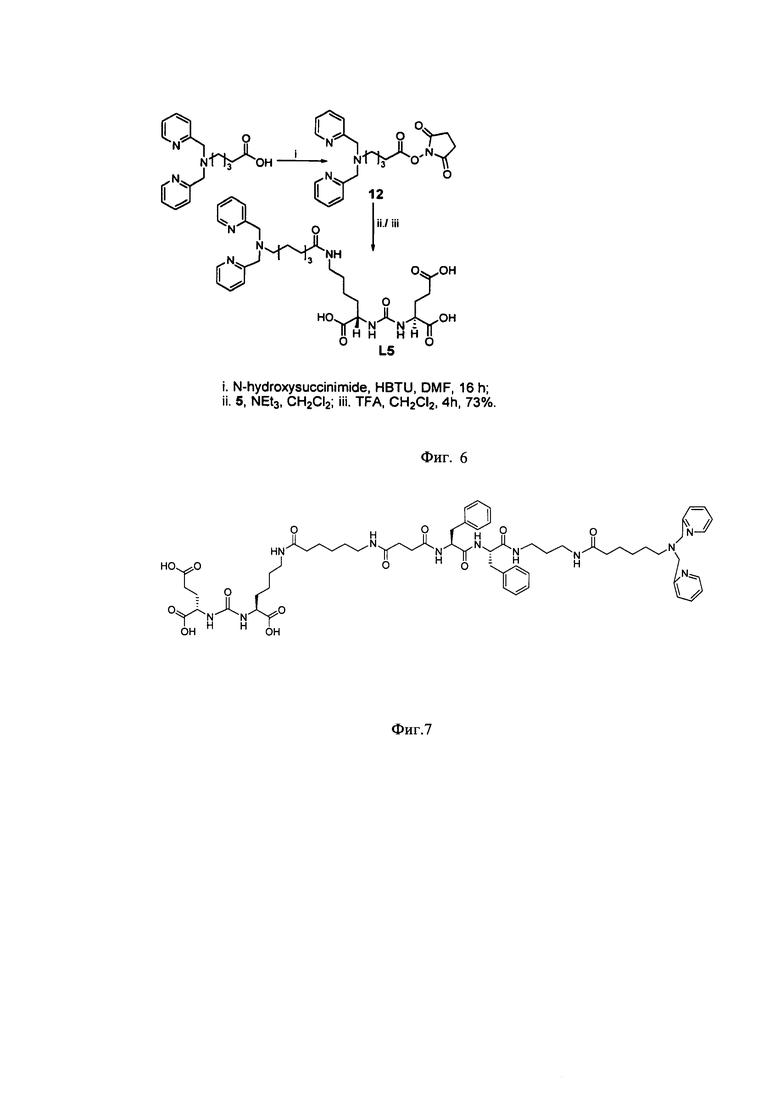
Известен способ получения комплексов технеция и рения с бис(гетероарилами) и способы их использования как ингибиторов ПСМА [7]. В патенте также первоначально указаны способы получения ряда производных мочевины, в том числе в качестве гетероарилов представлены производные пиридина (фиг. 2). В работе не изложены детальные описания способов получения соединений, однако указано, что присоединение хелатирующего агента с гетероциклическими или алифатическими донорными группами проводится с помощью реактива HATU (2-(1Н-7-Азабензотриазол-1-ил)-1,1,3,3-тетраметил уроний гексафторфосфат метанамин) в присутствии триэтиламина (фиг. 3). При этом защита на карбоксильных группах первоначально сохранена. Снятие защиты происходит в жестких условиях после мечения рением или технецием, что является трудоемким процессом, снижающим выходы целевых продуктов и непригодно для будущего применения в клинике. Выходы составляют от 20 до 50%. Также, в способе не предложены условия получения на основе молекулы Glu-urea-Lys-дифенил-ПСМА-лиганда.
Представлены три способа получения меченых ингибиторов ПСМА, их биологическое распределение и использование в качестве диагностических агентов [8-10]. Различные 99mTc/Re-меченые соединения получали путем присоединения известных хелатирующих агентов Tc/Re к аминофункциональному ингибитору PSMA с или без применения линкера с переменной длиной. В том числе описаны способы получения синтетической молекулы ингибитора ПСМА посредством ω-бис(пиридин-2-илметил)амино)алифатических кислот. Но в качестве ингибитора ПСМА не упоминается объект предлагаемого способа.
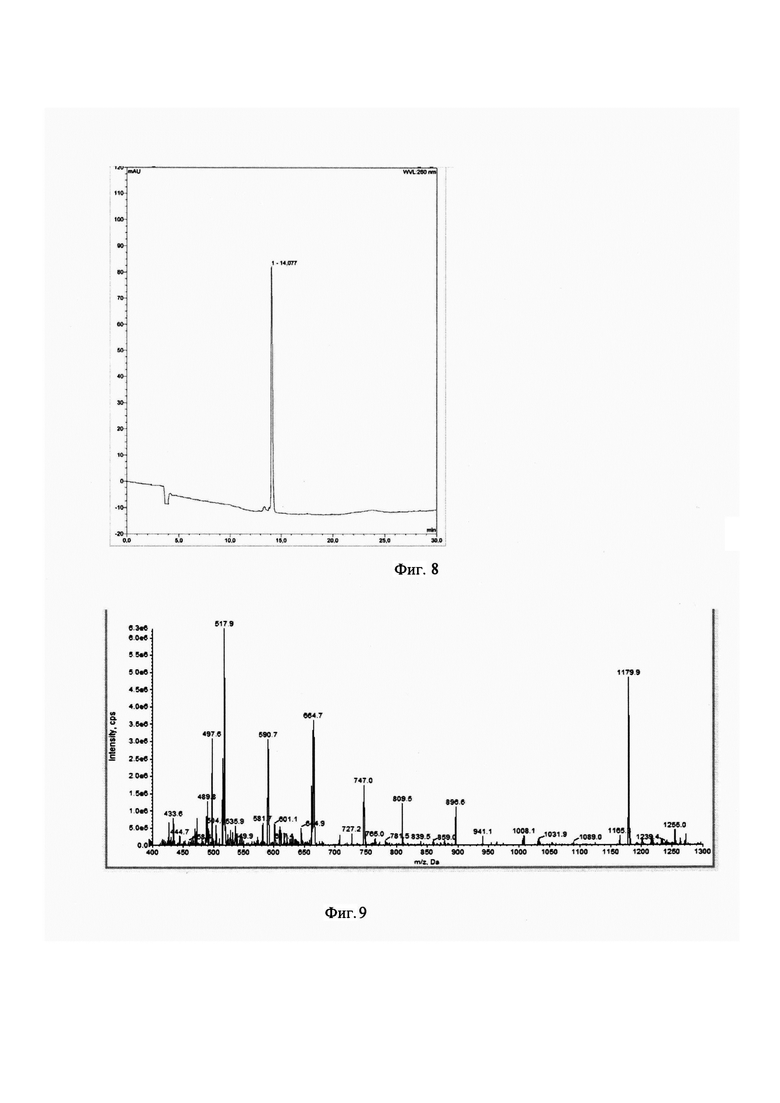
Так, предлагается один из способов присоединения хелатирующего агента к целевой молекуле посредством применения высокотоксичного пиридин-2-карбальдегида с последующим снятием защиты с карбоксильных групп ингибитора ПСМА под действием трифторуксусной кислоты в метиленхлориде в течение 4 часов (фиг. 4). В этом способе к ингибитору ПСМА через амино-группу в его структуре присоединяют пиридин-2-карбальдегид в присутствии NaBH(ОАс)3 в среде метиленхлорида при перемешивании при комнатной температуре в течение 4 часов. Выходы продуктов не охарактеризованы, но данный способ отличается низкими выходами.
Представлен также второй способ получения ингибитора ПСМА с биспиридил хелатором, включающий в себя две основные стадии. На первой стадии к ингибитору ПСМА прибавляют избыток дисукцимидил суберата (DSS) в диметилформамиде и перемешивают при комнатной температуре в течение 2 часов, получают сукцинимидное производное ингибитора ПСМА (фиг. 5). На второй стадии проводят конъюгацию между сукцинимидным производным ингибитора ПСМА с амино-группой биспиридил хелатора с различной длиной углеродной цепи в среде диметилформамида в присутствии триэтиламина в течение 8 часов перемешивая при комнатной температуре. Далее реакционную смесь упаривают при пониженном давлении, продукт выделяют экстракцией метиленхлоридом из водного слоя с последующей очисткой флэш-хроматографией (50/50 метанол/мети ленхлорид). Далее, для снятия зашиты с карбоксильных групп проводят гидролиз, используя трифторуксусную кислоту 7 мл и анизола 0,3 мл при перемешивании 20 мин, раствор выпаривают под вакуумом, промывают диэтиловым эфиром и водой. Затем грубый продукт очищают ВЭЖХ (75/25 вода (0,1% TFA)/ ацетонитрил (0,1%TFA), скорость потока 2 мл/мин). Данный способ получения также отличается применением токсичных растворителей метиленхлорида и метанола, трудоемкой схемой с невысокими выходами по стадиям.
Наиболее близким к предлагаемому способу можно считать способ получения, описанный также в трех патентах [9]. В этом способе присоединение хелатирующего агента - сукцинимид-1-ил 5-(бис(пиридин-2-илметил)амино)пентаноата к амино-группе ингибитора ПСМА осуществляют в метиленхлориде в присутствии триэтиламина при перемешивании при комнатной температуре, далее продукт выделяют экстракцией этилацетатом, промывают водой, насыщенным раствором натрия хлорида и сушат, используя безводный натрия сульфат. Далее очищают флэш-хроматографией (50/50 метанол/метиленхлорид). Снятие защиты с карбоксильных групп проводят под действием трифторуксусной кислоты в метиленхлориде в течение 4 часов, растворители удаляют досуха. Остаток растворяют в 7 мл воды и промывают метиленхлоридом (3×10 мл), водный слой концентрируют под вакуумом. Затем грубый продукт очищают ВЭЖХ (80/20 вода (0,1% TFA)/ ацетонитрил (0,1%TFA)). Выход продукта указан из расчета последней стадии и составляет 73% (фиг. 6).
Недостатками этого способа является необходимость применение сложной схемы синтеза, способов очистки с токсичными растворителями, также в патенте не указано хелатирование молекулы Glu-urea-Lys-дифенил-ПСМА-лиганда.
Новый технический результат - повышение селективности способа и выходов целевых продуктов, повышение универсальности.
Для достижения нового технического результата в способе получения производного мочевины с хелатным центром, тропного к простат-специфичному мембранному антигену для связывания технеция-99 м/рения 188/186 для диагностики рака предстательной железы, включающем получение конъюгата ингибитора простат-специфичного мембранного антигена (ПСМА) с хелатирующим агентом на основе сукциимидного эфира ω-бис(пиридин-2-илметил)амино)алифатических кислот, в качестве ингибитора ПСМА используют (3S,7S,25S,28S)-33-амино-25,28-дибензил-5,13,20,23,26,29-гексаоксо-4,6,12,29,24,27,30-гептаазатриоктан-1,3,7-трикарбоновую кислоту, а в качестве хелатирующего агента - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноат, присоединение хелатирующего агента к ингибитору проводят при мольном соотношении 1 : 1,2 - 5,0 в 10-200 ммоль фосфатном/или боратном/или карбонатном буфере с рН=6,5-9,0 / или в воде очищенной / или в физиологическом растворе натрия хлорида с добавлением и/или без ацетонитрила или диметилформамида, синтез проводят при комнатной температуре при перемешивании в течение 2-12 часов или инкубируют 12-24 часа при температуре 5-10°С, далее продукт очищают полупрепаративной высокоэффективной хроматографии (ВЭЖХ).
Получают продукт с выходом более 90%.
Отличительные признаки проявили в заявляемой методике совокупности новые свойства явным образом не вытекающие из уровня техники в данной области и не очевидные для специалиста.
Предлагаемая совокупность признаков не описана в патентной и научно-технической литературе.
Примеры конкретных способов получения
Пример 1. Методика синтеза сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноата (DPAH-NHS-ester)
Синтез проводят как описано в патенте [11], используя циклогексанон. На последней стадии проводят активацию 6-(ди(пиридин-2-илметил)амино)гексановой кислоты. Для этого в круглодонной колбе к смеси 6-(ди(пиридин-2-илметил)амино)гексановой кислоты (в виде соли гидрохлорида) (1,200 г, 3,48 ммоль) в 6 мл тетрагидрофурана добавляют триэтиламин (0,510 мл, 3,48 ммоль) и далее смесь перемешивают 30 мин при комнатной температуре. Затем N-гидроксисукцинимид (0,474 г, 4,2 ммоль) and N,N-дициклогексилкарбодиимид (0,867 г, 4,2 ммоль) добавляют. Перемешивают 48 часов при комнатной температуре. Конец реакции определяют методом тонкослойной хроматографии (элюент: этилацетат - этанол = 10:3). На хроматограмме должно быть только одно основное пятно с Rf 0,35. Выпавший осадок N,N-дициклогексилмочевины отфильтровывают. В фильтрате отгоняют тетрагидрофуран, к полученному маслу добавляют 10 мл воды и экстрагируют метиленхлоридом (3×15 мл). Метиленхлоридное извлечение сушат над безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Полученную светло-желтую маслообразную массу сушат под вакуумом. Ориентировочная масса промежуточного продукта сукцинимид-1-ил 6-(ди(пиридин-2-илметил)амино)гексаноата (DPAH-NHS ester) составляет 0,874 г (62%).
Пример 2. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
2⋅10-3 ммоль (2 мг) Glu-urea-Lys-дифенил-ПСМА-лиганда, полученного как описано в источнике [2], растворяют в 0,5 мл 10 ммоль фосфатном буфере (PBS) (рН=8,0), добавляют 2,4⋅10-3 ммоль DPAH-NHS ester (1 мг) в 0,5 мл 10 ммоль PBS (рН=8,0), содержащем 20% ацетонитрила, перемешивают 12 часов при комнатной температуре. Контроль за ходом реакции осуществляют с помощью жидкостной хроматографии в подкисленной трифторуксусной кислотой (TFA) среде (tR = 14,077 мин, система Ultimate 3000 («Thermo», Германия), колонка Luna С18(2) 5 мкм, 100 А°, 250×4.6 мм, градиент концентрации: 0 мин 100% А (0% В), 5 мин 80% А (20% В), 10 мин 65% А (35% В), 15 мин 50% А (50% В), 25 мин 20% А (80% В), 30 мин 0% А (100% В), 32 мин 95% А (5% В), где система А - 0,1% TFA в воде и система В - 0,1% TFA в ацетонитриле, скорость потока 1 мл/мин) (фиг. 8). Очистку продукта проводят полупрепаративным методом (система Ultimate 3000 («Dionex», Германия), колонка Luna С18(2) 10 мкм, 100 А°, 250×10 мм, градиент концентрации 0 мин 100% А (0% В), 5 мин 80% А (20% В), 10 мин 65% А (35% В), 15 мин 50% А (50% В), 25 мин 20% А (80% В), 30 мин 0% А (100% В), 32 мин 95% А (5% В), где система А - 0,1% TFA в воде и система В - 0,1% TFA в ацетонитриле, скорость потока 5 мл/мин). Фракции, соответствующие целевому продукту (tR = 14,110 мин), объединяют и лиофилизируют. Выход продукта составил 95%, m/z 1179,9 (М+Н)+ (фиг. 9).
Пример 3. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 50 ммоль PBS. Выход продукта составил 94%.
Пример 4. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 100 ммоль PBS. Выход продукта составил 94,5%.
Пример 5. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 150 ммоль PBS. Выход продукта составил 93%.
Пример 6. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 200 ммоль PBS. Выход продукта составил 90%.
Пример 7. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 10 ммоль PBS (рН=6,0). Выход продукта составил 75%.
Пример 8. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 10 ммоль PBS (рН=6,5). Выход продукта составил 80%.
Пример 9. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 10 ммоль PBS (рН=7,0). Выход продукта составил 84%.
Пример 10. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 10 ммоль PBS (рН=7,5). Выход продукта составил 88%.
Пример 11. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 10 ммоль PBS (рН=8,5). Выход продукта составил 90%.
Пример 12. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 10 ммоль PBS (рН=9,0). Выход продукта составил 89%.
Пример 13. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют 100 ммоль боратного буфера (рН=8,0). Выход продукта составил 92%.
Пример 14. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют физиологичный раствор натрия хлорида. Выход продукта составил 89%.
Пример 15. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что в качестве среды используют воду очищенную. Выход продукта составил 87%.
Пример 16. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что вместо ацетонитрила добавляют диметилформамид. Выход продукта составил 92%.
Пример 17. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что синтез проводят при комнатной температуре в течение 1 часа. Выход продукта составил 76%.
Пример 18. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что синтез проводят при комнатной температуре в течение 24 часов. Выход продукта составил 95%.
Пример 19. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что синтез проводят при комнатной температуре в течение 2 часов. Выход продукта составил 90%.
Пример 20. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что синтез проводят 12 часов при температуре 5-10°С. Выход продукта составил 85%.
Пример 21. Методика получения производного мочевины с хелатным центром, отвечающего формуле (фиг. 7)
Реакционную смесь готовят так же, как и в примере 2 с тем отличием, что синтез проводят 24 часа при температуре 5-10°С. Выход продукта составил 93%.
Обоснование режима
Проведенные исследования позволили сделать следующие выводы.
Реакция конъюгации Glu-urea-Lys-дифенил-ПСМА-лиганда с хелатирующим агентом DPAH-NHS ester проявляет существенную зависимость от рН. При низких значениях рН (менее 6,5) и высоких (более 9,0) происходит процесс гидролиза DPAH-NHS ester, являющего сукцинимидным эфиром. Оптимальным значением рН для модификации является 6,5-9,0 (примеры 2, 7-12). Молярность буферного раствора также не существенно влияет на выход целевого продукта, но наиболее подходящим является использование буферных растворов от 10 до 200 ммоль (примеры 2-7). Для модификации используют фосфатный, боратный, карбонатный буферные растворы, физиологичный раствор натрия хлорида или воду очищенную (примеры 2, 13-15). Выходы целевого продукта в разных растворителях выше 80%, следовательно, для модификации Glu-urea-Lys-дифенил-ПСМА-лиганда можно проводить в указанных растворителях, однако, предпочтительнее фосфатный буфер. В качестве со-растворителей можно применять 10 - 20% ацетонитрила или диметилформамида, выходы целевого продукта выше 90% (примеры 2, 16). Для достижения высоких выходов необходимо проводить синтез при комнатной температуре при перемешивании в течение 2-12 часов или 12-24 часа при температуре 5-10°С (примеры 2, 18-21).
Источники информации, принятые во внимание при составлении описания:
1) Радионуклидная диагностика рака предстательной железы: позитронно-эмиссионная томография с 68GA-PSMA-ингибиторами и их фармразработка / А.А. Ларенков, Г.Е. Кодина // Медицинская радиология и радиационная безопасность. 2017. Том 62. №6, с/ 58-74. DOI 10.12737/article_5a2542f7216cb3.01677610
2) Синтез коньюгатов лигандов простатического специфического мембранного антигена с доксорубицином для терапии рака предстательной железы и их биологическое тестирование / А.Э. Мачулкин, А.С.Гаранина, И.И. Киреев, И.Б. Алиева, Е.К. Белоглазкина, Н.В. Зык, В.Э. Котелянский, А.Г. Мажуга // Российский биотерапевтический журнал. Спецвыпуск. Т. 16.2017. С. 51.
3) Design, Synthesis, and Pre-clinical Evaluation of Prostate-Specific Membrane Antigen (PSMA)-Targeted 99mTc-Radioimaging Agents / Sumith A Kularatne, Zhigang Zhou, Jun Yang, Carol Beth Post, and Philip S. Low // Mo/. Pharmaceutics, 2009, 6 (3), pp 790-800, DOI: 10.1021/mp9000712
4) С. Santos-Cuevas, J. Davanzo, G. Ferro-Flores, F.O.  B.
B.  E. Ignacio-Alvarez, E.
E. Ignacio-Alvarez, E.  M.
M.  99mTc-labeled PSMA inhibitor: Biokinetics and Radiation Dosimetry in Healthy Subjects and Imaging of Prostate Cancer Tumors in Patients //Nucl Med Biol. (2017) 52:1-6.
99mTc-labeled PSMA inhibitor: Biokinetics and Radiation Dosimetry in Healthy Subjects and Imaging of Prostate Cancer Tumors in Patients //Nucl Med Biol. (2017) 52:1-6.
5) G. Lu, K.P. Maresca, S.M. Hillier, C.N. Zimmerman, W.C. Eckelman, J.L. Joyal, J.W. Babich / Synthesis and SAR of 99mTc/Re-labeled small molecule prostate specific membrane antigen inhibitors with novel polar chelates//Bioorg. Med. Chem. Lett. (2013) 23:1557-1563.
6) Patent HK1215249 (A1). Labeled inhibitors of prostate specific membrane antigen (PSMA), biological evaluation, and use as imaging agents. Pomper, Martin Gilbert,; Ray, Sangeeta,; Mease, Ronnie C.; Foss, Catherine / 2016-08-19.
7) Patent WO 2010065899. Technetium-and rhenium-bis(heteroaryl) complexes and methods of use thereof for a inhibiting PSMA / John W. Babich, Craig Zimmerman, John Joyal, Kevin P. Maresca, John Marquis,Genliang Lu, Jian-Cheng Wang, Shawn Hillier // 10 июн 2010.
8) Patent WO 2009002529A2. Labeled inhibitors of prostate specific membrane antigen (psma), biological evaluation, and use as imaging agents / Martin Gilbert Pomper, Sangeeta Ray, Ronnie C. Mease, Catherine Foss // 2007-06-26.
9) AU 2015203742(A1). Labeled inhibitors of prostate specific membrane antigen (PSMA), biological evaluation, and use as imaging agents / Catherine Foss, Martin Gilbert Pomper, Sangeeta Ray, Ronnie C. Mease // 2015-07-30.
10) US 2015/0246144 A1. Labeled inhibitors of prostate specific membrane antigen (PSMA), biological evaluation, and use as imaging agents / Martin Gilbert Pomper, Sangeeta Ray, Ronnie C. Mease, Catherine Foss // 2015-09-03.
11) Патент №2616974, 19.04.2017. Юсубов M.C., Ларькина M.C., Подрезова Е.В., Стасюк Е.С., Скуридин B.C. Способ получения ω-бис(пиридин-2-илметил)амино)алифатических кислот - прекурсоров с хелатными центрами для связывания металлов.
Приложение
Фигура 1. Структурная формула коньюгата карбамида с аминокислотами - соединение Glu-urea-Lys-дифенил-ПСМА-лиганд
Фигура 2. Основная формула M-Glu-Urea-Lys-X аналогов с биспиридил хелатором
Фигура 3. Основная схема синтеза M-Glu-Urea-Lys-X аналогов
Фигура 4. Способ получения ингибиторов ПСМА с биспиридил хелатором при использование пиридин-2-карбальдегида
Фигура 5. Способ получения ингибиторов ПСМА с биспиридил хелатором при использование DSS
Фигура 6. Способ получения ингибиторов ПСМА с биспиридил хелатором при использовании сукцинимид-1-ил 5-(бис(пиридин-2-илметил)амино)пентаноата
Фигура 7. Основная формула коньюгата карбамида с аминокислотами - соединение Glu-urea-Lys-дифенил-ПСМА-лиганд с хелатным центром на основе биспиридила хелата
Фигура 8. ВЭЖ хроматограмма целевого продукта (tR = 13,383 мин, чистота более 97%)
Фигура 9. Масс-спектр целевого продукта (электроспрей)
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ПСМА-ТАРГЕТНОГО СОЕДИНЕНИЯ НА ОСНОВЕ МОЧЕВИНЫ Lu-PS-161 И КОМПЛЕКС | 2023 |
|
RU2808636C1 |
| КОМПЛЕКС ПРОИЗВОДНОГО МОЧЕВИНЫ С РАДИОНУКЛИДНОЙ МЕТКОЙ Tс ДЛЯ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПРОСТАТСПЕЦИФИЧЕСКИЙ МЕМБРАННЫЙ АНТИГЕН, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2023 |
|
RU2825402C1 |
| Молекула общей структуры Y-Nic-F, способы получения, предшественники для её получения, а также применение в качестве действующего вещества в составе потенциального радиофармацевтического лекарственного препарата | 2021 |
|
RU2811181C2 |
| ПСМА-ТАРГЕТНОЕ СОЕДИНЕНИЕ И ЕГО КОМПЛЕКС С РАДИОНУКЛИДАМИ ДЛЯ ТЕРАНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПСМА | 2022 |
|
RU2803734C1 |
| СОЕДИНЕНИЕ ДЛЯ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПСМА, И КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2019 |
|
RU2730507C1 |
| ЛИОФИЛИЗАТ ДЛЯ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКОГО РАДИОФАРМАЦЕВТИЧЕСКОГО ЛЕКАРСТВЕННОГО ПРЕПАРАТА НА ОСНОВЕ РАДИОНУКЛИДА Tc | 2022 |
|
RU2799325C2 |
| Лиганды PSMA для визуализации и эндорадиотерапии | 2018 |
|
RU2807076C2 |
| ПРОСТАТИЧЕСКИЙ СПЕЦИФИЧЕСКИЙ МЕМБРАННЫЙ АНТИГЕН-ТАРГЕТНЫЕ ВЫСОКОАФФИННЫЕ СРЕДСТВА ДЛЯ ЭНДОРАДИОТЕРАПИИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2017 |
|
RU2749399C2 |
| СОЕДИНЕНИЕ ПЕПТИДНОЙ ПРИРОДЫ, ОБЛАДАЮЩЕЕ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С ПСМА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2823164C2 |
| ЛИГАНДЫ, ТРОПНЫЕ К ПРОСТАТИЧЕСКОМУ СПЕЦИФИЧЕСКОМУ МЕМБРАННОМУ АНТИГЕНУ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ДВОЙНЫХ КОНЪЮГАТОВ С ТЕРАПЕВТИЧЕСКИМИ АГЕНТАМИ НА ИХ ОСНОВЕ ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ ПСМА ЭКСПРЕССИРУЮЩИХ ОПУХОЛЕЙ | 2023 |
|
RU2841078C1 |
Изобретение относится к способу получения производного мочевины с хелатным центром, тропного к простат-специфичному мембранному антигену для связывания технеция-99м/рения 188/186 для диагностики рака предстательной железы. Способ включает получение конъюгата ингибитора простат-специфичного мембранного антигена (ПСМА) с хелатирующим агентом на основе сукциимидного эфира ω-бис(пиридин-2-илметил)амино)алифатических кислот. В качестве ингибитора ПСМА используют (3S,7S,25S,28S)-33-амино-25,28-дибензил-5,13,20,23,26,29-гексаоксо-4,6,12,29,24,27,30-гептаазатриоктан-1,3,7-трикарбоновую кислоту. В качестве хелатирующего агента используют сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноат. Присоединение хелатирующего агента к ингибитору проводят при мольном соотношении 1:1,2-5,0 в 10-200 ммоль фосфатном, или боратном, или карбонатном буфере с рН 6,5-9,0, или в воде очищенной, или в физиологическом растворе натрия хлорида с добавлением и/или без ацетонитрила или диметилформамида, синтез проводят при комнатной температуре в течение 2-12 часов при перемешивании или инкубируют 12-24 часа при температуре 5-10°С, далее продукт очищают полупрепаративной высокоэффективной хроматографии. Предложенный способ позволяет получать целевой продукт с высоким выходом, который может быть использован для диагностики рака предстательной железы. 21 пр., 9 ил.
Способ получения производного мочевины с хелатным центром, тропного к простат-специфичному мембранному антигену для связывания технеция-99м/рения 188/186 для диагностики рака предстательной железы, включающий получение конъюгата ингибитора простат-специфичного мембранного антигена (ПСМА) с хелатирующим агентом на основе сукциимидного эфира ω-бис(пиридин-2-илметил)амино)алифатических кислот, отличающийся тем, что в качестве ингибитора ПСМА используют (3S,7S,25S,28S)-33-амино-25,28-дибензил-5,13,20,23,26,29-гексаоксо-4,6,12,29,24,27,30-гептаазатриоктан-1,3,7-трикарбоновую кислоту, а в качестве хелатирующего агента - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноат, присоединение хелатирующего агента к ингибитору проводят при мольном соотношении 1:1,2-5,0 в 10-200 ммоль фосфатном, или боратном, или карбонатном буфере с рН 6,5-9,0, или в воде очищенной, или в физиологическом растворе натрия хлорида с добавлением и/или без ацетонитрила или диметилформамида, синтез проводят при комнатной температуре в течение 2-12 часов при перемешивании или инкубируют 12-24 часа при температуре 5-10°С, далее продукт очищают полупрепаративной высокоэффективной хроматографией.
| WO 2009002529 A2, 31.12.2008 | |||
| WO 2010065899 A2, 10.06.2010 | |||
| Способ получения ω-(бис(пиридин-2-илметил)амино)алифатических кислот - прекурсоров с хелатными центрами для связывания металлов | 2016 |
|
RU2616974C1 |
| ТЕХНЕЦИЙ- И РЕНИЙ-БИС(ГЕТЕРОАРИЛЬНЫЕ) КОМПЛЕКСЫ И МЕТОДЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ИНГИБИРОВАНИЯ PSMA | 2009 |
|
RU2532912C2 |
Авторы
Даты
2019-06-21—Публикация
2018-02-13—Подача