Область техники
[0001] Настоящее изобретение относится к риновакцинационной системе для того, чтобы вводить композицию вакцины против гриппа в слизистую носа, которую используют в комбинации с медицинским шприцом.
Уровень техники
[0002] Грипп представляет собой острую инфекцию дыхательных путей, обусловленную вирусом гриппа, в частности, грипп приобретает масштабы эпидемии зимой год за годом. Кроме того, грипп иногда ведет к пандемии, и множество людей становится тяжело больными, что ведет к смерти. Для гриппа известно, что вакцинация с использованием вакцины против гриппа может давать некоторые профилактические эффекты, таким образом люди массово проходят вакцинацию перед эпидемическим сезоном.
[0003] Вакцина против гриппа, одобренная в Японии, представляет собой только инактивированный белковый компонент антигена вируса гриппа для подкожной вакцинации, и в настоящее время расщепленную вакцину из него используют в качестве сезонной вакцины против гриппа. Такая вакцина для подкожной вакцинации высоко эффективна для предотвращения осложнений при инфекции гриппа, таких как пневмония, но она обладает низкой антителозависимой активностью в слизистой оболочке верхних дыхательных путей, которая представляет собой области инфекции вирусом гриппа, чего недостаточно в качестве активности, защищающей от инфекции. И такое инъекционное введение имеет проблемы, например, боль и побочные эффекты, такие как воспаление, обусловленные топической вакцинацией.
[0004] Для приведенной выше проблемы вакцинации против гриппа на сегодняшний день проведен широкий спектр испытаний, в которых вакцина для назального введения привлекла внимание в качестве новой вакцинации. Однако сообщалось о том, что невозможно индуцировать высокий иммунный ответ на вирус гриппа, даже несмотря на то, что расщепленную вакцину, которую широко используют в существующей клинической практике, вводят непосредственно назально экспериментальным животным или человеку.
[0005] При таких обстоятельствах, первая в мире субъединичная вакцина против гриппа для назального введения, которая содержит термолабильный токсин Escherichia coli в качестве адъюванта, одобрена в Швейцарии [Berna Biotech, Switzerland; коммерческое название: Nasalflu], и ее продажи начались в октябре 2000 года, но от ее клинического использования отказались в феврале 2004 года из-за токсичности адъюванта. Также в патентном источнике 1 раскрыта вакцина против гриппа для назального введения, которая содержит адъювант, что указывает на то, что индукцию иммунитета можно усиливать посредством использования адъюванта. Однако при практическом использовании токсичность адъювантов вызывает озабоченность.
[0006] Для назального введения также необходимо учитывать сложную структуру носовой полости и желательно делать вакцину против гриппа широко распространенной, прикрепленной и сохраняющейся в течение длительного времени в носовой полости. Например, основу (материал), раскрытую в патентном источнике 2, можно использовать для распылительного введения.
[0007] Насосное распылительное устройство, такое как безвоздушное распылительное устройство, используемое в патентном источнике 2, позволяет достигать хорошей пригодности состава к распылению (способность диспергироваться распылением, однородность размеров частиц состава и т. д.), что, как ожидают, даст достаточный желаемый эффект лекарственного средства, однако, сложно заполнять распылительный контейнер только одной дозой, чтобы сделать его одноразовой системой для введения, с точки зрения структуры распылительного контейнера. Таким образом, для того, чтобы назально вводить вакцину против гриппа с использованием такого насосного распылительного устройства, нет другого пути, кроме заполнения распылительного контейнера составом вакцины с большим избытком, вводить его одному человеку и затем выбрасывать остаток вместе с распылительным устройством или использовать остаток для множества субъектов с точки зрения стоимости. Однако повторное использование такого кончика безвоздушного распылительного устройства в носовых полостях множества пациентов или субъектов может заставить большинство людей испытывать негативные эмоции, и использование является негигиеничным и несет опасность другой инфекции (больничная инфекция).
[0008] Как указано выше, желательно разработать вакцину против гриппа для назального введения в качестве вакцины против гриппа следующего поколения и ввести ее в практическое использование, которое займет место стандартной вакцины против гриппа для подкожного или внутримышечного введения. Однако, существуют различные проблемы для практического использования, например, как снижать токсичность адъюванта, используемого для усиления индукции иммунитета, или как разработать устройство для введения, чтобы достаточно усилить его эффект.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
[0009] [Патентный источник 1] WO 2010/114169
[Патентный источник 2] WO 2007/123193
Сущность изобретения
[0010] Одна из задач по настоящему изобретению состоит в том, чтобы предоставить систему для введения композиции вакцины против гриппа для распылительного введения на слизистую носа, которую получают с использованием инактивированного цельного вириона гриппа в качестве антигена, который уже получил одобрение, но без использования адъюванта, который проявляет высокий эффект и низкие побочные эффекты, несмотря на низкий уровень антигена, который используют в комбинации с устройством для введения.
[0011] Кроме того, WO 2014/103488 представляет собой применение, связанное с настоящей заявкой, которое уже опубликовано. Однако дата приоритета настоящей заявки раньше, чем дата публикации связанной заявки и, таким образом, она не является документом известного уровня техники для настоящей заявки.
[0012] Авторы настоящего изобретения всесторонне изучали приведенную выше проблему и после этого обнаружили, что комбинация (i) гелиевого основания (материал) для распылительного введения на слизистую носа, содержащего карбоксивиниловый полимер, которое обрабатывают посредством приложения внешнего усилия сдвига для того, чтобы увеличивать эффективность распыления и (ii) инактивированного цельного вириона гриппа может усиливать индукцию иммунитета у человека без адъюванта; и кроме того создали систему для введения посредством размещения комбинации в струйном шприце с отмеренной дозой, который имеет оптимизированную геометрическую форму/конфигурацию сопла. Настоящее изобретение выполнено на основе новых находок. Настоящее изобретение может предусматривать следующие варианты осуществления.
[0013] [1] Риновакцинационная система для вакцины против гриппа, которая содержит струйный шприц, который заполнен композицией вакцины против гриппа, которая содержит (i) инактивированный цельный вирион гриппа и (ii) гелиевый материал основания, содержащий карбоксивиниловый полимер, который обрабатывают посредством приложения внешнего усилия сдвига для того, чтобы увеличивать эффективность распыления, которая отличается тем, что не содержит адъювант.
[0014] [2] Риновакцинационная система для вакцины против гриппа согласно [1], в которой струйный шприц представляет собой медицинский шприц, который имеет отверстие кончика в соединении по текучей среде с цилиндром шприца, которое оборудовано назальным распылительным соплом, которое содержит
полый корпус сопла, имеющий концевую часть, определяющую отверстие сопла в нем,
твердый упаковочный стержень, расположенный внутри корпуса сопла, и
камеру сопла, которая определена между упаковочным стержнем и корпусом сопла, чтобы сделать возможным соединение по текучей среде между отверстием кончика и отверстием сопла,
где отверстие сопла имеет диаметр в диапазоне между 0,25 мм и 0,30 мм.
[0015] [3] Риновакцинационная система для вакцины против гриппа согласно [1] или [2], в которой количество (i) инактивированного цельного вириона гриппа составляет 1-500 мкг ГА/мл на один тип штамма вируса вакцины.
[0016] [4] Риновакцинационная система для вакцины против гриппа по любому одному из с [1] до [3], в которой композиция вакцины против гриппа содержит карбоксивиниловый полимер от 0,1% масс./об. до 1,0% масс./об.
[0017] [5] Риновакцинационная система для вакцины против гриппа по любому одному из с [1] до [4], в которой эффективность распыления для того, чтобы управлять (1) распределением размеров частиц распыляемой композиции, (2) однородностью плотности распыления и/или (3) углом распыления.
[0018] [6] Риновакцинационная система для вакцины против гриппа по любому одному из с [1] до [3], в которой композицию вакцины против гриппа получают посредством обработки гелиевого материала основания, содержащего от 0,5% масс./об. до 2,0% масс./об. карбоксивинилового полимера, посредством приложения внешнего усилия сдвига для того, чтобы управлять (1) распределением размеров частиц распыляемой композиции, (2) однородностью плотности распыления и/или (3) углом распыления, в качестве эффективности распыления, чтобы получать гелиевый материал основания, и затем
смешивания получаемого гелиевого материала основания со стоковым раствором вируса, который содержит инактивированный цельный вирион гриппа, гомогенно за короткое время без напряжений.
[0019] [7] Риновакцинационная система для вакцины против гриппа по любому одному из с [1] до [6], в которой композицию вакцины против гриппа получают с использованием гелиевого материала основания, содержащего карбоксивиниловый полимер, который обрабатывают посредством приложения внешнего усилия сдвига для того, чтобы увеличивать эффективность распыления, что предназначено для того, чтобы управлять этим (1) в отношении распределения размеров частиц распыляемой композиции, средний размер частицы находится в диапазоне от 30 мкм до 80 мкм, и распределение частиц между 10 мкм и 100 мкм составляет 80% или больше,
(2) плотность распыления является однородной для того, чтобы создавать гомогенную форму полного конуса, и
(3) угол распыления корректируют в диапазоне от 30° до 70°.
[0020] [8] Риновакцинационная система для вакцины против гриппа по любому одному из с [1] до [6], в которой композицию вакцины против гриппа получают с использованием гелиевого материала основания, содержащего карбоксивиниловый полимер, который обрабатывают посредством приложения внешнего усилия сдвига для того, чтобы увеличивать эффективность распыления, что предназначено для того, чтобы управлять этим (1) в отношении распределения размеров частиц распыляемой композиции, средний размер частицы находится в диапазоне от 40 мкм до 70 мкм, и распределение частиц между 10 мкм и 100 мкм составляет 90% или больше,
(2) плотность распыления является однородной для того, чтобы создавать гомогенную форму полного конуса, и
(3) угол распыления корректируют в диапазоне от 40° до 60°.
[0021] [9] Риновакцинационная система для вакцины против гриппа по любому одному из с [2] до [8], в которой отверстие сопла по существу не содержит изогнутую часть.
[0022] [10] Риновакцинационная система для вакцины против гриппа по любому одному из с [2] до [9], в которой концевая часть, определяющая отверстие сопла, имеет толщину вдоль направления инъекции состава, которая находится в диапазоне между 0,20 мм и 0,30 мм.
[0023] [11] Риновакцинационная система для вакцины против гриппа по любому одному из с [2] до [10],
в которой корпус сопла содержит внутреннюю стенку, которая по меньшей мере часть, которой придали цилиндрическую форму, и упаковочный стержень содержит внешнюю стенку по меньшей мере часть, которой придали цилиндрическую форму, имеющую множество канавок, разнесенных по окружности,
в которой камеру сопла определяют между по меньшей мере частью внутренней стенки корпуса сопла и по меньшей мере частью внешней стенки упаковочного стержня, и
в которой упаковочный стержень содержит создающий вихревой поток элемент, противолежащий концевой части корпуса сопла.
[0024] [12] Риновакцинационная система для вакцины против гриппа согласно [11], в которой создающий вихревой поток элемент формируют с тем, чтобы смещать направление потока состава из канавок упаковочного стержня к центральной оси для того, чтобы тем самым генерировать вихревой поток состава.
[0025] [13] Риновакцинационная система для вакцины против гриппа согласно [11] или [12], в которой по меньшей мере часть внутренней стенки корпуса сопла формируют так, чтобы она имела сечение, по существу перпендикулярное направлению инъекции, которое непрерывно или постепенно уменьшается в направлении инъекции.
[0026] Настоящее изобретение позволяет предоставлять композицию вакцины против гриппа, которая содержит инактивированный цельный вирион гриппа в качестве активного ингредиента, но не содержит адъювант, который индуцирует высокий иммунный ответ, несмотря на низкий уровень антигена и низкие побочные эффекты, поскольку композиция не содержит адъювант. Ожидают, что при использовании системы для введения, оборудованной струйным шприцом с отмеренной дозой, имеющим назальное распылительное сопло оптимизированной формы, композицию вакцины против гриппа будут подходящим образом применять при эпидемии гриппа.
Композицию вакцины против гриппа по настоящему изобретению можно обширно распределять, прикреплять и удерживать в течение длительного времени в слизистой носа, поскольку композиция содержит гелиевый материал основания, содержащий карбоксивиниловый полимер, который обрабатывают посредством приложения внешнего усилия сдвига для того, чтобы увеличивать эффективность распыления, таким образом композиция вакцины против гриппа по настоящему изобретению может индуцировать высокий иммунный ответ, несмотря на низкий уровень антигена.
В соответствии с процессом получения композиции вакцины против гриппа по настоящему изобретению можно предоставлять композицию вакцины против гриппа, которая хорошо сохраняет антигенность инактивированного цельного вириона, поскольку вирион обрабатывают за короткое время без напряжений, и индуцирует высокий иммунный ответ и низкие побочные эффекты.
Несмотря на то, что настоящее изобретение не содержит адъювант в качестве иммунопотенциирующего средства, настоящее изобретение может обеспечивать равную или более сильную индукцию иммунитета для слизистой оболочки верхних дыхательных путей и организма в целом по сравнению с композицией, которая содержит вакцину против вируса гриппа и адъювант.
Краткое описание фигур
[0027] На фиг. 1 представлен частично фрагментированный вид сбоку общей структуры медицинского шприца, содержащего назальное распылительное сопло по одному из вариантов осуществления в соответствии с настоящим изобретением.
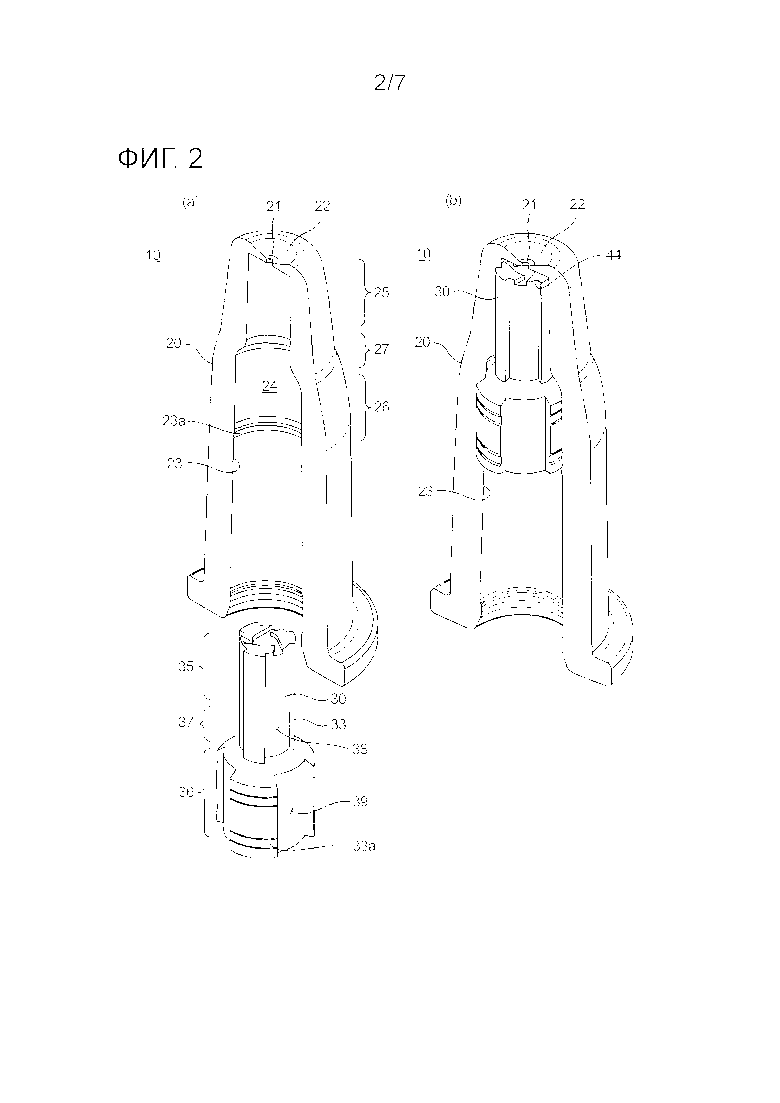
На фиг. 2(a) и 2(b) представлен частично фрагментированный вид в перспективе общей структуры назального распылительного сопла по одному из вариантов осуществления настоящего изобретения, показывающий конфигурации до и после установки упаковочного стержня внутри корпуса сопла, соответственно.
На фиг. 3(a) представлен вертикальный вид в поперечном разрезе назального распылительного сопла с фиг. 2(b), а на фиг. 3(b), 3(c) и 3(d) представлен горизонтальный вид в поперечном разрезе назального распылительного сопла, выполненный вдоль линии B-B, линии C-C и линии D-D на фиг. 3(a), соответственно.
На фиг. 4(a) и 4(b) представлен увеличенный вид в поперечном разрезе концевой части корпуса сопла, где в концевой части предусмотрена изогнутая часта на фиг. 4(a), но не на фиг. 4(b).
На фиг. 5 представлен результат измерения распределения размеров частиц состава в примере 4 с использованием лазерного дифракционного анализатора размера частиц, которые распыляли с использованием струйного шприца по настоящему изобретению.
На фиг. 6 представлен результат измерения угла распыления состава в примере 4 с использованием высокоскоростного микроскопа, который распыляли из кончика сопла в струйном шприце по настоящему изобретению. Угол распыления распыляемого состава составлял 52,27°.
На фиг. 7 представлен результат измерения характера распыления состава в примере 4 с использованием листа для тестирования паттерна распыления, который распыляли с использованием струйного шприца по настоящему изобретению. Он представлял собой однородный полноконический круг.
Описание вариантов осуществления
[0028] Настоящее изобретение предусматривает риновакцинационную систему для вакцины против гриппа, которая содержит
медицинский шприц, который имеет отверстие кончика в соединении по текучей среде с цилиндром шприца, который оборудован назальным распылительным соплом, содержащим полый корпус сопла, имеющим концевую часть, которая определяет отверстие сопла в нем, твердый упаковочный стержень, расположенный внутри корпуса сопла, и камеру сопла, которая определена между упаковочным стержнем и корпусом сопла для того, чтобы сделать возможным соединение по текучей среде между отверстием кончика и отверстием сопла, где отверстие сопла имеет диаметр в диапазоне между 0,25 мм и 0,30 мм,
который заполняют композицией вакцины против гриппа, которая содержит гелиевый материал основания, содержащий карбоксивиниловый полимер, который обрабатывают посредством приложения внешнего усилия сдвига для того, чтобы увеличивать эффективность распыления, и инактивированный цельный вирион гриппа, которая отличается тем, что не содержит адъювант.
[0029] «Гелиевый материал основания, содержащий карбоксивиниловый полимер, который обрабатывают посредством приложения внешнего усилия сдвига для того, чтобы увеличивать эффективность распыления», используемый в настоящем документе, обозначает, например, «гелиевый материал основания, содержащий средство, прилипающее к коже/слизистой», раскрытый в WO 2007/123193, который представляет собой материал основания, содержащий карбоксивиниловый полимер и необязательно содержащий геллановую камедь, вязкость которого корректируют посредством приложения внешнего усилия сдвига. Материал основания отличается тем, что его вязкость можно корректировать до различных значений посредством приложения внешнего усилия сдвига, а углом распространения распылением из распылительного контейнера и плотностью распыления можно управлять, чтобы достигать этой цели. Кроме того, использование данной системы для введения, оборудованной струйным шприцом с отмеренной дозой, имеющим назальное распылительное сопло оптимизированной формы, позволяет достигать хорошей пригодности состава к распылению (способность диспергироваться распылением, однородность размера частиц состава и т. д.), как и в случае насосного распылительного устройства, такого как безвоздушное распылительное устройство, раскрытое в WO 2007/123193, и, тем самым, использование может сделать распространение инактивированного цельного вириона гриппа на слизистой носа обширным и долговременным, чтобы увеличивать иммуногенность антигена.
[0030] Карбоксивиниловый полимер, который представляет собой ингредиент материала для гелиевого материала основания в настоящем изобретении, представляет собой гидрофильный полимер, получаемый посредством полимеризации акриловой кислоты в качестве основного ингредиента, который можно выбирать из фармацевтических добавок, которые в целом используют для того, чтобы получать водное гелиевое средство без какого-либо ограничения.
Содержание гелиевого материала основания, содержащего карбоксивиниловый полимер, который обрабатывают посредством приложения внешнего усилия сдвига для того, чтобы увеличивать эффективность распыления, составляет 0,1-1,0% масс./об., предпочтительно 0,3-0,7% масс./об. в качестве содержания карбоксивинилового полимера.
[0031] Вакцина по настоящему изобретению отличается тем, что содержит инактивированный цельный вирион гриппа в качестве антигена. Инактивированный цельный вирион гриппа, используемый в настоящем документе, обозначает вирион, который получают посредством культивирования вируса гриппа, чтобы получить суспензию этого вируса, и очистки суспензии вируса, при этом сохраняя морфологию этого вируса. Таким образом, вакцина против гриппа по настоящему изобретению обозначает вакцину, за исключением расщепленной вакцины (включая субвирион) и субъединичной вакцины (включая очищенные ГА или НА), а также ее обозначают как цельно-вирионную вакцину.
[0032] Указанный выше инактивированный цельный вирион гриппа предпочтительно представляет собой такой вирион, который очищают от суспензии вируса в отсутствие поверхностно-активных средств и простых эфиров. Стоковый раствор вируса, используемый в настоящем документе, обозначает раствор вируса, содержащий инактивированный цельный вирион гриппа, который очищают или концентрируют для смешивания с гелиевым материалом основания в настоящем изобретении. По отношению к вакцине по настоящему изобретению, концентрация инактивированного цельного вириона гриппа предпочтительно составляет 1-500 мкг ГА/мл (в эквиваленте ГА), более предпочтительно 20-250 мкг ГА/мл (в эквиваленте ГА) на один тип штамма вируса вакцины. Указанную выше концентрацию можно определять посредством измерения концентрации белка ГА.
[0033] Вирус гриппа, используемый в настоящем документе, включает вирус гриппа всех известных в настоящее время типов и все его подтипы, а также вирус гриппа всех типов и всех подтипов, которые будут выделены или идентифицированы в будущем. Кроме того, с точки зрения необходимости такого же эффективного предотвращения инфекции, которая не стала эпидемической у человека до сегодняшнего дня, но может стать эпидемической у человека в будущем, предпочтительной является комбинация подтипа вируса гриппа A, выбранного из группы, состоящей из подтипов H1-H16, за исключением подтипа H1 и H3 (т. е. H2 и H4-H16), и подтипа вируса гриппа A, выбранного из группы, состоящей из подтипов N1-N9. Эти подтипы также обозначают как вирус гриппа нового типа. В качестве указанных выше подтипов, комбинация подтипа, выбранного из группы, состоящей из подтипов H5, H7 и H9, и подтипа, выбранного из группы, состоящей из подтипов N1-N9, является более предпочтительной. Вирус гриппа можно извлекать из типа штамма, двух или более типов штаммов, относящихся к одному и тому же подтипу, или двух или более типов штаммов, относящихся к различным подтипам.
[0034] Вирус гриппа, используемый в настоящем документе, включает штамм, выделенный у инфицированного животного или человека, и рекомбинантный вирус, генетически созданный в культивируемых клетках. В качестве способа культивирования вируса гриппа, вирус можно высевать в аллантоисную полость куриных яиц и культивировать или им можно инфицировать культивируемые клетки и осуществлять культивирование.
[0035] Адъювант представляет собой общий термин для веществ, которые обладают модулирующей иммунный ответ активностью, такой как усиление и супрессия, и его используют в качестве иммунопотенциирующего средства для добавления в вакцину для усиления иммуногенности антигена. На сегодняшний день исследовано множество адъювантов. Использование адъюванта усиливает иммунный эффект вакцины, но это обладает недостатками в виде побочных эффектов, таких как воспаление. Некоторые адъюванты можно выбирать в качестве кандидата, подлежащего использованию в вакцине для назального введения, но одобрения не получила ни одна вакцина для назального введения, содержащая адъювант, поскольку не существовало адъюванта, обладающего первазивной безопасностью.
[0036] Авторы настоящего изобретения обнаружили, что можно получать вакцину, которая обладает высоким эффектом и низкими побочными эффектами, несмотря на отсутствие адъюванта и более низкий уровень антигена, когда гелиевый материал основания, который имеет указанную выше пригодную эффективность распыления, такую как высокое адгезионное свойство на слизистой носа, используют с указанной выше цельно-вирионной вакцины. Кроме того, авторы настоящего изобретения также обнаружили, что при использовании устройства, которое может распылять даже гелиевый материал основания, обладающий высокой вязкостью, композицию вакцины против гриппа можно распылять на слизистую носа, где средний размер частицы распыляемой композиции находится в подходящем диапазоне от 30 мкм до 80 мкм (предпочтительно, в диапазоне от 40 мкм до 70 мкм), распределение размеров частиц между 10 мкм и 100 мкм составляет 80% или больше (предпочтительно, 90% или больше), угол распыления из устройства находится в диапазоне от 30° до 70° (предпочтительно, диапазон от 40° до 60°) с тем, чтобы композицию можно было вводить в желаемое место в носовой полости, и плотность распыления является однородной для того, чтобы создавать гомогенную форму полного конуса. Кроме того, авторы настоящего изобретения также нашли процесс и способ предотвращения гриппа с использованием композиции. Основываясь на новых находках, выполнено настоящее изобретение.
[0037] Вакцина по настоящему изобретению может содержать дополнительный фармацевтически приемлемый носитель(носители) помимо инактивированного цельного вириона гриппа и гелиевый материал основания. Носитель, используемый в настоящем документе, может представлять собой носитель, который в целом используют при получении вакцины или состава для введения в носовую полость, который включает, например, физиологический раствор, буферный физиологический раствор, декстрозу, воду, глицерин, изотонический водный буферный раствор и их сочетание. И вакцина по настоящему изобретению необязательно может содержать консервант (например, тимеросал), изотоническое средство, регулятор pH, поверхностно-активное средство и инактивирующее средство (например, формалин).
[0038] Вакцину по настоящему изобретению используют для распылительного введения в носовую полость.
Вакцина по настоящему изобретению может предотвращать грипп или облегчать его симптом.
[0039] Для введения вакцины выполняют распыление в одну или обе ноздри с использованием оптимизированного назального распылительного сопла по настоящему изобретению, которое можно использовать в качестве одноразового устройства.
Решение о дозе вакцины следует принимать, учитывая возраст, пол и массу пациента или другие факторы, и фактически вакцину можно вводить в количестве в целом от 1 мкг ГА до 150 мкг ГА, предпочтительно от 5 мкг ГА до 50 мкг ГА в качестве антигена на один тип штамма вируса вакцины.
[0040] Со ссылкой на приложенные рисунки, варианты осуществления назального распылительного сопла, используемого для струйного шприца с отмеренной дозой, имеющего назальное распылительное сопло в соответствии с настоящим изобретением, описаны далее в настоящем документе. В дальнейшем описании термины направления, такие как «передний, «задний», «проксимальный» и «дистальный» в целях удобства используют для лучшего понимания, однако эти термины не предназначены для того, чтобы ограничивать объем по настоящего изобретения. Также похожие компоненты обозначены с помощью похожих ссылочных позиций на всем протяжении приложенных рисунков.
[0041]
(Медицинский шприц)
На фиг. 1 представлен частично фрагментированный вид сбоку медицинского шприца 1, который содержит назальное распылительное сопло 10 по варианту осуществления в соответствии с настоящим изобретением. Как проиллюстрировано на фиг. 1, медицинский шприц 1 в целом содержит корпус 4 шприца, выполненный из синтетической смолы или стекла, который имеет цилиндр 3 шприца, способный хранить в себе фармацевтический состав, и шток 5 поршня, вставленный в цилиндр 3 шприца корпуса 4 шприца. Медицинский шприц 1 также содержит поршень 7, который имеет фиксирующий элемент 5a, предусмотренный на дистальном конце штока 5 поршня и скользящий внутри цилиндра 3 шприца с тем, чтобы выкачивать состав в цилиндре 3 шприца из дистального отверстия 6 кончика корпуса 4 шприца, фланец 8 для пальцев, предусмотренный около проксимального конца корпуса 4 шприца, и концевой элемент 9 поршня, передающий усилие, прикладываемое практикующим врачом, таким как врач, к штоку 5 поршня. Медицинский шприц 1 может быть схож со струйным шприцом с отмеренной дозой, раскрытый в WO 2013/145789.
[0042] Следует отметить, что назальное распылительное сопло 10 по настоящему изобретению можно применять к медицинским шприцам 1 любых типов, которые перекачивают состав в цилиндре 3 шприца посредством толкания штока 5 поршня (и поршня 7), и, таким образом, настоящее изобретение не ограничено известными конфигурациями медицинского шприца. Следовательно, настоящее раскрытие не требует дополнительного описания детализированной структуры медицинского шприца (или струйного шприца с отмеренной дозой) 1 и более подробного обсуждения структуры и функции назального распылительного сопла 10, используемого для медицинского шприца. Следует отметить, что раскрытие WO 2013/145789 включено в настоящий документ посредством ссылки в настоящую заявку.
[0043]
(Назальное распылительное сопло)
Как показано на фиг. 1, медицинские шприцы 1 дополнительно содержат назальное распылительное сопло 10 напротив отверстия 6 кончика корпуса 4 шприца и защитный колпачок 50 для защиты стерилизованной концевой части 22 назального распылительного сопла 10 от контаминантов и механического влияния. На фиг. 2(a) и 2(b) представлен частично фрагментированный вид в перспективе, показывающий общую структуру назального распылительного сопла 10 по варианту осуществления настоящего изобретения. Как показано, назальное распылительное сопло 10 в целом содержит полый корпус 20 сопла, который имеет концевую часть 22 с отверстием 21 сопла и твердый упаковочный стержень 30, предусмотренный внутри корпуса 20 сопла. На фиг. 2(a) и 2(b) представлено назальное распылительное сопло 10 до и после расположения или установки упаковочного стержня 30 внутри корпуса 20 сопла, соответственно. Концевая часть 22 корпуса 20 сопла имеет круглую форму и в ее центре предусмотрено отверстие 21 сопла.
[0044] На фиг. 3(a) представлен вертикальный вид в поперечном разрезе назального распылительного сопла 10 с фиг. 2(b). На фиг. 3(b), 3(c) и 3(d) представлен горизонтальный вид в поперечном разрезе назального распылительного сопла 10, выполненный по линии B-B, линии C-C и линии D-D на фиг. 3(a), соответственно. Полый корпус 20 сопла определяет внутреннее пространство 24 по существу цилиндрической формы. Как показано на фиг. 3(c) и 3(d), внутреннее пространство 24 содержит часть 25 сопла малого диаметра ближе к отверстию 21 сопла полого корпуса 20 сопла, часть 26 сопла большого диаметра напротив отверстия 6 кончика корпуса 4 шприца и выступ 27 сопла, который разработан так, чтобы иметь диаметр, непрерывно или постепенно уменьшающийся от части 26 сопла большого диаметра в направлении части 25 сопла малого диаметра.
[0045] С другой стороны, твердый упаковочный стержень 30 для размещения внутри корпуса 20 сопла имеет внешнюю стенку 33, которая имеет конфигурацию, по существу комплементарную внутренней стенке 23 корпуса 20 сопла (внутреннее пространство 24). Как показано на фиг. 2(a), 3(c) и 3(d), часть 35 стержня малого диаметра и часть 36 стержня большого диаметра содержит выступ 37 стержня, который разработан так, чтобы иметь диаметр, непрерывно или постепенно уменьшающийся от части 36 стержня большого диаметра в направлении части 35 стержня малого диаметра.
[0046] Предпочтительно, как проиллюстрировано на фиг. 3(a), во внутренней стенке 23 корпуса 20 сопла предусмотрено выпячивание 23a, тогда как на внешней стенке 33 упаковочного стержня 30 предусмотрена выемка 33a для приема выпячивания 23a. Когда упаковочный стержень 30 полностью вставляют внутрь внутреннего пространства 24 корпуса 20 сопла, выпячивание 23a может плотно садиться в выемку 33a, чтобы обеспечивать соединение между упаковочным стержнем 30 и корпусом 20 сопла.
[0047] Также, как проиллюстрировано на фиг. 2(a)-2(b) и 3(a)-3(d), упаковочный стержень 30 содержит множество канавок 38 и 39, разнесенных по окружности друг от друга как на части 35 стержня малого диаметра, так и на части 36 стержня большого диаметра. Также упаковочный стержень 30 вставляют внутрь корпуса 20 сопла с тем, чтобы определять пропуск 40 между выступом 27 сопла и выступом 37 стержня (фиг. 3(a)). Таким образом, назальное распылительное сопло 10, собранное как проиллюстрировано на фиг. 2(b), имеет камеру 42 сопла, которую определяют канавки 38, 39 и пропуск 40, что делает возможным соединение по текучей среде для состава 2, доставляемого из отверстия 6 кончика корпуса 4 шприца через камеру 42 сопла в концевую часть 22 назального распылительного сопла 10.
[0048] Кроме того, как показано на фиг. 3(b), упаковочный стержень 30 содержит создающий вихревой поток элемент 44 напротив концевой части 22 назального распылительного сопла 10. Создающий вихревой поток элемент 44 выполнен с возможностью создавать вихревой поток состава 2, который доставляют из каждой из канавок 38 части 35 стержня малого диаметра перед впрыском из отверстия 21 сопла корпуса 20 сопла. Более конкретно, концевые части у части 35 стержня малого диаметра, которые определяют создающий вихревой поток элемент 44, формируют с тем, чтобы они шли со смещением относительно вертикальной центральной оси отверстия 21 сопла. Благодаря созданию вихревого потока состава 2 перед впрыском из отверстия 21 сопла, угол распыления состава 2 можно расширять для того, чтобы распылять его более однородным образом.
[0049] Как проиллюстрировано на фиг. 3(c)-3(d), предпочтительно конструировать канавки 38 части 35 стержня малого диаметра меньше, чем канавки 39 части 36 стержня большого диаметра, чтобы увеличивать давление состава 2 в создающем вихревой поток элементе 44 перед впрыском из отверстия 21 сопла. Также, благодаря диаметрам части 36 стержня большого диаметра и части 35 стержня малого диаметра, которые сконструированы для непрерывного или постепенного уменьшения от первой к последней, легче вставлять назальное распылительное сопло 10 глубоко в носовую полость и распылять состав в направлении нижней носовой раковины и даже более глубоких частей пациентов. Таким образом предпочтительно, диаметр части 35 стержня малого диаметра достаточно меньше, чем отверстие носовой полости пациента без минимизации страха пациента.
Примеры
[0050] В соответствии со способами, представленными далее, получали гелиевый материал основания и стоковые растворы вирусов трех типов, и гелиевый материал основания и каждый стоковый раствор вируса смешивали, как показано далее, чтобы получать композиции вакцин против гриппа в качестве примеров. Каждую вязкость измеряли при 20°C с использованием вискозиметра типа E.
[0051]
<Получение гелиевого материала основания>
Пример гелиевого материала основания (1)
pH: 7,15
Вязкость: 4,000 мПа×с
[0052]
<Получение стокового раствора вируса, содержащего инактивированный цельный вирион гриппа>
Пример стокового раствора вируса (1)
[0053]
Пример стокового раствора вируса (2)
[0054]
Пример стокового раствора вируса (3)
[0055]
<Смесь гелиевого материала основания и стокового раствора вируса>
Пример гелиевого материала основания (1) и каждый из примеров стокового раствора вируса (1)-(3), указанных выше, смешивали в соотношении 1:1 при встряхивании, чтобы получать каждую гомогенную композицию вакцины против гриппа, примеры 1, 2 и 3, соответственно. Далее приведены композиция каждого примера и их физические свойства/эффективность распыления, полученные с использованием распылительного устройства или струйного шприца. Смешивание при встряхивании можно выполнять мягко и за короткое время без напряжений в инактивированном цельном антигене вируса. Количества каждого ингредиента в получаемых композициях вакцин против гриппа, их физические свойства и их эффективности распыления, полученные посредством распыления композиций с использованием подходящего устройства также приведены далее.
Пример 1
Вязкость: 500 мПа×с
Эффективность распыления при распылении 250 мкл раствора с использованием распылительного устройства:
- средний размер частицы распыляемого состава: 52,7 мкм
- соотношение размеров частиц между 10 мкм и 100 мкм: 91,5%
- угол распыления из устройства: 53°
- плотность распыления: равномерный круг с полным конусом
[0056]
Пример 2
Вязкость: 430 мПа×с
Осмотическое давление: 293 мОсм
Эффективность распыления при распылении 250 мкл раствора с использованием распылительного устройства:
- средний размер частицы распыляемого состава: 55,2 мкм
- соотношение размеров частиц между 10 мкм и 100 мкм: 95,0%
- угол распыления из устройства: 51°
- плотность распыления: равномерный круг с полным конусом
[0057]
Пример 3
Вязкость: 520 мПа×с
Осмотическое давление: 295 мОсм
Эффективность распыления при распылении 250 мкл раствора с использованием распылительного устройства:
- средний размер частицы распыляемого состава: 57,4 мкм
- соотношение размеров частиц между 10 мкм и 100 мкм: 95,0%
- угол распыления из устройства: 52°
- плотность распыления: равномерный круг с полным конусом
Эффективность распыления при распылении 250 мкл раствора с использованием струйного шприца
- средний размер частицы распыляемого состава: 56,5 мкм
- соотношение размеров частиц между 10 мкм и 100 мкм: 88,2%
- угол распыления из устройства: 51,48°
-плотность распыления: равномерный круг с полным конусом
[0058]
Пример 4
Вязкость: 525 мПа×с
Осмотическое давление: 291 мОсм
Эффективность распыления при распылении 250 мкл раствора с использованием струйного шприца:
- средний размер частицы распыляемого состава: 59,6 мкм (см. фиг. 5)
- соотношение размеров частиц между 10 мкм и 100 мкм: 85,6% (см. фиг. 5)
- угол распыления из устройства: 52,27° (см. фиг. 6)
- плотность распыления: равномерный круг с полным конусом (см. фиг. 7)
[0059] В качестве композиции вакцины против гриппа без использования гелиевого материала основания получали сравнительные примеры 1-4 в соответствии с композициями, представленными в следующих таблицах, при необязательном использовании инактивированного цельного антигена, который использовали в приведенных выше примерах.
Сравнительный пример 1
[0060]
Сравнительный пример 2
[0061]
Сравнительный пример 3
[0062]
Сравнительный пример 4
[0063]
Тест для оценки иммунного ответа (1)
Каждой композицией вакцины против гриппа, полученной в примере 1 и сравнительном примере 1, две группы, состоящие из 4 взрослых добровольцев каждая, вакцинировали с помощью назального распылительного введения с использованием подходящего одноразового устройства, в количестве 0,25 мл на одну ноздрю (эквивалентно 45 мкг ГА для обеих ноздрей), два раза с интервалом в 3 недели.
Последовательно собирали кровь и смывы из носовой полости и в них измеряли титр нейтрализующих антител к вакцинному штамму и проводили анализ. Результаты представлены в таблице 1 для примера 1 и в таблице 2 для сравнительного примера 1.
Таблица 1
Таблица 2
Сравнивая результаты вакцины из примера 1 (стоковый раствор вируса+гелиевый материал основания) и вакцины из сравнительного примера 1 (композиция, которая содержит инактивированный расщепленный антиген вируса гриппа без гелиевого материала основания), титр нейтрализующих антител в сыворотке у 3/4 субъектов, вакцинированных вакциной из сравнительного примера 1, не возрастает, тогда как титр нейтрализующих антител в сыворотке у 4/4 субъектов, вакцинированных вакциной из примера 1 возрастает, и значительно возрастает. Титр нейтрализующих антител в смывах из носовой полости увеличен во всех случаях использования обеих вакцин из примера 1 и сравнительного примера 1, но вакцина из примера 1 демонстрировала более значительное увеличение.
[0064]
Тест для оценки иммунного ответа (2)
Используя каждую композицию вакцины против гриппа, полученную в примере 2 и сравнительном примере 2, две группы, состоящие из 25 взрослых добровольцев для примера 2 и 24 взрослых добровольцев для сравнительного примера 2, вакцинировали посредством назального распылительного введения с использованием подходящего одноразового устройства, в количестве 0,25 мл для одной ноздри (эквивалентно 45 мкг ГА для обеих ноздрей), два раза с интервалом в 3 недели, и еще один раз приблизительно через полгода, всего три раза.
Кровь и смывы из носовой полости собирали через 3 недели после третьей вакцинации и в них измеряли и анализировали титр нейтрализующих антител к вакцинному штамму. Результаты представлены в таблице 3.
Таблица 3
При сравнении результатов вакцины из примера 2 (стоковый раствор вируса+гелиевый материал основания) и вакцины из сравнительного примера 2 (только стоковый раствор вируса) показано, чем вакцина из примера 2, содержащая гелиевый материал основания, увеличивала иммунный ответ в большей степени, чем та, что из сравнительного примера 2.
Известно, что человек в нативном состоянии, который никогда не контактировал с антигеном вируса гриппа (например, младенцы и дети), развивает меньший иммунный ответ. Полагают, что иммунный ответ у таких восприимчивых индивидуумов на вакцину против гриппа можно оценивать посредством оценки иммунного ответа у здоровых взрослых на вакцину высоко патогенного вируса птичьего гриппа (штамм H5N1), поскольку почти все здоровые взрослые никогда не контактировали с вирусом птичьего гриппа (т. е., в наивном состоянии).
Как показано в приведенных выше результатах, обнаружено, что даже для восприимчивых индивидуумов титр нейтрализующих антител в сыворотке и смывах из носовой полости можно индуцировать на высоком уровне с помощью назальной вакцинации вакциной из примера 2 (стоковый раствор вируса+гелиевый материал основания) три раза.
[0065]
Аналитический тест иммунного ответа (3)
Используя каждую композицию вакцины против гриппа, полученную в примере 3, сравнительном примере 3 и сравнительном примере 4, две группы, состоящие из 47 взрослых добровольцев для примера 3 и 47 взрослых добровольцев для сравнительного примера 3, вакцинировали посредством назального введения струйным шприцом, в количестве 0,25 мл для одной ноздри (всего 15 мкг ГА/штамм/0,5 мл для обеих ноздрей), два раза с интервалом в 3 недели. И, используя композицию вакцины против гриппа, полученную в сравнительном примере 4 (вакцина, используемая в настоящее время), группу, состоящую из 38 взрослых добровольцев, подкожно вакцинировали один раз количестве 0,5 мл (15 мкг ГА/штамм/0,5 мл).
Кровь и смывы из носовой полости собирали через 3 недели после последней вакцинации (2-я или 1-я), и в них измеряли и анализировали титр нейтрализующих антител к вакцинному штамму. В таблицах 4 и 5 представлены все результаты о различных типах вакцины против гриппа.
Таблица 4
Таблица 5
При сравнении результатов назально вводимой вакцины из примера 3 (стоковый раствор вируса+гелиевый материал основания), назально вводимой вакцины из сравнительного примера 3 (только стоковый раствор вируса) и подкожно вводимой вакцины из сравнительного примера 4 (используемая в настоящее время вакцина для подкожного введения) показано, что назально вводимая вакцина из примера 3 по сравнению с гелиевым материалом основания увеличивала иммунный ответ более значительно, чем назально вводимая вакцина из сравнительного примера 3. Кроме того, по результатам для смывов из носовой полости, группа назально вводимой вакцины из примера 3 демонстрировала выявление нейтрализующих антител на слизистой носа, но группа подкожно вводимой вакцины (вакцины, используемой в настоящее время) из сравнительного примера 4 не демонстрировала выявление.
[0066] Таким образом, заполняя медицинский шприц, имеющий отверстие кончика в соединении по текучей среде с цилиндром шприца, который оборудован назальным распылительным соплом, содержащим полый корпус сопла, имеющий концевую часть, которая определяет отверстие сопла в нем, твердый упаковочный стержень, расположенный внутри корпуса сопла, и камеру сопла, которая определена между упаковочным стержнем и корпусом сопла, чтобы сделать возможным соединение по текучей среде между отверстием кончика и отверстием сопла, где отверстие сопла имеет диаметр в диапазоне между 0,25 мм и 0,30 мм
составом для назального введения вакцины против гриппа из примера 4, которую получали с использованием гелиевого материала основания, полученного посредством приложения внешнего усилия сдвига,
получали риновакцинационную систему для вакцины против гриппа, которая обладает эффективностью распыления для того, чтобы управлять (1) распределением размеров частиц распыляемой композиции, средний размер частицы находится в диапазоне от 30 мкм до 80 мкм [59,6 мкм], и распределение частиц между 10 мкм и 100 мкм составляет 80% или больше [85,6%], (2) однородной плотностью распыления для того, чтобы создавать гомогенную форму полного конуса, и (3) углом распыления, который корректируют в диапазоне от 30° до 70° [52,27°].
Обозначение номеров позиций
[0067]
1: медицинский шприц, 2: фармацевтический состав, 3: цилиндр шприца, 4: корпус шприца, 5: шток поршня, 5a: фиксирующий элемент, 6: отверстие, 7: поршень, 8: фланец для пальцев, 9: концевой элемент поршня, 10: назальное распылительное сопло, 20: корпус сопла, 21: отверстие сопла, 22: концевая часть, 23: внутренняя стенка, 23a: выпячивание, 24: внутреннее пространство, 25: часть сопла малого диаметра, 26: часть сопла большого диаметра, 27: выступ сопла, 30: упаковочный стержень, 33: внешняя стенка, 33a: выемка, 35: часть стержня малого диаметра, 36: часть стержня большого диаметра, 37: выступ стержня, 38, 39: канавка, 40: пропуск, 42: камера сопла, 44: создающий вихревой поток элемент, 46: изогнутая часть, 50: защитный колпачок.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ НАЗАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ГРИППА | 2013 |
|
RU2652296C2 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |
| СИСТЕМА ДЛЯ ТРАНСНАЗАЛЬНОГО ВВЕДЕНИЯ ВАКЦИНЫ ПРОТИВ ГЕПАТИТА B | 2019 |
|
RU2795235C2 |
| НАЗАЛЬНАЯ ВАКЦИННАЯ КОМПОЗИЦИЯ ПРОТИВ ГЕПАТИТА B И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2018 |
|
RU2773357C2 |
| ТЕРМОСТАБИЛЬНЫЕ ПРЕПАРАТЫ ВАКЦИН И МИКРОИГЛЫ | 2014 |
|
RU2720808C2 |
| ВАКЦИНА ПРОТИВ ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2446824C2 |
| ВАКЦИНЫ И СПОСОБЫ ЛЕЧЕНИЯ СОБАЧЬЕГО ГРИППА | 2006 |
|
RU2396976C2 |
| ВАКЦИНА ГРИППОЗНАЯ ИНАКТИВИРОВАННАЯ РАСЩЕПЛЕННАЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2584594C1 |
| ВАКЦИНА ПРОТИВ ВИРУСА ГРИППА ДЛЯ ВВЕДЕНИЯ ЧЕРЕЗ СЛИЗИСТУЮ И СПОСОБ ПРЕДОТВРАЩЕНИЯ ГРИППА | 2004 |
|
RU2390351C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ Bordetella bronchiseptica | 2012 |
|
RU2554480C2 |






Настоящее изобретение относится к медицине, а именно к иммунологии, в частности к риновакцинационной системе для вакцины против гриппа. Риновакцинационная система для вакцины против гриппа содержит струйный шприц, который заполнен композицией вакцины против гриппа, которая содержит (i) инактивированный цельный вирион гриппа и (ii) гелиевый материал основания, содержащий карбоксивиниловый полимер, который обработан посредством приложения внешнего усилия сдвига для увеличения эффективности распыления. Вакцина свободна от адъюванта. Струйный шприц представляет собой медицинский шприц, у которого отверстие кончика сообщается по текучей среде с цилиндром шприца, который имеет назальное распылительное сопло, которое содержит полый корпус сопла, который имеет концевую часть, которая образует в нем отверстие сопла, твердый упаковочный стержень, расположенный внутри корпуса сопла, и камеру сопла, образованную между упаковочным стержнем и корпусом сопла для обеспечения сообщения по текучей среде между отверстием кончика и отверстием сопла, при этом отверстие сопла имеет диаметр в диапазоне от 0,25 мм до 0,30 мм. Использование данного изобретения позволяет получить риновакцинационную систему для вакцины против гриппа, содержащую струйный шприц, что обеспечивает эффективное введение вакцины против гриппа на слизистую носа. 11 з.п. ф-лы, 7 ил., 5 табл., 4 пр.
1. Риновакцинационная система для вакцины против гриппа, содержащая струйный шприц, который заполнен композицией вакцины против гриппа, которая содержит (i) инактивированный цельный вирион гриппа и (ii) гелиевый материал основания, содержащий карбоксивиниловый полимер, который обработан посредством приложения внешнего усилия сдвига для увеличения эффективности распыления, которая отличается тем, что свободна от адъюванта, в которой струйный шприц представляет собой медицинский шприц, у которого отверстие кончика сообщается по текучей среде с цилиндром шприца, который имеет назальное распылительное сопло, которое содержит
полый корпус сопла, который имеет концевую часть, которая образует в нем отверстие сопла, твердый упаковочный стержень, расположенный внутри корпуса сопла, и камеру сопла, образованную между упаковочным стержнем и корпусом сопла для обеспечения сообщения по текучей среде между отверстием кончика и отверстием сопла, при этом отверстие сопла имеет диаметр в диапазоне от 0,25 мм до 0,30 мм.
2. Риновакцинационная система по п. 1, в которой количество (i) инактивированного цельного вириона гриппа составляет 1-500 мкг ГА/мл на один тип штамма вируса вакцины.
3. Риновакцинационная система по п. 1, в которой композиция вакцины против гриппа содержит от 0,1% масс./об. до 1,0% масс./об. карбоксивинилового полимера.
4. Риновакцинационная система по п. 1, в которой осуществление распыления управляет (1) распределением размеров частиц распыляемой композиции, (2) однородностью плотности распыления и/или (3) углом распыления.
5. Риновакцинационная система по п. 1, в которой композиция вакцины против гриппа получена путем обработки гелиевого материала основания, содержащего от 0,5% масс./об. до 2,0% масс./об. карбоксивинилового полимера, посредством приложения внешнего усилия сдвига для того, чтобы управлять (1) распределением размеров частиц распыляемой композиции, (2) однородностью плотности распыления и/или (3) углом распыления, в качестве эффективности распыления, чтобы получать гелиевый материал основания, и затем
смешивания получаемого гелиевого материала основания гомогенно за короткое время без напряжений со стоковым раствором вируса, содержащим инактивированный цельный вирион гриппа.
6. Риновакцинационная система по п. 1, в которой композиция вакцины против гриппа получена с использованием гелиевого материала основания, содержащего карбоксивиниловый полимер, который обработан посредством приложения внешнего усилия сдвига для того, чтобы улучшить осуществление распыления, которое управляет
(1) распределением размеров частиц распыляемой композиции, средний размер частицы находится в диапазоне от 30 мкм до 80 мкм и распределение частиц между 10 мкм и 100 мкм составляет 80% или больше,
(2) однородной плотностью распыления, чтобы создавать гомогенную форму полного конуса, и
(3) углом распыления, который регулируется в диапазоне от 30 до 70°.
7. Риновакцинационная система по п. 1, в которой композиция вакцины против гриппа получена с использованием гелиевого материала основания, содержащего карбоксивиниловый полимер, который обработан путем приложения внешнего усилия сдвига для того, чтобы улучшить осуществление распыления, которое управляет
(1) распределением размеров частиц распыляемой композиции, средний размер частицы находится в диапазоне от 40 мкм до 70 мкм и распределение частиц между 10 мкм и 100 мкм составляет 90% или больше,
(2) однородной плотностью распыления, чтобы создавать гомогенную форму полного конуса, и
(3) углом распыления, который корректируют в диапазоне от 40 до 60°.
8. Риновакцинационная система по п. 1, в которой отверстие сопла выполнено по существу без изогнутой части.
9. Риновакцинационная система по п. 1, в которой концевая часть, которая образует отверстие сопла, имеет толщину вдоль направления инъекции состава, которая находится в диапазоне между 0,20 мм и 0,30 мм.
10. Риновакцинационная система по п. 1, в которой корпус сопла содержит внутреннюю стенку, имеющую, по меньшей мере, часть, выполненную в цилиндрической форме, и упаковочный стержень содержит внешнюю стенку, по меньшей мере, часть которой выполнена в цилиндрической форме со множеством канавок, отстоящих в окружном направлении,
причем камера сопла образована между, по меньшей мере, частью внутренней стенки корпуса сопла и, по меньшей мере, частью внешней стенки упаковочного стержня, и
упаковочный стержень содержит создающий вихревой поток элемент, противолежащий концевой части корпуса сопла.
11. Риновакцинационная система по п. 10, в которой создающий вихревой поток элемент выполнен таким образом, что направление потока состава из канавок упаковочного стержня смещено к центральной оси, чтобы тем самым создавать вихревой поток состава.
12. Риновакцинационная система по п. 10 или 11, в которой, по меньшей мере, часть внутренней стенки корпуса сопла имеет сечение, по существу перпендикулярное направлению инъекции, которое непрерывно или ступенчато уменьшается в направлении инъекции.
| ПРИГОДНЫЙ К РАСПЫЛЕНИЮ АДГЕЗИВНЫЙ К КОЖЕ/СЛИЗИСТОЙ ОБОЛОЧКЕ ПРЕПАРАТ ГЕЛЕВОГО ТИПА И СИСТЕМА ДЛЯ ВВЕДЕНИЯ С ИСПОЛЬЗОВАНИЕМ ПРЕПАРАТА | 2007 |
|
RU2438710C2 |
| OKA T | |||
| et al | |||
| Influenza vaccine: enhancement of immune response by application of carboxy-vinylpolymer // Vaccine | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| US 5215739 A1, 01.06.1993 | |||
| 1972 |
|
SU412524A1 | |
| ШТАМП ДЛЯ МНОГОШТУЧНОЙ ШТАМПОВКИ | 1991 |
|
RU2011467C1 |
Авторы
Даты
2019-08-02—Публикация
2015-06-24—Подача