Изобретение относится к медицине, биотехнологии, фармакологии и может быть использовано для оценки цитотоксичности новых синтезированных веществ, в частности аптамеров.
Изучение цитотоксичности веществ по отношению к нормальным клеткам играет важнейшую роль в изучении токсичности потенциальных противоопухолевых препаратов. Для дальнейших доклинических исследований важно определить соотношение цитотоксичности изучаемых соединений на опухолевых клетках к цитотоксичности на нормальных клетках. В настоящее время разрабатываются новые противоопухолевые препараты аптамерной природы, и способы оценки их цитотоксичности востребованы в практике.
Для выявления и определения цитотоксического эффекта воздействия вещества на клетку широко используются морфологические способы, например, «Способ микроскопической оценки цитотоксичности компонентов материалов скаффолдов» (1). Для этого из крови выделяют эритроциты, промывают их и инкубируют с компонентами материалов скаффолдов при 37°С в течение 30 мин. Затем эритроциты смешивают с аутологичной плазмой крови, помещают каплю на предметное стекло и проводят микрофотосъемку с объективом 100х. Цитотоксичность компонентов скаффолдов оценивают по изменению морфологии эритроцитов и их агрегатов в аутологичной плазме крови.
Известен способ определения цитотоксичности веществ путем обработки по крайней мере одной клетки веществом с последующим определением токсичности вещества по изменению уровня внутриклеточных АФК (2). В данном способе изменение внутриклеточного уровня АФК определяют по свечению флуоресцентного красителя DCFH-DA, способного проникать внутрь клеток, а также излучать свет при связывании с АФК. По изменению интенсивности свечения судят о токсичности тестируемого вещества.
Недостатками известного способа является его относительно низкая чувствительность, что осложняет выявление ранних признаков токсичности, и сложность данного способа, обусловленная использованием дополнительных реагентов, а также отсутствие возможности проведения количественной оценки уровня АФК.
Широко применяется способ, получивший название МТТ-тест. Метод МТТ-теста основан на способности бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид, МТТ)
восстанавливаться до окрашенного формазана в присутствии митохондриальных ферментов живых клеток (3).
Выполнение МТТ-теста
Тестируемые вещества растворить в ДМСО в концентрации 10-2 М. После 24 часов инкубации к культуре клеток НЕК293 добавить методом раститровки различные концентрации тестируемых соединений. Каждую концентрацию выполнить в трех повторностях. В контрольные лунки добавить растворитель ДМСО в концентрации не более 1%. Конечный объем среды в лунке должен составлять 200 мкл. Планшет с внесенными соединениями поместить в CO2-инкубатор.
После 72 часов инкубации клеточной линии НЕК293 с опытными веществами внести в каждую лунку по 20 мкл рабочего раствора МТТ(5 мг/мл). Инкубировать еще 2 часа в условиях CO2-инкубатора. Через 2 часа достать планшет из CO2-инкубатора, заменить в каждой лунке среду на раствор ДМСО. Аккуратно встряхнуть планшет до растворения кристаллов формазана. С помощью планшетного ридера (например, Victor, PerkinElmer) определить оптическую плотность каждой лунки при 530 нм, вычесть измеренное фоновое поглощение при 620 нм. Значение концентрации, вызывающее 50% ингибирование роста популяции клеток (IC50), определить на основе дозозависимых кривых и/или с помощью программного обеспечения (например, OriginPro 9.0). Обработка результатов измерений осуществляется с помощью программного обеспечения WorkOut 2.5 (DazDag Ltd), установленной на рабочей станции планшетного ридера Victor3.
Выживаемость клеток НЕК293 в присутствии исследуемого вещества рассчитывается по формуле: (ОП опытных лунок - ОП среды) / (ОП контр. лунок - ОП среды) × 100%, где ОП - оптическая плотность (4).
Этот способ выбран нами в качестве прототипа. Способ достаточно надежен и воспроизводим. К недостаткам способа можно отнести ограниченную информативность, поскольку он оценивает состояние митохондриальных дегидрогеназ. Кроме того, недостатками данного способа являются его длительность и сложность, обусловленные использованием дополнительных реагентов, а также то, что данный способ позволяет определять только высокую степень токсичности, приводящую к потерям живых клеток. Указанные недостатки обусловлены особенностями способа. При исследовании противоопухолевых веществ, в частности, аптамеров, важно оценить цитотоксичность, выраженную в угнетении пролиферации клеток и активации апоптоза.
Задачей, на решение которой направлено настоящее изобретение, является повышение информативности способа. Это осуществляется сравнением процессов пролиферации и апоптоза путем измерения экспрессии генов BCL2 и PCNA в клетках, подвергшихся воздействию испытуемого образца аптамера.
Предлагаемый способ решения данной задачи заключается в следующем. Культуру клеток инкубируют с испытуемым веществом. Затем из клеток выделяют и очищают общую РНК. Проводят синтез 1-й цепи кДНК посредством обратной транскриптазы. Количественно определяют уровень транскрипта генов BCL2 и PCNA. Ген PCNA является маркером пролиферации, а ген BCL2 принимает участие в апоптозе. При воздействии на клетку токсического агента наблюдается подавление пролиферации и стимуляция апоптоза. В реакции ПЦР в реальном времени определяют уровень экспрессии генов. По соотношению экспрессии генов BCL2 и PCNA судят о цитотоксичности испытуемого вещества.
Для проверки адекватности выбора маркеров мы поставили опыт с аптамером RG-17, цитотоксичность которого была выявлена в тесте МТТ. Мы инкубировали вещество в 4-хкратной терапевтической дозе с культурой фибробластов человека. Количество чашек - 5. Еще 5 чашек были контрольными, в них вместо препарата к среде добавляли растворитель. Время инкубации составляло 72 часа. В образцах культуры фибробластов определяли уровень экспрессии генов BCL2 и PCNA. Результаты представлены в таблице:
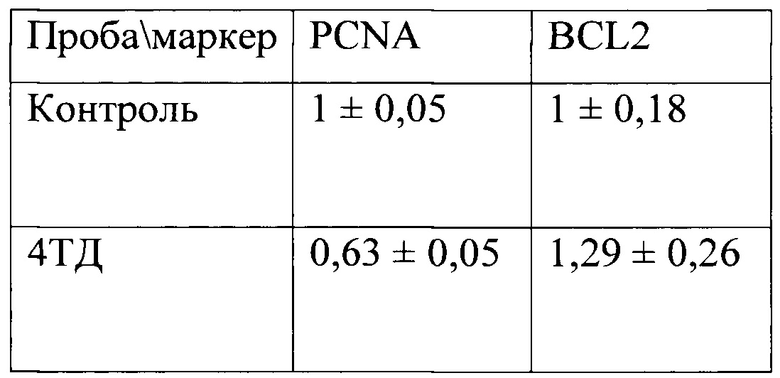
Значение экспрессии маркера пролиферации PCNA достоверно (р<0,01 по критерию Манна-Уитни) снижено в образцах клеток, инкубированных с испытуемым веществом, по сравнению с контрольной группой клеток. Значение экспрессии гена BCL2 имеет тенденцию к росту в опытной группе по сравнению с контролем. Чем больше соотношение экспрессии генов BCL2 и PCNA будет превышать 1, то есть, чем сильнее процесс апоптоза клеток будет превалировать над процессом пролиферации, тем более выражен цитотоксический эффект испытуемого вещества.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1
Аптамер пролонгированного действия RA-361 в концентрации 400 мкг/мл был добавлен к среде инкубации культуры фибробластов человека. Испытания проводились в 5-ти параллельных пробах - чашках Петри, контрольные чашки содержали вместо испытуемого вещества растворитель. Через трое суток инкубации клетки снимали с чашек, дважды отмывали в буфере PBS и суспендировали в 150 мкл этого буфера.
Выделение РНК. В микропробирке «Эппендорф» лизировали клетки 1 мл «TPI reagent» MRC 10 мин, перемешивая на роторном смесителе. Добавляли 200 мкл хлороформа и встряхивали на шейкере 15 сек. В течение 10 мин пробирку оставляли при комнатной температуре, а затем центрифугировали 15 мин при 4°С и 12000 об/мин. Супернатант в объеме 600 мкл смешивали с 700 мкл изопропанола. Пробирку оставляли на столе, а через 10 мин РНК осаждали центрифугированием в течение 10 мин при 12000 об/мин и 4°С.Осадок РНК промывали 1 мл 75% этанола, затем центрифугировали при тех же условиях, высушивали на вакуумном центробежном концентраторе и растворяли в 50 мкл ДЭПК воды с добавлением 1 мкл ингибитора рнк-аз RiboLock Thermo Scientific. Определяли концентрацию РНК на спектрофотометре Biowave II, после чего обрабатывали ДНК-зой DNase I Thermo Scientific согласно прилагаемому протоколу. Повторяли процедуры осаждения изопропанолом, промывания 75% этанолом, высушивания осадка РНК и растворения в ДЭПК воде с добавлением RiboLock. Измеряли концентрацию РНК и оценивали степень ее деградации, проводя электрофорез в 1% агарозном геле.
Реакция обратной транскрипции
Реакцию обратной транскрипции для получения кДНК проводили в объеме 25 мкл. Использовали готовые наборы реагентов «ОТ-1» для обратной транскрипции компании СИНТОЛ. Реакция обратной транскрипции содержала: 2 мкг выделенной РНК, 1 мкл Random-6 праймера, 10 мкл 2,5х Реакционной смеси, 1 мкл (50 ед) обратной транскриптазы MMLV-RT и 0,5 мкл RiboLock. Реакцию проводили в течение 40 мин при 42°С, после чего реакционную смесь инкубировали 4 мин при 92°С для инактивации обратной транскриптазы. Полученную реакционную смесь, содержащую кДНК, сразу использовали в качестве матрицы для проведения ПЦР.
ПЦР в реальном времени
Измерение уровней экспрессии генов BCL2 и PCNA проводили методом ПЦР в реальном времени готовыми наборами реактивов «Набор реагентов для проведения ПЦР-РВ в присутствии красителя SYBR Green I R-402» компании СИНТОЛ на амплификаторе CFX96 (Bio-Rad Laboratories, США). Реакцию проводили в объеме 25 мкл согласно протоколу набора, смесь прямого и обратного праймеров в концентрации 1,5 мкМ каждого добавляли в объеме 5 мкл. Ставили каждую реакцию в трех параллельных пробах.
Протокол реакции ПЦР: предварительный прогрев при 95°С - 5 мин, 40 основных циклов: денатурация при 95°С - 10 сек, отжиг и элонгация: 60°С - 30 сек. Расчет нормализованной экспрессии проводили, используя референсные гены GUSB, HPRT и GAPDH, контролным образцом служила кДНК интактных фибробластов человека. Праймеры, используемые в работе: 

Соотношение экспрессии генов BCL2 и PCNA составило 2, следовательно, мы наблюдали выраженный цитотоксический эффект испытуемого образца аптамера.
Пример 2
Заявленным способом определяли цитотоксичность аптамера RA-36. Концентрация составляла 100 мг/мл. Соотношение экспрессии генов BCL2 и PCNA составило 0,8. Следовательно, в этой дозе аптамер не обладает цитотоксическими свойствами.
Таким образом из приведенных примеров видно, что предлагаемый способ действительно существенно повышает информативность по сравнению с известными способами, кроме того реализуется проще известного способа, выбранного в качестве прототипа, и имеет более высокую чувствительность. Список использованной литературы
1. Патент РФ №2653476
2. Igor Pujalty, Isabelle Passagne, Brigitte Brouillaud, Mona Treguer, Etienne Durand, Celine Ohayon-Courtes, Beatrice L'Azou 1, Cytotoxicity and oxidative stress induced by different metallic nanoparticles on human kidney cells» // Particle and Fibre Toxicology 2011, 8:10, http://www.particleandfibretoxicology.eom/content/8/l/10
3. Berridge M. V., Herst P. M., Tan A. S. Tetrazolium dyes as tools in cell biology: new insights into their cellular reduction //Biotechnology annual review.-2005.-T. 11.-C. 127-152.
4. «Методика определения цитотоксичности веществ МТТ-тестом на культуре нормальных клеток человека НЕК293», СТП-14.621.21.0008.12-2015, Институт физиологически активных веществ Российской академии наук.
| название | год | авторы | номер документа |
|---|---|---|---|
| КЛЕТОЧНАЯ КУЛЬТУРА КОНЪЮНКТИВЫ ЧЕЛОВЕКА Chang conjunctiva АТСС - CCL 20.2 ДЛЯ ПРЕДУПРЕЖДЕНИЯ ФЕНОМЕНА УСИЛЕНИЯ ТОКСИЧНОСТИ ГЛАЗНЫХ ИНСТИЛЛЯЦИЙ ПРИ СОВМЕСТНОМ ПРИМЕНЕНИИ КОМБИНАЦИИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2017 |
|
RU2646100C1 |
| ОЛИГОПЕПТИДНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2549675C2 |
| МОНОМОЛЕКУЛЯРНЫЙ ХИМЕРНЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР К РАКОВОМУ АНТИГЕНУ СА125 | 2018 |
|
RU2747095C2 |
| СПОСОБ ОЦЕНКИ ЦИТОТОКСИЧНОСТИ РИБОСОМ-ИНАКТИВИРУЮЩИХ БЕЛКОВ II ТИПА IN VITRO | 2015 |
|
RU2580225C1 |
| Способ определения специфической активности препарата цетуксимаб биологическим методом на культуре клеток | 2023 |
|
RU2803730C1 |
| Способ терапии глиомы человека за счет снижения пролиферации и индукции дифференцировки опухолевых клеток глиомы человека | 2022 |
|
RU2820200C2 |
| ФРАГМЕНТЫ ДВУЦЕПОЧЕЧНОЙ РНК, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНОЙ И ИНТЕРФЕРОН-ИНДУЦИРУЮЩЕЙ АКТИВНОСТЯМИ | 2008 |
|
RU2391405C1 |
| ПЕПТИД, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2658781C1 |
| ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО К РАКОВО-ЭМБРИОНАЛЬНОМУ АНТИГЕНУ, ХИМЕРНЫЙ МОНОМОЛЕКУЛЯРНЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР, ВЕКТОР И КЛЕТКА-ХОЗЯИН ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ ТАКОГО РЕЦЕПТОРА И СПОСОБ ДИАГНОСТИКИ ИЛИ ЛЕЧЕНИЯ. | 2012 |
|
RU2522004C2 |
| МОНОМОЛЕКУЛЯРНЫЙ ХИМЕРНЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР К РАКОВО-ЭМБРИОНАЛЬНОМУ АНТИГЕНУ | 2015 |
|
RU2650858C2 |
Изобретение относится к биотехнологии и может быть использовано в фармакологии и медицине для оценки цитотоксичности новых синтезированных веществ, в частности аптамеров противоопухолевого действия. Сравнивают процессы пролиферации и апоптоза в клетках после инкубации с образцом аптамера. Для этого измеряют соотношение экспрессий генов BCL2 и PCNA. По степени превышения значения больше 1 судят о цитотоксичности аптамера. 2 табл., 2 пр.
Способ оценки цитотоксичности аптамера, включающий инкубацию аптамера с культурой клеток, отличающийся тем, что проводят измерение экспрессии генов BCL2 и PCNA, а о цитотоксичности судят по соотношению уровней экспрессии генов, чем больше соотношение экспрессии генов BCL2 и PCNA будет превышать 1, тем более выражен цитотоксический эффект испытуемого вещества.
| WO 2018045258 A1, 08.03.2018 | |||
| US 20180051317 A1, 22.02.2018 | |||
| СПОСОБ МИКРОСКОПИЧЕСКОЙ ОЦЕНКИ ЦИТОТОКСИЧНОСТИ КОМПОНЕНТОВ МАТЕРИАЛОВ СКАФФОЛДОВ | 2017 |
|
RU2653476C1 |
Авторы
Даты
2019-08-06—Публикация
2018-07-05—Подача