Изобретение относится к области пассивной иммунотерапии онкологических заболеваний, в частности к методу адоптивного переноса клеток, в котором используют генетически модифицированные аутологичные или аллогенные цитотоксические Т-лимфоциты, обладающие приобретенной иммуногенностью против клеток опухоли. Модификация Т-лимфоцитов происходит по средствам генетических конструкций, кодирующих химерные антигенные рецепторы к антигену СА125. Изобретение может быть использовано в Т-клеточной терапии рака.
Использование иммунотерапии в онкологии основывается на известных механизмах противоопухолевого иммунитета и является альтернативой химиотерапии при лечении онкологических заболеваний. Наиболее распространенным иммунотерапевтическим подходом к лечению онкологических заболеваний является направленная иммунотерапия с использованием моноклональных антител (мАт).
Принципиально иная иммунотерапевтическая стратегия, состоящая в получении генетически модифицированных опухоль-специфичных Т-клеток, была реализована J. Brentjens с сотрудниками (Chekmasova et al., 2010; Koneru et al., 2015b). Им удалось получить трансфецированные Т-лимфоциты, которые, с одной стороны, обладают цитотоксической противоопухолевой активностью, а с другой стороны, с высокой селективностью узнают MUC16-позитивные опухолевые клетки. Узнавание и запуск цитотоксической активности обеспечиваются экспрессией на поверхности Т-клеток искусственного химерного антигенного рецептора (CAR, chimeric antigen receptor). Первоначально были получены Т-лимфоциты с химерным антигенным рецептором 4Н11-28z, мишенью которого является участок С-концевого домена MUC16, остающийся на поверхности клетки после протеолитического отщепления эктодомена MUC16 (Chekmasova et al., 2010). 4H11-28z является рецептором второго поколения и состоит из антиген-распознающей части, представленной одноцепочечными вариабельными фрагментами иммуноглобулинов scFv (single-chain Fv), цитоплазматического сигнального домена рецептора CD28 (необходим для передачи ко-стимулирующего сигнала), а также ζ-цепи рецептора CD3 (обеспечивает передачу сигнала внутрь клетки). Т-клетки, несущие химерный рецептор 4H11-28z, эффективно лизировали как первичные, так и перевиваемые клетки рака яичников человека (линии OVCAR3 и SKOV3). Кроме того, было показано, что такие Т-клетки обладают противоопухолевой активностью in vivo (Chekmasova et al., 2010). Важно отметить, что поскольку CAR взаимодействует с клеткой-мишенью независимо от главного комплекса гистосовместимости, то один и тот же химерный рецептор может быть использован для разных пациентов независимо от их варианта гена HLA и уровня его экспрессии.
Впервые MUC16 был детектирован Робертом Бастом с коллегами (Bast et al., 1981). Используя моноклональное антитело ОС125, ранее полученное к сыворотке больных раком яичника, они обнаружили при иммуногистохимическом анализе образцов опухоли, что это антитело связывает опухоль-ассоциированный антиген, экспрессирующийся в 80% случаев эпителиального рака яичников. Позже данный антиген получил наименование СА125 (cancer antigen 125). Иммунногистохимическое исследование также выявило, что клетки, экспрессирующие антиген СА125, происходят из клеток эмбрионального Мюллерова протока и целомического эпителия (Kabawat et al., 1983). Только в 2001 году ген, кодирующий антиген СА125, был полностью клонирован и идентифицирован, а белок, который он кодирует, получил название MUC16 (O'Brien et al., 2001; Yin and Lloyd, 2001). Первоначально CA125 (MUC16) получил известность как биомаркер рака яичников. Однако дальнейшие исследования установили, что его уровень в сыворотке крови может повышаться при некоторых нормальных физиологических процессах (Masahashi et al., 1988). Также было установлено, что уровень СА125 повышен при других злокачественных новообразованиях и в значительной степени связан с неблагоприятным прогнозом течения заболевания (Einama et al., 2011; Shimizu et al., 2012; Streppel et al., 2012). MUC16 способствует пролиферации опухолевых клеток, усилению их инвазивных свойств и метастазированию, а также с помощью различных механизмов блокирует противоопухолевый иммунный ответ (Rump et al., 2004).
MUC16 является привлекательной мишенью для иммунотерапевтического воздействия в связи с его высокой экспрессией на поверхности злокачественных клеток, особенно при таких онкопатологиях как эпителиальный рак яичников (Kabawat et al., 1983) и аденокарцинома протоков поджелудочной железы (Streppel et al., 2012). При этом, экспрессия MUC16 в нормальных тканях либо не выявляется, либо является низкой. MUC16 представляет собой высокомолекулярный трансмембранный гликопротеин I типа, который несет на своей поверхности в составе тандемного повторяющегося домена антиген СА125 - единственный сывороточный маркер, одобренный сегодня для мониторинга терапии и рецидивов рака яичников. Антиген СА125 попадает в кровь вследствие протеолитического расщепления MUC16. В результате на поверхности клетки остается С-концевой домен белка, включающий небольшой экстраклеточный участок, трансмембранный и цитоплазматический домены. В настоящее время как антиген СА125 (в составе тандемного повторяющегося домена MUC16), так и экстраклеточный участок С-концевого домена MUC16 рассматриваются как мишени при разработке иммунотерапевтических агентов.
Задача настоящего изобретения заключается в применении иммунотерапевтического метода на основе введения генномодифицированных лимфоцитов, экспрессирующих химерные иммуноглобулиновые мономолекулярные Т-клеточные рецепторы к СА125, для лечения онкологических заболеваний, характеризующихся повышенным уровнем СА125.
Полученный технический результат это - получение генномодифицированных Т-лимфоцитов, которые, с одной стороны, обладают цитотоксической противоопухолевой эффективностью, а с другой стороны, с высокой селективностью узнают СА125-позитивные опухолевые клетки.
Технический результат достигается за счет трансфекции Т-лимфоцитов генетической конструкцией, содержащей ген мономолекулярного Т-клеточного рецептора к опухоль-специфичному антигену СА125. При этом антигенсвязывающий участок рецептора представлен одноцепочечным антителом.
В одном из вариантов осуществления настоящее изобретение относится к одноцепочечному антителу к опухоль-специфичному антигену СА125, антиген связывающий сайт которого включает:
(i) вариабельный участок Н цепи, представленный аминокислотной последовательностью SEQ ID NO: 1 или, по меньшей мере, на 60% идентичной ей последовательностью, и
(ii) вариабельный участок L цепи, представленный аминокислотной последовательностью SEQ ID NO: 2 или, по меньшей мере, на 60% идентичной ей последовательностью.
В предпочтительном варианте одноцепочечное антитело к опухоль-специфичному антигену СА125, представлено аминокислотной последовательностью SEQ ID NO: 3.
В одном из вариантов осуществления настоящее изобретение относится к химерному мономолекулярному Т-клеточному рецептору к опухоль-специфичному антигену СА125, включающему заявленное одноцепочечное антитело.
В одном из вариантов осуществления настоящее изобретение относится к нуклеиновой кислоте, кодирующей заявленное одноцепочечное антитело.
В одном из вариантов осуществления настоящее изобретение относится к вектору экпрессии, в который встроена заявленная нуклеиновая кислота.
В предпочтительном варианте вектор экпрессии включает нуклеотидную последовательность SEQ ID NO: 4.
В одном из вариантов осуществления настоящее изобретение относится к клетке-хозяину, продуцирующей химерный мономолекулярный Т-клеточный рецептор к опухоль-специфичному антигену СА125, содержащей заявленный вектор.
Описание рисунков
Рис. 1 Строение плазмиды.
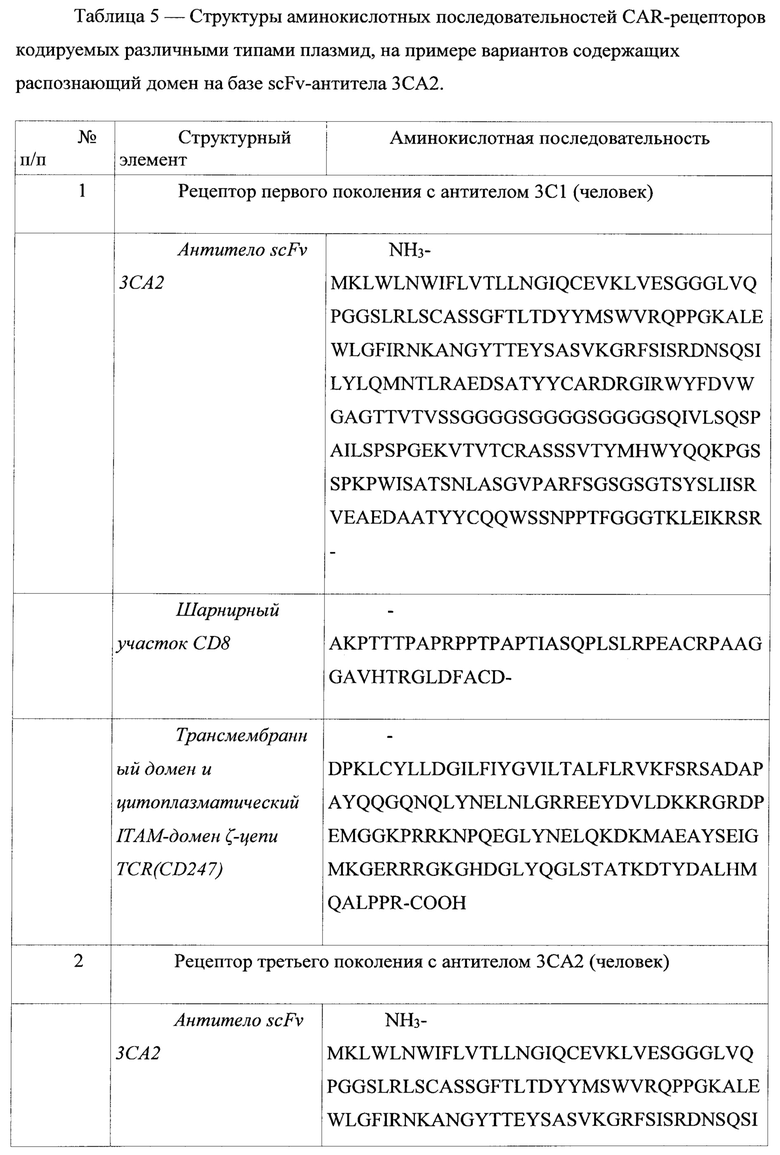
Рис. 2. Эффективность трансфекции (процент трансфецированных клеток) линии MCF-7 плазмидой, кодирующей зеленый флуоресцентный белок (GFP).
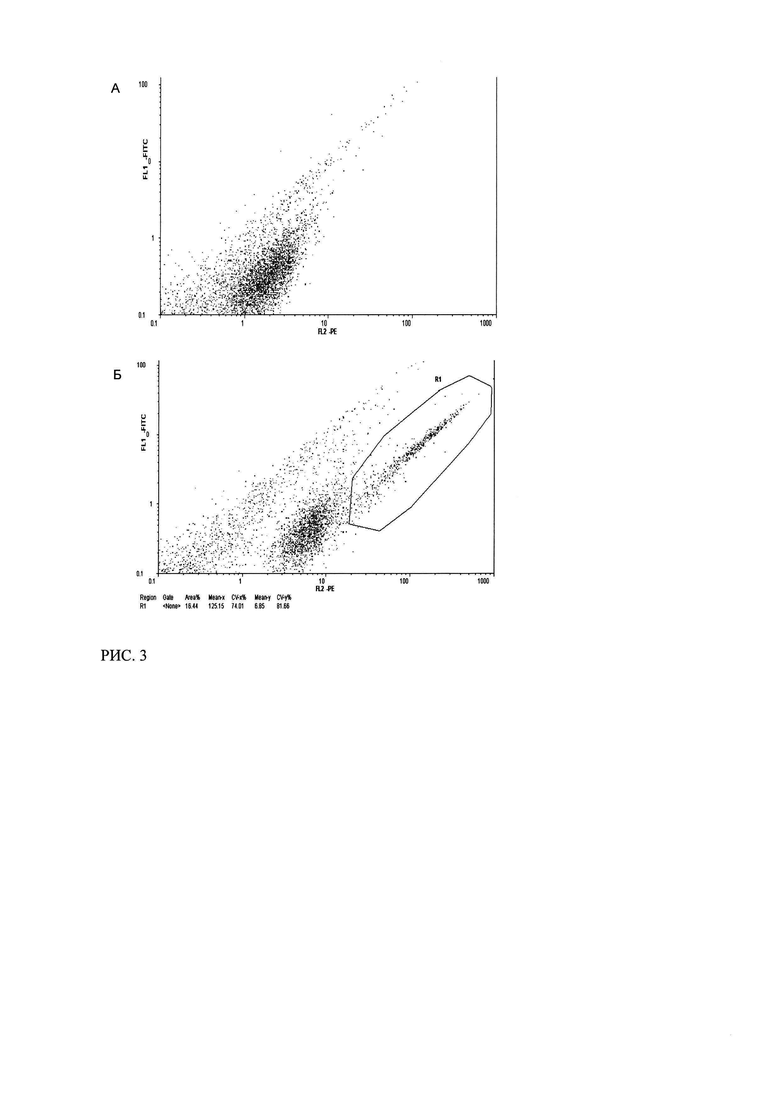
Рис. 3. Данные цитофлуориметрического анализа клеток MCF-7, трасфецированных плазмидой p1CA1, после окрашивания ФИТЦ-мечеными антителами изотипического контроля (А) и ФИТЦ-мечеными антителами к ζ-цепи CD3 (Б).
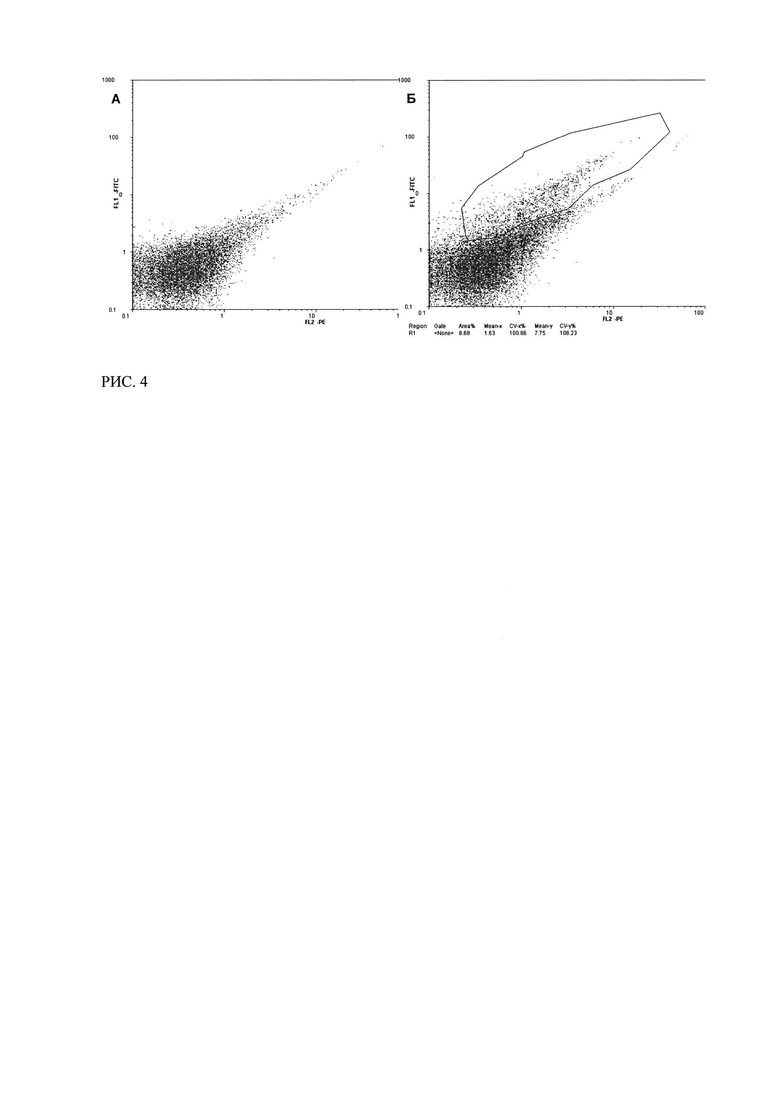
Рис. 4. Цитофлуориметрический анализ связывания трансфецированных плазмидой p1CA1 клеток MCF-7 с ФИТЦ-СА125 в растворе (через 48 часа после трансфекции).
(А - нетрансфецированные клетки MCF-7 (отрицательный контроль); Б - клетки MCF-7, трансфецированные плазмидой p1CA1, через 48 часов после трансфекции).
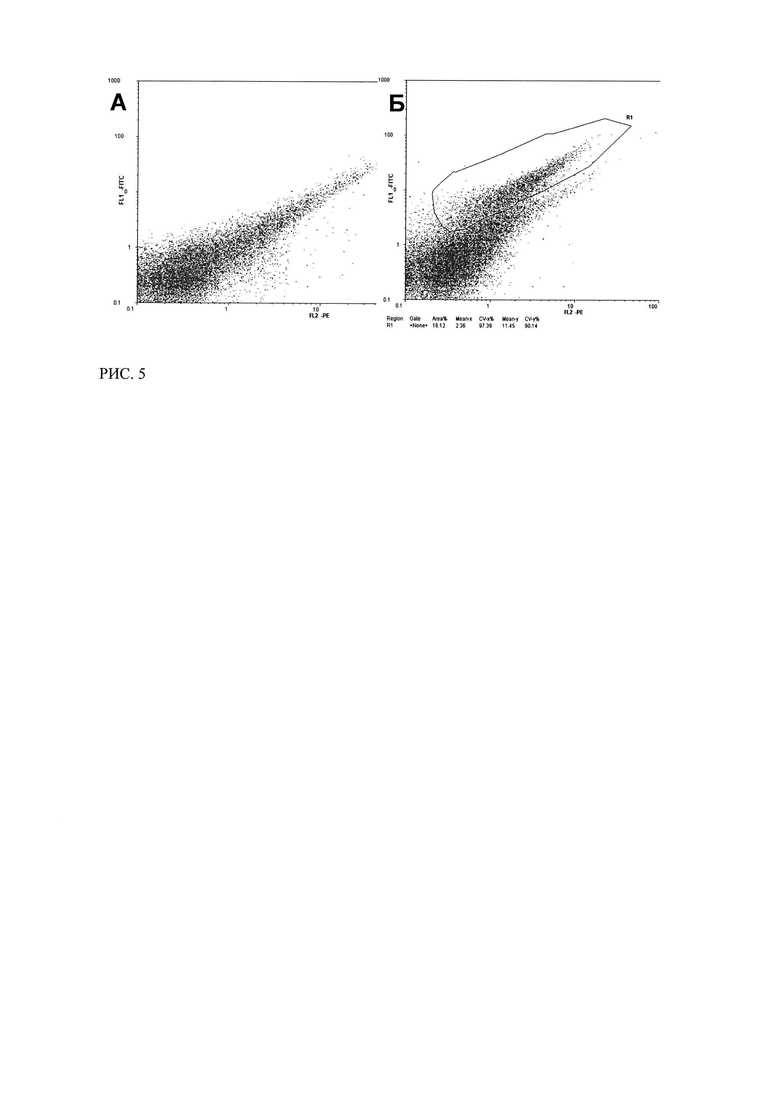
Рис. 5. Цитофлуориметрический анализ связывания трансфецированных плазмидой р3СА2 клеток MCF-7 с ФИТЦ-СА125 в растворе (через 24 часа после трансфекции).
(А - нетрансфецированные клетки MCF-7 (отрицательный контроль); Б - клетки MCF-7, трансфецированные плазмидой р3СА2, через 24 часов после трансфекции).
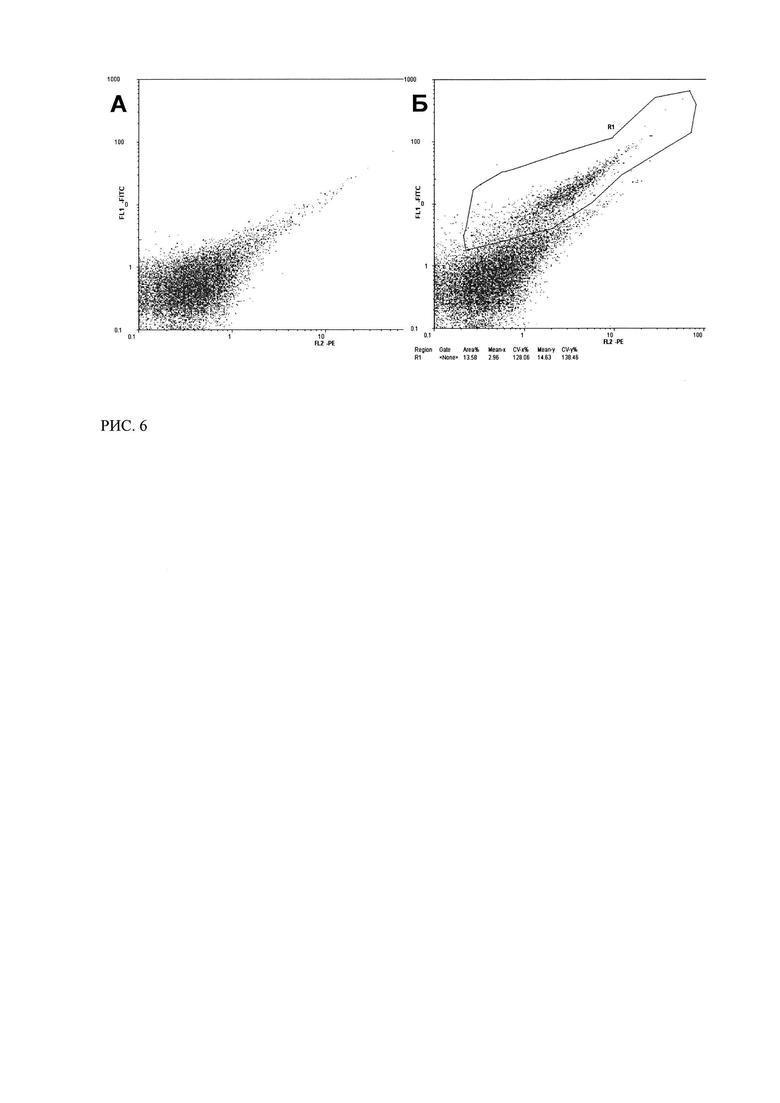
РИС. 6. Цитофлуорометрический анализ связывания трансфецированных плазмидой p1CA1 клеток MCF-7 с ФИТЦ-СА125 в растворе (через 24 часа после трансфекции).
(А - нетрансфецированные клетки MCF-7 (отрицательный контроль); Б - клетки MCF-7, трансфецированные плазмидой p1CA1, через 24 часа после трансфекции).
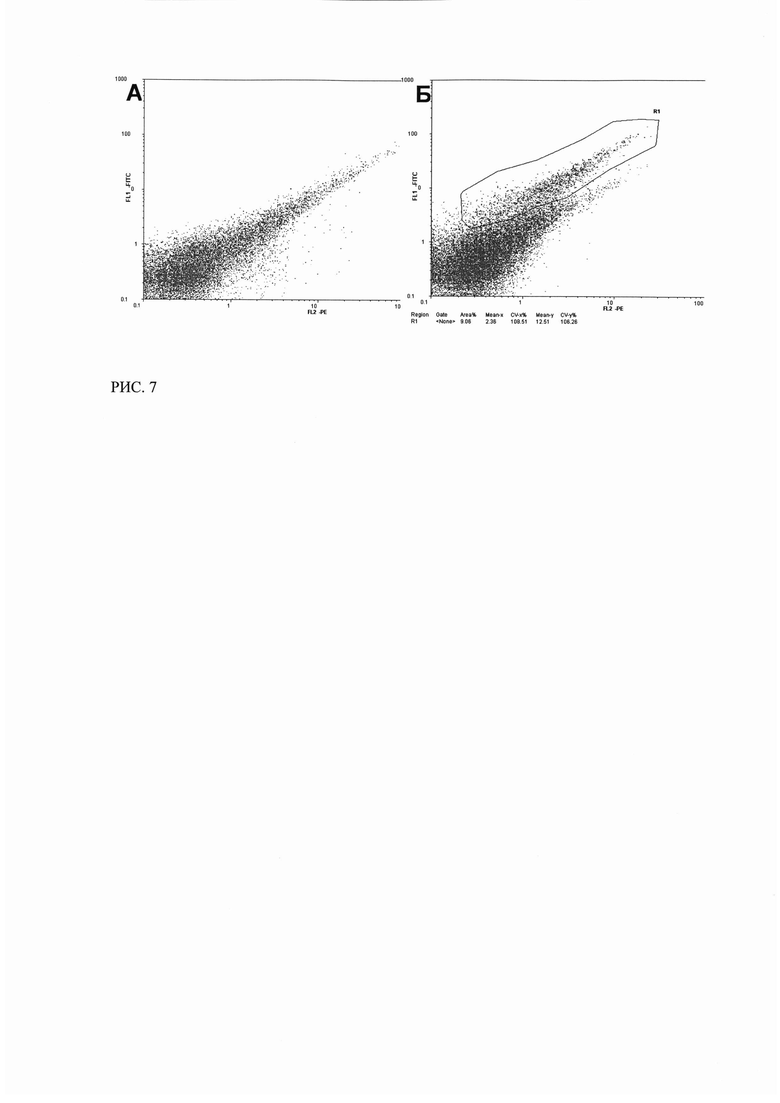
РИС. 7. Цитофлуориметрический анализ связывания трансфецированных плазмидой р3СА3 клеток MCF-7 с ФИТЦ-СА125 в растворе (через 48 часов после трансфекции).
(А - нетрансфецированные клетки MCF-7 (отрицательный контроль); Б - клетки MCF-7, трансфицированные плазмидой р3СА3, через 48 часов после трансфекции).
Рисунок 8 - Результаты гель-электрофореза продуктов ОТ-ПЦР, подтверждающие экспрессию целевого гена на плазмиде р3СА2 в трансфецированных клетках.
(Дорожка 1 - маркеры молекулярных масс ДНК; дорожка 2 - ОТ-ПЦР на матрице РНК нетрансфецированных клеток MCF-7; дорожка 3 - клетки MCF-7, трансфецированных плазмидой р3СА2; дорожка 4 - лимфоциты, трансфецированные плазмидой, содержащей ген GFP; дорожка 5 - лимфоциты, трансфецированные плазмидой р3СА2).
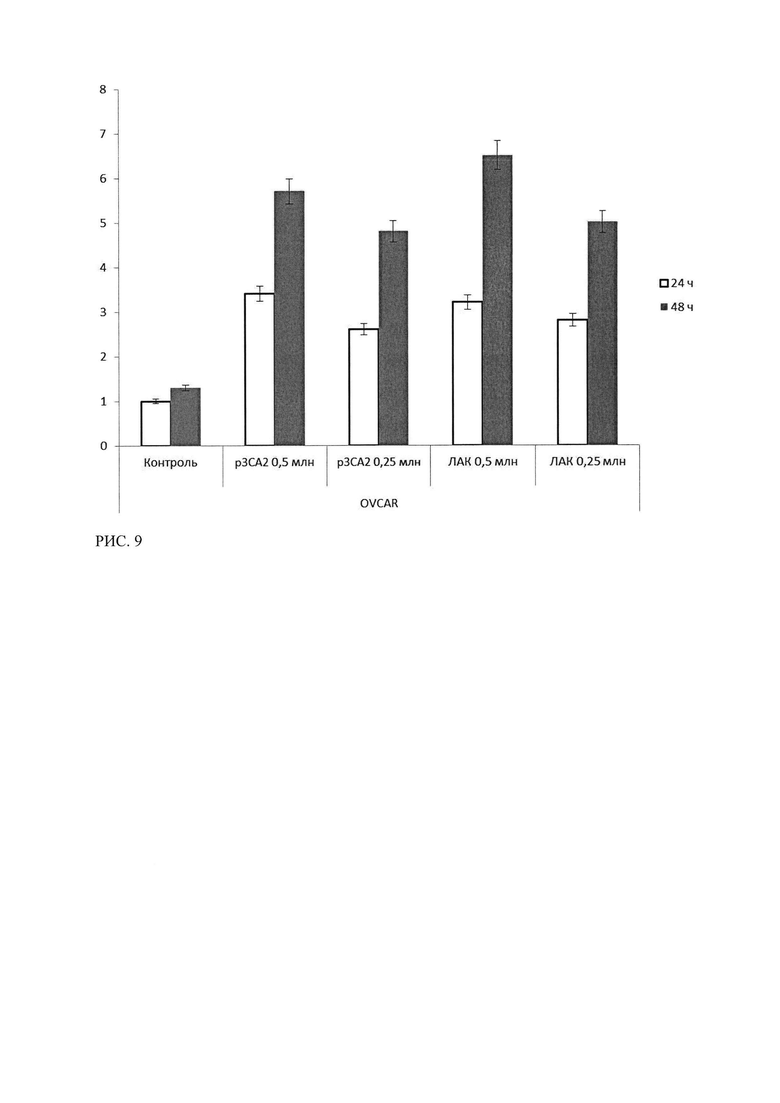
Рисунок 9 - Результаты ЛДГ-теста клеток культуры OVCAR-3 после 24 и 48 часов инкубации с лимфоцитами, трансфецированными р3СА2 и ЛАК. Результаты контроля клетки OVCAR-3, инкубированные со средой, в течение 24 часов, приняты за 1.
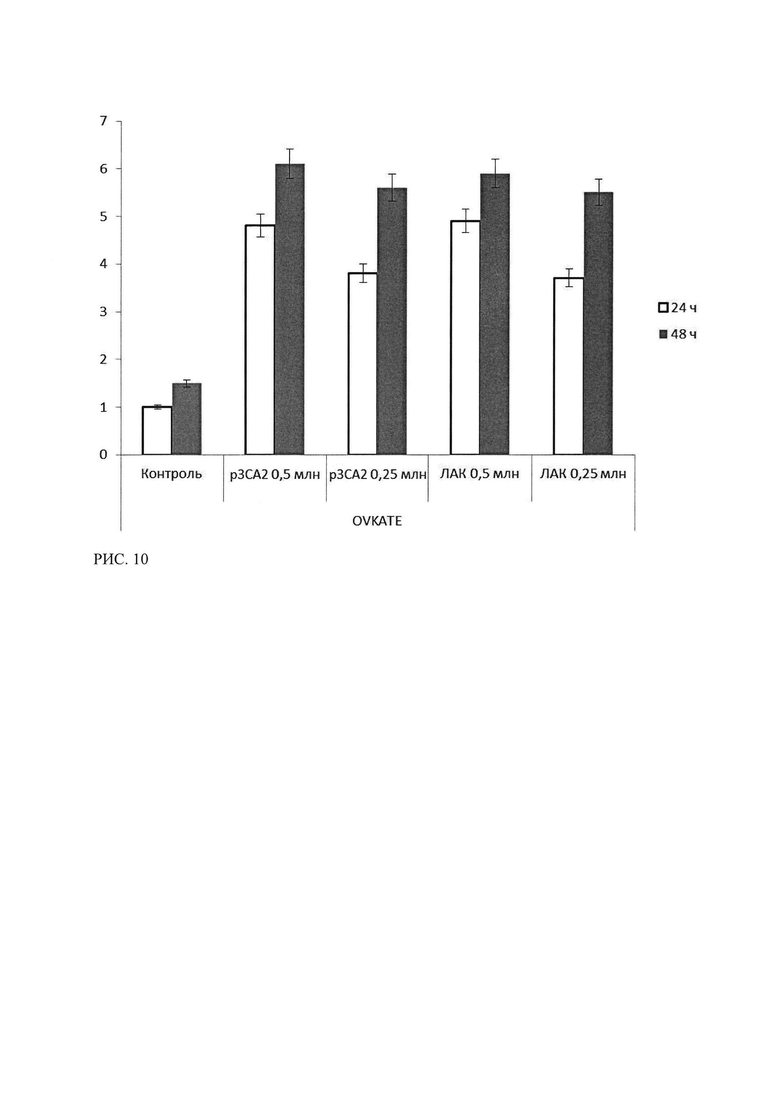
Рисунок 10 - Результаты ЛДГ-теста клеток культуры OVKATE после 24 и 48 часов инкубации с лимфоцитами, трансфецированными р3СА2 и ЛАК. Результаты контроля клетки OVKATE, инкубированные со средой, в течение 24 часов, приняты за 1.
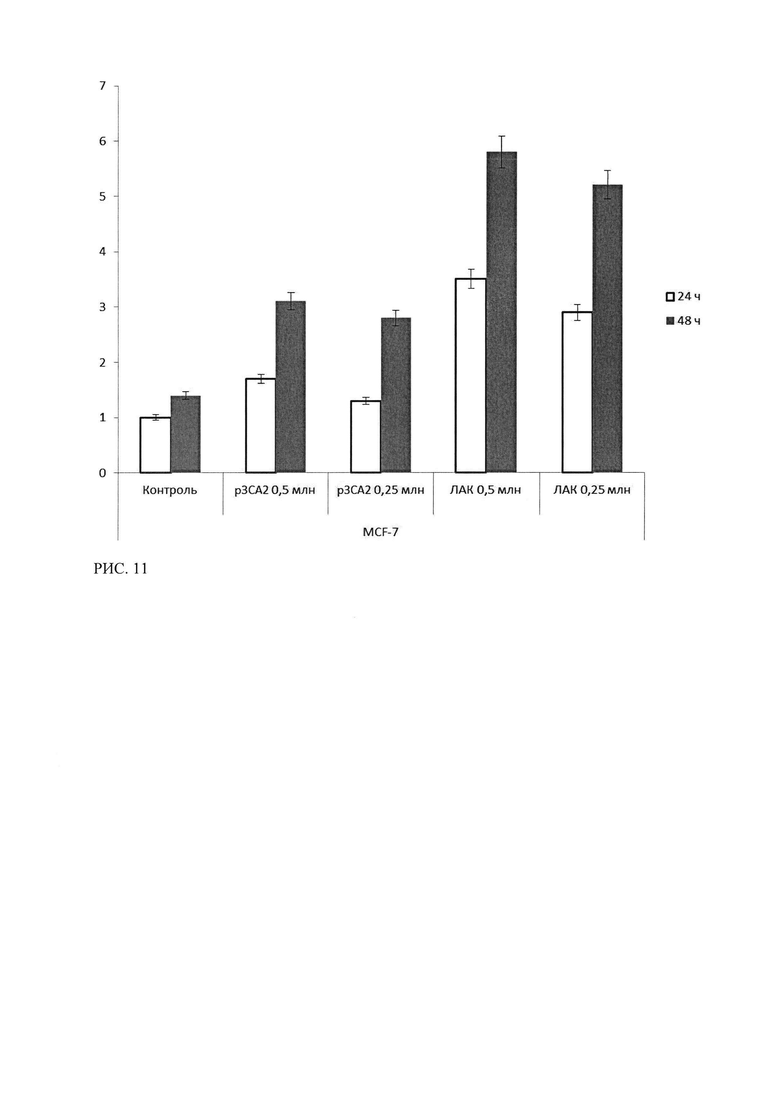
Рисунок 11 - Результаты ЛДГ-теста клеток культуры MCF-7 после 24 и 48 часов инкубации с лимфоцитами, трансфицированными р3СА2 и ЛАК. Результаты контроля клетки MCF-7, инкубированные со средой, в течение 24 часов, приняты за 1.
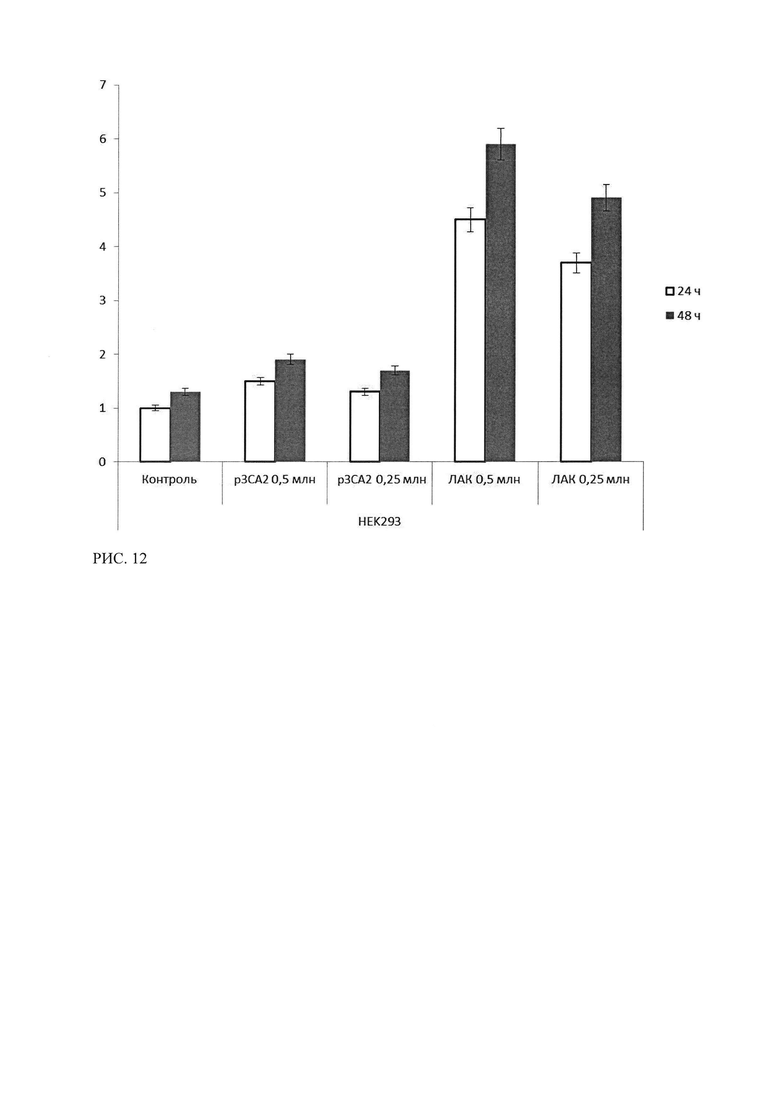
Рисунок 12 - Результаты ЛДГ-теста клеток культуры НЕК293 после 24 и 48 часов инкубации с лимфоцитами, трансфицированными р3СА2 и ЛАК. Результаты контроля клетки НЕК293, инкубированные со средой, в течение 24 часов, приняты за 1.
Используемый в настоящем документе термин «одноцепочечное антитело» обозначает рекомбинантное антитело, т.н. одноцепочечный вариабельный фрагмент scFv (singl chain variable fragments), кодируется одним геном и содержит только один антиген-связывающий участок, состоящий из вариабельных доменов легкой (VL) и тяжелой (VH) цепей, соединенных гибким пептидным линкером.
Одноцепочечное антитело scFv включает VH и VL участки антитела, и эти участки существуют в виде одной полипептидной цепи. В общем случае, Fv полипептид дополнительно включает полипептидный линкер между VH и VL участками, и это позволяет scFv формировать структуру, необходимую для связывания антигена (для обзора относительно scFvs, смотри Pluckthun "The Pharmacology of Monoclonal Antibodies" том 113 (Rosenburg и Moore ed. (Springer Verlag, New York) стр. 269-315, 1994). В контексте настоящего изобретения линкеры не являются особенно ограниченными до тех пор, пока они не ингибируют экспрессию вариабельных участков антитела, присоединенных к их концам.
Пример антитела изобретения

Используемый в настоящем документе термин «антигенсвязывающий сайт (центр, участок)» обозначает активные центры антител, формируются взаимодействием VH-домена и VL-домена цепей иммуноглобулина. Поэтому изменения в последовательности аминокислотных остатков этих доменов определяют специфичность антител.
В то время как первый сайт связывания антигена и второй сайт связывания антигена не являются особенно ограниченными до тех пор, пока они обладают активностью связывания с СА125, примеры включают сайты, необходимые для связывания с антигенами, например

Настоящее изобретение охватывает также последовательности гомологичные (идентичные) на 60% и более SEQ ID NO: 1 или SEQ ID NO: 2. Гомология рассчитывается с помощью программ, известных для специалиста данной области.
Настоящее изобретение охватывает также варианты аминокислотных последовательностей SEQ ID NO: 1 или SEQ ID NO: 2. Варианты аминокислотных последовательностей могут являться замещающими либо инсерционными вариантами.
Настоящее изобретение охватывает также варианты аминокислотных последовательностей SEQ ID NO: 1 или SEQ ID NO: 2, а также любые вставки и делеции 1-2 аминокислот или их аналогов.
Как правило, инсерционные мутанты подразумевают добавление материала на неконечной точке пептида. Сюда может относиться включение нескольких остатков, иммунореактивного эпитопа или просто одного остатка. Добавляемый материал может подвергаться изменениям, например, метилирование, ацетилирование и т.п. Либо к N- или С-терминальному концу пептида могут добавляться дополнительные остатки.
Что касается замещающих вариантов, то, как правило, они подразумевают замещение одной аминокислоты другой аминокислотой на одном или нескольких участках пептида. Замещение может использоваться для модулирования одного или нескольких свойств пептида, например, устойчивости к протеолизу, без потери других функций или свойств. Предпочтительно, чтобы подобные замещения были консервативными, иными словами, одна аминокислота замещается другой аминокислотой схожей формы и заряда. Консервативные замещения хорошо известны, к ним относятся, например, замены следующего типа: аланин на серии, аргинин на лизин, аспарагин на глутамин или гистидин, аспартат на глутамат, цистеин на серии, глутамин на аспарагин, глутамат на аспартат; глицин на пролин, гистидин на аспарагин или глутамин, изолейцин на лейцин или валин, лейцин на валин или изолейцин, лизин на арганин, метионин на лейцин или изолейцин, фенилаланин на тирозин, лейцин или метионин, серии на треонин, треонин на серии, триптофан на тирозин, тирозин на триптофан или фенилаланин, валин на изолейцин или лейцин.
Ниже представлено обсуждение замены аминокислот пептида для получения эквивалента либо улучшенной молекулы второго поколения. Например, некоторые аминокислоты могут замещаться другими аминокислотами в структуре пептида/ белка без существенной потери в связывающей способности взаимодействия с такими структурами, как, например, участки связывания на молекулах носителя или участки антител, отвечающие за связывание антигена. Поскольку связывание является связыванием взаимодействия и в силу природы пептида/ белка, которая определяет биологическую функциональную активность такого пептида/ белка, замещение некоторых аминокислот может осуществляться в ряде пептида/ белка и в ряде кодирования ДНК; в результате будет получен белок со схожими свойствами. Таким образом, выдвигается предположение, что различные изменения могут вноситься в ряд ДНК генов без существенной потери их биологических свойств или активности (см. обсуждение ниже). Далее, аминокислоты, рассматриваемые в рамках настоящего изобретения, могут содержать изменения, например, метилирование, ацетилирование, миристилирование и т.п.
При внесении таких изменений можно учесть индекс гидропатичности аминокислот. Важность индекса гидропатичности аминокислот для переноса биологической функции на пептид/ белок хорошо известна (Kyte and Doolittle, 1982). Допускается, что относительные свойства гидропатичности аминокислоты влияет на вторичную структуру получаемого пептида/ белка, что, в свою очередь, определяет взаимодействие пептида/ белка с другими молекулами, например, с ферментами, субстратами, рецепторами, ДНК, антителами, антигенами и т.п.
Каждая аминокислота имеет индекс гидропатичности, зависящий от ее гидропатичности и заряда (Kyte and Doolittle, 1982): изолейцин (+4,5), валин (+4,2), лейцин (+3,8), фенилаланин (+2,8), цистеин/ цистин (+2,5), метионин (+1,9), аланин (+1,8), глицин (-0,4), треонин (-0,7), серин (-0,8), триптофан (-0,9), тирозин (-1,3), пролин (-1,6), гистидин (-3,2), глутамат (-3,5), глутамин (-3,5), аспартат (-3,5), аспарагин (-3,5), лизин (-3,9) и аргинин (-4,5).
Известно, что некоторые аминокислоты могут замещаться другими аминокислотами с аналогичным индексом или показателем гидропатичности с получением аналогичного пептида/ белка со схожей биологической активностью, т.е. получается эквивалентный по биологическим функциям пептид/ белок. При внесении таких изменений предпочтительными являются аминокислоты с индексом гидропатичности в пределах ±2, особенно приемлемым является показатель ±1, но самыми оптимальными являются индексы ±0,5.
Признанным является тот факт, что замещение схожих аминокислот может быть оптимальным с учетом гидропатичности. В Патенте США №4,554,101, ссылка на который приводится в настоящем документе, указывается, что максимальная локальная средняя гидропатичность белка (в зависимости от гидропатичности соседних аминокислот) совпадает с биологическим свойством белка. Как описано в Патенте США №4,554,101, аминокислотные остатки имеют следующие значения гидропатичности: аргинин (+3,0), лизин (+3,0), аспартат (+3,0±1), глутамат (+3,0±1), серин (+0,3), аспарагин (+0,2), глутамин (+0,2), глицин (0), треонин (-0,4), пролин (-0,5+-1), аланин (-0,5), гистидин (-0,5), цистеин (-1,0), метионин (-1,3), валин (-1,5), лейцин (-1,8), изолейцин (-1,8), тирозин (-2,3), фениланин (-2,5), триптофан (-3,4).
Признанным является тот факт, что аминокислоту можно заместить другой аминокислотой со схожим значением гидропатичности, в результате все равно будет получен белок с эквивалентными биологическими и иммунологическими свойствами. При внесении таких изменений предпочтительными являются аминокислоты с показателем гидропатичности в пределах +-2, особенно приемлемым является показатель ±1, но самыми оптимальными являются индексы ±0,5.
Как указано выше, замещение аминокислот основано преимущественно на относительной схожести заместителей боковых цепей аминокислоты, например, на их гидропатичности, заряде, размере и т.п. Примерами замещений, где учитываются упомянутые выше характеристики, хорошо известны, к ним относятся следующие: арганин и лизин, глутамат и аспартат, серин и треонин, глутамин и аспарагин, валин, лейцин и изолейцин. Тем не менее, изменения аминокислот в рамках настоящего изобретения могут быть и не консервативными, но все же входить в сферу применения настоящего изобретения до тех пор, пока рецепторы сохраняют функцию связывания с клетками опухоли.
Используемый в настоящем документе термин «химерный мономолекулярный Т-клеточный рецептор» включает в себя антигенраспознающую часть, представляющую собой вариабельный фрагмент антитела, объединенную с эффекторным фрагментом Т-клеточного рецептора (обычно с ζ-цепью). Распознавание антигена таким химерным рецептором за счет иммуноглобулиновой части является независимым от представления антигена клетками главного комплекса гистосовместимости (ГКГ), связывание с антигеном приводит к секреции модифицированными Т-лимфоцитами интерлейкина-2 (ИЛ-2) и ряда других цитокинов и проявлению цитотоксического действия, объединение в химерном рецепторном комплексе различных ко-стимулирующих доменов не являются особенно ограниченным до тех пор, пока рецептор обладает активностью связывания с СА125.
В качестве мишени выбран онкофетальный опухоль-специфический антиген СА125. По химическому строению СА-125 является мембрано-ассоциированным гликопротеином семейства муцинов с одним трансмембранным доменом. Уникальным свойством СА-125 является его большой размер. Он в два раза больше, чем MUC 1 и MUC4, и содержит около 22.000 аминокислот. Состоит из N-терминального домена, тандема повторяющихся доменов и С-концевого домена. Первые два домена располагаются экстрацеллюлярно и сильно гликозилированы. Тандем из повторяющихся доменов содержит преимущественно серин, треонин и пролин. С-концевой домен содержит так называемые SEA модули, трансмембранный домен и цитоплазматический хвост. Путем протеолитического расщепления экстрацеллюлярная часть СА-125 может быть отделена от клеточной поверхности. Небольшие количества СА 125 обнаруживаются в нормальных тканях производных целомического эпителия, включая мезотелиальные клетки, выстилающие грудную, брюшную полости, перикард; он также ассоциирован с эпителием, выстилающим маточные трубы, эндометрий, цервикальный канал.
По данным The Cancer Genome Atlas в большинстве опухолей яичника уровень MUC16 (СА125) повышен и является независимым фактором прогноза у пациентов с этим заболеванием. Исследования последних лет показали, что СА125 не только чувствительный маркер для рака яичника, но и играет важную роль в опухолевой прогрессии, увеличивая пролиферативный потенциал опухоли через AKT-ERK сигнальный путь и повышая инвазивный потенциал клеток, гиперэкспрессирующих его (Rao TD et al.)
По данным разных авторов до 50% опухолей легких и молочной железы (аденокарциномы) экспрессируют СА125 (Zhu W, Michael CW.).
Кроме того СА125 позитивные опухоли часто встречаются (с частотой от 30 до 80%) при таких локализациях рака как матка и шейка матки, почка, щитовидная желез, органы желудочно-кишечного тракта (толстая кишка, поджелудочная железа, желудок, печень), некоторых вариантах саркомы (Vasudev NS et al; A. Berchuck et al).
Настоящее изобретение обеспечивает гены или нуклеиновые кислоты, кодирующие антитела в соответствии с настоящим изобретением.
Полинуклеотид может быть сконструирован на основе последовательности анти-СА125 антитела и встроен в экспрессионный вектор, с последующей экспрессией в приемлемых хозяйских клетках (смотри, например, Со, М. S. и др., 3. Immunol. (1994) 152, 2968-2976; Better, М. и Horwitz, А.Н., Methods Enzymol. (1989) 178, 476-496; Pluckthun, А. и Skerra, A., Methods Enzymol. (1989) 178, 497-515; Lamoyi, E., Methods Enzymol. (1986) 121, 652-663; Rousseaux, J. и др., Methods Enzymol. (1986) 121, 663-669; Bird, R.E. и Walker, B.W., Trends Biotechnol. (1991) 9, 132-137).
Такие векторы включают M13 векторы, pUC векторы, pBR322, pBluescript и pCR-Script. Альтернативно, тогда, когда целью является субклонировать и вырезать кДНК, эти векторы включают, например, pGEM-T, pDIRECT и рТ7, в дополнение к векторам, описанным выше. Экспрессионные векторы являются особенно полезными при использовании векторов для получения химерного рецептора в соответствии с настоящим изобретением. Например, при ориентации на экспрессию в Т-клетках экспрессионные векторы не только имеют характеристики, которые позволяют осуществлять амплификацию вектора в Т-лимфоцит, но могут также нести промотор, который позволяет осуществлять эффективную экспрессию в клетку, например, lacZ промотор (Ward и др., Nature (1989) 341:544-546; FASEB J. (1992) 6:2422-2427), araB промотор (Better и др., Science (1988) 240:1041-1043), Т7 промотор или другие. Такие векторы включают pGEX-5X-l (Pharmacia), "QIAexpress system" (Qiagen), pEGFP, или pET (в этом случае хозяин предпочтительно представляет собой BL21, который экспрессирует РНК полимеразу Т7).
Экспрессионные плазмидные векторы могут содержать сигнальные последовательности. В качестве сигнальной последовательности для секреции антитела может использоваться pelB сигнальная последовательность (Lei, S. P. et al J. Bacteriol. (1987) 169:4379) тогда, когда белок секретируется в периплазму E.coli.
Вектор может быть введен в хозяйские клетки при использовании, например, способов на основе хлорида кальция или электропорации.
В дополнение к векторам, векторы для получения антитела в соответствии с настоящим изобретением представлены конструкциями p1CA1, р3СА2, р3СА3. Были созданы на основе распознающих участков антител Х75, Х181 и X189 соответственно путем клонирования в плазмиду pCI участков, кодирующих i) вариабельные фрагменты κ-(легких) и γ- (тяжелых) цепей выбранных моноклональных антител к СА125, разделенных линкерным пептидом (G4S)3 (одноцепочечные миниантитела в scFv-формате), ii) «шарнирный» участок белка CD8 и iii) участок белка CD247 (ζ-цепь Т-клеточного рецептора) включающий трансмембранный и цитоплазматический домены.
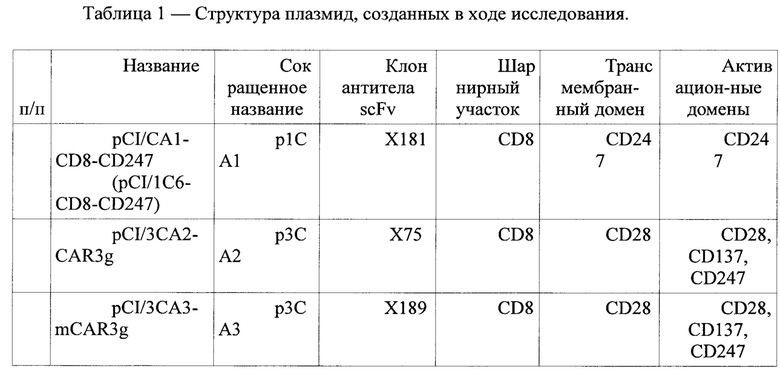
Штаммы кишечной палочки XL-1Blue и TG1 культивировали на среде LB (Amresco, США) при 37°С в аэробных условиях. Плотную среду готовили путем добавления к бульону LB 1.5% агара бактериологического. С целью создания селективных условий для рекомбинантных плазмид в питательные среды добавляли растворы антибиотиков: ампициллин (до концентрации 100 мкг/мл) или канамицин (до концентрации 50 мкг/мл). Штаммы бактерий и плазмиды, использованные в работе, перечислены в Таблице 2.


Примеры



Используемый в настоящем документе термин «клетка-хозяин» включает в себя трансфецированные указанными конструкциями лимфоциты периферической крови человека, характеризующихся высокой цитотоксической активностью в отношении СА125-экспрессирующих клеток.
Все ссылки на документы уровня техники, которые приводятся в данной заявке, являются введенными в это описание в качестве ссылки.
Примеры
Далее настоящее изобретение будет, в частности, описываться со ссылкой на примеры, но они не должны трактоваться как такие, которые ограничивают его.
Пример 1. Получение геннотерапевтической плазмидной конструкции.
Методы молекулярного клонирования
Молекулярное клонирование для получения рекомбинантных плазмид (Таблица 4) проводили с использованием стандартных протоколов. Последовательность действий при клонировании сводилась к следующему: 1) ПЦР-амплификация ДНК-вставки из кДНК или плазмидной ДНК, получение ДНК-вставки из плазмидной ДНК путем ее рестрикционного гидролиза; получение ДНК-вставки путем синтеза; 2) обработка плазмидного вектора и вставки (после предварительной очистки) эндонуклеазами рестрикции; 3) очистка вектора и вставки с помощью препаративного электрофореза в 1% агарозном геле; 4) лигирование вектора и вставки; 5) трансформация бактериальных штаммов. Очистку ДНК из ПЦР-смесей, рестрикционных смесей и выделение из агарозного геля осуществляли с помощью наборов DNA Clean & Concentrator и Zymoclean™ Gel DNA Recovery Kit (Zymo Reseach), плазмиды и ПЦР-продукты обрабатывали рестрикционными эндонуклеазами EcoRI, XbaI, SmaI, HindIII в буферных растворах в соответствии с рекомендациями производителя (Сибэнзим, Fermentas), реакции лигирования проводили с использованием фермента ДНК-лигазы бактериофага Т4 (Fermentas). Продукты лигирования отделяли от буферного раствора путем осаждения этанолом (66%) в присутствие 0,3М ацетата натрия и использовали для трансформации штамма Е. coli XL-1Blue. Структуру полученных рекомбинантных плазмид подтверждали при помощи ПЦР, рестрикционного анализа и секвенирования.
Определение нуклеотидной последовательности фрагментов генов легких и тяжелых цепей иммуноглобулинов в выбранных клонах гибридом
Для получения антигенраспознающих фрагментов тяжелых цепей иммуноглобулиновых генов на матрице препаратов кДНК, полученных из клонов СА1, СА2 и СА3 была проведена реакция ПЦР с некоторыми особенностями. В частности, в качестве форвард-праймера была использована эквимолярная смесь вырожденных олигонуклеотидов Gamma-1 - Gamma-10, взятая в суммарной концентрации 0,5 мкМ, а в качестве реверс-прамера был использован олигонуклеотид CH-R1 в концентрации 0,25 мкМ. Аналогичным образом для амплификации фрагментов легких цепей была использована смесь олигонуклеотидов Карра-1 - Карра-11, а также праймер CL-R1 в тех же концентрациях. Отжиг производился на температурах 45°, 52°, 60°. Длительность программы составляла 40 циклов. Полученные в результате ПЦР-продукты (320-420 п.н.) очищали, клонировали в вектор pAL-TA (Евроген) в соответствии с рекомендациями изготовителя, а итоговые рекомбинантные плазмиды секвенировали.
Информацию о структуре фрагментов иммуноглобулиновых генов затем использовали для дизайна ген-специфических праймеров и сборки генов миниантител в scFv-формате.
Получение плазмид, кодирующих химерный антигенный рецептор (CAR) второго поколения
Ген миниантитела СА1 был получен следующим образом:
1) На матрице кДНК из соответствующего клона гибридомы была проведена пара ПЦР-реакций с праймерами CA1-SP-F1 и CA1-SP-R1 для амплификации фрагмента гена легких цепей вместе с участком, кодирующим сигнальный пептид, а также с праймерами CA1/6G-F1 и CA1-SP-R1 для амплификации фрагмента гена тяжелых цепей. Полученные фрагменты очищали, смешивали в эквимолярных соотношениях, разводили и использовали в качестве матрицы для второго раунда ПЦР с праймерами CA1-SP-F1 и CA1-SP-R1. Благодаря наличию перекрывающихся последовательностей, кодирующих линкерный пептид (G4S)3, на концах двух исходных ПЦР-продуктов во втором раунде ПЦР происходил их отжиг друг на друга и элонгация. Полученный таким образом гибридный ген (819 п.н.), кодирующий scFv-антитело структуры VL-линкер-CL клонировали в вектор pCI по сайтам EcoRI и XbaI.
2) Фрагмент гена ζ-цепи Т-клеточного рецептора (CD247, 528 п.н.) был амплифицирован из кДНК человеческих периферийных мононуклеарных клеток крови с использованием пары праймеров CD247-F1 и CD247-R1. Полученный фрагмент, кодирующий трансмембранный домен и цитоплазматический активационный домен рецептора CD247 клонировали в вектор pCI, содержащий клонированный ген scFv СА1 по сайтам рестрикции XbaI и SmaI. В результате этого была получены рекомбинантная плазмида pCI/CA1-CD247 первого поколения, кодирующая рецептор структуры VL-линкер-CL-CD247.
Для добавления к полученной структуре химерного антигенного рецептора шарнирного участка из молекулы CD8 было проведено следующее:
На матрице кДНК человеческих периферийных мононуклеарных клеток крови с использованием пары праймеров CD8-F1 и CD8-R1 был амплифицирован фрагмент (144 п.н.) гена CD8, кодирующий шарнирный участок молекулы. На матрице той же кДНК был заново амплифицирован фрагмент гена CD247 с использованием праймеров CD247-F2 и CD247-R1. Благодаря наличию перекрывающихся последовательностей в праймерах CD8-R1 и CD247-F2 стало возможным провести отжиг двух очищенных ПЦР-продуктов друг на друга и реамплификацию гибридной конструкции (675 п.н.) с использованием праймеров CD8-F1 и CD247-R1. Полученный ПЦР-продукт был обработан рестриктазами XbaI и SmaI и клонирован в вектор pCI, содержащий клонированный ген scFv 1С6. В результате этого была получены рекомбинантная плазмида pCI/CAl-CD8-CD247, кодирующая рецептор структуры VL-линкер-CL-CD8(шарнир)-CD247.
Получение плазмид, кодирующих рецептор третьего поколения на базе антитела 3СА2/3
Для создания плазмид, кодирующих рецепторы третьего поколения были синтезированы (на базе ЗАО Евроген) два искусственных гена, кодирующие структуру типа CD8 (шарнир) - CD28 (трансмембранный и активационные домены) - CD137/4-1ВВ (активационный домен) - CD247 (ITAM-домен). Один из синтезированных генов (CAR3g, 825 п.н., Таблица 4) кодирует человеческий вариант белковых доменов, другой (mCAR3g, 813 п.н., Таблица 4) - мышиный.
Оба синтетических фрагмента были обработаны рестриктазами XbaI и EcoRV и клонированы в расщепленные по сайтам XbaI и SmaI векторы pCI/3CA2-CD8-CD247 и pCI/3CA3-CD8-CD247. В результате этого были получены четыре варианта плазмид, кодирующие человеческие и мышиные варианты химерных иммунорецепторов с распознающими доменами на основе антител 3СА2 и 3СА3: pCI/3CA2-CAR3g, pCI/3СА2-mCAR3g, pCI/3CA3-CAR3g и PCI/3CA3-mCAR3g.
В Таблице 5 приведены примеры аминокислотной последовательности полученных химерных иммунорецепторов на примере трех вариантов иммунорецептора, содержащего scFv-антитело 3СА2.




Пример 2. Оценка функционирования плазмид, кодирующих Т-клеточный рецептор.
Для подтверждения правильного функционирования химерных иммунорецепторов, кодируемых созданными конструкциями, была выполнена трансфекция клеток MCF-7. Через 24 ч после трансфекции методом проточной цитометрии было исследовано связывание с клетками антител к ζ-цепи Т-клеточного рецептора. Было показано, что положительный сигнал обнаруживался в трансфицированных всеми плазмидами клетках, тогда как сигнал в контрольных препаратах клеток, окрашенных изотипическими контрольными антителами, отсутствовал. Кроме этого, трансфецированные конструкциями клетки MCF-7 связывали СА125 в растворе, что было показано после инкубации в течение 30 мин клеток с раствором СА125, меченного ФИТЦ.
Методы, использованные для изучения функционирования плазмид
Перевиваемые клеточные линии
В работе использовались клеточные линии MCF-7 (клетки рака молочной железы человека), OVCAR-3, CAOV, OVKATE, SCOV (карцинома яичника, человек), лимфоциты человека, выделенные из крови здоровых доноров.
Вся работа с культурами клеток выполнялась в стерильных условиях в ламинарном боксе в специально оборудованной для клеточной работы комнате.
Среда для культивирования имела следующий состав: DMEM (ПанЭко, Россия), 10% эмбриональная бычья сыворотка (ПанЭко), антибиотики пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл) (ПанЭко). Клетки культивировали в условиях высокой влажности при 37°С и 5% СО2. При достижении 80-90% конфлюэнтности клетки пассировали. Для этого клетки 2 раза промывали раствором стерильного фосфатно-солевого буфера (PBS, ПанЭко), обрабатывали 0,25% раствором трипсина-ЭДТА. Для повышения эффективности работы ферментов на этой стадии флаконы с клетками помещали на 37°С на 4-5 минут. После открепления всех клеток от подложки трипсин инактивировали добавлением среды с сывороткой, затем клетки разбивали до получения однородной суспензии, отбирали требуемое количество клеток, а к оставшимся клеткам добавляли соответствующее количество полной культуральной среды и продолжали культивирование.
Заморозка и оттаивание клеточных линий
Среда для заморозки имела следующий состав: 90% полной среды для культивирования и 10% ДМСО (ПанЭко, Россия).
От культивируемых клеток отбирали среду, промывали 2 раза PBS, добавляли 0,25% раствора трипсина-ЭДТА. Инкубировали при 37°С в течение 5 минут, пипетировали для получения одноклеточной суспензии, нейтрализовали трипсин полной культуральной средой, содержащей сыворотку. Полученную суспензию центрифугировали 5 минут при 1000 об./мин. Надосадочную жидкость удаляли, осадок ресуспендировали в соответствующем количестве среды для заморозки, переносили в криопробирки в концентрации 106 клеток в 1 мл среды и сразу помещали на -70°С на 24 часа. Через 24 часа криопробирки переносили в жидкий азот для продолжительного хранения. В одной криопробирке замораживали 1.0-2.0 млн. клеток.
Криопробирки размораживали на водяной бане при 37°С, стерилизовали 70% этанолом, затем их содержимое переносили в пробирку, содержащую среду для культивирования прогретую до 37°С, центрифугировали 5 минут при 1000 об./мин, надосадочную жидкость удаляли, осадок ресуспендировали в соответствующем количестве среды и переносили в флакон со средой. Клетки равномерно распределяли по культуральной поверхности и помещали в инкубатор на 37°С, 5% СО2. Через 24 ч, когда клетки прикреплялись к подложке и начинали пролиферировать, заменяли среду для устранения погибших в процессе заморозки клеток.
Культивирование лимфоцитов человека
Среда для культивирования лимфоцитов человека включала: RPMI (ПанЭко), 10% эмбриональную бычью сыворотку (ПанЭко), антибиотики пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл) (ПанЭко). Клетки культивировали в условиях высокой влажности при 37°С и 5% CO2.
Лимфоциты человека получали следующим образом. Свежую кровь человека отбирали в 5 мл стерильную пробирку, обрабатывали антикоагулянтом (цитрат натрия). Цельную кровь либо отстаивали при комнатной температуре в течение часа для осаждения эритроцитов, а затем отбирали плазму, содержащую лейкоциты, либо брали кровь непосредственно после выделения и разбавляли в PBS в соотношении 1:2, полученный раствор наслаивали на раствор фиколла-урографина (плотность 1,077 г/см3) (ПанЭко) в соотношении 2:1. Разделение клеток проводили центрифугированием в течение 30 мин при 1500 об./мин, после чего отбирали кольцо лимфоцитов. Отмывали лимфоциты от фиколла в 5 мл PBS 2 раза, клетки осаждали центрифугированием в течение 10 мин при 1000 об./мин Осадок ресуспендировали в соответствующем количестве среды для культивирования лимфоцитов. Чистоту выделения популяции лимфоцитов и подсчет концентрации проводили на гематологическом анализаторе АВХ Micros 60 (HORIBA АВХ Diagnostics Inc, Франция). Обычно среди выделенных клеток процент лимфоцитов составлял около 80-90%. Лимфоциты либо непосредственно использовали для опыта, либо помещали в культуральные чашки и инкубировали в стандартных условиях (37°С, 5% СО2).
Активация лимфоцитов человека
Лимфоциты, выделенные из периферической крови человека, активировали следующим образом. Непосредственно после выделения к культуральной среде лимфоцитов добавляли фитогемагглютинин (1 мкг/мл) (ФГА, ПанЭко), интерлейкин-2 (50 ЕД/мл), («Ронколейкин», БИОТЕХ, Россия). Клетки культивировали в условиях высокой влажности при 37°С и 5% СО2 в течение 72-120 часов.
Трансфекция Т-лимфоцитов человека
Лимфоциты отмывали PBS в количестве 2-3*106 кл. (подсчет производился на гематологическом анализаторе Advia 60 (Hematology system)), осаждали (центрифугирование при 3 тыс. об/мин в течение 5 мин). Осадок ресуспендировали в 100 мкл специализированного буфера (плотность клеток в растворе составила 2*107 кл/мл). Подготавливали чашки Петри с 5 мл прогретой среды RPMI (10% FBS). Трансфекцию неактивированных Т-лимфоцитов человека проводили с использованием набора «Human Т Cell Nucleofector Kit», программы V-024, обеспечивающей высокую эффективность трансфекции, на приборе Amaxa Nucleofector (Lonza). Проводили электропорацию. Для трансфекции одного образца использовали 2-3 млн клеток. Переносили клетки в культуральную среду, перемешивали и помещали в инкубатор.
Трансфекцию активированных Т-лимфоцитов человека проводили с использованием набора «Human Т Cell Nucleofector Kit», программ Т-020 и Т-023, на приборе Amaxa Nucleofector (Lonza). Для трансфекции одного образца использовали 4-5 млн клеток.
Выделение РНК из клеток и ОТ-ПЦР
Для подтверждения экспрессии в трансфицированных клетках конструкций, кодирующих химерные Т-клеточные рецепторы, через 48 часов после трансфекции из клеток выделяли тотальную РНК.
Выделение тотальной РНК проводили по стандартным протоколам компании-производителя наборов для выделения РНК (RNeasy Mini Kit (50), QIAGEN, Германия). На одно выделение брали около 106 клеток. Клетки осаждали центрифугированием в течение 5 мин при 1500 об/мин, осадок дважды промывали в 1 мл PBS, центрифугировали (5 мин, 1500 об/мин). Предварительно готовили буфер RLT (для выделения РНК из 106 клеток добавляли 3,5 мкл β-Mercaptoethanol (QIAGEN) к 350 мкл пустого буфера RLT (QIAGEN) из набора RNeasy Mini Kit), буфер PRE разбавляли 96% этанолом до рабочей концентрации (для выделения РНК из 106 клеток добавляли 400 мкл 96% этанола к 100 мкл пустого буфера PRE (QIAGEN) из набора RNeasy Mini Kit). К полученному осадку клеток добавляли 350 мкл лизирующего буфера RLT, пипетировали клетки до полного растворения. К гомогенизированному лизату добавляли равный объем (350 мкл) 70% этанола, тщательно перемешивали. Образец наносили на колонку (RNeasy Mini Spin Columns (QIAGEN)) для последующего осаждения РНК на мембране колонки, центрифугировали 15 с при 10000 об/мин. Переносили верхнюю часть колонки, содержащую мембрану, в чистую пробирку, добавляли 500 мкл буфера PRE и центрифугировали 15 с при 10000 об/мин. Удаляли раствор, прошедший сквозь мембрану, затем добавляли 500 мкл буфера PRE и центрифугировали 2 мин при 15000 об/мин для высушивания мембраны. После этого переносили верхнюю часть колонки в чистую пробирку и добавляли 40 мкл воды, свободной от РНаз, непосредственно на мембрану для смывания РНК. Пробирки центрифугировали 1 мин при 10000 об/мин. Выделенную РНК хранили при температуре -70°С.
Обратную транскрипцию проводили по стандартному протоколу компании - производителя наборов для ОТ-ПЦР («ОТ-ПЦР», Силекс, Россия). Из расчета на один образец на льду смешивали 0.1-5 мкг (2 мкл) тотальной РНК и 0.5 нг (1 мкл) случайных гексапраймеров, добавляли воды, свободной от Рназ, 15 мкл. Препарат перемешивали, капли осаждали кратковременным центрифугированием. Смесь инкубировали при 70°С в течение 5 мин, после чего переносили в лед, капли осаждали кратковременным центрифугированием. На льду добавляли 10×ОТ буфера из расчета на полный объем 25 мкл (2,5 мкл), 4 мкл 2,5 мМ смеси дНТФ и 100 ед. (0,5 мкл) M-MLV обратной транскриптазы. Так как использовали случайные гексапраймеры, реакционную смесь предварительно прогревали при температуре 25°С в течение 10 мин, а затем переносили на 37°С и инкубировали 1 ч. Реакцию останавливали прогреванием при 70°С в течение 10 мин, охлаждали во льду. Полученную кДНК непосредственно сразу же использовали в качестве матрицы для проведения ПЦР или же хранили при -20°С. В качестве контроля использовали пробы, не содержащие обратной транскриптазы.
Проведение ПЦР. ПЦР проводили по стандартному протоколу компании - производителя наборов для ПЦР («Набор реактивов для проведения ПЦР-РВ», Синтол, Россия). ПЦР проводили в объеме реакционной смеси (25 мкл), содержащей 10 мкл 2,5× реакционной смеси (Синтол), праймеры (в конечной концентрации 10 пмоль/мкл, 1 мкл), 1 мкг (1 мкл) кДНК, 12 мкл воды, свободной от РНаз. Температура отжига и время элонгации праймеров были адаптированы к оптимальным условиям ПЦР для каждой используемых пар праймеров. Температуры денатурации и элонгации и соответствующие времена были подобраны на основании стандартных условий функционирования Taq полимеразы. Реакцию проводили в амплификаторе OmniGene (Hybaid, Великобритания). Каждая реакция включала начальную денатурацию в течение 2 мин при 94°С. Температура денатурации в циклах также равнялась 94°С, время денатурации - 20 сек. Температура отжига праймеров равнялась 60°С, время отжига составляло 30 сек. Элонгацию проводили при 72°С в течение 30 сек. Амплификация в каждом случае включала 30 циклов.
Продукты амплификации разделяли методом электрофореза в 1,5% или 2% агарозном геле, приготовленном на буфере ×1 ТВЕ, содержащем этидиум бромид в конечной концентрации 0.5 мкг/мл., в буфере 1×ТВЕ при напряженности электрического поля 5-10 В/см.
Цитофлуорометрический анализ
Цитофлуорометрический анализ проводился на проточном цитофлуориметре Beckman Coulter (USA), в котором в качестве источника излучения используется аргоновый лазер (λ=488 нм). Полученные данные обрабатывали, используя программу FloMax, версия 3.0. Клетки осаждали центрифугированием при 1000 об/мин в течение 5-10 мин. Осадок промывали в 1 мл раствора PBS дважды. К полученному осадку добавляли 2 мл PBS и тщательно пипетировали. Полученный препарат клеток либо сразу анализировали на проточном цитофлуориметре, либо клетки затем подвергали фиксации и пермеабилизации и окраске с помощью антител.
Детекция ζ-цепи Т-клеточного рецептора в клетках MCF-7
Фиксацию и пермеабилизацию клеток для мечения с помощью антител проводили с использованием набора «Fixation and permeabilization kit for flow cytometry» (DakoCytomation, Дания-США) согласно прилагаемой инструкции. Сухой остаток анализируемых клеток, содержащий не более 2 млн. клеток, суспендировали в 100 мкл раствора PBS, разделяли на 2 равные части (опытный образец и изотипический контроль) и к каждой части добавляли 100 мкл фиксирующего реагента А. Клетки тщательно суспендировали и инкубировали при комнатной температуре в течение 15 мин. Образцы промывали в 2 мл PBS, клетки осаждали центрифугированием при 1000 об/мин в течение 5 минут, удаляли супернатант до жидкого остатка в 50 мкл. Затем клетки суспендировали для получения однородной суспензии, добавляли по 100 мкл пермобилизирующего раствора В к каждому образцу и тут же к образцам добавляли антитела на ζ-цепь (Dako), мышиные антитела на IgG (Dako, Дания) в качестве изотопического контроля соответственно, тщательно суспендировали. Образцы инкубировали в течение 15 мин в темноте, затем промывали в 2 мл PBS, осаждали клетки центрифугированием при 1000 об/мин в течение 5 минут. К полученному осадку добавляли 2 мл PBS и тщательно пипетировали. После этого препараты сразу же анализировали на проточном цитофлуориметре.
Анализ связывания рецепторов, экспрессируемых клетками MCF-7, с СА125
Для оценки способности экспрессируемых химерных Т-клеточных рецепторов клеток MCF-7 связывать СА125, клетки через 24 и 48 часов после трансфекции инкубировали с раствором ракового антигена, меченного флуоресцентным красителем ФИТЦ (СА125-ФИТЦ) (6 мг/мл), в течение 30 минут. После чего клетки анализировали на проточном цитофлуориметре.
Анализ связывания рецепторов, экспрессируемых лимфоцитами, с СА125
Оценку способности экспрессируемых химерных Т-клеточных рецепторов на поверхности лимфоцитов связывать СА125 проводили методом непрямого иммуноцитохимического окрашивания. Для плазмиды p1CA1 в качестве антител использовали биотинилированные X181 (ООО «ХЕМА», Россия), для плазмиды р3СА2-Х75, для р3СА3 - X189 (ООО «ХЕМА», Россия). Клетки через 48 часов после трансфекции центрифугировали при 1500 об./мин в течение 5 мин, промывали в 1 мл раствора PBS (ПанЭко), осадок пипетировали в 100 мкл раствора PBS. Антитела добавляли в количествах, рекомендованных производителем (3 мкл/ 106 клеток), инкубировали в течение 20 мин при комнатной температуре. После инкубации препарат дважды отмывали центрифугированием при 1500 об/мин в течение 5 мин, промывали в 1 мл раствора PBS, осадок пипетировали в 100 мкл раствора PBS. Для выявления антител к клеткам добавляли стрептавидин, меченый фикоэритрином (РЕ) (Beckman Coulter), в количествах, рекомендованных производителем (10 мкл/тест), инкубировали 20 мин при комнатной температуре в темноте. После чего препарат дважды отмывали центрифугированием при 1500 об/мин в течение 5 мин в растворе PBS. Анализ препаратов сразу же проводили на проточном цитофлуориметре. В качестве отрицательного контроля использовали лимфоциты, к которым был добавлен только стрептавидин, конъюгированный с РЕ.
Оценку способности связывать СА125 активированными и неактивированными лимфоцитами человека, трансфецированными плазмидами p1CA1 - р3СА3, проводили спустя 24 часа после трансфекции методами прямого и непрямого иммуноцитохимического окрашивания, анализ препаратов проводили на проточном цитофлуориметре, вычисления - с использованием программного обеспечения Bekman Coulter (USA). Активацию лимфоцитов проводили добавляя к культуральной среде фитогемагглютинин (1 мкг/мл) и интерлейкин-2 (50 ЕД/мл), в течение 72-120 часов.
В методе прямого иммуноцитохимического окрашивания использовали раствор антигена, меченного флуоресцентным красителем ФИТЦ (СА125-ФИТЦ), инкубация суспензии клеток с раствором СА125-ФИТЦ проводилась в течение 30 минут. При непрямом иммуноцитохимическом окрашивании суспензию лимфоцитов инкубировали в течении 30 минут с СА125 не несущим флуоресцентной метки, а затем добавляли стрептавидин, конъюгированный с РЕ (в данном случае оценивали количество клеток, положительных по РЕ - FL-2).
Изучение функциональности, созданных рекомбинантных плазмид, на модели клеточной линии MCF-7
Отработку метода проводили, используя клетки человека линии MCF-7 (клетки рака молочной железы человека). Выбор данной клеточной линии был связан с простотой культивирования, высокой скоростью роста и высокой эффективностью трансфекции. Кроме того, для проверки экспрессии цитоплазматических доменов химерного Т-клеточного рецептора, кодируемого плазмидами серии рСА, необходимо использовать клетки, не экспрессирующие в норме ζ-цепи Т-клеточного рецептора.
Пример 3. Изучение экспрессии цитоплазматического фрагмента химерных Т-клеточных рецепторов, кодируемых плазмидами p1CA1, р3СА2 и р3СА3 в клетках.
Одним из свидетельств функциональности созданных рекомбинантных плазмид является появление на поверхности клеток MCF-7 после трансфекции иммунореактивных эпитопов ζ-цепи Т-клеточного рецептора (CD3ζ). Для проверки экспрессии ζ-цепи клетки MCF-7, трансфецированные с помощью реагента PolyFect и плазмиды p1CA1 спустя 24 часа после трансфекции были обработаны мечеными антителами к ζ-цепи Т-клеточного рецептора и подвергнуты анализу на проточном цитофлуориметре. Был обнаружен положительный сигнал связывания антител с 16,5% клеток в культуре (Рисунок 3Б). В контрольном образце клеток, окрашенных мышиными антителами к IgG (Dako, изотипический контроль), сигнал связывания антител отсутствовал (Рисунок 3А). Полученные данные свидетельствуют о наличии экспрессии химерного иммунорецептора, кодируемого плазмидой p1CA1 и его корректной внутриклеточной сборке.
В экспериментах аналогичного дизайна (анализ спустя 24 часа после трансфекции, окрашивание клеток антителами к CD3ζ) с использованием рекомбинантных плазмидных ДНК р3СА2, р3СА3, была продемонстрирована экспрессия ζ-цепи в 22,3% и 17% клеток соответственно.
Анализ клеток MCF-7 после трансфекции плазмидами р3СА2 и р3СА3 показал, что Т-клеточные рецепторы, кодируемые исследуемыми плазмидными ДНК, также правильно собираются на поверхности клеток, о чем свидетельствуют данные по окраске антителами к внутриклеточному фрагменту ζ-цепи Т-клеточного рецептора и более высокому уровню экспрессии ζ-цепи относительно p1CA1.
Таким образом было показано, что сборка химерного иммунорецептора протекает корректно в случае всех исследованных плазмид. Однако были обнаружены индивидуальные различия плазмид, выражающиеся в различном количественном уровне экспрессии и проценте клеток.
Анализ связывания растворимой формы СА125 с клетками MCF-7, трасфецированными плазмидами p1CA1, р3СА2, р3СА3
Для оценки способности связывать СА125 трансфецированные клетки MCF-7, спустя 24 и 48 часов после трансфекции, инкубировали с раствором антигена, меченного флуоресцентным красителем ФИТЦ (СА125-ФИТЦ), в течение 30 минут. На Рисунках 4, 5, 6, 7 приведены результаты связывания, полученные методом проточной цитометрии.
Как видно из сравнения рисунков 6а, 6б клетки, трансфецированные плазмидой p1CA1, связывали СА125-ФИТЦ спустя 24 часа после трансфекции. Сравнимый результат был получен при увеличении времени инкубации клеток до 48 часов после трансфекции (Рисунок 4).
Таким образом, было показано, что химерный иммунорецептор, экспрессирующийся в клетках MCF-7, трансфецированных плазмидой p1CA1, способен связывать антиген СА125 в растворе. Причем эта способность сохранялась в течение не менее, чем 48 часов после трансфекции.
При исследовании плазмид р3СА2 и р3СА3 было показано, что клетки, трансфецированные данными плазмидами также связывали СА125-ФИТЦ спустя 24 и 48 часов после трансфекции (Рисунок 5, 7). Таким образом, Т-клеточный рецептор, кодируемый всеми исследуемыми конструкциями и экспрессируемый MCF-7, способен связывать антиген СА125 в растворе.
Как видно из сравнения рисунков 6а, 6б клетки, трансфецированные плазмидой p1CA1, связывали СА125-ФИТЦ спустя 24 часа после трансфекции. Сравнимый результат был получен при увеличении времени инкубации клеток до 48 часов после трансфекции (Рисунок 4).
Таким образом, было показано, что химерный иммунорецептор, экспрессирующийся в клетках MCF-7, трансфецированных плазмидой p1CA1, способен связывать антиген СА125 в растворе. Причем эта способность сохранялась в течение не менее, чем 48 часов после трансфекции.
При исследовании плазмид р3СА2 и р3СА3 было показано, что клетки, трансфецированные данными плазмидами также связывали СА125-ФИТЦ спустя 24 и 48 часов после трансфекции (Рисунок 5, 7). Таким образом, Т-клеточный рецептор, кодируемый всеми исследуемыми конструкциями и экспрессируемый MCF-7, способен связывать антиген СА125 в растворе.
Количественный уровень связывания растворимой формы СА125 с трансфецированными клетками MCF-7 варьировал при использования различных вариантов генетических конструкций, кодирующих химерные иммунорецепторы.
Получены значения относительного уровня связывания ФИТЦ-СА125 на поверхности трансфецированных клеток, результаты проточной цитофлуориметрии. В частности, наиболее высокий уровень связывания СА125 наблюдался в культуре клеток, трансфецированных генотерапевтической конструкцией 3рСА2. Анализ проводился в двух временных точках - 24 и 48 часов после трансфекции. Однако строгой временной зависимости уровня связывания ФИТЦ-СА125 выявлено не было.
Показано, что лимфоциты периферической крови человека, трансфецированные плазмидой с химерным рецептором обладают цитотоксическими свойствами по отношению к опухолевым клеткам, экспрессирующим СА125.
Разработка метода трансфекции на лимфоцитах человека и отбор оптимального варианта генетической конструкции, кодирующей химерный антигенный рецептор
Выбор метода трансфекции лимфоцитов человека
После предварительной отработки метода трансфекции и оценки функциональности полученных рекомбинантных плазмид на клетках линии MCF-7 дальнейшую разработку метода проводили непосредственно на лимфоцитах человека. Предварительный этап работы заключался в выборе типа Т-клеток и метода трансфекции Т-клеток. Изначально для исследований использовали не активированные лимфоциты человека. Это связано с меньшим риском при клиническом применении не пролиферирующих покоящихся клеток по сравнению с активированными и пролиферирующими. Однако анализ литературных данных показал, что эффективная трансфекция, экспрессия химерного иммунорецептора и его способность к связыванию с соответствующим антигеном, наблюдается только в случае использования активированных лимфоцитов.
Активацию лимфоцитов проводили с помощью рекомбинатного интерлейкина-2 человека (50 U/мл) одновременно со стимуляцией пролиферации с помощью фитогемагглютенина в течение 3 суток. По истечении этого времени доля CD3+ Т-лимфоцитов в культуре составляла около 60%.
В связи с рядом особенностей лимфоцитов человека эффективную трансфекцию можно осуществить методом электропорации или же с помощью лентивирусов. Однако учитывая возможные риски в ходе клинического применение создаваемого лекарственного средства было решено отказаться от использования лентивирусной трансдукции в пользу метода трансфекции с помощью электропорации. Электропорацию лимфоцитов человека проводили с использованием прибора Amaxa Nucleofector (Lonzabio). Эффективность трансфекции лимфоцитов человека таким способом для плазмиды, содержащей ген зеленого флуоресцентного белка GFP, достигала 40%.
Анализ экспрессии плазмидных генов в трансфецированных лимфоцитах
Исследование экспрессии плазмидных генов, кодирующих химерные мономолекулярные иммунорецепторы, проводили методом ОТ-ПЦР в клетках линии MCF-7 и лимфоцитах человека спустя 24 часа после трансфекции плазмидами p1CA1, р3СА2, р3СА3. Наличие идентифицируемых с помощью электрофореза в агарозном геле продуктов амплификации с использованием праймеров, специфичных к фрагментам генов κ- и ζ-цепей иммуноглобулинов, входящих в состав распознающей части иммунорецептора (scFv) подтвердило присутствие соответствующих мРНК-транскриптов в клетках. Результаты ОТ-ПЦР для плазмиды р3СА2 представлены на Рисунке 8.
Анализ связывания растворимой формы СА125 с лимфоцитами человека, трансфицированными плазмидами p1CA1, р3СА2, р3СА3
Для оценки способности связывать СА125 трансфицированные плазмидами p1CA1, р3СА2, р3СА3 нестимулированные лимфоциты периферической крови человека, спустя 24 и 48 часов после трансфекции, инкубировали с раствором антигена, меченного флуоресцентным красителем ФИТЦ (СА125-ФИТЦ), в течение 30 минут. Методом проточной цитофлуориметрии оценивали количество клеток, несущих на поверхности СА125-ФИТЦ. Анализ диаграмм связывания СА125-ФИТЦ лимфоцитами, трансфицированными исследуемыми плазмидами показал, следующий процент связывания: p1CA1 - 28%, р3СА2 - 43%, р3СА3 - 36%. Таким образом, при исследовании способности лимфоцитов, трансфецированных плазмидами p1CA1, р3СА2, р3СА3, связывать СА125, было обнаружено, что наиболее высокий уровень связывания СА125 отмечается для лимфоцитов, трансфецированных плазмидой р3СА2.
Помимо этого, был также проведен цитофлуориметрический анализ связывания ФИТЦ-СА125 с активированными ИЛ-2/ФГА лимфоцитами, трансфецированными серией плазмид p1CA1, р3СА2, р3СА3. Было показано, что уровень связывания СА125 такими клетками существенно превосходит уровень связывания с нестимулированными покоящимися лимфоцитами, трансфецированными теми же плазмидами (p1CA1 - 31, р3СА2 - 72%, р3СА3 - 56%). В результате проведенного эксперимента было убедительно продемонстрировано, что трансфецированные различными вариантами плазмид и пре-активированные ИЛ-2 лимфоциты обладают значительно более высокой способностью к связыванию растворимого СА125 по сравнению с активированными, но не трансфецированными лимфоцитами.
Более того было показано, что предварительная активация лимфоцитов ИЛ-2 приводит к резкому увеличению способности трансфецированных клеток связываться с СА125 по сравнению с трансфецированными, но не активированными клетками. Необходимость активации трансфецированных лимфоцитов является важным результатом для дальнейшей разработки плана доклинического исследования лекарственного средства.
Т.о. было показано, что химерная конструкция р3СА2 обладает большей эффективностью и является более перспективной для дальнейшего исследования. На основании совокупности полученных в экспериментах in vitro данных для дальнейшей работы была выбрана рекомбинантная плазмида р3СА2 (pCI/3CA2-CAR3g).
Данный вариант генетической конструкции эффективно трансфецирует как перевиваемую культуру MCF-7, так и культуру человеческих лимфоцитов, и обеспечивает экспрессию на поверхности клеток функциональных молекул химерных иммунорецепторов. Клон антител 3СА2, использованный при создании генетической конструкции р3СА2 способен связываться как с молекулами растворимой формы СА125, так и с трансмембранной формой антигена, экспрессирующейся на поверхности клеточных линий.
Исследование цитотоксического эффекта лимфоцитов человека, трансфецированных р3СА2 в отношении СА125-позитивных опухолевых клеточных линий человека
Исследование цитотоксического эффекта лимфоцитов человека, трансфецированных р3СА2 в отношении СА125-позитивных опухолевых клеточных линий человека (OVCAR-3 и OVKATE) и СА125-негативных клеточных линий (MCF-7 и НЕК293). Линия НЕК293 была использована как дополнительная неопухолевая культура, не экспрессирующая СА125.
В качестве методов оценки противоопухолевого цитотоксического эффекта использован метод ЛДГ-теста. Данный метод позволил лучше провести оценку клеточной гибели, в частности дифференцировать процент апоптоза и некроза, индуцируемого в опухолевых клетках при воздействии лимфоцитов, трансфецированных р3СА2 (p3CA2(pCI/3CA2- CAR3g).
Исследование цитотоксичности трансфицированных р3СА2 лимфоцитов с помощью ЛДГ-теста
Было проведено исследование специфической цитотоксической активности лимфоцитов, трансфицированных лекарственным средством р3СА2, в отношении культур злокачественных новообразований рака молочной железы (MCF-7) и рака яичника (OVCAR-3, OVKATE) с применением ЛДГ-теста, а также для культуры НЕК293 - эмбриональная почка. ЛДГ-тест, в отличие от МТТ-теста, показывающего количество живых, метаболически активных клеток, отражает количество погибших клеток за все время инкубации (отношение активности ЛДГ в среде инкубации в опытной лунке и в контрольной пропорционально количеству погибших клеток). Объектом исследования цитотоксичности лимфоцитов с химерным антигенным рецептором служили СА125-позитивные культуры клеток опухолей человека OVCAR-3, OVKATE. В качестве СА125-негативных клеточных линий использовали MCF-7 и HEK293. ЛДГ-тест ставился через 24 и 48 часов инкубации трансфицированных лимфоцитов с клетками-мишенями. В серии экспериментов были использованы два значения количества вносимых лимфоцитов 0,5 млн. и 0,25 млн. с целью проверки возможности снижения количества лимфоцитов-эффекторов.
Как показано на рисунке 9, для клеток линии OVCAR-3, внесение лимфоцитов, трансфецированных р3СА2, вызывает гибель клеток исследуемой культуры. Эффект р3СА2 сопоставим с эффектом от внесения ЛАК, цитотоксический эффект пропорционален времени инкубации и увеличивается примерно в 2 раза при увеличении времени воздействия до 48 часов. Также показано, что снижение количества вносимых лимфоцитов, трансфецированных р3СА2 в 2 раза приводит к снижению цитотоксического эффекта в 1,3 раза при инкубации в течение 24 часов, и незначительному снижению в 1,1 раза при увеличении времени инкубации до 48 часов.
Результаты ЛДГ-теста для культуры OVKATE представлены на русинке 10, показано, что наибольший эффект оказывают лимфоциты, трансфецированные р3СА2, эффект пропорционален времени инкубации, но при уменьшении количества вносимых лимфоцитов снижается в 1,3 раза при инкубации 24 часа и в 1,1 раза при инкубации 48 часов. Что дает основания для возможного снижения количества лимфоцитов трансфецированных р3СА2 при получении адекватного цитотоксического эффекта.
При исследовании цитотоксического эффекта р3СА2 и сравнении с эффекта ЛАК для клеток неэкспрессирующих СА125 (MCF-7, HEK293), методом ЛДГ-теста было показано, что цитотоксический эффект ЛАК (активированные лимфоциты совместно с опухолевыми клетками) для обеих культур превосходит эффект, оказываемый лимфоцитами, трансфецированными р3СА2 (рисунки 11, 12).
Также показано усиление эффекта при увеличении времени инкубации до 48 часов и увеличение количества мертвых клеток при увеличении количества вносимых лимфоцитов.
Т.о. в ходе исследования специфической эффективности лекарственного средства р3СА2 методом ЛДГ-теста было показано, что лимфоциты, трансфецированные р3СА2, проявляют стойкую цитотоксическую активность (уровень ЛДГ в опытных лунках более чем в три с половиной раза выше контроля) в отношении опухолевых культур рака яичника, экспрессирующих СА125. Данный эффект превосходит цитотоксический эффект ЛАК и имеет зависимость от времени инкубации и, в меньшей степени, от количества внесенных лимфоцитов. В отношении культур клеток, неэкспрессирующих СА125, показан низкий цитотоксический эффект р3СА2, и отсутствие достоверных различий в эффектах ЛАК для СА-негативных и СА-позитивных линиях. Данное отличие свидетельствует о специфичности воздействия р3СА2 в отношении клеток, экспрессирующих СА125.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
VL:
Nucleotide Seq SEQ ID NO:5
GACATTGTGCTGACACAGTCTCCTGCTTCCTTAGCTGTATCTCTGGGGCAGAGGGCCACCATCTCATACAGGGCCAGCAAAAGTGTCAGTACATCTGGCTATAGTTATATGCACTGGAACCAACAGAAACCAGGACAGCCACCCAGACTCCTCATCTATCTTGTATCCAACCTAGAATCTGGGGTCCCTGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACCCTCAACATCCATCCTGTGGAGGAGGAGGATGCTGCAACCTATTACTGTCAGCACATTAGGGAGCTTACACGTTCGGAGGGGGGACCAAGCTGGAAATAA
Am Ac Seq SEQ ID NO:2
DIVLTQSPASLAVSLGQRATISYRASKSVSTSGYSYMHWNQQKPGQPPRLLIYLVSNLESGVPARFSGSGSGTDFTLNIHPVEEEDAATYYCQHIRELTRSEGGPSWK
VH:
Nucleotide Seq SEQ ID NO:6
CAGGTTCAGTTGCAGCAGTCTGGAGCTGAGCTGATGAAGCCTGGGGCCTCAGTGAAGATCTCCTGCAAGGCTACTGGCTACACATTCAGTCTCTACTGGATAGAGTGGGTAAAGCAGAGTCCTGGACATGGCCTTGAGTGGATTGGAGAAATTTTACCTGGAACTGACACTACTAACTACAATGAGAAGTTCAAGGGCAAGGCCGCATTCACTGCAGATACATCCGCCAACACAGCCTACATGCAACTCAGCAGCCTGACATCTGAGGACTCTGCCGTCTATTACTGTGCAAGATGGGACTACTTTGGTAGTCGTGACTCCTGGGGCCAAGGCACCAGTCTCACAGTCTCCTCA
Am Ac Seq SEQ ID NO:1
QVQLQQSGAELMKPGASVKISCKATGYTFSLYWIEWVKQSPGHGLEWIGEILPGTDTTNYNEKFKGKAAFTADTSANTAYMQLSSLTSEDSAVYYCARWDYFGSRDSWGQGTSLTVSS
scFv
Х181
Am Ac Seq SEQ ID NO:3
DIVLTQSPASLAVSLGQRATISYRASKSVSTSGYSYMHWNQQKPGQPPRLLIYLVSNLESGVPARFSGSGSGTDFTLNIHPVEEEDAATYYCQHIRELTRSEGGPSWKGGGGSGGGGSGGGGSQVQLQQSGAELMKPGASVKISCKATGYTFSLYWIEWVKQSPGHGLEWIGEILPGTDTTNYNEKFKGKAAFTADTSANTAYMQLSSLTSEDSAVYYCARWDYFGSRDSWGQGTSLTVSS
Nucleotide Seq SEQ ID NO:7
GACATTGTGCTGACACAGTCTCCTGCTTCCTTAGCTGTATCTCTGGGGCAGAGGGCCACCATCTCATACAGGGCCAGCAAAAGTGTCAGTACATCTGGCTATAGTTATATGCACTGGAACCAACAGAAACCAGGACAGCCACCCAGACTCCTCATCTATCTTGTATCCAACCTAGAATCTGGGGTCCCTGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACCCTCAACATCCATCCTGTGGAGGAGGAGGATGCTGCAACCTATTACTGTCAGCACATTAGGGAGCTTACACGTTCGGAGGGGGGACCAAGCTGGAAATAAggtggaggcggttcaggcggaggtggctctggcggtggcggatcgCAGGTTCAGTTGCAGCAGTCTGGAGCTGAGCTGATGAAGCCTGGGGCCTCAGTGAAGATCTCCTGCAAGGCTACTGGCTACACATTCAGTCTCTACTGGATAGAGTGGGTAAAGCAGAGTCCTGGACATGGCCTTGAGTGGATTGGAGAAATTTTACCTGGAACTGACACTACTAACTACAATGAGAAGTTCAAGGGCAAGGCCGCATTCACTGCAGATACATCCGCCAACACAGCCTACATGCAACTCAGCAGCCTGACATCTGAGGACTCTGCCGTCTATTACTGTGCAAGATGGGACTACTTTGGTAGTCGTGACTCCTGGGGCCAAGGCACCAGTCTCACAGTCTCCTCA
pCI/3CА2-CAR3g
Nucleotide Seq SEQ ID NO:4
GAATTCGCCACC ATGGAGACAGACACACTCCTGTTATGGGTACTGCTGCTCTGGGTT
CCAGGTTCCACTGGTGACATTGTGCTGACACAGTCTCCTGCTTCCTTAGCTGTATCTCTGGGGCAGAGGGCCACCATCTCATACAGGGCCAGCAAAAGTGTCAGTACATCTGGCTATAGTTATATGCACTGGAACCAACAGAAACCAGGACAGCCACCCAGACTCCTCATCTATCTTGTATCCAACCTAGAATCTGGGGTCCCTGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACCCTCAACATCCATCCTGTGGAGGAGGAGGATGCTGCAACCTATTACTGTCAGCACATTAGGGAGCTTACACGTTCGGAGGGGGGACCAAGCTGGAAATAAGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGTGGCGGATCGCAGGTTCAGTTGCAGCAGTCTGGAGCTGAGCTGATGAAGCCTGGGGCCTCAGTGAAGATCTCCTGCAAGGCTACTGGCTACACATTCAGTCTCTACTGGATAGAGTGGGTAAAGCAGAGTCCTGGACATGGCCTTGAGTGGATTGGAGAAATTTTACCTGGAACTGACACTACTAACTACAATGAGAAGTTCAAGGGCAAGGCCGCATTCACTGCAGATACATCCGCCAACACAGCCTACATGCAACTCAGCAGCCTGACATCTGAGGACTCTGCCGTCTATTACTGTGCAAGATGGGACTACTTTGGTAGTCGTGACTCCTGGGGCCAAGGCACCAGTCTCACAGTCTCCTCATCTAGAGCGAAGCCCACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGATGATCCCAAACTCTGCTACCTGCTGGATGGAATCCTCTTCATCTATGGTGTCATTCTCACTGCCTTGTTCCTGAGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAAACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGCTAACAGCCAGGGGATTTCACCACTCAAAGGCCAGACCTGCAGACGCCCAGATTATGAGACACAGGATGAAGCATTTACAACCCGGTTCACTCTTCTCAGCCACTGAAGTATCCCGGG
| название | год | авторы | номер документа |
|---|---|---|---|
| МОНОМОЛЕКУЛЯРНЫЙ ХИМЕРНЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР К РАКОВО-ЭМБРИОНАЛЬНОМУ АНТИГЕНУ | 2015 |
|
RU2650858C2 |
| МОНОМОЛЕКУЛЯРНЫЙ ХИМЕРНЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР К РАКОВО-ЭМБРИОНАЛЬНОМУ АНТИГЕНУ | 2015 |
|
RU2652955C1 |
| ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО К РАКОВО-ЭМБРИОНАЛЬНОМУ АНТИГЕНУ, ХИМЕРНЫЙ МОНОМОЛЕКУЛЯРНЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР, ВЕКТОР И КЛЕТКА-ХОЗЯИН ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ ТАКОГО РЕЦЕПТОРА И СПОСОБ ДИАГНОСТИКИ ИЛИ ЛЕЧЕНИЯ. | 2012 |
|
RU2522004C2 |
| КОНСТРУКЦИИ СЛИЯНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ АНТИТЕЛ С ПОВЫШЕННЫМИ АФФИННОСТЬЮ СВЯЗЫВАНИЯ Fc-РЕЦЕПТОРА И ЭФФЕКТОРНОЙ ФУНКЦИЕЙ | 2010 |
|
RU2623167C2 |
| ИДЕНТИФИКАЦИЯ ОПУХОЛЕАССОЦИИРОВАННЫХ АНТИГЕНОВ ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ | 2013 |
|
RU2644686C2 |
| ОПУХОЛЕСПЕЦИФИЧНОЕ АНТИТЕЛО ПРОТИВ EGFR И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2730605C2 |
| ПЕРЕНАПРАВЛЕНИЕ КЛЕТОЧНОГО ИММУНИТЕТА ПОСРЕДСТВОМ ХИМЕРНЫХ РЕЦЕПТОРОВ | 1996 |
|
RU2167676C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР С КОСТИМУЛИРУЮЩИМ ДОМЕНОМ 4-1BB | 2020 |
|
RU2830540C2 |
| СПОСОБ ПОДАВЛЕНИЯ ВИЧ-ИНФИЦИРОВАННЫХ КЛЕТОК МЛЕКОПИТАЮЩЕГО И БЕЛКОВЫЙ РЕКОМБИНАНТНЫЙ РЕЦЕПТОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1995 |
|
RU2165703C2 |
| МНОГОЦЕПОЧЕЧНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР И ЕГО ПРИМЕНЕНИЯ | 2013 |
|
RU2663725C2 |

Настоящее изобретение относится к области иммунологии. Предложены одноцепочечное антитело к опухоль-специфичному антигену СА125, химерный мономолекулярный Т-клеточный рецептор к опухоль-специфичному антигену СА125. Также рассмотрены нуклеиновая кислота, вектор экспрессии, клетка-хозяин. Данное изобретение может найти дальнейшее применение в терапии онкологических заболеваний. 5 н. и 2 з.п. ф-лы, 16 ил., 6 табл., 3 пр.
1. Одноцепочечное антитело к опухоль-специфичному антигену СА125, антигенсвязывающий сайт которого включает
(i) вариабельный участок Н цепи, представленный аминокислотной последовательностью SEQ ID NO: 1, и
(ii) вариабельный участок L цепи, представленный аминокислотной последовательностью SEQ ID NO: 2.
2. Одноцепочечное антитело к опухоль-специфичному антигену СА125 по п. 1, представленное аминокислотной последовательностью SEQ ID NO: 3.
3. Химерный мономолекулярный Т-клеточный рецептор к опухоль-специфичному антигену СА125, включающий одноцепочечное антитело по любому из пп. 1, 2.
4. Нуклеиновая кислота, кодирующая одноцепочечное антитело по любому из пп. 1, 2.
5. Вектор экспрессии, в который встроена нуклеиновая кислота по п. 4.
6. Вектор экспрессии по п. 5, отличающийся тем, что включает нуклеотидную последовательность SEQ ID NO: 4.
7. Клетка-хозяин, продуцирующая химерный мономолекулярный Т-клеточный рецептор к опухоль-специфичному антигену СА125 по п. 3, содержащая вектор по п. 5.
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| КИСЕЛЕВА ЯЮ и др | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2021-04-26—Публикация
2018-05-11—Подача