Изобретение относится к медицине, в частности к медицинской генетике и онкогематологии, и касается способа выявления мутаций F317L и F359V/C киназного домена BCR-ABL у больных хроническим миелоидным лейкозом (ХМЛ).
Несмотря на то что ингибиторы тирозинкиназ (ИТК) используются в терапии ХМЛ уже более 15 лет, не менее трети пациентов проявляют к ним резистентность (Овсянникова Е.Г. и др., Мутационный статус резистентных к иматинибу больных хроническим миелолейкозом. Онкогематология, 2012, т. 4, с. 16-23). Точечные мутации гена BCR-ABL, затрагивающие киназный домен между экзонами а3 и a11 гена ABL, являются наиболее частой причиной резистентности к ИТК, поскольку в результате изменения конформации белка BCR-ABL молекулы ингибиторов не могут с ним эффективно взаимодействовать. Определение мутационного статуса онкогена BCR-ABL является обязательным для больных ХМЛ с недостаточным ответом на терапию иматинибом, а также при переходе на терапию нилотинибом и дазатинибом. Наиболее часто встречающейся мутацией киназного домена BCR-ABL является T315I, при обнаружении которой используется препарат следующего поколения - понатиниб. Количественное определение мутантной формы гена BCR-ABLT315I, в том числе с применением аллель-специфичной полимеразной цепной реакции в реальном времени, является одним из диагностических критериев, которыми необходимо руководствоваться при ведении пациентов, демонстрирующих недостаточный ответ при стандартной терапии (Абдуллаев А.О. и др., Количественная оценка уровня транскрипта BCR-ABL T315I у больных хроническим миелоидным лейкозом при помощи аллель-специфичной полимеразной цепной реакции в режиме реального времени. Гематология и трансфузиология, 2014, т. 59, №4, с. 7-11). Мутации F317L и F359V/C, составляя каждая около 8,5% от количества всех встречающихся мутаций киназного домена, являются одной из основных причин резистентности к иматинибу и ИТК второго поколения. При выявлении мутаций F359V/C снижена эффективность лечения нилотинибом, поэтому назначается лечение дазатинибом; при обнаружении мутации F317L не рекомендована терапия дазатинибом, назначается нилотиниб. В связи с этим, представляется важной задачей разработка нового способа своевременного выявления мутаций F317L и F359V/C с целью корректировки применяемой терапии. Количественное определение найденных мутаций позволяет оперативно определять эффективность применяемой терапии относительно конкретного опухолевого клона, несущего мутацию. В основном определение мутационного статуса киназного домена гена BCR-ABL осуществляется с помощью прямого секвенирования продуктов полимеразной цепной реакции (ПЦР-продуктов). Секвенирование является достаточно точным, однако трудоемким и дорогостоящим методом. Метод полимеразной цепной реакции (ПЦР), в отличие от прямого секвенирования, характеризуется высокой чувствительностью. Анализ специфичности выявления мутации в гене BCR-ABL методом прямого секвенирования и ПЦР в реальном времени показывает сопоставимые результаты. Выявление экспрессии мутантных форм BCR-ABLF3I7L и BCR-ABLF359V/C у больных ХМЛ может быть использовано для диагностики резистентности к ингибиторам тирозинкиназ первого и второго поколения, а также для оценки чувствительности к проводимой терапии.
Известен способ определения уровня экспрессии BCR-ABLF317L и BCR-ABLF359V с помощью ПЦР в реальном времени (Ferri С. et al. Early detection and quantification of mutations in the tyrosine kinase domain of chimerical BCR-ABL1 gene combining high-resolution melting analysis and mutant-allele specific quantitative polymerase chain reaction, Leukemia & lymphoma, 2012, 54(3): 598-606). Способ включает следующие этапы:
1. Получение РНК из лейкоцитов с помощью реагента TRIzol (Invitrogen).
2. Получение кДНК с помощью смеси случайных гексамеров и обратной транскриптазы (M-MLV) (Invitrogen).
3. Амплификацию фрагмента ДНК 1313 п.о. с помощью праймеров BCR13-Fw tgtggacagtctggagtttcaca и ABL7-Rw agacgtcggacttgatggagaact. Для постановки ПЦР в реальном времени использовали тысячекратные разведения амплифицированного образца.
4. Анализ образцов и отрицательного контроля с помощью ПЦР в реальном времени в двух повторах для каждой реакции со специфическим праймером на мутацию и с праймером, определяющим «дикий тип». Количественное определение производили в конечном объеме 25 мкл с помощью реактива SYBR-Green (SYBR-Green Universal PCR Master Mix 2x (Roche)). Анализ проводили с помощью прибора Rotor-Gene real-time PCR platform (Qiagen).
Определение BCR-ABLF317L:
Общий прямой праймер: ATP-Fw tgcagtcatgaaagagatcaaa; специфические обратные праймеры для определения мутации: D F317La-Rw *aggaggttcccgtaggttatc, D F317Lb-Rw *aggaggttcccgtaggttatt, D F317Lc-Rw *gttcccgtaggtcgtgag; специфический обратный праймер для определения «дикого типа»: ND-Rw tttgatctctttcatgactgc.
Определение BCR-ABLF359V:
Общий прямой праймер: D-Fw gaacgccgtggtgctgct; специфический обратный праймер для определения мутации: DF359V-Rw *agcaagatctctgtggacgac; специфический обратный праймер для определения «дикого типа»: ND C-Rw tttcttctccaggtactcc.
Температурные условия: 50°С - 2 мин, 95°С - 5 мин, 95°С - 10 с 45 циклов, 60°С - 15 с и 72°С - 10 с (прототип).
Недостатками способа являются: наличие двух стадий ПЦР увеличивает время исследования; использование реактива SYBR-Green дает недостаточно специфичный результат; отсутствие калибровочной кривой для определения концентрации BCR-ABLF317L и BCR-ABLF359V в образце снижает точность получаемых результатов.
Задачей заявляемого изобретения является создание нового способа количественного определения мутаций F317L и F359V/C киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ, с более высокой точностью и специфичностью получаемых результатов и с сокращением времени исследования.
Технический результат заявляемого изобретения состоит в том, что создан новый способ количественного определения мутаций F317L и F359V/C киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ, который обладает более высокой чувствительностью и специфичностью определения количества мутантного клона за более короткое время.
Сущность способа состоит в следующем: способ основан на постановке ПЦР в реальном времени для количественного определения экспрессии мутантных форм гена BCR-ABLF317L и BCR-ABLF359V/C с использованием одной стадии ПЦР. Способ содержит аллель-специфические праймеры и специфические зонды и включает стандарты с известным числом копий исследуемого гена (плазмиды со вставкой участка химерных онкогенов BCR-ABLF3I7L и BCR-ABLF359V/C). В качестве объекта исследования использовали кДНК, полученную способом обратной транскрипции из РНК, выделенной из образцов крови больных хроническим миелоидным лейкозом, резистентных к ИТК.
Нуклеотидные последовательности праймеров, используемые для проведения детекции, представлены в Перечне последовательностей. Копия перечня последовательностей, представленная на машиночитаемом носителе, идентична перечню последовательностей в печатной форме.
В качестве праймеров для определения экспрессии BCR-ABLF3I7L использовали систему, состоящую из прямого праймера, SEQ ID NO: 1, и смеси обратных специфических праймеров на мутацию, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4. Для количественного определения BCR-ABLF317L использовали специфический зонд SEQ ID NO: 5. В качестве праймеров для определения экспрессии BCR-ABLF359V/C использовали систему, состоящую из прямого праймера, SEQ ID NO: 6, и смеси обратных специфических праймеров на мутацию, SEQ ID NO: 7, SEQ ID NO: 8. Для количественного определения BCR-ABLF359V/C использовали специфический зонд SEQ ID NO: 9. Число копий BCR-ABLF3I7L и BCR-ABLF359V/C в клинических образцах определяли по калибровочной кривой, которая строится по стандартам с известной концентрацией. Для определения общей экспрессии BCR-ABL использовали систему, состоящую из прямого праймера, SEQ ID NO: 10, обратного праймера, SEQ ID NO: 11, и специфического зонда SEQ ID NO: 12. Для определения экспрессии контрольного гена ABL использовали систему, состоящую из прямого праймера, SEQ ID NO: 13, обратного праймера, SEQ ID NO: 14, и специфического зонда SEQ ID NO: 15. Экспрессию BCR-ABLF317L вычисляли относительно общей экспрессии BCR-ABL и контрольного гена ABL по формуле: (Q BCR-ABLF3I7L cp./Q ABL ср.) / (Q BCR-ABL cp./Q ABL cp.)*100%. Экспрессию BCR-ABLF359V/C вычисляли относительно общей экспрессии BCR-ABL и контрольного гена ABL по формуле: (Q BCR-ABLF359V/C cp./Q ABL ср.) / (Q BCR-ABL cp./Q ABL ср.)* 100%.
Способ осуществляется следующим образом:
1. Выделение тотальной РНК из клинических образцов. РНК выделяли из ядерных клеток крови быстрым лизисом в гуанидин-изотиоцианатном буфере с последующей фенольной обработкой [Chomczynski P., Anal Biochem., 1987 Apr, 162(1): 156-9]. Этот способ позволяет получить наибольшее количество РНК из биологического материала.
2. Проведение реакции обратной транскрипции с получением кДНК. Реакционная смесь обратной транскрипции при синтезе кДНК содержит в общем объеме 25 мкл 2,0 мкг РНК, четыре основных dNTP в концентрации 1 мМ по каждому, 10 наномоль смеси случайных гексамеров, 50 мМ Трис-HCl, рН 8,3, 75 мМ хлорид калия, 3,0 мМ хлорид магния, 10 мМ дитиотреитола, 40 ед. ингибитора РНКаз (предпочтительно RNAsinпроизводства Promega, США), 200 ед. ревертазы M-MLV (предпочтительно производства Promega, США). При составлении реакционной смеси использовали 5х буфер для обратной транскрипции (предпочтительно производства Promega, США). Инкубировали при 37°С в течение 45 мин, затем прогревали 2 мин при 94°С для остановки реакции.
3. Проведение реакции амплификации в режиме реального времени, совмещенной с определением продуктов реакции, для BCR-ABLF3I7L и BCR-ABLF359V/C, BCR-ABL и контрольного (референсного) гена ABL.
Количественное определение экспрессии BCR-ABLF3I7L и BCR-ABLF359V/C проводили с помощью реакции амплификации в режиме реального времени с использованием прибора ABIPrizm 7500 фирма «Applied Biosystems», США (возможно проведение реакции на любом приборе для ПЦР в реальном времени с аналогичными характеристиками). Смесь для ПЦР включала буфер для ПЦР - 12,5 мкл × (N+1); праймеры - 2,5 мкл × (N+1); зонд - 2,5 мкл × (N+1); воду - 2,3 мкл × (N+1); ДНК-полимеразу - 0,2 мкл × (N+1). Общий объем рассчитывался по формуле: 20 мкл × (N+1), где N - число реакций (пробирок, лунок).
Буфер для ПЦР представлял собой водный раствор следующего состава: дезоксинуклеозидтрифосфаты по 4 мМ дАТФ, дГТФ, дТТФ, дЦТФ (производства «Fermentas», Литва, или аналогичные); TrisHCl рН 9,0 40 мМ (производства «Sigma», США, или аналог); KCl 100 мМ (производства «AppliChem», Германия, или аналог); MgCl2 4 мМ (производства «AppliChem», Германия, или аналог); меркаптоэтанол-2 (в) 0,1 М (производства «AppliChem», Германия, или аналог).
Смесь праймеров для определения BCR-ABLF317L представляла собой 3,5 мкМ водный раствор смеси олигонуклеотидов (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4.
Зонд BCR-ABLF317L представлял собой 2 мкМ водный раствор олигонуклеотидного зонда, меченного флуоресцентным красителем (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 5.
Вода представляла собой деионизованную воду с удельным сопротивлением не менее 18 Мом/см.
ДНК-полимераза представляла собой раствор термостабильной ДНК-полимеразы происхождения Thermus aquaticus, обладающей 5'->3'экзонуклеазной активностью, с ферментативной активностью 5 Ед/мкл в буфере для хранения (производства «Силекс», Россия, или аналогичный).
Положительный контроль включал контрольные пробы, содержащие плазмиду pGEM®-T Easy с вставкой фрагмента кДНК гена BCR-ABLF317L с концентрациями 102, 103, 104, 105 и 106 копий гена в 5 мкл.
Смесь праймеров для определения BCR-ABLF359V/C представляла собой 3,5 мкМ водный раствор смеси олигонуклеотидов (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8.
Зонд BCR-ABLF359V/C представлял собой 2 мкМ водный раствор олигонуклеотидного зонда, меченного флуоресцентным красителем (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 9.
Положительный контроль включал контрольные пробы, содержащие плазмиду pGEM®-T Easy с вставкой фрагмента кДНК гена BCR-ABLF359V/C с концентрациями 102, 103, 104, 105 и 106 копий гена в 5 мкл.
Смесь праймеров для определения BCR-ABL представляла собой 3,5 мкМ водный раствор смеси олигонуклеотидов (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 10 и SEQ ID NO: 11.
Зонд BCR-ABL представлял собой 2 мкМ водный раствор олигонуклеотидного зонда, меченного флуоресцентным красителем (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 12.
Положительный контроль представлял собой контрольные пробы, содержащие плазмиду pGEM®-T Easy с вставкой фрагмента кДНК гена BCR-ABL р210 с концентрациями 102, 103, 104, 105 и 106 копий гена в 5 мкл.
Смесь праймеров ABL представляла собой 3,5 мкМ водный раствор смеси олигонуклеотидов (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 13 и SEQ ID NO: 14.
Зонд ABL представлял собой 2 мкМ водный раствор олигонуклеотидного зонда, меченного флуоресцентным красителем (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 15.
Положительный контроль представлял собой контрольные пробы, содержащие плазмиду pGEM®-T Easy с вставкой фрагмента кДНК гена ABL с концентрациями 104, 105 и 106 копий гена в 5 мкл.
Температурные условия реакции амплификации: нагрев при температуре 95°С в течение 10 мин, 50 циклов в режиме при температуре 95°С в течение 15 с, затем при 60°С в течение 60 с.
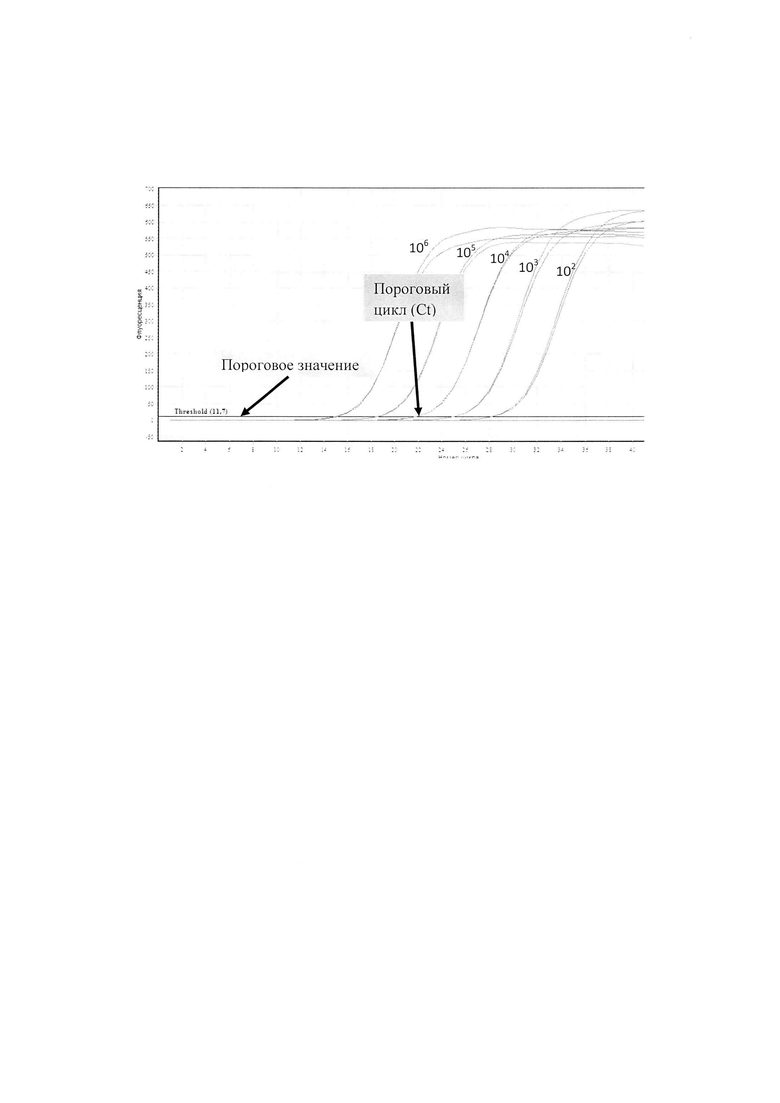
Для построения калибровочной кривой использовали трехкратные повторы разведений положительного контроля, концентрация которых составляла 102, 103, 104, 105 и 106 копий в 5 мкл. По окончании ПЦР-амплификации в режиме реального времени для каждой пробы определяли значение порогового цикла (Ct) - цикла амплификации, в котором кривая флуоресценции данного образца пересекает линию порогового значения. Изобретение иллюстрируется фигурой.
По значениям стандартов с известной концентрацией (положительных контролей) строили калибровочную кривую, по которой, исходя из значения порогового цикла в каждой пробирке/лунке, определяли исходное число копий гена в каждом образце. Для более точного определения числа копий гена каждый образец ставили в трех повторах, для расчетов использовали среднее значение числа копий. Построение калибровочной кривой и определение числа копий гена производили с помощью компьютерных программ, прилагаемых к ПЦР-амплификатору.
Относительную экспрессию генов BCR-ABLF317L, BCR-ABLF359V/C и BCR-ABL в образце определяли как среднее число копий определяемого гена поделенное на среднее число копий контрольного гена и умноженное на 100%. В качестве контрольного гена использовали ген ABL.
Количественную оценку результатов ПЦР определяли по формулам:
(Q BCR-ABLF317L cp./Q ABL ср.) / (Q BCR-ABL cp./Q ABL cp.)*100%,
(Q BCR-ABLF359V/C cp./Q ABL cp.) / (Q BCR-ABL cp./Q ABL cp.)*100%.
Выявление экспрессии мутантной формы BCR-ABLF317L и BCR-ABLF359V/C у больных ХМЛ может быть использовано для диагностики резистентности к ИТК, а также для оценки ответа пациента на проводимую терапию.





Изобретение относится к области медицины, в частности к медицинской генетике и онкогематологии, и предназначено для количественного определения мутаций F317L и F359V/C киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ. Применяют одну стадию ПЦР для определения экспрессии BCR-ABLF317L и BCR-ABLF359V/C. В качестве праймеров используют систему для определения F317L, состоящую из прямого праймера SEQ ID NO: 1 и обратных специфических праймеров на мутацию SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 и специфического зонда SEQ ID NO: 5. Определяют экспрессию F359V/C, BCR-ABL и ABL, используя системы, состоящие из праймеров и зондов. Число копий BCR-ABLF317L и BCR-ABLF359V/C в образцах определяют по калибровочной кривой, которая строится по стандартам с известной концентрацией. Экспрессию BCR-ABLF317L, BCR-ABLF359V/C и BCR-ABL вычисляют относительно контрольного гена ABL по формулам. Изобретение обеспечивает эффективный способ определения мутаций F317L и F359V/C киназного домена BCR-ABL, обладающий более высокой чувствительностью и специфичностью. 1 ил.
Способ количественного определения мутаций F317L и F359V/C киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ, отличающийся тем, что применяют одну стадию ПЦР для определения экспрессии BCR-ABLF317L и BCR-ABLF359V/C; в качестве праймеров используют систему для определения F317L, состоящую из прямого праймера SEQ ID NO: 1 и обратных специфических праймеров на мутацию SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 и специфического зонда SEQ ID NO: 5; для определения F359V/C - состоящую из прямого праймера SEQ ID NO: 6 и обратных специфических праймеров на мутацию SEQ ID NO: 7, SEQ ID NO: 8 и специфического зонда SEQ ID NO: 9; для определения экспрессии BCR-ABL используют систему, состоящую из праймеров SEQ ID NO: 10 и SEQ ID NO: 11 и зонда SEQ ID NO: 12, для определения экспрессии ABL используют систему, состоящую из праймеров SEQ ID NO: 13 и SEQ ID NO: 14 и зонда SEQ ID NO: 15; число копий BCR-ABLF317L и BCR-ABLF359V/C в образцах определяют по калибровочной кривой, которая строится по стандартам с известной концентрацией и экспрессию BCR-ABLF317L, BCR-ABLF359V/C и BCR-ABL вычисляют относительно контрольного гена ABL по формулам: (Q BCR-ABLF317L cp./Q ABL ср.) / (Q BCR-ABL cp./Q ABL cp.)*100%; (Q BCR-ABLF359V/C ср./Q ABL ср.) / (Q BCR-ABL cp./Q ABL cp.)*100%.
| FERRI C | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Leuk Lymphoma | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Способ количественного определения мутации G250E киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ | 2016 |
|
RU2620076C1 |
| МОРДАНОВ С.В | |||
| Роль аномалий гена BCR-ABL в развитии резистентности к терапии иматинибом у больных хроническим миелоидным лейкозом | |||
| Автореф | |||
| дис | |||
| канд | |||
| мед | |||
| наук | |||
| Москва, 2013, 129 с | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| Найдено из Интернет: URL: https://www.dissercat.com/content/rol-anomalii-gena-bcr-abl-v-razvitii-rezistentnosti-k-terapii-imatinibom-u-bolnykh-khroniche. | |||
Авторы
Даты
2019-08-27—Публикация
2019-03-26—Подача