Изобретение относится к медицине, в частности к медицинской генетике и онкогематологии, и касается способа выявления мутации G250E киназного домена BCR-ABL у больных хроническим миелоидным лейкозом (ХМЛ).
Таргетная терапия ХМЛ ингибиторами тирозинкиназ (ИТК) способствует существенному увеличению продолжительности и улучшению качества жизни больных. Однако примерно у половины пациентов эта терапия оказывается неэффективной из-за развития резистентности (Овсянникова Е.Г. и др., Мутационный статус резистентных к иматинибу больных хроническим миелолейкозом. Онкогематология, 2012, т. 4, с. 16-23). Основной причиной резистентности больных ХМЛ к терапии ингибиторами тирозинкиназ являются точечные мутации, затрагивающие киназный домен химерного онкогена BCR-ABL между экзонами а3 и a11 гена ABL. В результате мутаций изменяется конформация белка BCR-ABL и молекулы ИТК не могут взаимодействовать с ним с прежней эффективностью. Определение мутационного статуса этого участка является обязательным для больных ХМЛ с недостаточным ответом на терапию иматинибом, а также при переходе на терапию нилотинибом и дазатинибом. Наиболее часто встречающейся мутацией киназного домена BCR-ABL является T315I, при обнаружении которой используется препарат следующего поколения - понатиниб. Количественное определение мутантной формы гена BCR-ABLT315I, в том числе с применением аллель-специфичной полимеразной цепной реакции в реальном времени, является одним из диагностических критериев, которыми необходимо руководствоваться при ведении пациентов, демонстрирующих недостаточный ответ при стандартной терапии (Абдуллаев А.О. и др., Количественная оценка уровня транскрипта BCR-ABL T315I у больных хроническим миелоидным лейкозом при помоши аллель-специфичной полимеразной цепной реакции в режиме реального времени. Гематология и трансфузиология, 2014, т. 59, №4, с. 7-11). Следующей по частоте встречаемости мутацией является G250E, которая составляет около 12% от количества всех встречающихся мутаций киназного домена и вызывает резистентность к иматинибу. При этом дазатиниб и нилотиниб могут быть использованы при выявлении этой мутации. В связи с этим представляется важной задачей разработка нового способа своевременного выявления мутации G250E для коррекции применяемой терапии. Количественное определение выявленных мутаций позволяет оперативно определять эффективность применяемой терапии относительно конкретного опухолевого клона, несущего мутацию.
Известно, что идентификацию мутаций киназного домена гена BCR-ABL осуществляют с помощью прямого секвенирования продуктов полимеразной цепной реакции (ПЦР-продуктов). В последнее время с этой целью также используют полноэкзомное секвенирование (Смирнихина С.А., Лавров А.В., Адильгереева Э.П., Туркина А.Г., Куцев С.И. Клиническое значение полноэкзомных исследований миелоидных опухолей методом секвенирования следующего поколения. Клиническая онкогематология, 2013, №1, с. 11-19). Секвенирование является достаточно точным, однако довольно трудоемким и дорогостоящим методом. Метод полимеразной цепной реакци (ПЦР) в отличие от прямого секвенирования характеризуется высокой чувствительностью. Анализ специфичности выявления мутации в гене BCR-ABL методом прямого секвенирования и ПЦР в реальном времени показывает сопоставимые результаты. Выявление экспрессии мутантной формы BCR-ABLG250E у больных ХМЛ может быть использовано для диагностики резистентности к ингибиторам тирозинкиназ первого поколения (ИТК-1), а также для оценки чувствительности к проводимой терапии.
Известен способ определения уровня экспрессии BCR-ABLG250E с помощью ПЦР в реальном времени (Ferri С.et al. Early detection and quantification of mutations in the tyrosine kinase domain of chimerical BCR-ABL 1 gene combining high-resolution melting analysis and mutant-allele specific quantitative polymerase chain reaction, Leukemia & lymphoma, 2012, 54(3): 598-606). Способ включает следующие этапы:
1. Получение РНК из лейкоцитов с помощью реагента TRIzol (Invitrogen).
2. Получение кДНК с помощью смеси случайных гексамеров и обратной транскриптазы (M-MLV) (Invitrogen).
3. Амплификацию фрагмента ДНК 1313 п.о. с помощью праймеров BCR13-Fw 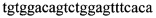 и ABL7-Rw
и ABL7-Rw 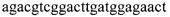 . Для постановки ПЦР в реальном времени использовали тысячекратные разведения амплифицированного образца.
. Для постановки ПЦР в реальном времени использовали тысячекратные разведения амплифицированного образца.
4. Анализ образцов и отрицательного контроля с помощью ПЦР в реальном времени в двух повторах для каждой реакции со специфическим праймером на мутацию и с праймером, определяющим «дикий тип». Анализ проводили с помощью прибора Rotor-Gene real-time PCR platform (Qiagen). Общий прямой праймер: P-Fw 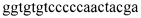 ; специфический обратный праймер для определения мутации: D G250E-Rw
; специфический обратный праймер для определения мутации: D G250E-Rw 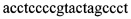 ; специфический обратный праймер для определения «дикого типа»: ND P-Rw
; специфический обратный праймер для определения «дикого типа»: ND P-Rw 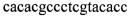 . Температурные условия: 50°С - 2 мин, 95°С - 5 мин, 95°С - 10 с 45 циклов, 60°С - 15 с и 72°С - 10 с (прототип).
. Температурные условия: 50°С - 2 мин, 95°С - 5 мин, 95°С - 10 с 45 циклов, 60°С - 15 с и 72°С - 10 с (прототип).
Недостатками способа являются: наличие двух стадий ПЦР увеличивает время исследования; использование реактива SYBR-Green дает недостаточно специфичный результат; отсутствие калибровочной кривой для определения концентрации BCR-ABLG250E в образце снижает точность получаемых результатов.
Задачей заявляемого изобретения является создание нового способа количественного определения мутации G250E киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ, с более высокой точностью и специфичностью получаемых результатов и с сокращением времени исследования.
Технический результат заявляемого изобретения состоит в том, что создан новый способ количественного определения мутации G250E киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ, который обладает более высокой чувствительностью и специфичностью за более короткое время.
Сущность способа состоит в следующем: способ основан на постановке ПЦР в реальном времени для количественного определения экспрессии мутантного гена BCR-ABLG250E с использованием одной стадии ПЦР. Способ содержит аллель-специфический праймер и специфический зонд и включает стандарты с известным числом копий исследуемого гена (плазмида со вставкой участка химерного онкогена BCR-ABLG250E). В качестве объекта исследования использовали кДНК, полученную способом обратной транскрипции из РНК, выделенной из образцов крови больных хроническим миелоидным лейкозом, резистентных к ИТК-1. Нуклеотидные последовательности праймеров, используемые для проведения детекции, представлены в Перечне последовательностей. В качестве праймеров для определения экспрессии BCR-ABLG250E использовали систему, состоящую из прямого праймера, SEQ ID NO: 1, и обратного специфического праймера на мутацию, SEQ ID NO: 2. Для количественного определения использовали специфический зонд SEQ ID NO: 3. Число копий BCR-ABLG250E в клинических образцах определяли по калибровочной кривой, которая строится по стандартам с известной концентрацией. Для определения общей экспрессии BCR-ABL использовали систему, состоящую из прямого праймера, SEQ ID NO: 4, обратного праймера, SEQ ID NO: 5, и специфического зонда SEQ ID NO: 6. Для определения экспрессии контрольного гена ABL использовали систему, состоящую из прямого праймера, SEQ ID NO: 7, обратного праймера, SEQ ID NO: 8, и специфического зонда SEQ ID NO: 9. Экспрессию BCR-ABLG250E вычисляли относительно общей экспрессии BCR-ABL и контрольного гена ABL по формуле: (Q BCR-ABLG250E cp./Q ABL ср.) / (Q BCR-ABL cp./Q ABL cp.)*100%.
Способ осуществляется следующим образом:
1. Выделение тотальной РНК из клинических образцов. РНК выделяли из ядерных клеток крови быстрым лизисом в гуанидин-изотиоцианатном буфере с последующей фенольной обработкой [Chomczynski P., Anal Biochem., 1987 Apr, 162(1): 156-9]. Этот способ позволяет получить наибольшее количество РНК из биологического материала.
2. Проведение реакции обратной транскрипции с получением кДНК. Реакционная смесь обратной транскрипции при синтезе кДНК содержит в общем объеме 25 мкл 2,0 мкг РНК, четыре основных dNTP в концентрации 1 мМ по каждому, 10 наномоль смеси случайных гексамеров, 50 мМ Трис-HCl, рН 8,3, 75 мМ хлорид калия, 3,0 мМ хлорид магния, 10 мМ дитиотреитола, 40 ед. ингибитора РНКаз (предпочтительно RNAsin производства Promega, США), 200 ед. ревертазы M-MLV (предпочтительно производства Promega, США). При составлении реакционной смеси использовали 5х буфер для обратной транскрипции (предпочтительно производства Promega, США). Инкубировали при 37°С в течение 45 мин, затем прогревали 2 мин при 94°С для остановки реакции.
3. Проведение реакции амплификации в режиме реального времени, совмещенной с определением продуктов реакции, для BCR-ABLG250E, BCR-ABL и контрольного (референсного) гена ABL.
Количественное определение экспрессии BCR-ABLG250E проводили с помощью реакции амплификации в режиме реального времени с использованием прибора ABIPrizm 7500 фирма «Applied Biosystems», США (возможно проведение реакции на любом приборе для ПЦР в реальном времени с аналогичными характеристиками). Смесь для ПЦР включала буфер для ПЦР - 12,5 мкл × (N+1); праймеры - 2,5 мкл × (N+1); зонд - 2,5 мкл × (N+1); воду - 2,3 мкл × (N+1); ДНК-полимеразу - 0,2 мкл × (N+1). Общий объем рассчитывался по формуле: 20 мкл × (N+1), где N - число реакций (пробирок, лунок).
Буфер для ПЦР представлял собой водный раствор следующего состава: дезоксинуклеозидтрифосфаты по 4 мМ дАТФ, дГТФ, дТТФ, дЦТФ (производства «Fermentas», Литва, или аналогичные); TrisHCl рН 9,0 40 мМ (производства «Sigma», США, или аналог); KCl 100мМ (производства «AppliChem», Германия, или аналог); MgCl2 4 мМ (производства «AppliChem», Германия, или аналог); меркаптоэтанол-2 (в) 0,1М (производства «AppliChem», Германия, или аналог).
Смесь праймеров для определения BCR-ABLG250E представляла собой 3,5 мкМ водный раствор смеси олигонуклеотидов (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 1 и SEQ ID NO: 2.
Зонд BCR-ABLG250E представлял собой 2 мкМ водный раствор олигонуклеотидного зонда, меченного флуоресцентным красителем (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 3.
Вода представляла собой деионизованную воду с удельным сопротивлением не менее 18 Мом/см.
ДНК-полимераза представляла собой раствор термостабильной ДНК-полимеразы происхождения Thermus aquaticus, обладающей 5'->3'экзонуклеазной активностью, с ферментативной активностью 5 Ед/мкл в буфере для хранения (производства «Силекс», Россия, или аналогичный).
Положительный контроль включал контрольные пробы, содержащие плазмиду pGEM®-T Easy с вставкой фрагмента кДНК гена BCR-ABLG250E с концентрациями 102, 103, 104, 105 и 106 копий гена в 5 мкл.
Смесь праймеров для определения BCR-ABL представляла собой 3,5 мкМ водный раствор смеси олигонуклеотидов (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 4 и SEQ ID NO: 5.
Зонд BCR-ABL представлял собой 2 мкМ водный раствор олигонуклеотидного зонда, меченного флуоресцентным красителем (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 6.
Положительный контроль представлял собой контрольные пробы, содержащие плазмиду pGEM®-T Easy с вставкой фрагмента кДНК гена BCR-ABL р210 с концентрациями 102, 103, 104, 105 и 106 копий гена в 5 мкл.
Смесь праймеров ABL представляла собой 3,5 мкМ водный раствор смеси олигонуклеотидов (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 7 и SEQ ID NO: 8.
Зонд ABL представлял собой 2 мкМ водный раствор олигонуклеотидного зонда, меченного флуоресцентным красителем (производства «ДНК-Синтез», Россия, или аналогичный), SEQ ID NO: 9.
Положительный контроль представлял собой контрольные пробы, содержащие плазмиду pGEM®-T Easy с вставкой фрагмента кДНК гена ABL с концентрациями 104, 105 и 106 копий гена в 5 мкл.
Температурные условия реакции амплификации: нагрев при температуре 95°С в течение 10 мин, 50 циклов в режиме при температуре 95°С в течение 15 с, затем при 60°С в течение 60 с.
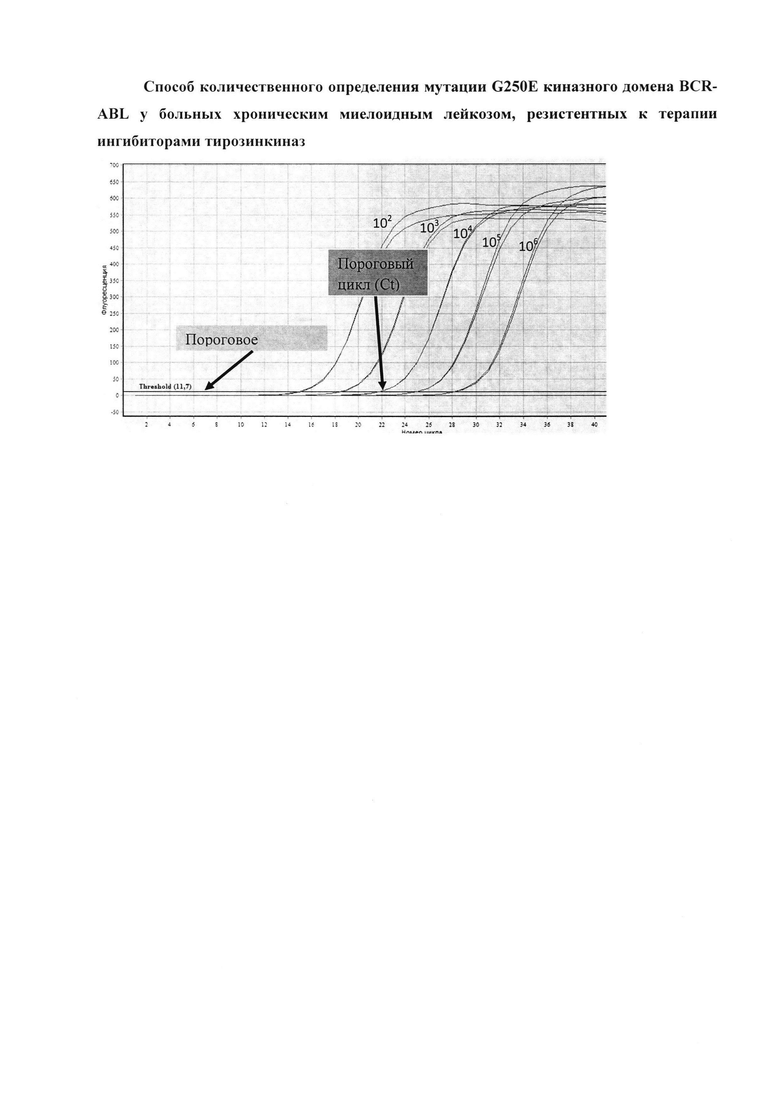
Для построения калибровочной кривой использовали трехкратные повторы разведений положительного контроля, концентрация которых составляла 102, 103, 104, 105 и 106 копий в 5 мкл. По окончании ПЦР-амплификации в режиме реального времени для каждой пробы определяли значение порогового цикла (Ct) - цикла амплификации, в котором кривая флуоресценции данного образца пересекает линию порогового значения. Изобретение иллюстрируется фигурой.
По значениям стандартов с известной концентрацией (положительных контролей) строили калибровочную кривую, по которой, исходя из значения порогового цикла в каждой пробирке/лунке, определяли исходное число копий гена в каждом образце. Для более точного определения числа копий гена каждый образец ставили в трех повторах, для расчетов использовали среднее значение числа копий. Построение калибровочной кривой и определение числа копий гена производили с помощью компьютерных программ, прилагаемых к ПЦР-амплификатору.
Относительную экспрессию генов BCR-ABLG250E и BCR-ABL в образце определяли как среднее число копий определяемого гена, поделенное на среднее число копий контрольного гена и умноженное на 100%. В качестве контрольного гена использовали ген ABL.
Количественную оценку результатов ПЦР определяли по формуле:
(Q BCR-ABLG250E cp./Q ABL ср.) / (Q BCR-ABL cp./Q ABL cp.)*100%.
Выявление экспрессии мутантной формы BCR-ABLG250E у больных ХМЛ может быть использовано для диагностики резистентности к ИТК-1, а также для оценки ответа пациента на проводимую терапию.



Изобретение относится к биохимии. Описан способ выявления мутации G250E киназного домена BCR-ABL у больных хроническим миелоидным лейкозом (ХМЛ). Заявляемый способ включает постановку полимеразной цепной реакции в реальном времени с использованием кДНК, полученной способом обратной транскрипции из РНК, выделенной из образцов крови больных хроническим миелоидным лейкозом, резистентных к ингибиторам тирозинкиназ первого поколения. В качестве праймеров используют систему, состоящую из прямого праймера SEQ ID NO: 1 и обратного специфического праймера на мутацию SEQ ID NO: 2. Для количественного определения мутации G250E используют специфический зонд, SEQ ID NO: 3. Число копий BCR-ABLG250E в образцах определяют по калибровочной кривой. Для определения общей экспрессии BCR-ABL используют систему, состоящую из прямого праймера, SEQ ID NO: 4, обратного праймера, SEQ ID NO: 5, и специфического зонда SEQ ID NO: 6. Для определения экспрессии контрольного гена ABL используют систему, состоящую из прямого праймера, SEQ ID NO: 7, обратного праймера, SEQ ID NO: 8, и специфического зонда SEQ ID NO: 9. Экспрессию BCR-ABLG250E вычисляют относительно общей экспрессии BCR-ABL и контрольного гена ABL по формуле: (Q BCR-ABLG250E cp./Q ABL ср.) / (Q BCR-ABL cp./Q ABL cp.)*100%. Способ позволяет повысить чувствительность и специфичность определения количества мутантного клона и сократить время исследования. 1 ил.
Способ количественного определения мутации G250E киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ, включающий выделение тотальной РНК из клинических образцов, проведение реакции обратной транскрипции с получением кДНК, проведение реакции амплификации в режиме реального времени, отличающийся тем, что применяют одну стадию ПЦР для определения экспрессии BCR-ABLG250E; в качестве праймеров используют систему, состоящую из прямого праймера SEQ ID NO: 1 и обратного специфического праймера на мутацию SEQ ID NO: 2, и специфического зонда, SEQ ID NO: 3; для определения экспрессии BCR-ABL используют систему, состоящую из праймеров SEQ ID NO: 4 и SEQ ID NO: 5 и зонда SEQ ID NO: 6, для определения экспрессии ABL используют систему, состоящую из праймеров SEQ ID NO: 7 и SEQ ID NO: 8 и зонда SEQ ID NO: 9; число копий BCR-ABLG250E в образцах определяют по калибровочной кривой, которая строится по стандартам с известной концентрацией, и вычисляют экспрессию BCR-ABLG250E и BCR-ABL относительно контрольного гена ABL по формуле: (Q BCR-ABLG250E cp./Q ABL ср.)/(Q BCR-ABL cp./Q ABL cp.)*100%.
| FERRI C | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения раствора нитродиазобензола и применения его в крашении | 1921 |
|
SU598A1 |
| RU 2015152196 А, 07.12.2015 | |||
| BRANFORD S | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1923 |
|
SU571A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Коллектор для коллекторных машин | 1925 |
|
SU3472A1 |
Авторы
Даты
2017-05-22—Публикация
2016-11-21—Подача