Изобретение относится к пищевой и фармацевтической промышленности и может быть использовано для получения из морских жиров алкил-глицериновых эфиров, обладающих высоким биологическим действием.
Липиды с простой эфирной связью, в том числе 1-О-алкил-глицериновые эфиры (АГЭ), привлекают внимание медиков, диетологов, биохимиков высокой биологической активностью. На фиг. 1 приведены структурные формулы главных ненасыщенных природных алкил-глицериновых эфиров, при условии, если: R1=C16H33 - химиловый спирт, R1=C18H37 - батиловый спирт, R1=C18H35 - селахиловый спирт.
В организме АГЭ входят в состав мембран в виде плазмалогенных структур, особенно значительные их количества присутствуют в нервной ткани, в первую очередь в головном мозге. Находясь в липидных рафтах регулируют транспорт холестерина, белков, активность секретаз, отвечающих за расщепление амилоидного белка β42, препятствуя развитию нейродегенеративных заболеваний. Первыми принимают на себя последствия окислительного стресса, защищая другие жизненно важные молекулы от окисления и предотвращая более тяжкие последствия для организма (Wood P., Khan A., Mankidy R., Goodenowe D. «Plasmalogen deficit: a new and testable hypothesis for the etiology of Alzheimer's disease». In: «Alzheimer's disease pathogenesis - Core Concepts, Shifting Paradigms and Therapeutic Targets». 2011. Р. 561-588).
Диета современного человека такова, что данные соединения всегда находятся в дефиците. Учитывая, что с возрастом пероксисомы теряют активность по синтезу простой эфирной связи, необходимо иметь дополнительные источники этих важных липидов. Наземные растения и животные бедны ими, в отличие от обитателей морских глубин - акул, скатов, кальмаров. За рубежом и в России реализованы технологии получения АГЭ. Однако, радикал в первом положении глицерина может быть насыщенным или ненасыщенным. В случае с насыщенными АГЭ, их выделение достаточно проработано, чего не сказать о ненасыщенных АГЭ.
Последние исследования выявили особую биологическую активность у ненасыщенного селахилового спирта, 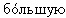 , чем у насыщенных АГЭ (A.-L. Deniau, P. Mosset, D.Le Bot, A.B. Legrand Which alkylglycerols from shark liver oil have anti-tumour activities? / Biochimie. 2010. Р. 1-3). Поэтому поиск методов выделения таких соединений и создания препаратов с их участием является важным в свете профилактики и лечения многих недугов человека.
, чем у насыщенных АГЭ (A.-L. Deniau, P. Mosset, D.Le Bot, A.B. Legrand Which alkylglycerols from shark liver oil have anti-tumour activities? / Biochimie. 2010. Р. 1-3). Поэтому поиск методов выделения таких соединений и создания препаратов с их участием является важным в свете профилактики и лечения многих недугов человека.
Особо стоит остановиться о возможности получения данных соединений в лабораторных условиях, поскольку от биохимических и медицинских исследований зависит дальнейшее продвижение создаваемых препаратов. Отсутствие некоторых из них на рынке не должно ограничивать исследователей в проводимых ими экспериментах.
На данный момент не существует способа получения в одном процессе ненасыщенных АГЭ с высокими концентрацией и выходом, упрощением всей технологической схемы, позволяющей осуществлять способ доступными средствами в любой лаборатории.
Известен способ получения концентратов ненасыщенных АГЭ из печени колючей акулы (катрана), гренландской акулы и химеры (Hallgren B., Larsson S.O. «Separation and identification of alkoxyglycerols» // Acta Chem. Scand. 1959. Vol. 13, N 7. P. 2147-2148). Способ осуществляют следующим образом: неомыляемые вещества, извлеченные из гидролизованного печеночного жира рыб, хроматографируют на колонке с активированной окисью алюминия, для элюции АГЭ используют смесь 10%-ного раствора метанола в метиленхлориде. Получены концентраты ненасыщенных АГЭ следующего содержания (по селахиловому спирту) - 47,8% для катрана, 59,4% для гренландской акулы и 53,6% для химеры. Другие уточняющие данные по выделению АГЭ отсутствуют.
Недостатки способа:
1) осуществление данного способа скорее иллюстрирует само наличие АГЭ в печени гидробионтов, чем действительно предлагает рациональный способ их выделения;
2) хроматографическое выделение АГЭ, без предварительного концентрирования, для получения препаратов в значительных объемах не приемлемо - низкая эффективность метода, проблемы с регенерацией сорбента, а, главное, высокая себестоимость получаемого продукта;
3) использование метилового спирта снижает интерес к способу, так как использует чрезвычайно токсичный растворитель, не допустимый в пищевых производствах.
Известен способ выделения алкил-глицериновых эфиров из жира командорского кальмара Berryteuthis magister (Патент РФ № 2415125 МПК C07C 43/13, C07C 41/16, C07C 41/40, опубл. 27.03.2011). Способ включает гидролиз морского жира для выделения свободных жирных кислот и высвобождения неомыляемой фракции, содержащей АГЭ, нейтрализацию полученной жировой смеси кислотой, промывку водой и последовательную двойную кристаллизацию из органического растворителя, фильтрацию и сушку образующегося осадка после каждой кристаллизации. Для проведения первой и второй кристаллизации жировую смесь в органическом растворителе выдерживают сначала в течение 10-12 часов при комнатной температуре, а затем в течение 12-15 часов при 0-4°С.
В процессе используют ацетон или гексан, причем может использоваться только один растворитель во всем процессе или их комбинация.
При использовании в качестве органического растворителя гексана соотношение жировая смесь - гексан составляет при первой кристаллизации 1:10, кг/л, а при второй кристаллизации промежуточного продукта 1:50, кг/л.
При использовании в качестве органического растворителя ацетона целесообразно соотношение жировая смесь - ацетон 1:10, кг/л, как при первой, так и при второй кристаллизации промежуточного продукта.
Метод позволяет получать насыщенные АГЭ с выходом 50-59,0% и чистотой более 99%.
Недостатки:
1) метод использует значительные объемы растворителей, что требует использование больших емкостей, соответствующих фильтровальных установок и постоянную регенерацию растворителей;
2) две кристаллизации метода разделены сушкой осадка для того, чтобы при смене растворителя не было загрязнения одного растворителя другим; сушка реально прерывает процесс и откладывает последующую вторую кристаллизацию на несколько часов;
3) продолжительность проведения всего процесса - от исходного жира до целевого продукта (АГЭ) - составляет не менее 59 часов, в среднем 65 часов, притом, что проведение процесса между стадиями является неразрывным. Такая большая продолжительность процесса крайне негативно сказывается на производительности линии получения АГЭ и не позволяет быстро и своевременно перерабатывать поступающее сырье.
4) АГЭ, выделяемые по данному способу на 98-99% состоят из насыщенных соединений, все ненасыщенные АГЭ, обладающие наибольшей биологической активностью, остаются в неиспользуемом остатке и теряются из-за не разработанности технологии.
Известен способ получения алкил-глицериновых эфиров из морских жиров (Патент РФ № 2476611, МПК C22B 7/04, C22B 15/00, C22B 23/00, C22B 4/06, опубл. 27.02.2013), включающий гидролиз морского жира для выделения свободных жирных кислот и высвобождения неомыляемой фракции, содержащей АГЭ, нейтрализацию полученной жировой смеси кислотой, промывку водой и последовательную двойную кристаллизацию из органического растворителя, фильтрацию и сушку образующегося осадка на последней стадии кристаллизации. Для проведения первой кристаллизации жировую смесь комнатной температуры смешивают с органическим растворителем температуры -15°-5°С при интенсивном перемешивании и сразу отфильтровывают образовавшийся осадок, промывают его небольшим количеством органического растворителя при той же температуре и этот аморфный осадок вновь смешивают с органическим растворителем температуры -15°-5°С (2-я кристаллизация) при интенсивном перемешивании и сразу отфильтровывают осадок и высушивают его от растворителя при комнатной температуре, получая целевой продукт - АГЭ. Соотношение жировая смесь : органический растворитель при первой кристаллизации составляет 1:1-5, кг/л, на второй также - 1:1-5, кг/л, в расчете на начальное количество жировой смеси. В качестве органических растворителей могут быть взяты ацетон и гексан, причем весь процесс должен использовать только один растворитель для избежания загрязнения одного растворителя другим.
Общий выход по АГЭ - 50-59%.
Недостатки:
1) в продукте содержатся практически только насыщенные АГЭ;
2) способ не обеспечивает полного извлечения АГЭ из липидов, поэтому все ненасыщенные АГЭ, обладающие высоким биологическим потенциалом, остаются в фильтрате и, в дальнейшем, попадают в отходы.
Наиболее близким к заявляемому изобретению является способ получения концентрата ненасыщенных алкил-глицериновых эфиров из морских липидов (Патент РФ №2649014, МКП С11В 11/00, опубл.29.03.2018). Способ включает (пример 1) гидролиз морского жира для выделения свободных жирных кислот и высвобождения неомыляемой фракции, содержащей АГЭ, нейтрализацию полученной жировой смеси разбавленной серной кислотой, промывку водой и последовательную двойную кристаллизацию из ацетона при минус 15°С в течение 18 часов, фильтрацию и сушку образующегося осадка. Осадок содержит насыщенные АГЭ (суммарно более 99%), которые применяют, как БАД «Липидомарин» или в диетологии (Патент РФ №2658431 «Сухая питательная смесь для диетического питания», МКП A23J 1/04, A23L 33/00, A23L 17/50, опубл. 21.06.2018).
Жидкую фракцию, содержащую свободные жирные кислоты и ненасыщенные АГЭ, упаривают от растворителя, этерифицируют раствором серной кислоты в безводном этаноле, добавляют воду, отделяют липиды и экстрагируют ненасыщенные АГЭ из липидной смеси водными растворами этанола, упаривают.
Полученный продукт ненасыщенных АГЭ очищают (пример 3, часть В) методом колоночной хроматографии на силикагеле с элюирующей системой петролейный эфир - этилацетат в градиенте.
Способ имеет следующие недостатки:
1. Этерификация предполагает использование безводного этанола, что означает серьезную подготовку к этой стадии - в качестве осушителя нужно будет использовать либо бензол (азеатропная перегонка), либо молекулярные сита, либо щелочные металлы и пр.
2. Экстракция АГЭ из липидов водными растворами этанола длительный процесс, так как в каждом случае нужно добиться равновесия системы, при котором АГЭ максимально переходят в водно-спиртовой слой, а этиловые эфиры жирных кислот, наоборот, из него удаляются. Процесс ускорен применением центрифуги, но это не сокращает времени на его проведение.
3. Колоночная хроматография, используемая в процессе, допускает получение объединенного концентрата ненасыщенных АГЭ (суммарно 96,8% с выходом 91,1% на стадии).
Однако получение индивидуальных ненасыщенных АГЭ, в первую очередь, селахилового спирта, она не предполагает. Поэтому метод можно рассматривать как один из возможных путей реализации задачи выделения чистых суммарных ненасыщенных АГЭ, но никак ни метод получения ценных индивидуальных соединений.
Техническая проблема, поставленная перед изобретением, - разработка эффективного и экономичного способа получения из морских жиров ненасыщенных алкил-глицериновых эфиров, с целью максимального их извлечения из сырья при одновременно высоком качестве целевого продукта (высокая степень чистоты), как перспективных средств профилактики социально-значимых заболеваний.
Поставленная техническая проблема решается тем, что в известном способе выделения ненасыщенных и насыщенных алкил-глицериновых эфиров из морских жиров, включающим гидролиз морского жира для выделения свободных жирных кислот и высвобождения неомыляемой фракции, содержащей АГЭ, нейтрализацию полученной жировой смеси разбавленной серной кислотой, промывку 1%-ным раствором NaCl, последовательную двойную кристаллизацию из ацетона при минус 15°С в течение 18 часов, фильтрацию и сушку образующегося осадка содержащего насыщенные АГЭ. Полученную жидкую фракцию, содержащую ненасыщенные АГЭ, упаривают, из упаренного продукта выделяют суммарные ненасыщенные АГЭ методом колоночной хроматографии на силикагеле с элюирующей системой, согласно изобретению, в качестве элюирующей системы используют бензол : хлороформ = 10:0→0:10, об./об., очищенный концентрат АГЭ ацетилируют ацетилхлоридом, после чего разделяют на индивидуальные ацетилированные АГЭ методом высокоэффективной жидкостной хроматорафии на колонке с обращенной фазой (С18) и элюцией 85%-ным водным этанолом, фракции с индивидуальными ацетилированными АГЭ собирают и упаривают, ацетильные группы снимают щелочным гидролизом, АГЭ экстрагируют гексаном и упаривают.
При разработке способа были найдены решения, позволившие осуществить его наиболее экономичным, а главное, простым способом.
Использование новой элюирующей системы для выделения чистых ненасыщенных АГЭ: система бензол-хлороформ, 10:0→0:10, об./об., с повышением градиента позволило не только очистить методом колоночной хроматографии на силикагеле концентрат ненасыщенных АГЭ до содержания в нем основного вещества более 98%, но и применить очистку непосредственно после упаривания жидкой фракции. Таким образом, в отличии от прототипа отсутствует необходимость этерифицикации свободных жирных кислотх липидной смеси раствором серной кислоты в безводном этаноле, отделение липидов от реакционной смеси и проведение многократной экстракции ненасыщенных АГЭ из липидной смеси водными растворами этанола, объединение экстрактов и их упаривание.
Отклонение от параметров системы бензол-хлороформ, 10:0→0:10, об./об., в ту или другую сторону снижало выход или чистоту продукта.
Ацетилирование очищенного концентрата АГЭ ацетилхлоридом позволило разделить фракции ненасыщенных АГЭ в виде их ацетилированных производных методом высоэффективной жидкостной хроматографии на индивидуальные ненасыщенных АГЭ. При этом наносимый на колонку препарат является жидким, в отличие от исходных веществ, легко наносится на колонку и легко разделяется, так как полярные гидроксильные группы этерифицированы, на индивидуальные соединения элюирующей системой этанол-вода 85:15, об./об.
Описание общей схемы заявленного способа.
Гидролиз жира из пищеварительной железы командорского кальмара (согласно прототипу)
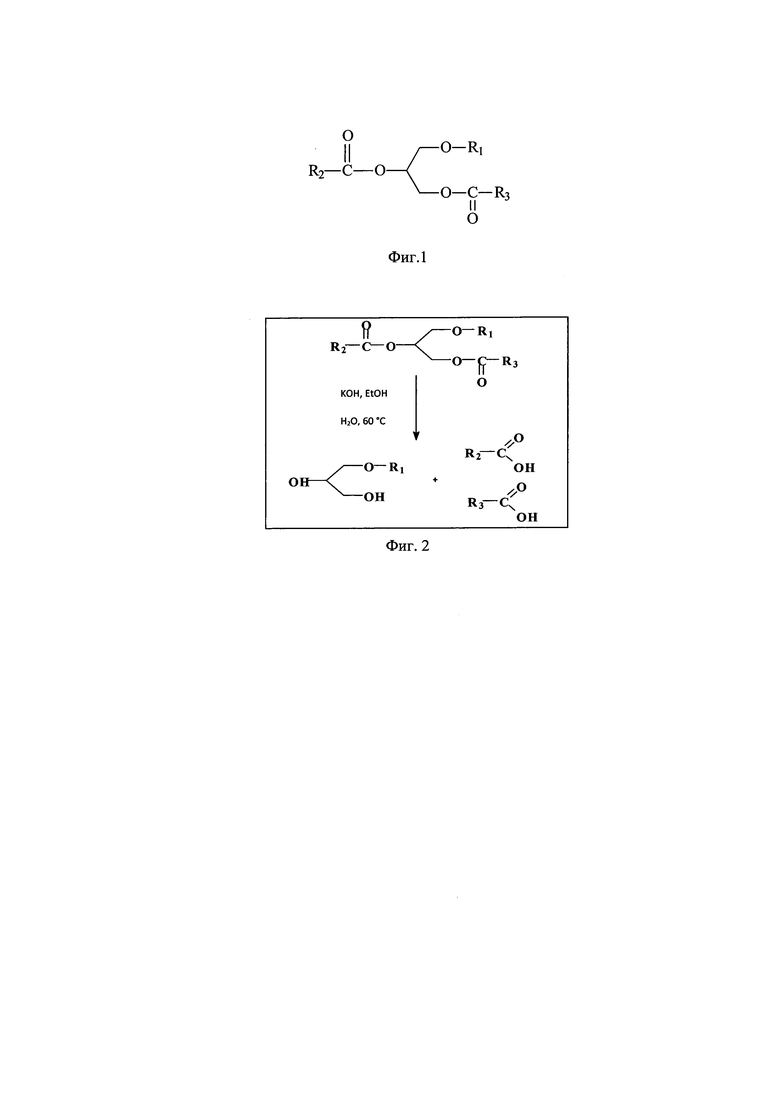
Начальной стадией выделения АГЭ является щелочной гидролиз липидов пищеварительной железы кальмара, в результате которого происходит отщепление ЖК от молекулы алкил-диацил-глицерина (АДАГ), схема гидролиза приведена на фиг. 2.
К 2 кг жира добавляют 1,5 л 96%-ного этанола и 1 л 40%-ого раствора КОН. Реакцию проводят при 60°С в течение 1 ч. Окончание реакции гидролиза контролируют методом тонкослойной хроматографии.
По окончании реакции смесь переносят в делительную воронку, прибавляют 4 л воды и нейтрализуют водным раствором H2SO4 до значения pH=4 по индикаторной бумаге. Гидролизованные липиды дважды промывают 3 л 1%-го раствора NaCl.
Осаждение насыщенных алкил-глицериновых эфиров
Отбирают 1 кг гидролизованных липидов, приливают 2,8 л холодного (-15°С) ацетона, интенсивно перемешивают и помещают в морозильную камеру (-15°С) на 18 часов для осаждения (кристаллизация) насыщенных АГЭ. Процесс кристаллизации из ацетона проводят дважды.
Осадок после второй кристаллизации отфильтровывают через фильтрованную бумагу при -15°С. Полученный фильтрат, содержащий жирные кислоты и ненасыщенные алкил-глицериновые эфиры упаривают под вакуумом.
Колоночная хроматография
Полученный концентрат ненасыщенных АГЭ очищают методом колоночной хроматографии на силикагеле 230-400 mesh, 60А («Merck»), используя элюирующую систему бензол : хлороформ 10:0→0:10, об./об. с повышением градиента. Фракции, содержащие суммарные чистые АГЭ, объединяют и упаривают.
Высокоэффективная жидкостная хроматография
Для получения индивидуальных ненасыщенных АГЭ, очищенный концентрат АГЭ ацетилируют ацетилхлоридом известным методом, при котором гидроксильные группы АГЭ образуют сложноэфирную связь с уксусной кислотой («Lipid analysis: a practical approach»/ Ed. by R. J. Hamilton and Sh. Hamilton, Oxford University Press, 1992. Protocol 37. P. 55), добавляя к АГЭ по каплям ацетилхлорид и выдерживая на бане в течение 1 минуты, добавляют 3-х кратный объем воды и экстрагируют ацетильные производные АГЭ хлороформом, упаривают растворитель.
ВЭЖХ ацетилированных АГЭ проводят на хроматографе LC-8A (Shimadzu, Япония) с рефрактометрическим детектором RID-10A. Препаративное разделение осуществляют на колонке Discovery HS С-18, 10 μм 25 см × 50 мм (Supelco, США) в изократическом режиме системой растворителей этанол-вода (85:15, об./об.). Скорость элюирования - 50 мл/мин. Элюаты индивидуальных ацетилированных ненасыщенных АГЭ собирают и упаривают под вакуумом.
Снятие ацетильных групп проводят щелочным гидролизом, обрабатывая индивидуальные ацетилированные АГЭ 5%-ным водно-спиртовым раствором NaOH, добавляют равный объем воды и экстрагируют индивидуальные ненасыщенные АГЭ гексаном, упаривают.
Изобретение иллюстрируется следующими фиг. и табл.
На фиг 1. приведена структурная формула алкил-глицериновых эфиров,
* - если R1= C16H33 - химиловый спирт,
R1= C18H37 - батиловый спирт,
R1= C18H35 - селахиловый спирт;
на фиг. 2 - схема щелочного гидролиз алкил-диацил-глицеридов (АДАГ);
в табл. 1 представлен состав липидов в продуктах (и полупродуктах) на разных стадиях выделения ненасыщенных АГЭ.
Способ осуществляют следующим образом.
ПРИМЕР 1. Выделение насыщенных и ненасыщенных АГЭ из жира пищеварительной железы командорского кальмара Berryteuthis magister.
Основными классами липидов пищеварительной железы являются алкил-диацил-глицерины (АДАГ) и свободные жирные кислоты, 37,5% и 29,7% соответственно. Кроме перечисленных компонентов, в состав липидов входят также триацил-глицерины (18,5%), холестерин (7,0%). Полярные липиды, эфиры стеринов и воски присутствуют в незначительных количествах.
Качественный и количественный состав смесей липидов на всех стадия процесса оценивают, используя метод тонкослойной хроматографии (ТСХ) (пластинки «Sorbfil», система гексан-диэтиловый эфир-уксусная кислота 50:50:1, об./об./об.) с использованием планшетного сканера и оценки плотности (интенсивности) проявленных на ТСХ-хроматограммах пятен, применяя программу «ТСХ-менеджер версия 3.1 2005 @PinSoft».
Состав АГЭ, выделенных из гидролизованных липидов, а также полученных фракций определяли ГХ-МС.
Берут 100 кг пищеварительной железы (замороженные внутренности кальмара) нагревают в шнеке с водяной рубашкой и сепарируют. Получают 48,5 кг жира.
Гидролиз липидов пищеварительной железы кальмара
К 2 кг жира добавляют 1,5 л 96%-ного этанола и 1 л 40%-ого раствора КОН. Реакцию проводят при 60°С в течение 1 ч. Окончание реакции гидролиза контролируют методом тонкослойной хроматографии.
По окончании реакции смесь переносят в делительную воронку, прибавляют 4 л воды и нейтрализуют водным раствором H2SO4 до значения pH=4 по индикаторной бумаге. Отделившиеся липиды дважды промывают 3 л 1%-ного водного раствора NaCl.
Получено 1,76 кг гидролизованного жира.
Выход (на исходную массу липидов) - 88,0%.
Состав липидов после проведенного гидролиза показан в сводной табл.
Выделение насыщенных алкил-глицериновых эфиров
После щелочного гидролиза проводят кристаллизацию насыщенных АГЭ из ацетона, согласно разработанному ранее методу (Патент РФ №2476611 «Способ получения алкил-глицериновых эфиров из морских жиров», МПК C22B 7/04, C22B 15/00, C22B 23/00, C22B 4/06, опубл. 27.02.2013). На первой стадии кристаллизации при -15°С образовывался осадок, который повторно осаждают из ацетона при той же температуре.
Отбирают 1 кг гидролизованных липидов, приливают 2,8 л холодного (-15°С) ацетона, интенсивно перемешивают и помещают в морозильную камеру (-15°С) на 18 часов для осаждения насыщенных АГЭ. Процесс повторяют при тех же самых условиях. Выпавший осадок отфильтровывают через фильтрованную бумагу при -15°С. Полученный продукт представляет собой смесь насыщенных АГЭ с чистотой 99,2%, основным компонентом которой являлся химиловый спирт (содержание 93,4%).
Выход насыщенных АГЭ составил 11,0% от взятых на кристаллизацию липидов, или 42,0% от содержания АГЭ в гидролизованных липидах.
Полученный фильтрат, содержащий жирные кислоты и ненасыщенные алкил-глицериновые эфиры, упаривают под вакуумом и выделяют из него ненасыщенные алкил-глицериновые эфиры.
Выделение суммарных ненасыщенных алкил-глицериновых эфиров
Колоночная хроматография
2 г полученного суммарного концентрата ненасыщенных АГЭ очищали методом колоночной хроматографии на силикагеле 230-400 mesh, 60А («Merck»), используя элюирующую систему бензол : хлороформ 10:0→0:10, об./об. с повышением градиента. Фракции, содержащие суммарные чистые АГЭ, объединяли и упаривали.
Получено: 320 мг ненасыщенных АГЭ с содержанием АГЭ-18:1 (селахиловый спирт) 74,5% и АГЭ-20:1 (радикал в 1-м положении - 20:1) 11,8%.
Выход на стадии: 100% % (для селахилового спирта, АГЭ-18:1)
100% для АГЭ-20:1.
Высокоэффективная жидкостная хроматография
Для получения индивидуальных ненасыщенных АГЭ (селахилового спирта), очищенный концентрат АГЭ в количестве 320 мг ацетилируют ацетилхлоридом известным методом («Lipid analysis: a practical approach»/ Ed. by R. J. Hamilton and Sh. Hamilton, Oxford University Press, 1992. Protocol 37. P. 55), добавляя к АГЭ по каплям ацетилхлорид и выдерживая на бане в течение 1 минуты, добавляют 3-х кратный объем воды и экстрагируют ацетильные производные АГЭ хлороформом, упаривают растворитель.
ВЭЖХ ацетилированных АГЭ проводят на хроматографе LC-8A (Shimadzu, Япония) с рефрактометрическим детектором RID-10A. Препаративное разделение осуществляют на колонке Discovery HS С-18, 10 μм 25 см × 50 мм (Supelco, США) в изократическом режиме системой растворителей этанол-вода (85:15, об./об.). Скорость элюирования - 50 мл/мин. Элюаты индивидуальных ацетилированных ненасыщенных АГЭ объединяют и упаривают под вакуумом.
Снятие ацетильных групп проводят щелочным гидролизом, обрабатывая индивидуальные ацетилированные АГЭ 5%-ным водно-спиртовым раствором NaOH. Добавляют равный объем воды и экстрагируют индивидуальные ненасыщенные АГЭ углеводородным растворителем гексаном, упаривают.
Получено: 224,0 мг АГЭ-18:1 (селахиловый спирт) с концентрацией 98,1 %
Выход на стадии: 91,4%.
Получено: 35,7 мг АГЭ-20:1 (радикал в 1-м положении - 20:1) с концентрацией 97,8%.
Выход: 89,5%.
Предложенный методический подход позволил получить как насыщенные АГЭ с чистотой 99,2% (содержание химилового спирта, АГЭ-16:0 - 93.4%), так и индивидуальные ненасыщенные АГЭ-18:1 (селахиловый спирт) с чистотой 98,1% и АГЭ-20:1 с чистотой 97,8%. При этом особенностью является использование простых, доступных в современных лабораториях методов выделения.
Нами было осуществлено выделение индивидуальных ненасыщенных АГЭ из морского сырья с помощью сочетания колоночной хроматографии на силикагеле с использованием элюирующей системы бензол - хлороформ (10:0→0:10, об./об.) с возрастающей полярностью и высокоэффективной жидкостной хроматографии с элюирующей системой этанол - вода (85:15, об./об.), причем для увеличения подвижности разделяли не сами АГЭ, а их ацетилированные производные.
Преимуществом данного метода является возможность выделять чистые индивидуальные ненасыщенные АГЭ.
Способ обеспечивает в лабораторных условиях получение препаратов ненасыщенных АГЭ высокой степени очистки, пригодных к использованию, как в биохимических, так и в медицинских экспериментах.
Получаемые по способу препараты снижают зависимость от импортной продукции и позволяют оперативно проводить необходимые научные исследования.
(насыщен. АГЭ)
(объединенный)
(АГЭ-18:1)
(АГЭ-20:1)
(химиловый спирт)
(батиловый спирт)
(селахиловый спирт)
продуктах,
%
1 нас. - насыщенные алкильные фрагменты, ненас. - ненасыщенные алкильные фрагменты, сл. - следовые количества (менее 0.1%).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения концентрата ненасыщенных алкил-глицериновых эфиров из морских липидов | 2017 |
|
RU2649014C1 |
| Способ получения концентрата ненасыщенных алкил-глицериновых эфиров из морских гидробионтов | 2017 |
|
RU2642294C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛ-ГЛИЦЕРИНОВЫХ ЭФИРОВ ИЗ МОРСКИХ ЖИРОВ | 2009 |
|
RU2415125C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛ-ГЛИЦЕРИНОВЫХ ЭФИРОВ ИЗ МОРСКИХ ЖИРОВ | 2011 |
|
RU2476211C1 |
| Средство для стимулирования адаптации организма к экстремальным и стрессовым факторам и способ стимулирования адаптации организма к экстремальным и стрессовым факторам | 2018 |
|
RU2683311C1 |
| Способ получения докозагексаеновой кислоты | 2019 |
|
RU2698720C1 |
| Способ получения арахидоновой кислоты из морской красной водоросли рода Gracilaria | 2016 |
|
RU2620164C1 |
| Способ получения арахидоновой кислоты | 2016 |
|
RU2627273C1 |
| Способ количественного определения углеводородов в биологических объектах | 1984 |
|
SU1337764A1 |
| Способ получения арахидоновой кислоты | 1977 |
|
SU897766A1 |
Изобретение относится к пищевой и фармацевтической промышленности и может быть использовано для получения из морских жиров алкил-глицериновых эфиров, обладающих высоким биологическим действием. Заявляемый способ включает гидролиз морского жира, нейтрализацию полученной жировой смеси разбавленной серной кислотой, промывку водным раствором NaCl, последовательную двойную кристаллизацию из ацетона при минус 15°С в течение 18 часов, отделение осадка насыщенных алкил-глицериновых эфиров и его сушку, упаривание жидкой фракции, содержащей ненасыщенные алкил-глицериновые эфиры, выделение ненасыщенных алкил-глицериновых эфиров колоночной хроматографией с элюирующей системой бензол:хлороформ = 10:0 → 0:10, об./об.; после чего очищенный концентрат алкил-глицериновых эфиров ацетилируют ацетилхлоридом, затем разделяют на индивидуальные ацетилированные алкил-глицериновые эфиры методом высокоэффективной жидкостной хроматорафии на колонке с обращенной фазой (С18) и элюцией 85%-ным водным этанолом, фракции с индивидуальными ацетилированными алкил-глицериновыми эфирами собирают и упаривают, ацетильные группы снимают щелочным гидролизом, алкил-глицериновые эфиры экстрагируют гексаном и упаривают. Способ обеспечивает в лабораторных условиях получение препаратов ненасыщенных АГЭ высокой степени очистки, пригодных к использованию, как в биохимических, так и в медицинских экспериментах. Получаемые по способу препараты снижают зависимость от импортной продукции и позволяют оперативно проводить необходимые научные исследования. 2 ил., 1 табл., 1 пр.
Способ получения ненасыщенных алкил-глицериновых эфиров из морских жиров, включающий гидролиз морского жира, нейтрализацию полученной жировой смеси разбавленной серной кислотой, промывку водным раствором NaCl, последовательную двойную кристаллизацию из ацетона при минус 15°С в течение 18 часов, отделение осадка насыщенных алкил-глицериновых эфиров и его сушку, упаривание жидкой фракции, содержащей ненасыщенные алкил-глицериновые эфиры, их выделение колоночной хроматографией с элюирующей системой отличающийся тем, что в качестве элюирующей системы используют бензол:хлороформ = 10:0 → 0:10, об./об.; очищенный концентрат алкил-глицериновых эфиров ацетилируют ацетилхлоридом, после чего разделяют на индивидуальные ацетилированные алкил-глицериновые эфиры методом высокоэффективной жидкостной хроматорафии на колонке с обращенной фазой (С18) и элюцией 85%-ным водным этанолом, фракции с индивидуальными ацетилированными алкил-глицериновыми эфирами собирают и упаривают, ацетильные группы снимают щелочным гидролизом, алкил-глицериновые эфиры экстрагируют гексаном и упаривают.
| Способ получения концентрата ненасыщенных алкил-глицериновых эфиров из морских липидов | 2017 |
|
RU2649014C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛ-ГЛИЦЕРИНОВЫХ ЭФИРОВ ИЗ МОРСКИХ ЖИРОВ | 2011 |
|
RU2476211C1 |
| Устройство для подачи топлива в мельницу | 1982 |
|
SU1076706A1 |
Авторы
Даты
2019-08-29—Публикация
2019-06-20—Подача