Изобретение относится к области биотехнологии, а именно к способам выделения и очистки рекомбинантных белков, в частности к получению высокоочищенного препарата рекомбинантной нейраминидазы NanH. Основными сферами применения полученной бактериальной нейраминидазы NanH является включение ее в технологический процесс производства ряда терапевтических препаратов, а также биомедицинские исследования в области гликобиологии, иммунологии и онкологии.
Изобретение решает задачу получения больших количеств высокоочищенной ферментативно-активной рекомбинантной нейраминидазы NanH, пригодной для использования на стадии ремоделирования в получении терапевтически функциональных препаратов гликопротеинов с заданными свойствами, а также в качестве инструмента для изучения структуры, биосинтеза, регуляции и функции сиалированных гликоконъюгатов, для анализа и выявления связей между нарушениями строения гликоконъюгатов при онкогенезе и других патологических состояниях человека и животных.
Способ позволяет получить препарат рекомбинантной нейраминидазы NanH, имеющей более высокую степень чистоты по сравнении с коммерческим препаратом, гомогенной по целевому продукту, с более низким содержанием эндотоксинов в сравнении с коммерческим препаратом, а также низким содержанием остаточной ДНК продуцента.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Гидролиз α-кетозидной связи сиалидазой (нейраминидазой) между сиаловой кислотой и гликопротеином (гликолипидом).
Фиг. 2. Плазмидная карта рМТ1617 (экспрессионный вектор на основе pET15b для получения клостридиальной нейраминидазы NANH_CLOPF).
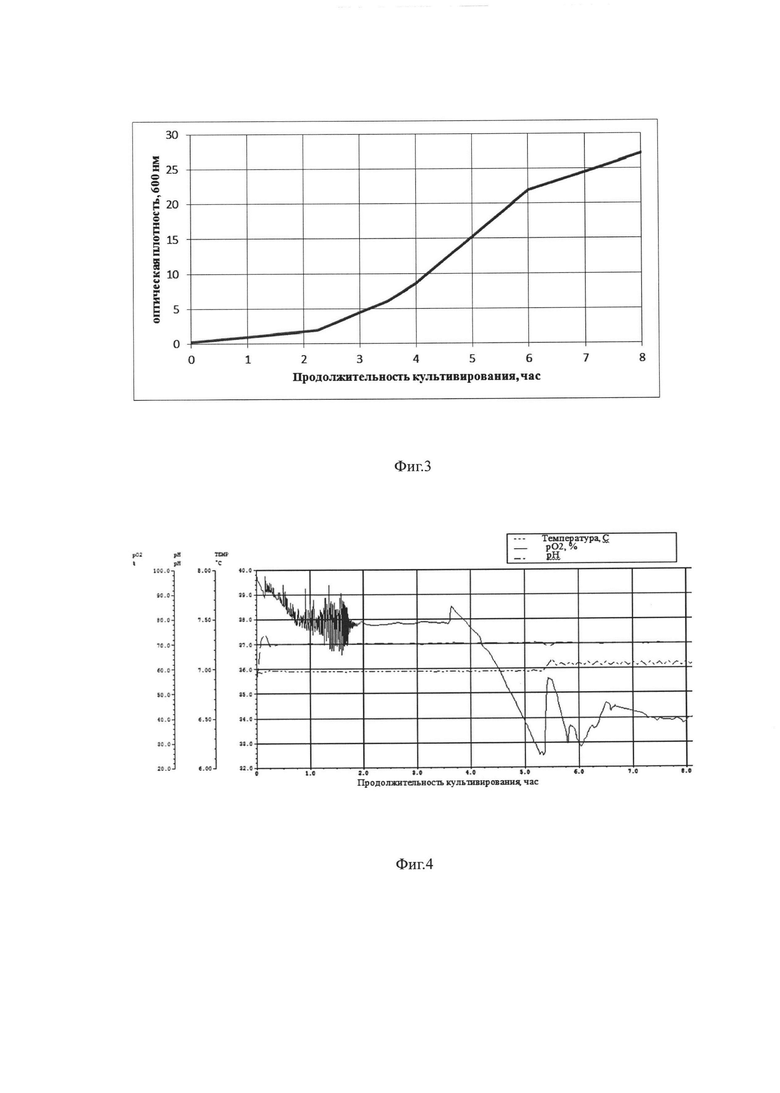
Фиг. 3. Динамика накопления биомассы при культивировании штамма-продуцента в объеме 15 л по предлагаемой схеме.
Фиг. 4. Параметры культивирования штамма-продуцента в объеме 15 л.
Фиг. 5. Анализ накопления белка нейраминидазы методом электрофореза в восстанавливающих условиях в 8% ПААГ при культивировании штамма-продуцента в объеме 15 л.
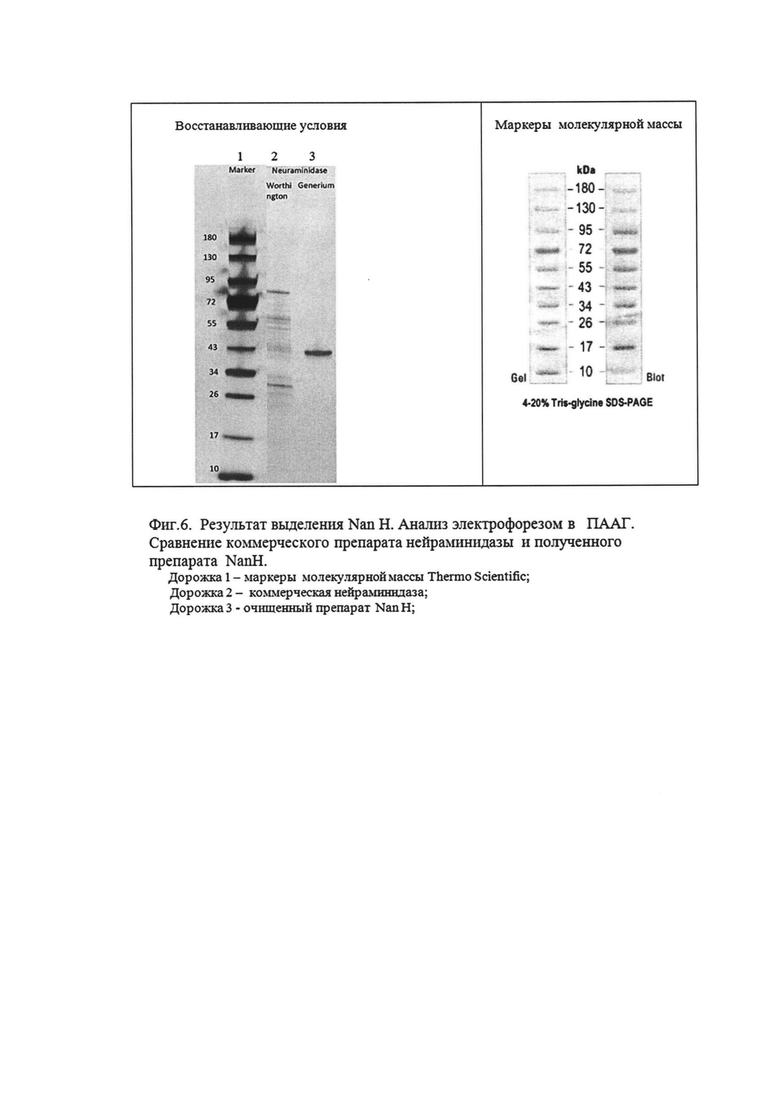
Фиг. 6. Результат выделения NanH. Анализ электрофорезом в ПААГ. Сравнение коммерческого препарата нейраминидазы и полученного препарата NanH.
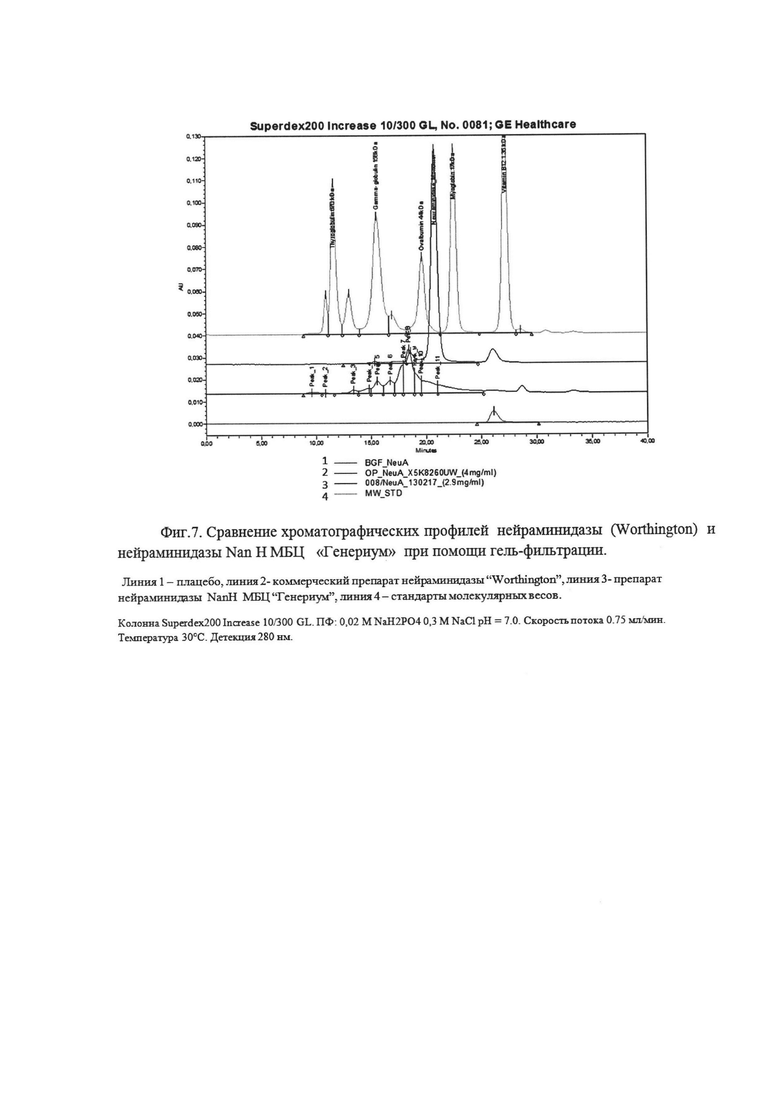
Фиг. 7. Сравнение хроматографических профилей нейраминидазы (Worthington) и нейраминидазы NanH МБЦ «Генериум» при помощи гель-фильтрации.
Фиг. 8. Результат анализа ГФ ВЭЖХ. Промышленная серия NanH.
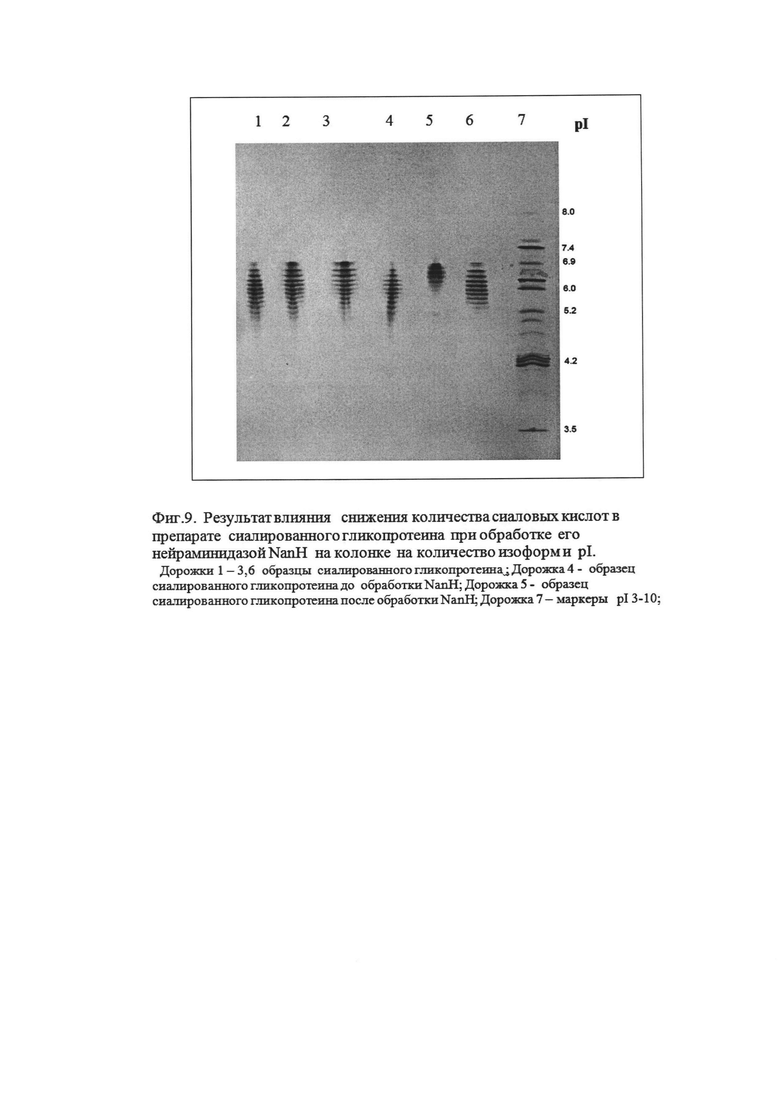
Фиг. 9. Результат влияния снижения количества сиаловых кислот в препарате белка при обработке NanH на колонке на количество изоформ и pI.
Отсутствие отечественных коммерчески доступных препаратов рекомбинантной нейраминидазы NanH из Clostridium perfringens, экспрессированных в E.coli, и чрезвычайно высокая стоимость препаратов у зарубежных производителей делает коммерчески невыгодным использование этих препаратов при производстве лекарственных средств. Препараты данных фирм производятся не в соответствии со стандартами «Надлежащей производственной практики» / «Good Manufacturing Practice» (GMP) и предназначены только для аналитических исследований.
 NanH - фермент, относящийся к семейству гликозил-гидролаз. Номенклатурное название - экзо-α-сиалидаза. Также употребимы названия: α-нейраминидаза, N-ацилнейраминидатгликогидролаза, сиалидаза.
NanH - фермент, относящийся к семейству гликозил-гидролаз. Номенклатурное название - экзо-α-сиалидаза. Также употребимы названия: α-нейраминидаза, N-ацилнейраминидатгликогидролаза, сиалидаза.
Сиалидазы гидролизуют α-кетозидную связь между сиаловыми кислотами и гликопротеинами, а также гликолипидами и полисахаридами (Фиг. 1), они также модулируют содержание сиаловой кислоты на поверхности клетки и регулируют иммунную систему (Sheh-Yi Sheu b, Huen-juin Tseng a, Shu-ping Huanga, Chin-hsiang Chien, Cloning, expression, and deletion analysis of large nanH of Clostridium perfringens ATCC 10543, // Enzyme and Microbial Technology - 2002. - V. 31. - P. 794-803, Annt M. Berry, Robert A. Lock, and James C. Paton, Cloning and Characterization of nanB, a Second Streptococcus pneumoniae Neuraminidase Gene, and Purification of the NanB Enzyme from Recombinant Escherichia coli, // Journal of bacteroliology - 1996, - V. 178. - N. 16. - P. 4854-4860).
Силиадазы широко распространены в природе, включая вирусы, простейших, бактерии, грибы, микоплазму и другие микроорганизмы, птиц, высших животных и людей. Возможно, наиболее широко изученная сиалидаза относится к вирусу гриппа (J.N. Varghese, W.G. Laver & P.М. Colman, Structure of the influenza virus glycoprotein antigen neuraminidase at 2.9  resolution, // Nature - 1983, - V. 303, - P. 35-40), считается, что она играет важную роль в репликации вируса и высвобождении из инфицированных клеток. У людей сиалидазы играют важную роль в лизосомальном катаболизме, а также в модуляции функциональных молекул, связанных со многими биологическими процессами (Komandoor Е. Achyuthan, Ann М. Achyuthan, Comparative enzymology, biochemistry and pathophysiology of human exo-α-sialidases (neuraminidases), // Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology - 2001. - V. 129. - P. 29-64). Нарушение их экспрессии и биосинтеза может привести к медицинским проблемам, таким как онкология, сиалидоз и галактосиалидоз. Изменения в сиалидазной активности также обнаруживаются при неврологических и психических расстройствах, таких как эпилепсия, алкоголизм, шизофрения и тяжелая депрессия. (Miyagi Т, Yamaguchi K., Mammalian sialidases: physiological and pathological roles in cellular functions, // Glycobiol - 2012, - V, 22. - P. 880-896).
resolution, // Nature - 1983, - V. 303, - P. 35-40), считается, что она играет важную роль в репликации вируса и высвобождении из инфицированных клеток. У людей сиалидазы играют важную роль в лизосомальном катаболизме, а также в модуляции функциональных молекул, связанных со многими биологическими процессами (Komandoor Е. Achyuthan, Ann М. Achyuthan, Comparative enzymology, biochemistry and pathophysiology of human exo-α-sialidases (neuraminidases), // Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology - 2001. - V. 129. - P. 29-64). Нарушение их экспрессии и биосинтеза может привести к медицинским проблемам, таким как онкология, сиалидоз и галактосиалидоз. Изменения в сиалидазной активности также обнаруживаются при неврологических и психических расстройствах, таких как эпилепсия, алкоголизм, шизофрения и тяжелая депрессия. (Miyagi Т, Yamaguchi K., Mammalian sialidases: physiological and pathological roles in cellular functions, // Glycobiol - 2012, - V, 22. - P. 880-896).
В бактериях сиалидазы могут использоваться для удаления сиаловых кислот в качестве питательных веществ из различных сиалированных субстратов или для распознавания сиаловых кислот, расположенных на поверхности клеток. Несмотря на факт, что бактериальные сиалидазы обладают многими схожими структурными особенностями, их биохимические свойства, особенно их субстратная специфичность, широко варьируются. Бактериальные сиалидазы могут катализировать гидролиз концевых сиаловых кислот, связанных α(2,3)-, α(2,6)- или α(2,8)- связью с различным диапазоном субстратов. Кроме того, некоторые из этих ферментов могут катализировать перенос сиаловых кислот при особых условиях среды, в том числе и нейраминидаза NanH, из сиалогликанов в асиалогликоконъюгаты через механизм реакции трансгликозилирования и могут быть использованы в синтезе сложных сиалилолигосахаридов с помощью хемоэнзиматических подходов и анализа структуры полученных гликанов. (Seonghun Kim, Doo-Byoung Oh, Hyun Ah Kang, Ohsuk Kwon, Features and applications of bacterial sialidases // Appl Microbiol Biotechnol - 2011. - V. 91. - P. 1-15).
Хемоэнзиматический синтез с использованием ферментов, особенно сиалидаз, которые могут выборочно проводить региостереоспецифическое формирование связи при мягких условиях реакции, был выделен в качестве перспективного метода для преодоления ограничений, связанных с классическим химическим синтезом. Schmidt D, Sauerbrei В, Thiem J., Chemoenzymatic synthesis of sialyl oligosaccharides with sialidases employing transglycosylation methodology // J Org Chem - 2000. - V. 65. - P. 8518-8526. Региоселективный гидролиз бактериальными сиалидазами может быть использован в качестве инструмента для анализа структуры сиалированных гликанов (Estrella R.P., Whitelock J.M., Roubin R.H., Packer N.H., Karlsson N.G., Small-scale enzymatic digestion of glycoproteins and proteoglycans for analysis of oligosaccharides by LC-MS and FACE gel electrophoresis, /// Methods Mol Biol - 2009. - V. 534. - P. 171-92.).
Таким образом, очевидна потребность в качественных препаратах сиалидаз, отвечающим постоянно растущим требованиям фармакологии и гликобиологии.
Многие микроорганизмы или бактериальные источники, используемые в настоящее время для производства нейраминидаз, являются либо патогенами человека, либо эти микроорганизмы и источники требуют относительно сложных ростовых сред и условий и дают лишь небольшие количества желаемого фермента, нейраминидазы (SU 1655987 А1, Способ получения очищенной нейраминидазы из холерного вибриона, 1987, US Patent 3259550, Production of neuraminidase // 1966, US Patent 4071408, Neuraminidase // 1978). Кроме того, получающиеся в результате нейраминидазы обычно загрязняются гликогидразами, протеазами, фосфолипазами, гемолизинами., бактериальными эндотоксинами. Эти примеси трудно удалить из полученной нейраминидазы. В заявленном изобретении предоставлен способ получения рекомбинантной нейраминидазы NanH, экспрессированной в Escherichia coli, в микроорганиизме, обычно не считающимся патогенным для человека.
Впервые нейраминидаза из Clostridium perfringens, анаэробного грам-позитивного рода Closrtidium perfringens, вызывающего газовую гангрену, выделенная из культуральной жидкости, охарактеризована в публикации Stephan Nees, 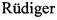 W. Veh and Roland Schauer, Purification and Characterization of Neuraminidase from Clostridium perfringens, // - Hoppe-Seyler's Z. Physiol. Chem. - 1975. - V. 356. - P. 1027-1042. Гены нейраминидазы были успешно клонированиы и секвенированы (Peter Roggentin, Bernd Rothe, Friedrich Lottspeich, Roland Schauer. Cloning and sequencing of a Clostridium perfringens sialidase gene. // - 1988. - FEBS Lett. - V. 238(1). - P. 31-34).
W. Veh and Roland Schauer, Purification and Characterization of Neuraminidase from Clostridium perfringens, // - Hoppe-Seyler's Z. Physiol. Chem. - 1975. - V. 356. - P. 1027-1042. Гены нейраминидазы были успешно клонированиы и секвенированы (Peter Roggentin, Bernd Rothe, Friedrich Lottspeich, Roland Schauer. Cloning and sequencing of a Clostridium perfringens sialidase gene. // - 1988. - FEBS Lett. - V. 238(1). - P. 31-34).
В последующих исследованиях было выяснено, что Clostridium perfringens производит три нейраминидазы, две из которых имеют молекулярную массу 71 кДа (NanI) и 129 kDa (NanJ) и являются секретируемыми экзосиалидазами (Jihong Li, Francisco A. Uzal and Bruce A.Mc Clane, Clostridium perfringens Sialidases: Potential Contributors to Intestinal Pathogenesis and Therapeutic Targets. // - 2016. - Toxins - V. 8. - P. 341-356), в то время как «маленький», 43 кДа (NanH) изофермент остается в клетках (Peter Roggentin, Reinhard G. Kleineidam, Roland Schauer. Diversity in the Properties of Two Sialidase Isoenzymes Produced by Clostridium perfringens spp. // - 1995 - Biol. Chem. Hoppe-Seyler. - V. 376. - P 569-575). Большая форма NanI (71 кДа) одна из самых изучаемых и наиболее известных бактериальных саилидаз. Ее получают из Closrtidium perfringens в промышленных масштабах и используют для научных работ. (Christina Traving, Roland Schauer, Peter Roggentin. Gene structure of the 'large' sialidase isoenzyme from Clostridium perfringens A99 and its relationship with other clostridial nanH proteins. // Glycoconjugate Journal. - 1994. - V. 11. - P. 141-151., Akihisa Takamizawa, Shigeru Miyata, Osamu Matsushita, Masato Kaji, Yuki Taniguchi, Eiji Tamai, Seiko Shimamoto, and Akinobu Okabe, High-level expression of clostridial sialidase using a ferredoxin gene promoter-based plasmid. // - 2004. - Protein Expression and Purification, - V. 36 - P. 70-75.) В то время как малая форма, хотя она и была клонирована и секвенирована одной из первых, долгое время не была хорошо изучена, поскольку все попытки очистить этот фермент из культуральной жидкости Clostridium perfringens были либо безуспешными, либо фермент выделялся в очень небольших количествах и был загрязнен примесями двух других ферментов. В работе Peter Roggentin, Reinhard G. Kleineidam and Roland Schauer. Diversity in the Properties of Two Sialidase Isoenzymes Produced by Clostridium perfringens spp. // - 1995. - Biol. Chem. Hoppe-Seyler. - V. 376. - P. 569-575., впервые была получена и охарактеризована клонированная в Escherichia coli «малая», (43 кДа) нейраминидаза NanH.
В публикации Susanne Kruse, Reinhard G. Kleineidam, Peter Roggentin, Roland Schauer, Expression and Purification of a Recombinant "Small" Sialidase from Clostridium perfringens A99. // Protein expression and purification. - 1996. - V. 7. - P. 415-422., был предложен способ получения очищенной NanH в исследовательских целях, по сути наиболее близкий к заявленному изобретению. Структурный ген очищали с помощью метода ПЦР и вводили в плазмидный вектор pQE-10, перенося шестигидидиновую аффинную метку (His6) на N-конец белка. Чтобы свести к минимуму протеолитическую деградацию белка, ген субклонировали в штамм BL21 (DE3) Escherichia coli pLys S с уменьшенной протеазной активностью. Затем авторы получают NanH в виде фьюжен-белка (белка, слитого с последовательностью из 6 гистидинов на N конце) с использованием аффинной хроматографии на Ni-NTA agarose и последующим гидролизом фьюжен-белка аминопептидазой К, с последующим диализом и ионообменной ВЭЖХ хроматографией на EMD TMAE-650S с последующим концентрированием активных фракций и диализом для перевода в буфер готовой формы. Выход с 1 л бактериальной культуры составил по данным авторов около 1 мг очищенного фермента NanH.
Данный метод выделения имеет свои очевидные недостатки для получения фермента в промышленных масштабах:
1. Низкий выход целевого белка.
2. Данная схема очистки с использованием аминопептидазы К является неприемлемой для масштабного производства препарата.
3. Использование ВЭЖХ чрезвычайно повышает стоимость продукта в связи с использованием дорогостоящих колонок, сорбентов, высокоочищенных растворителей. Масштабирование хроматографического разделения, как правило, проводится при низком давлении и целью является производство максимально возможного количества продукта в кратчайшие сроки и при минимуме затрат.
4. Авторы не сообщают об уровне содержания в препарате бактериальных эндотоксинов. Удаление бактериальных эндотоксинов является принципиальным и необходимым требованием, как с точки зрения российских, так и международных стандартов (ГФ XIII, Document Q AS/ 11.452 FINAL July 2012). Однако оно является технически трудновыполнимой задачей, поэтому содержание бактериальных эндотоксинов в промежуточных продуктах, применяемых при производстве ЛС, является критическим параметром.
5. Не оцениваются такой потенциально опасный контаминант, как клеточная ДНК, в том числе потенциально онкогенная.
Для решения задачи получения высокоочищенной нейраминидазы NanH в промышленных объемах авторы изобретения предлагают новый способ получения рекомбинантной нейраминидазы NanH из Clostridium perfringens, где рекомбинантный белок продуцируют в E.coli, а очистку белка из растворимой фракции клеточного лизата с проводят помощью металлохелатной хроматографии с последующей разделяющей хроматографией. Выход высокоочищенного активного препарата нейраминидазы NanH, пригодного для использования на производстве ЛС и гликобиологических исследований, составляет не менее 1,0 г с литра бактериальной культуры.
Основным техническим результатом изобретения является получение в промышленных масштабах активного белка NanH, имеющего высокую, не менее 87% хроматографической чистоты степень очистки. Данный белок пригоден для использования на производстве ЛС и гликобиологических исследований.
Для осуществления изобретения был создан штамм генно-инженерно-модифицированного микроорганизма E.coli NANH_CLOPF: штамм получен трансформацией реципиентного штамма-хозяина BL21(DE3) плазмидами pLysS, несущей ген Т7 лизоцима, являющегося ингибитором Т7 РНК полимеразы, рМТ1617 (pET15b-NANH_CLOPF), несущей ген белка NANH_CLOPF, составной частью которого являются последовательности 20 аминокислотных остатков, содержащих гексагистидиновый тэг, и 382 аминокислотных остатков сиалидазы (NanH) Clostridium perfringens. На Фиг. 2. представлена плазмидная карта рМТ1617 (экспрессионный вектор на основе pET15b для получения клостридиальной нейраминидазы NANH_CLOPF). Оптимизированная для трансляции в E.coli нуклеотидная последовательность ДНК, кодирующий белок NanH, приведена в составе SEQ ID NO1. Таким образом, был сконстурирован экспрессионный плазмидный вектор, кодирующий химерный белок с N-концевой химеризацией, составленной пептидными последовательностями шести гистидинов, сайт узнавания тромбина, а также 382 аминокислотных остатков сиалидазы (NanH) из Clostridium perfringens. (аминокислотная последовательность представлена SEQ ID NO 2),
Рефолдинг продукта не требуется, так как он синтезируется в бактериальной цитоплазме преимущественно в растворенном состоянии при культивировании штамма-продуцента E.coli с уровнем биосинтеза вариантов целевого белка не менее 1 г/л культуральной жидкости. Целевой белок NanH извлекают из клеток при лизисе бактериальных клеток с использованием гомогенизатора высокого давления.
Получение активного, хроматографически гомогенного с низким содержанием бактериальных эндотоксинов и ДНК хозяина препарата NanH достигается благодаря хроматографической очистке, включающей в себя металлохелатную хроматографию и разделяющую анионобменную хроматографию.
Основная очистка целевого белка от бактериальных эндотоксинов и примесных белков осуществляется на стадии анионообменной хроматографией.
В некоторых случаях включение в процесс дополнительной стадии - концентрирующей анионообменной хроматографии - позволяет элюировать целевой белок NanH в высокой концентрации и буфере готовой формы, исключая стадии концентрирования и перевода в буфер на мембранах и полых волокнах.
Если концентрация ЭДТА в элюирующем буфере при проведении элюции целевого белка не превышает концентрацию 5 мМ, целевой белок дополнительно очищается от бактериальных эндотоксинов и примесных белков.
Материалы и методы
Для экспрессии NanH получают генно-инженерные конструкции (ГИК) рМТ1617 (pET15b-NANH_CLOPF). Для получения ГИК, кодирующих NanH, была разработана схема клонирования на базе вектора pET15b(+) (Novagen), предполагающая получение версии, имеющей 6×His-tag на N-конце. Для получения соответствующей ГИК в компании ТОР Gene Technologies был заказан синтетический ген nanH (NANH_CLOPF), (предполагающий получение геномной последовательности бактерии Clostridium perfringens, кодирующей 382 аминокислотных остатка сиалидазы (NanH), слитой на 5'-конце с частью векторной последовательности материнской плазмиды pET15b(+)), кодирующий NANH_CLOPF, фланкированный сайтами рестрикции NdeI, BamHI и содержащий на 3'-конце последовательности стоп-кодоны (TGATAA). В TOP Gene Technologies провели кодон-оптимизацию последовательности для экспрессии белка в E.coli, принимая во внимание требование об отсутствии в последовательности «внутренних» сайтов эндонуклеаз рестрикции NdeI, BamHI, XhoI. Кодон-оптимизация полученной последовательности NanH проверена на сайте http://gcua.schoedl.de/sequential_v2.html. Соответствие транслируемой аминокислотной последовательности заказанной подтверждено с помощью выравнивания в программе MEGA 6.0. Отсутствие нежелательных сайтов рестрикции подтверждено с помощью программного обеспечения CloneManager 9.0. Отсутствие нежелательных сайтов рестрикции подтверждено с помощью программного обеспечения CloneManager 9.0.
Для получения ГИК рМТ1617 (pET15b-NANH_CLOPF) проведена наработка и рестрикционное картирование синтетического гена pAPG110-NANH_CLOPF. Согласно разработанной схеме проведено клонирование фрагмента, кодирующего клостридиальную нейраминидазу NanH (NANH_CLOPF) из плазмиды pAPG110-NANH_CLOPF, в векторную плазмиду pET15b по сайтам рестрикции NdeI, BamHII. Полученные в ходе рестрикции фрагменты очищали и использовали для лигирования. Лигазной смесью трансформировали химически компетентные клетки E.coli XL10-GOLD. Клетки высевали для получения трансформированных клонов.
Затем выделяли плазмидную ДНК и проводили рестрикционное картирование с использованием эндонуклеазы рестрикции BsrFI. Образец плазмидной ДНК передавали на секвенирование в компанию "Евроген". Полученная последовательность была выравнена с «теоретической» последовательностью рМТ1617.
Для проведения аналитической экспрессии плазмидную ДНК ГИК рМТ1617 трансформировали в штаммы BL21(DE3) pLysS. На основании аналитической экспрессии отбирали клоны-суперпродуценты NanH. Затем получали штамм-суперпродуцент NanH.
Для получения целевого белка NanH проводили препаративную экспрессию путем культивирования продуцента в полноценной питательной среде с относительным содержанием растворенного кислорода не менее 10% при температуре 37°С, значении рН - 6,5-7,6. Длительность процесса культивирования составляет 6-8 часов. Индукцию экспрессии целевого продукта на этапе биосинтеза обеспечивали внесением раствора изопропил-β-D-1-тиогалактопиранозида (ИПТГ) до конечной концентрации 1 мМ в питательной среде на 3-3,5 ч роста по достижении оптической плотности культуры 4,0-5,0 о.е.
С 3-3,5 часа культивирования плотности начинается этап биосинтеза гибридного белка. Экспрессия белка нейраминидазы находится под контролем промотора, который дерепрессируется внесением раствора ИПТГ до конечной концентрации 0,0238 мас. %. Культивирование проводили в течение 6-8 ч.
Уровень биосинтеза вариантов целевого белка нейраминидазы составляет не менее 0,65 г/л культуральной жидкости.
Бактериальную биомассу собирали центрифугированием и хранили при минус 70°С. Клеточную биомассу лизировали, лизат осветляли центрифугированием и проводили выделение белка NanH из лизата путем связывания целевого белка металлохелатной хроматографией на колонке с Ni2+ IMAC Sepharose FF. Доочищали фермент анионообменной хроматографией на Q Sepharose FF. На каждом этапе контроль степени очистки проводили электрофорезом в ПААГ.
Выход белка составляет не менее 1,0 г на литр бактериальной культуры.
Конечный продукт, полученный по изобретению, имеет следующие параметры:
- содержание белка (УФ-спектрофотометрия) - не менее 1,0 мг/мл;
- содержание бактериальных эндотоксинов (ГФ XIII, гель-тромб тест с ЛАЛ-реактивом ОФС.1.2.4.0006.15) не более 5 ЭЕ/мг;
- Хроматографическая чистота (ГФ ВЭЖХ) не менее 90%;
- Ферментативная активность (Колориметрический метод, "Neuraminidase Assay Kit" (Sigma-Aldrich) не менее 20 U/мг;
- Остаточная ДНК штамма-продуцента (Количественный ПЦР в реальном времени) не более 5 пг/мг;
С использованием методов очистки настоящего изобретения удалось получить препарат NanH с хроматографической чистотой, определенной с помощью гель-фильтрационной ВЭЖХ, 90% гомогенности.
Удельная активность препаратов NanH по настоящему изобретению составляет от 20 единиц/мг белка и выше.
Содержание бактериальных эндотоксинов в препарате NanH по настоящему изобретению составляет не более 4.3 ЕЭ /мг белка.
Содержание остаточной ДНК штамма продуцента в препарате NanH настоящего изобретения составляет не более 4,47 пг/мг белка.
Получение NanH на основе оптимизированной синтетической последовательности ДНК с короткой последовательностью из шести гистидинов на N-конце рекомбинантного белка происходит без удаления гексагистидинового тэга, что позволяет упростить очистку и удалить из схемы очистки применение дорогостоящих препаратов для удаления тэга. Аминокислотная последовательность NanH представлена SEQ ID NO 2.
В первой стадии авторы изобретения применяют в металлохелатной хроматографии коммерчески доступный сорбент IMAC Sepharose 6 FF. Применение на этой стадии промывок кислым буфером с высокой ионной силой позволяет в значительной степени удалить примеси клеточных белков из целевого продукта. Далее проводят анионообменную хроматографию, для которой может быть использован сорбент Q Sepharose FF. Применение данных сорбентов не ограничивает все варианты реализации изобретения, и специалист может применять в очистке белка любые известные сорбенты, пригодные для металлохелатной и анионобменной хроматографии белков с гексагистидиновым тагом. Существенным условием, необходимым для достижения технического результата, является в последовательность стадий металлохелатной и анионобменной хроматографии. Условия посадки и съема целевого белка подбираются для каждой стадии и каждого сорбента с помощью обычных технических приемов, известных квалифицированному специалисту, таким образом, чтобы максимально очистить целевой белок от контаминирующих примесей клеточных белков и бактериальных эндотоксинов. Таким образом был получен высокоочищенный активный препарат NanH, пригодный для использования на производстве ЛС и гликобиологических исследований, с выходом не менее 1 г с литра бактериальной культуры. Концентрирование очищенного препарата проводили с помощью концентрирующей анионообменной хроматографии, для которой также может быть использован сорбент Q Sepharose FF.
С использованием метода очистки, предложенного в заявленном изобретении, удалось получить препарат NanH с хроматографической чистотой, определенной с помощью ВЭЖХ, не менее чем 87%-ной гомогенности.
Удельная активность препаратов NanH, полученных раскрытым в изобретении способом, составляет 20 единиц/мг белка и выше; содержание бактериальных эндотоксинов составляет менее 4.3 ЕЭ/мг белка; содержание остаточной ДНК штамма продуцента составляет не более 4,47 пг/мг белка.
Заявленный способ позволяет получить препарат рекомбинантной NanH, имеющий более высокую степень чистоты по сравнению с коммерческими аналогами, результаты сравнения представлены в Таблице 1.
Пример 1. Микробиологический синтез белка NanH
Штамм-продуцент культивировали в ферментере (Biotron LiFlus SP/SL-20L, Юж. Корея) в объеме питательной среды 15 л. при поддержании рН на уровне 7,0-7,1. Культивирование вели при температуре 37°С. Относительное содержание растворенного кислорода поддерживали на уровне 25-100% путем перемешивания со скоростью 800 об/мин и подачи воздуха с объемным расходом 15 л/мин. Перед началом процесса в охлажденную питательную среду асептически вносят 50% раствор глюкозы - до конечной концентрации 0,5%. Инокулят в объеме 0,75 л, выращенный до оптической плотности, измеренной при длине волны 600 нм (ОД600), равной 1,3 о.е. (оптических единиц), вносят в ферментер со стерильной питательной средой, содержащей гидролизат казеина - 1,6%, дрожжевой экстракт - 1%, дигидрофосфат калия - 0,68%, сульфат аммония 0,33%, гидрофосфат натрия 0,71%. В ходе процесса культивирования производят мониторинг основных параметров роста культуры: ОД600, рН, морфология клеток, относительное содержание растворенного кислорода. На 3,0 час культивирования, когда оптическая плотность культуры достигает 4,4 о.е., вносят индуктор - стерильный раствор, содержащий 23,8% ИПТГ до конечной концентрации 0,0238% (1 мМ). Культивирование проводят на протяжении 10 часов. Конечная оптическая плотность - 27,2 о.е., выход биомассы - 100 г/л. Продуктивность по целевому продукту составляет 1 г/л культуральной жидкости.
На Фиг. 3. представлена динамика накопления биомассы при культивировании штамма-продуцента, на Фиг. 4. представлены параметры культивирования, на Фиг. 5. представлен анализ накопления белка нейраминидазы при культивировании методом электрофореза.
Пример 2. Выделение и очистка белка NanH из бактериальной биомассы. Получение промышленной серии препарата NanH.
2.1 Дезинтеграция биомассы.
Буфер А - 20 mM Tris HCl, 0.5 М NaCl, рН 7.8;
Замороженную биомассу клеток 128 г суспендируют в 160 мл буфера А с PMSF до 0,003% в течение 15 мин на льду и разрушают в проточном гомогенизаторе высокого давления Panda Plus 2000 (GEA Niro Soavi). Гомогенизатор промывают 250 мл охлажденной до 0°С водой очищенной, настраивают по охлажденному до 0°С буферу А, настройка II ступени - 135 бар, настройка I ступени - 630-780 бар, затем лизируют суспензию клеток в этом режиме, собирая лизат в емкость, помещенную в ледяную баню, промывают гомогенизатор 30 мл буфера А. Лизис повторяют еще 2 раза в том же режиме. Лизат объемом 1400 мл осветляют центрифугированием 33250×g (JLA-16.250) при 4°С в течение 120 мин.
2.2. Металлохелатная хроматография.
Супернатант 1300 мл, разбавляют буфером А до 1400 мл, доводят рН до 7,8 2М NaOH, фильтруют через глубинный фильтр Sartopor 2 300, добавляют имидазол до концентрации 3 мМ и наносят на колонку с Ni2+ IMAC Sepharose, уравновешенную буфером А. После нанесения колонку промывают буфером А, натрий-ацетатным буфером с 1 М NaCl, рН 5.8, промывают буфером, содержащим 15 мМ имидазола. Целевой белок элюируют 300 мМ имидазола.
2.3. Разделяющая хроматография.
Элюат с Ni2+ IMAC Sepharose разбавляют в 6 раз, доводят рН до 7,8 2М NaOH, осветляют центрифугированием 33250×g (JLA-16.250) при 4°С в течение 20 мин и наносят на колонку Q Sepharose FF, уравновешенную буфером 20 mM Tris HCl, рН 7.8. Отмывают тем же буфером до выхода элюата не сорбировавшихся компонентов а затем буфером 20 mM Tris HCl, 5 mM EDTA, рН 7.5 до оптической плотности 20 mAU. Элюируют целевой белок этим же буфером.
2.4 Концентрирующая хроматография.
Элюат после хроматографии на Q Sepharose FF-1 разбавляют в 5 раз и вновь наносят на колонку Q Sepharose FF, уравновешенную буфером 20 mM Tris HCl, рН 7.8. Отмывают буфером для уравновешивания до выхода элюата не сорбировавшихся компонентов, затем буфером 20 mM Tris HCl, 5 mM EDTA, рН 7.5 до выхода проводимости 2.7 mSm/sm, элюируют этим же буфером, содержащим 70 мМ NaCl.
2.5 Разведение, стерилизующая фильтрация и фасовка.
Буфер F-20 mM Tris HCl, 5 mM EDTA, 70 mM NaCl, рН 7.5;
Элюат с Q Sepharose FF-2 разбавляют буфером готовой формы: 20 mM Tris HCl, 5 mM EDTA, 70 mM NaCl, рН 7.5 до концентрации белка 1,0-3,0 мг,мл, и стерильно фильтруют через FILTER-MAX, "rapid" - 150 ml, 0.22 μm, аликвотируют и хранят при минус 20°С.
Получено:
670,0 мл, ε280=1,65, С=2.2 мг/мл, 1474 мг
Содержание бактериальных эндотоксинов: От 0,3 до 0,6 ЕЭ/мл.
Активность на синтетическом субстрате: 34.9 U/мг.
Чистота образца по ГФ ВЭЖХ составляет: 90,0%.
Остаточная ДНК штамма продуцента (E.colli): ≤1,7 пг/мг.
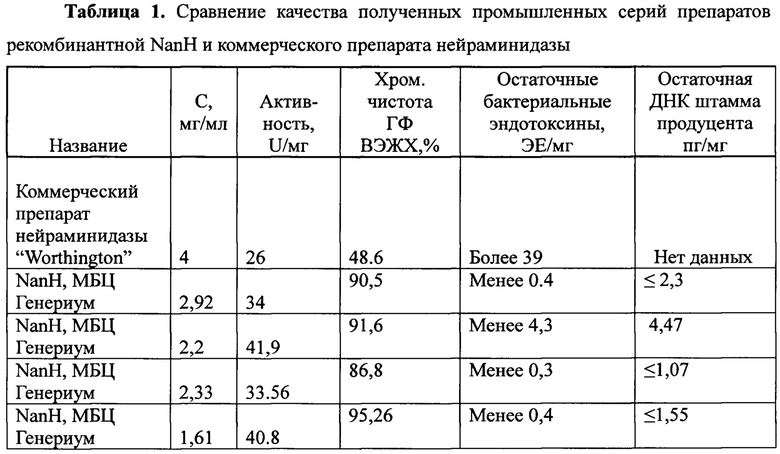
Пример 3. Анализ активности рекомбинантной NanH.
Для определения активности NanH используют набор "Neuraminidase Assay Kit" (Sigma-Aldrich, cat# MAK121). Нейраминидазная активность в образце, определяемая при ферментном высвобождении сиаловой кислоты, прямо пропорциональна количеству продукта, содержание которого измеряется колориметрически при длине волны 570 нм.
В этом методе линейный диапазон измерения находится в пределах 0.1-10 units/L.
Для проведения анализа вносят 20 мкл 10 mM стандарта (cat# MAK121F) в 480 мкл воды очищенной для получения 400 μМ стандартного рабочего раствора. Затем в пробирки вносят 0, 15, 30, и 50 мкл стандартного рабочего раствора, добавляют воды очищенной до конечного объема 50 мкл. Концентрация полученных стандартных растворов - 0 (вода), 120, 240 и 400 μМ. Вносят по 20 мкл каждого стандартного образца в лунки 96-луночного планшета.
Если активность образцов выше 10 units/L, разбавляют образцы в БГФ для нейраминидазы (20 mM Tris HCl,5 mM EDTA, 70 mM NaCl, рН 7.5), а затем в том же буфере, но содержащем БСА в концентрации 0,1 мг/мл (учитывая в дальнейшем коэффициент разбавления). Образец в объеме 20 мкл вносят в две лунки 96-луночного планшета. Одна лунка будет использоваться для определения активности образца, вторая в качестве бланка (Sample blank).
Готовят реакционную смесь для образцов и стандартов, а также для Sample blank (не содержит субстрат) согласно процедуре, указанной в инструкции к набору:
Добавляют 80 мкл реакционной смеси в каждую лунку планшета, перемешивают и инкубирую при температуре 37°С в защищенном от света месте.
Измеряют оптическую плотность образцов и стандартов через 20 минут при длине волны 570 нм.
Продолжают инкубацию планшета при температуре 37°С еще в течение 30 минут. Измеряют оптическую плотность образцов и стандартов при длине волны 570 нм.
Вычисление нейраминидазной активности препарата NanH производят по формуле:
units/L=ΔMsample-ΔMblank-ΔMwater/Slope*t
где:
ΔMsample, ΔMblank, ΔMwater - разность оптических плотностей образца, Sample blank и water.
Slope - наклон калибровочной кривой.
t - время между измерениями оптической плотности (30 мин).
Результаты тестирования образцов, полученных способом, описываемым в нашем изобретении и коммерческого образца, представлены в таблице 2.
Пример 4. Электрофоретическое разделение белков
Электрофорез проводят в 4-20% градиентном ПААГ в восстанавливающих условиях, окрашивают солями серебра (Thermo Scientific).
Пробоподготовку образцов проводят разведением образцов до концентрации ~50 мкг/мл добавлением буфера для нанесения проб (S.b.) с добавлением 2 М раствора дитиотреитола (ДТТ). Прогревают в течение 5 минут при (100±2)°С. Центрифугируют 1 мин., 13000 об/мин и наносят пробы (растворы, полученные при разведении образцов) по 10 мкл в лунку геля, маркеры молекулярной массы - 5 мкл в лунку геля.
Электрофорез проводят при напряжении 400 В, силе тока 30 мА, до выхода красителя. Затем окрашивают солями серебра по инструкции к набору Thermo Scientific. Результаты представлены на Фиг. 6.
Пример 5. Тестирование очищенных препаратов рекомбинантной NanH в сравнении с коммерческим препаратом нейраминидазы на содержание бактериальных эндотоксинов.
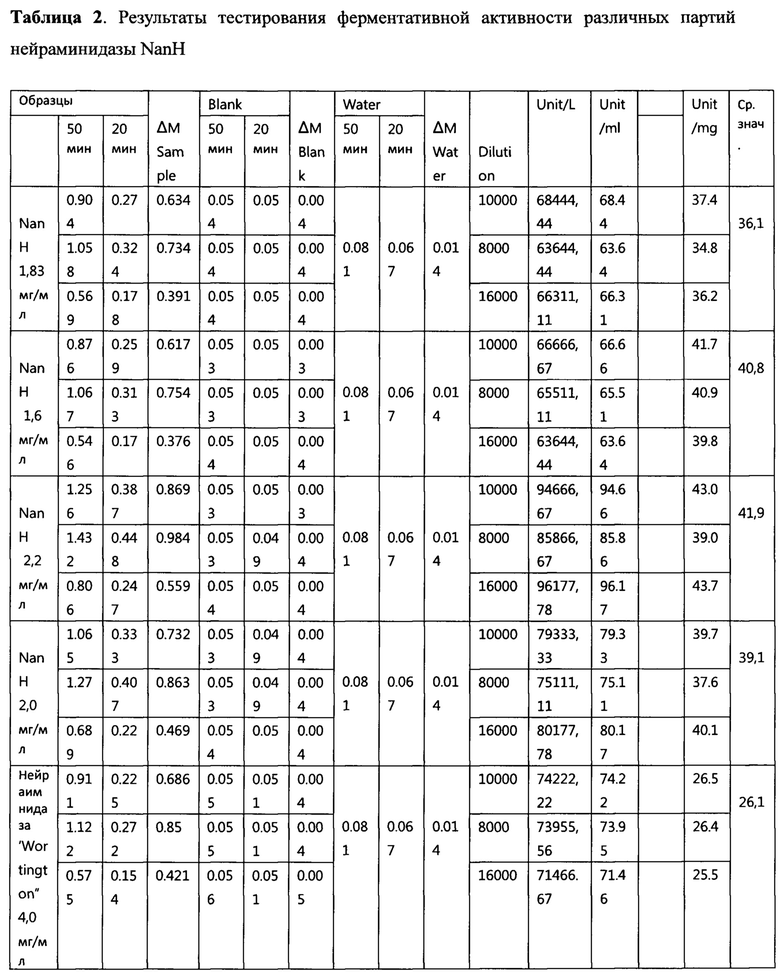
Анализ на содержание бактериальных эндотоксинов проводят методом гель-тромб теста в соответствии с ГФ XIII, гель-тромб тест с ЛАЛ-реактивом ОФС.1.2.4.0006.15. Образцы разводят водой для лал-теста («Пиротест», Россия). Используют для работы: LAL-реактив Endosafe (Charles River, USA) с чувствительностью 0,03 ЕЭ/мл; Контрольный стандартный образец эндотоксина (Charles River, USA) с содержанием 20 ЕЭ/мл. В пробирки для анализа помещают по 100 мкл образцов и по 100 мкл LAL-реактива и инкубируют в течение 60 мин при температуре 37°С. Положительный результат: образование плотного сгустка геля. При переворачивании пробирки на 180 градусов гель не разрушается. Отрицательный результат: гель не образуется или разрушается при переворачивании пробирки.
Содержание эндотоксинов в конечной точке выражается в ЕЭ/мл и рассчитывается по формуле: «С» = (разведение в конечной точке) × (чувствительность LAL-реактива). Полученные результаты представлены в Таблице 3.
Примечания к таблице:
«+» - положительный результат, эндотоксины присутствуют; «-» - отрицательный результат, эндотоксины не обнаруживаются.
Положительный результат: образование плотного сгустка геля. При переворачивании пробирки на 180 градусов гель не разрушается. Отрицательный результат: гель не образуется или разрушается при переворачивании пробирки.
Содержание эндотоксинов в конечной точке выражается в ЕЭ/мл и рассчитывается по формуле: «С» = (разведение в конечной точке) × (чувствительность LAL-реактива).
Пример 6. Тестирование хроматографической чистоты очищенных препаратов рекомбинантной NanH в сравнении с коммерческим препаратом нейраминидазы.
Тестирование производят методом ВЭЖХ гель-фильтрации на колонке с Superdex200 Increase 10/300 GL (GE) на хроматографической системе ВЭЖХ Alliance 2695, UV/Visible Detector 2487 (Waters). В качестве подвижной фазы используют буфер 0,02 М NaH2PO4; 0,3 М NaCl; рН=7.0. Анализ коммерческого препарата нейраминидазы был выполнен в одной повторности в связи с малым количеством образца и его высокой стоимостью. Анализ NanH от МБЦ «Генериум» был выполнен в трех повторностях. Сравнение хроматографических профилей испытуемых образцов показывает (Фиг. 7.), что NanH МБЦ «Генериум» существенно более однородна по составу, тогда как коммерческая нейраминидаза более гетерогенна, что вызывает трудности в определении основного пика на хроматограмме коммерческого образца.
Хроматографическая чистота NanH МБЦ «Генериум», представлен на Фиг. 8, значительно выше, чем коммерческого препарата нейраминидазы, результаты представлены в Таблице 4.

Пример 8. Тестирование очищенных препаратов рекомбинантной NanH на остаточную ДНК штамма продуцента.
Тестирование на остаточную ДНК штамма продуцента проводят методом количественного ПЦР в реальном времени, не более 20 пг/мг. Для дизайна количественной полимеразной цепной реакции (The quantitative polymerase chain reaction - QPCR) была выбрана система Taqman, в которой при размножении специфической последовательности ДНКа, зонд деградируется ДНКа-полимеразой. Перед проведением тестирования образцы были очищены с использованием набора QIAamp DNA Blood Mini Kit (Qiagen). Конечный объем при элюции составил 50 мкл. В реакцию qPCR (пробу) добавляли 10 мкл образца. Количество повторов для каждого образца - 3.
Количество ДНК в пробе менее 0,5 пг ниже предела достоверного обнаружения. Результаты анализа представлены в Таблице 4.

Пример 9. Изучение влияния снижения количества сиаловых кислот в препарате белка при обработке NanH на колонке на количество изоформ и pI.
Ремоделирование белка нейраминидазой NanH производства ОМВТ «Генериум» проводили на колонке с аффинным сорбентом. В полученном ремоделированном белке определяли количество изоформ pI методом изоэлектрического фокусирования в денатурирующих условиях в предзалитом полиакриламидном геле (ПААГ) с окрашиванием раствором кумасси Р 250, с использованием прибора для изофокусирования «Multiphor II», результаты представлены на Фиг. 9. Для ремоделированного бела характерно уменьшение числа изоформ и смещение их pI в более щелочную область по сравнению с образцом белка до ремоделирования и другими образцами белка, что говорит о значительном уменьшении сиаловых кислот в образце белка после обработки нейраминидазой NanH.
Список последовательностей
SEQ ID NO. 1
Первичная последовательность фрагмента ДНК вектора рМТ1617, заключающего ген белка NANH_CLOPF.

SEQ ID NO 2
Аминокислотная последовательность NANH с гексагистидиновым тагом

Список последовательностей
SEQ ID NO. 1
Первичная последовательность фрагмента ДНК вектора pMT1617, заключающего ген белка NANH_CLOPF.
ATG GGC AGC AGC CAT CAT CAT CAT CAT CAC AGC AGC GGC CTG GTG CCG CGC GGC AGC CAT
ATG TGC AAC AAA AAC AAT ACC TTT GAA AAA AAC CTG GAT ATT AGC CAT AAA CCG GAA CCG
CTG ATT CTG TTT AAC AAA GAT AAC AAC ATT TGG AAC AGC AAA TAT TTT CGC ATT CCG AAC
ATT CAG CTG CTG AAC GAT GGT ACC ATT CTG ACC TTT AGC GAT ATT CGC TAT AAT GGT CCG
GAT GAT CAT GCG TAT ATT GAT ATT GCG AGC GCA CGC AGC ACC GAT TTT GGC AAA ACC TGG
AGC TAT AAC ATT GCG ATG AAA AAC AAT CGC ATT GAT AGC ACC TAT AGC CGC GTG ATG GAT
AGC ACC ACC GTG ATT ACC AAC ACC GGT CGC ATT ATT CTG ATT GCA GGC AGC TGG AAC ACC
AAT GGC AAC TGG GCG ATG ACC ACC AGC ACC CGT CGC AGC GAT TGG AGC GTG CAG ATG ATT
TAT AGC GAT GAT AAT GGC CTG ACC TGG AGC AAC AAA ATT GAT CTG ACC AAA GAT AGC AGC
AAA GTG AAA AAC CAG CCG AGC AAC ACC ATT GGT TGG CTG GGT GGC GTG GGC AGC GGC ATT
GTG ATG GAT GAT GGC ACC ATT GTG ATG CCG GCG CAG ATT AGC CTG CGC GAA AAC AAC GAA
AAC AAT TAC TAT AGT CTG ATT ATT TAT AGC AAA GAT AAT GGC GAA ACC TGG ACC ATG GGC
AAC AAA GTG CCG AAC AGC AAC ACC AGC GAA AAC ATG GTG ATT GAA CTG GAT GGT GCG CTG
ATT ATG AGC ACC CGC TAT GAT TAT AGC GGC TAT CGT GCA GCG TAT ATT AGC CAT GAT CTG
GGC ACC ACC TGG GAA ATT TAT GAA CCG CTG AAT GGC AAA ATT CTG ACC GGC AAA GGC AGC
GGC TGC CAG GGC AGC TTT ATT AAA GCG ACC ACC AGC AAT GGC CAT CGC ATT GGC CTG ATT
AGC GCA CCG AAA AAC ACC AAA GGC GAA TAT ATT CGC GAT AAC ATT GCG GTG TAT ATG ATT
GAT TTT GAT GAT CTG AGC AAA GGC GTG CAG GAA ATT TGC ATT CCG TAT CCG GAA GAT GGC
AAC AAA CTG GGT GGT GGC TAT AGC TGC CTG AGC TTT AAA AAC AAC CAT CTG GGC ATT GTG
TAT GAA GCG AAT GGC AAC ATT GAA TAT CAG GAT CTG ACC CCG TAT TAT AGC CTG ATT AAC
AAA CAG TGA TAA GGA TCC
SEQ ID NO 2
Аминокислотная последовательность NANH с гексагистидиновым тагом
MGSSHHHHHHSSGLVPRGSHMCNKNNTFEKNLDISHKPEPLILFNKDNNIWNSKYFRIPNIQLLNDGTILTFSDIRYNGPDDHAYIDIASARSTDFGKTWSYNIAMKNNRIDSTYSRVMDSTTVITNTGRIILIAGSWNTNGNWAMTTSTRRSDWSVQMIYSDDNGLTWSNKIDLTKDSSKVKNQPSNTIGWLGGVGSGIVMDDGTIVMPAQISLRENNENNYYSLIIYSKDNGETWTMGNKVPNSNTSENMVIELDGALIMSTRYDYSGYRAAYISHDLGTTWEIYEPLNGKILTGKGSGCQGSFIKATTSNGHRIGLISAPKNTKGEYIRDNIAVYMIDFDDLSKGVQEICIPYPEDGNKLGGGYSCLSFKNNHLGIVYEANGNIEYQDLTPYYSLINKQ.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК-АПТАМЕРОВ, СВЯЗЫВАЮЩАЯСЯ С ПРОТЕОЛИТИЧЕСКОЙ СУБЪЕДИНИЦЕЙ НЕЙРОТОКСИНА ТИПА A CLOSTRIDIUM BOTULINUM | 2014 |
|
RU2571210C1 |
| Рекомбинантный слитый белок | 2019 |
|
RU2732795C1 |
| Способ получения аттенуированного бесплазмидного штамма F.tularensis 15 CMSA, синтезирующего микобактериальный антиген супероксиддисмутазу А | 2019 |
|
RU2745161C1 |
| АТТЕНУИРОВАННЫЙ ШТАММ ВИРУСА СЕНДАЙ | 2013 |
|
RU2552487C2 |
| Рекомбинантный белок GBO-ActRIIB для увеличения мышечной массы сельскохозяйственных животных и птицы | 2022 |
|
RU2792817C1 |
| Способ получения линии гуманизированных мышей, содержащих инсерцию 3974insT в гене mGrin2a (mice glutamate [NMDA] receptor subunit epsilon-1), приводящую к преждевременному прекращению трансляции белка grin2a | 2021 |
|
RU2764650C1 |
| Генетическая конструкция, адаптированная для доставки гена SMN1 человека с помощью аденоассоциированного вируса серотипа 2 для обеспечения нейроспецифичной экспрессии | 2022 |
|
RU2801848C1 |
| Последовательность нуклеотидов, кодирующая β-N-ацетилгексозаминидазу Aggregatibacter actinomycetemcomitans, и генетические конструкции, её содержащие | 2021 |
|
RU2789544C1 |
| РЕКОМБИНАНТНЫЕ ПЛАЗМИДНЫЕ ДНК, КОДИРУЮЩИЕ СИНТЕЗ ПРОИЗВОДНЫХ СОМАТОТРОПНОГО ГОРМОНА ЧЕЛОВЕКА, СПОСОБ ИХ КОНСТРУИРОВАНИЯ, ШТАММЫ ESCHERICHIA COLI, СОДЕРЖАЩИЕ ЭТИ ПЛАЗМИДЫ - ПРОДУЦЕНТЫ ПРОИЗВОДНЫХ СОМАТОТРОПНОГО ГОРМОНА ЧЕЛОВЕКА (ИХ ВАРИАНТЫ) | 1983 |
|
RU1248280C |
| БИОСЕНСОРНАЯ СИСТЕМА ДЛЯ БЫСТРОГО ОБНАРУЖЕНИЯ ОПРЕДЕЛЯЕМЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717658C2 |




Изобретение относится к области биотехнологии, а именно к способам выделения и очистки рекомбинантных белков, в частности к получению высокоочищенного препарата рекомбинантной нейраминидазы NanH. Получение активного, хроматографически гомогенного с низким содержанием бактериальных эндотоксинов и ДНК хозяина препарата NanH в промышленных масштабах достигается благодаря схеме хроматографической очистки, включающей в себя металлохелатную хроматографию и разделяющую хроматографию. Нейраминидазу NanH получают на основе оптимизированной синтетической последовательности ДНК, без удаления содержащейся на N-конце рекомбинантного белка короткой последовательности из шести гистидинов, что позволяет упростить очистку и удалить из схемы очистки применение дорогостоящего препарата тромбина. Уже на первой стадии металлохелатной хроматографии происходит максимальная очистка целевого белка от контаминирующих примесей клеточных белков. Изобретение позволяет получить более высокий, по сравнению с применяемыми ранее способами, выход целевого белка: не менее 1,0 г с 1 л культуральной жидкости. 8 з.п. ф-лы, 9 ил., 5 табл., 9 пр.
1. Способ получения рекомбинантной нейраминидазы NanH, включающий экспрессию в |E. coli плазмиды, содержащей ген белка NanH, слитого с последовательностью из 6 гистидинов, металлохелатную хроматографию и концентрирование, отличающийся тем, что в процессе очистки белка гидролиз гистидинового тага не производится и после металлохелатной хроматографии проводят разделяющую хроматографию.
2. Способ по п. 1, где для экспрессии белка применяют плазмиду pET15b.
3. Способ по любому из пп. 1, 2, где для экспрессии белка применяют штамм BL21(DE3) pLysS.
4. Способ по любому из пп. 1-3, где для металлохелатной хроматографии применяют IMAC Sepharose 6 FF.
5. Способ по любому из пп. 1-4, где в качестве разделяющей хроматографии применяют анионообменную хроматографию.
6. Способ по п. 5, где концентрирование проводят путем хроматографии.
7. Способ по п. 6, где для концентрирования применяют анионообменную хроматографию.
8. Способ по любому из пп. 5-7, где при концентрировании применяют Q Sepharose FF.
9. Способ по п. 8, где при элюции белка в концентрирующей хроматографии применяют ЭДТА в концентрации не более 5 мМ.
| S.KRUSE et al | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Protein Expr Purif | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| US 4071408 A1, 31.01.1978 | |||
| Способ получения очищенной нейраминидазы холерного вибриона | 1989 |
|
SU1655987A1 |
Авторы
Даты
2019-08-29—Публикация
2018-10-22—Подача