ОБЛАСТЬ ТЕХНИКИ
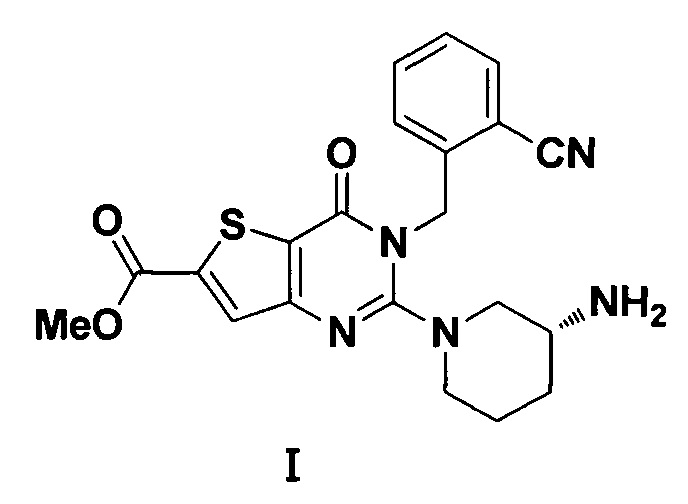
Настоящее изобретение относится к области фармацевтической химии и, более конкретно, к кристаллической форме А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]пиримидин-6-карбоновой кислоты и способу ее получения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТНЕХНИКИ
Сахарный диабет (DM) представляет собой метаболическое заболевание, имеющее множественные причины, и представляет собой синдром ряда нарушений метаболизма белков, жиров, воды, электролитов и тому подобное, вызванных абсолютным или относительным недостатком секреции инсулина в организме человека или пониженной чувствительностью клеток-мишеней к инсулину. Острые осложнения диабета включают диабетический кетоацидоз, гиперосмолярную диабетическую кому, множество острых инфекций и лактатацидоз и так далее. Кроме того, гипогликемия, имеющаяся при лечении диабета, также является одним из наиболее часто встречающихся острых осложнений. Хронические осложнения диабета включают диабетическое заболевание глаз, диабетическую нефропатию, диабетическую нейропатию, диабетическое макрососудистое заболевание сердца и лимбической системы мозга и диабетическую стопу и повреждения кожи и т.д.
Диабет II типа представляет собой тип метаболического синдрома, вызванный неконтролируемыми уровнями глюкозы в крови in vivo. Диабет II типа характеризуется высоким уровнем глюкозы в крови, инсулинорезистентностью и недостатком секреции инсулина, и обычно ассоциирован с дислипидемией, гипертензией и ожирением. Диабет II типа является всемирной эпидемией, и во всем мире 6% населения в настоящее время страдает от диабета II типа, который стал третьим в мире хроническим неинфекционным заболеванием, угрожающим здоровью человека. Пациенты с диабетом II типа могут продуцировать инсулин в организме человека, но его количество является относительно недостаточным, или полученный инсулин не может функционировать эффективно вследствие пониженной чувствительности тканей или инсулинорезистентности, таким образом, в крови накапливается глюкоза, и уровень глюкозы повышается. Так как данный тип пациентов с диабетом может секретировать инсулин, инсулиновая терапия обычно не требуется, и глюкозу в крови можно контролировать только подбором диеты или пероральными гипогликемическими средствами.
В 2000 году в мире был примерно 171 миллион диабетиков. Ожидают, что при отсутствии эффективного лечения в 2030 году число диабетиков достигнет 360 миллионов, из которых более чем 90% будет представлять собой диабет II типа. В Китае затраты на лечение диабета составляют вплоть до 173,4 миллиарда китайских юаней в год, вызванные диабетом прямые медицинские затраты составили 13% общих медицинских расходов в Китае. Ожидают, что число пациентов с диабетом в Соединенных Штатах достигнет 50 миллионов в 2028 году при ежегодной скорости роста 5%. В то время как в Китае число пациентов с диабетом составляющее вплоть до 92,5 миллионов в настоящее время, как ожидается, достигнет 100 миллионов в 2028 при ежегодной скорости роста 4%. Будучи сложным заболеванием, пациенты с диабетом II типа обладают сильной неоднородностью, и жители Востока обладают более высокой чувствительностью к диабету II типа, чем жители Запада, и потребность в индивидуально подобранном лечении является высокой.
Современные лекарственные средства для лечения диабета II типа главным образом включают инсулин, сульфонилмочевины, метформин, тиазолидиндионы, двойные агонисты PPARα/γ, ингибиторы DPP IV (дипептидилпепдидаза IV) и аналоги GLP-1. Несмотря на то, что существующие лекарственные средства могут контролировать уровни глюкозы в крови и уменьшать возникновение осложнений, большинство из них имеют более серьезные побочные эффекты, такие как желудочно-кишечная токсичность, набор массы, отек, гипогликемия и тому подобное, и они не могут фундаментально контролировать и излечивать диабет II типа. Так как традиционные лекарственные средства для лечения диабета оказывают ограниченный эффект и имеют плохую переносимость, а также очевидные побочные эффекты, с точки зрения здоровья человека и экономических интересов, исследование и разработка безопасных и высоко эффективных лекарственных средств для лечения диабета имеет важную исследовательскую значимость.
Ингибиторы DPP IV могут значимо снижать уровни глюкозы в крови в организме, повышать толерантность к глюкозе, стимулировать секрецию инсулина, снижать уровень глюкагона, задерживать инсулинорезистентность и повышать ответный уровень инсулина при повышении уровня глюкозы в крови у пациентов с диабетом II типа. По сравнению с существующими пероральными противодиабетическими лекарственными средствами, ингибиторы DPP IV имеют следующие характеристики: (1) они не требуют инъекций и постоянно снижают уровень гликозилированного гемоглобина в результате перорального введения; (2) имеют хорошую переносимость после длительного применения; (3) могут усиливать секрецию инсулина и улучшать высвобождение глюкагона; (4) улучшают чувствительность к инсулину и повышают функцию β-клеток поджелудочной железы; (5) более низкая встречаемость гипогликемии, и это не будет вызывать набор веса, тошноту и рвоту, и желудочно-кишечную дисфункцию; (6) оказывают синергетический эффект при использовании с другими лекарственными средствами против диабета II типа.
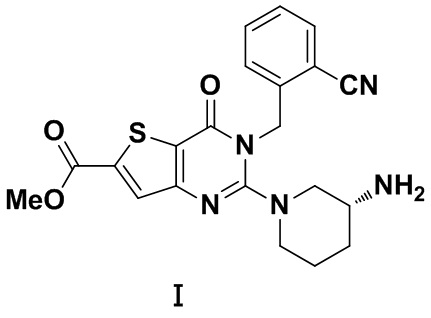
(R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]пиримидин-6-карбоновая кислота (Формула I) является новым ингибитором DPP IV с сильной активностью снижения уровня глюкозы в крови in vivo. Однако общая эффективность существующих разных кристаллических форм (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен [3,2-d]пиримидин-6-карбоновой кислоты все еще является неудовлетворительной.
Вследствие этого существует насущная необходимость в данной области в разработке новой кристаллической формы (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]пиримидин-6-карбоновой кислоты с высокой эффективностью, низкой токсичностью и длительным эффектом, так чтобы получать фармацевтически активный ингредиент с лучшей эффективностью.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Одной из целей настоящего изобретения является обеспечение кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]пиримидин-6-карбоновой кислоты с высокой эффективностью, низкой токсичностью и длительным эффектом.
В первом аспекте настоящего изобретения предложена кристаллическая форма А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]пиримидин-6-карбоновой кислоты формулы I, профиль порошковой рентгеновской дифрактограммы (ПРД) кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 8,87±0,2  , 14,18±0,2
, 14,18±0,2  ,20,67±0,2
,20,67±0,2  ,25,18±0,2
,25,18±0,2  ,28,61±0,2
,28,61±0,2  .
.
В другом предпочтительном воплощении профиль ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 8,87  , 14,18
, 14,18 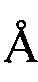 , 20,67
, 20,67 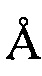 , 25,18
, 25,18 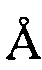 , 28,61
, 28,61 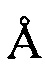 .
.
В другом предпочтительном воплощении профиль ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 7,25±0,2  , 8,09±0,2
, 8,09±0,2 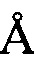 , 8,87±0,2
, 8,87±0,2 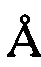 , 14,18±0,2
, 14,18±0,2 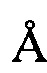 , 16,65±0,2
, 16,65±0,2 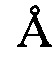 , 20,67±0,2
, 20,67±0,2  , 21,95±0,2
, 21,95±0,2 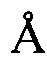 , 25,18±0,2
, 25,18±0,2 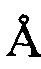 , 28,61±0,2
, 28,61±0,2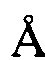 .
.
В другом предпочтительном воплощении профиль ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 7,25 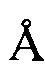 , 8,09
, 8,09 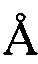 , 8,87
, 8,87 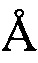 , 14,18
, 14,18 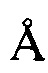 , 16,65
, 16,65 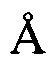 , 20,67
, 20,67  , 21,95
, 21,95 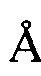 , 25,18
, 25,18  , 28,61
, 28,61  .
.
В другом предпочтительном воплощении профиль ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 7,25±0,2  , 8,09±0,2
, 8,09±0,2  , 8,87±0,2
, 8,87±0,2  , 14,18±0,2
, 14,18±0,2  , 16,65±0,2
, 16,65±0,2  , 19,03±0,2
, 19,03±0,2  , 20,01±0,2
, 20,01±0,2  , 20,67±0,2
, 20,67±0,2 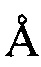 , 21,95±0,2
, 21,95±0,2  , 24,53±0,2
, 24,53±0,2 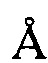 , 25,18±0,2
, 25,18±0,2 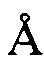 , 27,47±0,2
, 27,47±0,2  , 28,61±0,2
, 28,61±0,2 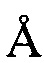 .
.
В другом предпочтительном воплощении профиль ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 7,25  , 8,09
, 8,09  , 8,87
, 8,87  , 14,18
, 14,18 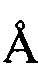 , 16,65
, 16,65  , 19,03
, 19,03  , 20,01
, 20,01  , 20,67
, 20,67  , 21,95
, 21,95 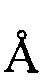 , 24,53
, 24,53  , 25,18
, 25,18 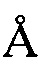 , 27,47
, 27,47 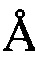 , 28,61
, 28,61  .
.
В другом предпочтительном воплощении профиль ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 5,42±0,2  , 7,25±0,2
, 7,25±0,2  , 8,09±0,2
, 8,09±0,2  , 8,87±0,2
, 8,87±0,2  , 14,18±0,2
, 14,18±0,2  , 15,59±0,2
, 15,59±0,2  , 16,65±0,2
, 16,65±0,2  , 17,84±0,2
, 17,84±0,2  , 19,03±0,2
, 19,03±0,2  , 20,01±0,2
, 20,01±0,2  , 20,67±0,2
, 20,67±0,2  , 21,72±0,2
, 21,72±0,2  , 21,95±0,2
, 21,95±0,2  , 22,49±0,2
, 22,49±0,2  , 24,53±0,2
, 24,53±0,2 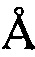 , 25,18±0,2
, 25,18±0,2  , 25,56±0,2
, 25,56±0,2  , 27,47±0,2
, 27,47±0,2  , 28,61±0,2
, 28,61±0,2  , 33,09±0,2
, 33,09±0,2  , 34,25±0,2
, 34,25±0,2  , 37,86±0,2
, 37,86±0,2  .
.
В другом предпочтительном воплощении профиль ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 5,42 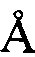 , 7,25
, 7,25  , 8,09
, 8,09 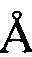 , 8,87
, 8,87  , 14,18
, 14,18 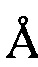 , 15,59
, 15,59  , 16,65
, 16,65  , 17,84
, 17,84  , 19,03
, 19,03  , 20,01
, 20,01  , 20,67
, 20,67  , 21,72
, 21,72  , 21,95
, 21,95  , 22,49
, 22,49  , 24,53
, 24,53  , 25,18
, 25,18  , 25,56
, 25,56  , 27,47
, 27,47  , 28,61
, 28,61  , 33,09
, 33,09  , 34,25
, 34,25  , 37,86
, 37,86  .
.
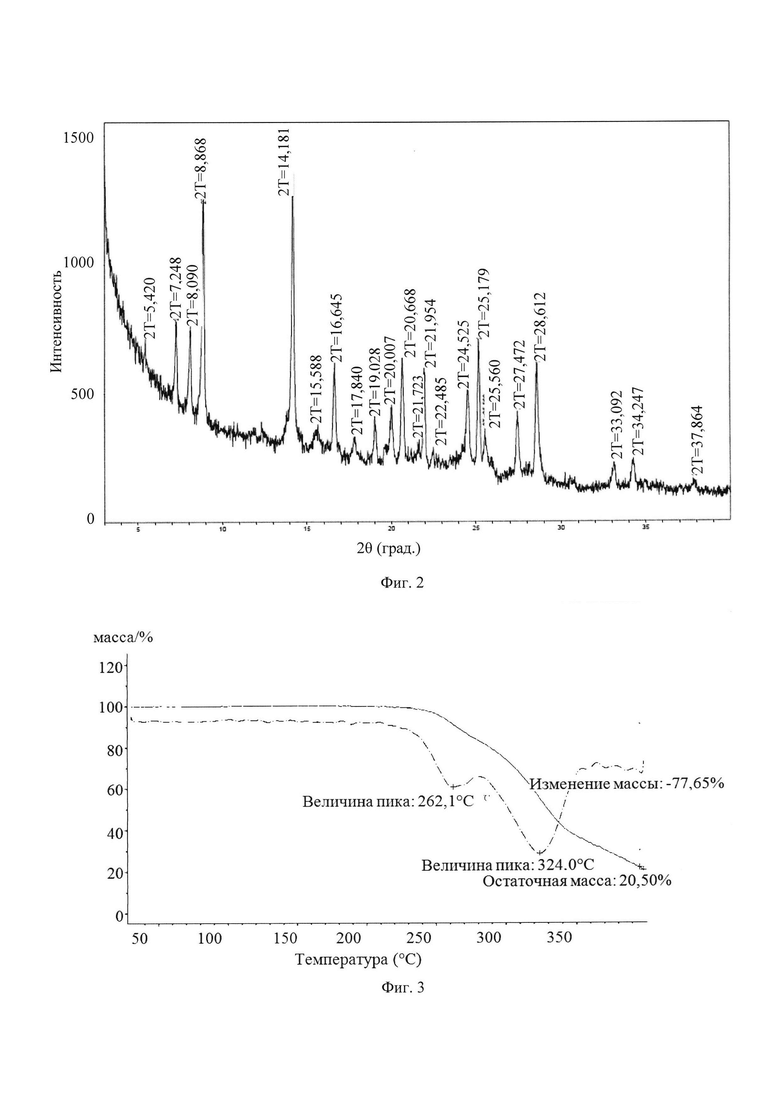
В другом предпочтительном воплощении кристаллическая форма А имеет профиль ПРД по существу, как показано на Фиг. 2.
В другом предпочтительном воплощении характеристический пик поглощения, выраженный расстоянием между плоскостями кристалла d, профиля ПРД кристаллической формы А имеет отклонение ±0,5, предпочтительно отклонение ±0,3 и более предпочтительно отклонение ±0,1.
В другом предпочтительном воплощении кристаллическая форма А имеет одну или более чем одну характеристику, выбранную из следующей группы, состоящей из следующих характеристик:
1) ТГ (термогравиметрический) профиль кристаллической формы А имеет характеристический пик поглощения при 261±2°С.
В другом предпочтительном воплощении ТГ профиль кристаллической формы А имеет характеристический пик поглощения при 262,1°С.
2) ТГ профиль кристаллической формы А имеет характеристический пик поглощения при 323±5°С.
В другом предпочтительном воплощении ТГ профиль кристаллической формы А имеет характеристический пик поглощения при 324°С.
3) Кристаллическая форма А имеет потерю массы при тепловой обработке от 77 до 78 масс. % при 400°С.
В другом предпочтительном воплощении кристаллическая форма А имеет потерю массы при тепловой обработке 77,65 масс. % при 400°С.
В другом предпочтительном воплощении кристаллическая форма А имеет ТГ профиль по существу, как показано на Фиг. 3.
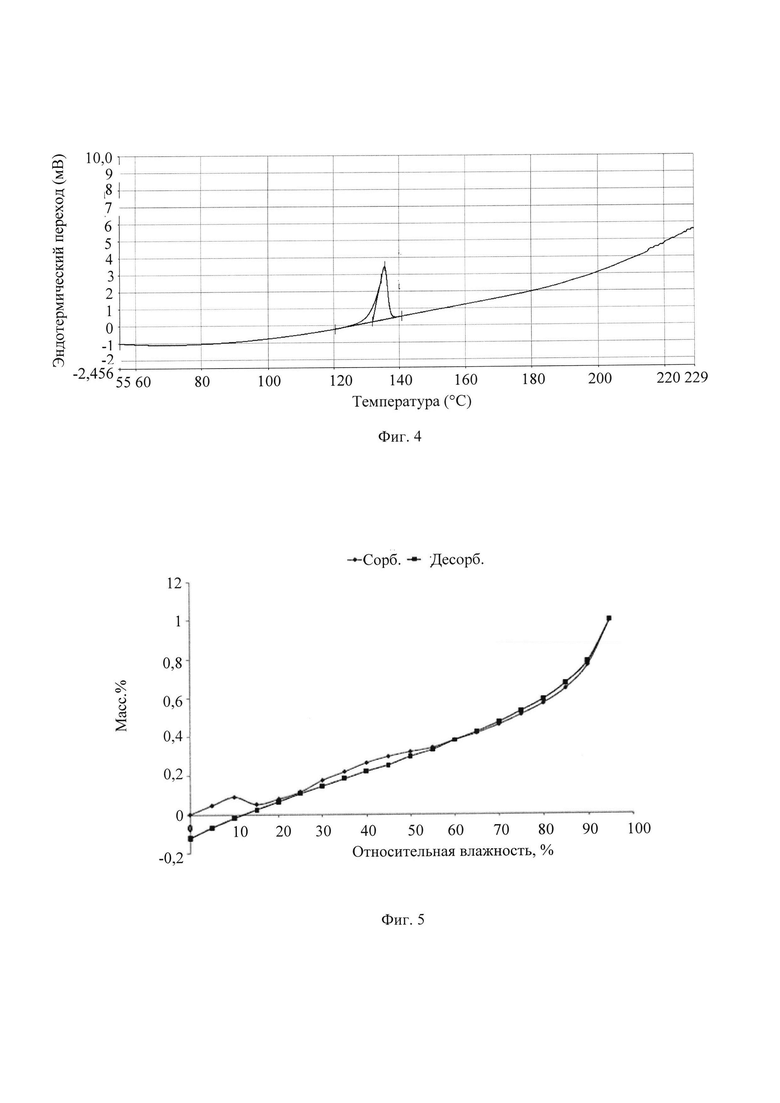
4) Профиль ДСК (дифференциальная сканирующая калориметрия) кристаллической формы А имеет характеристический пик поглощения при 135±5°С.
В другом предпочтительном воплощении профиль ДСК кристаллической формы А имеет характеристический пик поглощения при 135,67°С.
В другом предпочтительном воплощении исходное значение температуры эндотермического перехода кристаллической формы А составляет 131±2°С.
В другом предпочтительном воплощении исходное значение температуры эндотермического перехода кристаллической формы А составляет 131,84°С.
В другом предпочтительном воплощении кристаллическая форма А имеет профиль ДСК по существу, как показано на Фиг. 4.
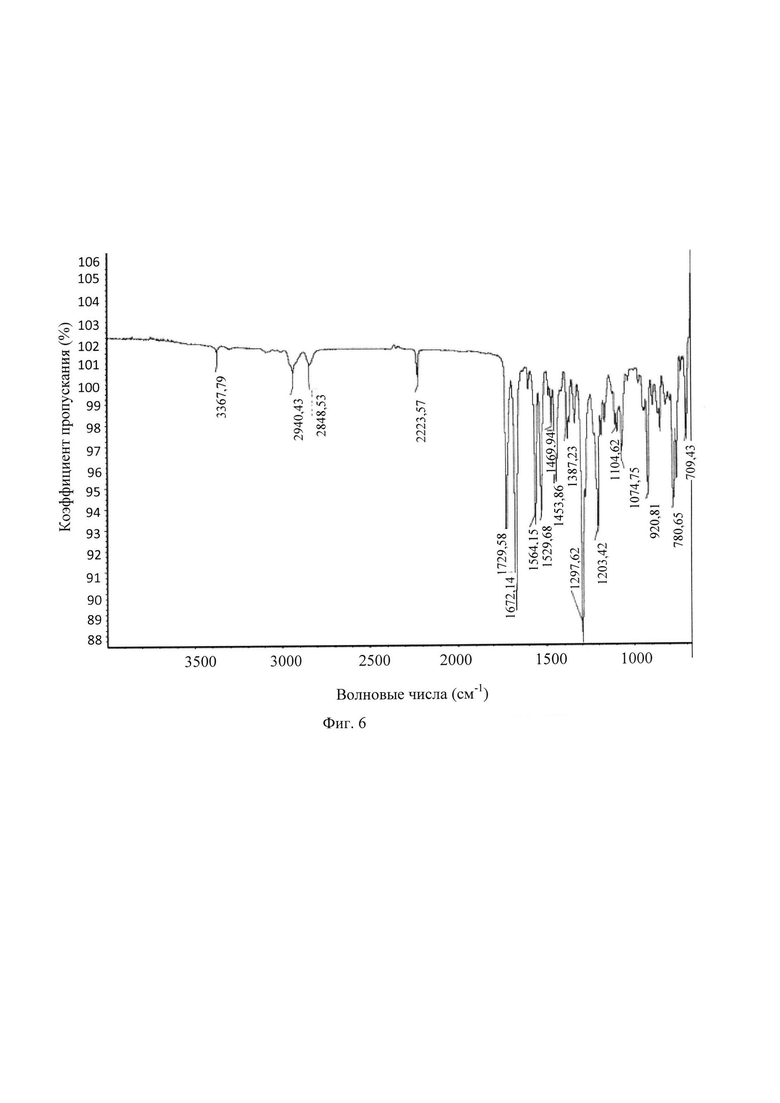
5) Кристаллическая форма А имеет гигроскопичность меньше чем 1%.
В другом предпочтительном воплощении, когда относительная влажность (RH) составляет меньше чем 50%, кристаллическая форма А имеет гигроскопичность меньше чем 0,3%.
В другом предпочтительном воплощении кристаллическая форма А имеет кривую DVS (динамическая сорбция паров) по существу, как показано на Фиг. 5.
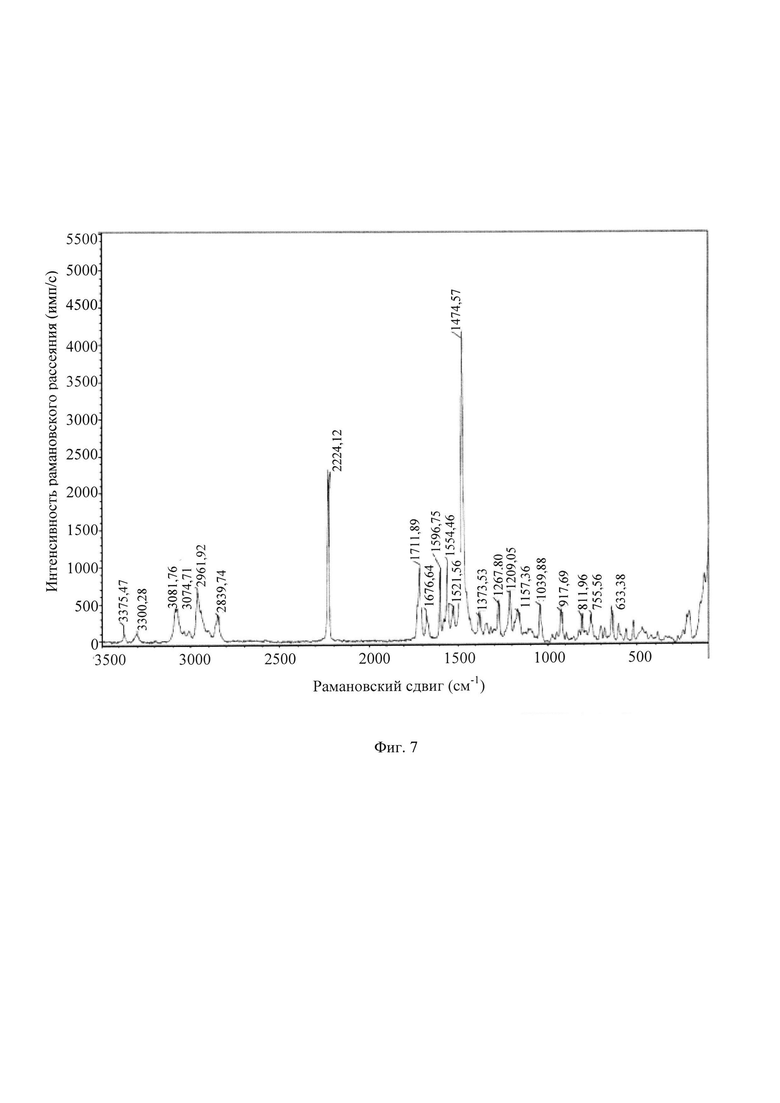
В другом предпочтительном воплощении ИК (инфракрасный)-спектр кристаллической формы А включает следующие характеристические пики поглощения, выраженные длиной волны λ: 3368±2 см-1, 2940±2 см-1, 2848±2 см-1, 2222±2 см-1, 1729±2 см-1, 1672±2 см-1, 1564±2 см-1, 1529±2 см-1, 1470±2 см-1, 1454±2 см-1, 1387±2 см-1, 1298±2 см-1, 1203±2 см-1, 1105±2 см-1, 1075±2 см-1, 921±2 см-1, 781±2 см-1, 709±2 см-1.
В другом предпочтительном воплощении ИК-спектр кристаллической формы А включает следующие характеристические пики поглощения, выраженные длиной волны λ: 3368, 2940, 2848, 2222, 1729, 1672, 1564, 1529, 1470, 1454, 1387, 1298, 1203, 1105, 1075, 921,781,709 см-1.
В другом предпочтительном воплощении кристаллическая форма А имеет ИК-спектр по существу, как показано на Фиг. 6.
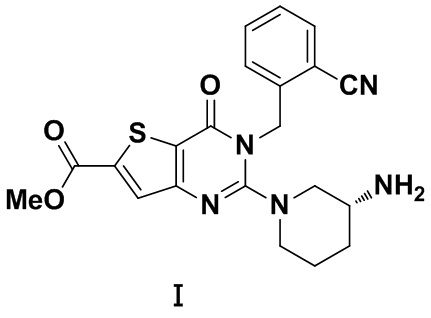
В другом предпочтительном воплощении кристаллическая форма А имеет Рамановский спектр по существу, как показано на Фиг. 7.
Во втором аспекте настоящего изобретения предложена композиция кристалла, и она содержит кристалл кристаллической формы А согласно первому аспекту настоящего изобретения или изготовлена из кристалла кристаллической формы А согласно первому аспекту настоящего изобретения.
В другом предпочтительном воплощении массовое процентное содержание кристалла кристаллической формы А составляет от 60 до 99,999%, предпочтительно от 80 до 99,999%, более предпочтительно от 90 до 99,999% на основе общей массы композиции кристалла.
В другом предпочтительном воплощении композиция кристалла дополнительно содержит: не являющуюся А кристаллическую форму кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен [3,2-d]пиримидин-6-карбоновой кислоты и аморфную (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновую кислоту.
В третьем аспекте настоящего изобретения предложен способ получения кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты согласно первому аспекту настоящего изобретения, и способ включает следующие стадии:
1) Обеспечение первого раствора, содержащего первый растворитель и (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновую кислоту, растворенную в первом растворителе, где первый растворитель является хорошим растворителем и выбран из следующей группы, состоящей из спиртов, кетонов, сложных эфиров, хлоралканов и их комбинаций.
В другом предпочтительном воплощении спирты представляют собой С1-С10 спирты, предпочтительно С1-С8 спирты, более предпочтительно С1-С5 спирты.
В другом предпочтительном воплощении спирты выбраны из следующей группы, состоящей из метанола, этанола, н-пропанола, изопропанола, н-бутанола, неопентилового спирта или их комбинаций.
В другом предпочтительном воплощении кетоны представляют собой С2-С8 кетоны, предпочтительно С3-С5 кетоны.
В другом предпочтительном воплощении кетоны выбраны из следующей группы, состоящей из ацетона, изобутанолбутанона или их комбинаций.
В другом предпочтительном воплощении сложные эфиры представляют собой C1-C10 сложные эфиры, предпочтительно С1-С7 сложные эфиры, более предпочтительно С1-С5 сложные эфиры.
В другом предпочтительном воплощении сложные эфиры выбраны из следующей группы, состоящей из метилформиата, этилацетата, изобутилформиата или их комбинаций.
В другом предпочтительном воплощении хлоралканы представляют собой дихлорметан, трихлорметан или их комбинации, предпочтительно дихлорметан.
В другом предпочтительном воплощении (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновая кислота является аморфным соединением.
2) Добавление второго растворителя к первому раствору для кристаллизации и получения кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-циaнoбeнзил)-4-кapбoнил-3,4-дигидpoтиoфeн[3,2-d]-пиpимидин-6-кapбoнoвoй кислоты согласно первому аспекту настоящего изобретения, где второй растворитель является слабым растворителем и выбран из следующей группы, состоящей из воды, эфиров, алканов, тетрагидрофурана, 1,4-диоксана или их комбинаций.
В другом предпочтительном воплощении эфиры представляют собой С1-С10 эфиры, предпочтительно С1-С8 эфиры, более предпочтительно С1-С6 эфиры.
В другом предпочтительном воплощении простые эфиры выбраны из следующей группы, состоящей из петролейного эфира, трет-бутилметилового эфира, диэтилового эфира, изопропилового эфира, диэтилового эфира или их комбинаций.
В другом предпочтительном воплощении алканы представляют собой С2-С15 алканы, предпочтительно С3-С10 алканы, более предпочтительно С4-С8 алканы.
В другом предпочтительном воплощении алканы выбраны из следующей группы, состоящей из н-пентана, н-гексана, н-гептана или их комбинаций.
В другом предпочтительном воплощении после стадии 2) способ дополнительно включает следующую стадию:
(3) фильтрация и/или сушка полученного твердого вещества на стадии (2) с получением кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты по первому аспекту настоящего изобретения.
В другом предпочтительном воплощении температура сушки составляет от 10 до 70°С, предпочтительно от 20 до 80°С, более предпочтительно от 25 до 40°С.
В другом предпочтительном воплощении давление для сушки составляет от 0 до 20 кПа, предпочтительно от 0 до 10 кПа, более предпочтительно от 5 до 10 кПа.
В другом предпочтительном воплощении время сушки составляет от 5 до 150 часов, предпочтительно от 30 до 100 часов, более предпочтительно от 60 до 80 часов.
В другом предпочтительном воплощении выход способа составляет от 50 до 99%, предпочтительно от 75% до 99%, более предпочтительно от 85% до 99%.
В другом предпочтительном воплощении в первом растворе концентрация растворенной (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты составляет от 0,1 г/л до насыщенной концентрации.
В другом предпочтительном воплощении в первом растворе концентрация растворенной (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты составляет от 0,1 г/л до 100 г/л, предпочтительно от 1 г/л до 870 г/л, более предпочтительно от 10 г/л до 70 г/л, наиболее предпочтительно от 10 г/л до 50 г/л.
В другом предпочтительном воплощении в первом растворе концентрация растворенной (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты представляет собой ненасыщенную концентрацию.
В другом предпочтительном воплощении кристаллизацию проводят при 0-50°С.
В другом предпочтительном воплощении кристаллизацию проводят при 0-40°С, предпочтительно от 20 до 30°С, предпочтительно при комнатной температуре.
В другом предпочтительном воплощении кристаллизацию проводят при перемешивании.
В четвертом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая кристаллическую форму А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты согласно первому аспекту настоящего изобретения и фармацевтически приемлемые эксципиенты.
В другом предпочтительном воплощении эксципиент выбран из следующей группы, состоящей из наполнителей, разрыхлителей, связующих веществ, смазывающих веществ и их комбинаций.
В другом предпочтительном воплощении наполнитель выбран из следующей группы, состоящей из крахмала, лактозы, микрокристаллической целлюлозы, декстрина, маннита, оксида магния, сульфата кальция или их комбинаций.
В другом предпочтительном воплощении разрыхлитель выбран из следующей группы, состоящей из карбоксиметилцеллюлозы и ее солей, попречно-сшитой карбоксиметилцеллюлозы и ее солей, попречно-сшитого повидона, карбоксиметилкрахмала натрия, гидроксипропилцеллюлозы с низкой степенью замещения или их комбинаций.
В другом предпочтительном воплощении связующее вещество выбрано из следующей группы, состоящей из повидона, гидроксипропилметилцеллюлозы, крахмальной мезги или их комбинаций.
В другом предпочтительном воплощении смазывающее вещество выбрано из следующей группы, состоящей из стеарата магния, стеарата кальция или их комбинаций.
В пятом аспекте настоящего изобретения предложено применение кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты согласно первому аспекту настоящего изобретения, или композиции кристалла согласно второму аспекту настоящего изобретения, или фармацевтической композиции согласно четвертому аспекту настоящего изобретения для получения лекарственного средства для предупреждения или лечения диабета II типа и/или осложнений диабета II типа.
В другом предпочтительном воплощении осложнения диабета II типа выбраны из следующей группы, состоящей из ишемической болезни сердца, инсульта, гипертензии, нефропатии, заболевания периферических сосудов, неврологического заболевания и ретинопатии.
В шестом аспекте настоящего изобретения предложен способ лечения или предупреждения диабета II типа и/или осложнений диабета II типа посредством введения субъекту терапевтически эффективного количества кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты согласно первому аспекту настоящего изобретения, или композиции кристалла согласно второму аспекту настоящего изобретения, или фармацевтической композиции согласно четвертому аспекту настоящего изобретения.
Следует понимать, что в настоящем изобретении любые из технических признаков, конкретно описанных выше и ниже (например, в Примерах), можно объединять друг с другом, образуя, таким образом, новые или предпочтительные технические решения, которые не будут избыточно описаны в данном документе один за другим.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 представляет собой фотографию в поляризованном свете кристаллической формы А кристалла из Примера 1 настоящего изобретения.
Фиг. 2 представляет собой порошковую рентгеновскую дифрактограмму кристаллической формы А кристалла из Примера 1 настоящего изобретения.
Фиг. 3 представляет собой ТГ профиль кристаллической формы А кристалла из Примера 1 настоящего изобретения.
Фиг. 4 представляет собой спектр дифференциальной сканирующей колориметрии (ДСК) кристаллической формы А кристалла из Примера 1 настоящего изобретения.
Фиг. 5 представляет собой кривую анализа гигроскопичности (DVS) кристаллической формы А кристалла из Примера 1 настоящего изобретения.
Фиг. 6 представляет собой инфракрасный спектр (ИК) кристаллической формы А кристалла из Примера 1 настоящего изобретения.
Фиг. 7 представляет собой Рамановский спектр кристаллической формы А кристалла из Примера 1 настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
После обширного и интенсивного долгого исследования авторы изобретения неожиданно получили кристаллическую форму А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты с лучшими фармацевтическими свойствами. На основе указанных выше полученных данных авторы изобретения завершили разработку настоящего изобретения.
АМОРФНЫЙ ПОРОШОК
(R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновая кислота (Формула I) представляет собой новый ингибитор DPP IV с сильной активностью в отношении снижения уровня глюкозы в крови in vivo. Соединение представляет собой селективный и обратимо действующий конкурентный ингибитор DPP IV с ингибиторной активностью вплоть до наномолярного уровня, и ингибиторная активность и селективность ингибиторов DPP IV in vitro превосходит ингибиторную активность и селективность зарегистрированных лекарственных средств ситаглиптин и вилдаглиптин. В организме животного данное соединение может эффективно ингибировать активность DPP IV в плазме нормальных мышей и крыс, и его ингибиторная активность в отношении DPP IV превосходит ингибиторную активность зарегистрированного лекарственного средства алоглиптин. Соединение может повышать толерантность к глюкозе при пероральном тесте толерантности к глюкозе у нормальных мышей ICR дозозависимым образом с эффективной дозой только 0,1 мг/кг, и его эффект превосходит эффект алоглиптина. При постоянном введении соединения мышам ob/ob, оно может эффективно снижать уровень глюкозы в крови натощак мышей ob/ob, что превосходит лекарственное средство алоглиптин в качестве положительного контроля. При постоянном введении соединения ген-дефицитным мышам db/db, оно может снижать уровень глюкозы в крови натощак ген-дефицитных мышей db/db, что сопоставимо с лекарственным средством алоглиптин в качестве положительного контроля. Исследование фармакокинетики и безопасности показало, что данное соединение обладает хорошими фармакокинетическими свойствами и безопасностью у крыс и собак. У крыс и собак период полувыведения и AUC0-t (средняя концентрация в моче) данного соединения превосходит период полувыведения и AUC0-t зарегистрированного лекарственного соединения алоглиптин. Испытание безопасности показало, что данное соединение полностью безопасно, и испытание по оценке острой токсичности у мышей ICR показало, что смерть не наблюдается в группе 300 мг/кг, и испытание по оценке острой токсичности у породы собак Бигль показало, что смерть не наблюдается в группе 1 г/кг, и испытание по оценке подострой токсичности у крыс показало, что явной токсичности не наблюдается при пероральном введении в группе 150 мг/кг. По итогам исследований оценки фармакодинамики in vitro, фармакологической оценки in vivo, фармакокинетических исследований и оценки безопасности и т.д., гипогликемический эффект соединения in vivo лучше, чем гипогликемический эффект ингибиторов DPPIV, используемых в настоящее время клинически. Вследствие этого, считается, что соединение разработано в качестве нового терапевтического агента для диабета II типа.
Полиморфизм лекарственных средств относится к лекарственному средству, которое имеет два или более чем два физического состояния в разных кристаллических формах. Для твердых химических лекарственных средств вследствие их разного расположения молекул и законов симметрии, одно лекарственное средство может образовывать множество твердых физических состояний в различной кристаллической форме, и это часто называется «явлением полиморфа», что значит, что одно лекарственное средство имеет твердые состояния в разных кристаллических формах. Явление полиморфа преобладает в твердых лекарственных средствах, и полиморф является одним из важных факторов, которые влияют на качество и эффективность твердых лекарственных средств.
Аморфный порошок (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты получают посредством способа получения, описанного в патентной заявке CN 201210262331.3. 1H-ЯМР (ядерный магнитный резонанс) (CDCl3): δ 7,76 (s, 1Н), 7,610 (d, 1H), 7,493 (t, 1H), 7,320 (t, 1H), 7,180 (d, 1H), 5,500 (квартет, 2H), 3,895 (s, 3H), 3,680 (d, 2H), 3,355 (m, 1H), 3,010 (m, 2H), 2,150 (m, 1H), 1,894 (m, 2H), 1,644 (m, 1H); ЖХ-МС (жидкостная хроматография с масс-спектрометрией) m/z 424,1 [М+Н]+.
КРИСТАЛЛИЧЕСКАЯ ФОРМА А
В настоящем изобретении предложена кристаллическая форма А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты формулы I, ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 8,87±0,2  , 14,18±0,2
, 14,18±0,2  , 20,67±0,2
, 20,67±0,2  , 25,18±0,2
, 25,18±0,2  , 28,61±0,2
, 28,61±0,2  .
.

В другом предпочтительном воплощении ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 8,87  , 14,18
, 14,18  , 20,67
, 20,67  , 25,18
, 25,18  , 28,61
, 28,61  .
.
Типично, ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 7,25±0,2  , 8,09±0,2
, 8,09±0,2  , 8,87±0,2
, 8,87±0,2  , 14,18±0,2
, 14,18±0,2  , 16,65±0,2
, 16,65±0,2  , 20,67±0,2
, 20,67±0,2  , 21,95±0,2
, 21,95±0,2  , 25,18±0,2
, 25,18±0,2  , 28,61±0,2
, 28,61±0,2  .
.
В другом предпочтительном воплощении ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 7,25  , 8,09
, 8,09  , 8,87
, 8,87  , 14,18
, 14,18  , 16,65
, 16,65  , 20,67
, 20,67  , 21,95
, 21,95  , 25,18
, 25,18  , 28,61
, 28,61  .
.
В другом предпочтительном воплощении ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 7,25±0,2  , 8,09±0,2
, 8,09±0,2  , 8,87±0,2
, 8,87±0,2  , 14,18±0,2
, 14,18±0,2  , 16,65±0,2
, 16,65±0,2  , 19,03±0,2
, 19,03±0,2  , 20,01±0,2
, 20,01±0,2  , 20,67±0,2
, 20,67±0,2  , 21,95±0,2
, 21,95±0,2  , 24,53±0,2
, 24,53±0,2  , 25,18±0,2
, 25,18±0,2  , 27,47±0,2
, 27,47±0,2  , 28,61±0,2
, 28,61±0,2  .
.
В другом предпочтительном воплощении ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 7,25  , 8,09
, 8,09  , 8,87
, 8,87  , 14,18
, 14,18  , 16,65
, 16,65  , 19,03
, 19,03  , 20,01
, 20,01  , 20,67
, 20,67  , 21,95
, 21,95  , 24,53
, 24,53  , 25,18
, 25,18  , 27,47
, 27,47  , 28,61
, 28,61  .
.
В другом предпочтительном воплощении ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 5,42±0,2  , 7,25±0,2
, 7,25±0,2  , 8,09±0,2
, 8,09±0,2  , 8,87±0,2
, 8,87±0,2  , 14,18±0,2
, 14,18±0,2  , 15,59±0,2
, 15,59±0,2  , 16,65±0,2
, 16,65±0,2  , 17,84±0,2
, 17,84±0,2  , 19,03±0,2
, 19,03±0,2  , 20,01±0,2
, 20,01±0,2  , 20,67±0,2
, 20,67±0,2  , 21,72±0,2
, 21,72±0,2  , 21,95±0,2
, 21,95±0,2  , 22,49±0,2
, 22,49±0,2  , 24,53±0,2
, 24,53±0,2  , 25,18±0,2
, 25,18±0,2  , 25,56±0,2
, 25,56±0,2  , 27,47±0,2
, 27,47±0,2  , 28,61±0,2
, 28,61±0,2  , 33,09±0,2
, 33,09±0,2  , 34,25±0,2
, 34,25±0,2  , 37,86±0,2
, 37,86±0,2  ,
,
В другом предпочтительном воплощении ПРД кристаллической формы А включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 5,42  , 7,25
, 7,25  , 8,09
, 8,09  , 8,87
, 8,87  , 14,18
, 14,18  , 15,59
, 15,59  , 16,65
, 16,65  , 17,84
, 17,84  , 19,03
, 19,03  , 20,01
, 20,01  , 20,67
, 20,67  , 21,72
, 21,72  , 21,95
, 21,95  , 22,49
, 22,49  , 24,53
, 24,53  , 25,18
, 25,18  , 25,56
, 25,56  , 27,47
, 27,47  , 28,61
, 28,61  , 33,09
, 33,09  , 34,25
, 34,25  , 37,86
, 37,86  .
.
В другом предпочтительном воплощении кристаллическая форма А имеет порошковую рентгеновскую дифрактограмму по существу, как показано на Фиг. 2.
В настоящем изобретении характеристический пик поглощения, выраженный расстоянием между плоскостями кристалла d на порошковой рентгеновской дифрактограмме кристаллической формы А, имеет отклонение ±0,5, предпочтительно отклонение ±03 и более предпочтительно отклонение ±0,1.
Конкретно, кристаллическая форма А имеет одну или более чем одну характеристику, выбранную из следующей группы, состоящей из следующих характеристик:
1) ТГ профиль кристаллической формы А имеет характеристический пик поглощения при 261±2°С.
В другом предпочтительном воплощении ТГ профиль кристаллической формы А имеет характеристический пик поглощения при 262,1°С.
2) ТГ профиль кристаллической формы А имеет характеристический пик поглощения при 323±5°С.
В другом предпочтительном воплощении ТГ профиль кристаллической формы А имеет характеристический пик поглощения при 324°С.
3) Кристаллическая форма А имеет потерю массы при тепловой обработке от 77 до 78 масс. % при 400°С.
В другом предпочтительном воплощении кристаллическая форма А имеет потерю массы при тепловой обработке 77,65 масс. % при 400°С.
В другом предпочтительном воплощении кристаллическая форма А имеет ТГ профиль по существу, как показано на Фиг. 3.
4) Профиль ДСК кристаллической формы А имеет характеристический пик поглощения при 135±5°С.
В другом предпочтительном воплощении профиль ДСК кристаллической формы А имеет характеристический пик поглощения при 135,67°С.
В другом предпочтительном воплощении исходное значение температуры эндотермического перехода кристаллической формы А составляет 131±2°С.
В другом предпочтительном воплощении исходное значение температуры эндотермического перехода кристаллической формы А составляет 131,84°С.
В другом предпочтительном воплощении кристаллическая форма А имеет профиль ДСК по существу, как показано на Фиг. 4.
5) Кристаллическая форма А обладает гигроскопичностью меньше чем 1%.
В другом предпочтительном воплощении, когда относительная влажность RH составляет меньше чем 50%, кристаллическая форма А обладает гигроскопичностью меньше чем 0,3%.
В другом предпочтительном воплощении кристаллическая форма А имеет кривую DVS по существу, как показано на Фиг. 5.
В другом предпочтительном воплощении ИК-спектр кристаллической формы А включает следующие характеристические пики поглощения, выраженные длиной волны X: 3368±2 см-1, 2940±2 см-1, 2848±2 см-1, 2222±2 см-1, 1729±2 см-1, 1672±2 см-1, 1564±2 см-1, 1529±2 см-1, 1470±2 см-1, 1454±2 см-1, 1387±2 см-1, 1298±2 см-1, 1203±2 см-1, 1105±2 см-1, 1075±2 см-1, 921±2 см-1, 781±2 см-1, 709±2 см-1.
В другом предпочтительном воплощении ИК-спектр кристаллической формы А включает следующие характеристические пики поглощения, выраженные длиной волны X: 3368, 2940, 2848, 2222, 1729, 1672, 1564, 1529, 1470, 1454, 1387, 1298, 1203, 1105, 1075, 921,781,709 см-1.
В другом предпочтительном воплощении кристаллическая форма А имеет ИК-спектр по существу, как показано на Фиг. 6.
В другом предпочтительном воплощении кристаллическая форма А имеет Рамановский спектр по существу, как показано на Фиг. 7.
По сравнению с порошком аморфной (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты, соединение кристаллической формы А по настоящему изобретению, вводимое перорально, имеет лучшую гипогликемическую активность в отношении предупреждения или лечения диабета II типа, и кристаллическая форма А может улучшать растворимость соединения, усиливать способность к пероральному поглощению и улучшать биодоступность, и кристаллическая форма А оказывает лучший эффект в предупреждении или лечении диабета II типа.
КОМПОЗИЦИЯ КРИСТАЛЛА
В настоящем изобретении композиция кристалла содержит кристалл кристаллической формы А или изготовлена из кристалла кристаллической формы А.
В другом предпочтительном воплощении массовое процентное содержание кристалла кристаллической формы А составляет от 60 до 99,999%, предпочтительно от 80 до 99,999%, более предпочтительно от 90 до 99,999% на основе общей массы композиции кристалла.
В другом предпочтительном воплощении композиция кристалла дополнительно содержит кристалл (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]пиримидин-6-карбоновой кислоты, отличный от кристаллической формы А, и аморфную (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновую кислоту.
СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОЙ ФОРМЫ А
В настоящем изобретении предложен способ получения кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты, и способ включает следующие стадии:
1) Обеспечение первого раствора, содержащего первый растворитель и (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновую кислоту, растворенную в первом растворителе, где первый растворитель является хорошим растворителем и выбран из следующей группы, состоящей из спиртов, кетонов, сложных эфиров, хлоралканов и их комбинаций.
В настоящем изобретении спирты, кетоны и сложные эфиры конкретно не ограничены и могут быть выбраны из традиционных веществ в данной области, или могут быть получены традиционными способами или имеются в продаже.
Обычно спирты представляют собой С1-С10 спирты, предпочтительно С1-С8 спирты, более предпочтительно С1-С5 спирты.
Обычно спирты включают без ограничений метанол, этанол, н-пропанол, изопропанол, н-бутанол, неопентиловый спирт или их комбинации.
Обычно кетоны представляют собой С2-С8 кетоны, предпочтительно С3-С5 кетоны.
Обычно кетоны включают без ограничений ацетон, изобутанолбутанон или их комбинации.
Обычно сложные эфиры представляют собой С1-С10 сложные эфиры, предпочтительно С1-С7 сложные эфиры, более предпочтительно С1-С5 сложные эфиры.
Обычно сложные эфиры включают без ограничений метилформиат, этилацетат, изобутилформиат или их комбинации.
Обычно хлоралканы включают без ограничений дихлорметан, трихлорметан или их комбинации, предпочтительно дихлорметан.
В другом предпочтительном воплощении (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновая кислота является аморфным соединением.
2) Добавление второго растворителя к первому раствору для кристаллизации и получения кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты, где второй растворитель является слабым растворителем и выбран из следующей группы, состоящей из воды, эфиров, алканов, тетрагидрофурана, 1,4-диоксана или их комбинаций.
Обычно простые эфиры представляют собой С1-С10 эфиры, предпочтительно С1-С8 эфиры, более предпочтительно С1-С6 эфиры.
Обычно эфиры включают без ограничений петролейный эфир, трет-бутилметиловый эфир, диэтиловый эфир, изопропиловый эфир, диэтиловый эфир или их комбинации.
Обычно алканы представляют собой С2-С15 алканы, предпочтительно С3-С10 алканы, более предпочтительно С4-С8 алканы.
Обычно алканы включают без ограничений н-пентан, н-гексан, н-гептан или их комбинации.
В другом предпочтительном воплощении после стадии 2) способ дополнительно включает следующую стадию:
(3) Фильтрация и/или сушка полученного твердого вещества на стадии (2) с получением кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-циaнoбeнзил)-4-кapбoнил-3,4-дигидpoтиoфeн[3,2-d]-пиpимидин-6-кapбoнoвoй кислоты.
В настоящем изобретении условия сушки (такие как температура, давление, время и т.д.) конкретно не ограничены.
В другом предпочтительном воплощении температура сушки составляет от 10 до 70°С, предпочтительно от 20 до 80°С, более предпочтительно от 25 до 40°С.
В другом предпочтительном воплощении давление для сушки составляет от 0 до 20 кПа, предпочтительно от 0 до 10 кПа, более предпочтительно от 5 до 10 кПа.
В другом предпочтительном воплощении время сушки составляет от 5 до 150 часов, предпочтительно от 30 до 100 часов, более предпочтительно от 60 до 80 часов.
В другом предпочтительном воплощении выход способа составляет от 50% до 99%, предпочтительно от 75% до 99%, более предпочтительно от 85% до 99%.
В настоящем изобретении в первом растворе концентрация растворенной (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты составляет от 0,1 г/л до насыщенной концентрации.
В другом предпочтительном воплощении в первом растворе концентрация растворенной (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты составляет от 0,1 г/л до 100 г/л, предпочтительно от 1 г/л до 870 г/л, более предпочтительно от 10 г/л до 70 г/л, наиболее предпочтительно от 10 г/л до 50 г/л.
В другом предпочтительном воплощении в первом растворе концентрация растворенной (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты представляет собой ненасыщенную концентрацию.
Обычно кристаллизацию выполняют при 0-50°С.
В другом предпочтительном воплощении кристаллизацию проводят при 0-40°С, предпочтительно 20-30°С, предпочтительно при комнатной температуре.
В другом предпочтительном воплощении время кристаллизации конкретно не ограничено, предпочтительно составляет от 0,05 до 72 часов (или более), предпочтительно составляет от 0,1 до 48 часов, более предпочтительно составляет от 1 до 24 часов, наиболее предпочтительно составляет от 2 до 12 часов.
В другом предпочтительном воплощении кристаллизацию проводят при перемешивании.
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ
В настоящем изобретении предложена фармацевтическая композиция, содержащая кристаллическую форму А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты и фармацевтически приемлемые эксципиенты.
Следует понимать, что в настоящем изобретении эксципиенты конкретно не ограничены и могут быть выбраны из традиционных в данной области веществ или могут быть получены традиционными способами или имеются в продаже.
Обычно эксципиент включает без ограничений наполнители, разрыхлители, связующие вещества, смазывающие вещества или их комбинации.
Обычно наполнитель включает без ограничений крахмал, лактозу, микрокристаллическую целлюлозу, декстрин, маннит, оксид магния, сульфат кальция или их комбинации.
Обычно разрыхлитель включает без ограничений карбоксиметилцеллюлозу и ее соли, поперечно-сшитую карбоксиметилцеллюлозу и ее соли, поперечно-сшитый повидон, натрий карбоксиметилкрахмал, гидроксипропилцеллюлозу с низкой степенью замещения или их комбинации.
Обычно связующее вещество включает без ограничений повидон, гидроксипропилметилцеллюлозу, крахмальную мезгу или их комбинации.
Обычно смазывающее вещество включает без ограничений стеарат магния, стеарат кальция или их комбинации.
Также в настоящем изобретении предложено применение кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты, или композиции кристалла, или фармацевтической композиции для получения лекарственного средства для предупреждения или лечения диабета II типа и/или осложнений диабета II типа.
Обычно осложнения диабета II типа включают без ограничений ишемическую болезнь сердца, инсульт, гипертензию, нефропатию, заболевание периферических сосудов, неврологическое заболевание и ретинопатию.
Также в настоящем изобретении предложен способ лечения или предупреждения диабета II типа и/или осложнений диабета II типа посредством введения субъекту терапевтически эффективного количества кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты, или композиции кристалла, или фармацевтической композиции.
Количество для введения кристаллической формы А по настоящему изобретению или ее фармацевтической композиции варьирует в зависимости от возраста, пола, расы и состояния субъекта.
Соединение по настоящему изобретению можно вводить отдельно или в комбинации с другими лекарственными средствами или активными ингредиентами.
В настоящем изобретении способ введения кристаллической формы А или фармацевтической композиции по настоящему изобретению, который конкретно не ограничен и может быть таким же, как или похожим на способ введения традиционной (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты, включает без ограничений пероральный, чрескожный, внутривенный, внутримышечный, местный способ введения и тому подобное.
По сравнению с предшествующим уровнем техники, настоящее изобретение имеет следующие главные преимущества:
(1) кристаллическая форма А, полученная способом по настоящему изобретению, обладает более высокой чистотой;
(2) кристаллическая форма А по настоящему изобретению имеет лучшую стабильность, в частности термостабильность;
(3) кристаллическая форма А по настоящему изобретению обладает более низкой гигроскопичностью и при относительной влажности RH составляет меньше чем 50%, гигроскопичность кристаллической формы А составляет меньше чем 0,3%.
(4) кристаллическая форма А по настоящему изобретению не является легко поддающейся разложению в обычных условиях;
(5) способ получения кристаллической формы А по настоящему изобретению является простым, легко контролируемым и воспроизводимым и подходит для промышленного производства.
Настоящее изобретение будет дополнительно проиллюстрировано ниже со ссылкой на конкретные примеры. Следует понимать, что данные примеры должны только иллюстрировать изобретение, а не ограничивать объем изобретения. Экспериментальные способы без конкретных условий, описанных в следующих примерах, обычно осуществляются в общепринятых условиях или в соответствии с инструкциями производителя. Если не указано иное, доли и процентное содержание рассчитано по массе.
Если не определено иное, вся профессиональная и научная терминология, используемая в данном тексте, имеет такие же значения, как известные специалистам в данной области техники. Кроме того, любые материалы и методы, аналогичные или совпадающие с зарегистрированным содержанием, можно применять к способам по изобретению. Способ по предпочтительному воплощению, описанный в данном документе, и материалы представлены только в целях демонстрации.
ОБЩИЕ СПОСОБЫ ТЕСТИРОВАНИЯ И ПАРАМЕТРЫ ТЕСТИРОВАНИЯ
В настоящем изобретении кристалл подвергают серии нижеследующих общих тестирований.
Порошковая рентгеновская дифракция (ПРД) представляет собой метод структурного анализа внутреннего пространственного распределения атомов в веществе посредством использования дифракции рентгеновского излучения, образуемой кристаллами. Когда рентгеновские лучи, имеющие определенную длину волны, облучают поверхность кристалла, рентгеновские лучи рассеиваются вследствие наличия правильной упорядоченности атомов или ионов внутри кристалла, и указанные рассеянные рентгеновские лучи усиливаются в некоторых направлениях, демонстрируя, вследствие этого, уникальное явление дифракции, соответствующее кристаллической структуре.
В настоящем изобретении параметры тестирования для ПРД являются следующими: тип прибора: Bruker D8advance; мишень: Cu-Kα (40 кВ, 40 мА); расстояние от образца до детектора: 30 см; интервал сканирования: 3°~40° (значение 2 тета); скорость сканирования: 0,1 с.
Термогравиметрический анализ (TGA) представляет собой аналитическую методику определения изменения массы одного вещества с температурой в контролируемых программой условиях. Термогравиметрический анализ можно использовать с получением тепла, образуемого в результате изменения температурных условий образца. Он подходит для проверки процесса и значения потери растворителя кристалла или молекул воды или сублимации и разложения образца в кристаллическом веществе. Также с помощью него можно эффективно узнать содержит ли данное вещество растворитель кристалла или воду.
В настоящем изобретении параметры тестирования в отношении TGA являются следующими: тип прибора: Netzsch TG 209F3; тигель: тигель из оксида алюминия; температурный диапазон: от 30 до 400°С; скорость сканирования: 10 K/мин; газ для продувки: 25 мл/мин; защитный газ: 15 мл/мин.
Дифференциальный сканирующий калориметр (ДСК) представляет собой методику определения изменения разницы температур между образцом и инертным стандартом (обычно используется α-Аl2О3) с температурой посредством контролируемого программой нагревания или охлаждения. Анализ ДСК подходит для анализа состояний образца, таких как разложение при плавлении, смешанный кристалл, трансформация кристалла и т.д.
В настоящем изобретении параметры тестирования для ДСК являются следующими: тип прибора: Perkin Elmer DSC 8500; тигель: тигель из оксида алюминия; скорость сканирования от 50 до 280°С при скорости нагревания 10°С/мин при продувки азотом.
Рамановская спектроскопия (RM) представляет собой способ исследования колебания молекул на основе эффекта Рамана. По сравнению с поглощением в инфракрасной области, Рамановская спектроскопия исследует частоту рассеянного света, образующегося в результате взаимодействия данной молекулы с видимой частью спектра.
Неполярные группы, которые обычно имеют неявное поглощение в инфракрасной области, имеют явные Рамановские спектры поглощения.
В настоящем изобретении параметры тестирования для RM являются следующими: тип прибора: Рамановский микроскоп Thermo DXR (Рамановский спектрометр на конфокальном микроскопе); длина волны лазера: 532 нм; время экспозиции: 1,0 с; количество экспозиций: 10.
Инфракрасная спектрометрия (ИК) представляет собой первый аналитический метод, используемый для узнавания и идентификации кристаллических веществ. Вследствие разной электрической среды ковалентной связи в разных молекулах кристаллов, сила ковалентной связи может меняться, и изменение силы ковалентной связи будет неизбежно приводить к получению разных ИК-спектров разных кристаллических форм.
В настоящем изобретении параметры тестирования для ИК являются следующими: тип прибора: инфракрасный спектрометр с преобразованием Nicolet 6700 типа Fourier; одноточечный метод ATR (нарушенное полное внутреннее отражение) с разрешением 4,0 см-1.
Тестирование динамической сорбции паров (DVS) / тестирование поглощения влаги проводят быстрым измерением увеличения и потери влаги в образце, обусловленной потоком газа-носителя с установленной относительной влажностью (RH). Образец помещают на цифровые микровесы с высокой чувствительностью и высокой устойчивостью в подвешенном состоянии, и затем посредством измерения увеличения/уменьшения массы вещества так, чтобы измерить адсорбцию/десорбцию водяного пара, определяя таким образом гигроскопичность образца.
В настоящем изобретении параметры тестирования для DVS являются следующими: тип прибора: SMS DVS Intrinsic; негидрат: от 0 до 95%-0% RH; температура: 25°С; гидрат: от 40 до 95%-0% RH; температура: 25°С.
Пример 1
Получение кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты (№1)
200 мг (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты растворяли в 1 мл этанола, и добавляли 12 мл петролейного эфира, и при перемешивании при комнатной температуре кристаллизацию проводили до тех пор, пока больше не происходило осаждения твердого вещества, и время кристаллизации составляло примерно 2 часа. Полученное фильтровали, и полученное твердое вещество помещали в печь для вакуумной сушки и проводили вакуумную сушку в течение 70 часов при 25°С при 5 кПа с получением 110 мг кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты.
РЕЗУЛЬТАТ
Кристаллическую форму А кристалла, полученного в Примере 1, подвергали тестированию, такому как поляризация, ПРД, TGA, ДСК, DVS, ИК-спектрометрия и Рамановская спектроскопия и т.д.
Фиг. 1 представляет собой фотографию в поляризованном свете кристаллической формы А кристалла из Примера 1. Из Фиг. 1 видно, что кристаллическая форма А представляет собой порошкообразный кристалл.
Фиг. 2 представляет собой порошковую рентгеновскую дифрактограмму кристаллической формы А кристалла из Примера 1. Из Фиг. 2 видно, что кристаллическая форма А имеет пики поглощения при 5,42  , 7,25
, 7,25  , 8,09
, 8,09  , 8,87
, 8,87  , 14,18
, 14,18  , 15,59
, 15,59  , 16,65
, 16,65  , 17,84
, 17,84  , 19,03
, 19,03  , 20,01
, 20,01  , 20,67
, 20,67  , 21,72
, 21,72  , 21,95
, 21,95  , 22,49
, 22,49  , 24,53
, 24,53  , 25,18
, 25,18  , 25,56
, 25,56  , 27,47
, 27,47  , 28,61
, 28,61  , 33,09
, 33,09  , 34,25
, 34,25  , 37,86
, 37,86  .
.
Фиг. 3 представляет собой ТГ профиль кристаллической формы А кристалла из Примера 1. Из Фиг. 3 видно, что кристаллическая форма А имеет потерю массы 77,65% при 210-400°С.
Фиг. 4 представляет собой профиль дифференциальной сканирующей колориметрии (ДСК) кристаллической формы А кристалла из Примера 1. Из Фиг. 4 видно, что ДСК, соответствующая кристаллической форме А, демонстрирует температуру плавления 131,84°С.
Фиг. 5 представляет собой кривую анализа гигроскопичности (DVS) кристаллической формы А кристалла из Примера 1. Из Фиг. 5 видно, что кристаллическая форма А обладает слабой гигроскопичностью, и, в диапазоне традиционной влажности при хранении, диапазон варьирования влажности является небольшим, меньше чем 2,0%. При 40% RH содержание влаги составляет 0,26%; при 65% RH поглощенная влага составляет 0,42%; при 80% RH поглощенная влага составляет 0,57%.
Фиг. 6 представляет собой инфракрасный спектр (ИК) кристаллической формы А кристалла из Примера 1. Из Фиг. 6 видно, что кристаллическая форма А имеет характеристические пики поглощения при 3368, 2940, 2848, 2222, 1729, 1672, 1564, 1529, 1470, 1454, 1387, 1298, 1203, 1105, 1075, 921, 781, 709 см-1.
Фиг. 7 представляет собой Рамановский спектр (Раман) кристаллической формы А кристалла из Примера 1. Из Фиг. 7 видно, что кристаллическая форма А имеет характеристические пики поглощения при 3375,5, 3300,3, 3081,8, 3074,7, 2961,9, 2839,7, 2224,1, 1711,9, 1676,6, 1596,8, 1554,5, 1521,6, 1474,6, 1373,5, 1267,8, 1209,1, 1157,4, 1039,9, 917,7, 812,0, 755,6, 633,4 см-1.
Пример 2
Получение кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты (№2)
200 мг (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты растворяли в 1 мл этилацетата, и добавляли 8 мл петролейного эфира, и при перемешивании при комнатной температуре кристаллизацию проводили до тех пор, пока больше не происходило осаждения твердого вещества. Полученное вещество фильтровали, и образованное твердое вещество помещали в печь для вакуумной сушки и проводили вакуумную сушку в течение 70 часов при 25°С при 5 кПа с получением 100 мг кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты.
Результат ПРД полученного продукта по существу являлся таким же, как результат из Примера 1.
Пример 3
Получение кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты (№3)
200 мг (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты растворяли в 1 мл этилацетата, и добавляли 10 мл диэтилового эфира, и при перемешивании при комнатной температуре кристаллизацию проводили до тех пор, пока больше не происходило осаждения твердого вещества. Полученное вещество фильтровали, и образованное твердое вещество помещали в печь для вакуумной сушки и проводили вакуумную сушку в течение 70 часов при 25°С под 5 кПа с получением 80 мг кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты.
Результат ПРД полученного продукта по существу являлся таким же, как результат из Примера 1.
Пример 4
Получение кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты (№4)
200 мг (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты растворяли в 1 мл этанола, и добавляли 10 мл диэтилового эфира, и при перемешивании при комнатной температуре кристаллизацию проводили до тех пор, пока больше не происходило осаждения твердого вещества. Полученное вещество фильтровали, и образованное твердое вещество помещали в печь для вакуумной сушки и проводили вакуумную сушку в течение 70 часов при 25°С под 5 кПа с получением 60 мг кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты.
Результат ПРД полученного продукта по существу являлся таким же, как результат из Примера 1.
Пример 5
Получение кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты (№5)
200 мг (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты растворяли в 1 мл ацетона, и добавляли 10 мл петролейного эфира, и при перемешивании при комнатной температуре кристаллизацию проводили до тех пор, пока больше не происходило осаждения твердого вещества. Полученное вещество фильтровали, и образованное твердое вещество помещали в печь для вакуумной сушки и проводили вакуумную сушку в течение 70 часов при 25°С при 5 кПа с получением 80 мг кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты.
Результат ПРД полученного продукта по существу являлся таким же, как результат из Примера 1.
Пример 6
Получение кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты (№6)
200 мг (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидpoтиoфeн[3,2-d]-пиpимидин-6-кapбoнoвoй кислоты растворяли в 1 мл дихлорметана, и добавляли 8 мл петролейного эфира, и при перемешивании при комнатной температуре кристаллизацию проводили до тех пор, пока больше не происходило осаждения твердого вещества. Полученное вещество фильтровали, и образованное твердое вещество помещали в печь для вакуумной сушки и проводили вакуумную сушку в течение 70 часов при 25°С при 5 кПа с получением 100 мг кристаллической формы А кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты.
Результат ПРД полученного продукта по существу являлся таким же, как результат из Примера 1.
Все литературные источники, упомянутые в настоящем изобретении, включены в данный документ посредством ссылки, как если бы они были индивидуально включены посредством ссылки. Кроме того, следует понимать, что после прочтения указанной выше идеи, многие изменения и модификации могут быть сделаны специалистами в данной области, и данные эквиваленты также находятся в пределах объема, как определено прилагаемой формулой изобретения.

Изобретение относится к кристаллической форме А соединения (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]пиримидин-6-карбоновой кислоты формулы I, где ПРД (порошковая рентгеновская дифрактограмма) кристаллической формы A включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 8,87±0,2 Å, 14,18±0,2 Å, 20,67±0,2 Å, 25,18±0,2 Å, 28,61±0,2 Å.
А также к способам получения и фармацевтической композиции кристаллической формы А. Кристаллическая форма А обладает сильной гипогликемической активностью in vivo и, как ожидают, является новым фармацевтически активным ингредиентом для лечения или предупреждения диабета II типа и/или осложнений диабета II типа. 4 н. и 4 з.п. ф-лы., 7 ил., 6 пр.
1. Кристаллическая форма A кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]пиримидин-6-карбоновой кислоты формулы I, где ПРД (порошковая рентгеновская дифрактограмма) кристаллической формы A включает следующие характеристические пики поглощения, выраженные расстоянием между плоскостями кристалла d: 8,87±0,2 Å, 14,18±0,2 Å, 20,67±0,2 Å, 25,18±0,2 Å, 28,61±0,2 Å.
2. Кристаллическая форма A по п. 1, где ПРД кристаллической формы A дополнительно включает один или более следующих характеристических пиков поглощения, выраженных расстоянием между плоскостями кристалла d: 7,25±0,2 Å, 8,09±0,2Å, 16,65±0,2 Å, 21,95±0,2 Å.
3. Кристаллическая форма A по п. 1, где кристаллическая форма A имеет одну или более чем одну характеристику, выбранную из следующей группы, состоящей из следующих характеристик:
1) ТГ (термогравиметрический) профиль кристаллической формы A имеет характеристический пик поглощения при 261±2 °C;
2) ТГ профиль кристаллической формы A имеет характеристический пик поглощения при 323±5 °C;
3) кристаллическая форма A имеет потерю массы при тепловой обработке от 77 до 78 масс.% при 400 °C;
4) профиль ДСК (дифференциальная сканирующая калориметрия) кристаллической формы A имеет характеристический пик поглощения при 135±5 °C;
5) кристаллическая форма A имеет гигроскопичность меньше чем 1 %.
4. Композиция кристалла для получения лекарственного средства для лечения или предупреждения диабета II типа и/или осложнений диабета II типа, которая содержит кристалл кристаллической формы A по п. 1 и дополнительно содержит не являющуюся A кристаллическую форму кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]пиримидин-6-карбоновой кислоты и аморфную (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновую кислоту.
5. Способ получения кристаллической формы A кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты по п. 1, где способ включает следующие стадии:
1) обеспечение первого раствора, содержащего первый растворитель и (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновую кислоту, растворенную в первом растворителе, который является хорошим растворителем и выбран из следующей группы, состоящей из этанола, ацетона, этилацетата и дихлорметана или их комбинаций;
2) добавление второго растворителя к первому раствору для кристаллизации и получения кристаллической формы A кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты по п. 1, где второй растворитель является слабым растворителем и выбран из следующей группы, состоящей из петролейного эфира и диэтилового эфира или их комбинаций,
кристаллизацию проводят при 0-50 °C.
6. Способ по п. 5, где в первом растворе концентрация растворенной (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты составляет от 0,1 г/л до насыщенной концентрации.
7. Способ по п. 5, где кристаллизацию проводят при 20-30 °C.
8. Фармацевтическая композиция для лечения или предупреждения диабета II типа и/или осложнений диабета II типа, которая содержит эффективное количество кристаллической формы A кристалла (R)-метил-2-(3-аминопиперидин-1-ил)-3-(2-цианобензил)-4-карбонил-3,4-дигидротиофен[3,2-d]-пиримидин-6-карбоновой кислоты по п. 1 и фармацевтически приемлемые эксципиенты, которые выбраны из группы, состоящей из наполнителей, разрыхлителей, связующих веществ, смазывающих веществ и их комбинаций.
| US 20140323466 A1, 30.10.2014 | |||
| ПРИМЕНЕНИЕ ИНГИБИТОРА DPP-IV ДЛЯ СНИЖЕНИЯ ПРИСТУПОВ ГЛИКЕМИИ | 2006 |
|
RU2440143C2 |
| CN 102659813 A, 12.09.2012 | |||
| CN 101817833 B, 06.03.2013. | |||
Авторы
Даты
2019-09-03—Публикация
2016-02-03—Подача