ФИНАНСИРУЕМЫЕ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИЯ И РАЗРАБОТКИ
Настоящее изобретение выполнено при государственной поддержке согласно договору под номером R01 ЕВ 011872, предоставленной Национальными институтами здравоохранения посредством Национального института биомедицинской визуализации и биоинженерии. Правительство обладает определенными правами на это изобретение.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к визуализации нервов под флуоресцентным контролем во время операции, особенно к области местного введения контрастных агентов для визуализации основного белка миелина (МВР) нервов во время операции. Также предложены фармацевтические композиции для местного введения контрастных агентов, позволяющие осуществлять идентификацию нервов во время операции.
Непреднамеренное повреждение нервов является основной причиной заболеваемости, связанной со многими хирургическими вмешательствами для спасения жизни. Осложнения, возникающие в результате этих повреждений, зависят от тяжести и локализации повреждения нерва и часто приводят к симптомам, отрицательно влияющим на качество жизни пациента, таким как утрата функции и/или чувствительности, мышечная атрофия, паралич и хроническая невропатия. Особую важность представляет онкологическая хирургия, требующая радикальной резекции брюшной полости и таза, поскольку множество мелких нервов вовлечено в сенсорные, моторные и автономные функции. В колоректальной и гинекологической хирургии после достижения контроля над раком крайне важно сохранение автономных нервов, которые контролируют мочевой пузырь и кишку. В области урологии исследования исходов после радикальной простатэктомии показали, что мочеотделительная и половая дисфункция в результате повреждения нервов часто встречались даже через 5 лет после процедуры. Эти нервы в нервно-сосудистом пучке часто трудно визуализировать во время операции даже при увеличении вследствие их сложного переплетения, размера и анатомических вариаций среди индивидуумов. Причины повреждения нервов различны, но часто являются результатом ограниченной способности к распознаванию нервных волокон от окружающей ткани; их по ошибке можно принять за сосуды, либо их можно резецировать вместе с целевой злокачественностью вследствие их близкого расположения. Современные нервосберегающие технологии главным образом основаны на идентификации анатомических ориентиров, что часто зависит от опыта хирурга.
В доклинических исследованиях успешно продемонстрирована идентификация нервов во время операции с применением хирургии под флуоресцентным визуализационным контролем, при которой используют контрастные агенты, вводимые путем системной инъекции (см. патенты и публикации авторов изобретения). После внутривенной (в/в) инъекции животным необходимо время, достаточное, чтобы позволить контрастному агенту распространиться во всем организме, выбрать специфичный белок и удалиться из нецелевых областей. Так как хирургия под флуоресцентным контролем использовалась впервые, немного нацеленных оптических агентов было протестировано с участием людей. В связи с надзором со стороны контролирующих органов за тестированием системно вводимых человеку контрастных агентов существует барьер для перехода к клиническому применению. Местное введение дает потенциальную возможность снижения затрат на программу клинических исследований, что делает переход к исследованиям на людях более осуществимым.
По сравнению с системной доставкой контрастного агента местное нанесение обладает множеством потенциальных преимуществ. Оно потенциально может ограничить возможность системного всасывания и токсичность, улучшая, тем самым, профиль безопасности контрастного агента. Оно может обеспечить высокую и замедленную дозу контрастного агента в области хирургического вмешательства, где наиболее необходима визуализация во время операции, ограничивая при этом его концентрацию в других областях. Это также позволило бы хирургам контролировать распределение времени местного нанесения так, что они могли бы наносить агент в область хирургического вмешательства по мере необходимости.
Следовательно, все еще существует необходимость в агенте для местного введения, который может метить нервы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены агенты для местного введения, способные к связыванию с основным белком миелина.
В одном воплощении, фармацевтический агент содержит соединение формулы I или его соль, где формула I представляет собой:
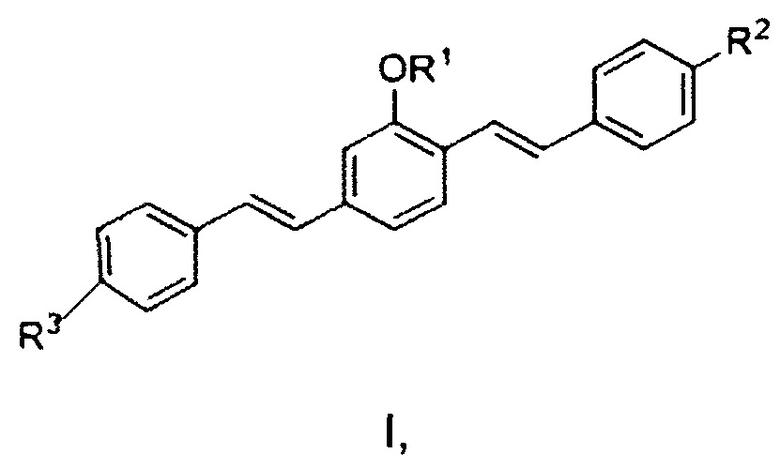
R1 представляет собой алкильную группу, R2 представляет собой электронодонорную группу, и R3 представляет собой электроноакцепторную группу. Также в него включен водный фармацевтический носитель, содержащий по меньшей мере два растворителя, выбранных из PEG (полиэтиленгликоль)-300, пропиленгликоля, поливинилпирролидона, поливинилового спирта, карбопола и лаурокапрама.
Также предложен способ визуализации основного белка миелина в открытом или минимально инвазивном хирургическом поле посредством местного введения фармацевтического агента путем приведения в контакт области хирургического вмешательства с фармацевтическим агентом. Этот агент, содержащий соединение формулы I или его соль, где формула I представляет собой:
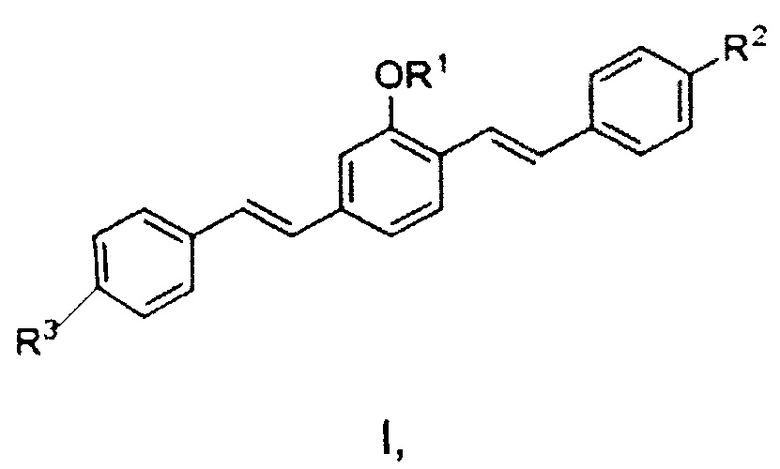
где R1 представляет собой алкильную группу, R2 представляет собой электронодонорную группу, и R3 представляет собой электроноакцепторную группу, также содержит водный фармацевтический носитель. Способ дополнительно включает, после нанесения, стадию обнаружения агента путем приложения источника света, настроенного на спектральные характеристики возбуждения агента, и наблюдения субъекта через оптический фильтр, настроенный на спектральные характеристики излучения агента.
Также предложены наборы для обеспечения вводимого местным путем фармацевтического агента, описанного выше.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Эти и другие признаки, аспекты и преимущества настоящего изобретения станут более понятны после изучения приведенного ниже подробного описания со ссылкой на сопроводительные графические материалы, при этом:
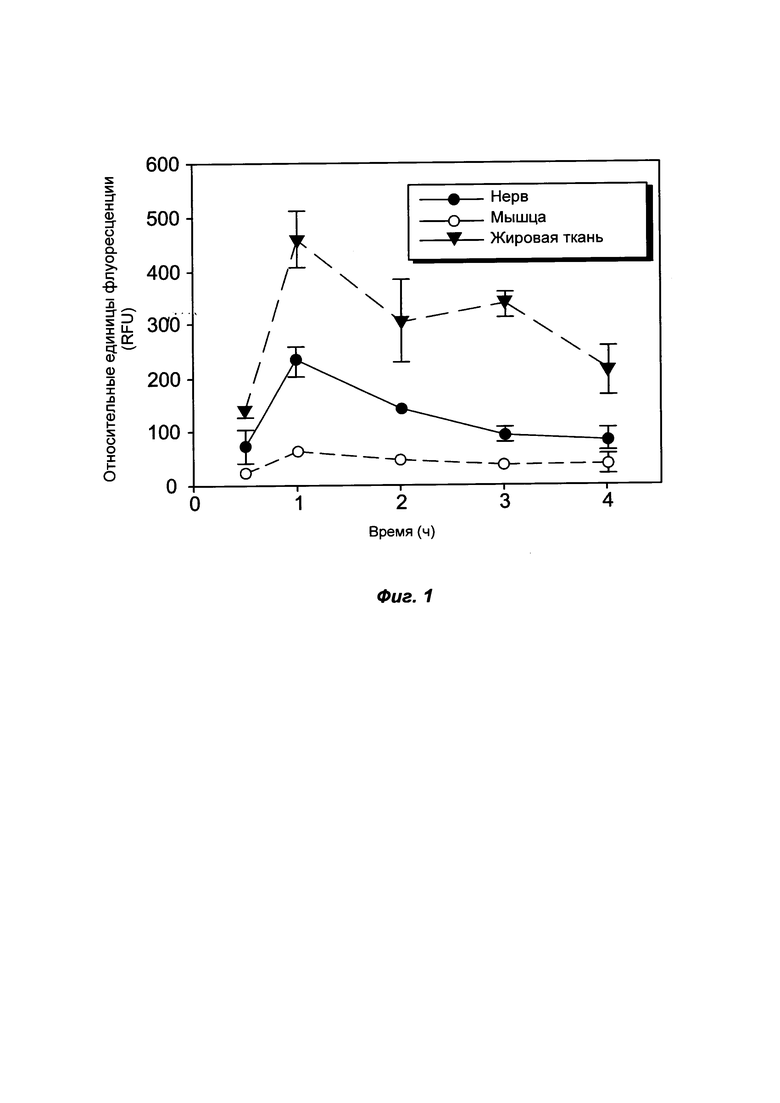
На ФИГ. 1 показана кинетика захвата и клиренса вводимого путем в/в инъекции соединения ФОРМУЛЫ I(f) на мышиной модели.
ФИГ. 2А представляет собой репрезентативное изображение нервов в белом свете после местного нанесения соединения ФОРМУЛЫ I(f) во время операции на мышиной модели.
ФИГ. 2В относится к такой же мышиной модели, что и ФИГ. 2А, и представляет собой репрезентативное флуоресцентное изображение нервов после местного нанесения соединения ФОРМУЛЫ I(f) во время операции на мышиной модели.
ФИГ 2С представляет собой полученное при помощи флуоресцентного микроскопа изображение, на котором показано, что пучки миелина тороидальной формы окрашены соединением ФОРМУЛЫ I(f) после местного нанесения во время операции на мышиной модели.
ФИГ. 2D представляет собой полученное при помощи микроскопа изображение, на котором показано флуоресцентное мечение нерва у мыши посредством наносимого местным путем соединения ФОРМУЛЫ I(d).
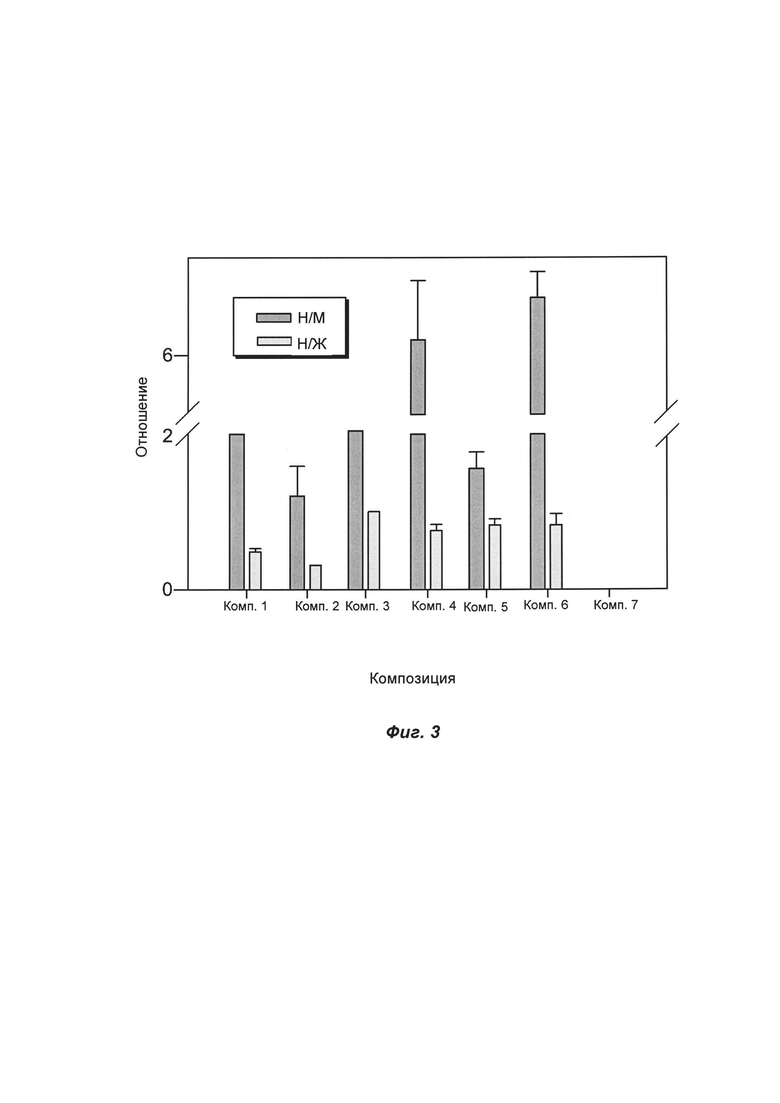
ФИГ. 3 представляет собой диаграмму сравнения отношений "нерв к мышце" (Н/М) и "нерв к жировой ткани" (Н/Ж) для соединения ФОРМУЛЫ I(f), приготовленного в виде композиции с разными фармацевтическими носителями, при местном нанесении в область хирургического вмешательства на мышиной модели.
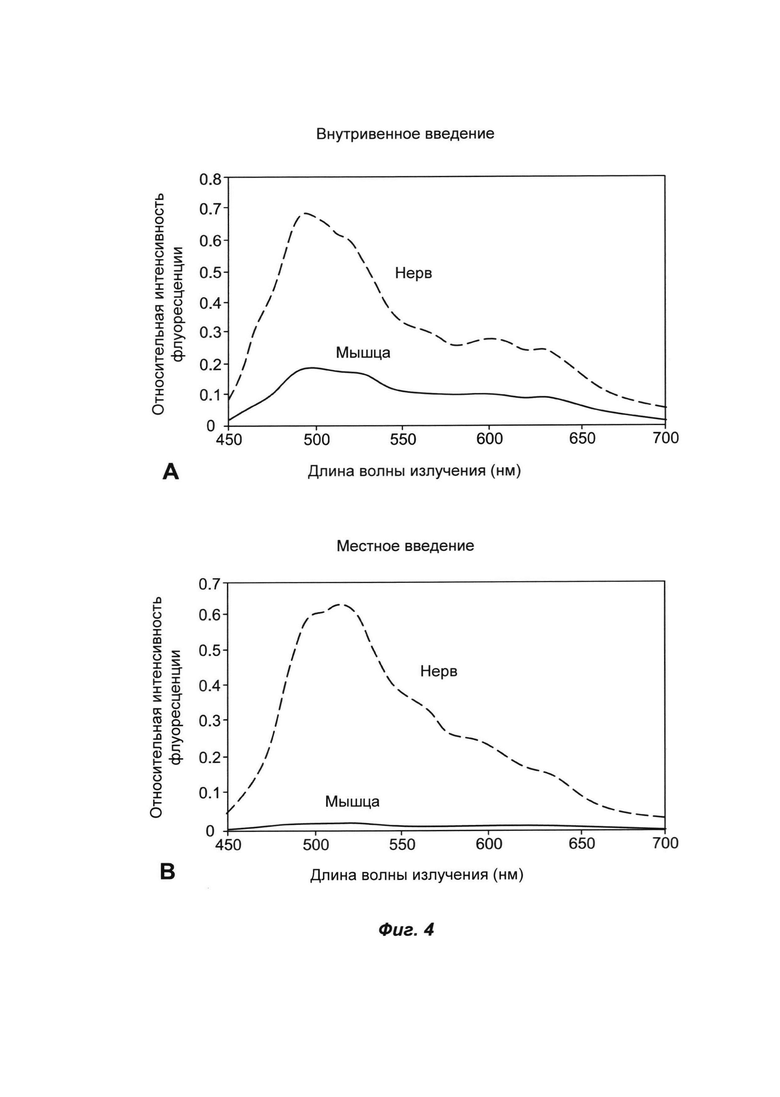
ФИГ. 4 представляет собой полученные при многоспектральной визуализации графики, сравнивающие контраст между системным (внутривенным) введением соединения ФОРМУЛЫ I(f) (график А) и местным нанесением соединения ФОРМУЛЫ I(f) на мышиной модели (график В).
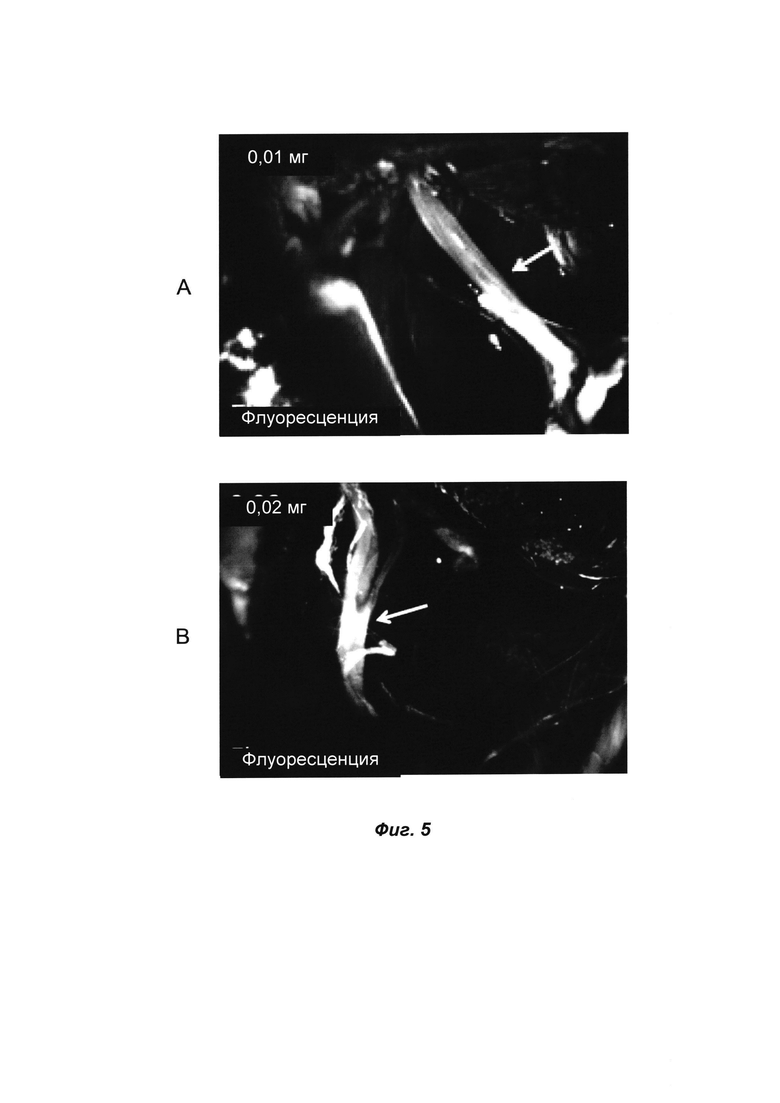
ФИГ. 5 представляет собой флуоресцентные изображения при местном нанесении в область хирургического вмешательства 0,01 миллиграмма (А) и 0,02 миллиграмма (В) соединения ФОРМУЛЫ I(f) в композиции 6.
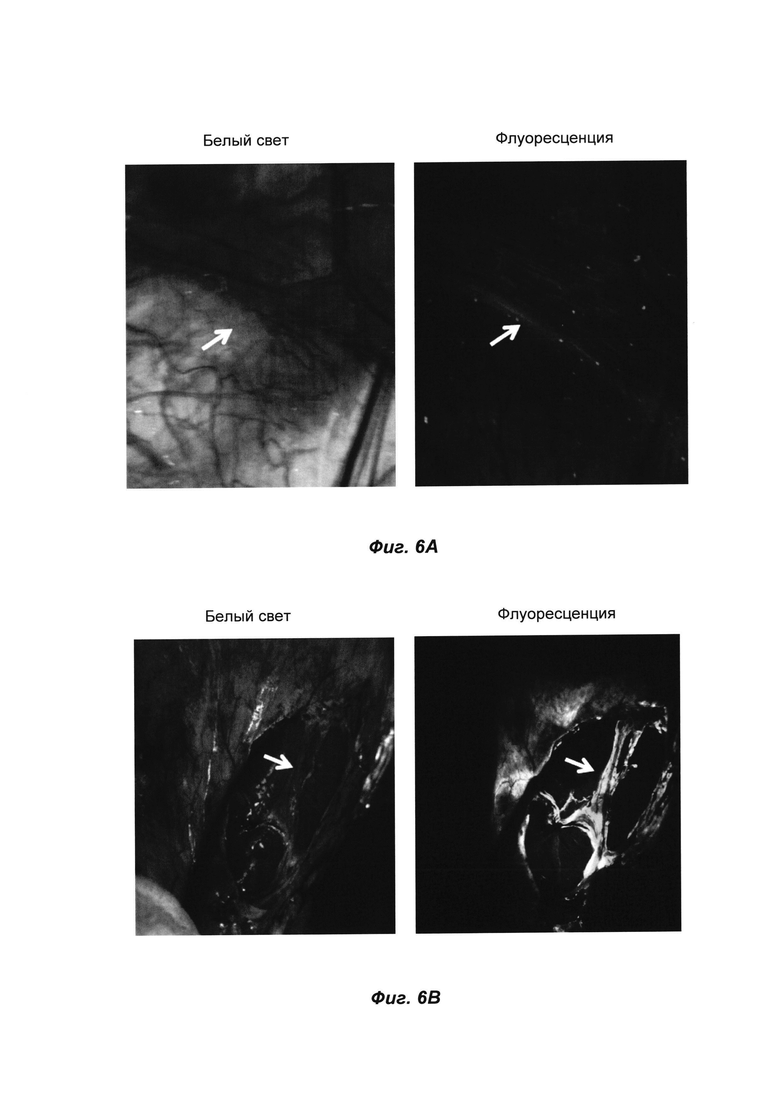
ФИГ. 6А представляет собой кадры, полученные при видеосъемке визуализации во время операции в режиме реального времени, на которых показаны изображения в белом свете и флуоресцентные изображения при местном нанесении 4 миллиграммов соединения ФОРМУЛЫ I(f) в композиции 4 на свиной хирургической модели; при визуализации в белом свете нерв был совсем невидим, тогда как в случае флуоресцентного контроля он в высокой степени поддавался обнаружению (стрелка в двух областях).
ФИГ. 6В представляет собой кадры, полученные при видеосъемке визуализации во время операции в режиме реального времени, на которых показаны изображения в белом свете и флуоресцентные изображения при нанесении 0,3 миллиграмма соединения ФОРМУЛЫ I(f) в композиции 6 в область хирургического вмешательства вокруг забрюшинного пространства; при более низкой дозировке нерв (стрелка) был более выраженным при флуоресцентной визуализации по сравнению с визуализацией в белом свете.
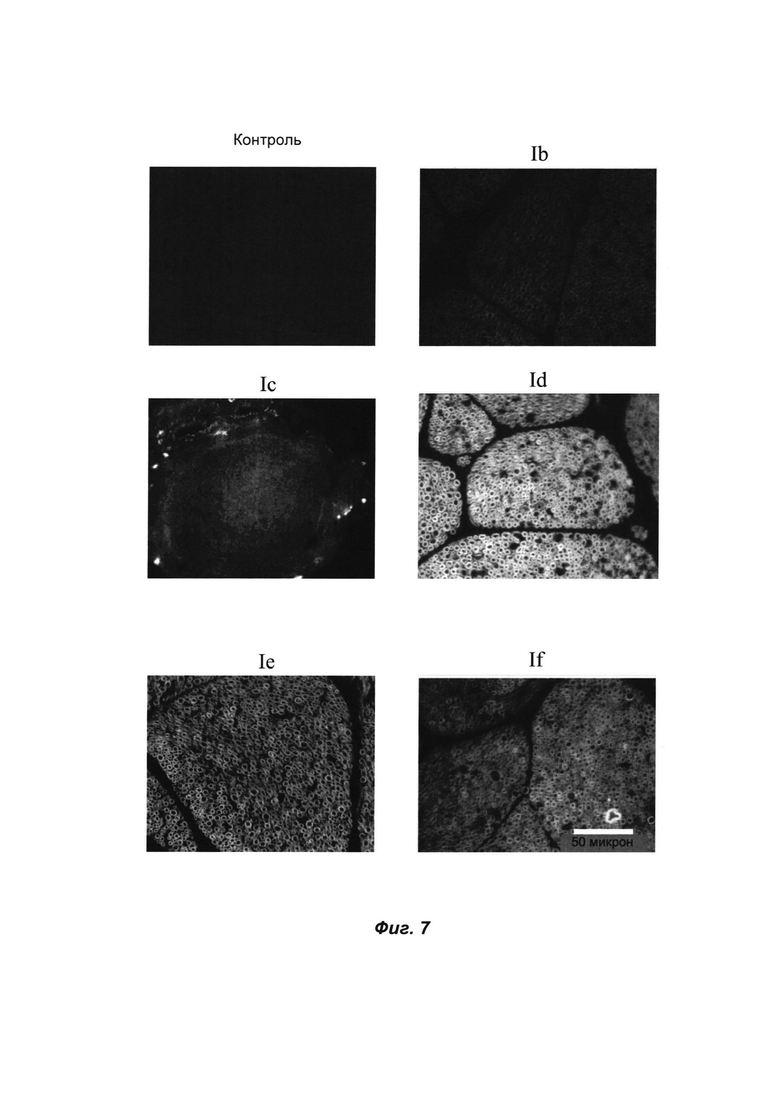
ФИГ. 7 представляет собой сравнительные полученные при помощи флуоресцентного микроскопа изображения срезов из замороженной нервной ткани, меченных 10 мкМ красителей формулы I (Ib-f) по сравнению с контрольной тканью, которую инкубировали только лишь с буферным раствором. Масштабная линейка ~ 50 микрон.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Приведенное ниже подробное описание является иллюстративным и не предназначено для ограничения заявленного изобретения и применений изобретения. Кроме того, авторы изобретения не намерены ограничиваться ни теорией, представленной в приведенном выше описании предшествующего уровня техники, ни описанием графических материалов.
Для более понятного и краткого описания и подчеркивания сущности заявленного изобретения, ниже приведены определения специальных терминов, которые используются в последующем описании и прилагаемой формуле изобретения.
"Миелин-ассоциированная невропатия" в целом относится к любому состоянию, при котором компонентом синдрома, заболевания или другого патологического состояния, такого как, без ограничения, рассеянный склероз, синдром Гийена-Барре, лейкодистрофии, метахроматическая лейкодистрофия, болезнь Рефсума, адренолейкодистрофия, болезнь Краббе, фенилкетонурия, болезнь Канавана, болезнь Пелицеуса-Мерцбахера, болезнь Александера, диабетическая невропатия, вызванная химиотерапией невропатия, болезнь Альцгеймера, сосудистая деменция, деменция с тельцами Леви или любая их комбинация, является повреждение или нарушение функции участков нейронов, покрывающих нейроны изолирующим веществом.
"Агент" относится к раствору или носителю для введения соединения субъекту таким образом, чтобы обеспечить возможность введения соединения в желаемой концентрации и с желаемой эффективностью. Агент может включать, без ограничения, растворители, стабилизирующие добавки, буферы и наполнители. Фармацевтический агент относится к агентам, обладающим лекарственными или другими биологическими свойствами, включающими, без ограничения, применение в терапии или диагностике.
Агент проявляет "специфическое связывание" с миелином, если он связывается с миелином чаще, быстрее, в течение более длительного времени или с большей аффинностью, чем с тканями, не содержащими миелин. "Неспецифическое связывание" относится к связыванию агента с тканью, не содержащей миелин. Для получения относительных значений связывания, таких как специфическое связывание или неспецифическое связывание, каждый образец следует подвергать измерению при аналогичных физиологических условиях (а именно: температуре, рН, композиции и способе введения). Специфическое связывание обычно характеризуется относительно высокой аффинностью агента по отношению к мишени и емкостью от относительно низкой до умеренной. Обычно связывание считают специфическим, если константа аффинности Ka составляет по меньшей мере 106 М-1. Более высокая константа аффинности указывает на большую аффинность и, следовательно, как правило, большую специфичность. Например, антитела обычно связывают антигены с константой аффинности в диапазоне от 106 М-1 до 109 М-1 или выше. "Неспецифическое связывание" обычно имеет низкую аффинность при емкости от умеренной до высокой. Неспецифическое связывание обычно происходит, когда константа аффинности ниже 106 М-1. Контроль за временем и способом, используемым для приведения агента в контакт с тканями, уменьшают неспецифическое связывание.
"Промывка" обычно относится к любому способу, такому как, без ограничения, погружение в немеченый раствор или другое вещество, такие как, без ограничения, вода, физиологический раствор, буферный физиологический раствор или этанол, или промывание ими путем многократного применения, предназначенные для предоставления среды для диссоциации, дисперсии и удаления несвязанного или неспецифически связанного соединения для мечения из немиелинизированных компонентов ткани или образца ткани без устранения специфического связывания с миелином.
"Базовая флуоресценция" относится к частоте и величине электромагнитного излучения, испускаемого тканью или образцом ткани, подвергаемыми воздействию внешнего источника электромагнитного излучения при отсутствии введения или связывания с ними какого-либо флуоресцирующего соединения, в отличие от излучения, испускаемого после введения и связывания такого флуоресцирующего соединения и подвергания воздействию внешнего источника электромагнитного излучения.
"Контрольный образец, репрезентативный для среза ткани", относится к образцу ткани, имеющему размер, морфологию или структуру, подобные анализируемому образцу ткани, и имеющему уровень миелина, при этом уровень миелина в указанном образце служит в качестве стандарта, с которым можно сравнивать уровни миелина в других образцах.
"Фармацевтический носитель" относится к композиции, которая дает возможность наносить вещество, представляющее собой агент, в область нанесения, окружающие ткани или приготовленный срез ткани, чтобы обеспечить эффективное время пребывания этого агента для специфического связывания с мишенью, или чтобы обеспечить удобный путь его высвобождения. Стратегии солюбилизации могут включать, без ограничения, регулирование рН, образование соли, образование ионизируемых соединений, использование сорастворителей, комплексообразования, поверхностно-активных веществ и мицелл, эмульсий и микроэмульсий. Фармацевтический носитель может включать, без ограничения, солюбилизатор, усилители проникновения через кожу, детергент, буферный раствор, стабилизаторы и консерванты. Примеры этих веществ включают, без ограничения, HCl, лимонную кислоту, DMSO (диметилсульфоксид), пропиленгликоль, этанол, PEG 300, циклодекстрины, цитрат, ацетат, фосфат, карбонат или трис(гидроксиметил)аминометан. Примером усилителя проникновения через кожу является лаурокапрам, который также способен к транспортировке или переносу соединения через барьер, например к трансдермальному проникновению.
"Модель демиелинизации" относится к любому вызванному экспериментальным путем повреждению или нарушению функции участков нейронов, покрывающих нейроны изолирующим веществом, которые можно использовать при экспериментальном исследовании невропатической демиелинизации, включая, без ограничения, экспериментальный аллергический энцефаломиелит.
Ремиелинизация относится к самопроизвольной, терапевтическим или экспериментальным путем индуцированной репарации, регенерации или иному улучшению конституции или функциональности нейронных аксонов, покрывающих нейроны изолирующим веществом.
Подразумевают, что "алкил" включает линейные, разветвленные или циклические углеводородные структуры и их комбинации, в том числе низший алкил и высший алкил. Алкильные группы представляют собой группы С20 или с меньшим числом атомов углерода. "Низший алкил" относится к алкильным группам, имеющим от 1 до 6, предпочтительно от 1 до 4 атомов углерода, и включают метил, этил, н-пропил, изопропил и н-, втор- и трет-бутил. Высший алкил относится к алкильным группам, имеющим семь или более атомов углерода, предпочтительно 7-20 атомов углерода, и включает н-, втор- и трет-гептил, октил и додецил. Циклоалкил представляет собой подгруппу алкила и включает циклические углеводородные группы, имеющие от 3 до 8 атомов углерода. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил и норборнил. Алкенил и алкинил относятся к алкильным группам, где два или более атомов водорода заменены двойной или тройной связью, соответственно.
"Замещенный" относится к остаткам, включающим, без ограничения, алкил, алкиларил, арил, арилалкил и гетероарил, где вплоть до трех атомов Н остатка заменено низшим алкилом, замещенным алкилом, арилом, замещенным арилом, галогенал килом, алкокси, карбонилом, карбокси, карбоксалкокси, карбоксамидо, ацилокси, амидино, нитро, галогеном, гидрокси, ОСН(СООН)2, циано, первичной аминогруппой, вторичной аминогруппой, ациламино, алкилтио, сульфоксидом, сульфоном, фенилом, бензилом, фенокси, бензилокси, гетероарилом или гетероарилокси.
Электронодонорная группа относится к химическим группам, которые добавляют электронную плотность сопряженной π-системе, делая ее более нуклеофильной. Электронодонорные группы могут быть распознаны по неподеленным парам электронов на атоме, примыкающем к π-системе. Примеры электронодонорных групп включают, без ограничения, -NR'R'', -NHR, -NH2, -NC(NH2)2, -ОН, -OR, -SR, -NHCOR, -OCOR, -C6H5 и -CH=CR2.
"Электроноакцепторная группа" относится к химическим группам, которые удаляют электронную плотность из сопряженной π-системы, придавая структуре меньшую нуклеофильность. Электроноакцепторные группы могут быть распознаны либо по атому, примыкающему к π-системе, имеющему несколько связей с более электроотрицательными атомами либо имеющему формальный положительный заряд. Примеры электроноакцепторных групп включают, без ограничения, -СНО, -COR, -COOR, -СООН, -CONH2, -CONHR, -CONR2, -CF3, -CN, C=C(CN)2, -SO3H, -NH3+, -NR3+, -NO2, -SOR, -SO2R, -SO2NH2, -SO2NHR и -SO2NR2.
Агент проявляет "специфичный захват" в отношении миелинизированных тканей, если он связывается с миелинизированными тканями чаще, быстрее, в течение более длительного времени или с большей аффинностью, либо если он характеризуется большей абсорбцией или большим накоплением в миелинизированных тканях по сравнению с немиелинизированными тканями. Специфичный захват обычно характеризуется относительно высокой аффинностью агента по отношению к мишени.
Если не указано иное, все числа, выражающие количества ингредиентов, свойства, такие как молекулярная масса, условия реакции и так далее, используемые в описании и формуле изобретения, во всех случаях следует понимать модифицированными с помощью термина "приблизительно". Соответственно, если не указано обратное, числовые параметры, изложенные в последующем описании и прилагаемой формуле изобретения, представляют собой приближенные значения, которые могут изменяться в зависимости от желаемых свойств, которые хотят получить с помощью настоящего изобретения. В крайнем случае и не в качестве попытки ограничить применение теории эквивалентов объемом формулы изобретения, каждый числовой параметр следует по меньшей мере понимать в свете числа указанных значащих цифр и путем применения обычных методов округления.
Многие из описанных здесь соединений могут содержать один или более асимметрических центров и, таким образом, могут образовывать энантиомеры, диастереомеры и другие стереоизомерные формы, которые, исходя из абсолютной стереохимии, могут быть определены как (R)- или (S)-. Химическая структура агента включает, например, без ограничения, все такие возможные изомеры, а также их рацемические и оптически чистые формы. Оптически активные (R)- и (S)-изомеры могут быть получены с использованием хиральных синтонов или хиральных реагентов либо разделены с использованием традиционных методик. В случаях, когда описанные здесь соединения содержат олефиновые двойные связи или другие центры геометрической асимметрии и если не указано иное, подразумевают, что соединения включают как Е-, так и Z-геометрические изомеры. Подобным образом также включены все таутомерные формы.
В некоторых воплощениях предложен способ качественного или количественного обнаружения основного белка миелина посредством местного нанесения агента, который специфически связывается с основным белком миелина. Специфическое связывание с основным белком миелина можно осуществлять посредством соединения формулы I или его соли
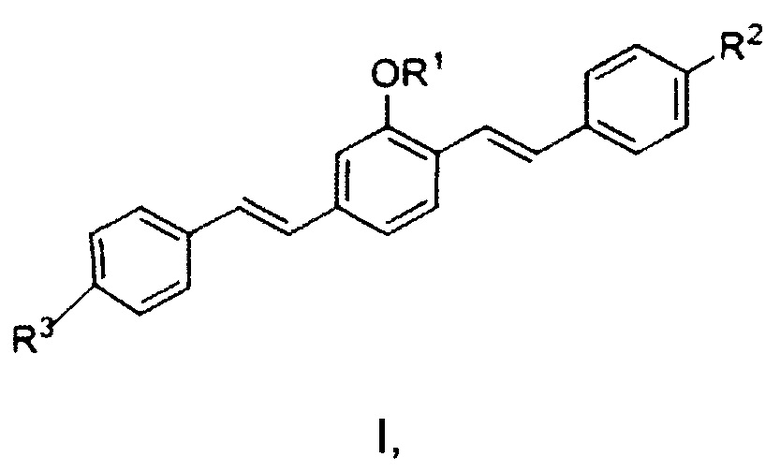
где R1 представляет собой алкильную группу, R2 представляет собой электронодонорную группу, и R3 представляет собой электроноакцепторную группу.
В некоторых воплощениях R1 представляет собой низшие алкильные группы, имеющие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, и включает метил, этил, н-пропил, изопропил и н-, втор- и трет-бутил. Электронодонорная группа R2 может включать первичный, вторичный или третичный амин либо алкоксигруппу. Предпочтительно R2 может представлять собой амин, более предпочтительно NH2.
В некоторых предпочтительных воплощениях специфическое связывание с основным белком миелина можно осуществлять посредством соединения формулы I(a) или его соли
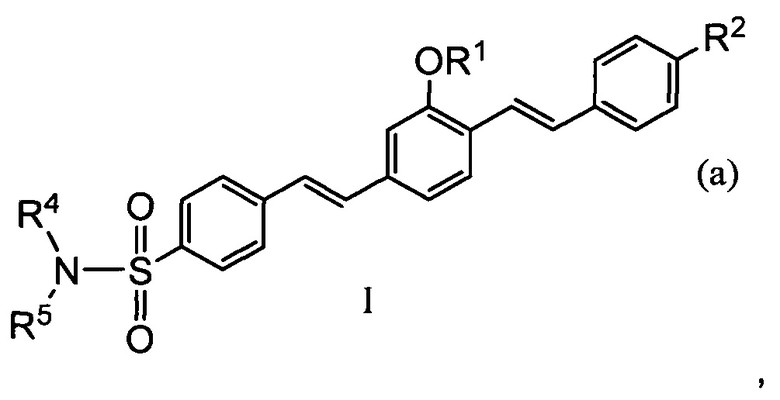
где R4 и R5 можно использовать для улучшения растворимости в воде и снижения logP агента. R4 и R5 могут независимо представлять собой атом водорода или алкил, предпочтительно низшую алкильную группу, имеющую от 1 до 6 атомов углерода. В других воплощениях R4 и R5 могут независимо представлять собой замещенные алкильные группы, такие как, без ограничения, алкокси- или спиртовые группы. В некоторых воплощениях алкоксигруппа может содержать этиленгликолевые единицы или заканчивающийся этиленгликолем спирт; например (CH2CH2O)nX или СН2СН2СН2(ОСН2СН2)nOX, где n представляет собой целое число от 1 до 6, а X представляет собой водород, метил или этил. В других воплощениях изобретения, когда R4 и R5 образуют незамещенную или замещенную гетероциклическую кольцевую структуру, гетероциклическая кольцевая структура может представлять собой пиперидин, пиперазин или морфолин, либо алкил- или алкоксил-замещенный пиперидин, пиперазин или морфолин.
В каждом воплощении R2 и сульфонамидная группа R4R5NSO2 сопряжены посредством π-орбиталей двойных связей бензольных колец и олефиновых заместителей, обеспечивая посредством этого свободный путь для потока электронов от электронодонорной группы к электроноакцепторной группе.
В некоторых воплощениях агент может представлять собой соль формулы I, где R4 и R5 могут включать аммониевый катион с анионом. Аммониевая соль может представлять собой соль третичного аммония, где анион может представлять собой галогенид. В других воплощениях анион может быть многоатомным, например, без ограничения, нитрат, карбонат, сульфат и фосфат. Многоатомный анион также может включать галогенид, например, без ограничения, тетрафторборат, гексафторфосфат, фторполифосфат или их комбинацию. В других примерах анион может иметь происхождение от карбоновых кислот, например, без ограничения, цитрат, тартрат, малеат, малат, фумарат, итаконат или аскорбат.Для применений in vivo эти анионы с низкой биологической токсичностью должны быть предпочтительны.
Другие неограничивающие примеры формулы I приведены в таблице I (формула I (b-f)).
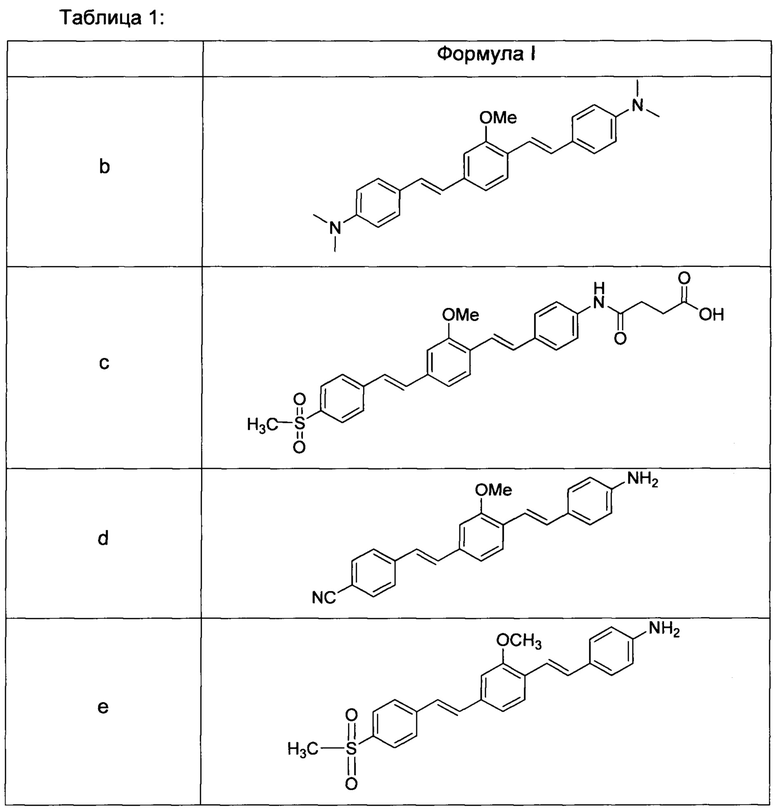
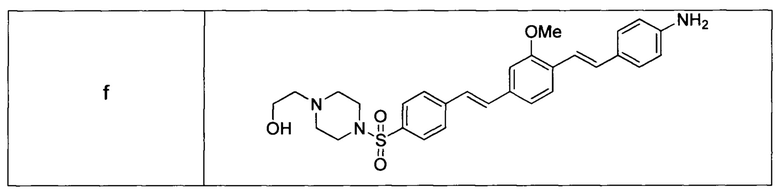
В некоторых воплощениях агенты, которые обладают улучшенной водной растворимостью по сравнению с подобными агентами, могут уменьшить неспецифическое распределение агентов в нецелевую ткань, такую как жировая ткань. Улучшенная водная растворимость также может обеспечить возможность приготовления агентов в виде композиции с фармацевтическими носителями, обладающими незначительными известными токсическими эффектами или не обладающими ими, что, таким образом, делает их более подходящими для применения в более высокой дозировке и обеспечивает исследователей и врачей важными диагностическими и лечебными средствами.
В некоторых воплощениях к области нанесения можно приложить источник света, настроенный на спектральные характеристики возбуждения агента. Агент можно наблюдать через оптический фильтр, настроенный на его спектральные характеристики излучения. Нервы и другую содержащую миелин ткань благодаря их специфическому связыванию с флуоресцирующим агентом можно отличить от ткани, не содержащей основной белок миелина. Это дает возможность хирургу избежать непреднамеренного разреза или повреждения миелинизированной ткани путем избегания флуоресцирующей ткани или способствует аккуратному проведению лечения в целевой миелинизированной ткани.
В некоторых воплощениях фармацевтический агент может представлять собой специальную композицию, и его можно применять локально в виде растворов, порошков, гелей, эмульсий, кремов, мазей, гранул или коллагеновых имплантатов.
После местного введения к области нанесения можно приложить источник света, настроенный на спектральные характеристики возбуждения агента. Агент можно наблюдать через оптический фильтр, настроенный на его спектральные характеристики излучения. Нервы и другую содержащую миелин ткань благодаря их специфическому связыванию с флуоресцирующим агентом можно отличить от ткани, не содержащей основной белок миелина. Это, например, дает возможность хирургу избежать непреднамеренного разреза или повреждения миелинизированной ткани путем избегания флуоресцирующей ткани или способствует аккуратному проведению лечения в целевой миелинизированной ткани. В некоторых воплощениях агент содержит соединение формулы I.
Чтобы определить, имеет ли пациент недостаточную миелинизацию, уровни миелинизации можно сравнивать с уровнями, выявленными у субъекта или субъектов, в отношении которых полагают или известно, что они не страдают от миелин-ассоциированной невропатии. В другом воплощении можно определять скорости демиелинизации или ремиелинизации. После лечения с помощью известного или предлагаемого терапевтического средства, в отношении которого полагают или ожидают, что оно предотвращает или замедляет демиелинизацию или стимулирует ремиелинизацию у пациентов, страдающих от миелин-ассоциированных невропатий, уровни миелинизации оценивают в течение периода времени путем осуществления визуализации пациентов, обрабатываемых терапевтическим средством. Можно осуществлять визуализацию в разные моменты времени и сравнивать уровень миелинизации в один момент времени с уровнем в другой момент времени. Сам уровень миелинизации можно определять качественно или количественно.
После связывания с основным белком миелина образец можно промывать таким способом и в такой среде, которые подходят для удаления какой-либо несвязанной и неспецифически связанной метки из образца без устранения специфического связывания с основным белком миелина.
В некоторых воплощениях фармацевтический носитель можно использовать для улучшения по меньшей мере одного из: растворимости, проникновения или биодоступности агента, содержащего соединение формулы I или его соль. В некоторых воплощениях фармацевтический носитель можно использовать для улучшения растворимости соединения в растворе, а также осуществления действия по переносу или транспортировке соединения через барьер, например для обеспечения возможности проникновения через кожу.
В некоторых воплощениях фармацевтический носитель может включать карбопол, полиэтиленгликоль (такой как PEG-300), пропиленгликоль, поливиниловый спирт, поливинилпирролидон или лаурокапрам для местного введения во время операции.
В некоторых воплощениях фармацевтический носитель представляет собой водный раствор, содержащий, исходя из объема, 1-30% PEG-300, 1-20% пропиленгликоля, 1-10% поливинилпирролидона и 0-10% лаурокапрама.
В некоторых воплощениях фармацевтический носитель представляет собой водный раствор, содержащий, исходя из объема, 20% PEG-300, 10% пропиленгликоля, 5% поливинилпирролидона и 5% лаурокапрама.
Другие фармацевтические носители могут включать, без ограничения, поверхностно-активные вещества, липиды, в том числе триглицериды, циклодекстрины и фосфолипиды, а также другие детергенты, буферные растворы, стабилизаторы и консерванты. В каждом случае использования как водорастворимых, так и нерастворимых в воде органических растворителей их можно применять в комбинации с другими фармацевтическими носителями для ограничения распространения осаждения, боли, воспаления и гомолизиса после введения.
Методики улучшения растворимости агента могут включать регулирование рН, образование соли, как описано выше, сорастворители, комплексообразование, эмульсии, мицеллы и липосомы. Фармацевтический носитель также может включать, без ограничения, поверхностно-активные вещества, такие как детергент, буферные растворы, стабилизаторы и консерванты. В некоторых воплощениях носитель также может включать усилитель проникновения через кожу, действие которого состоит в переносе соединения или лекарственного средства через барьер, включая трансдермальную доставку.
В некоторых воплощениях агент, содержащий соединение формулы I или его соль, может быть упакован и представлен в виде набора, обеспечивающего сохранение стерильности агента, а также других основных параметров, таких как рН, растворимость и концентрация. Набор должен содержать агент в форме, подходящей для введения, например растворенный в фармацевтическом носителе. В некоторых воплощениях фармацевтический носитель может дополнительно содержать сорастворитель, поверхностно-активное вещество, буферный раствор, стабилизатор и консервант или их комбинацию для правильного хранения или обращения с агентом.
В некоторых воплощениях набор может быть выполнен в виде многокамерного сосуда для хранения фармацевтического агента в первой камере и фармацевтического носителя во второй камере. В некоторых воплощениях фармацевтический агент может храниться в первой камере с фармацевтическим носителем и возможно с буферным раствором, стабилизатором и консервантом или их комбинацией. Вторая камера может содержать другие компоненты фармацевтического носителя для улучшения растворимости перед применением. Как таковые, компоненты носителя могут быть желательны для применения агента по назначению, но вредны для хранения или в отношении длительной стабильности агента.
ПРИМЕРЫ
В приведенных ниже неограничивающих примерах показаны и описаны различные воплощения настоящего изобретения. Примеры включают данные, полученные при сравнении системного введения контрастных агентов с местным нанесением контрастных агентов для мечения нервов во время операции. Такое сравнение показывает, что при правильном приготовлении наносимый местным путем контрастный агент для мечения нервов может избирательно метить нервы в пределах значительно более короткого времени, при более низкой дозировке и с лучшим нервно-мышечным контрастом по сравнению с системно вводимым агентом для мечения нервов. Получение характеристик контрастных агентов in vitro:
Спектры поглощения агентов измеряли с использованием спектрометра Lambda 20 UV/Vis (УФ/видимый свет) (Perkin Elmer, Waltham, MA) при длинах волн в диапазоне от 200 до 800 нм в 100%-ном диметилсульфоксиде (DMSO), абсолютном метаноле (МеОН) и дистиллированной/деионизированной воде (ddH2O). Затем длину волны при максимуме поглощения использовали в качестве длины волны возбуждения для снятия спектров излучения флуоресценции на стационарном флуориметре (steady state fluorimeter) (Photon Technology International, Birmingham, NJ).
Мечение нервов ex vivo:
Различные нервы собирали от самцов крыс линии Sprague Dawley. Ткань подвергали фиксации путем перфузии и постфиксации 10%-ным забуференным нейтральным формалином. После постфиксации ткань подвергали криопротекции в 20%-ном растворе сахарозы, приготовленном в забуференном фосфатом физиологическом растворе (PBS). Затем нервы подвергали быстрой заморозке с использованием метанола и сухого льда в среде ОСТ. В некоторых случаях, чтобы помочь удержать нервы в вертикальном положении в среде ОСТ, использовали поливинилиденфторидные мембраны. Срезы толщиной 5-10 микрон нарезали на микротоме Leica и хранили в морозильном аппарате при -80°С до окрашивания агентами (1)-(5).
Для окрашивания срезов нервов ex vivo предметные стекла ополаскивали PBS (3×5 мин). Контрастный агент (при конечной концентрации 10 мкМ) наносили на ткань в буфере, содержащем 10% Cremophor EL и 65% сыворотки крысы в PBS. Предметные стекла инкубировали в течение 1 ч в темной влажной камере, после чего промывали PBS (3×5 мин), накрывали покровным стеклом и визуализировали с использованием специального фильтрового куба (фильтр возбуждения: 387 нм с полосой пропускания 11 нм, дихроичным зеркалом 409 нм; эмиссионный фильтр: пропускание в длинноволновой области спектра 409 нм). Также выполняли контрольную операцию с использованием только буфера и точно такой же процедуры для определения автофлуоресценции при тех же параметрах.
Аппаратура для визуализации in vivo:
Коммерческая система для мелких животных: флуоресцентный стереомикроскоп (SteREO Lumar V12, Carl Zeiss Inc., Thornwood, NY), снабженный многоспектральной камерой (Nuance, CRI, Woburn, MA), использовали при времени экспозиции 1-5 с. Возбуждение флуорофоров достигалось с использованием фильтра, центрированного при 406 нм при ширине полосы 15 нм. Спектр излучения флуоресценции регистрировали при длинах волны от 420 до 720 нм с прибавлением по 10 нм, используя присоединенную многоспектральную камеру. Альтернативно, также использовали эмиссионный фильтр с длинноволновым пропускающим фильтром в области спектра 550 (в отсутствие многоспектральной камеры).
Визуализацию во время операции в реальном времени выполняли с помощью прибора для лапароскопической флуоресцентной визуализации в двойном режиме. Лапароскопический модуль содержит стандартный хирургический лапароскоп с абсолютным нулем 10 мм с полем зрения 70 градусов, диаметром 4 мм, длиной световода лапароскопа 1800 мм, устройство для присоединения видеоаппаратуры 35 мм, компактная GigE цветная камера массой 90 грамм, 659×494 пикселей (acA640-90gc Basler, Ahrensburg, Germany) и блокирующий фильтр 405 нм (BLP01-405R Semrock, Rochester, NY), имеющий пропускание более 97% от 420 до 800 нм. Датчик формата 1/3'' обеспечивает высокую чувствительность с размером пикселя 7,4 мкм и адекватное поле зрения (40 градусов из 70 градусов, пропускаемых лапароскопом). Устройство для присоединения видеоаппаратуры связано с окуляром лапароскопа, обеспечивая сменную установку для лапароскопов разных типов. Фильтр 405 нм закреплен непосредственно перед датчиком изображения с помощью фиксирующего кольца с с-креплением. Камера навинчивается непосредственно на устройство для присоединения видеоаппаратуры.
Источник освещения для белого света и флуоресцентной визуализации соединен с одиночным световодом с использованием традиционной оптики. Модуль соединения с источником света состоит из двух 32 мм асферических линз для коллимации светодиода (LED) белого света и 500 мВт, 405 нм синего лазерного диода, соединенных с многомодовым оптоволоконным кабелем диаметром 400 мкм (Shanghai Laser & Optics Century Co., Ltd., China). LED спектр фильтруется длинноволновым пропускающим фильтром 450 нм (NT49-819, Edmund Optics, Barrington, NJ) для минимизации возбуждения флуоресцентного агента, при этом поддерживая цветной спектр белого света. LED и лазер объединены с дихроичным зеркалом 425 нм (DMLP425R, Thorlabs). Объединенное освещение соединено в световоде с третьей 32 мм асферической линзой (ACL4532, Thorlabs). Максимальная интенсивность излучения от LED и 405 нм лазера составляет 2,0 мВт/см2 и 7,3 мВт/см2 соответственно на расстоянии 25 мм от наконечника лапароскопа.
Композиция, дозирование и кинетика визуализации in vivo после системной в/в инъекции контрастного агента на животной модели:
Для системного введения путем в/в инъекции контрастные агенты приготавливали в виде композиции с использованием следующих эксципиентов: 5-15% пропиленгликоля (Fisher Р355-1), 5-30% 2-гидроксипропил-β-циклодекстрина (2-HPβCD, Sigma Н5784) и 70-90% дистиллированной/деионизированной воды. В некоторых случаях также добавляли PEG-300 и DMSO. рН композиции для в/в введения доводили до конечного значения 7,4, используя 1М соляную кислоту. Полную растворимость соединения ФОРМУЛЫ I(f) в композиции проверяли с использованием (1) визуального наблюдения за частицами, (2) центрифугирования (5 мин при 12000 g) с последующим наблюдением, (3) растворения в физиологически релевантном буфере (например, в фосфатном буфере Серенсена) с последующим визуальным наблюдением и анализом в УФ/видимом свете и (4) оценки седиментации и размера частиц с использованием динамического светорассеяния.
Конкретная композиция для в/в введения соединения ФОРМУЛЫ I(f) состояла из 80% дистиллированной/деионизированной воды, 10% 2-гидроксипропил-β-циклодекстрина (2-HPβCD, Sigma Н5784) и 10% пропиленгликоля (Fisher Р355-1).
Для исследований на мышах приобретали в Charles River Laboratories (Wilmington, MA) мышей CD-1, имеющих массу тела в диапазоне от 25 до 30 г, и крыс линии Sprague Dawley, имеющих массу тела в диапазоне от 250 до 300 г. В день эксперимента мышей или крыс анестезировали с использованием 2%-4% изофлурана и вводили им путем однократной инъекции в хвостовую вену каждое из приготовленных в виде в/в композиции соединений ФОРМУЛЫ I(f) в дозе 16 мг/кг. Затем животных возвращали в клетки до запланированного момента времени визуализации.
Композиция для местного введения во время операции и дозирование:
Было протестировано несколько разных композиций, включая, без ограничения:
композицию 1: 10% PEG-300; 20% PG; 0,4% Карбопола; 69,6% воды;
композицию 2: 10% DMSO; 20% PEG-800; 20% PG; 0,1% Полисорбата-80; 49,9% воды;
композицию 3: 30% PEG-300; 5% DMSO; 10% PVA; 55% воды;
композицию 4: 30% PEG-300; 10% PVA; 60% воды;
композицию 5: 30% PEG-300; 5% DMSO; 30% Плюроник F-68 (Pluronic F-68); 0,1% Полисорбата-80; 34,9% воды;
композицию 6: 20% PEG-300; 10% PG; 5% PVP; 5% лаурокапрама; 60% воды;
композицию 7: 20% PEG-300; 10% PG; 5% PVP; 5% лаурокапрама; 5% EtOH; 5% олеиновой кислоты; 10% Твин-80; 40% воды;
где: PVA представляет собой поливиниловый спирт; PVP представляет собой поливинилпирролидон; и PEG представляет собой полиэтиленгликоль.
Различные количества порошкообразного контрастного агента приготавливали в виде композиции с указанными выше эксципиентами. Раствор или гель наносили в область хирургического вмешательства на мышиной модели, при этом время контакта находилось в диапазоне от менее 1 минуты до 20 минут. Затем область хирургического вмешательства орошали раствором для промывки, таким как теплый физиологический раствор, и визуализировали животных.
Для визуализационных исследований на свиньях воздействовали на свиней седативными средствами тилетамин/золазепам (4,4 мг/кг), вводили гликопирролат (0,007 мг/кг) и осуществляли подкожную доставку бупивакаина (0,25%) в виде локального инфильтрата вдоль срединной линии перед лапаротомией. Во время операции свинье делали интубацию и поддерживали с помощью изофлурана (1,5%-2,5%). В ушную вену помещали ангиокатетер 16 размера для сбора крови и введения препарата. Во время процедуры вводили нормосол-R (Normosol-R) со скоростью 10-15 мл/кг/ч. Для обеспечения безопасности и здоровья свиней осуществляли постоянный мониторинг основных показателей состояния организма, температуры и насыщения кислородом. Раствор или гель наносили в область хирургического вмешательства, при этом время контакта находилось в диапазоне от 1 минуты до 5 минут. Затем область хирургического вмешательства орошали теплым физиологическим раствором, и визуализировали области хирургического вмешательства.
На ФИГ. 1 показана кинетика захвата и клиренса вводимого путем в/в инъекции соединения ФОРМУЛЫ I(f) на мышиной модели. Соединение ФОРМУЛЫ I(f) в дозе 16,6 мг/кг использовали для измерения флуоресценции нервов через 0,5, 1, 2, 3 и 4 часа после в/в инъекции. Через 1 ч после инъекции наблюдали максимальную флуоресценцию седалищного нерва и жировой ткани, которая быстро снижалась в последующие моменты времени. Наилучшее отношение "нерв к мышце" со значением 3,7 наблюдали через 1 ч после инъекции.
Вводимые местным путем красители для мечения нервов также обладали способностью к мечению нервов у живого животного. Флуоресценцию от нервов можно обнаружить в пределах нескольких минут после местного нанесения во время операции. Репрезентативные изображения в белом свете и флуоресцентные изображения вводимого мыши местным путем соединения ФОРМУЛЫ I(f) показаны на ФИГ. 2А (белый свет) и ФИГ. 2В (флуоресценция). При визуализации с использованием двухрежимного прибора для лапароскопии во время операции очень тонкие нервные волокна в ветви плечевого сплетения мышиной модели легче обнаруживали при флуоресцентном контроле. В этом примере соединение ФОРМУЛЫ I(f) в композиции 4 наносили в область хирургического вмешательства в плечевое сплетение мыши в течение 5 минут, а затем перед визуализацией эту область орошали стерильным физиологическим раствором.
На ФИГ. 2С показано, что наносимый местным путем контрастный агент может проникать в нервный пучок подобно контрастному агенту, вводимому путем в/в инъекции. После местного нанесения, орошения и удаления седалищного нерва на мышиной модели из замороженной нервной ткани изготавливали срезы толщиной 15 микрон. Визуализация посредством флуоресцентной микроскопии показала, что пучки миелина тороидальной формы окрашены флуорофором.
На ФИГ. 2D показано флуоресцентное мечение нерва у мыши посредством наносимого местным путем соединения ФОРМУЛЫ I(d), которое является родственным соединению ФОРМУЛЫ I(f) по структуре его ядра. Визуализацию осуществляли с использованием имеющегося в продаже прибора для мелких животных.
На ФИГ. 3 показаны отношения "нерв к мышце" и "нерв к жировой ткани" для наносимого местным путем соединения ФОРМУЛЫ I(f) при нанесении в область хирургического вмешательства на мышиной модели со сравнением разных фармацевтических носителей для местного нанесения во время операции. Соединение ФОРМУЛЫ I(f) приготавливали в виде композиции разными путями, как описано выше. Эти разные композиции влияли на контраст между нервами и окружающей тканью. Например, наилучший контраст между нервами и мышцами и между нервами и жировой тканью демонстрировали композиция 6 и композиция 4. Каждый из компонентов композиций добавляли для оказания влияния на (а) солюбилизацию агента, (б) стабильность приготовленного в виде композиции агента, (в) вязкость приготовленного в виде композиции агента для усиления экспозиции в области хирургического вмешательства, (г) проникновение агента в пределах области хирургического вмешательства и (д) специфический сигнал и неспецифическую фоновую флуоресценцию. В область хирургического вмешательства наносили около 70 микрограммов приготовленного в виде композиции соединения ФОРМУЛЫ I(f) в течение примерно 1 минуты с последующей промывкой физиологическим раствором.
Вводимые местным путем агенты для мечения нервов могут дополнительно обеспечить более четкие изображения в результате меньшей неспецифической флуоресценции от окружающей нецелевой ткани (такой как мышцы). На ФИГ. 4 показаны полученные при многоспектральной визуализации графики, сравнивающие контраст между системным (внутривенным) введением соединения ФОРМУЛЫ I(f) (ФИГ. 4А) и местным нанесением соединения ФОРМУЛЫ I(f) (ФИГ. 4В) на мышиной модели. Суммарная доза, требуемая для визуализации в заданной области хирургического вмешательства, была меньше для контрастного агента, вводимого местным путем. В этом примере доза соединения ФОРМУЛЫ I(f), вводимая путем в/в инъекции, составляла приблизительно 16 мг/кг (0,4 миллиграмма на типичную мышь). Доза, вводимая местным путем, составляла приблизительно 0,1 миллиграмма в композиции 4. На Фиг. 4 показано, что нервы были видны более четко при местном введении агента, так как интенсивность флуоресценции от окружающей мышечной ткани была меньше по сравнению с системно вводимым контрастным агентом на протяжении всего диапазона длин волны излучения.
Местную дозу во время операции можно наносить при значительно более низких концентрациях. На мышиной модели флуоресцентную визуализацию нервов можно эффективно осуществлять при столь низкой дозе, как 0,01 мг. В случае ФИГ. 5 0,01 или 0,02 миллиграмма соединения ФОРМУЛЫ I(f) в композиции 6 наносили местным путем в область хирургического вмешательства, инкубировали в течение 3 минут, а затем сразу проводили орошение физиологическим раствором.
При масштабировании до более крупного животного вводимое местным путем соединение ФОРМУЛЫ I(f) также тестировали на свиной хирургической модели. В случае ФИГ. 6А 4 миллиграмма соединения ФОРМУЛЫ I(f) в композиции 4 наносили в хирургическое поле, инкубировали в течение 5 минут, а затем проводили орошение теплым физиологическим раствором. При визуализации в белом свете нерв был совсем невидим, тогда как в случае флуоресцентного контроля он в высокой степени поддавался обнаружению (стрелка в двух областях). В случае ФИГ. 6В 0,3 миллиграмма соединения ФОРМУЛЫ I(f) в композиции 6 наносили в область хирургического вмешательства вокруг забрюшинного пространства, затем инкубировали в течение 3 минут, после чего проводили орошение физиологическим раствором. Даже при такой более низкой дозировке нерв (стрелка) был более выраженным при флуоресцентной визуализации по сравнению с визуализацией в белом свете. Эти местные дозировки во время операции на свиной модели были намного меньше, чем типичная дозировка для системной в/в инъекции (обычно от 30 до 50 миллиграммов агента для мечения нервов на свинью массой 35 килограмм).
Местное нанесение красителей во время операции для мечения нервов у живых животных было продемонстрировано для соединений ФОРМУЛЫ I(f) и ФОРМУЛЫ I(d). Для этого нового способа нанесения молекулы, имеющие отношение к данному классу соединений со структурой ядра типа "притяжение-отталкивание", также обладают преимуществом. Ниже приведен пример мечения ex vivo резецированной нервной ткани. В этом случае соединения использовали для окрашивания срезов из замороженной нервной ткани крыс. На ФИГ. 7 показаны примеры микроскопических изображений срезов нервной ткани крыс, меченных флуоресцентной меткой. В данном случае соединения структуры "притяжение-отталкивание" (ФОРМУЛЫ I(f), ФОРМУЛЫ I(d) и ФОРМУЛЫ I(e)) демонстрировали наиболее сильное флуоресцентное окрашивание срезов нервной ткани.
Несмотря на то, что в настоящем документе проиллюстрированы и описаны только лишь некоторые признаки воплощений изобретения, специалисты в области техники столкнутся с многочисленными модификациями и изменениями. Поэтому понятно, что прилагаемая формула изобретения подразумевает охватывание всех таких модификаций и изменений, соответствующих сущности этого изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПТИЧЕСКИЕ АГЕНТЫ ВИЗУАЛИЗАЦИИ | 2008 |
|
RU2475266C2 |
| МЕЧЕНЫЕ ПЕПТИДЫ, СВЯЗЫВАЮЩИЕ ФАКТОР РОСТА ГЕПАТОЦИТОВ (HGF), ДЛЯ ВИЗУАЛИЗАЦИИ | 2008 |
|
RU2473361C9 |
| ПОЛИПЕПТИДЫ АНТИТЕЛ И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2687163C1 |
| АГЕНТЫ ДЛЯ ОПТИЧЕСКОЙ ВИЗУАЛИЗАЦИИ | 2008 |
|
RU2484111C9 |
| ФЛУОРЕСЦЕНТНЫЕ КОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ДИАГНОСТИКИ ОПУХОЛИ | 2016 |
|
RU2720976C2 |
| ПЕПТИДНЫЕ СОЕДИНЕНИЯ | 2005 |
|
RU2393167C2 |
| Агенты, связывающие CD8, и их применение | 2020 |
|
RU2830301C1 |
| ПЕПТИДИЛ-ДИАЦИЛГЛИЦЕРИДЫ | 2009 |
|
RU2545347C2 |
| Аптамеры для интраоперационного окрашивания глиобластомы и способ их применения | 2023 |
|
RU2826956C1 |
| СОСТАВ ДЛЯ ОПТИЧЕСКОЙ ВИЗУАЛИЗАЦИИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2019 |
|
RU2802481C2 |

Группа изобретений к обнаружению основного белка миелина. Композиция для мечения нервов содержит агент формулы I или его соль:
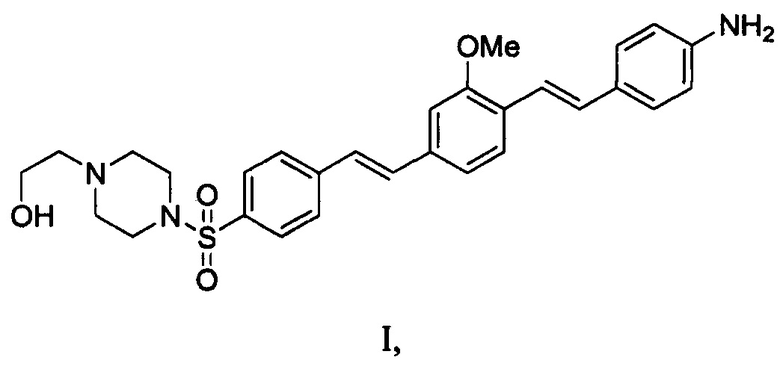
и водный фармацевтический носитель, содержащий PEG (полиэтиленгликоль)-300 в комбинации с поливинилпирролидоном или поливиниловым спиртом. Также раскрыты способ визуализации основного белка миелина в открытом или минимально инвазивном хирургическом поле посредством местного введения композиции для мечения нервов и набор для обеспечения композиции для мечения нервов. Группа изобретений обеспечивает наилучший контраст визуализации. 3 н. и 14 з.п. ф-лы, 11 ил., 1 табл., 1 пр.
1. Композиция для мечения нервов, содержащая агент формулы I или его соль, где формула I представляет собой
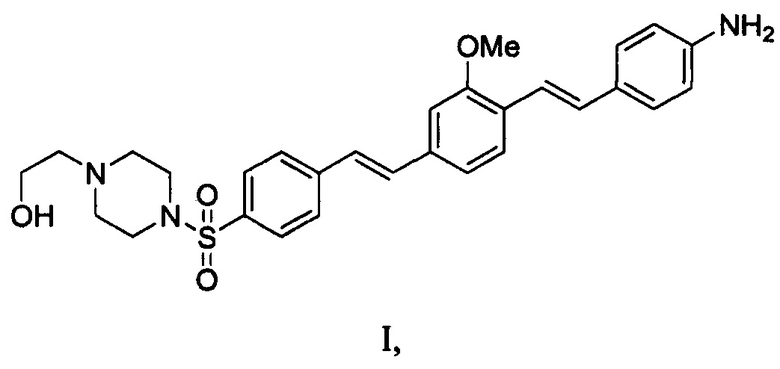
и
водный фармацевтический носитель, содержащий:
PEG (полиэтиленгликоль)-300 в комбинации с поливинилпирролидоном или поливиниловым спиртом.
2. Композиция по п. 1, в которой водный фармацевтический носитель содержит, исходя из объема:
1-30% PEG-300, 1-20% пропиленгликоля, 1-10% поливинилпирролидона и 0-10% лаурокапрама.
3. Композиция по п. 1, в которой водный фармацевтический носитель содержит, исходя из объема: 10-30% PEG-300 и 5-20% поливинилового спирта.
4. Композиция по п. 1, в которой указанная соль дополнительно содержит анион, причем указанный анион представляет собой галогенид, многоатомный анион или  активное соединение.
активное соединение.
5. Композиция по п. 4, в которой анион представляет собой хлорид.
6. Способ визуализации основного белка миелина в открытом или минимально инвазивном хирургическом поле посредством местного введения композиции для мечения нервов, включающий стадии:
приведения в контакт области хирургического вмешательства с композицией для мечения нервов, содержащей:
агент формулы I или его соль, где формула I представляет собой:
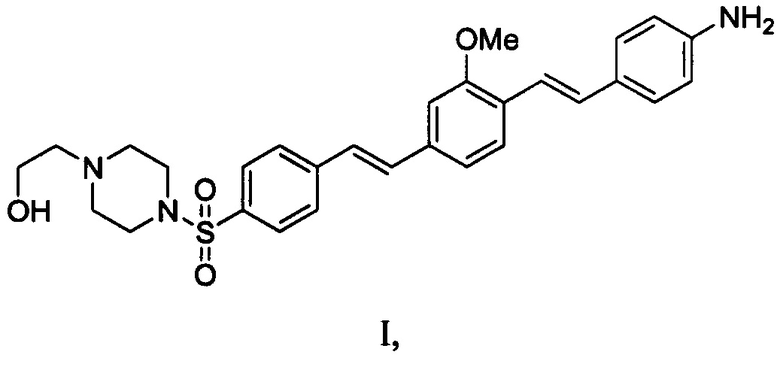
и
водный фармацевтический носитель, содержащий:
PEG-300 в комбинации с поливинилпирролидоном или поливиниловым спиртом; и
обнаружения агента путем приложения источника света, настроенного на спектральные характеристики возбуждения агента, и наблюдения субъекта через оптический фильтр, настроенный на спектральные характеристики излучения агента.
7. Способ по п. 6, который дополнительно включает определение присутствия миелина на основании спектрального возбуждения агента.
8. Способ по п. 6, где обнаружение осуществляют методом флуоресцентной микроскопии, лазерно-конфокальной микроскопии, кросс-поляризационной микроскопии, авторадиографии или их комбинации.
9. Способ по п. 6, в котором водный фармацевтический носитель содержит, исходя из объема:
1-30% PEG-300, 1-20% пропиленгликоля, 1-10% поливинилпирролидона и 0-10% лаурокапрама.
10. Способ по п. 6, в котором водный фармацевтический носитель содержит, исходя из объема: 10-30% PEG-300 и 5-20% поливинилового спирта.
11. Способ по п. 6, в котором указанная соль дополнительно содержит анион, причем указанный анион представляет собой галогенид, многоатомный анион, или основное активное соединение.
12. Способ по п. 11, в котором анион представляет собой хлорид.
13. Набор для обеспечения композиции для мечения нервов, содержащий:
агент формулы I или его соль, где формула I представляет собой
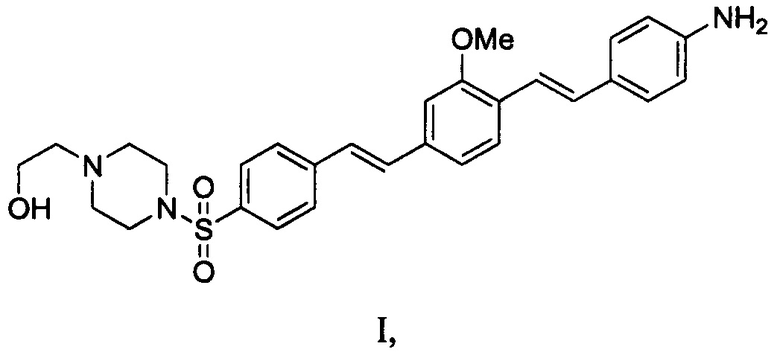
и
водный фармацевтический носитель, содержащий:
PEG-300 в комбинации с поливинилпирролидоном или поливиниловым спиртом.
14. Набор по п. 13, в котором водный фармацевтический носитель содержит, исходя из объема:
1-30% PEG-300, 1-20% пропиленгликоля, 1-10% поливинилпирролидона и 0-10% лаурокапрама.
15. Набор по п. 13, в котором водный фармацевтический носитель содержит, исходя из объема: 10-30% PEG-300 и 5-20% поливинилового спирта.
16. Набор по п. 13, в котором водный фармацевтический носитель дополнительно содержит сорастворитель, поверхностно-активное вещество, буферный раствор, стабилизатор, консервант или их комбинацию.
17. Набор по п. 13, дополнительно содержащий многокамерный сосуд, содержащий первую камеру и вторую камеру, в котором агент хранят в первой камере, а фармацевтический носитель - во второй камере.
| US 20110142759 A1, 16.06.2011 | |||
| US 20080317679 A1, 25.12.2008 | |||
| СПОСОБЫ ВИЗУАЛИЗАЦИИ И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ФЛЮОРЕСЦЕНТНЫЕ КРАСИТЕЛИ, СВЯЗАННЫЕ С ВИРУСНЫМИ КОМПОНЕНТАМИ ДЛЯ ВИЗУАЛИЗАЦИИ НЕРВОВ | 2009 |
|
RU2475537C2 |
Авторы
Даты
2019-09-06—Публикация
2017-03-13—Подача