Родственная заявка
В соответствии с § 119(e) 35 Свода Законов США, по данной заявке испрашивается приоритет в соответствии с предварительной заявкой на патент США № 61/127659, поданной 14 мая 2008 г, и предварительной заявкой на патент США № 61/082981, поданной 23 июля 2008 г, описания которых включены в данное описание путем ссылки.
Область, к которой относится изобретение
В настоящей заявке описаны композиции и способы, относящиеся к области медицинской визуализации.
Предпосылки изобретения
Ятрогенное повреждение нервов может привести к инвалидизирующей потере функции у людей. Обычные причины ятрогенного повреждения нервов включают повреждения, вызванные неудачными хирургическими вмешательствами, вытяжением или сдавливанием, гематомой или неадекватным положением пациента (Fercan Komurcu, MD et al., 2005, Annals of Plastic Surgery, 54(2):135-139).
Например, нервы часто визуализируются во время процедур простатэктомии. В качестве предпосылки, рак предстательной железы представляет собой наиболее распространенный тип рака у американских мужчин. Одним обычным вариантом лечения является удаление раковой ткани предстательной железы (т.е. простатэктомии) перед тем, как рак распространится местно, и перед метастазированием. Осложнения радикальной простатэктомии включают недержание мочи и импотенцию. У значительного процента мужчин, подвергающихся радикальной простатэктомии, возникает импотенция вследствие повреждения кавернозных нервов во время операции.
Риск ятрогенного повреждения нервов может быть снижен избеганием повреждения нервных пучков, которые проходят вдоль поверхности предстательной железы и необходимы для эрекции. Однако успешного сохраняющего нервы хирургического вмешательства часто трудно достичь ввиду трудности дифференцировки ткани предстательной железы и иннервирующей нервной ткани.
Существует потребность в усовершенствованных способах визуализации и композициях для визуализации нервов.
Краткое описание сущности изобретения
В настоящей заявке описаны композиции и способы для визуализации нервов. Нервы могут локализоваться в различных областях тела индивида.
В настоящей заявке также описано открытие того, что связывание флюоресцентного красителя с вирусным компонентом (например, вирусом, вирусными белками, капсидами), способным проникать в нервные аксоны, может образовывать комплекс красителя/вирусного компонента, который может проникать в аксоны нервов, таким образом, обеспечивая возможность улучшенной визуализации нервных клеток. Один вариант осуществления относится к композиции, содержащей:
флюоресцентный краситель; и
вирусный компонент, выбранный из нейротропного, репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса,
где флюоресцентный краситель связан с вирусным компонентом для образования комплекса красителя/вирусного компонента, который способен проникать в нервные клетки.
В этом и других вариантах осуществления, описанных в настоящей заявке, нейротропные репликационно-дефектные вирусы могут представлять собой, например, ослабленные или инактивированные вирусные компоненты, которые способны проникать в нервные клетки. В другом варианте осуществления композиция может представлять собой вакцину, содержащую флюоресцентный краситель и вирусный компонент, выбранный из нейротропного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса. Соответственно, другой вариант осуществления относится к вакцине, содержащей:
флюоресцентный краситель; и
вирусный компонент, выбранный из нейротропного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса,
где флюоресцентный краситель связан с вирусным компонентом для образования комплекса красителя/вирусного компонента, который способен проникать в нервные клетки.
Другой вариант осуществления относится к способу получения композиции, включающему:
комбинирование флюоресцентного красителя с вирусным компонентом, выбранным из нейротропного, репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса,
обеспечение возможности связывания флюоресцентного красителя с вирусным компонентом для образования комплекса красителя/вирусного компонента, который способен проникать в нервные клетки.
Другой вариант осуществления относится к способам визуализации нервов и/или диагностики аномалий и/или состояний нервов. Способы включают стадии (a) введения описанной в настоящей заявке композиции индивиду, (b) предоставления возможности комплексу красителя/вирусного комплекса проникнуть в нервные клетки, (c) подачи достаточного количества энергии излучения на индивида с тем, чтобы произошла флюоресценция красителя, (d) интраоперационного получения изображения флюоресценции индивида. Способ может включать стадию осмотра изображения флюоресценции для обозрения одного или нескольких нервов у индивида, или осмотра изображения флюоресценции для определения того, пересечен ли один или более нервов.
Соответственно, другой вариант осуществления относится к способу снижения ятрогенного повреждения у индивида во время хирургической процедуры, включающему:
(a) введение композиции индивиду, причем композиция содержит:
флюоресцентный краситель; и
вирусный компонент, выбранный из нейротропного, репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса,
где флюоресцентный краситель связан с вирусным компонентом для образования комплекса красителя/вирусного компонента;
(b) предоставление возможности комплексу красителя/вирусного комплекса проникнуть в нервные клетки;
(c) подачу достаточного количества энергии излучения на индивида с тем, чтобы произошла флюоресценция красителя;
(d) интраоперационное получение изображения флюоресценции индивида;
(e) осмотр изображения флюоресценции для обозрения одного или нескольких нервов у индивида.
Другой вариант осуществления относится к способу диагностики состояния нерва, включающему:
(a) введение композиции индивиду, причем композиция содержит:
флюоресцентный краситель; и
вирусный компонент, выбранный из нейротропного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса,
где флюоресцентный краситель связан с вирусным компонентом для образования комплекса красителя/вирусного компонента;
(b) предоставление возможности комплексу красителя/вирусного комплекса проникнуть в нервные клетки;
(c) подачу достаточного количества энергии излучения на индивида с тем, чтобы произошла флюоресценция красителя;
(d) интраоперационное получение изображения флюоресценции индивида; и
(e) осмотр изображения флюоресценции для определения того, пересечен ли нерв.
Один вариант осуществления относится к набору, содержащему композиции, описанные в настоящей заявке, наряду с инструкциями по применению композиции в соответствии с одним или более способов, описанных в настоящей заявке. В других вариантах осуществления набор включает один или более ингредиентов, красителей, вирусов, предшественников или других инструментов, которые могут использоваться для получения композиций, описанных в настоящей заявке, наряду с инструкциями по применению композиции в соответствии с одним или более способов, описанных в настоящей заявке.
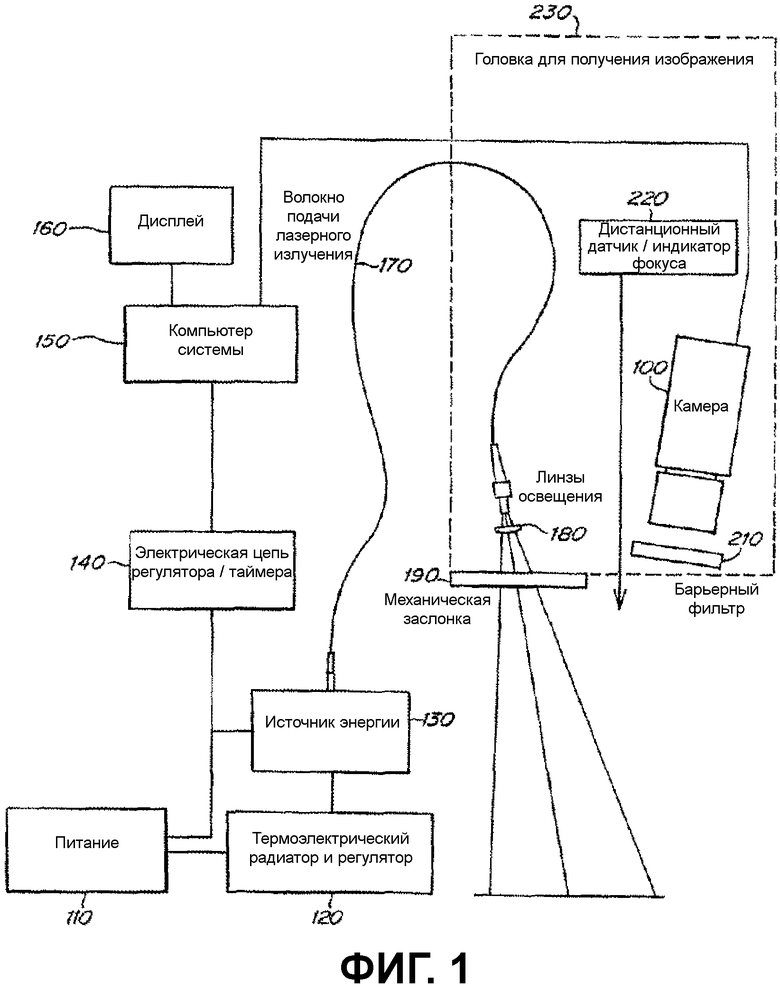
На фиг.1 схематически изображена система для медицинской визуализации;
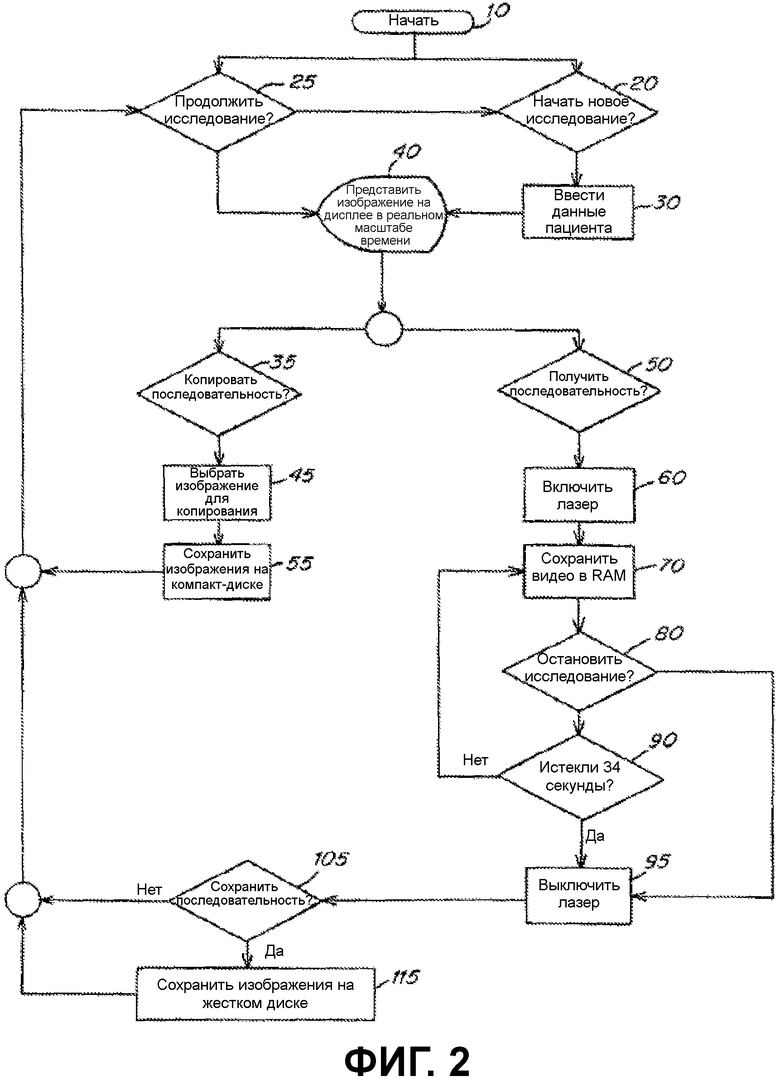
Фиг.2 представляет собой блок-схему, изображающую алгоритмы для медицинской визуализации, которая может выполняться программным обеспечением, установленным на процессор компьютера;
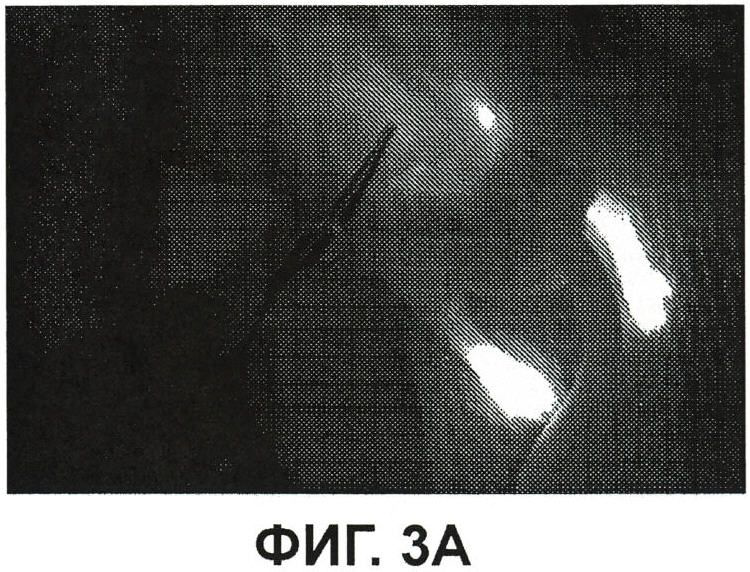
На фиг.3А показано изображение флюоресценции спины мыши из примера 3.
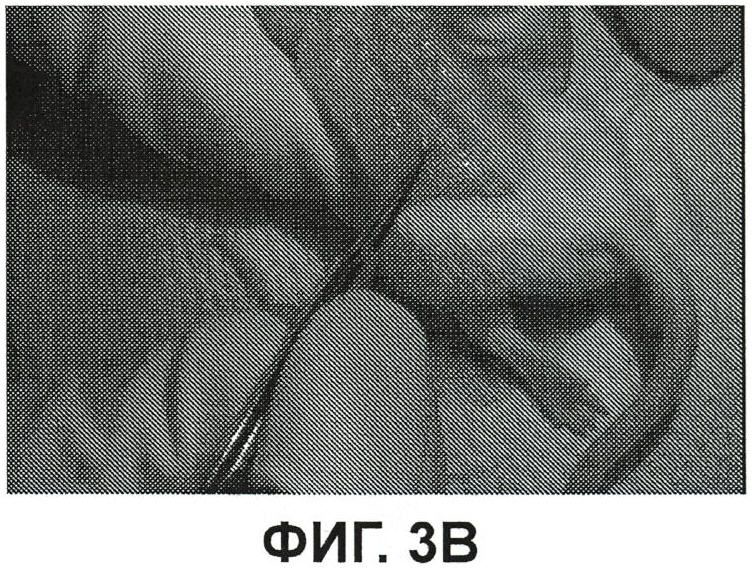
Фиг.3B представляет собой полученное видимым (белым) светом изображение той же спины мыши, показанной фиг.3A, но без флюоресцентной визуализации;
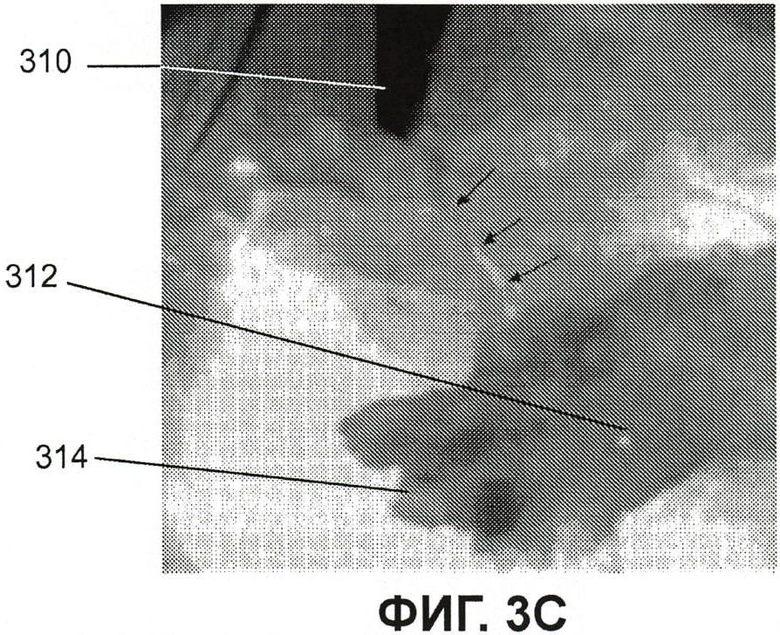
Фиг.3C представляет собой изображение флюоресценции с некоторым освещением видимым светом обнаженного спинного мозга мыши из примера 3;
Фиг.3D представляет собой изображение флюоресценции того же спинного мозга ближе к голове мыши с нервами, входящими в спинной мозг, не меченными ICG/PBS/HSV-2 ΔRR;
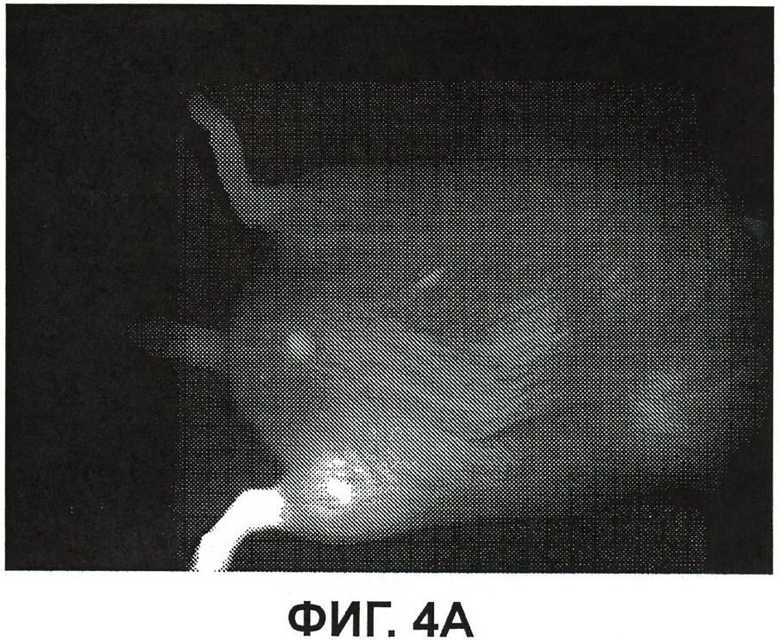
На фиг.4A показана флюоресценция ICG/PBS/HSV-2ΔRR (комплекса красителя/вирусного компонента) в виде с вентральной стороны тела мыши из примера 4;
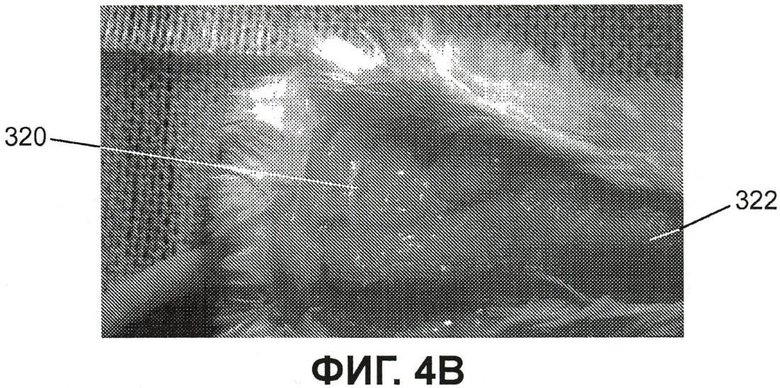
Фиг.4B представляет собой изображение, показывающее спину (вид со спины) мыши из примера 4, с рассечением тканей для показа позвоночника и флюоресцирующего нерва от левой стопы при использовании визуализации флюоресцентным и белым светом;
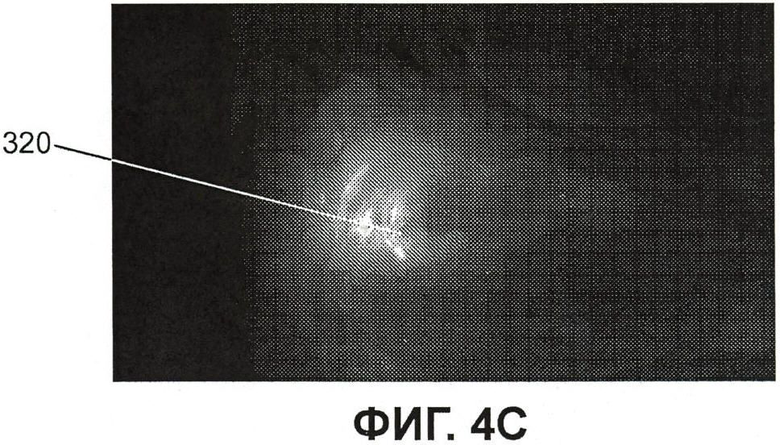
Фиг.4C представляет собой изображение флюоресценции той же мыши, что и на фиг.4B;
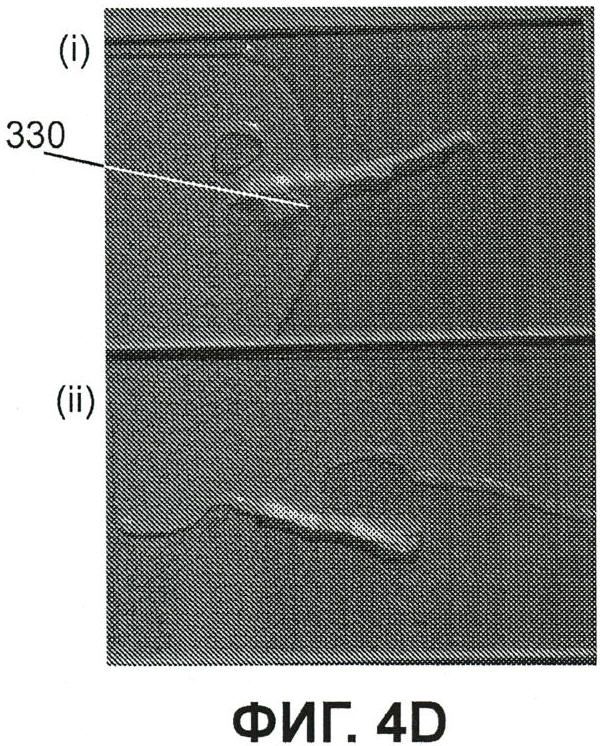
Фиг.4D представляет собой флюоресцентные изображения (i) отпрепарированного флюоресцирующего дорзального корневого ганглия с левой стороны позвоночника мыши из примера 4 только в белом свете с коротким сегментом его аксонов с правой стороны ганглия, и (ii) соответствующего ганглия с правой стороны позвоночника, где не производилась инъекция в аксоны правой подушечки лапы.
Фиг.4E представляет собой изображения (i) ганглия, показанного на фиг.4D(i), и (ii) ганглия, показанного на фиг.4D(ii);
Фиг.4F представляет собой увеличенное изображение ганглия, показанного на фиг.4E(i);
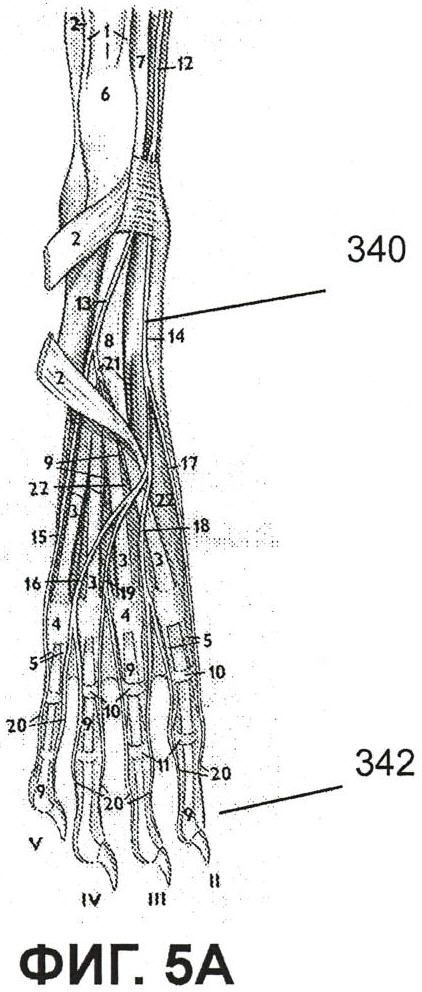
На фиг.5A показан рисунок, представляющий анатомическое строение левой конечности кролика, для сравнения с изображением флюоресценции;
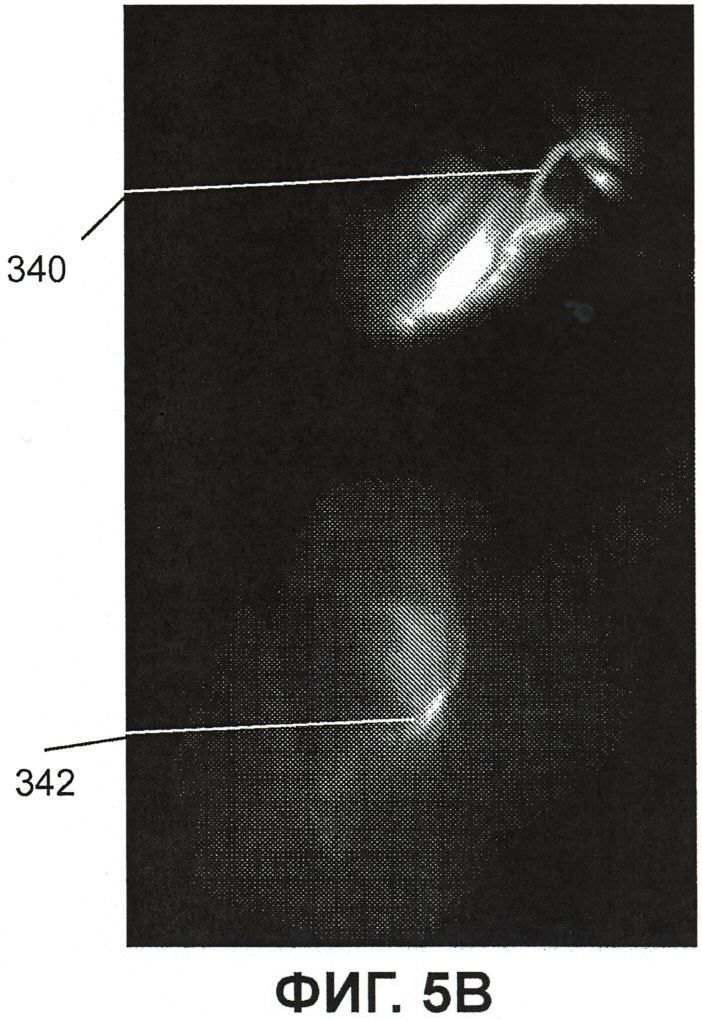
Фиг.5B представляет собой изображение флюоресценции, показывающее, что комплекс ICG/HSV-2ΔRR прошел из участка инъекции в пальцевую подушечку вверх в верхний подошвенный нерв;
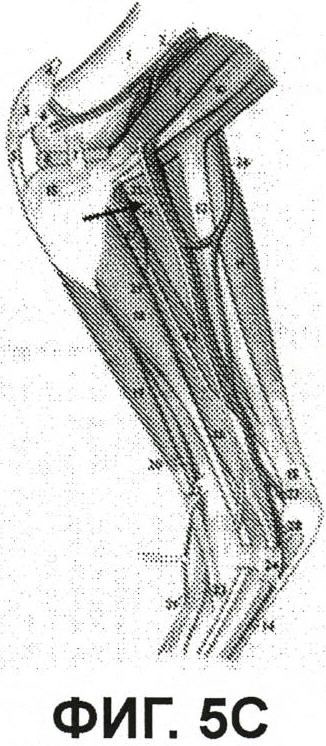
На фиг.5C показан рисунок, представляющий анатомическое строение правой конечности кролика, для сравнения с изображением флюоресценции;
Фиг.5D представляет собой изображение изолированного сегмента подкожной вены в видимом белом свете;
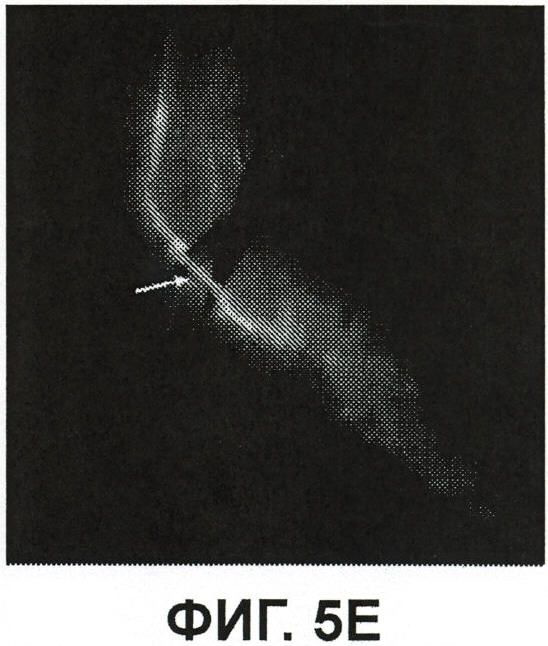
Фиг.5E представляет собой изображение флюоресценции, показывающее изолированный сегмент подкожной вены с помощью флюоресценции комплекса ICG/HSV-2ΔRR;
Фиг.5F и 5H представляют собой изображения флюоресценции, показывающие соответственно иссеченный сегмент подкожной вены предыдущих двух рамок (фиг.5F) и нерв in situ (фиг.5H);
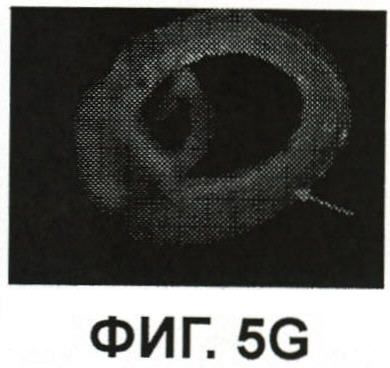
Фиг.5G и 5I представляют собой изображения флюоресценции, показывающие иссеченный сегмент подкожной вены, показанный на фиг.5F, но окрашенный на наличие гена LacZ инактивированного УФ вируса ICG/PBS/HSV-2ΔRR;
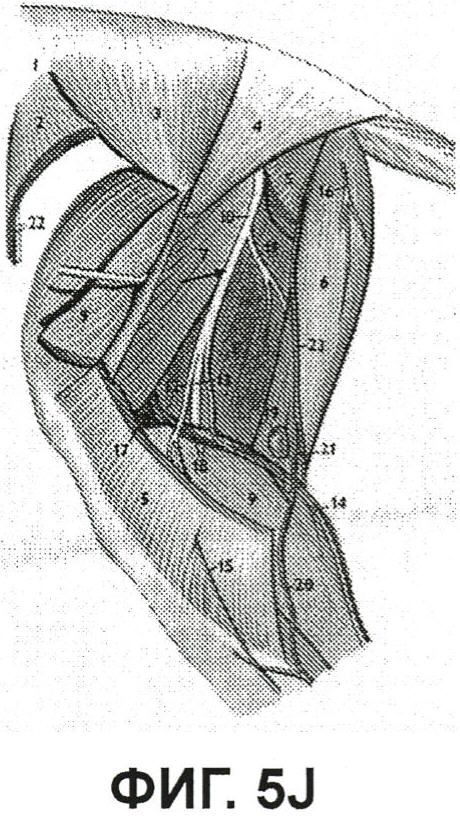
На фиг.5J показан рисунок, представляющий анатомическое строение левой конечности кролика, для сравнения с изображением флюоресценции; и
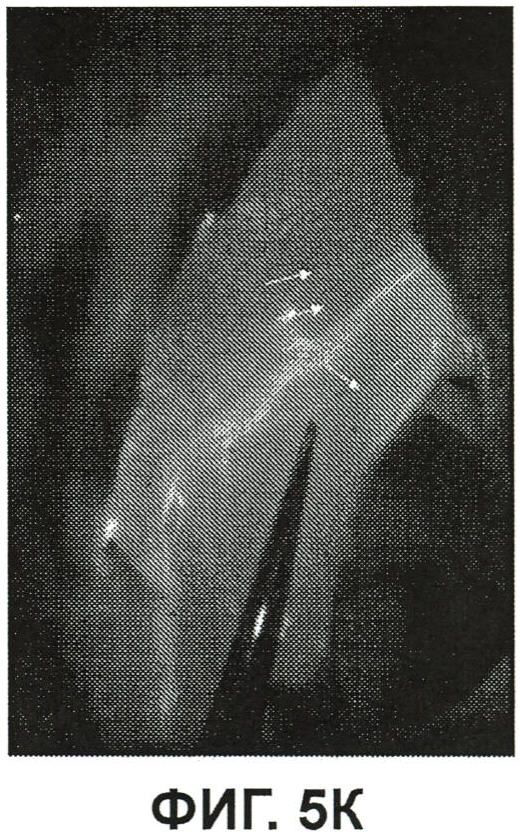
Фиг.5K представляет собой изображение флюоресценции дорзальной стороны левой задней конечности кролика из примера 5.
Детальное описание
Один вариант осуществления относится к композициям для визуализации нервов.
В одном варианте осуществления композиция включает краситель, такой как флюоресцентный краситель, используемый для медицинской визуализации. Однако многие красители не подходят для визуализации определенных частей тела, таких как нервы, поскольку красители обычно не способны проникать в нервные клетки. В настоящей заявке описано обнаруженное явление, состоящее в том, что нейротропный вирусный компонент, т.е. вирусный компонент, способный проникать в нервные клетки, может использоваться для аксонального переноса красителя через части или всю сеть нервов. Это может быть достигнуто образованием комплекса красителя, связанного с вирусным компонентом.
Красители
Используемый в настоящем описании термин «флюоресцентный краситель» или «краситель» означает маленькую молекулу или белок, или другой полимер, или макромолекулу, которая флюоресцирует испусканием света в видимом или близком к инфракрасному диапазоне длины волн после возбуждения энергией светового излучения соответствующей длины волн.
Подходящие флюоресцентные красители включают любой нетоксичный краситель, который флюоресцирует при воздействии на него энергии излучения, например света. В определенных вариантах осуществления краситель представляет собой флюоресцентный краситель, который испускает свет в спектре, близком к инфракрасному спектру. В некоторых вариантах осуществления краситель может не быть растворимым в липидах, тогда как в других вариантах осуществления он может быть растворимым в липидах. В определенных вариантах осуществления краситель представляет собой трикарбоцианиновый краситель, такой как индоцианин зеленый (ICG), выпускаемый компанией Akorn, Inc. (Buffalo Grove, IL). Краситель ICG утвержден FDA (Администрацией пищевых продуктов и лекарственных средств США) для использования у людей. В других вариантах осуществления краситель представляет собой инфрацианин зеленый. В других вариантах осуществления краситель выбран из флюоресцеина изотиоцианата, родамина, фикоэритрина, фикоцианина, аллофикоцианина, о-фтальдегида, флуоресцамина, розового бенгальского, трипана синего, флуорозолота, 3-индоцианина зеленого-ацил-1,3-тиазолидинтиона, зеленого флюоресцентного белка, красного флюоресцентного белка, желтого флюоресцентного белка, синего флюоресцентного белка и других флюоресцентных белков. Красители могут смешиваться или комбинироваться. В некоторых вариантах осуществления могут применяться аналоги красителей. «Аналог красителя» представляет собой краситель, который был химически модифицирован, но все же сохраняет свою способность флюоресцировать при воздействии на него энергии излучения соответствующей длины волн.
В одном варианте осуществления краситель представляет собой флюоресцентный белок, такой как зеленый флюоресцентный белок, ковалентно связанный с белком в вирусном капсиде, сконструированном замещением гена вирусного белка таким же геном вирусного белка, но слитым с геном зеленого флюоресцентного белка. В одном варианте осуществления зеленый флюоресцентный белок ковалентно связан с белком нейротропного вируса, который проникает в нервные клетки.
Вирусные компоненты
В одном варианте осуществления вирусный компонент выбран из вируса, вирусных белков и капсид. В одном варианте осуществления вирусный белок представляет собой капсид или капсидный белок. В одном варианте осуществления вирусный белок представляет собой аналог вирусного белка. В одном варианте осуществления вирусные белки и аналоги способны проникать в нервную клетку самостоятельно, не являясь частью вирусного капсида или цельного вируса. В другом варианте осуществления вирусные белки и аналоги могут быть частью вирусного капсида или цельного вируса, который сам проникает в нервную клетку. Аналоги имеют другую структуру нуклеиновой кислоты, что приводит к консервативным аминокислотным изменениям, которые хотя и изменяют первичную последовательность белка или пептида, обычно не изменяют его функцию. Консервативные аминокислотные замещения обычно включают замещения внутри следующих групп:
глицин, аланин;
валин, изолейцин, лейцин;
аспарагиновая кислота, глутаминовая кислота;
аспарагин, глутамин;
серин, треонин;
лизин, аргинин;
фенилаланин, тирозин.
В одном варианте осуществления вирусный белок и его аналоги могут быть выделены перед тем, как краситель связывается с ними.
Ввиду того, что он используется в медицинских заявках, данный компонент является невирулентным или «репликационно-дефектным». Используемый в настоящем описании термин «репликационно-дефектный» означает не образующий вирусных частиц (вирусного потомства) в клетке-мишени (нервной клетке). В одном варианте осуществления «репликационно-дефектный» относится к неспособности к репродукции. «Репликационно-дефектный» вирус может также относиться к ослабленному вирусу. В одном варианте осуществления ослабленные вирусы представляют собой живые вирусы, которые имеют низкую вирулентность. В одном варианте осуществления ослабленные вирусы не реплицируются. В другом варианте осуществления они могут экспрессировать вирусные антигены в инфицированных клетках без репликации. В другом варианте осуществления ослабленные вирусы медленно реплицируются и продуцируют потомство ослабленного вируса.
В одном варианте осуществления вирусный компонент не является нейровирулентным.
В одном варианте осуществления, вирусу придается свойство репликационной дефектности посредством мутации или инактивации нагреванием, светом (например, УФ светом) или химической обработкой. Дозировка и длины волн ультрафиолетового («УФ») света для уничтожения определенных вирусов хорошо известны. Например, на сайте http://www.americanairandwater.com/uv-faccts/uv-dosage.htm перечисляется дозировка УФ света, которая ингибирует образование колоний определенных вирусов, представлена ниже в таблице 1:
В одном варианте осуществления мутация может быть осуществлена удалением или инактивацией вирусного генетического материала (такого как РНК для РНК вирусов, или ДНК для ДНК вирусов) или белков, требуемых для вирусной репликации, цитопатическими воздействиями или лизисом клеток. В одном варианте осуществления вирус представляет бой мутант вируса бешенства, например Imovax (Sanofi Pasteur SA).
В другом варианте осуществления репликационно-дефектный вирус представляет собой вакцину. Используемый в настоящем описании термин «вакцина» относится к невирулентной композиции (содержащей один или более вирусных компонентов), которая улучшает иммунитет в отношении заболевания. В другом варианте осуществления вакцина может использоваться в качестве вирусного компонента, такая как вакцина Zostavax® (Merck & Co., Inc., Whitehouse Station, NJ). Соответственно, другой вариант осуществления относится к вакцине, содержащей:
флюоресцентный краситель; и
вирусный компонент, выбранный из нейропатического вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса,
где флюоресцентный краситель связан с вирусным компонентом для образования комплекса красителя/вирусного компонента, который способен проникать в нервные клетки.
Вирусный компонент является нейротропным в том, что он проникает в клетки нервной системы (например, двигательные нервы и/или сенсорные нервы). В некоторых вариантах осуществления вирус представляет собой тот, который переносится по аксонам нервной системы. Он должен быть безопасным для применения у людей. Таким образом, в определенных вариантах осуществления может использоваться любой вирусный компонент, который способен проникать в нервную клетку и связываться с красителем, пока он не является литическим, и предпочтительно пока он не вызывает цитопатический эффект.
Нейротропное свойство вирусного компонента используется для визуализации путем обеспечения возможности связывания флюоресцентного красителя с этим компонентом, посредством этого образуя комплекс красителя/вирусного компонента, который также является нейротропным, т.е. способным проникать в клетки нервной системы. Связывание между красителем и вирусными белками может происходить посредством взаимодействий ван-дер-Вальса, междипольных взаимодействий, катион-пи взаимодействий, водородного связывания, ионного связывания, ковалентного связывания или любого другого типа связывания, достаточного для того, чтобы краситель вошел в нервную клетку с вирусом или вирусной частицей. В некоторых вариантах осуществления краситель и вирус или вирусные белки могут связываться непосредственно, и это означает, что они не связываются или ассоциируются промежуточным, вставленным линкером между красителем и его ассоциированным вирусом или вирусными частицами.
В одном варианте осуществления может использоваться капсид нейтротропного вируса со связанным флюоресцентным красителем.
В некоторых вариантах осуществления вирус представляет собой герпесвирус и может представлять собой вирус простого герпеса 2 типа (HSV-2) или его мутант. HSV-2 инфицирует клетки нервной системы. Ген ICP10 HSV-2 кодирует фермент рибонуклеотид-редуктазу (RR), состоящий из двух субъединиц, именуемых большой и маленькой субъединицами, кодируемыми соответственно генами UL39 и UL40. Ген ICP10 HSV-2 (GeneBank No. M 12700) описан в патентах США №№ 6013265, 6054131 и 6207168.
В одном примере мутанта HSV-2 имеется делеция домена репликационно-дефектного (RR) из ICP10. Устранение этого домена может быть полезно в том, что полученный мутант становится репликационно-дефектным.
В одном варианте осуществления вирус представляет собой мутантную форму HSV-2, обозначенную ICP10ΔRR, в которой домен репликационно-дефектного ICP10 замещен геном, кодирующим LacZ. Вирус ICP10ΔRR известен в данной области (Peng et al., 1996, Virology, 216:184-196; LacZ-specific staining facilitates detection of cells that are infected with the mutant virus). ICP10ΔRR может также иметь делецию гена RR, без добавления гена LacZ. Ген LacZ может быть замещен любым геном, представляющим интерес. Может использоваться любой мутант HSV-2, в котором имеется делеция или инактивация домена RR. Мутант ICP10ΔRR HSV-2 в настоящем описании именуется HSV-2 ΔRR.
В другом варианте осуществления вирус может представлять собой вирус ветряной оспы (вирус опоясывающего герпеса).
Для получения подходящих вирусов могут использоваться стандартные процедуры молекулярной биологии, известные в данной области. Иллюстративные процедуры описаны в публикации Sambrook et al. (1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York), в публикации Ausubel et al. (1997, Current Protocols in Molecular Biology, John Wiley & Sons, New York) и в публикации Gerhardt et al. (eds., 1994, Methods for General and Molecular Bacteriology, American Society for Microbiology, Washington, D. C).
Композиции
Как описано выше, в некоторых вариантах осуществления композиция включает краситель, связанный с репликационно-дефектным вирусным компонентом. В определенных вариантах осуществления композиция включает краситель, связанный с вирусным белком или инактивированным вирусом, как далее описано в настоящей заявке. Композиции могут вводиться индивиду для визуализации нервов.
Соответственно, другой вариант осуществления относится к способу получения композиции, включающему:
комбинирование флюоресцентного красителя с вирусным компонентом, выбранным из нейротропного репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса,
предоставление возможности флюоресцентному красителю связаться с вирусным компонентом для образования комплекса красителя/вирусного компонента, который способен проникать в нервные клетки.
В некоторых вариантах осуществления композиция содержит небольшое количество или не содержит краситель, который не связан с вирусом или вирусным белком. Например, количество красителя, используемого для получения композиции, может титроваться до используемого количества вируса или вирусного белка. Аналогичным образом, посторонний (несвязанный) краситель может быть удален из композиции посредством диализа или использования градиента сахарозы.
В настоящей заявке также описывается получение и применение композиций, раскрытых в настоящей заявке. Такая композиция может состоять из одного активного ингредиента в форме, подходящей для введения индивиду, или композиция может содержать активный ингредиент и один или более фармацевтически приемлемых носителей, один или более дополнительных ингредиентов или некоторую их комбинацию. Активный ингредиент может присутствовать в композиции в форме физиологически приемлемого сложного эфира или соли, например, в комбинации с физиологически приемлемым катионом или анионом, как хорошо известно в данной области.
Используемый в настоящем описании термин «активный ингредиент» означает вирусный компонент, такой как нейротропный вирус, вирусный капсид или вирусный белок, с которым связан флюоресцентный краситель.
Используемый в настоящем описании термин «фармацевтически приемлемый носитель» означает химическую композицию, с которой активный ингредиент может комбинироваться и которая после объединения может использоваться для введения индивиду активного ингредиента.
Используемый в настоящем описании термин «физиологически приемлемый» означает сложный эфир или соль активного ингредиента, которые совместимы с любыми другими ингредиентами композиции и которые не оказывают вредного воздействия на индивида, которому вводится композиция.
Составы композиций, описанных в настоящей заявке, могут быть получены любым способом, известным или тем, который будет разработан в будущем в области фармакологии. В целом, такие способы получения включают стадию приведения активного ингредиента в ассоциацию с носителем или одним или более других вспомогательных ингредиентов, а затем, если необходимо или желательно, профилирование или упаковку продукта в желательную одно- или многодозовую стандартную лекарственную форму.
Хотя описания композиций, представленные в настоящей заявке, в основном, направлены на композиции, которые подходят для введения людям, специалистам в данной области будет понятно, что такие композиции, в целом, подходят для введения животным всех видов. Модификация композиций, подходящих для введения человеку, с целью придания композиции пригодности для введения различным животным, хорошо известны, и средний специалист в области ветеринарной фармакологии может сконструировать и выполнить такую модификацию, если потребуется, просто обычным экспериментированием. Индивиды, которым предусмотрено введение композиций, включают, без ограничения, людей, нечеловекообразных обезьян и других животных.
Композиции могут быть получены, упакованы или поставлены для продажи в препаративных формах, подходящих для парентерального, внутривенного, внутриглазного, подоболочечного или любого другого пути введения.
Композиции могут быть получены, упакованы или поставлены для продажи насыпью, в виде одной стандартной дозы или в виде множества стандартных доз. Используемый в настоящем описании термин «стандартная доза» представляет собой любое дискретное количество композиции, содержащее заданное количество активного ингредиента. Количество активного ингредиента, в целом, равно дозировке активного ингредиента, которое должно вводиться индивиду, или подходящей фракции такой дозировки, такой как, например, половина или одна треть такой дозировки.
Используемый в настоящем описании термин «парентеральное введение» композиции включает любой путь введения, характеризуемый физическим нарушением целостности ткани индивида и введением композиции через брешь в ткани. Таким образом, парентеральное введение включает без ограничения введение композиции инъекцией, путем применения композиции посредством проникновения в ткань нехирургической раны и тому подобным путем. В частности, предусматривается, что парентеральное введение включает без ограничения подкожную, внутрибрюшинную, внутримышечную, внутристернальную инъекцию и методики гемодиализных вливаний при почечной недостаточности.
Препаративные формы композиций, подходящих для парентерального введения, включают активный ингредиент в комбинации с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический солевой раствор. Такие препаративные формы могут быть получены, упакованы или поступать в продажу в форме, подходящей для болюсного введения или для непрерывного введения. Инъецируемые препаративные формы могут быть получены, упакованы или поступать в продажу в стандартной лекарственной форме, такой как ампулы или многодозовые контейнеры, содержащие консервант. Препаративные формы для парентерального введения включают без ограничения суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые препаративные формы длительного высвобождения или биологически разлагаемые препаративные формы. Такие препаративные формы могут, кроме того, содержать один или более дополнительных ингредиентов, включая без ограничения суспендирующие, стабилизирующие или диспергирующие агенты. В одном варианте осуществления препаративной формы для парентерального введения активный ингредиент представлен в сухой форме (т.е. порошкообразной, гранулярной или лиофилизированной) для восстановления влагосодержания подходящим носителем (например, стерильной апирогенной водой) перед парентеральным введением композиции с восстановленным влагосодержанием.
Дозы, которые могут вводиться животному, например, человеку, находятся в диапазоне от примерно 102 до примерно 108 или от примерно 102 до примерно 104, или от примерно 103 до примерно 108 бляшкообразующих единиц (pfu) вируса на грамм массы тела. В другом варианте осуществления доза находится в диапазоне, например, от примерно 104 мг до примерно 2×103 мг красителя/г массы тела. Например, эксперименты на животных, описанные ниже в экспериментальном разделе, выполнялись с красителем ICG и следующим количеством вируса: (a) 4,2×104 pfu вируса на грамм массы тела для мышей, и (b) 972,8 pfu на грамм массы тела для кроликов.
Способы визуализации
Один вариант осуществления относится к способу визуализации по меньшей мере одного нерва индивида. Изображение может быть получено интраоперационно. Таким образом, область, где предстоит проведение хирургического вмешательства, или соседние области, могут быть открыты для доступа. Способ включает: (a) введение композиции, описанной в настоящей заявке, для образования комплекса красителя/вирусного компонента, (b) обеспечения возможности проникновения комплекса красителя/вирусного компонента в нервные клетки; (c) подачи достаточного количества энергии излучения на область с тем, чтобы происходила флюоресценция красителя, (d) интраоперационного получения изображения флюоресценции и (e) осмотра изображения флюоресценции для определения присутствия или отсутствия по меньшей мере одного нерва на изображении флюоресценции.
В одном варианте осуществления «осмотр изображения флюоресценции» может относиться к осмотру фиксированного изображения (печатного или на экране) или в реальном масштабе времени на видеомониторе, в дополнение к другим способам осмотра изображений. В одном варианте осуществления отдельные изображения нервов (т.е. карты нервов), возможность получения которых была обеспечена связыванием флюоресцентного красителя с вирусным компонентом (например, вирусным вектором), могут использоваться для диагностических целей и для документации локализации нерва. В одном варианте осуществления одно применение картирования нервов не целесообразно. Предусматривается, что данная технология может использоваться для мечения нервов красителем для использования при флюороскопии, методике визуализации, обычно используемой врачами для получения в реальном масштабе времени подвижных изображений внутренних структур тела пациента. Например, интраоперационная визуализация хирургического поля обозрения любыми доступными обычными средствами может происходить так, что определение локализации и/или распознавания нервов - особенно их мелких ветвей - не адекватно для обеспечения хирургического вмешательства с сохранением нервов. В таких ситуациях интраоперационное флюороскопическое применение настоящей технологической инновации будет иметь решающее значение для успешных исходов.
На основании описанных ниже экспериментов, по оценке, флюоресценция красителя может перемещаться ретроградным образом через нервы со скоростью примерно 2 см/ч или быстрее. Эта высокая скорость потока красителя может обеспечить возможность введения композиций за несколько часов (или дольше) до выполнения визуализации. Композиция, включающая краситель, может вводиться за достаточное время до визуализации с тем, чтобы краситель поступил в область, подлежащую визуализации, и присутствовал в такой области во время визуализации. Требуемое количество времени может зависеть от применения визуализации нервов и участка введения. В качестве примера, композиция может вводиться за 1, 2, 3, 4, 5, 6, 7 или 8 часов или менее до визуализации в определенных процедурах, например, на основании расстояния, которое должен пройти краситель до участка визуализации. В одном варианте осуществления композиция вводится не более чем за 1, 2 или 3 часа до визуализации.
Путем осмотра изображения флюоресценции хирургическая бригада может определить отсутствие или присутствие нерва на изображении. Часто нервы могут быть идентифицированы по их размеру, форме и макроскопической локализации с использованием обычного освещения операционного поля видимым светом. Однако часто контраст между нервами - особенно их мелкими ветвями - и подлежащими тканями настолько слабый, что без значительного контраста, обеспечиваемого флюоресценцией нервов, их вообще невозможно визуально обнаружить. Хирургическая бригада может, кроме того, определить локализацию одного или более определенного нерва (нервов) путем осмотра изображения флюоресценции. Таким образом, хирургическая бригада может использовать информацию о присутствии/отсутствии или локализации одного или более нервов для определения того, как они выполнят хирургическую процедуру. Например, на основании информации, полученной посредством использования описанных способов, хирургическая бригада может принять решение произвести разрез в точке на теле индивида, где менее вероятно нечаянное пересечение или хирургический контакт с определенным нервом на основании установленного отсутствия нерва в данной области.
Другие варианты осуществления предусматривают получение множества изображений. Множество изображений может сравниваться друг с другом для определения того, что нерв не был поврежден, например, нечаянно рассечен.
Информация, полученная по полученным изображениям, может помочь при трансплантации концов нервов, если они пересечены. В случае пересечения трансплантаты нервов могут накладываться непосредственно на концы для содействия прорастанию регенеративных нервных волокон. В этом случае свет, видимый в результате флюоресценции концов пересеченных нервов, обеспечивает мишень для направления наложения анастомозов нервов нервным трансплантатом.
Способ диагностики
Другой вариант осуществления относится к способу диагностики состояния нерва, например, был ли нерв поврежден или пересечен, или успешно резецирован, например, во время хирургической процедуры. В одном варианте осуществления способ диагностики включает стадии (a) введения индивиду композиции, описанной в настоящей заявке; (b) предоставления возможности комплексу красителя/вирусного комплекса проникнуть в нервные клетки; (c) подачу достаточного количества энергии излучения на индивида с тем, чтобы произошла флюоресценция красителя; (d) интраоперационного получения изображения флюоресценции индивида; и (e) осмотра изображения флюоресценции или для осмотра одного или более нервов у индивида и/или определения того, пересечен ли один или более нервов.
Таким образом, путем осмотра изображения нерва пользователь может определить, был ли пересечен определенный нерв. В некоторых вариантах осуществления изображение используется для определения того, был ли корригирован (т.е. резецирован) пересеченный нерв.
Изображения, полученные указанными способами, могут использоваться для содействия направлению трансплантации нерва, когда происходят непреднамеренные пресечения нервов, или когда их невозможно избежать иным образом. В некоторых вариантах осуществления изображение осматривается после выполнения трансплантации нерва для подтверждения того, что нерв был успешно резецирован.
Опытный практикующий врач сможет путем осмотра изображения, полученного в соответствии с описанными способами, определить, пересечен ли нерв. Например, неровные зазубренные линии могут указывать на пересечение. Аналогичным образом, если нерв представляется более длинным или широким на первом изображении, чем на более позднем изображении, то это может также указывать на то, что нерв был пересечен. Напротив, если нерв представляется более длинным или широким на более позднем изображении, чем на более раннем изображении, то это может указывать на то, что он был резецирован. Таким образом, в некоторых вариантах осуществления способ предусматривает получение множества изображений.
Устройства для визуализации
После введения флюоресцентный краситель в композиции возбуждается для флюоресценции, и испускаемый им свет улавливается камерой. Подходящим устройством является система SPY (Novadaq Technologies Inc., Mississauga, Canada), или как описано в патенте США № 6915154.
В целом, подходящее устройство имеет источник света, способного возбуждать флюоресцентный краситель, и камеру, способную улавливать испускаемую красителем флюоресценцию.
На фиг.1 иллюстрируется пример системы, подходящей для возбуждения и получения изображения флюоресцентного красителя. В определенных вариантах осуществления источник питания 110 подает энергию на термоэлектрический радиатор и регулятор 120, источник световой энергии 130 и электрическую цепь регулятора/таймера 140. Регулятор 120 регулирует температуру источника световой энергии 130. Например, температура диодного лазера воздействует на его рабочую длину волн (например, сдвиг 0,3 нм на градус Цельсия). В некоторых вариантах осуществления, как описано в настоящей заявке, источник световой энергии 130 может не представлять собой диодный лазер и, следовательно, регулятор 120 может не требоваться. Электрическая цепь регулятора/таймера 140 определяет время воздействия источника световой энергии 130 на детектор/камеру 100 через компьютер 150. Он также включает программное обеспечение обработки изображения на считываемом компьютером 150 носителе. Компьютер 150 находится в электрическом сообщении с камерой 100 и дисплеем 160. Дисплей 160 принимает данные изображения из компьютера 150 и представляет его на дисплее. Как описано выше, в некоторых вариантах осуществления источник световой энергии 130 представляет собой лазер. Он имеет волокно 170, через которое передается световая энергия. Волокно 170 проводит свет к линзе освещения 180, через которую свет проходит по направлению к полю-мишени обозрения, когда открывается механическая заслонка 180. Барьерный фильтр 210 может использоваться для фильтрации света, исходящего из поля зрения, в диапазоне длины волн выше или ниже той, при которой возбуждается флюоресцентный краситель. В других вариантах осуществления источник световой энергии 130 может представлять собой LED (светоизлучающий диод). Он должен непосредственно освещать представляющую интерес ткань в поле зрения (т.е. может не потребоваться волокно 170). Камера 100 улавливает излучение, испускаемое красителем, после того как он возбуждается и передает выявленные данные изображения к компьютеру 150. Линза 180, волокно 170 и камера 100 представляют собой часть головки 230 для получения изображения. Головка 230 может представлять собой шарнирно соединенную головку. В некоторых вариантах осуществления головка 230, кроме того, включает дистанционный датчик/индикатор фокуса 220. Компоненты систем дополнительно описаны в настоящей заявке.
В определенных вариантах осуществления энергия излучения подается на представляющую интерес ткань в количестве, достаточном для вызова флюоресценции флюоресцентного красителя, посредством этого обеспечивая возможность визуализации представляющей интерес ткани. В некоторых вариантах осуществления источником световой энергии является лазер. Лазер может включать привод и диод. Предпочтительно, лазер представляет собой лазерный диод высокой мощности (HPLDs). Примеры HPLDs включают лазеры AIInGaAsP и лазеры GaAs, которые хорошо известны в данной области. Такие источники могут представлять собой одиночные диоды (одиночные излучатели), или диодно-лазерные стержни, которые изготовлены из полупроводниковых чипов с краевым излучением. Возможно включение в лазер фильтра, например, полосового фильтра, для обеспечения того, чтобы испускаемое излучение имело по существу однородную длину волн. Лазер может содержать оптику для отклонения пучка лазерных лучей. Регулируемая оптика может также использоваться для обеспечения равномерного освещения по данной площади (например, полю обозрения).
В некоторых вариантах осуществления излучение источника является непрерывным или квази-непрерывным. В других вариантах осуществления излучение лазера является импульсным. Импульсное излучение может быть синхронизировано с получением изображения путем использования импульсного генератора. В некоторых вариантах осуществления лазерный импульс может длиться по меньшей мере в течение 3 фемтосекунд. В некоторых вариантах осуществления лазерное излучение длится в течение примерно 30 с. В других вариантах осуществления лазерное излучение длится в течение от примерно 0,5 с до примерно 60 с. Подходящая частота повторений для импульсного лазера может находиться в диапазоне любых из следующих величин: от примерно 1 Гц до примерно 80 Гц, от примерно 10 Гц до примерно 100 Гц, от примерно 100 Гц до примерно 1 кГц, от примерно 1 кГц до примерно 100 кГц, от примерно 100 кГц до примерно 80 МГц. В некоторых вариантах осуществления лазер может работать при выходной мощности примерно 1,8, примерно 2,2, или примерно 2,5 ватт. В других вариантах осуществления лазер может работать при выходной мощности в диапазоне от примерно 1 до примерно 4 ватт. В еще одних вариантах осуществления средняя мощность составляет менее чем 5 ватт.
В некоторых вариантах осуществления источником энергии является свет ламп накаливания с соответствующим фильтром с тем, чтобы обеспечить подходящую длину волн света для вызова флюоресценции флюоресцентного красителя. В еще одних вариантах осуществления источником света является светоизлучающий диод (LED).
В некоторых вариантах осуществления энергия излучения может иметь длину волн в диапазоне от 150 нм до 1500 нм. Энергия может состоять из инфракрасного света. В некоторых вариантах осуществления свет возбуждения может иметь длину волн примерно 805 нм. В определенных вариантах осуществления свет возбуждения имеет длину волн в диапазоне примерно от 805 нм до 850 нм. В одном варианте осуществления возбуждающая световая энергия подается при длине волн, которая короче, чем испускаемая длина волн, т.е. длина волн выявления. Возбуждающая световая энергия может подаваться диффузно, с тем, чтобы не повредить облучаемую ткань. В некоторых вариантах осуществления свет возбуждения подается на область примерно 7,5 см x 7,5 см. В других вариантах осуществления свет подается на площадь в диапазоне от примерно 1 см x 1 см до примерно 20 см x 20 см. В одном варианте осуществления площадь составляет примерно от 25 до 100 см2. Как описано выше, множественные красители могут использоваться в некоторых вариантах осуществления. В этих вариантах осуществления могут использоваться множественные источники света, например, первый лазер для возбуждения первого красителя и второй лазер для возбуждения второго красителя. Специалисту в данной области будет понятно, что источник света должен выбираться или конфигурироваться для возбуждения определенного красителя. В других вариантах осуществления один источник света может быть сконфигурирован для возбуждения множественных красителей, например, чередованием длины волн, при которой излучается энергия.
Визуализирующая головка 230 может состоять из фотодетектора, например, камеры 100. Получение изображения может достигаться с использованием любого сенсора, способного выявить флюоресцентный сигнал. Примеры включают сенсоры на основе кремния, сенсоры из композитов оксидов-полуоксидов металлов (CMOS-сенсоры) и фотографическую пленку. В одном варианте осуществления сенсор включает камеру, например, устройство, соединенное с зарядкой (CCD). Примеры CCD включают Hitachi KP-M2; KP-M3 (Hitachi, Tokyo, Japan).
Камера может включать средство для фокусировки изображения. Определенные варианты осуществления охватывают ручное средство для фокусировки изображения. Другие варианты осуществления охватывают автоматизированное средство для фокусировки изображения. Камера может, кроме того, включать систему линз, которая обеспечивает возможность увеличения поля изображения.
В некоторых вариантах осуществления относительное расположение камеры и лазера фиксировано, с тем, чтобы усилить четкость и минимизировать фоновые помехи. В этих вариантах осуществления лазер расположен под углом менее чем примерно 85° относительно осей лазера и камеры. В других вариантах осуществления лазер расположен под углом от примерно 20° до примерно 70° относительно осей лазера и камеры. В некоторых вариантах осуществления лазер расположен под углом более чем примерно 85° относительно осей лазера и камеры. Такой угол может составлять, например, 90°.
В определенных вариантах осуществления камера передает уловленное изображение на аналогово-цифровой преобразователь и затем посредством захвата изображения и программного обеспечения его обработки, осуществляемой на компьютере, изображение может храниться на любом подходящем носителе, например, жестком диске, оптическом диске, магнитной ленте. Камера может также направлять изображения на телевизор/систему VCR (кодирования ТВ сигналов) с тем, чтобы изображения могли представляться на дисплее в реальном масштабе времени, записываться и вновь проигрываться в более позднее время. Таким образом, получение изображения может выполняться в реальном масштабе времени или с задержкой.
В определенных вариантах осуществления компьютер 150 представляет собой персональный компьютер, имеющий по меньшей мере 512 мегабайт памяти случайного доступа (RAM) и запоминающее устройство емкостью по меньшей мере 10 гигабайт. В некоторых вариантах осуществления компьютер 150 может содержать процессор Pentium IV (Intel, Santa Clara, CA). В некоторых вариантах осуществления компьютер 150 может также иметь привод для CD (компакт-дисков) и DVD (цифрового многоцелевого диска). Привод может иметь функциональность считывания и записи. Система также обеспечивает программное обеспечение обработки изображения.
В определенных вариантах осуществления эндоскоп может использоваться для возбуждения флюоресцентного красителя в композиции и для выявления его флюоресценции, например, для применений при вмешательствах. Он включает датчик и источник энергии излучения. Эндоскоп может состоять из оптических волокон. В определенных других вариантах осуществления может использоваться микроскоп, содержащий датчик и источник излучения, например, хирургический микроскоп. В некоторых вариантах осуществления датчик содержит видеокамеру. В определенных других вариантах осуществления датчик может улавливать изображения со скоростью по меньшей мере 10 в секунду, по меньшей мере 15 в секунду, по меньшей мере 20 в секунду, по меньшей мере 30 в секунду или по меньшей мере 50 в секунду. Таким образом, определенные варианты осуществления предусматривают множество изображений. В других вариантах осуществления изобретение предусматривает одно изображение.
Фиг.2 иллюстрирует один вариант осуществления способа визуализации. Этот способ может проводиться запрограммированными инструкциями, хранящимися на считываемом компьютером носителе, жестких носителях или плотных носителях. (Специалисту в данной области будет понятно, что такое программное обеспечение включает инструкции, хранящиеся на считываемом компьютером носителе). При исполнении программное обеспечение подает инструкции на процессор компьютера, как описано ниже. Специалисту в данной области, кроме того, будет понятно, что компьютер сообщается с лазером, датчиком и дисплеем, как описано в настоящей заявке.
В начале (стадия 10) пользователю может быть представлено множество диалоговых окон или других обычных парадигм интерфейса пользователя. Например, пользователь может быть опрошен, желает ли он начать новое исследование (стадия 20). Если пользователь отвечает утвердительно, то он может быть проинструктирован ввести или иным образом выбрать пациента для исследования. Например, пользователю может быть дано указание выбрать имя из списка, связанного с базой данных, которая доступна для компьютера. Альтернативно, ему может быть дано указание ввести идентификатор пациента. Компьютер может затем получить доступ к базе данных для определения существования дополнительной информации, связанной с пациентом, и, предпочтительно, получить такую информацию. В предпочтительном варианте осуществления программное обеспечение требует, чтобы пользователь ввел или другим образом выбрал величины для полей Имени Пациента, Фамилии Пациента и ID номера (идентификационного номера). Наиболее предпочтительно, достаточная информация вводится или иным образом загружается, с тем, чтобы изображения могли храниться в соответствии со стандартом передачи цифровых медицинских изображений (DICOM). Стандарт DICOM представляет собой продукт Комитета по Стандартам DICOM и его многих международных рабочих групп. Повседневные работы управляются Национальной Ассоциацией Производителей Электрического оборудования (Rosslyn, VA). Стандарт общедоступен на сайте интернета http://medical.nema.org/, и он полностью включен в настоящее описание путем ссылки.
После ввода данных о пациенте монитор или другой дисплей представляет изображения, уловленные камерой или другим сенсором, сообщающимся с компьютером (стадия 40). В этот момент пользователь может изменить положение, ориентацию, увеличение или другой параметр камеры для получения желательного вида участков тела пациента.
Альтернативно, пользователь может выбрать продолжение исследования (стадия 25) в начале 10. После такого указания процесс продолжается до стадии 40.
После представления изображения на дисплее пользователю предлагается указать, желает ли он копировать последовательности (стадия 35) или получить последовательность (стадия 50). Термин «последовательности» относится к данным, связанным с изображениями в реальном масштабе времени, уловленными камерой или другим сенсором, сообщающимся с компьютером. После того, как пользователь указывает, что он хочет получить изображения от сенсора на стадии 50, компьютер вызывает включение лазера, и он сохраняет последовательность, полученную от сенсора в RAM (стадия 70). Продолжается представление на дисплее изображений в реальном масштабе времени. Затем пользователь опрашивается о том, желает ли он выключить лазер (стадия 80). Если он отвечает утвердительно, то компьютер вызывает отключение лазера (стадия 100). Альтернативно, если пользователь не указывает, что он хочет отключить лазер, то компьютер определяет, прошло ли заданное количество времени (например, 34 секунды) от стадии 60. После того, как прошло заданное количество времени, компьютер вызывает отключение лазера. Продолжается хранение видеопоследовательностей в RAM до выключения лазера. После выключения лазера пользователь опрашивается, желает ли он сохранить последовательность (стадия 105). Если он отвечает утвердительно, то последовательности хранятся на жестком диске (стадия 115) или других носителях.
Теперь, возвращаясь к стадии 40 с целью описания программного обеспечения, после представления на дисплее изображения в реальном масштабе времени, пользователь опрашивается, желает ли он копировать последовательность (стадия 35), Если пользователь отвечает положительно, то изображения, связанные с исследованием, выбираются и сохраняются на компактном диске или другом выбранном носителе (стадия 55). Альтернативно, программное обеспечение может обеспечить пользователю возможность выбора определенных изображений для хранения на выбранном носителе. Предпочтительно, изображение (изображения) хранятся в формате, который совместим с получением картины и компьютерной системой, например, в формате DICOM.
В другом варианте осуществления камера может также направлять изображения в LCD монитор или другой дисплей (например, систему кодирования ТВ сигналов и т.д.), с тем, чтобы изображение (изображения) могло быть представлено на дисплее в реальном масштабе времени и/или записано и воспроизведено в более позднее время. Поскольку изображение (изображения) может использоваться для направления всей или части хирургической процедуры, изображение (изображения) может быть представлено на дисплее в течение всей хирургической процедуры. В других вариантах осуществления изображение (изображения) может быть представлено на дисплее в течение периода, меньшего, чем вся продолжительность хирургической процедуры. В другом варианте осуществления программное обеспечение позволяет манипулировать изображениями после их получения, например, наплыв, выбор интересующей области, изменение яркости и контраста и представление на дисплее множества изображений одновременно.
В некоторых вариантах осуществления система включает стерильную драпировку. Стерильная драпировка покрывает шарнирно соединенную ручку для предотвращения или минимизации риска заражения индивида. Стерильная драпировка может иметь в ней отверстие. Отверстие может быть покрыто материалом, который способен предавать энергию излучения, например, инфракрасный свет, генерируемый лазером.
Определения
Неопределенные артикли единственного числа используются в настоящем описании для обозначения одного или более чем одного (т.е. по меньшей мере одного) грамматического объекта артикля. В качестве примера, «элемент» означает один элемент или более чем один элемент. «Множество» означает по меньшей мере два.
Используемый в настоящем описании термин «индивид» относится к любому животному. Животное может представлять собой млекопитающее. Примеры подходящих млекопитающих включают без ограничения человекообразных и нечеловекообразных обезьян, собак, кошек, овец, коров, свиней, лошадей, мышей, крыс, кроликов и морских свинок.
«ICG» обозначает индоцианин зеленый, биологически совместимый, флюоресцирующий почти в инфракрасном спектре краситель, утвержденный для применения у людей.
«PBS» обозначает солевой раствор с фосфатным буфером.
«HSV-2» обозначает вирус простого герпеса 2-го типа.
«HSV-2 ICP10ΔRR»'обозначает мутантный вирус, в котором произведена делеция или инактивация домена RR в вирусе HSV-2 дикого типа.
Термин «pfu» обозначает бляшкообразующую единицу, минимальное число вирусов, требуемое для образования одной бляшки (одной инфицированной области) в системе клеточной или бактериальной культуры, подходящей для данного теста.
«S.C.» обозначает спинной мозг.
Следующие примеры приведены только в целях иллюстрации и, пока нет иных уточнений, не предназначены для ограничения. Таким образом, изобретение не следует никоим образом рассматривать как ограниченное следующими примерами, а, скорее, следует рассматривать как охватывающее любые и все варианты, которые становятся очевидными в результате представленных в настоящем описании положений.
Примеры
Пример 1: Получение мутантов вируса
Мутант HSV-2 ΔRR может быть получен, как описано в публикациях Laing, J. et al., Intranasal administration of the growth compromised HSV-2 vector ΔRR prevents kainate induced seizures and neuronal loss in rats and mice, MoI. Ther. 2006 May; 13(5): 870-881 и Peng et al., Virology 216:184 1996.
Пример 2: Получение композиций
Получали два основных раствора:
(1) основной раствор ICG: 25 мг ICG в 0,8 мл H2O
(2) основной раствор вируса HSV-2 ΔRR: 107 pfu в 20 мкл солевого раствора с фосфатным буфером (PBS).
20 мкл основного раствора вируса объединяли с 20 мкл основного раствора ICG и держали в течение 1 ч при 4°C (смесь ICG/PBS/HSV-2 ΔRR).
Пример 3: Исследование на животных
Пример 3 представляет собой сравнение изображения, полученного одним флюоресцентным красителем в сравнении с флюоресцентным красителем, связанным с вирусом. Пока нет других указаний, все изображения представляют собой цифровые изображения, полученные камерой CCD.
Мышь (60 г) кратковременно наркотизировали ингаляцией галотаном. В подушечку стопы правой лапы мыши инъецировали 10 мкл ICG, солевого раствора с фосфатным буфером (PBS) и мутантом вируса, HSV-2 ΔRR (смесь «ICG/PBS/HSV-2 ΔRR»). В подушечку стопы левой лапы мыши инъецировали 10 мкл смеси ICG/PBS в качестве контроля. Одинаковая концентрация ICG присутствовала в обеих смесях.
Через 2 часа после инъекций в подушечки лап мышь наркотизировали и затем проводили эвтаназию внутрибрюшинной инъекцией пентобарбитала натрия. Изображения, полученные флюоресценцией ICG, получали сначала у интактной мыши, а затем на различных стадиях рассечения.
Результаты
Фиг.3A представляет собой изображение флюоресценции спины мыши из примера 3 с обнаженным позвоночником и мышцами спины. Флюоресценция левой стопы при инъекции одного ICG ограничивается самой левой стопой. Имеется флюоресценция самой правой стопы, в которую инъецировали смесь ICG/PBS/HSV-2 ΔRR, но флюоресценция распространяется вверх на позвоночник, где расположены дорзальные корневые ганглии (т.е. тельца нейронных клеток) нервов стоп. Комплекс ICG-PBS- HSV-2 ΔRR прошел вверх по аксонам от стопы до клеточных телец аксонов у позвоночника. Инъекция ICG-PBS-HSV-2 ΔRR в подушечку стопы позволила проследить ход нервов подушечки стопы вплоть до позвоночника. На фиг.3B изображен такой же вид, как на фиг.3A, но в виде изображения в видимом (белом) свете без изображения флюоресценции.
Фиг.3C представляет собой изображение флюоресценции (наряду с некоторым освещением видимым белым светом) обнаженного позвоночника мыши из примера 3. Часть флюоресцирующего нерва (в результате инъекции в подушечку стопы) около участка, где он входит в спинной мозг, указана тремя стрелками. Фиг.3D представляет собой изображение флюоресценции того же спинного мозга ближе к голове мыши при нервах, входящих в спинной мозг, не меченных ICG/PBS/HSV-2 ΔRR. На фиг.3D показано, что мечены только нервы подушечек стоп, аксоны которых захватили и перенесли флюоресцирующий вирус, как показано стрелками, а не другие, не связанные нервы. На фиг.3C и 3D метка 310 указывает положение пинцета, оттягивающего нерв от спинного мозга, указанного цифрой 312. Спинной мозг рассечен в положении 314 (только фиг.3C). Голова мыши лежит в целом по направлению к правой стороне фиг.3C, тогда как хвост мыши обращен в целом по направлению к левой стороне чертежа.
Пример 4: Исследование на животных
Пример 4 представляет собой сравнение флюоресцентного красителя, связанного с вирусом, в сравнении с инъекцией для демонстрации того, что флюоресценция ограничивается нервами, отходящими от левой стопы, которые входят в позвоночник с левой стороны.
Мышь (50 г) кратковременно анестезировали ингаляцией галотана. Мыши производили инъекцию 10 мкл смеси ICG/PBS/HSV-2 ΔRR в подушечку стопы левой лапы и ничего не инъецировали в подушечку стопы правой лапы в качестве контроля.
Через 2 часа после инъекции в подушечку стопы лапы мышь наркотизировали внутрибрюшинной инъекцией пентобарбитала натрия. В последующем обнажали сердце, рассекали яремную вену и медленно инъецировали 10 мл изотонического солевого раствора в воздушную камеру сердца для обескровливания и умерщвления мыши. Целью кровопускания было снижение фоновой тканевой флюоресценции в результате попадания в болюс, инъецируемый в подушечку лапы, молекул ICG, которые не были связаны с вирусом, и которые попадали в лимфатическую систему. Как и с первой мышью, сначала получали изображения флюоресценции ICG интактной мыши, а затем - на различных стадиях рассечения.
Результаты
На фиг.4A показано изображение флюоресценции ICG/PBS/HSV-2 ΔRR в вентральной проекции всего тела мыши (мышь лежит на спине). Инъекция в подушечку стопы левой лапы приводит к флюоресценции всей левой стопы и распространяется вверх в левую лапу. Подушечка правой стопы, правая стопа и лапа, в которые не проводилась инъекция, не флюоресцируют.
На фиг.4B показана спина (дорзальная проекция) мыши, отпрепарированная для демонстрации позвоночника и флюоресцирующих нервов, отходящих от стопы, с использованием флюоресцентной визуализации и визуализации в белом свете. Метка 320 указывает положение нерва, отходящего от левой стопы. Положение спинного мозга указано цифрой 322. На фиг.4C отдельно показано изображение флюоресценции у той же мыши. Флюоресценция ограничена левой стороной позвоночника при отсутствии флюоресценции с правой стороны (где не производилась инъекция в подушечку стопы).
На фиг.4D показан (i) отпрепарированнный флюоресцирующий дорзальный корневой ганглий 330 с левой стороны позвоночника мыши только в белом свете с коротким сегментом его аксонов с правой стороны ганглия, и (ii) соответствующий ганглий 332 с правой стороны позвоночника; инъекция в подушечку стопы правой лапы не производилась. На фиг.4E показано (i) изображение флюоресценции ганглия, показанного на фиг.4D(i), и (ii) изображение флюоресценции ганглия, показанного на фиг.4D(ii). На фиг.4F показано увеличенное изображение более низкой облученности ганглия, показанного на фиг.4E(i). На фиг.4D-4F показано, что инъекция в подушечку стопы левой лапы обеспечивает мечение нерва левой стопы по всему его ходу до его дорзального корневого ганглия, и что отсутствует флюоресценция в соответствующем правом дорзальном корневом ганглии ввиду отсутствия инъекции в подушечку стопы правой лапы.
Пример 5: Вирус, инактивированный УФ
Данный пример демонстрирует применение визуализации вируса, инактивированного УФ облучением, что придает ему свойство репликационно-дефектного вируса.
Основной раствор ICG получали растворением 25 мг ICG в 0,8 мл H2O. Основной раствор вируса получали 107 pfu HSV-2 ΔRR в 20 мкл PBS.
50 мкл основного раствора вируса объединяли с 50 мкл основного раствора ICG в колбе и предоставляли возможность осаждения в течение 1 ч при 4°C («смесь мICG/PBS/HSV-2 ΔRR»). Указанную выше смесь ICG/PBS/HSV-2 ΔRR инактивировали УФ облучением примерно при 350 нм в течение примерно 15 минут.
Голландского опоясанного кролика (2,57 кг) кратковременно наркотизировали ингаляцией галотана. Кролику инъецировали 100 мкл смеси ICG/PBS/HSV-2 ΔRR в среднюю пальцевую подушечку правой стопы и инъецировали 100 мкл инактивированной УФ смеси ICG/PBS/HSV-2 ΔRR в среднюю пальцевую подушечку левой стопы. Через 4,5 часа после выполнения инъекций в подушечки стоп кролика наркотизировали и затем подвергали эвтаназии внутрибрюшинной инъекцией пентобарбитала натрия. Сначала выполняли препарирование правой конечности, начиная примерно на 5 см выше участка инъекции ICG/PBS/HSV-2 ΔRR в пальцевую подушечку.
Фиг.5A представляет собой рисунок, изображающий анатомическое строение конечности кролика с изображением флюоресценции (Фиг.5B), и он представлен для иллюстрации положения флюоресценции ICG в среднем подошвенном нерве правой лапы, поднятом препаровочными ножницами в положении 340. Видна также флюоресценция от расположенных поблизости кровеносных сосудов. Флюоресценция в участке инъекции в пальцевую подушечку 342 видна в нижней части фиг.5B.
Фиг.5C представляет собой рисунок, показывающий анатомическое строение правой конечности кролика. Стрелка указывает на большой нерв, прилегающий к кровеносным сосудам. Такую же процедуру препарирования проводили на левой конечности, в которую инъецировали инактивированный УФ вирус ICG/HSV-2ΔRR. Изображения изолированного сегмента подкожного нерва показаны в видимом свете (фиг.5D) и с флюоресценцией ICG (Фиг.5E) с белой стрелкой, указывающей на положение нерва.
Изолированный сегмент нерва иссекали и помещали на предметное стекло микроскопа. После смачивания изотоническим солевым раствором накладывали покровное стекло. Флюоресценция ICG сегмента видна на Фиг.5F, зарегистрированная системой SPY (выпускаемой Novadaq Technologies Inc., Mississauga, Canada). Флюоресценция ICG нерва была также зарегистрирована in situ при увеличении 10X (Фиг.5H). Затем сегмент нерва окрашивали ферментом (C12-FDG), который окрашивает LacZ (ген, который заместил сегмент гена, вырезанный из вируса HSV-2, для его ослабления). Микрофотографии окрашенного нерва показаны при двух увеличениях (фиг.5G - увеличение 4X и фиг.5I - увеличение 10X), указывая на присутствие вируса в нерве.
На фиг.5K показано изображение флюоресценции дорзальной стороны левой конечности кролика из примера 5, рисунок анатомического строения которой показан на фиг.5J. Стрелка на фиг.5J указывает на большой нерв в верхней конечности. Фиг.5K демонстрирует, что ICG/PBS/HSV-2 ΔRR прошел от участка инъекции в пальцевую подушечку вверх до верхнего подошвенного нерва. Инактивированный УФ вирус, меченный ICG, переместился в мелкие ветви, которые, как предполагается, представляют собой седалищный и большеберцовый нервы (стрелки), что обеспечило возможность визуализации даже этих маленьких нервов. Стрелки находятся примерно на 11 см выше участка инъекции в пальцевую подушечку, указывая на то, что флюоресцирующий инактивированный УФ вирус прошел на 11 см выше пальцевой подушечки, обеспечивая возможность визуализации даже отдаленных нервов. На фиг.5K справа также, вероятно, показана флюоресценция кровеносных сосудов.
Многие модификации и изменения могут быть внесены в варианты осуществления настоящего изобретения, что будет очевидно для специалистов в данной области. Определенные варианты осуществления, описанные в настоящей заявке, предложены только в качестве примера и ни в коей мере не предназначены для ограничения. Предполагается, что описание и примеры должны рассматриваться только как иллюстративные, причем действительный объем и сущность изобретения указаны следующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2720984C2 |
| ВАРИАНТ СРЕДСТВА ДЛЯ RNAi | 2018 |
|
RU2789647C2 |
| ВЕКТОРЫ, СОДЕРЖАЩИЕ СПЕЙСЕРНЫЕ/ФИЛЛЕР ПОЛИНУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2725813C2 |
| МОДИФИЦИРОВАННЫЕ КАПСИДНЫЕ БЕЛКИ ДЛЯ УЛУЧШЕНИЯ ДОСТАВКИ ПАРВОВИРУСНЫХ ВЕКТОРОВ | 2016 |
|
RU2751953C2 |
| РЕКОМБИНАНТНЫЙ АДЕНОАССОЦИИРОВАННЫЙ ВИРУС, ЯВЛЯЮЩИЙСЯ ГИБРИДОМ СЕРОТИПОВ AAV9 И AAVrh74, С ПОНИЖЕННЫМ ТРОПИЗМОМ К ПЕЧЕНОЧНОЙ ТКАНИ | 2019 |
|
RU2812279C2 |
| ВИРИОНЫ АДЕНОАССОЦИИРОВАННОГО ВИРУСА С ВАРИАНТНЫМ КАПСИДОМ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2017 |
|
RU2742724C1 |
| ГЕННОЕ РЕДАКТИРОВАНИЕ ГЛУБОКИХ ИНТРОННЫХ МУТАЦИЙ | 2016 |
|
RU2759335C2 |
| ГЕННАЯ ТЕРАПИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ НАРУШЕНИЙ | 2010 |
|
RU2603740C2 |
| ГЕННАЯ ТЕРАПИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ НАРУШЕНИЙ | 2010 |
|
RU2743398C2 |
| ГЕННАЯ ТЕРАПИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ НАРУШЕНИЙ | 2021 |
|
RU2836835C2 |







Изобретение относится к области молекулярной биологии и медицине. В настоящей заявке описаны композиции и способы визуализации нервных клеток. Композиция содержит вирусный компонент, связанный с флюоресцентным красителем для образования комплекса, который способен проникать в нервные клетки, где вирусный компонент выбран из нейротропного, репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса. Изобретение может быть использовано для снижения риска ятрогенного повреждения нервов в медицине. 5 н. и 14 з.п. ф-лы, 23 ил., 1 табл., 5 пр.
1. Композиция, для применения в визуализации нервов, содержащая: вирусный компонент, связанный с флюоресцентным красителем для образования комплекса, который способен проникать в нервные клетки; где вирусный компонент выбран из нейротропного, репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса.
2. Композиция по п.1, где краситель выбран из индоцианина зеленого, инфрацианина зеленого, зеленого флюоресцентного красителя, флюоресцеина изотиоцианата, родамина, фикоэритрина, фикоцианина, аллофикоцианина, о-фтальдегида, флуоресцамина, розового бенгальского, трипана синего, флуорозолота, 3-индоцианина-зеленого-ацил-1,3-тиазолидинтиона, зеленого флюоресцентного белка, красного флюоресцентного белка, желтого флюоресцентного белка, синего флюоресцентного белка и других флюоресцентных белков.
3. Композиция по п.2, где краситель представляет собой индоцианин зеленый.
4. Композиция по п.1, где вирус представляет собой герпесвирус, или его мутант, или вариант.
5. Композиция по п.4, где герпесвирус представляет собой HSV-2.
6. Композиция по п.1, где вирус представляет собой вирус ветряной оспы - опоясывающего герпеса.
7. Композиция по п.1, где вирус представляет собой HSV-2 ICP10ΔRR.
8. Композиция по п.1, где вирусу приданы свойства репликационно-дефектного вируса УФ инактивацией, мутацией, химической обработкой или тепловой обработкой.
9. Композиция по п.1, где репликационно-дефектный вирус выбран из ослабленного вируса, мутированного вируса и вакцины.
10. Вакцина, для применения в визуализации нервов, содержащая: вирусный компонент, связанный с флюоресцентным красителем для образования комплекса, который способен проникать в нервные клетки; где вирусный компонент выбран из нейротропного, репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса.
11. Способ получения композиции для применения в визуализации нервов, включающий:
обеспечение возможности связывания флюоресцентного красителя с вирусным компонентом для образования комплекса, который способен проникать в нервные клетки;
где вирусный компонент выбран из нейротропного, репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса.
12. Способ по п.11, где вирусу приданы свойства репликационно-дефектного вируса мутацией, УФ инактивацией, химической обработкой или тепловой обработкой.
13. Способ мониторинга риска ятрогенного повреждения у индивида во время хирургической процедуры, включающий:
(а) введение композиции индивиду, причем композиция содержит: вирусный компонент, связанный с флюоресцентным красителем для образования комплекса, который способен проникать в нервные клетки;
где вирусный компонент выбран из нейротропного, репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса.
(b) предоставление возможности комплексу красителя/вирусного комплекса проникнуть в нервные клетки;
(c) подачу энергии излучения на индивида с тем, чтобы произошла флюоресценция красителя;
(d) интраоперационное получение изображения флюоресценции у индивида;
(e) осмотр изображения флюоресценции для обозрения одного или нескольких нервов у индивида.
14. Способ по п.13, где краситель выбран из индоцианина зеленого, инфрацианина зеленого, зеленого флюоресцентного красителя, флюоресцеина изотиоцианата, родамина, фикоэритрина, фикоцианина, аллофикоцианина, о-фтальдегида, флуоресцамина, розового бенгальского, трипана синего, флуорозолота, 3-индоцианина-зеленого-ацил-1,3-тиазолидинтиона, зеленого флюоресцентного белка, красного флюоресцентного белка, желтого флюоресцентного белка, синего флюоресцентного белка и других флюоресцентных белков.
15. Способ по п.14, где краситель представляет собой индоцианин зеленый.
16. Способ по п.13, где композиция содержит репликационно-дефектный герпесвирус.
17. Способ по п.16, где герпесвирус представляет собой HSV-2.
18. Способ по п.16, где репликационно-дефектный вирус содержит HSV-2 ICP10ΔRR.
19. Способ диагностики состояния нерва, включающий:
(а) введение композиции индивиду, причем композиция содержит:
вирусный компонент, связанный с флюоресцентным красителем для образования комплекса, который способен проникать в нервные клетки;
где вирусный компонент выбран из нейротропного, репликационно-дефектного вируса, вирусного белка нейротропного вируса и капсида нейротропного вируса.
(b) предоставление возможности комплексу красителя/вирусного комплекса проникнуть в нервные клетки;
(c) подачи энергии излучения на индивида с тем, чтобы произошла флюоресценция красителя;
(d) интраоперационное получение изображения флюоресценции у индивида; и
(e) осмотр изображения флюоресценции для определения того, пересечен ли нерв.
| US 6399354 В1, 04.06.2002, формула | |||
| СПОСОБ ПРИГОТОВЛЕНИЯ КУЛИНАРНЫХ ИЗДЕЛИЙ ИЗ ЦЫПЛЯТ БРОЙЛЕРОВ | 1992 |
|
RU2061390C1 |
| Способ окрашивания перехватов Ранвье | 1989 |
|
SU1707499A1 |
Авторы
Даты
2013-02-20—Публикация
2009-05-14—Подача