ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к рекомбинантному микроорганизму, обладающему улучшенным уровнем внутриклеточной энергии, и к способу продуцирования L-аминокислот с помощью микроорганизма. уровень техники
УРОВЕНЬ ТЕХНИКИ
Для продуцирования желаемого вещества с помощью микроорганизма применяли главным образом специфичные для желаемого вещества подходы, такие как усиление экспрессии генов, кодирующих ферменты, участвующие в продуцировании желаемого вещества, или удаление ненужных генов. Например, посредством повышения активности пути биосинтеза L-аминокислоты был разработан ряд применимых штаммов, включающих Е. coli, способных к продуцированию желаемой L-аминокислоты с высоким выходом. Для продуцирования применимых желаемых веществ с высоким выходом с помощью микроорганизмов требуется образование и поддержание достаточного количества энергии.
Для биосинтеза веществ, таких как белки, нуклеиновые кислоты и т.п., in vivo используется энергия, запасаемая в форме NADH, NADPH и АТР (аденозин-5'-трифосфата). В частности, АТР представляет собой носитель энергии, который транспортирует химическую энергию, образующуюся в метаболических реакциях, для различных видов активности организмов.
АТР образуется главным образом в ходе метаболических процессов у микроорганизмов. Основными внутриклеточными путями образования АТР являются субстратное фосфорилирование, которое происходит путем гликолиза, или окислительное фосфорилирование, в ходе которого образуется АТР посредством электронтранспортной системы с использованием восстанавливающей способности, накапливаемой в NADH и т.п. путем гликолиза. Образованный АТР расходуется на такие виды активности in vivo, как биосинтез, движение, передача сигналов и деление клеток. Таким образом, промышленные микроорганизмы, применяемые для продуцирования применимых желаемых веществ, обычно характеризуются высоким потреблением АТР. Соответственно, проводили исследования для улучшения производительности путем повышения уровней внутриклеточной энергии при массовом продуцировании применимых желаемых веществ (Biotechnol Adv (2009) 27: 94-101).
Железо является одним из элементов, существенных для поддержания гомеостаза микроорганизмов, и Е. coli использует различные пути поглощения железа (Mol Microbiol (2006) 62: 120-131). Одним из путей поглощения железа является поглощение железа посредством каналов комплекса FhuCDB, образованного белками FhuC, FhuD и FhuB. Недавно было выявлено, что в присутствии избытка L-триптофана в клетках белок TrpR, регулирующий экспрессию генов, участвующих в биосинтезе L-триптофана, образует комплекс с L-триптофаном, и этот комплекс, в свою очередь, связывается с регуляторной областью оперона fhuCDB, что позволяет предположить возможность существования корреляции между поглощением железа посредством белкового комплекса FhuCDB и биосинтезом L-триптофана. Однако, функция белкового комплекса FhuCDB в биосинтезе L-триптофана, а также его влияние на поглощение железа еще не были выяснены (Nat Chem Biol (2012) 8: 65-71).
Авторы настоящего изобретения исследовали способы улучшения уровней АТР и повышения производительности в отношении применимых желаемых веществ, таких как L-аминокислоты, и они обнаружили, что уровни внутриклеточного АТР можно улучшить путем инактивации функции белкового комплекса FhuCDB посредством делеции гена fhuCDB, и в результате этого производительность в отношении желаемых веществ можно повысить, что тем самым довершает настоящую заявку.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Целью настоящей заявки является обеспечение микроорганизма, обладающего улучшенным уровнем внутриклеточного АТР.
Другой целью настоящей заявки является обеспечение способа продуцирования желаемого вещества с помощью микроорганизма, обладающего улучшенным уровнем внутриклеточного АТР.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
В одном аспекте в настоящей заявке представлен микроорганизм, обладающий улучшенным уровнем внутриклеточного АТР.
В конкретном варианте осуществления настоящей заявки микроорганизм может представлять собой микроорганизм, в котором виды активности одного или нескольких из белка FhuC, белка FhuD и белка FhuB, образующих систему поглощения железа, были инактивированы, и, следовательно, который обладает повышенным уровнем внутриклеточного АТР по сравнению с немодифицированным штаммом.
Термин "FhuCDB", используемый в данном документе, означает компонент системы поглощения железа (системы fhu), включающий в себя продукты экспрессии fhuA, fhuC, fhuD и fhuB, организованных в один оперон. fhu А кодирует многофункциональный ОМР FhuA (79 кДа), действующий в качестве рецептора для комплекса феррихром-железо, фагов, бактериальных токсинов и антибиотиков. FhuA специфичен для комплекса Fe3+-феррихром и действует в качестве лиганд-специфичного управляемого канала (Protein Sci 7, 1636-1638). Другие белки системы fhu, а именно FhuD, FhuC и FhuB, также существенны для функций системы поглощения железа. Периплазматический белок FhuD и ассоциированные с цитоплазматической мембраной белки FhuC и FhuB образуют комплекс FhuCDB, функцией которого является транспорт феррихрома и других гидроксаматных соединений Fe3+ (комплексов Fe3+-аэробактин, Fe3+-копроген) через цитоплазматическую мембрану из периплазматического пространства в цитоплазму (J Bacteriol 169, 3844-3849). При поглощении железа посредством комплекса FhuCDB расходуется одна молекула АТР, и для этого процесса поглощения железа энергию предоставляет белковый комплекс TonB-ExbB-ExbD (FEBS Lett 274, 85-88).
FhuC кодирует ассоциированный с цитоплазматической мембраной белок размером 29 кДа и вместе с FhuD и FhuB образует канал для поглощения железа. FhuC может иметь аминокислотную последовательность SEQ ID NO: 5, и, в частности, FhuC может кодироваться нуклеотидной последовательностью SEQ ID NO: 1.
FhuD кодирует ассоциированный с цитоплазматической мембраной белок размером 31 кДа и вместе с FhuC и FhuB образует канал для поглощения железа. FhuD может иметь аминокислотную последовательность SEQ ID NO: 6, и, в частности, FhuD может кодироваться нуклеотидной последовательностью SEQ ID NO: 2.
FhuB кодирует ассоциированный с цитоплазматической мембраной белок размером 41 кДа и вместе с FhuC и FhuB образует канал для поглощения железа. FhuB может иметь аминокислотную последовательность SEQ ID NO: 7, и, в частности, FhuB может кодироваться нуклеотидной последовательностью SEQ ID NO: 3.
Более конкретно, хотя белки обладают идентичными видами активности, между объектами существуют небольшие различия в аминокислотных последовательностях. Таким образом, FhuC, FhuD и FhuB могут соответственно иметь SEQ ID NO: 5, 6 и 7, но не ограничиваться ими. Иными словами, FhuC, FhuD и FhuB в настоящей заявке могут представлять собой варианты, имеющие аминокислотные последовательности с заменой, делецией, вставкой, добавлением или инверсией одной или более аминокислот в одном или более положениях аминокислотных последовательностей, и они могут иметь последовательности, обладающие 70% или более высокой, 80% или более высокой, 90% или более высокой или 95% или более высокой гомологией с аминокислотными последовательностями SEQ ID NO: 5, 6 и 7 соответственно. Кроме того, в нуклеотидных последовательностях могут быть произведены различные модификации в кодирующей области при условии, что они не изменяют аминокислотные последовательности белков, экспрессируемых с кодирующей области, по причине вырожденности кодонов или с учетом предпочтительности кодонов для организма, в котором они подлежат экспрессии. Вышеописанная нуклеотидная последовательность приведена только в качестве примера различных нуклеотидных последовательностей, получаемых с помощью способа, хорошо известного специалистам в данной области, но не ограниченных ей.
Термин "гомология", используемый в данном документе, относится к степени идентичности оснований или аминокислотных остатков после выравнивания обеих последовательностей для наилучшего совпадения определенных сравнимых областей в аминокислотной или нуклеотидной последовательности гена, кодирующего белок. Если гомология является достаточно высокой, то продукты экспрессии соответствующих генов могут обладать идентичной или сходной активностью. Процентное значение идентичности последовательностей можно определить с помощью известной программы для сравнения последовательностей, например, BLASTN (NCBI), CLC Main Workbench (CLC bio), MegAlign™ (DNASTAR Inc) и т.п.
Термин "микроорганизм", используемый в данном документе, относится к прокариотическому микроорганизму или эукариотическому микроорганизму, обладающему способностью к продуцированию применимого желаемого вещества, такого как L-аминокислоты. Например, микроорганизм, обладающий улучшенным уровнем внутриклеточного АТР, может принадлежать к роду Escherichia, роду Erwinia, роду Serratia, роду Providencia, роду Corynebacteria, роду Pseudomonas, роду Leptospira, роду Salmonellar, роду Brevibacteria, роду Hypomononas, роду Chromobacterium или роду Norcardia микроорганизмов, или грибов, или дрожжей. В частности, микроорганизм может принадлежать к роду микроорганизмов Escherichia, и более конкретно, микроорганизм может представлять собой Е. coli.
"Немодифицированный штамм", как используется в данном документе, относится к микроорганизму, который не является модифицированным с помощью методики молекулярной биологии, такой как мутация или рекомбинация. В частности, немодифицированный штамм относится к микроорганизму до повышения уровня внутриклеточного АТР, в котором уровень внутриклеточного АТР повышают путем инактивации одного или нескольких из FhuC, FhuD и FhuB, образующих систему поглощения железа, комплекс FhuCDB, тем самым снижая расход внутриклеточного АТР. Иными словами, немодифицированный штамм относится к исходному микроорганизму, от которого происходит рекомбинантный микроорганизм.
В конкретном варианте осуществления настоящей заявки микроорганизм может содержать один или несколько из FhuC, FhuD и FhuB в инактивированном состоянии, и комбинацию FhuC, FhuD и FhuB в инактивированном состоянии, и, в частности, все из FhuC, FhuD и FhuB в инактивированном состоянии.
Термин "инактивация", используемый в данном документе, означает, что активность соответствующего белка устранена или ослаблена посредством мутации в результате делеции, замены или вставки части или всего гена, кодирующего соответствующий белок, посредством модификации последовательности, регулирующей экспрессию, для снижения экспрессии гена, посредством модификации последовательности хромосомного гена для ослабления или устранения активности белка или посредством их комбинаций.
В частности, делецию части или всего гена, кодирующего белок, можно осуществлять путем замены полинуклеотида, который кодирует эндогенный целевой белок, в хромосоме полинуклеотидом, в котором имеет место делеция частичной последовательности, либо маркерным геном посредством инсерционного вектора на основе бактериальной хромосомы. Кроме того, можно индуцировать мутацию с помощью мутагена, такого как химические вещества или UV-свет, получая таким образом мутанта, имеющего делецию соответствующего гена, но не ограничиваясь этим.
Термин "последовательность, регулирующая экспрессию", используемый в данном документе, т.е. нуклеотидная последовательность, регулирующая экспрессию гена, относится к сегменту, способному к повышению или снижению экспрессии конкретного гена у субъекта, и может включать в себя промотор, сайт связывания фактора транскрипции, сайт связывания рибосом, последовательность, регулирующую терминацию транскрипции и трансляции, но не ограничивается этим.
В частности, модификацию последовательности, регулирующей экспрессию, для того, чтобы вызвать снижение экспрессии гена, можно осуществлять путем индуцирования мутаций в последовательности, регулирующей экспрессию, посредством делеции, вставки, консервативной или неконсервативной замены в нуклеотидной последовательности или их комбинации для дополнительного ослабления активности последовательности, регулирующей экспрессию, или путем замены последовательности, регулирующей экспрессию, последовательностью, обладающей более слабой активностью, но не ограничиваясь этим.
В конкретном варианте осуществления настоящей заявки микроорганизм может представлять собой микроорганизм из рода Escherichia, обладающий улучшенной производительностью в отношении желаемого вещества по сравнению с немодифицированным штаммом. У микроорганизма из рода Escherichia согласно настоящей заявке один или несколько белков, образующих комплекс FhuCDB, инактивированы для инактивации пути поглощения железа, и, таким образом, при поглощении железа посредством данного пути снижается расход АТР. В результате этого микроорганизм из рода Escherichia имеет улучшенный уровень внутриклеточного АТР по сравнению с немодифицированным штаммом, и, следовательно, микроорганизм обладает улучшенной производительностью в отношении желаемого вещества.
Термин "микроорганизм, обладающий улучшенной производительностью" относится к микроорганизму, обладающему улучшенной производительностью в отношении желаемого вещества по сравнению с немодифицированным штаммом или исходной клеткой до модификации.
Термин "желаемое вещество", используемый в данном документе, включает вещество, продуцируемое количество которого повышают путем повышения уровня внутриклеточного АТР у микроорганизма, без ограничения. Желаемое вещество может, в частности, представлять собой L-аминокислоту и, более конкретно, L-треонин или L-триптофан.
В конкретном варианте осуществления микроорганизм может представлять собой Е. coli, обладающую улучшенной производительностью в отношении L-триптофана, где один или несколько из FhuC, FhuD и FhuB Е. coli, обладающей производительностью в отношении L-триптофана, были инактивированы, и обладающую улучшенным уровнем внутриклеточного АТР по сравнению с немодифицированным штаммом. Е. coli, обладающую производительностью в отношении L-триптофана, можно получить путем повышения экспрессии гена L-триптофанового оперона, устранения ингибирования по принципу обратной связи конечным продуктом L-триптофаном или устранения ингибирования и аттенюации гена L-триптофанового оперона на уровне транскрипции, но не ограничиваясь этим.
В конкретном варианте осуществления настоящей заявки микроорганизм может представлять собой Е. coli, обладающую улучшенной производительностью в отношении L-треонина, где один или несколько из FhuC, FhuD и FhuB Е. coli, обладающей производительностью в отношении L-треонина, были инактивированы, и обладающую улучшенным уровнем внутриклеточного АТР по сравнению с немодифицированным штаммом. Е. coli, обладающую производительностью в отношении L-треонина, можно получить путем повышения экспрессии гена L-треонинового оперона, устранения ингибирования по принципу обратной связи конечным продуктом L-треонином или устранения ингибирования и аттенюации гена L-треонинового оперона на уровне транскрипции, но не ограничиваясь этим.
В другом аспекте в настоящей заявке обеспечивается способ продуцирования L-аминокислот, при этом способ включает культивирование микроорганизма из рода Escherichia, обладающего улучшенным уровнем внутриклеточного АТР, в среде и извлечение L-аминокислот из культуральной среды или микроорганизма.
Термин "микроорганизм из рода Escherichia, обладающий улучшенным уровнем внутриклеточного АТР", используемый в данном документе, является таким же, как описанный выше.
В способе продуцирования L-аминокислот в соответствии с конкретным вариантом осуществления настоящей заявки культивирование микроорганизма, обладающего производительностью в отношении L-аминокислот, можно осуществлять в соответствии с надлежащими условиями среды и культивирования, известными из уровня техники. Процедуры культивирования могут без труда корректироваться специалистами в данной области в соответствии с выбранным микроорганизмом. Примеры процедур культивирования включают периодический тип, непрерывный тип и тип культивирования с подпиткой, но не ограничиваются этим.
Среда, применяемая для культивирования, должна соответствовать требованиям для культивирования конкретного микроорганизма. Культуральные среды для различных микроорганизмов описаны в литературе ("Manual of Methods for General Bacteriology", American Society for Bacteriology, Washington D.C., USA, 1981). Эти среды содержат ряд источников углерода, источников азота и следовых элементов. Источники углерода включают углеводы, такие как глюкоза, лактоза, сахароза, фруктоза, мальтоза, крахмал и целлюлоза; липиды, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; а также органические кислоты, такие как уксусная кислота. Эти источники углерода можно использовать в отдельности или в комбинации, но не ограничиваясь этим. Источник азота включает органические источники азота, такие как пептон, дрожжевой экстракт, подлива, солодовый экстракт, жидкий кукурузный экстракт (CSL) и бобовая мука, а также неорганические источники азота, такие как мочевина, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Эти источники азота можно использовать в отдельности или в комбинации, но не ограничиваясь этим. В дополнение, среда может включать дигидрофосфат калия, гидрофосфат дикалия и их соответствующие натрийсодержащие соли в качестве источника фосфора, но не ограничиваться этим. Также среда может включать металл, такой как сульфат магния или сульфат железа. Кроме того, также можно добавлять аминокислоты, витамины и соответствующие предшественники.
Дополнительно, для поддержания культуры в аэробных условиях в культуру можно вводить кислород или кислородсодержащий газ (например, воздух). Температура культуры может обычно составлять 20°C-45°C и, в частности, 25°C-40°C. Культивирование можно продолжать, пока продуцирование L-аминокислот, таких как L-треонин или L-триптофан, не достигнет желаемого уровня, и, в частности, время культивирования может составлять от 10 часов до 100 часов.
Способ продуцирования L-аминокислот в соответствии с конкретным вариантом осуществления настоящей заявки может дополнительно включать извлечение L-аминокислот из полученных таким образом культуральной среды или микроорганизма. Извлечение L-аминокислот можно осуществлять с помощью соответствующего способа, известного из уровня техники, в зависимости от способа культивирования микроорганизма согласно настоящей заявке, например, периодического типа, непрерывного типа или типа культивирования с подпиткой, для очистки или извлечения желаемых L-аминокислот из культуры микроорганизма, но не ограничиваясь этим.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
В соответствии с настоящей заявкой, в случае, когда применяют микроорганизм из рода Escherichia, обладающий улучшенным уровнем внутриклеточного АТР по сравнению с немодифицированным штаммом, и способ продуцирования желаемого вещества с его помощью, высокий уровень внутриклеточного АТР усиливает экспрессию генов, биосинтез, транспорт веществ и т.п., тем самым обеспечивая эффективное продуцирование применимых желаемых веществ, включающих белки, L-аминокислоты и т.п.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1 показаны уровни внутриклеточного АТР у Е. coli в соответствии с конкретным вариантом осуществления настоящей заявки по сравнению с немодифицированным штаммом;
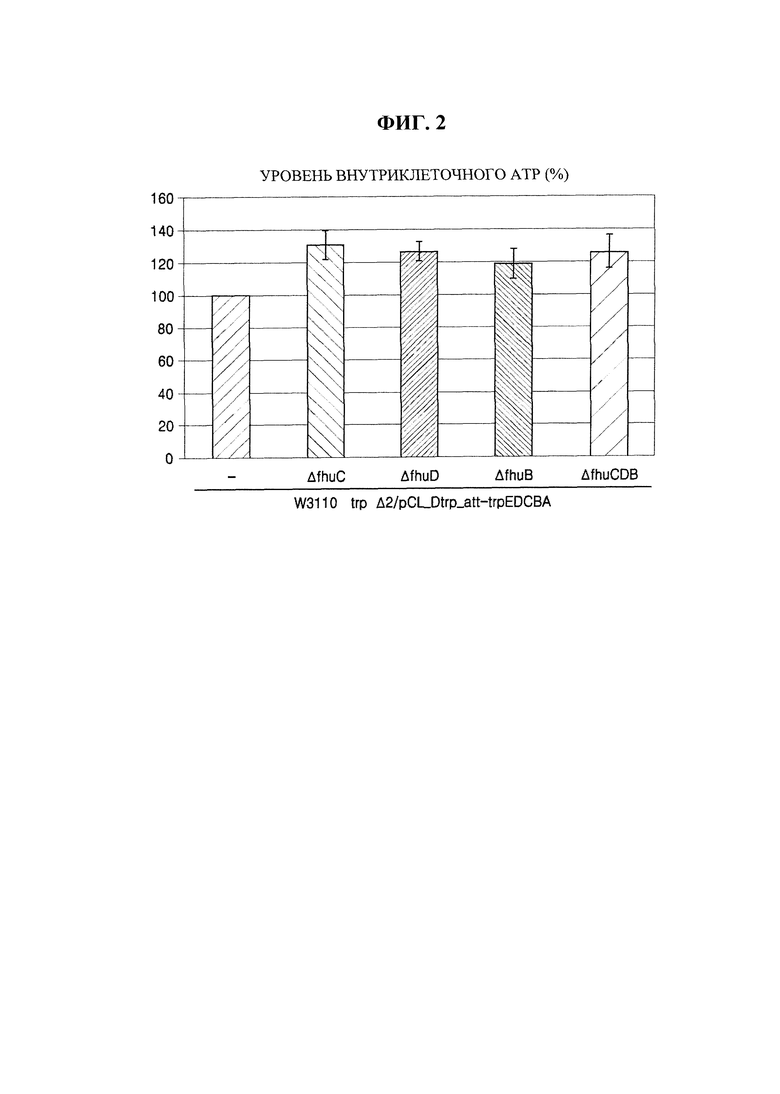
на фиг. 2 показаны уровни внутриклеточного АТР у происходящей от дикого типа Е. coli, обладающей производительностью в отношении L-триптофана, в соответствии с конкретным вариантом осуществления настоящей заявки по сравнению с немодифицированным штаммом;
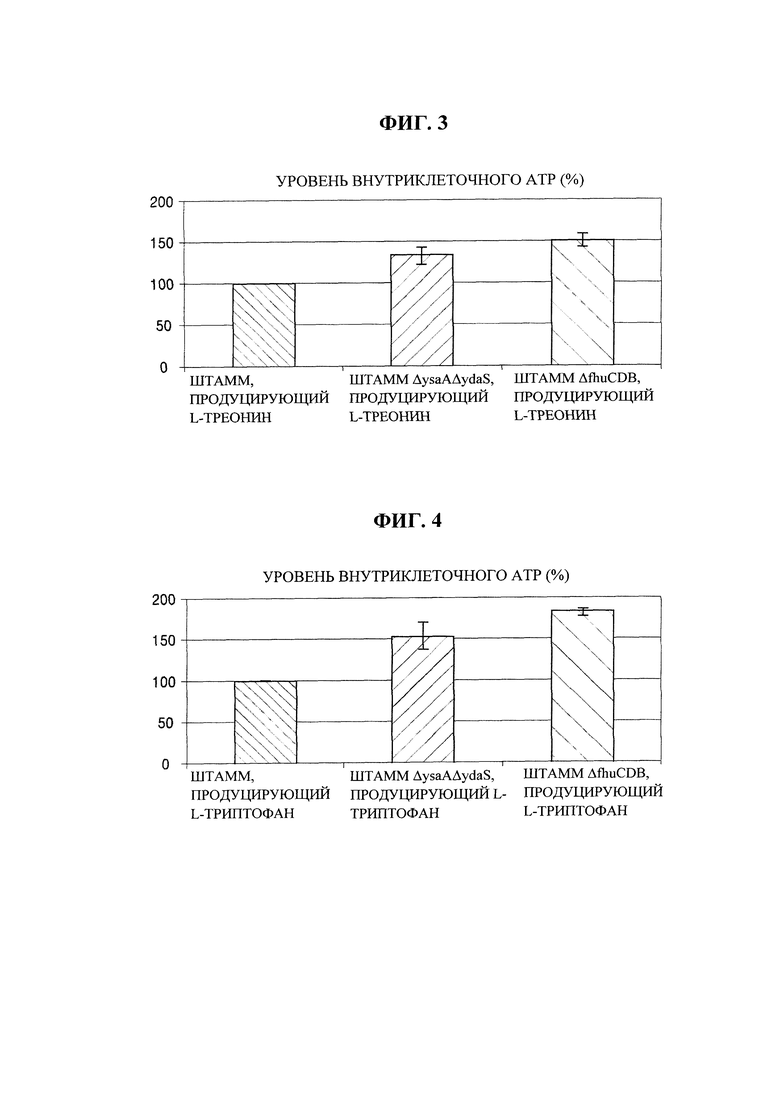
на фиг. 3 показаны уровни внутриклеточного АТР у Е. coli, обладающей производительностью в отношении L-треонина, в соответствии с конкретным вариантом осуществления настоящей заявки по сравнению с немодифицированным штаммом;
на фиг. 4 показаны уровни внутриклеточного АТР у Е. coli, обладающей производительностью в отношении L-триптофана, в соответствии с конкретным вариантом осуществления настоящей заявки по сравнению с немодифицированным штаммом;
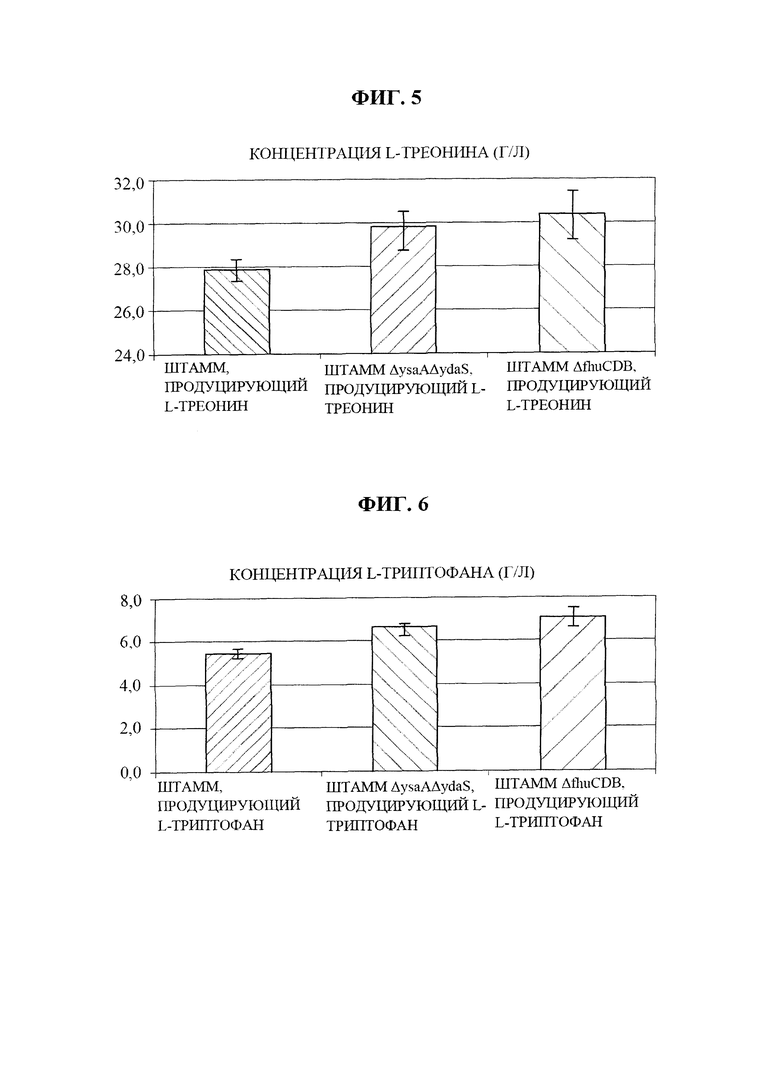
на фиг. 5 показана производительность в отношении L-треонина у Е. coli, обладающей производительностью в отношении L-треонина, в соответствии с конкретным вариантом осуществления настоящей заявки по сравнению с немодифицированным штаммом; и
на фиг. 6 показана производительность в отношении L-триптофана у Е. coli, обладающей производительностью в отношении L-триптофана, в соответствии с конкретным вариантом осуществления настоящей заявки по сравнению с немодифицированным штаммом.
ПРИНЦИП ИЗОБРЕТЕНИЯ
Далее настоящая заявка будет описана более подробно со ссылками на примеры. Однако данные примеры приведены только в целях иллюстрации, и ограничение объема настоящей заявки данными примерами не подразумевается.
Пример 1. Получение Е. coli W3110 дикого типа с инактивированными белками, кодируемыми генами fhuC, fhuD и fhuB
В этом примере гены fhuC, fhuD и fhuB Е. coli W3110 дикого типа (АТСС® 39936™) соответственно подвергали делеции путем гомологичной рекомбинации.
Гены fhuC, fhuD и fhuB, подлежащие делеции, соответственно имеют нуклеотидные последовательности SEQ ID NO: 1, 2 и 3, и эти гены существуют в форме оперона SEQ ID NO: 4.
Для делеции fhuC, fhuD и fhuB осуществляли одностадийную инактивацию с помощью рекомбиназы Red фага лямбда, разработанную Datsenko KA et al. (Proc Natl Acad Sci USA., (2000) 97:6640-6645). В качестве маркера для подтверждения вставки в ген использовали ген устойчивости к хлорамфениколу из pUCprmfmloxC, который получали путем лигирования промотора rmf с pUC19 (New England Biolabs (USA)) и лигирования с ним мутантной кассеты loxP-CmR-loxP, полученной из pACYC184 (New England Biolab) (заявка на корейский патент №2009-0075549).
Вначале осуществляли первичную полимеразную цепную реакцию (далее в данном документе называемую 'ПЦР') с применением pUCprmfmloxC в качестве матрицы и комбинаций праймеров с SEQ ID NO: 8 и 9, 10 и 11, 12 и 13, и 8 и 13 с частью генов fhuC и fhuB и частичной последовательностью гена устойчивости к хлорамфениколу в гене pUCprmfmloxC в условиях 30 циклов денатурации при 94°C в течение 30 секунд, отжига при 55°C в течение 30 секунд и элонгации при 72°C в течение 1 минуты с получением таким образом продуктов ПЦР ΔfhuClst, ΔfhuDlst, ΔfhuBlst и ΔfhuCDBlst размером приблизительно 1,2 т.п.о.
После этого продукты ПЦР ΔfhuClst, ΔfhuDlst, ΔfhuBlst и ΔfhuCDBlst размером 1,2 т.п.о., полученные посредством ПЦР, подвергали электрофорезу в 0,8% агарозном геле, а затем элюировали и применяли в качестве матрицы для вторичной ПЦР. Вторичную ПЦР осуществляли с применением элюированных продуктов первичной ПЦР в качестве матриц и комбинаций праймеров с SEQ ID NO: 14 и 15, 16 и 17, 18 и 19, 14 и 19, содержащих нуклеотидные последовательности размером 20 п.о. в 5'- и 3'-концевых областях продуктов ПЦР, полученных в первичной ПЦР, в условиях 30 циклов денатурации при 94°C в течение 30 секунд, отжига при 55°C в течение 30 секунд и элонгации при 72°C в течение 1 минуты с получением таким образом продуктов ПЦР ΔfhuC, ΔfhuD, ΔfhuB и ΔfhuCDB размером приблизительно 1,3 т.п.о. Полученные таким образом продукты ПЦР подвергали электрофорезу в 0,8% агарозном геле, а затем элюировали и применяли в рекомбинации.
E. coli W3110, который трансформировали вектором pKD46 в соответствии со способом одностадийной инактивации, разработанным Datsenko KA et al. (Proc Natl Acad Sci USA., (2000) 97:6640-6645), получали в виде компетентного штамма, и трансформацию осуществляли путем введения фрагмента гена размером 1,3 т.п.о., полученного посредством первичной и вторичной ПЦР. Штаммы культивировали в среде LB, дополненной хлорамфениколом, и отбирали трансформантов, обладающих устойчивостью к хлорамфениколу. Делецию любого или всех из fhuC, fhuD и fhuB подтверждали по продуктам ПЦР размером приблизительно 4,4 т.п.о., приблизительно 4,3 т.п.о., приблизительно 3,3 т.п.о. и приблизительно 1,6 т.п.о., которые амплифицировали посредством ПЦР с применением геномов, полученных из отобранных штаммов, в качестве матриц и праймеров с SEQ ID NO: 20 и 21.
После удаления pKD46 из полученных таким образом первичных рекомбинантных штаммов, обладающих устойчивостью к хлорамфениколу, в первичные рекомбинантные штаммы, обладающие устойчивостью к хлорамфениколу, вводили вектор pJW168 (Gene, (2000) 247, 255-264) для удаления маркерного гена устойчивости к хлорамфениколу из штаммов (Gene, (2000) 247, 255-264). Осуществляли ПЦР с применением праймеров с SEQ ID NO: 20 и 21 с получением продуктов ПЦР размером приблизительно 3,4 т.п.о., приблизительно 3,3 т.п.о., приблизительно 2,2 т.п.о. и приблизительно 0,6 т.п.о., что указывает на то, что полученные в конечном счете штаммы имели делецию любого или всех из генов fhuC, fhuD и fhuB. Штаммы соответственно обозначали как Е. coli W3110_ΔfhuC, W3110_ΔfhuD, W3110_ΔfhuB и W3110_ΔfhuCDB.
Пример 2. Измерение уровней внутриклеточного АТР у Е. coli с делениями генов fhuC, fhuD и fhuB, происходящих от Е. coli дикого типа
В этом примере на практике измеряли уровни внутриклеточного АТР у штаммов, полученных в примере 1.
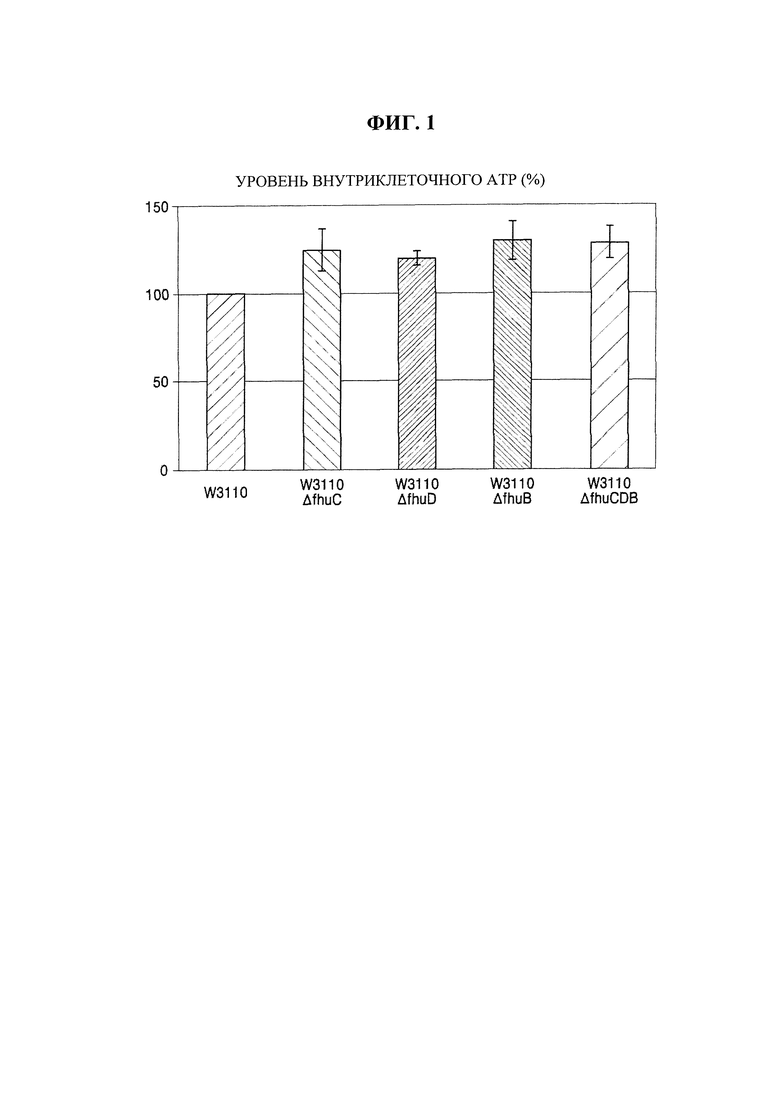
Для этой цели использовали "эффективный способ количественного определения синтетической активности клеточного АТР", разработанный Kiyotaka Y. Hara et al., в котором использовали люциферазу (J Biom Sere, (2006) Vol.11, No.3, рр310-17). Вкратце, Е. coli W3110, представляющий собой немодифицированный штамм, применяемый в примере 1, и Е. coli W3110_ΔfhuCDB, полученный посредством делеции генов, соответственно культивировали в течение ночи в жидкой среде LB, содержащей глюкозу. После культивирования образцы надосадочной жидкости удаляли путем центрифугирования, полученные таким образом клетки промывали с помощью 100 мМ Tris-Cl (рН 7,5) и затем обрабатывали РВ-буфером (проникающий буфер: 40% [об./об.] глюкозы, 0,8% [об./об.] Triton Х-100) в течение 30 минут для высвобождения внутриклеточного АТР из клеток. Затем образцы надосадочной жидкости удаляли путем центрифугирования, и к клеткам добавляли люциферин в качестве субстрата для люциферазы. Клеткам позволяли прореагировать в течение 10 минут. Формирование цвета под действием люциферазы измеряли с помощью люминометра для количественного определения уровней АТР. Результаты приведены на фиг. 1. Результаты на фиг. 1 регистрировали как среднее значение для трех повторяемых экспериментов.
Как показано на фиг. 1, уровни внутриклеточного АТР у Е. coli W3110_ΔfhuC, W3110_ΔfhuD, W3110_ΔfhuB и W3110_ΔfhuCDB, полученных в примере 1, у которых любой или все из fhuC, fhuD и fhuB, происходящих от Е. coli дикого типа, были подвергнуты делеции, были повышены по сравнению с немодифицированным штаммом Е. coli W3110.
Пример 3. Получение происходящего от дикого типа штамма, продуцирующего L-триптофан, с инактивированными белками, кодируемыми генами fhuC, fhuD и fhuB, и измерение уровней внутриклеточного АТР
В этом примере любой или все из генов fhuC, fhuD и fhuB происходящего от дикого типа штамма Е. coli W3110 trpΔ2/pCL-Dtrp_att-trpEDCBA, продуцирующего L-триптофан (публикация корейского патента №10-2013-0082121), подвергали делеции путем гомологичной рекомбинации, как в примере 1, с получением штаммов W3110 trpΔ2_ΔfhuC/pCL-Dtrp_att-trpEDCBA, W3110 trpΔ2_ΔfhuD/pCL-Dtrp_att-trpEDCBA, W3110 trpΔ2_ΔfhuB/pCL-Dtrp_att-trpEDCBA и W3110 trpΔ2_ΔfhuCDB/pCL-Dtrp_att-trpEDCBA. У этих штаммов, полученных таким образом, уровни внутриклеточного АТР измеряли таким же образом, как в примере 2, и результаты приведены на фиг. 2.
Как показано на фиг. 2, уровни внутриклеточного АТР у штаммов, которые получали посредством делеции любого или всех из генов fhuC, fhuD и fhuB штамма дикого типа, продуцирующего L-триптофан, были повышены по сравнению с немодифицированным штаммом и контрольным штаммом.
Пример 4. Изучение титра происходящего от дикого типа штамма, продуцирующего L-триптофан, с инактивированными белками, кодируемыми генами fhuC, fhuD и fhuB
Как описано в примере 3, происходящий от дикого типа штамм W3110 trpΔ2/pCL-Dtrp_att-trpEDCBA, продуцирующий L-триптофан, и штаммы с улучшенными уровнями внутриклеточного АТР, полученные посредством делеции любого или всех из генов fhuC, fhuD и fhuB, подвергали титрованию с применением глюкозы в качестве источника углерода.
Каждый из штаммов инокулировали платиновой петлей в твердую среду LB и культивировали в инкубаторе при 37°C в течение ночи, а затем инокулировали платиновой петлей в 25 мл глюкозосодержащей титрационной среды, имеющей состав из таблицы 1. Затем штаммы культивировали в инкубаторе при 37°C и при 200 об./мин. в течение 48 часов. Результаты приведены в таблице 2. Все результаты регистрировали как среднее значение для трех повторяемых экспериментов.

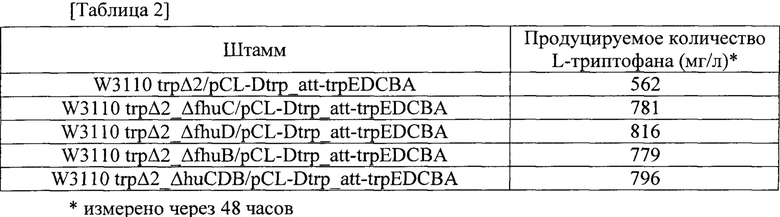
Как показано в таблице 2, было продемонстрировано, что у штаммов с улучшенными уровнями внутриклеточного АТР, полученных в примере 3 посредством делеции любого или всех из генов fhuC, fhuD и fhuB штамма дикого типа W3110 trpΔ2/pCL-Dtrp_att-trpEDCBA, продуцирующего L-триптофан, продуцирование L-триптофана повысилось на величину до приблизительно 63% по сравнению с немодифицированным штаммом trpΔ2/pCL-Dtrp_att-trpEDCBA. С учетом уровней внутриклеточного АТР, подтвержденных на фиг. 2, эти результаты по повышенным уровням внутриклеточного АТР указывают на то, что значения производительности штаммов в отношении L-триптофана были повышены.
Пример 5. Получение штамма, продуцирующего L-треонин, и штамма, продуцирующего L-триптофан, с инактивированными белками, кодируемыми генами fhuC, fhuD и fhuB
В этом примере гены fhuC, fhuD и fhuB штамма KCCM10812P, продуцирующего L-триптофан (корейский патент №0792095), и штамма KCCM10541, продуцирующего L-треонин (корейский патент №0576342), соответственно подвергали делеции путем гомологичной рекомбинации, как в примере 1.
Немодифицированный штамм Е. coli KCCM10812P, обладающий производительностью в отношении L-триптофана, представляет собой штамм, происходящий от варианта Е. coli (KFCC 10066), обладающего производительностью в отношении L-фенилаланина, и представляет собой рекомбинантный штамм Е. coli, обладающий производительностью в отношении L-триптофана, характеризующийся тем, что хромосомная ауксотрофность по триптофану была уменьшена или устранена, гены pheA, trpR, mtr и tnaAB были подвергнуты аттенюации, а гены aroG и trpE были модифицированы.
Также, немодифицированный штамм Е. coli KCCM10541P, обладающий производительностью в отношении L-треонина, представляет собой штамм, происходящий от Е. coli KFCC 10718 (публикация корейского патента №1992-0008365), и представляет собой Е. coli, обладающую устойчивостью к аналогу L-метионина, фенотипом ауксотрофности по метионину, устойчивостью к аналогу L-треонина, "растекающимся" фенотипом ауксотрофности по изолейцину, устойчивостью к аналогу L-лизина и устойчивостью к α-аминомасляной кислоте, а также производительностью в отношении L-треонина.
Гены fhuC, fhuD и fhuB, подлежащие делеции, подвергали делеции у Е. coli KCCM10812P и Е. coli KCCM10541P таким же образом, как в примере 1, соответственно. В результате этого получали штамм KCCM10541_ΔfhuCDB, продуцирующий L-треонин, и штамм KCCM10812P_ΔfhuCDB, продуцирующий L-триптофан.
Пример 6. Измерение уровней АТР у штамма, продуцирующего L-треонин, и штамма, продуцирующего L-триптофан, с инактивированными белками, кодируемыми генами fhuC, fhuD и fhuB
В этом примере на практике измеряли уровни внутриклеточного АТР у штаммов, полученных в примере 5.
Уровни внутриклеточного АТР измеряли таким же образом, как в примере 2. Результаты приведены на фиг. 3 и 4. Результаты из фиг. 3 и 4 регистрировали как среднее значение для трех повторяемых экспериментов. В качестве контрольных групп использовали штамм, продуцирующий L-треонин (Е. coli KCCM10541P_ΔysaΔydaS), и штамм, продуцирующий L-триптофан (Е. coli KCCM10812P_ΔysaΔydaS), с делециями ysa и ydaS, которые, как известно, обладают более высокими уровнями внутриклеточного АТР, чем немодифицированные штаммы Е. coli KCCM10812P и Е. coli KCCM10541P, используемые в примере 3 (корейский патент №1327093).
Как показано на фиг. 3 и 4, штаммы с делециями fhuC, fhuD и fhuB, полученные из штамма, продуцирующего L-треонин, и штамма, продуцирующего L-триптофан, в примере 3, продемонстрировали повышенные уровни внутриклеточного АТР по сравнению с немодифицированными штаммами и контрольными штаммами.
Пример 7. Изучение титра штамма, продуцирующего L-треонин, с инактивированными белками, кодируемыми генами fhuC, fhuD и fhuВ
Как описано в примере 5, штаммы с улучшенными уровнями внутриклеточного АТР, которые получали посредством делеции генов fhuC, fhuD и fhuB у микроорганизма, продуцирующего L-треонин, Е. coli KCCM10541P (корейский патент №0576342), подвергали титрованию с применением глюкозы в качестве источника углерода. Штамм, продуцирующий L-треонин, с делециями ysa и ydaS (Е. coli KCCM10541P_ΔysaΔydaS) применяли в качестве контрольной группы для сравнения результатов титрования.
Каждый из штаммов культивировали в твердой среде LB в инкубаторе при 33°C в течение ночи, а затем инокулировали платиновой петлей в 25 мл глюкозосодержащей титрационной среды, имеющей состав из таблицы 3. Затем штаммы культивировали в инкубаторе при 33°C и при 200 об./мин. в течение 50 часов. Результаты приведены в таблице 4 и на фиг. 5. Все результаты регистрировали как среднее значение для трех повторяемых экспериментов.


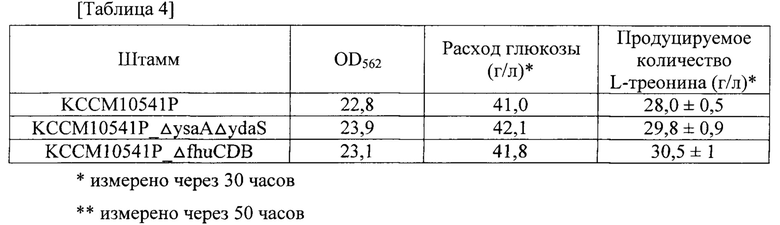
Как показано в таблице 4, было продемонстрировано, что рекомбинантный штамм Е. coli, продуцирующий L-треонин, полученный в соответствии с настоящей заявкой, демонстрировал физиологическую активность, сходную с таковой у немодифицированного штамма, и характеризовался продуцированием L-треонина, повышенным на величину до приблизительно 9% по сравнению с немодифицированным штаммом. С учетом уровней внутриклеточного АТР, подтвержденных на фиг. 3, эти результаты по повышенным уровням внутриклеточного АТР указывают на то, что значения производительности штаммов в отношении L-треонина были повышены.
Пример 8. Изучение титра штамма, продуцирующего L-триптофан, с инактивированными белками, кодируемыми генами fhuC, fltuD и fhuB
Как описано в примере 5, штаммы с улучшенными уровнями внутриклеточного АТР, которые получали посредством делеции генов fhuC, fhuD и fhuB у микроорганизма, продуцирующего L-триптофан, KCCM10812P (корейский патент №0792095), подвергали титрованию с применением глюкозы в качестве источника углерода. Штамм, продуцирующий L-триптофан, с делециями ysa и ydaS (Е. coli KCCM10812P_ΔysaΔydaS) применяли в качестве контрольной группы для оценивания титра таким же образом, как в примере 4.
Результаты титрования приведены в таблице 5 и на фиг. 6. Все результаты регистрировали как среднее значение для трех повторяемых экспериментов.
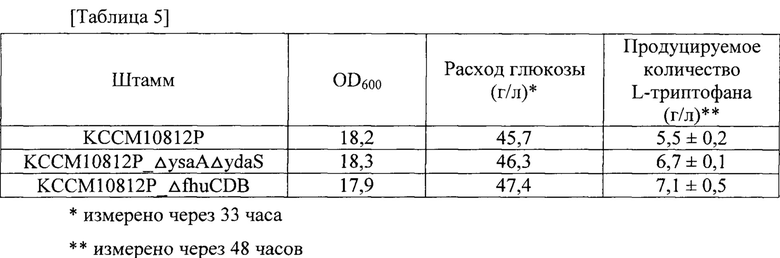
Как показано в таблице 5, было продемонстрировано, что рекомбинантный штамм Е. coli, продуцирующий L-триптофан, полученный в соответствии с настоящей заявкой, демонстрировал физиологическую активность, сходную с таковой у немодифицированного штамма, и характеризовался продуцированием L-триптофана, повышенным на величину до приблизительно 30% по сравнению с немодифицированным штаммом. С учетом уровней внутриклеточного АТР, подтвержденных на фиг. 4, эти результаты по повышенным уровням внутриклеточного АТР указывают на то, что значения производительности штаммов в отношении L-триптофана были повышены.
Рекомбинантный штамм СА04-2801 (KCCM10812P_ΔfhuCDB) согласно настоящей заявке был депонирован в Корейском центре культур микроорганизмов, международном органе по депонированию, 15 ноября 2013 г. под № доступа KCCM11474P.
На основании вышеприведенного описания специалистам в данной области будет понятно, что настоящую заявку можно реализовать в другой конкретной форме без изменения ее технической сущности или существенных характеристик. Таким образом, следует понимать, что вышеописанный вариант осуществления не является ограничивающим, но является иллюстративным во всех аспектах. Объем настоящей заявки определен прилагаемой формулой изобретения, а не предшествующим ей описанием, и, следовательно, предполагается, что все изменения и модификации, которые находятся в пределах формулы изобретения, или эквиваленты таких пределов охватываются, таким образом, формулой изобретения.












Изобретение относится к способу продуцирования L-аминокислот, где L-аминокислота представляет собой L-треонин или L-триптофан. Способ включает культивирование микроорганизма из рода Escherichia в среде и извлечение L-аминокислот из культуральной среды или микроорганизма. В указанном микроорганизме инактивированы один или несколько белков, выбранных из аминокислотной последовательности SEQ ID NO: 5, аминокислотной последовательности SEQ ID NO: 6 и аминокислотной последовательности SEQ ID NO: 7, образующих систему поглощения железа. При этом микроорганизм обладает повышенным уровнем внутриклеточного ATP и улучшенной способностью к продуцированию L-аминокислоты по сравнению с немодифицированным штаммом. 3 з.п. ф-лы, 6 ил., 5 табл., 8 пр.
1. Способ продуцирования L-аминокислот, при этом способ включает: культивирование микроорганизма из рода Escherichia в среде и извлечение L-аминокислот из культуральной среды или микроорганизма, где микроорганизм обладает повышенным уровнем внутриклеточного ATP и улучшенной способностью к продуцированию L-аминокислоты по сравнению с немодифицированным штаммом и где один или несколько белков, выбранных из аминокислотной последовательности SEQ ID NO: 5, аминокислотной последовательности SEQ ID NO: 6 и аминокислотной последовательности SEQ ID NO: 7, которые образуют систему поглощения железа, инактивированы, где L-аминокислота представляет собой L-треонин или L-триптофан.
2. Способ по п.1, где один или более белков инактивированы посредством мутации в результате делеции, замены или вставки части или всего гена, кодирующего соответствующий белок, посредством модификации последовательности, регулирующей экспрессию, для снижения экспрессии гена, посредством модификации последовательности хромосомного гена для ослабления или устранения активности белка или посредством их комбинаций.
3. Способ по п.1, где все белки, имеющие аминокислотные последовательности SEQ ID NO: 5, 6 и 7, инактивированы.
4. Способ по п.1, где микроорганизм представляет собой E. coli.
| Привод кругового поступательного движения | 1990 |
|
SU1829965A3 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Кренометр для самолетов | 1923 |
|
SU6972A1 |
| БАКТЕРИЯ - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2005 |
|
RU2316588C1 |
Авторы
Даты
2019-09-17—Публикация
2015-04-14—Подача