ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к микроорганизму рода Escherichia, продуцирующему L-триптофан, и к способу продуцирования L-триптофана с использованием данного микроорганизма.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
L-триптофан, который представляет собой незаменимую аминокислоту, широко используется в качестве пищевой добавки и т.д., и также широко используется в качестве сырья для фармацевтических продуктов, таких как инфузионные растворы и ингредиенты для лечебного питания. L-триптофан можно получать способом химического синтеза, способом на основе ферментативной реакции, способом ферментации и т.д., но в настоящее время главным образом используют способ прямой ферментации с использованием микроорганизма.
Что касается направления разработки штамма, продуцирующего L-триптофан, данная разработка исходно выполнялась посредством отбора мутаций (корейский патент №1987-0001813) или способами, преодолевающими ингибирование триптофаном по механизму обратной связи, посредством ферментов в пути биосинтеза вместе с генной инженерией, или посредством усиления ферментативного синтеза в метаболических процессах, как, например, посредством усиления экспрессии ферментов биосинтеза триптофана.
Тем временем способ улучшения синтеза L-аминокислот с использованием пути Энтнера-Дудорова был раскрыт ранее (патент США №7432085). Патент США №7432085 относится к способу улучшения продуцирования L-аминокислоты, полученной посредством биосинтетического пути с использованием пировиноградной кислоты в качестве промежуточного соединения, посредством увеличения активностей ферментов, вовлеченных в путь Энтнера-Дудорова, и конкретно, ключевой характеристикой указанного патента является увеличение активности 6-фосфоглюконатдегидратазы или 2-кето-3-дезокси-6-фосфоглюконатальдолазы.
Однако авторы настоящего изобретения впервые подтвердили то, что в случае L-триптофана, в отличие от других L-аминокислот, при ослаблении или инактивации активностей и 6-фосфоглюконатдегидратазы, и 2-кето-3-дезокси-6-фосфоглюконатальдолазы в пути Энтнера-Дудорова, способность продуцировать L-триптофан может быть значительно улучшена, посредством этого осуществляя настоящее изобретение в том, что касается микроорганизма рода Escherichia с улучшенной способностью продуцировать L-триптофан и способа продуцирования L-триптофана с использованием данного микроорганизма.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Задачей настоящего изобретения является предложение микроорганизма, продуцирующего L-триптофан.
Другой задачей настоящего изобретения является предложение способа эффективного продуцирования L-триптофана с использованием микроорганизма, продуцирующего L-триптофан.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Для решения вышеуказанных задач, в одном аспекте в настоящем изобретении предложен микроорганизм рода Escherichia, продуцирующий L-триптофан посредством ослабления или инактивации активностей эндогенной 6-фосфоглюконатдегидратазы (edd) и 2-кето-3-дезокси-6-фосфоглюконатальдолазы (eda).
Термин «L-триптофан» в том виде, как он здесь используется, относится к ароматической L-аминокислоте, которая представляет собой α-аминокислоту и незаменимую аминокислоту, не синтезируемую in vivo, имеющую химическую формулу C11H12N2O2.
Термин «путь Энтнера-Дудорова» в том виде, как он здесь используется, относится к пути углеродного метаболизма, присутствующему в микроорганизме рода Escherichia, который представляет собой путь, катализирующий превращение источников углерода, введенных в данный путь углеродного метаболизма, в глицеральдегид-3-фосфат и пируват через последовательную двухэтапную ферментативную реакцию посредством 6-фосфоглюконатдегидратазы и 2-кето-3-дезокси-6-фосфоглюконатальдолазы.
Термин «6-фосфоглюконатдегидратаза (edd; ЕС 4.2.1.12)» в том виде, как он здесь используется, относится к ферменту, участвующему в пути Энтнера-Дудорова, который катализирует реакцию превращения 6-фосфо-D-глюконата в 2-дигидро-3-дезокси-6-фосфо-D-глюконат. Конкретно, данный фермент может иметь аминокислотную последовательность SEQ ID NO: 1, но без ограничения может быть включена любая последовательность, имеющая активность данного фермента. Кроме того, в типичном воплощении ген, кодирующий 6-фосфоглюконатдегидратазу, может быть представлен нуклеотидной последовательностью SEQ ID NO: 2, но без ограничения может быть включена любая последовательность, кодирующая фермент.
Термин «2-кето-3-дезокси-6-фосфоглюконатальдолаза (eda; ЕС 4.1.2.14)» в том виде, как он здесь используется, относится к ферменту, участвующему в пути Энтнера-Дудорова, который катализирует реакцию превращения 2-дигидро-3-дезокси-6-фосфо-D-глюконата в глицеральдегид-3-фосфат и пируват. В частности, данный фермент может иметь аминокислотную последовательность SEQ ID NO: 3, но может быть включена любая последовательность, имеющая активность данного фермента, без ограничения. Кроме того, в типичном воплощении ген, кодирующий 2-кето-3-дезокси-6-фосфоглюконатальдолазу, может быть представлен нуклеотидной последовательностью SEQ ID NO: 4, но без ограничения может быть включена любая последовательность, кодирующая фермент.
Каждый из ферментов, описанных выше, помимо аминокислотных последовательностей, представленных SEQ ID NO: 1-3, может включать, без ограничения, любую аминокислотную последовательность, которая имеет гомологию 70% или выше, конкретно 80% или выше, более конкретно 90% или выше, даже более конкретно 95% или выше, еще более конкретно 98% или выше и еще более конкретно 99% или выше относительно каждой из вышеперечисленных аминокислотных последовательностей, при условии, что данный фермент демонстрирует эффект, по существу такой же или соответствующий эффекту каждого из ферментов. Кроме того, очевидно, что любой модифицированный фермент, который имеет описанную выше гомологию, и имеет эффект, соответствующий эффекту каждого фермента, может входить в объем настоящей заявки, несмотря на то, что данный фермент может иметь аминокислотную последовательность с частичной делецией, модификацией, заменой или присоединением.
Кроме того, гены, кодирующие каждый из ферментов, также могут включать, без ограничения, помимо нуклеотидных последовательностей, представленных SEQ ID NO: 2 или 4, последовательность любого гена, кодирующего ферменты, которая имеет гомологию 80% или выше, конкретно 90% или выше, даже более конкретно 95% или выше, еще более конкретно 98% или выше и еще более конкретно 99% или выше с каждой из вышеперечисленных нуклеотидных последовательностей, при условии, что данная последовательность кодирует фермент, который имеет эффект, по существу такой же или соответствующий эффекту каждого из ферментов. Кроме того, очевидно, что любая нуклеотидная последовательность, которая имеет описанные выше гомологии, может принадлежать к объему настоящей заявки, несмотря на то, что данная последовательность может иметь в ней частичную делецию, модификацию, замену или присоединение.
Термин «гомология» в том виде, как он здесь используется, относится к проценту идентичности между двумя полинуклеотидными или полипептидными группировками. Соответствие последовательностей одной и другой группировок может быть определено методикой, известной в данной области. Например, гомология может быть определена путем непосредственного выравнивания информации по последовательностям (например, такие параметры, как бальная оценка, идентичность и сходство) на двух молекулах полинуклеотидов или двух молекулах полипептидов с использованием компьютерной программы (например BLAST 2.0), которая легко доступна и способна к выравниванию информации по последовательностям. Кроме того, гомология может быть определена посредством гибридизации полинуклеотидов при условиях образования стабильной двойной цепи в гомологичных областях и последующего расщепления гибридизированной цепи посредством нуклеазы, специфичной в отношении одиночной цепи, для определения размера расщепленных фрагментов.
Термин «эндогенная активность» в том виде, как он здесь используется, относится к активному состоянию фермента в микроорганизме в природном состоянии или до модификации.
Термин «ослабление активности фермента по сравнению с его эндогенной активностью» в том виде, как он здесь используется, относится к подходу, включающему случай, когда имеется уменьшение активности фермента в микроорганизме по сравнению с активностью, которой он обладал исходно в его природном состоянии или до модификации, случай, когда уровень общей экспрессии белка ниже, чем уровень штамма дикого типа или уровень штамма до модификации микроорганизма, из-за ингибирования экспрессии или ингибирования трансляции гена, кодирующего данный фермент, или комбинацию данных случаев.
Термин «инактивация» в том виде, как он здесь используется, относится к случаю, когда ген, кодирующий фермент в микроорганизме, совсем не экспрессируется, и к случаю, когда ген экспрессируется, но не демонстрирует активность по сравнению с активностью штамма дикого типа или штамма до модификации микроорганизма.
Ослабление или инактивация ферментативной активности могут быть достигнуты разными способами, хорошо известными в данной области. Примеры данных способов могут включать способ замены на хромосоме гена, кодирующего фермент, мутировавшим геном, таким образом, что ферментативная активность уменьшается, включая случай, когда ферментативная активность устраняется; способ введения модификации в последовательность контроля экспрессии гена, кодирующего фермент, на хромосоме; способ замены последовательности контроля экспрессии гена, кодирующего фермент, последовательностью, имеющей слабую активность или не имеющей активности; способ делеции части или всего гена, кодирующего фермент, на хромосоме; способ введения антисмыслового олигонуклеотида (например антисмысловой РНК), который ингибирует трансляцию от мРНК в фермент, посредством комплементарного связывания с транскриптом гена на хромосоме; способ обеспечивающий невозможность посадки рибосомы, посредством образования вторичной структуры путем искусственного добавления последовательности Шайна-Дальгарно (SD) и комплементарной ей последовательности на переднем конце последовательности SD гена, кодирующего фермент; способ инженерии обратной транскрипции (RTE), в котором добавляется промотор, подлежащий обратной транскрипции на 3'-конце открытой рамки считывания (ORF) соответствующей последовательности и т.д., и также могут включать их комбинацию, но не ограничиваются ими.
В частности, способ делеции части или всего гена, кодирующего фермент, может осуществляться посредством замены полинуклеотида, кодирующего эндогенный белок-мишень в хромосоме, полинуклеотидом или маркерным геном, имеющим частичную делецию в последовательности нуклеиновой кислоты, с использованием вектора для хромосомной вставки в бактериях. В типичном воплощении способа делеции части или всего гена ген может быть подвергнут делеции посредством гомологичной рекомбинации.
Термин «часть» в том виде, как он здесь используется, несмотря на то, что он может варьировать, в зависимости от видов полинуклеоидов, может конкретно относиться к части от 1 нуклеотида до 300 нуклеотидов, более конкретно, к части от 1 нуклеотида до 100 нуклеотидов, и даже более конкретно к части от 1 нуклеотида до 50 нуклеотидов, но конкретно не ограничивается ими.
Термин «гомологичная рекомбинация» в том виде, как он здесь используется, относится к генетической рекомбинации, которая происходит посредством кроссинговера в локусах генетической цепи, имеющих взаимную гомологию.
В частности, последовательность контроля экспрессии может быть модифицирована путем индуцирования модификации последовательности контроля экспрессии посредством делеции, вставки, неконсервативной или консервативной замены, или их комбинации в последовательности нуклеиновой кислоты последовательности контроля экспрессии; или посредством замены более слабым промотором и т.д. Последовательность контроля экспрессии может включать промотор, последовательность оператора, последовательность, кодирующую область связывания рибосомы, и последовательности, контролирующие терминацию транскрипции и трансляции.
Кроме того, последовательность гена на хромосоме может быть модифицирована посредством индуцирования модификации в последовательности посредством делеции, вставки, неконсервативной или консервативной замены или их комбинации в последовательности гена для дальнейшего ослабления ферментативной активности; или посредством замены на последовательность гена, которая была улучшена таким образом, чтобы иметь более слабую активность, или на последовательность гена, которая была улучшена таким образом, чтобы не иметь активности.
В типичном воплощении настоящей заявки было подтверждено, что ослабление или инактивация активности может осуществляться посредством по меньшей мере одного мутационного способа, выбранного из группы, состоящей из инсерционной мутации, осуществляемой посредством вставки по меньшей мере одной пары оснований в ген, кодирующий 6-фосфоглюконатдегидратазу, и в ген, кодирующий 2-кето-3-дезокси-6-фосфоглюконатальдолазу; делеционной мутации, осуществляемой посредством делеции по меньшей мере одной пары оснований в гене; и транзиционной или трансверсионной мутации пары оснований, осуществляемой посредством введения бессмысленного кодона или другого кодона в ген.
В настоящей заявке микроорганизм рода Escherichia может представлять собой конкретно Escherichia coli, но не ограничивается им.
В частности, родительский штамм микроорганизма рода Escherichia, продуцирующий L-триптофан посредством ослабления или инактивации активностей edd и eda, может конкретно не ограничиваться, при условии, что микроорганизм принадлежит к роду Escherichia. Например, микроорганизм, продуцирующий L-триптофан, может представлять собой микроорганизм, в котором для усиления биосинтетического пути были ослаблены или инактивированы активности гена в конкурирующем пути, регулятора в направленном пути триптофанового оперона и гена введения и разрушения триптофана, и/или осуществлялась сверхэкспрессия активности триптофанового оперона. Способы ослабления или инактивации активности являются такими же, что и объясненные выше, и способы, известные в данной области, включены без ограничения. Кроме того, способы сверхэкспрессии активности триптофанового оперона, известные в данной области, включены без ограничения. Например, данные способы могут включать способ дополнительного введения в хромосому полинуклеотида, который включает часть или сам представляет собой полную нуклеотидную последовательность гена оперона, или области контроля экспрессии, введенной извне; способ увеличения числа копий посредством введения в векторную систему; способ увеличения активности оперона посредством замены последовательности контроля экспрессии, которая контролирует экспрессию гена, другой последовательностью контроля экспрессии, модификации, имеющей введенную мутацию в часть или во всю нуклеотидную последовательность области контроля экспрессии, и введения модификации в сам ген и т.д., но не ограничиваясь ими. Конкретно, микроорганизм может представлять собой Е. coli, в которой часть или полный ген pheA, ген trpR, ген mtr и ген tnaAB подвергаются делеции, и/или сверхэкспрессируется триптофановый оперон.
В настоящей заявке ген edd, ген eda, ген pheA, ген trpR, ген mtr, ген tnaAB, триптофановый оперон и последовательности белков, кодируемые ими, могут быть получены из известных баз данных, например, GenBank NCBI (Национальный центр биотехнологической информации), но без ограничения ими. Кроме того, конкретные подробности в отношении гена pheA, гена trpR, гена mtr и гена tnaAB можно найти в раскрытии корейского патента №10-0792095, и полное описание данного корейского патента может быть включено в качестве ссылки в настоящую заявку.
Из типичных воплощений настоящего изобретения было подтверждено, что в том, что касается инактивации активностей 6-фосфоглюконатдегидратазы и 2-кето-3-дезокси-6-фосфоглюконатальдолазы в разных родительских штаммах, любой микроорганизм рода Escherichia, независимо от его родительского штамма, значительно улучшает продукцию L-триптофана при совместном ослаблении или инактивации активностей как 6-фосфоглюконатдегидратазы, так и 2-кето-3-дезокси-6-фосфоглюконатальдолазы.
В другом аспекте в настоящей заявке предложен способ получения L-триптофана, включающий культивирование микроорганизма рода Escherichia, продуцирующего L-триптофан, посредством ослабления или инактивации активностей эндогенных 6-фосфоглюконатдегидратазы (edd) и 2-кето-3-дезокси-6-фосфоглюконатальдолазы (eda) по настоящей заявке; и выделение L-триптофана из культуральной среды или культивируемого микроорганизма.
Среда и другие условия культуры, используемые для культивирования микроорганизма по настоящей заявке, не являются конкретно ограниченными, но может быть использована любая среда, используемая для традиционного культивирования микроорганизма рода Escherichia. В частности, микроорганизм по настоящей заявке можно культивировать в традиционной среде, содержащей подходящие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины и т.д., в аэробных условиях при подведении температуры, рН и т.д.
Примеры источников углерода для использования в настоящем изобретении могут включать такие углеводы, как глюкоза, фруктоза, сахароза, мальтоза, маннит, сорбит и т.д.; спирты, такие как многоатомные спирты, глицерин, пируват, лактат, цитрат и т.д.; и аминокислоты, такие как органическая кислота (orgarnic acid), глутаминовая кислота, метионин, лизин и т.д. Кроме того, могут быть использованы природные органические питательные вещества, такие как гидролизат крахмала, меласса, сырая меласса, рисовые отруби, крахмал маниока, меласса сахарного тростника, жидкий кукурузный экстракт и т.д., и, конкретно, углеводы, такие как глюкоза и стерильная предобработанная меласса (т.е. меласса, превращенная в восстановленный сахар) и т.д. Кроме того, могут использоваться разные другие источники углерода в подходящем количестве без ограничения. Данные источники углерода могут использоваться одни или в комбинации двух или более чем двух.
Примеры источников азота для использования в настоящем изобретении могут включать неорганические соединения, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония, нитрат аммония и т.д.; аминокислоты, такие как глутаминовая кислота, метионин, глутамин и т.д.; и органические источники азота, такие как пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, казеиновый гидролизат, рыба или продукты ее разложения, обезжиренный соевый жмых или продукты его разложения и т.д. Данные источники азота можно использовать одни или в комбинации двух или более чем двух.
Примеры источников фосфора для использования в настоящем изобретении могут включать одноосновный фосфат калия, двухосновный фосфат калия, соответствующие натрийсодержащие соли и т.д., но не ограничиваются ими. Примеры неорганических соединений могут включать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат марганца, карбонат кальция и т.д., и, кроме того, могут быть включены аминокислоты, витамины и/или подходящие предшественники для культуральной среды. Данные среду или предшественники можно добавлять в культуру согласно протоколу периодического культивирования или непрерывного культивирования.
В настоящем изобретении рН культуры может регулировать во время культивирования посредством добавления в культуру подходящим способом такого соединения, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. Во время периода культивирования может быть добавлен пеногаситель, такой как полигликолевый сложный эфир жирной кислоты, для предотвращения образования пены. Кроме того, в культуру можно вводить кислород или кислородсодержащий газ для того, чтобы поддерживать аэробное состояние культуры; или можно вводить газообразный азот, водород или диоксид углерода без введение газа для того, чтобы поддерживать анаэробное или микроаэробное состояние культуры.
Температура культуры обычно может находиться в интервале от 27°С до 40°С и конкретно от 30°С до 37°С, но не ограничиваясь ими. Культивирование можно продолжать, пока не будет получено желательное количество полезных веществ, и конкретно от 10 часов до 100 часов, без ограничения.
L-триптофан можно выделять подходящим способом, известным в данной области, например посредством периодической культуры, непрерывной культуры или культуры с подпиткой и т.д., согласно способу культивирования по настоящему изобретению.
Выделение также может включать стадию очистки.
L-аминокислоты могут высвобождаться в культуральную среду, в которой культивируются микроорганизмы, или могут содержаться в микроорганизмах.
Полезные эффекты изобретения
В настоящем изобретении предложен микроорганизм рода Escherichia, продуцирующий L-триптофан, посредством ослабления или инактивации активности эндогенных 6-фосфоглюконатдегидратазы и 2-кето-3-дезокси-6-фосфоглюконатальдолазы, и таким образом настоящее изобретение обеспечивает эффект того, что L-триптофан может продуцироваться с использованием микроорганизма с более высоким выходом и с большей эффективностью и рентабельностью.
Способы осуществления изобретения
Ниже настоящее изобретение будет подробно описано с сопровождающими примерами. Однако раскрытые здесь примеры служат лишь для иллюстративных целей и не должны истолковываться как ограничивающие объем настоящего изобретения.
Сравнительный пример 1: получение родительского штамма (ΔpheAΔtrpRΔmtrΔtnaAB/pCL1920-Ptrc-trpO)
(1) Получение штамма дикого типа, в котором инактивированы белки, кодируемые генами pheA, trpR, mtr и tnaAB
Для усиления пути биосинтеза триптофана родительским штаммом были инактивированы все из следующих: ген pheA, который представляет собой ген конкурирующего пути; ген trpR, который является регулятором триптофанового оперона и направленного пути; ген mtr, который представляет собой ген для введения триптофана; и гены tnaA и tnaB, которые представляют собой гены для введения и разрушения триптофана, и посредством этого была лучше изучена способность микроорганизма по настоящему изобретению продуцировать триптофан. Посредством гомологичной рекомбинации генов в Е. coli W3110 (АТСС®39936™) были инактивированы все из следующих: хоризматмутаза/префенатгидратаза, кодируемая геном pheA; транскрипционный репрессор trpR, кодируемый геном trpR; триптофан/индол: Н+ симпортер, кодируемый геном mtr, триптофаназа и триптофан: Н+ симпортер, кодируемые генами tnaA и tnaB в форме оперона. Для этой цели использовали одноэтапный способ инактивации с использованием рекомбиназы lambda Red, разработанный Datsenko КА et al., и инактивацию проводили на основе способа, описанного в корейском патенте №10-0792095. Здесь описаны последовательности праймеров, использованных в Сравнительном примере 1, и Сравнительный пример 2 и Примеры 1 и 3, описанные ниже, показаны в Таблице 3 ниже.
В частности, примерно 1100 пар нуклеотидов фрагментов гена амплифицировали посредством ПЦР (полимеразная цепная реакция) с использованием гена pKD3 в качестве матрицы, вместе с частью гена pheA, имеющего последовательность SEQ ID NO: 6, и праймерами 1 и 2, имеющими частичную нуклеотидную последовательность гена устойчивости к хлорамфениколу гена pKD3. Затем фрагменты ДНК, полученные ПЦР, разделяли электрофорезом в 0,8%-ном агарозном геле, элюировали и использовали в качестве матрицы для второй ПЦР. Для получения 5' и 3' фрагментов ДНК гена pheA в Е. coli примерно 250 пар нуклеотидов фрагментов гена амплифицировали посредством ПЦР с использованием хромосомы Е. coli W3110 в качестве матрицы, вместе с праймерами 3 и 4, и праймерами 5 и 6. Затем фрагменты ДНК, полученные ПЦР, разделяли электрофорезом в 0,8%-ном агарозном геле, элюировали и использовали в качестве матрицы для второй ПЦР.
В описанном выше нуклеотидные последовательности из 18 пар оснований между праймером 1 и праймером 4 являются комплементарными, и нуклеотидные последовательности из 20 пар оснований между праймером 2 и праймером 5 являются комплементарными, и таким образом фрагменты, полученные посредством праймера 1 и праймера 2, фрагменты, полученные посредством праймера 3 и праймера 4, и фрагменты, полученные посредством праймера 5 и праймера 6, могут быть связаны в виде одного фрагмента. Полученные таким образом ПЦР-фрагменты амплифицировали 5 раз посредством ПЦР без применения какого-либо праймера, обрабатывали праймерами 3 и 6, и вновь амплифицировали 25 раз посредством ПЦР. В результате амплифицировали фрагменты гена размером примерно 1600 пар оснований.
Затем Е. coli W3110, которая была трансформирована pKD46, преобразовали в компетентные клетки согласно способу, разработанному Datsenko КА ef al., вводили в нее фрагменты гена размером примерно 1600 пар оснований, полученные посредством ПЦР, и высевали на твердую среду LB, содержащую хлорамфеникол (30 мг/л). После подтверждения посредством ПЦР того, что ген pheA в штамме, полученном таким образом, был инактивирован посредством того, что он имеет размер 1600 пар оснований, был получен штамм Е. coli W3110 ApheA.
Подобным образом, белки, кодируемые геном trpR, имеющим последовательность SEQ ID NO: 8, геном mtr, имеющим последовательность SEQ ID NO: 10, и генами tnaA и tnaB, имеющими последовательности SEQ ID NO: 12 и 14, были инактивированы с использованием праймеров в Таблице 3, с конструированием посредством этого штамма W3110 ΔpheAΔtrpRΔmtrΔtnaAB.
(2) Получение векторов с введенными генами, демонстрирующими способность продуцировать триптофан
С целью придания штамму дикого типа способность продуцировать триптофан, в W3110 ΔpheAΔtrpRΔmtrΔtnaAB, полученный выше, вводили вектор pCL1920 с промотором Ptrc и ген триптофанового оперона, и получали посредством этого pCL1920-Ptrc-trpO.
В частности, для вставки промотора Ptrc в вектор pCL1920 выделяли плазмиду pCL1920, обрабатывали HindIII и PstI, и получали промотор Ptrc посредством ПЦР повторением 30 циклов денатурации при 94°С в течение 30 секунд, отжига при 58°С в течение 30 секунд и полимеризации при 72°С в течение 30 секунд с использованием pTrcHis В (Invitrogen, США) в качестве матрицы, вместе с праймерами 23 и 24. Полученные таким образом фрагменты промотора Ptrc расщепляли HindIII и PstI и лигировали с вектором pCL1920, конструируя, посредством этого, вектор pCL1920-Ptrc.
Затем для конструирования вектора pCL1920_Ptrc_trpO получали вектор pCL1920-Ptrc поседством обработки PstI и щелочной фосфатазой, и ген триптофанового оперона амплифицировали из хромосомной ДНК Е. coli КССМ10812Р (корейский патент №10-0792095). Ген trpE, который представляет собой первый ген соответствующего гена оперона, имеет форму, ингибируемую по механизму обратной связи. Для амплификации проводили ПЦР с использованием хромосомной ДНК Е. coli КССМ10812Р в качестве матрицы, вместе с праймерами 25 и 26 посредством повтора 30 циклов денатурации при 94°С в течение 30 секунд, отжига при 58°С в течение 30 секунд и полимеризации при 72°С в течение 5 минут. Полученные таким образом фрагменты ДНК обрабатывали PstI и лигировали с вектором pCL1920-Ptrc, полученным заранее, и полученный в результате вектор называли pCL1920_Ptrc_trpO (SEQ ID NO: 15).
(3) Получение штамма со вставленным вектором, содержащим триптофановый оперон
После преобразования штамма, полученного в Сравнительном примере 1 (1), в компетентные клетки, в данный штамм вводили вектор, полученный в Сравнительном примере 1 (2), и посредством этого получали штамм дикого типа W3110 ΔpheAΔtrpRΔmtrΔtnaAB/pCL1920-Ptrc-trpO, продуцирующий триптофан.
Пример 1: получение штамма ΔeddΔeda из родительского штамма Сравнительного примера 1
В штамме дикого типа W3110 ΔpheAΔtrpRΔmtrΔtnaAB/pCL1920-Ptrc-trpO, полученном в Сравнительном примере 1, группу генов edd-eda одновременно подвергали делеции посредством гомологичной рекомбинации, и посредством этого был получен штамм, в котором были инактивированы как 6-фосфоглюконатдегидратаза, так и 2-кето-3-дезокси-6-фосфоглюконатальдолаза, кодируемые геном edd (SEQ ID NO: 2) и геном eda (SEQ ID NO: 4).
В частности, для получения вышеописанного штамма использовали одноэтапный способ инактивации, разработанный Datsenko КА et al., который представляет собой технологию получения мутанта с использованием рекомбиназы lambda Red. В качестве маркера для подтверждения вставки в ген использовали ген устойчивости к хлорамфениколу pUCprmfmloxC (публикация заявки на корейский патент №2009-007554). Фрагменты гена из примерно 1200 пар оснований амплифицировали ПЦР посредством повтора 30 циклов денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 1 минуты с использованием pUCprmfmloxC в качестве матрицы, вместе с праймерами 27 и 28, содержащими часть группы генов edd-eda и частичную нуклеотидную последовательность гена устойчивости к хлорамфениколу гена pUCprmfmloxC.
Дополнительно, фрагменты ДНК, полученные ПЦР-амплификацией, разделяли электрофорезом в 0,8%-ном агарозном геле, элюировали и использовали в качестве матрицы для второй ПЦР. Вторая ПЦР была разработана для получения последовательностей комплементарных нуклеотидов из 20 пар оснований в областях 5' и 3' первых фрагментов ДНК, и фрагменты гена из примерно 1300 пар оснований амплифицировали ПЦР посредством повтора 30 циклов денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 1 минуты с использованием продукта первой ПЦР в качестве матрицы, вместе с праймерами 29 и 30, к которым были добавлены области 5' и 3' группы генов edd-eda. Полученные таким образом фрагменты ДНК разделяли электрофорезм в 0,8%-ном агарозном геле, элюировали и использовали для рекомбинации.
Е. coli, трансформированную pKD46 согласно способу, разработанному Datsenko KA et al., получали в компетентном состоянии, и фрагмент гена с размером 1300 пар оснований, полученный ПЦР, вводили в нее для трансформации. Полученный таким образом штамм отбирали в среде LB, содержащей хлорамфеникол, и ПЦР-продукт, полученный с использованием праймеров 31 и 32, имел размер 1626 пар оснований, что подтверждало таким образом, что группа генов edd-eda была подвергнута делеции.
В первый рекомбинантный штамм, имеющий устойчивость к хлорамфениколу, после удаления pKD46 вводили pJW168, удаляя посредством этого из бактериального объекта (bacterial body) маркерный ген устойчивости к хлорамфениколу (Gene, (2000) 247, 255 - 64). Полученный в результате бактериальный объект представлял собой ПЦР-амплифицированный продукт, полученный с использованием праймеров 31 и 32, имеющий размер 580 пар оснований, что таким образом подтверждало, что была сделана намеченная делеция. Дополнительно после получения штамма в компетентном состоянии данный штамм трансформировали посредством введения в него вектора, полученного в Сравнительном примере 1, получая, посредством этого, штамм W3110ΔpheAΔtrpRΔmtrΔtnaABΔeddΔeda/pCL1920-Ptrc-trpO, продуцирующий триптофан.
Пример 2: подтверждение триптофанпродуцирующей способности штамма ΔeddΔeda
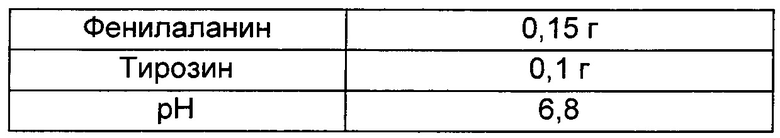
Оценку титра проводили с использованием штамма, полученного в Сравнительном примере 1 и Примере 1. Для оценки титра бактериальный объект инокулпровали с использованием платиновой петли, культивировали в твердой среде LB в течение ночи и инокулировали платиновой петлей на каждую титровальную среду в 25 мл флаконе, имеющую состав, показанный в Таблице 1 ниже. После инокуляции штамм культивировали при 37°С при скорости 200 об./мин в течение 42 часов, и полученные результаты показаны в Таблице 2 ниже. Все использованные результаты представляют собой среднее значение результатов, полученных от трех разных флаконов.
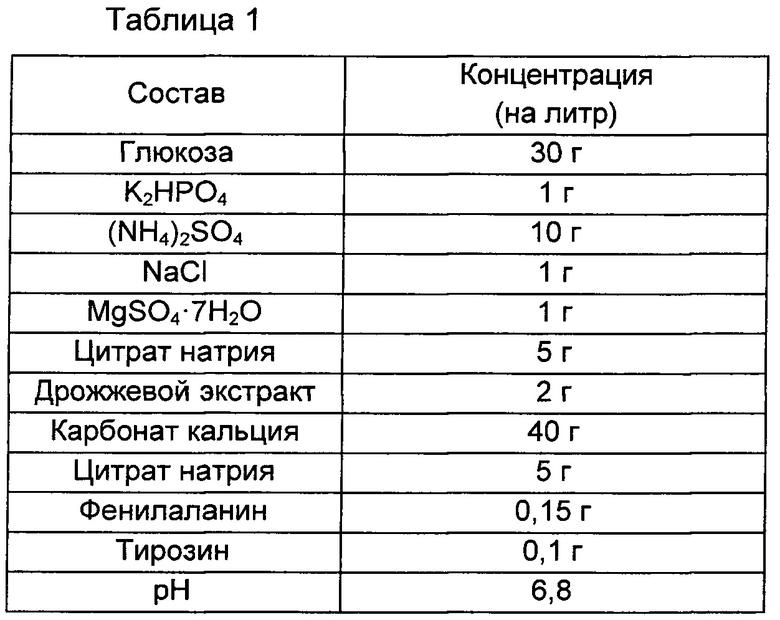
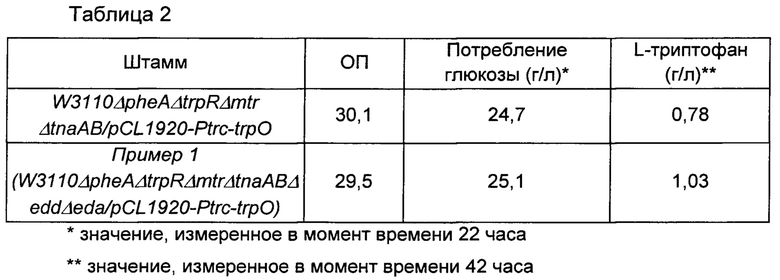
В результате описанного выше эксперимента, как показано в Таблице 2 выше, при делеции группы генов edd-eda, предложенной в настоящей заявке, не было значимого различия в потреблении глюкозы по сравнению с потреблением глюкозы родительским штаммом в Сравнительном примере 1, однако было показано, что количество продуцируемого триптофана увеличивается примерно на 32% по сравнению с количеством триптофана, продуцируемого родительским штаммом. Предполагается, что данный результат обусловлен тем фактом, что реакция протекала до рибулозо-5-фосфата без потери 6-фосфоглюконата, который представляет собой субстрат, посредством делеции в пути Энтнера-Дудорова, и таким образом увеличивалось не только количество NADPH (восстановленный никотинамидадениндинуклеотид фосфат), но также и количество 5-фосфорибозил-1-пирофосфата (PRPP) и эритрозо-4-фосфата (E4P), посредством чего улучшалась способность продуцировать триптофан.
Пример 3: получение штамма ΔeddΔeda из депонированного родительского штамма
Продуцирующий L-триптофан штамм Е. coli КССМ11166Р (корейский патент №10-1261147), депонированный в Корейском центре культуры микроорганизмов (КССМ), обрабатывали таким же способом, что и в Примере 1, и посредством этого получали штамм KCCM11166PΔeddΔeda, в котором была подвергнута делеции группа генов edd-eda.

Пример 4: подтверждение триптофанпродуцирующей способности штамма ΔeddΔeda
Оценку титра проводили с использованием депонированного штамма КССМ11166Р и штамма, полученного в Примере 3.
Для оценки титра бактериальный организм инокулировали с использованием платиновой петли, культивировали в твердой среде LB в течение ночи и инокулировали платиновой петлей на титровальную среду каждого 25 мл флакона, имеющую состав, показанный в Таблице 4 ниже. После инокуляции штамм культивировали при 37°С при скорости 200 об./мин в течение 42 часов, и полученные результаты показаны в Таблице 5 ниже. Все использованные результаты представляют собой среднее значение результатов, полученных от трех разных флаконов.
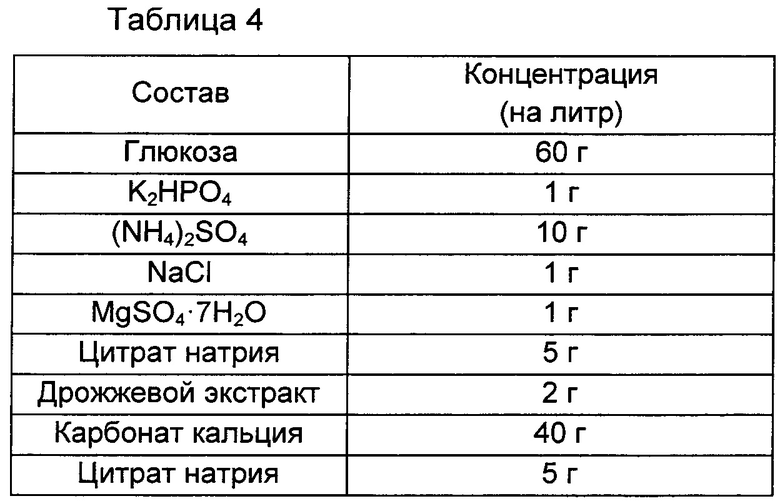
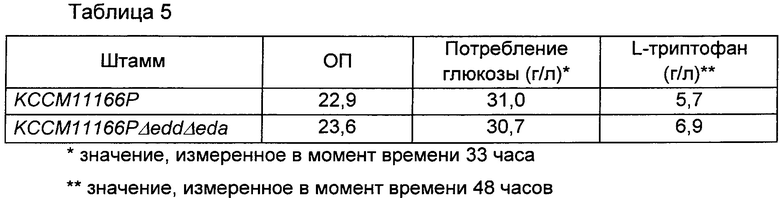
В результате приведенного выше эксперимента, как показано в Таблице 5 выше, при делеции группы генов edd-eda, предложенной в настоящей заявке, не было значимого различия в потреблении глюкозы по сравнению с потреблением глюкозы родительским штаммом, однако, было показано, что количество продуцированного триптофана увеличивается примерно на 21% по сравнению с количеством триптофана, продуцированного родительским штаммом. Предполагается, что данный результат обусловлен улучшением триптофанпродуцирующей способности, как указано в Примере 2 выше.
Авторы настоящего изобретения подтвердили, что штамм на основе КССМ11166Р, названный штамм «СА04-2800», в котором была инактивирована группа генов edd-eda, имеет улучшенную триптофанпродуцирующую способность, и его депонировали в КССМ 15 ноября 2013 г., и ему был присвоен номер депонирования КССМ11473Р.
Приведенные выше результаты свидетельствуют о том, что одновременная инактивация активностей edd-eda в микроорганизме рода Escherichia, имеющем путь Энтнера-Дудорова, может улучшать триптофанпродуцирующую способность по сравнению с микроорганизмом без инактивации активностей edd-eda.
В настоящей заявке опущено подробное описание того, что может быть признано и получено обычным специалистом в данной области, и помимо типичных описанных здесь воплощений в пределы сущности и объема настоящей заявки могут быть включены разные модификации без модифицирования технических идей или существенных характеристик настоящей заявки. Соответственно, настоящая заявка может быть воплощена в других конкретных формах, и обычный специалист в области, к которой относится настоящая заявка, сможет понять их. Номер депонирования
Депозитарный орган: Корейский центр культуры микроорганизмов (заграничный)
Номер депонирования: KCCM11473P
Дата депонирования: 15.11.2013 г.


























Группа изобретений относится к области биотехнологии. Предложен микроорганизм рода Escherichia, продуцирующий L-триптофан, где активности эндогенных 6-фосфоглюконатдегидратазы (Edd) и 2-кето-3-дезокси-6-фосфоглюконатальдолазы (Eda) ослаблены или инактивированы, где микроорганизм имеет усиленный РРР (пентозофосфатный путь) посредством ослабленного или блокированного пути Энтнера-Дудорова. Предложен способ получения L-триптофана с использованием указанного микроорганизма. Группа изобретений позволяет повысить продукцию L-триптофана по сравнению с родительским немодифицированным микроорганизмом. 2 н. и 4 з.п. ф-лы, 5 табл., 5 пр.
1. Микроорганизм рода Escherichia, продуцирующий L-триптофан, где активности эндогенных 6-фосфоглюконатдегидратазы (Edd) и 2-кето-3-дезокси-6-фосфоглюконатальдолазы (Eda) ослаблены или инактивированы, где микроорганизм имеет усиленный РРР (пентозофосфатный путь) посредством ослабленного или блокированного пути Энтнера-Дудорова.
2. Микроорганизм по п. 1, где 6-фосфоглюконатдегидратаза имеет аминокислотную последовательность, представленную в SEQ ID NO: 1.
3. Микроорганизм по п. 1, где 2-кето-3-дезокси-6-фосфоглюконатальдолаза имеет аминокислотную последовательность, представленную в SEQ ID NO: 3.
4. Микроорганизм по п. 1, где микроорганизм рода Escherichia представляет собой Escherichia coli.
5. Микроорганизм по п. 1, где ген pheA, ген trpR, ген mtr и ген tnaAB дополнительно делетированы целиком или частично.
6. Способ получения L-триптофана, включающий:
культивирование микроорганизма рода Escherichia по любому из пп. 1-5 в среде; и
выделение L-триптофана из культуральной среды или культивируемого микроорганизма.
| 6-ФОСФОГЛЮКОНОЛАКТОНАЗА ИЗ ESCHERICHIA COLI, ФРАГМЕНТ ДНК, БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ ESCHERICHIA - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2005 |
|
RU2288268C2 |
| US 20040142435 A1, 22.07.2004 | |||
| US 20060115878 A1, 01.06.2006 | |||
| KR 20090092373 A, 01.09.2009 | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| CA 2860974 A1, 18.07.2013 | |||
| WO 2008082179 A1, 10.07.2008 | |||
| JOSE LUIS BAEZ-VIVEROS et al., Metabolic transcription analysis of engineered Escherichia coli strains that overproduce L-phenylalanine, Microbial Cell Factories Vol | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2019-01-23—Публикация
2015-06-23—Подача