Изобретение относится к биологии и медицине, а именно к иммуногистохимии и иммуноцитохимии.
Известен способ иммуноокрашивания гистологических срезов тканей взрослых млекопитающих (модельных объектов мышей и человека), а также тканей беспозвоночных животных, включающий стадии фиксации материала параформальдегидом, блокирования неспецифического связывания бычьим сывороточным альбумином и/или сывороткой, инкубации с первичными и вторичными антителами в блокирующем буфере, отмывание от антител и получение изображения с последующей 3D-реконструкцией (совмещение всех изображений) для получения объемной картины образца (Garcia-Porrero, J. A., Manaia, A., Jimeno, J., Lasky, L. L., Dieterlen-Lièvre, F., & Godin, I. E. Antigenic profiles of endothelial and hemopoietic lineages in murine intraembryonic hemogenic sites. Developmental & Comparative Immunology, 1998, 22(3), 303-319).
Недостатками данного способа является высокая трудозатратность, связанная с получением серийных срезов, частая потеря срезов при резке тканей и иммунохимическом окрашивании, сложность совмещения изображений, полученных со срезов, влияющих на качество финальной объемной картины.
Опубликован и широко используется метод иммуноокрашивания отдельных органов эмбрионов и взрослых животных антителами, включающие стадии изоляции органов или систем органов, их фиксацию, блокирования неспецифического связывания и обработку первичными и вторичными антителами отмывание от антител и получение изображения с помощью конфокальной микроскопии (Kumar, M., & Tanwar, P. Organ Culture and Whole Mount Immunofluorescence Staining of Mouse Wolffian Ducts. JoVE, Journal of Visualized Experiments, 2017, (119), e55134.).
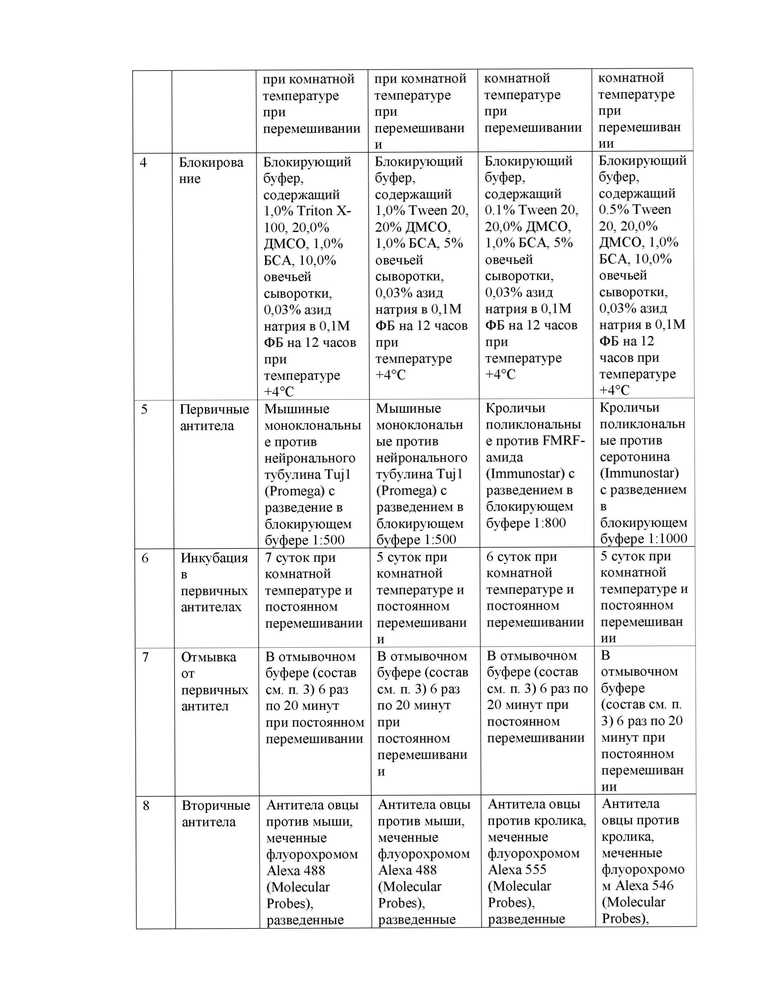
Главный недостаток данного аналога состоит в том, что антитела маркируют только поверхностные структуры, не проникая глубоко в ткани. Из-за этого, более глубокие тканевые слои, свыше 150 мкм, оказываются неокрашенными и не идентифицируемыми микроскопией.
Наиболее близким к заявляемому техническому решению является способ иммуноокрашивания изолированных тканей млекопитающих и их целых эмбрионов на ранних стадиях развития для конфокальной микроскопии. Способ включает подготовку материала, фиксацию в 2% параформальдегиде (ПФА) на фосфатном буфере в течение 20 мин на льду, промывку фосфатным буфером 3 раза по 10 мин на льду, дегидратацию 50% метанолом в течение 10 мин, а затем 100% метанолом 2 раза по 10 мин на льду, после чего проводят гидратацию материала, для чего материал обрабатывают последовательно 75 % метанолом, 50% метанолом и 2 раза фосфатным буфером, при этом продолжительность каждой обработки составляет 10 мин; блокируют неспецифическое связывание 0.2% обезжиренным сухим молоком с 1% бычьим сывороточным альбумином (БСА) и 0.3% Triton Х-100, приготовленными на фосфатном буфере, в течение 1 часа на льду; инкубацию с первичными антителами сывороткой или БСА, приготовленными на фосфатном буфере в течение ночи в холодной комнате при перемешивании, промывку фосфатным буфером с 0,4% Triton Х-100 и 1% обезжиренным молоком, при +4°С 3 раза по часу, затем ведут инкубацию с вторичными антителами фосфатным буфером с 0,4% Triton Х-100 и 1% обезжиренным молоком при +4°С в течение ночи, промывают фосфатным буфером с 0,4% Triton Х-100 и 1% обезжиренным молоком, при +4°С 3 раза по часу, после чего проводят дегидратацию биологического объекта, инкубируя объект в смеси метанола и фосфатного буфера в соотношении 50-50%, а затем выдерживают в течение 10 мин в 100% метаноле. После дегидратации материал подвергают оптическому просветлению путем химического обесцвечивания 2-3-х кратной обработкой раствором бензилового спирта (БС) и бензилбензоата (ББ) при соотношении 1:2, с последующим замещением на свежую смесь БС:ББ. Подготовленный материал анализируют конфокальной микроскопией с использованием z-стеков и 3D реконструкции (Yokomizo, T., Yamada-Inagawa, T., Yzaguirre, A. D., Chen, M. J., Speck, N. A., & Dzierzak, E. Whole-mount three-dimensional imaging of internally localized immunostained cells within mouse embryos. Nature protocols, 2012, 7(3), 421–431).
К недостаткам данного способа следует отнести:
- использование в качестве фиксатора 2% ПФА не позволяет повысить проницаемость мембран биологического образца на этапе фиксации;
- короткие по времени этапы отмывок фосфатным буфером не обеспечивают достаточное удаление первичных и вторичных антител из тканей и увеличивают неспецифический сигнал при детекции флуорохромов;
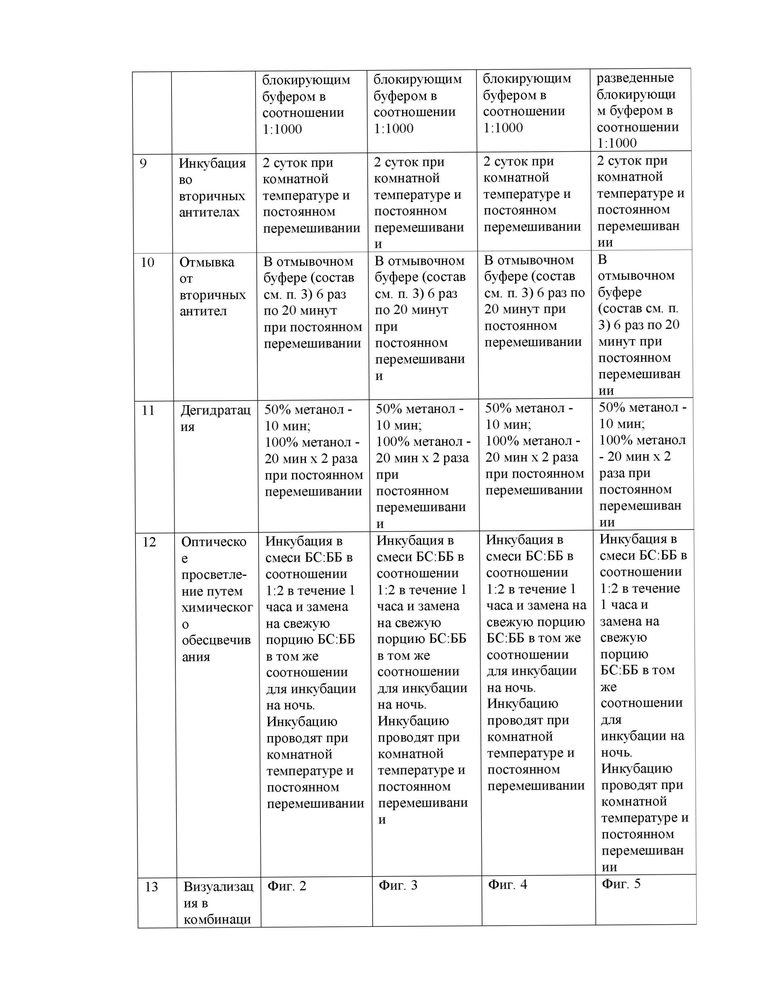
- низкий уровень блокирования неспецифического связывания антител, что также приводит появлению неспецифического сигнала при детекции флуорохромов, и, как следствие, может стать причиной искаженной или неточной интерпретации результатов.
- ограниченная проницаемость антител внутрь биологических тканей, на глубину свыше 150 мкм;
- короткий этап просветления биологического объекта, который не достаточен для полного химического обесцвечивания тканей и, как следствие, получение недостаточно четкого изображения при микроскопировании.
Задачей, на решение которой направлено заявляемое изобретение, является повышение качества визуализации клеток и тканей крупных биологических объектов, за счет облегчения проникновение антител в глубокие слои образца, при сохранении структуры тканей и специфики связывания, и обеспечения оптической прозрачности образца за счет его химического обесцвечивания для беспрепятственного проникновения лазерного луча в глубокие слои объекта.
Поставленная задача решается тем, что в известном методе иммуноокрашивания биологического материала для конфокальной микроскопии, включающим подготовку материала, фиксацию, удаление фиксатора, блокирование неспецифического связывания антител, инкубацию с первичными антителами в блокирующем буфере, отмывку от первичных антител, инкубацию с вторичными антителами в блокирующем буфере, отмывку от вторичных антител, дегидратацию, просветление и визуализацию объекта, согласно изобретению, в качестве блокирующего буфера используют фосфатный буфер, содержащий 0,1-1,0% неионного детергента, 20,0% диметилсульфоксида, 1,0% бычьего сывороточного альбумина, не более 10,0% овечьей сыворотки и 0.03% азида натрия, фиксацию проводят в растворе 4% параформальдегида с метанолом на фосфатном буфере в течение 5-6 часов при +4°С; удаление фиксатора ведут отмывочным буфером 3 раза по 20 мин при комнатной температуре; блокирование неспецифического связывания антител проводят в течение 12 часов блокирующим буфером при +4°С; инкубацию с первичными антителами в блокирующем буфере ведут в течение 5-7 суток при комнатной температуре и постоянном перемешивании, последующую отмывку от первичных антител ведут в отмывочном буфере, 6 раз по 20 мин, при комнатной температуре; инкубацию с вторичными антителами в блокирующем буфере проводят в течение 2 суток при комнатной температуре и постоянном перемешивании, отмывку от вторичных антител ведут 6 раз по 20 мин при комнатной температуре в отмывочном буфере; дегидратацию осуществляют инкубацией материала в 50% метаноле в течение 10 мин, а затем переносят в 100% метанол на 20 мин, с последующим замещением раствора на 100% свежий метанол и выдерживают не менее 20 мин при постоянном перемешивании; оптическое просветление путем химического обесцвечивания проводят инкубацией материала в смеси бензилового спирта и бензилбензоата в соотношении 1:2, в течение 1 часа при комнатной температуре, с дальнейшим замещением свежим раствором бензилового спирта и бензилбензоата в соотношении 1:2 и инкубируют в нем в течение ночи при постоянном перемешивании, после чего проводят визуализацию объекта.
Заявляемый способ позволяет, по сравнению с прототипом, значительно расширить круг исследуемых биологических материалов, в частности, он пригоден для исследования изолированных целых органов мелких лабораторных позвоночных животных, эмбрионов позвоночных животных, беспозвоночных животных целиком, но лишенных раковин или наружного скелета, размером до 6 см3.
Проведение фиксации в растворе 4% параформальдегида на фосфатном буфере, содержащим метанол, в течение 5-6 часов при +4°С повышает проникновение реактивов внутрь образца, обеспечивая повышение проницаемости мембран клеток с самых начальных этапов обработки, и, в конечном результате, приводит к повышению качества визуализации клеток и тканей крупных биологических объектов.
Целесообразно в качестве отмывочного буфера для удаления остатков фиксатора, первичных и вторичных антител использовать фосфатный буфер с добавлением неионных детергентов, сохраняющих структуру тканей в концентрациях от 0,1 до 1,0%. В качестве неионных детергентов, удовлетворяюших данному требованию, в практике известны только два детергента - Tween-20 или Triton X-100. К настоящему моменту в иммуногистохимии используются именно эти два соединения из семейства неионных (нейтральных) детергентов – Tween-20 и Triton X-100. Это связано с их низкой критической концентрацией мицеллообразования (ККМ), которые при 25°С составляют 0,06 мМ и 0,2 – 0,9 мМ, соответственно, и способностью разрушать белково-липидные, межлипидные, но не межбелковые взаимодействия, за счет чего сохраняется структура тканей и органов. Предложенный диапазон концентраций от 0,1 до 1,0% обусловлен тем, что концентрации ниже 0,1% не обеспечивает проникновение антител в глубокие слои образца более 100 мкм, а концентрации выше 1,0% могут привести к разрушению тканей.
Удаление фиксатора 3-кратной отмывкой по 20 мин. отмывочным буфером на основе фосфатного буфера с добавлением 0,1-1,0% неионного детергента при комнатной температуре обеспечивает более эффективное удаление фиксатора из глубоких слоев тканей и органов. Отмывка образца после фиксации очень важный этап, от которого зависит визуальная выраженность структур со специфическим окрашиванием. Плохо отмытый от фиксатора образец дает сильное фоновое свечение при микроскопировании, в результате чего, визуализация интересующих структур, становится более затруднительной, т.е. получаемое изображение нечеткое. Использование предложенного состава и режима отмывки материала на момент визуализации объекта в микроскопе, минимизирует фоновое свечение, и повышает качество визуализации интересующих структур.
Для достижения заявленного технического результата в качестве блокирующего буфера в заявленном способе предлагается использовать фосфатный буфер, содержащий 0,1-1,0% неионного детергента, 20,0% диметилсульфоксида, 1,0% бычьего сывороточного альбумина, не более 10,0% овечьей сыворотки и 0.03% азида натрия. Одновременное использование сочетанного действия двух блокирующих агентов: 1% бычьего сывороточного альбумина и не более чем 10% овечьей сыворотки, а также увеличение времени экспозиции (до 12 ч) при +4°С, способствует более полному «забиванию» мест неспецифического связывания, предотвращая их связывание с первичными и вторичными антителами, и, как следствие, получению более четких изображений, специфического окрашивания. Проникновение блокаторов в глубокие слои образца достигается не только присутствием неионного детергента (0,1-1,0%), но и добавлением в состав блокирующего буфера 20% ДМСО – пенетрирующего агента, способствующего переносу блокирующих веществ на глубину более 150 мкм. Предложенный состав блокирующего буфера при рекомендованных условиях экспозиции позволяет исключить неспецифическое окрашивание по всей глубине образца и в дальнейшем маркировать только структуры, представляющие научный интерес, и получать четкое изображение искомых структур.
Длительное инкубирование образца с антителами, разведенными в блокирующем буфере, содержащим детергент и ДМСО, способствует переносу антител в глубокие (более 150 мкм) слои образца. Увеличение времени экспозиции до 5-7 суток для первичных и до 2 суток для вторичных антител, при комнатной температуре при постоянном перемешивании, обеспечивает более надежное проникновение антител вглубь образца толщиной до 1 см. Предложенные условия инкубации дают возможность маркировать структуры, локализованные внутри изолированных тканей и органов мелких лабораторных животных, эмбрионов позвоночных животных, беспозвоночных животных целиком, но лишенных раковины или наружного скелета, значительно превышающие предел 150 мкм, не прибегая при этом к получению срезов.
Увеличение времени экспозиции биологического материала в смеси бензилового спирта и бензилбензоата (1:1) (на ночь), при проведении процедуры просветления способствует полному химическому обесцвечиванию образцов, после которого лазерный луч конфокального микроскопа проходит сквозь объект толщиной до 1 см. Благодаря этому, возможна детекция флуорохромов и получение изображения искомых структур, минуя трудоемкий процесс резки, обработки срезов, получения изображений с каждого из них и 3D реконструкции изображения.
Визуализацию объекта ведут с помощью конфокальной микроскопии в комбинации режимов Z–stack и TILE-scan.
Получение изображений с конфокального микроскопа посредством сочетания режимов Z–stack (z-стек) и TILE-scan (мозаичное сканирование) позволяет не только изучать структуры находящиеся в поле зрения ограниченном окуляром, но также смещать предметный столик с образцом. Это значительно расширяет обозреваемую площадь объекта, и, как следствие, позволяет делать 3D реконструкции больших участков.
Заявляемый способ иллюстрируется следующими фигурами:
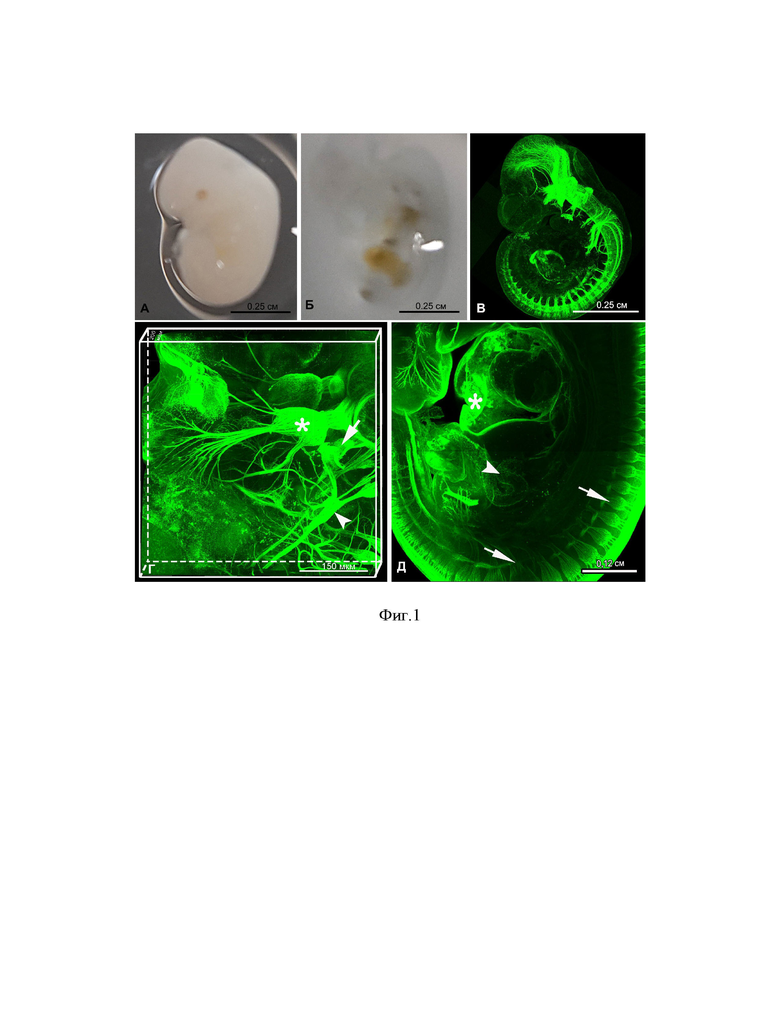
Фиг. 1. Этапы подготовки и визуализированная нервная система эмбриона мыши Mus musculus (12 суток после оплодотворения), где - (А) эмбрион до оптического просветления, (Б) эмбрионы после оптического просветления в смеси бензилового спирта и бензилбензоата, (В) детектированная нейрональными антителами Tuj1, эмбриональная нервная система, (Г) большое увеличение тройничного (звездочка), слухового (стрелка) и языкоглоточного (наконечник) ганглиев в головной части эмбриона, (Д) большое увеличение туловищной части эмбриона, демонстрирующее спинной мозг (стрелка), сердце (звездочка), кишечник (наконечник) и пр. Примерная глубина залегания структур: тройничный ганглий 0,5 и 1,5 мм (т.к. они на иллюстрации парные), слуховой на 1,0 мм глубины, языкоглоточный – 1,5 мм, спинной мозг 0,1-1,9 мм, сердце 1,0 мм, кишечник – 1,2 мм.
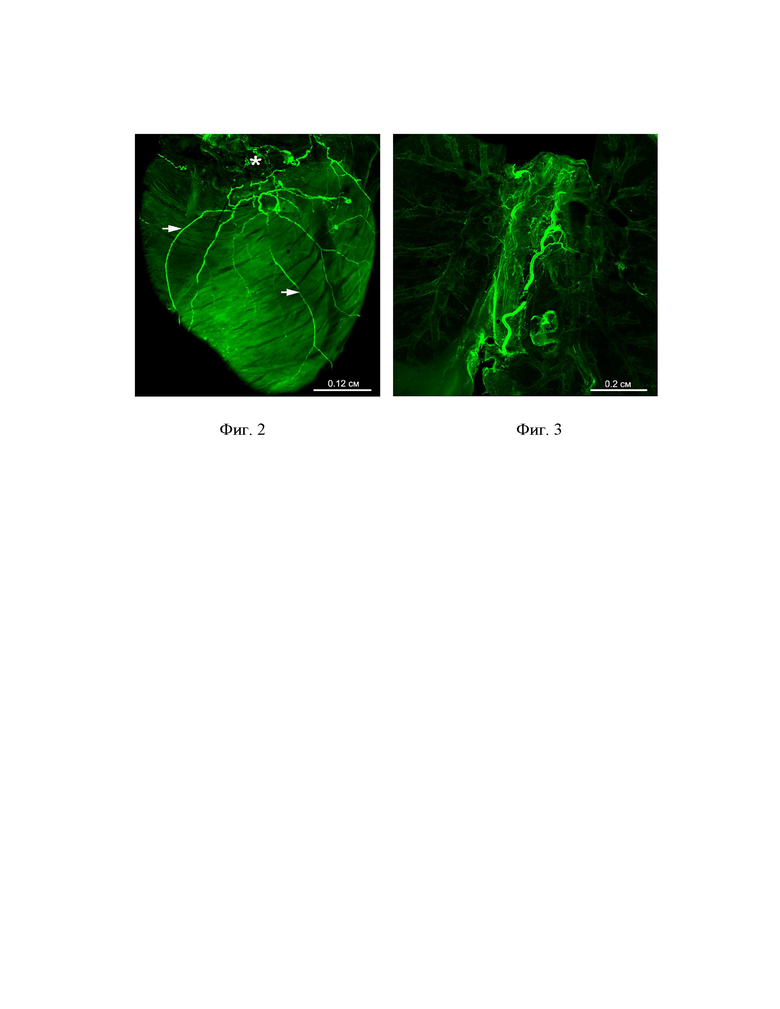
Фиг. 2. Детекция нейронального тубулина (Tuj1) в сердце взрослой мыши Mus musculus. Максимальная проекция поверхностных (стрелки) и глубинных (звездочка) нейрональных структур. Глубина залегания обозначенных звездочкой структур более 600 мкм.
Фиг. 3. Детекция нейронального тубулина (Tuj1) в легких и трахее взрослой мыши Mus musculus. Глубина залегания структур 1 мм.
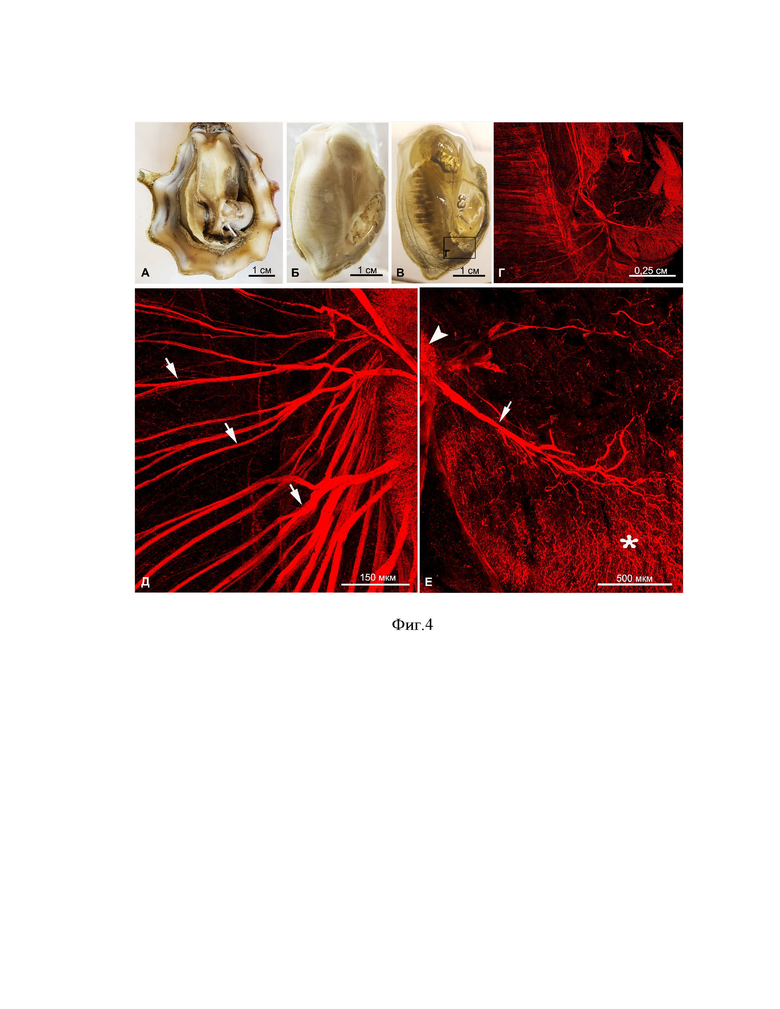
Фиг. 4. Этапы подготовки и визуализированные FMRF-амид-ергические элементы нервной системы тихоокеанской устрицы Crassostrea gigas, где - (А) устрица с одной удаленной створкой, (Б) мягкое тело устрицы извлеченное из раковины до процесса оптического просветления, (В) после оптического просветления в смеси БС:ББ, (Г) фрагмент нервной системы (участок отмечен рамкой на фиг. В), детектированный с помощью антител против FMRF-амида, (Д) большое увеличение паллиальных нервов (стрелки), иннервирующих мантию, (Е) большое увеличение ветви (стрелка) висцерального ганглия (наконечник), иннервирующей аддуктор (звездочка). Глубина залегания висцерального ганглия 5 мм.
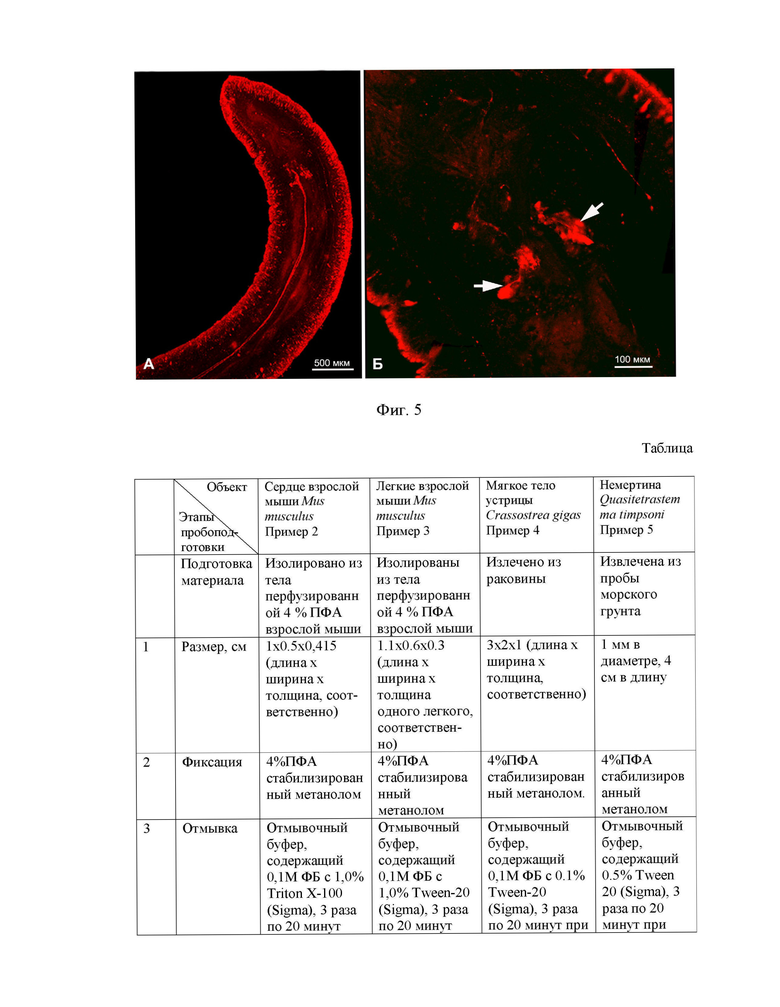
Фиг. 5. Визуализация серотонинергических элементов нервной системы немертины Quasitetrastemma timpsoni, где - (А) общий вид головного конца червя. (Б) Большое увеличение мозга (ганглия) (стрелки). Глубина залегания структуры 500 мкм.
Табл. Характеристика образцов и описание особенностей пробоподготовки материала (см. в графической части).
Способ осуществляют следующим образом.
Пример 1. В качестве объекта выбраны эмбрионы мыши Mus musculus, на сроке 12 суток после оплодотворения.
Подготовка материала. Размер извлеченных эмбрионов составляет примерно 0.5×0.5×0.25 см (длина × ширина × толщина, соответственно), объемом 0.06 см3. Эмбрионы фиксируют в 4,0% ПФА стабилизированным метанолом, 5 часов при +4°С. Далее материал отмывают от фиксатора в отмывочном буфере, содержащем 0,1М ФБ с 0.1% Triton X-100 (Sigma), 3 раза по 20 минут при комнатной температуре при перемешивании. Блокирование проводят инкубацией в блокирующем буфере, содержащем 0.1% Triton X-100, 20% ДМСО, 1,0% БСА, 5% овечью сыворотку, 0,03% азида натрия в 0,1М фосфатном буфере, в течении 12 часов при температуре +4°С. После этого эмбрионы инкубируют в первичных мышиных моноклональных антителах против нейронального тубулина Tuj1 (Promega) с разведением в блокирующем буфере 1:500, в течение 5 суток при комнатной температуре и постоянном перемешивании. После инкубации материал промывают отмывочным буфером 6 раз по 20 минут при постоянном перемешивании. Затем инкубируют во вторичных антителах против мыши, меченных флуорохромом Alexa 488 (Molecular Probes), разведенных блокирующим буфером в соотношении 1:1000, в течение 2 суток при комнатной температуре и постоянном перемешивании. По окончании инкубации эмбрионы отмывают от вторичных антител отмывочным буфером 6 раз по 20 минут при постоянном перемешивании. Далее, для процесса дегидратации материал помещают в 50% метанол на 10 мин, а затем в 100% метанол на 20 мин. После этого, 100% метанол замещают его свежей порцией вторично и выдерживают еще 20 мин. После дегидратации материал подвергают оптическому просветлению путем химического обесцвечивания в смеси бензилового спирта (БС) и бензил бензоата (ББ). Для этого замещают 100% метанол на смесь БС:ББ в соотношении 1:2 в течение 1 часа, после чего замещают свежей порцией БС:ББ в том же соотношении для инкубации на ночь. Инкубацию проводят при комнатной температуре и постоянном перемешивании. Визуальные отличия в степени прозрачности эмбрионов продемонстрированы на Фиг. 1, где – (А) эмбрионы до процесса просветления, а (Б) – после ночной инкубации в смеси БС:ББ. Для изучения эмбрионов в микроскопе, подготовленный материал помещают в чашки Петри со стеклянным дном (MackTek) и добавляют БС-ББ раствора столько, чтобы материал был покрыт им. Далее, используя инвертированный конфокальный микроскоп в режимах сканирования Z-stack и TILE-scan, сканируют весь эмбрион в разрешении, необходимом для детектирования нервных отростков. Файлы сохраняют и просматривают в 3D, используя программы ImageJ или IMARIS. Результаты сканирования эмбриона, иллюстрирующие наличие нейронального тубулина, представлены на Фиг. 1 (В, Г, Д).
Примеры 2-5 процедурно выполняют аналогично примеру 1, только берут различные биологические объекты и используют конкретные режимные параметры.
Данные по режимным параметрам и результаты для наглядности представлены в таблице.
Как следует из приведенных примеров и фигур заявляемый метод позволяет без труда визуализировать тканевые структуры, залегающие на глубине более 150 мкм, в отдельных органах и эмбрионах мелких позвоночных животных (мыши, крысы, амфибии, рептилии, рыбы), и в целых (нефрагментированных) беспозвоночных животных (немертины, моллюски) с параметрами глубины до 1 см и объемом до 6 см3, что ранее сделано не было.
В качестве биологического материала могут быть использованы и другие таксономические группы животных. Данный факт следует отнести к преимуществам предложенного метода, позволяющего адаптировать его для разных биологических объектов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПТИЧЕСКОГО ПРОСВЕТЛЕНИЯ ОБРАЗЦОВ БИОЛОГИЧЕСКИХ ТКАНЕЙ | 2009 |
|
RU2429462C2 |
| СПОСОБ ИММУНОГИСТОХИМИЧЕСКОГО ОКРАШИВАНИЯ ТОТАЛЬНЫХ ПРЕПАРАТОВ ОБРАЗЦОВ БИОЛОГИЧЕСКИХ ТКАНЕЙ (ВАРИАНТЫ) | 2013 |
|
RU2563679C2 |
| СПОСОБ ОКРАШИВАНИЯ ПРЕПАРАТОВ ЦЕЛЬНЫХ БИОЛОГИЧЕСКИХ ТКАНЕЙ И ОРГАНОВ МЕТОДОМ КЛИК-ГИСТОХИМИИ (ВАРИАНТЫ) | 2016 |
|
RU2620559C1 |
| СПОСОБ ВЫЯВЛЕНИЯ БЕЛКОВ В РАЗНЫХ ТИПАХ КЛЕТОК МЛЕКОПИТАЮЩИХ И ЧЕЛОВЕКА С ПОМОЩЬЮ ФЛУОРЕСЦЕИН-5-ИЗОТИОЦИАНАТА НА МИКРОСКОПИЧЕСКОМ УРОВНЕ | 2013 |
|
RU2547594C2 |
| СПОСОБ МНОГОПРОФИЛЬНОГО ИММУНОХИМИЧЕСКОГО ВЫЯВЛЕНИЯ АНТИГЕНОВ В ЖИДКИХ ОБРАЗЦАХ | 2003 |
|
RU2296995C2 |
| СПОСОБ ИССЛЕДОВАНИЯ КЛЕТОК С ПОМОЩЬЮ БИОЧИПА | 2009 |
|
RU2433175C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ЦЕЛЕВОГО БЕЛКА БЕЗ ПРИМЕСИ ПРИОНОВОГО БЕЛКА PrP | 2008 |
|
RU2491292C2 |
| СПОСОБ ДИАГНОСТИКИ ОПИЙНОЙ НАРКОМАНИИ И ЕЕ ДЛИТЕЛЬНОСТИ | 2002 |
|
RU2221251C1 |
| Способ комбинированного выявления клеток Купфера и коллагеновых волокон соединительной ткани на гистологических препаратах печени человека | 2024 |
|
RU2841222C1 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |

Изобретение относится к улучшенному методу иммуноокрашивания биологического материала для использования в конфокальной микроскопии. Метод включает подготовку материала, фиксацию, удаление фиксатора, блокирование неспецифического связывания антител, инкубацию с первичными антителами в блокирующем буфере, отмывку от первичных антител, инкубацию с вторичными антителами в блокирующем буфере, отмывку от вторичных антител, дегидратацию, просветление и визуализацию объекта, согласно изобретению. В качестве блокирующего буфера используют фосфатный буфер, содержащий 0,1-1,0% неионного детергента, 20,0% диметилсульфоксида, 1,0% бычьего сывороточного альбумина, не более 10,0% овечьей сыворотки и 0.03% азида натрия. В качестве неионных детергентов используют Tween-20 или Triton X-100. Фиксацию проводят в растворе 4% параформальдегида с метанолом на фосфатном буфере в течение 5-6 часов при +4°С; удаление фиксатора ведут отмывочным буфером 3 раза по 20 мин при комнатной температуре; блокирование неспецифического связывания антител проводят в течение 12 часов блокирующим буфером при +4°С; инкубацию с первичными антителами в блокирующем буфере ведут в течение 5-7 суток при комнатной температуре и постоянном перемешивании, последующую отмывку от первичных антител ведут в отмывочном буфере, 6 раз по 20 мин, при комнатной температуре; инкубацию с вторичными антителами в блокирующем буфере проводят в течение 2 суток при комнатной температуре и постоянном перемешивании, отмывку от вторичных антител ведут 6 раз по 20 мин при комнатной температуре в отмывочном буфере. Удаление фиксатора, отмывку от первичных и вторичных антител, как правило, ведут отмывочным буфером, содержащим фосфатный буфер с добавлением неионных детергентов, сохраняющих структуру тканей, в концентрациях от 0,1 до 1,0%. Дегидратацию осуществляют инкубацией материала в 50% метаноле в течение 10 мин, а затем переносят в 100% метанол на 20 мин, с последующим замещением раствора на 100% свежий метанол и выдерживают не менее 20 мин при постоянном перемешивании; оптическое просветление путем химического обесцвечивания проводят инкубацией материала в смеси бензилового спирта и бензилбензоата в соотношении 1:2, в течение 1 часа при комнатной температуре, с дальнейшим замещением свежим раствором бензилового спирта и бензилбензоата в соотношении 1:2 и инкубируют в нем в течение ночи при постоянном перемешивании, после чего проводят визуализацию объекта. Визуализацию объекта обычно ведут с помощью конфокальной микроскопии в комбинации режимов Z-stack и TILE-scan. Состав блокирующего буфера в предлагаемых условиях экспозиции позволяет исключить неспецифическое окрашивание по всей глубине образца, маркировать только определенные структуры, и получать их четкое изображение. Метод позволяет без труда визуализировать тканевые структуры, залегающие на глубине более 150 мкм, что является преимуществом метода, позволяющего адаптировать его для разных биологических объектов и значительно расширить круг исследуемых биологических материалов размером до 6 см3. 4 з.п. ф-лы, 5 ил., 1 табл., 5 пр.
1. Метод иммуноокрашивания биологического материала для конфокальной микроскопии, включающий подготовку биологического материала, фиксацию, удаление фиксатора, блокирование неспецифического связывания антител, инкубацию с первичными антителами в блокирующем буфере, отмывку от первичных антител, инкубацию с вторичными антителами в блокирующем буфере, отмывку от вторичных антител, дегидратацию, просветление и визуализацию, отличающийся тем, что в качестве блокирующего буфера используют фосфатный буфер, содержащий 0,1-1,0% неионного детергента, 20,0% диметилсульфоксида, 1,0% бычьего сывороточного альбумина, не более 10,0% овечьей сыворотки и 0,03% азида натрия; фиксацию проводят в растворе 4,0% параформальдегида с метанолом на фосфатном буфере в течение 5-6 часов при +4°С, отмывку фиксатора ведут отмывочным буфером три раза по 20 мин при комнатной температуре; блокирование неспецифического связывания антител проводят в течение 12 часов блокирующим буфером при +4°С; инкубацию с первичными антителами в блокирующем буфере ведут в течение 5-7 суток при комнатной температуре и постоянном перемешивании, последующую отмывку ведут в отмывочном буфере шесть раз по 20 мин при комнатной температуре; инкубацию с вторичными антителами в блокирующем буфере проводят в течение 2-х суток при комнатной температуре и постоянном перемешивании, отмывку от вторичных антител ведут шесть раз по 20 мин при комнатной температуре отмывочным буфером; дегидратацию осуществляют инкубацией материала в 50% метаноле в течение 10 мин, а затем переносят в 100% метанол на 20 мин, с последующим замещением раствора на 100% свежий метанол и выдерживают не менее 20 мин при постоянном перемешивании; оптическое просветление путем химического обесцвечивания проводят инкубацией материала в смеси бензилового спирта и бензилбензоата в соотношении 1:2, в течение 1 часа при комнатной температуре, с дальнейшим замещением свежим раствором бензилового спирта и бензилбензоата в соотношении 1:2 и инкубируют в нем в течение ночи при постоянном перемешивании, после чего проводят визуализацию объекта.
2. Метод по п. 1, отличающийся тем, что в качестве биологического материала используют, в частности, изолированные целые органы мелких лабораторных позвоночных животных, эмбрионы позвоночных животных, беспозвоночные животные целиком, но лишенные раковин или наружного скелета, размером до 6,0 см3.
3. Метод по п. 1, отличающийся тем, что удаление фиксатора, отмывку от первичных и вторичных антител ведут отмывочным буфером, содержащим фосфатный буфер с добавлением неионных детергентов, сохраняющих структуру тканей, в концентрациях от 0,1 до 1,0%.
4. Метод по п. 3, отличающийся тем, что в качестве неионных детергентов используют Tween-20 или Triton X-100.
5. Метод по п. 1, отличающийся тем, что визуализацию объекта ведут с помощью конфокальной микроскопии в комбинации режимов Z-stack и TILE-scan.
| WO 2017133746 A2, 15.11.2018 & RU 2018131560 | |||
| ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ ПРОТИВ ВИРУСА ВЕТРЯНОЙ ОСПЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2011 |
|
RU2633058C2 |
| Garcia-Porrero, J | |||
| A | |||
| et al., Antigenic profiles of endothelial and hemopoietic lineages in murine intraembryonic hemogenic sites | |||
| Developmental & Comparative Immunology, 1998, 22(3), 303-319 | |||
| Kumar, M | |||
| et al., Organ Culture and Whole Mount Immunofluorescence Staining of Mouse Wolffian Ducts | |||
| JQVE, Journal of Visualized Experiments, 2017, (119), страницы 1-6 | |||
| Yokomizo, T | |||
| et al., Whole-mount three-dimensional imaging of internally localized immunostained cells within mouse embryos | |||
| Nature Protocols, 2012, 7(3), 421-431 | |||
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2014 |
|
RU2667644C2 |
Авторы
Даты
2019-09-17—Публикация
2019-05-20—Подача