ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Родственные заявки отсутствуют.
ЗАЯВЛЕНИЕ В ОТНОШЕНИИ ФИНАНСИРУЕМЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИЙ И РАЗРАБОТОК
[0002] Данное изобретение было осуществлено без государственной поддержки.
ВКЛЮЧЕНИЕ ПУТЕМ ССЫЛКИ МАТЕРИАЛА, ПРЕДСТАВЛЕННОГО В ЭЛЕКТРОННОМ ВИДЕ
[0003] Отсутствует
ЗАЯВЛЕНИЕ В ОТНОШЕНИИ ПРЕДШЕСТВУЮЩИХ РАСКРЫТИЙ АВТОРА ИЛИ СОАВТОРА
[0004] Предшествующие раскрытия данного изобретения отсутствуют.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0005] Настоящее изобретение в целом относится к применению соединений для лечения различных нарушений, заболеваний и патологических состояний и более определенно к применению замещенных производных пиримидина для модулирования протеинкиназ и для лечения заболеваний, опосредованных протеинкиназами.
УРОВЕНЬ ТЕХНИКИ
[0006] Протеинкиназы представляют собой большое семейство структурно родственных ферментов, которые отвечают за контроль различных процессов сигнальной трансдукции в клетке. Протеинкиназы, содержащие подобный 250-300 аминокислотный каталитический домен, катализируют фосфорилирование белка-мишени субстратов.
[0007] Киназы могут быть классифицированы на семейства по субстратам, которые они фосфорилируют (например, протеин-тирозин, протеин-серин/треонин, липиды и т.д.). Фосфорилирование тирозина является центральным явлением в регуляции различных биологических процессов, таких как пролиферация, миграция, дифференцировка и выживание клеток. Некоторые семейства рецепторных и нерецепторных тирозинкиназ контролируют данные явления, катализируя перенос фосфата от АТФ к остатку тирозина определенных белков-мишеней клетки. Были идентифицированы мотивы последовательностей, которые, как правило, соответствуют каждому из данных семейств киназ (Hanks et al., FASEB J., (1995), 9, 576-596; Knighton et al., Science, (1991), 253, 407-414; Garcia-Bustos et al., EMBO J., (1994),13:2352-2361). Примеры киназ в семействе протеинкиназ включают, но не ограничиваются ими, abl, Akt, bcr-abl, Blk, Brk, Btk, c-kit, c-Met, c-src, c-fms, CDK1, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK8, CDK9, CDK10, cRaf1, CSF1R, CSK, EGFR, ErbB2, ErbB3, ErbB4, Erk, Fak, fes, FGFR1, FGFR2, FGFR3, FGFR4, FGFR5, Fgr, flt-1, Fps, Frk, Fyn, Hck, IGF-1R, INS-R, Jak, KDR, Lck, Lyn, MEK, p38, PDGFR, PIK, PKC, PYK2, ros, Tie, Tie-2, TRK, Yes и Zap70.
[0008] Исследования показали, что протеинкиназы играют центральную роль в регулировании и поддержании широкого спектра клеточных процессов и клеточных функций. Например, активность киназы действует как молекулярные переключатели, регулирующие пролиферацию, активацию и/или дифференцировку клеток. Неконтролируемая или избыточная активность киназы наблюдалась при многих болезненных состояниях, включая доброкачественные и злокачественные нарушения пролиферации, также как заболевания, возникающие в результате несоответствующей активации иммунной системы (аутоиммунные нарушения), отторжения аллотрансплантата, и реакции «трансплантат против хозяина».
[0009] Сообщается, что многие заболевания связаны с аномальными клеточными ответами, запускаемыми событиями, опосредованными протеинкиназами. Данные заболевания включают аутоиммунные заболевания, воспалительные заболевания, заболевания костей, метаболические заболевания, неврологические и нейродегенеративные заболевания, рак, сердечно-сосудистые заболевания, аллергии и астму, болезнь Альцгеймера и связанные с гормонами заболевания. Кроме того, специфические рецепторы эндотелиальных клеток РТКs, такие как VEGF-2 и Tie-2, опосредуют ангиогенный процесс и вовлечены в поддержку прогрессирования рака и других заболеваний, связанных с неконтролируемой васкуляризацией. Соответственно, в медицинской химии проводится интенсивный поиск ингибиторов протеинкиназ, которые являются эффективными в качестве терапевтических средств.
[0010] Многие виды рака характеризуются нарушениями в клеточных сигнальных путях, которые приводят к неконтролируемому росту и пролиферации раковых клеток. Рецепторные тирозинкиназы (RTKs) играют важную роль в данных сигнальных путях, передавая внеклеточные молекулярные сигналы в цитоплазму и/или ядро клетки. RTKs представляют собой трансмембранные белки, которые обычно включают внеклеточный лиганд-связывающий домен, трансмембранный домен и каталитический цитоплазматический домен тирозинкиназы. Полагают, что связывание лиганда с внеклеточной частью способствует димеризации, приводя к транс-фосфорилированию и активации внутриклеточного домена тирозинкиназы (Schlessinger et al. Neuron 1992;9:383-391).
[0011] Учитывая отсутствие доступных в настоящее время вариантов лечения большинства состояний, связанных с протеинкиназами, по-прежнему существует большая потребность в новых терапевтических средствах, которые ингибируют данные белковые мишени.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
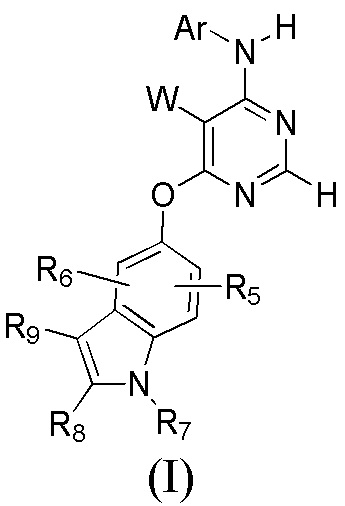
[0012] Соответственно, целью настоящего изобретения является предоставление противоопухолевого средства, содержащего замещенные производные пиримидина, как описано в формуле (I), их фармацевтически приемлемые составы, способов получения новых соединений и композиций для применения соединений. Соединения и композиции, содержащие соединения формулы (I), пригодны при лечении различных заболеваний.
[0013] Комбинированная терапия, описанная в настоящей заявке, может быть обеспечена путем получения замещенных производных пиримидина формулы (I) и другого терапевтического агента в виде отдельных фармацевтических составов с последующим их введением пациенту одновременно, частично одновременно, отдельно или через равные интервалы.
[0014] Настоящее изобретение относится к способам применения определенных химических соединений, таких как ингибиторы киназы для лечения различных заболеваний, нарушений и патологий, например, рака и сосудистых нарушений, таких как инфаркт миокарда (ИМ), инсульт или ишемия. Соединения, описанные в данном изобретении, могут блокировать ферментативную активность некоторых или многих членов семейства FGFR-киназ в дополнение к блокированию активности других рецепторных и нерецепторных киназ. Такие соединения могут быть эффективными для лечения заболеваний, в которых нарушения влияют на подвижность клеток, адгезию и прогрессию клеточного цикла, и кроме того заболеваний, связанных с гипоксическими состояниями, остеопорозом и состояними, которые возникают или связаны с увеличением проницаемости сосудов, воспалением или респираторным дистрессом, ростом опухоли, инвазией, ангиогенезом, метастазами и апоптозом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0015] Настоящее изобретение относится к соединениям, имеющим общую Формулу (I)
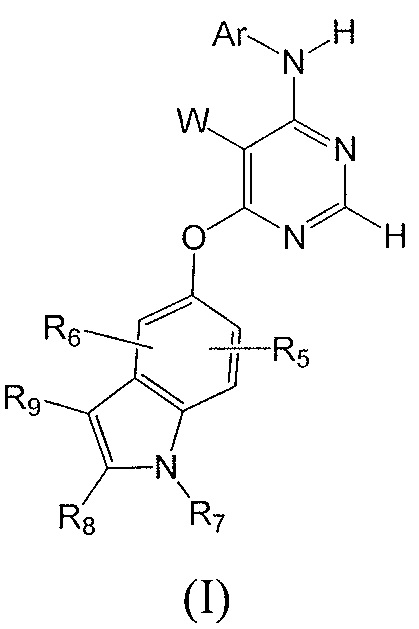
или их фармацевтически приемлемым солям, в которой:
[0016] W выбирают из: F, Cl, Br, I, CN, C1-C4алкила, C1-C6алкокси, C2-C6алкенила, CF3, CF2H, CFH2, C2-C6алкинила, CON(R1)R2.
[0017] R1 и R2 представляют собой водород, алкил, циклоалкил, алкенил, алкинил, алкилтио, арил, арилалкил.
[0018] Ar представляет собой гетероарил или арил, каждый из которых замещен от 0 до 4 заместителями, независимо выбранными из:
(1) галогена, гидрокси, амино, амида, циано, -COOH, -SO2NH2, оксо, нитро и алкоксикарбонила; и
(2) NR1
(3) групп формулы (Ia):
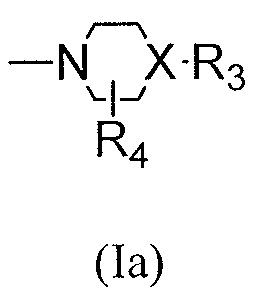
в которой:
R4 представляет собой водород, C1-C4алкил, оксо;
X представляет собой СН, когда R3 представляет собой водород; или X-R3 представляет собой O; или Х представляет собой N, R3 представляет собой группы водорода, С1-С6алкила, С2-С6алкенила, С2-С6алкинила, С3-С10арила или гетероарила, (С3-С7циклоалкил)C1-C4алкила, C1-C6галогеналкила, C1-C6алкокси, C1-C6алкилтио, C2-C6алканоила, C1-C6алкоксикарбонила, C2-C6алканоилокси, моно- и ди-(С3-С8циклоалкил)аминоC0-C4алкила, (4-7-членного гетероцикла)C0-C4алкила, C1-C6алкилсульфонила, моно- и ди-(C1-C6алкил)сульфонамидо и моно- и ди-(C1-C6алкил)аминокарбонила, каждый из которых замещен от 0 до 4 заместителями, независимо выбранными из галогена, гидрокси, циано, амино, -СООН и оксо.
R5 и R6 независимо выбраны из: водорода, F, Cl, Br, CN, C1-C4алкила, C1-C6алкокси.
R7, R8 и R9 независимо выбраны из водорода, C1-C4алкила, C2-C6алкенила, C2-C6алкинила, C3-C10арила или гетероарила, С1-С6алкокси, С1-С6алкилтио, С2-С6алканоила, С1-С6алкоксикарбонила, C2-C6алканоилокси.
[0019] Термин «гало» или «галоген» относится к фтору, хлору, брому или иоду.
[0020] Термин «алкил» в настоящем описании отдельно или как часть другой группы относится к одновалентному полученному из алкана (углеводорода) радикалу, содержащему от 1 до 12 атомов углерода, если не указано иначе. Алкильные группы могут быть замещены в любой доступной точке прикрепления. Алкильная группа, замещенная другой алкильной группой, также упоминается как «разветвленная алкильная группа». Типичные алкильные группы включают метил, этил, пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил, изогексил, гептил, диметилпентил, октил, 2,2,4-триметилпентил, нонил, децил, ундецил, додецил; и подобные. Типичные заместители включают, но не ограничиваются ими, одну или более из следующих групп: алкил, арил, галоген (такой как F, Cl, Br, I), галогеналкил (такой как CCl3 или CF3), алкокси, алкилтио, гидрокси, карбокси (-COOH), алкилоксикарбонил (-C(O)R), алкилкарбонилокси (-OCOR), амино (-NH2), карбамоил (NHCOOR- или -OCONHR-), мочевину (-NHCONHR-) или тиол (-SH). В некоторых предпочтительных вариантах осуществления настоящего изобретения алкильные группы замещены, например, амино, гетероциклоалкильными, такими как морфолин, пиперазин, пиперидин, азетидин, гидроксил, метокси или гетероарильными группами, такими как пирролидин.
[0021] Термин «циклоалкил» в настоящем описании отдельно или как часть другой группы относится к полностью насыщенным и частично ненасыщенным углеводородным кольцам от 3 до 9, предпочтительно от 3 до 7 атомов углерода. Примеры включают циклопропил, циклобутил, циклопентил, и циклогексил, и подобные. Кроме того, циклоалкил может быть замещенным. Замещенный циклоалкил относится к таким кольцам, содержащим один, два или три заместителя, выбранных из группы, состоящей из галогена, алкила, замещенного алкила, алкенила, алкинила, нитро, циано, оксо (=O), гидрокси, алкокси, тиоалкила, -СО2Н, -С(=O)Н, СО2-алкила, -С(=O)алкила, кето, =N-OH, =N-O-алкила, арила, гетероарила, гетероцикло, -NR'R", -С(=O)NR'R", -CO2NR'R", -C(=O)NR'R", -NR'CO2R", -NR'C(=O)R", -SO2NR'R" и -NR'SO2R", в которой каждый из R' и R" независимо выбраны из водорода, алкила, замещенного алкила и циклоалкила или R' и R" вместе образуют гетероциклическое или гетероарильное кольцо.
[0022] Термин «алкенил» в настоящем описании отдельно или как часть другой группы относится к углеводородному радикалу, прямому, разветвленному или циклическому, содержащему от 2 до 12 атомов углерода и, по меньшей мере, один углерод в углеродной двойной связи. Примеры таких групп включают винил, аллил, 1-пропенил, изопропенил, 2-метил-1-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-гептенил и подобные. Алкенильные группы могут быть также замещены в любой доступной точке присоединения. Типичные заместители для алкенильных групп включают заместители, перечисленные выше для алкильных групп, и в частности включают C3-C7-циклоалкильные группы, такие как циклопропил, циклопентил и циклогексил, которые могут быть дополнительно замещены, например, амино, оксо, гидроксилом и т.д.
[0023] Термин «алкинил» относится к алкиновым группам с прямой или разветвленной цепью, которые имеют одну или более ненасыщенных углерод-углеродных связей, по меньшей мере, одна из которых представляет собой тройную связь. Алкинильные группы включают C2-C8алкинильные, C2-C6алкинильные и С2-С4алкинильные группы, которые имеют от 2 до 8, от 2 до 6 или от 2 до 4 атомов углерода соответственно. Типичные алкинильные группы включают этенил, пропенил, изопропенил, бутенил, изобутенил, пентенил и гексенил. Алкинильные группы могут быть также замещены в любой доступной точке присоединения. Типичные заместители для алкинильных групп включают заместители, перечисленные выше для алкильных групп, такие как амино, алкиламино и т.д. Цифры в индексе после символа «С» определяют количество атомов углерода, которое может содержать определенная группа.
[0024] Термин «алкокси» отдельно или как часть другой группы обозначает алкильную группу, как описано выше, связанную через кислородную связь (-O-). Предпочтительные алкоксигруппы имеют от 1 до 8 атомов углерода. Примеры таких групп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси, н-гексилокси, циклогексилокси, н-гептилокси, н-октилокси и 2-этилгексилокси.
[0025] Термин «алкилтио» относится к алкильной группе, как описано выше, присоединенной через серный мост. Предпочтительными алкокси и алкилтиогруппами являются группы, в которых алкильная группа присоединена через гетероатомный мост. Предпочтительные алкилтиогруппы имеют от 1 до 8 атомов углерода. Примеры таких групп включают метилтио, этилтио, н-пропилтиол, н-бутилтиол и подобные.
[0026] Используемый в настоящем описании термин «оксо» относится к кето (C=O) группе. Оксогруппа, которая является заместителем неароматического атома углерода, приводит к превращению -CH2- в -C(=O)-.
[0027] Термин «алкоксикарбонил» в настоящем описании отдельно или как часть другой группы обозначает алкоксигруппу, связанную через карбонильную группу. Алкоксикарбонильный радикал представлен формулой: -C(O)OR, в которой R-группа представляет собой прямую или разветвленную C1-C6алкильную группу, циклоалкил, арил или гетероарил.
[0028] Термин «арилалкил» в настоящем описании отдельно или как часть другой группы обозначает ароматическое кольцо, связанное через алкильную группу (такую как бензил), как описано выше.
[0029] Термин «арил» в настоящем описании отдельно или как часть другой группы относится к моноциклическим или бициклическим ароматическим кольцам, например, фенилу, замещенному фенилу и подобному, также как группам, которые являются конденсированными, например, нафтилу, фенантренилу и подобным. Таким образом, арильная группа содержит, по меньшей мере, одно кольцо, имеющее, по меньшей мере, 6 атомов, причем до пяти таких колец присутствуют, содержащих до 20 атомов в нем, с чередованием (резонированием) двойных связей между соседними атомами углерода или подходящими гетероатомами. Арильные группы необязательно могут быть замещены одной или более группами, включая, но не ограничиваясь ими, галоген, такой как I, Br, F или Cl; алкил, такой как метил, этил, пропил, алкокси, такой как метокси или этокси, гидрокси, карбокси, карбамоил, алкилоксикарбонил, нитро, алкенилокси, трифторметил, амино, циклоалкил, арил, гетероарил, циано, алкил S(O)m (m=0, 1, 2) или тиол.
[0030] Термин «ароматический» относится к циклически конъюгированной молекулярной структуре со стабильностью вследствие делокализации значительно больше, чем гипотетически локализованной структуры, такой как структура Кекуле.
[0031] Термин «амино» в данном описании отдельно или как часть другой группы относится к -NH2. «Амино» может быть необязательно замещен одним или двумя заместителями, которые могут быть одинаковыми или различными, такими как алкил, арил, арилалкил, алкенил, алкинил, гетероарил, гетероарилалкил, циклогетероалкил, циклогетероалкилалкил, циклоалкил, циклоалкилалкил, галогеналкил, гидроксиалкил, алкоксиалкил, тиоалкил, карбонил или карбоксил. Данные заместители могут быть дополнительно замещены карбоновой кислотой, любым из алкильных или арильных заместителей, изложенных в данном описании. В некоторых вариантах осуществления аминогруппы замещены карбоксилом или карбонилом с образованием N-ацил или N-карбамоилпроизводных.
[0032] Термин «алкилсульфонил» относится к группам формулы (SO2)-алкил, в которых атом серы является точкой присоединения. Предпочтительно, алкилсульфонильные группы включают C1-C6алкилсульфонильные группы, которые имеют от 1 до 6 атомов углерода. Метилсульфонил является одной типичной алкилсульфонильной группой.
[0033] Термин «гетероатом» относится к любому атому, кроме углерода, например, N, O или S.
[0034] Термин «гетероарил» в данном описании отдельно или как часть другой группы относится к замещенным и незамещенным ароматическим 5- или 6-членным моноциклическим группам, 9- или 10-членным бициклическим группам и 11-14-членным трициклическим группам, которые содержат, по меньшей мере, один гетероатом (O, S или N), по меньшей мере, в одном из колец. Каждое кольцо гетероарильной группы, содержащее гетероатом, может содержать один или два атома кислорода или серы и/или от одного до четырех атомов азота при условии, что общее число гетероатомов в каждом кольце составляет четыре или менее и каждое кольцо содержит, по меньшей мере, один атом углерода.
[0035] Термин «гетероцикл» или «гетероциклоалкил» в данном описании отдельно или как часть другой группы относится к циклоалкильной группе (неароматической), в которой один из атомов углерода в кольце замещен гетероатомом, выбранным из O, S или N. «Гетероцикл» имеет от 1 до 3 конденсированных, боковых или спироколец, по меньшей мере, одно из которых является гетероциклическим кольцом (то есть один или более кольцевых атомов являются гетероатомами, причем остальные кольцевые атомы представляют собой углерод). Гетероциклическое кольцо может быть необязательно замещенным, что означает, что гетероциклическое кольцо может быть замещено в одном или более замещаемых положениях кольца одной или более группами, независимо выбранными из алкила (предпочтительно, низшего алкила), гетероциклоалкила, гетероарила, алкокси (предпочтительно, низшего алкокси), нитро, моноалкиламино (предпочтительно, низшего алкиламино), диалкиламино (предпочтительно, алкиламино), циано, галогена, галогеналкила (предпочтительно, трифторметила), алканоила, аминокарбонила, моноалкиламинокарбонила, диалкиламинокарбонила, алкиламидо (предпочтительно, низшего алкиламидо), алкоксиалкила (предпочтительно, низшего алкокси; низшего алкила), алкоксикарбонила (предпочтительно, низшего алкоксикарбонила), алкилкарбонилокси (предпочтительно, низшего алкилкарбонилокси) и арила (предпочтительно, фенила), причем вышеуказанный арил необязательно замещен галогеном, низшими алкильными и низшими алкоксигруппами. Гетероциклическая группа может обычно быть связана через любой кольцевой атом или атом заместителя при условии, что получается стабильное соединение. N-связанные гетероциклические группы связаны через составляющий атом азота.
[0036] Как правило, гетероциклическое кольцо содержит 1-4 гетероатома; в определенных вариантах осуществления каждое гетероциклическое кольцо содержит 1 или 2 гетероатома в кольце. Каждое гетероциклическое кольцо обычно содержит от 3 до 8 кольцевых членов (кольца, содержащие от 7 кольцевых членов перечислены в определенных вариантах осуществления), и гетероциклы, содержащие конденсированные, боковые или спирокольца, обычно содержат от 9 до 14 кольцевых членов, которые состоят из атомов углерода и содержат один, два или три гетероатома, выбранных из азота, кислорода и/или серы.
[0037] Примеры «гетероциклических» или «гетероциклоалкильных» групп включают пиперазин, пиперидин, морфолин, тиоморфолин, пирролидин, имидазолидин и тиазолид.
[0038] Используемый в настоящем описании термин «заместитель» относится к молекулярному фрагменту, который ковалентно связан с атомом в молекуле, представляющей интерес. Например, «кольцевой заместитель» может представлять собой фрагмент, такой как галоген, алкильная группа, галогеналкильная группа или другая группа, обсуждаемая в настоящем описании, которая ковалентно связана с атомом (предпочтительно, атомом углерода или азота), который является кольцевым членом.
[0039] Термин «необязательно замещенный» обозначает, что арильная, или гетероциклическая, или другая группа может быть замещена в одном или более замещаемых положениях одной или более группами, независимо выбранными из алкила (предпочтительно, низшего алкила), алкокси (предпочтительно, низшего алкокси), нитро, моноалкиламино (предпочтительно, от одного до шести углеродов), диалкиламино (предпочтительно, от одного до шести углеродов), циано, галогена, галогеналкила (предпочтительно, трифторметила), алканоила, аминокарбонила, моноалкиламинокарбонила, диалкиламинокарбонила, алкиламидо (предпочтительно, низшего алкиламидо), алкоксиалкила (предпочтительно, низшего алкокси и низшего алкила), алкоксикарбонила (предпочтительно, низшего алкоксикарбонила), алкилкарбонилокси (предпочтительно, низшего алкилкарбонилокси) и арила (предпочтительно, фенила), причем вышеуказанный арил необязательно замещен галогеном, низшим алкилом и низшими алкоксигруппами. Необязательное замещение также указывается фразой «замещен от 0 до X заместителями», где Х представляет собой максимальное количество возможных заместителей. Определенные необязательно замещенные группы замещены от 0 до 2, 3 или 4 независимо выбранными заместителями.
[0040] Тире («-»), которое находится не между двумя буквами или символами, используется для указания места присоединения заместителя. Например, -CONH2 присоединен через атом углерода.
[0041] Пунктирный цикл, который размещен внутри гетероциклического кольца, используют для обозначения сопряженной системы. Связи между двумя атомами могут представлять собой одинарную или двойную связь. Термин «киназа» относится к любому ферменту, который катализирует присоединение фосфатных групп к остатку белка; например, серин и треонинкиназы катализируют присоединение фосфатных групп к остаткам серина и треонина.
[0042] Термин «терапевтически эффективное количество» относится к количеству соединения или фармацевтической композиции, которое будет вызывать биологическую или медицинскую реакцию ткани, системы, животного или человека, которая необходима исследователю, ветеринару, врачу или другому клиницисту, например, восстановление или поддержание васкулостаза или предотвращение риска или потери васкулостаза; сокращение опухолевой нагрузки; снижение заболеваемости и/или смертности.
[0043] Термин «фармацевтически приемлемый» относится к тому факту, что носитель, разбавитель или эксципиент совместим с другими ингредиентами состава и не является повреждающим для его реципиента.
[0044] Термины «введение соединения» или «вводящий соединение» относятся к действию обеспечения соединением изобретения или фармацевтической композицией объекта, нуждающегося в лечении.
[0045] Термин «защищенный» обозначает, что группа находится в модифицированной форме, чтобы исключить нежелательные побочные реакции в защищенном месте. Подходящие защитные группы для соединений настоящего изобретения будут распознаны из настоящей заявки, принимая во внимание уровень в данной области техники, и со ссылкой на стандартные руководства, такие как Greene, T. W. et al., Protective Groups in Organic Synthesis, John Wiley & Sons, New York (1999).
[0046] Термин «фармацевтически приемлемая соль» соединения, изложенный в настоящем описании, представляет собой кислотную или основную соль, которая является подходящей для использования при взаимодействии с тканями человека или животных без чрезмерной токсичности или канцерогенности и, предпочтительно, без раздражения, аллергической реакции или другой проблемы или осложнения. Такие соли включают минеральные и органические кислотные соли основных остатков, таких как амины, также как щелочные или органические соли кислотных остатков, таких как карбоновые кислоты. Определенные фармацевтические соли включают, но не ограничиваются ими, соли кислот, таких как хлористоводородная, фосфорная, бромистоводородная, яблочная, гликолевая, фумаровая, серная, сульфаминовая, сульфаниловая, муравьиная, толуолсульфоновая, метансульфоновая, бензолсульфоновая, этандисульфоновая, 2-гидроксиэтилсульфоновая, азотная, бензойная, 2-ацетоксибензойная, лимонная, винная, молочная, стеариновая, салициловая, глутаминовая, аскорбиновая, памоевая, янтарная, фумаровая, малеиновая, пропионовая, гидроксималеиновая, иодистоводородная, фенилуксусная, алкановые кислоты, такие как уксусная, HOOC-(CH2)n-COOH, где n равно 0-4, и подобные. Аналогичным образом, фармацевтически приемлемые катионы включают, но не ограничиваются ими, натрий, калий, кальций, алюминий, литий и аммоний. Специалист в данной области техники должен знать дополнительные фармацевтически приемлемые соли для соединений, представленных в настоящей заявке. В общем, фармацевтически приемлемая соль кислоты или основания может быть синтезирована из исходного соединения, которое содержит основный или кислотный фрагмент, с помощью любого стандартного химического способа. Кратко, такие соли могут быть получены с помощью взаимодействия форм свободной кислоты или основания данных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде, или в органическом растворителе, или в смеси двух; как правило, предпочтительным является применение неводных сред, таких как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Будет очевидно, что каждое соединение Формулы I может, но необязательно, быть приготовлено в виде гидрата, сольвата или нековалентного комплекса. Кроме того, различные кристаллические формы и полиморфные модификации входят в объем настоящего изобретения. Также в настоящем описании представлены пролекарства соединений Формулы I.
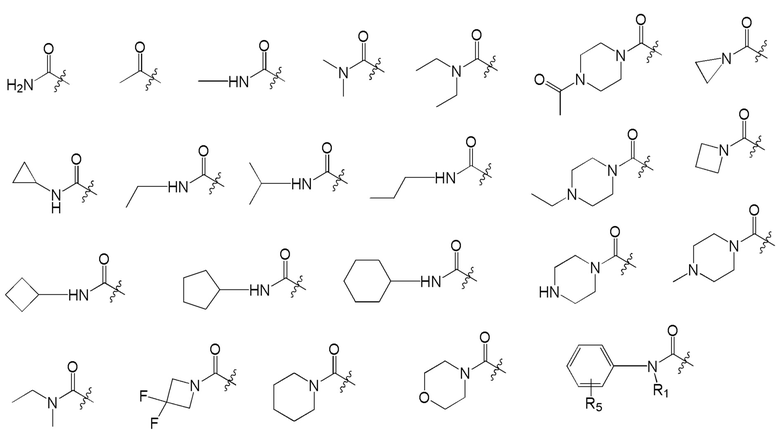
[0047] Предпочтительные W-группы формулы (I) представляют собой: F, Cl, Br, CN, CF3, CF2H, CFH2, CH3, OCH3, NH2 и приведенный ниже список:
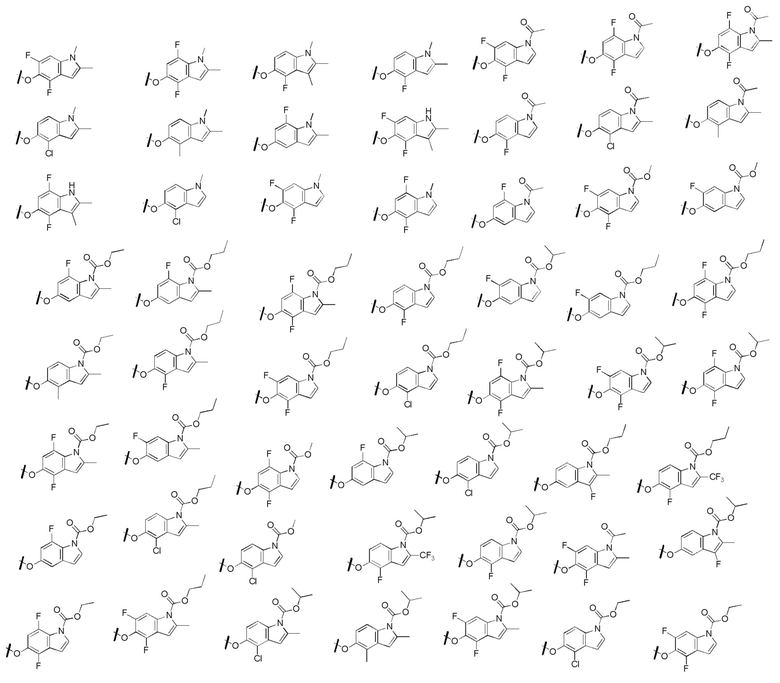
[0048] Предпочтительные замещенные индольные группы формулы (I) приведены ниже:

[0049] Предпочтительные группы Ar формулы (I) приведены ниже:
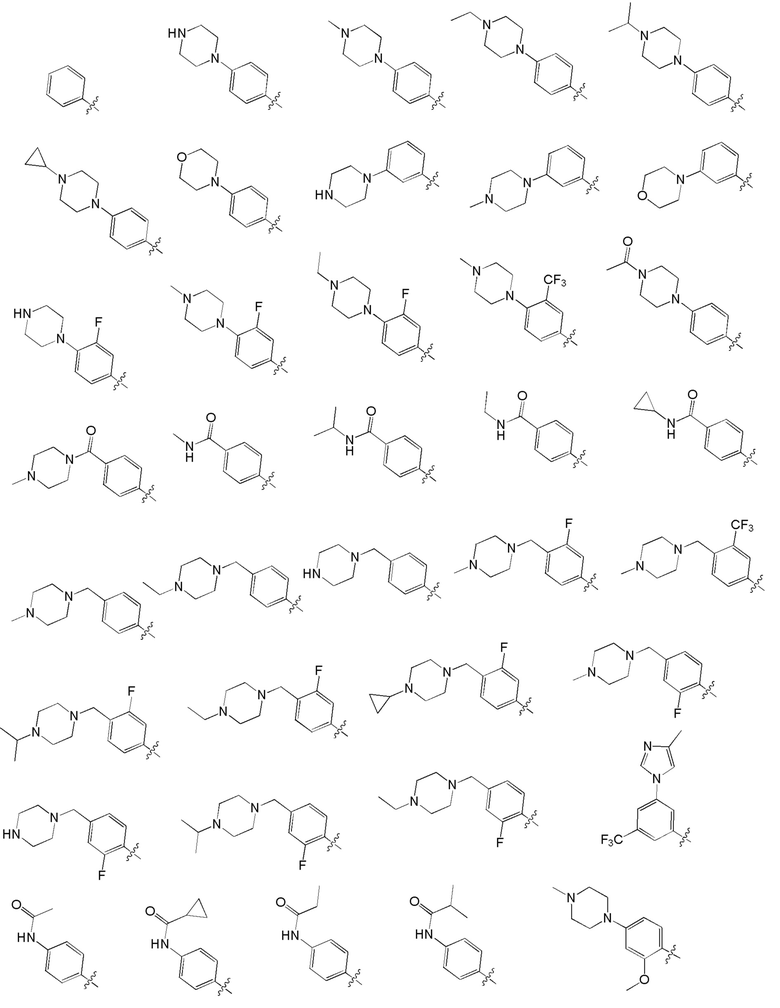
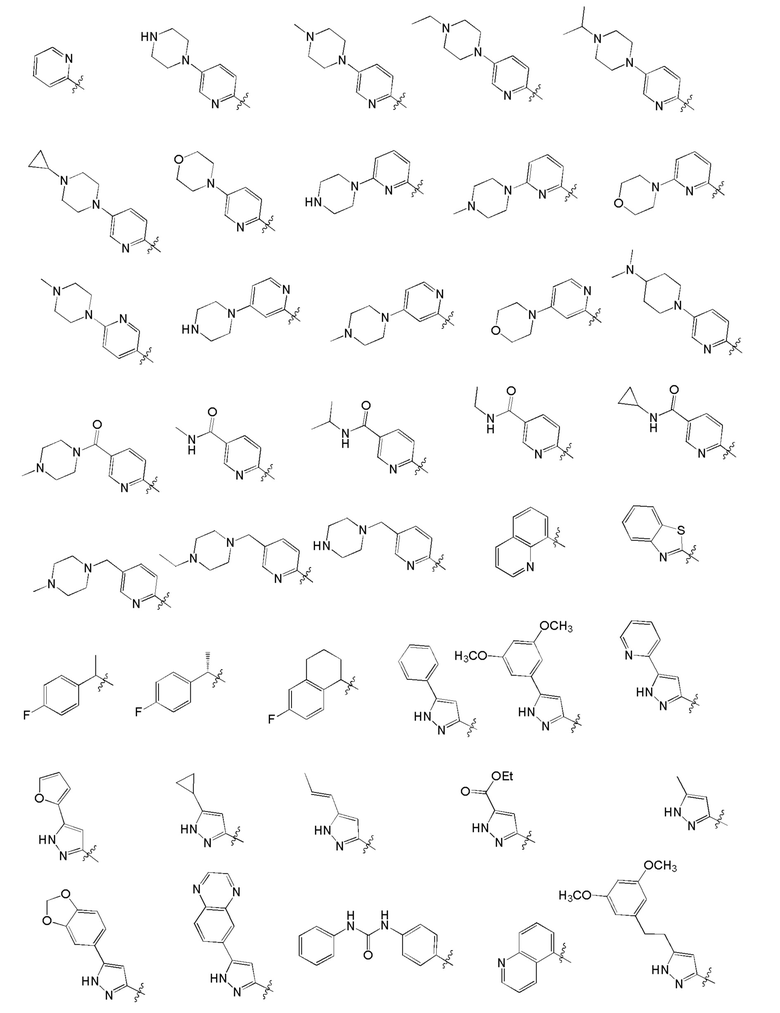
[0050] Примерами определенных соединений настоящего изобретения являются такие соединения, которые определены следующим образом:
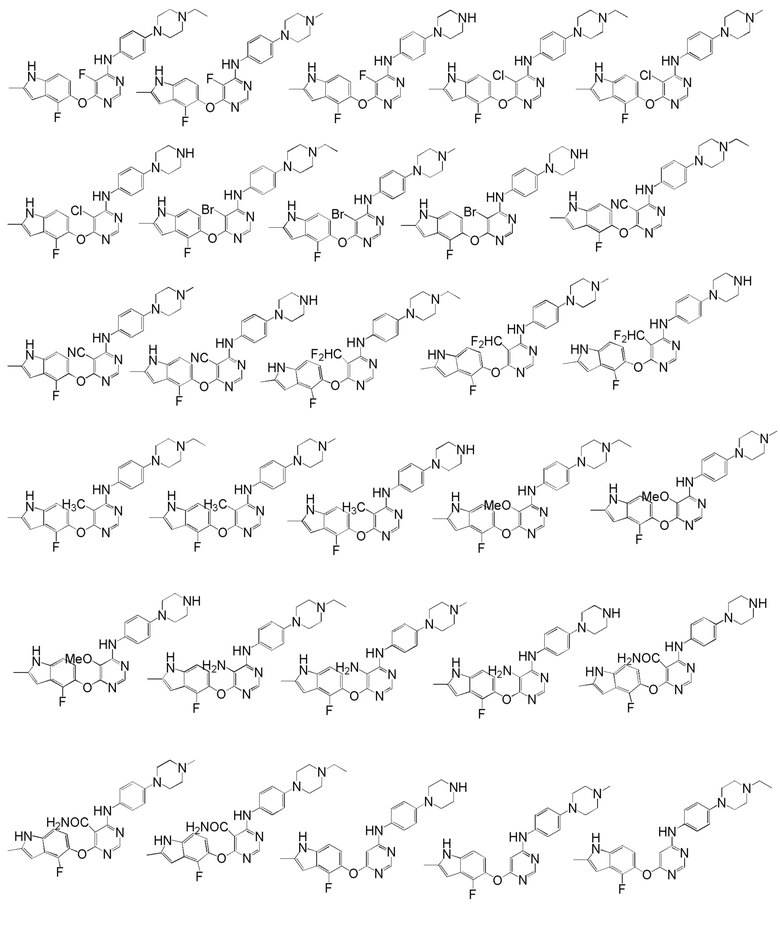
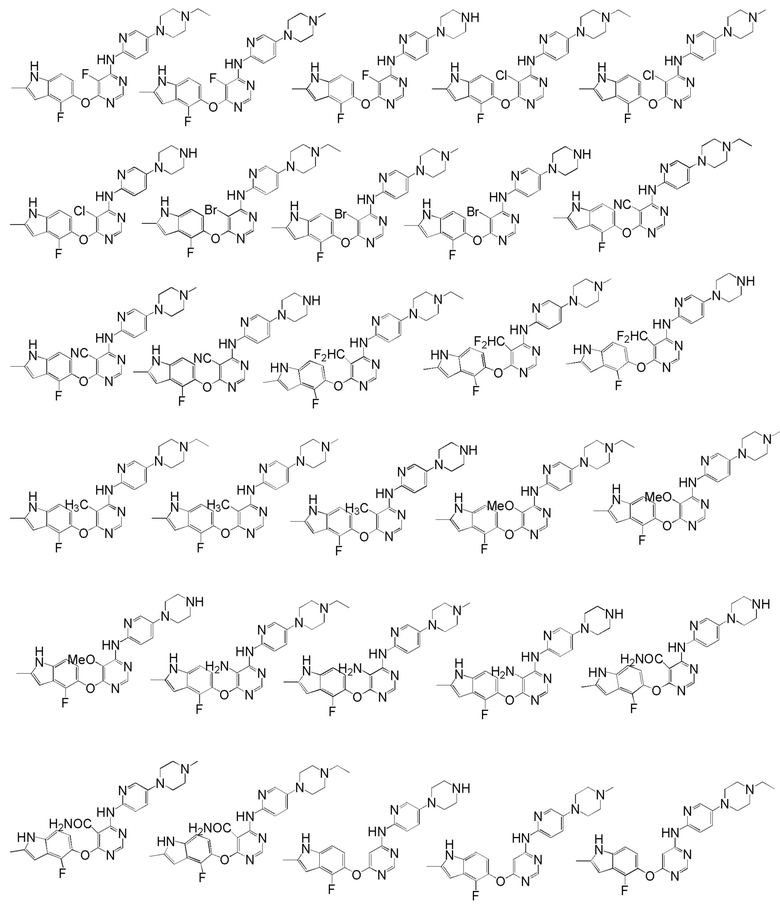

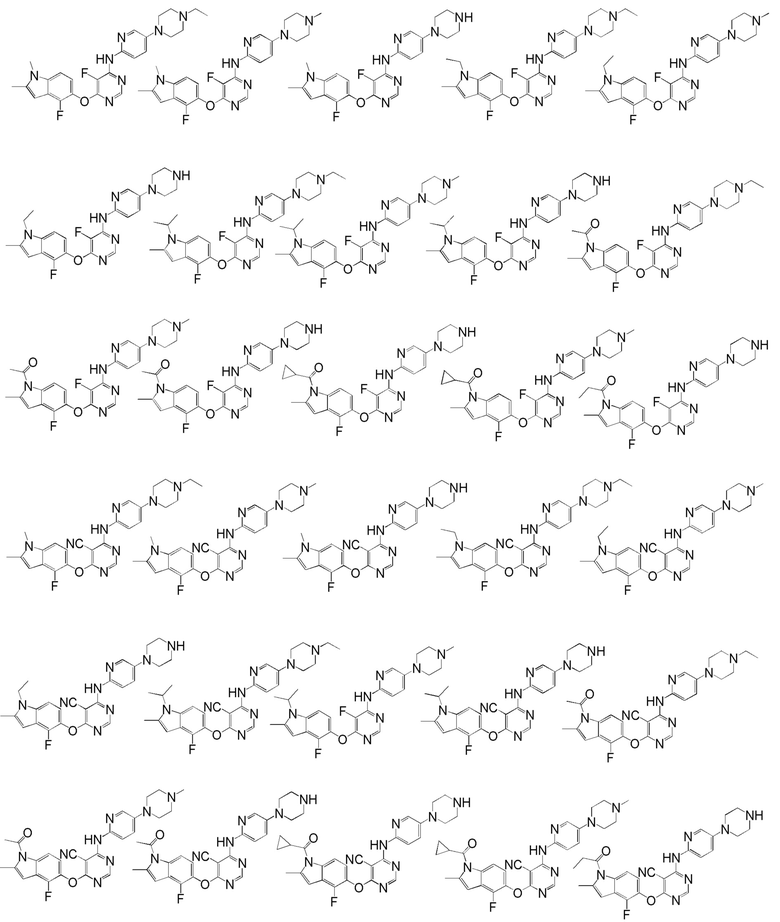
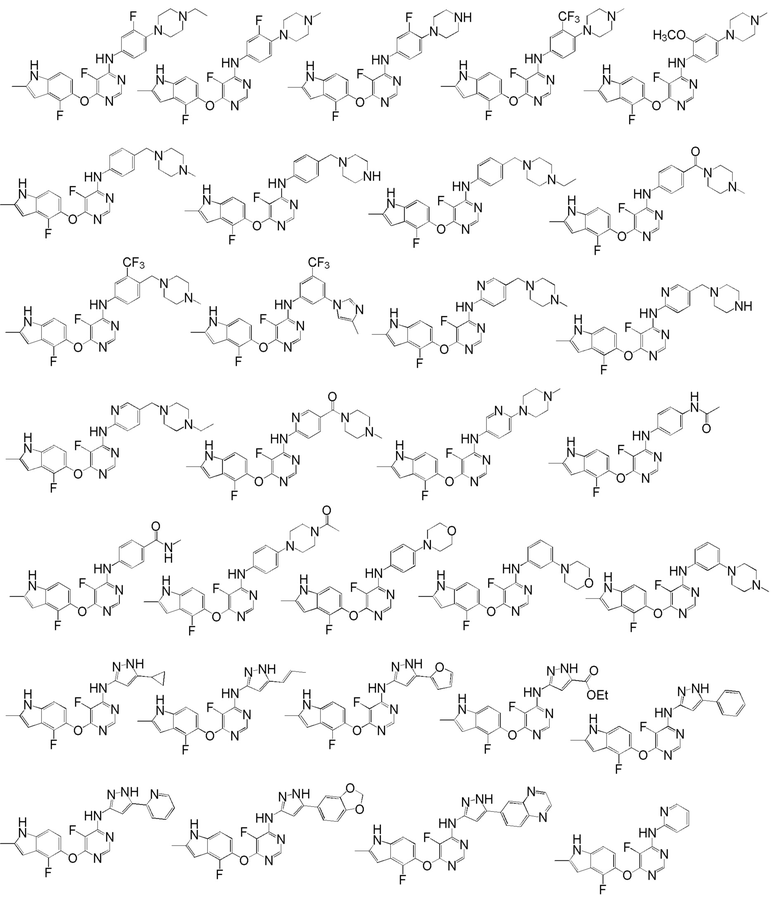
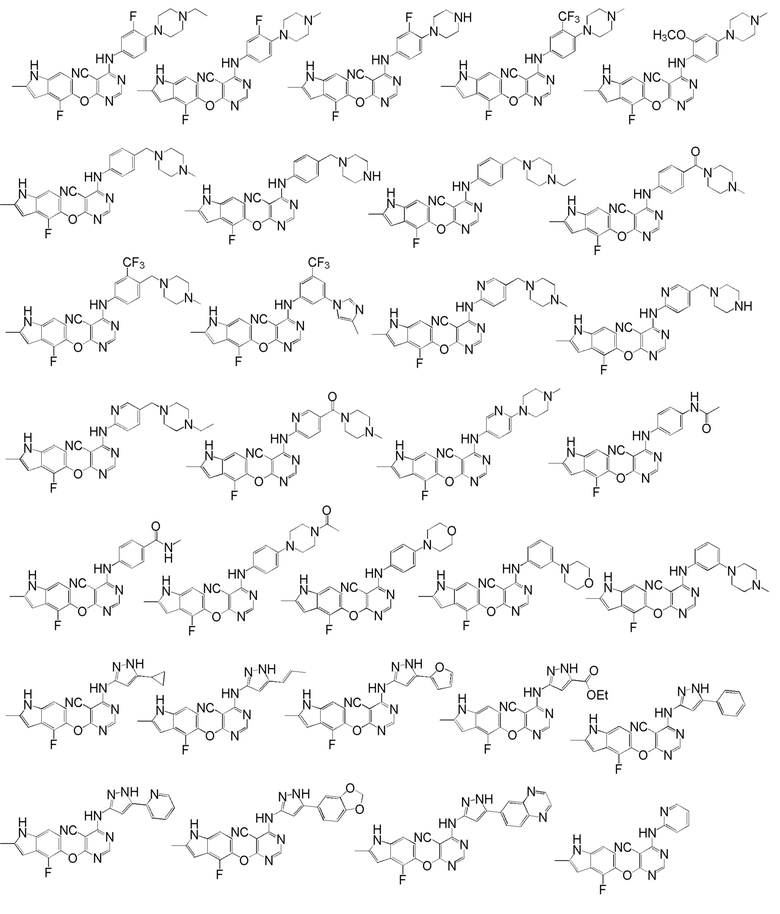
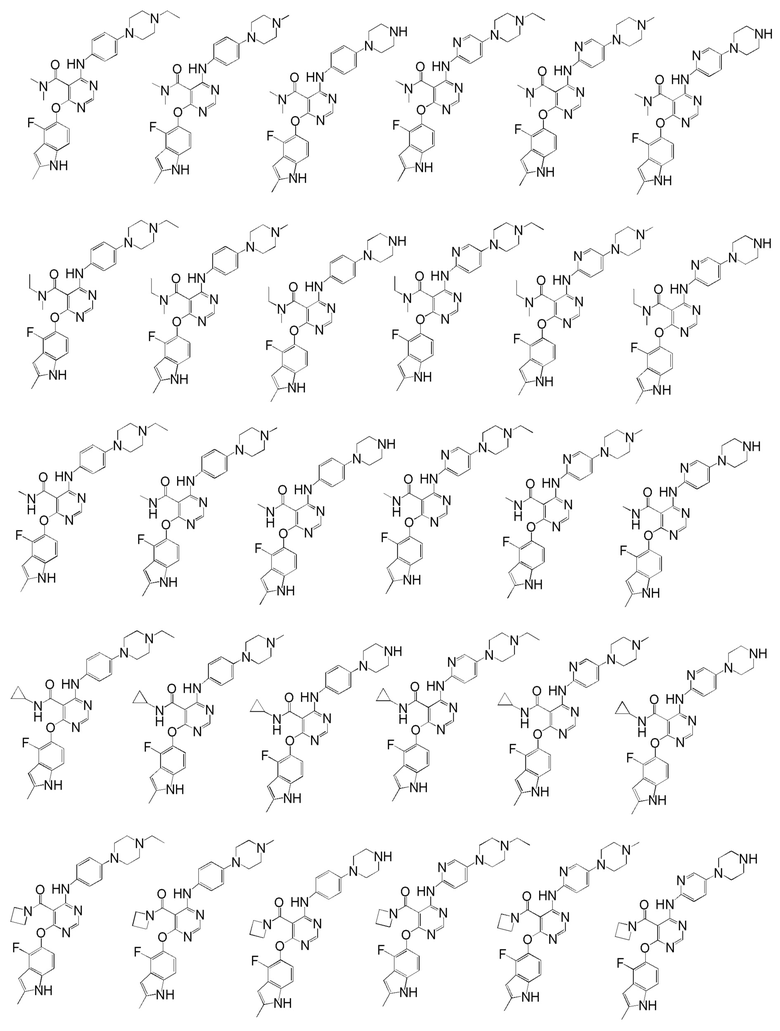
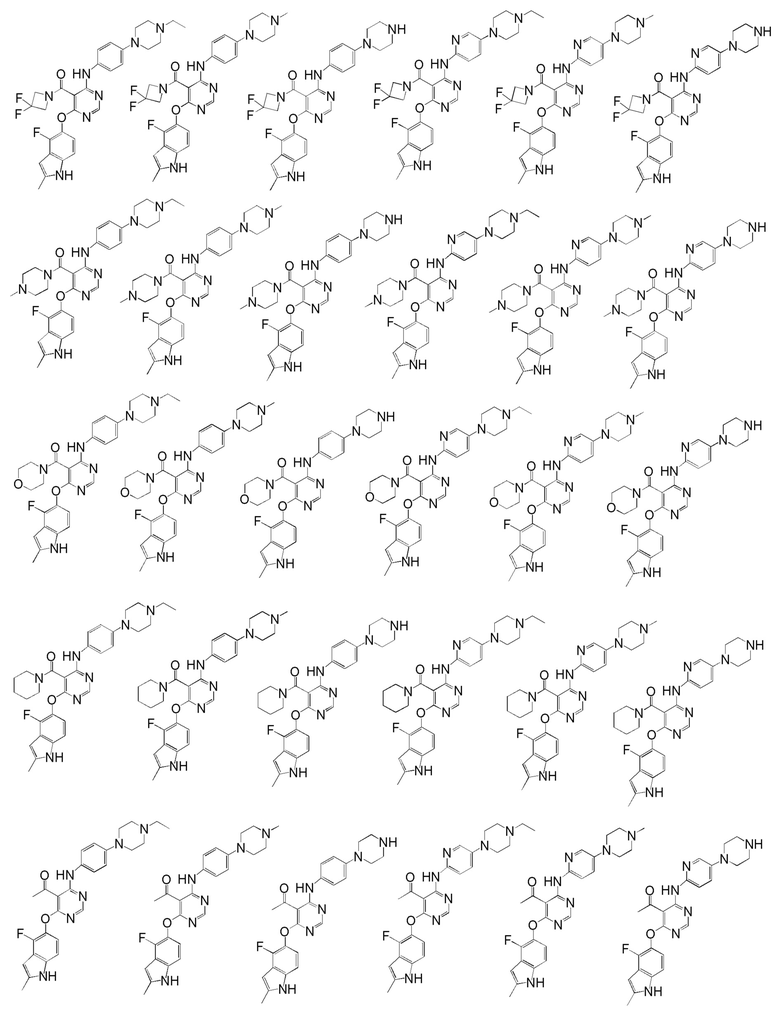
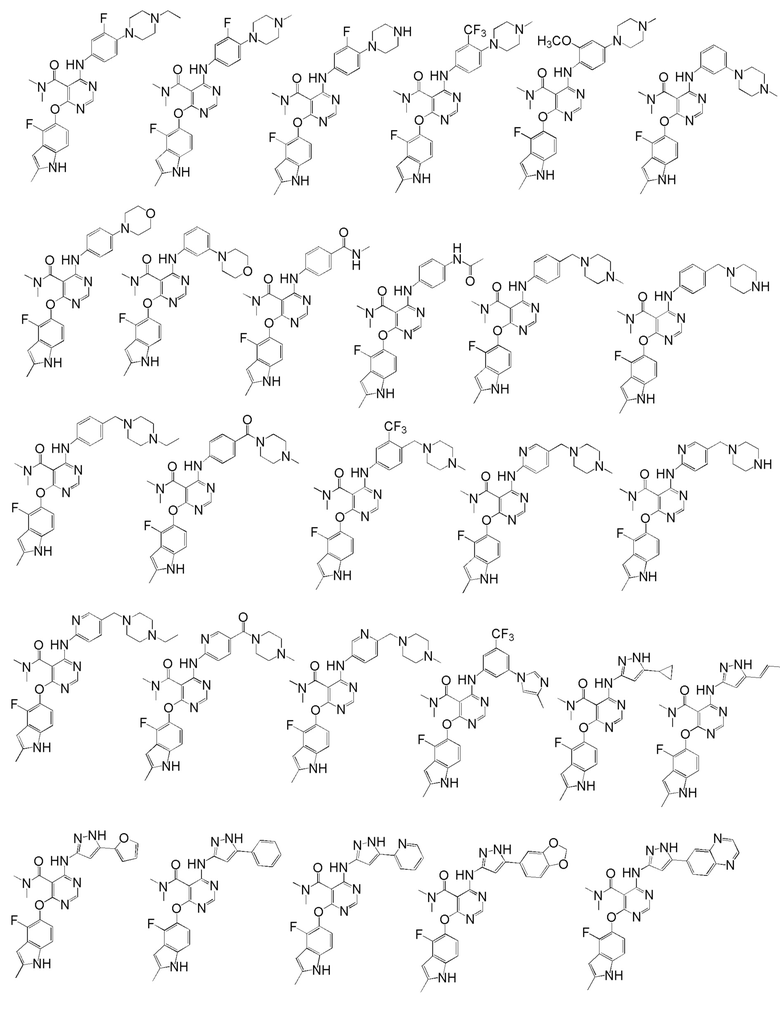
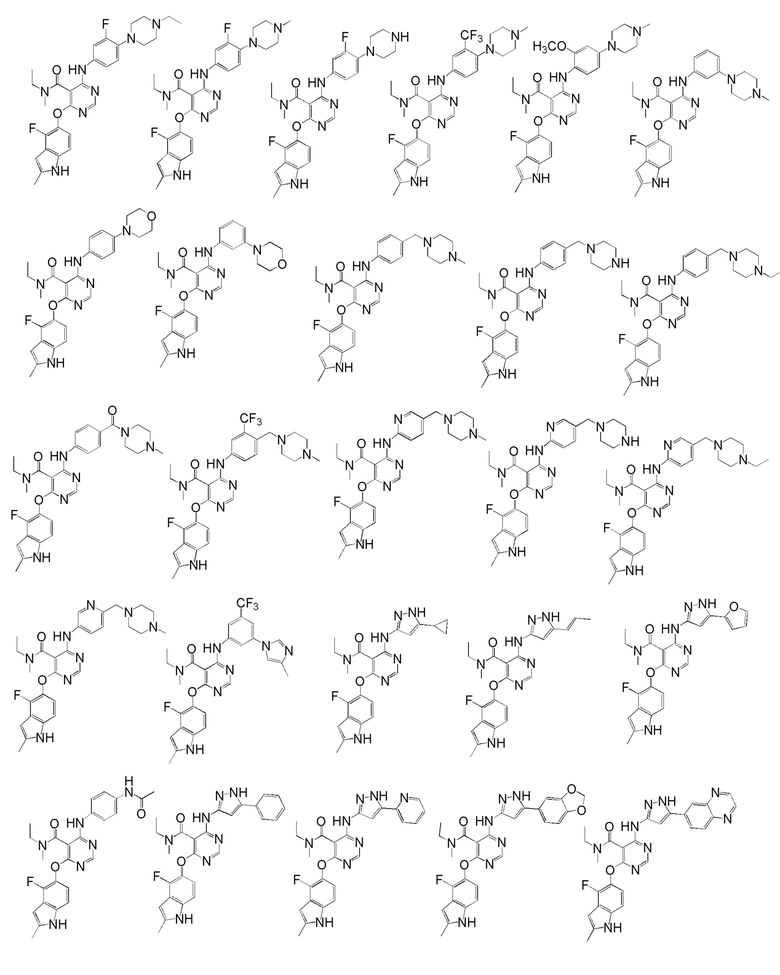
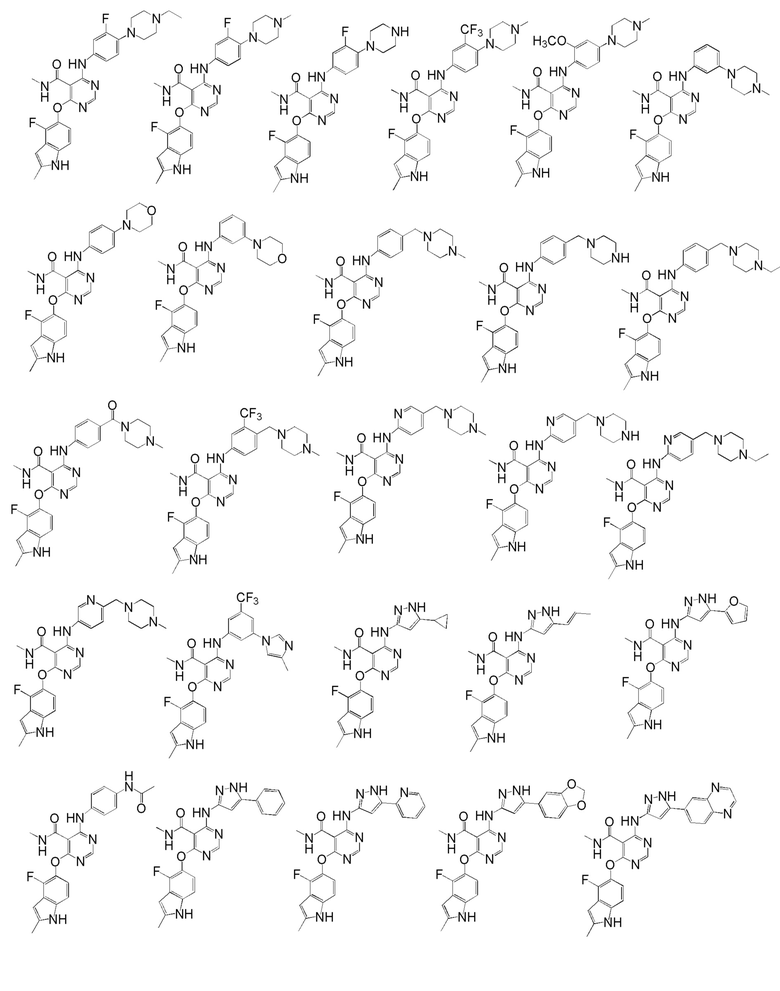
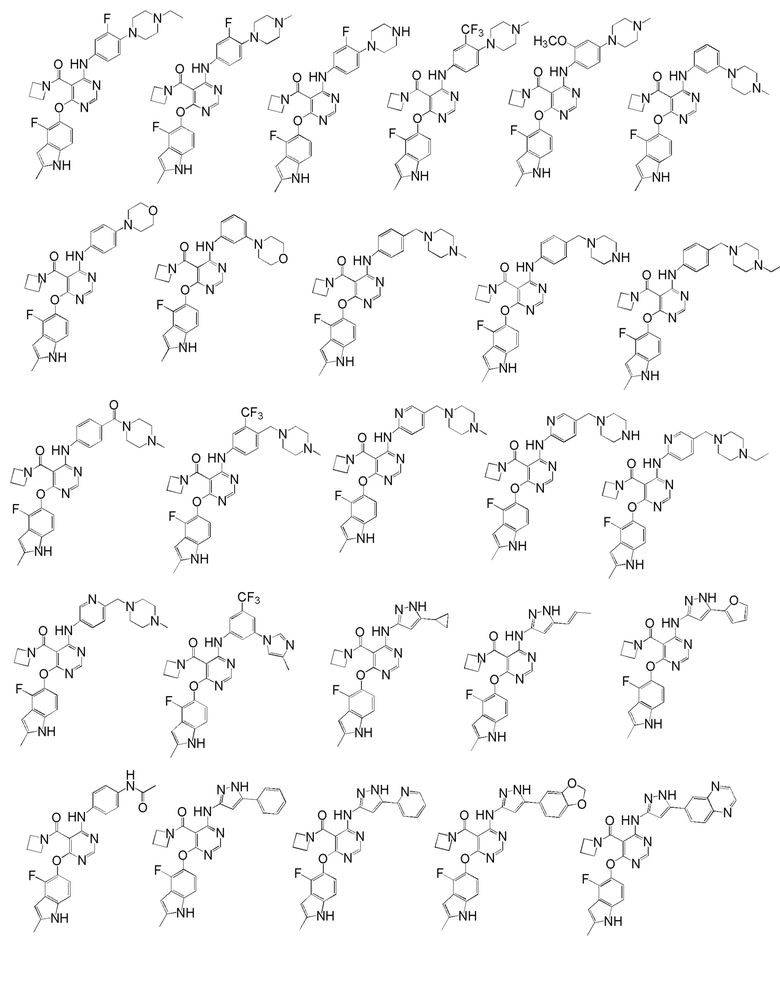


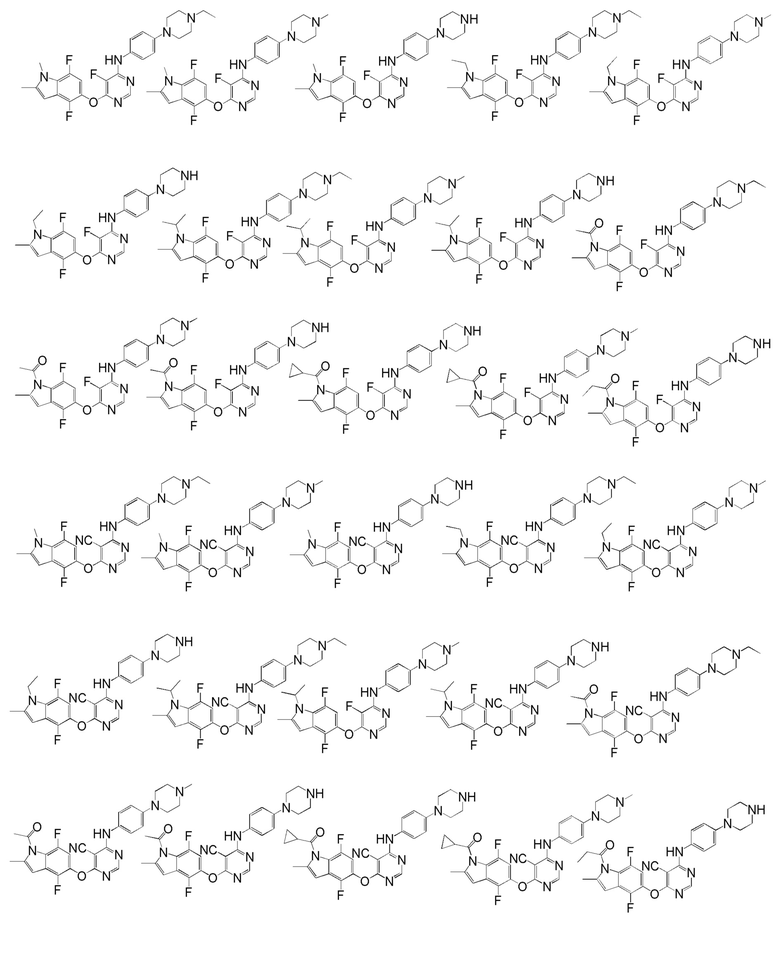

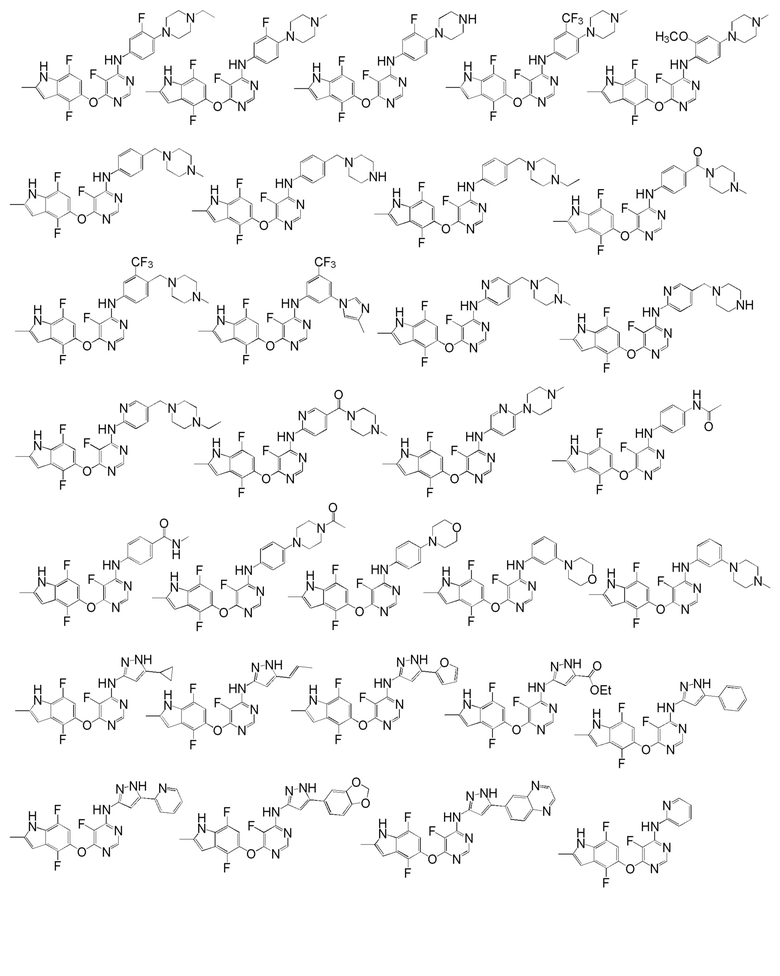
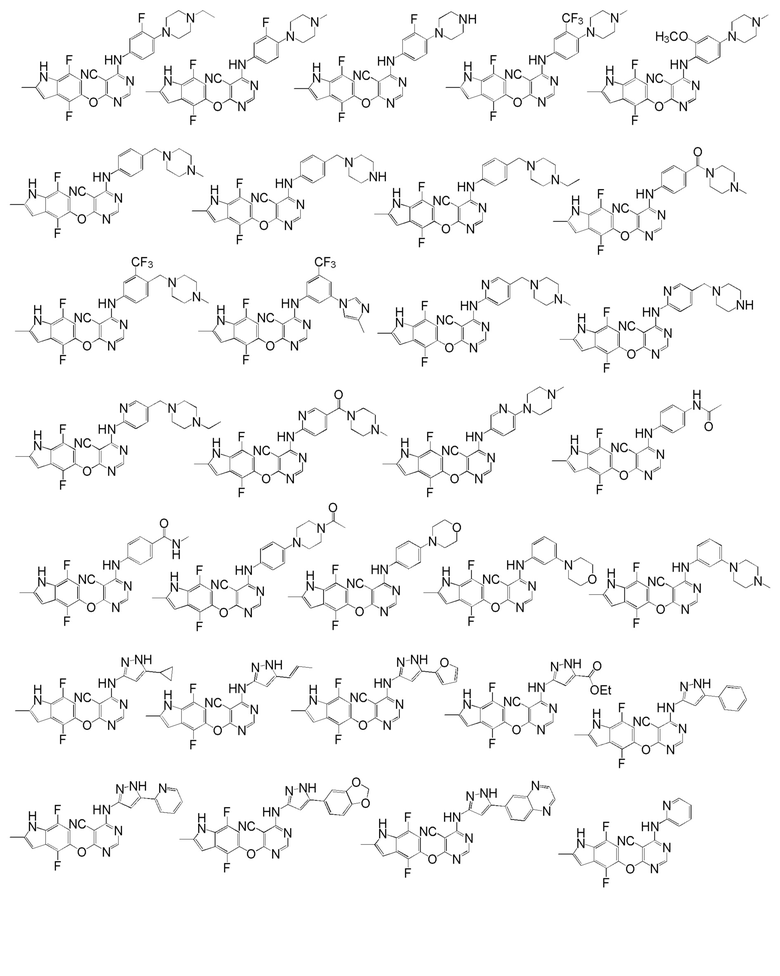


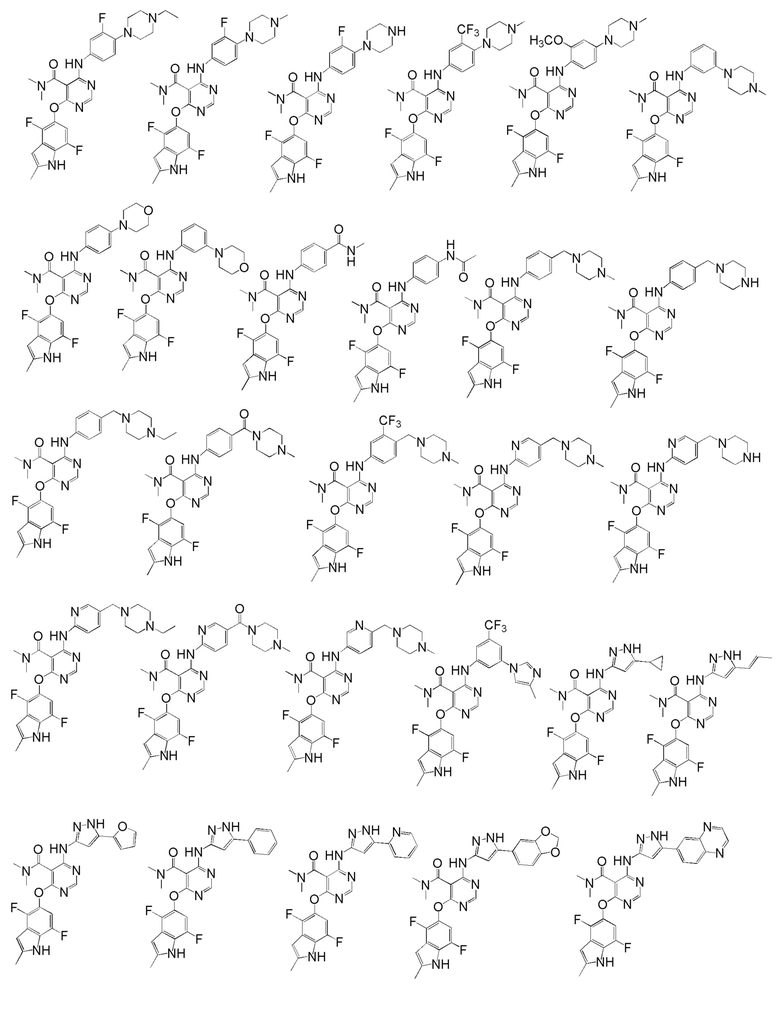
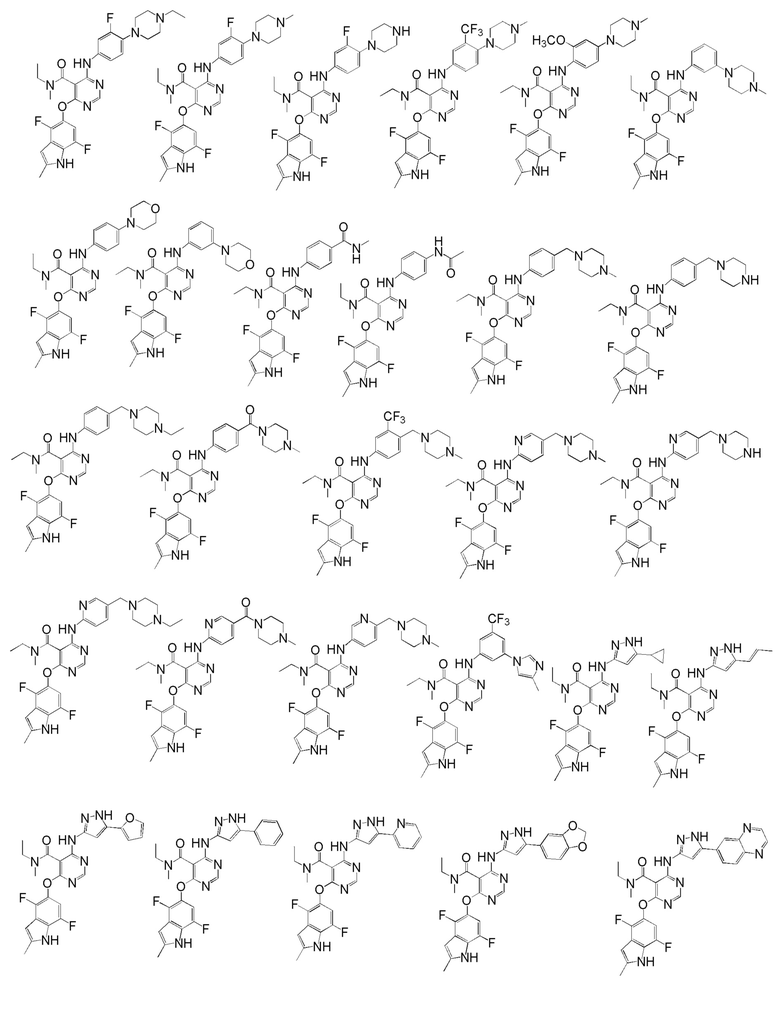
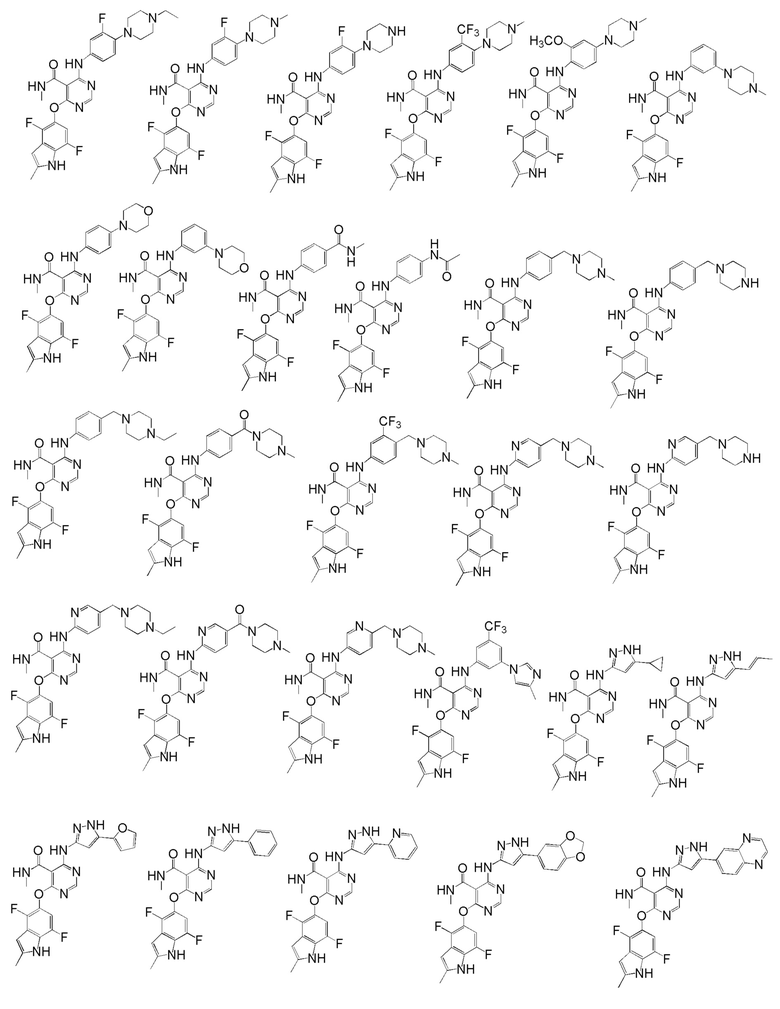
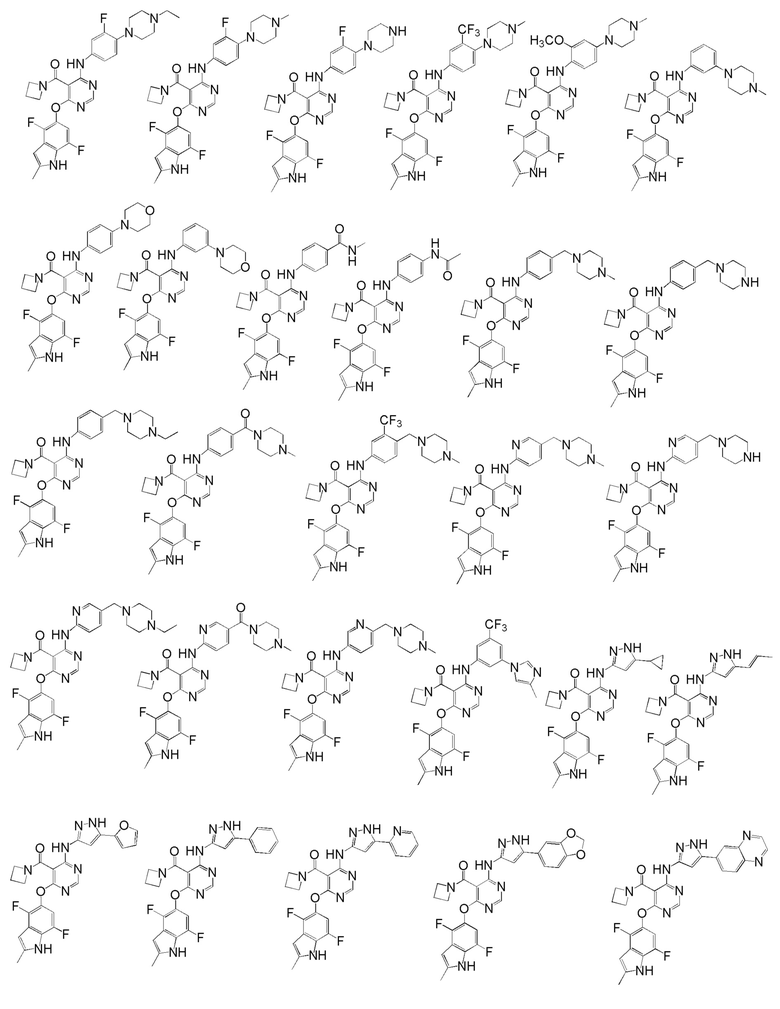
[0051] В другом варианте осуществления предоставляют способ получения соединений изобретения. Соединения настоящего изобретения обычно могут быть получены с использованием 4,6-дихлорпиримидина с различными заместителями в положении «5». Соединение (I) может содержать различные стереоизомеры, геометрические изомеры, таутомерные изомеры и подобные. Все возможные изомеры и их смеси включены в настоящее изобретение и соотношение компонентов в смеси особым образом не ограничено.
[0052] Производные пиримидина соединений Формулы (I) в данном изобретении могут быть синтезированы из коммерчески доступных прекурсоров с использованием установленных протоколов. В качестве примера может быть использован синтетический путь, подобный пути, который показан в любой из следующих схем, вместе с синтетическими способами, известными в области синтетической органической химии, или их вариациями, как очевидно специалисту в данной области техники. Каждая переменная в следующих схемах относится к любой группе, соответствующей описанию соединений, представленных в настоящей заявке.
[0053] В Схемах, которые следуют, термин «восстановление» относится к способу восстановления функциональных групп нитро в функциональные группы амино или способу превращения функциональных групп сложного эфира в спирты. Восстановление нитрогруппы может быть проведено многими способами, хорошо известными специалисту в области органического синтеза, включая, но не ограничиваясь ими, каталитическое гидрирование, восстановление SnCl2 и восстановление бихлоридом титана. В Схемах, которые следуют, термин «гидролиз» относится к реакции субстрата или реагента с водой. Более определенно, «гидролиз» относится к превращению функциональных групп сложного эфира или нитрита в карбоновую кислоту. Данный процесс может быть катализирован различными кислотами или основаниями, хорошо известными специалисту в области органического синтеза.
[0054] Соединения Формулы (I) могут быть получены с использованием известных химических реакций и методик. Представлены следующие общие способы получения, которые помогают специалисту в данной области техники в синтезе ингибиторов, причем более подробные примеры представлены в экспериментальном разделе, описывающем действующие примеры.
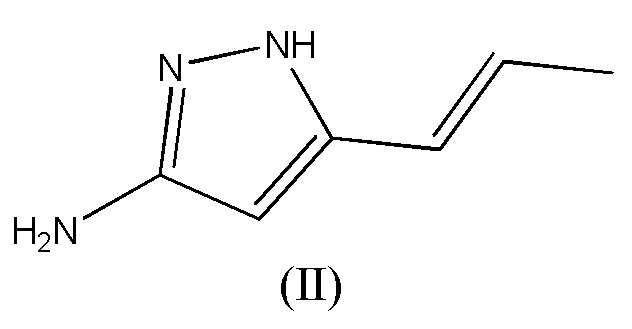
[0055] Пропенилпиразоламин, как определено в формуле (III), не является коммерчески доступным. Его можно получить с помощью нескольких способов, как описано ранее (см., например, предварительная заявка на патент США № 61/555738).
[0056] Прекурсоры замещенного индол-5-ола, как определено в формуле (III), могут быть приобретены у поставщиков или синтезированы из коммерчески доступных прекурсоров с использованием установленных протоколов. (WO 2004/009542, P33-38; Journal of Medicinal Chemistry, 2006, Vol 49, No. 7, P2143-2146; Org. Lett. Vol 10, No 12, 2008, P 2369-2372; WO 00/47212, P245-250; WO 2009036055 A1, P57).
[0057] В частности, прекурсор 47-дифториндол-5-ола, как определено в формуле (IIIa), не был ранее описан и может быть получен с помощью нескольких способов, как описано ранее (WO2014145403 A1).

[0058] Прекурсоры 5-замещенных 4,6-дихлорпиримидинов, как определено в формуле (IV), могут быть приобретены у поставщиков. В частности, прекурсор, как определено в формуле (IVa), может быть синтезирован из коммерчески доступных прекурсоров с использованием установленных протоколов (PCT Int. Appl., 2010141406, 09 Dec 2010, Compound 310F).

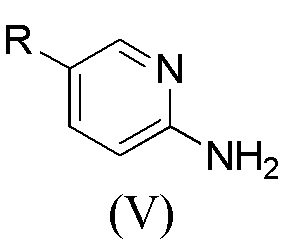
[0059] Как правило, прекурсоры ArNH2 могут быть приобретены у поставщиков. Прекурсоры ArNH2, как определено в формуле (V), могут быть приобретены у поставщиков или синтезированы из коммерчески доступных прекурсоров с использованием установленных протоколов. (J. Med. Chem. 2010, 53, 7938-7957, в частности, P7949).
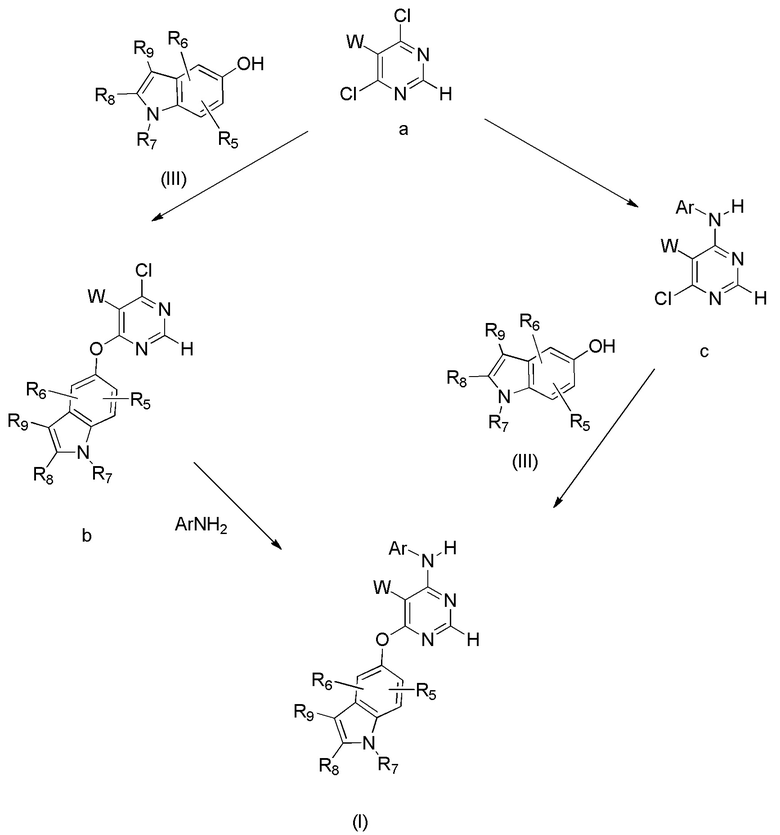
[0060] Получение соединений формулы (I) в данном изобретении может быть осуществлено с помощью способов, перечисленных в схеме 1.
[0061] Как показано в схеме 1, производное пиримидина (I) может быть синтезировано с помощью взаимодействия 5-замещенного 4,6-дихлорпиримидина с последовательностью замещенного индол-5-ола с получением монохлорпиримидина промежуточного соединения b, которое может взаимодействовать с ArNH2 с получением конечного соединения (I). Реакция может быть ступенчатой или одностадийной. Альтернативная последовательность также может быть использована для получения производных пиримидина.
Схема 1
[0062] Как показано в схеме 2, конечные соединения, как определено в (I-b), могут быть синтезированы из соответствующих прекурсоров, где W представляет собой «CN».
Схема 2

[0063] Реакцию предпочтительно проводят в присутствии инертного растворителя. Не существует никаких особых ограничений в отношении природы растворителя, который применяют, при условии, что он не оказывает негативного воздействия на реакцию или на участвующие реагенты и что он может растворять реагенты, по меньшей мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, в частности ароматические и алифатические углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензолы; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; нитросоединения, которые могут быть нитроалканами или нитроаранами, такие как нитроэтан и нитробензол; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, которые могут быть амидами жирных кислот, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; и сульфоксиды, такие как диметилсульфоксид и сульфолан.
[0064] Реакция может протекать в широком диапазоне температур, и точная температура реакции не является критической для изобретения. В целом, авторы изобретения полагают, что удобно проводить реакцию при температуре от -50°С до 100°С.
[0065] Настоящее изобретение предоставляет композиции, которые представляют собой составы одного или более активных лекарственных веществ и фармацевтически приемлемого носителя. В этой связи, изобретение предоставляет композицию для введения млекопитающему, которая может включать соединение формулы I или его фармацевтически приемлемые соли.
[0066] Фармацевтически приемлемые соли соединений данного изобретения включают соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислотных солей включают ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептаноат, глицерофосфат, гликолят, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат, тиоцианат, тозилат и ундеканоат. Другие кислоты, такие как щавелевая, хотя сами по себе не являются фармацевтически приемлемыми, могут быть использованы при получении солей, пригодных в качестве промежуточных соединений при получении соединений изобретения и их фармацевтически приемлемых кислотно-аддитивных солей.
[0067] Соли, полученные из соответствующих оснований, включают соли щелочных металлов (например, натрия и калия), щелочно-земельных металлов (например, магния), аммония и N+(C1-4алкил)4. Данное изобретение также предусматривает кватернизацию любых основных азотсодержащих групп соединений, раскрытых в настоящем описании. С помощью такой кватернизации могут быть получены водо- или маслорастворимые или диспергируемые продукты.
[0068] Композиции настоящего изобретения могут быть введены перорально, парентерально, путем ингаляционного спрея, местно, ректально, назально, буккально, вагинально или через имплантированный резервуар. Используемый в настоящем описании термин «парентеральный» включает подкожную, внутривенную, внутримышечную, внутрисуставную, внутрисиновиальную, интрастернальную, интратекальную, внутрипеченочную, внутриочаговую и внутричерепную инъекцию или методы инфузии. Предпочтительно, композиции вводят перорально, внутрибрюшинно или внутривенно.
[0069] Фармацевтически приемлемые композиции данного изобретения могут быть введены перорально в любой приемлемой для перорального применения лекарственной форме, включая, но не ограничиваясь ими, капсулы, таблетки, пастилки, эликсиры, суспензии, сиропы, капсулы-имплантаты, жевательные пастилки, водные суспензии или растворы.
[0070] Композиции для перорального применения могут содержать дополнительные ингредиенты, такие как: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, кукурузный крахмал и подобные; скользящее вещество, такое как стеарат магния; глидант, такой как коллоидный диоксид кремния; и подсластитель, такой как сахароза или сахарин или ароматизатор, такой как мята перечная, метилсалицилат или апельсиновый ароматизатор. Когда форма единицы дозировки представляет собой капсулу, она может дополнительно содержать жидкий носитель, такой как жирное масло. Другие формы единиц дозировки могут содержать другие различные материалы, которые изменяют физическую форму единиц дозировки, такие как, например, покрытие. Таким образом, таблетки или пилюли могут быть покрыты сахаром, шеллаком или другими агентами для энтеросолюбильного покрытия. Сироп может содержать помимо активных ингредиентов сахарозу в качестве подсластителя и определенные консерванты, красители, и красящие вещества, и ароматизаторы. Материалы, используемые при получении данных различных композиций, должны быть фармацевтически или ветеринарно чистыми и нетоксичными в используемых количествах.
[0071] В целях парентерального терапевтического введения активный ингредиент может быть включен в раствор или суспензию. Растворы или суспензии могут также включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, солевой раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты и агенты для установления тоничности, такие как хлорид натрия или декстроза. Парентеральный препарат может быть заключен в ампулы, шприцы одноразового применения или флаконы для многократного применения, изготовленные из стекла или пластика.
[0072] Фармацевтические формы, пригодные для инъекционного применения, включают стерильные растворы, дисперсии, эмульсии и стерильные порошки. Конечная форма должна быть стабильной в условиях производства и хранения. Кроме того, конечная фармацевтическая форма должна быть защищена от загрязнения и, следовательно, должна быть способна ингибировать рост микроорганизмов, таких как бактерии или грибы. Может быть введена единичная внутривенная или внутрибрюшинная доза. Альтернативно, может быть использована медленная долгосрочная инфузия или многократные краткосрочные ежедневные инфузии, обычно продолжающиеся от 1 до 8 дней. Также может быть использована дозировка через день или дозировка один раз в несколько дней.
[0073] Стерильные растворы для инъекций могут быть получены путем включения соединения в требуемом количестве в один или более подходящих растворителей, к которым могут быть добавлены при необходимости другие ингредиенты, перечисленные выше или известные специалисту в данной области техники. Стерильные растворы для инъекций могут быть получены путем включения соединения в требуемом количестве в подходящий растворитель с различными другими ингредиентами по мере необходимости. Затем могут проводиться методы стерилизации, такие как фильтрация. Как правило, дисперсии получают путем включения соединения в стерильный носитель, который также содержит дисперсионную среду и требуемые другие ингредиенты, как указано выше. В случае стерильного порошка предпочтительные способы включают вакуумную сушку или лиофильную сушку, к которому добавляются любые необходимые ингредиенты.
[0074] Подходящие фармацевтические носители включают стерильную воду; солевой раствор, декстрозу; декстрозу в воде или солевом растворе; продукты конденсации касторового масла и этиленоксида, объединяющие от приблизительно 30 до приблизительно 35 молей этиленоксида на моль касторового масла; жидкую кислоту; низшие алканолы; масла, такие как кукурузное масло; арахисовое масло, кунжутное масло и подобные с эмульгаторами, такими как моно- или диглицерид жирной кислоты или фосфатид, например, лецитин и подобные; гликоли; полиалкиленгликоли; водные среды в присутствии суспендирующего агента, такого как карбоксиметилцеллюлоза натрия; альгинат натрия; поли(винилпирролидон); и подобные отдельно или с подходящими дозирующими агентами, такими как лецитин; полиоксиэтиленстеарат; и подобные. Носитель также может содержать адъюванты, такие как сохраняющие стабильность, смачивающие, эмульгирующие агенты и подобные вместе с усилителем всасывания. Во всех случаях конечная форма, как отмечено, должна быть стерильной и должна также легко проходить через инъекционное устройство, такое как полая игла. Соответствующая вязкость может быть достигнута и поддерживаться надлежащим выбором растворителей или эксципиентов. Кроме того, может применяться использование молекулярных или дисперсных покрытий, таких как лецитин, соответствующий выбор размера частиц в дисперсиях или использование материалов со свойствами поверхностно-активных веществ.
[0075] В соответствии с изобретением предоставлены композиции, содержащие производные пиримидина, и способы, пригодные для доставки in vivo производных пиримидина в виде наночастиц, которые подходят для любого из вышеуказанных путей введения.
[0076] В патентах США № 5916596, 6506405 и 6537579 представлено получение наночастиц из биосовместимых полимеров, таких как альбумин. Таким образом, в соответствии с настоящим изобретением представлены способы образования наночастиц настоящего изобретения методом испарения растворителя из эмульсии масло-в-воде, полученной в условиях интенсивных сил сдвига (например, обработка ультразвуком, гомогенизация под высоким давлением или подобные).
[0077] В качестве альтернативы, фармацевтически приемлемые композиции данного изобретения могут быть введены в форме суппозиториев для ректального введения. Они могут быть получены путем смешивания агента с подходящим не раздражающим эксципиентом, который является твердым при комнатной температуре, но жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке для высвобождения лекарственного средства. Такие материалы включают масло какао, пчелиный воск и полиэтиленгликоли.
[0078] Фармацевтически приемлемые композиции данного изобретения также могут быть введены местно, особенно когда объект лечения включает области или органы, легко доступные посредством местного применения, включая заболевания глаз, кожи или нижнего отдела кишечника. Подходящие местные составы легко готовятся для каждой из данных областей или органов.
[0079] Местное применение для нижнего отдела кишечника может быть осуществлено с помощью состава ректальной суппозитории (см. выше) или в соответствующем составе клизмы. Также могут быть использованы местно-трансдермальные пластыри.
[0080] Для местного применения фармацевтически приемлемые композиции могут быть приготовлены в подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более носителях. Носители для местного введения соединений данного изобретения включают, но не ограничиваются ими, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, соединение полиоксипропилена, эмульгирующий воск и воду. В качестве альтернативы, фармацевтически приемлемые композиции могут быть приготовлены в подходящем лосьоне или креме, содержащем активные компоненты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителях. Подходящие носители включают, но не ограничиваются ими, минеральное масло, сорбитана моностеарат, полисорбат 60, воск цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
[0081] Для офтальмологического применения фармацевтически приемлемые композиции могут быть приготовлены в виде микронизированных суспензий в изотоническом с установленным рН стерильном солевом растворе или, предпочтительно, в виде растворов в изотоническом с установленным рН стерильном солевом растворе в присутствии или без консерванта, такого как бензалкония хлорид. В качестве альтернативы, для офтальмологического применения фармацевтически приемлемые композиции могут быть приготовлены в виде мази, такой как вазелин.
[0082] Фармацевтически приемлемые композиции данного изобретения также могут быть введены с помощью назального аэрозоля или ингаляции. Такие композиции получают в соответствии с методиками, хорошо известными в области фармацевтических составов, и могут быть получены в виде растворов в солевом растворе с использованием бензилового спирта или других подходящих консервантов, стимуляторов абсорбции для повышения биодоступности, фторуглеродов и/или других стандартных солюбилизирующих или диспергирующих агентов.
[0083] Наиболее предпочтительно, фармацевтически приемлемые композиции данного изобретения получают для перорального введения.
[0084] В соответствии с изобретением соединения изобретения могут быть использованы для лечения заболеваний, связанных с клеточной пролиферации или гиперпролиферацией, таких как рак, которые включают, но не ограничиваются ими, опухоли носовой полости, околоносовых пазух, носоглотки, ротовой полости, ротоглотки, гортани, гортанной части глотки, слюнных желез и параганглиомы. Соединения изобретения также могут быть использованы для лечения рака печени и желчных протоков (в частности, гепатоцеллюлярной карциномы), рака желудочно-кишечного тракта, в частности, колоректального рака, рака яичников, мелкоклеточного и немелкоклеточного рака легкого, рака молочной железы, сарком (включая фибросаркому, злокачественную фиброзную гистиоцитому, эмбриональную рабдомиосаркому, лейомиосаркому, нейрофибросаркому, остеосаркому, синовиальную саркому, липосаркому и альвеолярную саркому мягких тканей), новообразований центральной нервной системы (в частности, рака мозга) и лимфом (включая лимфому Ходжкина, лимфоплазмацитоидную лимфому, фолликулярную лимфому, лимфому лимфоидной ткани слизистых оболочек, лимфому из клеток мантийной зоны, крупноклеточную В-клеточную лимфому, лимфому Беркитта и Т-клеточную анапластическую крупноклеточную лимфому).
[0085] Соединения и способы настоящего изобретения или при введении по отдельности, или в комбинации с другими агентами (например, химиотерапевтическими средствами или белковыми терапевтическими средствами, описанными ниже) также являются пригодными при лечении различных нарушений, включая, но не ограничиваясь ими, например: инсульт, сердечно-сосудистое заболевание, инфаркт миокарда, застойную сердечную недостаточность, кардиомиопатию, миокардит, ишемическую болезнь сердца, коронарную болезнь сердца, кардиогенный шок, сосудистый шок, легочную гипертензию, отек легких (включая кардиогенный отек легких), плевральный выпот, ревматоидный артрит, диабетическую ретинопатию, пигментный ретинит и ретинопатии, включая диабетическую ретинопатию и ретинопатию недоношенных, воспалительные заболевания, рестеноз, астму, острый или респираторный дистресс-синдром взрослых (РДСВ), волчанку, пропотевание жидкости через сосуды, защиту от ишемического или реперфузионного повреждения, такого как ишемическое или реперфузионное повреждение, произведенное во время трансплантации органов, индукции трансплантационной толерантности; ишемическое или реперфузионное повреждение после ангиопластики; артрит (такой как ревматоидный артрит, псориатический артрит или остеоартрит); рассеянный склероз; воспалительное заболевание кишечника, включая язвенный колит и болезнь Крона; волчанку (системную эритематозную волчанку); реакцию «трансплантат против хозяина»; опосредованные T-клетками состояния гиперчувствительности, включая контактную гиперчувствительность, гиперчувствительность замедленного типа и глютеновую энтеропатию (целиакию); диабет типа 1; псориаз; контактный дерматит (включая вследствие сумаха ядовитого); тиреоидит Хашимото; синдром Шегрена; аутоиммунный гипертиреоз, такой как болезнь Грейвса; болезнь Аддисона (аутоиммунное заболевание надпочечников); аутоиммунное полигландулярное заболевание (также известное как аутоиммунный полигландулярный синдром); аутоиммунную алопецию; пернициозную анемию; витилиго; аутоиммунный гипопитуитаризм; синдром Гийена-Барре; другие аутоиммунные заболевания; раковые заболевания, включая заболевания, при которых киназы, такие как киназы Src-семейства активируются или сверхэкспрессируются, такие как рак толстой кишки и тимома, или раковые заболевания, при которых активность киназы облегчает рост опухоли или выживаемость; гломерулонефрит, сывороточную болезнь; крапивницу; аллергические заболевания, такие как респираторные аллергии (астма, поллиноз, аллергический ринит) или кожную аллергию; грибовидный микоз; острые воспалительные реакции (такие как острый или респираторный дистресс-синдром взрослых и ишемическое реперфузионное повреждение); дерматомиозит; гнездную алопецию; стойкую солнечную эритему; экзему; болезнь Бехчета; ладонно-подошвенный пустулез; гангренозную пиодермию; синдром Сезари; атопический дерматит; системный склероз; кольцевидную склеродермию; периферическую ишемию конечностей и ишемическое заболевание конечностей; болезни костей, такие как остеопороз, остеомаляция, гиперпаратиреоз, болезнь Педжета и почечная остеодистрофия; синдромы пропотевания жидкости из сосудов, включая синдромы пропотевания жидкости из сосудов, вызванные химиотерапией или иммуномодуляторами, такими как ИЛ-2; повреждение или травму спинного мозга или головного мозга; глаукому; заболевания сетчатки, включая макулярную дегенерацию; витреоретинальное заболевание; панкреатит; васкулиты, включая васкулит, болезнь Кавасаки, облитерирующий тромбангиит, гранулематоз Вегенера и болезнь Бехчета; склеродермию; преэклампсию; талассемию; саркому Капоши; болезнь фон Гиппеля-Линдау; и подобные.
[0086] В соответствии с изобретением соединения изобретения могут быть использованы для лечения заболеваний, связанных с нежелательной клеточной пролиферацией или гиперпролиферацией, включающего идентификацию млекопитающего, страдающего указанным заболеванием или состоянием, и введение указанному страдающему млекопитающему композиции, содержащей соединение формулы 1, при котором заболевание или состояние связано с киназой.
[0087] Изобретение также относится к способам лечения млекопитающих, страдающих вышеуказанными заболеваниями и состояниями. Количество соединений настоящего изобретения, которое можно комбинировать с материалами-носителями для получения композиции в единичной лекарственной форме, будет варьироваться в зависимости от объекта, которого лечат, определенного режима введения. Предпочтительно, композиции должны быть составлены так, чтобы пациенту, получающему данные композиции, можно было вводить дозировку от 0,01 до 100 мг/кг массы тела/день ингибитора.
[0088] В одном аспекте соединения изобретения вводят в комбинации с химиотерапевтическим средством, противовоспалительным средством, антигистаминными средствами, химиотерапевтическим средством, иммуномодулятором, терапевтическим антителом или ингибитором протеинкиназы, например, ингибитором тирозинкиназы, объекту, нуждающемуся в таком лечении.
[0089] Способ включает введение одного или более соединений изобретения млекопитающему, подлежащему лечению. Способ может дополнительно включать введение второго активного агента, такого как цитотоксический агент, включая алкилирующие агенты, факторы некроза опухолей, интеркаляторы, ингибиторы микротубулина и ингибиторы топоизомеразы. Второй активный агент можно вводить совместно в той же композиции или во второй композиции. Примеры подходящих вторых активных агентов включают, но не ограничиваются ими, цитотоксические лекарственные средства, такие как ацивицин; акларубицин; акодазола гидрохлорид; акронин; адозелезин; альдеслейкин; алтретамин; амбомицин; аметантрона ацетат; аминоглутетимид; амсакрин; анастрозол; антрамицин; аспарагиназа; асперлин; азацитинид; азетепа; азотомицин; батимастат; бензодепа; бикалутамид; бизантрена гидрохлорид; биснафида димезилат; бизелезин; блеомицина сульфат; бреквинар натрия; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицина гидрохлорид; карзелезин; цедефингол; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатола мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицина гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанина мезилат; диазиквон; доцетаксел; доксорубицин; доксорубицина гидрохлорид; дролоксифен; дролоксифена цитрат; дромостанолона пропионат; дуазомицин; эдатрексат; эфлорнитина гидрохлорид; элсамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицина гидрохлорид; эрбулозол; эзорубицина гидрохлорид; эстрамустин; эстрамустина фосфат натрия; этанидазол; эфирное масло 131; этопозид; этопозида фосфат; этоприн; фадрозола гидрохлорид; фазарабин; фенретинид; флоксуридин; флударабина фосфат; фторурацил; фторцитабин; фосквидон; фостриецин натрия; гемцитабин; гемцитабина гидрохлорид; золото Au 198; гидроксимочевина; идарубицина гидрохлорид; ифосфамид; илмофозин; интерферон альфа-2а; интерферон альфа-2b; интерферон альфа-n1; интерферон альфа-n3; интерферон бета-1a; интерферон гамма-Ib; ипроплатин; иринотекана гидрохлорид; ланреотида ацетат; летрозол; лейпролида ацетат; лиарозола гидрохлорид; лометрексол натрия; ломустин; лозоксантрона гидрохлорид; мазопрокол; майтанзин; мечлоретамина гидрохлорид; мегестрола ацетат; меленгестрола ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрия; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митогиллин; митомальцин; митомицин; митоспер; митотан; митоксантрона гидрохлорид; микофеноловая кислота; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пегаспаргаза; пелиомицин; пентамустин; пепломицина сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрона гидрохлорид; пликамицин; пломестан; порфимер натрия; порфиромицин; преднимустин; прокарбазина гидрохлорид; пуромицин; пуромицина гидрохлорид; пиразофурин; рибоприн; роглетимид; сафингол; сафингола гидрохлорид; семустин; симтразен; спарфосат натрия; спарсомицин; спирогермания гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; стронция хлорид Sr 89; сулофенур; тализомицин; таксан; таксоид; текогалан натрия; тегафур; телоксантрона гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепа; тиазофурин; тирапазамин; топотекана гидрохлорид; торемифена цитрат; трестолона ацетат; трицирибина фосфат; триметрексат; триметрексата глюкуронат; трипторелин; тубулозола гидрохлорид; иприт-урацила; уредепа; вапреотид; вертепорфин; винбластина сульфат; винкристина сульфат; виндезин; виндезина сульфат; винепидина сульфат; винглицината сульфат; винлейрозина сульфат; винорелбина тартрат; винрозидина сульфат; винзолидина сульфат; ворозол; зениплатин; зиностатин и зорубицина гидрохлорид.
[0090] В соответствии с изобретением соединения и композиции могут быть использованы при субцитотоксических дозах в комбинации с другими агентами для достижения высокой селективной активности при лечении не связанных с новообразованиями нарушений, таких как заболевание сердца, инсульт и нейродегенеративные заболевания (Whitesell et al., Curr Cancer Drug Targets (2003), 3(5), 349-58).
[0091] Примерные терапевтические агенты, которые могут быть введены в комбинации с соединениями изобретения, включают ингибиторы EGFR, такие как гефитиниб, эрлотиниб и цетуксимаб. Ингибиторы Her2 включают канертиниб, EKB-569 и GW-572016. Также включены ингибиторы Src, дазатиниб, также как Касодекс (бикалутамид), Тамоксифен, ингибиторы киназы МЕК-1, ингибиторы киназы MARK, ингибиторы PI3 и ингибиторы PDGF, такие как иматиниб, ингибиторы Hsp90, такие как 17-AAG и 17-DMAG. Также включены антиангиогенные и антиваскулярные средства, которые с помощью нарушения тока крови к солидным опухолям оставляют раковые клетки в состоянии покоя, не допуская их питания. Также может быть использована кастрация, которая также оказывает влияние на андрогензависимые непролиферативные карциномы. Также включены ингибиторы IGF1R, ингибиторы нерецепторных и рецепторных тирозинкиназ и ингибиторы интегрина.
[0092] Фармацевтическая композиция и способ настоящего изобретения может дополнительно комбинировать другие белковые терапевтические средства, такие как цитокины, иммуномодулирующие средства и антитела. Используемый в данном описании термин «цитокин» включает в себя хемокины, интерлейкины, лимфокины, монокины, колониестимулирующие факторы и ассоциированные с рецепторами белки и их функциональные фрагменты. Используемый в данном описании термин «функциональный фрагмент» относится к полипептиду или пептиду, который обладает биологической функцией или активностью, которая идентифицируется в результате определенного функционального анализа. Цитокины включают эндотелиальный моноцит-активирующий пептид II (EMAP-II), гранулоцитарно-макрофагальный КСФ (ГМ-КСФ), гранулоцитарный КСФ (Г-КСФ), макрофагальный КСФ (M-КСФ), ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-12 и ИЛ-13, интерфероны, и подобные, и которые связаны с определенным биологическим, морфологическим или фенотипическим изменением в клетке или клеточном механизме.
[0093] Другие терапевтические агенты для комбинаторной терапии включают циклоспорины (например, циклоспорин А), CTLA4-Ig, антитела, такие как ICAM-3, рецептор анти-ИЛ-2 (анти-Тас), анти-CD45RB, анти-CD2; анти-CD3 (ОКТ-3), анти-CD4, анти-CD80, анти-CD86, агенты, блокирующие взаимодействие между CD40 и gp39, такие как антитела, специфичные для CD40 и для gpn39 (т.е. CD154), слитые белки, построенные из CD40 и gp39 (CD40Ig и CD8gp39), ингибиторы, такие как ингибиторы ядерной транслокации, из NF-каппа B функции, такие как деоксиспергуалин (DSG), ингибиторы биосинтеза холестерина, такие как ингибиторы HM:G-CоА-редуктазы (ловастатин и симвастатин), нестероидные противовоспалительные средства (НПВС), такие как ибупрофен и ингибиторы циклооксигеназы, такие как рофекоксиб, стероиды, такие как преднизон или дексаметазон, соединения золота, антипролиферативные средства, такие как метотрексат, FK506 (такролимус, Програф), мофетила микофенолат, цитотоксические лекарственные средства, такие как азатиоприн и циклофосфамид, ингибиторы TNF-a, такие как тенидап, антитела анти-TNF или растворимый рецептор TNF и рапамицин (сиролимус или Рапамун) или их производные.
[0094] Когда другие терапевтические средства применяют в комбинации с соединениями настоящего изобретения, они могут быть использованы, например, в количествах, как отмечено в справочнике лекарственных средств (PDR) или как иным способом определено специалистом в данной области техники.
ПРИМЕРЫ
[0095] Следующие примеры предназначены для дополнительной иллюстрации настоящего изобретения, но, безусловно, не должны быть истолкованы как каким-либо образом ограничивающие его объем.
[0096] Все эксперименты проводили в безводных условиях (то есть в сухих растворителях) в атмосфере аргона, за исключением случаев, когда это указано, с использованием устройств горячей сушки и с применением стандартных методик обработки чувствительных к воздушной среде материалов. Водные растворы бикарбоната натрия (NaHCO3) и хлорида натрия (солевой раствор) являлись насыщенными.
[0097] Аналитическую тонкослойную хроматографию (ТСХ) проводили на пластинках Merck Kiesel gel 60 F254 с визуализацией с помощью ультрафиолета и/или погружений в анисовый альдегид, перманганат калия или фосфорномолибденовую кислоту.
[0098] Спектры ЯМР: 1H-Спектры ядерного магнитного резонанса регистрировали при 400 МГц. Данные представлены следующим образом: химический сдвиг, мультиплетность (с=синглет, д=дублет, т=триплет, к=квартет, кв=квинтет, дд=дублет дублетов, м=мультиплет, уш.с=уширенный синглет), константа взаимодействия (J/Гц) и интегрирование. Константы взаимодействия были взяты и вычислены непосредственно из спектров и не корректировались.
[0099] Масс-спектр низкого разрешения: использовали ионизацию электрораспылением (ES+). Указан протонированный родоначальный ион (M+H) или родоначальный ион натрия (M+Na) или фрагмент самой высокой массы. Аналитический градиент состоял из 10% АЦН в воде, доводя до 100% АЦН более 5 минут, если не указано иначе.
[0100] Высокоэффективную жидкостную хроматографию (ВЭЖХ) использовали для анализа чистоты производных. ВЭЖХ проводили на колонке Phenomenex Synergi Polar-RP, 4u, 80A, 150×4,6 мм, используя систему Shimadzu, оборудованную диодно-матричным детектором SPD-M10A. Подвижной фазой А являлась вода и подвижной фазой В являлся ацетонитрил с градиентом от 20% до 80% В более 60 минут и повторное уравновешивание при A/B (80:20) в течение 10 минут. УФ-детектирование проводили при 220 и 54 нм.
ПРИМЕР 1
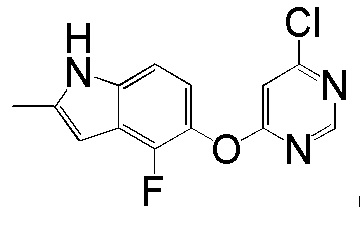 (1)
(1)
[0101] К раствору 4-фтор-2-метил-1Н-индол-5-ола (2,00 г, 12,11 ммоль) и 4,6-дихлорпиридина (2,00 г, 13,44 ммоль) в ДМСО (18 мл) добавляли карбонат калия (3,77 г, 27,25 ммоль) и смесь нагревали при 80°С в течение 60 мин с помощью микроволнового реактора initiator Biotage. Проверяли ТСХ и расходовали исходный материал. Реакционную смесь добавляли в емкость с водой (350 мл) и смесь перемешивали при комнатной температуре в течение 1 часа, затем выдерживали при 4°С в течение ночи. pН доводили до 6-7 с помощью 2N HCl и смесь охлаждали на ледяной бане. Твердое вещество собирали фильтрованием и промывали водой. После сушки на вакуумной линии соединение 1 получали в виде желтого твердого вещества (3,1 г, выход 92%). Никакую дополнительную очистку не проводили и продукт непосредственно использовали для следующей стадии реакции. 1H ЯМР (400 МГц, ДМСО-d6) δ 11,37 (уш.с, 1H), 8,63 (с, 1H), 7,43 (с, 1H), 7,13 (д, J= 8,8 Гц, 1H), 6,95 (т, J= 7,6 Гц, 1Н), 6,25 (с, 1Н), 2,40 (с, 3Н); ESI-МС: вычислено для (C13H9ClFN3O) 277, найдено 278 (MH+).
ПРИМЕР 2
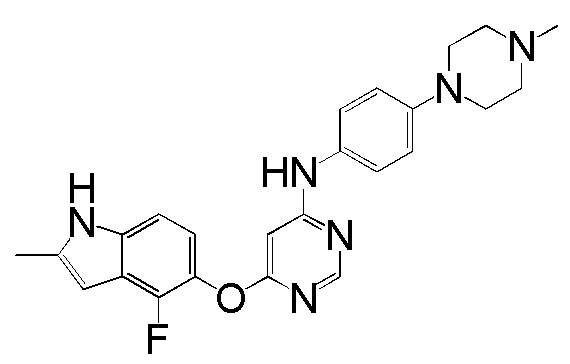
(2)
[0102] Смесь соединения 1 (161 мг, 0,58 ммоль), 4-(4-метилпиперазино)анилина (138 мг, 0,72 ммоль), ацетата палладия (II) (20 мг, 0,09 ммоль), ксантфоса (4,5-дифенилфосфанил-9,9'-диметил-9H-ксантена, 83 мг, 0,15 ммоль) и K2CO3 (500 мг, 3,62 ммоль) в 1,4-диоксане (8 мл) продували аргоном в течение 30 мин. Смесь нагревали с помощью микроволнового реактора initiator Biotage при 120°С в течение 15 мин. Проверяли ТСХ и реакцию завершали. Реакционную смесь разбавляли ДХМ и промывали насыщ. NH4Cl, солевым раствором, высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-15% MeOH в ДХМ) с получением соединения 2 в виде желтого твердого вещества (93 мг, выход 37%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,27 (уш.с, 1H), 9,25 (с, 1H), 8,18 (с, 1H), 7,31 (д, J= 8,8 Гц, 2H), 7,08 (д, J= 8,8 Гц, 1H), 6,84 (м, 3H), 6,20 (с, 1H), 5,90 (уш.с, 1H), 3,02 (м, 4H), 2,41 (м, 4H), 2,36 (уш.с, 3H), 2,18 (с, 3H); ESI-МС: вычислено для (C24H25FN6O) 432, найдено 433 (MH+).
ПРИМЕР 3
 (3)
(3)
[0103] Смесь соединения 1 (180 мг, 0,65 ммоль), 4-(4-этилпиперазин-1-ил)анилина (121 мг, 0,59 ммоль), ацетата палладия (II) (20 мг, 0,09 ммоль), ксантфоса (4,5-дифенилфосфанил-9,9'-диметил-9H-ксантена, 83 мг, 0,15 ммоль) и K2CO3 (500 мг, 3,62 ммоль) в 1,4-диоксане (8 мл) продували аргоном в течение 30 мин. Смесь нагревали с помощью масляной бани при 100°С в течение 2 ч. Проверяли ТСХ и реакцию завершали. Реакционную смесь разбавляли ДХМ/ИПС (10/1) и промывали насыщ. NH4Cl, солевым раствором, высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-15% MeOH в ДХМ) с получением соединения 3 в виде желтого твердого вещества (131 мг, выход 50%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,31 (уш.с, 1H), 9,24 (с, 1H), 8,21 (с, 1H), 7,35 (д, J= 8,8 Гц, 2H), 7,13 (д, J= 8,8 Гц, 1H), 6,87 (м, 3H), 6,28 (с, 1H), 5,94 (уш.с, 1H), 3,06 (м, 4H), 2,49 (м, 4H), 2,39 (м, 5H), 1,02 (т, J= 6,8 Гц, 3H); ESI-МС: вычислено для (C25H27FN6O) 446, найдено 447 (MH+).
ПРИМЕР 4
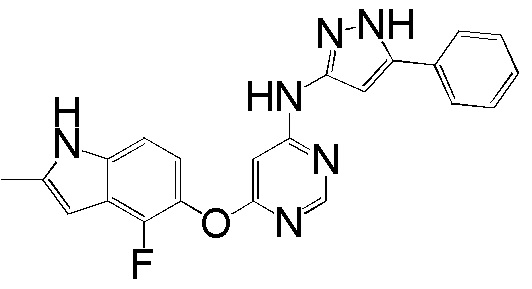
(4)
[0104] Раствор соединения 1 (180 мг, 0,65 ммоль), 3-амино-5-фенилпиразола (124 мг, 0,78 ммоль) и DIPEA (0,23 мл, 1,30 ммоль) в ДМСО (3,5 мл) перемешивали при 120°С в течение 120 часов. После охлаждения до комнатной температуры добавляли воду (10 мл) и реакционную смесь экстрагировали ИПС/ДХМ (1/9). Объединенный органический слой промывали солевым раствором, высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (0-10% MeOH в ДХМ) с получением соединения 4 в виде коричневого твердого вещества (60 мг, выход 23%). 1H ЯМР (400 МГц, ДМСО-d6) δ 12,75 (уш.с, 1Н), 11,25 (уш.с, 1Н), 9,90 (уш.с, 1Н), 8,24 (с, 1Н), 7,67 (д, J= 7,6 Гц, 2H), 7,42 (т, J= 7,6 Гц, 2H), 7,32 (т, J= 7,6 Гц, 1H), 7,10 (д, J= 8,8 Гц, 1H), 6,86 (т, J= 8,4 Гц, 1H) 6,80-6,50 (уш.с, 2H), 6,20 (с, 1H), 2,37 (уш.с, 3H); ESI-МС: вычислено для (C22H17FN6O) 400, найдено 401 (MH+).
ПРИМЕР 5
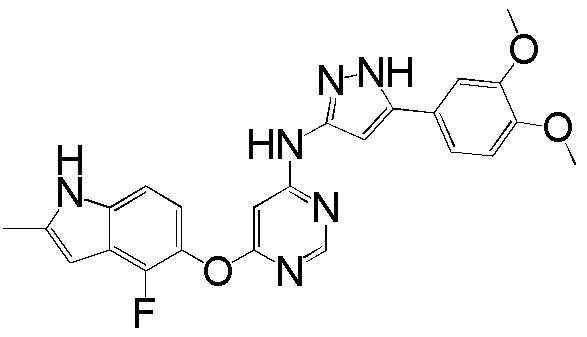
(5)
[0105] Раствор соединения 1 (150 мг, 0,54 ммоль), 5-(3,4-диметоксифенил)-1Н-пиразол-3-амина (142 мг, 0,65 ммоль) и DIPEA (0,19 мл, 1,08 ммоль) в ДМСО (5 мл) перемешивали при 120°С в течение 96 часов. После охлаждения до комнатной температуры смесь добавляли к воде (75 мл) и перемешивали при комнатной температуре в течение 30 мин. pH смеси доводили до 1~2 с использованием 2N HCl. Охлаждали с помощью ледяной бани и твердое вещество собирали фильтрованием, промывали водой с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (0-10% MeOH в ДХМ) с получением соединения 5 в виде желтого твердого вещества (61 мг, выход 25%). 1H ЯМР (400 МГц, ДМСО-d6) δ 12,61 (уш.с, 1Н), 11,30 (уш.с, 1Н), 9,89 (уш.с, 1Н), 8,27 (с, 1Н), 7,30 (с, 1Н) 7,23 (д, J= 8,4 Гц, 1H), 7,13 (д, J= 8,8 Гц, 1H), 7,02 (д, J= 8,4 Гц, 1H), 6,89 (т, J= 8,4 Гц, 1H), 6,80-6,50 (уш.с, 2H), 6,23 (с, 1H), 3,82 (с, 3H), 3,78 (с, 3H), 2,40 (уш.с, 3H); ESI-МС вычислено для (C24H21FN6O3) 460, найдено 461 (MH+).
ПРИМЕР 6
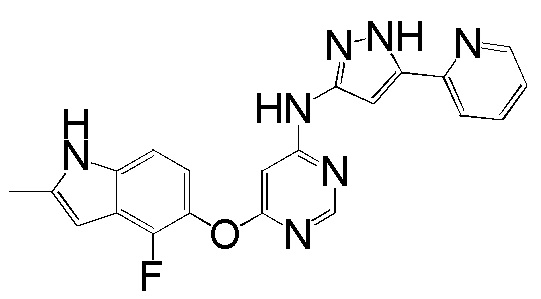
(6)
[0106] Раствор соединения 1 (100 мг, 0,36 ммоль), 5-пиридин-2-ил-2Н-пиразол-3-иламина (58 мг, 0,36 ммоль) и DIPEA (0,13 мл, 0,72 ммоль) в ДМСО (5 мл) перемешивали при 120°С в течение 96 часов. После охлаждения до комнатной температуры добавляли воду (10 мл) и реакционную смесь экстрагировали ИПС/ДХМ (1/9). Объединенный органический слой промывали солевым раствором, высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (0-10% MeOH в ДХМ) с получением соединения 6 в виде коричневого твердого вещества (33 мг, выход 23%). 1H ЯМР (400 МГц, ДМСО-d6) δ 13,01 (уш.с, 1H), 11,30 (уш.с, 1H), 9,96 (уш.с, 1H), 8,61 (уш.с, 1H), 8,28 (с, 1H), 7,90-7,70 (м, 2H), 7,32 (м, 1H), 7,13 (д, J= 8,4 Гц, 1H), 6,89 (т, J= 8,4 Гц, 1H), 7,00-6,50 (уш.с, 2H) 6,23 (с, 1H), 2,40 (уш.с, 3H); ESI-МС: вычислено для (C21H16FN7O) 401, найдено 402 (MH+).
ПРИМЕР 7

(7)
[0107] Раствор соединения 1 (300 мг, 1,08 ммоль) N-(4-аминофенил)ацетамида (154 мг, 1,03 ммоль) и DIPEA (0,47 мл, 2,70 ммоль) в ДМСО (10 мл) перемешивали при 100°C в течение 24 часов. После охлаждения до комнатной температуры смесь добавляли к воде/солевому раствору (75 мл), и перемешивали при комнатной температуре в течение 30 мин, и охлаждали на ледяной бане, и твердое вещество собирали фильтрованием, промывали водой с получением неочищенного продукта приблизительно 200 мг. Неочищенный продукт очищали с помощью колонки на силикагеле (0-10% MeOH в ДХМ) с получением соединения 7 в виде твердого вещества (68 мг, выход 16%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,32 (уш.с, 1H), 9,85 (уш.с, 1H), 8,27 (с, 1H), 7,50 (м, 4H), 7,12 (д, J= 8,8 Гц, 1H), 6,89 (т, J= 8,4 Гц, 1H), 6,24 (уш.с, 1H), 6,23 (с, 1H), 2,40 (с, 3H), 2,01 (с, 3H); ESI-МС: вычислено для (C21H18FN5O2) 460, найдено 461 (MH+).
ПРИМЕР 8
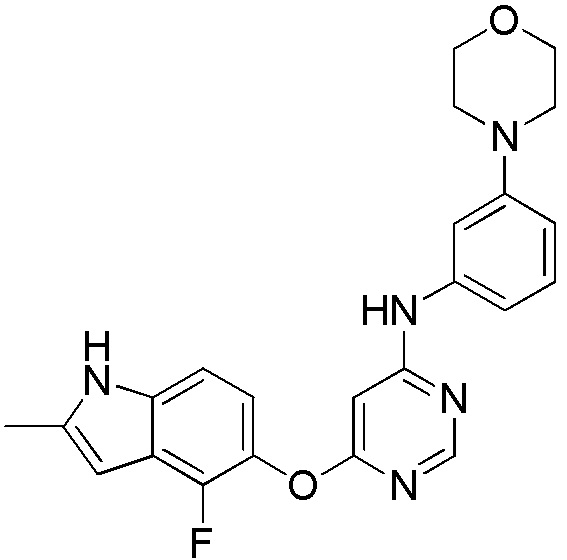
(8)
[0108] Раствор соединения 1 (200 мг, 0,72 ммоль), 3-морфолинанилина (122 мг, 0,95 ммоль) и DIPEA (0,31 мл, 1,80 ммоль) в ДМСО (10 мл) перемешивали при 100°С в течение 40 часов. После охлаждения до комнатной температуры смесь экстрагировали этилацетатом (3×35 мл) и промывали холодной водой и солевым раствором. Органические слои испаряли и полученный неочищенный продукт очищали с помощью колонки на силикагеле (0-5% MeOH в ДХМ) с получением соединения 8 в виде твердого вещества (50 мг, выход 17%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,33 (уш.с, 1H), 9,39 (уш.с, 1H), 8,30 (с, 1H), 7,15 (м, 3H), 7,01 (м, 1H), 6,89 (м, 1H), 6,62 (уш.с, 1H), 6,23 (уш.с, 1H), 6,06 (м, 1H), 3,71 (м, 4H), 3,03 (м, 4H), 2,40 (с, 3H); ESI-МС: вычислено для C23H22FN5O2 419, найдено 420 (MH+).
ПРИМЕР 9

(9)
[0109] Раствор соединения 1 (200 мг, 0,72 ммоль), 4-морфолинанилина (122 мг, 0,95 ммоль) и DIPEA (0,31 мл, 1,80 ммоль) в ДМСО (10 мл) перемешивали при 100°С в течение 30 часов. После охлаждения до комнатной температуры смесь экстрагировали этилацетатом (3×35 мл) и промывали холодной водой и солевым раствором. Органические слои испаряли и полученный неочищенный продукт очищали с помощью колонки на силикагеле (0-5% MeOH в ДХМ) с получением соединения 9 в виде твердого вещества (130 мг, выход 43%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,31 (уш.с, 1H), 9,26 (уш.с, 1H), 8,26 (с, 1H), 7,37 (м, 2H), 7,11 (м, 1H), 6,88 (м, 3H), 6,23 (уш.с, 1H), 5,95 (с, 1H), 5,75 (с, 1H), 3,72 (м, 4H), 3,05 (м, 4H), 2,40 (с, 3H); ESI-МС: вычислено для C23H22FN5O2 419, найдено 420 (MH+).
ПРИМЕР 10
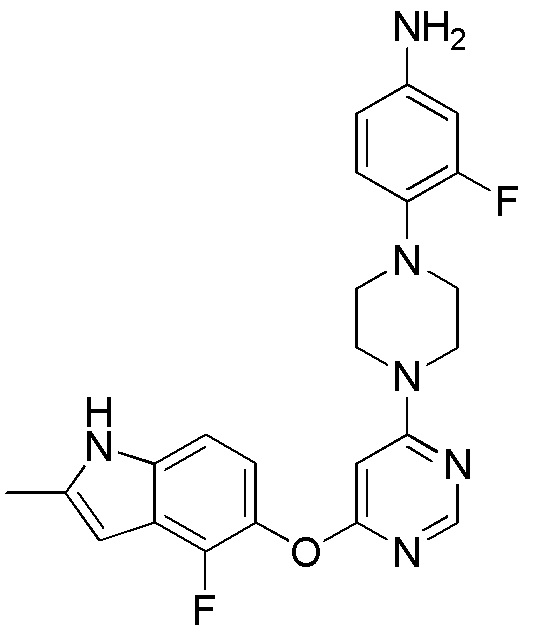
(10)
[0110] Раствор соединения 1 (200 мг, 0,72 ммоль), 3-фтор-4-(4-метилпиперазин-1-ил)анилина (143 мг, 0,68 ммоль) и DIPEA (0,31 мл, 1,80 ммоль) в ДМСО (10 мл) перемешивали при 100°C в течение 16 часов. После охлаждения до комнатной температуры смесь добавляли к воде/солевому раствору (75 мл), и перемешивали при комнатной температуре в течение 30 минут, и охлаждали на ледяной бане, и твердое вещество собирали фильтрованием, промывали водой с получением неочищенного продукта. Органические слои испаряли и полученный неочищенный продукт очищали с помощью колонки на силикагеле (0-5% MeOH в ДХМ) с получением соединения 10 в виде твердого вещества (130 мг, выход 43%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,26 (уш.с, 1H), 8,14 (уш.с, 1H), 8,14 (с, 1H), 7,09 (м, 1H), 6,83 (м, 2H), 6,47 (м, 2H), 6,40 (с, 1H), 6,32 (с, 1H), 6,20 (с, 1H), 3,71 (м, 4H), 2,91 (м, 4H), 2,40 (с, 3H); ESI-МС: вычислено для (C23H22F2N6O) 436, найдено 437 (MH+).
ПРИМЕР 11
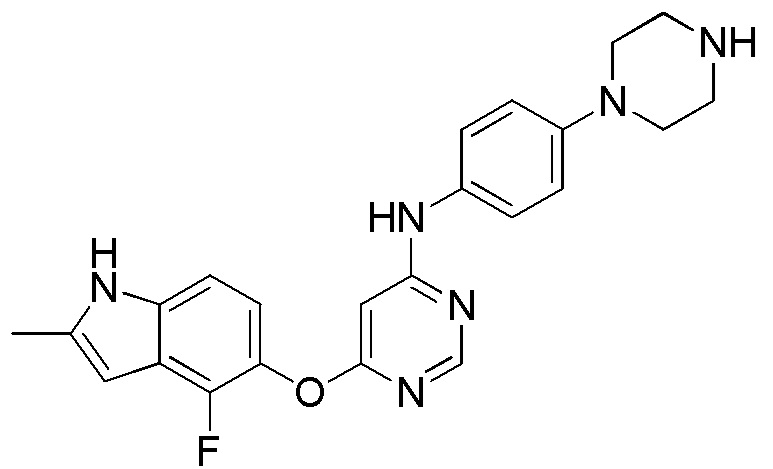
(11)
[0111] Смесь соединения 1 (300 мг, 0,68 ммоль), трет-бутил-4-(4-аминофенил) пиперазин-1-карбоксилата (285 мг, 1,03 ммоль) и DIPEA (0,47 мл, 2,70 ммоль) в ДМСО (10 мл) перемешивали при 100°С в течение ночи. После охлаждения до комнатной температуры смесь добавляли к воде (100 мл) и перемешивали при комнатной температуре в течение 30 мин. После охлаждения на ледяной бане твердое вещество собирали фильтрованием, промывали водой. После сушки на воздухе при комнатной температуре в течение ночи твердое вещество суспендировали в ДХМ/ТФУК (10/1, 10 мл). Смесь перемешивали при комнатной температуре в течение ночи. После перемешивания в течение ночи растворители испаряли, и остаток растворяли в ДХМ/MeOH (8/2, 15 мл), и промывали насыщенным раствором бикарбоната натрия. Органический слой высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-15% MeOH в ДХМ) с получением соединения 11 в виде белого с желтоватым или сероватым оттенком твердого вещества (130 мг, выход 42%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,70 (уш.с, 1H), 11,33 (уш.с, 1H), 9,28 (с, 1H), 8,22 (с, 1H), 7,37 (м, 2H), 7,14 (м, 1H), 6,89 (м, 1H), 6,23 (уш.с, 1H), 5,94 (с, 1H), 2,99 (м, 4H), 2,85 (м, 4H), 2,40 (уш.с, 3H); ESI-МС: вычислено для (C23H23FN6O) 418, найдено 419 (MH+).
ПРИМЕР 12
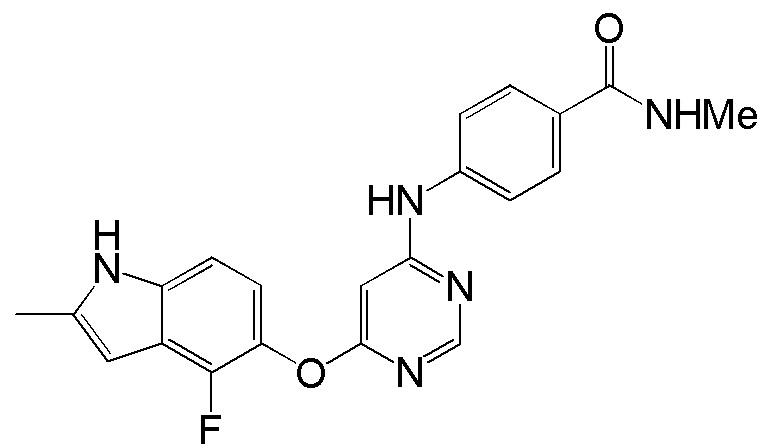
(12)
[0112] Смесь соединения 1 (200 мг, 0,72 ммоль), 4-амино-N-метилбензамида (108 мг, 0,72 ммоль), ксантфоса (4,5-дифенилфосфанил-9,9'-диметил-9H-ксантена, 104 мг, 0,18 ммоль), K2CO3 (1,59 г, 11,52 ммоль) и ацетата палладия (II) (24 мг, 0,11 ммоль) в 1,4-диоксане (12 мл) продували аргоном в течение 1 часа. Смесь нагревали в микроволновом реакторе в течение 30 мин при 120°С. Проверяли ТСХ, и исходный материал почти израсходовался. После охлаждения до комнатной температуры реакционную смесь разбавляли ДХМ/MeOH (8/2), и пропускали через слой целита, и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 5% MeOH в ДХМ). После удаления растворителей соединение 12 получали в виде коричневого твердого вещества (134 мг, выход 48%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,35 (с, 1Н), 9,75 (уш.с, 1H), 8,40 (с, 1Н), 8,27 (м, 1Н), 7,77 (м, 2H), 7,70 (м, 2H), 7,16 (м, 1H), 6,94 (м, 1H), 6,25 (с, 1H), 6,14 (с, 1H), 2,77 (с, 3H), 2,40 (с, 3H); ESI-МС: вычислено для (C21H18FN5O2) 391, найдено 392 (MH+).
ПРИМЕР 13
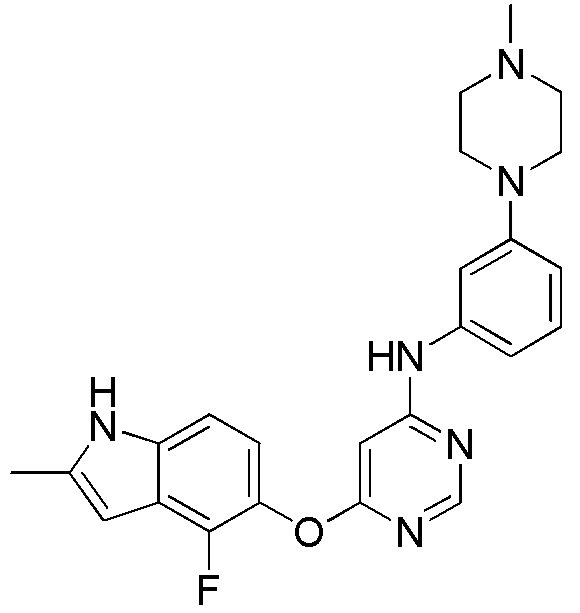
(13)
[0113] Смесь соединения 1 (200 мг, 0,72 ммоль), 4-амино-N-метилбензамида (108 мг, 0,72 ммоль), ксантфоса (4,5-дифенилфосфанил-9,9'-диметил-9H-ксантена, 104 мг, 0,18 ммоль), K2CO3 (1,59 г, 11,52 ммоль) и ацетата палладия (II) (24 мг, 0,11 ммоль) в 1,4-диоксане (12 мл) продували аргоном в течение 1 часа. Смесь нагревали в микроволновом реакторе в течение 30 мин при 120°С. Проверяли ТСХ, и исходный материал почти израсходовался. После охлаждения до комнатной температуры реакционную смесь разбавляли ДХМ/MeOH (8/2), и пропускали через слой целита, и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-10% MeOH в ДХМ). После удаления растворителей соединение 13 получали в виде коричневого твердого вещества (75 мг, выход 24%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,33 (с, 1H), 9,37 (уш.с, 1H), 8,29 (с, 1H), 7,11 (м, 3H), 7,01 (м, 1H), 6,89 (м, 1H), 6,61 (м, 1H), 6,24 (уш.с, 1H), 6,01 (м, 1H), 3,07 (с, 3H), 2,40 (м, 7H), 2,21 (с, 3H); ESI-МС: вычислено для (C24H25FN6O) 432, найдено 433 (MH+).
ПРИМЕР 14
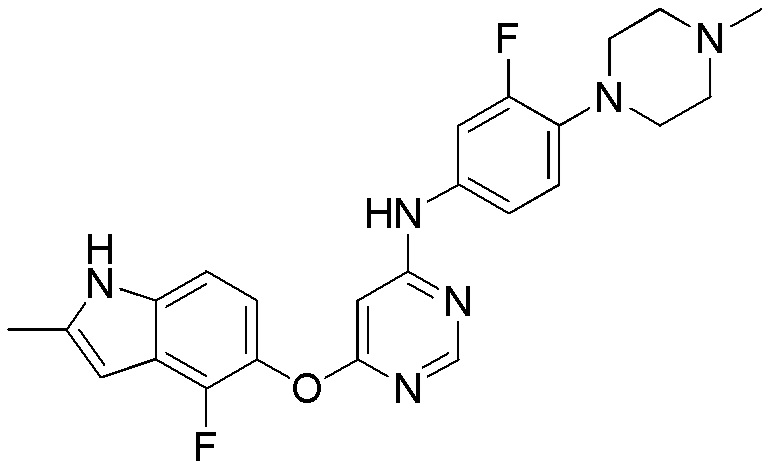
(14)
[0114] Смесь соединения 1 (200 мг, 0,72 ммоль), 3-фтор-4-(4-метилпиперазин-1-ил)анилина (150,72 мг, 0,72 ммоль), ксантфоса (4,5-дифенилфосфанил-9,9'-диметил-9H-ксантена (104 мг, 0,18 ммоль), K2CO3 (1,59 г, 11,52 ммоль) и ацетата палладия (II) (24 мг, 0,11 ммоль) в 1,4-диоксане (12 мл) продували аргоном в течение 1 часа. Смесь нагревали в микроволновом реакторе в течение 45 мин при 120°С. Проверяли ТСХ, и исходный материал почти израсходовался. После охлаждения до комнатной температуры реакционную смесь разбавляли ДХМ/MeOH (8/2), и пропускали через слой целита, и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-12% MeOH в ДХМ). После удаления растворителей соединение 14 получали в виде коричневого твердого вещества (68 мг, выход 21%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,33 (уш.с, 1H), 9,50 (с, 1H), 8,32 (с, 1H), 7,61 (м, 1H), 7,15 (м, 2H), 6,90 (м, 2H), 6,24 (с, 1H), 6,01 (с, 1H), 2,95 (м, 4H), 2,46 (м, 4H), 2,40 (с, 3H), 2,23 (с, 3H); ESI-МС: вычислено для (C24H24F2N6O) 450, найдено 451 (MH+).
ПРИМЕР 15
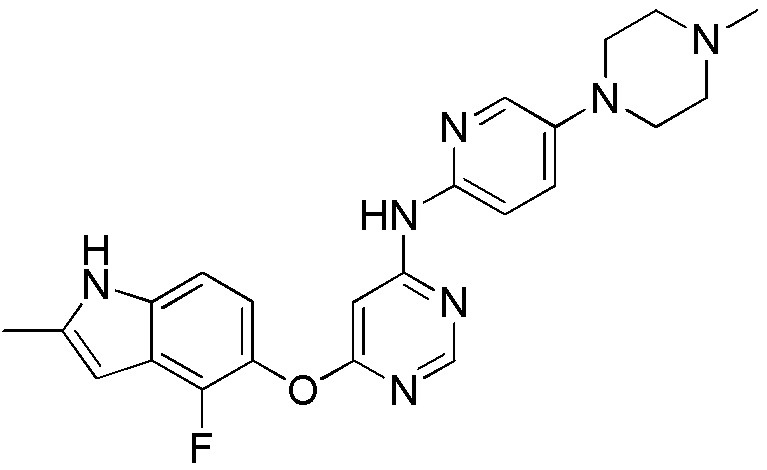
(15)
[0115] Смесь соединения 1 (200 мг, 0,72 ммоль), 5-(4-метилпиперазин-1-ил)пиридин-2-амина (138,48 мг, 0,72 ммоль), ксантфоса (4,5-дифенилфосфанил-9,9'-диметил-9H-ксантена, 104 мг, 0,18 ммоль), К2СО3 (1,59 г, 11,52 ммоль) и ацетата палладия (II) (24 мг, 0,11 ммоль) в 1,4-диоксане (12 мл) продували аргоном в течение 1 часа. Смесь нагревали в микроволновом реакторе в течение 45 мин при 120°С. Проверяли ТСХ, и исходный материал почти израсходовался. После охлаждения до комнатной температуры реакционную смесь разбавляли ДХМ/MeOH (8/2), и пропускали через слой целита, и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-12% MeOH в ДХМ). После удаления растворителей получали соединение 15 (84 мг, выход 27%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,29 (уш.с, 1H), 9,94 (с, 1H), 8,26 (с, 1H), 7,93 (м, 1H), 7,43 (м, 2H), 7,23 (уш.с, 1H), 7,11 (м, 1H), 6,89 (м, 1H), 6,22 (с, 1H), 3,09 (м, 4H), 2,46 (м, 4H), 2,40 (с, 3H), 2,22 (с, 3Н); ESI-МС: вычислено для (C23H24FN7O) 433, найдено 434 (МН+). ВЭЖХ: время удерживания: 7,71 мин, чистота: 97%.
ПРИМЕР 16
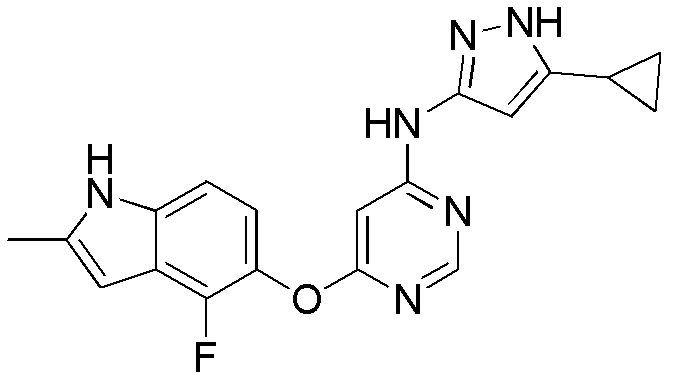
(16)
[0116] Раствор соединения 1 (0,150 г, 0,540 ммоль), 3-циклопропил-1Н-пиразол-5-амина (0,080 г, 0,648 ммоль), диизопропилэтиламина (0,140 г, 1,080 ммоль) и иодида натрия (0,089 г, 0,540 ммоль) в диметилсульфоксиде (1,5 мл) в атмосфере аргона нагревали до 150°С в течение 24 ч в герметичной пробирке. После охлаждения смеси экстрагировали этилацетатом (100 мл) и промывали насыщ. NaHCO3. Объединенные органические слои высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии на силикагеле с помощью CH2Cl2:MeOH (9:1) с получением соединения 16 (0,029 г, 15%) в виде бежевого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,99 (уш.с, 1H), 11,29 (с, 1H), 9,71 (с, 1H), 8,21 (с, 1H), 7,010 (д, 1H, J= 8,4 Гц), 6,87 (м, 1H), 6,22 (с, 1H), 5,85 (уш.с, 1H), 2,40 (с, 3H), 1,84 (м, 1H), 0,89 (м, 2H), 0,65 (м, 2H). МС (ESI): вычислено для C19H17FN6O: 364, найдено 365 (М+Н).
ПРИМЕР 17
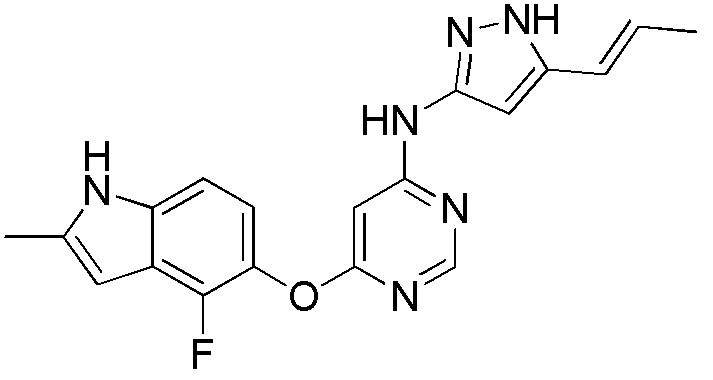
(17)
[0117] Раствор соединения 1 (0,100 г, 0,360 ммоль), (Е)-5-(проп-1-ен-1-ил)-1Н-пиразол-3-амина (0,044 г, 0,360 ммоль), диизопропилэтиламина (0,093 г, 0,720 ммоль) и иодида натрия (0,059 г, 0,396 ммоль) в диметилсульфоксиде (1,0 мл) в атмосфере аргона нагревали до 100°С в течение 2 дней в герметичной пробирке. После охлаждения смеси экстрагировали этилацетатом (100 мл) и промывали насыщ. NaHCO3. Объединенные органические слои высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии на силикагеле с помощью CH2Cl2:MeOH (9:1) с получением соединения 17 (0,037 г, 29%) в виде коричневого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 12,24 (с, 1H), 11,29 (с, 1H), 9,80 (с, 1H), 8,23 (с, 1H), 7,11 (д, 1H, J= 8,8 Гц), 6,70-6,90 (м, 2H), 6,22 (м, 4H), 2,40 (с, 3H), 1,81 (д, 3H, J= 4,4 Гц). МС (ESI): вычислено для C19H17FN6O: 364, найдено 365 (М+Н).
ПРИМЕР 18
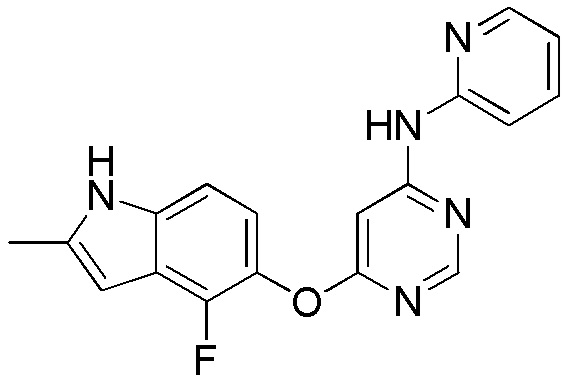
(18)
[0118] К продуваемому аргоном раствору соединения 1 (0,100 г, 0,360 ммоль), 2-аминопиридина (0,042 г, 0,450 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,038 г, 0,064 ммоль) и карбоната цезия (0,352 г, 1,080 ммоль) в безводном диоксане (4 мл) добавляли ацетат палладия (II) (0,015 г, 0,065 ммоль). Смеси раствора находились под непрерывным барботированием аргона в течение дополнительных 30 мин до герметизации. Герметичную пробирку нагревали до 80°С на масляной бане в течение 16 ч. После охлаждения смеси разбавляли 8:2 дихлорметаном/изопропанолом (6 мл) и отфильтровывали через целит. Раствор концентрировали и остаток очищали с помощью флэш-хроматографии на силикагеле с помощью CH2Cl2:MeOH (95:5) с получением соединения 18 (0,097 г, 80%) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,30 (с, 1H), 10,21 (с, 1H), 8,34 (с, 1H), 8,25 (м, 1H), 7,71 (м, 1H), 7,55 (д, 1H, J= 8,0 Гц), 7,48 (с, 1H), 7,12 (д, 1H, J= 8,8 Гц), 6,97 (м, 1H), 6,90 (м, 1H), 6,23 (уш.с, 1H). МС (ESI): вычислено для C18H15FN5O: 335, найдено 336 (М+Н).
ПРИМЕР 19
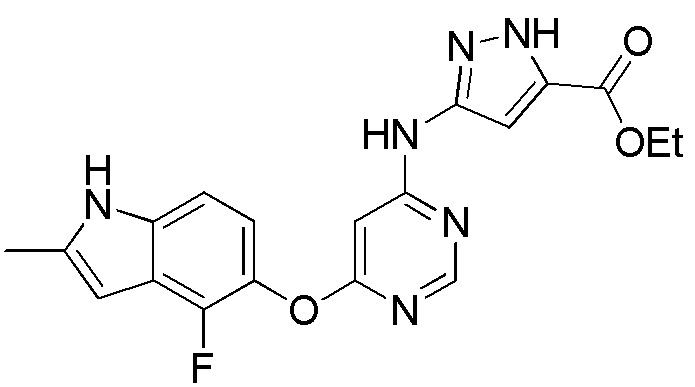
(19)
[0119] Раствор соединения 1 (0,100 г, 0,360 ммоль), 5-этил-1-метил-3-амино-1Н-пиразол-1,5-дикарбоксилата (0,077 г, 0,360 ммоль), диизопропилэтиламина (0,093 г, 0,720 ммоль) и иодида натрия (0,059 г, 0,396 ммоль) в диметилсульфоксиде (1,0 мл) в атмосфере аргона нагревали до 100°С в течение 2 дней в герметичной пробирке. После охлаждения смеси экстрагировали этилацетатом (100 мл) и промывали насыщ. NaHCO3. Объединенные органические слои высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии на силикагеле с помощью CH2Cl2:MeOH (9:1) с получением соединения 19 (0,018 г, 13%) в виде темно-коричневого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,44 (с, 1H), 11,30 (с, 1H), 10,05 (с, 1H), 8,30 (с, 1H), 7,11 (м, 1H), 6,50-6,90 (м, 3H), 6,22 (с, 1H), 4,29 (к, 2H, J= 6,8 Гц), 2,40 (с, 1H), 1,30 (т, 3H, J= 6,8 Гц). МС (ESI): вычислено для C19H17FN6O3: 396, найдено 397 (М+Н).
ПРИМЕР 20

(20)
[0120] Раствор соединения 1 (0,100 г, 0,360 ммоль), 3-амино-5-(2-фурил)пиразола (0,107 г, 0,720 ммоль), диизопропилэтиламина (0,093 г, 0,720 ммоль) и иодида натрия (0,093 г, 0,432 ммоль) в диметилсульфоксиде (1,0 мл) в атмосфере аргона нагревали до 100°С в течение 2 дней в герметичной пробирке. После охлаждения смеси экстрагировали этилацетатом (100 мл) и промывали насыщ. NaHCO3. Объединенные органические слои высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии на силикагеле с помощью CH2Cl2:MeOH (9:1) с получением соединения 20 (0,032 г, 23%) в виде бежевого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 12,80 (уш.с, 1H), 11,30 (с, 1H), 9,96 (уш.с, 1H), 8,28 (с, 1H), 7,75 (с, 1H), 7,12 (д, 1H, J= 8,4 Гц), 6,89 (м, 1H), 6,81 (уш.с, 1H), 6,60 (уш.с, 1H), 6,54 (м, 1H), 6,23 (уш.с, 1H). МС (ESI): вычислено для C20H15FN6O2: 390, найдено 391 (М+Н).
ПРИМЕР 21-А
(21-a)
[0121] Справочная методика: ACS Catalysis, 3(6), 1356-1359; 2013
[0122] К раствору 3-(3,5-диметоксифенил)пропионовой кислоты (5,00 г, 23,78 ммоль) в EtOH (50 мл) медленно добавляли SOCl2 (5 мл). Реакционную смесь нагревали с обратным холодильником в течение 4,5 ч и затем испаряли для удаления EtOH. Добавляли этилацетат (40 мл), воду (20 мл) и насыщенный водный раствор NaOH для доведения рН до 8-9. После разделения водный слой экстрагировали этилацетатом (15 мл × 2). Объединенную органическую фазу промывали водой (20 мл) и солевым раствором (20 мл), высушивали (Na2SO4) и концентрировали с получением указанного в заголовке соединения 21-a в виде желтого масла (5,57 г, 8%). Продукт непосредственно использовали для следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, ДМСО-d6) δ 6,39 (д, J= 2,4 Гц, 2H), 6,32 (уш.с, 1H), 4,04 (к, J= 6,8 Гц, 2H), 3,71 (с, 6H), 2,78 (т, J= 7,2 Гц, 2H), 2,57 (т, J= 7,2 Гц, 2H), 1,16 (т, J= 7,2 Гц, 3H); ESI-МС: вычислено для (C13H18O4) 238, найдено 239 (MH+).
ПРИМЕР 21-B
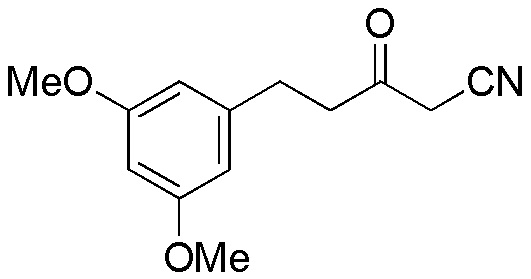
(21-b)
[0123] К раствору диизопропиламина (2,80 г, 27,70 ммоль) в сухом тетрагидрофуране (100 мл) в атмосфере аргона, охлажденному до -78°С, медленно добавляли н-бутиллитий (10,07 мл, 2,5 М в гексане, 25,18 ммоль) и перемешивали в течение 15 мин, затем нагревали до 0°С в течение 15 мин с последующим повторным охлаждением до -78°С в течение дополнительных 30 мин. К данному свежеприготовленному раствору LDA добавляли по каплям безводный ацетонитрил (1,29 г, 1,64 мл, 31,48 ммоль) и перемешивали в течение 1 часа. Затем по каплям добавляли раствор 21-а (3,00 г, 12,59 ммоль) в безводном тетрагидрофуране (10 мл) и продолжали перемешивать в течение еще одного часа. Затем смеси нагревали до комнатной температуры и перемешивали в течение ночи (15 часов). Смеси разбавляли дихлорметаном (500 мл) и гасили водой (300 мл). Экстрагировали дихлорметаном (2 × 200 мл) и объединенные органические слои высушивали над безводным сульфатом натрия, отфильтровывали и концентрировали. Концентрированный неочищенный продукт затем очищали с помощью флэш-хроматографии на силикагеле с помощью 100% CH2Cl2 с получением соединения 21-b (2,57 г, 87%) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 6,36 (с, 2H), 6,31 (с, 1H), 4,06 (уш.с, 2H), 3,71 (с, 6H), 2,79 (уш.с, 2H), 2,72 (м, 2Н). МС (ESI): вычислено для C13H15NO3: 233, найдено 234 (М+Н).
ПРИМЕР 21-С

(21-c)
[0124] К суспензии соединения 21-b (2,50 г, 10,72 ммоль) в абсолютном этаноле (100 мл) добавляли гидразингидрат (2,61 мл, 53,59 ммоль). Смеси нагревали с обратным холодильником в атмосфере аргона в течение ночи (16 часов). После охлаждения растворитель удаляли под вакуумом и добавляли диэтиловый эфир (100 мл) с последующей ультразвуковой обработкой для индуцирования осаждения. Осажденное твердое вещество охлаждали в холодильнике в течение 1 часа перед фильтрованием с получением соединения 21-c (2,65 г, 100%) в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 6,37 (с, 2H), 6,30 (с, 1H), 5,19 (с, 1H), 4,43 (уш.с, 2H), 3,70 (с, 6H) 2,77 (м, 2Н), 2,67 (м, 2Н). МС (ESI): вычислено для C13H17N3O2: 247, найдено 248 (М+Н).
ПРИМЕР 21
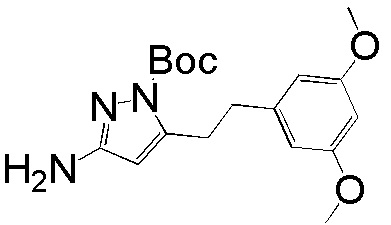
(21)
[0125] Раствор 5-(3,5-диметоксифенэтил)-1Н-пиразол-3-амина (соединение 21-с) (800 мг, 3,24 ммоль) в ТГФ (20 мл) добавляли к холодной суспензии гидрида натрия (60% в минеральном масле, 162 мг, 4,04 ммоль) в ТГФ (6 мл) при 0°С медленно. После перемешивания при 0°С в течение 60 минут добавляли ди-трет-бутилдикарбоксат (791 мг, 3,62 ммоль). (ТГФ использовали для помощи при добавлении ди-трет-бутилдикарбоксата, общее количество 30 мл находилось в бутылке). Смесь перемешивали при 0°С в течение 60 минут. Проверяли ТСХ и расходовали исходный материал. Реакционную смесь гасили ледяной водой, экстрагировали этилацетатом (3 × 15 мл). Объединенный органический слой промывали солевым раствором, высушивали над сульфатом натрия и концентрировали до минимального количества растворителей. Добавляли гексан (~20 мл) и смесь обрабатывали ультразвуком с образованием гомогенной суспензии. Гексан декантировали и желтый остаток дополнительно концентрировали с получением целевого продукта соединения 21 в виде желтого липкого сиропа со смесью 2 изомеров (приблизительно 4:5) защитной группы на кольце (1,06 г, выход 95%). 1H ЯМР (400 МГц, ДМСО-d6): δ 6,42 и 6,40 (д, д, J= 2,0 Гц, 2H), 6,32 и 6,30 (т, т, J= 2,4 Гц, 1H), 6,25 и 5,30 (уш.с, 2H), 5,62 и 5,21 (с, с, 1H), 3,71 (с, 6H), 3,08-2,64 (м, 4H), 1,54 и 1,51 (с, с, 9H).
ПРИМЕР 22
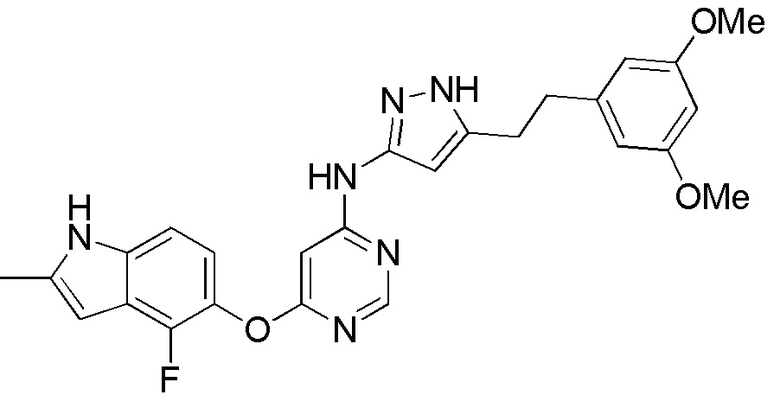
(22)
[0126] К продуваемому аргоном раствору соединения 1 (0,100 г, 0,360 ммоль), трет-бутил-3-амино-5-(3,5-диметоксифенэтил)-1Н-пиразол-1-карбоксилата (0,156 г, 0,450 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметил-ксантена (0,038 г, 0,065 ммоль) и карбоната цезия (0,352 г, 1,08 ммоль) в безводном диоксане (4 мл), барботируя аргоном, добавляли ацетат палладия (II) (0,015 г, 0,065 ммоль). Смеси раствора находились при непрерывном барботировании аргоном в течение дополнительных 10 мин. Запечатанную пробирку подвергали микроволновому излучению при 120°С в течение 35 мин. После охлаждения смеси разбавляли 8:2 дихлорметаном/изопропанолом (6 мл) и отфильтровывали через целит. Раствор концентрировали и высушивали под вакуумом в течение ночи. Неочищенный остаток повторно растворяли в 20% трифторметилуксусной кислоте/дихлорметане (2 мл/16 мл) и перемешивали в течение 4 часов. Смеси гасили насыщ. бикарбонатом натрия в течение 1 часа перемешивания до осаждения пузырьков, затем экстрагировали этилацетатом (2 × 100 мл), промывали водой (2 × 100 мл) и высушивали над безводным Na2SO4. Остаток очищали с помощью флэш-хроматографии на силикагеле с помощью CH2Cl2:MeOH (95:5) с получением соединения 22 (0,072 г, 41%) в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 12,01 (с, 1H), 11,28 (с, 1H), 9,74 (с, 1H), 8,21 (с, 1H), 7,10 (д, 1H, J= 8,4 Гц), 6,87 (т, 2H, J= 8,0 Гц), 6,38 (м, 3H), 6,30 (м, 2H), 6,22 (с, 1H), 3,70 (с, 6H), 2,82 (уш.с, 4H), 2,39 (с, 3H). МС (ESI): вычислено для C26H25FN6O3: 488, найдено 489 (М+Н).
ПРИМЕР 23
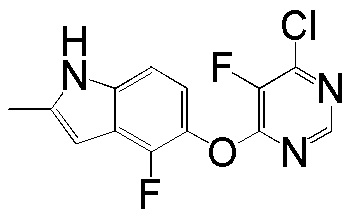
(23)
[0127] К раствору 4-фтор-2-метил-1Н-индол-5-ола (2,00 г, 12,11 ммоль) и 4,6-дихлор-5-фторпиридина (2,02 г, 12,11 ммоль) в ДМСО (18 мл) добавляли карбонат калия (6,02 г, 43,59 ммоль) и смесь нагревали при 85°С в течение 2,5 часов (масляная баня). После охлаждения до комнатной температуры реакционную смесь добавляли в емкость с водой (250 мл) и смесь перемешивали при комнатной температуре в течение 1 часа, затем выдерживали при 4°С в течение ночи. pН доводили до 6-7 с помощью 2 N HCl и охлаждали на ледяной бане. Твердое вещество собирали фильтрованием и промывали водой. Соединение 23 получали в виде желтого твердого вещества (3,29 г, выход 92%). Никакую дополнительную очистку не проводили и продукт использовали для следующей стадии реакции. 1H ЯМР (400 МГц, ДМСО-d6) δ 11,40 (уш.с 1Н), 8,42 (с, 1Н), 7,15 (д, J= 8,8 Гц, 1Н), 6,99 (т, J= 7,6 Гц, 1H), 6,25 (с, 1H), 2,40 (с, 3H); ESI-МС: вычислено для (C13H8ClF2N3O) 295, найдено 296 (MH+).
ПРИМЕР 24
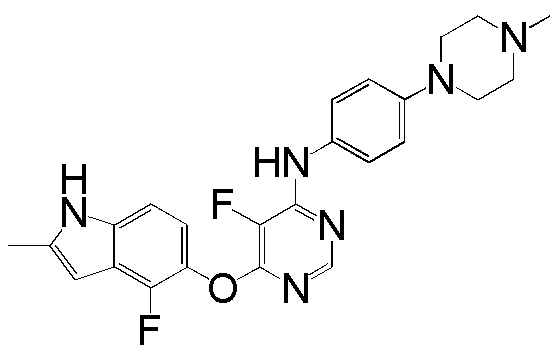
(24)
[0128] Смесь соединения 23 (200 мг, 0,68 ммоль), 4-(4-метилпиперизино)анилина (194 мг, 1,01 ммоль) и DIPEA (0,30 мл, 1,69 ммоль) в ДМСО (3,5 мл) перемешивали при 100°C в течение ночи. После охлаждения до комнатной температуры смесь добавляли к воде/насыщ. NH4Cl (50 мл/50 мл) и перемешивали при комнатной температуре в течение 30 мин. pН смеси доводили до 6~7 с использованием 2 N HCl. После хранения при 4°С в течение ночи твердое вещество собирали фильтрованием и промывали водой с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (0-15% MeOH в ДХМ) с получением соединения 24 в виде коричневого твердого вещества (92 мг, выход 30%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,31 (уш.с, 1Н), 9,37 (с, 1H), 7,92 (с, 3H), 7,48 (д, J= 9,2 Гц, 2H), 7,10 (д, J= 8,8 Гц, 1H), 6,92 (м, 3H), 6,22 (с, 1H), 3,08 (м, 4H), 2,45 (м, 4H), 2,38 (уш.с, 3H), 2,22 (с, 3H); ESI-МС: вычислено для (C24H24F2N6O) 450, найдено 451 (MH+).
ПРИМЕР 25
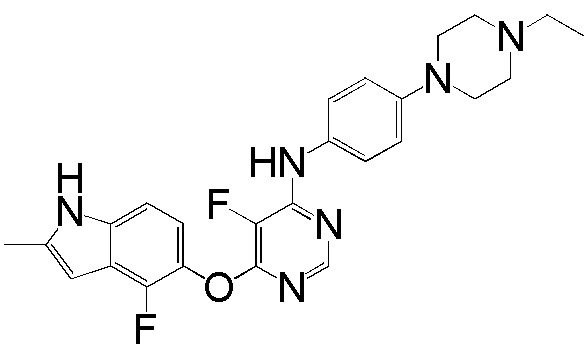
(25)
[0129] Смесь соединения 23 (200 мг, 0,68 ммоль), 4-(4-этилпиперазин-1-ил)анилина (208 мг, 1,01 ммоль) и DIPEA (0,30 мл, 1,69 ммоль) в ДМСО (3,5 мл) перемешивали при 100°С в течение ночи. После охлаждения до комнатной температуры смесь добавляли к воде/насыщ. NH4Cl (50 мл/50 мл) и перемешивали при комнатной температуре в течение 30 мин. pН смеси доводили до 6~7 с использованием 2 N HCl. После хранения при 4°С в течение ночи твердое вещество собирали фильтрованием и промывали водой с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (0-15% MeOH в ДХМ) с получением соединения 25 в виде коричневого твердого вещества (160 мг, выход 51%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,35 (уш.с, 1Н), 9,42 (с, 1H), 7,94 (с, 1H), 7,53 (д, J= 8,8 Гц, 2H), 7,10 (д, J= 8,8 Гц, 1H), 6,95 (м, 3H), 6,22 (с, 1H), 3,02-2,20 (м, 10H), 2,39 (с, 3H), 1,20 (уш.с, 3H); ESI-МС: вычислено для (C25H26F2N6O) 464, найдено 465 (MH+).
ПРИМЕР 26
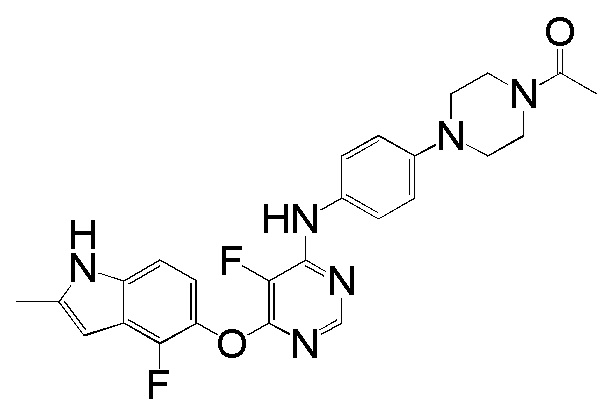
(26)
[0130] Смесь соединения 23 (200 мг, 0,68 ммоль), 1-актил-4-(4-аминофенил)пиперазина (159 мг, 0,73 ммоль) и DIPEA (0,30 мл, 1,69 ммоль) в ДМСО (3,5 мл) перемешивали при 100°С в течение ночи. После охлаждения до комнатной температуры смесь добавляли к воде/насыщ. NH4Cl (50 мл/50 мл) и перемешивали при комнатной температуре в течение 30 мин. pН смеси доводили до 6~7 с использованием 2 N HCl. После хранения при 4°С в течение ночи твердое вещество собирали фильтрованием, промывали водой с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (0-15% MeOH в ДХМ) с получением соединения 26 в виде коричневого твердого вещества (201 мг, выход 65%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,29 (уш.с, 1H), 9,38 (с, 1H), 7,91 (с, 1H), 7,49 (д, J= 9,2 Гц, 2H), 7,09 (д, J= 8,8 Гц, 1H), 6,92 (м, 3H), 6,20 (с, 1H), 3,56 (м, 4H), 3,09 (м, 2H), 3,02 (м, 2H), 2,38 (с, 3H), 2,02 (с, 3H); ESI-МС: вычислено для (C25H24F2N6O2) 478, найдено 479 (MH+).
ПРИМЕР 27
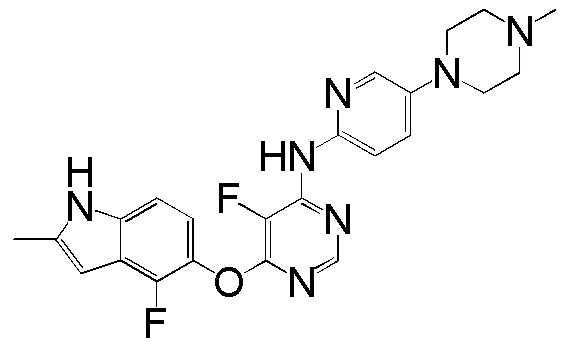
(27)
[0131] Смесь соединения 23 (200 мг, 0,67 ммоль), 5-(4-метилпиперазин-1-ил)пиридин-2-амина (135 мг, 0,70 ммоль), ацетата палладия (II) (23 мг, 0,10 ммоль), ксантфоса (4,5-дифенилфосфанил-9,9'-диметил-9H-ксантена, 97 мг, 0,17 ммоль) и K2CO3 (325 мг, 2,35 ммоль) в 1,4-диоксане (15 мл) продували аргоном в течение 30 мин. Смесь нагревали с помощью микроволнового реактора initiator Biotage при 120°С в течение 15 мин. Реакционную смесь пропускали через слой целита, элюировали ДХМ/MeOH (8/2, 20 мл). Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-15% MeOH в ДХМ) с получением соединения 27 в виде желтого твердого вещества (139 мг, выход 46%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,32 (уш.с, 1H), 9,69 (с, 1H), 8,04 (д, J= 2,8 Гц, 1H), 8,01 (с, 1H), 7,77 (д, J= 9,2 Гц, 1H), 7,42 (дд, J= 9,2 Гц, J= 1,2 Гц, 1H), 7,12 (д, J= 9,2 Гц, 2H), 6,93 (т, J= 7,2 Гц, 1H), 6,23 (с, 1H), 3,15 (м, 4H), 2,45 (м, 4H), 2,40 (уш.с, 3H), 2,22 (с, 3H); ESI-МС: вычислено для (C23H23F2N7O) 451, найдено 452 (MH+).
ПРИМЕР 28
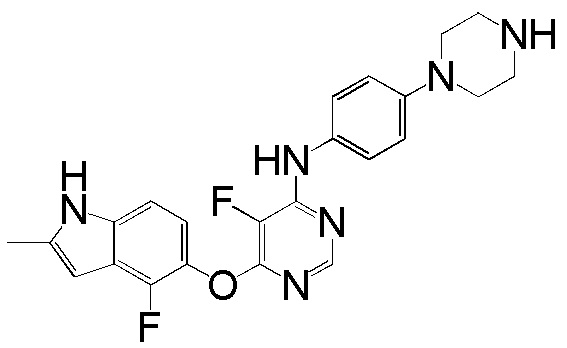
(28)
[0132] Смесь соединения 23 (200 мг, 0,67 ммоль), трет-бутил-4-(4-аминофенил)пиперазин-1-карбоксилата (195 мг, 0,70 ммоль), ацетата палладия (II) (23 мг, 0,10 ммоль), ксантфоса (4,5-дифенилфосфанил-9,9'-диметил-9H-ксантена, 97 мг, 0,17 ммоль) и K2CO3 (325 мг, 2,35 ммоль) в 1,4-диоксане (15 мл) продували аргоном в течение 30 мин. Смесь нагревали с помощью микроволнового реактора initiator Biotage при 120°С в течение 75 мин. Реакционную смесь пропускали через слой целита, элюировали ДХМ/MeOH (8/2, 20 мл). Раствор концентрировали до остатка и растворяли в ДХМ (5 мл). Добавляли 1 мл ТФУК и смесь перемешивали при комнатной температуре в течение ночи. После концентрирования остаток растворяли в ДХМ/MeOH (8/2, 15 мл) и добавляли воду. pН смеси доводили до приблизительно 7 с помощью водного раствора насыщ. бикарбоната натрия. Органический слой высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-15% MeOH в ДХМ) с получением соединения 28 в виде желтого твердого вещества (123 мг, выход 42%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,31 (уш.с, 1H), 9,40 (с, 1H), 7,93 (с, 1H), 7,52 (д, J= 8,8 Гц, 2H), 7,12 (д, J= 8,8 Гц, 1H), 6,92 (м, 3H), 6,22 (с, 1H), 3,11 (м, 4H), 3,01 (м, 4H), 2,40 (с, 3H), 1,41 (с, 1H); ESI-МС: вычислено для (C23H22F2N6O) 436, найдено 437 (MH+).
ПРИМЕР 29
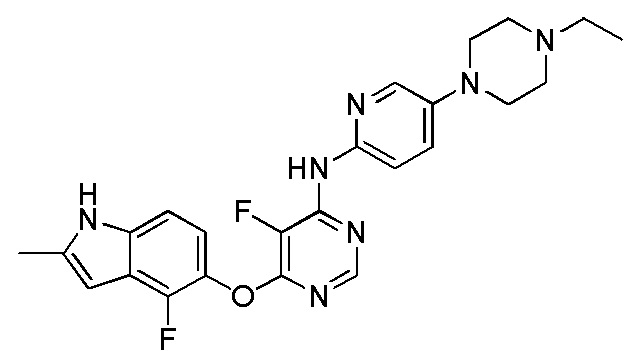
(29)
[0133] Смесь соединения 23 (200 мг, 0,676 ммоль), 5-(4-этилпиперазин-1-ил)пиридин-2-амина (147 мг, 0,710 ммоль), Pd(OAc)2 (23 мг, 0,10 ммоль), ксантфоса (98 мг, 0,17 ммоль), K2CO3 (327 мг, 2,37 ммоль) и безводного диоксана (12,0 мл) герметизировали в пробирке для микроволнового излучения и дегазировали аргоном в течение 20 мин. Затем смесь нагревали до 120°С в течение 15 мин при микроволновом излучении. Полученную смесь отфильтровывали через слой хлопка и концентрировали. Полученный остаток очищали с помощью колоночной флэш-хроматографией на силикагеле с использованием 0-10% MeOH в ДХМ (об./об.) в качестве элюента. Полученный остаток дополнительно очищали с помощью кристаллизации из EtOAc с получением целевого продукта N-(5-(4-этилпиперазин-1-ил)пиридин-2-ил)-5-фтор-6-((4-фтор-2-метил-1Н-индол-5-ил)окси)пиримидин-4-амина (соединение 29) в виде белого твердого вещества (54 мг, выход 17%).
[0134] 1H ЯМР (ДМСО-d6, 400 МГц) δ 11,32 (уш.с, 1H), 9,69 (уш.с, 1H), 8,04-8,01 (м, 2H), 7,77 (д, J= 9,2 Гц, 1H), 7,44-7,41 (м, 1H), 7,11 (д, J= 8,8 Гц, 1H), 6,95-6,91 (м, 1H), 6,23 (с, 1H), 3,16 (т, J= 4,4 Гц, 4H) 2,52 (4H, скрытый пиком ДМСО), 2,40 (с, 3H), 2,37 (к, J= 7,2 Гц, 2H), 1,03 (т, J= 7,2 Гц, 3H); МС (ESI): вычислено для C24H25F2N7O: 465, найдено: 467 (MH+).
ПРИМЕР 30
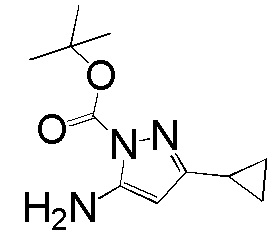
(30)
[0135] Раствор 3-циклопропил-1Н-пиразол-5-амина (3,05 г, 24,77 ммоль) в ТГФ (20 мл) медленно добавляли к холодной суспензии гидрида натрия (60% в минеральном масле, 1,09 г, 27,24 ммоль) в ТГФ (20 мл) при 0°С. После перемешивания при 0°С в течение 30 минут добавляли ди-трет-бутилдикарбоксат (5,95 г, 27,24 ммоль). (ТГФ использовали для помощи при добавлении ди-трет-бутилдикарбоксата, общее количество 125 мл находилось в бутылке). Смесь перемешивали при 0°С в течение 30 минут. Проверяли ТСХ и расходовали исходный материал. Реакционную смесь гасили ледяной водой, экстрагировали этилацетатом (3×50 мл). Объединенный органический слой промывали солевым раствором, высушивали над сульфатом натрия и концентрировали до минимального количества растворителей. Добавляли гексан (~100 мл) и смесь обрабатывали ультразвуком для образования гомогенной суспензии. Желтое твердое вещество собирали фильтрованием, промывали гексаном с получением целевого продукта соединения 30 в виде смеси 2 изомеров (приблизительно 1:3) защитной группы на кольце (3,73 г, выход 69%). 1H ЯМР (400 МГц, ДМСО-d6) δ: для основного изомера: 6,16 (уш.с, 2H), 4,92 (с, 1H), 1,68 (м, 1H), 1,49 (с, 9H), 0,86 (м, 2H), 0,78 (м, 2H); для минорного изомера: 5,35 (с, 1Н), 5,20 (уш.с, 2Н), 2,05 (м, 1Н), 1,49 (с, 9Н), 0,88 (м, 2Н), 0,78 (м, 2Н).
ПРИМЕР 31
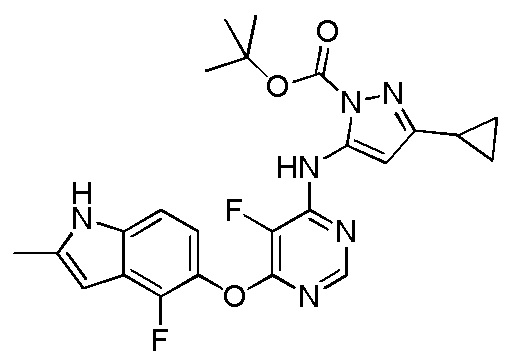
(31)
[0136] Смесь соединения 23 (265 мг, 0,896 ммоль), соединения 30 (200 мг, 0,896 ммоль), Pd(OAc)2 (40 мг, 0,18 ммоль), ксантфоса (181 мг, 0,31 ммоль), K2CO3 (500 мг, 3,62 ммоль) и безводного диоксана (12,0 мл) герметизировали в пробирке и дегазировали аргоном в течение 10 мин. Затем смесь нагревали до 120°С на масляной бане и перемешивали в течение 15 мин. Полученную смесь распределяли между EtOAc и водн. NaHCO3 (насыщение 50%) и органический слой отделяли, высушивали над безводным Na2SO4 и концентрировали. Полученный остаток очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием 0-100% EtOAc в гексане (об./об.) в качестве элюента с получением целевого продукта трет-бутил-3-циклопропил-5-((5-фтор-6-((4-фтор-2-метил-1Н-индол-5-ил)окси)пиримидин-4-ил)амино)-1Н-пиразол-1-карбоксилата (соединение 31) в виде желтого твердого вещества (255 мг, выход 56%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 11,34 (уш.с, 1H), 9,98 (уш.с, 1H), 8,14 (с, 1H), 7,13 (д, J= 8,8 Гц, 1H), 6,96-6,92 (м, 1H), 6,49 (с, 1H), 6,19 (с, 1H), 2,40 (с, 3H), 1,97-1,90 (м, 1H), 1,55-1,54 (м, 9H), 0,96-0,91 (м, 2H), 0,75-0,71 (м, 2H); МС (ESI): вычислено для C24H24F2N6O3: 482, найдено: 384 (MH+-tBOC).
ПРИМЕР 32
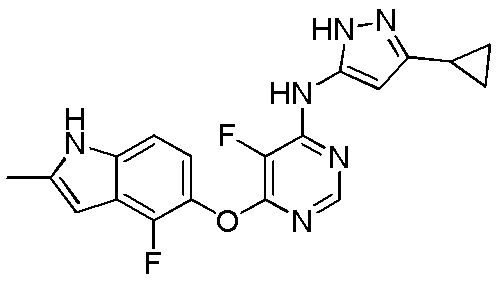
(32)
[0137] К смеси трет-бутил-3-циклопропил-5-((5-фтор-6-((4-фтор-2-метил-1Н-индол-5-ил)окси)пиримидин-4-ил)амино)-1Н-пиразол-1-карбоксилата (91 мг, 0,19 ммоль) в ДХМ (9 мл) добавляли ТФУК (1 мл) и смесь перемешивали при комнатной температуре в течение приблизительно 17 ч. Затем смесь распределяли между EtOAc и водн. NaHCO3 (насыщение 50%) и органический слой отделяли, высушивали над безводным Na2SO4 и концентрировали. Полученный остаток очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием 0-100% EtOAc в гексане (об./об.) в качестве элюента с получением целевого продукта N-(3-циклопропил-1Н-пиразол-5-ил)-5-фтор-6-((4-фтор-2-метил-1Н-индол-5-ил)окси)пиримидин-4-амина (соединение 32) в виде белого твердого вещества (44 мг, выход 61%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 12,11 (уш.с, 1H), 11,30 (уш.с, 1H), 9,76-9,76 (м, 1H), 7,96 (с, 1H), 7,11 (д, J= 8,8 Гц, 1H), 6,94-6,90 (м, 1H), 6,25-6,22 (м, 2H), 2,40 (с, 3H), 1,92-1,85 (м, 1H), 0,92-0,90 (м, 2H), 0,69-0,68 (м, 2H); МС (ESI): вычислено для C19H16F2N6O: 382, найдено: 384 (MH+).
ПРИМЕР 33
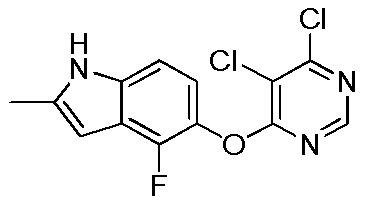
(33)
[0138] Смесь 4,5,6-трихлорпиримидина (2,22 г, 12,1 ммоль), 4-фтор-2-метил-1Н-индол-5-ола (2,00 г, 12,1 ммоль), K2CO3 (5,85 г) и ДМСО (20 мл) нагревали до 80°С и перемешивали в течение 2 часов. Смесь охлаждали до комнатной температуры и выливали в воду (200 мл) с образованием коллоидной смеси. Затем водн. 2М HCl (приблизительно 30 мл) добавляли по каплям к перемешиваемой коллоидной смеси, после чего получали осадок. Осадок отфильтровывали и промывали водой с получением целевого продукта 5-((5,6-дихлорпиримидин-4-ил)окси)-4-фтор-2-метил-1Н-индола (соединение 33) в виде коричневого твердого вещества (3,66 г, выход 97%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 11,39 (с, 1H), 8,53 (с, 1H), 7,15 (д, J= 8,4 Гц, 1H), 6,99-6,95 (м, 2H), 6,25 (с, 1H), 2,40 (с, 3H); МС (ESI): вычислено для C13H8Cl2FN3O: 311, найдено: слабый сигнал.
ПРИМЕР 34
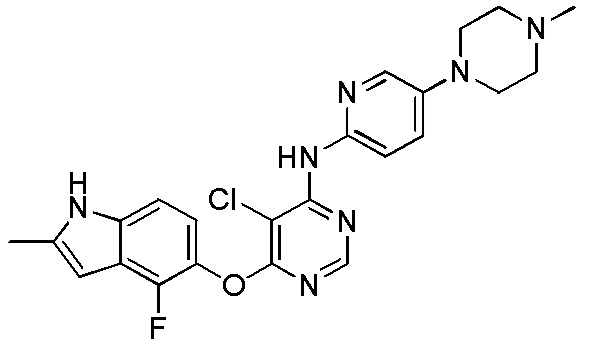
(34)
[0139] Смесь соединения 33 (200 мг, 0,641 ммоль), 5-(4-метилпиперазин-1-ил)пиридин-2-амина (129 мг, 0,673 ммоль), Pd(OAc)2 (42 мг, 0,19 ммоль), ксантфоса (186 мг, 0,322 ммоль), K2CO3 (310 мг, 2,24 ммоль) и безводного диоксана (10 мл) герметизировали в пробирке для микроволнового излучения и дегазировали аргоном в течение 10 мин. Затем смесь нагревали до 120°С в течение 20 мин при микроволновом излучении. Полученную смесь распределяли между EtOAc и водн. NaHCO3 (насыщение 50%), органический слой высушивали над безводным Na2SO4 и концентрировали. Полученный остаток очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием 0-10% MeOH в ДХМ (об./об.) в качестве элюента. Полученный остаток дополнительно очищали с помощью кристаллизации из EtOAc с получением целевого продукта 5-хлор-6-((4-фтор-2-метил-1Н-индол-5-ил)окси)-N-(5-(4-метилпиперазин-1-ил)пиридин-2-ил)пиримидин-4-амина (соединение 34) в виде желтого твердого вещества (36 мг, выход 12%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 11,31 (уш.с, 1H), 8,90 (уш.с, 1H), 8,13 (с, 1H), 8,07 (д, J= 3,2 Гц, 1H), 7,78 (д, J= 8,8 Гц, 1H), 7,46-7,43 (м, 1H), 7,11 (д, J= 8,4 Гц, 1H), 6,93-6,89 (м, 1H), 6,22 (с, 1H), 3,18-3,15 (м, 4H), 2,48-2,45 (м, 4H), 2,40 (с, 3H), 2,23 (с, 3H); МС (ESI): вычислено для C23H23ClFN7O: 467, найдено: 469 (MH+).
ПРИМЕР 35
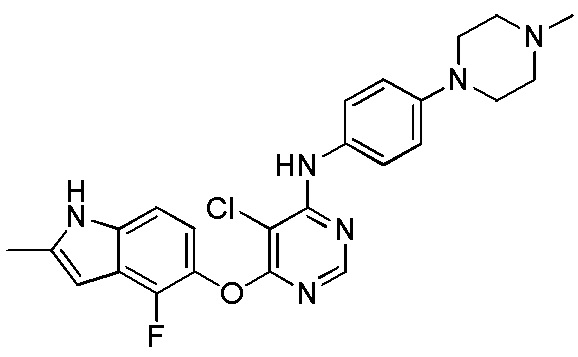
(35)
[0140] Смесь соединения 33 (200 мг, 0,641 ммоль), 4-(4-метилпиперазин-1-ил)анилина (150 мг, 0,784 ммоль), Pd(OAc)2 (22 мг, 0,10 ммоль), ксантфоса (93 мг, 0,16 ммоль), K2CO3 (310 мг, 2,24 ммоль) и безводного диоксана (10 мл) герметизировали в пробирке для микроволнового излучения и дегазировали аргоном в течение 10 мин. Затем смесь нагревали до 120°С в течение 20 мин при микроволновом излучении. Полученную смесь распределяли между EtOAc и водн. NaHCO3 (насыщение 50%), органический слой высушивали над безводным Na2SO4 и концентрировали. Полученный остаток очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием 0-10% MeOH в ДХМ (об./об.) в качестве элюента. Полученный остаток дополнительно очищали с помощью кристаллизации из EtOAc с получением целевого продукта 5-хлор-6-((4-фтор-2-метил-1Н-индол-5-ил)окси)-N-(4-(4-метилпиперазин-1-ил)фенил)пиримидин-4-амина (соединение 35) в виде белого с желтоватым или сероватым оттенком твердого вещества (29 мг, выход 10%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 11,30 (уш.с, 1Н), 8,96 (уш.с, 1H), 8,00 (с, 1H), 7,38-7,36 (м, 2H), 7,10 (д, J= 8,8 Гц, 1H), 6,93-6,87 (м, 2H), 6,22 (с, 1H), 3,12-3,10 (м, 4H), 2,46-2,44 (м, 4H), 2,40 (с, 3H), 2,22 (с, 3H); МС (ESI): вычислено для C24H24ClFN6O: 466, найдено: 468 (MH+).
ПРИМЕР 36
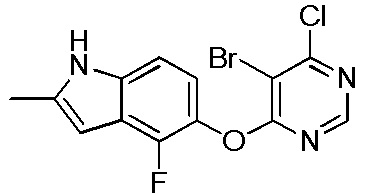
(36)
[0141] Смесь 5-бром-4,6-дихлорпиримидина (2,76 г, 12,1 ммоль), 4-фтор-2-метил-1H-индол-5-ола (2,00 г, 12,1 ммоль), К2СО3 (5,85 г) и ДМСО (20 мл) нагревали до 80°С и перемешивали в течение 2 часов. Смесь охлаждали до комнатной температуры и выливали в воду (200 мл) с образованием коллоидной смеси. Затем водн. 2М HCl (приблизительно 30 мл) добавляли по каплям к перемешиваемой коллоидной смеси, после чего получали осадок. Осадок отфильтровывали, и промывали водой, и дополнительно очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием 0-10% MeOH в ДХМ (об./об.) в качестве элюента с получением целевого продукта 5-((5-бром-6-хлорпиримидин-4-ил)окси)-4-фтор-2-метил-1Н-индола (соединение 36) в виде коричневого твердого вещества (1,73 г, выход 40%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 11,38 (уш.с, 1H), 8,53 (уш.с, 1H), 7,15 (д, J= 8,8 Гц, 1H), 6,98-6,94 (м, 1H), 6,25 (с, 1H), 2,40 (с, 3H); МС (ESI): вычислено для C13H8BrClFN3O: 355, найдено: слабый сигнал.
ПРИМЕР 37
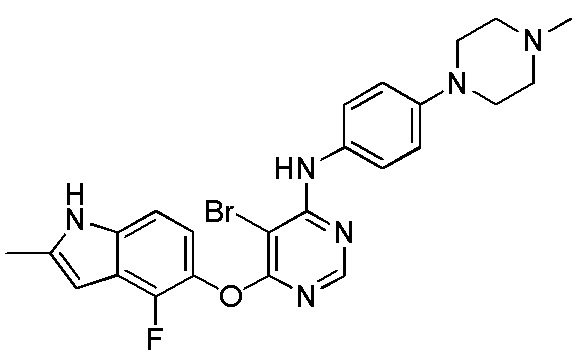
(37)
[0142] Смесь соединения 36 (228 мг, 0,641 ммоль), 4-(4-метилпиперазин-1-ил)анилина (129 мг, 0,673 ммоль), Pd(OAc)2 (22 мг, 0,10 ммоль), ксантфоса (93 мг, 0,16 ммоль), K2CO3 (310 мг, 2,24 ммоль) и безводного диоксана (10 мл) герметизировали в пробирке для микроволнового излучения и дегазировали аргоном в течение 10 мин. Затем смесь нагревали до 120°С в течение 20 мин при микроволновом излучении. Полученную смесь отфильтровывали через слой хлопка и концентрировали. Полученный остаток очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием 0-10% MeOH в ДХМ (об./об.) в качестве элюента. Полученный остаток дополнительно очищали с помощью кристаллизации из EtOAc с получением целевого продукта 5-бром-6-((4-фтор-2-метил-1H-индол-5-ил)окси)-N-(4-(4-метилпиперазин-1-ил)фенил)пиримидин-4-амина (соединение 37) в виде белого с желтоватым или сероватым оттенком твердого вещества (131 мг, выход 40%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 11,30 (уш.с, 1Н), 8,73 (уш.с, 1H), 7,99 (с, 1H), 7,34 (д, J= 8,8 Гц, 2H), 7,10 (д, J= 8,4 Гц, 1H), 6,93-6,86 (м, 3H) 6,21 (с, 1Н), 3,12-3,10 (м, 4Н), 2,46-2,44 (м, 4Н), 2,40 (с, 3Н), 2,22 (с, 3Н); МС (ESI): вычислено для C24H24BrFN6O: 510, найдено: 513 (MH+).
ПРИМЕР 38
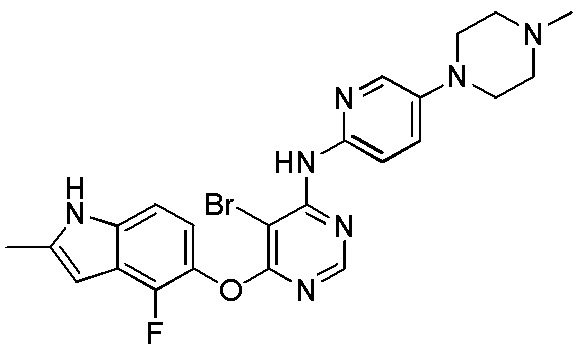
(38)
[0143] Смесь соединения 36 (200 мг, 0,563 ммоль), 4-(4-метилпиперазин-1-ил)анилина (114 мг, 0,592 ммоль), Pd(OAc)2 (19 мг, 0,08 ммоль), ксантфоса (81 мг, 0,14 ммоль), К2СО3 (272 мг, 1,97 ммоль) и безводного диоксана (10 мл) герметизировали в пробирке для микроволнового излучения и дегазировали аргоном в течение 10 мин. Затем смесь нагревали до 120°С в течение 20 мин при микроволновом излучении. Полученную смесь отфильтровывали через слой хлопка и концентрировали. Полученный остаток очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием 0-10% MeOH в ДХМ (об./об.) в качестве элюента. Полученный остаток дополнительно очищали с помощью кристаллизации из EtOAc с получением целевого продукта 5-бром-6-((4-фтор-2-метил-1H-индол-5-ил)окси)-N-(5-(4-метилпиперазин-1-ил)пиридин-2-ил)пиримидин-4-амина (соединение 38) в виде желтого твердого вещества (139 мг, выход 48%). 1H ЯМР (ДМСО-d6, 400 МГц) δ 11,31 (уш.с, 1H), 8,53 (уш.с, 1H), 8,15 (с, 1H), 8,06 (д, J= 2,8 Гц, 1H), 7,85 (д, J= 8,8 Гц, 1H), 7,47-7,44 (м, 1H), 7,11 (д, J= 8,4 Гц, 1H), 6,91 (д, J= 8,0 Гц, 1H), 3,18-3,15 (м, 4H), 2,48-2,45 (м, 4H), 2,40 (с, 3H), 2,23 (с, 3H); МС (ESI): вычислено для C23H23BrFN7O: 511, найдено: слабый сигнал.
ПРИМЕР 39
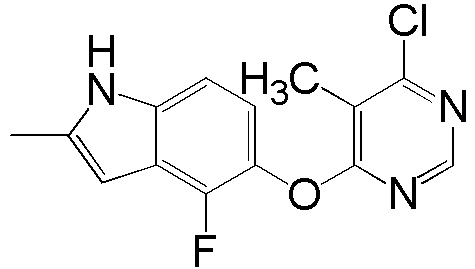
(39)
[0144] К раствору 4,6-дихлор-5-метилпиримидина (1,5 г, 9,20 ммоль) и 4-фтор-2-метил-1Н-индол-5-ола (1,5 г, 9,20 ммоль) в ДМСО (15,0 мл) добавляли карбонат калия (4,4 г, 32,21 ммоль) и смесь перемешивали при 80°С в течение 4 часов. После охлаждения реакционную смесь добавляли к перемешиваемому раствору воды (200,0 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем отфильтровывали с получением продукта соединения 39 в виде светло-коричневого твердого вещества (2,6 г, выход 96%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,33 (с, 1H), 8,40 (с, 1H), 7,14 (д, 1H), 6,92 (т, 1H), 6,23 (с, 1H), 2,40 (с, 6H); ESI-МС: вычислено для (C14H11ClFN3O) 291, найдено 292 [M+H]+.
ПРИМЕР 40
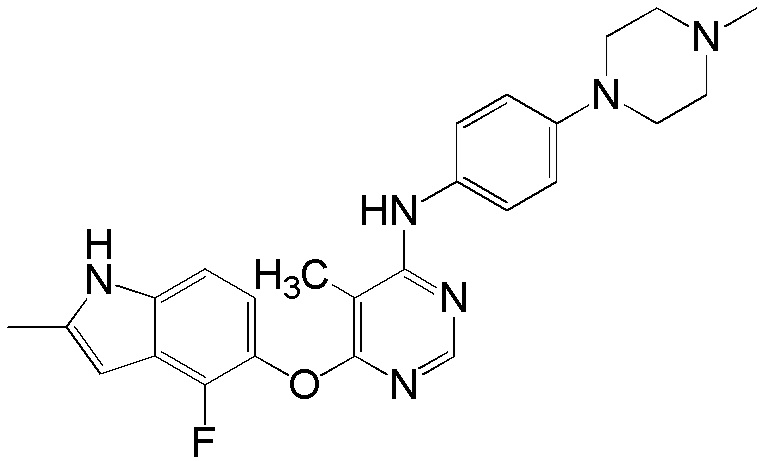
(40)
[0145] Смесь соединения 39 (200 мг, 0,69 ммоль), 4-(4-метилпиперазин-1-ил)анилина (132 мг, 0,69 ммоль), ацетата палладия (II) (23 мг, 0,10 ммоль), ксантфоса (97 мг, 0,17 ммоль) и K2CO3 (477 мг, 3,45 ммоль) в 1,4-диоксане (2,0 мл) продували аргоном в течение 15 минут. Смесь нагревали с помощью микроволнового реактора initiator Biotage при 120°С в течение 30 минут. Реакционную смесь пропускали через слой целита, элюировали ДХМ/MeOH (1/1, 20 мл). Раствор концентрировали и неочищенный продукт очищали с помощью флэш-системы Teledyne-Isco с использованием CH2Cl2/MeOH, от 0 до 10% метанола в дихлорметане с получением соединения 40 в виде белого с желтоватым или сероватым оттенком твердого вещества (30 мг, 10%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,22 (уш.с, 1H), 8,34 (с, 1H), 7,95 (с, 1H), 7,39 (д, 2H), 7,07 (д, 1H), 6,92-6,80 (м, 3H), 6,18 (с, 1H), 3,07 (т, 4H), 2,45 (т, 4H), 2,39 (с, 3H), 2,23 (д, 3H); ESI-МС: вычислено для (C25H27FN6O) 446, найдено 447 [M+H]+. ВЭЖХ: время удерживания: 17,10 мин. Чистота: 99%.
ПРИМЕР 41
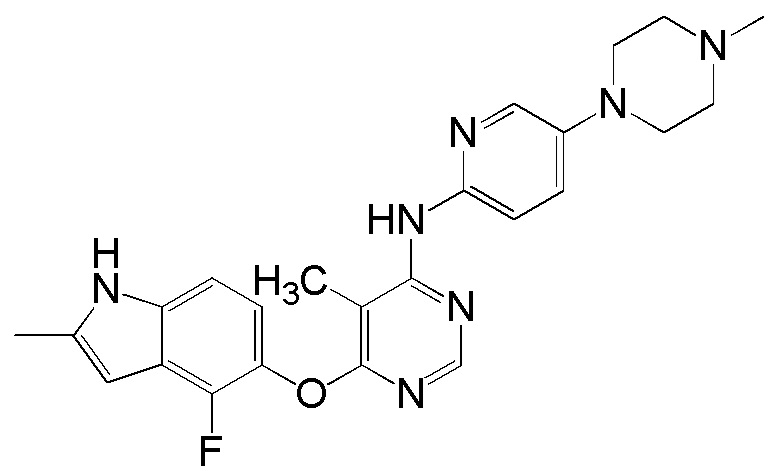
(41)
[0146] Смесь соединения 39 (200 мг, 0,69 ммоль), 5-(4-метилпиперазин-1-ил)пиридин-2-амина (165 мг, 0,86 ммоль), ацетата палладия (II) (23 мг, 0,10 ммоль), ксантфоса (97 мг, 0,17 ммоль) и K2CO3 (477 мг, 3,45 ммоль) в 1,4-диоксане (2,0 мл) продували аргоном в течение 15 минут. Смесь нагревали с помощью микроволнового реактора initiator Biotage при 120°С в течение 30 минут. Реакционную смесь пропускали через слой целита, элюировали ДХМ/MeOH (1/1, 20 мл). Раствор концентрировали и неочищенный продукт очищали с помощью флэш-системы Teledyne-Isco с использованием CH2Cl2/MeOH, от 0 до 10% метанола в дихлорметане с получением соединения 41 в виде белого с желтоватым или сероватым оттенком твердого вещества (180 мг, 59%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,25 (уш.с, 1H), 8,72 (с, 1H), 8,07 (с, 1H), 8,01 (д, 1H), 7,83 (д, 1H), 7,42-7,39 (м, 1H), 7,08 (д, 1H), 6,85 (т, 1H), 6,20 (с, 1H), 3,14-3,12 (м, 4H), 2,48-2,45 (м, 4H), 2,40 (с, 3H), 2,27 (с, 3H), 2,23 (с, 3H); ESI-МС: вычислено для (C24H26FN7O) 447, найдено 448 [M+H]+. ВЭЖХ: время удерживания: 16,82 мин. Чистота: 99,9%.
ПРИМЕР 42
(42)
[0147] К раствору 4,6-дихлор-5-метоксипиримидина (1,5 г, 8,38 ммоль) и 4-фтор-2-метил-1Н-индол-5-ола (1,4 г, 8,38 ммоль) в ДМСО (15,0 мл) добавляли карбонат калия (4,1 г, 29,33 ммоль) и смесь перемешивали при 80°С в течение 4 часов. После охлаждения реакционную смесь добавляли к перемешиваемому раствору воды (200,0 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем отфильтровывали с получением продукта соединения 42 в виде светло-коричневого твердого вещества (2,5 г, выход 96%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,36 (с, 1H), 8,29 (с, 1H), 7,14 (д, 1H), 6,99 (т, 1H), 6,24 (с, 1H), 4,03 (с, 3H), 2,41 (с, 3H); ESI-МС: вычислено для (C14H11ClFN3O2) 307, найдено 308 [M+H]+.
ПРИМЕР 43
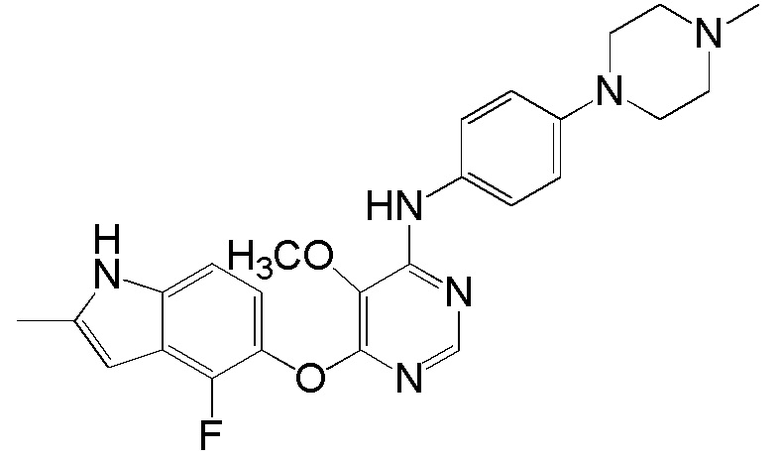
(43)
[0148] Смесь соединения 42 (200 мг, 0,65 ммоль), 4-(4-метилпиперазин-1-ил)анилина (125 мг, 0,65 ммоль), ацетата палладия (II) (22 мг, 0,10 ммоль), ксантфоса (94 мг, 0,16 ммоль) и K2CO3 (450 мг, 3,25 ммоль) в 1,4-диоксане (2,0 мл) продували аргоном в течение 15 минут. Смесь нагревали с помощью микроволнового реактора initiator Biotage при 120°С в течение 30 минут. Реакционную смесь пропускали через слой целита, элюировали ДХМ/MeOH (1/1, 20 мл). Раствор концентрировали и неочищенный продукт очищали с помощью флэш-системы Teledyne-Isco с использованием CH2Cl2/MeOH, от 0 до 10% метанола в дихлорметане с получением соединения 43 в виде белого с желтоватым или сероватым оттенком твердого вещества (100 мг, 30%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,26 (уш.с, 1H), 8,84 (с, 1H), 7,86 (с, 1H), 7,55 (д, 2H), 7,09 (д, 1H), 6,92-6,88 (м, 3H), 6,21 (с, 3H), 3,93 (с, 3H), 3,08 (т, 4H), 2,45 (т, 4H), 2,40 (с, 3H), 2,22 (с, 3H); ESI-MС: вычислено для (C25H27FN6O2) 462, найдено 463 [M+H]+. ВЭЖХ: время удерживания: 17,43 мин. Чистота: 99,4%.
ПРИМЕР 44
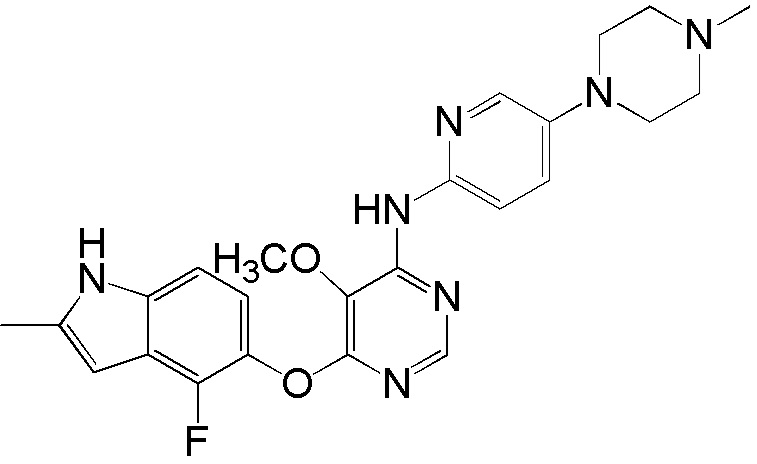
(44)
[0149] Смесь соединения 42 (200 мг, 0,65 ммоль), 5-(4-метилпиперазин-1-ил)пиридин-2-амина (155 мг, 0,81 ммоль), ацетата палладия (II) (22 мг, 0,10 ммоль), ксантфоса (94 мг, 0,16 ммоль) и K2CO3 (450 мг, 3,25 ммоль) в 1,4-диоксане (2,0 мл) продували аргоном в течение 15 минут. Смесь нагревали с помощью микроволнового реактора initiator Biotage при 120°С в течение 30 минут. Реакционную смесь пропускали через слой целита, элюировали ДХМ/MeOH (1/1, 20 мл). Раствор концентрировали и неочищенный продукт очищали с помощью флэш-системы Teledyne-Isco с использованием CH2Cl2/MeOH, от 0 до 10% метанола в дихлорметане с получением соединения 44 в виде белого с желтоватым или сероватым оттенком твердого вещества (170 мг, 56%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,28 (уш.с, 1H), 8,65 (с, 1H), 8,03-7,98 (с, 3H), 7,45-7,42 (м, 1H), 7,10 (д, 1H), 6,92 (т, 1H), 6,21 (с, 1H), 3,97 (с, 3H), 3,13 (т, 4H), 2,48 (т, 4H), 2,40 (с, 3H), 2,22 (с, 3H); ESI-МС: вычислено для (C24H26FN7O2) 463, найдено 464 [M+H]+. ВЭЖХ: время удерживания: 8,74 мин. Чистота: 99,9%.
ПРИМЕР 45
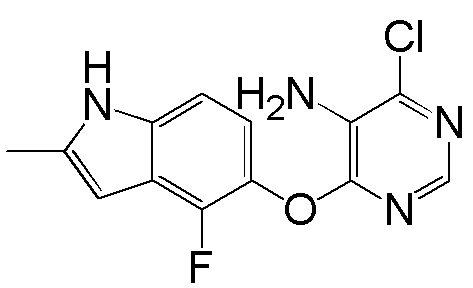
(45)
[0150] К раствору 4,6-дихлорпиримидин-5-амина (1,5 г, 9,15 ммоль) и 4-фтор-2-метил-1H-индол-5-ола (1,5 г, 9,15 ммоль) в ДМСО (15,0 мл) добавляли карбонат калия (4,4 г, 32,01 ммоль) и смесь перемешивали при 80°С в течение 4 часов. После охлаждения реакционную смесь добавляли к перемешиваемому раствору воды (200,0 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем фильтровали с получением продукта соединения 45 в виде светло-коричневого твердого вещества (2,5 г, выход 95%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,31 (с, 1H), 7,75 (с, 1H), 7,13 (д, 1H), 6,92 (т, 1H), 6,22 (с, 1H), 5,80 (с, 2H), 2,40 (с, 3H); ESI-МС: вычислено для (C13H10ClFN4O) 292, найдено 293 [M+H]+.
ПРИМЕР 46
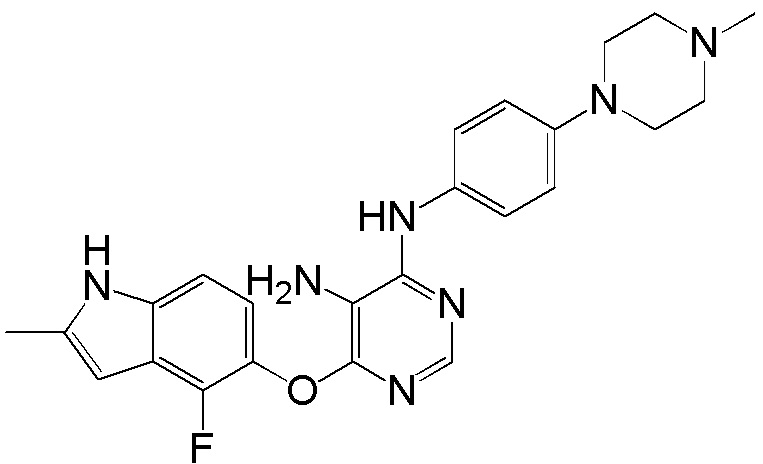
(46)
[0151] Смесь соединения 45 (200 мг, 0,68 ммоль), 4-(4-метилпиперазин-1-ил)анилина (130 мг, 0,68 ммоль), ацетата палладия (II) (23 мг, 0,10 ммоль), ксантфоса (98 мг, 0,17 ммоль) и K2CO3 (470 мг, 3,40 ммоль) в 1,4-диоксане (2,0 мл) продували аргоном в течение 15 минут. Смесь нагревали с помощью микроволнового реактора initiator Biotage при 120°С в течение 30 минут. Реакционную смесь пропускали через слой целита, элюировали ДХМ/MeOH (1/1, 20 мл). Раствор концентрировали и неочищенный продукт очищали с помощью флэш-системы Teledyne-Isco с использованием CH2Cl2/MeOH, от 0 до 10% метанола в дихлорметане с получением соединения 46 в виде белого с желтоватым или сероватым оттенком твердого вещества (5 мг, 2%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,22 (уш.с, 1H), 8,13 (уш.с, 1H), 7,60-7,48 (м, 3H), 7,17-6,91 (м, 4H), 6,20 (уш.с, 1H), 4,85 (уш.с, 2H), 3,07 (уш.с, 4H), 2,46 (уш.с, 4H), 2,40 (уш.с, 3H), 2,22 (уш.с, 3H); ESI-МС: вычислено для (C24H26FN7O) 447, найдено 448 [M+H]+. ВЭЖХ: время удерживания: 12,68 мин. Чистота: 87%.
ПРИМЕР 47
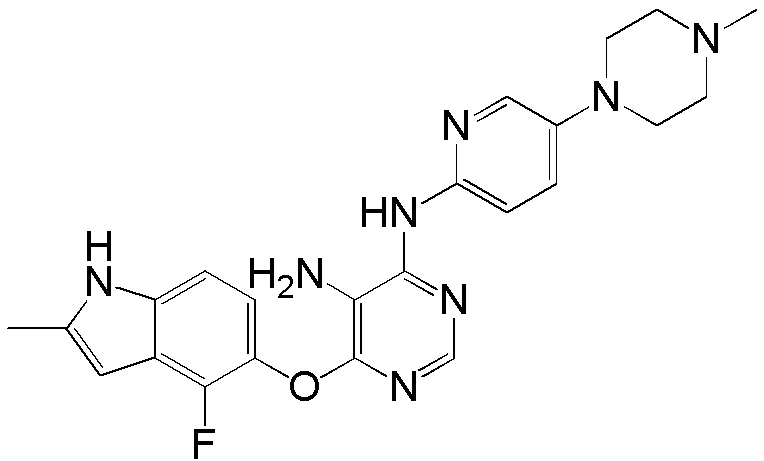
(47)
[0152] Смесь соединения 45 (200 мг, 0,68 ммоль), 5-(4-метилпиперазин-1-ил)пиридин-2-амина (164 мг, 0,85 ммоль), ацетата палладия (II) (23 мг, 0,10 ммоль), ксантфоса (98 мг, 0,17 ммоль) и K2CO3 (470 мг, 3,40 ммоль) в 1,4-диоксане (2,0 мл) продували аргоном в течение 15 минут. Смесь нагревали с помощью микроволнового реактора initiator Biotage при 120°С в течение 30 минут. Реакционную смесь пропускали через слой целита, элюировали ДХМ/MeOH (1/1, 20 мл). Раствор концентрировали и неочищенный продукт очищали с помощью флэш-системы Teledyne-Isco с использованием CH2Cl2/MeOH, от 0 до 10% метанола в дихлорметане с получением соединения 47 в виде белого с желтоватым или сероватым оттенком твердого вещества (100 мг, 33%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,28 (уш.с, 1H), 8,65 (с, 1H), 8,03-7,98 (с, 3H), 7,45-7,42 (м, 1H), 7,10 (д, 1H), 6,92 (т, 1H), 6,21 (с, 1H), 3,97 (с, 3H), 3,13 (т, 4H), 2,48 (т, 4H), 2,40 (с, 3H), 2,22 (с, 3H); ESI-МС: вычислено для (C25H25FN8O) 448, найдено 449 [M+H]+. ВЭЖХ: время удерживания: 5,44 мин. Чистота: 98%.
ПРИМЕР 48
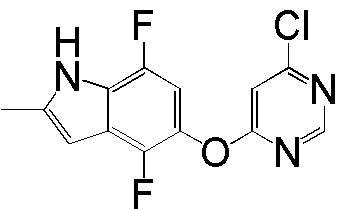
(48)
[0153] К раствору 4,7-дифтор-2-метил-1H-индол-5-ола, о котором было сообщено в WO2014145403 А1 (1,50 г, 8,19 ммоль), и 4,6-дихлорпиридина (1,28 г, 8,60 ммоль) в ДМСО (18 мл) добавляли карбонат калия (4,07 г, 29,48 ммоль) и смесь нагревали при 85°С в течение 1,5 часов с помощью микроволнового реактора initiator Biotage. Реакционную смесь добавляли в емкость с водой (250 мл). pН смеси доводили до приблизительно 6 с помощью 2 N HCl и смесь перемешивали при комнатной температуре в течение 1 часа, затем хранили при 4°С в течение ночи. Твердое вещество собирали фильтрованием и промывали водой. Соединение 48 получали в виде желтого твердого вещества (2,23 г, выход 92%). Никакую дополнительную очистку не проводили и продукт использовали для следующей стадии реакции. 1H ЯМР (400 МГц, ДМСО-d6) δ 11,85 (уш.с, 1H), 8,65 (с, 1H), 7,50 (с, 1H), 6,97 (м, 1H), 6,34 (с, 1H), 2,41 (с, 3H); ESI-МС: вычислено для (C13H8ClF2N3O) 295, найдено 296 (MH+).
ПРИМЕР 49
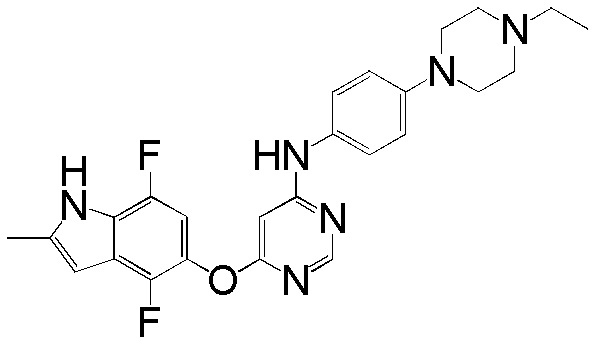
(49)
[0154] Смесь соединения 48 (200 мг, 0,68 ммоль), 4-(4-этилпиперазин-1-ил)анилина (139 мг, 0,68 ммоль) и DIPEA (0,30 мл, 1,69 ммоль) в ДМСО (3,5 мл) перемешивали при 100°С в течение ночи. После охлаждения до комнатной температуры смесь добавляли к воде/насыщ. NH4Cl (50 мл/50 мл) и перемешивали при комнатной температуре в течение 30 мин. pН смеси доводили до 6~7 с использованием 2 N HCl. После хранения при 4°С в течение ночи твердое вещество собирали фильтрованием и промывали водой c получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-15% MeOH в ДХМ) с получением соединения 49 в виде коричневого твердого вещества (147 мг, выход 47%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,77 (уш.с. 1H), 9,26 (с, 1H), 8,20 (с, 1H), 7,33 (д, J= 8,8 Гц, 2H), 6,87 (м, 3H), 6,31 (с, 1H), 5,98 (с, 1H) 3,04 (м, 4H), 2,41 (м, 4H), 2,39 (уш.с, 3H), 2,35 (к, J= 7,2 Гц, 2H), 1,00 (т, J= 7,2 Гц, 3H); ESI-МС: вычислено для (C25H26F2N6O) 464, найдено 465 (MH+).
ПРИМЕР 50
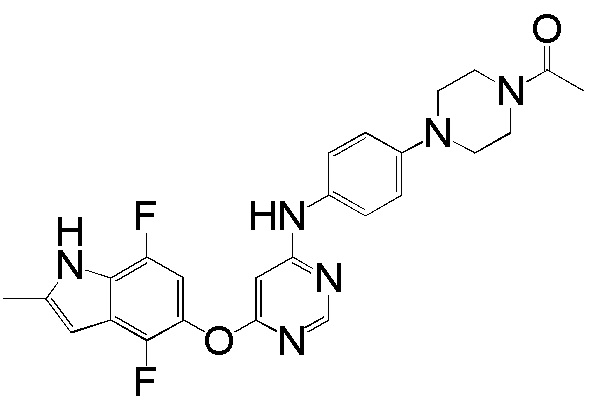
(50)
[0155] Смесь соединения 48 (200 мг, 0,68 ммоль), 1-актил-4-(4-аминофенил)пиперазина (159 мг, 0,73 ммоль) и DIPEA (0,30 мл, 1,69 ммоль) в ДМСО (3,5 мл) перемешивали при 100°С в течение ночи. После охлаждения до комнатной температуры смесь добавляли к воде/насыщ. NH4Cl (50 мл/50 мл) и перемешивали при комнатной температуре в течение 30 мин. pН смеси доводили до 6~7 с использованием 2 N HCl. После хранения при 4°С в течение ночи твердое вещество собирали фильтрованием и промывали водой c получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-15% MeOH в ДХМ) с получением соединения 50 в виде коричневого твердого вещества (212 мг, выход 65%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,77 (уш.с, 1H), 9,30 (с, 1H), 8,21 (с, 1H), 7,36 (д, J= 8,8 Гц, 2H), 6,90 (м, 3H), 6,31 (с, 1H), 5,99 (с, 1H), 3,55 (м, 4H), 3,06 (м, 2H), 3,01 (м, 2H), 2,39 (уш.с, 3H), 2,01 (с, 3H); ESI-МС: вычислено для (C25H24F2N6O2) 478, найдено 479 (MH+).
ПРИМЕР 51
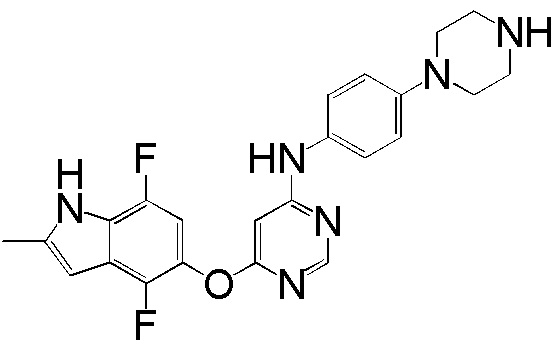
(51)
[0156] Смесь соединения 48 (200 мг, 0,68 ммоль), трет-бутил-4-(4-аминофенил)пиперазин-1-карбоксилата (187 мг, 0,68 ммоль) и DIPEA (0,30 мл, 1,69 ммоль) в ДМСО (3,5 мл) перемешивали при 100°С в течение ночи. После охлаждения до комнатной температуры смесь добавляли к воде (100 мл) и перемешивали при комнатной температуре в течение 30 мин. После охлаждения на ледяной бане твердое вещество собирали фильтрованием, промывали водой. После сушки на воздухе при комнатной температуре в течение ночи твердое вещество суспендировали в ДХМ/MeOH (10/1, 5 мл) и добавляли 1 мл ТФУК. Смесь перемешивали при комнатной температуре в течение ночи. После концентрирования остаток растворяли в ДХМ/MeOH (8/2, 15 мл) и добавляли воду. pН смеси доводили до приблизительно 7 с помощью водного раствора насыщ. бикарбоната натрия. Органический слой высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-15% MeOH в ДХМ) с получением соединения 51 в виде желтого твердого вещества (60 мг, выход 20%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,80 (уш.с, 1H), 9,31 (с, 1H), 8,22 (с, 1H), 7,38 (д, J= 8,8 Гц, 2H), 6,88 (м, 3Н), 6,33 (уш.с, 1Н), 6,01 (с, 1Н), 3,04 (м, 4Н), 2,91 (м, 4Н), 2,41 (уш.с, 3Н); ESI-МС: вычислено для (C23H22F2N6O) 436, найдено 437 (MH+).
ПРИМЕР 52
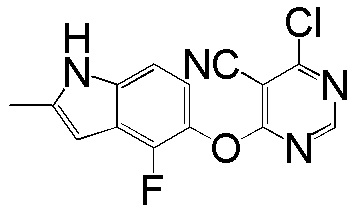
(52)
[0157] К раствору 4,7-дифтор-2-метил-1Н-индол-5-ола (200 мг, 1,21 ммоль) в смеси ацетонитрила (4 мл) и N,N-диметилформамида (1 мл) добавляли карбонат калия (200 мг, 1,45 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре до добавления суспензии 4,6-дихлорпиримидин-5-карбонитрила (221 мг, 1,27 ммоль) в 3 мл ацетонитрила. Данную смесь перемешивали при комнатной температуре в течение 1 ч. Проверяли ТСХ и реакцию завершали. Смесь разбавляли водой и этилацетатом. Слои разделяли и водную фазу дважды экстрагировали этилацетатом. Объединенные органические фазы промывали один раз водой, затем солевым раствором, высушивали над сульфатом натрия, отфильтровывали и фильтрат концентрировали под вакуумом с получением соединения 52 в виде коричневого твердого вещества (365 мг, выход 99%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,46 (уш.с, 1Н), 8,83 (с, 1Н), 7,17 (д, J= 8,8 Гц, 1Н), 7,00 (т, J= 7,6 Гц, 1H), 6,27 (с, 1H), 2,41 (с, 3H); ESI-МС: вычислено для (C14H8ClFN4O) 302, найдено 303 (MH+).
ПРИМЕР 53
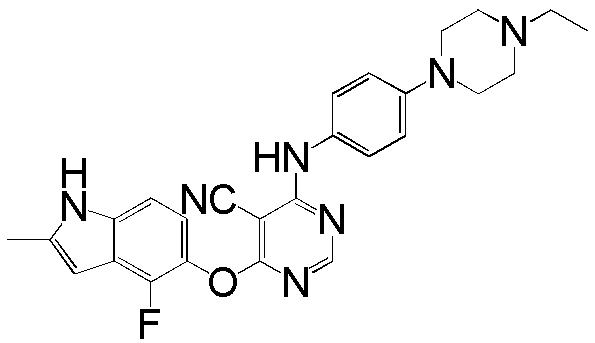
(53)
[0158] Смесь соединения 52 (200 мг, 0,66 ммоль), 4-(4-этилпиперазин-1-ил)анилина (135 мг, 0,66 ммоль) и DIPEA (0,29 мл, 1,65 ммоль) в ДМСО (3,5 мл) перемешивали при 80°С в течение 3 часов. Проверяли ТСХ и реакцию завершали. После охлаждения до комнатной температуры смесь добавляли к насыщ. NH4Cl (100 мл) и перемешивали при комнатной температуре в течение 30 мин. pН смеси доводили до 6~7 с использованием 2 N HCl. После хранения при 4°С в течение ночи твердое вещество собирали фильтрованием, промывали водой с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-10% MeOH в ДХМ) с получением соединения 53 в виде коричневого твердого вещества (173 мг, выход 56%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,37 (уш.с, 1H), 9,90 (с, 1H), 8,23 (с, 1H), 7,37 (д, J= 8,8 Гц, 2H), 7,12 (д, J= 8,8 Гц, 1H), 7,00 (д, J= 8,8 Гц, 2H), 6,93 (т, J= 7,6 Гц, 1H), 6,23 (с, 1H), 3,90-3,40 (м, 4H), 3,20-2,90 (м, 6H), 2,40 (с, 3H), 1,26 (уш.с, 3H); ESI-МС: вычислено для (C26H26FN7O) 471, найдено 472 (MH+).
ПРИМЕР 54

(54)
[0159] Смесь соединения 52 (100 мг, 0,66 ммоль), 4-(4-метилпиперазин-1-ил)анилина (63 мг, 0,33 ммоль) и DIPEA (0,15 мл, 0,82 ммоль) в ДМСО (5 мл) перемешивали при 80°С в течение 30 мин. Проверяли ТСХ и реакцию завершали. После охлаждения до комнатной температуры смесь добавляли к насыщ. NH4Cl (100 мл) и перемешивали при комнатной температуре в течение 30 мин. pН смеси доводили до 6~7 с использованием 2 N HCl. Хранили при 4°С в течение ночи и твердое вещество собирали фильтрованием, промывали водой с получением неочищенного продукта. Неочищенный продукт очищали с помощью колонки на силикагеле (0-10% MeOH в ДХМ) с получением соединения 54 в виде коричневого твердого вещества (52 мг, выход 34%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,34 (уш.с, 1H), 9,84 (уш.с, 1H), 8,21 (с, 1H), 7,32 (д, J= 8,4 Гц, 2H), 7,13 (д, J= 7,6 Гц, 1H), 6,95 (м, 3H), 6,23 (с, 1H), 3,12 (м, 4H), 3,20-2,90 (м, 6H), 2,45 (м, 4H), 2,40 (с, 3H), 2,20 (с, 3H); ESI-МС: вычислено для (C25H24FN7O) 457, найдено 458 (MH+). ВЭЖХ: время удерживания: 7,71 мин. Чистота: 99%.
ПРИМЕР 55
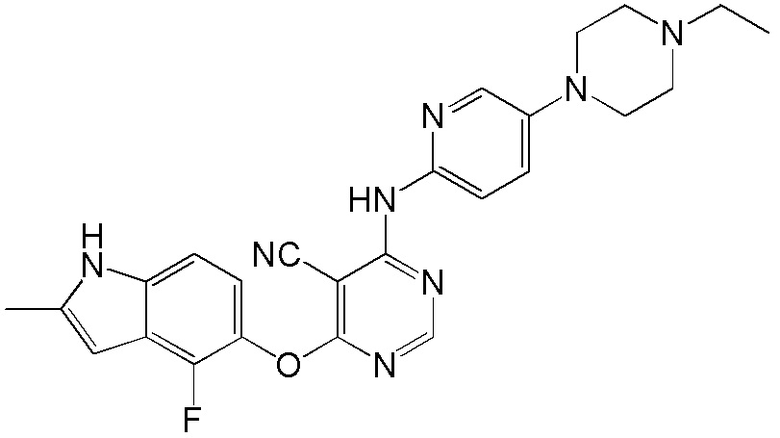
(55)
[0160] Смесь соединения 52 (100 мг, 0,66 ммоль), 5-(4-этилпиперазин-1-ил)пиридин-2-амина (68 мг, 0,33 ммоль) и DIPEA (0,15 мл, 0,82 ммоль) в ДМСО (5 мл) перемешивали при 80°С в течение 30 мин. Проверяли ТСХ и реакцию завершали. После охлаждения до комнатной температуры смесь добавляли к насыщ. NH4Cl (100 мл) и перемешивали при комнатной температуре в течение 30 мин. pН смеси доводили до 6~7 с использованием 2 N HCl. Хранили при 4°С в течение ночи и твердое вещество собирали фильтрованием, промывали водой с получением неочищенного продукта. Неочищенный продукт очищали с помощью колонки на силикагеле (0-10% MeOH в ДХМ) с получением соединения 55 в виде коричневого твердого вещества (28 мг, выход 18%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,36 (м, 1H, ротамер), 10,12 (уш.с, 0,42Н, ротамер), 9,61 (с, 0,58H, ротамер), 8,58 (м, 0,5Н, ротамер), 8,50 (м, 0,5H, ротамер), 8,40 (м, 0,43H, ротамер), 8,10 (м, 0,5H, ротамер), 8,08 (м, 0,5H, ротамер), 7,4 (с, 0,3H, ротамер), 7,41 (с, 0,98H, ротамер), 7,16 (м, 0,5H, ротамер), 7,12 (м, 0,49H, ротамер), 7,03 (м, 0,49H, ротамер), 6,94 (м, 0,50H, ротамер), 6,24 (м, 1H, ротамер), 3,17 (м, 4H), 2,50 (м, 4H, перекрыт растворителем), 2,39 (м, 5H), 1,01 (м, 3H); ESI-МС: вычислено для (C25H25FN8O) 472, найдено 473 (MH+). ВЭЖХ: время удерживания: 7,71 мин. Чистота: 99%.
ПРИМЕР 56
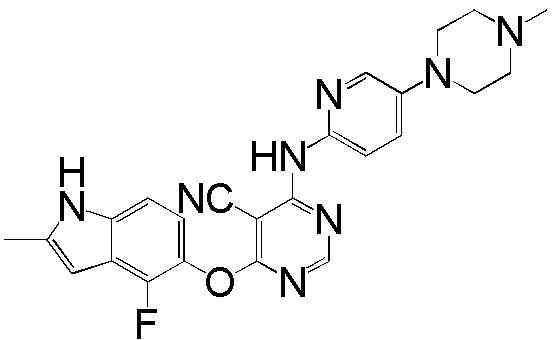
(56)
[0161] Смесь соединения 52 (100 мг, 0,66 ммоль), 4-(4-метилпиперазин-1-ил)анилина (63 мг, 0,33 ммоль) и DIPEA (0,15 мл, 0,82 ммоль) в ДМСО (5 мл) перемешивали при 80°С в течение 30 мин. Проверяли ТСХ и реакцию завершали. После охлаждения до комнатной температуры смесь добавляли к насыщ. NH4Cl (100 мл) и перемешивали при комнатной температуре в течение 30 мин. pН смеси доводили до 6~7 с использованием 2 N HCl. Хранили при 4°С в течение ночи и твердое вещество собирали фильтрованием, промывали водой с получением неочищенного продукта. Неочищенный продукт очищали с помощью колонки на силикагеле (0-10% MeOH в ДХМ) с получением соединения 56 в виде коричневого твердого вещества (32 мг, выход 22%); 1H ЯМР (400 МГц, ДМСО-d6) δ 11,36 (м, 1H, ротамер), 10,12 (уш.с, 0,42Н, ротамер), 9,61 (с, 0,58H, ротамер), 8,58 (м, 0,5Н, ротамер), 8,50 (м, 0,5H, ротамер), 8,40 (м, 0,43H, ротамер), 8,10 (м, 0,5H, ротамер), 8,08 (м, 0,5H, ротамер), 7,4 (с, 0,3H, ротамер), 7,41 (с, 0,98H, ротамер), 7,16 (м, 0,5H, ротамер), 7,12 (м, 0,49H, ротамер), 7,03 (м, 0,49H, ротамер), 6,94 (м, 0,50H, ротамер), 6,24 (м, 1H, ротамер), 3,17 (м, 4H), 2,50 (м, 4H, перекрытый растворителем), 2,39 (с, 3H), 2,25 (с, 3H); ESI-МС: вычислено для (C25H25FN8O) 472, найдено 473 (MH+). ВЭЖХ: время удерживания: 7,71 мин. Чистота: 99%.
ПРИМЕР 57
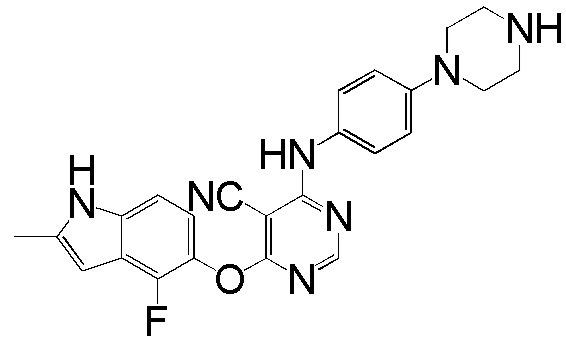
(57)
[0162] Смесь соединения 52 (100 мг, 0,33 ммоль), QW811_1 (92 мг, 0,33 ммоль) и DIPEA (0,15 мл, 0,82 ммоль) в ДМСО (3,5 мл) перемешивали при 80°С в течение 30 мин. После охлаждения до комнатной температуры смесь добавляли к воде (100 мл) и перемешивали при комнатной температуре в течение 30 мин. После охлаждения на ледяной бане твердое вещество собирали фильтрованием, промывали водой. После сушки на воздухе при комнатной температуре в течение ночи твердое вещество суспендировали в ДХМ/MeOH (10/1, 5 мл) и добавляли 1 мл ТФУК. Смесь перемешивали при комнатной температуре в течение ночи. После концентрирования остаток растворяли в ДХМ/MeOH (8/2, 15 мл) и добавляли насыщ. раствор бикарбоната натрия до рН приблизительно 7. Органический слой высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-15% MeOH в ДХМ) с получением соединения 57 в виде желтого твердого вещества (33 мг, выход 20%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,36 (уш.с, 1H), 9,91 (с, 1H), 8,25 (м, 1H), 7,36 (м, 2H), 7,18 (м, 1H), 6,95 (м, 3Н), 6,29 (м, 1H), 6,01 (с, 1H), 4,30 (м, 1H), 3,15 (м, 4H), 2,91 (м, 4H) 2,55 (уш.с, 1H), 2,41 (уш.с, 3H); ESI-МС: вычислено для C24H22FN7O 443, найдено 444 (MH+). ВЭЖХ: время удерживания: 17,31 мин. Чистота: 93%.
ПРИМЕР 58
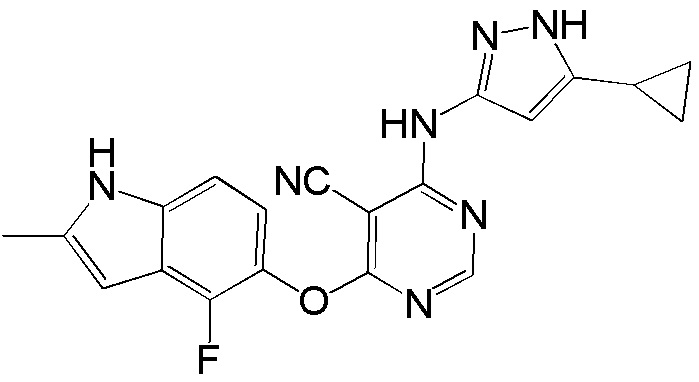
(58)
[0163] Смесь соединения 52 (200 мг, 0,72 ммоль), соединения 30 (152,56 мг, 0,68 ммоль), ксантфоса (4,5-дифенилфосфанил-9,9'-диметил-9Н-ксантена, 99 мг, 0,17 ммоль), K2CO3 (1,51 г, 10,93 ммоль) и ацетата палладия (II) (23 мг, 0,10 ммоль) в 1,4-диоксане (12 мл) продували аргоном в течение 1 часа. Смесь нагревали в микроволновом реакторе в течение 45 мин при 120°С. Проверяли ТСХ, и исходный материал почти израсходовался. После охлаждения до комнатной температуры реакционную смесь разбавляли ДХМ/MeOH (8/2), и пропускали через слой целита, и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 0-12% MeOH в ДХМ) и также очищали с использованием 5% 7N аммиака в дихлорметане. После удаления растворителей получали соединение 58 (12 мг, выход 4%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,24 (уш.с, 1H), 8,69 (с, 1H), 7,39 (м, 2H), 7,09 (м, 2H), 6,83 (м, 3H), 6,21 (м, 3H), 5,21 (с, 1H), 3,04 (м, 4H), 2,49 (м, 4H), 2,39 (с, 3H), 2,36 (м, 2H), 1,02 (т, J= 7,2 Гц, 3H); ESI-МС: вычислено для (C25H28FN7O) 461, найдено 462 (MH+). ВЭЖХ: время удерживания: 9,24 мин. Чистота: 97%.
ПРИМЕР 59
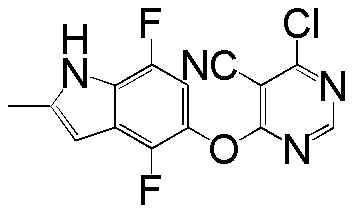
(59)
[0164] К раствору 4,7-дифтор-2-метил-1Н-индол-5-ола (500 мг, 2,73 ммоль) в смеси ацетонитрила (9 мл) и N,N-диметилформамида (1 мл) добавляли карбонат калия (453 мг, 3,28 ммоль). Реакционную смесь перемешивали в течение 30 мин. при комнатной температуре перед добавлением суспензии 2,4-дихлор-5-цианопиримидина (499 мг, 2,87 ммоль) в ацетонитриле/ДМФ (2,5 мл/2,5 мл). Данную смесь перемешивали при 0°С в течение 2 ч. Проверяли ТСХ и реакцию завершали. Смесь разбавляли водой/солевым раствором и этилацетатом. Слои разделяли и водную фазу дважды экстрагировали этилацетатом. Объединенные органические фазы промывали один раз водой/три раза солевым раствором, высушивали над сульфатом натрия, отфильтровывали и фильтрат концентрировали под вакуумом с получением соединения 59 в виде пурпурного клейкого твердого вещества (890 мг, выход 100%, содержащий некоторое количество ДМФ). Продукт использовали без дополнительной очистки. 1H ЯМР (400 МГц, ДМСО-d6) δ 11,91 (уш.с, 1H), 8,84 (с, 1H), 7,03 (дд, J= 5,6 Гц, J= 10,4 Гц, 1H), 6,35 (уш.с, 1H), 2,39 (с, 3H); ESI-МС: вычислено для (C14H7ClF2N4O) 320, найдено 321 (MH+).
ПРИМЕР 60

(60)
[0165] Смесь соединения 59 (неочищенный продукт, 195 мг, 0,61 ммоль), 4-(4-этилпиперазин-1-ил)анилина (100 мг, 0,49 ммоль) и DIPEA (0,21 мл, 1,22 ммоль) в ДМСО (2 мл) перемешивали при комнатной температуре в течение 2 часов. Проверяли ТСХ и реакцию завершали. Добавляли ДХМ (30 мл) с последующим добавлением NH4Cl (30 мл). После разделения водный слой экстрагировали ДХМ/ИПС (8/2, 15 мл × 2). Объединенный органический слой промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью колонки на силикагеле (0-10% MeOH в ДХМ) с получением соединения 60 в виде коричневого твердого вещества (128 мг, выход 53%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,80 (уш.с, 1H), 9,85 (с, 1H), 8,21 (с, 1H), 7,28 (д, J= 8,8 Гц, 2H), 6,97 (дд, J= 5,6 Гц, J= 10,4 Гц, 1H), 6,89 (д, J= 8,8 Гц, 2H), 6,31 (с, 1H), 3,10 (м, 4H), 2,50 (м, 4H), 2,39 (с, 3H), 2,33 (к, J= 6,8 Гц, 2H), 1,00 (т, J= 7,2 Гц, 3H); ESI-МС: вычислено для (C26H25F2N7O) 489, найдено 490 (MH+).
ПРИМЕР 61
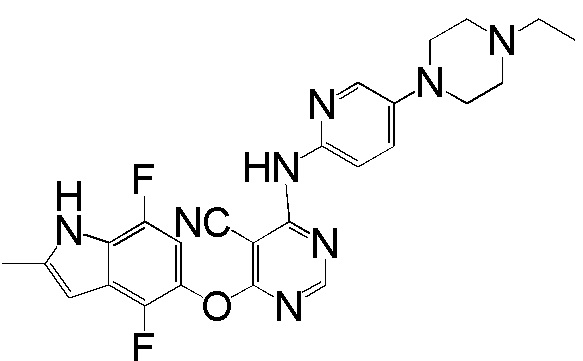
(61)
[0166] Смесь соединения 59 (179 мг, 0,56 ммоль), QW817 (100 мг, 0,49 ммоль) и DIPEA (0,21 мл, 1,22 ммоль) в ДМСО (2 мл) перемешивали при 100°С в течение ночи. Проверяли ТСХ и реакцию завершали. Добавляли ДХМ (30 мл) с последующим добавлением NH4Cl (30 мл). После разделения водный слой экстрагировали ДХМ/ИПС (8/2, 15 мл × 2). Объединенный органический слой промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью колонки на силикагеле (0-10% MeOH в ДХМ) с получением соединения 61 в виде коричневого твердого вещества (120 мг, выход 51%). (Два набора ЯМР в соотношении 1:1,35). Набор 1: 1H ЯМР (400 МГц, ДМСО-d6) δ 11,82 (уш.с, 1Н, перекрытый), 10,10 (уш.с, 1Н), 8,31 (с, 1Н), 8,07 (м, 2Н), 7,39 (с, 1Н), 6,99 (дд, J= 5,6 Гц, J= 10,4 Гц, 1Н), 6,32 (с, 1Н, перекрытый), 3,15 (м, 4Н, перекрытый), 2,50 (м, 4Н, перекрытый растворителем), 2,39 (с, 3H), 2,36 (м, 2H, перекрытый), 1,01 (м, 3H, перекрытый); Набор 2: 1H ЯМР (400 МГц, ДМСО-d6) δ 11,82 (уш.с, 1Н, перекрытый), 9,56 (с, 1H), 8,54 (с, 1H), 8,50 (с, 1H) 7,42 (м, 2H), 7,06 (дд, J= 5,6 Гц, J= 10,4 Гц, 1H), 6,32 (с, 1H, перекрытый), 3,15 (м, 4H, перекрытый), 2,53 (м, 4H), 2,40 (с, 3H), 2,36 (м, 2H, перекрытый), 1,01 (м, 3H, перекрытый); ESI-МС: вычислено для (C25H24F2N8O) 490, найдено 491 (MH+).
ПРИМЕР 62
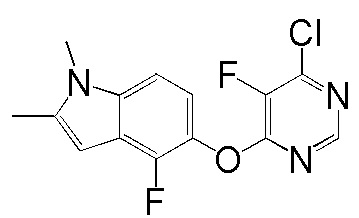
(62)
[0167] К холодной (0°С) суспензии гидрида натрия (60%, 81 мг, 2,03 ммоль) в ДМФ (5 мл) медленно добавляли раствор соединения 23 (300 мг, 1,01 ммоль) и йодметана (0,13 мл, 2,03 ммоль) в ДМФ (3,5 мл). Реакционную смесь перемешивали при 0°С в течение 1 часа. Проверяли ТСХ и расходовали исходный материал. Добавляли водный NH4Cl и EtOAc/гексан (20 мл/10 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Органический слой отделяли и водный слой экстрагировали EtOAc/гексаном (50/50, 10 мл × 2). Объединенный органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали с получением соединения 62 в виде коричневого твердого вещества (325 мг, выход 100%). Никакой дополнительной очистки не проводили. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,39 (с, 1H), 7,26 (д, J= 8,8 Гц, 1H), 7,05 (т, J= 7,6 Гц, 1H), 6,32 (с, 1H), 3,68 (с, 3H), 2,40 (с, 3H); ESI-МС: вычислено для (C14H10ClF2N3O) 309, найдено 310 (MH+).
ПРИМЕР 63
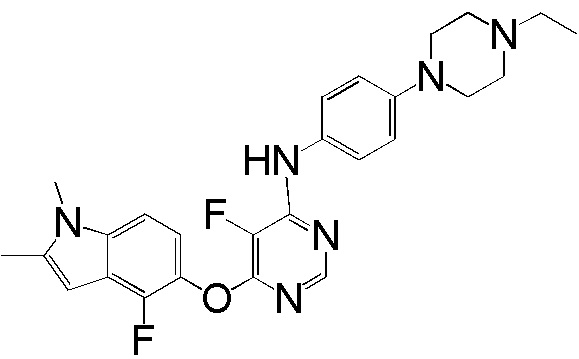
(63)
[0168] Смесь соединения 62 (неочищенный продукт, 188 мг, 0,61 ммоль), 4-(4-этилпиперазин-1-ил)анилина (100 мг, 0,49 ммоль) и DIPEA (0,21 мл, 1,22 ммоль) в ДМСО (2 мл) перемешивали при 100°С в течение ночи. Проверяли ТСХ и реакцию завершали. Добавляли ДХМ (30 мл) с последующим добавлением NH4Cl (30 мл). После разделения водный слой экстрагировали ДХМ/ИПС (8/2, 15 мл × 2). Объединенный органический слой промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью колонки на силикагеле (0-10% MeOH в ДХМ) с получением соединения 63 в виде коричневого твердого вещества (108 мг, выход 46%). 1H ЯМР (400 МГц, ДМСО-d6) δ 9,35 (уш.с, 1H), 7,89 (с, 1H), 7,45 (д, J= 8,8 Гц, 2H), 7,22 (д, J= 8,8 Гц, 1H), 6,99 (т, J= 7,6 Гц, 1H), 6,88 (д, J=8,8 Гц, 2H), 6,29 (с, 1H), 3,67 (с, 3H), 3,06 (м, 4H), 2,50 (м, 4H), 2,39 (с, 3H), 2,33 (к, J= 7,2 Гц, 2H), 1,00 (т, J= 7,2 Гц, 3H); ESI-МС: вычислено для (C26H28F2N6O) 478, найдено 479 (MH+).
ПРИМЕР 64
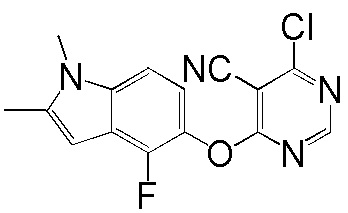
(64)
[0169] К холодной (0°С) суспензии гидрида натрия (60%, 66 мг, 1,65 ммоль) в ДМФ (3 мл) медленно добавляли раствор соединения 52 (250 мг, 0,83 ммоль) и йодметана (0,13 мл, 2,06 ммоль) в ДМФ (3 мл). Реакционную смесь перемешивали при 0°С в течение 1,5 часов. Проверяли ТСХ и расходовали исходный материал. Добавляли водный NH4Cl и EtOAc (20 мл) и смесь перемешивали при комнатной температуре в течение 15 мин. Органический слой отделяли и водный слой экстрагировали EtOAc (10 мл × 2). Объединенный органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали. Неочищенный продукт очищали на колонке (силикагель, 0-10% MeOH в ДХМ) с получением продукта соединения 64 в виде желтого твердого вещества (70 мг, выход 27%). 1H ЯМР (400 МГц, ДМСО-d6) δ 8,81 (с, 1H), 7,31 (м, 1H), 7,08 (м, 1H) 6,34 (с, 1H), 3,69 (с, 3H), 2,41 (с, 3H); ESI-МС: вычислено для (C15H10ClFN4O) 316, найдено 317 (MH+).
ПРИМЕР 65
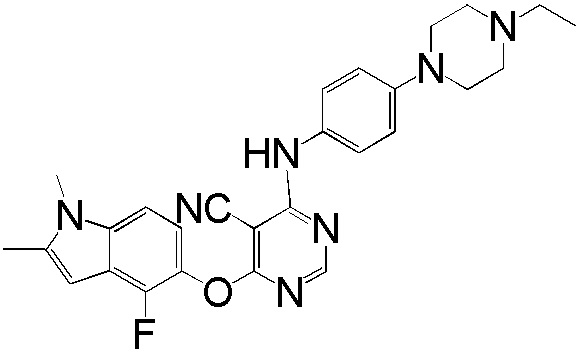
(65)
[0170] Смесь соединения 64 (55 мг, 0,18 ммоль), 4-(4-этилпиперазин-1-ил)анилина (36 мг, 0,18 ммоль) и DIPEA (0,1 мл, 0,44 ммоль) в ДМСО (2 мл) перемешивали при комнатной температуре в течение ночи. Проверяли ТСХ и реакцию завершали. Добавляли ДХМ (15 мл) с последующим добавлением NH4Cl (15 мл). После разделения водный слой экстрагировали ДХМ/ИПС (8/2, 10 мл × 2). Объединенный органический слой промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью колонки на силикагеле (0-10% MeOH в ДХМ) с получением соединения 65 в виде коричневого твердого вещества (23 мг, выход 27%). 1H ЯМР (400 МГц, ДМСО-d6) δ 9,82 (уш.с, 1Н), 8,18 (с, 1Н), 7,29 (д, J= 8,8 Гц, 2Н), 7,24 (д, J= 8,8 Гц, 1Н), 7,00 (т, J= 7,6 Гц, 1H), 6,90 (д, J= 8,8 Гц, 2H), 6,30 (с, 1H), 3,67 (с, 3H), 3,10 (м, 4H), 2,50 (м, 4H), 2,40 (с, 3H), 2,34 (к, J= 7,2 Гц, 2H), 1,01 (т, J= 7,2 Гц, 3H); ESI-МС: вычислено для (C27H28FN7O) 485, найдено 486 (MH+).
ПРИМЕР 66
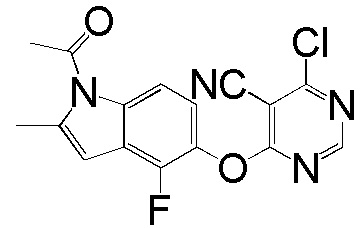
(66)
[0171] К раствору соединения 52 (250 мг, 0,83 ммоль) в ДМФ (3 мл) добавляли DIPEA (0,43 мл, 2,48 ммоль) при комнатной температуре. При комнатной температуре добавляли ацетилхлорид (0,5 мл, 7,07 ммоль) и смесь перемешивали при 70°С в течение ночи. Проверяли ТСХ и расходовали исходный материал. Реакционную смесь выливали в разбавленный бикарбонат натрия в воде (~1%) и экстрагировали EtOAc/гексаном (8/2, 15 мл × 3). Объединенный органический слой промывали водой (15 мл × 3), солевым раствором, высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колонки (силикагель, 10-60% EtOAc в гексане) с получением соединения 66 в виде желтого твердого вещества (43 мг, выход 15%). 1H ЯМР (400 МГц, ДМСО-d6) δ 8,83 (с, 1H), 8,00 (д, J= 9,2 Гц, 1H), 7,26 (т, J= 8,8 Гц, 1H), 6,66 (с, 1H), 2,72 (с, 3H), 2,64 (с, 3H); ESI-МС: вычислено для (C16H10ClFN4O2) 344, найдено 345 (MH+).
ПРИМЕР 67

(67)
[0172] Смесь соединения 66 (38,6 мг, 0,11 ммоль), 4-(4-этилпиперазин-1-ил)анилина (23,0 мг, 0,11 ммоль) и DIPEA (0,05 мл, 0,28 ммоль) в ДМСО (2 мл) перемешивали при комнатной температуре в течение ночи. Проверяли ТСХ и завершали реакцию. Добавляли NH4Cl/воду (9 мл/9 мл) и смесь перемешивали при комнатной температуре в течение 30 мин, затем охлаждали до 0°С. Твердые вещества собирали фильтрованием, промывали водн. NH4Cl и водой с получением соединения 67 в виде белого с желтоватым или сероватым оттенком твердого вещества (42 мг, выход 72%). 1H ЯМР (400 МГц, ДМСО-d6) δ 9,91 (с, 1Н), 8,21 (с, 1Н), 7,97 (д, J= 9,2 Гц, 1Н), 7,31 (д, J= 8,8 Гц, 2H), 7,21 (т, J= 8,8 Гц, 1H), 6,93 (д, J= 8,8 Гц, 2H), 6,63 (с, 1H), 3,60-3,10 (м, 4H), 3,20-2,50 (м, 6H), 2,71 (с, 3H), 2,63 (с, 3H), 1,08 (уш.с, 3H); ESI-МС: вычислено для (C28H28FN7O2) 513, найдено 514 (MH+).
ПРИМЕР 68
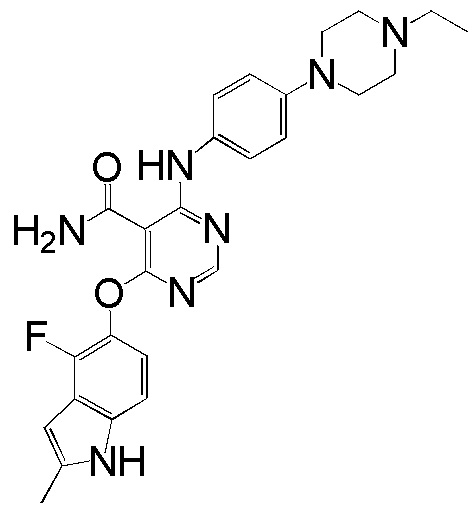
(68)
[0173] К раствору соединения 53 (100 мг, 0,21 ммоль) в ДМСО (2 мл) добавляли карбонат калия (103 мг, 0,74 ммоль) с последующим добавлением пероксида водорода (35% масс./масс. водн. раствора) (0,19 мл, 1,98 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 6 часов. Проверяли ТСХ и завершали реакцию. Добавляли воду и смесь экстрагировали ДХМ/ИПС (8/2, 5 мл × 3). Объединенный органический слой высушивали (Na2SO4) и концентрировали. Неочищенный продукт очищали с помощью колонки на силикагеле (0-10% MeOH в ДХМ) с получением продукта соединения 68 в виде желтого твердого вещества (65 мг, выход 63%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,46 (уш.с, 1H), 11,27 (уш.с, 1H), 8,10 (с, 1H), 8,02 (с, 1H), 7,90 (с, 1H), 7,39 (д, J= 8,8 Гц, 2H), 7,08 (д, J= 8,8 Гц, 1H), 6,96 (т, J= 7,6 Гц, 1H), 6,90 (д, J= 8,8 Гц, 2H), 6,19 (с, 1H), 3,15-3,06 (м, 8H), 2,38-2,28 (м, 5H), 1,01 (т, J= 7,2 Гц, 3H); ESI-МС: вычислено для (C26H28FN7O2) 489, найдено 490 (MH+).
ПРИМЕР 69
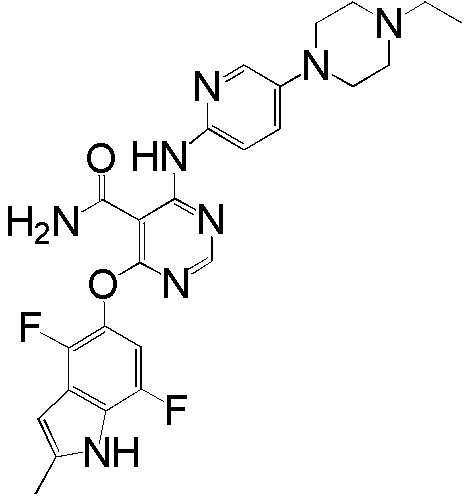
(69)
[0174] К раствору соединения 61 (60 мг, 0,12 ммоль) в ДМСО (2,5 мл) добавляли карбонат калия (108 мг, 0,75 ммоль) с последующим добавлением пероксида водорода (35% масс./масс. водн. раствора) (0,3 мл, 2,97 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 6 часов. Проверяли ТСХ и завершали реакцию. Добавляли воду и смесь экстрагировали ДХМ/ИПС (8/2, 5 мл × 3). Объединенный органический слой высушивали (Na2SO4) и концентрировали. Неочищенный продукт очищали с помощью колонки на силикагеле (0-15% МеОН в ДХМ) с получением продукта соединения 69 в виде желтого твердого вещества (14 мг, выход 21%). 1H ЯМР (400 МГц, ДМСО-d6) δ 11,75 (уш.с, 1H), 11,73 (уш.с, 1H), 8,27 (с, 1H), 8,16 (уш.с, 2H), 8,00 (д, J= 3,2 Гц, 1H), 7,93 (уш.с, 1H), 7,40 (дд, J= 2,8 Гц, J= 9,2 Гц, 1H), 7,03 (дд, J= 5,2 Гц, J= 10,8 Гц, 1H), 6,30 (с, 1H), 3,12 (м, 4H), 2,50-2,30 (м, перекрытый, 4H), 2,39-2,25 (м, 5H), 1,01 (т, J= 7,6 Гц, 3H); ESI-МС: вычислено для (C25H26F2N8O2) 508, найдено 509 (MH+).
ПРИМЕР 70
[0175] Протоколы технологического анализа KinaseProfiler™ (Millipore) использовали для исследования активности ингибирования киназы новых соединений данного изобретения. Для этого буферная композиция представляла собой 20 мМ MOPS, 1 мМ ЭДТА, 0,01% Brij-35, 5% глицерина, 0,1% β-меркаптоэтанола, 1 мг/мл БСА. Исследуемые соединения сначала растворяли в ДМСО до желательной концентрации, затем последовательно разбавляли в буфере для анализа киназы. В конечном объеме реакционной смеси 25 мкл, Aurora-A(h) (5-10 мЕд) инкубируют с 8 мМ MOPS рН 7,0, 0,2 мМ ЭДТА, 200 мкМ LRRASLG (Kemptide), 10 мМ ацетата магния и [γ33P-АТФ]. Реакцию инициировали с помощью добавления смеси MgATP. После инкубирования в течение 40 минут при комнатной температуре реакцию останавливали с помощью добавления 5 мкл 3% раствора фосфорной кислоты. 10 мкл реакционной смеси затем наносили на P30 плоский фильтр и промывали три раза в течение 5 мин в 50 мМ фосфорной кислоте и один раз в метаноле перед сушкой и измерением активности сцинтилляционным методом. Лунки, содержащие субстрат без киназы, и лунки, содержащие фосфопептидный контроль, использовали для установки 0% и 100% значения фосфорилирования соответственно.
[0176] В Таблице 1 представлены характерные данные для ингибирования Abl-киназы, Alk-киназы, с-Src-киназы, FGFR1-киназы, KDR-киназы, Ret-киназы и Tie2-киназы с помощью соединений данного изобретения в концентрации 1 мкМ.
ТАБЛИЦА 1
[0177] Многочисленные исследования были проведены для анализа влияния ингибирования тирозинкиназы в клеточных линиях. Для этого 1000 клеток высевают в 27 мкл/лунка в 384-луночные микропланшеты, которые затем помещают в увлажненный CO2-инкубатор при 37°С в течение ночи. На следующий день добавляют 3 мкл/лунка 10X концентрированное лекарственное средство и планшеты возвращают в инкубатор на 72 часа. После 72-часового инкубирования планшеты удаляют и добавляют реагент для определения жизнеспособности CellTiterblue (Promega) 6 мкл/лунка. Планшеты возвращают в инкубатор на 3 часа, после чего измеряют флуоресценцию на планшетном ридере Victor X3 (Perkin Elmer). Данные анализируют с использованием Excel (Microsoft) и значения GI50 определяют с использованием Prism (Graphpad).
[0178] Для фосфо-FGFR использовали следующий протокол анализа. 25000 клеток высевают в 90 мкл/лунка в 96-луночные микропланшеты, которые затем помещают в увлажненный CO2-инкубатор при 37°С в течение ночи. 96-луночные планшеты ELISA (Mesoscale Discovery) покрывают иммобилизованным антителом (R&D Systems Duo-Set) при 4 мкг/мл, 30 мкл/лунка. На следующий день добавляют 10 мкл/лунка 10X концентрированное лекарственное средство и планшеты возвращают в инкубатор на 20 мин. Планшеты ELISA промывают с использованием автоматизированного устройства для мойки (BioTek Instruments). Через 30 мин клетки инвертируют и осторожно вынимают для удаления избыточной среды и немедленно помещают на лед. Добавляют 30 мкл реагента для лизиса клеток mPer (Thermo Scientific) с ингибиторами протеазы и фосфатазы/лунка. Через 15 мин на льду лизаты смешивают и 30 мкл переносят на планшет ELISA. Планшеты инкубируют в течение 2 часов, промывают и добавляют 30 мкл/лунка детекторное антитело. Через 1 час планшеты промывают и добавляют 30 мкл реагента для выявления «SulfoTag» (MesoScale Discovery). Через 1 час планшеты промывают и добавляют 150 мкл/лунка раствора для считывания. Электрохемилюминесценцию определяют на Mesoscale Discovery Sector Imager 2000. Данные анализируют с использованием Excel (Microsoft) и значения EC50 определяют с использованием Prism (Graphpad).
[0179] В Таблице 2 представлены характерные данные GI50 для ингибирования отдельных линий раковых клеток. EC50 фосфо-FGFR2 на клетках Kato III также было включено в таблицу 2.
ТАБЛИЦА 2
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2016 |
|
RU2718915C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИНДОЛ-5-ОЛА И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2674249C2 |
| КОНДЕНСИРОВАННЫЕ КОЛЬЦЕВЫЕ ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ TRK | 2015 |
|
RU2708674C2 |
| ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПИРАЗОЛО-ПИРИДИНОВЫЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗ ДЛЯ СТИМУЛИРОВАНИЯ РЕГЕНЕРАЦИИ ПЕЧЕНИ ИЛИ СНИЖЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ ГЕПАТОЦИТОВ | 2020 |
|
RU2837173C2 |
| МОДУЛЯТОРЫ АКТИВНОСТИ НЕС1 И СПОСОБЫ ДЛЯ НИХ | 2011 |
|
RU2576036C2 |
| ПИРРОЛОПИРИМИДИНЫ В КАЧЕСТВЕ ПОТЕНЦИАТОРОВ МВТР | 2017 |
|
RU2757457C2 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНИЛПИРРОЛЫ, АКТИВНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2012 |
|
RU2621732C2 |
| ИНГИБИТОРЫ КИНАЗЫ | 2013 |
|
RU2637944C2 |
| ЗАМЕЩЕННЫЕ ПИРРОЛЫ, АКТИВНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2013 |
|
RU2666538C2 |
Настоящее изобретение относится к новому соединению формулы (I) или его фармацевтически приемлемой соли. Соединение обладает свойствами ингибитора Abl-киназы, Alk-киназы, c-Src-киназы, FGFR1-киназы, KDR-киназы, Ret-киназы, Tie2-киназы и p-FGFR2 и может быть использовано при лечении заболевания или состояния, характеризующегося нежелательной клеточной пролиферацией или гиперпролиферацией. В частности, может быть использовано для лечения и/или профилактики пролиферативного нарушения, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания или иммунологически родственного заболевания. В формуле (I)
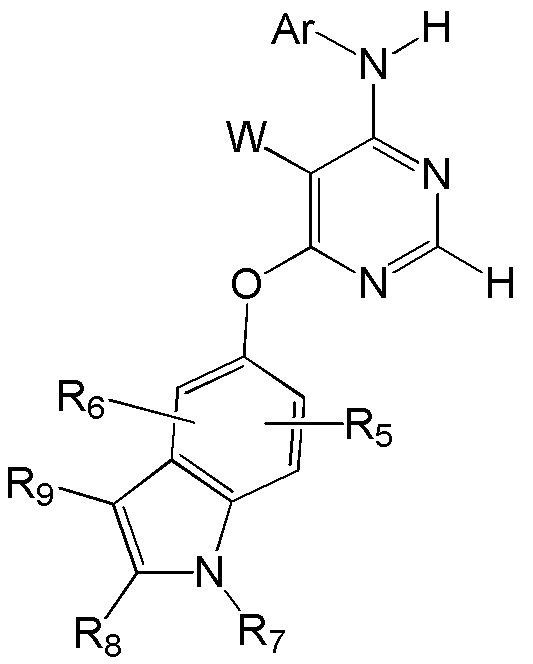
W выбирают из группы, состоящей из: F, Cl, Br, I, CN, C1-C4алкила, C1-C6алкокси, CF3, CHF2, CH2F, CON(R1)R2; R1 и R2 представляют собой водород; Ar представляет собой 5-6-членный гетероарил с 1-2 атомами азота в цикле или фенил, каждый из которых замещен от 0 до 2 заместителями, независимо выбранными из группы, состоящей из (1) галогена и алкоксикарбонила; и (3) группы формулы (Ia):
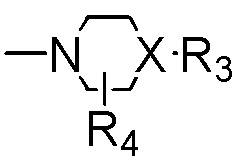 (Ia),
(Ia),
в которой R4 представляет собой водород или C1-C4алкил; X-R3 представляет собой СН; или X-R3 представляет собой O; или Х представляет собой N, и R3 представляет собой водород, С1-С6алкил, C2-C6алканоил, каждый из которых замещен от 0 до 2 заместителями, независимо выбранными из галогена и амино; R5 и R6 независимо выбраны из группы, состоящей из: водорода, F, Cl и Br; и R7, R8 и R9 независимо выбраны из группы, состоящей из: водорода и С1-С4алкила. 3 н. и 3 з.п. ф-лы, 2 табл., 68 пр.
1. Соединение формулы
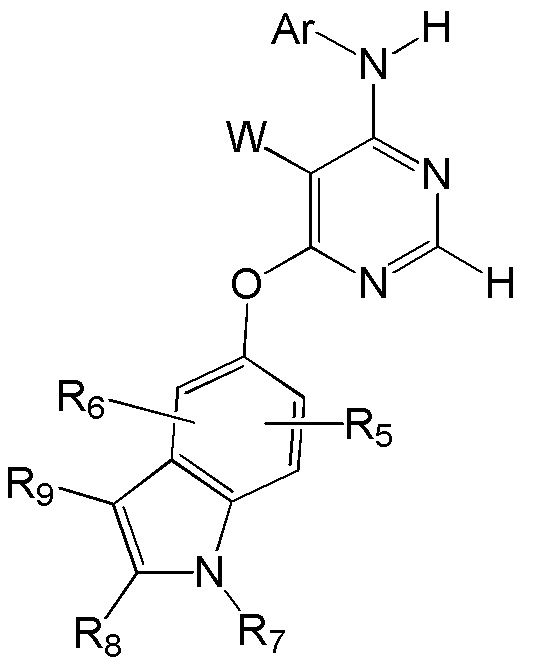
или его фармацевтически приемлемая соль, в которой:
W выбирают из группы, состоящей из: F, Cl, Br, I, CN, C1-C4алкила, C1-C6алкокси, CF3, CHF2, CH2F, CON(R1)R2;
R1 и R2 представляют собой водород;
Ar представляет собой 5-6-членный гетероарил с 1-2 атомами азота в цикле или фенил, каждый из которых замещен от 0 до 2 заместителями, независимо выбранными из группы, состоящей из:
(1) галогена и алкоксикарбонила;
и
(3) групп формулы (Ia):

(Ia),
в которой:
R4 представляет собой водород или C1-C4алкил;
X-R3 представляет собой СН; или X-R3 представляет собой O; или Х представляет собой N, и R3 представляет собой водород, С1-С6алкил, C2-C6алканоил, каждый из которых замещен от 0 до 2 заместителями, независимо выбранными из галогена и амино;
R5 и R6 независимо выбраны из группы, состоящей из: водорода, F, Cl и Br; и
R7, R8 и R9 независимо выбраны из группы, состоящей из: водорода и С1-С4алкила.
2. Фармацевтическая композиция, обладающая свойствами ингибитора Abl-киназы, Alk-киназы, c-Src-киназы, FGFR1-киназы, KDR-киназы, Ret-киназы, Tie2-киназы и p-FGFR2, содержащая, по меньшей мере, одно соединение по п. 1 в эффективном количестве или его фармацевтически приемлемые соли, и фармацевтически приемлемый носитель.
3. Композиция по п. 2 для применения при лечении заболевания или состояния у пациента, характеризующегося нежелательной клеточной пролиферацией или гиперпролиферацией.
4. Композиция по п. 2 или 3 для применения при лечении и/или профилактике пролиферативного нарушения, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания или иммунологически родственного заболевания.
5. Применение соединения по п. 1 для получения лекарственного средства, обладающего свойствами ингибитора Abl-киназы, Alk-киназы, c-Src-киназы, FGFR1-киназы, KDR-киназы, Ret-киназы, Tie2-киназы и p-FGFR2.
6. Соединение по п. 1 для применения в комбинации с эффективным количеством второго профилактического или терапевтического средства для лечения и/или профилактики пролиферативного нарушения, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания или иммунологически родственного заболевания, вызванного активностью Abl-киназы, Alk-киназы, c-Src-киназы, FGFR1-киназы, KDR-киназы, Ret-киназы, Tie2-киназы и p-FGFR2 у пациента.
| WO 2014183300 А1, 20.11.2014 | |||
| US 8013153 B2, 06.09.2011 | |||
| US 7109219 B2, 19.09.2006 | |||
| АЗОТСОДЕРЖАЩИЕ АРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, СПОСОБ ЛЕЧЕНИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2310651C2 |
| US 7468380 B2, 23.12.2008 | |||
| АЗОТСОДЕРЖАЩИЕ АРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, СПОСОБ ЛЕЧЕНИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2310651C2 |
| US 8901143 B2, 02.12.2014 | |||
| ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2008 |
|
RU2455994C2 |
| US 8501756 B2, 06.08.2013 | |||
| Способ пропитки дерева битуминозным составом | 1929 |
|
SU19681A1 |
| Способ получения пахучих веществ из растений | 1926 |
|
SU10380A1 |
Авторы
Даты
2019-09-25—Публикация
2015-02-27—Подача