Изобретение относится к области медицины и может быть использовано для диагностики наследственных форм рака молочной железы, основанной на выявлении генетических мутаций.
Рак молочной железы занимает первое место среди всех злокачественных заболеваний у женщин. По современным данным, частота развития рака молочной железы в России за последние 15 лет увеличилась более чем в 2 раза. Согласно данным мировой литературы, 5-10% случаев рака молочной железы (РМЖ) носят наследственный характер. В 90-х годах прошлого века были обнаружены гены, ассоциированные с РМЖ-BRCA1 и BRCA2. Они играют важную роль в поддержании стабильности генома, способствуя восстановлению двухцепочечных разрывов ДНК. BRCA1 и BRCA2 представляют собой крупные гены, в которых обнаружено множество различных мутаций, ведущих к потере их функций [1, 2].
Ген BRCA1 является высоко полиморфным геном, играющим основную роль в репарации ДНК и контроле клеточной пролиферации. Ген BRCA2 стимулирует гомологичную рекомбинацию, которая включает один из основных биохимических путей репарации двунитевых разрывов ДНК и, следовательно, может функционировать для поддержания целостности генома и подавления малигнизации пролиферирующих клеток [3-6].
Для этих генов известны мутации с «эффектом основателя», т.е. мутации, встречающиеся в популяции с повышенной частотой. Так, например, в восточноевропейской и российской популяции эффект основателя проявляет мутация 5382insC в гене BRCA1, а среди евреев ашкенази распространенными мутациями являются BRCA1 185delAG и BRCA2 6174delT [7-10]. Часто встречающихся патогенных мутаций в гене BRCA2 в России на данный момент не обнаружено. Мутации с эффектом основателя успешно детектируются с помощью высокочувствительного и экономичного метода - аллель-специфической ПЦР в режиме реального времени. Однако большинство мутаций индивидуально редки, рассредоточены по протяженным кодирующим участкам генов BRCA1/2 и многие из них были зарегистрированы только в отдельных семьях. Суммарная частота редко встречающихся мутаций сопоставима или даже превышает частоту мутаций с эффектом основателя. Эти мутации остаются затратными для диагностики из-за высокой стоимости и низкой производительности наиболее подходящего в подобной ситуации метода -секвенирования по Сэнгеру.
Сегодня в США, ряде стран Европы и Китае принято проводить генетический анализ для поиска семейных форм рака. Для этого собирают данные о родословной, зачастую семья наблюдается у одного врача. Осуществляется поиск патогенных генетических вариантов у пациента с признаками наследственной формы рака, и в случае обнаружения проводят анализ найденных вариантов у родственников. При наличии мутации ведется тщательное наблюдение у онколога и маммолога, что позволяет диагностировать и удалить опухоль у пациента на ранних стадиях заболевания [11-13]. Однако при таком подходе имеется существенный недостаток - при использовании анализа родословных более 30% носителей мутаций не выявляются [8]. В России данная практика не принята ввиду того, что информация о семейных патологиях часто отсутствует или крайне фрагментарна. Практика семейных врачей также в России не принята. При этом своевременная диагностика наследственных форм может значительно снизить заболеваемость и смертность при раке молочной железы.
Известен способ выявления факторов наследственной предрасположенности к РМЖ, включающий детекцию повторяющихся мутаций 5382insC, 185delAG в BRCA1 и 6174delT в BRCA2 с помощью ПЦР [14].
Известен способ прогнозирования наследственной предрасположенности к РМЖ путем выявления мутаций в гене BRCA1/2 и СНЕК2 [15]. Данный способ заключается в использовании тотального анализа часто встречающихся мутаций у всех больных раком молочной железы, находящихся на амбулаторном или стационарном лечении. Данный способ предполагает диагностировать узкий список мутаций в горячих точках с помощью аллель-специфической ПЦР в режиме реального времени.
Все вышеописанные способы прогнозирования наследственной предрасположенности к РМЖ сосредоточены на поиске горячих точек, при этом мутации с низкой частотой встречаемости в популяции, остаются проблемными для диагностики и не детектируются.
Наиболее близким к заявляемому способу - прототипом, является способ диагностики наследственных форм РМЖ, включающий забор периферической крови, выделение из лейкоцитов ДНК стандартным соль-хлороформным методом. Далее выбирают образцы ДНК, которые не содержат известные РМЖ-ассоциированные мутации (в генах BRCA1, BRCA2, CHEK2, NBS1, BLM, PALB2, RAD50, BRIP1, ATM, ТР53, BLM). Затем проводят регистрацию генетических маркеров путем массового параллельного секвенирования, на платформе Illumina MiSeq System, с последующим отбором и детальным анализом только вредоносных мутаций среди больных раком молочной железы в гомозиготном состоянии. Под вредоносными мутациями понимаются мутации, чье влияние на функцию гена представляется несомненным, - сдвиги «рамки считывания», нонсенс-мутации, повреждения сплайс - сайтов и т.д [16].
Недостатками прототипа являются ограниченные функциональные возможности и недостаточная эффективность способа, так как: поиск вредоносных мутаций осуществляется только в гомозиготном состоянии, что исключает детекцию мутаций в гетерозиготном состоянии; отбор пациентов на наличие признаков наследственного рака (ранний возраст начала заболевания, первично-множественный рак) также осуществляют только в гомозиготном состоянии, что мешает найти пациентов с генетической предрасположенностью к РМЖ, не подходящих под данные критерии. Дополнительно в прототипе осуществляется фильтрация на отсутствие в семье у пациента родственников, больных раком молочной железы или раком яичников.
Задачей настоящего изобретения является создание нового способа молекулярно-генетической диагностики наследственных форм рака молочной железы с использованием секвенирования нового поколения.
Техническим результатом настоящего изобретения является повышение эффективности диагностики.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
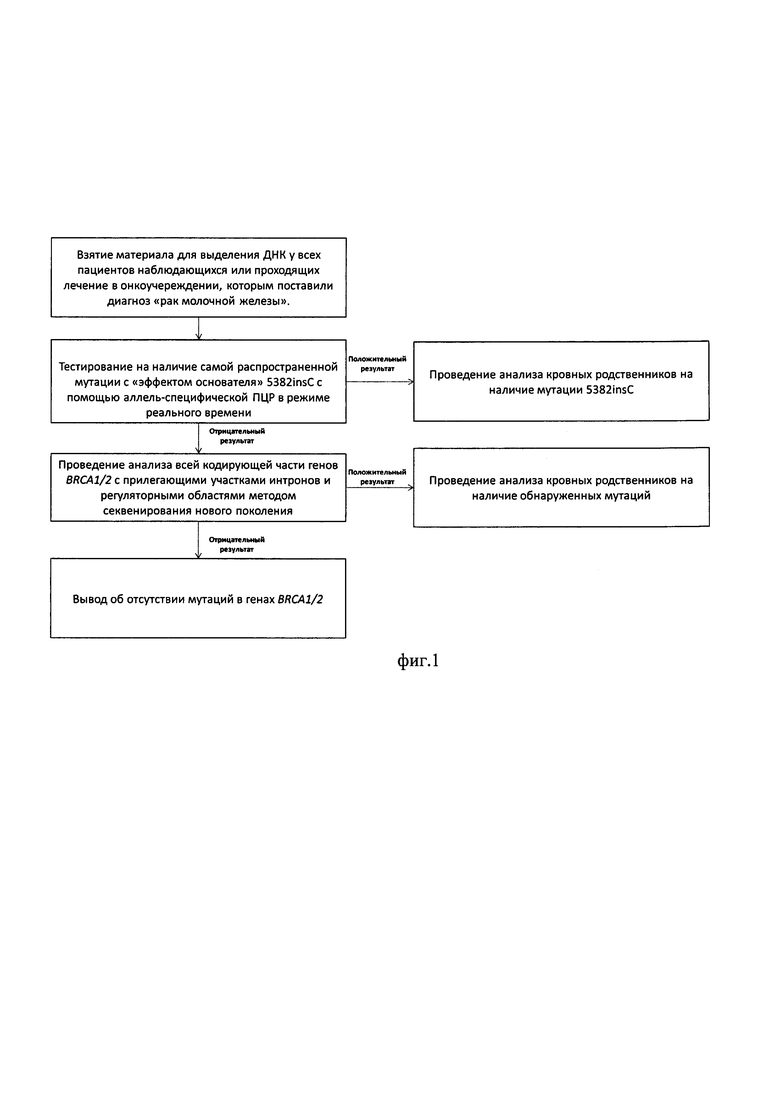
У всех пациенток с диагнозом «рак молочной железы», находящихся на лечении или наблюдении в онкологическом учреждении, проводят забор биологического материала (крови или буккального эпителия). ДНК, полученную из биологического материала, сначала тестируют на наличие самой распространенной в России патогенной мутации в гене BRCA1-5382insC - с помощью аллель-специфической ПЦР в режиме реального времени. В случае положительного результата, проводят поиск данной мутации среди кровных родственников пациента. В случае отсутствия мутации 5382insC у пациента, проводят анализ всей кодирующей части генов BRCA1/2 с прилегающими участками интронов и регуляторными областями методом секвенирования нового поколения.
При нахождении патогенной мутации у пациента, проводят аналогичный поиск у кровных родственников. Если результат отрицательный - делают вывод об отсутствии патогенных мутаций в генах BRCA1/2, если результат положительный. - делают вывод о наследственной предрасположенности пациента к
РМЖ и осуществляют поиск обнаруженной мутации среди кровных родственников пациента.
Под секвенированием нового поколения понимается определение нуклеотидной последовательности ДНК при помощи генетического анализатора Ion PGM.
Отличиями предлагаемого способа, по сравнению с прототипом, являются:
1. Диагностику мутаций проводят всем больным раком молочной железы, проходящим лечение или наблюдающимся в онкологическом учреждении, без учета анамнеза;
2. На первом этапе проводят анализ патогенной мутации 5382insC в гене BRCA1 с помощью аллель-специфической ПЦР в режиме реального времени, что позволяет установить наличие или отсутствие самой часто встречающейся мутации 5382insC у пациента и в случае положительного результата не осуществлять дальнейший поиск мутаций при помощи секвенирования нового поколения;
3. В случае положительного результата, проводят поиск данной мутации среди кровных родственников пациента, что позволяет установить наличие или отсутствие у них мутации 5382insC в гене BRCA1.
4. В случае отсутствия мутации 5382insC у пациента, проводят анализ всей кодирующей части генов BRCA1/2 с прилегающими участками интронов и регуляторными областями методом секвенирования нового поколения, что позволяет установить наличие или отсутствие мутаций в генах BRCA1/2.
5. При нахождении патогенной мутации у пациента, проводят аналогичный поиск у кровных родственников и если результат отрицательный - делают вывод об отсутствии патогенных мутаций в генах BRCA1/2, а если результат положительный - делают вывод о наследственной предрасположенности родственника(ов) пациента к РМЖ.
Предлагаемый способ может быть использован в медицине для целей медицинской диагностики, направленных на выявление носительства мутаций в генах BRCA1 и BRCA2.
На фиг. 1 представлена схема способа молекулярно-генетической диагностики наследственных форм рака молочной железы.
Заявляемым способом была проанализирована выборка из 445 пациентов Новосибирского областного клинического онкологического диспансера с диагнозом «рак молочной железы». Образцы крови были взяты в период с апреля 2013 года по июнь 2016 года. В связи с тем, что одним из признаков наследственной формы рака является молодой возраст, для повышения вероятности обнаружения патогенных мутаций были выбраны пациенты, которые на момент постановки диагноза находились в возрасте от 19 до 40 лет
При помощи секвенирования нового поколения было выявлено 40 носителей патогенных мутаций в гене BRCA1. Мутация с «эффектом основателя» 5382ins была обнаружена у 35 из 40 пациентов (7,9%), у 5 из 40 пациентов были обнаружены иные, отличающиеся друг от друга патогенные мутации.
Из 445 образцов в гене BRCA1 также было обнаружено 16 мутаций с неясным клиническим эффектом и 14 клинически незначимых мутаций, которые можно отнести к полиморфизмам. В процессе анализа выявлено 7 (1,6%) носителей различных патогенных мутаций в гене BRCA2. Кроме того, у 445 больных раком молочной железы были обнаружено 29 генетических вариантов с отсутствующей или неясной клинической значимостью в гене BRCA1 и 14 в гене BRCA2.
Таким образом, в результате анализа мутаций в генах BRCA1/2 среди 445 больных раком молочной железы было выявлено 35 носителей мутации BRCA1 5382insC и 12 носителей иных, отличающихся друг от друга патогенных мутаций.
Затраты на молекулярно- генетическую диагностику при условии постоянного потока пациентов составят порядка нескольких тысяч рублей. В случае обнаружения мутации, пациенту рекомендуется в 2 раза чаще посещать врачей соответствующего профиля. Если объединить затраты на молекулярно - генетическую диагностику и на дополнительное наблюдение у маммолога и онколога, то они составят около 50 тысяч рублей. При обнаружении рака на 1-2 стадии, затраты увеличиваются на порядок, но при обнаружении рака на 3-4 стадии затраты возрастают более чем в 30 раз. При этом не учитывается социальная составляющая, такая как качество и продолжительность жизни пациентов.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1.
Провели анализ образца крови пациентки К. с диагнозом «рак молочной железы» на наличие мутаций.
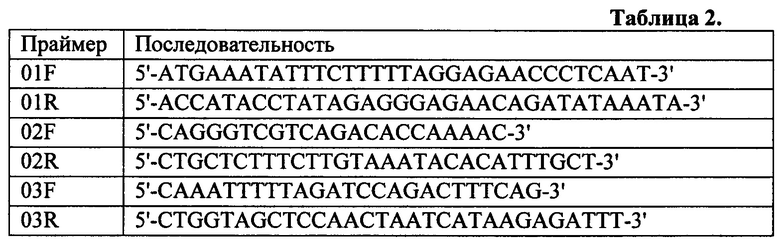
Для этого производили забор периферической крови у пациентки с РМЖ. ДНК выделяли с помощью коммерческого экспресс набора. Далее, с помощью аллель-специфической ПЦР в режиме реального времени, проводили анализ образца на наличие мутации 5382insC в гене BRCA1 с использованием в качестве матрицы ДНК, полученной из образца крови пациентки К. Реакционная смесь объемом 25 мкл содержала: от 5-500 нг геномной ДНК; флуоресцентно-меченые олигонуклеотиды (5'-FAM-AGTGCTATCCGAGGGAACAAAGCGAGCAAGAGAATCCTAG-3'; 5'-FAM-AGTGCTATCCGAGGGAAAAAGCGAGCAAGAGAATCCTCA-3'; 5'-TTATGTGGTTGGGATGGAAGAG-3'; 5'-TTCCCTCGGATAGCACT-BHQ1-3'; где FAM - 6-карбоксифлуоресцеин, флуорофор; BHQ1 - Black Hole Quencher 1, гаситель флуоресценции) (400 нМ); дезоксинуклеозидтрифосфаты (0,32 mM); хлорид магния (3 mM); сульфат аммония (16 mM); Tris-HCl (67 mM; рН=8,8); 1,25 единицы активности Taq ДНК полимеразы. ПЦР осуществляли в следующих условиях: начальная денатурация - 3 мин. при 95°С, далее 40 циклов: денатурация 10 секунд (95°С), гибридизация праймеров 15 секунд (61°С), элонгация цепей 30 секунд (72°С), регистрация флуоресценции - 15с (50°С). Аллель-специфическую ПЦР в режиме реального времени осуществляли с помощью прибора CFX96 (Bio-Rad США) У пациентки К. мутация 5382insC не была обнаружена. Далее проводили анализ всей кодирующей части генов BRCA1/2 с прилегающими участками интронов и регуляторными областями методом секвенирования нового поколения. Для этого использовали в качестве матрицы ДНК, полученную из образца пациентки К., нарабатывали продукт с использованием целевых пар праймеров, представленных в таблице 1 (Структуры праймеров BRCA1) и в таблице 2 (Структуры праймеров BRCA2). Реакционная смесь объемом 25 мкл содержала: от 5-100 нг геномной ДНК; сформированный пул праймеров (10 mM); дезоксинуклеозидтрифосфаты (0,25 mM); хлорид магния (3 mM); сульфат аммония (16 mM); Tris-HCl (67 mM; рН=8,8); 1,25 единицы активности Taq ДНК полимеразы. ПЦР осуществлялась в следующих условиях: стадия денатурации 15 секунд (95°С), стадия отжига 30 секунд (60°С), стадия элонгации 40 секунд (72°С). Для оптимальной наработки продукта необходимо 23 цикла для гена BRCA1 и 28 циклов для гена BRCA2. Мультиплексную ПЦР проводили в термоциклере БИС-Н M111-02 (Россия). Проводили очистку при помощи магнитных частиц Agencourt AMPure ХР. Далее образец подготавливали к секвенированию при помощи коммерческого набора для подготовки таргетной библиотеки ДНК. Подготовленный образец доводили до необходимой концентрации и загружали в прибор Ion OneTouch 2 для осуществления эмульсионной ПЦР. Для этого использовали набор реагентов для подготовки библиотеки к секвенированию Ion PGM Hi-Q ОТ2 Kit (Life Technologies, США) в соответствии с протоколом производителя. Продукт эмульсионной ПЦР очищали с помощью прибора Ion OneTouch ES согласно протоколу, загружали на чип, который помещали в прибор PGM Ion Torrent. Для этого использовали набор реагентов для высокопроизводительного секвенирования Ion PGM Hi-Q Sequencing Kit. Биоинформатический анализ исходных данных проводили на методике PRINSEQ [17]. Полученные в результате анализа нуклеотидные последовательности сравнивали с эталонной последовательностью человеческого генома GRCh37/hg19 с использованием программного обеспечения BWA-MEM версии 0.7.5 [18]. Поиск генетических вариантов проводили с использованием программного обеспечения SAM tools версии 0.1.19[19]. У пациентки К. не было найдено клинически значимых мутаций и был сделан вывод отсутствии мутаций в генах BRCA1/2.
Пример 2.
У пациентки М. с установленным диагнозом «рак молочной железы» была взята кровь для выделения ДНК. ДНК выделяли с помощью коммерческого экспресс набора. Далее методом аллель-специфической ПЦР в режиме реального времени, проводили анализ образца на наличие мутации 5382insC с использованием в качестве матрицы ДНК, полученной из образца пациентки М. Аллель-специфическую ПЦР в режиме реального времени и секвенирование нового поколения проводили аналогично примеру 1. У пациентки М. была обнаружена клинически значимая мутация IVS 18+1 G>T. Был сделан вывод о наличии данной мутации и проведен анализ на присутствие данной мутации у сестры, брата и двух дочерей пациентки. Для этого у брата, сестры и дочерей была взята кровь и выделена ДНК. Секвенирование нового поколения проводили аналогично примеру 1. У брата и сестры пациентки М. мутации не обнаружено, у дочерей найдена эта мутация в гетерозиготном состоянии. Был сделан вывод о наследственной предрасположенности дочерей пациентки М. к РМЖ и отсутствии мутаций в генах BRCA1/2 брата и сестры.
Заявляемый способ обладает повышенной эффективностью и позволяет увеличить процент выявляемости лиц, генетически предрасположенных к раку молочной железы, что позволит диагностировать опухоль на ранних стадиях и повысить выживаемость пациентов и улучшит качество жизни.
Источники информации
1. Mavaddat N. et al. Genetic susceptibility to breast cancer. // Mol. Oncol. Wiley-Blackwell, 2010. Vol. 4, №3. P. 174-191.
2. Lynch H.T., Snyder C., Lynch J. Hereditary Breast Cancer: Practical Pursuit for Clinical Translation // Ann. Surg. Oncol. Springer-Verlag, 2012. Vol. 19, №6. P. 1723-1731.
3. Sharan S.K. et al. Embryonic lethality and radiation hypersensitivity mediated by Rad51 in mice lacking Brca2. // Nature. 1997. Vol. 386, №6627. P. 804-810.
4. Xia F. et al. Deficiency of human BRCA2 leads to impaired homologous recombination but maintains normal nonhomologous end joining. // Proc. Natl. Acad. Sci. U.S.A. 2001. Vol. 98, №15. P. 8644-8649.
5. Moynahan M.E., Pierce A.J., Jasin M. BRCA2 Is Required for Homology-Directed Repair of Chromosomal Breaks // Mol. Cell. Cell Press, 2001. Vol. 7, №2. P. 263-272.
6. Davies A.A. et al. Role of BRCA2 in Control of the RAD51 Recombination and DNA Repair Protein // Mol. Cell. Cell Press, 2001. Vol. 7, №2. P. 273-282.
7. Gayther S.A. et al. Frequently occurring germ-line mutations of the BRCA1 gene in ovarian cancer families from Russia. // Am. J. Hum. Genet. Elsevier, 1997. Vol. 60, №5. P. 1239-1242.
8. Kwon J.S. et al. Expanding the criteria for BRCA mutation testing in breast cancer survivors. // J. Clin. Oncol. 2010. Vol. 28, №27. P. 4214-4220.
9. Iyevleva A.G. et al. Non-founder BRCA1 mutations in Russian breast cancer patients // Cancer Lett. Elsevier, 2010. Vol. 298, №2. P. 258-263.
10. Abeliovich D., Kaduri L., Lerer I., Weinberg N. A.G., Sagi M., Zlotogora J., Heching N. P.T. The founder mutations 185delAG and 5382insC in BRCA1 and 6174delT in BRCA2 appear in 60% of ovarian can_ cer and 30% of early onset breast cancer patients among Ashkenazi women // Am. J. Hum. Genet. Elsevier, 1997. Vol. 60, №3. P. 505-514.
11. Guo Y. et al. Identifying a BRCA2 c. 5722_5723del mutation in a Han-Chinese family with breast cancer // Biosci. Rep. 2019. P. BSR20182471.
12. Siu A.L. Screening for Breast Cancer: U.S. Preventive Services Task Force Recommendation Statement // Ann. Intern. Med. American College of Physicians, 2016. Vol. 164, №4. P. 279.
13. Phi X.-A. et al. Accuracy of screening women at familial risk of breast cancer without a known gene mutation: Individual patient data metaanalysis // Eur. J. Cancer. Pergamon, 2017. Vol. 85. P. 31-38.
14. Sokolenko A.P. et al. Founder mutations in early-onset, familial and bilateral breast cancer patients from Russia. // Fam. Cancer. 2007. Vol. 6, №3. P. 281-286.
15. Paul G.A. et al. Detection of Mutations Related To Hereditary Cancer in Relatives of Breast Cancer Patients // Sib. J. Oncol. 2017. Vol. 16, №4. P. 84-88.
16. Кулигина E.Ш. и др. Способ выявления рецессивных факторов наследственной предрасположенности к раку молочной железы. 2013.
17. Schmieder R., Edwards R. Quality control and preprocessing of metagenomic datasets. // Bioinformatics. Oxford University Press, 2011. Vol. 27, №6. P. 863-864.
18. Li H., Durbin R. Fast and accurate short read alignment with Burrows-Wheeler transform. // Bioinformatics. Oxford University Press, 2009. Vol. 25, №14. P. 1754-1760.
19. Li H. et al. The Sequence Alignment/Map format and SAMtools. // Bioinformatics. Oxford University Press, 2009. Vol. 25, №16. P. 2078-2079.









| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ РЕЦЕССИВНЫХ ФАКТОРОВ НАСЛЕДСТВЕННОЙ ПРЕДРАСПОЛОЖЕННОСТИ К РАКУ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2535157C1 |
| Панель для первичного генетического тестирования наследственной формы рака молочной железы | 2024 |
|
RU2833074C1 |
| Способ прогнозирования низкого риска развития рака молочной железы у женщин с высокопенетратными мутациями в генах BRCA1 и CHEK2 | 2022 |
|
RU2798666C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ЗЛОКАЧЕСТВЕННЫХ ЗАБОЛЕВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ И/ИЛИ ЯИЧНИКОВ У ПАЦИЕНТОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ ПОЧКИ | 2023 |
|
RU2821583C1 |
| СПОСОБ ДИФФЕРЕНЦИРОВАННОГО ПРИМЕНЕНИЯ ДАННЫХ СЕКВЕНИРОВАНИЯ ДНК ДЛЯ ПАЦИЕНТОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ ПОЧКИ | 2022 |
|
RU2803796C1 |
| Способ диагностики предрасположенности к раку молочной железы в русской популяции на основе ПЦР-ПДРФ | 2018 |
|
RU2723585C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАСЛЕДСТВЕННОЙ ПРЕДРАСПОЛОЖЕННОСТИ К РАКУ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2012 |
|
RU2522501C1 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ОПРЕДЕЛЕНИЯ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ КОДИРУЮЩЕЙ ЧАСТИ ГЕНА BRCA1 И ВЫЯВЛЕНИЯ МУТАЦИЙ, АССОЦИИРОВАННЫХ С НАСЛЕДСТВЕННЫМИ ФОРМАМИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2010 |
|
RU2440415C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ РАКА ЯИЧНИКОВ | 2015 |
|
RU2599502C1 |
| Способ определения риска наследственной детерминированности рака молочной железы по анамнестическим данным | 2016 |
|
RU2628865C1 |
Изобретение относится к области медицины. Предложен способ молекулярно-генетической диагностики наследственных форм рака молочной железы. Проводят тестирование выделенной ДНК на наличие мутации 5382insC в гене BRCA1 методом аллель-специфической ПЦР в режиме реального времени. В случае положительного результата проводят поиск данной мутации среди кровных родственников пациента. В случае отсутствия мутации 5382insC у пациента проводят у него анализ всей кодирующей части генов BRCA1/2 с прилегающими участками интронов и регуляторными областями методом секвенирования нового поколения. В случае отсутствия патогенных мутаций делают вывод об отсутствии мутаций в генах BRCA1/2 у пациента. В случае нахождении патогенной мутации у пациента делают вывод о его генетической предрасположенности к раку молочной железы и проводят аналогичный поиск мутаций у кровных родственников. В случае отсутствия патогенной мутации у кровных родственников делают вывод об отсутствии у них мутаций в генах BRCA1/2. Изобретение обеспечивает повышение эффективности диагностики. 2 з.п. ф-лы, 1 ил., 2 табл., 2 пр.
1. Способ молекулярно-генетической диагностики наследственных форм рака молочной железы, включающий сбор образцов биологического материала у пациентов с диагнозом «рак молочной железы», выделение из образцов ДНК с последующим тестированием ДНК на наличие патогенных мутаций в генах BRCA1/2, отличающийся тем, что сначала проводят тестирование выделенной ДНК на наличие мутации 5382insC в гене BRCA1 методом аллель-специфической ПЦР в режиме реального времени, в случае положительного результата проводят поиск данной мутации среди кровных родственников пациента, в случае отсутствия мутации 5382insC у пациента проводят у последнего анализ всей кодирующей части генов BRCA1/2 с прилегающими участками интронов и регуляторными областями методом секвенирования нового поколения, в случае отсутствия патогенных мутаций делают вывод об отсутствии мутаций в генах BRCA1/2 у пациента, в случае нахождении патогенной мутации у пациента делают вывод о его генетической предрасположенности к раку молочной железы и проводят аналогичный поиск мутаций у кровных родственников, а в случае отсутствия патогенной мутации у кровных родственников делают вывод об отсутствии у них мутаций в генах BRCA1/2.
2. Способ по п. 1, отличающийся тем, что аллель-специфическую ПЦР в режиме реального времени осуществляют с помощью прибора CFX96 Bio-Rad.
3. Способ по п. 1, отличающийся тем, что секвенирование нового поколения осуществляют на приборе PGM Ion Torrent с использованием набора реагентов для высокопроизводительного секвенирования Ion PGM Hi-Q Sequencing Kit.
| СПОСОБ ВЫЯВЛЕНИЯ РЕЦЕССИВНЫХ ФАКТОРОВ НАСЛЕДСТВЕННОЙ ПРЕДРАСПОЛОЖЕННОСТИ К РАКУ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2535157C1 |
| ОПРЕДЕЛЕНИЕ ПРЕДРАСПОЛОЖЕННОСТИ К РАКУ ПУТЕМ ИДЕНТИФИКАЦИИ ГЕНОТИПИЧЕСКИХ КОМБИНАЦИЙ СПЕЦИФИЧНЫХ ВАРИАНТОВ ГЕНОВ CYP1B1, BRCA2 И СНЕК2 | 2006 |
|
RU2470998C2 |
| Машина для срезывания кранцев на каблуках | 1928 |
|
SU18444A1 |
| COUCH F.J | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Breast Cancer Information Core | |||
| Hum Mutat | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
Авторы
Даты
2019-10-11—Публикация
2019-06-24—Подача