Область техники, к которой относится изобретение
Изобретение относится к способам получения и применения ферментных препаратов для гидролиза растительного сырья, например, улучшения питательных свойств кормов животных. Использование ферментных препаратов на основе бета-глюканазы, ксиланазы, целлюлазы например позволяет эффективно гидролизовать не перевариваемые полисахариды растений, что приводит к увеличению сахаристости растительных кормов, и усилению питательности растительных кормов животных, а, следовательно, и к увеличению продукции животноводства. Способ получения предусматривает использование рекомбинантных продуцентов на основе P. pastoris, продуцирующих ферменты в количестве не менее 12 грамм белка на литр культуральной жидкости. Получаемый ферментный препарат обладает активностью ксиланазы не менее 10000 Ед/гр; целлюлазы не менее 5000 Ед/гр; бета-глюканазы не менее 8000 Ед/гр; максимальную активность проявляет в диапазоне рН 5,0-8,0.
Уровень техники.
Бета-глюканаза (КФ 3.2.1.6), целлюлаза (КФ 3.2.1.4), ксиланаза (КФ 3.2.1.8) гидролизуют полисахариды клеточной стенки растений до олигосахаридов и моносахаридов (Planas A. Bacterial 1,3-1,4-L-glucanases: structure, function and protein engineering. 2000, Biochim Biophys Acta, 1543, 361; Beg et al Microbial xylanases and their industrial applications: a review. 2001, Appl Microbiol Biotechnol. 56:326; Kuhad et al Microbial cellulases and their industrial applications. 2011, Enzyme Res.; 280696). Ферменты активно используются на практике. В первую очередь эти ферменты используются для улучшения питательных свойств кормов, что приводит к увеличению усвояемости питательных веществ моногастричными животными (куры, свиньи, кролики) (Jeroch Н. and  S. Barley in poultry feeding: a review. 1995, World's Poultry Science Journal, 51, 271; Choct M. Enzymes for the feed industry: past, present and future. 2006, World's Poultry Science Journal, 62, 5). Бета-глюканаза, целлюлаза, ксиланаза широко распространены в природе. Ферменты продуцируются как грибами (Jiang С et al Expression and Characterization of a Novel Antifungal Exo-β-1,3-glucanase from Chaetomium cupreum. 2016, Appl Biochem Biotechnol., 126; Sajith et al An overview on fungal cellulases with an industrial perspective. 2016, 6, 1000461; Polizeli et al Xylanases from fungi: properties and industrial applications. 2005, Appl Microbiol Biotechnol, 67; 577), так и бактериями (Jeong WS Enzymatic Characteristics of a Highly thermostable β-(1-4)-Glucanase from Fervidobacterium islandicum AW-1 (KCTC 4680). 2016, J Microbiol Biotechnol., 124, 2215; Maki et al The prospects of cellulase-producing bacteria for the bioconversion of lignocellulosic biomass. 2009 Int J Biol Sci.; 5): 500; Chakdar et al Bacterial xylanases: biology to biotechnology. 2016; 3 Biotech. 6: 150).
S. Barley in poultry feeding: a review. 1995, World's Poultry Science Journal, 51, 271; Choct M. Enzymes for the feed industry: past, present and future. 2006, World's Poultry Science Journal, 62, 5). Бета-глюканаза, целлюлаза, ксиланаза широко распространены в природе. Ферменты продуцируются как грибами (Jiang С et al Expression and Characterization of a Novel Antifungal Exo-β-1,3-glucanase from Chaetomium cupreum. 2016, Appl Biochem Biotechnol., 126; Sajith et al An overview on fungal cellulases with an industrial perspective. 2016, 6, 1000461; Polizeli et al Xylanases from fungi: properties and industrial applications. 2005, Appl Microbiol Biotechnol, 67; 577), так и бактериями (Jeong WS Enzymatic Characteristics of a Highly thermostable β-(1-4)-Glucanase from Fervidobacterium islandicum AW-1 (KCTC 4680). 2016, J Microbiol Biotechnol., 124, 2215; Maki et al The prospects of cellulase-producing bacteria for the bioconversion of lignocellulosic biomass. 2009 Int J Biol Sci.; 5): 500; Chakdar et al Bacterial xylanases: biology to biotechnology. 2016; 3 Biotech. 6: 150).
Бета-глюканазу, целлюлазу, ксиланазу получают из природных продуцентов. Однако более распространено в промышленности использование рекомбинантных продуцентов, которые обеспечивают получение большего количества фермента в более чистом состоянии. В частности, в P. pastoris экспрессировали ксиланазу (Cayetano-Cruz et al High level expression of a recombinant xylanase by Pichia pastoris cultured in a bioreactor with methanol as the sole carbon source: Purification and biochemical characterization of the enzyme. 2016 Biochemical Engineering Journal 112, 161), бета-глюканазу (Yang et al Cloning and overexpression of a Paenibacillus beta-glucanase in Pichia pastoris: purification and characterization of the recombinant enzyme. 2007 J Microbiol Biotechnol. 17, 58), целлюлазу (Mellitzer et al Expression of lignocellulolytic enzymes in Pichia pastoris. 2012 Microbial Cell Factories 11, 61). Продукция ферментов в данной экспрессионной системе достигала 5 гр/л.
Изобретение сделано с помощью последовательностей генов, кодирующих ферментов и депонированных в GenBank. Для ксиланазы последовательность белка депонирована под NCBI Reference Sequence - WP 017571782.1 бактерии Nocardiopsis halotolerans, для бета-глюканазы - WP_013118126.1 бактерии Cellulomonas flavigena, для целлюлазы - WP_005482479.1 бактерии Streptomyces bottropensis. Штаммы бактерий депонированы во Всероссийской коллекции микроорганизмов под номерами - N. halotolerans ВКМ Ас-2519; С. flavigena ВКМ Ас-1137; S. bottropensis ВКМ Ас-1755. На основании последовательностей указанных генов были получены рекомбинантные продуценты ферментов в экспрессионной системе P. pastoris под контролем промотора АОХ1. Данные об экспрессии, получении, изучении свойств, создании препаратов, патентовании указанных ферментов не обнаружены.
Сущность изобретения.
Технической задачей изобретения является 1) Клонирование генов бактерий N. halotolerans, С.flavigena, S. bottropensis, кодирующих бета-глюканазу, целлюлазу, ксилазназу, и экспрессия ферментов в продуценте P. pastoris; 2) Получение ферментного препарата с активностью ксиланазы не менее 10000 Ед/гр; целлюлазы не менее 5000 Ед/гр; бета-глюканазы не менее 8000 Ед/мл.
Объектом изобретения является ферментный препарат на основе ксиланазы из штамма бактерии N. halotolerans ВКМ Ас-2519, бета-глюканазы из штамма бактерии С. flavigena ВКМ Ас-1137, целлюлазы из штамма бактерии S. bottropensis ВКМ Ас-1755 и его применение. Ферментный препарат гидролизуют полисахариды растительных кормов животных с увеличением сахаристости кормов животных.
Получение ферментного препарата на основе ксиланазы, целлюлазы или бета-глюканазы включает клонирование генов, кодирующих эти ферменты, в экспрессионный вектор продуцента P. pastoris; получение продуцентов отдельных ферментов - P. pastoris К для ксиланазы, P. pastoris Б - для бета-глюканазы, P. pastoris Ц для целлюлазы; культивирование продуцентов в биореакторах для наработки ферментов; сушка наработанных ферментов методом кипящего слоя; смешивание трех ферментов для получения ферментного препарата с необходимой активностью. В экспрессионных рекомбинантных плазмидах гены помещаются под контроль эффективного промотора АОХ1, который обеспечивает наработку ферментов в присутствии метанола. В последовательность генов, кодирующих ферменты, вводится N-концевая сигнальная последовательность, обеспечивающая внеклеточную продукцию ферментов. После проведения культивирования биомассу рекомбинантных продуцентов отделяют от культуральной жидкости, культуральную жидкость, содержащую фермент, концентрируют с помощью фильтрации через мембрану с фиксированным диаметром пор. Полученный концентрат сушится методом псевдосжиженного слоя при температуре до 35°С, в качестве подложки для сушки используется крахмал, отруби лактоза. Полученные высушенные ферменты смешивают в необходимом соотношении до получения ферментного препарата с необходимой активностью.
Сущность изобретения состоит в следующем. 1) Гены, кодирующие ксиланазу бактерии N. halotolerans, бета-глюканазу бактерии С. flavigena, целлюлазу бактерии S. bottropensis клонируются из геномов бактерий в экспрессионный вектор. На основе экспрессионных векторов получают продуцентов ксиланазы - P. pastoris К, бета-глюканазы - P. pastoris Б, целлюлазы - P. pastoris Ц. 2) Проводится наработка ферментов в биореакторах путем культивирования продуцентов в присутствии индуктора - метанола. Продуценты синтезируют ферменты в количестве не менее 12 грамм белка на литр культуральной жидкости. Продукция ферментов не менее 300 Ед/мл для целлюлазы, не менее 400 Ед/мл для бета-глюканазы, не менее 600 Ед/мл для ксиланазы. 3) В результате дальнейшей сушки и смешивая высушенных ферментов получают ферментный препарат с активностью ксиланазы не менее 10000 Ед/гр; целлюлазы не менее 5000 Ед/гр; бета-глюканазы не менее 8000 Ед/мл; который проявляет максимальную активность в диапазоне рН 5,0-8,0.
Перечень фигур.
На Фиг. 1 представлена продукция целлюлазы рекомбинантным продуцентом P. pastoris Ц. А - Образование биомассы продуцента (толстая линия), продукция белка (пунктир), активность фермента (тонкая линия). Б - SDS-ПААГ электрофорез продукции фермента: цифры справа - маркеры молекулярной массы в кДа, цифры сверху - время культивирования продуцента в часах.
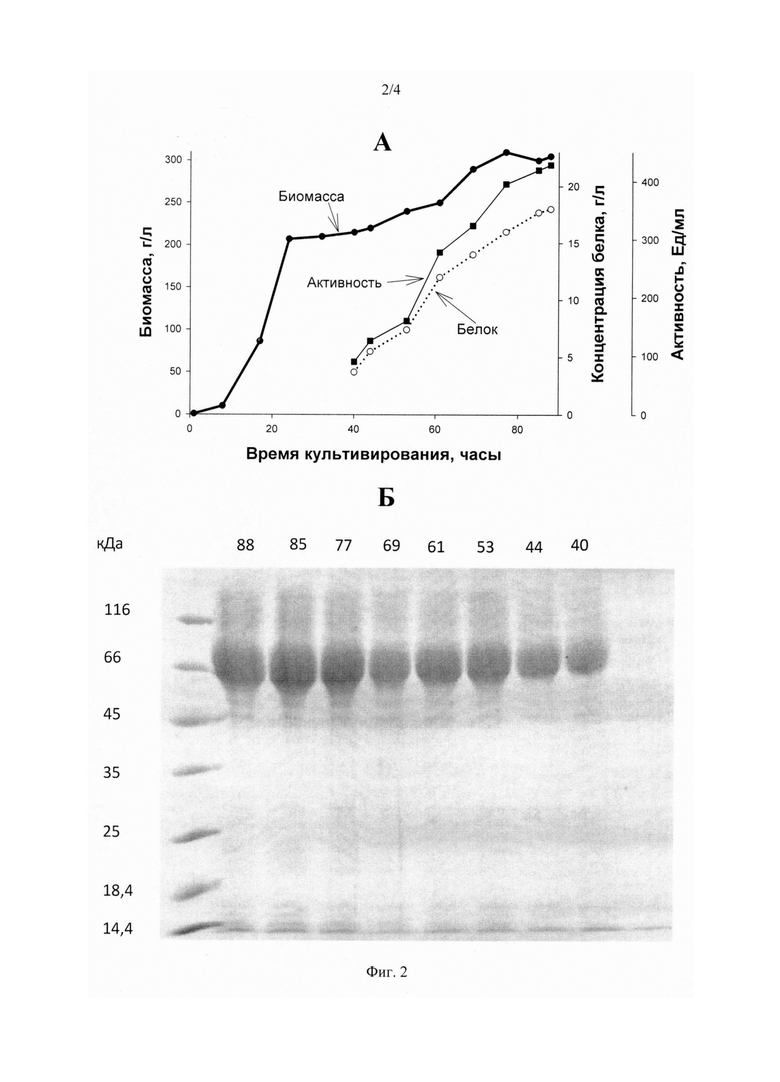
На Фиг. 2 представлена продукция бета-глюканазы рекомбинантным продуцентом Р. pastoris Б. А - Образование биомассы продуцента (толстая линия), продукция белка (пунктир), активность фермента (тонкая линия). Б - SDS-ПААГ электрофорез продукции фермента: цифры справа - маркеры молекулярной массы в кДа, цифры сверху - время культивирования продуцента в часах.
На Фиг. 3 представлена продукция ксиланазы рекомбинантным продуцентом P. pastoris К. А - Образование биомассы продуцента (толстая линия), продукция белка (пунктир), активность фермента (тонкая линия). Б - SDS-ПААГ электрофорез продукции фермента: цифры справа - маркеры молекулярной массы в кДа, цифры сверху - время культивирования продуцента в часах.
На Фиг. 4 изображено осахаривание пшеницы ферментным препаратом на основе ксиланазы, бета-глюканазы, целлюлазы при различных значениях рН. Сплошная линия - опыт, пунктир - контроль.
Сведения, подтверждающие возможность осуществления изобретения.
Пример 1. Наработка ферментного препарата на основе ксиланазы,. бета-глюканазы, целлюлазы с помощью продуцентов P. pastoris К, P. pastoris Б, P. pastoris Ц.
Продуцентами ксиланазы, целлюлазы и бета-глюканазы являются культуры продуцентов P. pastoris К, P. pastoris Ц и P. pastoris Б.
Музейную культуру хранят на скошенном сусло-агаре при 4-6°С в течение шести месяцев. Ее используют как исходную культуру при приготовлении посевного материала I генерации. Перед засевом из холодильника извлекают пробирку со скошенным агаром с культурами продуцентов P. pastoris К, P. pastoris Ц и P. pastoris Б. С соблюдением правил асептики засевают петлей по 8 пробирок с 3 мл среды каждая для каждого продуцента. Состав среды (г/л): глицерин - 40, пептон - 20, дрожжевой экстракт - 10. Выращивают культуры сутки при 30°С при 150 об/мин на качалке. Затем засевают из пробирок для каждого продуцента колб по 8 с 200 мл аналогичной среды каждая. Колбы помещают на качалку и инкубируют при встряхивании (180-200) об/мин при 30°С в течение суток.
Для культивирования продуцента используют питательную среду следующего состава, г/дм3:
В 3 ферментера заливают по 46 дм3 дистиллированной воды, при работающей мешалке загружают по 0,1 кг KH2PO4, 1 кг дрожжевого экстракта, 2 кг пептона, 0,25 кг (NH4)2SO4, 0,05 кг CaCL2, 0,12 кг MgSO4 7H2O, MgSO4 7H2O - 0,05 кг, глицерин - 4 кг и 0,05 дм3 софэксила. Корректируют рН до стерилизации до значения 6,0 и стерилизуют в ферментере при температуре 120°С в течение 40 мин. После охлаждения среды в ферментере до температуры 30°С отбирают пробу среды для биохимического и микробиологического контроля.
Культуру выращивают в ферментерах вместимостью до 100 дм3. В процессе культивирования проводили контроль дыхания культуры с помощью кислородного электрода. После исчерпания в среде источника углерода (глицерина) в каждый ферментер вносится по 250 мл метанола. Через два часа после внесения метанола начинается непрерывная подача метанола в ферментер в количестве 1,2 мл/л культуры в час. Внесение метанола осуществляется до окончания ферментации. Ферментация проводится в течение 95 часов. Отделение биомассы осуществляют фильтрацией культуральной жидкости на нутч-фильтре через бязевый мешок, создавая в аппарате разряжение 80-90 кПа. Далее внеклеточную жидкость концентрирруют на ультрафильтрационной установке с мембранными модулями АР-0,2-15ПА с диаметром пор 15 килодальтон с центробежным насосом при давлении 0,18 МПа. Продолжительность фильтрации - около 5 часов, средняя скорость фильтрации - 10 л/час. Приготовление опытных образцов сухого ферментного препарата проводят на сушильной установке с псевдоожиженным слоем MIDI-GLATT(GLATT IngenieurtechnikGmbH Weimar, Германия). Носителем для приготовления ферментного препарата является крахмал. В камеру загружают носитель в количестве 400 г, включают установку и выводят на температурный режим, подавая подогретый воздух. Затем подают рабочую суспензию с заданной скоростью. Температура в продукте изменяется от 22°С (начало процесса) до (28-35)°С в конце. Критерием завершения цикла сушки (насыщение носителя) является визуальное укрупнение частиц в камере и резкое снижение высоты подъема носителя в камере.
Получение ферментного препарата производится путем смешивания высушенных ферментных препаратов в равных соотношениях. Для этого необходимо загрузить сухие препараты в количестве 18,4 кг каждый в бочку смесителя ротационного типа пьяная бочка. Установить наклон продольной оси бочки к оси ее вращения на 45°. Включить установку и производить перемешивание в течение 30 минут. Определение активности проводят по ГОСТ Р 53046-2008 по увеличению концентрации восстанавливающих Сахаров в реакционной смеси, которую определяли в помощью раствора 3,5-динитросалициловой кислоты. При построении калибровочной кривой для определения концентрации восстанавливающих Сахаров для бета-глюканазы и целлюлазы использовали глюкозу, для ксиланаз - ксилозу. В качестве субстрата бета-глюканазы использовали 0,8% бета-глюкан, в качестве субстрата ксиланазы использовали 0,5% ксилан бука, в качестве субстрата целлюлазы использовали 0,5% КМ-целлюлозу. За единицу активности принимали количество фермента, катализирующего образование 1 мкМ восстанавливающих Сахаров за одну минуту при 50°С. В результате получается ферментный препарат с активностью ксиланазы не менее 10000 Ед/гр; целлюлазы не менее 5000 Ед/гр; бета-глюканазы не менее 8000 Ед/гр.
Результаты получения ферментов продуцентами P. pastoris К, P. pastoris Б, Р. pastoris Ц (продукция белка, ферментативная активность, рост продуцента) представлены в Фиг. 1, Фиг. 2 и Фиг. 3.
Пример 2. Осахаривание растительного сырья под воздействием ферментного препарата при различных значениях рН.
В качестве растительного сырья для осахаривания использовали злак, часто используемый в качестве корма сельскохозяйственных животных - пшеницу. Субстрат измельчали механически на мельнице и просеивали через сито с размером пор 0,2 мкм. Гидролиз растительного субстрата (5% (масса/объем)) проводили в универсальной буферной системе, которая была получена путем смешивания равных объемов 0,05 М уксусной кислоты, 0,05 М Н3РО4, 0,05 М борной кислоты. Необходимое значение рН буферного раствора доводили внесением 1 М раствора NaOH, величину рН в ходе внесения NaOH контролировали с помощью рН-метра. Буферные растворы приготовляли с шагом рН 0,5 единицы, начиная с 3 и заканчивая 9. Реакцию проводили при 40°С при перемешивании в течение суток. В реакционную смесь вносили ферментный препарат в количестве 1 мг/мл и злак в количестве 3 мг/мл. Контролем служила реакционная смесь, не содержащая ферментного препарата. Через 24 часа проводили определение восстанавливающих Сахаров в реакционной смеси и в контроле. Об эффективности гидролиза судили по разнице в концентрации восстанавливающих Сахаров между контролем и опытом после 24 часов реакции. Концентрацию восстанавливающих Сахаров определяли с помощью 3,5-динитросалициловой кислоты по калибровке, построенной на основе глюкозы. Результаты представлены на Фиг. 4. Как видно из представленных результатов, наибольшей эффективностью препарат обладает в диапазоне рН 5,0-8,0.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм мицелиального гриба TRICHODERMA LONGIBRACHIATUM TW-14-220 - продуцент целлюлаз, бета - глюканаз и ксиланаз для кормопроизводства и способ получения кормового комплексного ферментного препарата | 2017 |
|
RU2654564C1 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА TRICHODERMA LONGIBRACHIATUM - ПРОДУЦЕНТ КОМПЛЕКСА КАРБОГИДРАЗ, СОДЕРЖАЩЕГО ЦЕЛЛЮЛАЗЫ, БЕТА-ГЛЮКАНАЗЫ, КСИЛАНАЗЫ, ПЕКТИНАЗЫ И МАННАНАЗЫ | 2001 |
|
RU2195490C2 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА MYCELIOPHTHORA FERGUSII-ПРОДУЦЕНТ НЕЙТРАЛЬНЫХ ЦЕЛЛЮЛАЗЫ, БЕТА-ГЛЮКАНАЗЫ И КСИЛАНАЗЫ | 2008 |
|
RU2361915C1 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА TRICHODERMA REESEI - ПРОДУЦЕНТ КОМПЛЕКСА ЭНДОГЛЮКАНАЗЫ, КСИЛАНАЗЫ И ПЕКТИНАЗ ДЛЯ ПОЛУЧЕНИЯ БЕЛКОВЫХ ДОБАВОК НА ОСНОВЕ ЗЕРНОВОГО И ЗЕРНОБОБОВОГО СЫРЬЯ ДЛЯ ПРИМЕНЕНИЯ В КОРМОПРОИЗВОДСТВЕ | 2018 |
|
RU2696074C1 |
| ШТАММ ГРИБА Penicillium verruculosum B10 EGII ПРОДУЦЕНТ ЭНДО-1.3/1.4-β-ГЛЮКАНАЗЫ, ЦЕЛЛЮЛАЗЫ, β-ГЛЮКОЗИДАЗЫ И КСИЛАНАЗЫ И СПОСОБ ПОЛУЧЕНИЯ КОРМОВОГО КОМПЛЕКСНОГО ФЕРМЕНТНОГО ПРЕПАРАТА | 2012 |
|
RU2532840C2 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА TRICHODERMA LONGIBRACHIATUM - ПРОДУЦЕНТ КОМПЛЕКСА КАРБОГИДРАЗ, СОДЕРЖАЩЕГО ЦЕЛЛЮЛАЗЫ, БЕТА-ГЛЮКАНАЗЫ, КСИЛАНАЗЫ, МАННАНАЗЫ И ПЕКТИНАЗЫ | 2004 |
|
RU2287571C2 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ КОМПЛЕКСА ФЕРМЕНТОВ ЭНДОГЛЮКАНАЗ И КСИЛАНАЗ В КЛЕТКАХ ГРИБА PENICILLIUM VERRUCULOSUM И СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНЫХ ФЕРМЕНТНЫХ ПРЕПАРАТОВ НА ЕГО ОСНОВЕ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ КОРМОПРОИЗВОДСТВА | 2017 |
|
RU2653429C1 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM ПРОДУЦЕНТ КОМПЛЕКСА ФИТАЗЫ А И ЭНДО-1,4-β-ГЛЮКАНАЗЫ II И ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ДОБАВКИ В КОРМАХ | 2022 |
|
RU2810538C2 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM MX-73 ПРОДУЦЕНТ МОДИФИЦИРОВАННОЙ КСИЛАНАЗЫ Е С ПОВЫШЕННОЙ ТЕРМОСТАБИЛЬНОСТЬЮ, ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В ПИЩЕВОЙ И КОРМОВОЙ ПРОМЫШЛЕННОСТИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2018 |
|
RU2711578C1 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА TRICHODERMA LONGIBRACHIATUM - ПРОДУЦЕНТ ЦЕЛЛЮЛАЗ, БЕТА-ГЛЮКАНАЗ И КСИЛАНАЗ | 2005 |
|
RU2303065C1 |



Изобретение относится к биотехнологии. Предложен способ получения ферментного препарата путем культивирования в биореакторах каждого из рекомбинантных продуцентов P. pastoris К для ксиланазы из бактерии Nocardiopsis halotolerans ВКМ Ас-2519, P. pastoris Б для бета-глюканазы из бактерии Cellulomonas flavigena ВКМ Ас-1137, P. pastoris Ц для целлюлазы из бактерии Streptomyces bottropensis ВКМ Ас-1755, концентрирования культуральной жидкости продуцентов, сушки полученного концентрата и смешивания высушенных препаратов ксиланазы, бета-глюканазы и целлюлазы в соотношении 1:1:1. Получаемый препарат имеет активность ксиланазы не менее 10000 Ед./г; целлюлазы не менее 5000 Ед./г; бета-глюканазы не менее 8000 Ед./г; максимальную активность проявляет в диапазоне рН 5,0-8,0. 4 ил., 2 пр.
Способ получения ферментного препарата с активностью ксиланазы не менее 10000 Ед./г; целлюлазы не менее 5000 Ед./г; бета-глюканазы не менее 8000 Ед./г; с максимальной активностью в диапазоне рН 5,0-8,0, осахаривающего растительное сырье, получаемого путем культивирования в биореакторах каждого из рекомбинантных продуцентов P. pastoris К для ксиланазы из бактерии Nocardiopsis halotolerans ВКМ Ас-2519, P. pastoris Б для бета-глюканазы из бактерии Cellulomonas flavigena ВКМ Ас-1137, P. pastoris Ц для целлюлазы из бактерии Streptomyces bottropensis ВКМ Ас-1755, концентрирования культуральной жидкости продуцентов, сушки полученного концентрата и смешивания высушенных препаратов ксиланазы, бета-глюканазы и целлюлазы в соотношении 1:1:1.
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛОВОГО СПИРТА ИЗ ЗЕРНОВОГО СЫРЬЯ | 2010 |
|
RU2425883C1 |
| NCBI Referens Sequence WP_017571782.1, 28.06.2013 | |||
| Найдено в Интернете по адресу https://www.ncbi.nlm.nih.gov/protein/WP_017571782.1/ | |||
| NCBI Referens Sequence WP_013118126.1, 26.05.2013 | |||
| Найдено в Интернете по адресуhttps://www.ncbi.nlm.nih.gov/protein/WP_013118126.1 | |||
| NCBI Referens Sequence WP_005482479.1, 04.06.2013 | |||
| Найдено в Интернете по адресу https://www.ncbi.nlm.nih.gov/protein/WP_005482479.1/ | |||
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА И ФЕРМЕНТНЫЙ ПРЕПАРАТ | 1994 |
|
RU2057179C1 |
| Приспособление к рулетке для восстановления перпендикуляров | 1931 |
|
SU26127A1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ЗЕРНОВОГО СЫРЬЯ НА СПИРТ И КОРМОВОЙ ПРОДУКТ | 2009 |
|
RU2396007C1 |
| WO 2011079048 A3, 14.06.2012.. | |||
Авторы
Даты
2019-11-06—Публикация
2018-03-29—Подача