Настоящее изобретение относится к новым производным (R)-2-метил-пиперазина формулы (I), и к их применению в качестве фармацевтических препаратов. Изобретение также охватывает родственные аспекты, включая способы получения соединений, фармацевтические композиции, содержащие одно или несколько соединений формулы (I), и в особенности их применение в качестве модуляторов CXCR3 рецептора.
Хемокиновые рецепторы представляют собой группу рецепторов, связанных с G-белком (GPCR), которые связывают пептидные хемокиновые лиганды с высоким сродством. Основной функцией хемокиновых рецепторов является управлением направленным потоком лимфоцитов к лимфоидным органам и тканям в покоящихся условиях, а также при воспалении, но также установлена роль определенных хемокиновых рецепторов на негемопоэтические клетки и их предшественники.
Хемокиновый рецептор CXCR3 представляет собой рецептор, связанный с G-белком, связывающийся с воспалительными хемокинами CXCL9 (изначально называемый MIG, монокин, индуцируемый интерфероном-γ [INF-γ]) CXCL10 (IP-10, INF-γ-индуцируемый белок 10), и CXCL11 (I-TAC, INF-γ-индуцируемый Т клеточный α хемоаттрактант). CXCR3 главным образом экспрессируется в активированных лимфоцитах Т хелперах типа 1 (Th1), но также он присутствует на природных клетках-киллерах, макрофагах, дендритных клетках и подмножестве В лимфоцитов. Три CXCR3 лиганда экспрессируются главным образом при воспалительных состояниях, экспрессия в здоровой ткани чрезвычайно низкая. Клетки, которые могут экспрессировать CXCR3 лиганды, например, после воздействия воспалительных цитокинов, таких как интерферон-γ или TNF-α включают различные стволовые клетки, такие как эндотелиальные клетки, фибробласты, эпителиальные клетки, кератиноциты, а также гемопоэтические клетки, такие как макрофаги и моноциты. Взаимодействие CXCR3 и его лигандов (далее в настоящей заявке обозначается как CXCR3 ось) вовлечено в управление рецепторами изотипических клеток в специфические участки в организме, в особенности, в участки воспаления, иммунного поражения и иммунной дисфункции и также ассоциировано с повреждением ткани, индукцией апоптоза, клеточного роста, и ангиостаза. CXCR3 и его лиганды повышено регулируются и интенсивно экспрессируются в различных патологических ситуациях, включая аутоиммунные нарушения, воспаление, инфекцию, отторжение трансплантата, фиброз, нейродегенерацию и злокачественное новообразование.
Роль CXCR3 оси при аутоиммунных нарушениях подтверждена несколькими доклиническими и клиническими наблюдениями. Аутоиммунные нарушения, при которых гистологический анализ воспалительных очагов или уровней в сыворотке крови пациентов показывает повышенные уровни CXCR3 лигандов или повышенное количество CXCR3 положительных клеток, включают ревматоидный артрит (RA), системную красную волчанку (SLE), волчаночный нефрит, рассеянный склероз (МС), воспалительное заболевание кишечника (IBD; включая болезнь Крона и неспецифический язвенный колит), и сахарный диабет I типа (Groom, J.R. & Luster, A.D. Immunol Cell Biol 2011, 89, 207; Groom, J.R. & Luster, A.D. Exp Cell Res 2011, 317, 620; Lacotte, S., Brun, S., Muller, S. & Dumortier, H. Ann N Y Acad Sci 2009, 1173, 310). Поскольку экспрессия CXCR3 лигандов является чрезвычайно низкой в здоровых тканях, то процитированное выше корреляционное наблюдение убедительно подтверждает роль CXCR3 при аутоиммунных заболеваниях у человека.
Модели доклинического заболевания, реализуемые на CXCR3 дефицитных мышах, мышах, дефицитных по одному из CXCR3 лигандов, или использование антител, блокирующих функцию либо CXCR3 или одного из его лигандов, дополнительно подтверждает роль CXCR3 оси при иммунной патологии. Например, было показано, что у мышей, дефектных либо по CXCR3 или CXCR3 лиганду CXCL9, проявляется уменьшенная патология на модели для волчаночного нефрита (Menke, J. и др. J Am Soc Nephrol 2008, 19, 1177). На животной модели для другой формы воспаления почек, интерстициального цистита, было показано, что введение антитела, блокирующего функцию CXCL10, уменьшает патологию при индуцированном циклофосфамидом цистите (Sakthivel, S.K. и др. J Immune Based Ther Vaccines 2008, 6, 6). Аналогично, блокирование CXCL10 с помощью антитела уменьшает патологию у крыс на модели ревматоидного артрита (Mohan, K. & Issekutz, Т.В. J Immunol 2007, 179, 8463). Сходным образом, на мышиной модели воспалительного заболевания кишечника, блокирующее антитело к CXCL10 может предотвращать патологию при плане лечения (Singh, U.Р. и др. J Interferon Cytokine Res 2008, 28, 31) Кроме того, эксперименты, осуществленные с тканью из CXCR3 дефектных мышей, подтверждают роль CXCR3 при глютеновой болезни, другом нарушении аутоиммунного типа (Lammers, K.М. и др. Gastroenterology 2008, 135, 194).
Воспалительные заболевания, которые связаны с повышенной экспрессией CXCR3 оси, включают хроническое обструктивное заболевание легких (ХОЗЛ), астму, саркоидоз, атеросклероз и миокардит (Groom, J.R. & Luster, A.D. Immunol Cell Biol 2011, 89, 207; Groom, J.R. & Luster, A.D. Exp Cell Res 2011, 317, 620).
В одном исследовании было показано, что CXCR3 положительные клетки повышены в легких курильщиков с ХОЗЛ по сравнению со здоровыми субъектами и иммунореактивность к CXCR3-лигaндy CXCL10 присутствует в бронхоальвеолярном эпителии курильщиков с ХОЗЛ, но не в бронхоальвеолярном эпителии курильщиков и некурящих контрольных субъектов (Saetta, М. и др. Am J Respir Crit Care Med 2002, 165, 1404). Эти данные свидетельствуют о том, что CXCR3 ось может быть задействована в рекрутинг иммунокомпетентных клеток, который происходит в периферических дыхательных путях курильщиков с ХОЗЛ. В соответствии с этими наблюдениями, при доклинических исследованиях ХОЗЛ было обнаружено ослабление острого воспаления легких, индуцированного табачным дымом, у CXCR3 дефицитных мышей (Nie, L. и др. Respir Res 2008, 9, 82).
В одном из исследований атеросклероза, CXCR3 экспрессия была обнаружена в Т клетках в очагах атеросклеротического поражения у человека. CXCR3 лиганды CXCL9, CXCL10 и CXCL11 все были обнаружены в эндотелиальных и гладкомышечных клетках, ассоциированных с этими очагами, свидетельствуя о том, что они вовлечены в рекрутинг и удерживание CXCR3 положительных клеток, в особенности активированных Т лимфоцитов, наблюдаемых в пределах пораженных участков стенок сосудов при атерогенезе (Mach, F. и др. J Clin Invest 1999, 104, 1041).
Доклинические исследования дополнительно подтвердили роль CXCR3 в развитии атеросклероза. CXCR3 генетическая делеция у мышей с отсутствующим АроЕ приводит к существенному уменьшению развития атеросклеротических очагов в пределах нормальных аорт (Veillard, N.R. и др. Circulation 2005, 112, 870).
Ключевая роль для CXCR3 оси также была подвержена в реакциях отторжения после токсичности, связанной с трансплантацией органов и трансплантацией костного мозга (Groom, J.R. & Luster, A.D. Exp Cell Res 2011, 317, 620). Доклинически, CXCR3 дефицитные мыши проявляют существенную резистентность к отторжению аллотрансплантата (Hancock, W.W. и др. J Exp Med 2000, 192, 1515).
Концентрация CXCR3 лиганда в плазме также положительно коррелирует с различными патологиями печени, включая цирроз печени и фиброз у людей (Tacke, F., и др. Liver Int 2011, 31, 840).
В области онкологии, предполагается, что блокирование CXCR3 оси помогает ограничить метастатическое распространение злокачественных клеток. Например, введение небольшой молекулы антагониста CXCR3 рецептора А МГ487 может ограничить метастазирование опухолевых клеток в легкие (Pradelli, Е. и др. Int J Cancer 2009, 125, 2586). Функциональное подтверждение роли CXCR3 в регуляции В-клеточного хронического лимфолейкоза (CLL) описано Trentin и соавторами (Trentin, L. и др. J Clin Invest 1999, 104, 115).
В центральной нервной системе, блокирование CXCR3 оси может оказывать благоприятное влияние и предотвращать нейродегенерацию. Повышенная экспрессия CXCL10 в ЦНС показана при ишемии, болезни Альцгеймера, рассеянном склерозе (МС), и энцефалите, вызванного вирусом иммунодефицита человека (ВИЧ). Например, в экспериментах ex vivo было показано, что в ткани, имеющей происхождение либо из CXCR3 или CXCL10 дефектных мышей, гибель клеток нейронов уменьшается после нейротоксического NMDA-лечения по сравнению с тканью, имеющей происхождение из мышей дикого типа (van Weering, Н.R. и др. Hippocampus 2011, 21, 220). В исследовании, направленном на идентификацию молекул лекарственных средств, которые обеспечивают нейропротективное действие при индуцированной НТТ фрагментом нейродегенерации на модели болезни Хантингтона, было идентифицировано два антагониста CXCR3 рецептора (Reinhart, Р.Н. и др. Neurobiol Dis 2011, 43, 248)
Производные 4-тиазолил-пиперидина в качестве модуляторов CXCR3 рецептора были описаны в WO 2007/064553 и WO 2007/070433.
Различные производные 1-(пиперазин-1-ил)-2-гетероарил-этанона в качестве модуляторов CXCR3 рецептора были описаны в WO 2007/100610, WO 2010/126811, WO 2013/114332, WO 2015/011099, WO 2015/145322 и на стендовом докладе (A. Prokopowicz et al., Optimization of a biaryl series of CXCR3 antagonists, 244th ACS National Meeting, Philadelphia, US, August 19-23, 2012).
Сейчас было обнаружено, что производные (R)-2-метил-пиперазина формулы (I) являются эффективными CXCR3 модуляторами с неожиданно улучшенным профилем в hERG Q-Patch анализе, указывая на уменьшенный риск пролонгации QT. Эти производные могут быть полезными для лечения заболеваний, которые опосредуются или поддерживаются через CXCR3 ось, включая аутоиммунные нарушения (например, ревматоидный артрит, рассеянный склероз, воспалительное заболевание кишечника, системная красная волчанка, волчаночный нефрит, интерстициальный цистит, глютеновая болезнь), воспалительные нарушения (например, астма, ХОЗЛ, атеросклероз, миокардит, саркоидоз), отторжение трансплантата, фиброз (например, цирроз печени), нейродегенерацию и состояния, вовлекающие гибель нейронов (например, болезнь Альцгеймера, болезнь Хантингтона), и злокачественное новообразование.
1) В первом варианте осуществления, настоящее изобретение относится к соединениям формулы (I)

где
R1 представляет собой (С1-4)алкил, (С1-2)алкокси-(С1-2)алкил, гидрокси-(С1-4)алкил или -C(O)NH2; и
R2 представляет собой (С3-6)циклоалкил, (С1-4)алкокси, (С3-6)циклоалкокси или (С1-2)фторалкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
Во избежание неверного толкования, соединения формулы (I) имеют (R)-конфигурацию на асимметрическом атоме углерода пиперазинового кольца.
Определения, представленные в настоящей заявке, предназначены для придания однообразности соединениям формулы (I), как определено в любом из вариантов осуществления 1) - 23), и, mutatis mutandis, для всего описания и пунктов формулы изобретения, если специально не указано иначе, представленное определение обеспечивает более широкое или более узкое определение. Очевидно, что определение или предпочтительное определение термина характеризует и может быть заменено соответствующим термином независимо от (и в комбинации с) любым определением или предпочтительным определением любого одного или всех других терминов, как указано в настоящей заявке.
Соединения формулы (I), как определено в любом из вариантов осуществления 1) - 23), могут содержать один или несколько стереогенных или асимметричных центров, таких как один или несколько асимметричных атомов углерода. Следовательно, соединения формулы (I) могут быть представлены в виде смеси стереоизомеров или в стереоизомерно обогащенной форме, предпочтительно в виде чистых стереоизомеров. Смеси стереоизомеров могут быть разделены с помощью способа, известного специалисту в данной области техники.
Термин "обогащенный", например, если используется в контексте энантиомеров в контексте настоящего изобретения обозначает, в особенности, что соответствующий энантиомер присутствует в соотношении (mutatis mutandis: чистота) по меньшей мере 70:30, и в особенности по меньшей мере 90:10 (mutatis mutandis: чистота 70% / 90%) по отношению к соответствующему другому энантиомеру. Предпочтительно термин относится к соответствующему по существу чистому энантиомеру. Термин "по существу", например, при использовании в таком термине, как "по существу чистый" в контексте настоящего изобретения обозначает, в особенности, что соответствующий стереоизомер / композиция / соединение и т.д. состоит из количества по меньшей мере 90, в особенности по меньшей мере 95, и в особенности по меньшей мере 99 процентов по весу соответствующего чистого стереоизомера /композиции/ соединения и т.д.
Термин "алкил", используемый отдельно или в комбинации, относится к неразветвленной или разветвленной насыщенной углеродной цепи, содержащей от одного до четырех атомов углерода. Термин "(Сx-y)алкил" (x и y каждый представляет собой целое число), относится к алкильной группе, как определено в настоящей заявке ранее, содержащей от x до y атомов углерода. Например, (С1-4)алкильная группа содержит от одного до четырех атомов углерода. Примерами (С1-4)алкильных групп являются метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор.-бутил и трет.-бутил. Примерами (С1-2)алкильных групп являются метил и этил. В случае, когда R1 представляет собой "(С1-4)алкил", термин обозначает метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор.-бутил и трет.-бутил; предпочтительно метил, этил, н-пропил, изо-пропил и трет.-бутил; и более предпочтительно этил и изо-пропил.
Термин "алкокси", используемый отдельно или в комбинации, относится к алкил-О- группой, где алкильная группа имеет значения, как определено в настоящей заявке ранее. Термин "(Сx-y)алкокси" (x и y каждый представляет собой целое число) относится к алкокси группе, как определено в настоящей заявке ранее, содержащей x - y атомов углерода. Например, (С1-4)алкокси группа обозначает группу формулы (С1-4)алкил-O-, в которой термин "(С1-4)алкил" имеет указанное ранее значение. Примерами (С1-4)алкокси группы являются метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, втор.-бутокси и трет.-бутокси. Примерами (С1-2)алкокси групп являются метокси и этокси. В случае, когда R2 представляет собой "(С1-4)алкокси", термин обозначает метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, втор.-бутокси и трет.-бутокси и предпочтительно этокси.
Термин "гидрокси-(С1-4)алкил", используемый отдельно или в комбинации, относится к алкильной группе, как определено в настоящей заявке ранее, содержащей от одного до четырех атомов углерода, в которой один атом водорода заменен гидрокси. Примерами указанных групп являются гидрокси-метил, 1-гидрокси-этил, 2-гидрокси-этил, 1-гидрокси-проп-1-ил, 2-гидрокси-проп-1-ил, 3-гидрокси-проп-1-ил, 1-гидрокси-проп-2-ил, 2-гидрокси-проп-2-ил, 1-гидрокси-бут-1-ил, 2-гидрокси-бут-1-ил, 3-гидрокси-бут-1-ил, 4-гидрокси-бут-1-ил, 1-гидрокси-бут-2-ил, 2-гидрокси-бут-2-ил, 3-гидрокси-бут-2-ил, 4-гидрокси-бут-2-ил, 1-гидрокси-2-метил-проп-1-ил, 2-гидрокси-2-метил-проп-1-ил, 3-гидрокси-2-метил-проп-1-ил, и 2-гидрокси-1,1-диметил-эт-1-ил. В случае, если "R1" представляет собой "гидрокси-(С1-4)алкил", то термин обозначает гидрокси-метил, 1-гидрокси-этил, 2-гидрокси-этил, 1-гидрокси-проп-1-ил, 2-гидрокси-проп-1-ил, 3-гидрокси-проп-1-ил, 1-гидрокси-проп-2-ил, 2-гидрокси-проп-2-ил, 1-гидрокси-бут-1-ил, 2-гидрокси-бут-1-ил, 3-гидрокси-бут-1-ил, 4-гидрокси-бут-1-ил, 1-гидрокси-бут-2-ил, 2-гидрокси-бут-2-ил, 3-гидрокси-бут-2-ил, 4-гидрокси-бут-2-ил, 1-гидрокси-2-метил-проп-1-ил, 2-гидрокси-2-метил-проп-1-ил, 3-гидрокси-2-метил-проп-1-ил, и 2-гидрокси-1,1-диметил-эт-1-ил. Предпочтительными являются гидрокси-метил, 1-гидрокси-этил и 2-гидрокси-проп-2-ил и наиболее предпочтительным является 1-гидрокси-этил.
Термин "(Cxa-ya)алкокси-(Cx-y)алкил" (x, xa, y и ya каждый представляет собой целое число) относится к алкильной группе, как определено в настоящей заявке ранее, содержащей x - y атомов углерода, в которой один атом водорода заменен (Cxa-ya)алкокси, как определено в настоящей заявке ранее, содержащей xa - ya атомов углерода. Например, "(С1-2)алкокси-(С1-2)алкильная группа" относится к (С1-2)алкильной группе, как определено в настоящей заявке ранее, содержащей один или два атома углерода, в которой один атом водорода заменен (С1-2)алкокси, как определено в настоящей заявке ранее, содержащей один или два атома углерода. Примерами (С1-2)алкокси-(С1-2)алкильных групп являются метокси-метил, 1-метокси-этил, 2-метокси-этил, этокси-метил, 1-этокси-этил и 2-этокси-этил. В случае, если "R1" представляет собой "(С1-2)алкокси-(С1-2)алкил", то термин обозначает метокси-метил, 1-метокси-этил, 2-метокси-этил, этокси-метил, 1-этокси-этил и 2-этокси-этил и предпочтительно метокси-метил.
Термин "фторалкил" относится к алкильной группе, как определено в настоящей заявке ранее, содержащей один или два атома углерода, в которой один или больше (и возможно все) атомы водорода заменены фтором. Термин "(Сx-y)фторалкил" (x и y каждый представляет собой целое число)относится к фторалкильной группе, как определено в настоящей заявке ранее, содержащей x - y атомов углерода. Например, (С1-2)фторалкильная группа содержит один или два атома углерода, в которой один - пять атомов водорода заменены фтором. Репрезентативные примеры (С1-2)фторалкильных групп включают фторметил, дифторметил, трифторметил, 1-фторэтил, 1,1-дифторэтил, 2-фторэтил, 2,2-дифторэтил, и 2,2,2-трифторэтил. В случае, если R2 представляет собой "(С1-2)фторалкил", то термин обозначает предпочтительно фторметил, дифторметил, трифторметил, 1-фторэтил, 1,1-дифторэтил, 2-фторэтил, 2,2-дифторэтил, и 2,2,2-трифторэтил и более предпочтительно трифторметил.
Термин "циклоалкил", используемый отдельно или в комбинации, относится к насыщенному карбоциклическому кольцу, содержащему три - шесть атомов углерода. Термин "(Сx-y)циклоалкил" (x и y каждый представляет собой целое число), относится к циклоалкильной группе, как определено в настоящей заявке ранее, содержащей x - y атомов углерода. Например, (С3-6)циклоалкильная группа содержит от трех до шести атомов углерода. Примерами (С3-6)циклоалкильных групп являются циклопропил, циклобутил, циклопентил, и циклогексил. В случае, если "R2" представляет собой "(С3-6)циклоалкил", то термин обозначает циклопропил, циклобутил, циклопентил и циклогексил и предпочтительно циклопропил.
Термин "циклоалкокси", используемый отдельно или в комбинации, относится к циклоалкил-О- группе, где циклоалкильная группа имеет значения, как определено в настоящей заявке ранее. Термин "(Сx-y)циклоалкокси" (x и y каждый представляет собой целое число) относится к циклоалкокси группе, как определено в настоящей заявке ранее, содержащей x - y атомов углерода. Например, (С3-6)циклоалкокси группа обозначает группу формулы (С3-6)циклоалкил-O-, в которой термин "(С3-6)циклоалкил" имеет указанное ранее значение. Примерами (С3-6)циклоалкокси групп являются циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси. В случае, если R2 представляет собой "(С3-6)циклоалкокси", то термин обозначает циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси и предпочтительно циклобутилокси.
2) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой (С1-4)алкил, (С1-2)алкокси-(С1-2)алкил или гидрокси-(С1-4)алкил; и
R2 представляет собой (С3-6)циклоалкил, (С1-4)алкокси или (С1-2)фторалкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
3) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой (С1-4)алкил; и
R2 представляет собой (С3-6)циклоалкил, (С1-4)алкокси или (С1-2)фторалкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
4) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой метил, этил, н-пропил, изо-пропил, трет.-бутил, метокси-метил, гидрокси-метил, 1-гидрокси-этил, 2-гидрокси-проп-2-ил или -C(O)NH2; и
R2 представляет собой циклопропил, этокси, циклобутилокси или трифторметил; и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
5) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой этил, н-пропил, изо-пропил, трет.-бутил, метокси-метил или 1-гидрокси-этил; и
R2 представляет собой циклопропил, этокси или трифторметил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
6) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой этил, н-пропил, изо-пропил или трет.-бутил; и
R2 представляет собой циклопропил, этокси или трифторметил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
7) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой (С1-4)алкил или (С1-2)алкокси-(С1-2)алкил; и
R2 представляет собой (С3-6)циклоалкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
8) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой этил, изо-пропил или трет.-бутил; и
R2 представляет собой циклопропил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
9) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой (С1-4)алкил или (С1-2)алкокси-(С1-2)алкил; и
R2 представляет собой (С1-4)алкокси;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
10) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой этил, изо-пропил или трет.-бутил; и
R2 представляет собой этокси;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
11) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой (С1-4)алкил, (С1-2)алкокси-(С1-2)алкил, гидрокси-(С1-4)алкил или -C(O)NH2; и
R2 представляет собой (С1-2)фторалкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
12) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой метил, этил, н-пропил, изо-пропил, трет.-бутил, метокси-метил, гидрокси-метил, 1-гидрокси-этил, 2-гидрокси-проп-2-ил или -C(O)NH2; и
R2 представляет собой трифторметил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
13) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с вариантом осуществления 1), где
R1 представляет собой этил, н-пропил, изо-пропил, трет.-бутил, метокси-метил или 1-гидрокси-этил; и
R2 представляет собой трифторметил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
14) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с любым из вариантов осуществления 1), 2), 7), 9) или 11), где
R1 представляет собой (С1-4)алкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
15) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с любым из вариантов осуществления 1) - 5), 7), 9) или 11) - 13), где
R1 представляет собой этил, н-пропил, изо-пропил или трет.-бутил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
16) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с любым из вариантов осуществления 1), 2), 7), 9) или 11), где
R1 представляет собой (С1-2)алкокси-(С1-2)алкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
17) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с любым из вариантов осуществления 1), 2) или 11), где
R1 представляет собой гидрокси-(С1-4)алкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
18) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с любым из вариантов осуществления 1), 2), 3) или 14) - 17), где
R2 представляет собой (С3-6)циклоалкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
19) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с любым из вариантов осуществления 1), 2), 3) или 14) - 17), где
R2 представляет собой (С1-4)алкокси;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
20) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с любым из вариантов осуществления 1) или 14) - 17), где
R2 представляет собой (С3-6)циклоалкокси;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
21) Дальнейший вариант осуществления изобретения относится к соединениям формулы (I) в соответствии с любым из вариантов осуществления 1), 2), 3) или 14) - 17), где
R2 представляет собой (С1-2)фторалкил;
и к солям (в особенности фармацевтически приемлемым солям) таких соединений.
22) Примеры соединений формулы (I), как определено в варианте осуществления 1), выбирают из группы, включающей:
1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон;
1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-этил-[1,2,4]триазол-1-ил)-этанон;
2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-4-[4-(2-этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-этанон;
1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метоксиметил-[1,2,4]триазол-1-ил)-этанон;
Амид 1-(2-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-2-оксо-этил)-1Н-[1,2,4]триазол-3-карбоновой кислоты;
2-(3-Этил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-(3-Изопропил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-(3-Метоксиметил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-(3-Гидроксиметил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
1-{(R)-2-Метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-2-(3-пропил-[1,2,4]триазол-1-ил)-этанон;
2-[3-(1-Гидрокси-этил)-[1,2,4]триазол-1-ил]-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-[3-(1-Гидрокси-1-метил-этил)-[1,2,4]триазол-1-ил]-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
1-{(R)-4-[4-(2-Циклобутокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон;
1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-этил-[1,2,4]триазол-1-ил)-этанон;
1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон;
2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-4-[4-(2-циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-этанон;
1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метоксиметил-[1,2,4]триазол-1-ил)-этанон;
1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метил-[1,2,4]триазол-1-ил)-этанон;
2-(3-Метил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон; и
1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метил-[1,2,4]триазол-1-ил)-этанон;
или соли (в особенности фармацевтически приемлемые соли) таких соединений. 23) Таким образом, изобретение относится к соединениям формулы (I), как определено в варианте осуществления 1), и к таким соединениям, дополнительно ограниченным характеристиками в соответствии с любым из вариантов осуществления 2) - 22), все при рассмотрении их соответствующих зависимостей; к их фармацевтически приемлемым солям; и к применению таких соединений в качестве лекарственных средств, в особенности для лечения нарушений, связанных с дисфункцией CXCR3 рецептора или дисфункцией передачи сигналов лигандами посредством CXCR3, таких как, в особенности, аутоиммунные нарушения, воспалительные заболевания, инфекционные заболевания, отторжение трансплантата, фиброз, нейродегенеративные нарушения и злокачественное новообразование. В особенности следующие варианты осуществления относятся к соединениям формулы (I), следовательно, возможны и предназначены и таким образом специфически раскрываются в индивидуализированной форме:
1, 2+1, 3+1, 4+1, 5+1, 6+1, 7+1, 8+1, 9+1, 10+1, 11+1, 12+1, 13+1, 14+1, 14+2+1, 14+7+1, 14+9+1, 14+11+1, 15+1, 15+2+1, 15+3+1, 15+4+1, 15+5+1, 15+7+1, 15+9+1, 15+11+1, 15+12+1, 15+13+1, 16+1, 16+2+1, 16+7+1, 16+9+1, 16+11+1, 17+1, 17+2+1, 17+11+1, 18+1, 18+2+1, 18+3+1, 18+14+1, 18+14+2+1, 18+14+7+1, 18+14+9+1, 18+14+11+1, 18+15+1, 18+15+2+1, 18+15+3+1, 18+15+4+1, 18+15+5+1, 18+15+7+1, 18+15+9+1, 18+15+11+1, 18+15+12+1, 18+15+13+1, 18+16+1, 18+16+2+1, 18+16+7+1, 18+16+9+1, 18+16+11+1, 18+17+1, 18+17+2+1, 18+17+11+1, 19+1, 19+2+1, 19+3+1, 19+14+1, 19+14+2+1, 19+14+7+1, 19+14+9+1, 19+14+11+1, 19+15+1, 19+15+2+1, 19+15+3+1, 19+15+4+1, 19+15+5+1, 19+15+7+1, 19+15+9+1, 19+15+11+1, 19+15+12+1, 19+15+13+1, 19+16+1, 19+16+2+1, 19+16+7+1, 19+16+9+1, 19+16+11+1, 19+17+1, 19+17+2+1, 19+17+11+1, 20+1, 20+14+1, 20+14+2+1, 20+14+7+1, 20+14+9+1, 20+14+11+1, 20+15+1, 20+15+2+1, 20+15+3+1, 20+15+4+1, 20+15+5+1, 20+15+7+1, 20+15+9+1, 20+15+11+1, 20+15+12+1, 20+15+13+1, 20+16+1, 20+16+2+1, 20+16+7+1, 20+16+9+1, 20+16+11+1, 20+17+1, 20+17+2+1, 20+17+11+1, 21+1, 21+2+1, 21+3+1, 21+14+1, 21+14+2+1, 21+14+7+1, 21+14+9+1, 21+14+11+1, 21+15+1, 21+15+2+1, 21+15+3+1, 21+15+4+1, 21+15+5+1, 21+15+7+1, 21+15+9+1, 21+15+11+1, 21+15+12+1, 21+15+13+1, 21+16+1, 21+16+2+1, 21+16+7+1, 21+16+9+1, 21+16+11+1, 21+17+1, 21+17+2+1, 21+17+11+1, 22+1, и 23+1;
В перечне выше цифры относятся к вариантам осуществления в соответствии с их нумерацией, представленной выше, в то время как "+" указывает на зависимость от другого варианта осуществления. Различные индивидуализированные варианты осуществления разделены запятыми. Другими словами, "14+2+1" например, относится к варианту осуществления 14), зависимому от варианта осуществления 2), зависимому от варианта осуществления 1), то есть вариант осуществления "14+2+1" соответствует соединениям из варианта осуществления 1), дополнительно ограниченным характерными особенностями вариантов осуществления 2) и 14).
Если используется форма множественного числа для соединений, солей, фармацевтических композиций, заболеваний или т.д., то подразумевается, что она также охватывает единственное соединение, соль, фармацевтическую композицию, заболевание или т.д.
Любая ссылка на соединение формулы (I), как определено в любом из вариантов осуществления 1) - 23), подразумевается как относящаяся также к солям (и в особенности фармацевтически приемлемым солям) таких соединений, если это является подходящим и целесообразным.
Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют желательную биологическую активность данного соединения и проявляют минимальные токсические эффекты. Такие соли включают соли присоединения неорганической или органической кислоты и/или основания, в зависимости от присутствия щелочных и/или кислотных групп в данном соединении. Для ссылки см., например, 'Handbook of Pharmaceutical Salts. Properties, Selection and Use.', P. Heinrich Stahl, Camille G. Wermuth (Eds.), Wiley-VCH, 2008 и 'Pharmaceutical Salts and Co-crystals', Johan Wouters and Luc 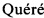 (Eds.), RSC Publishing, 2012.
(Eds.), RSC Publishing, 2012.
Настоящее изобретение также включает изотопно меченные, в особенности 2Н (дейтерий) меченные соединения формулы (I), эти соединения идентичны соединениям формулы (I), за исключением того, что один или несколько атомов заменены атомом, имеющим такое же атомное число, но атомную массу, отличающуюся от атомной массы, обычно обнаруживаемой в природе. Изотопно меченные, в особенности 2Н (дейтерий) меченные соединения формулы (I) и их соли охватываются объемом настоящего изобретения. Замещение водорода более тяжелыми изотопами 2Н (дейтерий) может приводить к большей метаболической стабильности, что приводит, например, к повышенному периоду полураспада in-vivo или уменьшенным схемам дозирования, или может приводить к уменьшенному ингибированию ферментов цитохром Р450, что приводит, например, к улучшенному профилю безопасности. В одном варианте осуществления изобретения, соединения формулы (I) не являются изотопно меченными, или они мечены только одним или несколькими атомами дейтерия. В подварианте осуществления, соединения формулы (I) не являются полностью изотопно меченными. Изотопно меченные соединения формулы (I) могут быть приготовлены аналогично методам, описанным в настоящей заявке ранее, но используя подходящие изотопные вариации пригодных реагентов или исходных веществ.
Всякий раз, когда слово "в диапазоне" используется для описания числового интервала, подразумевается, что конечные точки указанного диапазона явно включены в диапазоне. Например: если температурный интервал описан в диапазоне между 40°С и 80°С, то это означает, что конечные точки 40°С и 80°С включены в интервал; или если переменная определяется как целое число в диапазоне 1 и 4, то это обозначает, что переменная представляет собой целое число 1, 2, 3, или 4.
Если не используется относительно температур, термин "приблизительно" (или альтернативно "около"), указанный перед числовым значением "X" относится в настоящей заявке к интервалу, распространяющемуся от X минус 10% от X до X плюс 10% от X, и предпочтительно к интервалу, распространяющемуся от X минус 5% от X до X плюс 5% от X. В конкретных случаях температур, термин "приблизительно" (или альтернативно "около"), указанный перед температурой "Y", относится в настоящей заявке к интервалу, распространяющемуся от температуры Y минус 10°С до Y плюс 10°С, и предпочтительно к интервалу, распространяющемуся от Y минус 5°С до Y плюс 5°С. Кроме того, термин "комнатная температура", как используется в настоящей заявке, относится к температуре около 25°С.
Соединения формулы (I), как определено в любом из вариантов осуществления 1) - 23), и их фармацевтически приемлемые соли могут использоваться в качестве лекарственных средств, например, в форме фармацевтических композиций для энтерального (такого как, в особенности перорального) или парентерального (включая местное введение или ингаляцию) введения.
Получение фармацевтических композиций можно осуществить способом, который известен любому специалисту в данной области техники (см., например, Remington, The Science and Practice of Pharmacy, 21-ое изд. (2005), часть 5, "Pharmaceutical Manufacturing" [опубликованное Lippincott Williams & Wilkins]) путем превращения описанных соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически ценными веществами, в галенно вводимую форму совместно с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и, если это является желательным, пригодными фармацевтическими адъювантами.
Настоящее изобретение также относится к способу предотвращения или лечения заболевания или нарушения, указанного в настоящей заявке, включающего введение субъекту фармацевтически активного количества соединения формулы (I), как определено в любом из вариантов осуществления 1) - 23).
В предпочтительном варианте осуществления изобретения, вводимое количество находится в диапазоне от 1 мг до 1000 мг в сутки, предпочтительно в диапазоне от 5 мг до 500 мг в сутки, более предпочтительно в диапазоне от 25 мг до 400 мг в сутки, в особенности в диапазоне от 50 мг до 200 мг в сутки.
Для избежания какой-либо неопределенности, если соединения описываются как пригодные для предотвращения или лечения определенных заболеваний, то такие соединения также пригодны для применения для приготовления лекарственного средства для предотвращения или лечения указанных заболеваний.
Другой аспект изобретения охватывает способ предотвращения или лечения заболевания или нарушения, как указано ниже, у пациента, включающего введение указанному пациенту фармацевтически активного количества соединения формулы (I), как определено в любом из вариантов осуществления 1) - 23), или его фармацевтически приемлемой соли.
Соединения в соответствии с формулой (I), как определено в любом из вариантов осуществления 1) - 23), или их фармацевтически приемлемые соли, пригодны для предотвращения или лечения нарушений, связанных с дисфункцией CXCR3 рецептора или дисфункций лигандов передачи сигналов посредством CXCR3.
Такие нарушения, относящиеся к дисфункции CXCR3 рецептора или его лигандов, представляют собой заболевания или нарушения, где требуется модуляция CXCR3 рецептора человека. Вышеуказанные нарушения, в частности, могут быть определены как включающие аутоиммунные нарушения, воспалительные заболевания, инфекционные заболевания, отторжение трансплантата, фиброз, нейродегенеративные нарушения и злокачественное новообразование.
Аутоиммунные нарушения могут быть определены как включающие ревматоидный артрит (RA); рассеянный склероз (МС); воспалительное заболевание кишечника (IBD; включающее болезнь Крона и неспецифический язвенный колит); системную красную волчанку (SLE); псориаз; псориатический артрит; волчаночный нефрит; интерстициальный цистит; глютеновую болезнь; антифосфолипидный синдром; тиреоидит, такой как тиреоидит Хашимото; лимфоцитарный тиреоидит; миастению гравис; диабет I типа; увеит; эписклерит; склерит; болезнь Кавасаки, увео-ретинит; задний увеит; увеит, связанный с болезнью Бехчета; увеоменингитный синдром; аллергический энцефаломиелит; атопические заболевания, такие как ринит, конъюнктивит, дерматит; и постинфекционные аутоиммунные заболевания, включая ревматическую атаку и пост-инфекционные гломерулонефрит.
Воспалительные заболевания могут быть определены как включающие астму; ХОЗЛ; атеросклероз; миокардит; синдром сухого глаза (включая синдром Шегрена сухого глаза); миопатии (включая воспалительные миопатии); саркоидоз; гипертонию легочной артерии, в особенности связанную с саркоидозом; и ожирение.
Инфекционные заболевания могут быть определены как включающие заболевания, опосредованные различными инфекционными агентами, и осложнения, развивающиеся вследствие их, такие как малярия, церебральная малярия, проказа, туберкулез, грипп, токсоплазма, денге, гепатит В и С, простой герпес, лейшмания, хламидия трахоматис, болезнь Лайма, вирус Западного Нила.
Отторжение трансплантата может быть определено как включающее отторжение трансплантированных органов, такие как почки, печень, сердце, легкие, поджелудочная железа, роговица, и кожа; реакция «трансплантат против хозяина»; и хроническая аллотрансплантатная васкулопатия.
Фиброз могут быть определены как включающие цирроз печени (включая билиарный первичный цирроз печени (РВС) и аутоиммунный гепатит), идиопатический легочный фиброз, почечный фиброз, эндомиокардиальный фиброз, системный склероз, и артрофиброз
Нейродегенеративные нарушения могут быть определены как включающие нейродегенерацию и состояния, вовлекающие гибель нейронов, такие как рассеянный склероз (включая возвратно ремитирующий рассеянный склероз и прогрессирующий рассеянный склероз), болезнь Альцгеймера, болезнь Паркинсона, хорея Гентингтона, деменция, связанная с ВИЧ, опосредованная прионами нейродегенерация, эпилепсия, удар, церебральная ишемия, центральный паралич, нейромиелит зрительного нерва, клинически выделенный синдром, болезнь Альперса, боковой амиотрофический склероз (ALS), старческое слабоумие, деменция с тельцами Леви, синдром Rett, травма спинного мозга, травматические повреждение головного мозга, невралгия тройничного нерва, хроническая воспалительная димелинизирующая полиневропатия, болезнь Гийена-Барре, нарколепсия, глоссофарингеальная невралгия, легкое снижение познавательных способностей, снижение познавательных способностей, атрофия спинных мышц, и церебральная малярия. Злокачественное новообразование может быть определено как включающие все виды злокачественных новообразований, такие как рак толстого кишечника, рак прямой кишки, рак молочной железы, рак легкого, немелкоклеточный рак легкого, рак предстательной железы, рак пищевода, рак желудка, рак печени, рак желчных проток, рак селезенки, рак почки, рак мочевого пузыря, рак матки, рак яичников, рак шейки матки, рак яичка, рак щитовидной железы, рак поджелудочной железы, рак головного мозга, кровяная опухоль, базофильная аденома, пролактинома, гиперпролактинемия, аденомы, рак эндометрия, рак ободочной кишки; хронический лимфолейкоз (CLL); и в особенности метастатическое распространение этих злокачественных новообразований.
В особенности, соединения формулы (I) в соответствии с любым из вариантов осуществления 1) - 23), или их фармацевтически приемлемые соли, пригодны для предотвращения или лечения заболеваний, выбранных из одного, нескольких или всех из случающих групп заболеваний и нарушений:
1) Аутоиммунные нарушения, выбранные из ревматоидного артрита (RA); рассеянного склероза (МС); воспалительного заболевания кишечника (IBD; включая болезнь Крона и язвенный колит); системной красной волчанки (SLE); псориаза; волчаночного нефрита; и диабета I типа;
2) Воспалительные заболевания, выбранные из ХОЗЛ; синдрома сухого глаза (включая синдром Шегрена сухого глаза); миопатий (включая воспалительные миопатии); и саркоидоза;
3) Отторжение трансплантата, выбранные из реакций «трансплантат против хозяина»;
4) Фиброз, выбранный из цирроза печени (включая билиарный первичный цирроз печени (РВС) и аутоиммунный гепатит); и
5) Нейродегенеративные нарушения, выбранные из синдрома Гийена-Барре.
Приготовление соединений формулы (I)
Дальнейший аспект изобретения представляет собой способ получения соединений формулы (I). Соединения в соответствии с формулой (I) согласно настоящему изобретению могут быть приготовлены из коммерчески доступных или хорошо известных исходных веществ в соответствии с методами, описанными в экспериментальной части, с помощью аналогичных методов; или в соответствии с общей последовательностью реакций, представленной ниже, где R1 и R2 имеют значения, указанные для формулы (I). Другие сокращения, используемые в настоящей заявке, явно определены, или имеют значения, как определено в экспериментальном разделе. В некоторых случаях основные группы R1 и R2 могут быть несовместными со сборкой, проиллюстрированной на схемах ниже, и потому для них необходимо использовать защитные группы (PG). Использование защитных групп хорошо известно в данной области техники (см., например, "Protective Groups in Organic Synthesis", T.W. Greene, P.G.M. Wuts, Wiley-Interscience, 1999). Для целей настоящего обсуждения, предполагается, что такие защитные группы, если необходимо, находятся на месте. Полученные соединения также могут быть превращены в соли, в особенности их фармацевтически приемлемые соли с помощью способа, известного per se.
Общие пути получения:
Соединения формулы (I) могут быть получены, используя в качестве исходного вещества промежуточное соединение (1), которое омыляют в стандартных условиях (например, водн. NaOH в МеОН), получая соединения структуры (2) (Схема 1). Группу карбоновой кислоты в соединении структуры (2) превращают в соответствующий бром (3), используя (диацетоксийод)бензол и LiBr в ТГФ при КТ. Сочетание Сузуки можно использовать, используя партнер для сочетания структуры (4), где R представляет собой водород или (С1-4)алкил, используя стандартные условия для реакции Сузуки, также используя подходящее основание, такое как водн. Na2CO3, подходящий палладиевый катализатор, такой Pd(PPh3)2Cl2, и подходящий растворитель, такой как MeCN, предпочтительно нагревание при температуре около 80°С. Впоследствии Вое защитную группу полученного промежуточного соединения (5) можно отщепить в кислых условиях, предпочтительно используя HCl в подходящем растворителе, таком как диоксан, и при температуре около КТ, получая соединение структуры (6). Соединения формулы (I) могут быть получены на конечной стадии путем амидного сочетания, используя производное карбоновой кислоты (7), используя стандартные методы пептидного сочетания, такие как HATU, в присутствии подходящего основания, такого как DIPEA или NEt3 и в подходящем растворителе, таком как ДХМ или ДМФА, предпочтительно при температуре около КТ.
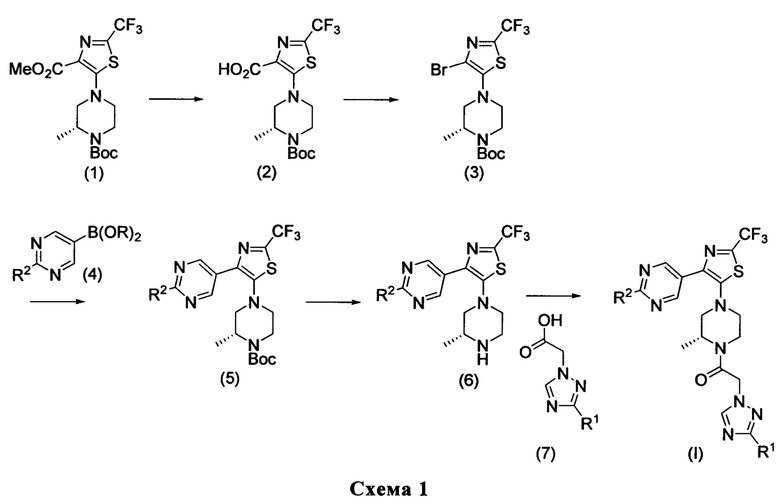
Соединения структуры (1) можно синтезировать с помощью последовательности реакции, представленной на Схеме 2. Коммерчески доступную 2-(трифторметил)тиазол-4-карбоновую кислоту обрабатывали с н-бутил литием и бромом в ТГФ при температуре приблизительно -78°С. Полученное бромированное соединение можно эстерифицировать, используя концентрированную серную кислоту в МеОН, и нагревать при температуре приблизительно 70°С. Нуклеофильное ароматическое замещение, используя коммерчески доступное производное пиперазина (8), в присутствии подходящего основания, такого как DIPEA, в подходящем растворителе, таком как MeCN, и при температуре приблизительно 80°С обеспечивает соединения структуры (1).
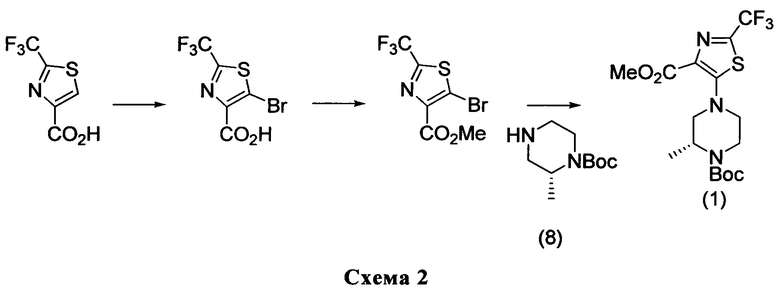
Соединения формулы (7) либо являются коммерчески доступными, или могут быть синтезированы согласно следующему пути, представленном на Схеме 3.
Триазольные структуры (9) могут быть алкилированы, используя производное уксусной кислоты формулы X-CH2-COO(PG), где X представляет собой уходящую группу, такую как бром, и PG представляет собой защитную группу, подходящую для кислотной функциональной группы (например, бензил), в присутствии основания, такого как Cs2CO3, в подходящем растворителе, таком как MeCN, и при температуре около КТ.
Снятие защиты с промежуточного соединения (10), такое как снятие бензильной защиты в атмосфере Н2, используя Pd/C в качестве катализатора и EtOH в качестве растворителя при температуре около КТ, приводит к получению соединения структуры (7). Другие подходящие защитные группы для кислотной функциональной группы и способы защиты и снятия защиты хорошо известны квалифицированному специалисту в данной области техники (см., в особенности, "Protective groups in organic synthesis", Greene T.W. и Wuts P.G.M., Wiley-Interscience, 1999).
Соединения структуры (4) либо являются коммерчески доступными или могут быть приготовлены аналогично методам, известным квалифицированным специалистам в данной области техники, такие как реакция соответствующего производного 5-бром-пиримидина с триизопропил боратом и n-BuLi в ТГФ и толуолом при температуре приблизительно -78°С.
Соединения формулы (I) могут быть получены из других соединений формулы (I) или их аналогов путем взаимопревращения заместителя в R1-положении в другой заместитель R1. Например, аналог формулы (I), где R1 представляет собой бром, может быть превращен в соединение формулы (I), где R1 представляет собой (С2-4)алкил, с помощью (i) реакции Сузуки, используя соответствующее производное сложного эфира (С2-4)алкенилбороновой кислоты (например, пинаколовый сложный эфир изопропенилбороновой кислоты) в присутствии палладиевого катализатора, такого как Pd(PPh3)2Cl2 и (ii) гидрирования, используя, например, водород в присутствии Pd/C в растворителе, таком как МеОН. Соединение формулы (I), где R1 представляет собой -C(O)NH2, может быть приготовлено путем гидролиза соответствующего нитрила, используя конц. H2SO4 в растворителе, таком как ДХМ. Дополнительно, соединение формулы (I), где R1 представляет собой гидрокси-(С1-4)алкил, может быть получено из соответствующего соединения, где R1 представляет собой метокси-(С1-4)алкил, путем диметилирования, используя BBr3 в растворителе, таком как ДХМ, или из соответствующего кетона, где R1 представляет собой -С(O)-(С1-3)алкил, путем восстановления с NaBH4.
Всякий раз, когда соединения формулы (I) получают в форме смесей энантиомеров, энантиомеры могут быть разделены, используя методы, известные специалисту в данной области техники: например, путем образования и разделения диастереомерных солей или путем ВЭЖХ через хиральную неподвижную фазу, такую как Daicel ChiralPak IC (5 мкм) колонка. Типичными условиями хиральной ВЭЖХ являются изократическая смесь элюента A (EtOH или iPrOH, в присутствии или отсутствии амина, такого как NEt3 или DEA) и элюента В (гексан или MeCN), при скорости потока от 0,8 до 16 мл/мин.
Экспериментальный раздел:
Сокращения (как используется в настоящей заявке и в описании выше):
водн. водный
Boc трет.-бутилоксикарбонил
BSA бычий сывороточный альбумин
Bu бутил
КХ колоночная хроматография на силикагеле
СНО яичники китайского хомячка
CV объем колонки
ДХМ дихлорметан
DEA диэтиламин
DIPEA N-этилдиизопропиламин
ДМФА диметилформамид
ДМСО диметилсульфоксид
ЕА этил ацетат
EDTA этилендиаминтетрауксусная кислота
EGTA этиленгликоль тетрауксусная кислота
Et этил
FBS фетальная телячья сыворотка
FLIPR флуоресцентный визуализирующий планшет-ридер
Fluo-4-AM 2-{[2-(2-{5-[бис(карбоксиметил)амино]-2-метилфенокси}этокси)-4-(2,7-дифтор-6-гидрокси-3-оксо-3H-ксантен-9-ил)фенил](карбоксиметил)амино}уксусная кислота
G418 (2R,3S,4R,5R,6S)-5-амино-6-[(1R,2S,3S,4R,6S)-4,6-диамино-3-[(2R,3R,4R,5R)-3,5-дигидрокси-5-метил-4-метиламинооксан-2-ил]окси-2-гидроксициклогексил]окси-2-(1-гидроксиэтил)оксан-3,4-диол
ч час (ы)
HATU 2-(7-Аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний
Hep гептаны
HEPES 4-(2-гидроксиэтил)-пиперазин-1-этансульфоновая кислота
ВВ Высокий вакуум
ВЭЖХ высокоэффективная жидкостная хроматография
iPr изо-пропил
ЖХ жидкостная хроматография
m мультиплет
М молярность [моль л-1]
Me метил
МС масс-спектроскопия
мин минута (ы)
ЯМР ядерная магнитно-резонансная спектроскопия
орг. органический
PBS фосфатно-солевой буферный раствор
Pd/C палладий на угле
PG защитная группа
Ph фенил
Преп препаративный
об./мин обороты в минуту
КТ комнатная температура
s синглет
нас. насыщенный
TFA трифторуксусная кислота
ТГФ тетрагидрофуран
ТСХ Тонкослойная хроматография
tR время удерживания
СЭЖХ Сверхвысокоэффективная жидкостная хроматография
I. Химия
Следующие примеры иллюстрируют приготовление биологически активных соединений в соответствии с изобретением, но не ограничивают его объем.
Общие положения: Все температуры указаны в градусах Цельсия (°С). Если специально не указано иначе, то реакции осуществляли при КТ в атмосфере азота и проводили в высушенной пламенем круглодонной колбе, оборудованной магнитной мешалкой.
Характеристика используемых методов:
ЖХ-МС время удерживаний получали, используя следующие условия элюирования:
I) ЖХ-МС (А):
Zorbax SB-Aq, 3,5 мкм, 4,6×50 мм колонка, термостатированная при 40°С. Два элюирующих растворителя были следующими: растворитель А = вода + 0,04% TFA; растворитель В=MeCN. Скорость потока элюента составляла 4,5 мл/мин и характеристики пропорции элюирующей смеси в зависимости от времени t от начала элюирования обобщены в таблице ниже (линейный градиент использовали между двумя последовательными временными точками):

II) ЖХ-МС (В):
Использовали Acquity UPLC CSH С18 1,7 мкм 2,1×50 мм ID колонку от Waters, термостатированную в Acquity UPLC Column Manager (60°C). Два элюирующих растворителя были следующими: растворитель А = вода + 0,05% муравьиная кислота; растворитель В = MeCN + 0,045% муравьиная кислота. Скорость потока элюента составляла 1 мл/мин и характеристики пропорции элюирующей смеси в зависимости от времени t от начала элюирования обобщены в таблице ниже (линейный градиент использовали между двумя последовательными временными точками):

Чистоту и идентичность соединения дополнительно подтверждали с помощью ЯМР спектроскопии (Bruker Avance II 400 МГц UltrashieldTM или Bruker AscendTM 500, оборудованный криозондом 5 мм DCH), 1Н (400 МГц или 500 МГц), 19F (376 МГц). Химические сдвиги записывали в виде част. на млн (част. на млн) относительно тетраметилсилана (ТМС) или трихлорфторметана, и мультиплетности представлены в виде s (синглета) или m (мультиплета).
Очистки с помощью препаративной ЖХ-МС осуществляли, используя условия, описанные в настоящей заявке далее.
I) Препаративная ЖХ-МС (I):
Использовали X-Bridge колонку (Waters С18, 10 мкм OBD, 30×75 мм). Два элюирующих растворителя были следующими: растворитель А = вода + 0,5% NH4OH (25%); растворитель В = MeCN. Скорость потока элюента составляла 75 мл/мин и характеристики пропорции элюирующей смеси в зависимости от времени t от начала элюирования обобщены в таблицах ниже (линейный градиент использовали между двумя последовательными временными точками):

II) Препаративная ЖХ-МС (II):
Использовали X-Bridge колонку (Waters С18, 10 мкм OBD, 30×75 мм). Два элюирующих растворителя были следующими: растворитель А = вода + 0,5% NH4OH (25%); растворитель В = MeCN. Скорость потока элюента составляла 75 мл/мин и характеристики пропорции элюирующей смеси в зависимости от времени t от начала элюирования обобщены в таблицах ниже (линейный градиент использовали между двумя последовательными временными точками):

III) Препаративная ЖХ-МС (III):
Использовали X-Bridge колонку (Waters С18, 10 мкм OBD, 30×75 мм). Два элюирующих растворителя были следующими: растворитель А = вода + 0,5% муравьиная кислота; растворитель В = MeCN. Скорость потока элюента составляла 75 мл/мин и характеристики пропорции элюирующей смеси в зависимости от времени t от начала элюирования обобщены в таблицах ниже (линейный градиент использовали между двумя последовательными временными точками):

IV) Препаративная ЖХ-МС (IV):
Использовали колонку Atlantis (Waters Т3, 10 мкм OBD, 30×75 мм). Два элюирующих растворителя были следующими: растворитель А = вода + 0,5% муравьиная кислота; растворитель В = MeCN. Скорость потока элюента составляла 75 мл/мин и характеристики пропорции элюирующей смеси в зависимости от времени t от начала элюирования обобщены в таблицах ниже (линейный градиент использовали между двумя последовательными временными точками):

V) Препаративная ЖХ-МС (V):
Использовали X-Bridge колонку (Waters С18, 10 мкм OBD, 30×75 мм). Два элюирующих растворителя были следующими: растворитель А = вода + 0,5% NH4OH (25%); растворитель В = MeCN. Скорость потока элюента составляла 75 мл/мин и характеристики пропорции элюирующей смеси в зависимости от времени t от начала элюирования обобщены в таблицах ниже (линейный градиент использовали между двумя последовательными временными точками):

Используемые методы препаративной хиральной ВЭЖХ:
Очистки с помощью препаративной хиральной ВЭЖХ осуществляли, используя условия, описанные в настоящей заявке далее.
I) Препаративная хиральная ВЭЖХ (I):
Использовали ChiralPak IB колоку (5 мкм, 30×250 мм). Элюирующим растворителем был Hep/EtOH 60/40, прогон в течение 9 мин и при скорости потока 40 мл/мин.
II) Препаративная хиральная ВЭЖХ (II):
Использовали (R,R) Whelk-01 колонку (10 мкм, 50×250 мм). Элюирующим растворителем был Hep/EtOH 70/30, прогон в течение 16,3 мин и при скорости потока 100 мл/мин.
III) Препаративная хиральная ВЭЖХ (III):
Использовали ChiralPak IB колонку (5 мкм, 30×250 мм). Элюирующим растворителем был Hep/EtOH 50/50, прогон в течение 8 мин и при скорости потока 34 мл/мин.
IV) Препаративная хиральная ВЭЖХ (IV):
Использовали ChiralPak IB колонку (5 мкм, 20×250 мм). Элюирующим растворителем был Hep/EtOH 50/50, 0,1% DEA, прогон в течение 18,7 мин и при скорости потока 16 мл/мин.
V) Препаративная хиральная ВЭЖХ (V):
Использовали ChiralPak IB колонку (5 мкм, 30×250 мм). Элюирующим растворителем был Hep/EtOH 70/30, прогон в течение 11,8 мин и при скорости потока 34 мл/мин.
VI) Препаративная хиральная ВЭЖХ (VI):
Использовали ChiralPak OZ-H колонку (5 мкм, 20×250 мм). Элюирующим растворителем был Нер/ЕtOН 50/50, 0,1% DEA, прогон в течение 11 мин и при скорости потока 19 мл/мин.
Пример 1: 1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон
1.1. 5-Бром-2-трифторметил-тиазол-4-карбоновая кислота
К раствору 2-(трифторметил)тиазол-4-карбоновой кислоты (3,2 г) в безводном ТГФ (60 мл) в атмосфере аргона, охлажденному до -78°С, добавляли н-BuLi (1,6М в гексане, 21,3 мл) по каплям в течение 15 мин таком образом, что внутренняя температура не повышалась выше -60°С. После этого добавляли по каплям раствор Br2 (0,92 мл) в циклогексане (8 мл) для поддержания внутренней температуры ниже -60°С. Полученную смесь перемешивали при -78°С в течение 2 ч и осторожно закаливали путем добавления воды (50 мл). Добавляли лимонную кислоту (10%) до достижения рН=2 и смесь экстрагировали с помощью ЕА. Органические слои промывали соляным раствором, высушивали (MgSO4), отфильтровывали и упаривали насухо, получая 4,15 г коричневого твердого вещества, используемого без дополнительной очистки. ЖХ-МС (A): tR=0,67 мин. F-ЯМР (CD3OD): -63,57 част. на млн (s).
1.2. метиловый эфир 5-бром-2-трифторметил-тиазол-4-карбоновой кислоты
К раствору промежуточного соединения 1.1 (12 г), МеОН (130 мл) добавляли H2SO4 (96%, 6,5 мл) и смесь перемешивали при 70°С в течение 3 ч. После охлаждения, реакционную смесь закаливали с помощью нас. водн. Na2CO3 и растворитель частично упаривали. Остаток разводили с помощью ДХМ и промывали с помощью нас. водн. Na2CO3 (1х), воды (1х) и солевого раствора (1х), и водные фазы экстрагировали с помощью ДХМ (2х). Объединенные органические слои высушивали над MgSO4, отфильтровывали, упаривали и высушивали под ВВ, получая 12 г коричневой смолы. ЖХ-МС (A): tR=0,83 мин. F-ЯМР (CD3OD): -63,59 част. на млн (s).
1.3. трет-бутиловый эфир (R)-4-(4-метоксикарбонил-2-трифторметил-тиазол-5-ил)-2-метил-пиперазин-1-карбоновой кислоты
К раствору промежуточного соединения 1.2 (10 г) в MeCN (250 мл) добавляли (R)-1-N-Вос-2-метилпиперазин (7,19 г) и DIPEA (8,85 мл) при КТ. Реакционную смесь перемешивали при 80°С в течение 43 ч. После охлаждения, реакционную смесь разводили с помощью ЕА и промывали водой и солевым раствором. Водн. слои экстрагировали с помощью ЕА. Объединенные органические слои высушивали над MgSO4, отфильтровывали и упаривали насухо. Неочищенное вещество очищали с помощью КХ (Biotage, SNAP 340g, растворитель A: Hep; растворитель В: ЕА; градиент в %В: 10 через 5CV, 10-30 через 5CV, 30 через 5CV), получая 9,14 г желтой смолы. ЖХ-МС (A): tR=0,97 мин; [М+Н]+: 410,0.
1.4. трет-бутиловый эфир (R)-4-(4-карбокси-2-трифторметил-тиазол-5-ил)-2-метил-пиперазин-1-карбоновой кислоты
К раствору промежуточного соединения 1.3 (4,25 г) в EtOH (40 мл) добавляли 1М NaOH (40 мл) при КТ и реакционную смесь перемешивали в течение 1 ч 20 мин. Растворитель упаривали и остаток подкисляли до рН 2 путем добавления водн. лимонной кислоты (10%). Водн. слой экстрагировали с помощью ДХМ (3х) и объединенные органические слои высушивали над Na2SO4 и концентрировали насухо, получая 4,1 г в виде оранжевого твердого вещества. ЖХ-МС (A): tR=0,88 мин; [М+Н]+: 395,9.
1.5. трет-бутиловый эфир (R)-4-(4-бром-2-трифторметил-тиазол-5-ил)-2-метил-пиперазин-1-карбоновой кислоты
К раствору промежуточного соединения 1.4 (10,17 г) в ТГФ (210 мл) добавляли LiBr (2,26 г) и (диацетоксийод)бензол (8,45 г) при КТ. Полученную суспензию перемешивали при КТ в течение 1 ч. 30 мин. Реакционную смесь разводили с помощью H2O и экстрагировали с помощью ДХМ (3х). Объединенные органические слои высушивали над MgSO4, отфильтровывали и упаривали насухо. Неочищенное вещество очищали с помощью КХ (Biotage, SNAP 340 г картридж, растворитель А: Hep; растворитель В: ЕА; градиент в %В: 5 для 5CV, 5-10 через 3CV), получая 9,63 г в виде желтого твердого вещества. ЖХ-МС (А): tR=1,04 мин; [М+Н]+: 429,2.
1.6. трет-бутиловый эфир (R)-4-[4-(2-этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-карбоновой кислоты
Смесь промежуточного соединения 1.5 (1,63 г), 2-этоксипиримидин-5-бороновой кислоты (778 мг), Pd(PPh3)2Cl2 (152 мг), 1М Na2CO3 (12 мл) в MeCN (12 мл) интенсивно перемешивали при 80°С в атмосфере аргона в течение ночи. Реакционной смеси предоставляли возможность охладиться до КТ, разводили с помощью H2O и экстрагировали с помощью ДХМ (3х). Объединенные органические слои высушивали над MgSO4, отфильтровывали и упаривали насухо. Неочищенное вещество очищали с помощью КХ (Biotage, SNAP 50 г картридж, растворитель А: Hep; растворитель В: ЕА; градиент в %В: 10 для 5CV, 10-30 через 5CV, 30 для 3CV), получая 1,35 г в виде светло-желтой смолы. ЖХ-МС (A): tR=1,04 мин; [М+Н]+: 473,9.
1.7. 2-Этокси-5-[5-((R)-3-метил-пиперазин-1-ил)-2-трифторметил-тиазол-4-ил]-пиримидин
К раствору промежуточного соединения 1.6 (1,32 г) в ДХМ (45 мл) добавляли TFA (4,28 мл) при КТ. Полученную смесь перемешивали при КТ в течение ночи. Реакционную смесь обрабатывали с помощью 1М NaOH до рН=14 и экстрагировали с помощью ДХМ (3х). Объединенные органические слои высушивали над MgSO4, отфильтровывали, упаривали и высушивали при ВВ, получая 1,01 г в виде бежевого твердого вещества. ЖХ-МС (A): tR=0,64 мин; [М+Н]+: 374,0.
1.8. (3-Бром-[1,2,4]триазол-1-ил)-ацетат, литиевая соль
К раствору этил (3-бром-1Н-1,2,4-триазол-1-ил)ацетата (200 мг) в ТГФ (0,75 мл) и ЕtOН (0,75 мл) добавляли H2O (0,5 мл) после этого добавляли 2М LiOH (0,47 мл). Реакционную смесь перемешивали при КТ в течение ночи, упаривали и остаток высушивали при ВВ, получая 201 мг в виде белого твердого вещества. ЖХ-МС (A): tR=0,29 мин; [М+Н]+: 205,9.
1.9. 2-(3-Бром-[1,2,4]триазол-1-ил)-1-{(R)-4-[4-(2-этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-этанон
Смесь промежуточного соединения 1.7 (120 мг), промежуточного соединения 1.8 (76 мг), HATU (159 мг), и DIPEA (82 мкл) в ДХМ (4 мл) и ДМФА (1 мл) перемешивали при КТ в течение ночи. ДХМ удаляли путем упаривания и неочищенное вещество очищали путем Преп ЖХ-МС (IV), получая 102 мг в виде белого твердого вещества. ЖХ-МС (A): tR=0,9 мин; [М+Н]+: 561,0.
1.10. 1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропенил-[1,2,4]триазол-1-ил)-этанон
Смесь промежуточного соединения 1.9 (40 мг), изопропенилбороновой кислоты пинаколового сложного эфира (15,1 мг), Pd(PPh3)2Cl2 (2,8 мг), 1М Na2CO3 (1 мл) в MeCN (1 мл) интенсивно перемешивали при 80°С в атмосфере аргона в течение 2 ч. Реакционной смеси предоставляли возможность охладиться до КТ и упаривали насухо. Неочищенное вещество очищали путем Преп ЖХ-МС (I). ЖХ-МС (A): tR=0,9 мин; [М+Н]+: 523,2.
1.11. 1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон
Колбу, содержащую промежуточное соединение 1.10 (г), Pd/C (1,5 мг) в МеОН (1 мл) выкачивали и снова заполняли аргоном (3х), после этого выкачивали и снова заполняли с помощью Н2 (3х) и реакционную смесь перемешивали при КТ в течение ночи. Реакционную смесь фильтровали через шприцевой фильтр и фильтрат упаривали насухо. Неочищенное вещество очищали путем Преп ЖХ-МС (IV), получая 7 мг в виде белого твердого вещества. ЖХ-МС (В): tR=1,11 мин; [М+Н]+: 525,2.
Пример 2: 1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-этил-[1,2,4]триазол-1-ил)-этанон
2.1. Бензиловый эфир (3-этил-[1,2,4]триазол-1-ил)-уксусной кислоты
К раствору 3-этил-1Н-1,2,4-триазола (2 г) в MeCN (125 мл) добавляли Cs2CO3 (6,37 г) после этого добавляли бензил бромацетат (3,23 мл). Реакционную смесь перемешивали при КТ в течение ночи и упаривали насухо. Остаток ресупендировали в ЕА и промывали водой. Водн. слои экстрагировали с помощью ЕА (2х) и объединенные органические слои высушивали над Na2SO4, отфильтровывали и упаривали насухо. Остаток очищали с помощью КХ (Biotage, SNAP 100 г картридж, растворитель А: ДХМ; растворитель В: ДХМ/МеОН 8:2; градиент в %В: 15 для 4CV, 15-100 над 4CV, 100 для 1CV), получая 3,89 г в качестве первый элюирующейся фракции (смесь двух региоизомеров триазола) и 309 мг в качестве второй элюирующейся фракции (бензиловый эфир (3-этил-[1,2,4]триазол-4-ил)-уксусной кислоты). Смесь региоизомеров очищали с помощью препаративной хиральной ВЭЖХ (I). Фракция, которая элюируется первой: бензиловый эфир (5-этил-[1,2,4]триазол-1-ил)-уксусной кислоты: 1,39 г желтого масла. ЖХ-МС (A): tR=0,72 мин; [М+Н]+: 246,2. Сигнал пространственной гомоядерной корреляции, наблюдаемый между CH2CH3 при 2,72 част. на млн и СН2СО2 при 4,93 част. на млн.
Фракция, которая элюируется второй: бензиловый эфир (3-этил-[1,2,4]триазол-1-ил)-уксусной кислоты: 2,08 г желтого масла. ЖХ-МС (A): tR=0,71 мин; [М+Н]+: 246,2. Сигнал пространственной гомоядерной корреляции, наблюдаемый между СН при 8,08 част. на млн (триазол) и СН2СО2 при 4,96 част, на млн.
2.2. (3-Этил-[1,2,4]триазол-1-ил)-уксусная кислота
Колбу, содержащую бензиловый эфир (3-этил-[1,2,4]триазол-1-ил)-уксусной кислоты сто стадии 2.1 (2,06 г), Pd/C (445 мг) в EtOH (20 мл) выкачивали и снова заполняли аргоном (3х), после этого выкачивали и снова заполняли с помощью H2 (3х) и реакционную смесь перемешивали при КТ в течение 9 ч. Реакционную смесь фильтровали через пробку целита и фильтрат упаривали насухо, получая 1,27 г в виде белого твердого вещества. ЖХ-МС (A): tR=0,25 мин; [М+Н]+: 156,2.
2.3. 1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-этил-[1,2,4]триазол-1-ил)-этанон
Смесь промежуточного соединения 1.7 (50 мг), промежуточного соединения 2.2 (21 мг), HATU (66 мг), и NEt3 (28 мкл) в ДХМ (1,5 мл) перемешивали при КТ в течение ночи. Реакционную смесь упаривали насухо и неочищенное вещество очищали путем Преп ЖХ-МС (I), получая 15 мг в виде белого твердого вещества. ЖХ-МС (В): tR=1,05 мин; [М+Н]+: 511,2.
Пример 3: 2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-4-[4-(2-этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-этанон
3.1. Бензиловый эфир (3-трет-бутил-[1,2,4]триазол-1-ил)-уксусной кислоты
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.1, 3-этил-1Н-1,2,4-триазол заменяли на 3-трет-бутил-1Н-1,2,4-триазол. Желательное соединение получали после КХ в качестве единичного региоизомера. ЖХ-МС (A): tR=0,73 мин; [М+Н]+: 274,1.
3.2. (3-трет-Бутил-[1,2,4]триазол-1-ил)-уксусная кислота
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.2, бензиловый эфир (3-этил-[1,2,4]триазол-1-ил)-уксусной кислоты заменяли на промежуточное соединение 3.1. ЖХ-МС (A): tR=0,36 мин; [М+Н]+: 184,3.
3.3. 2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-4-[4-(2-этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2 стадия 2.3, промежуточные соединения 2.2 заменяли на промежуточное соединение 3.2. Желательное соединение очищали с помощью Преп ЖХ-МС (IV). ЖХ-МС (A): tR=0,84 мин; [М+Н]+: 539,1.
Пример 4: 1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метоксиметил-[1,2,4]триазол-1-ил)-этанон
4.1. Бензиловый эфир (3-метоксиметил-[1,2,4]триазол-1-ил)-уксусной кислоты
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.1, 3-этил-1Н-1,2,4-триазол заменяли на 3-(метоксиметил)-1Н-1,2,4-триазол. Неочищенное вещество очищали с помощью двух КХ (1. Biotage, SNAP 10 г картридж, растворитель А: ДХМ; растворитель В: ДХМ/МеОН 8:2; градиент в %В: 5 для 7CV, 5-15 над 3CV, 15 для 3CV. 2. Biotage, SNAP 10 г картридж, растворитель А: ДХМ; растворитель В: ДХМ/МеОН 8:2; градиент в %В: 5 для 5CV, 5-10 через 3CV, 10 для 3CV, 10-15 для 3 CV), получая два региоизомера:
Фракция, которая элюируется первой: бензиловый эфир (5-метоксиметил-[1,2,4]триазол-1-ил)-уксусной кислоты: бесцветное масло. ЖХ-МС (A): tR=0,71 мин; [М+Н]+: 262,2.
Фракция, которая элюируется второй: бензиловый эфир (3-метоксиметил-[1,2,4]триазол-1-ил)-уксусной кислоты: бесцветное масло. ЖХ-МС (A): tR=0,67 мин; [М+Н]+: 262,1. Сигнал пространственной гомоядерной корреляции, наблюдаемый между СН (триазол) при 8,17 част. на млн и NCH2CO2 при 5,01 част. на млн.
4.2. (3-Метоксиметил-[1,2,4]триазол-1-ил)-уксусная кислота
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.2, бензиловый эфир (3-этил-[1,2,4]триазол-1-ил)-уксусной кислоты заменяли на бензиловый эфир (3-метоксиметил-[1,2,4]триазол-1-ил)-уксусной кислоты со стадии 4.1. ЖХ-МС (A): tR=0,24 мин; [М+Н]+: 172,0.
4.3. 1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метоксиметил-[1,2,4]триазол-1-ил)-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточного соединения 2.2 заменяли на промежуточное соединение 4.2. Желательное соединение очищали с помощью Преп ЖХ-МС (IV). ЖХ-МС (В): tR=1,02 мин; [М+Н]+: 527,2.
Пример 5: Амид 1-(2-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-2-оксо-этил)-1Н-[1,2,4]триазол-3-карбоновой кислоты
5.1. трет-бутиловый эфир (R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-карбоновой кислоты
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 1, стадия 1.6, 2-этоксипиримидин-5-бороновую кислоту заменяли на 2-(трифторметил)пиримидин-5-ил-бороновую кислоту. ЖХ-МС (A): tR=1,06 мин; [М+Н]+: 497,9.
5.2. 5-[5-((R)-3-Метил-пиперазин-1-ил)-2-трифторметил-тиазол-4-ил]-2-трифторметил-пиримидин, в виде гидрохлоридной соли
Смесь промежуточного соединения 5.1 (2,3 г) в HCl (10,2 мл, 4М в диоксане) перемешивали при КТ в течение 3 ч. Белую суспензию фильтровали, фильтрат промывали с помощью Et2O и высушивали под ВВ, получая 1,6 г в виде белого твердого вещества. ЖХ-МС (A): tR=0,72 мин; [M+H++CH3CN]+: 438,9.
5.3. 1-(2-{(R)-2-Метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-2-оксо-этил)-1Н-[1,2,4]триазол-3-карбонитрил
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 2.2 заменяли на 2-(3-циано-1Н-1,2,4-триазол-1-ил)уксусную кислоту и промежуточное соединение 1.7 заменяли на промежуточное соединение 5.2. Желательное соединение очищали с помощью Преп ЖХ-МС (IV). ЖХ-МС (В): tR=1,19 мин; [М+Н]+: 532,1.
5.4. Амид 1-(2-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-2-оксо-этил)-1Н-[1,2,4]триазол-3-карбоновой кислоты
К раствору промежуточного соединения 5,3 (18 мг) в ДХМ (0,1 мл) добавляли конц. H2SO4 (0,1 мл), и полученную эмульсию интенсивно перемешивали в течение 4 ч. 15 мин Реакционную смесь добавляли порциями к смеси NH4OH (25%) и льда, и водн. слой экстрагировали с помощью ДХМ (5х). Объединенные органические слои промывали соляным раствором, высушивали над MgSO4, упаривали и высушивали при ВВ. При очистке путем Преп.. ТСХ (ДХМ/МеОН 95:5) получали 9 мг в виде белого твердого вещества. ЖХ-МС (A): tR=0,82 мин; [М+Н]+: 550,0.
Пример 6: 2-(3-Этил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 5.2. Желательное соединение очищали с помощью Преп ЖХ-МС (IV). ЖХ-МС (A): tR=0,89 мин; [М+Н]+: 535,0.
Пример 7: 2-(3-Изопропил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
7.1. бензиловый эфир (3-изопропил-[1,2,4]триазол-1-ил)-уксусной кислоты и (5-бензиловый эфир изопропил-[1,2,4]триазол-1-ил)-уксусной кислоты
Эти соединения приготавливали, используя метод, аналогичный описанному в Примере 3, стадия 3.1, 3-этил-1Н-1,2,4-триазол заменяли на 3-изопропил-1Н-1,2,4-триазол. Смесь региоизомеров очищали с помощью препаративной хиральной ВЭЖХ (II). Фракция, которая элюируется первой: бензиловый эфир (3-изопропил-[1,2,4]триазол-1-ил)-уксусной кислоты. ЖХ-МС (A): tR=0,76 мин; [М+Н]+: 260,2. Сигнал пространственной гомоядерной корреляции, наблюдаемый между СН2 при 4,96 част. на млн и СН (триазол) при 8,08 част. на млн.
Фракция, которая элюируется второй: бензиловый эфир (5-изопропил-[1,2,4]триазол-1-ил)-уксусной кислоты. ЖХ-МС (A): tR=0,76 мин; [М+Н]+: 260,2. Сигнал пространственной гомоядерной корреляции, наблюдаемый между СН2 при 4,96 част. на млн и СН (изопропил) при 2,97 част. на млн.
7.2. (3-Изопропил-[1,2,4]триазол-1-ил)-уксусная кислота и (5-Изопропил-[1,2,4]триазол-1-ил)-уксусная кислота
(3-Изопропил-[1,2,4]триазол-1-ил)-уксусную кислоту приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.2, промежуточное соединение 2.1 заменяли на бензиловый эфир (3-изопропил-[1,2,4]триазол-1-ил)-уксусной кислоты со стадии 7.1. ЖХ-МС (A): tR=0,30 мин; [М+Н]+: 170,2. Альтернативно, использовали смесь региоизомеров со стадии 7.1, получая смесь (3-изопропил-[1,2,4]триазол-1-ил)-уксусной кислоты и (5-изопропил-[1,2,4]триазол-1-ил)-уксусной кислоты.
7.3. 2-(3-Изопропил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 5.2 и промежуточное соединение 2.2 заменяли на смесь региоизомеров со стадии 7.2. Желательное соединение очищали с помощью Преп ЖХ-МС (IV), после этого осуществляли препаративную хиральную ВЭЖХ (VI). Фракция, которая элюируется первой при препаративной хиральной ВЭЖХ: 2-(3-изопропил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон. ЖХ-МС (В): tR=1,17 мин; [М+Н]+: 549,2.
Пример 8: 2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 5.2 и промежуточное соединение 2.2 заменяли на промежуточное соединение 3.2. Желательное соединение очищали с помощью Преп ЖХ-МС (II). ЖХ-МС (В): tR=1,23 мин; [М+Н]+: 563,2.
Пример 9: 2-(3-Метоксиметил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточного соединения 1.7 заменяли на промежуточное соединение 5.2 и промежуточного соединения 2.2 заменяли на промежуточное соединение 4.2. Желательное соединение очищали с помощью Преп ЖХ-МС (I). ЖХ-МС (В): tR=1,09 мин; [М+Н]+: 551,2.
Пример 10: 2-(3-Гидроксиметил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
К раствору Примера 9 (25 мг) в ДХМ (1 мл) добавляли при -30°С BBr3 (58 мкл; 1M в ДХМ) в атмосфере аргона и полученную суспензию перемешивали при 0°С в течение 3 ч. Реакционную смесь закаливали с помощью H2O, разводили с помощью нас. водн. NaHCO3 и экстрагировали с помощью ЕА (3х). Объединенные органические слои промывали соляным раствором, высушивали над MgSO4, отфильтровывали и упаривали насухо. При осуществлении преп. ЖХ-МС (IV) получали 5 мг в виде белого порошка. ЖХ-МС (A): tR=0,81 мин; [М+Н]+: 537,1.
Пример 11: 1-{(R)-2-Метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-2-(3-пропил-[1,2,4]триазол-1-ил)-этанон
11.1. бензиловый эфир (3-пропил-[1,2,4]триазол-1-ил)-уксусной кислоты
Эти соединения приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.1, 3-этил-1Н-1,2,4-триазол заменяли на 3-пропил-1Н-1,2,4-триазол. Смесь региоизомеров очищали с помощью препаративной хиральной ВЭЖХ (III). Фракция, которая элюируется первой: бензиловый эфир (5-пропил-[1,2,4]триазол-1-ил)-уксусной кислоты. ЖХ-МС (A): tR=0,77 мин; [М+Н]+: 260,1. Сигнал пространственной гомоядерной корреляции, наблюдаемый между CH2CO2 при 4,95 част. на млн и CH2CH2CH3 при 2,65 част. на млн.
Фракция, которая элюируется второй: бензиловый эфир (3-пропил-[1,2,4]триазол-1-ил)-уксусной кислоты. ЖХ-МС (A): tR=0,76 мин; [М+Н]+: 260,1. Сигнал пространственной гомоядерной корреляции, наблюдаемый между CH2CO2 при 4,96 част. на млн и СН (триазол) при 8,08 част. на млн.
11.2. (3-Пропил-[1,2,4]триазол-1-ил)-уксусная кислота
Эти соединения приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.2, промежуточное соединение 2.1 заменяли на бензиловый эфир (3-пропил-[1,2,4]триазол-1-ил)-уксусной кислоты со стадии 11.1. ЖХ-МС (A): tR=0,35 мин; [М+Н]+: 170,4.
11.3. 1-{(R)-2-Метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-2-(3-пропил-[1,2,4]триазол-1-ил)-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 5.2 и промежуточное соединение 2.2 заменяли на промежуточное соединение 11.2. Желательное соединение очищали с помощью Преп ЖХ-МС (I). ЖХ-МС (В): tR=1,17 мин; [М+Н]+: 548,9.
Пример 12: 2-[3-(1-Гидрокси-этил)-[1,2,4]триазол-1-ил]-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
12.1. Бензиловый эфир (3-ацетил-[1,2,4]триазол-1-ил)-уксусной кислоты Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.1, 3-этил-1Н-1,2,4-триазол заменяли на 1-(1Н-1,2,4-триазол-5-ил)этанон. Неочищенное вещество очищали с помощью КХ (Biotage, SNAP 10 г картридж, растворитель А: Hep; растворитель В: ЕА; градиент в %В: 30 для 4CV, 30-70 над 4CV, 70 для 2CV, 70-100 над 2CV, 100 для 2CV), получая желательный региоизомер триазола в виде второй фракции. ЖХ-МС (A): tR=0,7 мин; [М+Н]+: 260,1. Сигнал пространственной гомоядерной корреляции, наблюдаемый между СН (триазол) при 8,28 част. на млн и CH2 при 5,1 част. на млн.
12.2. (3-Ацетил-[1,2,4]триазол-1-ил)-уксусная кислота
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.2, промежуточное соединение 2.1 заменяли на промежуточное соединение 12.1. ЖХ-МС (A): tR=0,25 мин; [М+Н]+: 170,0.
12.3. 2-(3-Ацетил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 5.2 и промежуточное соединение 2.2 заменяли на промежуточное соединение 12.2. Желательное соединение очищали с помощью Преп ЖХ-МС (I). ЖХ-МС (A): tR=0,89 мин; [М+Н]+: 549,0.
12.4. 2-[3-(1-Гидрокси-этил)-[1,2,4]триазол-1-ил]-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
К светло-желтому раствору промежуточного соединения 12,3 (40 мг) в ТГФ (0,75 мл) и EtOH (0,25 мл) добавляли NaBH4 (1,4 мг) при 0°С в атмосфере аргона и реакционную смесь перемешивали при 0°С в течение 1 ч. 30 мин. Затем добавляли вторую партию NaBH4 (0,7 мг) и смесь дополнительно перемешивали в течение 2 ч 20 мин. Реакционную смесь упаривали насухо, остаток суспендировали в ЕА и добавляли нас. водн. NH4Cl и предоставляли возможность перемешиваться в течение 30 мин. при КТ. Слои разделяли и органический слой промывали 1х солевым раствором. Водн. слои повторно экстрагировали с помощью ЕА (2х). Объединенные органические слои высушивали над MgSO4, отфильтровывали и упаривали насухо. При очистке путем Преп. ТСХ (ДХМ/МеОН 95/5) получали 10 мг в виде белого твердого вещества. ЖХ-МС (A): tR=0,82 мин; [М+Н]+: 551,1.
Пример 13: 2-[3-(1-Гидрокси-1-метил-этил)-[1,2,4]триазол-1-ил]-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
К суспензии промежуточного соединения 12,3 (40 мг) в Et2O (0,75 мл) добавляли MeMgBr (48 мкл; 3М в Et2O) при -20°С и полученную суспензию перемешивали при КТ в течение 1 ч. 30 мин. Реакционную смесь закаливали путем добавления нас. водн. NH4Cl и водн. слой экстрагировали с помощью ЕА (3х). Объединенные органические слои высушивали над MgSO4, фильтровали и упаривали насухо. При очистке путем Преп. ЖХ-МС (IV) получали 7 мг в виде белого порошка. ЖХ-МС (A): tR=0,84 мин; [М+Н]+: 565,1.
Пример 14: 1-{(R)-4-[4-(2-Циклобутокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон
14.1. трет-бутиловый эфир (R)-4-[4-(2-циклобутокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-карбоновой кислоты
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 1, стадия 1.6, 2-этоксипиримидин-5-бороновую кислоту заменяли на 2-(циклобутокси)пиримидин-5-бороновую кислоту. Неочищенное вещество очищали путем Преп ЖХ-МС (II) вместо КХ. ЖХ-МС (A): tR=1,08 мин; [М+Н]+: 500,1.
14.2. 2-Циклобутокси-5-[5-((R)-3-метил-пиперазин-1-ил)-2-трифторметил-тиазол-4-ил]-пиримидин, в виде гидрохлоридной соли
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 5, стадия 5.2, промежуточное соединение 5.1 заменяли на промежуточное соединение 14.1. ЖХ-МС (A): tR=0,71 мин; [М+Н]+: 400,1.
14.3. 1-{(R)-4-[4-(2-Циклобутокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 14.2 и промежуточного соединения 2.2 заменяли на региоизомерную смесь на стадии 7.2. Неочищенное вещество очищали с помощью КХ (ДХМ/МеОН 97:3) после этого осуществляли Преп ЖХ-МС (I) и Препаративную хиральную ВЭЖХ (IV).
Фракция, которая элюируется второй (Препаративная хиральная ВЭЖХ): 1-{(R)-4-[4-(2-циклобутокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон: ЖХ-МС (В): tR=1,21 мин; [М+Н]+: 551,3. Сигнал пространственной гомоядерной корреляции, наблюдаемый между СН2 при 5,14-5,37 част. на млн и СН (триазол) при 8,36 част. на млн.
Пример 15: 1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-этил-[1,2,4]триазол-1-ил)-этанон
15.1. трет-бутиловый эфир (R)-4-[4-(2-циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-карбоновой кислоты
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 1, стадия 1.6, 2-этоксипиримидин-5-бороновую кислоту заменяли на 2-циклопропил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин. ЖХ-МС (A): tR=1,06 мин; [М+Н]+: 470,3.
15.2. 2-Циклопропил-5-[5-((R)-3-метил-пиперазин-1-ил)-2-трифторметил-тиазол-4-ил]-пиримидин, в виде гидрохлоридной соли
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 5, стадия 5.2, промежуточное соединение 5.1 заменяли на промежуточное соединение 15.1. ЖХ-МС (A): tR=0,6 мин; [М+Н]+: 370,1.
15.3. 1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-этил-[1,2,4]триазол-1-ил)-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 15.2. Неочищенное вещество очищали путем Преп ЖХ-МС (IV). ЖХ-МС (В): tR=1,07 мин; [М+Н]+: 507,2.
Пример 16: 1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 15.2 и промежуточное соединение 2.2 заменяли на (3-изопропил-[1,2,4]триазол-1-ил)-уксусную кислоту со стадии 7.2. Неочищенное вещество очищали путем Преп ЖХ-МС (IV). ЖХ-МС (A): tR=0,8 мин; [М+Н]+: 521,2.
Пример 17: 2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-4-[4-(2-циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 15.2 и промежуточное соединение 2.2 заменяли на промежуточное соединение 3.2. Неочищенное вещество очищали путем Преп ЖХ-МС (IV). ЖХ-МС (В): tR=1,18 мин; [М+Н]+: 535,2.
Пример 18: 1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метоксиметил-[1,2,4]триазол-1-ил)-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 15.2 и промежуточное соединение 2.2 заменяли на промежуточное соединение 4.2. Неочищенное вещество очищали путем Преп ЖХ-МС (IV). ЖХ-МС (A): tR=0,75 мин; [М+Н]+: 523,2.
Пример 19: 1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метил-[1,2,4]триазол-1-ил)-этанон
19.1. бензиловый эфир (3-метил-[1,2,4]триазол-1-ил)-уксусной кислоты
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.1, 3-этил-1Н-1,2,4-триазол заменяли на 3-метил-1Н-1,2,4-триазол. Смесь региоизомеров очищали с помощью препаративной хиральной ВЭЖХ (V). Фракция, которая элюируется первой: бензиловый эфир (5-метил-[1,2,4]триазол-1-ил)-уксусной кислоты. ЖХ-МС (A): tR=0,68 мин; [М+Н]+: 232,16. 1Н-ЯМР (CDCl3): 7,83 (s, 1H); 7,40-7,33 (m, 5H); 5,23 (s, 2H); 4,93 (s, 2H); 2,43 (s, 3Н). Сигнал пространственной гомоядерной корреляции, наблюдаемый между СН2СО2 при 4,93 част. на млн и CH3 при 2,43 част. на млн.
Фракция, которая элюируется второй: бензиловый эфир (3-метил-[1,2,4]триазол-1-ил)-уксусной кислоты. ЖХ-МС (A): tR=0,67 мин; [М+Н]+: 232,16. 1Н-ЯМР (CDCl3): 8,05 (s, 1Н); 7,40-7,30 (m, 5Н); 5,23 (s, 0,95Н, СН2); 4,93-4,88 (3s, 2Н); 2,42 (s, 3Н). Сигнал пространственной гомоядерной корреляции, наблюдаемый между СН (триазол) при 8,05 част. на млн и СН2СО2 при 4,93-4,88 част. на млн.
19.2. (3-Метил-[1,2,4]триазол-1-ил)-уксусная кислота
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.2, промежуточное соединение 2.1 заменяли на бензиловый эфир (3-метил-[1,2,4]триазол-1-ил)-уксусной кислоты со стадии 19.1. ЖХ-МС (A): tR=0,18 мин; [М+Н]+: 142,22.
19.3. 1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метил-[1,2,4]триазол-1-ил)-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 2.2 заменяли на промежуточное соединение 19.2. Неочищенное вещество очищали путем Преп ЖХ-МС (V). ЖХ-МС (A): tR=0,81 мин; [М+Н]+: 497,1.
Пример 20: 2-(3-Метил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 5.2 и промежуточное соединение 2.2 заменяли на промежуточное соединение 19.2. DIPEA использовали вместо NEt3. Неочищенное вещество очищали путем Преп ЖХ-МС (III). ЖХ-МС (A): tR=0,87 мин; [М+Н]+: 521,0.
Пример 21: 1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метил-[1,2,4]триазол-1-ил)-этанон
Это соединение приготавливали, используя метод, аналогичный описанному в Примере 2, стадия 2.3, промежуточное соединение 1.7 заменяли на промежуточное соединение 15.2 и промежуточное соединение 2.2 заменял на промежуточное соединение 19.2. Неочищенное вещество очищали путем Преп ЖХ-МС (V). ЖХ-МС (A): tR=0,81 мин; [М+Н]+: 493,1.
II. Биологические исследования
A) FLIPR анализ: Биологическую активность соединений тестировали на спектрофотометре для чтения планшетов для визуализации флуоресценции (FLIPR: Molecular Devices), используя сконструированные СНО-K1 клетки, экспрессирующие CXCR3A человека (GenBank: AY242128), связанные с G белком (Galpha(16)). Клетки высевали на чашки за день перед биологическим исследованием в F12 среду, дополненную 10% FBS и G418 и гигромициновыми антибиотиками для поддержания рекомбинантной селекции. В день биологического исследования, клетки промывали и загружали краситель на один час с Fluo-4-AM (Invitrogen) в сбалансированном солевом растворе Хенкса (Invitrogen), забуференном 20 мМ Hepes при рН 7,4 и бикарбонат натрия (0,038%), содержащий 5 мМ пробенецид. Этот буфер, но не содержащий красителя и содержащий пробенецид в концентрации 2,5 мМ, также использовали для стадии промывки (промывочный буфер); или но не содержащий ни красителя, ни пробенецида, но дополненный 0,1% BSA для стадии разведения соединения (буфер для разведения). Клетки промывали для удаления избытка красителя и добавляли 60 микролитров буфера для промывки. Маточные растворы тестируемых соединений готовили при концентрации 10 мМ в ДМСО, и серийно разводили в буфере для разведения до концентраций, необходимых для построения кривых ингибирования в зависимости от дозы. Через 10 минут инкубационного периода при 37°С, 10 микролитров каждого разведения соединения переносили из планшета с соединением в планшет, содержащий рекомбинантные клетки в FLIPR приборе в соответствии с инструкциями производителя. После базальных считываний, добавляли 10 микролитров CXCL10 агониста при концентрации 20 нМ (от Peprotech), снова использовали FLIPR прибор. Записывали изменения флуоресценции перед и после добавления тестируемых соединений. Значения пика эмиссии выше исходного уровня после CXCL10 добавления экспортировали после вычитания исходной линии.
В): Анализ интернализации рецептора (RIA): Маточные растворы тестируемых соединений приготавливали при концентрации 10 мМ в ДМСО, и серийно разводили в PBS, содержащем 0,5% BSA до концентраций, необходимых для построения кривых ингибирования в зависимости от дозы. После этого разведенные соединения смешивали с равным объемом CXCL10 (Peprotech), разведенным в PBS. Антикоагулированную венозную цельную кровь человека добавляли к смеси, которую затем инкубировали в СО2 инкубаторе при 37°С для предоставления возможности интернализации рецептора опосредованной лигандом (конечная CXCL10 концентрация составляла 9 нМ). Через 30 мин., кровь смешивали с флуоресцентно меченными CXCR3 и CD4 специфическими антителами (Becton Dickinson) и инкубировали на льду в течение 10 минут. После этого образцы смешивали с BD FACS лизирующим раствором (Becton Dickinson) для элиминациии эритроцитов. После промывки клеток с помощью PBS, содержащего 0,5% BSA, образцы анализировали в проточном цитометре (FACS Canto II, Becton Dickinson). Для анализа данных с помощью программного обеспечения FACSDiva (Becton Dickinson), средние значения флуоресценции, соответствующие экспрессии CXCR3 на поверхности клеток, определяли на CD4 положительных клетках.
Рассчитанные значения IC50 могут изменяться в зависимости от ежедневого проведения анализа. Флуктуации такого рода известны специалистам в данной области техники. В случае, если IC50 значения определяли несколько раз для одного соединения, представляли среднее значения. Данные для FLIPR анализа представлены в таблице 1 и для анализа интернализации рецептора (RIA) в таблице 2 2.
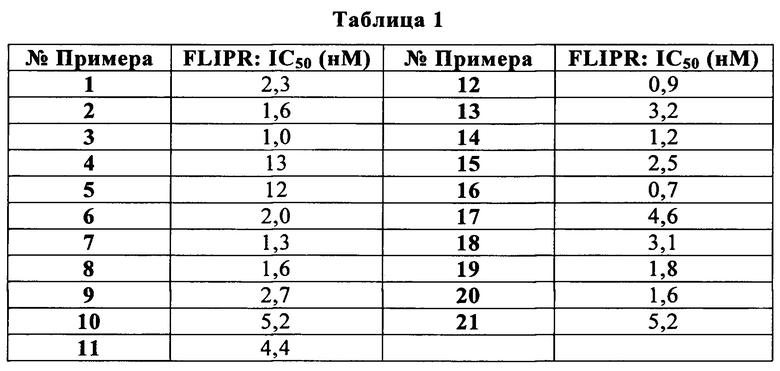
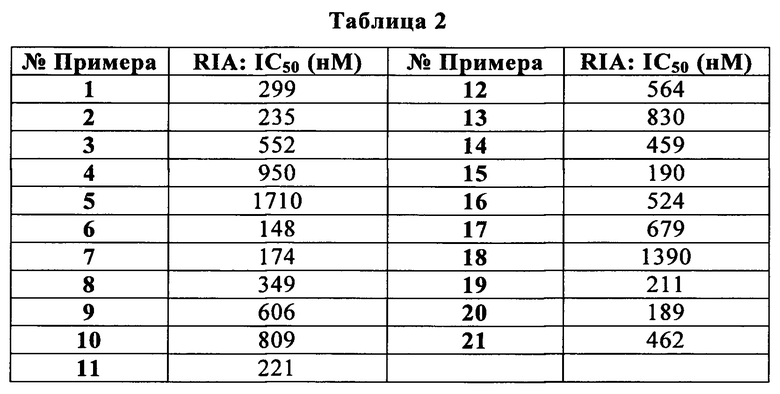
С) hERG Q-Patch анализ: Соединения оценивали относительно их способности блокировать hERG К канал, используя клетки СНО, стабильно экспрессирующие hERG ген (номер доступа U04270, bSys, Witterswil, Switzerland) и QPatch автоматизированную платформу (Sophion, Ballerup, Denmark) в режиме одной клетки при комнатной температуре. Клетки выращивали в культуральных колбах при 37°С в 5% СО2, в культуральной среде (Питательная среда Хема F-12, Invitrogen 21765-029), дополненной 9% (об./об.) фетальной бычьей сывороткой, 0,9% пенициллин/стрептомицин (10 тыс. Ед/мл, Invitrogen 15140148), 100 мкг/мл Гигромицина В (Invitrogen 10687010). Когда клетки достигали ~80% конфлюэнтности (каждые 2-3 дня), их либо разделяли для дальнейшей культуры или использовали для электрофизиологии. Для дальнейшего культивирования, клетки отсоединяли с помощью 0,25% раствор Трипсин EDTA (Invitrogen 25200-056) и фракцию клеток (10-30%) повторно высевали в культуральную среду. Для электрофизиологии, в экспериментальный день, клетки отсоединяли с помощью 0,25% раствора Трипсин EDTPA и все клетки суспендировали в суспензионной среде (293 SFM II, Invitrogen 11686-029), дополненной 20 мМ HEPES и 0,04 мг/мл ингибитора трипсина. Клетки поддерживали в суспензионной культуре при 32-35°С в роботизированном QPatch до использования, во время которого аликвоты переносили во внеклеточный раствор (в мМ: NaCl 150; KCl 4; CaCl2 1,2; MgCl2 1; HEPES 10; рН 7,4 с NaOH), содержащий 0,3% об./об. ДМСО и обрабатывали тестируемые планшеты. K+ токи измеряли с помощью технологии локальной фиксации потенциала на целой клетке с внутренним раствором (в мМ: KCl, 140; NaCl, 10; MgCl2, 1; HEPES, 10; EGTA, 5; рН=7,2 с КОН). Токи пропускали через ФНЧ, используя внутренний фильтр Bessel роботизированного QPatch с частотой среза 2 кГц и оцифровывали при 10 кГц. K+ следовые токи продуцировали из напряжения в открытом состоянии -80 мВ путем 500-мс деполяризации до +20 мВ, затем осуществляли 500-мс реполяризацию до -40 мВ; амплитуды следовых токов измеряли при окончании реполяризации до -40 мВ. Последовательность импульсов повторяли каждые 10 секунд при осуществлении эксперимента, исходный K+ ток измеряли через 3 минуты во внеклеточном растворе, после этого применяли тестируемый раствор, содержащий соединение, и K+ ток в присутствии соединения измеряли через 3 минут после применения на клетках. Соответствующий тестируемый раствор приготавливали путем (1) растворения тестируемого соединения в чистом ДМСО, (2) разведения этого раствора ДМСО во внеклеточном растворе, и (3) добавления другого ДМСО, таки образом, что конечный тестируемый раствор имел концентрацию либо 300 нМ или 3000 нМ тестируемого соединения и содержит 0,3% об./об. ДМСО. Влияния соединения количественно определяли в виде % блокирования путем деления тока в присутствии соединения на исходный ток; для каждого соединения осуществляли два или три эксперимента и конечное значение представляет собой среднее значение результатов каждого эксперимента.
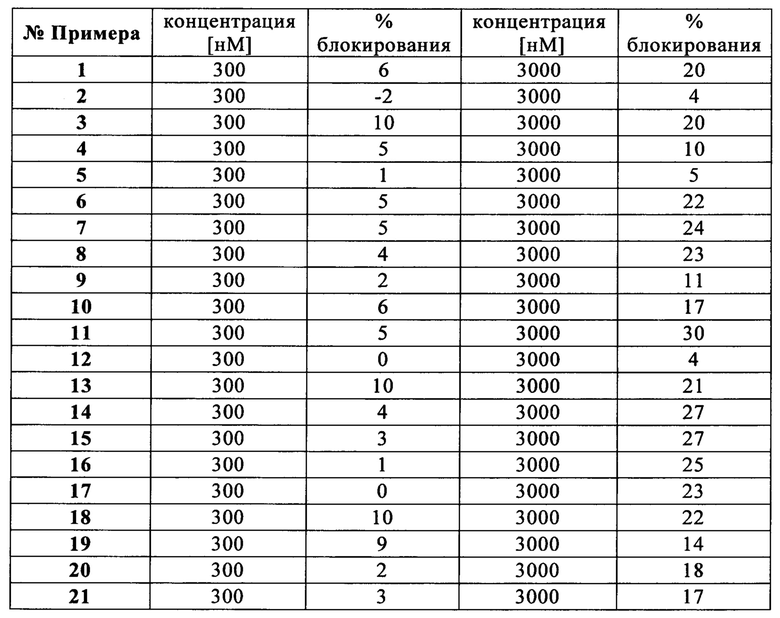
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ АЗОЛОНОВ, ДЕЙСТВУЮЩИЕ ПРОТИВ HELICOBACTER, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2152940C1 |
| СОЕДИНЕНИЯ, ГЕТЕРОБИЦИКЛО-ЗАМЕЩЕННЫЕ-[1,2,4]ТРИАЗОЛО[1,5c]ХИНАЗОЛИН-5-АМИНА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ А2А АНТАГОНИСТОВ | 2013 |
|
RU2671628C2 |
| Производные тетрагидротриазолопиримидина в качестве ингибиторов нейтрофильной эластазы человека | 2012 |
|
RU2622643C2 |
| ПРОИЗВОДНЫЕ АЗАБИЦИКЛО [3.1.0]ГЕКСАНА, ПРИМЕНИМЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДОПАМИНОВЫХ РЕЦЕПТОРОВ D3 | 2005 |
|
RU2434011C2 |
| Соединения триазоло-пиримидина и их применение | 2019 |
|
RU2802866C2 |
| НОВОЕ ФОСФОРАМИДАТНОЕ ПРОИЗВОДНОЕ НУКЛЕОЗИДА И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2621709C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ, ТАКИХ КАК COPD | 2011 |
|
RU2581839C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ, ТАКИХ КАК COPD | 2011 |
|
RU2604719C2 |
| АМИНОТЕТРАГИДРОПИРАНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ДИПЕПТИДИЛПЕПТИДАЗЫ-IV ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ ДИАБЕТА | 2010 |
|
RU2550508C2 |
| ПРОИЗВОДНЫЕ 1-[М-КАРБОКСАМИДО(ГЕТЕРО)АРИЛ-МЕТИЛ]-ГЕТЕРОЦИКЛИЛ-КАРБОКСАМИДА | 2013 |
|
RU2644761C2 |
Изобретение относится к соединениям формулы (I) и к их фармацевтически приемлемым солям и к применению таких соединений в качестве лекарственных средств. Технический результат: получены новые соединения, пригодные в качестве модуляторов CXCR3 рецептора. 3 н. и 11 з.п. ф-лы, 2 табл., 21 пр.
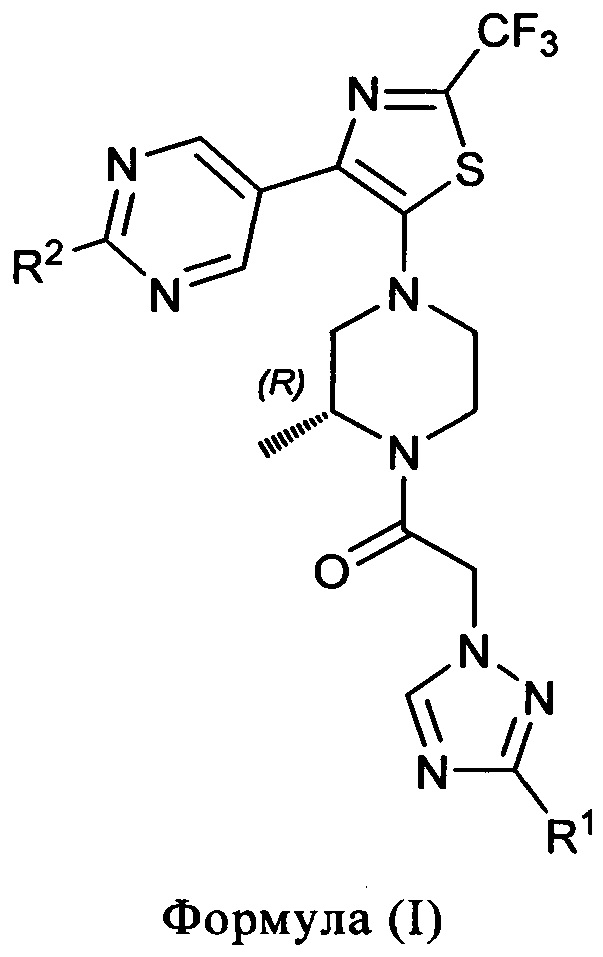
1. Соединение формулы (I)
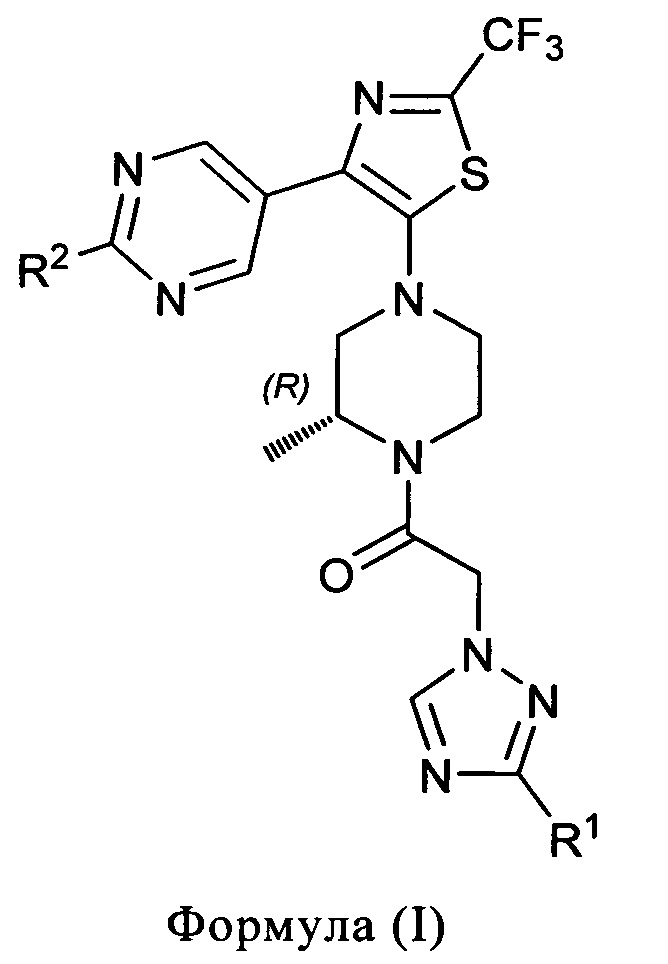 ,
,
где
R1 представляет собой (С1-4)алкил, (С1-2)алкокси-(С1-2)алкил, гидрокси-(С1-4)алкил или -C(O)NH2; и
R2 представляет собой циклопропил, (С1-4)алкокси, циклобутилокси или (С1-2)фторалкил;
или его фармацевтически приемлемая соль.
2. Соединение в соответствии с п. 1, где
R1 представляет собой (С1-4)алкил, (С1-2)алкокси-(С1-2)алкил или гидрокси-(С1-4)алкил; и
R2 представляет собой циклопропил, (С1-4)алкокси или (С1-2)фторалкил; или его фармацевтически приемлемая соль.
3. Соединение в соответствии с п. 1, где
R1 представляет собой этил, н-пропил, изо-пропил, трет.-бутил, метокси-метил или 1-гидрокси-этил; и
R2 представляет собой циклопропил, этокси или трифторметил; или его фармацевтически приемлемая соль.
4. Соединение в соответствии с п. 1, где
R1 представляет собой (С1-4)алкил, (С1-2)алкокси-(С1-2)алкил, гидрокси-(С1-4)алкил или -C(O)NH2; и
R2 представляет собой (С1-2)фторалкил;
или его фармацевтически приемлемая соль.
5. Соединение в соответствии с любым из пп. 1, 2 или 4, где
R1 представляет собой (С1-4)алкил;
или его фармацевтически приемлемая соль.
6. Соединение в соответствии с любым из пп. 1-4, где
R1 представляет собой этил, н-пропил, изо-пропил или трет.-бутил;
или его фармацевтически приемлемая соль.
7. Соединение в соответствии с любым из пп. 1, 2, 5 или 6, где
R2 представляет собой циклопропил;
или его фармацевтически приемлемая соль.
8. Соединение в соответствии с любым из пп. 1, 2, 5 или 6, где
R2 представляет собой (С1-4)алкокси;
или его фармацевтически приемлемая соль.
9. Соединение в соответствии с любым из пп. 1, 2, 5 или 6, где
R2 представляет собой (С1-4)фторалкил;
или его фармацевтически приемлемая соль.
10. Соединение в соответствии с п. 1, выбранное из группы, включающей:
1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон;
1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-этил-[1,2,4]триазол-1-ил)-этанон;
2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-4-[4-(2-этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-этанон;
1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метоксиметил-[1,2,4]триазол-1-ил)-этанон;
Амид 1-(2-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-2-оксо-этил)-1Н-[1,2,4]триазол-3-карбоновой кислоты;
2-(3-Этил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-(3-Изопропил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-(3-Метоксиметил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-(3-Гидроксиметил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
1-{(R)-2-Метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-2-(3-пропил-[1,2,4]триазол-1-ил)-этанон;
2-[3-(1-Гидрокси-этил)-[1,2,4]триазол-1-ил]-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
2-[3-(1-Гидрокси-1-метил-этил)-[1,2,4]триазол-1-ил]-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон;
1-{(R)-4-[4-(2-Циклобутокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон;
1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-этил-[1,2,4]триазол-1-ил)-этанон;
1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-изопропил-[1,2,4]триазол-1-ил)-этанон;
2-(3-трет-Бутил-[1,2,4]триазол-1-ил)-1-{(R)-4-[4-(2-циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-этанон;
1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метоксиметил-[1,2,4]триазол-1-ил)-этанон;
1-{(R)-4-[4-(2-Этокси-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метил-[1,2,4]триазол-1-ил)-этанон;
2-(3-Метил-[1,2,4]триазол-1-ил)-1-{(R)-2-метил-4-[2-трифторметил-4-(2-трифторметил-пиримидин-5-ил)-тиазол-5-ил]-пиперазин-1-ил}-этанон; и
1-{(R)-4-[4-(2-Циклопропил-пиримидин-5-ил)-2-трифторметил-тиазол-5-ил]-2-метил-пиперазин-1-ил}-2-(3-метил-[1,2,4]триазол-1-ил)-этанон;
или его фармацевтически приемлемая соль.
11. Фармацевтическая композиция, обладающая активностью в отношении модуляторов CXCR3 рецептора, где фармацевтическая композиция содержит, в качестве активного компонента, фармацевтически активное количество соединения в соответствии с любым из пп. 1-10 или его фармацевтически приемлемую соль и по меньшей мере один терапевтически инертный наполнитель.
12. Соединение в соответствии с любым из пп. 1-10 или его фармацевтически приемлемая соль для применения в качестве лекарственного средства с активностью в отношении модуляторов CXCR3 рецептора.
13. Соединение в соответствии с любым из пп. 1-10 или его фармацевтически приемлемая соль для применения для предотвращения или лечения заболевания, связанного с модулированием CXCR3 рецептора, выбранного из группы, включающей ревматоидный артрит, рассеянный склероз, нейромиелит зрительного нерва, воспалительное заболевание кишечника, болезнь Крона, неспецифический язвенный колит, системную красную волчанку, псориаз, псориатический артрит, волчаночный нефрит, интерстициальный цистит, глютеновую болезнь, миастению гравис, диабет I типа, увеит, астму, хроническое обструктивное заболевание легких, атеросклероз, миокардит, воспалительные миопатии, синдром сухого глаза, саркоидоз, грипп, церебральную малярию, отторжение трансплантированных органов, цирроз печени, системный склероз, гипертонию легочной артерии, нейродегенерацию, болезнь Альцгеймера, деменцию, связанную с ВИЧ, хорею Гентингтона, болезнь Гийена - Барре, хроническую воспалительную димелинизирующую полиневропатию, рак головного мозга, рак ободочной кишки, рак молочной железы или метастатическое распространение злокачественных новообразований.
14. Применение соединения в соответствии с любым из пп. 1-10 или его фармацевтически приемлемой соли для приготовления лекарственного средства для предотвращения или лечения заболевания, связанного с модулированием CXCR3 рецептора, выбранного из группы, включающей ревматоидный артрит, рассеянный склероз, нейромиелит зрительного нерва, воспалительное заболевание кишечника, болезнь Крона, неспецифический язвенный колит, системную красную волчанку, псориаз, псориатический артрит, волчаночный нефрит, интерстициальный цистит, глютеновую болезнь, миастению гравис, диабет I типа, увеит, астму, хроническое обструктивное заболевание легких, атеросклероз, миокардит, воспалительные миопатии, синдром сухого глаза, саркоидоз, грипп, церебральную малярию, отторжение трансплантированных органов, цирроз печени, системный склероз, гипертонию легочной артерии, нейродегенерацию, болезнь Альцгеймера, деменцию, связанную с ВИЧ, хорею Гентингтона, болезнь Гийена - Барре, хроническую воспалительную димелинизирующую полиневропатию, рак головного мозга, рак ободочной кишки, рак молочной железы или метастатическое распространение злокачественных новообразований.
| WO 2007070433 A2, 21.06.2007 | |||
| WO 2007064553 A2, 07.06.2007 | |||
| WO 2015011099 A1, 29.01.2015 | |||
| 2-АРИЛПРОПИОНОВЫЕ КИСЛОТЫ И ПРОИЗВОДНЫЕ, И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ СОЕДИНЕНИЯ | 2009 |
|
RU2520212C2 |
Авторы
Даты
2019-11-15—Публикация
2016-01-14—Подача