Краткое описание изобретения
Данное изобретение касается (R,S)-2-арилпропионовых кислот и соответствующих производных, отдельного (S)-энантиомера и фармацевтических композиций, содержащих указанные соединения, полезных для предупреждения и лечения повреждения тканей, вызванного усиленным рекрутингом полиморфно-ядерных нейтрофилов (ПМЯ-лейкоцитов) на участках воспаления.
Существующий уровень техники
Особые клетки крови (макрофаги, гранулоциты, нейтрофилы, полиморфно-ядерные) отвечают на химические стимулы, мигрируя вдоль градиента концентрации стимулирующего агента посредством процесса, называемого хемотаксис. Хемокины составляют большое семейство хемотаксических цитокинов, проявляющих свое действие через взаимодействие с рецепторами, принадлежащими семейству 7TM-GPCRs. Система хемокинов крайне важна для регулирования и контроля основного гомеостатического и воспалительного движения лейкоцитов. Функциональные последствия активации рецепторов хемокинов включают миграцию, дегрануляцию лейкоцитов, транскрипцию генов, митогенный и апоптотический эффекты.
Известны другие хемотаксические факторы, не относящиеся к семейству GPCRs, включающие продукты распада комплемента C5a, некоторые N-формилпептиды, генерированные в результате лизиса бактериальной поверхности, или пептиды синтетического происхождения, такие как формилметиониллейцилфенилаланин (f-MLP) и, в основном, различные цитокины, включающие интерлейкин-8 (CXCL8).
CXCL8 (интерлейкин-8) является эндогенным хемотактическим фактором, продуцируемым большинством ядросодержащих клеток, таких как фибробласты, макрофаги, эндотелиальные и эпителиальные клетки. К семейству такого хемотаксического фактора принадлежат ряды CXCL8-подобных хемокинов [GRO α, β, γ и NAP-2], которые связываются с CXCL8-рецепторами CXCR1 и CXCR2 (Chang et al., J. Immunol., 148, 451, 1992). Нейтрофилы представляют собой первую линию защиты против бактериальной инфекции вследствие способности указанных клеток мигрировать из периферической крови через эндотелиальные соединения и тканевые матрицы к местам действия (то есть по направлению градиентов концентрации хемотаксического фактора), где действуют, атакуя микроорганизмы, удаляя поврежденные клетки и восстанавливая ткани (M.A. Goucerot-Podicalo et al., Pathol. Biol (Paris), 44, 36, 1996).
При некоторых патологических состояниях, характеризующихся усиленным рекрутингом нейтрофилов, более серьезное повреждение ткани на месте связано с инфильтрацией нейтрофилов. Широко продемонстрирована роль активации нейтрофилов в оценке повреждения, связанного с постишемической реперфузией и легочной гипероксией. Экспериментальными моделями [N. Sekido et al., Nature, 365, 654, 1993 и T. Matsumoto et al., Lab. Investig., 77, 119, 1997] и клиническими исследованиями (A Mazzone et al., Recent Prog. Med., 85, 397, 1994; G. Receipts et al., Atheroscl., 91, 1, 1991) обнаружена прямая корреляция между клеточным повреждением и степенью инфильтрации ПМЯ-лейкоцитов, где CXCL8 является наиболее специфическим и сильным активатором.
Показана специфическая роль CXCL8 в вызывании повреждения после постишемической реперфузии у пациентов с острым инфарктом миокарда (Y. Abe et al., Br. Heart J., 70, 132, 1993). Экспериментальными исследованиями обнаружены рекрутинг и инфлюкс в пораженный головной мозг васкулярных лейкоцитов, в основном ПМЯ, в ранний постишемический период и, в поздний, моноцитов/макрофагов, экспрессия провоспалительных цитокинов, хемокинов и адгезивных молекул (U. Dirnagl et al., Trends Neurosci., 22, 391, 1999). Активированные ПМЯ участвуют в повреждении мозга, вызывая микроваскулярную окклюзию и продуцирование токсических медиаторов, таких как цитокины, реакционноспособный кислород и метаболиты азота, и липидные медиаторы (V. Witko-Sarsat et al., Lab. Invest., 80, 617, 2000). Роль ПМЯ-инфильтрации в развитии вызванного ишемией поражения и принципы снижения ПМЯ-аккумуляции изучены с помощью моделей транзиторной ишемии головного мозга на животных (N. Jiang et al., Brain Res., 788, 25, 1998). Было выдвинуто предположение, что ПМЯ-хемоатрактантные CXC хемокины, включая CXCL8, вовлечены в церебральную постишемическую аккумуляцию и активацию лейкоцитов (R.M. Ransohoff et al., Trends Neurosci., 21, 154, 1998). Действительно, сообщается о системных увеличениях CXCL8 у пациентов с ишемическим инсультом и аналогичное транзиторное увеличение в CINC, CXCL8-подобном хемокине нейтрофилов крыс, родственном с CXCL8 у людей, обнаружено на ишемических участках головного мозга (Y. Yamasaki et al., Stroke, 16, 318, 1995). Некоторые исследования нейропротекции с использованием подхода, основанного на применении антител против CXCL8, оказались успешны на кролике и крысе, что подтверждает потенциальную возможность направленной на CXCL8 терапии при ишемии головного мозга (T. Matsumoto et al., Lab. Invest., 77, 119, 1997, Y. Yamasaki et al., Brain Res., 759, 103, 1997, S. Yamagami et al., J. Leukoc. Biol, 65, 744, 1999).
Направленность на хемокины и/или соответствующие рецепторы является также перспективным подходом при лечении хронических воспалительных нарушений, таких как ревматоидный артрит (RA), воспалительные заболевания кишечника, рассеянный склероз и отторжения трансплантата. Комплексная сетчатая структура адгезивных молекул и хемокинов координирует миграцию клеток, согласованным действием индуцируя воспалительную реакцию, отдельные исследования посвящены изучению роли рецепторов хемокинов в патогенезе хронических заболеваний (JJ. Haringman et al, Ann. Rheum. Dis., 63, 1186, 2004).
Сообщается также о вовлечении различных хемокинов в патогенез некоторых дерматозов, таких как буллезный пемфигоид (BP), болезнь, вызывающая образование субэпидермальных пузырей, связанная с продуцированием аутоантител к гемидесмосомальному аутоантигену BP 180 KD (BP 180). В том числе CXCL8 вовлечен в воспалительный процесс как человеческого, так и экспериментального мышиного BP. Высокие уровни CXCL8 обнаружены в повреждениях кожи или сыворотке пациентов с BP и, в экспериментальной модели BP на мышах, инъекции CXCL8 способствуют образованию пузырей у C5-мышей или мышей с дефицитом тучных клеток, в противном случае устойчивых к индуцированию пузырей (Z. Liu et al., J. Clin. Invest., 95, 1539, 1995). Дополнетельно продемонстрировано, что антитела к BP180 опосредуют зависимое от дозы и времени высвобождение CXCL8 из культивированных нормальных эпидермальных кератиноцитов (E. Schmidt et al., J. Invest. Dermatol. 115, 842, 2000).
Как сообщается, биологическая активность CXCL8 опосредуется взаимодействием CXCL8 с CXCR1 и CXCR2 рецепторами мембраны клетки, принадлежащими к семейству из семи трансмембранных рецепторов и экспрессированными на поверхности нейтрофилов человека и некоторых типов T-клеток (L. Xu et al., J. Leukocyte Biol., 57, 335, 1995). Хотя известно, что активация CXCR1 играет решающую роль в опосредованном CXCL8 хемотаксисе, недавно было выдвинуто предположение, что активация CXCR2 может играть патофизиологическую роль в хронических воспалительных заболеваниях.
RA является хроническим системным воспалительным нарушением, которое поражает преимущественно суставы, вызывая пролиферативный синовит, который часто развивается до разрушения суставного хряща и неподвижности суставов. Активированные T-клетки, моноциты/макрофаги и нейтрофилы (PMN) являются преимущественным типом клеток, вовлеченных в синовиальное воспаление. Проникновение лейкоцитов через эндотелиальный барьер в синовиальную ткань и синовиальную жидкость считается решающим событием в патогенезе RA (Z. Szekanecz et al., J. Invest. Med., 44, 124, 1996). Повышенная направленная миграция клеток объясняется повышенной экспрессией провоспалительных медиаторов (цитокинов и хемокинов) и адгезивных молекул (Z. Szekanecz et al., Sem. Immunol., 15, 15, 2003). В частности, некоторые хемотаксические цитокины непосредственно вовлечены в рекрутинг и активацию ПМЯ- и мононуклеарных клеток во время развития RA. Специфическая патогенная роль CXCL8, CXCL5, CXCL1 и CXCL6 в синовите RA наглядно продемонстрирована и явно связана со специфической ролью хемокинов CXC в рекрутинге нейтрофилов, а также в промотировании ангиогенеза. На сегодняшний день, некоторые изучения основаны на концепции, что CXCL8 и CXCL1 являются основными медиаторами воспаления и разрушение суставов при RA и повышенные уровни указанных хемокинов обнаружены в синовиальных тканях и жидкостях пациентов с RA (A.E. Koch et al., J. Immunol., 147, 2187, 1991). Подобные данные получены в некоторых моделях на животных и в модели острого артрита, вызванного инъекцией в коленный сустав кролика LPS или кристаллов урата мононатрия, рекрутинг ПМЯ блокировали обработкой нейтрализующим специфическим антителом к CXCL8 с одновременной защитой от опухания суставов и повреждения тканей (P. L. Podolin et al., J. Immunol. 169, 6435, 2002). В противоположность реагентам, нейтрализующим активность отдельного хемокина, антагонист мультилигандного рецептора, такого как CXCR2, может блокировать активность всех медиаторов, действующих через рецептор, частично преодолевая избыточность системы и, таким образом, индуцируя более сильные биологические эффекты (KJ. Katschke et al., Arthritis Rheum., 44,1022, 2001).
Исследования вклада отдельных (S)- и (R)-энантиомеров кетопрофена в противовоспалительную активность рацемата и роли указанных энантиомеров в модуляции хемокина показывают (P. Ghezzi et al., J. Exp. Pharm. Ther., 287, 969, 1998), что два энантиомера и соответствующие соли могут ингибировать дозозависимым образом хемотаксис и рост внутриклеточной концентрации ионов Ca2+, индуцируемый CXCL8 на ПМЯ-лейкоцитах (EP0935961). Впоследствии было показано (C. Bizzarri et al., Biochem. Pharmacol. 61, 1429, 2001), что кетопрофен вносит свою долю в ингибирующую активность биологической активности CXCL8 по отношению к другим молекулам, принадлежащим к классу противовоспалительных нестероидных препаратов (NSAIDs), таких как флурбипрофен и ибупрофен. Рацемические смеси, (R-) и (S)-энантиомеры 2-арилпропионовой кислоты, являются ингибиторами индуцированного CXCL8 хемотаксиса ПМЯ и ПМЯ-дегрануляции (WO 03/043625), не проявляя активность в отношении COXs. Соединения по изобретению, как рацемические смеси, так и (S)-энантиомеры, хотя и лишены какой-либо активности в отношении COXs, но, замещенные в 4-положении фенильного кольца замещенными гетероциклами, такими как 2-аминотиазолы или 2-аминооксазолы, значительно более эффективны в ингибировании индуцированного CXCL8 хемотаксиса (активны в низком наномолярном диапазоне) по сравнению с ранее описанными соединениями (активными в микромолярном диапазоне). (R)-амиды и (R)-сульфонамиды (WO 01/58852 и WO 00/24710) описаны как эффективные ингибиторы индуцированного CXCL8 хемотаксиса ПМЯ.
Авторами неожиданно было обнаружено, что также (S)-амиды и (S)-сульфонамиды, производные 2-арилпропионовых кислот, соответственно замещенные в 4-положении фенильного кольца замещенными гетероциклами, такими как 2-аминотиазолы или 2-аминооксазолы, вносят свою долю в хорошую биологическую активность в ингибировании индуцированного CXCL8 хемотаксиса ПМЯ.
Подробное описание изобретения
Новые молекулы принадлежат к новому классу 2-арилпропионовых кислот и производных, замещенных в 4-положении 2-аминогетероциклами. При введении заместителей, указанных ниже, соединения формулы (I), а также (S)-амиды и (S) сульфонамиды, полученные из исходных карбоновых кислот, являются хорошими ингибиторами индуцированного CXCL8 хемотаксиса. Данная особенность является неожиданной, поскольку обычно наблюдается отсутствие ингибирующей активности в отношении CXCL8 для (S)-2-арилпропанамидов, относящихся к другим химическим классам уже заявленных соединений (WO 01/58852 и WO 00/24710).
Данное изобретение обеспечивает, таким образом, (R,S)-2-арилпропионовые кислоты и производные формулы (I):
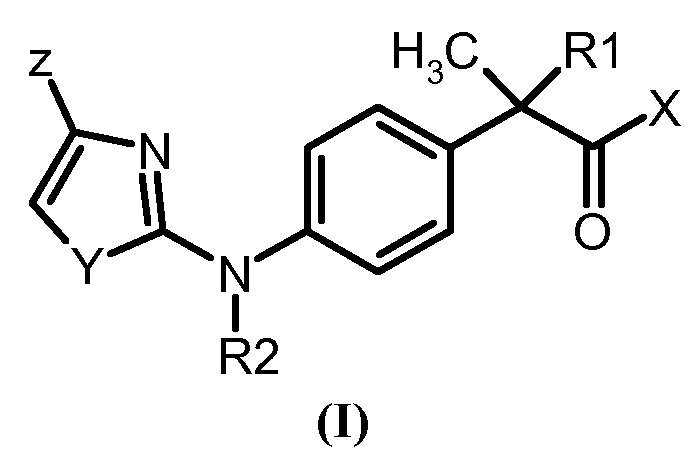
и соответствующие отдельные (S)-энантиомеры,
и фармацевтически приемлемые соли указанных соединений,
где
R1 выбирают из
- H и CH3;
X означает OH или остаток формулы NHR3,
где
R2 выбирают из
- H и линейного C1-C4-алкила;
R3 выбирают из
- H, OH, C1-C5-алкила, C3-C6-циклоалкила, C2-C5-алкенила, C1-C5-алкокси;
- неразветвленного или разветвленного C1-C6-алкила, C3-C6-циклоалкила, C2-C6-алкенила, C1-C6-фенилалкила, замещенного карбокси-(COOH) группой;
- остатка формулы SO2R4, где R4 означает C1-C2-алкила, C3-C6-циклоалкила, C1-C3-галогеналкила;
Y означает гетероатом, выбираемый из
- S, O и N,
Z означает остаток, выбираемый из
- галогена, линейного или разветвленного C1-C4-алкила, C2-C4-алкенила, C2-C4-алкинила, C1-C4-алкокси, гидрокси, карбоксила, C1-C4-ацилокси, фенокси, циано, нитро, амино, C1-C4-ациламино, галоген-C1-C3-алкила, галоген-C1-C3-алкокси, бензоила, линейного или разветвленного C1-C8-алкансульфоната, линейного или разветвленного C1-C8-алкансульфонамида, линейного или разветвленного C1-C8-алкилсульфонилметила.
Предпочтительными соединениями по изобретению являются те соединения, в которых:
R1 означает CH3;
R2 выбирают из
- H и CH3;
X означает OH;
Y выбирают из
- S и O;
Z выбирают из
- галогена, линейного или разветвленного C1-C4-алкила, C2-C4-алкенила, C1-C4-ацилокси, фенокси, циано, нитро, галоген-C1-C3-алкила, бензоила, линейного или разветвленного C1-C8-алкансульфоната, линейного или разветвленного C1-C8-алкансульфонамида.
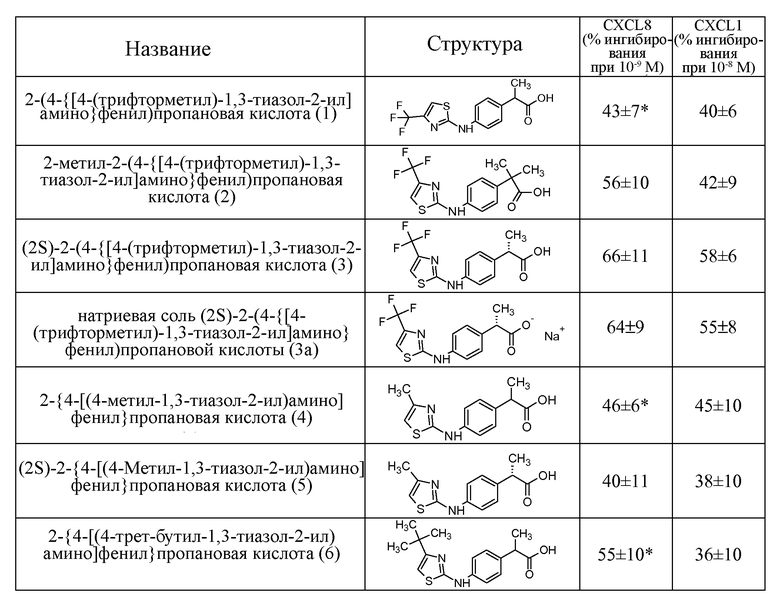
Предпочтительными соединениями по изобретению являются:
1- 2-[4-(4-трифторметилтиазол-2-ил)аминофенил]пропионовая кислота;
2- 2-метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота;
3- (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота;
3a- натриевая соль (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты;
4- 2-{4-[(4-метил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота;
5- (2S)-2-{4-[(4-метил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота;
6- 2-{4-[(4-трет-бутил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота;
7- (2S)-2-{4-[(4-трет-бутил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота;
8- 2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота;
9- (2S)-2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота;
10- (2S)-N-гидрокси-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид;
11- (2S)-N-(метилсульфонил)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид;
12- (2S)-N-[(трифторметил)сульфонил]-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид;
13- (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенилпропанамид;
14- (2S)-2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид;
15- (2S)-2-{4-[(4-третбутил-1,3-тиазол-2-ил)амино]фенил}пропанамид;
16- (2R)-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноил]амино}пропановая кислота;
17- (2S)-3-метил-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноил]амино}бутановая кислота;
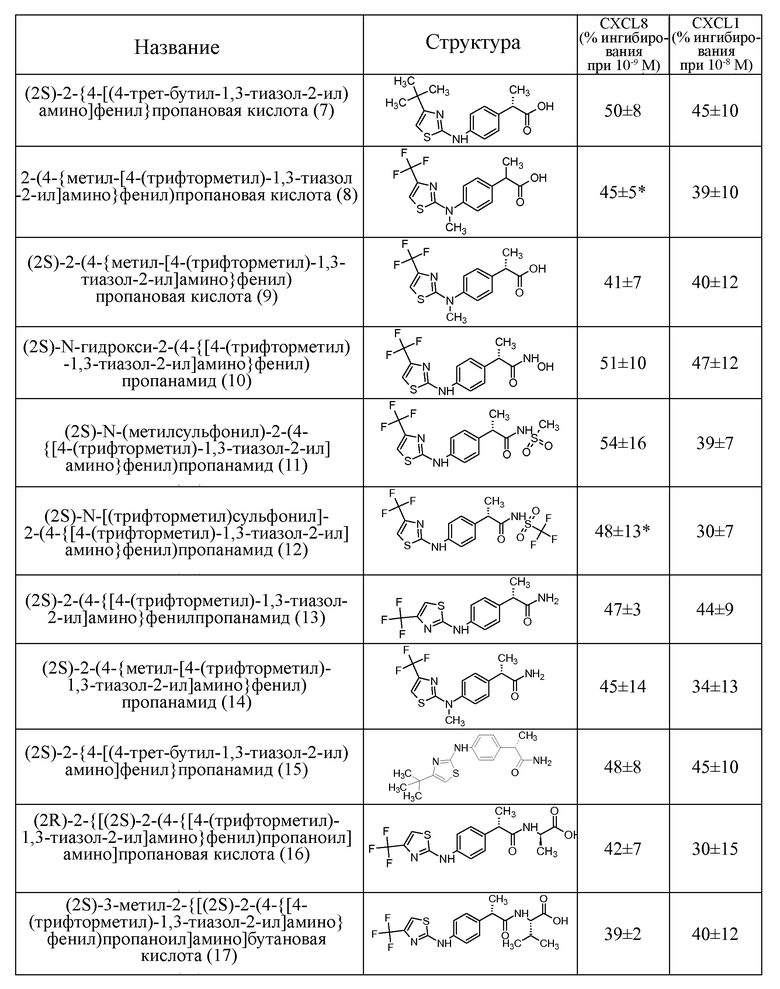
18- 2-{4-[(4-трифторметил)оксазол-2-ил]амино}фенилпропионовая кислота;
19- (2R)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановая кислота;
20- (2S)-2-(4-{метил-[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановая кислота;
21- (2S)-N-(метилсульфонил)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид;
22- (2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид;
23- (2S)-2-(4-{метил-[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид;
24- (2S)-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропаноил]амино}пропановая кислота;
25- (2S)-N-[(1S)-2-амино-1-метил-2-оксоэтил]-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид.
Наиболее предпочтительными соединениями из списка являются соединение 3 [(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота] и соответствующая натриевая соль 3a.
Соединения по изобретению формулы (I) обычно выделяют в форме аддитивных солей как с органическими, так и неорганическими фармацевтически приемлемыми основаниями. Примерами таких оснований являются: гидроксид натрия, гидроксид калия, гидроксид кальция, (D,L)-лизин, L-лизин, трометамин.
Соединения по изобретению формулы (I) оценивали in vitro на способность ингибировать хемотаксис полиморфно-ядерных лейкоцитов (называемых здесь ПМЯ) и моноцитов, индуцированных фракциями CXCL8 и GRO-α. С данной целью, для выделения ПМЯ из гепаринизированной крови человека, забранной у здоровых взрослых волонтеров, мононуклеаты удаляли осаждением на декстране (WJ. Ming et al, J. Immunol., 138, 1469, 1987). Жизнеспособность клеток определяли исключением с трипановым синим, тогда как соотношение циркулирующих полиморфно-ядерных полиморфонуклеаров оценивали по цитоцентрифугату после окрашивания с помощью Diff Quick.
В испытании на индуцированный CXCL8 хемотаксис использовали человеческий рекомбинантный CXCL8 (Pepro Tech) в качестве стимулирующего агента в хемотаксических экспериментах: лиофилизованный белок растворяли в объеме HBSS, содержащем 0,2% альбумина бычьей сыворотки (BSA), для получения основного раствора с концентрацией 10-5 М, разбавляемого HBSS до концентрации 10-9 М, для испытаний на хемотаксис.
Ингибирование индуцируемого GRO-α хемотаксиса оценивали аналогичным испытанием.
В хемотаксических экспериментах, ПМЯ инкубировали с соединениями по изобретению формулы (I) в течение 15' при 37°C в атмосфере, содержащей 5% CO2. Во время испытания на хемотаксис (W. Falket et al., J. Immunol. Methods, 33, 239, 1980) использовалине содержащие ПВП фильтры с пористостью 5 мкм и подходящие для репликации микрокамеры.
Соединения по изобретению формулы (I) оценивали при концентрации, изменяющейся в диапазоне от 10-6 до 10-10 М; для данной цели указанные соединения, добавляли при одинаковой концентрации как к нижним порам, так и верхним порам микрокамеры. Оценку способности соединений по изобретению формулы (I) ингибировать хемотаксис моноцитов человека проводили по описанной методике (J. Van Damme et al., Eur. J. Immunol., 19, 2367, 1989).
Все соединения по изобретению проявляли высокую степень селективности в отношении ингибирования индуцированного CXCL8 хемотаксиса по сравнению с хемотаксисом, индуцированным C5a
(10-6 М) или f-MLP (10-6 М).
Установлено, что соединения формулы (I), оцененные ex vivo в крови в целом по описанной методике (Patrignani et al., J. Pharmacol. Exper. Ther., 271, 1705, 1994), абсолютно неэффективны в качестве ингибиторов ферментов циклооксигеназ. Действительно, соединения по изобретению не препятствуют продуцированию PGE2 в мышиных макрофагах, стимулируемому липополисахаридами (LPS, 1 мкг/мл), при концентрации в диапазоне от 10-5 до 10-6 M.
По причине отсутствия ингибирующей активности в отношении COX у рацематов и (S)-энантиомеров описанных 2-арилпропионовых кислот и соответствующих производных, соединения по изобретению представляют собой новые примеры 2-арилпропионовых кислот и соответствующих производных с необходимыми отличительными признаками для терапевтического применения при патологиях, связанных с усиленными хемотаксисом и активацией нейтрофилов, индуцируемых CXCL8.
Таким образом, дальнейшая цель изобретения состоит в применении соединений формулы (I) в лечении заболеваний с вовлечением индуцируемого CXCL8 хемотаксиса ПМЯ человека.
Соединения по данному изобретению, в частности, полезны для предупреждения и лечения поражений, вызванных ишемией/реперфузией, в особенности в защите от функционального повреждения, вызываемого временной окклюзией средней артерии головного мозга (MCA). В частности, соединение 3a оценивали на предмет эффективности в модели транзиторной ишемии головного мозга, вызванной у крыс окклюзией средней мозговой артерии (MCA). Изучено кратковременное воздействие (24 часа) 3a на активность миелопероксидазы головного мозга (MPO), маркер ПМЯ-инфильтрации, повреждение головного мозга и неврологические расстройства. Соединение эффективно в снижении инфильтрата ПМЯ, размера инфаркта и улучшении, в значительной степени, неврологических функций.
Далее, с точки зрения экспериментального доказательства, обсуждаемого выше, и роли, выполняемой CXCL8 и агентами общего происхождения в процессах, которые включают в себя активацию и инфильтрацию нейтрофилов, соединения по изобретению являются эффективными при лечении таких хронических заболеваний, как буллезный пемфигоид, ревматоидный артрит (M. Selz et al., J. Clin. Invest., 87, 463, 1981), идиопатический фиброз (E. J. Miller, цитируемый ранее, и P. C. Carre et al., J. Clin. Invest., 88, 1882, 1991) и гломерулонефрит (T. Wada et al., J. Exp. Med., 180, 1135, 1994).
Поэтому еще одной целью данного изобретения является применение соединений формулы (I) при лечении поражений, вызванных такими заболеваниями, как ишемия и реперфузия, буллезный пемфигоид, ревматоидный артрит, идиопатический фиброз, гломерулонефрит и, в особенности, применения при лечении транзиторной ишемии головного мозга.
Фармацевтические композиции, включающие соединение по изобретению и подходящий носитель, также охватываются рамками объема данного изобретения.
Соединения по изобретению вместе с обычно используемым вспомогательным средством, носителем, разбавителем или наполнителем могут быть фактически представлены в форме фармацевтических композиций и стандартных лекарственных форм и в такой форме могут применяться в твердом виде, таком как таблетки или наполненные капсулы, или в виде жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или в виде наполненных указанными жидкостями капсул, причем все перечисленное предназначено для перорального применения, или в форме стерильных инъецируемых растворов для парентерального (в том числе подкожного) применения. Такие фармацевтические композиции и соответствующие стандартные лекарственные формы могут включать ингредиенты в общепринятых пропорциях, при наличии или отсутствии дополнительных активных соединений или действующих начал, и такие стандартные лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента, соразмерное с заданным диапазоном суточных доз для применения.
При применении в качестве фармацевтических средств кислоты по данному изобретению обычно вводят в форме фармацевтической композиции. Такие композиции могут быть получены способом, хорошо известным в фармацевтической области, и включают, по меньшей мере, одно активное соединение. Обычно соединения по данному изобретению вводят в фармацевтически эффективном количестве. Количество соединения для фактического введения обычно определяет врач с учетом конкретных обстоятельств, включающих излечиваемое состояние, выбранный способ введения, реальное вводимое соединение, возраст, массу и восприимчивость отдельного пациента, тяжесть симптомов пациента и тому подобное.
Фармацевтические композиции по изобретению можно вводить различными путями, включающими пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. В зависимости от предполагаемого способа доставки, соединения предпочтительно формулировать в виде либо инъецируемых, либо пероральных композиций. Композиции для перорального введения могут быть в форме нерасфасованных жидких растворов или суспензий или нерасфасованных порошков. Однако обычно композиции представляют в виде единичных дозированных форм, что способствует достижению точной дозировки. Термин "единичная дозированная форма/формы" относится к физически дискретным единицам, пригодным в качестве однократных доз для субъекта-человека и других млекопитающих, причем каждая единица содержит предварительно определенное количество активного вещества, рассчитанное для достижения требуемого терапевтического действия, в сочетании с подходящим фармацевтическим наполнителем. Типичные единичные дозированные формы включают предварительно наполненные, содержащие предварительно отмеренное количество жидких композиций ампулы или шприцы, или пилюли, таблетки, капсулы или тому подобное в случае твердых композиций. В таких композициях кислотное соединение обычно является меньшим компонентом (приблизительно от 0,1 до 50 мас. % или, предпочтительно, приблизительно от 1 до 40 мас. %), причем остальное количество составляют различные наполнители или носители и используемые в производственном процессе вспомогательные вещества, целесообразные для формирования требуемой лекарственной формы.
Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный наполнитель с буферами, суспендирующими и диспергирующими агентами, красящими веществами, корригентами и тому подобным. Жидкие формы, в том числе описанные ниже инъецируемые композиции, всегда хранят в отсутствие света, чтобы избежать любого каталитического действия света, такого как образование гидропероксида или пероксида. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений подобного характера: связывающее вещество, такое как микрокристаллическая целлюлоза, трагакантная камедь или желатин; наполнитель, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; вещество, придающее скольжение, такое как коллоидальный диоксид кремния; подсластитель, такой как сахароза или сахарин; или корригент, такой как мята перечная, метилсалицилат или апельсиновый корригент.
Композиции для инъекций обычно основаны на инъецируемом стерильном солевом растворе, или забуференном фосфатом солевом растворе, или других инъецируемых носителях, известных из уровня техники. Как указано выше, кислотное производное формулы I в таких композициях является обычно меньшим компонентом, часто составляющим от 0,05 до 10 мас. %, причем остальное количество составляет инъецируемый носитель и тому подобное. Средняя суточная доза будет зависеть от различных факторов, таких как тяжесть заболевания и состояния пациента (возраст, пол и масса). Доза обычно варьирует от 1 мг или нескольких мг до 1500 мг соединений формулы (I) в день, такую дозу необязательно делят для нескольких введений. Благодаря низкой токсичности соединений по изобретению можно также вводить более высокие дозы на протяжении длительных периодов времени.
Описанные выше компоненты для перорально вводимых или инъецируемых композиций являются лишь репрезентативными. Дополнительные вещества, а также способы обработки и тому подобное описаны в части 8 публикации "Remington's Pharmaceutical Sciences Handbook", 18th Edition, 1990, Mack Publishing Company, Easton, Pennsylvania, которая включена здесь в качестве ссылки.
Соединения по изобретению могут также быть введены в формах замедленного высвобождения или с помощью систем доставки лекарственного средства с замедленным высвобождением. Описание характерных примеров материалов, обеспечивающих замедленное высвобождение, можно также найти во включенных материалах в указанном выше справочнике Ремингтона.
Настоящее изобретение иллюстрируется с помощью следующих примеров, которые не следует истолковывать как ограничивающие объем изобретения.
Получение соединений формулы (I) осуществляют, используя известные способы синтеза как кислот, так и родственных амидов и ацилсульфонамидов. Основными промежуточными соединениями для рацемических и (S)-энантиомерных соединений являются рацемический и (S)-энантиомерный метил-2-[4-(карбамотиоиламино)фенил]пропаноат и метил-2-[4-(карбамоиламино)фенил]пропаноат, которые превращают в соответствующие 4-гетероциклические производные, гидролизуют до карбоновой кислоты и, впоследствии, осуществляют связывание с сульфонамидами и аминами, получая соединения формулы (I).
Экспериментальная часть
Перечень обозначений
CH2Cl2: дихлорметан; CHCl3: хлороформ; Et2O: диэтиловый эфир; AcOH: уксусная кислота; THF: тетрагидрофуран (ТГФ); LiHMDS: гексаметилдисилазид лития; CDI: 1,1'-карбонилдиимдазол; SOCl2: тионилхлорид; TEA: триэтиламин.
Получение промежуточных соединений
Метил-(2S)-2-(4-аминофенил)пропаноат получают оптическим разделением коммерческой рацемической 2-(4-нитрофенил)пропановой кислоты по известной методике (Akgun H. et al, Arzneim.-Forsch./Drug Res., 46(II), 891, 1996) и последующим восстановлением нитрогруппы до амина с помощью Fe/HCl в метаноле.
Метил-2-(4-аминофенил)пропаноат получают непосредственно восстановлением 2-(4-нитрофенил)пропановой кислоты с помощью Fe/HCl в метаноле.
(S)-Метил-2-[4-(карбамотиоиламино)фенил]пропаноат
В круглодонной колбе на 500 мл, снабженной конденсатором и магнитной мешалкой, при комнатной температуре метил-(2S)-2-(4-аминофенил)пропаноат (17,5 г, 98 ммоль) растворяют в толуоле (300 мл) и к раствору медленно добавляют конц. H2SO4 (2,6 мл, 50 ммоль). Добавляют тиоцианат натрия (10,29 г, 128 ммоль) и реакционную смесь нагревают до кипения с обратным холодильником 24 ч. После охлаждения до комнатной температуры, раствор промывают насыщенным раствором NH4Cl (2×100 мл), сушат на безводным Na2SO4 и упаривают в вакууме, с получение сырого продукта, который, после очистки флэш хроматографией (смесь н-гексан/EtOAc 1/1), дает очищенный (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноат (10,7 г, 48,4 ммоль) в виде белого твердого вещества (49%).
1H-ЯМР (CDCl3): δ 8,25 (ушир.с, 1H, CSNH), 7,40 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,20 (ушир.с, 2H, CSNH2), 3,75 (м, 1H), 3,65 (с, 3H), 1,50 (д, 3H, J=7 Гц).
(S)-Метил-2-[4-(карбамоиламино)фенил]пропаноат
Следуя той же методике, что описана для (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата, и исходя из метил-(2S)-2-(4-аминофенил)пропаноата (98 ммоль) и цианата натрия (128 ммоль), после обработки, выделяют (S)-метил-2-[4-(карбамоиламино)фенил]пропаноат в виде белого твердого вещества (59%).
1H-ЯМР (CDCl3): δ 8,90 (ушир.с, 1H, CONH), 7,55 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,50 (ушир.с, 2H, CONH2), 3,75 (м, 1H), 3,60 (с, 3H), 1,50 (д, 3H, J=7 Гц).
Метил-2-[4-(карбамотиоиламино)фенил]пропаноат
Следуя той же методике, что описана для (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата, и исходя из метил-2-(4-аминофенил)пропаноата (98 ммоль), после обработки, выделяют метил-2-[4-(карбамоиламино)фенил]пропаноат в виде белого твердого вещества (74%).
1H-ЯМР (CDCl3): δ 8,25 (ушир.с, 1H, CSNH), 7,40 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,20 (ушир.с, 2H, CSNH2), 3,75 (м, 1H), 3,65 (с, 3H), 1,50 (д, 3H, J=7 Гц).
Метил-2-[4-(карбамоиламино)фенил]пропаноат
Следуя той же методике, что описана для (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата, и исходя из метил-2-(4-аминофенил)пропаноата (98 ммоль) и цианата натрия (128 ммоль), после обработки, выделяют метил-2-[4-(карбамоиламино)фенил]пропаноат в виде белого твердого вещества (65%).
1H-ЯМР (CDCl3): δ 8,90 (ушир.с, 1H, CONH), 7,55 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,50 (ушир.с, 2H, CONH2), 3,75 (м, 1H), 3,60 (с, 3H), 1,50 (д, 3H, J=7 Гц).
Примеры
2-(4-{[4-(Трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота (1)
В круглодонной колбе на 250 мл, снабженной конденсатором и магнитной мешалкой, раствор метил-2-[4-(карбамотиоиламино)фенил]пропаноата (10,7 г, 48,4 ммоль) в 1,4-диоксане (200 мл) обрабатывают при комнатной температуре 3-бром-1,1,1-трифторпропан-2-оном (5 мл, 48,4 ммоль), и реакционную смесь нагревают до кипения с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, растворитель отгоняют в вакууме, остаток растворяют в CH2Cl2 (200 мл), промывают насыщенным раствором NaHCO3 (3×100 мл), сушат над безводным Na2SO4 и упаривают в вакууме с получением очищенного метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (12,8 г, 38,7 ммоль) в виде желтого масла (80%).
1H-NMR (CDCl3): δ 8,65 (с, 1H, NH), 7,30 (м, 4H), 7,05 (с, 1H), 3,75 (кв, 1H, J=7 Гц), 3,65 (с, 3H), 1,50 (д, 3H, J=7 Гц).
Раствор метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (12 г, 36,28 ммоль) в AcOH (50 мл) и 37% HCl (17,5 мл) нагревают до кипения с обратным холодильником в течение 12 ч. После охлаждения до комнатной температуры, растворитель выпаривают и сырой остаток растворяют в CH2Cl2 (200 мл) и промывают водой (3×100 мл) и насыщенным раствором соли (3×100 мл). Органический слой сушат над безводным Na2SO4 и растворитель выпаривают в вакууме. Полученное светло-желтое масло превращают в мягкую массу, обработкой в н-гексане (150 мл) в течение ночи. Очищенное соединение 1 (7,8 г, 24,67 ммоль) получают в виде белого твердого вещества путем фильтрования (68% из промежуточного сложного метилового эфира).
1H-NMR (CDCl3): δ 9,25 (ушир.с, 1H, NH), 7,40 (д, 2H, J=7 Гц), 7,25 (д, 2H, J=7 Гц), 7,00 (с, 1H), 3,80 (кв, 1H, J=7 Гц), 1,55 (д, 3H, J=7 Гц).
2-Метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота (2)
Смесь 2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (0,5 г, 1,5 ммоль) и K2CO3 (0,41 г, 3,0 ммоль) в сухом ТГФ (5 мл) барботируют трифторацетилхлоридом (3 ммоль). Реакционную смесь нагревают до кипения с обратным холодильником в течение 4 ч. После исчезновения исходного вещества и охлаждения до комнатной температуры, ТГФ выпаривают в вакууме и остаток растворяют в CH2Cl2 (10 мл) и в буферном растворе H3PO4/H2PO4 (pH 2,0, 10 мл). Смесь переносят в делительную воронку, две фазы разделяют, и органическую фазу вновь промывают тем же буфером (3×5 мл), сушат над Na2SO4 и упаривают в вакууме с получением очищенного метил-2-(4-{(трифторацетил)[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (0,60 гр., 1,4 ммоль) в виде прозрачного масла (94%). LiHMDS получают обработкой 1,1,1,3,3,3-гексаметилдисилазана (64 ммоль) с помощью н-BuLi (1,6 М в н-гексане, 63 ммоль) по известным методикам. К раствору LiHMDS (1,4 ммоль) в сухом ТГФ (5 мл), при T=-78°C, добавляют по каплям раствор 2-(4-{(трифторацетил)[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (0,60 гр., 1,4 ммоль) в сухом ТГФ (2 мл); полученную смесь оставляют перемешиваться на 1 ч, добавляют иодметан (62 мкл, 1,5 ммоль) и раствор оставляют перемешиваться при комнатной температуре в течение ночи. Добавляют Et2O (10 мл) и буферный раствор H3PO4/H2PO4 (pH 2,0, 10 мл). Фазы разделяют и водную фазу снова экстрагируют Et2O (3×5 мл); собранные органические экстракты сушат над безводным Na2SO4 и упаривают в вакууме с получением сырого продукта, который, после очистки флэш хроматографией, дает очищенный метил-2-метил-2-(4-{(трифторацетил)[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноат (0,40 гр., 0,91 ммоль) в виде желтого масла (65%).
К раствору сложного метилового эфира в ТГФ (5 мл) добавляют 1М NaOH (2,0 мл), и реакционную смесь нагревают до кипения с обратным холодильником в течение ночи. После охлаждения до комнатной температуры, смесь гасят буферным раствором H3PO4/H2PO4 (pH 2,0, 5 мл) и переносят в делительную воронку. Фазы разделяют, водную фазу снова экстрагируют CH2Cl2 (3×5 мл), собранные органические экстракты сушат над Na2SO4 и упаривают в вакууме с получением очищенного соединения 2 (0,29 г, 0,88 моль) в виде воскообразного желтого твердого вещества (97%).
1H-ЯМР (CDCl3): δ 12,20 (ушир.с, с, COOH), 9,25 (ушир.с, 1H, NH), 7,40 (д, 2H, J=7 Гц), 7,25 (д, 2H, J=7 Гц), 7,00 (с, 1H), 1,55 (с, 6H).
(2S)-2-(4-{[4-(Трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота (3)
Следуя той же методике, что описана для 1, и исходя из (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата (10,7 г, 48,4 ммоль), после обработки и гидролиза сложного метилового эфира, выделяют соединение 3 (12,24 г, 38,72 ммоль) в виде белого твердого вещества (80%).
[α]D = +37 (c=1,2; CH3OH); 1H-ЯМР (CDCl3): δ 9,25 (ушир.с, 1H, NH), 7,40 (д, 2H, J=7 Гц), 7,25 (д, 2H, J=7 Гц), 7,00 (с, 1H), 3,80 (кв, 1H, J=7 Гц), 1,55 (д, 3H, J=7 Гц).
(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноат натрия (3a)
В круглодонной колбе на 100 мл, снабженной магнитной мешалкой, соединение 3 (7,26 гр., 22,9 ммоль) суспендируют в воде (30 мл) и медленно добавляют 2н NaOH (11,45 мл, 22,9 моль). Полученный темно-красный раствор перемешивают в течение 1 ч при комнатной температуре, фильтруют на фильтре 0,45 мк и сушат сублимацией. Очищенный (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноат натрия 3a (7,51 г, 22,2 ммоль) получают в виде белого твердого вещества (97%). Т.пл. 142°-145°C. [α]D = -8,7 (c=0,62; CH3OH); 1H-ЯМР (D2O): δ 9,00 (ушир.с, 1H, NH), 7,30 (м, 4H), 7,28 (с, 1H), 3,55 (кв, 1H, J=7 Гц), 1,35 (д, 3H, J=7 Гц).
2-{4-[(4-Метил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота (4)
Следуя той же методике, что описана для 1, и исходя из метил-2-[4-(карбамотиоиламино)фенил]пропаноата (4,98 г, 20 ммоль) и 1-хлорпропан-2-она (2,13 мл, 26 ммоль), после обработки и гидролиза сложного метилового эфира, очищенное соединение 4 (2,5 г, 9,5 ммоль) выделяют фильтрованием (49% общий выход из метил-2-[4-(карбамотиоиламино)фенил]пропаноата).
1H-ЯМР (ДМСО-d6): δ 9,25 (ушир.с, 1H, NH), 7,45 (д, 2H, J=7 Гц), 7,30 (д, 2H, J=7 Гц), 6,60 (с, 1H), 3,65 (кв, 1H, J=7 Гц), 2,25 (с, 3H), 1,35 (д, 3H, J=7 Гц).
(2S)-2-{4-[(4-Метил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота (5)
Следуя той же методике, что описана для 4, и исходя из (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата (10 г, 45,23 ммоль), после обработки и гидролиза сложного метилового эфира, выделяют соединение 5 (10,72 г, 33,9 ммоль) в виде белого твердого вещества (75%).
[α]D=+20 (c=0,2; CH3OH); 1H-ЯМР (ДМСО-d6): δ 9,25 (ушир.с, 1H, NH), 7,45 (д, 2H, J=7 Гц), 7,30 (д, 2H, J=7 Гц), 6,60 (с, 1H), 3,65 (кв, 1H, J=7 Гц), 2,25 (с, 3H), 1,35 (д, 3H, J=7 Гц).
2-{4-[(4-трет-Бутил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота (6)
Следуя той же методике, что описана для 1, и исходя из метил-2-[4-(карбамотиоиламино)фенил]пропаноата (2,49 г, 10 ммоль) и 1-бромпинаколина (1,75 мл, 13 ммоль), после обработки и гидролиза сложного метилового эфира, очищенное соединение 6 (1,75 г, 5,7 ммоль) выделяют фильтрованием (38% общий выход из метил-2-[4-(карбамотиоиламино)фенил]пропаноата).
1H-ЯМР (ДМСО-d6): δ 9,20 (ушир.с, 1H, NH) 7,55 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,45 (с, 1H), 3,60 (кв, 1H, J=7 Гц), 1,35 (д, 3H, J=7 Гц), 1,25 (с, 9H).
(2S)-2-{4-[(4-трет-Бутил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота (7)
Следуя той же методике, что описана для 6, и исходя из (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата (10 г, 45,23 ммоль), после обработки и гидролиза сложного метилового эфира, выделяют соединение 7 (11.14 г, 36,6 ммоль) в виде белого твердого вещества (81%).
[α]D = +25,8 (c=1; CH3OH); 1H-ЯМР (ДМСО-d6): δ 9,20 (ушир.с, 1H, NH) 7,55 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,45 (с, 1H), 3,60 (кв, 1H, J=7 Гц), 1,35 (д, 3H, J=7 Гц), 1.25 (с, 9H).
2-(4-{Метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота (8)
К раствору промежуточного метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (0,1 г, 0,303 ммоль) и CsOH*H2O (0,046 г, 2,75 ммоль) в сухом CH2Cl2 (5 мл) добавляют иодметан (17,5 мкл, 0,275 ммоль), и реакционную смесь оставляют перемешиваться в течение ночи при комнатной температуре. После гашения буферным раствором H3PO4/H2PO4 (pH 2,0, 10 мл), реакционную смесь переносят в делительную воронку, две фазы разделяют и водную фазу экстрагируют CH2Cl2 (3×10 мл), собранные органические экстракты сушат над Na2SO4 и упаривают в вакууме с получением сырого продукта, который, после очистки флэш хроматографией, дает очищенный метил-2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноат (0,074 г, 0,215 моль) в виде желтого масла (71%).
К раствору сложного метилового эфира в ТГФ (5 мл) добавляют 1М NaOH (1,4 мл), и реакционную смесь перемешивают в течение ночи при комнатной температуре. После гашения буферным раствором H3PO4/H2PO4 (pH 2,0, 5 мл), реакционную смесь переносят в делительную воронку, две фазы разделяют и водную фазу экстрагируют CH2Cl2 (3×5 мл), собранные органические экстракты сушат над Na2SO4 и упаривают в вакууме с получением очищенного соединения 8 (0,070 г, 0,214 моль) в виде светло-желтого твердого вещества (97%).
1H-ЯМР (ДМСО-d6): δ 7,50-7,30 (м, 5H); 3,70 (кв, 1H, J=7 Гц); 3,45 (с, 3H); 1,35 (д, 3H, J=7 Гц).
(2S)-2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота (9)
Следуя той же методике, что описана для 8, и исходя из метил-(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (0,1 г, 0,303 ммоль), после обработки выделяют соединение 9 (0,055 г, 0,168 ммоль) в виде желтого стеклообразного твердого вещества (55%).
[α]D=+21 (c=0,5; CH3OH); 1H-ЯМР (ДМСО-d6): δ 7,50-7,30 (м, 5H); 3,70 (кв, 1H, J=7 Гц); 3,45 (с, 3H); 1,35 (д, 3H, J=7 Гц).
(2S)-N-Гидрокси-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (10)
В круглодонной колбе на 25 мл, снабженной магнитной мешалкой, раствор гидрохлорида гидроксиламина (0,046 г, 0,66 ммоль) и TEA (121 мкл, 0,88 ммоль) в CHCl3 (2 мл) перемешивают при комнатной температуре в течение 15 мин.
Отдельно, раствор соединения 3 (0,070 г, 0,22 ммоль) в SOCl2 (3 мл) нагревают до кипения с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры, избыток SOCl2 отгоняют в вакууме, и сырой ацилхлорид разбавляют CHCl3 (5 мл) и медленно добавляют по каплям к раствору гидроксиламина при T=0°C. После удаления ледяной бани, реакционную смесь перемешивают дополнительно 2,5 ч, затем разбавляют CHCl3 (30 мл), промывают 10% KHSO4 (3×10 мл), насыщенным раствором соли (3×10 мл) и сушат над безводным Na2SO4 с получением сырого продукта, который, после очистки флэш хроматографией, дает очищенное соединение 10 (0,050 г, 0,15 ммоль) в виде белого воскообразного твердого вещества (68%).
[α]D=+23,5 (c=0,5; CH3OH); 1H-ЯМР (ДМСО-d6): δ 10,5 (ушир.с, 1H, NH), 7,60 (с, 1H), 7,.45 (д, 2H, J=7Hz), 7,30 (ушир.с, 1H, OH), 7,25 (д, 2H, J=7 Гц), 6,75 (ушир.с, 1H, CONH), 3,50 (кв, 1H, J=7 Гц), 1,40 (д, 3H, J=7 Гц).
(2S)-N-(Метилсульфонил)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (11)
К раствору (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты (3) (0,1 г, 0,32 ммоль) в сухом CH2Cl2 (2 мл) добавляют CDI (0,055 г, 0,34 ммоль) и полученный раствор перемешивают в течение 1 ч при T=0°C. После удаления ледяной бани добавляют метансульфонамид (0,032 г, 0,34 ммоль) и TEA (40 мкл, 0,29 ммоль), и полученную смесь перемешивают при комнатной температуре в течение 12 ч. При полном исчезновении исходного вещества, добавляют буферный раствор H3PO4/H2PO4 (pH 2,0, 5 мл) и реакционную смесь переносят в делительную воронку. Две фазы разделяют, и органическую фазу промывают тем же буфером (3×5 мл), сушат над Na2SO4 и упаривают в вакууме с получением сырого продукта, который очищают флэш хроматографией. Очищенное соединение 11 (0,089 г, 0,23 моль) выделяют в виде желтого масла (71%).
[α]D = +46,7 (c=0,5; CH3OH); 1H-ЯМР (CDCl3): δ 8,05 (ушир.с, 1H, NH), 7,55 (ушир.с, 1H, CONH), 7,40 (д, 2H, J=7 Гц), 7,25 (д, 2H, J=7 Гц), 7,10 (с, 1H), 3,65 (кв, 1H, J=7 Гц), 3,25 (с, 3H), 1,55 (д, 3H, J=7 Гц).
(2S)-N-[(Трифторметил)сульфонил]-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенилпропанамид (12)
Следуя той же методике, что описана для 11, и исходя из (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты (3) (0,1 г, 0,32 ммоль) и трифторметансульфонамида (0,051 г, 0,34 ммоль), после обработки выделяют соединение 12 (0,078 г, 0,24 ммоль) в виде белого твердого вещества (75%).
Т.пл. 90°-95°C; [α]D = +32,2 ( =0,5; CH3OH); 1H-ЯМР (ДМСО-d6): δ 10,45 (ушир.с, 1H, NH), 7,60 (с, 1H), 7,45 (д, 2H, J=7 Гц), 7,25 (д, 2H, J=7 Гц), 3,45 (кв, 1H, J=7 Гц), 1,25 (д, 3H, J=7 Гц).
(2S)-2-(4-{[4-(Трифторметил)-l,3-тиазол-2-ил]амино}фенилпропанамид (13)
Следуя той же методике, что описана для 11, и исходя из (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты (3) (0,2 г, 0,63 ммоль) и безводного NH3, после обработки выделяют соединение 13 (0,19 г, 0,61 ммоль) в виде светло-желтого твердого вещества (97%).
Т.пл. 204-205°C; [α]D = +11,25 (c=1; CH3OH); 1H-ЯМР (ДМСО-d6): δ 10,45 (ушир.с, 1H, NH), 7,60 (с, 1H), 7,45 (д, 2H, J=7 Гц), 7,30 (ушир.с, 1H, CONH), 7,25 (д, 2H, J=7 Гц), 6,75 (ушир.с, 1H, CONH), 3,50 (кв, 1H, J=7 Гц), 1,30 (д, 3H, J=7 Гц).
(2S)-2-(4-{Метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (14)
Следуя той же методике, что описана для 13, и исходя из (2S)-2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты (9) (0,1 г, 0,30 ммоль), после обработки выделяют соединение 14 (0,096 г, 0,29 ммоль) в виде светло-желтого твердого вещества (97%).
[α]D = +7,8 (c=0,5; CH3OH); 1H-ЯМР (CDCl3): δ 7,45-7,30 (м, 4H), 6,85 (с, 1H), 5,35 (ушир.с, 2H, CONH2), 3,65 (кв, 1H, J=7 Гц), 3,55 (с, 3H), 1,55 (д, 3H, J=7 Гц).
(2S)-2-{4-[(4-трет-Бутил-1,3-тиазол-2-ил)амино]фенил}пропанамид (15)
Следуя той же методике, что описана для 13, и исходя из (2S)-2-{4-[(4-трет-бутил-1,3-тиазол-2-ил)амино]фенил}пропановой кислоты (7) (0,1 г, 0,33 ммоль), после обработки выделяют соединение 15 (0,097 г, 0,32 ммоль) в виде белого твердого вещества типа воска (98%).
[α]D = +10 (c=0,5; CH3OH); 1H-ЯМР (CDCl3): δ 10,45 (ушир.с, 1H, NH), 7,35 (д, 2H, J=7 Гц), 7,30 (д, 2H, J=7 Гц), 6,20 (с, 1H), 5,30 (ушир.с, 2H, CONH2), 3,55 (кв, 1H, J=7 Гц), 1,55 (д, 3H, J=7 Гц), 1,30 (с, 9H).
(2R)-2-{[(2S)-2-(4-{[4-(Трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноил]амино}пропановая кислота (16)
Охлажденный раствор (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты (3) (0,1 г, 0,32 ммоль) и CDI (0,054 г, 0,33 ммоль) в сухом CH2Cl2 (5 мл) перемешивают в течение 1 ч при T=0-5°C. После удаления бани лед-вода, добавляют при энергичном перемешивании смесь гидрохлорида метилового эфира D-аланина (0,045 г, 0,32 ммоль) и TEA (90 мкл, 0,65 ммоль), и полученную смесь перемешивают в течение ночи при комнатной температуре. При полном исчезновении исходного вещества, добавляют буферный раствор H3PO4/H2PO4 (pH 2,0, 5 мл) и реакционную смесь переносят в делительную воронку. Две фазы разделяют, и органическую фазу промывают тем же буфером (3×5 мл), сушат над Na2SO4 и упаривают в вакууме с получением сырого продукта, который очищают флэш хроматографией. Очищенный метил-(2R)-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноил]амино}пропаноат (0,1 г, 0,25 ммоль) выделяют в виде желтого масла (78%).
К раствору сложного метилового эфира (0,1 гр., 0,25 моль) в 1,4-диоксане (5 мл) добавляют 1М NaOH (0,25 мл) и реакционную смесь перемешивают в течение ночи при комнатной температуре. После гашения буферным раствором H3PO4/H2PO4 (pH 2,0, 5 мл) реакционную смесь переносят в делительную воронку, две фазы разделяют и водный слой экстрагируют CH2Cl2 (3×5 мл); собранные органические экстракты сушат над Na2SO4 и упаривают в вакууме, получая очищенное соединение 16 (0,093 г, 0,29 ммоль) в виде белого воскообразного твердого вещества (97%).
[α]D = +28,7 (c=0,5; CH3OH); 1H-ЯМР (CDCl3): δ 9,45 (ушир.с, 1H, NH), 7,30-7,15 (м, 4H), 7,00 (с, 1H), 6,35 (ушир.с, 1H, CONH), 4,45 (м, 1H) 3,50 (кв, 1H, J=7 Гц), 1,45 (д, 3H, J=7 Гц), 1,35 (д, 3H, J=7 Гц).
(2S)-3-Метил-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноил]амино}бутановая кислота (17)
Следуя той же методике, что описана для 16, и исходя из (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты (3) (0,18 г, 0,57 ммоль) и гидрохлорида метилового эфира L-валина (0,095 г, 0,57 ммоль), после обработки выделяют соединение 17 (0,093 г, 0,23 ммоль) в виде белого твердого вещества (69%).
Т.пл. 99-101°C; 1H-ЯМР (CDCl3): δ 10,40 (ушир.с, 1H, NH), 7,45 (д, 2H, J=7 Гц), 7,25 (д, 2H, J=7 Гц), 7,00 (с, 1H), 5,85 (ушир.с, 1H, CONH), 4,70 (м, 1H) 3,75 (кв, 1H, J=7 Гц), 2,30 (м, 1H), 1,65 (д, 3H, J=7 Гц), 0,90 (д, 3H, J=7 Гц), 0,75 (д, 3H, J=7 Гц).
2-{4-[(4-Трифторметил)оксазол-2-ил]амино}фенилпропионовая кислота (18)
Следуя той же методике, что описана для 1, и исходя из промежуточного метил-2-[4-(карбамоиламино)фенил]пропаноата (10 г, 45 ммоль), после обработки и гидролиза сложного метилового эфира, выделяют соединение 18 (9,32 г, 31,05 ммоль) в виде светло-коричневого масла (69%).
1H-ЯМР (ДМСО-d6): δ 12,45 (ушир.с, 1H, COOH), 10,45 (с, 1H, NH), 8,35 (с, 1H), 7,45 (д, 2H, J=7 Гц); 7,25 (д, 2H, J=7д Гц); 3,70 (м, 1H); 1,25 (д, 3H, J=7 Гц).
(2S)-2-(4-{[4-(Трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановая кислота (19)
Следуя той же методике, что описана для 3, и исходя из промежуточного (2S)-метил-2-[4-(карбамоиламино)фенил]пропаноата (5 г, 22,5 ммоль), после обработки и гидролиза сложного метилового эфира, выделяют соединение 19 (3,38 г, 11,25 ммоль) в виде светло-коричневого масла (50%).
[α]D = +54 (c=0,5; EtOAc); 1H-ЯМР (ДМСО-d6): δ 12,45 (ушир.с, 1H, COOH), 10,45 (ушир.с, 1H, NH), 8,35 (с, 1H), 7,45 (д, 2H, J=7 Гц); 7,25 (дd, 2H, J=7 Гц); 3,70 (м, 1H); 1,25 (д, 3H, J=7 Гц).
(2S)-2-(4-{Метил-[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановая кислота (20)
Следуя той же методике, что описана для 9, и исходя из промежуточного метил-(2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропаноата (0,1 г, 0,32 ммоль), после обработки и гидролиза сложного метилового эфира, выделяют соединение 20 (0,053 г, 0,17 ммоль) в виде светло-коричневого масла (53%).
[α]D = +38 (c=1; EtOAc); 1H-ЯМР (ДМСО-d6): δ 12,45 (ушир.с, 1H, COOH), 8,35 (с, 1H), 7,45-7,25 (м, 4H); 3,80 (м, 1H); 3,40 (с, 3H); 1,40 (д, 3H, J=7 Гц).
(2S)-N-(Метилсульфонил)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид (21)
Следуя той же методике, что описана для 11, и исходя из (2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановой кислоты (19) (0,1 г, 0,33 ммоль), после обработки выделяют соединение 21 (0,084 г, 0,23 ммоль) в виде желтого масла (70%).
[α]D = +39 (c=0,5; ацетон); 1H-ЯМР (CDCl3): δ 11,25 (ушир.с, 1H, NHSO2CH3); 9,45 (ушир.с, 1H, NH), 7,50 (м, 3H), 7,15 (д, 2H, J=7 Гц); 3.65 (м, 1H); 3,10 (с, 3H), 1,40 (д, 3H, J=7 Гц).
(2S)-2-(4-{[4-(Трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид (22)
Следуя той же методике, что описана для 13, и исходя из (2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановой кислоты (19) (0,2 г, 0,67 ммоль), после обработки выделяют соединение 22 (0,195 г, 0,65 ммоль) в виде желтого масла (97%).
Т.пл. 119°-121°C; [α]D = +36 (c=1; EtOAc); 1H-ЯМР (ДМСО-d6): δ 10,45 (ушир.с, 1H, NH), 8,35 (с, 1H), 7,45 (д, 2H, J=7 Гц); 7,25 (д, 2H, J=7 Гц); 6,80 (ушир.с, 2H, CONH2); 3,50 (м, 1H); 1,25 (д, 3H,J=7 Гц).
(2S)-2-(4-{Метил-[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид (23)
Следуя той же методике, что описана для 13, и исходя из (2S)-2-(4-{метил-[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановой кислоты (20) (0,065 г, 0,21 ммоль), после обработки выделяют очищенное соединение 23 (0,062 г, 0,20 ммоль) в виде желтого масла (95%).
[α]D = +18 (c=0,64; CH2Cl2); 1H-ЯМР (ДМСО-d6): δ 8,35 (с, 1H), 7,45 (д, 2H, J=7 Гц); 7,25 (д, 2H, J=7 Гц); 6,80 (ушир.с, 2H, CONH2); 3,50 (м, 1H); 3,40 (с, 3H); 1,25 (д, 3H, J=7 Гц).
(2S)-2-{[(2S)-2-(4-{[4-(Трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропаноил]амино}пропановая кислота (24)
Следуя той же методике, что описана для 16, и исходя из (2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановой кислоты (19) (0,118 г, 0,39 ммоль) и гидрохлорида метилового эфира L-аланина (0,035 г, 0,39 ммоль), после обработки и гидролиза сложного метилового эфира, выделяют очищенное соединение 24 (0,112 г, 0,29 ммоль) в виде светло-желтого масла (75%).
1H-ЯМР (CDCl3): δ 9,60 (ушир.с, 1H, NH); 7,70 (с, 1H), 7,45 (м, 4H), 6,00 (ушир.с, 1H, CONH), 4,60 (м, 1H); 3,70 (м, 1H); 1,60 (д, 3H, J=7 Гц), 1,35 (д, 3H, J=7 Гц).
(2S)-N-[(1S)-2-Амино-1-метил-2-оксоэтил]-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид (25)
Следуя той же методике, что описана для 13, и исходя из (2S)-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропаноил]амино}пропановой кислоты (24), после обработки выделяют очищенное соединение 25 (0,103 г, 0,28 ммоль) в виде прозрачного масла (93%).
1H-ЯМР (CDCl3): δ 9,60 (ушир.с, 1H, NH); 7,70 (с, 1H), 7,45 (м, 4H), 6,00 (ушир.с, 1H, CONH), 5,25 (ушир.с, 2H, CONH2) 4,60 (м, 1H); 3,70 (м, 1H); 1,60 (д, 3H, J=7 Гц), 1,35 (д, 3H, J=7 Гц).
Биологическая активность предпочтительных соединений
Дополнительные примеры
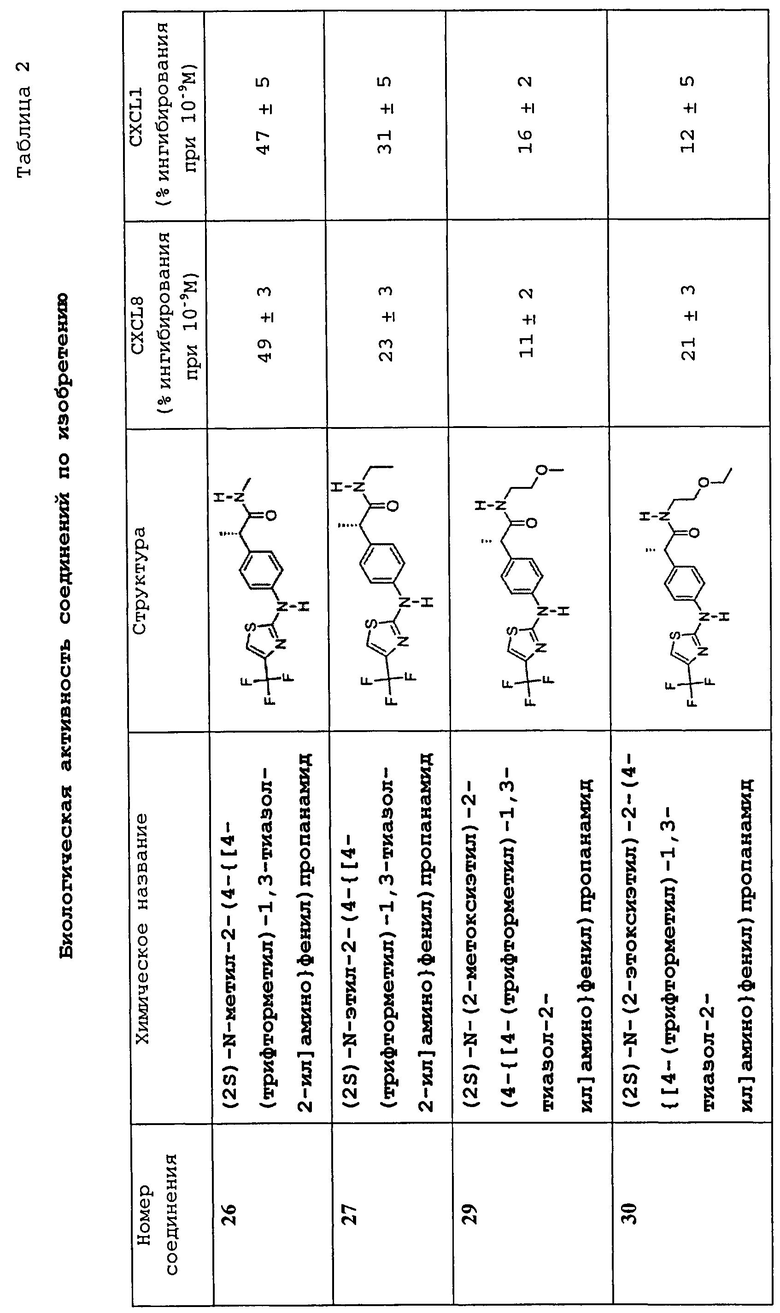
(2S)-N-метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (26)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (63 мг, 0,199 ммоль) и гидрохлорида метиламина (27 мг, 0,398 ммоль), соединение 26 было получено в виде светло-коричневого твердого вещества (41 мг, выход = 63%). MC (ES1+) m/z: 330, 11 (M+1).
(2S)-N-этил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (27)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (56 мг, 0,177 ммоль) и гидрохлорида этанамина (29 мг, 0,354 ммоль), соединение 27 было получено в виде коричневого твердого вещества (39 мг, выход = 65%). MC (ES1+) m/z: 344,15 (M+1).
(2S)-N-(2-метоксиэтил)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (29)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (61 мг, 0,19 ммоль) и 2-метоксиэтиламина (38 мкл, 0,437 ммоль), соединение 29 было получено в виде светлого твердого вещества (49 мг, выход = 70%). MC (ES1+) m/z: 374,25 (M+1).
(2S)-N-(2-эвоксиэтил)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (30)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (58 мг, 0,18 ммоль) и 2-этоксиэтиламина (41 мг,0,46 ммоль), соединение 30 было получено в виде белого твердого вещества (46 мг, выход = 66%). MC (ES1+) m/z: 388,31 (M+1).
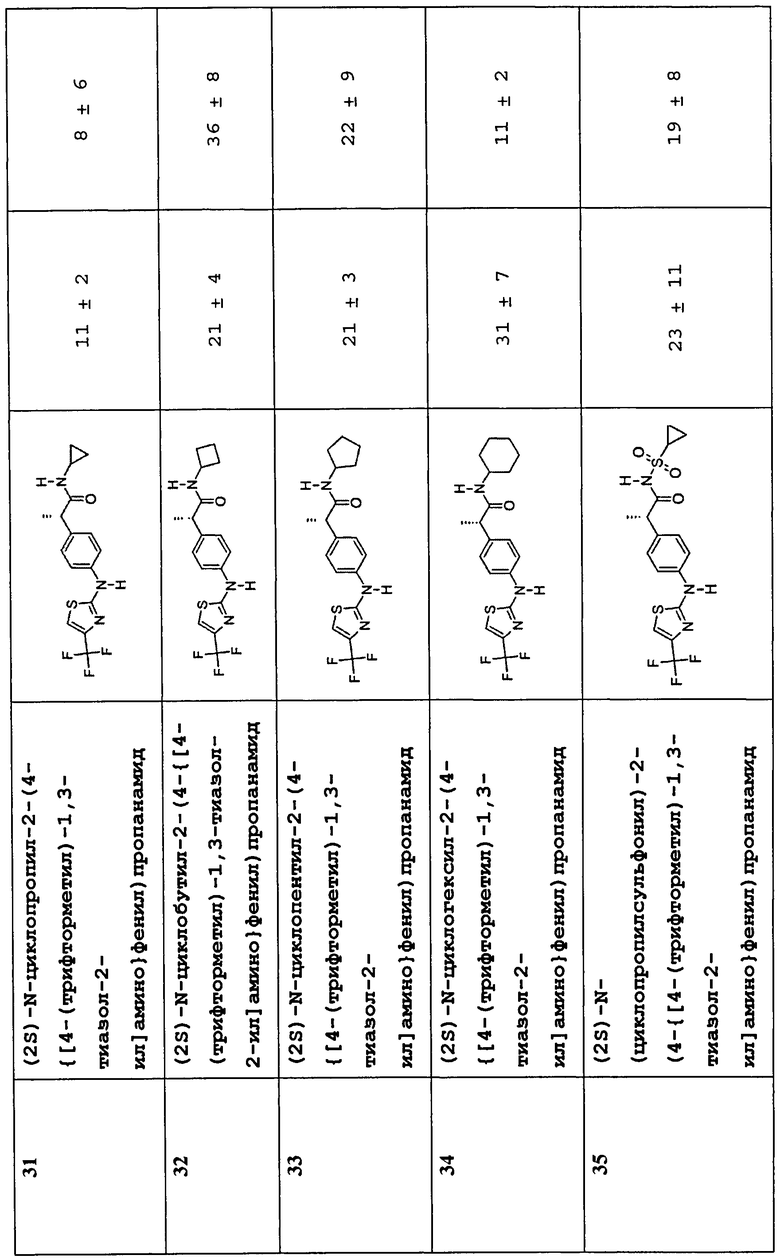
(2S)-N-циклопропил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (31)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (68 мг, 0,21 ммоль) и циклопропанамина (45 мкл, 0,644 ммоль), соединение 31 было получено в виде светло-желтого твердого вещества (42 мг, y = 57%). MC (ES1+) m/z: 356,22 (M+1).
(2S)-N-циклобутил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (32)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (65 мг, 0,20 ммоль) и циклобутанамина (53 мкл, 0,62 ммоль), соединение 32 было получено в виде белого твердого вещества (43 мг, выход = 59%). MC (ES1+) m/z: 370,22 (M+1).
(2S)-N-циклопентил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (33)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (62 мг, 0,19 ммоль) и циклопентанамина (58 мкл, 0,59 ммоль), соединение 33 было получено в виде бесцветного масла (55 мг, у=79%). MC (ES1+) m/z: 384,33 (M+1).
(2S)-N-циклогексил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (34)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (63 мг, 0,20 ммоль) и циклопентанамина (69 мкл, 0,60 ммоль), соединение 34 было получено в виде желтого масла (56 мг, выход = 71%). MC (ES1+) m/z: 398,39 (M+1).
(2S)-N-(циклопропилсульфонил)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (35)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (60 мг, 0,19 ммоль) и циклопропансульфонамида (69 мг, 0,57 ммоль), соединение 35 было получено в виде беловатого твердого вещества (33 мг, выход = 41%). MC (ES1+) m/z: 420,23 (M+1).
Общая методика A
В ампулу для СВЧ-обработки помещали Pd2(dba)3 (0,03 ммоль) и 2-(ди-трет-бутилфосфино)-2′,4′,6′-триизопропил-3,6-диметокси-1,1′-бифенил, (трет-BuBrettPhos, 0,06 ммоль). Ампулу укупоривали и затем дважды вакуумировали и заполняли аргоном. После этого с помощью шприца добавляли безводный трет-BuOH (0,5 мл) и полученную смесь перемешивали при 120°C в течение 3 минут. Во вторую ампулу для СВЧ-обработки помещали 1H-имидазол-2-амин (1,1 ммоль), метил-2-(4-бромфенил)пропаноат (1,0 ммоль), K3PO4 (1,5 ммоль) и безводный трет-BuOH (2 мл). Ампулу укупоривали и затем дважды вакуумировали и заполняли аргоном. После этого во вторую ампулу с помощью шприца добавляли предварительно нагретый раствор катализатора, и реакционную смесь подвергали СВЧ-облучению при 140°C в течение 50 минут.
Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, промывали водой, сушили над Na2SO4 и удаляли в вакууме растворитель. Сырой продукт очищали с помощью флэш-хроматографии (CH2Cl2/MeOH, 95:5) и получали рацемическую смесь. Полученное соединение растворяли в 5 мл 1,4-диоксана и к раствору добавляли 2 мл 1N раствора NaOH. Смесь перемешивали в течение 2 часов. Остаток разбавляли этилацетатом (20 мл) и промывали водой (2×10 мл). После сушки над Na2SO4 растворитель удаляли в вакууме. Хиральные разделения проводили с помощью хроматографии со сверхкритической подвижной фазой (SFC) с использованием детекторной системы Waters Prep 100 SFC MS и колонок CHIRALPAK AD-H и CHIRALPAK AS-H (5 µ, 250×10 мм). Элюент представлял собой смесь состава метанол/диоксид углерода в соотношении 20:80 при скорости потока 5 мл/мин.
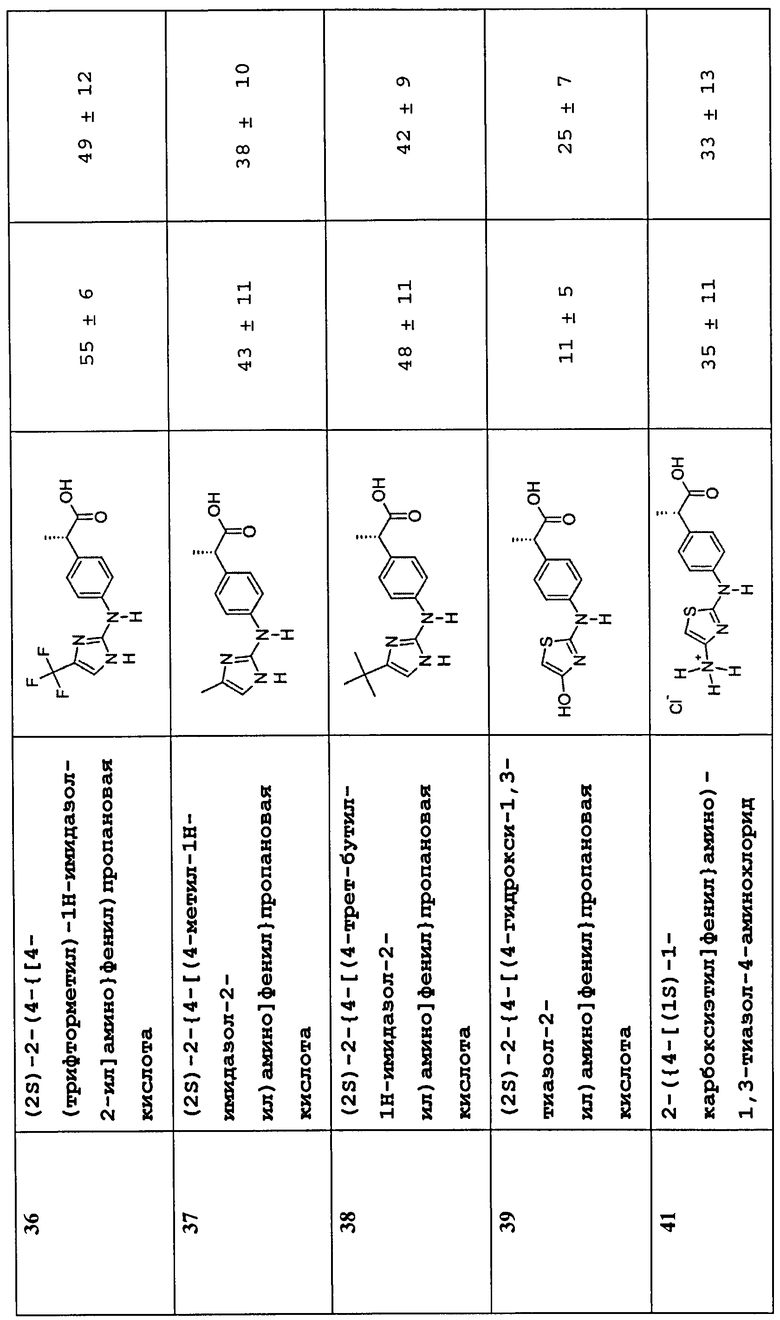
(2S)-2-(4-{[4-(трифторметил)-1H-имидазол-2-ил]амино}фенил)пропановая кислота (36)
В соответствии с общей методикой A и исходя из 4-(трифторметил)-1H-имидазол-2-амина, соединение 36 было получено в виде бледно-желтого масла после хирального разделения с помощью SFC-MS на колонке CHIRALPAK AD-H (13 мг, выход = 29%). 1H-ЯМР (DMSO-d6): δ 12,32 (ушир. c, 1H), 10,60 (ушир. c, 1H), 7,65 (с, 1H), 7,58 (д, 2H, J = 7 Гц), 7,27 (д, 2H, J = 7 Гц), 3,73 (д, 1H, J = 7 Гц), 1,40 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 300, 12 (M+1).
(2S)-2-{4-[(4-метил-1H-имидазол-2-ил)амино]фенил}пропановая кислота (37)
В соответствии с общей методикой A и исходя из 4-метил-1H-имидазол-2-амина, соединение 37 было получено в виде светло-коричневого масла после хирального разделения с помощью SFC-MS на колонке CHIRALPAK AD-H (12 мг, выход = 28%). 1H-ЯМР (DMSO-d6): δ 12,12 (ушир. c, 1H), 10,32 (ушир. c, 1H), 7,50 (д, 2H, J = 7 Гц), 7,31 (м, 1H), 7,23 (д, 2H, J = 7 Гц), 3,80 (д, 1H, J = 7 Гц), 2,2 (с, 3H), 1,43 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 246, 18 (M+1).
(2S)-2-{4-[(4-трет-бутил-1H-имидазол-2-ил)амино]фенил}пропановая кислота (38)
В соответствии с общей методикой А и исходя из 4-метил-1H-имидазол-2-амина, соединение 38 было получено в виде темно-оранжевого масла после хирального разделения с помощью SFC-MS на колонке CHIRALPAK AS-H (15 мг, выход = 33%). 1H-ЯМР (DMSO-d6): δ 12,13 (ушир. с, 1H), 10,38 (ушир. с, 1H), 7,52 (д, 2H, J = 7 Гц), 7,29 (м, 1H), 7,23 (д, 2H, J = 7 Гц), 3,76 (д, 1H, J = 7 Гц), 2,22 (с, 9Н), 1,44 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 288,23 (M+1).
(2S)-2-{4-[(4-гидрокси-1,3-тиазол-2-ил)амино]фенил}пропановая кислота (39)
В круглодонную колбу емкостью 50 мл, снабженную холодильником и магнитной мешалкой, загружали метил-(2S)-2-(4-аминофенил)пропионат (410 мг, 2,29 ммоль), этилхлорацетат (245 мкл, 2,29 ммоль) и 10 мл абсолютного этанола. Смесь нагревали при 80°C в течение 2 часов с контролем уровня конверсии с помощью ВЭЖХ-MC. Раствор охлаждали до комнатной температуры и оставляли перемешиваться до полного осаждения метил-(2S)-2-{4-[(4-гидрокси-1,3-тиазол-2-ил)амино]фенил}пропаноата. Твердое вещество отфильтровывали и высушивали под вакуумом при 50°C в течение 4 часов и использовали на следующей стадии без дальнейшей очистки. Соединение растворяли в растворе ледяной уксусной кислоты (10 мл) и 37% HCl (5 мл) и нагревали с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуре остаток разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (3×10 мл). Органические слои высушивали над Na2SO4 и выпаривали в вакууме с получением (2S)-2-{4-[(4-гидрокси-1,3-тиазол-2-ил)амино]фенил}пропионовой кислоты (393 мг, выход = 65%) в виде белого твердого вещества. [α]D = +30 (с = 1; MeOH); 1H-ЯМР (DMSO-d6): δ 12,20 (ушир. с, 1H), 11,05 (ушир. с, 1H), 10,13 (ушир. с, 1H), 7,45 (с, 1H), 7,38 (д, 2H, J = 7 Гц), 7,27 (д, 2H, J = 7 Гц), 3,80 (д, 1H, J = 7 Гц), 1,53 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 265,18 (M+1).
2-({4-[(1S)-1-карбоксиэтил]фенил}амино)-1,3-тиазол-4-аминохлорид (41)
В ампулу для СВЧ-обработки помещали Pd2(dba)3 (7,0 мг, 0,0076 ммоль), ксантфос (Xantphos, 13 мг, 0,022 ммоль) и 5 мл сухого ТГФ в атмосфере аргона. Смесь перемешивали при комнатной температуре в течение 20 минут. Затем добавляли метил-(2S)-2-{4-[(4-{ [(трифторметил)сульфонил]окси}-1,3-тиазол-2-ил)амино]фенил}пропаноат (104 мг, 0,25 ммоль), трет-бутилкарбамат (35 мг, 0,3 ммоль) и K3PO4 (74 мг, 0,35 ммоль) и полученную в результате смесь подвергали СВЧ-облучению при 135°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc, промывали водой, высушивали над Na2SO4 и выпаривали в вакууме. Смесь очищали флэш-хроматографией (CH2Cl2/MeOH в соотношении 95:5+2%-ный водный NH4OH) с получением метил-(2S)-2-[4-({4-[(трет-бутоксикарбонил)амино]-1,3-тиазол-2-ил}амино)фенил]пропаноата в виде светло-желтого масла (56 мг, выход = 59%). Соединение растворяли в 5 мл 1,4-диоксана и добавляли 1 мл 37%-ной HCl. Смесь нагревали с обратным холодильником в течение 1 часа. После охлаждения при комнатной температуре остаток упаривали в вакууме. Твердое вещество растирали с 15 мл метанола. После фильтрации MeOH выпаривали в вакууме, получая 2-({4-[(1S)-1-карбоксиэтил]фенил}амино)-1,3-тиазол-4-аминохлорид в виде оранжевого твердого вещества (42 мг, выход = 95%). [α]D = +41 (с = 0,5; MeOH); 1H-ЯМР (D2O): δ 7,53 (д, 2H, J = 7 Гц), 7,38 (д, 2H, J = 7 Гц), 7,22 (с, 1H), 3,85 (д, 1H, J = 7 Гц), 1,55 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 264,32 (M+1).
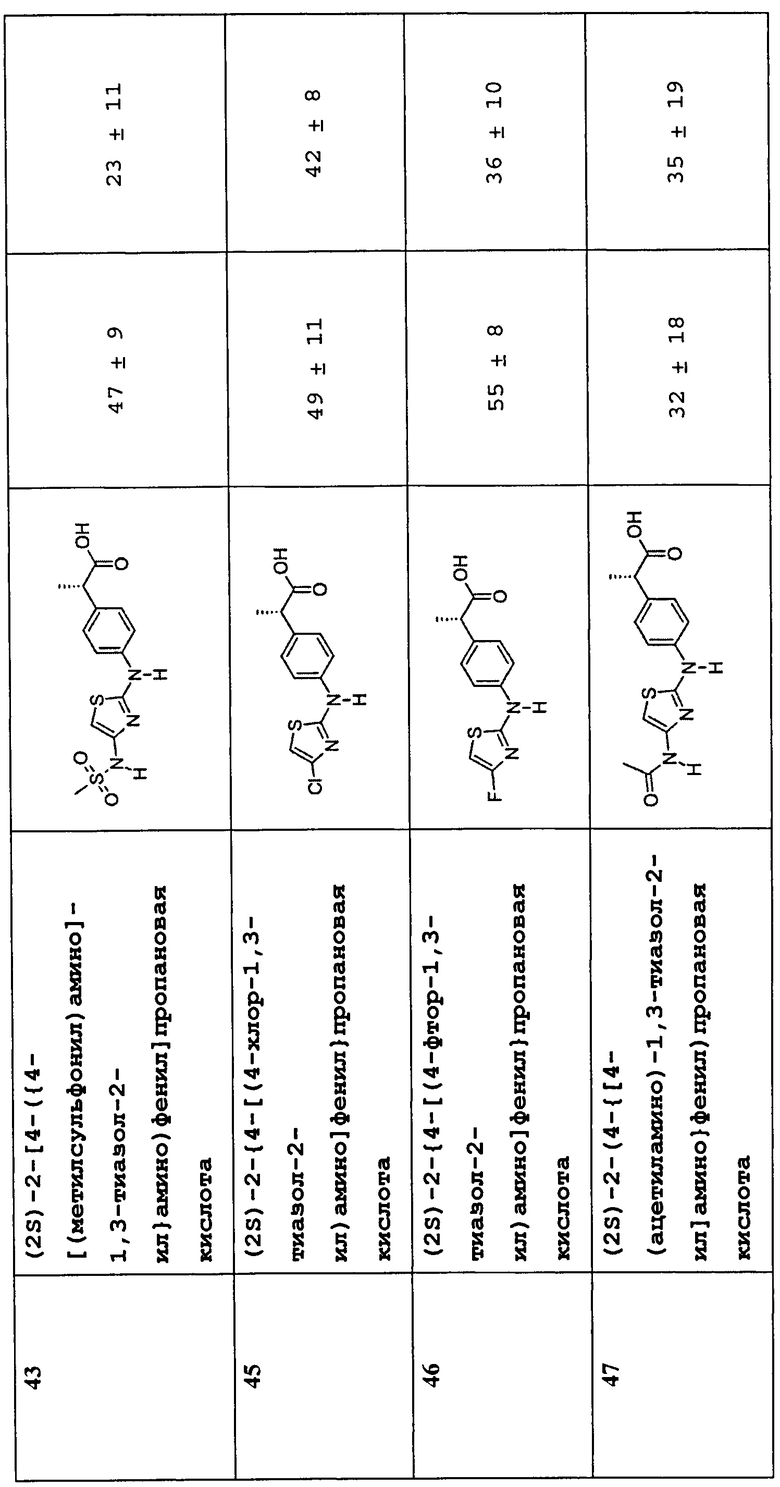
(2S)-2-[4-({4-[(метилсульфонил)амино]-1,3-тиазол-2-ил}амино)фенил]пропановая кислота (43)
Следуя той же методике, как и описанная для получения соединения 42, и исходя из соединения 41 (80 мг, 0,27 ммоль) и метансульфонилхлорида (25 мкл, 0,32 ммоль), соединение 43 было получено в виде темно-оранжевого масла после флэш-хроматографии с использованием в качестве элюента смеси CH2Cl2/MeOH в соотношении 95:5 (39 мг, выход = 42%). [α]D = +21 (с = 0,5; MeOH). 1H-ЯМР (CDCl3): δ 9,30 (ушир. с, 1H), 7,40 (д, 2H, J = 7 Гц), 7,20 (д, 2H, J = 7 Гц), 7,16 (с, 1H), 6,52 (ушир. с, 1H), 3,77 (д, 1H, J = 7 Гц), 3,20 (с, 3H), 1,53 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 342,31 (M+1).
(2S)-2-{4-[(4-хлор-1,3-тиазол-2-ил)амино]фенил}пропановая кислота (45)
Безводный хлорид меди (II) (26 мг, 0,19 ммоль) добавляли к раствору изоамилнитрита (32 мкл, 0,24 ммоль) в безводном ацетонитриле (5 мл). В результате получили зеленый раствор. Смесь перемешивали при комнатной температуре в течение 20 минут, затем по каплям с помощью шприца добавляли раствор метил-(2S)-2-[4-({4-[(трет-бутоксикарбонил)амино]-1,3-тиазол-2-ил}амино)фенил]пропаноата (50 мг, 0,18 ммоль) в безводном ацетонитриле (3 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили водой (10 мл). Смесь экстрагировали с использованием EtOAc (2×10 мл) и органические слои высушивали над Na2SO4, отфильтровывали и упаривали. Затем маслянистое твердое вещество очищали с помощью флеш-хроматографии (н-гексан/EtOAc в соотношении 8:2) с получением метил-(2S)-2-{4-[(4-хлор-1,3-тиазол-2-ил)амино]фенил}пропаноата в виде бледно-оранжевого твердого вещества (41 мг, выход = 77%). Соединение растворяли в 5 мл 1,4-диоксана и добавляли 1 мл 37%-ной HCl. Смесь нагревали с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры остаток растворяли в EtOAc (20 мл) и промывали водой (2×10 мл). Продукт высушивали над Na2SO4 и растворитель удаляли под вакуумом, получая соединение 45 в виде светлого твердого продукта (39 мг, выход - количественный). [α]D = +38 (с = 0,5; MeOH); 1H-ЯМР (CDCl3): δ 9,15 (ушир. с, 1H), 7,42 (д, 2H, J = 7 Гц), 7,21 (д, 2H, J = 7 Гц), 7,05 (с, 1H), 3,80 (д, 1H, J = 7 Гц), 1,50 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 283,59 (M+1).
(2S) -2- {4- [(4-фтор-1,3-тиазол-2-ил) амино] фенил}пропановая кислота (46)
Метил-(2S)-2-[4-({4-[(трет-бутоксикарбонил)амино]-1,3-тиазол-2-ил}амино)фенил]пропаноат (50 мг, 0,18 ммоль) растворяли в 6 мл безводного толуола. Раствор охлаждали до -10°C и затем добавляли диэтилэфират трехфтористого бора (30 мкл, 0,24 ммоль) и изоамилнитрит (32 мкл, 0,24 ммоль). В результате получили темно-красный раствор. Полученную смесь перемешивали в течение еще 10 минут при -10°C, а затем в течение 30 минут при 0°C. После этого раствор нагревали при 100°C в течение 30 минут. Ход реакции контролировали с помощью ВЭЖХ-MC. Смесь гасили насыщенным раствором NH4C1. Затем смесь разбавляли толуолом и отделяли органические слои, высушивали над Na2SO4, отфильтровывали и упаривали. Затем смесь очищали с помощью флеш-хроматографии (н-гексан/EtOAc в соотношении 8:2) с получением метил(2S)-2-{4-[(4-фтор-1,3-тиазол-2-ил)амино]фенил}пропаноата в виде красноватого масла (28 мг, выход = 56%). Полученное соединение растворяли в 5 мл 1,4-диоксана и добавляли 1 мл 37%-ной HCl. Смесь нагревали с обратным холодильником в течение 1 часа. После охлаждения до комнатной температуре остаток растворяли в EtOAc (20 мл) и промывали водой (2×10 мл). После сушки над Na2SO4 растворитель удаляли в вакууме, получая соединение 46 в виде оранжевого твердого вещества (27 мг, выход - количественный). [α]D = +33 (c = 0,2; MeOH); 1H-ЯМР (CDCl3): 5 9,20 (ушир. с, 1H), 7,41 (д, 2H, J = 7 Гц), 7,25 (д, 2H, J = 7 Гц), 7,15 (с, 1H), 3,80 (д, 1H, J = 7 Гц), 1,50 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 267,09 (M+1).
(2S)-2-(4-{[4-(ацетиламино)-1,3-тиаэол-2-ил]амино}фенил)пропановая кислота (47)
К раствору соединения 41 (60 мг, 0,19 ммоль) в 5 мл безводного ТГФ добавляли DMAP (58 мг, 0,478 ммоль) и ацетилхлорид (27 мкл, 0,38 ммоль), и раствор перемешивали при 50°C в течение 1 часа. Затем смесь очищали флэш-хроматографией (CH2Cl2/MeOH 8:02+0,1% уксусной кислоты), получая соединение 47 в виде белого твердого вещества (21 мг, выход = 36%). [α]D = +21 (с = 0,2; MeOH); 1H-ЯМР (CDCl3): δ 9,23 (ушир. с, 1H), 8,60 (ушир. с, 1H), 7,41 (д, 2H, J = 7 Гц), 7,22 (д, 2H, J = 7 Гц), 7,13 (с, 1H), 3,77 (д, 1H, J = 7 Гц), 2,12 (с, 3H), 1,53 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 306,23 (M+1).
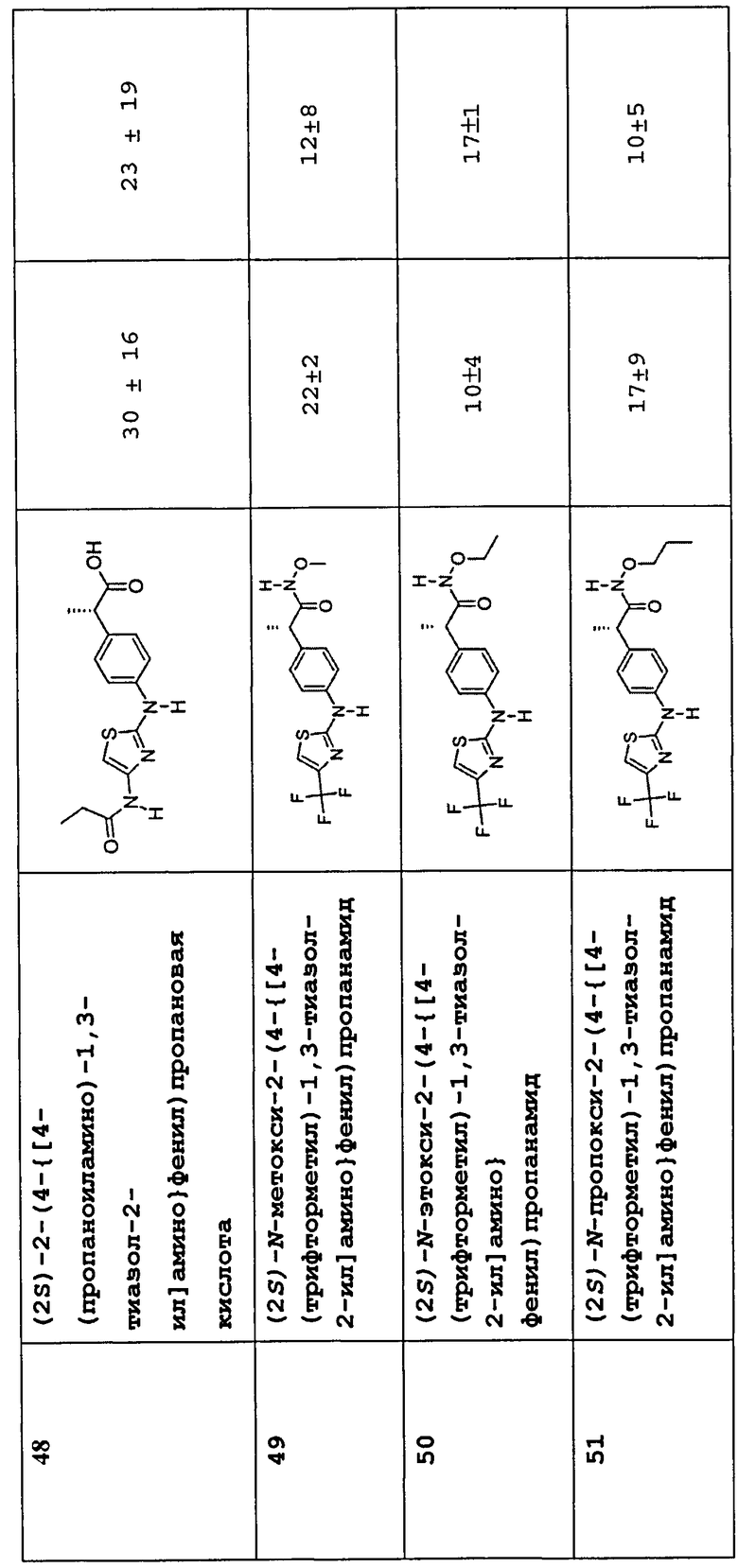
(2S)-2-(4-{[4-(пропаноиламино)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота (48)
В соответствии с процедурой, описанной для соединения 47, соединение 48 синтезировали исходя из соединения 41 (60 мг, 0,19 ммоль) и пропионилхлорида (33 мкл, 0,38 ммоль), получая, после флэш-хроматографии (CH2Cl2/MeOH в соотношении 8:02+0,1% уксусной кислоты), продукт в виде белого твердого вещества (25 мг, выход = 41%). [α]D = +20 (с = 0,2; MeOH); 1H-ЯМР (CDCl3): δ 9,22 (ушир. с, 1H), 8,58 (ушир. с, 1H), 7,40 (д, 2H, J = 7 Гц), 7,20 (Д, 2H, J = 7 Гц), 7,14 (с, 1H), 3,80 (д, 1H, J = 7 Гц), 2,05 (с, 2H), 1,68 (д, 3H, J = 7 Гц), 1,51 (д, 3H, J = 7 Гц). MC (ES1+) m/z: 320,28 (M+1).
(2S)-N-метокси-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (49)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (55 мг, 0,17 ммоль) и гидрохлорида 0-метилгидроксиламина (28 мг, 0,34 ммоль), соединение 49 было получено в виде белого твердого вещества (44 мг, выход = 75%). MC (ES1+) m/z: 346,32 (M+1).
(2S)-N-этокси-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (50)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (61 мг, 0,19 ммоль) и гидрохлорида О-этилгидроксиламина (43 мг, 0,437 ммоль), соединение 50 было получено в виде беловатого твердого вещества (45 мг, выход = 66%). MC (ES1+) m/z: 360,28 (M+1).
(2S)-N-пропокси-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид (51)
В соответствии с процедурой, описанной для соединения 11, и исходя из соединения 3 (58 мг, 0,18 ммоль) и гидрохлорида О-пропилгидроксиламина (51 мг, 0,46 ммоль), соединение 51 было получено в виде белого твердого вещества (48 мг, выход = 72%). MC (ES1+) m/z: 374,28 (M+1).
| название | год | авторы | номер документа |
|---|---|---|---|
| (2R)-2-[(4-СУЛЬФОНИЛ)АМИНОФЕНИЛ]ПРОПАНАМИДЫ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2007 |
|
RU2457201C2 |
| (R)-4-(ГЕТЕРОАРИЛ)ФЕНИЛЭТИЛЬНЫЕ ПРОИЗВОДНЫЕ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2008 |
|
RU2475486C2 |
| ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ И 7-ДЕАЗАПУРИНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2606514C2 |
| НОВЫЕ СОЕДИНЕНИЯ, КОТОРЫЕ МОДУЛИРУЮТ РЕЦЕПТОРЫ ТИПА PPARγ, И ИХ ПРИМЕНЕНИЕ В КОСМЕТИЧЕСКИХ И ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЯХ | 2004 |
|
RU2401836C2 |
| БИАРИЛЬНЫЕ МОНОБАКТАМНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2016 |
|
RU2746129C2 |
| ЗАМЕЩЕННОЕ ПРОПАНАМИДНОЕ ПРОИЗВОДНОЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТАКОЕ ПРОИЗВОДНОЕ | 2006 |
|
RU2394560C2 |
| (R)-АРИЛАЛКИЛАМИНОПРОИЗВОДНЫЕ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2006 |
|
RU2458051C2 |
| ПРОИЗВОДНОЕ СУЛЬФОНАМИДА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2014 |
|
RU2667520C9 |
| ПРОИЗВОДНЫЕ СЕРИНА В КАЧЕСТВЕ АГОНИСТОВ ГРЕЛИНОВЫХ РЕЦЕПТОРОВ | 2015 |
|
RU2695649C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА И ИНДАЗОЛА, ОБЛАДАЮЩИЕ КОНСЕРВИРУЮЩИМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К КЛЕТКАМ, ТКАНЯМ И ОРГАНАМ | 2009 |
|
RU2460525C2 |
Настоящее изобретение относится к соединению формулы (I), где R1 выбирают из H и CH3; R2 выбирают из H и линейного C1-C4-алкила; Х означает ОН или остаток формулы NHR3, где R3 выбирают из H, OH, С1-С5-алкила, С3-С6-циклоалкила, С1-С5-алкокси; неразветвленного или разветвленного С1-С6-алкила, замещенного карбокси-(СООН) группой; остатка формулы SO2R4, где R4 означает С1-С2-алкил, С3-С6-циклоалкил, С1-С3-галогеналкил; Y означает гетероатом, выбранный из S, О и N; Z означает остаток, выбранный из галогена, линейного или разветвленного С1-С4-алкила, гидрокси, амино, С1-С4-ациламино, галоген-С1-С3-алкила, линейного или разветвленного С1-С8-алкансульфонамида, и фармацевтически приемлемым солям указанного соединения. Изобретение также относится к способу получения соединений формулы (I). Соединения применяют для предупреждения и лечения повреждения тканей в составе фармацевтической композиции. Данное изобретение касается применения соединений в лечении таких болезней, как транзиторная ишемия головного мозга, буллезный пемфигоид, ревматоидный артрит, идиопатический фиброз, гломерулонефрит и поражения, вызванные ишемией и реперфузией. Технический результат - (R,S)-2-арилпропионовые кислоты и их соответствующие производные, полезные для профилактики и лечения повреждения тканей, вызванного усиленным рекрутингом полиморфно-ядерных нейтрофилов (ПМЯ-лейкоцитов) на участках воспаления. 4 н. и 7 з.п. ф-лы, 2 табл., 46 пр.
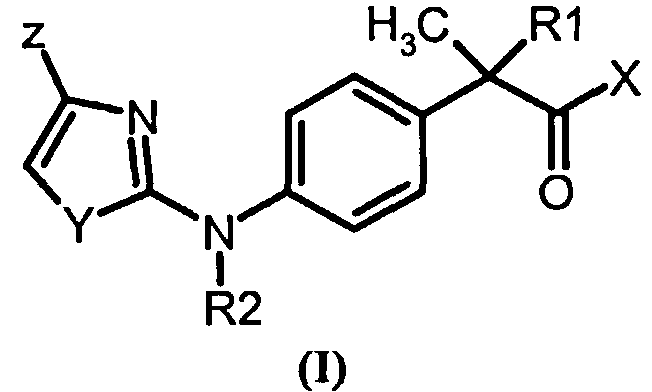
1. Соединения формулы (I)

где
R1 выбирают из
- H и CH3;
R2 выбирают из
- H и линейного C1-C4-алкила;
Х означает ОН или остаток формулы NHR3,
где
R3 выбирают из
- H, OH, С1-С5-алкила, С3-С6-циклоалкила, С1-С5-алкокси;
- неразветвленного или разветвленного С1-С6-алкила, замещенного карбокси-(СООН) группой;
- остатка формулы SO2R4, где R4 означает С1-С2-алкил, С3-С6-циклоалкил, С1-С3-галогеналкил;
Y означает гетероатом, выбранный из
- S, О и N
Z означает остаток, выбранный из
- галогена, линейного или разветвленного С1-С4-алкила, гидрокси, амино, С1-С4-ациламино, галоген-С1-С3-алкила, линейного или разветвленного С1-С8-алкансульфонамида,
и фармацевтически приемлемые соли указанных соединений.
2. Соединение (2S)-N-[(1S)-2-амино-1-метил-2-оксоэтил]-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид.
3. Соединения по п. 1, где атом углерода, связанный с фенильным кольцом формулы I, находится в S-конфигурации.
4. Соединения по п.1, где атом углерода, связанный с фенильным кольцом формулы I, находится в RS-конфигурации.
5. Соединения по п. 1,
где
R1 означает CH3;
R2 выбирают из
- H и CH3;
X означает OH;
Y выбирают из
- S и O;
Z выбирают из
- галогена, линейного или разветвленного С1-С4-алкила, галоген-С1-С3-алкила, линейного или разветвленного С1-С8-алкансульфонамида.
6. Соединения по п. 1, выбранные из
2-[4-(4-трифторметилтиазол-2-ил)аминофенил]пропионовой кислоты;
2-метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты;
(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты;
натриевой соли (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты;
2-{4-[(4-метил-1,3-тиазол-2-ил)амино]фенил}пропановой кислоты;
(2S)-2-{4-[(4-метил-1,3-тиазол-2-ил)амино]фенил}пропановой кислоты;
2-{4-[(4-трет-бутил-1,3-тиазол-2-ил)амино]фенил}пропановой кислоты;
(2S)-2-{4-[(4-трет-бутил-1,3-тиазол-2-ил)амино]фенил}пропановой кислоты;
2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты;
(2S)-2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты;
(2S)-N-гидрокси-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамида;
(2S)-N-(метилсульфонил)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамида;
(2S)-N-[(трифторметил)сульфонил]-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамида;
(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенилпропанамида;
(2S)-2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамида;
(2S)-2-{4-[(4-трет-бутил-1,3-тиазол-2-ил)амино]фенил}пропанамида;
(2R)-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноил]амино}пропановой кислоты;
(2S)-3-метил-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноил]амино}бутановой кислоты;
2-{4-[(4-трифторметил)оксазол-2-ил]амино}фенилпропионовой кислоты;
(2R)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановой кислоты;
(2S)-2-(4-{метил-[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановой кислоты;
(2S)-N-(метилсульфонил)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамида;
(2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамида;
(2S)-2-(4-{метил-[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамида;
(2S)-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропаноил]амино}пропановой кислоты.
7 Соединения по п.6, которым является (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота.
8. Фармацевтическая композиция для предупреждения и лечения повреждения тканей, включающая соединение по любому из пп.1-7 в смеси с подходящим носителем.
9. Соединения по любому из пп.1-7 для применения в лечении заболеваний с вовлечением индуцированного CXCL8 хемотаксиса ПМЯ человека.
10. Соединения по любому из пп.1-7 для применения в лечении таких заболеваний, как транзиторная ишемия головного мозга, поражения, вызванные ишемией и реперфузией, буллезный пемфигоид, ревматоидный артрит, идиопатический фиброз и гломерулонефрит.
11. Способ получения соединений по любому из пп.1-7, включающий стадии: превращение (R,S)- или (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата или (R,S)- или (S)-метил-2-[4-(карбамоиламино)фенил]пропаноата в родственные 4-гетероциклические производные; последующий гидролиз до карбоновой кислоты формулы (I), где X означает OH, взаимодействие с сульфонамидами или аминами, приводящее к соединениям формулы (I), в которой X означает NHR3, где R3, как определен в п.1.
| US 4025528 A, 24.05.1977 | |||
| Вакуумная охлаждаемая ловушка | 1987 |
|
SU1481465A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| WO 00/24710 A1, 04.05.2000 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| EP 1123276 B, 08.01.2003 | |||
| PATANI G.A | |||
| et al: "BIOISOSTERISM: A RATIONAL APPROACH IN DRUG DESIGN", CHEMICAL REVIEWS, 1996, vol.96, no.8, p.3147-3176 | |||
| Способ получения производных тиазола или их солей с щелочными металлами | 1986 |
|
SU1554763A3 |
Авторы
Даты
2014-06-20—Публикация
2009-09-18—Подача