Для данной заявки испрашивается приоритет в соответствии с патентной заявкой США с регистрационным № 62094663, поданной 18 декабря 2014 года, которая включена в настоящий документ в полном объеме посредством этой ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к использованию биологически активных молекул в глазных тканях и, более конкретно, к доставке лютеина в желтое пятно с использованием ионтофореза.
Лютеин (и зеаксантин) связаны со снижением риска развития AMD (возрастной дегенерации желтого пятна) и удалением катаракты из-за его антиоксидантных и фотозащитных эффектов, и его исключительного распределения в желтом пятне глаза1. Возраст является одним из наиболее важных факторов риска для AMD, типично поражающей индивидуумов в возрасте старше 50 лет2-4. Существует два типа AMD, «сухая AMD» и «влажная AMD». Сухая AMD развивается, когда происходит повреждение клеток желтого пятна в результате отложения продуктов жизнедеятельности, называемых «друзами». Это наиболее распространенный и наименее серьезный тип AMD. По оценке, у высокого числа из тех, у кого присутствуют симптомы сухой AMD, будет развиваться влажная AMD, которая развивается, когда прорастают анормальные кровеносные сосуды из-под желтого пятна и ведут к необратимому повреждению клеток2-4.
Лютеин широко используют в пероральных добавках, разумно предполагая, что системная циркуляция может приносить лютеин в циркуляцию сосудистой оболочки глаза для захвата в желтом пятне, через ксантофил-связывающий белок5. Однако, некоторые сообщения показывают, что только небольшая процентная доля лютеина достигает желтого пятна6-8. Кроме того, из-за ограничений барьера глаза терапевтические воздействия в заднем сегменте глаза затруднительны. Поскольку глаз защищен слезной пленкой, роговичным, стекловидным, гематоретинальным и гематоофтальмическим барьерами, очень сложно доставлять лекарственные средства в глаз, конкретно к сетчатке, в достаточных концентрациях и с минимальными побочными эффектами9,10. Применение in situ используют для того, чтобы преодолеть эту проблему; однако медленные системы доставки, такие как импланты, являются очень инвазивными и дорогостоящими. За последние несколько лет результаты многих исследований выявили риски этих воздействий11,12.
В последнее время инъекции лютеина в стекловидное тело используют для того, чтобы окрашивать конкретные преретинальные мембраны и другие структуры глаза во время хирургического вмешательства13-16. Это были первые данные о доставке лютеина in situ в желтое пятно, в которой используют свойственный лютеину окрашивающий эффект. Потенциал лютеина в задержке прогрессирования AMD и предполагаемое нейропротективное действие, показанные в различных исследованиях, еще не доказаны для применения in situ после внутриглазной доставки. Интравитреальная инъекция лютеина в профилактических целях может быть слишком инвазивной в качетве стратегии доставки лютеина в желтое пятно, обладая недостатком слабого одобрения пациентом.
Глазной ионтофорез представляет собой минимально инвазивный способ, используемый для того, чтобы переносить с помощью электрической силы высокие концентрации целевых молекул через склеру или/и через роговицу. Здесь используют небольшой электрический ток, прикладываемый к ионтофоретической камере, содержащей молекулу, представляющую интерес, и наполнитель17. Некоторые сообщения раскрывают, что лютеин, который находят в высоких концентрациях в желтом пятне человеческого глаза, обладает потенциалом задержки прогрессирования AMD, в дополнение к потенциальном нейропротективному действию18-20.
Здесь авторы изобретения сообщают о новом способе доставки лютеина в сетчатку, так что его присутствие в парафовеальной области желтого пятна можно значительно увеличивать и тем самым задерживать прогрессирование AMD и защищать клетки эндотелия сетчатки. Созданы и используются различные системы ионтофоретической доставки для офтальмологического использования, чтобы безопасно и эффективно доставлять лекарственное средство как в передний, так и в задний сегменты человеческого глаза21. Используя эту технологию, возможно доставлять значимые количества биологически активных молекул, в том числе макромолекул, через роговицу и склеру. В работе, о которой сообщается здесь, эмульсию лютеина диффузно доставляли в желтое пятно посредством ионтофореза22-23. Идея состояла в том, чтобы разработать минимально инвазивный способ перемещения высоких концентраций заряженного лютеина, через склеру или/и через роговицу посредством ионтофореза. Авторы изобретения оценивали распределение и концентрацию лютеина в различных глазных тканях с использованием двухфотонной микроскопии, рамановской спектроскопии и ВЭЖХ после склерального и роговичного ионтофоретического нанесения. Основное преимущество этого подхода состоит в использовании медицинского устройства, которое является более безопасным позволяет пациенту легче соблюдать схему лечения, избегая осложнений от частых и высокодозовых инъекций или хирургических имплантаций. Эту процедуру можно осуществлять быстро в кабинете врача во время обычного посещения офтальмолога без необходимости хирургической обстановки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Обнаружено, что ионтофорез, минимально инвазивный способ, в котором используют слабый электрический ток для увеличения проникновения ионизированных соединений в ткани, эффективен для внутриглазной доставки лютеина. Четырнадцать пигментированных кроликов лечили наложением на роговицу и склеру ионтофоретического резервуара, заполненного эмульсией лютеина с использованием или без использования тока (20,0 и 0,0 мА, соответственно). После ионтофореза брали глазные ткани из обоих глаз (тестового и контрольного) и оценивали доставку лютеина посредством визуального сравнения между глазом, который лечили, и контралатеральным глазом, который не лечили. Применение чрезроговичного и транссклерального ионтофореза вело к доставке лютеина в роговицу кролика во всех глазах, которые лечили (время 0 ч). Применение лютеина также создавало след оранжевого цвета на крае склеры и легкую окраску оранжевого цвета в конъюнктиве глаза, показывая транспортировку эмульсии также в эти ткани. В этой работе авторы изобретения показали впервые, что ионтофорез представляет собой эффективный способ для внутриглазной доставки лютеина.
В настоящем изобретении распределение лютеина в глазу после процедуры ионтофореза оценивали для того, чтобы подтверждать, что высокие количества лютеина доставляли в заднюю сетчатку с помощью этого способа. Результаты показывают, что ионтофорез представляет собой эффективный способ доставки положительно заряженной липосомной эмульсии лютеина в глаза кроликов. Кроме того, эксперименты осуществляли с использованием оптимизированных составов эмульсии лютеина и альтернативного ионтофоретического прототипа для того, чтобы оценивать распределение лютеина в различных глазных тканях.
Также осуществляли исследования с использованием трупных глаз человека, на которые слабый электрически ток подавали для того, чтобы оценивать доставку лютеина через роговицу и склеру. Роговицу, склеру, сосудистую оболочку, периферическую и центральную сетчатку из глаз, которые обрабатывали и не обрабатывали, собирали и анализировали с помощью двухфотонной микроскопии для того, чтобы визуализировать распределение лютеин-содержащих липосом.
Транссклеральное ионтофоретическое нанесение вело к доставке лютеина преимущественно в область задней сетчатки, что обнаруживает путь лютеина после ионтофореза, который проходит через ресничное тело/плоскую часть ресничного тела, после чего следует пассивная диффузия до достижения задней сетчатки. Отсутствие лютеина в сосудистой оболочке можно объяснять посредством небольшим размером плотных соединений пигментированного эпителия сетчатки, который ослабляет прохождение более крупных липосомных везикул, тем самым задерживая лютеин во внутренних слоях сетчатки.
В этой работе авторы изобретения впервые продемонстрировали доставку лютеина in situ в задний сегмент глаза через новый, минимально инвазивный способ. Результаты демонстрируют, что склеральный ионтофорез лютеина представляет собой эффективную стратегию доставки лютеина в желтое пятно, которая предоставляет альтернативу для существующих способов, используемых для того, чтобы отсрочивать заболевания в заднем сегменте глаза, такие как AMD.
Ионтофорез обладает преимуществом минимально инвазивного способа и, следовательно, более безопасен, чем альтернативные способы внутриглазной доставки соединений, а именно, импланты и внутриглазные инъекции. Следовательно, ионтофорез будет иметь более высокое соблюдение пациентом схемы лечения, поскольку он избегает осложнений хирургической имплантации или частых и высокодозовых интравитреальных инъекций. Другое преимущество состоит в том, что этот способ является менее дорогостоящим, чем те процедуры, и его можно осуществлять быстро в кабинете врача во время обычного посещения офтальмолога без необходимости хирургической обстановки.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Файл патента или заявки содержит по меньшей мере одну фигуру, выполненную в цвете. Копии публикации этого патента или патентной заявки с цветными фиг. будет предоставлен в Бюро после запроса и оплаты необходимой пошлины.
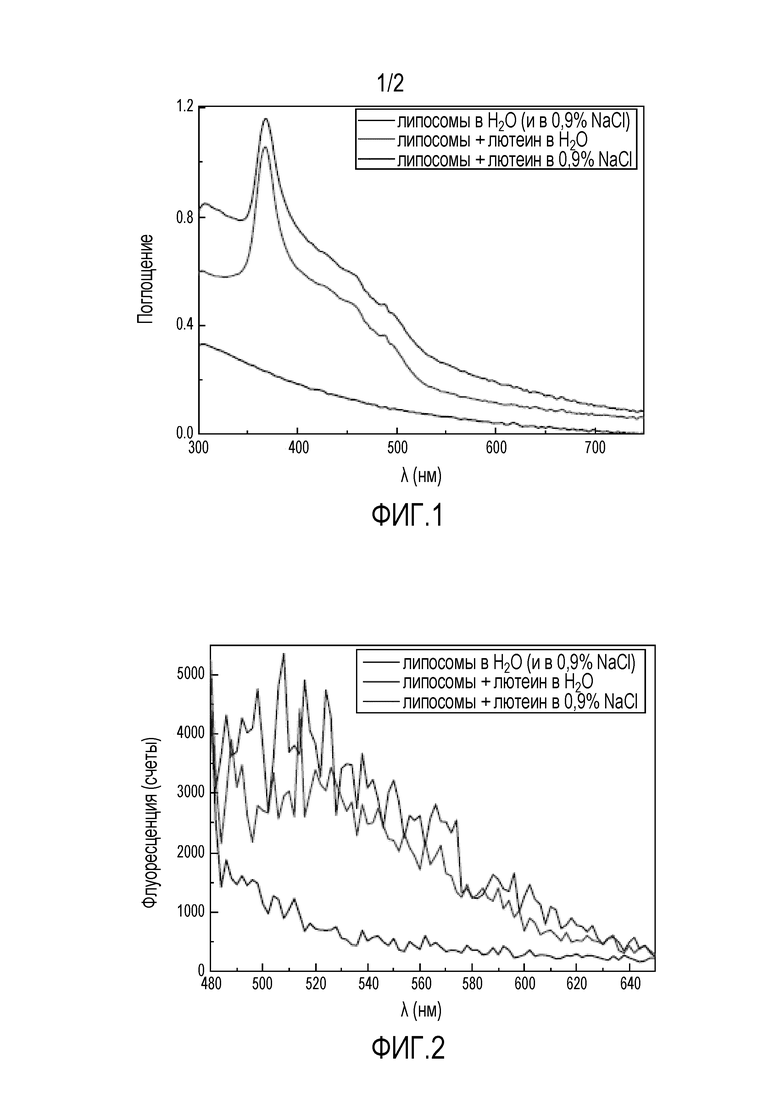
На фиг. 1 представлен график абсорбционных спектров Lipo+ (от 300 до 750 нм), разведение 1:50 в 0,9% NaCl (синий) или дистиллированной воде (красный); представлен контрольный спектр (раствор липосом без лютеина).
На фиг. 2 представлен график спектров флуоресценции Lipo+ (от 480 до 650 нм), разведение 1:50 в 0,9% NaCl (синий) или дистиллированной воде (красный); представлен контрольный спектр (раствор липосом без лютеина).
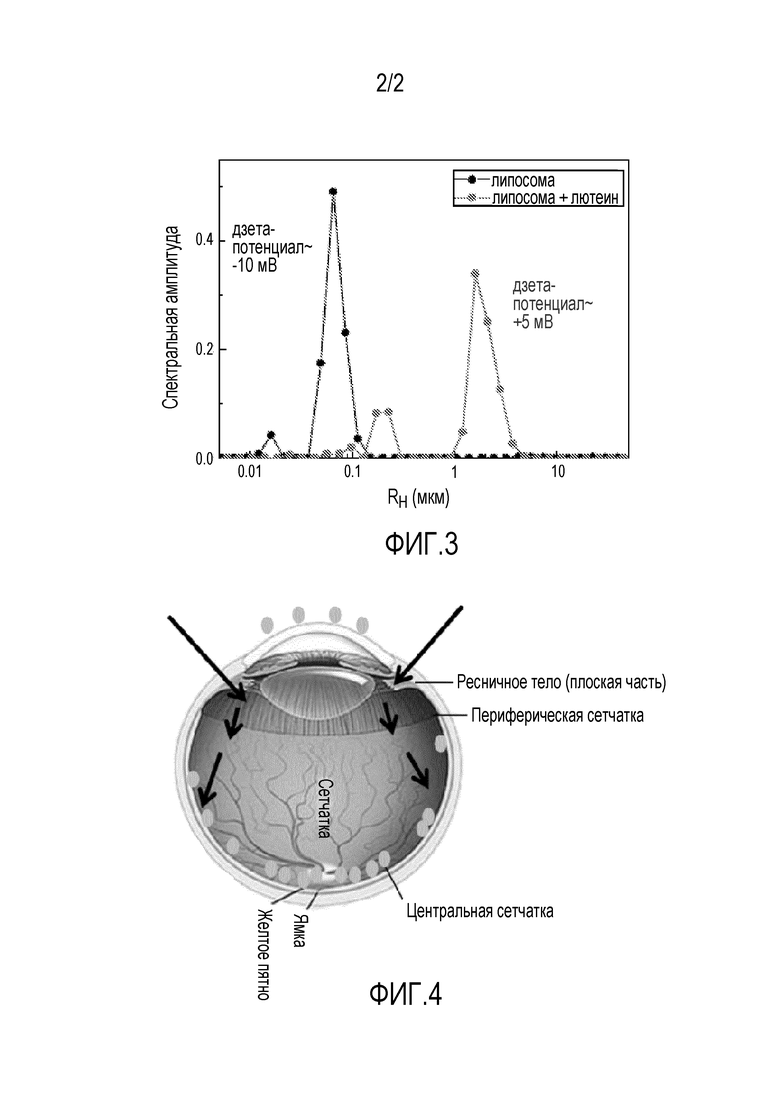
На фиг. 3 представлен график динамического рассеяния света и электрофоретической подвижности для того, чтобы оценивать распределение размеров частиц и заряд раствора Lipo+: тестировали разведение 1:50 в дистиллированной воде (красный) и также разведение липосом в воде 1:50 (без лютеина) в качестве контроля.
На фиг. 4 приведено схематическое представление траектории лютеина после применения ионтофореза; при склеральном нанесении лютеин откладывается в задней части глаза, тогда как при роговичном нанесении лютеин остается на верхней части роговичных эпителиальных клеток (пятна оранжевого цвета); стрелки показывают вход лютеина после применения ионтофореза.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Термин «введение» соединения следует понимать как обозначающий предоставление соединения по изобретению индивидууму, нуждающемуся в лечении, в форме, которую можно вводить в организм этого индивидуума в терапевтически эффективной форме и терапевтически эффективном количестве, включая в качестве неограничивающих примеров: пероральные дозированные формы, такие как таблетки, капсулы, сиропы, суспензии и т. п.; инъецируемые дозированные формы, такие как IV, IM или IP и т. п.; трансдермальные дозированные формы, в том числе кремы, желе, порошки или пластыри; трансбуккальные дозированные формы; ингаляционные порошки, спреи, суспензии и т. п.; и ректальные суппозитории.
Термин «эффективное количество», как используют в настоящем документе, относится к количеству, необходимому для того, чтобы вызывать желаемую биологическую реакцию. Как признают средние специалисты в данной области, эффективное количество композита или биологически активного средства может варьировать в зависимости от таких факторов, как желаемая биологическая конечная точка, биологически активное средство, подлежащее доставке, композиция инкапсулирующей матрицы, целевая ткань и т. д.
Как используют в настоящем документе, термин «экстракт» относится к продукту, полученному экстрагированием. Экстракт может быть в форме раствора в растворителе или экстракт может представлять собой концентрат или эссенцию, которая не содержит или по существу не содержит растворитель. Термин экстракт может представлять собой отдельный экстракт, полученный на конкретной стадии экстрагирования или серии стадий экстрагирования или экстракт также может представлять собой комбинацию экстрактов, полученных на отдельных стадиях экстрагирования. Например, экстракт «a» можно получать посредством экстрагирования клюквы с использованием спирта в воде, тогда как экстракт «b» можно получать посредством экстрагирования клюквы сверхкритическим диоксидом углерода. Затем экстракты a и b можно комбинировать для того, чтобы формировать экстракт «c». Такие комбинированные экстракты, таким образом, также охвачены термином «экстракт».
Как используют в настоящем документе, термин «фракция» обозначает экстракт, который содержит конкретную группу химических соединений, которые отличаются определенными физическими, химическими свойствами или физическими или химическими свойствами.
Термин «профилактика», когда используют по отношению к состоянию, такому как злокачественная опухоль, инфекционное заболевание или другое медицинское заболевание или состояние, ясно понимают в данной области, и он включает введение композиции, которая снижает частоту или задерживает начало симптомов медицинского состояния у субъекта по отношению к субъекту, который не получает композицию. Таким образом, профилактика злокачественной опухоли включает, например, снижение числа поддающегося обнаружению злокачественного роста в популяции пациентов, получающих профилактическое лечение, по отношению к контрольной популяции без лечения и/или задержку возникновения поддающегося обнаружению злокачественного роста в популяции, которую лечат, по сравнению с контрольной популяцией, которую не лечат, например, на статистически и/или клинически значимое количество. Профилактика инфекции включает, например, снижение числа диагнозов инфекции в популяции, которую лечат, по сравнению с контрольной популяцией, которую не лечат, и/или задержку начала симптомов инфекции в популяции, которую лечат, по сравнению с контрольно й популяцией, которую не лечат.
Под «фармацевтически приемлемым» подразумевают, что носитель, разбавитель или эксципиент должен быть совместим с другими ингредиентами состава и не нести вреда его реципиенту.
Термин «синергический» хорошо известен в данной области и относится к двум или больше компонентам, работающим вместе с тем, чтобы полный эффект был больше, чем у суммы компонентов.
Термин «лечение» хорошо известен в данной области и относится к излечению, а также облегчению по меньшей мере одного симптома какого-либо состояния или нарушения.
Термин «профилактическое или терапевтическое» лечение хорошо известен в данной области и включает введение организму-хозяину одной или нескольких из рассматриваемых композиций. Если их вводят перед клинической манифестацией нежелательного состояния (например, заболевания или другого нежелательного состояния животного-хозяина), то лечение является профилактическим, т. е., оно защищает организм-хозяин от развития нежелательного состояния, тогда как если его вводят после манифестации нежелательного состояния, то лечение является терапевтическим (т. е., оно предназначено для того, чтобы уменьшать, улучшать или стабилизировать нежелательное состояние или его побочные эффекты).
Соединения по данному изобретению можно вводить субъектам (человеку и животным, в том числе домашним животным, таким как собаки, кошки и лошади), нуждающимся в таком лечении, в дозах, которые будут обеспечивать оптимальный фармацевтический эффект. Следует принимать во внимание, что доза, необходимая для использования в каком-либо конкретном применении, будет варьировать от пациента к пациенту, не только в зависимости от конкретного выбранного соединения или композиции, но также от конкретного пути введения, свойств состояния, подлежащего лечению, возраста и состояния пациента, сопутствующего лекарственного средства или конкретной диеты, которой придерживается пациент, и других факторов, которые знают специалисты в данной области, причем подходящая доза в конечном итоге остается на выбор лечающего врач.
ПРИМЕР 1 - Внутриглазная доставка лютеина в глаза кроликов
Материалы и способы
Получение состава. Среди различных систем доставки, используемых в настоящее время для усовершенствования стабильности соединений, липосомы обладают преимуществами из-за их биосовместимости, потенциала замедленного высвобождения и способности нести как гидрофобные, так и гидрофильные соединения16. В этой работе кристаллический лютеин (Kemin Foods, FloraGLO® Crystalline Lutein, партия 1401103302) инкапсулировали в липосомы с использованием фосфолипидов 90H (Lipoid GmbH, партия 529400-2120046-12-112, CAS 308068-11-3) и октадециламина (Sigma-Aldrich партия BCBK6340V, CAS 124-30-1). Липидную пленку получали с использованием фосфолипидов 90H, октадециламина и лютеина, растворенных в CHCl3/MeOH (2:1) (Sigma-Aldrich, партия SHBC4982V, CAS 67-66-3/Sigma-Aldrich, партия SZBC237BV, CAS 67-56-1). Растворители удаляли под вакуумом посредством роторного испарения; раствор сушили под вакуумом при 40°C с помощью роторного испарителя Heidolph, скорость роторного испарителя модулировали для того, чтобы снижать формирование пузырьков и брызгов, которые могут вести к потере продукта, и после 1-2 часов получали сухую тонкую пленку. Для того чтобы удалять какие-либо следы растворителей, тонкую пленку оставляли под вакуумом в течение по меньшей мере 16 часов при комнатной температуре. Гидратацию липидной пленки осуществляли посредством добавления дистиллированнрй воды (Water Ultrapure - MilliQ-by AquaMax - проводимость 0,054 мкСм/см) при 40-45°C к липидной пленке для того, чтобы гидратировать липиды и формировать большие липосомные везикулы. Гомогенизацию больших липосомных везикул осуществляли с использованием Ika Works ULTRA-TURRAX T 25 Digital Homogenizer (Staufen, Germany) и уменьшение липосомных везикул до наноразмерного диапазона выполняли посредством экструзии с использованием крупномасштабного процессора текучих веществ с большим сдвигом Microfluidizer® M-110EH при 50-60°C и 1200 бар. Этот процесс повторяли 5 раз. Стерилизацию эмульсии осуществляли при 121°C в течение 20 минут при 1 атм. В таблице 1 представлена композиция эмульсии липосом. После стерилизации анализировали распределение размеров, дзета-потенциал, осмоляльность и pH конечного продукта, которые сведены в таблице 2.
Таблица 1. Композиция эмульсии липосом с лютеином.
Таблица 2. Характеристики липосом после стерилизации.
Устройство глазного ионтофореза. Устройство для ионтофореза состояло из двух одноразовых компонентов: глазной аппликатор и возвратный электрод. Эти два компонента соединяли с повторно используемым генератором. Глазной аппликатор состоял из поликарбонатного резервуара (диаметр 9 мм, высота 4,5 мм, объем 0,5 мл) и электрода из нержавеющей стали (AISI 304), соединенного с проводом к генератору (анод - положительный электрод). Возвратный электрод представлял собой внутрикожную иглу 25G, вставленный в шейку (передняя сторона) и соединеннй с зубчатым зажимом и проводом к генератору (катод). Генератор (EYEGATE CCI Generator 6121-EYE, Eyegate Pharma, Paris France) представлял собой генератор постоянного тока, диапазон уставок 0,25-2,5 мА (10 шагов по 0,25 мА) для тока и 0,5-5 мин для времени (10 шагов по 0,5 мин). Результирующее приложенное напряжение измеряли во время исследования с использованием мультиметра.
Животные. В этом исследовании использовали четырнадцать пигментированных кроликов штамма HY79b (производитель: «HYPHARM» -FR-49450 ROUSSAY). Всех животных идентифицировали индивидуально с использованием ушной метки и маркера в ушах после осмотра при включении. Животных содержали под наблюдением в течение 3 суток после их прибытия и ежедневно наблюдали на предмет признаков болезни, уделяя особое внимание глазам. Животных содержали индивидуально в стандартных клетках, при идентичных условиях окружающей среды. Поддерживали температуру 15-21°C и относительную влажность 55±10%. Помещения непрерывно вентилировали (≥ 15 объемов воздуха в час). Температуру и относительную влажность непрерывно контролировали и регистрировали. Животных обычным образом экспонировали (в клетке) под светом 10-200 лк в контролируемом цикле 12-часового света (с 7:00 утра до 7:00 вечера) и 12-часой темноты. На всем протяжении исследования животные имели свободный доступ к пище и воде. Они получали стандартную диету из сухих гранул (150 г/сутки), LASQCdiet® Rab-14H (LASVENDI GMBH, Soest Germany). Водопроводная вода, регулярно анализируемая, была доступна ad libitum из пластмассовых бутылок. Все стандартные рабочие процедуры и протоколы, описанные в этом плане исследования рассмотрены сертифицированным этическим комитетом. Всех животных обрабатывали в соответствии с Directive 2010/63/UE European Convention for the Protection of Vertebrate Animals used for Experimental17 и Other Scientific Purposes и Association for Research in Vision and Ophthalmology (ARVO) Statement для Use of Animals in Ophthalmic and Vision Research18.
Экспериментальная процедура. Четырнадцать пигментированных кроликов штамма HY79b случайным образом делили на две группы: контрольная (пассивное нанесение: без электрического тока; животные №9-14) и тестовая группа (ионтофоретическое нанесение: с использованием электрическрого тока; животные №1-8). Эти две группы подразделяли на две временные точки (0 и 2 часа). В таблице 3 сведен план исследования.
Таблица 3. План исследования.
Эмульсию лютеина вводили посредством ионтофореза анестезированным животным (внутримышечная инъекция смеси ксилазина/кетамина), с использованием векорасширителя и под местной анестезией (одна капля Cebesine®: 0,4% оксибупрокаин, Thea, партия F6757) приблизительно за 10 мин до нанесения). Животных обрабатывали посредством нанесения на роговицу и склеру 9 мм ионтофоретического аппликатора, заполненного лютеином, в течение 10 минут на правом глазу. Заряд 0,0 мА или 20,0 мА подавали на каждый глаз, в зависимости от группы (см. таблицу 3). Ионтофоретический аппликатор импрегнировали 0,5 мл эмульсии липосом с лютеином непосредственно перед дозированием; электрод устройства покрывали эмульсией лютеина. После всех введений следовало промывание сбалансированым солевым раствором (BSS).
Незамедлительно после ионтофоретического нанесения на правом глазу или через 2 часа после нанесения (см. таблицу 3), животных умерщвляли посредством внутривенного введения чрезмерной дозы пентобарбитала, который входит в способы, рекомендованные European Authorities17. Брали образцы роговицы (C), водянистой влаги (AH), ресничного тела (CB), сетчатки (R), стекловидного тела (V) и склеры (SC) из обоих глаз и взвешивали. Визуальную оценку окраски образцов осуществляли перед их хранением при -80°C для последующего ВЭЖХ (высокоэффективная жидкостная хроматография) анализа.
Результаты
Глазная ионтофоретическая доставка эмульсии лютеина у пигментированных кроликов. Для того чтобы оценивать способность лютеина к доставке посредством ионтофореза, авторы изобретения получали липосомы, несущие лютеин, (положительно заряженные) и наносили эту эмульсию в течение 10 мин при 2,0 мА в роговицу/склеру пигментированных кроликов. Эффект доставки посредством ионтофореза оценивали посредством визуальной оценки собранных тканей. В таблице 4 сведены результаты после нанесения эмульсии лютеина, с использованием и без использования тока.
Таблица 4. Окраска после ионтофоретического нанесения.
Примечание: C - роговица; SC - склера; CJ - конъюнктива
После применения ионтофореза во всех глазах, которые лечили с использованием 20,0 мА тока (время 0 ч), обнаруживали круглую окраску оранжевого цвета в роговице, что показывает присутствие эмульсии лютеина в тканях. Нанесение лютеина также давало в двух глазах (№2 и №3) след оранжевого цвета на краю склеры и слабую окраску оранжевого цвета в конъюнктиве глаза. После 2 ч лечения только половина глаз, которые лечили, демонстрировала эту окраску в роговице (№5 и №8), это событие может показывать, что после нанесения эмульсия диффундирует в глаз. Без тока не наблюдали доставку в различные глазные ткани.
Обсуждение
Приблизительно 10% людей в возрасте старше 65 лет во врем мире страдают от заболевания AMD19. Различные исследования показали, что лютеин является потенциальным средством, задерживающим прогрессирование AMD, а также потенциальной нейропротективной молекулой13,20-22. Кроме того, лютеин является естественным компонентом глаза, со свойственным тропизмом к желтому пятну, который специфично откладывается в парафовеальной области, где он является необходимым1. Эти особенности могут представлять собой преимущество для существующих продуктов, используемых для того, чтобы управлять AMD. Доступное лечение для этой патологии включает внутриглазные инъекции, которые имеют побочные эффекты, являются мучительными для пациента и дорогостоящими, так что разработка более безопасного и эффективного лечения является важной. За последние несколько лет результаты многих исследований выявили риски интравитреальных инъекций. Необходимость часто введить лекарственные средства через интравитреальные инъекции может вести к отслоению сетчатки, эндофтальмиту и повышенному внутриглазному давлению. В качестве осложнений интравитреальных инъекций сообщалось как об неинфекционном, так и инфекционном воспалении. С увеличением частоты интравитреальных инъекций в силу их одобрения для использования, экстенсивно исследовали заболеваемость инфекционного эндофтальмита23,24. В этой работе авторы изобретения тестировали впервые минимально инвазивную технологию для того, чтобы доставлять лютеин in situ. Ионтофорез обладает преимуществом минимально инвазивного способа и, следовательно, является более безопасным и более легким для повышения соблюдения пациентом схемы лечения, поскольку при нем избегают осложнений хирургической имплантации или частых и высокодозовых интравитреальных инъекций12. Фактически, в различных доклинических и клинических исследованиях сообщают о безопасности повторного применения глазного ионтофореза14,25,26. Другое преимущество состоит в том, что этот способ является менее дорогостоящим, и его можно осуществлять быстро в кабинете врача обычного посещения офтальмолога без необходимости хирургический обстановки. В различных исследованиях установлено использование ионтофореза для лечения заболеваний человеческого глаза, например, при ведении активного отторжения трансплантата роговицы27, лечении заболевания сухости глаз14,28, неинфекционного переднего увеита15 и заболевания кератоконуса29.
В этом исследовании авторы изобретения использовали ионтофорез, который включает подачу слабого постоянного тока в течение 10 минут, который переносит заряженные молекулы через глазные ткани. Ионтофоретическое нанесение вело к проникновению эмульсии липосом, несущих лютеин (ионизированное лекарственное средство), через роговичный сегмент глаза.
Это исследование является эффективной проверкой концепции, которое четко демонстрирует внутриглазную доставку эмульсии лютеина ионтофоретическим способом.
ПРИМЕР 2 - Внутриглазная доставка лютеина в трупных глазах
Материалы и способы
Получение состава. Продемонстрировано, что положительные частицы являются более хорошими кандидатами для ионтофоретического нанесения в качестве носителя лекарственного средства, чем отрицательно заряженные частицы, из-за более высокого проникновения в глазные ткани38. Кроме того, электрическое поле переносит положительно заряженные молекулы для того, чтобы перемещать их в мембраны глаза (отрицательно заряженные)39. В этой работе авторы изобретения воспользовались преимуществом того факта, что мембраны, присутствущие в человеческому глазу, при физиологическом pH, отрицательно заряжены и для разработки положительно заряженной эмульсии, несущей лютеин, подлежащий доставке через применение ионтофореза. Из-за того факта, что лютеин представляет собой молекулу с большой молекулярной массой, липофильную и нерастворимую в воде, доставка этого каротиноида через ионтофорез без модификации является почти невозможной1. Для того чтобы преодолеть это, получали состав с положительно заряженными липосомными везикулами, которые ведут себя как носители молекул лютеина (Lipo+). Липидную пленку получали с использованием фосфолипона 90H (Lipoid GmbH, партия 529400-2120046-12-112, CAS 308068-11-3), октадециламина (Sigma-Aldrich партия BCBK6340V, CAS 124-30-1) кристаллического лютеина (Kemin Health, FloraGLO® Crystalline Lutein, партия 1401103302). Для получения 4-5 л, соединения растворяли в 500-800 мл CHCl3/MeOH (1:1 об./об.) (Sigma-Aldrich, партия SHBC4982V, CAS 67-66-3/ Sigma-Aldrich, партия SZBC237BV, CAS 67-56-1) посредством нагрева при 30-35°C. См. композицию состава в таблице 5. Растворители удаляли под вакуумом посредством роторного испарения; раствор сушили под вакуумом при 40°C с помощью роторного испарителя Heidolph, и сухую тонкую пленку получали после 1-2 часов. Тонкую пленку оставляли под вакуумом в течение по меньшей мере 16 часов при комнатной температуре для того, чтобы гарантировать полное удаление каких-либо следов растворителей. Содержание органических растворителей анализировали посредством газовой хроматографии (GC) и убеждались, что оно составляет меньше чем 25 м. д. Гидратацию липидной пленки осуществляли посредством добавления дистиллированной воды (Water Ultrapure - MilliQ-by AquaMax - проводимость 0,054 мкСм/см) при 65°C к липидной пленке для того, чтобы формировать большие липосомные везикулы. Гомогенизацию этих больших липосомных везикул осуществляли с использованием Ika Works ULTRA-TURRAX T 25 Digital Homogenizer (Staufen, Germany) на 2000-4000 об./мин и уменьшение липосомных везикул до наноразмерного диапазона выполняли посредством экструзии с использованием крупномасштабного процессора текучих веществ с большим сдвигом Microfluidizer® M-110EH при 50-60°C и 1200 бар. Этот процесс повторяли 5 раз. Стерилизацию эмульсии осуществляли при 121°C в течение 20 минут при 1 атм. После процесса стерилизации регистрировали характеристики липосомного состава: pH (с использованием прибора Mettler Toledo S20), осмоляльность (с использованием Osmomat 3000), размер частицы и дзета-потенциал (с использованием динамического рассеяния света (DLS), также известного как способ фотонно-корреляционной спектроскопии - Nicomp 380 DLS.
Таблица 5. Композиция эмульсии липосом с лютеином.
Спектрофотометрическая оценка состава. Спектрофотометрию использовали для того, чтобы измерять свойства поглощения и флуоресценции для раствора Lipo+ (разведение 1:50 в воде или 0,9% NaCl). Раствор, содержащий только липосомы (без лютеина), использовали в качестве контроля. Спектры поглощения отслеживали между 300 и 750 нм для каждого образца и спектры флуоресценции между 480 и 650 нм, с возбуждением на 370 нм (выбрано по результатам спектров поглощения).
Размер частицы и дзета-потенциал. Динамическое рассеяние света использовали для того, чтобы оценивать распределение размеров компонентов в растворе Lipo+. Электрофорез осуществляли для того, чтобы оценивать дзета-потенциал раствора.
Глазное ионтофоретическое устройство. Принцип глазного ионтофореза состоит в приложении электрического поля к электролитическому веществу, содержащему по меньшей мере один продукт, для того, чтобы транспортировать продукт в организм или орган, подлежащий лечению, через биологические мембраны глаза12.
Типичную ионтофоретическую установку выполняют из двух компонентов: глазной аппликатор и возвратный электрод, оба соединены с генератором. В этом эксперименте глазной аппликатор содержит 2 электрода, чтобы работать независимо с роговичными и склеральными тканями. Глазной аппликатор (OPIA Technologies SAS, Paris, France) выполняют из полиуретановой смолы, и он содержит 2 резервуара: центральный круглый резервуар (диаметр 8 мм, высота 4,5 мм, объем 1 мл) и нержавеющий стальной электрод, накладываемый на роговицу, который окружен кольцевым резервуаром (внутренний диаметр 12,5 мм, внешний диаметр 18 мм, высота 4,5 мм, объем 1 мл) и нержавеющий стальной электрод, накладываемый на склеру (область плоской части ресничного тела около края). Каждый нержавеющий стальной электрод соединяли с проводом к отличающемуся генератору постоянного тока (анод - положительный электрод). Возвратные электроды присваивали каждому генератору и, соответственно, прикрепляли к зрительному нерву (для роговичного электрода) и области экватора склеры (для склерального электрода), замыкая каждую электрическую схему независимо. Генераторы (IONO-25, Iacer Srl, Italy) представляют собой генераторы постоянного тока, диапазон уставок 0,25-2,5 мА (5 шагов по 0,5 мА) для тока и время корректировали автоматически для того, чтобы доставлять суммарной дозы 20 мА.мин. Результирующее прикладываемое напряжение измеряли во время исследования для каждой схемы с использованием 2 мультиметров.
Трупные глаза. Шесть трупных глазных яблок человека от различных здоровых доноров получали из Veneto Eye Bank Foundation (Venezia Zelarino, Italy). Человеческие глаза использовали в соответствии с руководством Declaration of Helsinki для исследований с использованием тканей человека и эксплантировали между 3 и 16 часами после смерти и незамедлительно консервировали при 4°C в среде для хранения роговицы, обогащенной 6% декстрана. Средний возраст донора составлял 63,6±5,9 года. Средняя плотность клеток эндотелия составляла 2125±389 клеток/мм2. Каждое глазное яблоко, погруженное в раствор, обогащенный декстраном, отправляли в лабораторию в течение 5 суток. Четыре глазных яблока проходили роговично-склеральный ионтофорез для того, чтобы доставлять 0,1% офтальмологический раствор лютеина в ткань сетчатки. Два глазных яблока использовали в качестве контроля: ионтофорез осуществляли без присутствия состава.
Подготовка глаз. Каждое глазное яблоко аккуратно устанавливали в специально сконструированный держатель обращенным вверх. Склеральный и роговичный пассивные электроды помещали на зрительный нерв и склеру, соответственно. Глаз соединяли со столбовым манометром посредством трубки, заполненной 0,9% раствором хлорида натрия, чтобы сохранять давление внутри глаза на 15 мм рт. ст. во время эксперимента. Глазное яблоко сначала подвергали трем циклам предварительной подготовки между 15 и 42 мм рт. ст. для того, чтобы стабилизировать глазные ткани и механику во время эксперимента. Эта предварительная подготовка обеспечивала достижение уникального эталонного состояния в начале каждого эксперимента и восстановление толщины роговицы и склеры до физиологических уровней. После предоварительной подготовки измеряли толщину центральной роговицы (CCT) с использованием ультразвукового роговичного пахиметра (Pachmate, DGH, Exton, USA). В этих образцах средняя CCT составляла 558±19 мкм.
Импрегнирование раствором. Активный электрод (катод), в пластмассовой ванне, накладывали на поверхность роговицы и склеры. Пластмассовую трубку заполняли пеной, которую смачивали в Lipo+ в течение 20 минут. После этой обработки предварительным смачиванием, трубку аккуратно накладывали на переднюю поверхность глазного яблока и снова заполняли 2 мл раствора Lipo+. Задавали плотность тока 2,5 мА и осуществляли доставку в течение 5 минут для обоих генераторов, соединенных с роговицей и склерой. После роговично-склерального ионтофореза глазное яблоко оставляли обращенным вверх в держателе глаза с давлением внутри глаза 15 мм рт. ст. в течение 80 минут. В этот период лютеину, который достигал сетчатки посредством транссклерального ионтофореза, позволяли пассивно диффундировать через ткань сетчатки в направлении желтого пятна, конкретно парафовеальной области. Два из 6 использованных глаз в этом исследовании использовали в качестве контроля, таким образом, не осуществляя импрегнирование составом.
Оценка ткани. После 80 минут ткань сетчатки изолировали, не вызывая значительного повреждения, которое могло помешать ее использованию в двухфотонной визуализации высокого разрешения. Диссекцию тканей сетчатки, сосудистой оболочки глаза, роговицы и склеры выполняли с использованием стандартизованного протокола47. Двухфотонную микроскопию использовали для того, чтобы оценивать проникновение алютеин в область желтого пятна сетчатки. Перед началом регистрации изображений глазных тканей, несколько стеков на растворе Lipo+ (0,005%, 0,002% и 0,001% разведения в 0,9% хлориде натрия) получали для того, чтобы понять, какой фильтр лучше всего применять для усиления сигнала двухфотонной флуоресценции (TPF), испускаемого лютеином. Фильтр 550/80 нм (Semrock) был наиболее подходящим для исследования лютеина (на основе спектрофотометрических исследований), однако обнаружено, что фильтр 525/20 нм (Semrock) дает хороший результат для отношения сигнала к шуму (SNR). Следовательно, возбуждение, используемое для оценки глазных тканей, составляло 835 нм и TPF свет, испускаемый компонентами глазных тканей, собирали в обратном направлении с помощью NDD («non-descanned detector»1) для отражения отраженного света.
Резонансная рамановская спектроскопия: резонансное рамановское рассеяние использовали для оценки эффекта ионтофоретической доставки лютеина в сетчатку человека в трупных глазах. Одномодовый лазерный источник (мощность 50 мВт), сосредоточенный на длине волны 473,5 нм, использовали в качестве источника возбуждения для того, чтобы осуществлять измерения резонансной рамановской спектроскопии. Лазерный пучок фокусировали на глазных тканях посредством комбинации линз и объектива микроскопа (NA=0,25) с тем, чтобы облучаемая площадь сетчатки составляла 1 мм в диаметре; мощность лазера снижали до 1 мВт в плоскости сетчатки с использованием фильтра нейтральной плотности. Рамановский рассеянный свет собирали посредством фотоумножительной трубки (PMT), со спектральным разрешением 10 см-1 и с усредненной скоростью 80 счетов в темноте. Интенсивность рамановского сигнала регистрировали в виде счетов фотонов в секунду (cps). Измерения осуществляли в трех областях сетчатки: внутренняя склера в месте ионтофоретической доставки (т. е., перилимбальная склера, обращенная в направлении ресничного тела); средняя периферия сетчатки, которая содержала область сетчатки, окружающую сосудистые аркады и головку зрительного нерва; и желтое пятно. Измерения осуществляли в четырех областях по всей каждой области для того, чтобы собирать достаточно данных для того, чтобы корректно оценивать данные в исследуемых и контрольных глазах. Перед экспериментом, чтобы найти корреляцию между рамановскими показаниями и фактическим содержанием лютеина в глазных тканях, осуществляли калибровочные эксперименты с использованием тонких кварцевых кювет, заполненных различными концентрациями лютеина.
Результаты
Спектральные характеристики Lipo+. Спектры поглощения и флуоресценции раствора Lipo+ изначально изучали в этом исследовании для того, чтобы определять длину волны двухфотонного возбуждения. Между 300 и 750 нм отслеживали абсорбционные спектры, которые представлены на фиг. 1. Раствор Lipo+ демонстрировал пик абсорбции на 370 нм и его использовали в качестве длины волны возбуждения для отслеживания спектров флуоресценции Lipo+ между 480 и 650 нм (фиг. 2). Lipo+ демонстрировал две флуоресцентные полосы пиков: 500-530 нм и 540-570 нм. На основании этих результатов для двухфотонных экспериментов выбирали фильтр 550/88.
Физические характеристики Lipo+. Размер частицы и дзета-потенциал также определяли перед тестированием ионтофореза для того, чтобы подтвердить положительный заряд и размер Lipo+. Это определение осуществляли через динамическое рассеяние света и электрофорез, соответственно, для разведения Lipo+ в дистиллированной воде 1:50 и также сравнивали с раствором липосом без лютеина (в качестве контроля). Согласно фиг. 3, пик агрегатов Lipo+ составляет 3,5 мкм (усредненно), а также меньший пик наблюдают на 300 нм (усредненно), что указывает на отдельные липосомы. Также определение дзета-потенциала показывало заряд раствора Lipo+, равный +5 мВ.
Распределение лютеина в трупных глазах после ионтофоретического нанесения. Несмотря на то, что для двухфотонных экспериментов выбран фильтр 550/88 (на основании предыдущих экспериментов с флуоресценцией), начальный анализ состава липосом с лютеином показывал, что фильтр 525/20 дает более хорошие результаты в отношении SNR. При этой начальной калибровке (с 0,005, 0,002 и 0,001% разведениями Lipo+ в 0,9% NaCl), липосомы наблюдали как сферические везикулы и микроскоп калибровали правильно (данные не приведены). Это является очень важным контролем, поскольку пигментные клетки сетчатки полны меланина, пигмента, который возбуждается при той же длине волны, что и лютеин. Кроме того, с использованием этого контроля авторы изобретения могли различать липосомы с лютеином и пигмент.
Для того чтобы оценивать распределение липосом, несущеих лютеин, в человеческом глазу после ионтофоретического нанесения, на пять трупных глаз воздействовали током 2,5 мА в течение 5 мин в роговице/склере, оставляли в покое на 80 мин (контролировали внутриглазное давление на 15 мм рт. ст.) и собирали различные структуры глаза: роговицу, склеру, сосудистую оболочку, периферическую и центральную сетчатку. Распределение липосом оценивали посредством двухфотонной микроскопии (возбуждение на 835 нм). Шестой трупный глаз использовали в качестве: глаз никогда не был в контакте с липосомным составом. В нем не обнаруживали липосомы, когда включали лазер 835 нм, что показывает, что сигнал является специфичным для экзогенного лютеина (данные не представлены).
Анализ различных собранных глазных тканей показывал, что после комбинированного роговично-склерального ионтофореза лютеин изобиловал в сетчатке, тогда как липосомы, не обогащенные лютеином, находили в тканях сосудистой оболочки глаза для всех глаз, тестированных с использованием состава.
Также, из исследования сетчатки, раствор Lipo+ не был способен пересекать стенки сосудов сетчатки, поскольку липосомы находили только в тканях, окружающих сосуды.
При определении в переднем сегменте (склера и роговица), липосомы, обогащенные лютеином, не находили ни в строме роговицы, на в ткани склеры, но находили в эпителиальных клетках роговицы.
В сетчатке также возможно наблюдать больше лютеина во внешней части близко к фоторецепторам, чем в ганглионарных клетках, внутренней части сетчатки.
Поскольку анализ сосудистой оболочки не выявлял присутствия липосом в этой области после подачи тока, эти результаты показывают, что после транссклерального нанесения лютеина посредством ионтофореза через ресничное тело/плоскую часть ресничного тела, липосомы с лютеином пассивно диффундируют через мембраны глаза до тех пор, пока не достигают задней сетчатки около ямки. На фиг. 4 приведено схематическое представление пути лютеина внутри глаза. Анализ роговичной ткани после применения роговичного ионтофореза обнаруживал липосомы, сидящие на верхней части эпителиальных клеток этой ткани.
Также осуществляли анализ резонансной рамановской спектроскопии различных глазных тканей. Рамановские сигналы накладывали на фоновую флуоресценцию, вероятно берущую начало из флуоресценции собственного каротиноида флуоресцеина и липофусцина. Для получения точных показаний высоты рамановских пиков, не содержащих фоновые сигналы, авторы изобретения вычитали влияние потенциально перекрывающихся шумовых выбросов в спектре посредством полиномиальной аппроксимации (до 5-го порядка) геометрической формы измеряемых рамановских линий для каждого измеренного спектра. Конечную высоту пика сигнала двойной связи C=C на 1530 см-1 выбирали в качестве сигнатуры присутствия лютеина.
Во внутренней склере рамановский пик на 1530 см-1, измеренный в глазу, который лечили, был в 7 раз больше, чем в контрольном глазу, что дает доказательство эффекта ионтофореза при доставке лютеина в глаз через интактную склеру. В средней периферии сетчатки рамановский пик на 1530 см-1, измеренный в глазу, который лечили, был в 1,7 раза больше, чем в контрольном глазу, что показывает, что большое количество лютеина достигало заднего полюса сетчатки в конце ионтофоретического лечения. В желтом пятне рамановский пик на 1530 см-1, измеряемый в глазу, который лечили, был в 1,3 раза больше, чем в контроле, что демонстрирует, что ионтофорез эффективен при доставке лютеина в желтое пятно.
Обсуждение
Возрастная дегенерация желтого пятна (AMD) представляет собой ведущую причину необратимой слепоты у людей в возрасте старше 50 в развитых странах40,41. Больше чем 8 миллионов американцев имеют AMD, и общая распространенность заболевания по прогнозам возрастет больше чем на 50% к 2020 году37. Несколько эпидемиологических исследований выявили, что лютеиновая добавка вела к увеличению уровней оптической плотности пигмента желтого пятна (MPOD) у пациентов с ранней стадией AMD, что связано с защитой от болезни желтого пятна42,21. Фактически, лютеин естественным путем концентрируется в сетчатке, где вместе с зеаксантином образует пигмент желтого пятна. Действуя в качестве фильтра синего света, лютеин может защищать подлежащие фоторецепторы в центре желтого пятна от фотохимического повреждения43. Антиоксидантные свойства лютеина также могут защищать желтое пятно от окислительного стресса44.
Доступные решения для замедления прогрессирования AMD основаны на внутриглазных инъекциях или хирургических вмешательствах, включающих доказанные побочные эффекты и возможные осложнения, такие как отслоение сетчатки, повышенное внутриглазное давление, а также неинфекционное и инфекционное воспаление23,33. В этой работе авторы изобретения использовали минимально инвазивную доставку лютеина in situ в задний сегмент человеческого глаза. Ионтофорез обладает преимуществом более безопасного и более легкого способа достижения соблюдения пациентом схемы лечения и проталкавания высоких концентраций продукта, представляющего интерес, через различные слои глаза до тех пор, пока он не достигнет сетчатки. В различных сообщениях установлена безопасность повторного лечения с использованием глазного ионтофореза для лечения рзаличных заболеваний, таких как сухой глаз, неинфекционный увеит и кератоконус14,15,25,26,28,29.
В настоящем документе, используя трупные глаза в качестве доклинической модели, авторы изобретения подавали слабый электрический ток для того, чтобы проталкивать лютеин в глаз, без побочных эффектов. Авторы изобретения наблюдали, что липосомы с лютеином преимущественно откладываются в периферической и центральной сетчатке около ямки, но отсутствуют в областях сосудистой оболочки глаза. Используя это наблюдение, возможно экстраполировать, что путь лютеина после транссклерального нанесения лежит через ресничное тело/плоскую часть ресничного тела, после чего следует пассивная диффузия через глазные мембраны до тех пор, пока не будет достигнута область задней сетчатки (фиг. 4). Авторы изобретения впервые доказали, что транссклеральный ионтофорез представляет собой эффективный путь перенести лютеин в сетчатку человеческого глаза, что предоставляет новый путь укрепления пигмента желтого пятна. При отложении в задней области, постулируют, что лютеин способен достигать внешней части сетчатки, где находятся фоторецепторы, посредством пассивной диффузии/белкового градиента. Это может подтверждать, что причина, по которой лютеин не наблюдали в сосудистой оболочке, состоит в том, что размер отверстий в нервном сетчаточном барьере составляет 80-90 нм45 (липосомы имеют размер 341 нм и иногда могут формировать кластеры по 2-3 мкм, что подсказывает, что липосомы с лютеином остаются захваченными в сетчатке (фиг. 4). Что важно, анализ резонансной рамановской спектроскопии выявлял, что концентрация лютеина возрастает в желтом пятне после ионтофореза. Это наблюдение явно демонстрирует, что транссклеральный ионтофорез представляет собой эффективный способ доставки лютеина в желтое пятно и является эффективной альтернативой для существующих способов профилактики начала AMD, предотвращает его прогрессирование и/или лечит возникшее заболевание.
После применения роговичного ионтофореза липосомы не присутствовали в строме роговицы. Этот факт можно объяснить, поскольку лютеин является гидрофобным, а строма на 70% состоит из воды и, таким образом, очень гидрофильна46, что делает невозможным проникновение лютеина в эту ткань.
Приведенное выше описание и рисунки содержат иллюстративные варианты осуществления настоящего изобретения. Приведенные выше варианты осуществления и способы, описанные в настоящем документе, можно варьировать на основании способностей, опыта и предпочтений специалистов в данной области. Простое перечисление стадий способа в определенном порядке не составляет какого-либо ограничения порядка стадий способа. Приведенное выше описание и рисунки лишь объясняют и иллюстрируют изобретение, и изобретение не ограничено этим, за исключением случаев, когда так ограничена формула изобретения. Специалисты в данной области, которые имеют раскрытие прежде, чем они будут способны выполнить модификации и вариации в нем, не отступая от объема изобретения.
СПИСОК ЛИТЕРАТУРЫ
1. Kijlstra A., Tian Y., Kelly E. R., Berendschot T. T. 2012. Lutein: more than just a filter for blue light. Prog Retin Eye Res. 31:303-315.
2. Yemelyanov A. Y., Katz N. B., Bernstein P. S. 2001. Ligand-binding characterization of xanthophyll carotenoids to solubilized membrane proteins derived from human retina. Exp Eye Res. 72:381-392.
3. Bone R. A., Landrum J. T., Guerra L. H., Ruiz C. A. 2003. Lutein and zeaxanthin dietary supplements raise macular pigment density and serum concentrations of these carotenoids in humans. J Nutr. 133:992-998.
4. Landrum J. T., Bone R. A., Joa H., Kilburn M. D., Moore L. L., Sprague K. E. 1997. A one year study of the macular pigment: the effect of 140 days of a lutein supplement. Exp Eye Res. 65:57-62.
5. Ma L., Lin X. M. 2010. Effects of lutein and zeaxanthin on aspects of eye health. J Sci Food Agric. 90:2-12.
6. Barar J., Javadzadeh A. R., Omidi Y. 2008. Ocular novel drug delivery: impacts of membranes and barriers. Expert Opin Drug Deliv. 5:567-581.
7. de la Fuente M., Ravina M., Paolicelli P., Sanchez A., Seijo B., Alonso M. J. 2010. Chitosan-based nanostructures: a delivery platform for ocular therapeutics. Adv Drug Deliv Rev. 62:100-117.
8. Sousa-Martins D., Maia M., Moraes M., Lima-Filho A. A., Rodrigues E. B., Chen J., Farah M. E., Santos L. B., Belfort R., Jr. 2012. Use of lutein and zeaxanthin alone or combined with Brilliant Blue to identify intraocular structures intraoperatively. Retina. 32:1328-1336.
9. Rodrigues E. B., Costa E. F., Penha F. M., Melo G. B., Bottos J., Dib E., Furlani B., Lima V. C., Maia M., Meyer C. H., Hofling-Lima A. L., Farah M. E. 2009. The use of vital dyes in ocular surgery. Surv Ophthalmol. 54:576-617.
10. Maia M., Furlani B. A., Souza-Lima A. A., Martins D. S., Navarro R. M., Belfort R., Jr. 2014. Lutein: a new dye for chromovitrectomy. Retina. 34:262-272.
11. Badaro E., Furlani B., Prazeres J., Maia M., Lima A. A., Souza-Martins D., Muccioli C., Lucatto L. F., Belfort R., Jr. 2014. Soluble lutein in combination with brilliant blue as a new dye for chromovitrectomy. Graefes Arch Clin Exp Ophthalmol. 252:1071-1078.
12. Eljarrat-Binstock E., Domb A. J. 2006. Iontophoresis: a non-invasive ocular drug delivery. J Control Release. 110:479-489.
13. Izumi-Nagai K., Nagai N., Ohgami K., Satofuka S., Ozawa Y., Tsubota K., Umezawa K., Ohno S., Oike Y., Ishida S. 2007. Macular pigment lutein is antiinflammatory in preventing choroidal neovascularization. Arterioscler Thromb Vasc Biol. 27:2555-2562.
14. Patane M. A., Cohen A., From S., Torkildsen G., Welch D., Ousler G. W., 3rd. 2011. Ocular iontophoresis of EGP-437 (dexamethasone phosphate) in dry eye patients: results of a randomized clinical trial. Clin Ophthalmol. 5:633-643.
15. Cohen A. E., Assang C., Patane M. A., From S., Korenfeld M., Avion Study I. 2012. Evaluation of dexamethasone phosphate delivered by ocular iontophoresis for treating noninfectious anterior uveitis. Ophthalmology. 119:66-73.
16. Tan C., Xia S., Xue J., Xie J., Feng B., Zhang X. 2013. Liposomes as vehicles for lutein: preparation, stability, liposomal membrane dynamics, and structure. J Agric Food Chem. 61:8175-8184.
17. French Decree n° 2013-118. 2013 European directive 2010/63/UE. J. Offic. Rep. Fr Text 24 out of 130.
18. ASSOCIATION FOR RESEARCH IN VISION AND OPHTHALMOLOGY (ARVO). 1995. Statement for the Use of Animals in Ophthalmic and Vision Research.
19. Ratnapriya R., Chew E. Y. 2013. Age-related macular degeneration-clinical review and genetics update. Clin Genet. 84:160-166.
20. Age-Related Eye Disease Study 2 Research G. 2013. Lutein+zeaxanthin and omega-3 fatty acids for age-related macular degeneration: the Age-Related Eye Disease Study 2 (AREDS2) randomized clinical trial. JAMA. 309:2005-2015.
21. Richer S., Stiles W., Statkute L., Pulido J., Frankowski J., Rudy D., Pei K., Tsipursky M., Nyland J. 2004. Double-masked, placebo-controlled, randomized trial of lutein and antioxidant supplementation in the intervention of atrophic age-related macular degeneration: the Veterans LAST study (Lutein Antioxidant Supplementation Trial). Optometry. 75:216-230.
22. Zhao L., Sweet B. V. 2008. Lutein and zeaxanthin for macular degeneration. Am J Health Syst Pharm. 65:1232-1238.
23. Simunovic M. P., Rush R. B., Hunyor A. P., Chang A. A. 2012. Endophthalmitis following intravitreal injection versus endophthalmitis following cataract surgery: clinical features, causative organisms and post-treatment outcomes. Br J Ophthalmol. 96:862-866.
24. Irigoyen C., Ziahosseini K., Morphis G., Stappler T., Heimann H. 2012. Endophthalmitis following intravitreal injections. Graefes Arch Clin Exp Ophthalmol. 250:499-505.
25. Patane M. A., Schubert W., Sanford T., Gee R., Burgos M., Isom W. P., Ruiz-Perez B. 2013. Evaluation of ocular and general safety following repeated dosing of dexamethasone phosphate delivered by transscleral iontophoresis in rabbits. J Ocul Pharmacol Ther. 29:760-769.
26. Patane M. A., Cohen A., Assang C., From S. 2010. Randomized, double-masked study of EGP-437 in subjects with non-infectious anterior segment uveitis. Poster presented at: American Academy of Ophthalmology annual meeting.
27. Halhal M., Renard G., Courtois Y., BenEzra D., Behar-Cohen F. 2004. Iontophoresis: from the lab to the bed side. Exp Eye Res. 78:751-757.
28. Horwath-Winter J., Schmut O., Haller-Schober E. M., Gruber A., Rieger G. 2005. Iodide iontophoresis as a treatment for dry eye syndrome. Br J Ophthalmol. 89:40-44.
29. Arboleda A., Kowalczuk L., Savoldelli M., Klein C., Ladraa S., Naud M. C., Aguilar M. C., Parel J. M., Behar-Cohen F. 2014. Evaluating in vivo delivery of riboflavin with coulomb-controlled iontophoresis for corneal collagen cross-linking: a pilot study. Invest Ophthalmol Vis Sci. 55:2731-2738.
30. Lim L. S., Mitchell P., Seddon J. M., Holz F. G., Wong T. Y. Age-related macular degeneration. The Lancet. 379:1728-1738.
31. de Jong P. T. V. M. 2006. Age-Related Macular Degeneration. New England Journal of Medicine. 355:1474-1485.
32. Jager R. D., Mieler W. F., Miller J. W. 2008. Age-Related Macular Degeneration. New England Journal of Medicine. 358:2606-2617.
33. Irigoyen C., Ziahosseini K., Morphis G., Stappler T., Heimann H. 2012. Endophthalmitis following intravitreal injections. Graefes Arch Clin Exp Ophthalmol. 250:499-505.
34. Ozawa Y., Sasaki M., Takahashi N., Kamoshita M., Miyake S., Tsubota K. 2012. Neuroprotective effects of lutein in the retina. Curr Pharm Des. 18:51-56.
35. Sasaki M., Ozawa Y., Kurihara T., Noda K., Imamura Y., Kobayashi S., Ishida S., Tsubota K. 2009. Neuroprotective effect of an antioxidant, lutein, during retinal inflammation. Invest Ophthalmol Vis Sci. 50:1433-1439.
36. Woo T. T., Li S. Y., Lai W. W., Wong D., Lo A. C. 2013. Neuroprotective effects of lutein in a rat model of retinal detachment. Graefes Arch Clin Exp Ophthalmol. 251:41-51.
37. Friedman D. S., O'Colmain B. J., Munoz B., Tomany S. C., McCarty C., de Jong P. T., Nemesure B., Mitchell P., Kempen J., Eye Diseases Prevalence Research G. 2004. Prevalence of age-related macular degeneration in the United States. Arch Ophthalmol. 122:564-572.
38. Eljarrat-Binstock E., Orucov F., Aldouby Y., Frucht-Pery J., Domb A. J. 2008. Charged nanoparticles delivery to the eye using hydrogel iontophoresis. J Control Release. 126:156-161.
39. Gungor S., Delgado-Charro M. B., Ruiz-Perez B., Schubert W., Isom P., Moslemy P., Patane M. A., Guy R. H. 2010. Trans-scleral iontophoretic delivery of low molecular weight therapeutics. J Control Release. 147:225-231.
40. Pascolini D., Mariotti S. P., Pokharel G. P., Pararajasegaram R., Etya'ale D., Negrel A. D., Resnikoff S. 2004. 2002 global update of available data on visual impairment: a compilation of population-based prevalence studies. Ophthalmic Epidemiol. 11:67-115.
41. Congdon N., O'Colmain B., Klaver C. C., Klein R., Munoz B., Friedman D. S., Kempen J., Taylor H. R., Mitchell P., Eye Diseases Prevalence Research G. 2004. Causes and prevalence of visual impairment among adults in the United States. Arch Ophthalmol. 122:477-485.
42. Seddon J. M., Ajani U. A., Sperduto R. D., Hiller R., Blair N., Burton T. C., Farber M. D., Gragoudas E. S., Haller J., Miller D. T., et al. 1994. Dietary carotenoids, vitamins A, C, and E, and advanced age-related macular degeneration. Eye Disease Case-Control Study Group. JAMA. 272:1413-1420.
43. van de Kraats J., Kanis M. J., Genders S. W., van Norren D. 2008. Lutein and zeaxanthin measured separately in the living human retina with fundus reflectometry. Invest Ophthalmol Vis Sci. 49:5568-5573.
44. Barker F. M., 2nd, Snodderly D. M., Johnson E. J., Schalch W., Koepcke W., Gerss J., Neuringer M. 2011. Nutritional manipulation of primate retinas, V: effects of lutein, zeaxanthin, and n-3 fatty acids on retinal sensitivity to blue-light-induced damage. Invest Ophthalmol Vis Sci. 52:3934-3942.
45. Cunha-Vaz J., Bernardes R., Lobo C. 2011. Blood-retinal barrier. Eur J Ophthalmol. 21 Suppl 6:S3-9.
46. Prausnitz M. R., Noonan J. S. 1998. Permeability of cornea, sclera, and conjunctiva: a literature analysis for drug delivery to the eye. J Pharm Sci. 87:1479-1488.
47. www.jove.com/video/3765
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННЫЕ ЛИПОСОМЫ В КАЧЕСТВЕ ЛИПОФИЛЬНЫХ МОЛЕКУЛ-НОСИТЕЛЕЙ | 2017 |
|
RU2718065C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ВВЕДЕНИЯ СРЕДСТВ, СВЯЗЫВАЮЩИХ ТУБУЛИН, ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2354398C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ВВЕДЕНИЯ СРЕДСТВ, СВЯЗЫВАЮЩИХ ТУБУЛИН, ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ ЗАБОЛЕВАНИЙ | 2004 |
|
RU2359693C2 |
| Лечение глазных болезней типа дегенерации желтого пятна, глаукомы и диабетической ретинопатии с помощью лекарственных средств, устраняющих стареющие клетки | 2018 |
|
RU2815482C2 |
| ИНГИБИТОРЫ ГИСТОНДЕАЦЕТИЛАЗЫ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ ГЛАЗ | 2003 |
|
RU2324483C2 |
| НУТРИЦЕВТИЧЕСКАЯ ОФТАЛЬМОЛОГИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЙ СЕТЧАТКИ С НЕОВАСКУЛЯРНЫМ КОМПОНЕНТОМ | 2019 |
|
RU2806096C2 |
| ОФТАЛЬМОЛОГИЧЕСКОЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ НЕОАНГИОГЕННЫХ ПАТОЛОГИЙ ГЛАЗА | 2009 |
|
RU2519739C2 |
| АНТАГОНИСТЫ ИНТЕГРИНОВЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2721907C2 |
| ГЛАЗНОЙ ИМПЛАНТАТ, ИЗГОТАВЛИВАЕМЫЙ СПОСОБОМ ДВОЙНОЙ ЭКСТРУЗИИ | 2005 |
|
RU2389479C2 |
| Способ ранней диагностики первичной открытоугольной глаукомы | 2019 |
|
RU2698931C1 |
Изобретение имеет отношение к способу отложения лютеина и/или зеаксантина в глазных тканях, а также к способу лечения, облегчения или профилактики глазного заболевания или нарушения функции. Способ отложения лютеина и/или зеаксантина включает стадии получения липосомы, содержащей лютеин и /или зеаксантин в количествах, эффективных для увеличения уровней пигмента желтого пятна в тканях глаза субъекта, зарядки устройства для ионтофореза композицией липосом, содержащих лютеин и/или зеаксантин, наложения устройства для ионтофореза на глаз субъекта и приведения устройства для ионтофореза в действие. Технический результат – разработка минимально инвазивного способа перемещения высоких концентраций заряженного лютеина через склеру и/или через роговицу посредством ионтофореза. 2 н. и 4 з.п. ф-лы, 5 табл., 4 ил., 2 пр.
1. Способ отложения лютеина и/или зеаксантина в глазных тканях, включающий стадии получения липосомы, содержащей лютеин и/или зеаксантин в количествах, эффективных для увеличения уровней пигмента желтого пятна в тканях глаза субъекта, зарядки устройства для ионтофореза композицией липосом, содержащих лютеин и/или зеаксантин, наложения устройства для ионтофореза на глаз субъекта и приведения устройства для ионтофореза в действие.
2. Способ по п. 1, в котором липосома имеет положительный дзета-потенциал.
3. Способ лечения, облегчения или профилактики глазного заболевания или нарушения функции, включающий стадии получения липосомы, содержащей лютеин и/или зеаксантин, зарядки устройства для ионтофореза композицией липосом, содержащих лютеин и/или зеаксантин, наложения устройства для ионтофореза на глаз субъекта и приведения устройства для ионтофореза в действие.
4. Способ по п. 3, в котором лечение, облегчение или профилактика глазного заболевания или нарушения функции представляет собой задержку начала возрастной дегенерации желтого пятна.
5. Способ по п. 3, в котором глазное заболевание или нарушение функции представляет собой возрастную дегенерацию желтого пятна.
6. Способ по п. 3, в котором облегчение или профилактика глазного заболевания или нарушения функции включает выполнение способа у здоровых субъектов.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Электрический измерительный прибор | 1928 |
|
SU11864A1 |
| МАСЛЯНЫЙ НАСОС | 1929 |
|
SU17945A1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИЗДЕЛИЕ, СОДЕРЖАЩЕЕ ЕЕ, И СПОСОБ КОРРЕКЦИИ ДЕФЕКТОВ ПРЕЛОМЛЕНИЯ В ГЛАЗУ МЛЕКОПИТАЮЩЕГО | 1992 |
|
RU2137449C1 |
Авторы
Даты
2019-11-20—Публикация
2015-12-21—Подача