ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к серии соединений гидрохинона, к способам их получения и применению в противоопухолевой или иммуномодуляторной терапии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Солидная опухоль, кроме раковых клеток, также содержит фибробласты, эндотелиальные клетки, различные иммунные клетки и значительное количество внеклеточного матрикса и т.п. Иммунные клетки играют ключевую роль в процессах инвазии, метастазирования опухоли и ускользания от иммунного ответа, где опухоль-ассоциированные макрофаги (OAM) составляют значительную долю в интерстициальных клетках опухоли, и большинство из них мигрирует и претерпевает дифференцировку из мононуклеарных клеток периферической крови и созревает под действием опухолевых клеток и их микроокружения. ОАМ могут секретировать различные факторы роста, цитокины, иммуносупрессивную среду и протеолитические ферменты, что стимулирует развитие и метастазирование опухоли.
Опухоль-ассоциированные макрофаги могут претерпевать поляризацию на два вида фенотипа: макрофаг M1 и макрофаг М2. Макрофаги M1 также называют классически активированными макрофагами, которые обладают очень сильным провоспалительным и поражающим эффектом в отношении патогенов и могут стимулировать клеточный ответ Th1-типа, опосредованный воспалительными факторами, такими как интерлейкин 12 (IL12), интерлейкин 23 (IL23) и т.п.; макрофаги М2, также называемые альтернативно активированными макрофагами, обладают функциями иммуномодуляции, тканевого ремоделирования и проангиогенеза и т.п. Все большее количество данных показывает, что опухоль-ассоциированные макрофаги (ОАМ) играют ключевую роль «палки о двух концах» в образовании и развитии злокачественных опухолей: макрофаги M1 могут убивать опухолевые клетки, тогда как макрофаги М2 играют критическую роль в инициации, стимуляции и метастазировании опухолевых клеток (Cell 2010, 141:39-51). Поляризация ОАМ тесно связана с микроокружением опухоли и часто презентирует поляризованное состояние М2 в злокачественной опухоли. Таким образом, восстановление микроокружения опухоли ингибированием М2-поляризации ОАМ может изменить микроокружение опухолевых клеток, стимулировать смерть опухолевых клеток, ингибируя, таким образом, инициацию, стимуляцию и метастазирование опухоли.
В недавнем исследовании показано, что антиоксиданты, такие как 2-трет-бутил-4-метоксифенол (ВНА), апоцинин, стабильный радикал (2,2,6,6-тетраметилпиперидин-1-ил)оксил (TEMPO) и N-ацетилцистеин (NAC) и т.п. могут ингибировать образование активных радикалов кислорода (активных форм кислорода, АФК), ингибируя таким образом дифференцировку моноцитов в направлении макрофагов М2, и впоследствии -образование рака легкого в модели мышей K-rasLA2 (Cell Research 2013, 23:898-914). Тем не менее также проведено множество исследований, в которых показано, что антиоксиданты должны ускорять рост опухоли, что расходится с противоопухолевой активностью 2-трет-бутил-4-метоксифенола in vivo, таким образом, ингибирование образования АФК является только одним из факторов ингибирования М2-поляризации ОАМ под действием 2-трет-бутил-4-метоксифенола, и также существуют другие механизмы М2-поляризации ОАМ под действием ВНА, ингибирующие, таким образом, образование и развитие опухоли (Cancer Res. 1986, 46, 165-168; Cancer Res., 1985, 45:1-8). Однако, что парадоксально, в более раннем исследовании были получены данные о том, что 2-трет-бутил-4-метоксифенол обладает канцерогенным действием (Archives of Biochemistry and Biophysics 2006, 449, 71-177; Regulatory Toxicology and Pharmacology 47 (2007) 68-77; Food and Chemical Toxicology 2000, 38,1075-1084).
Как описано в литературе (Cell Research 2013, 23:898-914.), в модели мышей K-rasLA2, которым давали корм, содержащий 0,75% ВНА, было отмечено полное ингибирование развития рака легкого. Однако с учетом различий площади поверхности тела и биологических видов эта дозировка в пересчете на человека с массой тела 60 кг соответствует 7,5 г/сутки. Данная дозировка существенно превышает количество для приема внутрь, составляющее 0,5 мг/кг массы тела в сутки в соответствии с нормативными требованиями, установленными в Европейском Союзе и в США, а также превышает верхний предел 0,2 г/кг 2-трет-бутил-4-метоксифенола, добавляемого в пищу, в соответствии с нормативами, установленными в Китае. Поэтому 2-трет-бутил-4-метоксифенол не пригоден для непосредственного применения в качестве противоопухолевого терапевтического лекарственного средства.
Следовательно, существует потребность в дополнительной оценке терапевтических воздействий 2-трет-бутил-4-метоксифенола на опухоли.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения состоит в разработке серии соединений гидрохинона, способов их получения и их применения в противоопухолевой или иммуномодуляторной терапии.
Структурная формула соединения гидроксихинона, предложенного авторами настоящего изобретения, представлена формулой I, и его фармацевтические соли, гидраты или сольваты также находятся в диапазоне защиты настоящего изобретения,
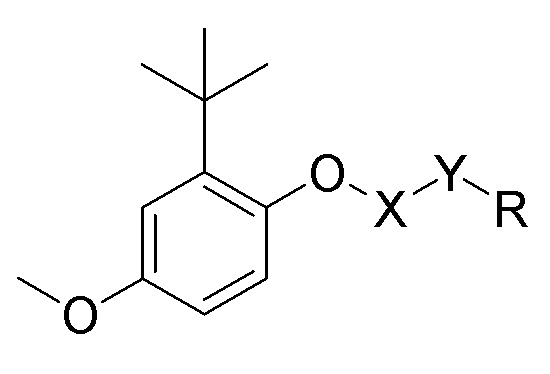
формула I
при этом в формуле I X представляет собой С=O или СН2, R выбран из любой из следующих групп: замещенной или незамещенной алкильной группы, имеющей по меньшей мере один атом углерода, замещенной или незамещенной циклоалкильной группы, содержащей по меньшей мере три атома углерода, замещенной или незамещенной алкенильной группы или алкинильной группы, имеющей по меньшей мере два атома углерода, и замещенной или незамещенной арильной группы или гетероарильной группы;
в формуле I Y представляет собой NH, О или отсутствует;
группы заместителей в R представляют собой атом галогена, аминогруппу, нитрогруппу, сложноэфирную группу, карбонильную группу, производные аминокислот, природный флавон, природный алкалоид, полиэтиленгликоль, полиглутаминовую кислоту или полисахарид.
В формуле I число атомов углерода алкильной группы составляет 1-40, предпочтительно 1-30, более предпочтительно 1-25; число атомов углерода циклоалкильной группы может составлять 3-40, предпочтительно 3-30, более предпочтительно 3-25; число атомов углерода алкенильной группы или алкинильной группы составляет 2-40, предпочтительно 2-30, более предпочтительно 2-25.
В формуле I арильная группа или гетероарильная группа, в частности, могут представлять собой нафталиновые кольца, индол, бензольные кольца, пиридин, пурин, пиримидин, имидазол, фуран, пиррол или бензогетероцикл и т.п.
В формуле I X и Y выбраны из любого из следующего 1)-3):
1) когда X представляет собой С=O, Y представляет собой NH;
2) когда X представляет собой СН2, Y представляет собой О;
3) когда X представляет собой С=O или СН2, Y отсутствует.
Соединение, представленное формулой I, включает без ограничений любое из следующих соединений 1)-66):
1) (2-трет-бутил-4-метоксифенол)(N-бензил)карбамат, 2) (2-трет-бутил-4-метоксифенол)(N-н-бутил)карбамат, 3) (2-трет-бутил-4-метоксифенол)(N-изопропил)карбамат, 4) (2-трет-бутил-4-метоксифенол)(N-циклогексил)карбамат, 5) (2-трет-бутил-4-метоксифенол)(N-фенэтил)карбамат, 6) пивалоил(2-трет-бутил-4-метоксифенолоксил)метиловый эфир; 7) 2-трет-бутил-4-метоксифенолбензоат, 8) 2-трет-бутил-4-метоксифенолацетат, 9) 2-трет-бутил-4-метоксифенолникотинат, 10) 2-трет-бутил-4-метоксифенолизоникотинат, 11) 2-трет-бутил-4-метоксифенолциклогексенкарбоксилат, 12) 2-трет-бутил-4-метоксифенолпропионат, 13) 2-трет-бутил-4-метоксифенолакрилат, 14) (2-трет-бутил-4-метоксифенол)-3,4-диметоксифенилацетат, 15) 2-трет-бутил-4-метоксифенолбутиноат, 16) бис(2-трет-бутил-4-метоксифенол)-2,2'-бифенилдикарбоксилат, 17) (2-трет-бутил-4-метоксифенол)-2-хлор-5-трифторметилбензоат, 18) (2-трет-бутил-4-метоксифенол)-3-фторфенилацетат, 19) (2-трет-бутил-4-метоксифенол)(1Н-индол-3-ил)ацетат, 20) (2-трет-бутил-4-метоксифенол)-3-(4-фторфенил)-пропионат, 21) (2-трет-бутил-4-метоксифенол)-М-трет-бутоксикарбонилпиперидин-3-формиат, 22) ди(2-трет-бутил-4-метоксифенол)терефталат, 23)(2-трет-бутил-4-метоксифенол)-3-(3-нитрофенил)пропионат, 24) (2-трет-бутил-4-метоксифенол)-4-фенилбензоат, 25) (2-трет-бутил-4-метоксифенол)-4-метилпиридин-3-формиат, 26) (2-трет-бутил-4-метоксифенол)-4-метоксипиридин-3-формиат, 27) 2-трет-бутил-4-метоксифенолгексадецилат, 28) и (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилглицинат, 29) (2-трет-бутил-4-метоксифенол)-3-фтор-4-хлорбензоат, 30) N-трет-бутоксикарбонилтетрагидропиррол, (2-трет-бутил-4-метоксифенол)бензогетероцикл-3-формиат, 31) (2-трет-бутил-4-метоксифенол)-3-цианобензоат, 32) (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилаланинат, 33) (2-трет-бутил-4-метоксифенол)-2-нафтоат, 34) ди(2-трет-бутил-4-метоксифенол)малонат, 35) (2-трет-бутил-4-метоксифенол)-3,6-дихлорпиридазин-4-формиат, 36) (2-трет-бутил-4-метоксифенол)-1-метилциклопропилформиат, 3 7) (2-трет-бутил-4-метоксифенол)-2-индолформиат, 38) (2-трет-бутил-4-метоксифенол)-2-хлор-3-пиколинат, 39) (2-трет-бутил-4-метоксифенол)-2-тиофенацетат, 40) (2-трет-бутил-4-метоксифенол)-3-(4-метилфенил) пропионат, 41) (2-трет-бутил-4-метоксифенол)пропиолат, 42) (2-трет-бутил-4-метоксифенол)-2-фенилпропионат, 43) (2-трет-бутил-4-метоксифенол)-2-фторпропионат, 44) (2-трет-бутил-4-метоксифенол)циклогексилацетат, 45) (2-трет-бутил-4-метоксифенол)циклопентанкарбоксилат, 46) (2-трет-бутил-4-метоксифенол)адамантанацетат, 47) (2-трет-бутил-4-метоксифенол)циклопропилацетат, 48) (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилпиперидин-4-формиат, 49) (2-трет-бутил-4-метоксифенол)октаноат, 50) (2-трет-бутил-4-метоксифенол)-7-оксооктаноат, 51) (2-трет-бутил-4-метоксифенол)циклогексен-2-карбоксилат, 52) (2-трет-бутил-4-метоксифенол)-2,4,5-трифторфенилацетат, 53) (2-трет-бутил-4-метоксифенол)-2-бром-5-йодбензоат, 54) (2-трет-бутил-4-метоксифенол)-2-фтор-4-нитрилбензоат, 55) (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилпиперидин-3-формиат, 56) ди(2-трет-бутил-4-метоксифенол)-пара-фенилендиацетат, 57) (2-трет-бутил-4-метоксифенол)-4-бензоилбутират, 58) (2-трет-бутил-4-метоксифенол)-3,5-диметоксифенилпропеноат, 59) (2-трет-бутил-4-метоксифенол)-4-хлорпиридин-2-формиат, 60) (2-трет-бутил-4-метоксифенол)-N-метилпиперидин-3-формиат, 61) (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонил-6-аминопентаноат, 62) (2-трет-бутил-4-метоксифенол)-3,3,3-трифторпропионат, 63) (2-трет-бутил-4-метоксифенол)морфолин-4-илацетат, 64) (2-трет-бутил-4-метоксифенол)-3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионат, 65) ди(2-трет-бутил-4-метоксифенол)адипат; и 66) 2-(2-трет-бутил-4-метоксифенокси)этилацетат.
В настоящем изобретении дополнительно предложен способ получения соединения, представленного формулой I, включающий следующие стадии (1), (2), (3) или (4):
1) когда X представляет собой С=O, Y представляет собой NH, способ включает следующие стадии:
RNH2 подвергают взаимодействию с трифосгеном с получением R-N=C=O; соединение, представленное формулой I, получают посредством реакции конденсации R-N=C=O с 2-трет-бутил-4-метоксифенолом;

формула I
при этом в формуле I в RCH2 и R-N=C=O R выбран из любой из следующих групп: замещенной или незамещенной алкильной группы, имеющей по меньшей мере один атом углерода, замещенной или незамещенной циклоалкильной группы, имеющей по меньшей мере три атома углерода, замещенной или незамещенной алкенильной группы или алкинильной группы, имеющей по меньшей мере два атома углерода, и замещенной или незамещенной арильной группы или гетероарильной группы;
группы заместителей в R представляют собой атом галогена, аминогруппу, нитрогруппу, сложноэфирную группу, карбонильную группу, производные аминокислот, природный флавон, природный алкалоид, полиэтиленгликоль, полиглутаминовую кислоту или полисахарид;
в формуле I X представляет собой C=O, Y представляет собой NH;
2) когда X представляет собой CH2, Y представляет собой O, способ включает следующие стадии:
получение соединения, представленного формулой I, посредством реакции конденсации 2-трет-бутил-4-метоксифенола натрия с соединением, представленным формулой 1;


формула I формула 1
при этом в формуле I и в формуле 1 R выбран из любой из следующих групп: замещенной или незамещенной алкильной группы, имеющей по меньшей мере один атом углерода, замещенной или незамещенной циклоалкильной группы, имеющей по меньшей мере три атома углерода, замещенной или незамещенной алкенильной группы или алкинильной группы, имеющей по меньшей мере два атома углерода, и замещенной или незамещенной арильной группы или гетероарильной группы;
группы заместителей в R представляют собой атом галогена, аминогруппу, нитрогруппу, сложноэфирную группу, карбонильную группу, производные аминокислот, природный флавон, природный алкалоид, полиэтиленгликоль, полиглутаминовую кислоту или полисахарид;
в формуле IX представляет собой СН2, Y представляет собой О;
(3) когда X представляет собой С=O, Y отсутствует, то есть соединение представлено формулой II, способ включает следующие стадии 1) или 2):
1) получение соединения, представленного формулой II, посредством конденсации 2-трет-бутил-4-метоксифенола натрия с хлорангидридом карбоновой кислоты, представленным формулой 2;

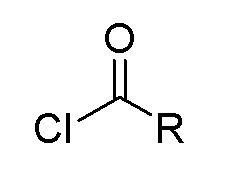
формула II формула 2
при этом в формуле II и в формуле 2 R выбран из любой из следующих групп: замещенной или незамещенной алкильной группы, имеющей по меньшей мере один атом углерода, замещенной или незамещенной циклоалкильной группы, имеющей по меньшей мере три атома углерода, замещенной или незамещенной алкенильной группы или алкинильной группы, имеющей по меньшей мере два атома углерода, и замещенной или незамещенной арильной группы или гетероарильной группы;
группы заместителей в R представляют собой атом галогена, аминогруппу, нитрогруппу, сложноэфирную группу, карбонильную группу, производные аминокислот, природный флавон, природный алкалоид, полиэтиленгликоль, полиглутаминовую кислоту или полисахарид;
в формуле II X представляет собой С=O;
2) получение соединения, представленного формулой II, посредством конденсации 2-трет-бутил-4-метоксифенола натрия с карбоновой кислотой, представленной формулой 3;

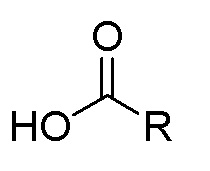
формула II формула 3
при этом в формуле II и в формуле 3 R выбран из любой из следующих групп: замещенной или незамещенной алкильной группы, имеющей по меньшей мере один атом углерода, замещенной или незамещенной циклоалкильной группы, имеющей по меньшей мере три атома углерода, замещенной или незамещенной алкенильной группы или алкинильной группы, имеющей по меньшей мере два атома углерода, и замещенной или незамещенной арильной группы или гетероарильной группы;
группы заместителей в R представляют собой атом галогена, аминогруппу, нитрогруппу, сложноэфирную группу, карбонильную группу, производные аминокислот, природный флавон, природный алкалоид, полиэтиленгликоль, полиглутаминовую кислоту или полисахарид;
в формуле II X представляет собой С=O;
(4) когда X представляет собой СН2, Y отсутствует, то есть соединение представлено формулой II, способ включает следующую стадию:
1) получение соединения, представленного формулой II, посредством реакции конденсации 2-трет-бутил-4-метоксифенола натрия с соединением, представленным формулой 4;

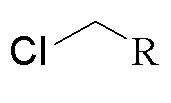
формула II формула 4
при этом в формуле II и в формуле 4 R выбран из любой из следующих групп: замещенной или незамещенной алкильной группы, имеющей по меньшей мере один атом углерода, замещенной или незамещенной циклоалкильной группы, имеющей по меньшей мере три атома углерода, замещенной или незамещенной алкенильной группы или алкинильной группы, имеющей по меньшей мере два атома углерода, и замещенной или незамещенной арильной группы или гетероарильной группы;
группы заместителей в R представляют собой атом галогена, аминогруппу, нитрогруппу, сложноэфирную группу, карбонильную группу, производные аминокислот, природный флавон, природный алкалоид, полиэтиленгликоль, полиглутаминовую кислоту или полисахарид;
X представляет собой СН2.
В описанном выше способе получения реакцию конденсации можно проводить в традиционных условиях реакции, таких как комнатная температура, нагревание, кипячение с обратным холодильником, ледяная баня и т.п.
Соединение, представленное формулой I, его фармацевтически приемлемые соли, гидраты или сольваты можно применять в противоопухолевой или иммуномодуляторной терапии, т.е. соединение, представленное формулой I, можно использовать для высвобождения 2-трет-бутил-4-метоксифенола in vivo.
В настоящем изобретении подтверждается, что 2-трет-бутил-4-метоксифенол (ВНА) может ингибировать поляризационный эффект макрофагов М2, а также противоопухолевый противометастатический эффект 2-трет-бутил-4-метоксифенола в модели рака молочной железы Her2 у мышей; введение дозировки 2-трет-бутил-4-метоксифенола (50-1000 мг/кг массы тела (МТ)) мышам HER2 частями демонстрирует очевидные противоопухолевые эффекты.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
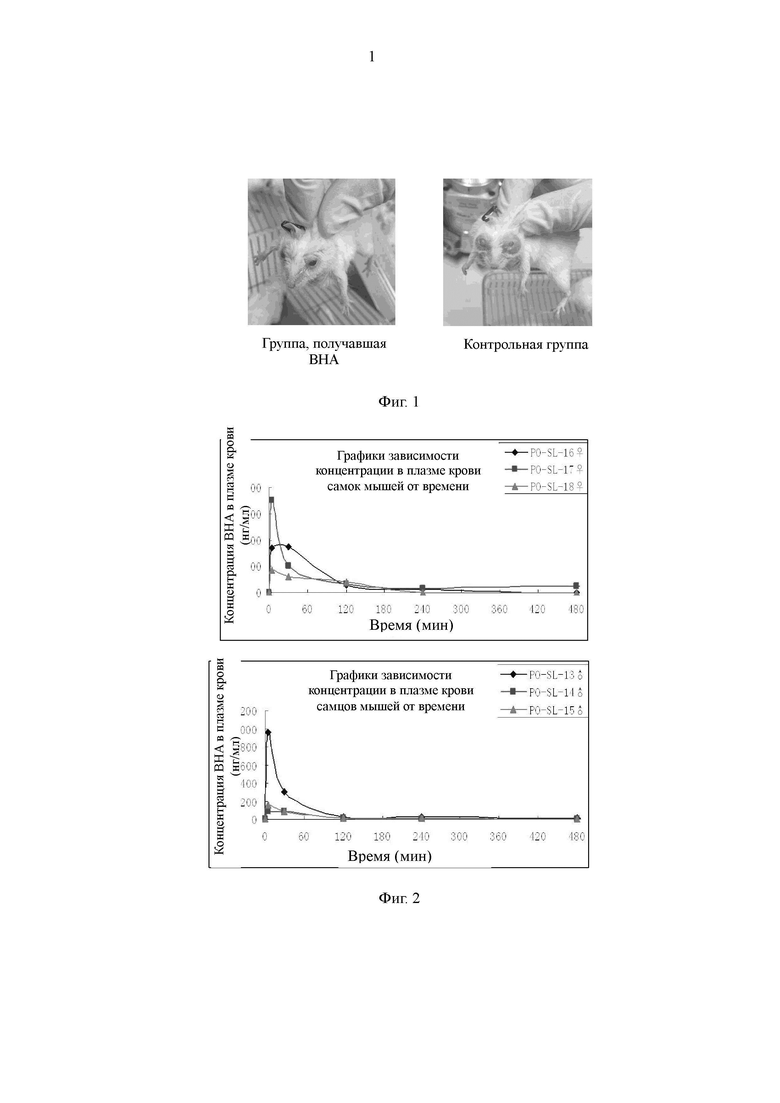
На Фиг. 1 представлена схема, иллюстрирующая, что 2-трет-бутил-4-метоксифенол ингибирует поляризационный эффект макрофагов М2.
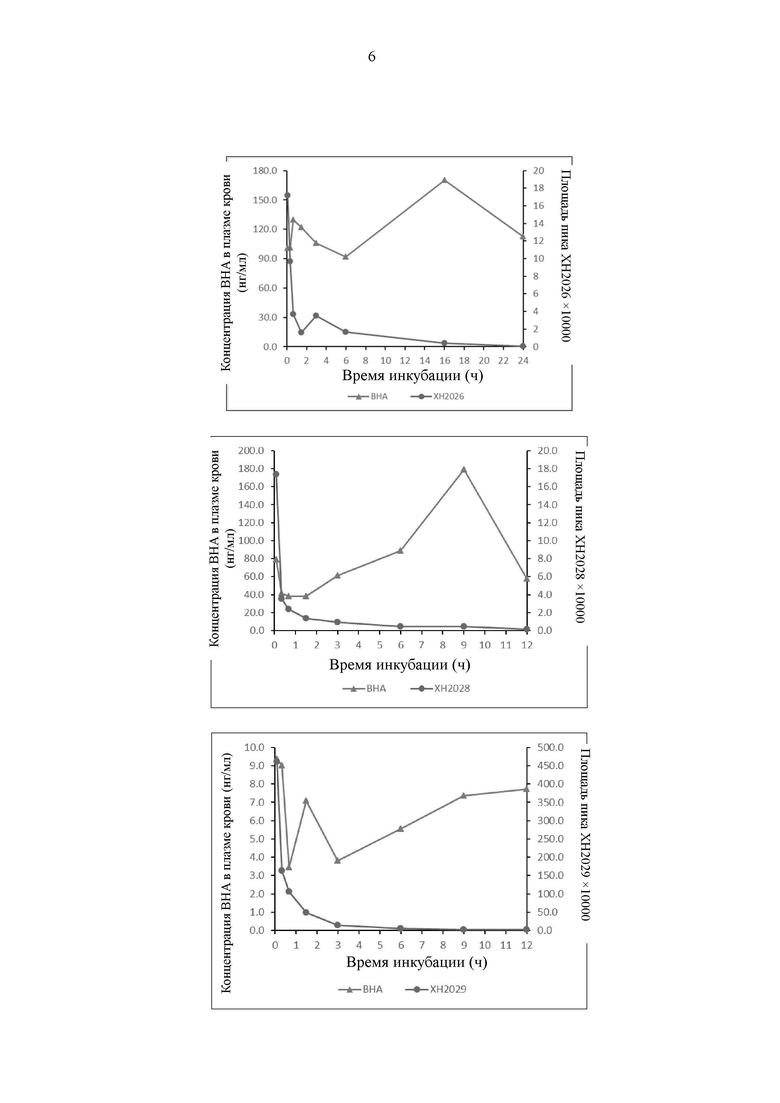
На Фиг. 2 представлены результаты экспериментов по метаболизму ВНА у мышей in vivo.
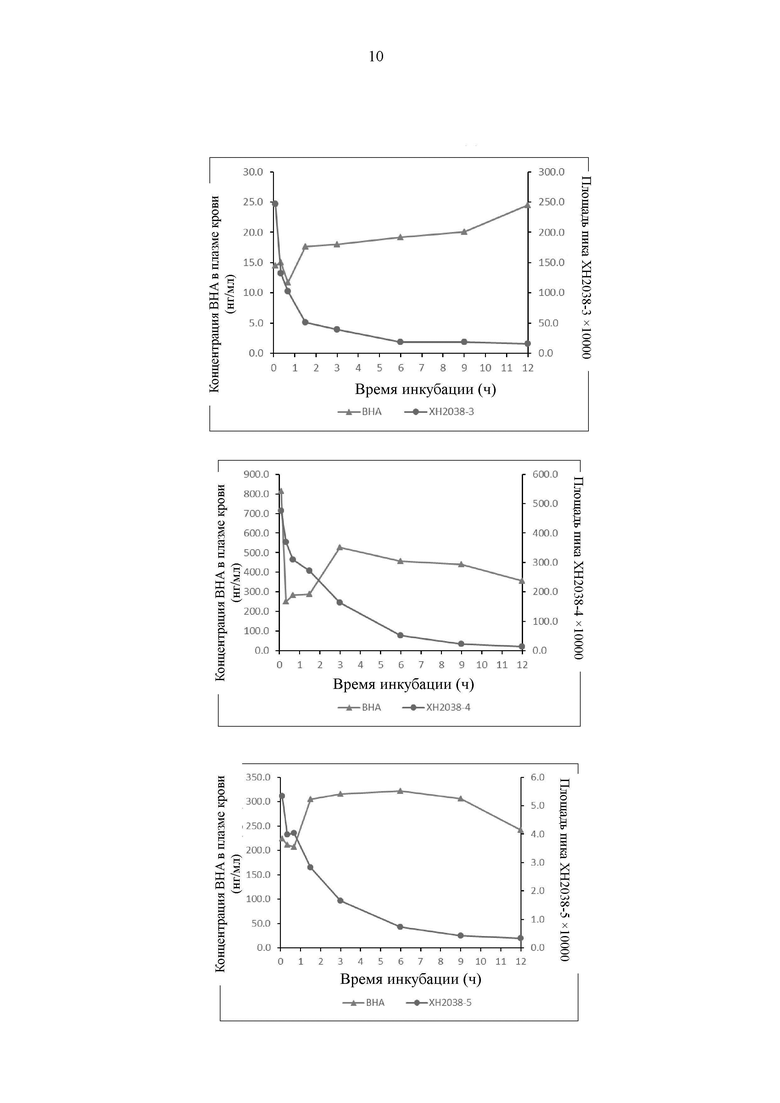
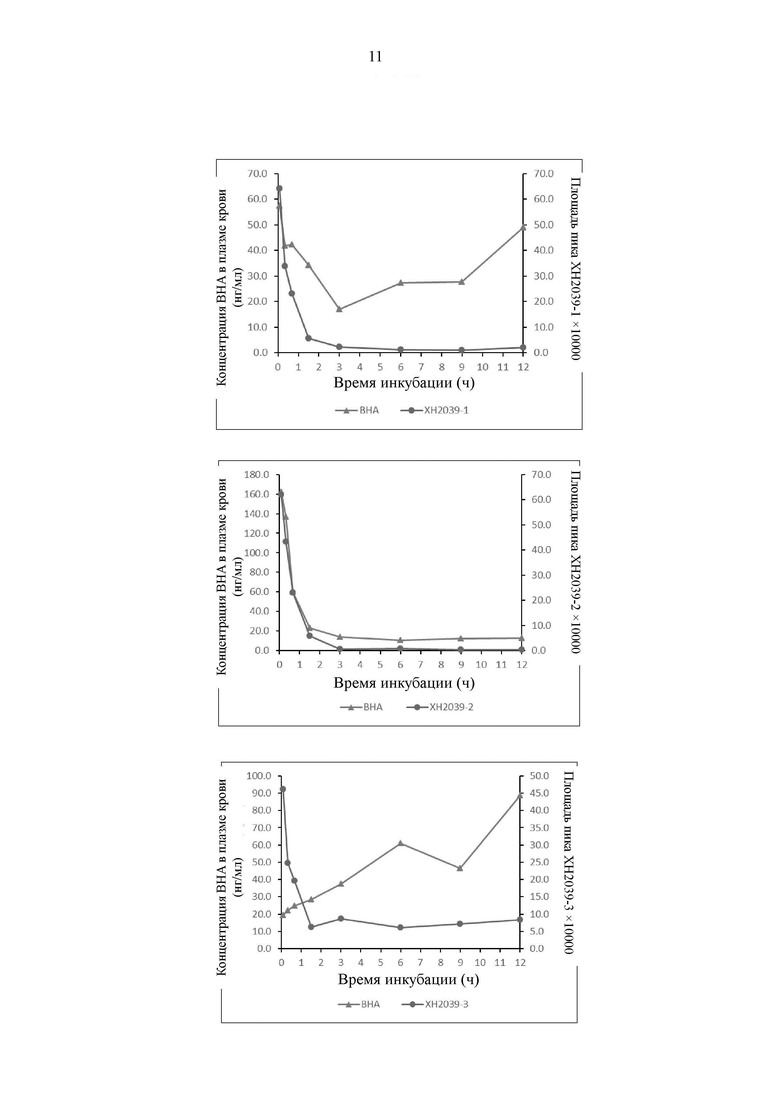
На Фиг. 3 представлен график, иллюстрирующий, что соединение по настоящему изобретению высвобождает ВНА в плазме крови человека.
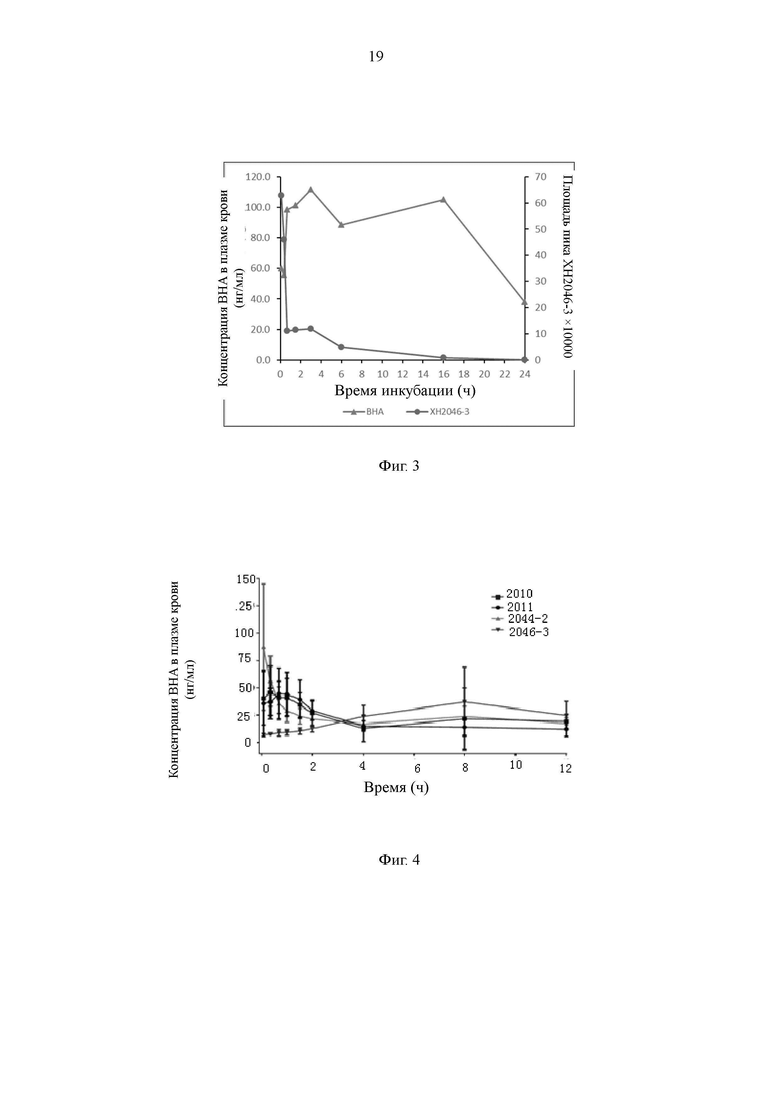
На Фиг. 4 представлен график, иллюстрирующий, что соединение по настоящему изобретению высвобождает ВНА у мышей in vivo.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет объяснено посредством приведенных ниже конкретных примеров, тем не менее настоящее изобретение не ограничено ими.
Все экспериментальные методы в приведенных ниже примерах представляют собой традиционные методы, если не указано иное; все реактивы и материалы могут быть приобретены коммерческим путем.
В настоящем изобретении впервые подтверждено, что 2-трет-бутил-4-метоксифенол (ВНА) ингибирует поляризационный эффект макрофагов М2, и подтвержден противоопухолевый противометастатический эффект 2-трет-бутил-4-метоксифенола в модели рака молочной железы Her2 у мышей, как показано на Фиг. 1. В модели опухоли Her2 рака молочной железы метастазы в голове не наблюдали в группе, получавшей ВНА (см. фигуру слева). Метастазы в голове, приводящие к слепоте, наблюдали у мышей в контрольной группе с холостой пробой (см. фигуру справа). В то же время, с помощью тестов метаболизма лекарственного средства обнаружено, что период полувыведения ВНА in vivo является очень коротким, составляя лишь 30-60 минут, как показано на Фиг. 2. Кроме того, в настоящем изобретении был проведен токсикологический эксперимент, и обнаружено, что центральный эффект частичного «похмельного состояния», который может разрешаться через полчаса, наблюдается только у мышей, получавших 600 мг/кг. У половины мышей, получавших 1100 мг/кг, наступил летальный исход, а у выживших мышей через 30-60 минут симптомы токсической реакции исчезли. Токсический эффект у мышей, получавших низкую дозу, которую вводили в течение длительного двухлетнего периода, не наблюдали. Следовательно, в сочетании с результатами исследования продукта метаболизма 2-трет-бутил-4-метоксифенола в литературе (оказывающего повреждающее действие на ДНК, Food and Chemical Toxicology 1999, 37: 1027-1038) в настоящем изобретении сделано заключение, что сам 2-трет-бутил-4-метоксифенол обладает противоопухолевым эффектом, и взаимодействие между продуктом его метаболизма трет-бутилгидрохиноном (TBHQ) и ДНК может привести в результате к проявлению его побочных эффектов.
В результате углубленного анализа было обнаружено, что и абсорбция после перорального введения, и метаболизм 2-трет-бутил-4-метоксифенола происходят очень быстро (время до достижения максимальной концентрации 5 мин, Т1/2 равно 20 мин у мышей), концентрация в плазме крови при каждом введении имеет импульсный характер с очень небольшим временным интервалом, и при максимальной концентрации лекарственного средства, значительно превышающей минимальную эффективную концентрацию, это является не только недостатком для проявления терапевтического эффекта, но также приводит к неизбежному проявлению токсического побочного эффекта.
Таким образом, если высвобождение 2-трет-бутил-4-метоксифенола может быть контролируемым, что позволит поддерживать его стабильную концентрацию в плазме крови, может быть не только достигнута повышенная эффективность и пониженная токсичность, но также эффективно снижена доза 2-трет-бутил-4-метоксифенола. В то же время, поскольку 2-трет-бутил-4-метоксифенол является антиоксидантом и легко окисляется, его стабильность в окружающей среде и метаболизм в печени (пресистемный метаболизм оказывает серьезное влияние) также создают непосредственное препятствие для его действия в качестве лекарственного средства. В целях контроля высвобождения 2-трет-бутил-4-метоксифенола, повышения его стабильности в окружающей среде и уменьшения влияния пресистемного метаболизма, насколько это возможно, что повышает безопасность лекарственных средств, в настоящем изобретении предложено пролекарство 2-трет-бутил-4-метоксифенола и подтверждены характеристики его высвобождения in vivo и in vitro, цитотоксичность и безопасность in vivo.
Пример 1. Получение 2-трет-бутил-4-метоксифенолбензоата (ХН2005) 2-трет-бутил-4-метоксифенол (0,9 г, 5 ммоль), растворенный в безводном тетрагидрофуране (20 мл), добавляют по каплям к смешанному раствору (10 мл) гидрида натрия (220 мг, 5,5 ммоль) и безводного тетрагидрофурана при 0-5°С, а затем подвергают взаимодействию в течение одного часа при этой температуре. К реакционному раствору, полученному на описанной выше стадии, добавляют по каплям бензоилхлорид (0,58 мл, 5 ммоль)/дихлорметан (10 мл), подвергают взаимодействию в течение двух часов при этой температуре, затем подвергают взаимодействию в течение трех часов при комнатной температуре. Растворитель удаляют при пониженном давлении, к остатку добавляют этилацетат (30 мл) и ледяную воду (10 мл), перемешивают до прозрачного состояния, жидкость разделяют и отбирают органический слой, промывают водой 10 мл × 3, высушивают безводным сульфатом натрия в течение ночи, подвергают колоночной хроматографии (элюент представляет собой этилацетат: петролейный эфир в соотношении 4:1) с получением 1,14 г белого твердого вещества. Выход составляет 80%. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 1,30 (s, 9Н), 3,78 (s, 3Н), 6,86-6,92 (m, 2Н), 7,09-7,11 (d, J=8,4 Гц, 1H), 7,62-7,66 (m, 2Н), 7,75-7,79 (m, 1Н), 8,15-8,17 (d, J=7,2 Гц, 2Н); 13С ЯМР (100 МГц, ДМСО-d6) δ: 29,8, 34,2, 55,3, 111,1, 113,1, 125,2, 129,2, 129,3, 129,7, 134,1, 141,9, 142,3, 156,6, 165,0.
Пример 2. Получение 2-трет-бутил-4-метоксифенолацетата (ХН2006) В соответствии со способом получения примера 1 2-трет-бутил-4-метоксифенол подвергают взаимодействию с гидридом натрия с последующим взаимодействием с ацетилхлоридом с получением соединения примера 2. Затем его очищают перекристаллизацией с этиловым спиртом. Выход составляет 90%. 1Н ЯМР (400 МГц, CDCl3) δ: 1,33 (s, 9Н), 2,32 (s, 3Н), 3,79 (s, 3Н), 6,72-6,75 (m, 1H), 6,91-6,93 (m, 2Н). 13С ЯМР (100 МГц, CDCl3) δ: 21,6, 30,1, 34,6, 55,6, 110,6, 113,9, 124,6, 142,4, 142,7, 156,9, 170,2.
Пример 3. 2-трет-бутил-4-метоксифенолникотинат (ХН2010)
Растворяют ниацин (0,62 г, 5 ммоль) в диметилформамиде (20 мл), затем добавляют дициклогексилкарбодиимид (1200 мг, 6 ммоль) и перемешивают в течение 5 минут. Добавляют 2-трет-бутил-4-метоксифенол (900 мг, 5 ммоль) и выдерживают при температуре 35-40°С в течение ночи. Удаляют диметилформамид при пониженном давлении. Затем растворяют остаток в смеси этилацетата (50 мл) и воды (2 мл) и перемешивают в течение 20 минут. Жидкость, полученную в результате фильтрования с отсасыванием, очищают колоночной хроматографией (элюент представляет собой этилацетат: петролейный эфир в соотношении 3: 1) с получением продукта. Выход составляет 73%. 1Н ЯМР (400 МГц, CDCl3) δ: 1,34 (s, 9Н), 3,81 (s, 3Н), 6,76-6,81 (m, 1Н), 6,97-7,03 (m, 2Н), 7,46-7,49 (m, 1Н), 8,44-8,47 (dt, J1=8,4 Гц, J2=2,0 Гц, 1H), 8,84-8,86 (dd, J1=4,8 Гц, J2=1,6 Гц, 1Н), 9,41-9,42 (d, J=2,0 Гц, 1Н); 13С ЯМР (100 МГц, CDCl3) δ: 30,2, 34,7, 55,6, 110,8, 114,1, 123,7, 124,7, 125,9, 137,7, 142,5, 142,7, 151,5, 154,1, 157,3, 164,6.
Пример 4. 2-Трет-бутил-4-метоксифенолизоникотинат (ХН2011)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации изоникотиновой кислоты и 2-трет-бутил-4-метоксифенола. Выход составляет 75%. 1Н ЯМР (400 МГц, CDCl3) δ: 1,33 (3,9Н), 3,81 (s, 3Н), 6,76-6,80 (m, 1H), 6,97-7,01 (m, 2Н), 8,00-8,02 (d, J=6,2 Гц, 2Н), 8,86-8,87 (d, J=6,2 Гц, 2Н). 13С ЯМР (100 МГц, CDCl3) δ: 30,4, 34,9, 55,6, 110,8, 114,3, 123,5, 124,5, 137,0, 142,4, 151,0, 157,4, 164,9.
Пример 5. Получение 2-трет-бутил-4-метоксифенолциклогексенкарбоксилата (ХН2015)
Способ получения аналогичен способу примера 3. Циклогексенкарбоновую кислоту и сложный эфир 2-трет-бутил-4-метоксифенола подвергают конденсации, и выход составляет 75%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,32 (s, 9Н), 1,83-1,87 (m, 1Н), 2,16-2,23 (m, 3Н), 2,43-2,45 (m, 2Н), 2,81-2,84 (m, 1Н), 3,79 (s, 3Н), 5,75 (d, J=1.1 Гц, 2Н), 6,71-6,74 (m, 1H), 6,85-6,87 (d, J=8,8 Гц, 1Н), 6,92-6,93 (d, J=3,0 Гц, 1Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 24,5, 24,9, 27,4, 30,0, 34,5, 39,9, 55,4, 110,5, 113,7, 124,4, 125,0, 126,8, 142,2, 142,9, 156,7, 174,8.
Пример 6. 2-трет-бутил-4-метоксифенолпропионат (ХН2016)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации пропионовой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 85%. 1H ЯМР (400 МГц, CDCl3) δ: 1,27-1,32 (m, 12Н), 2,59-2,63 (q, J=3,56 Гц, 2Н), 3,79 (s, 3Н), 6,77-6,75 (m, 1H), 6,89-6,93 (m, 2Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 9,0, 28,3, 30,1, 34,6, 55,5, 110,5, 113,8, 124,5, 142,3, 142,8, 156,8, 173,4.
Пример 7. 2-Трет-бутил-4-метоксифенолакрилат (ХН2017)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации акриловой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 55%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 6,94-6,97 (m, 2Н), 6,77-6,75 (m, 1H), 6,60 (m, 1H), 6,36 (m, 1H), 6,03-6,06 (d, J=24 Гц, 1Н), 3,81 (s, 3Н), 1,33 (s, 9Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 156,8, 142,5, 132,6, 128,5, 124,5, 113,9, 110,5, 55,5, 34,6, 30,0.
Пример 8. (2-Трет-бутил-4-метоксифенол)-3,4-диметоксифенилацетат (ХН2018)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 3,4-диметоксифенилуксусной кислоты и 2-трет-бутил-4-метоксифенола, и выход составляет 83%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 6,92-6,84 (m, 5Н), 6,72-6,68 (m, 1Н), 3,88 (s, 6Н), 3,82 (s, 2Н), 3,78 (s, 3Н), 1,27 (s, 9Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 170,8, 157,0, 149,1, 148,4, 142,9, 142,5, 125,7, 124,5, 122,0, 113,9, 112,7, 111,3, 110,6, 56,1, 56,0, 55, 6, 41,8, 34,6, 30,0.
Пример 9. 2-Трет-бутил-4-метоксифенолбутиноат (ХН2019)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации бутиновой кислоты и 2-трет-бутил-4-метоксифенола, и выход составляет 41%. 1Н ЯМР (400 МГц, CDCl3) δ: 1,35 (s, 9Н), 2,07 (s, 3Н), 3,82 (s, 3Н), 6,77-6,75 (m, 1Н), 6,94-6,97 (m, 2Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 29,5, 30,2, 34,7, 55,6, 72,6, 88,1, 110,6, 114,0, 124,5, 142,1, 142,7, 153,0, 157,3.
Пример 10. Бис(2-трет-бутил-4-метоксифенол)-2,2'-бифенилдикарбоксилат (ХН2020)
Способ получения аналогичен способу примера 3. 2,2'-бифенилдикарбоновую кислоту и 2-трет-бутил-4-метоксифенол подвергают взаимодействию с введением в реакционную смесь в исходном молярном соотношении 1: 2, и выход составляет 62%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,26 (s, 9Н), 3,76 (s, 6Н), 6,65-6,68 (m, 2Н), 6,77-6,79 (m, 2Н), 6,87-6,88 (m, 2Н), 7,26-7,29 (m, 2Н), 7,45-7,48 (m, 2Н), 7,55-7,58 (m, 2Н), 8,19-8,21 (dd, J1=7,8 Гц, J2=1,4 Гц, 2Н). 13С ЯМР (100 МГц, CDCl3) 5 (млн-1): 28,8, 33,2, 54,2, 109,2, 112.4, 123,2, 126,2, 127,6, 129,1, 130,7, 141,3, 141,5, 142,8, 155,4, 164,4.
Пример 11. (2-Трет-бутил-4-метоксифенол)-2-хлор-5-трифторметилбензоат (ХН2021)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2-хлор-5-трифторметилбензойной кислоты и 2-трет-бутил-4-метоксифенола, и выход составляет 74%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,38 (s, 9Н), 3,83 (s, 3Н), 6,80-6,82 (m, 1Н), 6,99 (m, 1Н), 7,06-7,08 (m, 1H), 7,60-7,64 (m, 1Н), 7,74-7,78 (m, 1H), 8,32 (s, 1Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,2, 34,7, 55,6, 110,8, 114,1, 124,5, 128,8, 129,7, 130,5, 132,3, 138,5, 142,6, 157,4, 163,5.
Пример 12. (2-Трет-бутил-4-метоксифенол)-3-фторфенилацетат (ХН2022)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 3-фторфенилуксусной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 80%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,23 (s, 9Н), 3,78 (s, 3Н), 3,88 (s, 2Н), 6,68-6,71 (m, 1Н), 6,81-6,85 (m, 2Н), 6,90-7,10 (m, 1H), 7,12-7,18 (m, 1Н),7,32-7,38 (m, 1Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 29,9, 34,5, 41,7, 55,5, 110,5, 113,8, 114,3, 114,5, 116,6, 124,3, 125,3, 130,1, 130,2, 135,3, 135,4, 142,3, 142,6, 156,9, 161,9, 164,1, 169,8.
Пример 13. (2-Трет-бутил-4-метоксифенол)(1Н-индол-3-ил)ацетат (ХН2023)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 1Н-индол-3-уксусной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 65%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,32 (s, 9Н), 3,81 (s, 3Н), 6,66-6,70 (m, 2Н), 6,78-6,82 (m, 1H), 6,85-6,90 (m, 1H), 7,12-7,42 (m, 2Н), 7,67 (m, 1H), 8,32 (s, 1H), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,0, 32,1, 34,7, 55,7, 107,9, 110,6, 111,0, 111,5, 113,9, 114,2, 119,0, 119,9, 122,4, 123,6, 124,6, 124,7, 132,5, 143,2, 143,7, 157,0, 157,5, 163,7, 171,2.
Пример 14. (2-трет-бутил-4-метоксифенол)-3-(4-фторфенил)пропионат (ХН2024)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 3-(4-фторфенил)пропионовой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 64%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,28 (s, 9Н), 2,88 (m, 2Н), 3,06 (m, 2Н), 3,82 (s, 3Н), 6,52 (m, 1Н), 6,79 (m, 1Н), 6,91 (m, 1Н), 6,99 (m, 2Н), 7,25 (m, 2Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,0, 34,4, 36,6, 55,4, 110,5, 111,7, 113,7, 115,2, 115,4, 124,4, 129,9, 135,7, 142,2, 142,5, 156,8, 160,3, 162,8, 171,6.
Пример 15. (2-Трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилпиперидин-3-формиат (ХН2025)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации N-трет-бутоксикарбонилпиперидин-3-муравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 60%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,32 (s, 9Н), 1,47 (s, 9Н), 1,76-1,82 (m, 2Н), 2,22-2,26 (m, 1Н), 2,79 (m, 1H), 2,84-2,88 (m, 1Н), 3,16-3,20 (m, 1Н), 3,82 (s, 3Н), 3,97-4,02 (m, 1Н), 4,33-4,36 (m, 1Н), 6,68 (m, 1Н), 6,83 (m, 1Н),6,92 (m, 1H), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 24,4, 27,5, 28,6, 29,7, 30,2, 34,8, 42,1, 55,7, 110,8, 113,9, 124,6, 142,8, 154,8, 157,1, 172,6.
Пример 16. Ди(2-трет-бутил-4-метоксифенол)терефталат (ХН2026)
Способ получения аналогичен способу примера 3. Пара-фталевую кислоту (5 ммоль) и 2-трет-бутил-4-метоксифенол (10 ммоль) конденсируют, выход составляет 55%.
1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,37 (s, 18Н), 3,83 (s, 6Н), 6,80-6,83 (m, 2Н), 7,00-7,05 (m, 4Н), 8,38 (s, 4Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,1, 34,6, 55,5, 110,7, 113,9, 124,5, 130,4, 134,1, 142,5, 142,6, 157,1, 164,5.
Пример 17. (2-Трет-бутил-4-метоксифенол)-3-(3-нитрофенил)пропионат (ХН2028)
Способ получения аналогичен способу примера 3 и осуществления посредством реакции конденсации 3-(3-нитрофенил)пропионовой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 70%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,33 (s, 9Н), 2,94-2,99 (t, J=7,2 Гц, 2Н), 3,14-3,20 (t, J=7,2 Гц, 2Н), 3,78 (s, 3Н), 6,69-6,73 (m, 1Н), 6,80-6,83 (d, J=8,8 Гц, 1H), 6,89-6,90 (d, J=2,1 Гц, 1Н), 7,45-7,50 (m, 1Н), 7,61-7,64 (m, 1H), 8,08-8,11 (m, 1H), 8,14-8,16 (m, 1Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,2, 34,5, 36,0, 55,7, 110,7, 114,1, 121,9, 123,5, 124,6, 129,7, 135,2, 142,3, 142,6, 148,5, 157,1, 171,4.
Пример 18. (2-Трет-бутил-4-метоксифенол)-4-фенилбензоат (ХН2029)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 4-фенилбензойной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 80%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,38 (s, 9Н), 3,80 (s, 3Н), 6,78-6,80 (m, 1Н), 6,98-7,04 (m, 2Н), 7,18-7,22 (m, 2Н), 7,63-7,65 (m, 2Н), 7,72-7,74 (m, 2Н), 8,28-8,30 (m, 2Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,1, 34,6, 55,5, 110,6, 113,8, 124,7, 127,3, 128,3, 128,5, 130,7, 139,8, 142,6, 142,8, 146,3, 156,9, 165,6.
Пример 19. (2-Трет-бутил-4-метоксифенол)-4-метилпиридин-3-формиат (ХН2030)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 4-метилпиридин-3-муравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 80%. 1H ЯМР (400 МГц, CDCl3) δ (млн-1): 1,38 (s, 9Н), 2,68 (s, 3Н), 3,82 (s, 3Н), 6,78-6,81 (m, 1H), 6,98-6,99 (m, 1H), 7,02-7,04 (m, 1Н), 7,33-7,35 (m, 1H), 8,34-8,36 (m, 1Н), 9,31-9,32 (d, J=1,68 Гц, 1Н), 13С ЯМР (100 МГц, CDCl3) δ: 24,9, 30,2, 55,5, 110,7, 114,0, 123,4, 124,7, 138,0, 150,4, 156,4, 157,1, 164,0, 164,7.
Пример 20. (2-Трет-бутил-4-метоксифенол)-4-метоксипиридин-3-формиат (ХН2031)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 4-метоксипиридин-3-муравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 75%. Благодаря орто-метоксигруппе на спектре ЯМР видна пара пиков стереоизомеров, образовавшихся в результате хиральной плоскости; соотношение двух стереоизомеров составляет 1:2. 1Н ЯМР (400 МГц, CDCl3) δ: 1,33 (s, 9Н), 3,81 (s, 3Н), 3,82 и 4,00 (s, 3Н), 6,76-6,81 (m, 1Н), 6,97-7,01 (m, 2Н), 7,47-7,48 и 8,04-8,05 (m, 1Н), 7,55-7,58 и 7,93-7,95 (m, 1H), 8,35-8,37 и 8,63-8,64 (m, 1H). 13С ЯМР (100 МГц, CDCl3) δ: 30,0, 34,5, 53,8, 55,3, 110,5, 111,6, 113,8, 115,9, 124,3, 139,9, 142,3, 147,9, 150,8, 152,6, 157,1, 157,3, 163,1, 164,1, 164,8.
Пример 21. 2-Трет-бутил-4-метоксифенолгексадецилат (ХН2033)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации гексадециловой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 75%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 0,88 (m, 3Н), 1,25-1,33 (m, 34Н), 1,71-1,79 (m, 2Н), 2,55-2,59 (m, 2Н), 3,78 (s, 3Н), 6,71-6,74 (m, 1Н), 6,88-6,93 (m, 2Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 14,3, 22,8, 24,9, 29,3, 29,5, 29,6, 29,7, 29,8, 30,1, 32,0, 34,8, 35,0, 55,5, 110,5, 113,9, 124,6, 142,3, 142,8, 156,8, 172,9.
Пример 22. (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилглицинат (ХН2034)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации N-трет-бутоксикарбонилглицина и 2-трет-бутил-4-метоксифенола, выход составляет 45%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,30 (s, 9Н), 1,46 (s, 9Н), 3,83 (s, 3Н), 4,20 (s, 2Н), 5,2 (br s, 1H), 6,71-6,73 (m, 1Н), 6,92-6,94 (m, 2Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 28,2, 30,0, 34,4, 42,9, 55,4, 80,0, 110,4, 113,8, 124,2, 142,2, 155,5, 156,9, 169,5.
Пример 23. (2-Трет-бутил-4-метоксифенол)-3-фтор-4-хлорбензоат (ХН2035)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 3-фтор-4-хлорбензойной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 78%. lH ЯМР (400 МГц, CDCl3) δ (млн-1): 1,34 (s, 9Н), 3,82 (s, 3Н), 6,71-6,73 (m, 1H), 6,98-7,00 (m, 2Н), 7,56-7,60 (m, 1H), 7,96-7,97 (m, 2Н). 13С ЯМР (100 МГц, CDCl3) δ: 30,2, 34,7, 55,6, 110,8, 114,1, 118,4, 124,6, 126,6, 130,4, 131,2, 142,6, 156,9, 157,3, 159,4, 164,1.
Пример 25. (2-Трет-бутил-4-метоксифенол)-3-цианобензоат (ХН2036-2)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 3-цианобензойной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 70%. 1H ЯМР (400 МГц, CDCl3) δ (млн-1): 1,35 (s, 9Н), 3,82 (s, 3Н), 6,78-6,81 (m, 1Н), 6,99-7,01 (m, 2Н), 7,67-7,71 (t, J=3,84 Гц, 1Н), 7,92-7,95 (m, 1Н), 8,44-8,47 (m, 2Н), 8,50 (s, 1Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,1, 34,5, 55,6, 110,7, 113,3, 113,9, 117,7, 124,4, 129,8, 131,1, 133,7, 134,1, 136,5, 142,4, 157,2, 163,9.
Пример 26. (2-Трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилаланинат (ХН2036-3)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации N-трет-бутоксикарбонилаланина и 2-трет-бутил-4-метоксифенола, выход составляет 37%. 1Н ЯМР (400 МГц, CDCl3): 1,32 (s, 9Н), 1,40 (s, 9Н), 1,43 (d, 2Н), 3,73 (s, 3Н), 4,61 (m, 1Н), 6,99-7,01 (m, 2Н), 6,78-6,81 (m, 1H).
Пример 27. (2-Трет-бутил-4-метоксифенол)-2-нафтоат (ХН2036-4)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2-нафтойной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 77%. !Н ЯМР (400 МГц, CDC13) 5 (млн-1): 1,32 (s, 9Н), 3,73 (s, 3Н), 6,84 (m, 1H), 6,88-6,89 (m, 2Н), 7,46-7,49 (m, 3Н), 7,82-7,85 (m, 4Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,0, 34,6, 42,4, 55,5, 110,6, 113,9, 124,5, 126,4, 127,6, 127,8, 128,6, 130,7, 131,7, 133,6, 142,4, 142,9, 157,0, 170,5.
Пример 28. Ди(2-трет-бутил-4-метоксифенол)малонат (ХН2037)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации малоновой кислоты (5 ммоль) и 2-трет-бутил-4-метоксифенола, выход составляет 70%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,35 (s, 18Н), 3,80 (s, 6Н), 3,88 (s, 2Н), 6,75 (m, 2Н), 6,94 (m, 2Н), 6,99-7,01 (m, 2Н). 13С ЯМР (100 МГц, CDCl3) 5 (млн-1): 30,2, 34,7, 42,6, 55,5, 110,8, 114,0, 124,4, 142,5, 142,6, 157,3, 165,4.
Пример 29. (2-Трет-бутил-4-метоксифенол)-3,6-дихлорпиридазин-4-формиат (ХН2038-1)
Способ получения аналогичен способу примера 3 осуществляется посредством реакции конденсации 3,6-дихлорпиридазин-4-муравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 77%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,36 (s, 9Н), 3,82 (s, 3Н), 6,76-6,79 (m, 1Н), 6,97-7,02 (m, 2Н), 7,99 (s, 1Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,2, 34,7, 55,6, 110,8, 114,1, 124,4, 131,5, 137,8, 138,8, 142,3, 142,6, 157,5, 158,0, 161,4.
Пример 30. (2-Трет-бутил-4-метоксифенол)-1-метилциклопропил формиат (ХН2038-2)
Способ получения аналогичен способу примера 1 и осуществляется путем взаимодействия 1-метилциклопропилмуравьиной кислоты и хлорида сульфоксида, а затем путем реакции конденсации с 2-трет-бутил-4-метоксифенолом натрия, выход составляет 87%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 0,83-0,85 (m, 2Н), 1,33 (s, 9Н), 1,40-1,42 (m, 2Н), 1,46 (s, 3Н), 3,78 (s, 3Н), 6,72-6,73 (m, 1Н), 6,84-6,87 (m, 1H), 6,90-6,92 (m, 1Н), 13С ЯМР (100 МГц, CDCl3) 5 (млн-1): 17,3, 19,1, 19,7, 30,1, 34,6, 55,6, 110,6, 113,7, 124,7, 142,4, 143,2, 156,7, 175,2.
Пример 31. (2-Трет-бутил-4-метоксифенол)-2-индолформиат (ХН2038-3)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2-индолмуравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 67%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,33 (s, 3Н), 3,77 (s, 3Н), 7,08-7,11 (m, 1Н), 7,16-7,20 (m, 1Н), 7,32-7,40 (m, 2Н), 7,43-7,44 (m, 1Н), 7,74-7,77 (m, 1Н), 9,36 (s, 1H), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,1, 34,6, 55,5, 109,9, 110,5, 112,1, 113,9, 121,0, 122,7, 124,6, 125,8, 126,8, 127,4, 137,3, 142,3, 142,7, 157,0, 161,3.
Пример 32. (2-Трет-бутил-4-метоксифенол)-2-хлор-3-пиколинат (ХН2038-4)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2-хлор-3-пиколиновой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 87%. 1H ЯМР (400 МГц, CDCl3) δ (млн-1): 1,34 (s, 9Н), 3,83 (s, 3Н), 6,79-6,82 (m, 1Н), 6,98-6,99 (m, 1Н), 7,05-7,07 (m, 1Н), 7,43 (m, 1Н), 8,37-8,39 (m, 1H), 8,61 (s, 1Н). 13С ЯМР (100 МГц, CDCl3) 6 (млн-1): 30,2, 34,7, 55,6, 110,9, 114,1, 122,4, 124,5, 126,7, 140,5, 142,5, 142,6, 150,7, 152,5, 157,4, 163,7.
Пример 33. (2-Трет-бутил-4-метоксифенол)-2-тиофенацетат (ХН2038-5)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2-тиофенуксусной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 70%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,27 (s, 9Н), 3,78 (s, 3Н), 4,10 (s, 2Н), 6,70-6,73 (m, 1H), 6,87 (m, 1H), 6,90-,92 (m, 2Н), 6,98-7,07 (m, 1H), 7,04-7,06 (m, 2Н), 7,24 (m, 1Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,1, 34,6, 36,1, 55,5, 110,6, 113,9, 124,4, 125,4, 127,1, 127,5, 134,2, 142,4, 142,8, 157,0, 169,4.
Пример 34. (2-Трет-бутил-4-метоксифенол)-3-(4-метилфенил)пропионат (ХН2039-1)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 3-(4-метилфенил)пропионовой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 65%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,29 (s, 9Н), 2,32 (s, 3Н), 2,88-2,90 (t, J=8,2 Гц, 2Н), 3,03-3,05 (t, J=8,2 Гц, 2Н), 3,78 (s, 3Н), 6,69-6,72 (m, 1Н), 6,81-6,84 (m, 1H), 6,90-,92 (m, 1Н), 7,12-7,15 (m, 4Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 21,0, 30,3, 34,5, 36,6, 55,4, 110,4, 113,7, 124,4, 128,3, 129,2, 135,8, 137,0, 142,2, 142,6, 156,7, 171,8.
Пример 35. (2-Трет-бутил-4-метоксифенол)-2-фенилпропионат (ХН2039-3)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2-фенилпропионовой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 65%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,16 (s, 9Н), 1,63-1,67 (d, J=8,8 Гц, 3Н), 3,76 (s, 3Н), 3,93-3,97 (q, J=8,8 Гц, 1Н), 6,68-6,70 (m, 2Н), 6,75-6,77 (m, 1H), 6,87-6,88 (m, 1H), 7,20-7,45 (m, 5Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 18,1, 29,7, 34,4, 46,1, 55,4, 110,4, 113,6, 124,1, 127,4, 127,8, 128,7, 139,5, 142,3, 142,9, 156,7, 173,3.
Пример 36. (2-Трет-бутил-4-метоксифенол)-2-фторпропионат (ХН2039-4)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2-фторпропионовой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 60%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,33 (s, 9Н), 1,72-1,80 (m, 3Н), 3,80 (s, 3Н), 5,19-5,31 (m, 1H), 6,73-6,76 (m, 1Н), 6,92-6,95 (m, 2Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 18,0, 18,2, 29,9, 34,6, 55,4, 84,9, 86,7, 110,5, 113,9, 123,9, 142,0, 142,3, 157,1, 169,4.
Пример 37. (2-Трет-бутил-4-метоксифенол)циклогексилацетат (ХН2039-5)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации циклогексилуксусной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 68%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,00-1,20 (m, 3Н), 1,20-1,40 (m, 11Н), 1,63-1,76 (m, 3Н), 1,90-2,00 (m, 1H), 1,83-1,87 (m, 2Н), 2,44-2,46 (m, 2Н), 3,77 (s, 3Н), 6,70-6,73 (m, 1Н), 6,88-6,92 (m, 2Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 26,0, 26,1, 30,0, 33,1, 34,5, 34,6, 42,6, 55,4, 110,4, 113,7, 124,5, 142,2, 142,7, 156,6, 171,9.
Пример 38. (2-Трет-бутил-4-метоксифенол)циклопентанкарбоксилат (ХН2039-6)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации циклопентилмуравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 78%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,33 (s, 9Н), 1,63-1,70 (m, 2Н), 1,74-1,82 (m, 2Н), 1,93-2,07 (m, 4Н), 3,78 (s, 3Н), 6,71-6,73 (m, 1Н), 6,86-6,88 (d, J=8,8 Гц, 1Н), 6,91-6,92 (d, J=2,8 Гц, 1Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 25,7, 29,9, 34,5, 44,4, 55,4, 110,4, 113,6, 124,4, 142,2, 142,9, 156,6, 175,6.
Пример 39. (2-Трет-бутил-4-метоксифенол)адамантанацетат (ХН2040-1)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации адамантануксусной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 70%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,32 (s, 9Н), 1,66-1,76 (m, 12Н), 2,01 (br s, 3Н), 2,32 (s, 2Н), 3,79 (s, 3Н), 6,71-6,74 (m, 1H), 6,91-6,94 (m, 2Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 28,7, 30,1, 33,3, 34,6, 36,8, 42,6, 49,2, 55,6, 110,5, 113,8, 124,6, 142,4, 142,7, 156,8, 170,8.
Пример 40. (2-Трет-бутил-4-метоксифенол)циклопропилацетат (ХН2040-2)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации циклопропилуксусной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 73%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 0,25-0,29 (m, 2Н), 0,61-0,66 (m, 2Н), 1,19-1,23 (m, 1H), 1,33 (s, 9Н), 2,47-2,49 (d, J=7,2 Гц, 2Н), 3,79 (s, 3Н), 6,72-6,75 (m, 1H), 6,91-6,93 (m, 2Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 4,77, 6,92, 30,1, 40,2, 55,6, 110,6, 113,9, 124,7, 142,4, 142,9, 156,9, 172,2.
Пример 41. (2-Трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилпиперидин-4-формиат (ХН2040-3)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации N-трет-бутоксикарбонилпиперидин-4-муравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 73%. 1H ЯМР (400 МГц, CDCl3) δ (млн-1): 1,32 (s, 9Н), 1,47 (s, 9Н), 1,73-1,84 (m, 2Н), 2,05-2,10 (m, 2Н), 2,66-2,73 (m, 1Н), 2,85-2,93 (m, 2Н), 3,79 (s, 3Н), 4,11-4,16 (m, 2Н), 6,71-6,74 (m, 1Н), 6,82-6,84 (d, J=8,8 Гц, 1Н), 6,92-6,93 (d, J=3,2 Гц, 1H), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 28,0, 28,5, 30,1, 34,7, 41,8, 43,4, 55,6, 79,8, 110,7, 113,8, 124,5, 142,3, 142,8, 154,7, 156,9, 173,7.
Пример 42. (2-Трет-бутил-4-метоксифенол)октаноат (ХН2040-4)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации октановой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 63%. 1H ЯМР (400 МГц, CDCl3) δ (млн-1): 0,87-0,91 (m, 3Н), 1,27-1,43 (m, 18Н), 1,73-1,81 (m, 2Н), 2,55-2,59 (t, J=7,6 Гц, 2Н), 6,71-6,74 (m, 1H), 6,88-6,90 (d, J=8,8 Гц, 1Н), 6,92-6,93 (d, J=3,2 Гц, 1H), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 14,2, 22,7, 24,9, 29,0, 29,3, 30,1, 31,8, 34,7, 35,0, 55,6, 110,5, 113,8, 124,6, 142,3, 142,8, 156,8, 172,9.
Пример 43. (2-Трет-бутил-4-метоксифенол)-7-оксооктаноат (ХН2040-5)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 7-оксооктановой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 60%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,30-1,44 (m, 13Н), 1,60-1,66 (m, 2Н), 1,74-1,80 (m, 2Н), 2,16 (s, 3Н), 2,45-2,49 (t, J=7,2 Гц, 2Н), 2,57-2,60 (t, J=7,6 Гц, 2Н), 3,79 (s, 3Н), 6,71-6,74 (m, 1H), 6,88-6,90 (d, J=8,8 Гц, 1Н), 6,92-6,93 (d, J=3,2 Гц, 1Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 23,4, 24,6, 28,7, 29,5, 30,1, 34,6, 34,7, 43,5, 55,6, 110,6, 111,8, 124,6, 142,3, 142,7, 156,8, 172,6, 209,0.
Пример 44. (2-Трет-бутил-4-метоксифенол)циклогексен-2-карбоксилат (ХН2041-1)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации циклогексен-2-карбоновой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 57%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,31 (s, 9Н), 2,78-2,86 (m, 4Н), 3,36-3,41 (m, 1Н), 3,79 (s, 3Н), 5,72 (s, 2Н), 6,71-6,74 (m, 1H), 6,88-6,90 (d, J=8,8 Гц, 1H), 6,92-6,93 (d, J=3,2 Гц, 1Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,1, 34,6, 36,2, 42,4, 55,6, 110,6, 113,8, 124,5, 129,1, 142,3, 143,1, 156,8, 175,1.
Пример 45. (2-Трет-бутил-4-метоксифенол)-2,4,5-трифторфенилацетат (ХН2041-2)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2,4,5-трифторфенилуксусной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 77%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,27 (s, 9Н), 3,78 (s, 3Н), 3,87 (s, 2Н), 6,71-6,74 (m, 1Н), 6,88-6,91 (m, 2Н), 6,95-7,01 (m, 1H), 7,19-7,25 (m, 1H), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 29,8, 34,4, 55,4, 105,4, 105,6, 105,7, 105,9, 110,5, 113,8, 119,1, 119,3, 124,2, 142,2, 142,5, 157,0, 168,7.
Пример 46. (2-Трет-бутил-4-метоксифенол)-2-бром-5-йодбензоат (ХН2041-3)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2-бром-5-йодбензойной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 87%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,34 (s, 9Н), 3,82 (s, 3Н), 6,78-6,80 (m, 1Н), 6,97-6,98 (d, J=2,8 Гц, 1Н), 7,05-7,07 (d, J=8,8 Гц, 1H), 7,45-7,47 (d, J=8,4 Гц, 1Н), 7,69-7,71 (dd, J1=8,4 Гц, J2=2,0 Гц, 1H), 8,28 (d, J=2,0 Гц, 1Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,4, 34,8, 55,7, 92,1, 110,9, 114,2, 122,4, 124,5, 133,7, 136,5, 140,3, 142,1, 142,8, 157,4, 164,1.
Пример 47. (2-Трет-бутил-4-метоксифенол)-2-фтор-4-нитрилбензоат (ХН2041-4)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 2-фтор-4-нитрилбензойной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 85%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,32 (s, 9Н), 3,83 (s, 3Н), 6,78-6,81 (dd, J1=8,4 Гц, J2=3,2 Гц, 1Н), 6,98-6,99 (d, J=3,2 Гц, 1Н), 7,02-7,05 (d, J=8,4 Гц, 1Н), 8,09-8,12 (dd, J1=9,6 Гц, J2=2,0 Гц, 1H), 8,15-8,18 (m, 1Н), 8,30-8,34 (m, 1H), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,0, 34,5, 55,5, 110,7, 113,1, 113,4, 114,0, 119,1, 123,9, 124,0, 124,3, 133,7, 142,2, 142,4, 151,3, 157,3, 160,3, 162,0, 163,0.
Пример 48. (2-Трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилпиперидин-3-формиат (ХН2041-5)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации N-трет-бутоксикарбонилпиперидин-3-муравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 65%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,32 (s, 9Н), 1,47 (s, 9Н), 1,50-1,67 (m, 2Н), 1,76-1,82 (m, 2Н), 2,22-2,26 (m, 1H), 2,67-2,73 (m, 1Н), 2,82-2,89 (m, 1Н), 3,10-3,16 (m, 1Н), 3,79 (s, 3Н), 3,98-4,01 (m, 1H), 4,33 (br s, 1H), 6,71-6,74 (dd, J1=8,8 Гц, J2=2,8 Гц, 1Н), 6,83-6,85 (d, J=8,8 Гц, 1Н), 6,91-6,92 (d, J=2,8 Гц, 1H), 13C ЯМР (100 МГц, CDCl3) δ (млн-1): 14,1, 24,2, 27,2, 28,3, 29,4, 30,1, 34,5, 41,8, 55,4, 79,8, 110,5, 113,7, 124,4, 142,2, 142,6, 154,6, 156,8, 172,4.
Пример 49. Ди(2-трет-бутил-4-метоксифенол)-пара-фенилендиацетат (ХН2042)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации пара-фенилендиуксусной кислоты (5 ммоль) и 2-трет-бутил-4-метоксифенола (10 ммоль), выход составляет 65%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,23 (s, 18Н), 3,74 (s, 6Н), 6,67-6,71 (dd, J1=8,8 Гц, J2=3,2 Гц, 2Н), 6,83-6,86 (d, J=8,8 Гц, 2Н), 6,89-6,90 (d, J=3,2 Гц, 2Н), 7,39 (s, 4Н), 13С ЯМР (100 МГц, CDCl3) 5 (млн-1): 30,1, 34,6, 41,9, 55,6, 110,7, 114,0, 124,6, 130,1, 132,5, 142,5, 142,9, 157,1, 170,5.
Пример 50. (2-Трет-бутил-4-метоксифенол)-4-бензоилбутират (ХН2043-1)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 4-бензоилмасляной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 75%. 1H ЯМР (400 МГц, CDCl3) δ (млн-1): 1,32 (s, 9Н), 2,20-2,23 (m, 2Н), 2,71-2,75 (t, J=8,8 Гц, 2Н), 3,14-3,17 (t, J=7,0 Гц, 2Н), 3,79 (s, 3Н), 6,72-6,75 (m, 1H), 6,91-6,93 (m, 2Н), 7,44-7,49 (m, 2Н), 7,55-7,59 (m, 1Н), 7,97-7,99 (m, 2Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 19,4, 30,2, 34,1, 34,7, 37,6, 55,7, 110,7, 114,0, 124,7, 128,2, 128,9, 133,4, 136,9, 142,4, 142,8, 157,0, 172,5, 199,6.
Пример 51. (2-Трет-бутил-4-метоксифенол)-3,5-диметоксифенилакрилат (ХН2043-2)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 3,5-диметоксифенилакриловой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 60%. 1H ЯМР (400 МГц, CDCl3) 5 (млн-1): 1,35 (s, 9Н), 3,81 (s, 3Н), 6,53-6,54 (t, J=2,3 Гц, 1Н), 6,61-6,65 (d, J=16 Гц, 1H), 6,73-6,78 (m, 3Н), 6,95-7,00 (m, 2H), 7,77-7,81 (d, J=16 Гц, 1H), 13C ЯМР (100 МГц, CDCl3) δ (млн-1): 30,3, 34,8, 55,7, 103,1, 106,4, 110,7, 114,0, 118,4, 124,8, 136,2, 142,7, 146,8, 157,1, 161,3, 166,2.
Пример 52. (2-Трет-бутил-4-метоксифенол)-4-хлорпиридин-2-формиат (XH2043-3)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 4-хлорпиридин-2-муравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 65%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,36 (s, 9Н), 3,82 (s, 3Н), 6,78-6,81 (dd, J1=9,2 Гц, J2=3,0 Гц, 1Н), 6,98-6,99 (d, J=3,0 Гц, 1H), 7,04-7,06 (d, J=9,2 Гц, 1H), 7,56-7,58 (dd, J1=5,2 Гц, J2=2,3 Гц, 1Н), 8,27-8,28 (m, 1Н), 8,75-8,76 (d, J=5,2 Гц, 1H), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,4, 34,9, 55,7, 110,9, 114,2, 124,6, 126,4, 127,7, 142,8, 145,8, 149,3, 151,3, 157,4, 163,7.
Пример 53. (2-Трет-бутил-4-метоксифенол)-N-метилпиперидин-3-формиат (ХН2043-4)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации N-метилпиперидин-3-муравьиной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 60%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,34 (s, 9Н), 1,51-1,61 (m, 1Н), 1,65-1,74 (m, 1Н), 1,80-1,85 (m, 1Н), 1,99-2,05 (m, 1Н), 2,13-2,18 (m, 1Н), 2,24-2,31 (m, 1Н), 2,34 (s, 3Н), 2,79-2,92 (m, 2Н), 3,14-3,16 (br d, 1Н), 3,78 (s, 3Н), 6,70-6,74 (dd, J1=8,4 Гц, J2=3,2 Гц, 1Н), 6,84-6,86 (d, J=8,4 Гц, 1H), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 24,6, 26,3, 29,9, 34,5, 42,3, 46,4, 55,4, 55,5, 57,1, 110,5, 113,7, 124,4, 142,2, 142,6, 156,7, 172,9.
Пример 55. (2-Трет-бутил-4-метоксифенол)-3,3,3-трифторпропионат (ХН2044-1)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 3,3,3-трифторпропионовой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 60%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,33 (s, 9Н), 3,41-3,48 (q, J=19,9 Гц, 2Н), 3,79 (s, 3Н), 6,72-6,75 (m, 1Н), 6,91-6,94 (m, 2Н), 13С ЯМР (100 МГц, CDCl3) 5 (млн-1): 30,2, 34,8, 40,3, 55,7, 110,9, 114,2, 124,4, 142,5, 157,5, 163,5.
Пример 56. (2-Трет-бутил-4-метоксифенол)морфолин-4-илацетат (ХН2044-2)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации морфолин-4-илуксусной кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 68%. 1H ЯМР (400 МГц, CDCl3) δ: 1,30 (s, 9Н), 2,65-2,68 (t, J=4,4 Гц, 4Н), 3,47 (s, 2Н), 3,75-3,79 (m, 7Н), 6,70-6,73 (m, 1Н), 6,89-6,92 (m, 2Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,3, 34,7, 53,5, 55,7, 60,2, 67,0, 110,7, 114,1, 124,6, 142,4, 157,1, 169,2.
Пример 57. (2-Трет-бутил-4-метоксифенол)-3-(3,5-ди-трет-бутил-4-гидрокси-фенил)пропионат (ХН2045-2)
Способ получения аналогичен способу примера 3 и осуществляется посредством реакции конденсации 3-(3,5-ди-трет-бутил-4-гидрокси-фенил)пропионовой кислоты и 2-трет-бутил-4-метоксифенола, выход составляет 68%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,29 (s, 9Н), 1,45 (s, 18Н), 2,86-2,90 (m, 2Н), 2,99-3,03 (m, 2Н), 3,78 (s, 3Н), 5,10 (br s, 1H), 6,69-6,72 (m, 1H), 6,80-6,83 (d, J=8,8 Гц, 1H), 6,90-6,91 (d, J=3,0 Гц, 1H), 7,06 (s, 2Н), 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 30,0, 30,2, 30,8, 34,2, 34,5, 37,0, 55,4, 110,4, 113,7, 124,5, 124,9, 130,7, 135,9, 142,2, 142,7, 152,3, 156,7, 172,1.
Пример 58. Ди(2-трет-бутил-4-метоксифенол)адипат (ХН2046-3)
Способ получения аналогичен способу примера 3 посредством реакции конденсации адипиновой кислоты (5 ммоль) и 2-трет-бутил-4-метоксифенола (10 ммоль), выход составляет 65%. 1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1.32 (s, 18Н), 1.89-1.93 (m, 4Н), 2.64-2.68 (m, 4Н), 3.79 (s, 6Н), 6.71-6.74 (m, 2Н), 6.89-6.93 (m, 4Н). 13С ЯМР (100 МГц, CDCl3) δ (млн-1): 24.3, 30.1, 34.6, 55.6, 110.6, 113.9, 124.6, 142.4, 142.7, 156.9, 172.3.
Пример 59. Изопропиловый эфир (2-трет-бутил-4-метоксифенол-оксил)метилкарбоната(XJP2005)
Растворяют 2-трет-бутил-4-метоксифенол (5 ммоль) в тетрагидрофуране (15 мл) и добавляют по каплям раствор гидрида натрия (5,5 ммоль) в тетрагидрофуране (10 мл), затем перемешивают в течение 30 минут. Добавляют по каплям хлорметилизопропилкарбонат (5 ммоль), а затем подвергают взаимодействию в течение 24 часов при комнатной температуре. Получают бесцветное маслянистое вещество в результате очистки колоночной хроматографией (этилацетат: петролейный эфир в соотношении 1: 9), выход составляет 75%. 1Н-ЯМР (CDCl3) δ (млн-1): 1,32 (s, 9Н), 1,35 (d, J=6,4 Гц, 6Н), 3,78 (s, 3Н), 4,31 (m, 1Н), 5,26 (s, 2Н), 6,71-6,74 (m, 1Н), 6,90-6,91 (d, J=3,0 Гц, 1H), 6,96-6,97 (d, J=8,6 Гц, 1Н).
Пример 60. Этиловый эфир N-(2-трет-бутил-4-метоксифенол-оксикарбонил)глицина (XJP2006)
Растворяют этиловый эфир глицина (5,10 ммоль) в 100 мл дихлорметана, добавляют насыщенный раствор гидрокарбоната натрия, перемешивают в ледяной бане в течение 5 мин. Затем добавляют трифосген (530 мг, 1,786 ммоль), интенсивно перемешивают в течение 15 мин. Получают изоцианат бензилового эфира D-аспарагиновой кислоты (1-1) путем экстракции дихлорметаном четыре раза, высушивания безводным Na2SO4 в течение 1 ч и концентрирования до сухого состояния перегонкой при пониженном давлении. Добавляют 2-трет-бутил-4-метоксифенол (1,28 ммоль) к 100 мл безводного тетрагидрофурана, добавляют триэтиламин (386 мг, 3,83 ммоль), перемешивают в течение 30 мин при комнатной температуре, растворяют в изоцианате (1-1), полученном, как описано выше, с 2 мл дихлорметана, добавляют к реакционному раствору, повышают температуру до 40°С, перемешивают в течение ночи. Реакционную смесь гасят, непосредственно смешивают с силикагелем, а затем выпаривают до сухого состояния перегонкой, очищают колоночной хроматографией на силикагеле (этилацетат: петролейный эфир в соотношении 1:3). Получают бесцветное маслянистое вещество, выход составляет 56,8%. 1H-ЯМР (CDCl3) δ (млн-1): 1,28-1,32 (t, J=7,0 Гц, 3Н), 1,34 (s, 9Н), 3,79 (s, 3Н), 4,06-4,08 (d, J=5,3 Гц, 2Н), 4,22-4,28 (q, J=7,0 Гц, 2Н), 5,53-5,56 (t, J=5,3 Гц, 1Н), 6,71-6,74 (m, 1H), 6,90-6,91 (d, J=3,0 Гц, 1H), 6,96-6,97 (d, J=8,6 Гц, 1Н).
Пример 61. 2-(2-Трет-бутил-4-метоксифенокси)этилацетат (XJP1005)
Растворяют 2-трет-бутил-4-метоксифенол (5 ммоль) в тетрагидрофуране (15 мл), затем добавляют по каплям в раствор гидрида натрия (5.5 ммоль) в тетрагидрофуране (10 мл), затем перемешивают в течение 30 минут. Добавляют по каплям этилбромацетат (5 ммоль), а затем подвергают взаимодействию в течение 24 часов при комнатной температуре. Получают бесцветное маслянистое вещество посредством очистки колоночной хроматографией (этилацетат: петролейный эфир в соотношении 1:9), выход составляет 75%. 1Н-ЯМР (CDCl3) δ: (млн-1) 1,28-1,32 (t, J=7,2 Гц, 3Н), 1,40 (s, 9Н), 3,77 (s, 3Н), 4,24-4,30 (q, J=7,2 Гц, 2Н), 4,59 (s, 2Н), 6,65-6,66 (m, 2Н), 6,88-6,91 (m, 1Н).
Пример 62. Получение (2-трет-бутил-4-метоксифенол)(N-бензил)карбамата (ZXY1025-2)
Растворяют 2-трет-бутил-4-метоксифенол (0,9 г, 5 ммоль) в дихлорметане (15 мл), добавляют триэтиламин (0,1 мл), добавляют по каплям раствор бензилизоцианата (5 ммоль) в дихлорметане (10 мл), затем перемешивают и подвергают взаимодействию в течение 4-10 часов, промывают водой, и белое твердое вещество может быть получено в результате колоночной хроматографии, выход составляет 85%. 1H-ЯМР (CDCl3) δ (млн-1) 1,32 (s, 3Н), 3,78 (s, 3Н), 4,47-4,48 (d, J=2,2 Гц, 2Н), 5,32-5,34 (br t, J=2,2 Гц, 1Н), 6,71-6,74 (m, 1Н), 6,89-6,90 (d, J=3,2 Гц, 1Н), 6,98-7,01 (d, J=8,4 Гц, 1Н), 7,30-7,38 (m, 5Н).
Пример 63. Получение (2-трет-бутил-4-метоксифенол)(N-н-бутил)карбамата(ZXY1025-3)
Способ получения аналогичен способу примера 62, и соединение получают посредством взаимодействия 2-трет-бутил-4-метоксифенола и бутилизоцианата, выход составляет 90%. 1Н-ЯМР (CDCl3) δ (млн-1): 0,92-0,95 (t, J=8,0 Гц, 3Н), 1,32-1,41 (m, 11Н), 1,51-1,58 (m, 2Н), 3,25-3,30 (q, J=6,8 Гц, 2Н), 3,78 (s, 3Н), 4,99 (br t, 1Н), 6,70-6,73 (m, 1Н), 6,88-6,89 (d, J=3,2 Гц, 1Н), 6,94-6,97 (d, J=8.8 Гц, 1Н).
Пример 64. (2-Трет-бутил-4-метоксифенол)(N-изопропил)карбамат(ZXY1025-4)
Способ получения аналогичен способу примера 62, и выход составляет 85%. 1Н-ЯМР (CDCl3) δ (млн-1): 1,21-1,23 (d, J=6,4 Гц, 6Н), 1,32 (s, 9Н), 3,78 (s, 3Н), 3,88-3,93 (m, 1Н), 4,82-4,84 (br d, J=8,0 Гц, 1H), 6,70-6,73 (m, 1H), 6,88-6,89 (d, J=3,2 Гц, 1H), 6,94-6,97 (d, J=8,8 Гц, 1H).
Пример 65. (2-Трет-бутил-4-метоксифенол)(N-циклогексил)карбамат(ZXY1025-5)
Способ получения аналогичен способу примера 62, и выход составляет 87%. 1Н-ЯМР (CDCl3) δ (млн-1): 1,13-1,25 (m, 2Н), 1,32-1,42 (m, 12Н), 1,60-1,64 (m, 1Н), 1,72-1,75 (m, 2Н), 1,99-2,03 (m, 2Н), 3,54-3,61 (m, 1Н), 3,78 (s, 3Н), 4,87-4,89 (d, J=8,4 Гц, 1Н), 6,70-6,73 (m, 1Н), 6,88-6,89 (d, J=2,0 Гц, 1Н), 6,95-6,97 (d, J=8.4 Гц, 1Н).
Пример 66. (2-Трет-бутил-4-метоксифенол)(N-фенэтил)карбамат(ZXY1025-6)
Способ получения аналогичен способу примера 62, и выход составляет 87%. 1Н-ЯМР (CDCl3) δ (млн-1): 1,30 (s, 9Н), 2,87-2,90 (t, J=6,4 Гц, 2Н), 3,52-3,57 (m, 2Н), 3,77 (s, 3Н), 5,03 (m, 1H), 6,69-6,72 (m, 1Н), 6,88-6,94 (m, 2Н), 7,22-7,25 (m, 3Н), 7,30-7,34 (m, 2Н).
Пример 67. Пивалоил(2-трет-бутил-4-метоксифенолоксил)метиловый эфир (XJP1041)
Растворяют 2-трет-бутил-4-метоксифенол (5 ммоль) в тетрагидрофуране (15 мл), затем добавляют по каплям раствор гидрида натрия (5.5 ммоль) в тетрагидрофуране (10 мл), затем перемешивают в течение 30 минут. Добавляют по каплям метиловый эфир пивалоилхлорида (5 ммоль), а затем подвергают взаимодействию в течение 24 часов при комнатной температуре. Беловатое твердое вещество может быть получено в результате очистки колоночной хроматографией (этилацетат: петролейный эфир в соотношении 1:9), выход составляет 75%. 1Н-ЯМР (CDCl3) δ (млн-1) 1,24 (s, 9Н), 1,32 (s, 9Н), 3,78 (s, 3Н), 5,30 (s, 2H), 6,69-6,72 (m, 1H), 6,88-6,94 (m, 2H).
Пример 68. Оценка эффекта высвобождения соединения in vitro
1. Условия анализа
Подвижная фаза: градиентное элюирование; А: вода; В: метанол;
Хроматографическая колонка: CAPCEL PAK MF РН-1;
Прибор для детектирования: TQ-S; источник иона: Химическая ионизация при атмосферном давлении (ХИАД); режим детектирования иона: MRM;
2. Тесты на высвобождение целевого соединения в фосфатно-солевом буферном растворе (ФСБ) (рН равно 7,4)
Растворяют некоторое количество соединения в ФСБ, подвергают вихревому перемешиванию, делят на 10 равных частей, где каждая часть составляет 0,3 мл. Инкубируют при 37°С, отбирают образцы в различные моменты времени (0 ч, 1 ч, 2 ч, 6 ч, 12 ч, 24 ч и 48 ч и т.д.) с последующим определением с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Скорость высвобождения лекарственных средств рассчитывают по площади пика целевого соединения при 0 ч в качестве стандарта. Площади пиков соединений, полученные в другие моменты времени, сравнивают со стандартной площадью пика. Результаты эксперимента показывают, что соединения всех примеров сохраняют стабильность в водном растворе, и ВНА не было обнаружено.
3. Эксперимент по высвобождению целевого соединения в плазме крови человека Целевое соединение растворяют в ДМСО, затем разводят до 5 мкг/мл 0,9%
физиологическим раствором. Холостой образец плазмы крови человека после субпакета хранят при -70°С, размораживают в холодильнике при 4°С до использования. Отбирают холостой образец 20 мкл плазмы крови, добавляют 20 мкл раствора целевого соединения, полученного, как описано выше, подвергают вихревому перемешиванию в течение 15 с и оставляют на водяной бане при 37°С. Образцы отбирают в моменты времени 5 мин, 20 мин, 40 мин, 1,5 ч, 3 ч, 6 ч и 9 ч соответственно, по три параллельных образца на каждый момент времени. К образцам добавляют 100 мкл метанола в различные моменты инкубации на водяной бане, осаждают белок, подвергают вихревому перемешиванию в течение 1 мин, центрифугируют при низкой температуре при 13000 об/мин в течение 15 мин. Отбирают супернатант и помещают 10 мкл на колонку для детектирования.
Результаты показывают, что все соединения могут высвобождать ВНА, однако скорость и продолжительность времени высвобождения различаются, как показано на Фиг. 3.
Пример 69. Эксперименты по метаболизму лекарственных средств у крыс in vivo
1. Экспериментальный метод
Лекарственное средство вводили внутрижелудочно крысам массой 180-200 г; вводимая доза: 100 мг/кг; вводимый раствор: 2,5 мг/мл (лиаза представляет собой кукурузное масло); состояние натощак в течение 12 ч до введения со свободным доступом к питьевой воде. В различные моменты забора крови собирают 20 мкл плазмы крови крыс. Добавляют 20 мкл деионизированной воды с последующим добавлением 100 мкл метанола, подвергают вихревому перемешиванию в течение 1 мин, концентрируют в течение 15 мин при 13000 об/мин. и отбирают 10 мкл для анализа с помощью жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ-МС/МС). Забор крови осуществляют в общей сложности в 11 временных точках: 0 мин, 5 мин, 20 мин, 40 мин, 1 ч, 1,5 ч, 2 ч, 4 ч, 8 ч, 12 ч, 24 ч.
2. Анализ для условий тестирования
Подвижная фаза: А: вода; В: метанол (бинарный градиент); Условия элюирования представлены в таблице 1:
Источник иона: Химическая ионизация при атмосферном давлении (ХИАД); режим детектирования иона: MRM.
3. Результаты эксперимента для репрезентативных соединений
В соответствии с результатами эксперимента по высвобождению ВНА в плазме крови в настоящем изобретении отбирают соединения с качественными метаболическими характеристиками для обеспечения экспериментов по метаболизму in vivo. Результаты показывают, что пролекарства в настоящем изобретении могут непрерывно высвобождать ВНА in vivo (Фиг. 4), и концентрация в плазме крови может оставаться стабильной в течение 12 ч.
Пример 70. Тест на цитотоксическую активность
Токсичность соединений определяют методом MTS (с добавлением реагента непосредственно в среду культивирования клеток без промежуточных стадий (с применением вещества [3-[4,5-диметилтиазол-2-ил]-5-[3-карбоксиметоксифенил]-2-[4-сульфофенил]-2Н-тетразолиум)) на иммортализованных макрофагах костного мозга мыши (IBMM), эмбриональных фибробластах мыши (NIH3t3) и гуманизированных эмбриональных нефроцитах. Результаты показывают, что все соединения примеров характеризуются слабой цитотоксичностью со значениями полумаксимальной ингибирующей концентрации (IC50) выше 20 ммоль, в частности, более низкой токсичностью для макрофагов и более широким диапазоном безопасности лекарственных средств для регулирования дифференцировки макрофагов (индекс стимуляции (SI) более 1000). Также может быть доказано, что противоопухолевое действие соединений примеров не связано с цитотоксичностью, что в корне отличается от механизма действия существующих противоопухолевых лекарственных средств. Результаты представлены в следующей таблице 2.
Таблица 2. Результаты эксперимента по определению цитотоксичности соединений
Пример 71. Эксперименты по острой токсичности у мышей
1. Экспериментальный метод
Острую токсичность некоторых соединений определяли с использованием метода «вверх-вниз». Лекарственное средство вводят внутрижелудочно мышам массой 20–22 г; лиаза представляет собой кукурузное масло, состояние натощак за 12 ч до введения при свободном доступе к питьевой воде.
2. Результаты эксперимента
Результаты представлены в таблице 3, где соединения идентифицированы по результатам эксперимента по определению цитотоксичности. Острая токсичность репрезентативных соединений XH2006, XH2010, XH2011 и XH2044-2, полученных в соответствии с настоящим изобретением, ниже по сравнению с 2-трет-бутил-4-метоксифенолоксилом (BHA), что указывает на их лучшую безопасность.
Таблица 3. Результаты экспериментов по острой токсичности некоторых соединений у мышей
Промышленное применение
Преимущества настоящего изобретения заключаются в следующем: 1) соединения, предложенные в настоящем изобретении, способны к медленному высвобождению 2-трет-бутил-4-метоксифенола in vivo, что позволяет преодолеть недостаток, состоящий в коротком периоде полувыведения 2-трет-бутил-4-метоксифенола при непосредственном введении в организм (Т1/2 составляет 0,5-1 ч), и к поддержанию стабильной концентрации 2-трет-бутил-4-метоксифенола в плазме крови (Т1/2 составляет 12-24 ч). 2) Эквивалентная доза соединения, предложенного в настоящем изобретении, ниже, и для достижения аналогичной концентрации в плазме крови и кривой подобных лекарственных средств (AUC) вводимая доза соединения по изобретению составляет лишь 1/100-1/5000 непосредственно вводимой дозы 2-трет-бутил-4-метоксифенола, что позволяет избежать токсического эффекта в результате введения высокой дозы 2-трет-бутил-4-метоксифенола. 3) Цитотоксичность соединения, предложенного в настоящем изобретении, ниже по сравнению с 2-трет-бутил-4-метоксифенолом, и острая токсичность части соединений у мышей (ЛД50 более 1200 мг/кг) ниже, чем таковая у 2-трет-бутил-4-метоксифенола (ЛД50 составляет 1100 мг/кг). 4) В соединении, предложенном в настоящем изобретении, защищена фенольная гидроксильная группа 2-трет-бутил-4-метоксифенола, что позволяет избежать ее окисления под действием окружающей среды и повышает стабильность лекарственных средств в окружающей среде.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОР НЕКРОЗА КЛЕТОК, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2793918C2 |
| ПЯТИЧЛЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ ОКСОКАРБОНОВОЙ КИСЛОТЫ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2832934C1 |
| ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЯ НА ОСНОВЕ КЕТОАМИДА | 2021 |
|
RU2819346C1 |
| ПИРРОЛО[2,1-f][1,2,4]ТРИАЗИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2013 |
|
RU2589053C1 |
| СОЕДИНЕНИЕ НАФТИЛАМИДА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2015 |
|
RU2655607C2 |
| БЕНЗОКСАЗИН-ОКСАЗОЛИДИНОНОВОЕ СОЕДИНЕНИЕ, ЗАМЕЩЕННОЕ АЗОТСОДЕРЖАЩИМ ГЕТЕРОЦИКЛОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2018 |
|
RU2744784C1 |
| 5-АРОМАТИЧЕСКОЕ АЛКИНИЛЗАМЕЩЕННОЕ БЕНЗАМИДНОЕ СОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2695371C2 |
| СОЕДИНЕНИЯ 2-АРИЛБЕНЗОФУРАН-7-ФОРМАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2013 |
|
RU2583900C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЭСТЕИНАСЦИДИНА, СОЕДИНЕНИЯ, ПРОМЕЖУТОЧНЫЙ ПРОДУКТ | 1997 |
|
RU2194709C2 |
| СОЕДИНЕНИЕ ИЗОИНДОЛИН, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2813232C2 |














Настоящее изобретение относится к соединению, представленному формулой I, или к его фармацевтически приемлемой соли, которое способно к медленному высвобождению 2-трет-бутил-4-метоксифенола in vivo и способно поддерживать стабильную концентрацию 2-трет-бутил-4-метоксифенола в плазме крови.

формула I
В формуле I X и Y выбраны из любого из следующих 1) или 2):
1) X представляет собой C=O, Y представляет собой NH;
2) X представляет собой C=O, Y отсутствует;
R выбран из любой из следующих групп: С1-С25 алкильной группы, незамещенной или замещенной галогеном, сложноэфирной группой, производными аминокислот; незамещенной С3-С25 циклоалкильной группы; фенильного кольца, незамещенного или замещенного сложноэфирной группой, галогеном; незамещенного нафталинового кольца; пиридинового кольца, незамещенного или замещенного галогеном; пиридазинового кольца, замещенного галогеном; незамещенного индольного кольца; незамещенной С2-С25 алкенильной или алкинильной группы. 6 н. и 2 з.п. ф-лы, 4 ил., 3 табл., 71 пр.
1. Соединение, представленное формулой I, или его фармацевтически приемлемая соль

формула I
где в формуле I:
X и Y выбраны из любого из следующих 1) или 2):
1) X представляет собой C=O, Y представляет собой NH;
2) X представляет собой C=O, Y отсутствует;
R выбран из любой из следующих групп: С1-С25 алкильной группы, незамещенной или замещенной галогеном, сложноэфирной группой, производными аминокислот; незамещенной С3-С25 циклоалкильной группы; фенильного кольца, незамещенного или замещенного сложноэфирной группой, галогеном; незамещенного нафталинового кольца; пиридинового кольца, незамещенного или замещенного галогеном; пиридазинового кольца, замещенного галогеном; незамещенного индольного кольца; незамещенной С2-С25 алкенильной или алкинильной группы.
2. Соединение или соль по п. 1, где соединение, представленное формулой I, выбрано из следующих соединений:
2) (2-трет-бутил-4-метоксифенол)(N-н-бутил)карбамат,
3) (2-трет-бутил-4-метоксифенол)(N-изопропил)карбамат,
4) (2-трет-бутил-4-метоксифенол)(N-циклогексил)карбамат,
7) 2-трет-бутил-4-метоксифенолбензоат,
8) 2-трет-бутил-4-метоксифенолацетат,
9) 2-трет-бутил-4-метоксифенолникотинат,
10) 2-трет-бутил-4-метоксифенолизоникотинат,
12) 2-трет-бутил-4-метоксифенолпропионат,
13) 2-трет-бутил-4-метоксифенолакрилат,
15) 2-трет-бутил-4-метоксифенолбутиноат,
27) 2-трет-бутил-4-метоксифенолгексадецилат,
28) (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилглицинат,
29) (2-трет-бутил-4-метоксифенол)-3-фтор-4-хлорбензоат,
32) (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилаланинат,
33) (2-трет-бутил-4-метоксифенол)-2-нафтоат,
35) (2-трет-бутил-4-метоксифенол)-3,6-дихлорпиридазин-4-формиат,
37) (2-трет-бутил-4-метоксифенол)-2-индолформиат,
38) (2-трет-бутил-4-метоксифенол)-2-хлор-3-пиколинат,
41) (2-трет-бутил-4-метоксифенол)пропиолат,
43) (2-трет-бутил-4-метоксифенол)-2-фторпропионат,
45) (2-трет-бутил-4-метоксифенол)циклопентанкарбоксилат,
49) (2-трет-бутил-4-метоксифенол)октаноат,
53) (2-трет-бутил-4-метоксифенол)-2-бром-5-иодбензоат,
59) (2-трет-бутил-4-метоксифенол)-4-хлорпиридин-2-формиат,
62) (2-трет-бутил-4-метоксифенол)-3,3,3-трифторпропионат.
3. Соединение, выбранное из любого из следующих соединений, или его фармацевтически приемлемая соль:
1) (2-трет-бутил-4-метоксифенол)(N-бензил)карбамат,
5) (2-трет-бутил-4-метоксифенол)(N-фенэтил)карбамат,
6) пивалоил(2-трет-бутил-4-метоксифенолоксил)метиловый эфир,
11) 2-трет-бутил-4-метоксифенолциклогексенкарбоксилат,
14) (2-трет-бутил-4-метоксифенол)-3,4-диметоксифенилацетат,
16) бис(2-трет-бутил-4-метоксифенол)-2,2’-бифенилдикарбоксилат,
17) (2-трет-бутил-4-метоксифенол)-2-хлор-5-трифторметилбензоат,
18) (2-трет-бутил-4-метоксифенол)-3-фторфенилацетат,
19) (2-трет-бутил-4-метоксифенол)(1H-индол-3-ил)ацетат,
20) (2-трет-бутил-4-метоксифенол)-3-(4-фторфенил)пропионат,
21) (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилпиперидин-3-формиат,
22) ди(2-трет-бутил-4-метоксифенол)терефталат,
23) (2-трет-бутил-4-метоксифенол)-3-(3-нитрофенил)пропионат,
24) (2-трет-бутил-4-метоксифенол)-4-фенилбензоат,
25) (2-трет-бутил-4-метоксифенол)-4-метилпиридин-3-формиат,
26) (2-трет-бутил-4-метоксифенол)-4-метоксипиридин-3-формиат,
31) (2-трет-бутил-4-метоксифенол)-3-цианобензоат,
34) ди(2-трет-бутил-4-метоксифенол)малонат,
36) (2-трет-бутил-4-метоксифенол)-1-метилциклопропилформиат,
39) (2-трет-бутил-4-метоксифенол)-2-тиофенацетат,
40) (2-трет-бутил-4-метоксифенол)-3-(4-метилфенил)-пропионат,
42) (2-трет-бутил-4-метоксифенол)-2-фенилпропионат,
44) (2-трет-бутил-4-метоксифенол)циклогексилацетат,
46) (2-трет-бутил-4-метоксифенол)адамантанацетат,
47) (2-трет-бутил-4-метоксифенол)циклопропилацетат,
48) (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилпиперидин-4-формиат,
50) (2-трет-бутил-4-метоксифенол)-7-оксооктаноат,
51) (2-трет-бутил-4-метоксифенол)циклогексен-2-карбоксилат,
52) (2-трет-бутил-4-метоксифенол)-2,4,5-трифторфенилацетат,
54) (2-трет-бутил-4-метоксифенол)-2-фтор-4-нитрилбензоат,
55) (2-трет-бутил-4-метоксифенол)-N-трет-бутоксикарбонилпиперидин-3-формиат,
56) ди(2-трет-бутил-4-метоксифенол)пара-фенилендиацетат,
57) (2-трет-бутил-4-метоксифенол)-4-бензоилбутират,
58) (2-трет-бутил-4-метоксифенол)-3,5-диметоксифенилпропеноат,
60) (2-трет-бутил-4-метоксифенол)-N-метилпиперидин-3-формиат,
63) (2-трет-бутил-4-метоксифенол)морфолин-4-илацетат,
64) (2-трет-бутил-4-метоксифенол)-3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионат;
65) ди(2-трет-бутил-4-метоксифенол)адипат;
66) 2-(2-трет-бутил-4-метоксифенокси)этилацетат.
4. Способ получения соединения, представленного формулой I, в которой X представляет собой C=O, Y представляет собой NH; включающий следующие стадии:
взаимодействие RNH2 с трифосгеном с получением R-N=C=O; получение соединения, представленного формулой I, посредством реакции конденсации R-N=C=O с 2-трет-бутил-4-метоксифенолом;

формула I
при этом в формуле I в RNH2 и R-N=C=O R выбран из любой из следующих групп: С1-С25 алкильной группы, незамещенной или замещенной галогеном, сложноэфирной группой, производными аминокислот; незамещенной С3-С25 циклоалкильной группы; фенильного кольца, незамещенного или замещенного сложноэфирной группой, галогеном; незамещенного нафталинового кольца; пиридинового кольца, незамещенного или замещенного галогеном; пиридазинового кольца, замещенного галогеном; незамещенного индольного кольца; незамещенной С2-С25 алкенильной и алкинильной группы;
в формуле I X представляет собой C=O, Y представляет собой NH.
5. Применение соединения, представленного формулой I, или его фармацевтически приемлемой соли по п. 1 при получении лекарственных средств для противоопухолевой или иммуномодуляторной терапии.
6. Применение по п. 5, где соединение, представленное формулой I, высвобождает 2-трет-бутил-4-метоксифенол.
7. Применение соединения, представленного формулой I, или его фармацевтически приемлемой соли по п. 1 при получении пролекарств для высвобождения 2-трет-бутил-4-метоксифенола.
8. Противоопухолевое лекарственное средство или иммуномодуляторное лекарственное средство, содержащее соединение, представленное формулой I, или его фармацевтически приемлемую соль по п. 1 в качестве активного ингредиента.
| Устройство для передачи дискретной информации многопозиционным кодом | 1984 |
|
SU1192148A2 |
| Y.F.Shealy et al | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| J.Med.Chem., 2003, 46(10), 1931-1939 | |||
| J | |||
| Mosnacek et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Polymer Degradation and Stability, 2003, 80, 113-126 | |||
| JP 9278741 A, 28.10.1997 | |||
Авторы
Даты
2019-12-09—Публикация
2017-02-22—Подача