ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к аминоарильному производному, представленному формулой (1), обладающему ингибирующей активностью по отношению к диацилглицеролацилтрансферазе 2 (DGAT2), фармацевтической композиции, содержащей его в качестве активного ингредиента, и его применению.
УРОВЕНЬ ТЕХНИКИ
Улучшение уровня жизни соразмерно экономическому развитию, частому потреблению продуктов быстрого приготовления и изменению привычек питания на основе мяса вызвали избыточное накопление калорийной энергии в организме. Данные изменения в рационе питания современных людей также привели к снижению расхода калорий из-за отсутствия физических упражнений, что привело к серьезному распространению метаболических заболеваний, таких как ожирение, гиперлипидемия, диабет, сердечно-сосудистые заболевания и ишемическая болезнь сердца. В частности, ожирение является одним из быстро распространяющихся заболеваний и, как сообщается, является причиной метаболических заболеваний, таких как диабет. Привлекает внимание разработка терапевтических агентов для лечения метаболических заболеваний путем контроля функций ферментов, участвующих в пути биосинтеза триглицеридов, что является основной причиной ожирения.
Нейтральные жиры, такие как триглицериды (ТГ), играют очень важную роль в функции накопления в качестве источника энергии в организме. Однако при избыточном накоплении нейтральных жиров в органах или тканях они вызывают ожирение, гипертриглицеридемию, жировую дистрофию печени и т.д., вызывая тем самым серьезные заболевания, такие как сахарный диабет, атеросклероз, нарушение обмена веществ и гипофункцию органов. Диацилглицеролацилтрансфераза, являющаяся ключевым ферментом в биосинтезе триглицеридов, обнаружена в различных тканях млекопитающих и представляет собой фермент, который синтезирует ТГ путем связывания жирного ацил-КоА с гидроксильной группой диацилглицерола на заключительном этапе глицеролфосфатного пути, который является основным путем синтеза триглицеридов. В настоящее время известны две изоформы - DGAT1 и DGAT2. Хотя их биохимические функции схожи, разница заключается в том, что DGAT1 в основном экспрессируется в тонком кишечнике и жировой ткани, и DGAT2 в основном экспрессируется в печени и жировой ткани. Кроме того, по отношению к семейству генов DGAT1 относится к семейству ACAT, а DGAT2 принадлежит к семейству MGAT. Таким образом, ожидается, что их роль в биосинтезе ТГ также является различной.
Несколько исследований, включающих исследования на животных, показали, что DGAT2 в первую очередь способствует биосинтезу ТГ in vivo. В отличие от мышей с нокаутом DGAT2, которые почти не синтезируют ТГ и умирают вскоре после рождения из-за аномального слоя кожи, у мышей с нокаутом DGAT1 наблюдается небольшое снижение уровня ТГ и не возникает проблем с выживанием мышей (Stone SJ et al., 2000, Nat. Genet. 25: 87-90). Кроме того, в результате снижения уровня экспрессии DGAT1 или DGAT2 с помощью антисмыслового олигонуклеотида (АСО) на животной модели жировой дистрофии печени облегчались симптомы жировой дистрофии печени, и скорость синтеза глюкозы в печени значительно снижалась только, когда было снижено количество DGAT2 (Choi CS et al., 2007. Hepatology. 45: 1366-74).
Лежащие в основе молекулярные механизмы полностью не выяснены, но считается, что ингибирование DGAT2 приводит к подавлению экспрессии нескольких генов, кодирующих белки, участвующие в синтезе липидов, такие как белки 1c, связывающие стеролрегулирующие элементы стерола (SREBP1c), и стеароил-КоА-десатураза 1 (SCD1). В то же время считалось, что окислительный путь индуцируется увеличением количества генов, таких как карнитинпальмитоилтрансфераза 1 (CPT1). Данное изменение, в свою очередь, приводит к снижению уровней липидов DAG и TAG в печени и, таким образом, к улучшению чувствительности печени к инсулину. Кроме того, ингибирование DGAT2 ингибирует секрецию TAG ЛОНП в печени и снижает уровень циркулирующего холестерина. Наконец, уровни аполипопротеина B (APOB) в плазме подавляются, что, как полагали, было связано со сниженным поступлением TAG при липидировании вновь синтезированного белка APOB. То есть при ингибировании DGAT2 было выявлено благотворное влияние как на гликемический контроль, так и на профиль холестерина в плазме, что означает, что ингибирование DGAT2 можно применять для лечения метаболических нарушений.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Цель настоящего изобретения заключается в обеспечении нового аминоарильного производного, представленного формулой (1), проявляющего ингибирующую активность относительно диацилглицеролацилтрансферазы 2 (DGAT2).
Другая цель настоящего изобретения заключается в обеспечении способа получения аминоарильного производного.
Еще другая цель настоящего изобретения заключается в обеспечении фармацевтической композиции для лечения метаболических заболеваний, связанных с DGAT2, содержащей аминоарильное производное в качестве активного ингредиента, и способа его получения.
Еще другая цель настоящего изобретения заключается в обеспечении способа лечения метаболические заболевания, связанного с DGAT2, у субъекта, в котором повышена эффективность на животных моделях заболеваний, а также улучшена эффективность и удобство приема субъектом за счет применения аминоарильного производного в качестве активного ингредиента, обладающего улучшенными физико-химическими свойствами по сравнению с общепринятыми соединениями.
РЕШЕНИЕ ПРОБЛЕМЫ
Для достижения цели выше, настоящее изобретение обеспечивает соединение следующей формулы (1) или фармацевтически приемлемую соль или изомер:
[формула (1)]
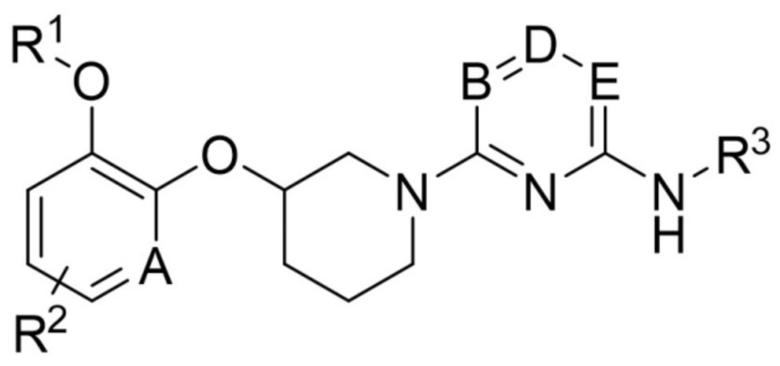
В которой
Каждый A и D независимо представляет собой CH или N;
Каждый B и E независимо представляет собой CH, C-галоген, C-галогеналкил или N;
R1 представляет собой алкил, циклоалкил или галогеналкил;
R2 представляет собой водород, галоген или алкил;
R3 представляет собой -G-J;
где G представляет собой арил, арилен, ариленалкилен, гетероарил или гетероарилен;
J представляет собой водород, амино, аминокарбонил, алкоксиалкил, циклоалкил, циклоалкилокси, гетероциклоалкил, арил, арилокси, арилалкокси, гетероарил, гетероариламино, карбоксиалкил, карбоксиалкенил, карбоксиалкиларил, карбоксиалкоксиарил, карбоксиалкилгетероциклоалкил, карбоксиалкенилгетероциклоалкил, карбоксиалкоксигетероциклоалкил, карбоксиалкиламиноарил, карбоксиалкиларилокси или карбоксиалкилгетероарил;
где алкил, алкокси, циклоалкил, арил, гетероциклоалкил, гетероарил или гетероарилен необязательно замещен одним или более заместителями, выбранными из галогена, -COOH, алкила, алкокси, галогеналкила, алкилсульфонила и гетероарилалкила; и
гетероциклоалкил, гетероарил и гетероарилен содержат один или более гетероатомов, выбранных из N, O и S.
Соединение формулы (1) согласно настоящему изобретению может образовывать фармацевтически приемлемую соль. Фармацевтически приемлемая соль может включать соль присоединения кислоты, которая образуется из неорганической кислоты, такой как хлористоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, бромистоводородная кислота и йодистоводородная кислота; органической кислоты, такой как винная кислота, муравьиная кислота, лимонная кислота, уксусная кислота, трихлоруксусная кислота, трифторуксусная кислота, глюконовая кислота, бензойная кислота, молочная кислота, фумаровая кислота, малеиновая кислота и салициловая кислота; или сульфокислоты, такой как метансульфокислота, этансульфокислота, бензолсульфокислота и п-толуолсульфокислота, которые образуют нетоксичную соль присоединения кислоты, содержащую фармацевтически приемлемый анион. Кроме того, фармацевтически приемлемая соль карбоновой кислоты включает соль щелочного металла или щелочноземельного металла, такого как литий, натрий, калий, кальций и магний; соли с аминокислотами, такими как лизин, аргинин и гуанидин; органическую соль, такую как дициклогексиламин, N-метил-D-глюкамин, трис(гидроксиметил)метиламин, диэтаноламин, холин и триэтиламин. Соединение формулы (1) настоящего изобретения можно превратить в его соли обычными способами.
Между тем, поскольку соединение формулы (1) согласно настоящему изобретению может содержать асимметричный углеродный центр и асимметричную ось или плоскость, оно может существовать в виде E- или Z-изомера, R- или S-изомера, рацемических смесей или смесей диастереоизомеров и каждого диастереоизомера, все из которых включены в объем настоящего изобретения.
В настоящем изобретении, если не указано иначе, термин “соединение формулы (1)” применяют для обозначения всех соединений формулы (1), включая их фармацевтически приемлемые соли и изомеры.
В настоящем изобретении, следующие понятия, определенные для заместителей, применяют для определения соединения формулы (1).
Термин “галоген” или “гало” обозначает фтор (F), хлор (Cl), бром (Br) или йод (I).
Термин “алкил” или “алкилен” обозначает нормальный или разветвленный углеводород, может содержать одинарную связь, двойную связь или тройную связь, и предпочтительно представляет собой C1-C10 алкил или C1-C10 алкилен, или C1-C7 алкил или C1-C7 алкилен. Примеры алкила включают, но не ограничиваются, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, ацетилен, винил, трифторметил и подобные.
Термин “алкенил” обозначает нормальный или разветвленный углеводород, содержащий, по меньшей мере, одну углерод-углеродную двойную связь, и предпочтительно представляет собой C2-C10 алкенил или C2-C7 алкенил. Примеры алкенил включаюта, но не ограничиваются, винил, аллил, бутенил, изопропенил, изобутенил и подобные.
Термин “циклоалкил” обозначает частично или полностью насыщенные одно или конденсированные кольцевые углеводороды, и предпочтительно представляет собой C3-C10-циклоалкил. Примеры циклоалкила включают, но не ограничиваются, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и подобные.
Если не определено иначе, термин “алкокси” обозначает алкилокси, содержащий 1-10 атомов углерода.
Термин “арил” или “арилен” обозначает ароматические углеводороды, предпочтительно C5-C12 арил или C5-C12 арилен, более предпочтительно C6-C10 арил или C6-C10 арилен, и включает, но не ограничивается, фенил, нафтил и подобные.
Термин “гетероарил” или “гетероарилен” обозначает 3-12-членные, более предпочтительно 5-12-членные ароматические углеводороды, которые образуют одно или конденсированное кольцо-которое может быть конденсировано с бензо или C3-C8 циклоалкилом-содержащим один или более гетероатомов, выбранных из N, O и S в качесвте кольцевого члена. Примеры гетероарила включают, но не ограничиваются, пиридинил, пиримидинил, пиридазинил, пиразинил, оксадиазолил, изоксадиазолил, тетразолил, триазолил, индолил, индазолил, изоксазолил, оксазолил, тиазолил, изотиазолил, фуранил, бензофуранил, имидазолил, тиофенил, бензтиазол, бензимидазол, хинолинил, индолинил, 1,2,3,4-тетрагидроизохинолил, 3,4-дигидроизохинолинил, тиазолопиридил, 2,3-дигидробензофуран, 2,3-дигидротиофен, 2,3-дигидроиндол, бензо[1,3]диоксин, хроман, тиохроман, 1,2,3,4-тетрагидрохинолин, 4H-бензо[1,3]диоксин, 2,3-дигидробензо[1,4]диоксин, 6,7-дигидро-5H-циклопента[d]пиримидин и подобные.
Термин “гетероциклоалкил” обозначает частично или полностью насыщенные углеводороды, которые образуют одно или конденсированное кольцо, содержащее один или более гетероатомов, выбранных из N, O и S, и предпочтительно представляет собой 3-12-членный гетероциклоалкил или 5-12-членный гетероциклоалкил. Примеры гетероциклоалкила включают, но не ограничиваются, пирролидинил, пиперидинил, морфолинил, имидазолинил, пиперазинил, тетрагидрофуран, тетрагидротиофуран и подобные.
Арилалкокси, алкиларил, гетероарилалкил и алкилгетероарил обозначают группы, которые образованы комбинацией приведенного выше арила или гетероарила с алкилом или алкокси. Примеры включают, но не ограничиваются, бензил, метоксифенил, тиофенметил, пиримидин метил и подобные.
Согласно одному варианту осуществления настоящего изобретения, в формуле выше (1)
Каждый A и D независимо представляет собой CH или N;
Каждый B и E независимо представляет собой CH, C-галоген, C-halo-C1-C7 алкил или N;
R1 представляет собой C1-C7 алкил, C3-C7 циклоалкил или галоген-C1-C7 алкил;
R2 представляет собой водород, галоген или C1-C7 алкил;
R3 представляет собой -G-J;
где G представляет собой C6-C10 арил, C6-C10 арилен, C6-C10 арилен-C1-C7 алкилен, 5-12-членный гетероарил или 5-12-членный гетероарилен;
J представляет собой водород, амино, аминокарбонил, C1-C7 алкокси-C1-C7 алкил, C3-C10 циклоалкил, C3-C10 циклоалкил-окси, 5-12-членный гетероциклоалкил, C6-C10 арил, C6-C10 арилокси, C6-C10 арил-C1-C7 алкокси, 5-12-членный гетероарил, 5-12-членный гетероарил-амино, карбокси-C1-C7 алкил, карбокси-C2-C7 алкенил, карбокси-C1-C7 алкил-C6-C10 арил, карбокси-C1-C7 алкокси-C6-C10 арил, карбокси-C1-C7 алкил-5-12-членный гетероциклоалкил, карбокси-C2-C7 алкенил-5-12-членный гетероциклоалкил, карбокси-C1-C7 алкокси-5-12-членный гетероциклоалкил, карбокси-C1-C7 алкил-амино-C6-C10 арил, карбокси-C1-C7 алкил-C6-C10 арилокси или карбокси-C1-C7 алкил-5-12-членный гетероарил;
где алкил, алкокси, циклоалкил, арил, гетероциклоалкил, гетероарил или гетероарилен необязательно замещен 1-4 заместителями, выбранными из галогена, -COOH, C1-C7 алкила, C1-C7 алкокси, галоген-C1-C7 алкила, C1-C7 алкилсульфонила и 5-12-членного гетероарил-C1-C7 алкила; и
гетероциклоалкил, гетероарил и гетероарилен содержат 1-5 гетероатома, выбранные из N, O и S.
Репрезентативные соединения формулы (1) согласно настоящему изобретению включают, но не ограничиваются, следующие соединения:
(R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)тиазол-5-карбоновая кислота;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-4,5-диметилтиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)тиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-4-фенилтиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)бензо[d]тиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-6-метоксибензо[d]тиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-6-(метансульфонил)бензо[d]тиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-3-(1-(2-метоксиэтокси)-2-метилпропан-2-ил)изооксазол-5-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-4-фенилоксазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)бензо[d]оксазол-2-амин;
(R)-5-хлор-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)бензо[d]оксазол-2-амин;
(R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)уксусная кислота;
(R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)-2-метилпропановая кислота;
(R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)-2,2-диметилпропановая кислота;
(R,E)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)акриловая кислота;
(R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)пропановая кислота;
(R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-6-ил)-2-метилпропановая кислота;
(R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-6-ил)пропановая кислота;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(1H-пиразол-3-ил)пиразин-2-амин;
(R)-2-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)уксусная кислота;
(R)-3-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-фторпиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(1-метил-1H-тетразол-5-ил)пиразин-2-амин;
(R)-N-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-фенилпиразин-2-амин;
(R)-N-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)метансульфонамид;
(R)-2-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)-N-(пиридин-4-илметил)ацетамид;
(R)-2-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)-2-метилпропановая кислота;
(R)-2-(4-((6-(3-(2-этоксифенокси)пиридин-1-ил)пиразин-2-ил)амино)фенил)-2-метилпропановая кислота;
(R)-2-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)-2-метилпропановая кислота;
(R)-3-(3'-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-[1,1'-бифенил]-4-ил)-2,2-диметилпропановая кислота;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(пиридин-2-ил)пиразин-2-амин;
(R)-6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)никотиновая кислота;
(R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)изоникотиновая кислота;
(R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)никотиновая кислота;
(R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)-2-метилпропановая кислота;
(R)-2-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)уксусная кислота;
(R,E)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)акриловая кислота;
(R)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)пропановая кислота;
(R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)-2,2-диметилпропановая кислота;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(5-фенилпиридин-2-ил)пиразин-2-амин;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(4-фенилпиридин-2-ил)пиразин-2-амин;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2-метилпропановая кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)пропановая кислота;
(R)-3-(3-(5-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(5-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)фенил)-2-метилпропановая кислота;
(R)-2-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-2-метилпропановая кислота;
(R)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-2,2-диметилпропановая кислота;
1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пирролидин-3-карбоновая кислота;
1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-3-метилпирролидин-3-карбоновая кислота;
1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоновая кислота;
(R)-1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоновая кислота;
(R)-1-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-4- карбоновая кислота;
(R)-2-(1-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-4-ил)уксусная кислота;
(R)-2-(1-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-4-ил)-2-метилпропановая кислота;
2-(((S)-1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-ил)уксусная кислота;
(R)-2-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((2-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин-4-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)глицин;
(R)-(4-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)глицин;
(R)-(4-(6-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиридин-2-ил)фенил)глицин;
(R)-(4-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)глицин;
(R)-2-((4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)амино)-2-метилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенокси)-2-метилпропановая кислота;
(R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенокси)-2-метилпропановая кислота;
(R)-3-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-1H-пиразол-1-ил)-2,2-диметилпропановая кислота;
(R)-3-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота;
(R)-3-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота;
(R)-4-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота;
(R)-4-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота;
(R)-2-(3-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота;
(R)-2-(3-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота;
(R)-2-(4-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота;
(R)-2-(4-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота;
(R)-2-(3-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота;
(R)-2-(3-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота;
(R)-2-(4-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота;
(R)-2-(4-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота;
(R)-4-(((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)метил)бензойная кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-2-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-3-(трифторметил)пиридин-2-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-4-(трифторметил)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-3-метилпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиразин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)пиримидин-2-амин;
(R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-5-карбоновая кислота;
(R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)пиримидин-4-ил)-2-метилпропановая кислота;
(R)-2-(2-((4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин-2-ил)пиримидин-4-ил)-2-метилпропановая кислота;
(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-L-пролин;
1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пирролидин-3-карбоновая кислота;
1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпирролидин-3-карбоновая кислота;
1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-карбоновая кислота;
(R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-карбоновая кислота;
1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпиперидин-3-карбоновая кислота;
(R)-1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-карбоновая кислота;
5-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)бицикло[2,2,1]гептан-2-карбоновая кислота;
(R)-2-(1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-ил)уксусная кислота;
(R)-2-(1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-ил)-2-метилпропановая кислота;
(R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперазин-1-ил)уксусная кислота;
2-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)уксусная кислота;
(E)-3-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)акриловая кислота;
3-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)пропановая кислота;
2-(((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)окси)уксусная кислота;
2-(((R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)окси)уксусная кислота;
2-(((R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)окси)-2-метилпропановая кислота;
(R)-4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(1R,4r)-4-((2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(1R,4r)-4-((2-((6-((R)-3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(1S,4s)-4-((2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(1S,4s)-4-((2-((6-((R)-3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(R)-6-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиколиновая кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота;
(R)-2-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)пропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота;
(R)-2-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота;
(R)-3-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота;
(R)-2-((4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)амино)-2-метилпропановая кислота;
(R)-2-(4-((2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)фенил)уксусная кислота;
(R)-2-(4-((2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-(2-этокси-4-фторфенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота; and
(R)-2-(4-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота.
Термины и сокращения, применяемые в настоящем изобретении, сохраняют их обычное значение, если не указано иначе.
Настоящее изобретение также обеспечивает способ получения соединения формулы (1). В настоящем изобретении далее, способ получения соединения формулы (1) поясняется на основе примерных реакций, чтобы проиллюстрировать настоящее изобретение. Однако специалист в данной области может получить соединение формулы (1) различными способами, основанными на структуре формулы (1), и данные способы следует интерпретировать как включенные в объем настоящего изобретения. То есть соединение формулы (1) можно получить способами, описанными в настоящем изобретении, или комбинированием различных способов, описанных на известном уровне техники, которые следует интерпретировать как включенные в объем настоящего изобретения. Соответственно, способ получения соединения формулы (1) не ограничивается следующими способами.
Как показано на следующей реакционной схеме 1, соединение формулы (1) можно получить прямым введением замещенной аминогруппы в соединение (2) или реакцией кросс-сочетания с применением палладиевого катализатора в соединение (3), которое получают введением защищенного амина в соединение (2) и удалением защитной группы.
[Реакционная схема 1]
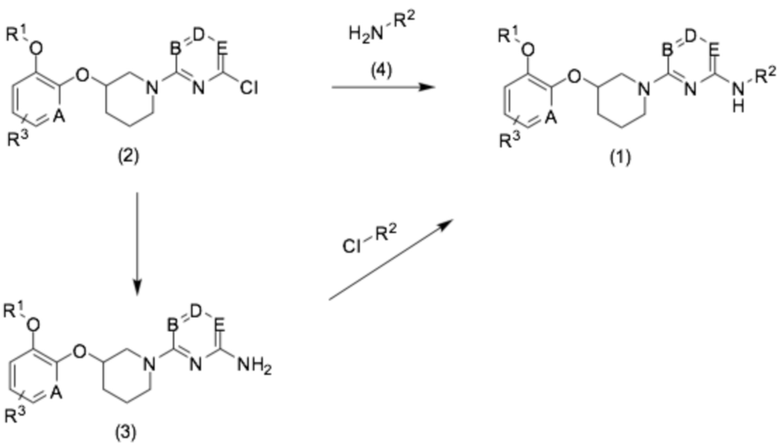
Соединение (2) можно получить из трет-бутил-3-гидроксипиперидин-1-карбоксилата в качестве исходного соединения согласно способу следующей реакционной схемы 2.
[Реакционная схема 2]
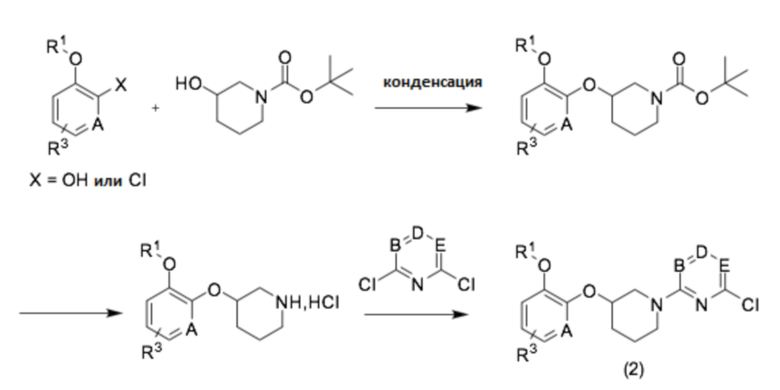
Кроме того, соединение (3) можно получить согласно способу следующей реакционной схемы 3.
[Реакционная схема 3]
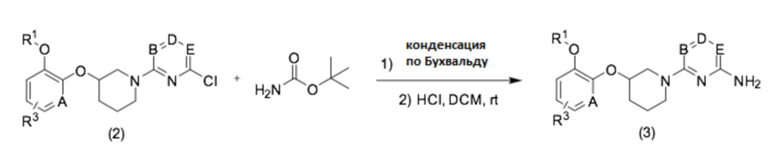
Кроме того, аминоарильные промежуточные соединения получали введением аминогруппы в соединение, полученные реакцией кросс-сочетания диоксабороланового ключевого промежуточного соединения и различных типов хлорарильных соединений. Например, метил 2-(4-(2-аминопиримидин-4-ил)фенил)-2-метилпропаноат можно получить согласно способу следующей реакционной схемы 4, применяя метил 2-(4-бромфенил)-2-метилпропаноат в качестве исходного соединения.
[Реакционная схема 4]
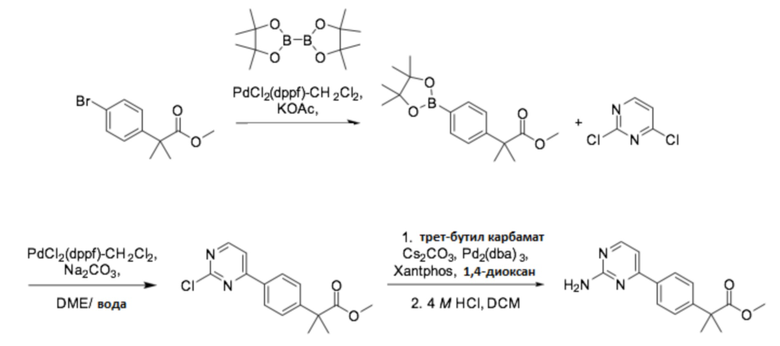
Соединение, конкретно не описанное в способе получения настоящего описания, представляет собой известное соединение или соединение, которое можно легко получить из известного соединения известным способом получения или аналогичным способом.
Соединение формулы (1), полученное способами выше, можно разделить или очистить от продуктов реакции общепринятыми способами, такими как перекристаллизация, ионосферез, колоночная хроматография на силикагеле или ионообменная хроматография.
Как пояснено выше, соединения согласно настоящему изобретению, исходные соединения или промежуточные соединения для их получения можно получить различными способами, которые следует интерпретировать как включенные в объем настоящего изобретения в отношении получения соединения формулы (1).
Соединение формулы (1) согласно настоящему изобретению проявляют ингибирующую активность относительно диацилглицеролацилтрансферазы 2 (DGAT2). Соответственно, настоящее изобретение обеспечивает фармацевтическую композицию для лечения заболеваний, связанных с DGAT2, содержащую соединение формулы (1) или его фармацевтически приемлемую соль или изомер, вместе с фармацевтически приемлемым носителем. Различные типы пролекарств, которые превращаются в соединение формулы (1) in vivo, также включены в объем настоящего изобретения.
Примерные заболевания, связанные с DGAT2, которые можно лечить фармацевтической композицией согласно настоящему изобретению, включают, но не ограничиваются, заболевания, выбранные из группы, состоящей из жировой дистрофии печени, неалкогольного стеатогепатита (НАСГ), неалкогольной жировой болезни печени (НАЖБП), диабета, ожирения, гиперлипидемия, атеросклероза и гиперхолестеринемии.
В настоящем изобретении, “фармацевтическая композиция” может содержать другие компоненты, такие как носители, разбавители, вспомогательные вещества и т.д., в дополнение к активному ингредиенту настоящего изобретения. Соответственно, фармацевтическая композиция может содержать фармацевтически приемлемые носители, разбавители, вспомогательные вещества или их комбинации, если это необходимо. Фармацевтическая композиция облегчает введение соединений в организм. Различные способы введения соединений включают, но не ограничиваются, пероральное, инъекционное, аэрозольное, парентеральное и местное введение.
В настоящем изобретении, “носитель” обозначает соединение, что облегчает добавление соединений в клетку или ткань. Например, диметилсульфоксид (ДМСО) представляет собой обычный носитель, облегчающий введение многих органических соединений в живые клетки или ткани.
В настоящем изобретении, “разбавитель” обозначает соединение, которое не только стабилизирует биологически активную форму, но и разбавляет в растворителе, растворяя соединения. В качестве разбавителя в данной области применяют растворенную в буфере соль. Традиционно применяемый буфер представляет собой фосфатно-солевой буфер, имитирующий солевую форму в жидкости организма. Поскольку буферный раствор может контролировать рН раствора при низкой концентрации, буферный разбавитель практически не изменяет биологическую активность соединений.
В настоящем изобретении, “фармацевтически приемлемый” обозначает такое свойство, которое не ухудшает биологическую активность и физические свойства соединений.
Соединения согласно настоящему изобретению можно формулировать в виде различных лекарственных форм для фармацевтического введения. При получении фармацевтической композиции настоящего изобретения активный компонент, в частности, соединение формулы (1) или его фармацевтически приемлемую соль или изомер, смешивают с выбранными фармацевтически приемлемыми носителями с учетом приготавливаемой лекарственной формы. Например, фармацевтическую композицию настоящего изобретения можно формулировать в виде инъекций, препаратов для перорального применения и других, по мере необходимости.
Соединение настоящего изобретения можно формулировать общепринятыми спосообами, применяя известные фармацевтические носители и вспомогательные вещества, помещенные в единичные или многоместные контейнеры. Составы могут представлять собой раствор, суспензию или эмульсию в масле или водном растворителе и содержат обычные диспергирующие агенты, суспендирующие агенты или стабилизаторы. Кроме того, соединение может быть, например, в виде сухого порошка, растворяемого в стерилизованной апирогенной воде перед применением. Соединение настоящего изобретения можно формулировать в виде суппозиториев, применяя обычную основу для суппозиториев, такая как масло какао или другие глицериды. К твердым формам для приема внутрь относятся капсулы, таблетки, пилюли, порошки и гранулы. Предпочтительными являются капсулы и таблетки. Таблетки и пилюли предпочтительно покрыты кишечнорастворимой оболочкой. Твердые формы получают смешиванием соединений настоящего изобретения, по меньшей мере, с одним носителем, выбранными из инертных разбавителей, таких как сахароза, лактоза или крахмал, смазывающими веществами, такими как стеарат магния, разрыхлителями, связующими веществами и подобными.
Соединение или содержащую его фармацевтическую композицию согласно настоящему изобретению можно вводить в комбинации с другими лекарственными средствами, например, другими терапевтическим агентами для метаболических расстройство, при необходимости.
Дозу соединения формулы (1) согласно настоящему изобретению определяет по назначению врача с учетом массы тела, возраста и состояния больного. Типичная доза для взрослых находится в диапазоне приблизительно от 0,3 до 500 мг в день в зависимости от частоты и интенсивности введения. Типичная суточная доза для внутримышечного или внутривенного введения для взрослых находится в диапазоне приблизительно от 1 до 300 мг в день, и ее можно вводить в виде разделенных стандартных доз. Некоторым пациентам требуется более высокая суточная доза.
В настоящем изобретении, термин “лечение” применяют для обозначения сдерживания, задержки или улучшения течения заболеваний у субъекта, проявляющего симптомы заболеваний.
ПОЛЕЗНЫЕ ЭФФЕКТЫ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Новое аминоарильное производное формулы (1) согласно настоящему изобретению проявляет превосходную ингибирующую активность относительно диацилглицеролацилтрансферазы 2 (DGAT2) и, таким образом, его можно с пользой применять в предотвращении, облегчении или лечении метаболических расстройств, связанных с DGAT2. Кроме того, новое аминоарильное производное формулы (1) согласно настоящему изобретению показывает повышенную липофильность и печеночную селективность, тем самым улучшая эффективность за счет повышенного воздействия на печень, а также ожидается преимущества удобства приема, поскольку период полувыведения является относительно длительным в моделях заболеваний на животных и в клинической практике.
СПОСОБ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В настоящем изобретении далее, настоящее изобретение будет описано более подробно посредством примеров получения и примеров. Однако, данные примеры являются только иллюстративными, и объем настоящего изобретения не ограничивается ими.
В следующих примерах, M относится к молярной концентрации, и N относится к нормальной концентрации. Кроме того, описание сокращений и терминов, применяемых на реакционной схеме, в примерах получения и примерах являются следующими:
DCM: дихлорметан
DIPEA: диизопропилэтиламин
DME: диметоксиэтан
DMF: N,N-диметилформамид
HCl: хлористоводородная кислота
Pd/C: палладий/уголь
TEA: триэтиламин
TFA: трифторуксусная кислота
THF: тетрагидрофуран
Пример получения 1: (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин
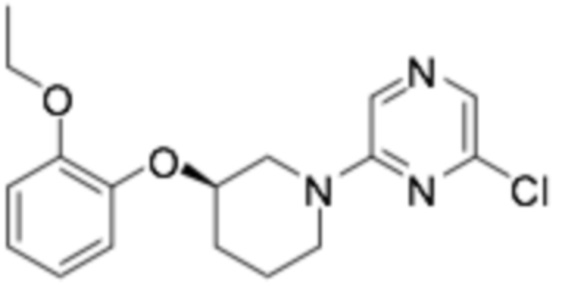
Стадия 1: трет- бутил-( R )-3-(2-этоксифенокси)пиперидин-1-карбоксилат
(S)-трет-бутил-3-гидроксипиперидин-1-карбоксилат (30,0 г, 149 ммоль), 2-этоксифенол (20,6 г, 149 ммоль), трифенилфосфин (43,8 г, 167 ммоль) растворяли в 500 мл толуола и перемешивали при комнатной температуре. Диэтилазодикарбоксилат (30,4 мл) разбавляли в 50 мл толуола и медленно добавляли по каплям к реакционной смеси. После перемешивания при комнатной температуре в течение 15 часов, ее фильтровали, промывали 300 мл диэтилового эфира, промывали 100 мл 3N раствора гидроксида натрия, органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:6). (выход 47%)
1H NMR (300 МГц, ХЛОРОФОРМ-D): δ 6,89-6,95 (м, 4H), 4,07 (м, 3H), 3,9 (уш с, 1H), 3,66 (уш с, 1H), 3,16 (м, 2H), 2,07 (уш с, 1H), 1,76-1,83 (м, 2H), 1,45 (m+s, 3H)
Стадия 2: гидрохлорид ( R )-3-(2-этоксифенокси)пиперидина
Трет-бутил-(R)-3-(2-этоксифенокси)пиперидин-1-карбоксилат (10,0 г, 31,1 ммоль), полученный на стадии 1, растворяли в 100 мл дихлорметана и добавляли 4 M раствор хлористоводородной кислоты по каплям при комнатной температуре. После перемешивания при комнатной температуре в течение 4 часов, подтверждали, что реакция завершилась по ТСХ, и органический растворитель удаляли при пониженном давлении. После разбавления этилацетатом и промывки водным раствором гидрокарбоната натрия, органический растворитель сушили над сульфатом магния, и неочищенное соединение, полученное перегонкой при пониженном давлении, применяли в следующей реакции без дополнительной очистки.
m/z (M+H)+ рассчитанная для C13H19NO2: 221, найденная 222
Стадия 3: ( R )-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин
Гидрохлорид (R)-3-(2-этоксифенокси)пиперидина, полученный на стадии 2, 2,6-дихлорпиразин (5,10 г, 34,2 ммоль) и триэтиламин (13 мл, 93 ммоль) смешивали с 100 мл этанола и перемешивали при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов, подтверждали, что реакция завершилась по ТСХ, и органический растворитель удаляли при пониженном давлении, растворяли в этилацетате и промывали соляным раствором. Органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 91%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,93 (с, 1H), 7,74 (с, 1H), 7,04-6,93 (м, 2H), 6,92-6,80 (м, 2H), 4,35-4,24 (м, 1H), 4,07-3,89 (м, 3H), 3,82-3,68 (м, 1H), 3,67-3,46 (м, 2H), 2,09 (кв, J=4,3 Гц, 1H), 2,02-1,97 (м, 1H), 1,93 (кв, J=4,3 Гц, 1H), 1,68-1,58 (м, 1H), 1,38 (т, J=7,0 Гц, 3H)
Пример получения 2: (R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-амин
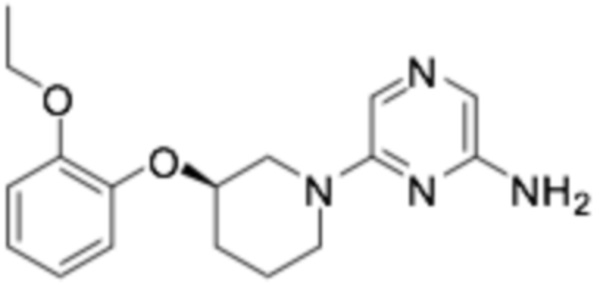
Стадия 1: трет- бутил ( R )-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)карбамат
После растворения (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразина (1,41 г, 4,22 ммоль), полученного в примере получения 1, трет-бутилкарбамата (0,55 г, 4,65 ммоль), карбоната цезия (3,44 г, 10,56 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантина (220 мг, 0,38 ммоль) и трис(дибензилиденацетон)дипалладия (0) (232 мг, 0,25 ммоль) в 50 мл 1,4-диоксана, растворенный кислород удаляли барботированием азота при перемешивании, и приток наружного воздуха перекрывали в герметичном контейнере. Реакцию перемешивали при 110°C в течение 5 часов и затем охлаждали до комнатной температуры. После фильтрования через слой целита и удаления органического растворителя при пониженном давлении, реакцию растворяли в этилацетате и промывали соляным раствором. Органический растворитель сушили над сульфатом магния и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 3:1). (выход 89%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,40 (с, 1H), 7,78 (с, 1H), 6,96 (т, J=7,0 Гц, 2H), 6,91-6,77 (м, 2H), 6,66 (с, 1H), 4,48-4,15 (м, 1H), 4,14-3,85 (м, 3H), 3,84-3,69 (м, 1H), 3,52-3,41 (1H), 3,40-3,23 (м, 1H), 2,11 (т, J=6,1 Гц, 1H), 2,01-1,92 (м, 1H), 1,88 (кв, J=4,3 Гц, 1H), 1,57 (дт, J=13,4, 4,0 Гц, 1H), 1,52 (с, 9H), 1,37 (т, J=7,0 Гц, 3H)
Стадия 2: ( R )-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-амин
Трет-бутил (R)-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил) карбамат, полученный на стадии 1, растворяли в 10 мл дихлорметане, перемешивали и добавляли по каплям к нему 2 мл трифторуксусной кислоты. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении, разбавляли этилацетатом, и промывали водным раствором гидрокарбоната натрия. Органический растворитель сушили над сульфатом магния и органический растворитель удаляли при пониженном давлении, получая неочищенный продукт, и следующую реакцию проводили без дополнительной очистки.
1H NMR (300 МГц, ХЛОРОФОРМ-D): δ 7,49 (с, 1H), 7,28 (с, 1H), 7,27 (д, 1H), 6,90-7,05 (м, 3H), 3,80-4,25 (м, 7H), 3,25 (м, 2H), 2,18 (м, 1H), 1,75-1,98 (м, 2H), 1,91 (м, 1H), 1,43 (т, 3H), 1,27 (м, 1H)
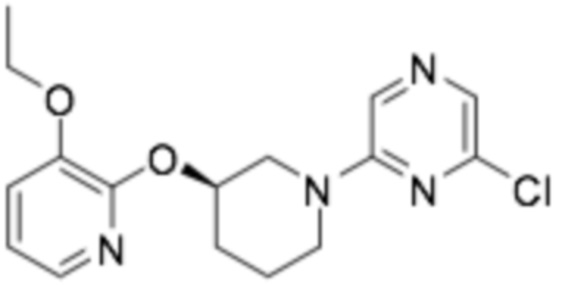
Пример получения 3: (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин
Стадия 1: 2-хлор-3-этоксипиридин
2-Хлорпиридин-3-ол (10,0 г, 77 ммоль), йодэтан (14,45 г, 93 ммоль) и карбонат калия (21,34 г, 154 ммоль) добавляли к 77 мл DMF и перемешивали при комнатной температуре в течение 48 часов. Реакционную смесь фильтровали и добавляли воду, с последующей экстракцией этилацетатом. После промывки водой и соляным раствором, органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Требуемый продукт получали очисткой колоночной хроматографией. (выход 99%)
1H NMR (400 МГц, ХЛОРОФОРМ-D): δ 7,96 (т, J=3,0 Гц, 1H), 7,17 (д, J=3,2 Гц, 2H), 4,10 (кв, J=7,0 Гц, 2H), 1,48 (т, J=7,1 Гц, 3H)
Стадия 2: трет- бутил ( R )-3-((3-этоксипиридин-2-ил)окси)пиперидин-1-карбоксилат
Гидрид натрия (3,38 г, 84 ммоль) добавляли к 96 мл безводного DMF, и затем добавляли трет-бутил (R)-3-гидроксипиперидин-1-карбоксилат (17,00 г, 84 ммоль). Температуру повышали до 60°C, перемешивали в течение 1 часа, и добавляли 2-хлор-3-этоксипиридин (12,1 г, 77 ммоль), полученный на стадии 1, с последующим перемешиванием в течение 24 часов. Добавляли воду к реакционной смеси, с последующей экстракцией этилацетатом. После промывки водой и соляным раствором, органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Требуемый продукт получали очисткой колоночной хроматографией. (выход 75%)
1H NMR (400 МГц, ХЛОРОФОРМ-D): δ 7,68 (тд, J=3,2, 1,7 Гц, 1H), 7,03 (дт, J=7,8, 1,4 Гц, 1H), 6,82-6,72 (м, 1H), 5,06 (с, 1H), 4,03 (кв, J=7,0 Гц, 2H), 3,55 (д, J=100,2 Гц, 4H), 2,16-1,96 (м, 1H), 1,96-1,70 (м, 2H), 1,68-1,50 (м, 1H), 1,50-1,27 (м, 12H)
Стадия 3: ( R )-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин
Заявленное в заголовке соединение получали способом, аналогичным стадии 3 примера получения 1, применяя трет-бутил (R)-3-((3-этоксипиридин-2-ил)окси)пиперидин-1-карбоксилат (31,5 г, 98 ммоль), полученный на стадии 2, гидрохлорид (R)-3-этокси-2-(пиперидин-3-илокси)пиридина (30 г, 116 ммоль), полученный, применяя способом, аналогичным стадии 2 примера получения 1, и 2,6-дихлорпиразин (19 г, 128 ммоль). (выход 80%)
1H NMR (400 МГц, ХЛОРОФОРМ-D): δ 7,96 (д, J=11,0 Гц, 1H), 7,74-7,66 (м, 2H), 7,04 (дд, J=7,8, 1,4 Гц, 1H), 6,83 (дд, J=7,8, 5,0 Гц, 1H), 5,24 (тд, J=7,0, 3,4 Гц, 1H), 4,05-3,83 (м, 3H), 3,83-3,70 (м, 2H), 3,67-3,53 (м, 1H), 2,22-2,09 (м, 1H), 2,07-1,93 (м, 2H), 1,75-1,60 (м, 1H), 1,35-1,27 (т, J=7,1 Гц, 3H)
Пример получения 4: (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин
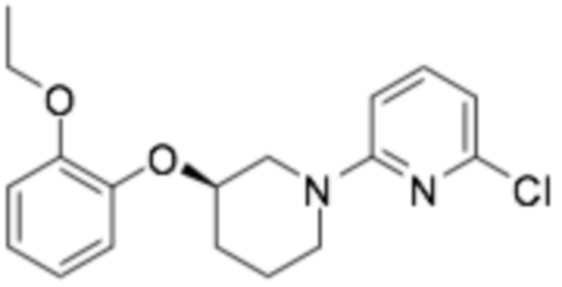
Требуемый продукт получали способом, аналогичным стадии 3 примера получения 1, применяя гидрохлорид (R)-3-(2-этоксифенокси)пиперидина (10 г, 45,2 ммоль), полученный на стадии 2 примера получения 1, и 2,6-дихлорпиридин (11,37 г, 77 ммоль). (выход 41%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 7,44-7,29 (м, 1H), 7,17-7,05 (м, 1H), 6,94-6,86 (м, 3H), 6,73-6,49 (м, 1H), 6,49-6,32 (м, 1H), 4,30-4,17 (м, 2H), 4,04-3,96 (м, 2H), 3,95-3,78 (м, 1H), 3,35-3,18 (м, 2H), 2,22-2,07 (м, 1H), 1,97-1,75 (м, 2H), 1,64-1,52 (м, 1H), 1,40 (кв, J=6,9 Гц, 3H)
Пример получения 5: (R)-4-хлор-2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин
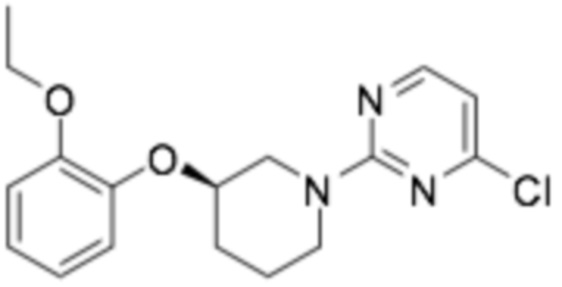
Заявленное в заголовке соединение получали способом, аналогичным примеру получения 1 (стадия 2, стадия 3), применяя трет-бутил-(R)-3-(2-этоксифенокси)пиперидин-1-карбоксилат (15,0 г, 46,7 ммоль), полученный на стадии 1 примера получения 1, и 2,4-дихлорпиримидин (13,9 г, 93 ммоль). (выход 19%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 8,11 (д, 1H), 7,03 (м, 1H), 6,95 (м, 1H), 6,89 (м, 2H), 6,45 (д, 1H), 4,44 (дд, 1H), 4,22 (м, 1H), 4,10 (м, 1H), 4,02 (м, 2H), 3,63 (м, 1H), 3,51 (м, 1H), 2,12 (м, 1H), 1,92 (м, 2H), 1,55 (м, 1H), 1,40 (т, 3H)
Пример получения 6: (R)-2-хлор-4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин
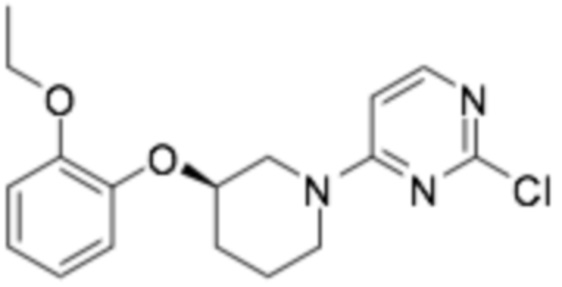
Заявленное в заголовке соединение получали способом, аналогичным примеру получения 1 (стадия 2, стадия 3), применяя трет-бутил-(R)-3-(2-этоксифенокси)пиперидин-1-карбоксилат (15,0 г, 46,7 ммоль), полученный на стадии 1 примера получения 1, и 2,4-дихлорпиримидин (13,9 г, 93 ммоль). (выход 72%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 7,97 (д, 1H), 6,98 (м, 2H), 6,89 (м, 2H), 6,32 (д, 1H), 4,31 (м, 1H), 4,01 (м, 3H), 3,71 (м, 3H), 2,01 (м, 3H), 1,61 (м, 1H), 1,38 (т, 3H)
Пример получения 7: (R)-2-хлор-4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин
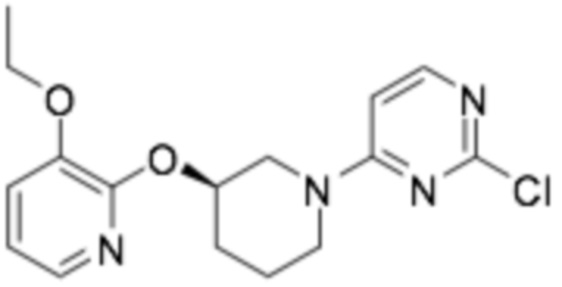
Его применяли способом, аналогичным стадии 3 примера получения 1, получая требуемый продукт, применяя гидрохлорид (R)-3-этокси-2-(пиперидин-3-илокси)пиридина (5,90 г, 22,80 ммоль), полученный на стадии 3 примера получения 3, и 2,4-дихлорпиримидин (3,74 г, 25,08 ммоль). (выход 26%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 7,91 (д, J=6,4 Гц, 1H), 7,70 (дд, J=4,8, 1,6 Гц, 1H), 7,03 (дд, J=7,8, 1,4 Гц, 1H), 6,82 (кв, J=4,1 Гц, 1H), 6,32 (д, J=5,9 Гц, 1H), 5,19 (с, 1H), 4,05-3,59 (м, 6H), 2,25-1,90 (м, 3H), 1,76-1,57 (м, 1H), 1,31 (т, J=6,9 Гц, 3H)
Пример получения 8: (R)-2-хлор-4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-фторпиримидин
Заявленное в заголовке соединение получали способом, аналогичным стадии 3 примера получения 1, применяя гидрохлорид (R)-3-(2-этоксифенокси)пиперидина (4 г, 18,08 ммоль), полученный на стадии 2 примера получения 1, и 2,4-дихлор-5-фторпиримидин (7,54 г, 45,2 ммоль). (выход 81%)
1H-ЯМР (ХЛОРОФОРМ-D): δ 7,96-7,83 (м, 1H), 7,09-6,83 (м, 4H), 4,44-4,31 (м, 1H), 4,11 (д, J=9,8 Гц, 1H), 4,08-3,95 (м, 2H), 3,93 (с, 1H), 3,82 (дд, J=24,6, 7,5 Гц, 2H), 2,15-1,95 (м, 3H), 1,63 (д, J=7,9 Гц, 1H), 1,40 (кв, J=6,9 Гц, 3H)
Пример получения 9: (R)-4-хлор-2-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин
Заявленное в заголовке соединение получали способом, аналогичным стадии 3 примера получения 1, применяя гидрохлорид (R)-3-(2-этоксифенокси)пиперидина (1 г, 4,52 ммоль), полученный на стадии 2 примера получения 1, и 2,4-дихлор-5-(трифторметил) пиримидин (2,45 г, 11,3 ммоль). (выход 38%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 8,37 (д, J=21,0 Гц, 1H), 6,96 (т, J=7,5 Гц, 2H), 6,87 (т, J=5,5 Гц, 2H), 4,28 (тд, J=6,6, 3,4 Гц, 1H), 4,19 (с, 1H), 4,06-3,89 (м, 4H), 3,89-3,72 (1H), 2,16-1,88 (м, 3H), 1,67 (с, 1H), 1,62-1,48 (м, 1H), 1,48-1,30 (м, 3H)
Пример получения 10: (R)-2-хлор-4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин
Заявленное в заголовке соединение получали способом, аналогичным стадии 3 примера получения 1, применяя гидрохлорид (R)-3-(2-этоксифенокси)пиперидина (1 г, 4,52 ммоль), полученный на стадии 2 примера получения 1, и 2,4-дихлор-5-(трифторметил)пиримидин (2,45 г, 11,3 ммоль). (выход 28%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 8,36 (с, 1H), 7,12-7,01 (м, 1H), 7,01-6,91 (м, 1H), 6,90-6,78 (м, 2H), 4,32 (тд, J=7,5, 3,7 Гц, 1H), 4,16 (дд, J=13,5, 3,0 Гц, 1H), 4,01 (тд, J=7,3, 6,3 Гц, 2H), 3,76 (дд, J=13,5, 5,7 Гц, 1H), 3,68-3,47 (м, 2H), 2,19-1,84 (м, 4H), 1,71-1,57 (м, 1H), 1,39 (т, J=7,1 Гц, 3H)
Пример получения 11: 4-Фенилпиридин-2-амин
Фенилбороновую кислоту (0,14 г, 1,16 ммоль), 4-бромпиридин-2-амин (0,2 г, 1,16 ммоль), дихлорметановый аддукт [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (0,09 г, 0,12 ммоль) растворяли в 3 мл 1,2-диметоксиэтана, и добавляли по каплям 1 M насыщенный водный раствор гидрокарбоната натрия (3,47 мл, 3,47 ммоль), с последующим перемешиванием при 90°C в течение 5 часов. После охлаждения до комнатной температуры, фильтрования через слой целита и промывки дихлорметаном, органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (Biotage 40 M колонка). (выход 97%).
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,25 (д, J=5,5 Гц, 1H), 8,00-7,77 (м, 2H), 7,41 (т, J=7,3 Гц, 2H), 7,36 (т, J=7,3 Гц, 1H), 7,04-6,78 (м, 1H), 6,42 (кв, J=2,6 Гц, 1H), 4,57 (с, 1H)
Пример получения 12: Метил 2-(6-аминопиридин)ацетат
Стадия 1: 2-(6-хлорпиридин-3-ил)ацетонитрил
2-Хлор-5-(хлорметил)пиридин (5,0 г, 30,9 ммоль) растворяли в 20 мл этанола, и цианид калия (2,21 г, 33,9 ммоль) растворяли в 9 мл воды и добавляли по каплям при 0°C. Реакцию перемешивали при кипячении с обратным холодильником в течение 2 часов и затем перемешивали при комнатной температуре в течение 18 часов. После разбавления в 500 мл дихлорметана и промывки соляным раствором, органический растворитель сушили над сульфатом магния и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (дихлорметан : гексан = 7:3). (выход 83%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,36 (д, J=2,4 Гц, 1H), 7,77-7,60 (м, 1H), 7,38 (д, J=8,6 Гц, 1H), 3,87-3,63 (2H)
Стадия 2: Метил 2-(6-хлорпиридин-3-ил)ацетат
2-(6-хлорпиридин-3-ил)ацетонитрил (3,92 г, 25,7 ммоль), полученный на стадии 1, растворяли в 5 мл концентрированной хлористоводородной кислоты и перемешивали при 80°C в течение 24 часов. Реакцию выливали в ледяную воду, экстрагировали 500 мл дихлорметана, промывали соляным раствором, и затем органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:1). (выход 90%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,28 (д, J=2,4 Гц, 1H), 7,61 (дд, J=7,9, 2,4 Гц, 1H), 7,29 (д, J=8,6 Гц, 1H), 3,71 (с, 3H), 3,61 (с, 2H)
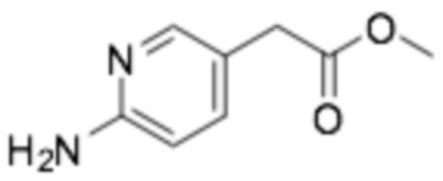
Стадия 3: Метил 2-(6-аминопиридин)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 2 (стадия 1, стадия 2), применяя метил 2-(6-хлорпиридин-3-ил)ацетат (2,0 г, 10,8 ммоль), полученный на стадии 2, и трет-бутилкарбамат (3,8 г, 32,3 ммоль). (выход 26,8%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,93 (д, J=2,4 Гц, 1H), 7,39 (дд, J=7,9, 2,4 Гц, 1H), 6,48 (д, J=8,6 Гц, 1H), 4,49 (с, 2H), 3,68 (с, 3H), 3,47 (с, 2H)
Пример получения 13: Метил (E)-3-(6-аминопиридин-3-ил)акрилат
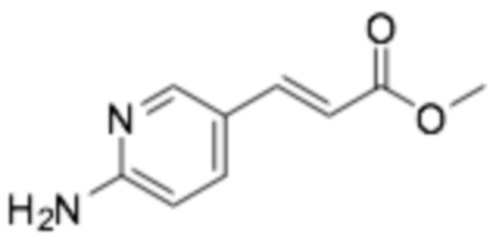
К раствору 2-амино-5-бромпиридина (2,70 г, 15,61 ммоль), ацетата палладия (II) (0,16 г, 0,70 ммоль), трис(o-толил)фосфина (0,48 г, 1,56 ммоль), TEA (2,61 мл, 18,73 ммоль) в 30 мл DMF добавляли метилакрилат (1,48 г, 17,17 ммоль), и смесь перемешивали при 100°C в течение 6 ч. Реакцию прекращали добавлением воды, и содержимое экстрагировали этилацетатом. Объединенный органический слой промывали соляным раствором, сушили над MgSO4, и концентрировали при пониженном давлении. Остаток очищали хроматографической колонкой с силикагелем (DCM/EA/MeOH=4:1:0-2:1:0-2:1:0,1), получая требуемый продукт в виде желтого твердого остатка. (выход 83%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,18 (д, J=1,8 Гц, 1H), 7,74-7,63 (м, 1H), 7,56 (с, 1H), 6,50 (д, J=8,6 Гц, 1H), 6,25 (д, J=15,9 Гц, 1H), 4,73 (с, 2H), 3,78 (с, 3H)
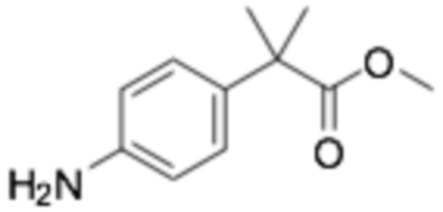
Пример получения 14: Метил 2-(4-аминофенил)-2-метилпропаноат
Стадия 1: Метил 2-(4-нитрофенил)ацетат
Концентрированную серную кислоту (34 мл, 0,64 моль) добавляли к воде (34 мл), и добавляли к данной смеси 4-нитрофенилацетонитрил (11,8 г, 73 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 30 мин, разбавляли 34 мл воды, и охлаждали до 0°C при отделении бесцветных кристаллов. Твердый остаток отфильтровывали, промывали ледяной водой, удаляя следы кислоты, и сушили, получая кислоту. Затем твердый остаток обрабатывали THF/диазометаном при 0°C. Продукт получали упариванием и колоночной хроматографией. (выход 56%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,18 (д, J=8,6 Гц, 2H), 7,45 (д, J=8,6 Гц, 2H), 3,73 (с, 2H), 3,71 (с, 3H)
Стадия 2: метил 2-метил-2-(4-нитрофенил)пропаноат
К суспензии гидрида натрия (60 процентный в масле, 1,47 г, 37 ммоль) в DMF (50 мл) при 0°C добавляли метил 2-(4-нитрофенил)ацетат (3,25 г, 16,7 ммоль), полученный на стадии 1. Смесь перемешивали в течение 15 минут при 0°C и добавляли йодметан (4,2 мл, 6,6 ммоль). Смесь перемешивали в течение дополнительных 5 минут при 0°C и при комнатной температуре в течение 12 часов, затем гасили 1 N водной хлористоводородной кислотой (1 мл) и экстрагировали EtOAc (30×2 мл). Органический слой промывали водой (30×2 мл) и соляным раствором (20 мл), сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (EtOAc : гексан = 1:3), получая требуемый продукт. (выход 57%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,17 (д, J=8,7 Гц, 2H), 7,49 (д, J=8,7 Гц, 2H), 3,66 (с, 3H), 1,61 (с, 6H)
Стадия 3: Метил 2-(4-аминофенил)-2-метилпропаноат
Смесь метил 2-метил-2-(4-нитрофенил)пропаноата (2,11 г, 9,45 ммоль) и Pd/C (0,2 г) в MeOH (30 мл) перемешивали в атмосфере баллона H2 при комнатной температуре в течение 4 часов, затем фильтровали через целит, получая продукт (выход 95%).
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,12 (д, J=8,2 Гц, 2H), 6,64 (д, J=8,7 Гц, 2H), 3,62 (с, 3H), 1,52 (д, J=0,9 Гц, 6H)
Пример получения 15: Метил 2-(3-аминофенил)-2-метилпропаноат
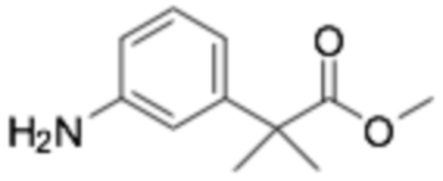
Требуемый продукт получали способом, аналогичным примеру получения 14, применяя 2-(3-нитрофенил)уксусную кислоту (4 г, 22,08 ммоль). (выход на 3 стадии 30%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,15-7,03 (м, 1H), 6,78-6,67 (м, 1H), 6,67-6,59 (1H), 6,58-6,51 (м, 1H), 3,65 (кв, J=14,9 Гц, 3H), 1,61-1,45 (м, 6H)
Пример получения 16: Метил 2-(2-аминобензо[d]оксазол-5-ил)ацетат
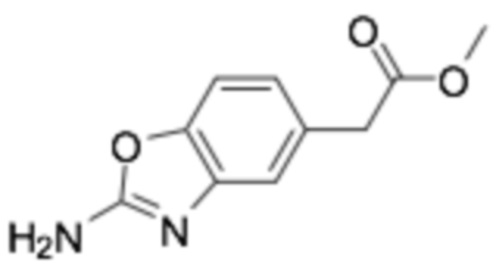
Требуемый продукт получали способом, аналогичным примеру получения 18 (стадия 1, стадия 2, стадия 3, стадия 5, стадия 6), применяя 2-(4-гидроксифенил)уксусную кислоту (20 г, 131 ммоль). (выход на 5 стадий 48%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,27 (с, 1H), 7,21 (д, J=8,2 Гц, 1H), 6,98 (д, J=8,2 Гц, 1H), 5,46 (с, 2H), 3,69 (с, 3H), 3,67 (с, 2H)
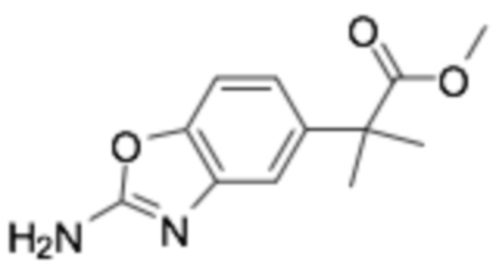
Пример получения 17: Метил 2-(2-аминобензо[d]оксазол-5-ил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 18 (стадия 1, стадия 2, стадия 3, стадия 4, стадия 5, стадия 6), применяя 2-(4-гидроксифенил)уксусную кислоту (20 г, 131 ммоль). (выход на 6 стадий 43%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,34 (д, J=1,8 Гц, 1H), 7,20 (д, J=8,7 Гц, 1H), 7,04 (дд, J=8,7, 1,8 Гц, 1H), 5,58 (с, 2H), 3,65 (с, 3H), 1,61 (с, 6H)
Пример получения 18: Метил 2-(2-аминобензо[d]оксазол-6-ил)-2-метилпропаноат
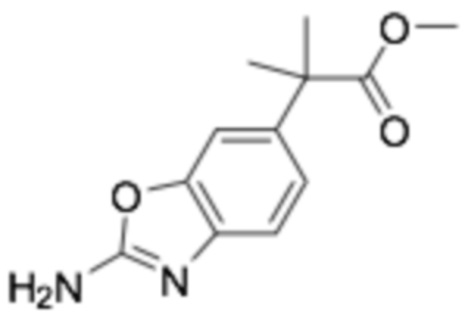
Стадия 1: 2-(3-гидрокси-4-нитрофенил)уксусная кислота
2-(3-Гидроксифенил)уксусную кислоту (2 г, 13,15 ммоль) и 4 мл 70% азотную кислоту перемешивали при комнатной температуре в течение 30 минут. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Следующую реакцию проводили без дополнительной колонки.
m/z (M+H)+ рассчитанная для C8H7NO5: 198, найденная 198
Стадия 2: Метил 2-(3-гидрокси-4-нитрофенил)ацетат
2-(3-гидрокси-4-нитрофенил)уксусную кислоту (2,59 г, 13,14 ммоль), полученную на стадии 1, и 0,245 мл серной кислоты растворяли в 50 мл метанола и перемешивали при 70°C в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 26,8%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 10,57 (с, 1H), 8,05 (д, J=8,7 Гц, 1H), 7,10-7,03 (м, 1H), 6,90 (дд, J=8,7, 1,8 Гц, 1H), 3,71 (с, 3H), 3,65 (с, 2H)
Стадия 3: Метил 2-(3-(бензилокси)-4-нитрофенил)ацетат
Метил 2-(3-гидрокси-4-нитрофенил)ацетат (0,744 г, 3,52 ммоль), полученный на стадии 2, 0,461 мл бензилбромида и карбонат калия (1,315 г, 9,52 ммоль) добавляли к 30 мл DMF и перемешивали при комнатной температуре в течение 15 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 30,1%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,90-7,73 (м, 1H), 7,45 (дд, J=16,5, 9,1 Гц, 2H), 7,42-7,35 (м, 2H), 7,35-7,28 (м, 1H), 7,12-7,04 (м, 1H), 6,93 (дд, J=8,2, 1,4 Гц, 1H), 5,28-5,18 (м, 2H), 3,71-3,66 (м, 3H), 3,66-3,59 (м, 2H)
Стадия 4: Метил 2-(3-(бензилокси)-4-нитрофенил)-2-метилпропаноат
Гидрид натрия (0,076 г, 3,19 ммоль) растворяли в 10,6 мл DMF в присутствии азота, метил 2-(3-(бензилокси)-4-нитрофенил)ацетат (0,32 г, 1,062 ммоль), полученный на стадии 3, растворяли в DMF и медленно добавляли по каплям, с последующим перемешиванием при 0°C в течение 15 минут. Затем, добавляли 0,166 мл метилйодида и перемешивали при комнатной температуре в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 85%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,86 (д, J=8,5 Гц, 1H), 7,48 (д, J=7,3 Гц, 2H), 7,42 (т, J=7,5 Гц, 2H), 7,35 (т, J=7,2 Гц, 1H), 7,07 (с, 1H), 7,02 (д, J=8,5 Гц, 1H), 5,26 (с, 2H), 3,69-3,58 (м, 3H), 1,58-1,53 (м, 6H)
Стадия 5: Метил 2-(4-амино-3-гидроксифенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным стадии 3 примера получения 94, применяя метил 2-(3-(бензилокси)-4-нитрофенил)-2-метилпропаноат (0,297 г, 0,902 ммоль), полученный на стадии 4. (выход 89%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 6,78-6,65 (м, 3H), 3,76-3,60 (м, 3H), 1,49 (д, J=15,1 Гц, 6H)
Стадия 6: Метил 2-(2-аминобензо[ d ]оксазол-6-ил)-2-метилпропаноат
Метил 2-(4-амино-3-гидроксифенил)-2-метилпропаноат (0,167 г, 0,798 ммоль), полученный на стадии 5, и бромциан (0,423 г, 3,99 ммоль) растворяли в 5,7 мл метанола и 5,7 мл воды и перемешивали при комнатной температуре в течение 6 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Следующую реакцию проводили без дополнительной очистки.
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,29-7,26 (м, 1H), 7,25 (д, J=2,7 Гц, 1H), 7,16 (дд, J=8,7, 1,8 Гц, 1H), 5,44 (с, 1H), 3,66-3,61 (м, 3H), 1,64-1,55 (м, 6H)
Пример получения 19: Метил 2-(6-аминопиридин-3-ил)-2-метилпропаноат
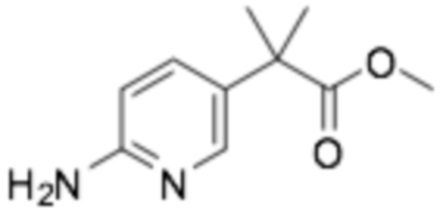
Стадия 1: Метил 2-(6-хлорпиридин-3-ил)ацетат
При 0°C ацетилхлорид добавляли по каплям к 48,6 мл метанола, с последующим перемешиванием в течение 15 минут. После добавления 2-(6-хлорпиридин-3-ил)уксусной кислоты (2,50 г, 14,6 ммоль), смесь перемешивали при 100°C в течение 5 часов, и органический растворитель удаляли при пониженном давлении. Ее разбавляли этилацетатом, промывали соляным раствором, и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении, получая требуемый продукт. (выход 96%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,29 (д, J=2,3 Гц, 1H), 7,62 (дд, J=8,2, 2,7 Гц, 1H), 7,31 (д, J=7,8 Гц, 1H), 3,72 (с, 3H), 3,62 (с, 2H)
Стадия 2: Метил 2-(6-хлорпиридин-3-ил)-2-метилпропаноат
DMF, в котором растворяли гидрид натрия (60%, 0,948 г, 23,7 ммоль), понижали до 0°C, и добавляли метил 2-(6-хлорпиридин-3-ил)ацетат, полученный на стадии 1. После перемешивания в течение 15 минут при 0°C к нему добавляли по каплям йодметан (2,70 мл, 43,1 ммоль). После перемешивания в течение дополнительных 5 минут при 0°C, смесь перемешивали при комнатной температуре в течение 15 часов. После промывки этилацетатом, ее промывали 1 N раствором хлористоводородной кислоты, и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан). (выход 59%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,38 (д, J=2,7 Гц, 1H), 7,63 (дд, J=8,2, 2,7 Гц, 1H), 7,29 (д, J=8,2 Гц, 1H), 3,67 (с, 3H), 1,61 (с, 6H)
Стадия 3: Метил 2-(6-(( трет- бутоксикарбонил)амино)пиридин-3-ил)-2-метилпропаноат
После растворения метил 2-(6-хлорпиридин-3-ил)-2-метилпропаноата (0,47 г, 2,2 ммоль), полученного на стадии 2, трет-бутилкарбамата (0,77 г, 6,6 ммоль), карбоната цезия (1,08 г, 3,30 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантина (255 мг, 0,440 ммоль) и трис(дибензилиденацетон)дипалладия (0) (201 мг, 0,220 ммоль) в 11,0 мл 1,4-диоксана, растворенный кислород удаляли барботированием азота при перемешивании, и приток наружного воздуха перекрывали в герметичном контейнере. Реакцию перемешивали при 140°C в течение 15 часов и затем охлаждали до комнатной температуры. После фильтрования через слой целита и удаления органического растворителя при пониженном давлении, ее растворяли в этилацетате и промывали соляным раствором. Органический растворитель сушили над сульфатом магния и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан). (выход 26%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,22 (д, J=2,3 Гц, 1H), 7,95-7,79 (1H), 7,63 (дд, J=8,9, 2,5 Гц, 1H), 7,47-7,36 (1H), 3,65 (с, 3H), 1,66-1,58 (6H), 1,52 (с, 9H)
Стадия 4: Метил 2-(6-аминопиридин-3-ил)-2-метилпропаноат
После растворения метил 2-(6-((трет-бутоксикарбонил)амино)пиридин-3-ил)-2-метилпропаноата (169 мг, 0,574 ммоль), полученного на стадии 3, в 3,00 мл DCM, добавляли по каплям 4 N раствор хлористоводородной кислоты в диоксане. После перемешивания при комнатной температуре в течение ночи, органический растворитель удаляли при пониженном давлении, нейтрализовали, экстрагировали этилацетатом и очищали колонкой с силикагелем (DCM : метанол), получая требуемый продукт. (выход 71%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,81-7,62 (м, 2H), 7,43 (с, 2H), 7,18 (д, J=9,1 Гц, 1H), 3,68 (с, 3H), 1,55 (с, 6H)
Пример получения 20: Этил 2-(2-аминопиримидин-4-ил)-2-метилпропаноат
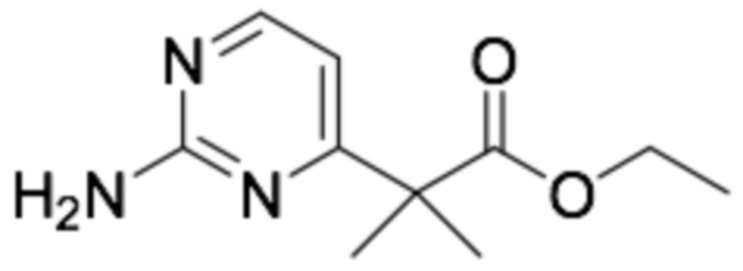
Стадия 1: Диэтил 2-(2-хлорпиримидин-4-ил)малонат
Гидрид натрия (60%, 7,89 г, 197 ммоль) добавляли к 300 мл THF, в котором растворяли диэтилмалонат (15,8 г, 99,0 ммоль) при 0°C. После перемешивания при той же температуре в течение 30 минут добавляли 2,4-дихлорпиримидин (9,80 г, 65,8 ммоль), с последующим перемешивании при кипячении с обратным холодильником при 90°C в течение 3 часов. Реакцию прекращали добавлением к реакционному раствору насыщенного водного раствора хлорида аммония, с последующей экстракцией этилацетатом. Органический растворитель сушили над сульфатом магния и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан). (выход 96%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,66 (д, J=5,0 Гц, 1H), 7,56 (д, J=5,0 Гц, 1H), 4,85 (с, 1H), 4,37-4,17 (м, 4H), 1,29 (кв, J=7,0 Гц, 6H)
Стадия 2: Этил 2-(2-хлорпиримидин-4-ил)ацетат
Диэтил 2-(2-хлорпиримидин-4-ил)малонат (17,3 г, 63,4 ммоль), полученный на стадии 1, и эторксид натрия (20%, 6,48 г, 19,0 ммоль) растворяли в 150 мл этанол и перемешивали при кипячении с обратныцм холодильником в течение 3 часов. pH доводили до pH 7 1 N водной хлористоводородной кислотой, экстрагировали этилацетатом, сушили над сульфатом магния и очищали колонкой с силикагелем (этилацетат : гексан), получая требуемый продукт. (выход 68%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,59 (д, J=5,0 Гц, 1H), 7,34 (д, J=5,0 Гц, 1H), 4,31-4,12 (2H), 3,83 (с, 2H), 1,38-1,19 (м, 3H)
Стадия 3: Этил 2-(2-аминопиримидин-4-ил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 2, стадия 3, стадия 4), применяя этил 2-(2-хлорпиримидин-4-ил)ацетат (5,70 г, 28,4 ммоль), полученный на стадии 2. (выход на 3 стадии 36%)
m/z (M+H)+ рассчитанная для C10H16N3O2: 210, найденная 210
Пример получения 21: Метил 3-(2-аминобензо[d]оксазол-5-ил)-2,2-диметилпропаноат
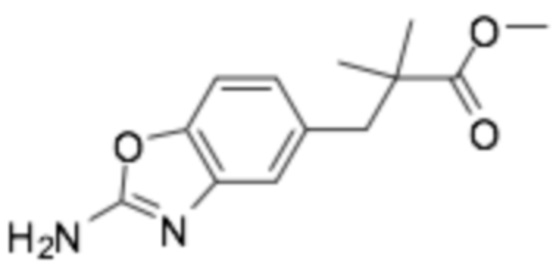
Стадия 1: Метил 3-(4-гидроксифенил)-2,2-диметилпропаноат
Бромид индия (III) (0,41 г, 1,16 ммоль) и диметилкетентриметилсилилметилацеталь (6,08 г, 34,9 ммоль) растворяли в дихлорметане, и затем медленно добавляли 1-(бензилокси)-4-(бромметил)бензол (6,44 г, 23,2 ммоль). После перемешивания при комнатной температуре в течение 2 часов, реакционный раствор выливали в насыщенный водный раствор бикарбоната натрия. После экстракции смеси этилацетатом, органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:3). (выход 60%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 6,96 (д, J=8,7 Гц, 2H), 6,75-6,68 (2H), 4,86-4,71 (1H), 3,65 (с, 3H), 2,78 (с, 2H), 1,20-1,13 (м, 6H)
Стадия 2: Метил 3-(4-гидрокси-3-нитрофенил)-2,2-диметилпропаноат
Метил 3-(4-гидроксифенил)-2,2-диметилпропаноат (2,9 г, 13,9 ммоль), полученный на стадии 1, растворяли в уксусной кислоте, понижали до 0°C, и медленно добавляли азотную кислоту (70%, 1,02 мл, 16,01 ммоль), и температура реакции постепенно повышали до комнатной температуры в течение 1 часа, с последующим перемешиванием. После завершения реакции, ее экстрагировали этилацетатом, и органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:3). (выход 56%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 10,47 (с, 1H), 7,85 (д, J=2,3 Гц, 1H), 7,34 (дд, J=8,5, 2,1 Гц, 1H), 7,06 (д, J=8,2 Гц, 1H), 3,68 (т, J=15,1 Гц, 3H), 2,82 (д, J=15,1 Гц, 2H), 1,20 (с, 6H)
Стадия 3: Метил 3-(3-амино-4-гидроксифенил)-2,2-диметилпропаноат
Метил 3-(4-гидрокси-3-нитрофенил)-2,2-диметилпропаноат (1,97 г, 7,78 ммоль), полученный на стадии 2, растворяли в метаноле, добавляли Pd/C (207 мг, 0,19 ммоль), и затем присоединяли баллон с водородом и перемешивали при комнатной температуре в течение 4 часов. После завершения реакции, требуемое соединение получали на целитовом фильтре. (выход 98%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 6,84 (с, 1H), 6,72 (д, J=8,2 Гц, 1H), 6,62-6,54 (1H), 5,44 (с, 2H), 3,62 (с, 3H), 2,65 (с, 2H), 1,12 (д, J=7,8 Гц, 6H)
Стадия 4: Метил 3-(2-аминобензо[ d ]оксазол-5-ил)-2,2-диметилпропаноат
Метил 3-(3-амино-4-гидроксифенил)-2,2-диметилпропаноат (1,7 г, 7,61 ммоль), полученный на стадии 3, растворяли в метаноле, понижали до 5°C, и медленно добавляли бромциан (3,1 мл, 9,14 ммоль), растворенный в 10 мл воды при интенсивном перемешивании. После перемешивания при комнатной температуре в течение 2 часов, добавляли бикарбонат натрия (640 мг, 7,61 ммоль) в течение 1 часа для доведения pH реакционного раствора от 6,5 до 7,0, с последующим перемешиванием при комнатной температуре в течение дополнительного 1 часа. Полученный твердый остаток фильтровали, промывали холодной водой, и перекристаллизовывали из этанола, получая требуемое соединение. (выход 65%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,15 (д, J=8,2 Гц, 1H), 7,09 (д, J=0,9 Гц, 1H), 6,81 (с, 1H), 5,39 (с, 2H), 3,66 (с, 3H), 2,90 (с, 2H), 1,17 (д, J=13,3 Гц, 6H)
Пример получения 22: Метил (E)-3-(2-аминобензо[d]оксазол-5-ил)акрилат
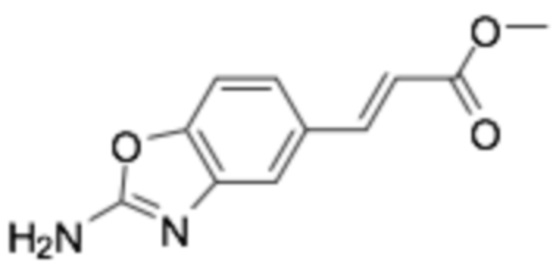
Стадия 1: Метил ( E )-3-(4-гидрокси-3-нитрофенил)акрилат
Гидрид натрия (2,154 г, 90 ммоль), растворенный в 6 мл DMF, в присутствии азота и метил-2-(диэтоксифосфорил)ацетат (11,32 г, 53,9 ммоль), растворенный в THF, медленно добавляли по каплям, и затем перемешивали в течение 15 минут при 0°C. Затем, добавляли 4-гидрокси-3-нитробензальдегид (3 г, 17,95 ммоль) и перемешивали при комнатной температуре в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), его промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния и удаляли при пониженном давлении. Следующую реакцию проводили без дополнительной очистки.
Стадия 2: Метил ( E )-3-(3-амино-4-гидроксифенил)акрилат
Метил (E)-3-(4-гидрокси-3-нитрофенил)акрилат (4 г, 17,92 ммоль), полученный на стадии 1, железо (3,5 г, 62,7 ммоль) и 3,08 мл уксусной кислоты растворяли в 60 мл этанола и перемешивали при 75°C в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×30 мл), его промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 20%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,59-7,42 (м, 1H), 7,07-6,88 (м, 1H), 6,88-6,74 (м, 1H), 6,73-6,58 (м, 1H), 6,29-6,10 (м, 1H), 3,82-3,63 (м, 3H), 3,35-3,21 (м, 2H)
Стадия 3: Метил ( E )-3-(2-аминобензо[ d ]оксазол-5-ил)акрилат
Требуемый продукт получали способом, аналогичным стадии 6 примера получения 18, применяя метил (E)-3-(3-амино-4-гидроксифенил)акрилат (0,7 г, 3,62 ммоль), полученный на стадии 2. (выход 67%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,82-7,58 (м, 1H), 7,55-7,38 (м, 1H), 7,36-7,19 (м, 2H), 6,53-6,35 (м, 1H), 3,86-3,62 (3H)
Пример получения 23: Метил 3-(2-аминобензо[d]оксазол-5-ил)пропаноат
Стадия 1: Метил 3-(3-амино-4-гидроксифенил)пропаноат
Требуемый продукт получали способом, аналогичным стадии 3 примера получения 94, применяя метил (E)-3-(4-гидрокси-3-нитрофенил)акрилат (5,34 г, 23,93 ммоль), полученный на стадии 1 примера получения 22. Следующую реакцию проводили без дополнительной очистки.
Стадия 2: Метил 3-(2-аминобензо[ d ]оксазол-5-ил)пропаноат
Требуемый продукт получали способом, аналогичным стадии 6 примера получения 18, применяя метил 3-(3-амино-4-гидроксифенил)пропаноат (4,67 г, 23,92 ммоль), полученный на стадии 1. (выход 40%)
m/z (M+H)+ рассчитанная для C11H13N2O3: 221, найденная 221
Пример получения 24: Метил 3-(2-аминобензо[d]оксазол-6-ил)пропаноат
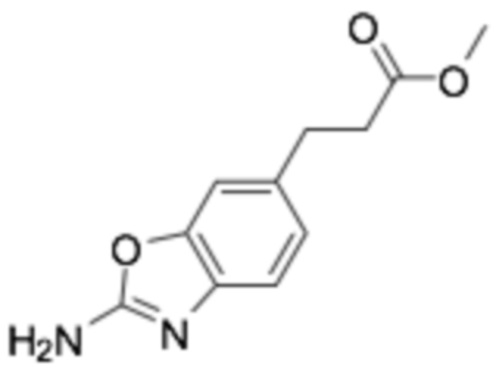
Стадия 1: Метил 3-(4-амино-3-гидроксифенил)пропаноат
Требуемый продукт получали способом, аналогичным примеру получения 22 (стадия 1) и примеру получения 94 (стадия 3), применяя 3-гидрокси-4-нитробензальдегид (1,8 г, 10,77 ммоль). (выход на 2 стадии 36%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 6,74-6,57 (м, 1H), 6,57-6,50 (м, 1H), 6,50-6,35 (м, 1H), 3,65-3,49 (м, 3H), 2,82-2,59 (м, 2H), 2,59-2,39 (2H)
Стадия 2: Метил 3-(2-аминобензо[ d ]оксазол-6-ил)пропаноат
Требуемый продукт получали способом, аналогичным примеру получения 18 (стадия 6), применяя метил 3-(4-амино-3-гидроксифенил)пропаноат (0,75 г, 3,87 ммоль), полученный на стадии 1. (выход 51,7%)
m/z (M+H)+ рассчитанная для C11H13N2O3: 221, найденная 221
Пример получения 25: 4-фенилоксазол-2-амин
2-Бром-1-фенилэтан-1-он (0,100 г, 0,502 ммоль) растворяли в ацетонитриле (5,02 мл), перемешивали при комнатной температуре, и добавляли мочевину (0,302 г, 5,02 ммоль). После перемешивания при 80°C в течение 16 часов, растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 19,8%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,74-7,55 (м, 2H), 7,55-7,44 (м, 1H), 7,44-7,34 (м, 2H), 7,30 (т, J=7,5 Гц, 1H), 5,15 (д, J=42,1 Гц, 2H)
Пример получения 26: Метил 2-(4-(2-аминопиридин-4-ил)фенил)-2-метилпропаноат
Стадия 1: Метил 2-метил-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксофоролеин-2-ил)фенил)пропаноат
Метил 2-(4-бромфенил)-2-метилпропаноат (1 г, 3,89 ммоль) и бис(пинаколато)дибор (1,481 г, 5,83 ммоль) растворяли в толуоле (19,45 мл), добавляли дихлорметановый комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (0,159 г, 0,194 ммоль) и ацетат калия (1,527 г, 15,56 ммоль). Смесь перемешивали при кипячении с обратным холодильником в течение 16 часов при 110°C. Ее фильтровали через слой целита, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 72%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,76 (д, J=8,2 Гц, 2H), 7,32 (д, J=8,2 Гц, 2H), 3,62 (с, 3H), 1,55 (д, J=13,7 Гц, 7H), 1,32 (с, 12H)
Стадия 2: Метил 2-(4-(2-аминопиридин-4-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 11, применяя метил 2-метил-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксофоролеин-2-ил)фенил)пропаноат (0,851 г, 2,80 ммоль), полученный на стадии 1, и 4-бромпиридин-2-амин (0,484 г, 2,80 ммоль). (выход 100%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,10 (д, J=5,5 Гц, 1H), 7,54 (д, J=8,2 Гц, 2H), 7,44-7,38 (м, 2H), 6,86 (дд, J=5,5, 1,4 Гц, 1H), 6,68 (с, 2H), 4,46 (с, 1H), 3,67 (с, 3H), 1,60 (с, 6H)
Пример получения 27: Метил 2-(3-(2-аминопиридин-4-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 26, применяя метил 2-(3-бромфенил)-2-метилпропаноат (1 г, 3,89 ммоль). (выход на 2 стадии 90%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,15 (д, J=5,5 Гц, 1H), 7,55 (с, 1H), 7,50-7,39 (м, 3H), 6,89 (дд, J=5,2, 1,5 Гц, 1H), 6,71 (с, 1H), 4,51 (с, 2H), 3,70 (с, 3H), 1,65 (с, 6H)
Пример получения 28: Этил 1-(2-аминопиримидин-4-ил)пиперидин-4-карбоксилат
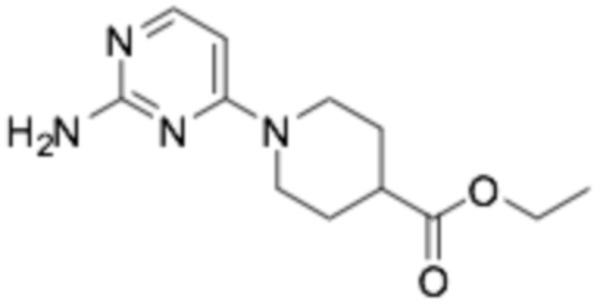
Стадия 1: Этил 1-(2-хлорпиримидин-4-ил)пиперидин-4-карбоксилат
2,4-Дихлорпиримидин (0,1 г, 0,671 ммоль) растворяли в этаноле (6,71 мл), и добавляли этилпиперидин-4-карбоксилат (0,124 мл, 0,806 ммоль) и TEA (0,187 мл, 1,343 ммоль). Ее перемешивали при 85°C в течение 3 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 80%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,05 (д, J=6,4 Гц, 1H), 6,42 (д, J=6,1 Гц, 1H), 4,27 (с, 2H), 4,22-4,16 (2H), 3,22-3,06 (2H), 2,63 (тт, J=10,6, 4,1 Гц, 1H), 2,06-1,96 (м, 2H), 1,86-1,67 (2H), 1,29 (тд, J=7,2, 4,5 Гц, 3H)
Стадия 2: Этил 1-(2-(( трет- бутоксикарбонил)амино)пиримидин-4-ил)пиперидин-4-карбоксилат
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 2, применяя этил 1-(2-хлорпиримидин-4-ил)пиперидин-4-карбоксилат (1,43 г, 5,30 ммоль), полученный на стадии 1 и трет-бутилкарбамат (0,683 г, 5,83 ммоль). (выход 37%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,88 (д, J=6,1 Гц, 1H), 6,04-5,92 (1H), 4,76-4,70 (1H), 4,26 (д, J=13,1 Гц, 2H), 4,22-4,09 (м, 2H), 3,09-2,93 (м, 2H), 2,66-2,50 (м, 1H), 1,98 (дд, J=13,6, 3,8 Гц, 2H), 1,82-1,68 (2H), 1,64 (с, 9H), 1,31-1,22 (м, 3H)
Стадия 3: Этил 1-(2-аминопиримидин-4-ил)пиперидин-4-карбоксилат
Этил 1-(2-((трет-бутоксикарбонил)амино)пиримидин-4-ил)пиперидин-4-карбоксилат (0,480 г, 1,370 ммоль), полученный на стадии 2, растворяли в DCM (12,3 мл), и затем добавляли трифторуксусную кислоту (1,37 мл), растворенную в DCM, и перемешивали при комнатной температуре в течение 2 часов. После удаления растворителя при пониженном давлении, ее растворяли в DCM и промывали водой. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 100%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 10,02-9,49 (1H), 7,56 (д, J=7,3 Гц, 1H), 6,10 (д, J=7,6 Гц, 1H), 4,90-4,54 (1H), 4,20 (кв, J=7,1 Гц, 2H), 4,00-3,77 (1H), 3,28 (д, J=16,5 Гц, 2H), 2,74-2,62 (м, 1H), 2,07 (д, J=12,5 Гц, 2H), 1,91-1,69 (2H), 1,30 (т, J=7,2 Гц, 3H)
Пример получения 29: Этил 1-(6-аминопиридин-2-ил)пиперидин-4-карбоксилат
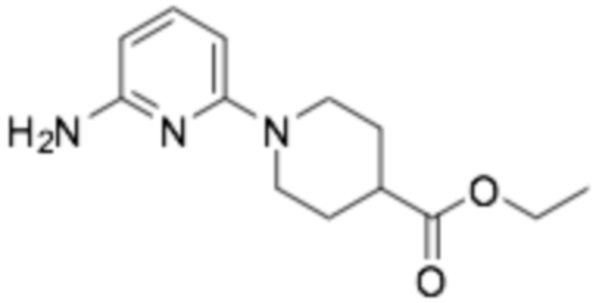
Стадия 1: Этил 1-(6-хлорпиридин-2-ил)пиперидин-4-карбоксилат
2,6-дихлорпиридин (0,565 г, 3,82 ммоль) растворяли в этаноле (6,71 мл) и добавляли этилпиперидин-4-карбоксилат (0,500 г, 3,18 ммоль) и DIPEA (1,11 мл, 6,36 ммоль). Ее перемешивали при 100°C в течение 16 часов. После прекращения реакции добавлением воды, ее растворяли в диэтиловом эфире и промывали водой. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 53%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,40 (т, J=7,8 Гц, 1H), 6,59 (д, J=7,6 Гц, 1H), 6,52 (д, J=8,2 Гц, 1H), 4,38-4,04 (м, 4H), 3,13-2,91 (м, 2H), 2,55 (тт, J=11,0, 3,9 Гц, 1H), 2,01 (дд, J=13,4, 3,4 Гц, 2H), 1,88-1,68 (м, 2H), 1,29 (т, J=7,2 Гц, 3H)
Стадия 2: Этил 1-(6-аминопиридин-2-ил)пиперидин-4-карбоксилат
Требуемый продукт получали способом, аналогичным примеру получения 28 (стадия 2, стадия 3), применяя этил 1-(6-хлорпиридин-2-ил)пиперидин-4-карбоксилат, полученный на стадии 1. (выход на 2 стадии 36%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,49 (т, J=8,2 Гц, 1H), 5,95 (дд, J=8,4, 5,0 Гц, 2H), 4,19 (кв, J=7,0 Гц, 2H), 3,94 (д, J=13,7 Гц, 2H), 3,22 (т, J=10,8 Гц, 2H), 2,69-2,54 (м, 1H), 2,08 (дд, J=13,9, 3,5 Гц, 2H), 1,98-1,79 (м, 2H), 1,29 (т, J=7,0 Гц, 3H)
Пример получения 30: Этил (R)-1-(2-аминопиримидин-4-ил)пиперидин-3-карбоксилат
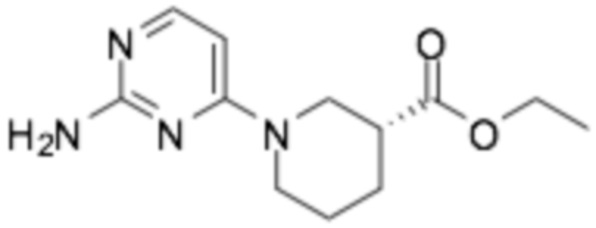
Требуемый продукт получали способом, аналогичным примеру получения 28, применяя этил (R)-пиперидин-3-карбоксилат (0,621 мл, 4,03 ммоль). (выход на 3 стадии 6%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,68 (д, J=6,7 Гц, 1H), 6,49-6,21 (1H), 6,07 (д, J=6,7 Гц, 1H), 4,31 (д, J=13,1 Гц, 1H), 4,16 (кв, J=7,1 Гц, 2H), 4,01 (д, J=13,1 Гц, 1H), 3,43-3,30 (1H), 3,30-3,16 (1H), 2,63-2,47 (м, 1H), 2,19-2,03 (м, 1H), 1,91-1,76 (м, 2H), 1,65-1,46 (м, 1H), 1,26 (т, J=7,0 Гц, 3H)
Пример получения 31: Этил (R)-1-(6-аминопиридин-2-ил)пиперидин-3-карбоксилат
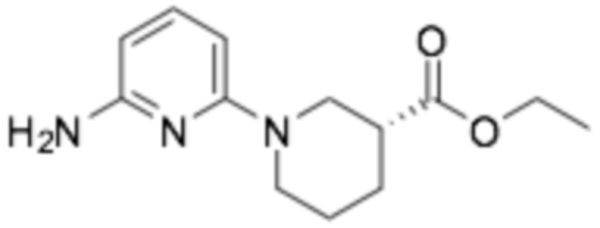
Требуемый продукт получали способом, аналогичным примеру получения 29, применяя этил (R)-пиперидин-3-карбоксилат (0,500 г, 3,18 ммоль). (выход на 3 стадии 37%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,49 (т, J=8,2 Гц, 1H), 5,95 (дд, J=8,4, 5,0 Гц, 2H), 4,19 (кв, J=7,0 Гц, 2H), 3,94 (д, J=13,7 Гц, 2H), 3,22 (т, J=10,8 Гц, 2H), 2,69-2,54 (м, 1H), 2,08 (дд, J=13,9, 3,5 Гц, 2H), 1,98-1,79 (м, 2H), 1,29 (т, J=7,0 Гц, 3H)
Пример получения 32: Этил 2-(1-(2-аминопиримидин-4-ил)пиперидин-4-ил)ацетат
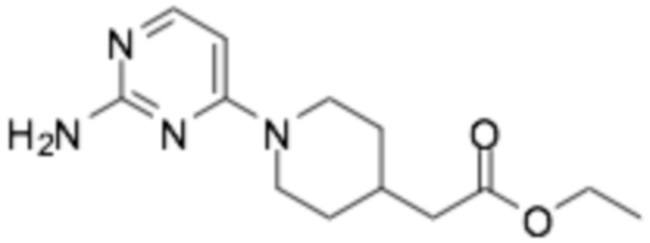
Стадия 1: Этил 2-(1-(2-хлорпиримидин-4-ил)пиперидин-4-ил)ацетат
Требуемый продукт получали способом, аналогичным стадии 4 примера получения 36, применяя этил 2-(пиперидин-4-ил)ацетат (0,315 г, 1,84 ммоль), полученный на стадии 3, 2,6-дихлорпиримидин (2,023 ммоль) и 0,77 мл триэтиламина. (выход 86%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,90-7,72 (м, 1H), 6,34-6,17 (м, 1H), 4,65-4,02 (м, 2H), 3,98 (кв, J=7,2 Гц, 2H), 2,94-2,62 (м, 2H), 2,21-2,04 (м, 2H), 2,04-1,81 (м, 1H), 1,81-1,55 (м, 2H), 1,23-0,93 (м, 5H)
Стадия 2: Этил 2-(1-(2-аминопиримидин-4-ил)пиперидин-4-ил)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя этил 2-(1-(2-хлорпиримидин-4-ил)пиперидин-4-ил)ацетат (0,45 г, 1,586 ммоль), полученный на стадии 1. (выход на 2 стадии 61%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,92-7,74 (м, 1H), 5,93 (д, J=6,4 Гц, 1H), 4,88-4,57 (2H), 4,32 (д, J=13,3 Гц, 2H), 4,13 (кв, J=7,2 Гц, 2H), 3,00-2,71 (м, 2H), 2,41-2,11 (м, 2H), 2,06 (квт, J=11,2, 3,8 Гц, 1H), 1,87-1,63 (м, 2H), 1,37-1,04 (м, 5H)
Пример получения 33: Метил 2-(1-(2-аминопиримидин-4-ил)пиперидин-4-ил)-2-метилпропаноат
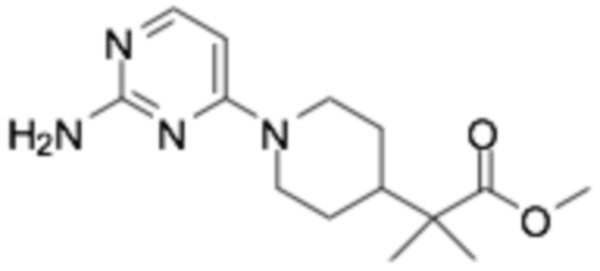
Стадия 1: Метил 2-(1-(2-хлорпиримидин-4-ил)пиперидин-4-ил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным стадии 4 примера получения 36, применяя метил 2-метил-2-(пиперидин-4-ил)пропаноат (0,26 г, 1,403 ммоль), полученный на стадии 4 примера получения 34, и 2,4-дихлорпиримидин (0,23 г, 1,544 ммоль). (выход 81%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,13-7,81 (м, 1H), 6,44-6,26 (м, 1H), 4,41 (с, 1H), 3,72-3,52 (м, 3H), 2,82 (д, J=9,1 Гц, 2H), 2,32-1,74 (м, 2H), 1,63 (д, J=8,7 Гц, 2H), 1,43-1,16 (м, 2H), 1,16-0,91 (м, 6H)
Стадия 2: Метил 2-(1-(2-аминопиримидин-4-ил)пиперидин-4-ил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3 и стадия 4), применяя метил 2-(1-(2-хлорпиримидин-4-ил)пиперидин-4-ил)-2-метилпропаноат (0,344 г, 1,155 ммоль), полученный на стадии 1. (выход на 2 стадии 59%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,92-7,67 (м, 1H), 5,96-5,77 (м, 1H), 4,83 (д, J=43,0 Гц, 2H), 4,50-4,27 (м, 2H), 3,72-3,58 (м, 3H), 2,81-2,59 (м, 2H), 1,93-1,70 (м, 1H), 1,68-1,42 (м, 2H), 1,31-1,15 (м, 2H), 1,15-0,96 (м, 6H)
Пример получения 34: Метил 2-(1-(6-аминопиридин-2-ил)пиперидин-4-ил)-2-метилпропаноат
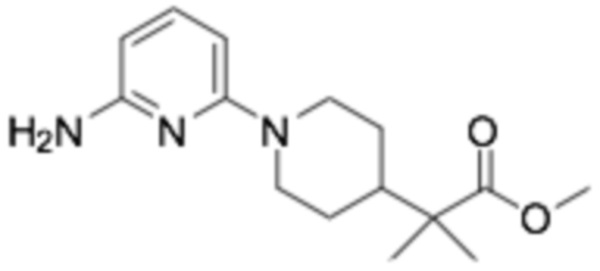
Стадия 1: трет- бутил 4-(2-метокси-2-оксоэтилидин)пиперидин-1-карбоксилат
Метил 2-(трифенил-λ5-фосфанилиден)ацетат (15,6 г, 46,7 ммоль) и трет-бутил 4-оксопиперидин-1-карбоксилат (5 г, 25,09 ммоль) растворяли в 50 мл толуола и перемешивали при комнатной температуре в течение 4 часов. А после подтверждения того, что исходное соединение исчезло по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×30 мл), смесь промывали соляным раствором (20 мл), органический растворитель сушили над сульфатом магния, и затем органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 94%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 5,70 (с, 1H), 3,74-3,63 (3H), 3,56-3,38 (м, 4H), 2,92 (т, J=5,7 Гц, 2H), 2,36-2,20 (м, 2H), 1,51-1,37 (м, 9H)
Стадия 2: трет- бутил 4-(2-метокси-2-оксоэтил)пиперидин-1-карбоксилат
Требуемый продукт получали способом, аналогичным стадии 3 примера получения 94, применяя трет-бутил 4-(2-метокси-2-оксоэтилидин)пиперидин-1-карбоксилат (1 г, 3,92 ммоль), полученный на стадии 1. (выход 99%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 4,20-3,96 (м, 2H), 3,75-3,64 (м, 3H), 2,73 (т, J=11,1 Гц, 2H), 2,30-2,21 (2H), 2,00-1,89 (м, 1H), 1,70 (д, J=13,1 Гц, 2H), 1,51-1,41 (м, 9H), 1,17 (квд, J=12,3, 4,2 Гц, 2H)
Стадия 3: трет- бутил 4-(1-метокси-2-метил-1-оксопропан-2-ил)пиперидин-1-карбоксилат
1,67 мл диизопропиламина, растворенного в 7,5 мл THF, в присутствии азота, и 4,66 мл н-бутиллития медленно добавляли по каплям при 0°C, с последующим перемешиванием в течение 30 минут. Затем, трет-бутил 4-(2-метокси-2-оксоэтил)пиперидин-1-карбоксилат (1 г, 3,89 ммоль), полученный на стадии 2, растворенный в 5 мл THF, в присутствии азота, медленно добавляли по каплям и перемешивали в течение 30 минут. После этого, добавляли 1,22 мл метилйодид и перемешивали при -78°C в течение 1 часа. Это повторяли еще раз, и после перемешивания при комнатной температуре в течение 4 часов, подтверждали, что реакция завершилась по ТСХ. Реакцию прекращали хлоридом аммония, экстрагировали этилацетатом (2×20 мл), промывали соляным раствором (10 мл), и органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 68%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 4,14 (кв, J=7,1 Гц, 2H), 3,70 (кв, J=4,1 Гц, 3H), 2,66 (д, J=12,5 Гц, 2H), 1,77-1,67 (м, 1H), 1,66-1,59 (м, 2H), 1,47 (с, 9H), 1,31-1,18 (м, 2H), 1,18-1,08 (м, 6H)
Стадия 4: Метил 2-метил-2-(пиперидин-4-ил)пропаноат
Требуемый продукт получали способом, аналогичным стадии 3 примера получения 36, применяя трет-бутил 4-(1-метокси-2-метил-1-оксопропан-2-ил)пиперидин-1-карбоксилат (0,35 г, 1,226 ммоль), полученный на стадии 3. (выход 99%)
m/z (M+H)+ рассчитанная для C10H20NO2: 186, найденная 186
Стадия 5: Метил 2-(1-(6-хлорпиридин-2-ил)пиперидин-4-ил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным стадии 4 примера получения 36, применяя метил 2-метил-2-(пиперидин-4-ил)пропаноат (0,227 г, 1,225 ммоль), полученный на стадии 4. (выход 42%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,48-7,29 (м, 1H), 6,60-6,48 (1H), 6,48-6,37 (1H), 4,44-4,23 (м, 2H), 3,73-3,54 (м, 3H), 2,83-2,62 (м, 2H), 1,90-1,71 (м, 1H), 1,71-1,47 (м, 2H), 1,47-1,19 (м, 2H), 1,19-1,05 (м, 6H)
Стадия 6: Метил 2-(1-(6-аминопиридин-2-ил)пиперидин-4-ил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3 и стадия 4), применяя метил 2-(1-(6-хлорпиридин-2-ил)пиперидин-4-ил)-2-метилпропаноат (0,16 г, 0,539 ммоль), полученный на стадии 5. (выход на 2 стадии 43%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,30-7,17 (м, 1H), 6,07-5,91 (м, 1H), 5,91-5,73 (м, 1H), 4,29 (д, J=12,8 Гц, 2H), 4,12 (д, J=18,8 Гц, 2H), 3,66 (дд, J=15,8, 14,9 Гц, 3H), 2,75-2,50 (2H), 1,85-1,70 (м, 1H), 1,61-1,43 (м, 2H), 1,43-1,26 (м, 2H), 1,18-1,04 (м, 6H)
Пример получения 35: Этил 2-(4-(2-аминопиримидин-4-ил)пиперазин-1-ил)ацетат
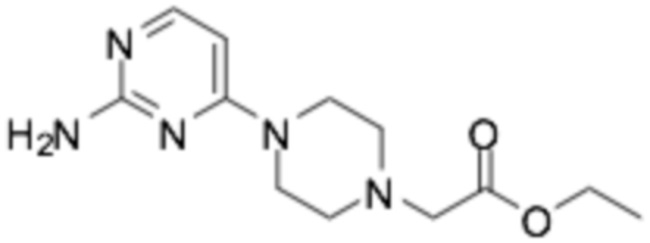
Стадия 1: трет- бутил 4-(2-хлорпиримидин-4-ил)пиперазин-1-карбоксилат
2,4-дихлорпиримидин (0,200 г, 1,343 ммоль) растворяли в DCM (6,71 мл) и затем добавляли трет-бутил пиперазин-1-карбоксилат (0,300 г, 1,611 ммоль) и DIPEA (0,586 мл, 3,36 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 83%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,06 (д, J=5,9 Гц, 1H), 6,38 (д, J=5,9 Гц, 1H), 3,71-3,59 (3H), 3,57-3,45 (м, 4H), 1,52-1,43 (9H)
Стадия 2: гидрохлорид 2-хлор-4-(пиперазин-1-ил)пиримидина
Требуемый продукт получали способом, аналогичным стадии 3 примера получения 28, применяя трет-бутил 4-(2-хлорпиримидин-4-ил)пиперазин-1-карбоксилат (0,332 г, 1,11 ммоль), полученный на стадии 1. (выход 100%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,25 (д, J=6,9 Гц, 1H), 7,13 (дд, J=7,1, 1,1 Гц, 1H), 4,15 (т, J=4,8 Гц, 4H), 3,40 (т, J=5,3 Гц, 4H)
Стадия 3: Этил 2-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)ацетат
Гидрохлорид 2-хлор-4-(пиперазин-1-ил)пиримидина (0,095 г, 0,404 ммоль), полученный на стадии 2, растворяли в ацетонитриле (4 мл), с последующим добавлением этил 2-бромацетата (0,067 мл, 0,606 ммоль) и карбоната калия (0,168 г, 1,212 ммоль). Ее перемешивали при 60°C в течение 16 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 33%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,04 (д, J=6,1 Гц, 1H), 6,39 (д, J=6,1 Гц, 1H), 4,20 (кв, J=7,1 Гц, 2H), 3,72 (с, 4H), 3,27 (с, 2H), 2,67 (т, J=5,0 Гц, 4H), 1,28 (т, J=7,0 Гц, 3H)
Стадия 4: этил 2-(4-(2-аминопиримидин-4-ил)пиперазин-1-ил)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 2, применяя этил 2-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)ацетат (0,038 г, 133 ммоль), полученный на стадии 3. (выход на 2 стадии 33%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,84 (д, J=5,9 Гц, 1H), 5,91 (д, J=5,9 Гц, 1H), 4,73 (с, 2H), 4,18 (кв, J=7,2 Гц, 2H), 3,62 (т, J=4,8 Гц, 4H), 3,24 (д, J=7,8 Гц, 2H), 2,60 (т, J=5,0 Гц, 4H), 1,31-1,23 (м, 3H)
Пример получения 36: Этил 2-(1-(6-аминопиридин-2-ил)пиперидин-4-ил)ацетат
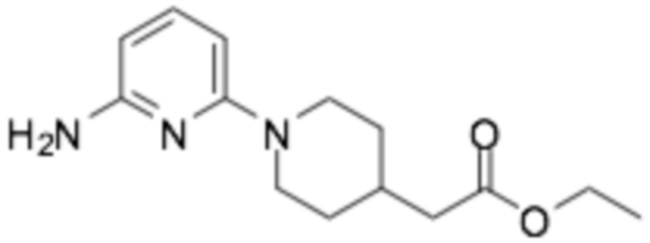
Стадия 1: трет- бутил 4-(2-этокси-2-оксоэтилидин)пиперидин-1-карбоксилат
Этил 2-(диэтоксифосфорил)ацетат (6,75 г, 30,1 ммоль) растворяли в 40 мл THF в присутствии азота, добавляли гидрид натрия (1,204 г, 50,2 ммоль) при 0°C, и трет-бутил 4-оксопиперидин-1-карбоксилат (5 г, 25,09 ммоль) растворяли в 10 мл THF и медленно добавляли по каплям. После перемешивания при комнатной температуре в течение 15 часов, подтверждали, что исходное соединение исчезло по ТСХ. Реакцию прекращали хлоридом аммония, экстрагировали этилацетатом (2×30 мл) и промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 25%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 5,51 (с, 1H), 4,19-4,01 (м, 2H), 3,95-3,78 (м, 2H), 3,56-3,43 (м, 2H), 3,08-2,91 (2H), 2,07 (д, J=38,4 Гц, 2H), 1,55-1,36 (9H), 1,31-1,18 (м, 3H)
Стадия 2: трет- бутил 4-(2-этокси-2-оксоэтил)пиперидин-1-карбоксилат
Требуемый продукт получали способом, аналогичным стадии 3 примера получения 94, применяя трет-бутил 4-(2-этокси-2-оксоэтилидин)пиперидин-1-карбоксилат (0,6 г, 2,228 ммоль), полученный на стадии 1. (выход 99%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 4,26-3,90 (м, 4H), 2,84-2,58 (м, 2H), 2,21 (д, J=7,3 Гц, 2H), 2,01-1,78 (м, 1H), 1,73-1,59 (2H), 1,48-1,39 (м, 9H), 1,32-1,19 (м, 3H), 1,19-1,02 (м, 2H)
Стадия 3: Этил 2-(пиперидин-4-ил)ацетат
Трет-бутил 4-(2-этокси-2-оксоэтил)пиперидин-1-карбоксилат (0,6 г, 2,248 ммоль), полученный на стадии 2, растворяли в 10 мл дихлорметана, добавляли по каплям 2,76 мл 4,0 M раствора хлористоводородной кислоты (1,4-диоксан) и перемешивали при комнатной температуре в течение 15 часов. Реакцию прекращали 1 N водным раствором гидроксида натрия, экстрагировали этилацетатом (2×15 мл) и промывали соляным раствором (10 мл), органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 99%)
m/z (M+H)+ рассчитанная для C9H18NO2: 172, найденная 172
Стадия 4: Этил 2-(1-(6-хлорпиридин-2-ил)пиперидин-4-ил)ацетат
Этил 2-(пиперидин-4-ил)ацетат (0,385 г, 2,247 ммоль), полученный на стадии 3, 2,6-дихлорпиридин (0,399 г, 2,7 ммоль) и 0,982 мл DIPEA растворяли в 8 мл DMF и перемешивали при 100°C в течение 15 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×15 мл), его промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 35%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,38 (т, J=7,9 Гц, 1H), 6,57 (д, J=7,3 Гц, 1H), 6,51 (д, J=8,5 Гц, 1H), 4,38-4,23 (2H), 4,17 (кв, J=7,1 Гц, 2H), 2,88 (тд, J=12,7, 2,3 Гц, 2H), 2,36-2,19 (м, 2H), 2,17-1,98 (м, 1H), 1,88-1,75 (2H), 1,37-1,19 (м, 5H)
Стадия 5: Этил 2-(1-(6-аминопиридин-2-ил)пиперидин-4-ил)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя этил 2-(1-(6-хлорпиридин-2-ил)пиперидин-4-ил)ацетат (0,22 г, 0,778 ммоль), полученный на стадии 4. (выход на 2 стадии 69%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,30 (с, 1H), 6,03 (д, J=8,2 Гц, 1H), 5,86 (д, J=7,9 Гц, 1H), 4,33-4,22 (2H), 4,17 (кв, J=7,2 Гц, 2H), 2,80 (т, J=12,2 Гц, 2H), 2,28 (т, J=7,6 Гц, 2H), 2,02 (тт, J=11,3, 3,8 Гц, 1H), 1,80 (д, J=12,8 Гц, 2H), 1,41-1,21 (м, 5H)
Пример получения 37: Метил (2-аминопиримидин-4-ил)-L-пролинат
Требуемый продукт получали способом, аналогичным примеру получения 28, применяя гидрохлорид метил L-пролината (0,267 г, 1,611 ммоль). (выход на 3 стадии 40%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,88 (д, J=6,1 Гц, 1H), 6,03-5,72 (1H), 4,70 (с, 2H), 4,65-4,41 (1H), 3,88-3,70 (3H), 3,70-3,55 (1H), 3,55-3,30 (1H), 2,52-2,22 (1H), 2,22-2,00 (м, 3H)
Пример получения 38: Метил 1-(6-аминопиридин-2-ил)пирролидин-3-карбоксилат
Требуемый продукт получали способом, аналогичным примеру получения 29, применяя гидрохлорид метилпирролидин-3-карбоксилата (0,500 г, 3,02 ммоль). (выход на 3 стадии 10%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,26 (м, 1H), 5,83 (д, J=7,6 Гц, 1H), 5,77 (д, J=7,9 Гц, 1H), 4,26-4,07 (м, 2H), 3,85-3,70 (м, 4H), 3,70-3,53 (м, 2H), 3,53-3,37 (м, 1H), 3,18 (т, J=7,6 Гц, 1H), 2,37-2,20 (м, 2H)
Пример получения 39: Метил 1-(2-аминопиримидин-4-ил)пирролидин-3-карбоксилат
Требуемый продукт получали способом, аналогичным примеру получения 28, применяя гидрохлорид метилпирролидин-3-карбоксилата (0,667 г, 4,03 ммоль). (выход на 3 стадии 14%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,77 (д, J=6,1 Гц, 1H), 5,69 (д, J=6,1 Гц, 1H), 5,22 (с, 2H), 3,79-3,65 (м, 4H), 3,65-3,46 (м, 2H), 3,40 (с, 1H), 3,13 (т, J=7,0 Гц, 1H), 2,21 (д, J=7,0 Гц, 2H)
Пример получения 40: Этил 1-(2-аминопиримидин-4-ил)-3-метилпиперидин-3-карбоксилат
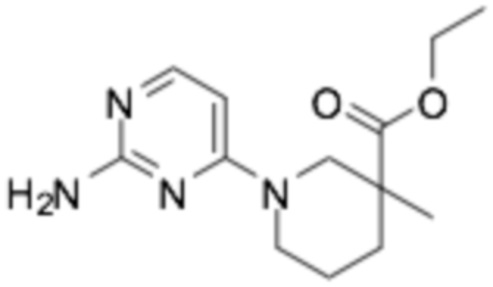
Стадия 1: 1-( трет- бутил) 3-этилпиперидин-1,3-дикарбоксилат
Этил пиперидин-3-карбоксилат (1,0 г, 6,36 ммоль) растворяли в DCM (50 мл), и затем добавляли ди-трет-бутилдикарбоната (1,754 мл, 7,63 ммоль) и TEA (1,733 мл, 12,72 ммоль). Ее перемешивали при комнатной температуре в течение 4 часов. После прекращения реакции добавлением воды, ее растворяли в DCM и промывали водой. Органический растворитель сушили над сульфатом магния и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 70%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 4,16 (кв, J=7,1 Гц, 3H), 3,94 (д, J=12,8 Гц, 1H), 2,93 (с, 1H), 2,87-2,75 (м, 1H), 2,45 (т, J=10,5 Гц, 1H), 2,06 (дд, J=13,1, 4,0 Гц, 1H), 1,72 (дт, J=13,1, 3,7 Гц, 1H), 1,68-1,59 (м, 1H), 1,51-1,45 (м, 10H), 1,32-1,17 (м, 3H)
Стадия 2: 1-( трет- бутил) 3-этил 3-метилпиперидин-1,3-дикарбоксилат
Диизопропиламин (1,277 мл, 8,96 ммоль) растворяли в THF (22,4 мл), и затем н-бутиллитий (3,58 мл, 8,96 ммоль) добавляли при -78°C. Смесь перемешивали при -78°C в течение 10 минут, и перемешивали при комнатной температуре в течение 10 минут, и затем понижали температуру до -78°C. К реакционной смеси растворяли в THF (22,40 мл) и добавляли 1-(трет-бутил) 3-этилпиперидин-1,3-дикарбоксилат (1,153 г, 4,48 ммоль), полученный на стадии 1. После перемешивания при -78°C в течение 1 часа, добавляли йодметан (0,336 мл, 5,37 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После прекращения реакции водным раствором хлорида аммония, ее растворяли в этилацетате и промывали водой. Органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 21%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 4,21-4,03 (м, 2H), 3,82 (д, J=13,3 Гц, 1H), 3,48-3,36 (м, 1H), 3,32-3,18 (м, 1H), 3,17-3,07 (1H), 2,07-1,95 (м, 1H), 1,58 (д, J=7,3 Гц, 1H), 1,56 (с, 1H), 1,52 (дд, J=9,6, 4,1 Гц, 0H), 1,48-1,38 (м, 11H), 1,29-1,20 (м, 3H), 1,14 (с, 3H)
Стадия 3: гидрохлорид этил 3-метилпиперидин-3-карбоксилата
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 1, применяя 1-(трет-бутил) 3-этил 3-метилпиперидин-1,3-дикарбоксилат (0,250 г, 0,921 ммоль), полученный на стадии 2, и применяли сразу в следующей стадии без дополнительной очистки.
m/z (M+H)+ рассчитанная для C9H18NO2: 172, найденная 172
Стадия 4: Этил 1-(2-аминопиримидин-4-ил)-3-метилпиперидин-3-карбоксилат
Требуемый продукт получали способом, аналогичным примеру получения 28, применяя гидрохлорид этил 3-метилпиперидин-3-карбоксилата (0,191 г, 0,921 ммоль), полученный на стадии 3. (выход на 3 стадии 45%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,83 (кв, J=6,2 Гц, 1H), 6,01 (д, J=6,4 Гц, 1H), 4,84 (д, J=17,1 Гц, 2H), 4,31-4,02 (м, 3H), 3,98 (д, J=12,2 Гц, 1H), 3,24-2,93 (м, 2H), 2,18 (дт, J=13,2, 5,0 Гц, 1H), 1,69-1,53 (м, 2H), 1,53-1,41 (м, 1H), 1,20-0,94 (м, 6H)
Пример получения 41: Бензил (S)-2-(1-(2-аминопиримидин-4-ил)пиперидин-3-ил)ацетат
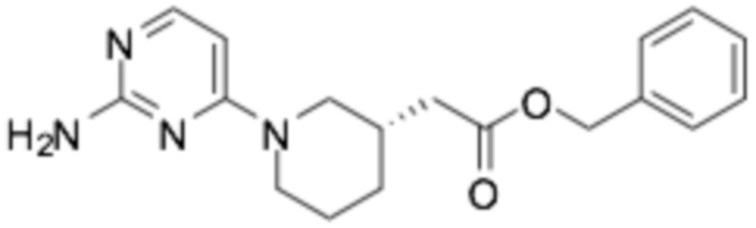
Стадия 1: ( R )-1-(2-хлорпиримидин-4-ил)пиперидин-3-карбоновая кислота
Промежуточное соединение, полученное в примере получения 30, этил (R)-1-(2-хлорпиримидин-4-ил)пиперидин-3-карбоксилат (0,950 г, 3,52 ммоль) добавляли к THF (17,6 мл) и этанолу (17,6 мл), и затем добавляли 6 N водный раствор гидроксида натрия (2,94 мл, 17,61 ммоль) и перемешивали при комнатной температуре в течение 4 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 66%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,02 (д, J=6,4 Гц, 1H), 6,43 (д, J=5,9 Гц, 1H), 4,40-4,18 (1H), 4,18-4,11 (2H), 4,02 (с, 1H), 3,39 (дд, J=13,5, 9,4 Гц, 1H), 3,25 (т, J=10,5 Гц, 1H), 2,61-2,44 (м, 1H), 2,16-2,04 (м, 1H), 1,93-1,70 (м, 2H), 1,63-1,54 (м, 1H), 1,25 (тд, J=7,1, 2,7 Гц, 3H)
Стадия 2: Бензил ( S )-2-(1-(2-хлорпиримидин-4-ил)пиперидин-3-ил)ацетат
(R)-1-(2-хлорпиримидин-4-ил)пиперидин-3-карбоновую кислоту (0,300 г, 1,241 ммоль), полученную на стадии 1, растворяли в DCM (12,4 мл), и затем последовательно добавляли по каплям оксалилхлорид (0,543 мл, 6,21 ммоль) и DMF (0,481 мкл, 6,21 мкмоль). После перемешивания при комнатной температуре в течение 1 часа, растворитель удаляли при пониженном давлении. Реакцию растворяли в ацетонитриле (10,3 мл) и THF (10,3 мл), и затем добавляли триметилсилилдиазометан (1,86 мл, 3,72 ммоль), растворенный до 2 M в диэтиловом эфире, при 0°C. После перемешивания при комнатной температуре в течение 16 часов, растворитель удаляли при пониженном давлении. Реакцию растворяли в 2,4,6-триметилпиридине (8,26 мл), добавляли бензиловый спирт (0,271 мл, 2,61 ммоль), с последующим перемешиванием при 180°C в течение 7 минут. После прекращения реакции добавлением воды, ее растворяли в диэтиловом эфире, промывали водой и сушили над сульфатом магния. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 52%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,07 (т, J=5,6 Гц, 1H), 6,49 (д, J=6,4 Гц, 1H), 4,49-4,17 (1H), 4,06 (т, J=6,1 Гц, 1H), 3,45 (дд, J=13,3, 9,3 Гц, 1H), 3,40-3,26 (м, 1H), 2,73-2,59 (м, 1H), 2,17 (дд, J=17,7, 4,6 Гц, 1H), 2,01-1,79 (м, 2H), 1,73-1,54 (м, 1H)
Стадия 3: Бензил ( S )-2-(1-(2-аминопиримидин-4-ил)пиперидин-3-ил)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 2, применяя бензил (S)-2-(1-(2-хлорпиримидин-4-ил)пиперидин-3-ил)ацетат (0,224 г, 0,648 ммоль), полученный на стадии 2. (выход на 2 стадии 40%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,82 (д, J=6,4 Гц, 1H), 7,43-7,35 (м, 5H), 5,89 (д, J=6,1 Гц, 1H), 5,17 (т, J=12,8 Гц, 2H), 4,66 (с, 2H), 4,18 (д, J=11,6 Гц, 2H), 3,03-2,92 (м, 1H), 2,77 (дд, J=13,1, 10,1 Гц, 1H), 2,44-2,25 (м, 2H), 2,07 (дд, J=10,7, 7,3 Гц, 1H), 1,96-1,86 (м, 1H), 1,72 (дт, J=13,4, 4,0 Гц, 1H), 1,60-1,47 (м, 1H), 1,39-1,22 (м, 1H)
Пример получения 42: Этил (S,E)-3-(1-(2-аминопиримидин-4-ил)пиперидин-3-ил)акрилат
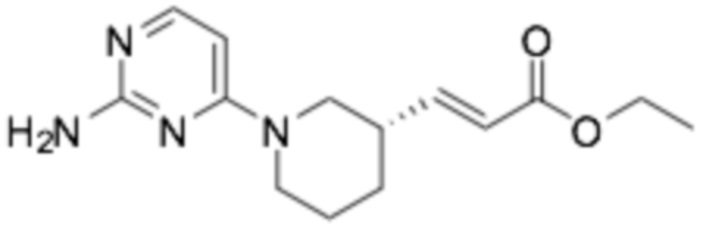
Стадия 1: трет- бутил ( R )-3-формилпиперидин-1-карбоксилат
1-(трет-бутил) 3-этилпиперидин-1,3-дикарбоксилат (1,73 г, 6,72 ммоль), полученный на стадии 1 примера получения 40, растворяли в толуоле (67,2 мл) и затем добавляли по каплям 1 M диизобутилалюмогидрид (16,81 мл, 16,81 ммоль) при -78°C и перемешивали в течение 3 часов и 30 минут. Реакцию прекращали медленным добавлением этилацетата (10 мл) и метанола (5 мл) при -78°C. Через 15 минут, добавляли 1 M водный раствор тартрата натрия калия и перемешивали в течение 1 часа, и затем разбавляли этилацетатом и фильтровали для удаления осадка. Органический растворитель удаляли при пониженном давлении и затем очищали колонкой с силикагелем, получая требуемый продукт. (выход 20%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,69 (с, 1H), 3,91 (д, J=13,3 Гц, 1H), 3,64 (д, J=12,3 Гц, 1H), 3,31 (дд, J=13,5, 8,5 Гц, 1H), 3,14-2,99 (м, 1H), 2,41 (с, 1H), 1,93 (д, J=3,7 Гц, 1H), 1,76-1,59 (м, 2H), 1,52-1,46 (м, 1H), 1,46-1,36 (9H)
Стадия 2: трет- бутил (S,E)-3-(3-этокси-3-оксопро-1-фен-1-ил)пиперидин-1-карбоксилат
Трет-бутил (R)-3-формилпиперидин-1-карбоксилат (0,283 г, 1,327 ммоль), полученный на стадии 1, растворяли в DCM (6,63 мл), и добавляли этил 2-(трифенил-15-фосфанилиден)ацетат (0,601 г, 1,725 ммоль), и перемешивали при комнатной температуре в течение 16 часов. Органический растворитель удаляли при пониженном давлении и затем очищали колонкой с силикагелем, получая требуемый продукт. (выход 96%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 6,83 (дд, J=15,8, 6,6 Гц, 1H), 5,85 (дд, J=16,0, 1,4 Гц, 1H), 4,18 (кв, J=7,0 Гц, 2H), 3,89 (тд, J=8,6, 4,3 Гц, 2H), 2,81 (т, J=11,2 Гц, 2H), 2,43-2,22 (м, 1H), 1,87 (дд, J=13,0, 3,9 Гц, 1H), 1,67 (дт, J=13,0, 3,9 Гц, 1H), 1,48 (с, 1H), 1,43 (д, J=14,6 Гц, 9H), 1,41-1,31 (м, 1H), 1,27 (дд, J=13,5, 6,2 Гц, 3H)
Стадия 3: Этил (S,E)-3-(1-(2-хлорпиримидин-4-ил)пиперидин-3-ил)акрилат
Гидрохлорид этил (S,E)-3-(пиперидин-3-ил)акрилата получали способом, аналогичным стадии 2 примера получения 1, применяя трет-бутил (S,E)-3-(3-этокси-3-оксопро-1-фен-1-ил)пиперидин-1-карбоксилат, полученный на стадии 2, и затем требуемый продукт получали способом, аналогичным стадии 1 примера получения 28 без дополнительной очистки. (выход 91%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,02 (д, J=6,4 Гц, 1H), 6,86 (дд, J=15,8, 7,1 Гц, 1H), 6,39 (д, J=5,9 Гц, 1H), 5,89 (дд, J=16,0, 1,4 Гц, 1H), 4,51-4,15 (м, 3H), 3,06-2,92 (м, 1H), 2,86 (дд, J=13,0, 10,7 Гц, 1H), 2,51-2,31 (м, 1H), 2,01-1,92 (1H), 1,90-1,78 (1H), 1,65-1,55 (м, 1H), 1,54 (с, 3H), 1,52-1,41 (м, 1H), 1,29 (т, J=7,1 Гц, 3H)
Стадия 4: Этил (S,E) -3-(1-(2-аминопиримидин-4-ил)пиперидин-3-ил)акрилат
Требуемый продукт получали способом, аналогичным примеру получения 2, применяя этил (S,E)-3-(1-(2-хлорпиримидин-4-ил)пиперидин-3-ил)акрилат, полученный на стадии 3. (выход на 2 стадии 49%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,94-7,81 (м, 1H), 6,91 (дд, J=15,9, 7,0 Гц, 1H), 5,97 (т, J=6,0 Гц, 1H), 5,95-5,84 (1H), 4,73 (д, J=18,0 Гц, 2H), 4,41 (с, 1H), 4,23 (кв, J=7,1 Гц, 2H), 4,20-4,06 (м, 1H), 3,00-2,85 (м, 1H), 2,78 (дд, J=13,1, 10,4 Гц, 1H), 2,48-2,31 (1H), 1,98 (д, J=12,5 Гц, 1H), 1,87-1,77 (м, 1H), 1,62-1,53 (м, 1H), 1,53-1,42 (м, 1H), 1,32 (т, J=7,2 Гц, 3H)
Пример получения 43: Этил 1-(2-аминопиримидин-4-ил)пиперидин-3-карбоксилат
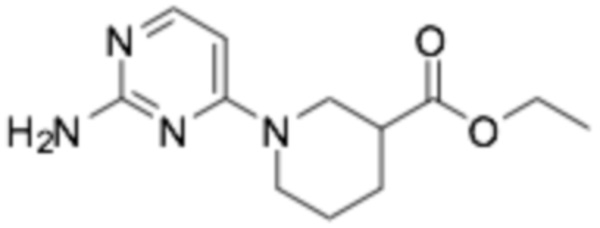
Требуемый продукт получали способом, аналогичным примеру получения 28, применяя этилпиперидин-3-карбоксилат (0,626 мл, 4,03 ммоль). (выход на 3 стадии 14%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,86 (д, J=6,1 Гц, 1H), 6,01 (д, J=6,4 Гц, 1H), 4,93 (с, 2H), 4,58-4,29 (1H), 4,29-4,14 (2H), 4,14-4,01 (1H), 3,33-3,12 (1H), 3,12-2,98 (1H), 2,67-2,43 (м, 1H), 2,23-1,96 (1H), 1,82 (д, J=4,0 Гц, 1H), 1,74-1,61 (1H), 1,56 (с, 1H), 1,39-1,23 (3H)
Пример получения 44: трет-бутил (S)-2-((1-(2-аминопиримидин-4-ил)пиперидин-3-ил)окси)ацетат
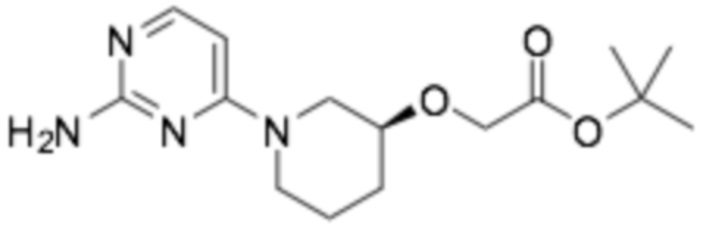
Стадия 1: Бензил ( S )-3-гидроксипиперидин-1-карбоксилат
Гидрохлорид (S)-пиперидин-3-ола (1,0 г, 7,27 ммоль) растворяли в DCM (14,5 мл), добавляли TEA (2,026 мл, 14,53 ммоль), и бензилкарбонохлоридат (1,025 мл, 7,27) ммоль) добавляли по каплям при 0°C в течение 2 часов и 30 минут. Смесь дополнительно перемешивали при 0°C в течение 30 минут, разбавляли DCM, и промывали 1 N HCl водным раствором. Органический растворитель сушили над сульфатом магния, и затем органический растворитель удаляли при пониженном давлении. Его непосредственно применяли в следующей реакции без дополнительной очистки.
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,57-7,31 (м, 5H), 5,27-5,09 (2H), 3,90-3,70 (м, 2H), 3,61 (с, 1H), 3,38-3,15 (м, 2H), 2,00-1,87 (м, 1H), 1,87-1,73 (1H), 1,73-1,46 (м, 3H)
Стадия 2: Бензил ( S )-3-(2-( трет- бутокси)-2-оксоэтокси)пиперидин-1-карбоксилат
После растворения бензил (S)-3-гидроксипиперидин-1-карбоксилата (7,27 ммоль), полученного на стадии 1, в толуоле (14,5 мл), добавляли трет-бутил 2-бромацетат (1,611 мл, 10,91 ммоль) и гидросульфат тетра н-бутиламмония (0,074 г, 0,218 ммоль), растворенный в 5 мл воды. Гидроксид натрия (7,27 г, 182 ммоль), растворенный в 7,27 мл воды, добавляли по каплям к реакции. После перемешивания при комнатной температуре в течение 16 часов, ее растворяли в этилацетате и промывали соляным раствором. Органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (выход 59%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,46-7,26 (5H), 5,11 (с, 2H), 3,96 (с, 2H), 3,88 (д, J=11,4 Гц, 1H), 3,66 (д, J=12,8 Гц, 1H), 3,41 (с, 1H), 3,21-3,07 (2H), 1,96 (с, 1H), 1,77 (д, J=3,7 Гц, 1H), 1,59 (д, J=9,6 Гц, 1H), 1,45 (с, 9H)
Стадия 3: трет- бутил ( S )-2-(пиперидин-3-илокси)ацетат
Бензил (S)-3-(2-(трет-бутокси)-2-оксоэтокси)пиперидин-1-карбоксилат, полученный на стадии 2, растворяли в этаноле (21,2 мл), и затем добавляли Pd/C (0,1485 г, 1,395 ммоль), и реакцию деблокирования проводили, применяя баллон с водородом. После фильтрации через слой целита, растворитель удаляли при пониженном давлении, и очищали колонкой с силикагелем, получая требуемый продукт. (выход 100%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 4,03 (дд, J=25,9, 16,5 Гц, 2H), 3,45-3,31 (м, 1H), 3,09 (дд, J=12,4, 2,6 Гц, 1H), 2,90-2,78 (м, 1H), 2,78-2,62 (2H), 2,04-1,91 (м, 1H), 1,79-1,70 (1H), 1,61 (тт, J=12,8, 4,4 Гц, 1H), 1,56-1,39 (м, 11H)
Стадия 4: трет- бутил ( S )-2-((1-(2-аминопиримидин-4-ил)пиперидин-3-ил)окси)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 28, применяя трет-бутил (S)-2-(пиперидин-3-илокси)ацетат (0,517 г, 1,577 ммоль), полученный на стадии 3. (выход на 3 стадии 50%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,83 (т, J=3,2 Гц, 1H), 5,96 (д, J=6,4 Гц, 1H), 4,64 (с, 2H), 4,15 (д, J=11,9 Гц, 1H), 4,06-4,00 (2H), 3,87 (с, 1H), 3,41 (т, J=4,1 Гц, 1H), 3,21-3,04 (м, 2H), 2,05 (с, 1H), 1,83 (с, 1H), 1,53-1,38 (м, 11H)
Пример получения 45: трет-бутил (S)-2-((1-(6-аминопиридин-2-ил)пиперидин-3-ил)окси)ацетат
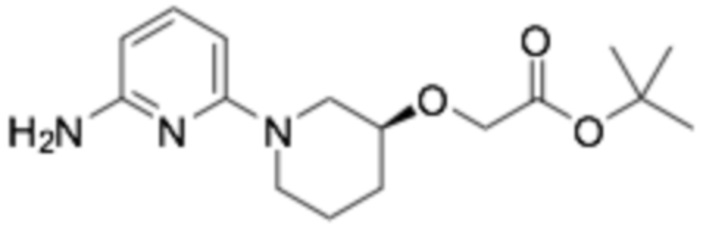
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 29 и примера получения 2, применяя трет-бутил (S)-2-(пиперидин-3-илокси)ацетат (0,503 г, 2,336 мл), полученный на стадии 3 примера получения 44. (выход на 3 стадии 6%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,22 (д, J=7,8 Гц, 1H), 6,01 (д, J=8,2 Гц, 1H), 5,82 (д, J=7,8 Гц, 1H), 4,25 (дд, J=12,3, 4,1 Гц, 1H), 4,22-4,09 (м, 2H), 4,05 (с, 2H), 3,94-3,85 (м, 1H), 3,45 (тд, J=9,1, 4,4 Гц, 1H), 2,92-2,80 (м, 2H), 2,09 (д, J=3,7 Гц, 1H), 1,89-1,74 (м, 1H), 1,55-1,49 (м, 2H), 1,47 (с, 9H)
Пример получения 46: трет-бутил (R)-2-((1-(2-аминопиримидин-4-ил)пиперидин-3-ил)окси)ацетат
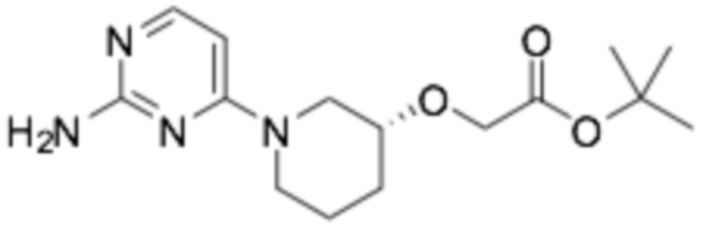
Требуемый продукт получали способом, аналогичным примеру получения 44, применяя гидрохлорид (R)-пиперидин-3-ола (1,0 г, 7,27 ммоль). (5-выход на стадии 23%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,80 (д, J=6,4 Гц, 1H), 5,96 (д, J=6,4 Гц, 1H), 4,91 (с, 1H), 4,21-4,08 (1H), 4,08-3,96 (2H), 3,84 (д, J=12,8 Гц, 1H), 3,55-3,37 (м, 1H), 3,27-3,08 (2H), 2,29-1,89 (м, 1H), 1,90-1,75 (м, 1H), 1,69-1,57 (м, 1H), 1,57-1,48 (м, 1H), 1,47 (с, 9H)
Пример получения 47: трет-бутил (R)-2-((1-(2-аминопиримидин-4-ил)пиперидин-3-ил)окси)-2-метилпропаноат
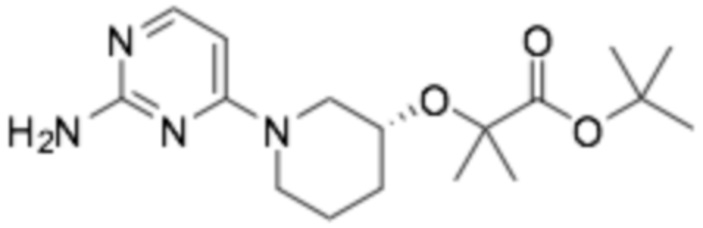
Стадия 1: ( R )-1-бензилпиперидин-3-ол
Гидрохлорид (R)-пиперидин-3-ола (1,0 г, 7,27 ммоль) растворяли в DMF (14,5 мл) и добавляли карбонат калия (2,210 г, 15,99 ммоль) и бензилбромид (0,951 мл, 7,99 ммоль). Реакцию перемешивали при 60°C в течение 3 дней. После фильтрования карбоната калия, DMF растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 57%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,33 (тд, J=8,0, 6,1 Гц, 4H), 7,28-7,23 (м, 1H), 3,84 (т, J=3,8 Гц, 1H), 3,53 (с, 2H), 2,50 (д, J=14,0 Гц, 3H), 2,27 (с, 1H), 1,95-1,74 (1H), 1,75-1,46 (м, 3H)
Стадия 2: трет- бутил ( R )-2-((1-бензилпиперидин-3-ил)окси)ацетат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 44, применяя (R)-1-бензилпиперидин-3-ол (0,785 г, 4,10 ммоль), полученный на стадии 1. (выход 40%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,39-7,26 (м, 4H), 7,24-7,20 (м, 1H), 3,96 (с, 2H), 3,52 (с, 2H), 3,49-3,39 (м, 1H), 3,06-2,91 (м, 1H), 2,65 (д, J=11,0 Гц, 1H), 2,07-1,90 (3H), 1,71 (дт, J=13,7, 3,7 Гц, 1H), 1,55-1,46 (1H), 1,46-1,40 (м, 9H), 1,28 (ддд, J=22,1, 12,2, 4,5 Гц, 1H)
Стадия 3: трет- бутил ( R )-2-((1-бензилпиперидин-3-ил)окси)-2-метилпропаноат
После растворения трет-бутил (R)-2-((1-бензилпиперидин-3-ил)окси)ацетата (0,507 г, 1,660 ммоль), полученного на стадии 2, в THF (10 мл), добавляли бис(триметилсилил)амид лития (1,938 мл, 2,52 ммоль) при -78°C. После перемешивания при комнатной температуре в течение 1 часа, смесь охлаждали до -78°C, и затем добавляли йодметан (0,068 мл, 1,109 ммоль), растворенный в THF (0,7 мл). Ее перемешивали снова при комнатной температуре в течение 1 часа. Трет-бутил 2-(((R)-1-бензилпиперидин-3-ил)окси)пропаноат, в которой вводили одну метильную группу, получали очисткой колонкой с силикагелем. Тот же способ повторяли, получая требуемый продукт. (выход 38%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,28 (д, J=4,6 Гц, 4H), 7,24-7,15 (м, 1H), 3,48 (д, J=3,7 Гц, 2H), 3,46-3,37 (м, 1H), 3,01 (дт, J=10,5, 2,1 Гц, 1H), 2,76-2,64 (м, 1H), 2,04-1,81 (м, 4H), 1,64 (тт, J=10,2, 3,4 Гц, 1H), 1,58-1,45 (м, 1H), 1,37 (д, J=6,9 Гц, 9H), 1,34 (с, 3H), 1,33-1,29 (м, 3H), 1,29-1,14 (м, 1H)
Стадия 4: трет- бутил ( R )-2-((1-(2-аминопиримидин-4-ил)пиперидин-3-ил)окси)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 44 (стадия 3, стадия 4), применяя трет-бутил (R)-2-((1-бензилпиперидин-3-ил)окси)-2-метилпропаноат, полученный на стадии 3. (выход на 4 стадии 43%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,14 (д, J=95,6 Гц, 1H), 6,29 (с, 1H), 4,45 (с, 2H), 3,54 (с, 1H), 3,13 (с, 2H), 2,33-2,01 (м, 3H), 1,46 (с, 9H), 1,38 (д, J=14,2 Гц, 6H)
Пример получения 48: Метил 1-(2-аминопиримидин-4-ил)-3-метилпирролидин-3-карбоксилат
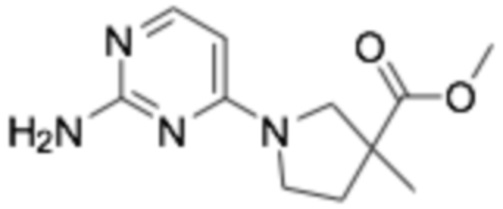
Требуемый продукт получали способом, аналогичным примеру получения 40, применяя гидрохлорид метилпирролидин-3-карбоксилата (1,0 г, 6,04 ммоль). (выход на 6 стадий 30%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,82 (д, J=5,9 Гц, 1H), 5,72 (д, J=5,9 Гц, 1H), 4,68 (с, 2H), 3,99-3,76 (1H), 3,71 (с, 3H), 3,52 (с, 1H), 2,54-2,36 (1H), 1,95-1,81 (м, 1H), 1,63 (м, 2H), 1,38 (с, 3H)
Пример получения 49: Метил 1-(6-аминопиридин-2-ил)-3-метилпирролидин-3-карбоксилат
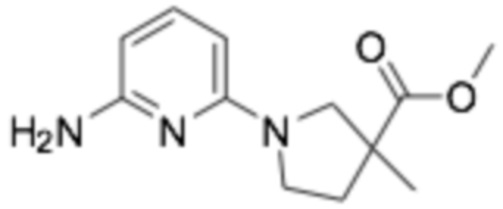
Требуемый продукт получали способом, аналогичным примеру получения 29, применяя промежуточное соединение, гидрохлорид метил 3-метилпирролидин-3-карбоксилата (0,390 г, 2,171 ммоль), полученный в примере получения 48. (выход на 3 стадии 10%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,22 (т, J=8,0 Гц, 1H), 5,78 (д, J=7,3 Гц, 1H), 5,71 (д, J=8,2 Гц, 1H), 4,13 (с, 2H), 3,83 (д, J=10,5 Гц, 1H), 3,69 (с, 3H), 3,57-3,41 (м, 2H), 3,32 (д, J=10,5 Гц, 1H), 2,51-2,36 (м, 1H), 1,92-1,80 (м, 1H), 1,37 (с, 3H)
Пример получения 50: Метил (1r,4r)-4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат
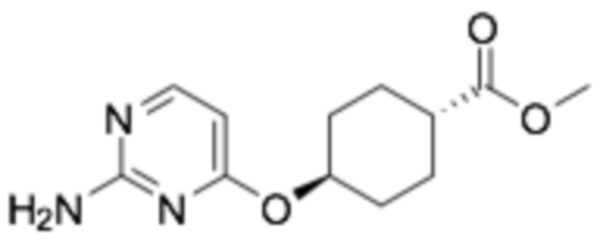
Стадия 1: Метил (1 r ,4 r )-4-гидроксициклогексан-1-карбоксилат
(1r,4r)-4-гидроксициклогексан-1-карбоновую кислоту (0,300 г, 2,081 ммоль) растворяли в метаноле (10 мл) и добавляли серную кислоту (0,017 мл, 0,312 ммоль). После перемешивания при 60°C в течение 16 часов, органический растворитель удаляли при пониженном давлении и очищали колонкой с силикагелем, получая требуемый продукт. (выход 100%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,25 (д, J=5,9 Гц, 1H), 6,64-6,50 (м, 1H), 5,16-5,05 (1H), 3,73-3,62 (м, 3H), 2,35 (тт, J=11,4, 3,7 Гц, 1H), 2,18 (дт, J=12,8, 3,5 Гц, 2H), 2,07 (дд, J=14,2, 3,7 Гц, 2H), 1,74-1,56 (м, 2H), 1,49 (ддд, J=23,0, 12,7, 3,5 Гц, 2H)
Стадия 2: Метил (1 r ,4 r )-4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат
Требуемый продукт получали способом, аналогичным примеру получения 117, применяя метил (1r,4r)-4-гидроксициклогексан-1-карбоксилат (0,333 г, 2,105 ммоль). (выход на 2 стадии 28%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,98 (д, J=5,9 Гц, 1H), 6,01 (д, J=5,5 Гц, 1H), 5,02-4,89 (м, 1H), 4,82 (с, 2H), 3,68 (дд, J=7,3, 2,7 Гц, 5H), 2,44-2,26 (м, 1H), 2,20-1,99 (м, 4H), 1,71-1,57 (м, 2H), 1,52 (с, 1H), 1,41 (дд, J=12,6, 3,4 Гц, 1H)
Пример получения 51: Метил (1s,4s)-4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат
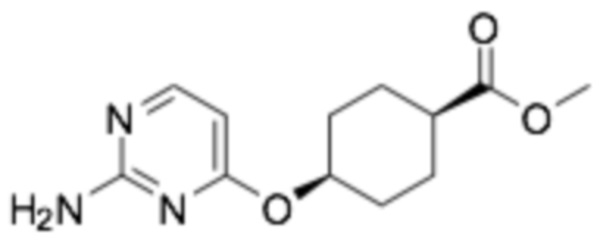
Требуемый продукт получали способом, аналогичным примеру получения 50, применяя (1s,4s)-4-гидроксициклогексан-1-карбоновую кислоту (1,000 г, 6,94 ммоль). (выход на 3 стадии 20%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,93 (т, J=5,7 Гц, 1H), 6,00 (т, J=5,7 Гц, 1H), 5,20-4,97 (м, 3H), 3,64 (с, 3H), 2,45-2,31 (м, 1H), 2,04-1,81 (м, 4H), 1,79-1,52 (м, 4H)
Пример получения 52: Метил 2-(3-(6-аминопиридин-2-ил)фенил)-2-метилпропаноат
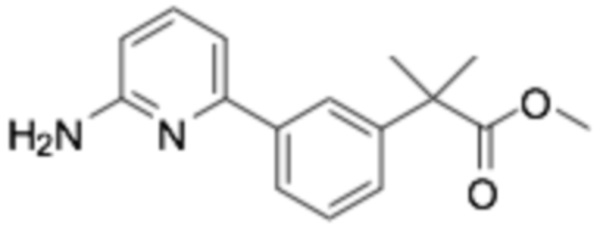
Стадия 1: Метил 2-метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат
После растворения метил 2-(3-бромфенил)-2-метилпропаноата (250 мг, 0,972 ммоль), 4,4,4,4,5,5,5,5-октаметил-2,2-би(1,3,2-диоксаборолана) (296 мг, 1,17 ммоль), ацетата калия (286 мг, 2,92 ммоль) и дихлорметанового комплекса дихлорида 1,1′-бис(дифенилфосфино)ферроценпалладия (II) (39,7 мг, 0,0490 ммоль) в 9,72 мл 1,4-диоксана, растворенный кислород удаляли барботированием азота при перемешивании, и приток наружного воздуха перекрывали в герметичном контейнере. Реакцию перемешивали при 110°C в течение 15 часов и затем охлаждали до комнатной температуры. После фильтрования через слой целита и удаления органического растворителя при пониженном давлении, требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан). (выход 94%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,77 (с, 1H), 7,69 (д, J=7,3 Гц, 1H), 7,46-7,37 (1H), 7,33 (т, J=7,5 Гц, 1H), 3,65 (с, 3H), 1,60 (с, 6H), 1,34 (с, 12H)
Стадия 2: Метил 2-(3-(6-(( трет- бутоксикарбонил)амино)пиридин-2-ил)фенил)2-метилпропаноат
Метил 2-метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (279 мг, 0,917 ммоль), полученный на стадии 1, и трет-бутил (6-бромпиридин-2-ил)карбамат (251 мг, 0,917 ммоль), полученный в примере получения 73, 2 M водный раствор карбоната натрия (1,38 мл, 2,75 ммоль) и бис(трифенилфосфино)дихлорпалладий (64 мг, 0,092 ммоль) растворяли в 7,64 мл диметоксиэтана, и растворенный кислород удаляли барботированием азота при перемешивании, и приток наружного воздуха перекрывали в герметичном контейнере. Реакцию перемешивали при 100°C в течение 15 часов и затем охлаждали до комнатной температуры. После фильтрования через слой целита и удаления органического растворителя при пониженном давлении, растворяли в этилацетате и промывали соляным раствором. Органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан). (выход 72%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,95 (д, J=1,8 Гц, 1H), 7,86 (д, J=8,2 Гц, 1H), 7,80 (дт, J=7,3, 1,6 Гц, 1H), 7,76-7,66 (1H), 7,42-7,33 (м, 3H), 7,31 (с, 1H), 3,66 (с, 3H), 1,64 (с, 6H), 1,55 (с, 9H)
Стадия 3: Метил 2-(3-(6-аминопиридин-2-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным стадии 4 примера получения 19, применяя метил 2-(3-(6-((трет-бутоксикарбонил)амино)пиридин-2-ил)фенил)2-метилпропаноат (244 мг, 0,659 ммоль), полученный на стадии 2. (выход 81%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,92 (т, J=1,8 Гц, 1H), 7,84-7,70 (м, 1H), 7,50 (т, J=8,0 Гц, 1H), 7,39 (т, J=7,5 Гц, 1H), 7,34 (дт, J=7,9, 1,6 Гц, 1H), 7,07 (д, J=7,3 Гц, 1H), 6,54-6,39 (1H), 4,49 (с, 2H), 3,66 (с, 3H), 1,64 (с, 6H)
Пример получения 53: Метил 2-(3-(2-аминопиримидин-4-ил)фенил)-2-метилпропаноат
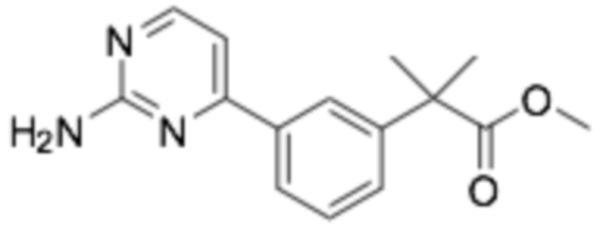
Стадия 1: Метил 2-метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат
Метил 2-(3-бромфенил)-2-метилпропаноат (0,5 г, 1,944 ммоль) и 4,4,4,4,5,5,5,5-оксаметил-2,2-бис(1,3,2-диоксаборолан) (0,494 г, 1,944 ммоль), ацетат калия (0,478 г, 4,862 ммоль), дихлорметановый комплекс 1,1'-бис(дифенилфосфино)ферроцендихлор-палладия (II) (0,08 г, 0,098 ммоль) растворяли в 8 мл 1,4-диоксана и перемешивали при 110°C в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×15 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 85%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,76 (д, J=0,9 Гц, 1H), 7,72-7,65 (м, 1H), 7,43-7,37 (м, 1H), 7,31 (т, J=7,5 Гц, 1H), 3,71-3,53 (м, 3H), 1,59 (с, 6H), 1,33 (с, 12H)
Стадия 2: Метил 2-(3-(2-хлорпиримидин-4-ил)фенил)-2-метилпропаноат
Метил 2-метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат, полученный на стадии 1 (0,25 г, 0,822 ммоль), 2,4-дихлорпиримидин (0,147 г, 0,986 ммоль), 1 мл карбоната натрия и дихлорид бис(трифенилфосфин)палладия (II) (0,058 г, 0,082 ммоль) растворяли в 4 мл DME и перемешивали при 100°C в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×15 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 80%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,66-8,55 (м, 1H), 8,05 (дд, J=15,1, 1,8 Гц, 1H), 7,98-7,85 (м, 1H), 7,66-7,56 (м, 1H), 7,56-7,38 (м, 2H), 3,70-3,59 (3H), 1,67-1,58 (м, 6H)
Стадия 3: Метил 2-(3-(2-аминопиримидин-4-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя метил 2-(3-(2-хлорпиримидин-4-ил)фенил)-2-метилпропаноат (0,19 г, 0,653 ммоль), полученный на стадии 2. (выход на 2 стадии 64%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,31 (д, J=5,5 Гц, 1H), 8,00 (т, J=1,6 Гц, 1H), 7,84 (дт, J=7,3, 1,6 Гц, 1H), 7,50-7,38 (2H), 7,06 (т, J=5,3 Гц, 1H), 5,43 (с, 2H), 3,65 (т, J=15,3 Гц, 3H), 1,63 (с, 6H)
Пример получения 54: Метил 2-(4-(6-аминопиридин-2-ил)фенил)-2-метилпропаноат
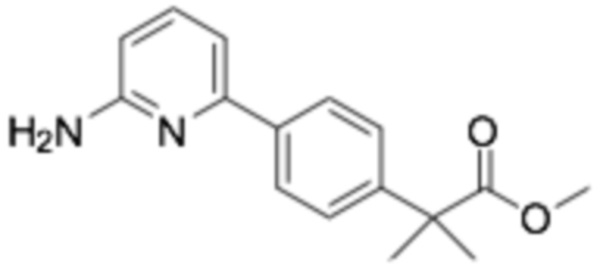
Стадия 1: Метил 2-метил-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 53, применяя метил 2-(4-бромфенил)-2-метилпропаноат (1 г, 3,89 ммоль). (выход 95%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,80 (д, J=8,2 Гц, 2H), 7,39-7,31 (м, 2H), 3,74-3,59 (м, 3H), 1,60 (с, 6H), 1,37-1,32 (м, 12H)
Стадия 2: Метил 2-(4-(6-(( трет- бутоксикарбонил)амино)пиридин-2-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 53, применяя метил 2-метил-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (0,62 г, 2,038 ммоль), полученный на стадии 1, и трет-бутил (6-хлорпиридин-2-ил)карбамат (0,559 г, 2,446 ммоль). (выход 62%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,88 (дт, J=8,5, 2,1 Гц, 2H), 7,84 (д, J=8,2 Гц, 1H), 7,70 (т, J=8,0 Гц, 1H), 7,44-7,38 (м, 2H), 7,36 (д, J=7,3 Гц, 1H), 7,31 (д, J=11,4 Гц, 1H), 3,65 (с, 3H), 1,60 (с, 6H), 1,52 (с, 9H)
Стадия 3: Метил 2-(4-(6-аминопиридин-2-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным стадии 4 примера получения 19, применяя метил 2-(4-(6-((трет-бутоксикарбонил)амино)пиридин-2-ил)фенил)-2-метилпропаноат (0,467 г, 1,263 ммоль), полученный на стадии 2. (выход 78%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,99-7,75 (м, 2H), 7,57-7,44 (м, 1H), 7,44-7,33 (м, 2H), 7,16-6,94 (м, 1H), 6,51-6,35 (м, 1H), 4,61 (с, 2H), 3,72-3,51 (м, 3H), 1,73-1,51 (м, 6H)
Пример получения 55: Метил 2-(4-(2-аминопиримидин-4-ил)фенил)-2-метилпропаноат
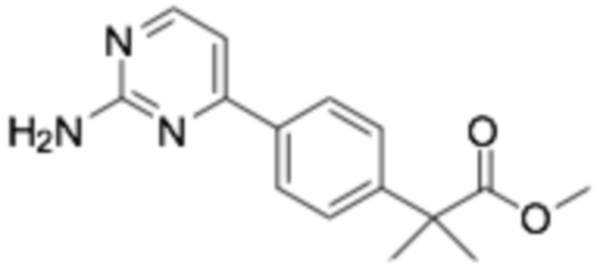
Стадия 1: Метил 2-(4-(2-хлорпиримидин-4-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 53, применяя метил 2-метил-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (0,7 г, 2,301 ммоль), полученный на стадии 1 примера получения 54, и 2,4-дихлорпиримидин (0,411 г, 2,76 ммоль). (выход 99%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,65-8,56 (м, 1H), 8,09-8,01 (м, 2H), 7,61 (д, J=5,5 Гц, 1H), 7,53-7,43 (м, 2H), 3,66 (д, J=5,5 Гц, 3H), 1,62 (д, J=9,6 Гц, 6H)
Стадия 2: Метил 2-(4-(2-аминопиримидин-4-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя метил 2-(4-(2-хлорпиримидин-4-ил)фенил)-2-метилпропаноат (0,59 г, 2,029 ммоль), полученный на стадии 1. (выход на 2 стадии 44%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,43-8,20 (м, 1H), 8,05-7,83 (м, 2H), 7,54-7,34 (2H), 7,06-6,89 (м, 1H), 5,36 (с, 2H), 3,70-3,55 (м, 3H), 1,69-1,51 (м, 6H)
Пример получения 56: Метил 3-(3-(2-аминопиридин-4-ил)фенил)пропаноат
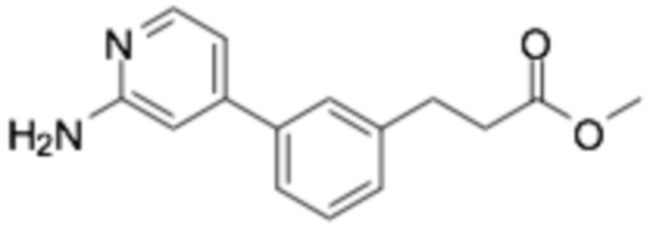
Требуемый продукт получали способом, аналогичным примеру получения 26, применяя метил 3-(3-бромфенил)пропаноат (1 г, 4,11 ммоль). (выход на 2 стадии 69%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,13 (д, J=5,2 Гц, 1H), 7,45 (д, J=7,9 Гц, 2H), 7,40 (т, J=7,6 Гц, 1H), 7,27 (с, 1H), 6,89 (д, J=5,5 Гц, 1H), 6,72 (с, 1H), 4,64-4,42 (2H), 3,70 (с, 3H), 3,04 (т, J=7,8 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H)
Пример получения 57: Метил 3-(3-(2-аминопиримидин-4-ил)фенил)пропаноат
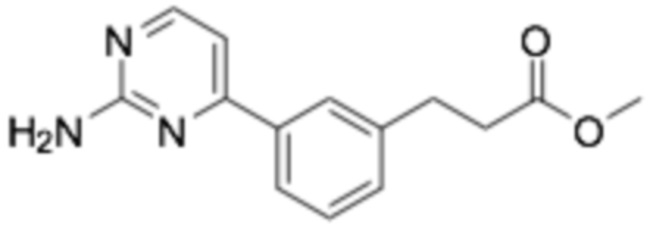
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 28 и Пример получения 2, применяя промежуточное соединение, метил 3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (0,200 г, 0,689 ммоль), полученный в примере получения 56. (выход на 3 стадии 43%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,33 (д, J=5,2 Гц, 1H), 7,86 (с, 1H), 7,84-7,74 (м, 1H), 7,47-7,37 (1H), 7,32 (д, J=7,3 Гц, 1H), 7,01 (д, J=5,2 Гц, 1H), 5,57-5,31 (2H), 3,70 (д, J=22,6 Гц, 3H), 3,03 (т, J=7,8 Гц, 2H), 2,69 (т, J=7,8 Гц, 2H)
Пример получения 58: Метил 3-(3-(2-аминопиридин-4-ил)фенил)-2,2-диметилпропаноат
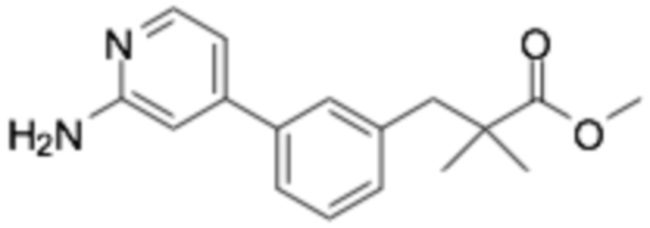
Стадия 1: Метил 3-(3-бромфенил)-2,2-диметилпропаноат
Диизопропиламин (20,5 мл, 144 ммоль) добавляли к 400 мл безводного тетрагидрофурана, и 2,5 M н-бутиллитий (57,6 мл, 144 ммоль) медленно добавляли по каплям при -78°C. Реакционный раствор перемешивали при той же температуре в течение 20 минут. Температуру повышали до комнатной температуры и перемешивали в течение 10 минут, затем понижали -78°C и перемешивали в течение 10 минут. Реакционный раствор добавляли по каплям к метилизобутирату (16,5 мл, 144 ммоль), растворенному в 100 мл безводного тетрагидрофурана. Реакционный раствор перемешивали при -78°C в течение 1 часа, и медленно добавляли по каплям 1-бром-3-(бромметил)бензол (30,0 г, 120 ммоль), растворенный в 100 мл безводный тетрагидрофурана. Реакционный раствор повышали до комнатной температуры и перемешивали в течение 20 минут. Реакцию прекращали добавлением 1 N водного раствора хлористоводородной кислоты к реакционному раствору, с последующей экстракцией диэтиловым эфиром. Органический слой концентрировали при пониженном давлении и затем очищали колонкой с силикагелем (этилацетат : гексан), получая требуемый продукт. (выход 72%).
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,35 (д, J=7,9 Гц, 1H), 7,26-7,20 (1H), 7,13 (т, J=7,8 Гц, 1H), 7,03 (д, J=7,6 Гц, 1H), 3,67 (с, 3H), 2,81 (с, 2H), 1,18 (с, 6H)
Стадия 2: Метил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 52, применяя метил 3-(3-бромфенил)-2,2-диметилпропаноат, полученный на стадии 1. (выход 73%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,65 (д, J=7,3 Гц, 1H), 7,54 (с, 1H), 7,29-7,23 (м, 1H), 7,19 (д, J=7,6 Гц, 1H), 3,66 (с, 3H), 2,86 (с, 2H), 1,33 (с, 12H), 1,18 (с, 6H)
Стадия 3: Метил 3-(3-(2-аминопиридин-4-ил)фенил)2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52, применяя 4-бромпиридин-2-амин (109 мг, 0,628 ммоль) и метил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилпропаноат (200 мг, 0,628 ммоль), полученный на стадии 2, и следующую реакцию проводили без очистки.
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,11 (д, J=5,5 Гц, 1H), 7,43 (д, J=7,6 Гц, 1H), 7,37-7,29 (м, 2H), 7,15 (д, J=7,6 Гц, 1H), 6,85 (д, J=4,0 Гц, 1H), 6,67 (с, 1H), 4,56-4,43 (2H), 3,66 (с, 3H), 2,92 (с, 2H), 1,21 (с, 6H)
Пример получения 59: Метил 3-(3-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат
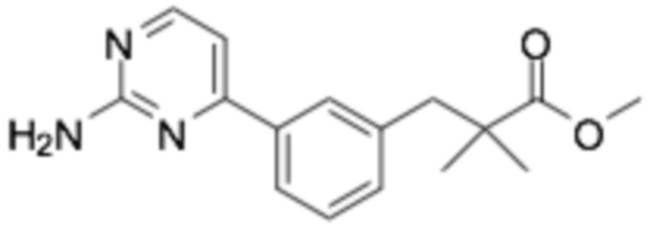
Стадия 1: Метил 3-(3-(2-хлорпиримидин-4-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52, применяя 2,4-дихлорпиримидин (1,40 г, 9,43 ммоль) и метил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилпропаноат (3,00 г, 9,43 ммоль), полученный на стадии 2 примера получения 58. (выход 76%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,62 (д, J=5,2 Гц, 1H), 7,91 (д, J=7,9 Гц, 1H), 7,87 (с, 1H), 7,62 (д, J=5,5 Гц, 1H), 7,41 (т, J=7,6 Гц, 1H), 7,29 (д, J=7,6 Гц, 1H), 3,70 (с, 3H), 2,96 (с, 2H), 1,22 (с, 6H)
Стадия 2: Метил 3-(3-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 3, 4 примера получения 19, применяя метил 3-(3-(2-хлорпиримидин-4-ил)фенил)-2,2-диметилпропаноат (2,18 г, 7,15 ммоль), полученный на стадии 1. (выход на 2 стадии 44%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,32 (д, J=5,5 Гц, 1H), 7,85 (д, J=7,8 Гц, 1H), 7,80-7,69 (1H), 7,38 (т, J=7,8 Гц, 1H), 7,23 (д, J=7,8 Гц, 1H), 7,12-6,97 (1H), 5,31 (д, J=22,0 Гц, 2H), 3,67 (с, 3H), 2,94 (с, 2H), 1,21 (с, 6H)
Пример получения 60: Метил 2-(2-аминопиридин-4-ил)-2-метилпропаноат
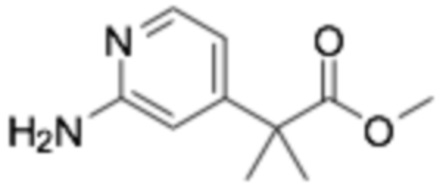
Требуемый продукт получали способом, аналогичным примеру получения 19, применяя 2-(2-хлорпиридин-4-ил)уксусную кислоту (5,00 г, 29,1 ммоль). (выход на 4 стадии 5%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,00 (д, J=4,6 Гц, 1H), 6,66-6,54 (м, 1H), 6,44 (с, 1H), 4,45 (с, 2H), 3,67 (с, 3H), 1,52 (с, 6H)
Пример получения 61: Этил 2-(6-аминопиридин-2-ил)-2-метилпропаноат
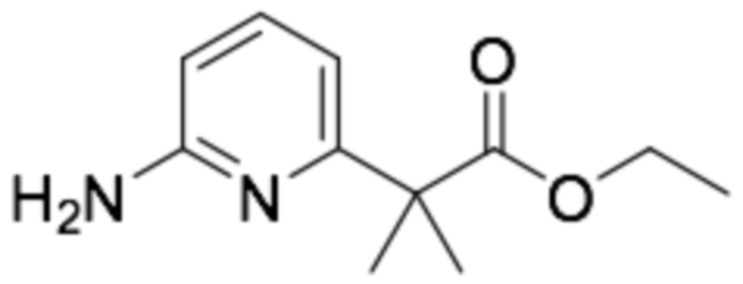
Стадия 1: Этил 2-(6-хлорпиридин-2-ил)ацетат
Диизопропиламин (1,77 мл, 12,4 ммоль) добавляли к 20 мл безводного тетрагидрофурана, и 2,5 M н-бутиллитий (4,97 мл, 12,4 ммоль) медленно добавляли по каплям при -78°C. Реакционный раствор перемешивали при той же температуре в течение 20 минут. Температуру повышали до комнатной температуры и перемешивали в течение 10 минут, затем понижали до -78°C и перемешивали в течение 10 минут. 2-хлор-6-метилпиридин (0,57 мл, 5,2 ммоль), растворенный в 100 мл безводного тетрагидрофурана, добавляли по каплям к реакционному раствору. Реакционный раствор перемешивали при -78°C в течение 1 часа, и диэтилкарбоната (0,75 мл, 6,2 ммоль), растворенный в 100 мл безводного тетрагидрофурана, медленно добавляли по каплям. Реакционный раствор повышали до 0°C и перемешивали в течение 4 часов. Реакцию прекращали добавлением насыщенного водного раствора хлорида аммония к реакционному раствору, с последующей экстракцией этилацетатом. Органический слой концентрировали при пониженном давлении и затем очищали колонкой с силикагелем (этилацетат : гексан), получая требуемый продукт. (выход 88%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,61 (т, J=7,8 Гц, 1H), 7,22 (д, J=7,6 Гц, 2H), 4,16 (кв, J=7,1 Гц, 2H), 3,80 (с, 2H), 1,29-1,20 (м, 3H)
Стадия 2: Этил 2-(6-аминопиридин-2-ил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 2, стадия 3, стадия 4), применяя этил 2-(6-хлорпиридин-2-ил)ацетат (903 мг, 4,52 ммоль), полученный на стадии 1. (выход на 3 стадии 5%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,38 (т, J=7,9 Гц, 1H), 6,62 (д, J=7,3 Гц, 1H), 6,34 (д, J=7,9 Гц, 1H), 4,34 (с, 2H), 4,19-4,12 (м, 2H), 1,53 (с, 6H), 1,19 (т, J=7,0 Гц, 3H)
Пример получения 62: трет-бутил 3-(6-аминопиридин-2-ил)-2,2-диметилпропаноат
Стадия 1: 2-(Бромметил)-6-хлорпиридин
2-Хлор-6-метилпиридин (3,00 г, 23,5 ммоль), N-бромсукцинимид (4,19 г, 23,5 ммоль) и 2,2'-азобис(2-метилпропионитрил) (0,077 г, 0,47 ммоль) растворяли в 50 мл 1,2-дихлорэтана, нагревали при 80°C в течение 3 часов, и промывали соляным раствором. Органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан). (выход 25%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,67 (т, J=7,8 Гц, 1H), 7,39 (д, J=7,8 Гц, 1H), 7,28 (с, 1H), 4,50 (с, 2H)
Стадия 2: трет- бутил 3-(6-хлорпиридин-2-ил)-2,2,-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 58, применяя 2-(бромметил)-6-хлорпиридин (1,23 г, 5,96 ммоль), полученный на стадии 1, и трет-бутил изобутират (1,03 г, 7,15 ммоль). (выход 84%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,52 (т, J=7,5 Гц, 1H), 7,15 (д, J=7,8 Гц, 1H), 7,06 (д, J=7,8 Гц, 1H), 3,00 (с, 2H), 1,44 (с, 9H), 1,18 (с, 6H)
Стадия 3: трет- бутил 3-(6-аминопиридин-2-ил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя трет-бутил 3-(6-хлорпиридин-2-ил)-2,2-диметилпропаноат (1,35 г, 5,00 ммоль), полученный на стадии 2. (выход на 2 стадии 9%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,31 (т, J=7,8 Гц, 1H), 6,48 (д, J=7,3 Гц, 1H), 6,34-6,29 (1H), 4,27 (с, 2H), 2,84 (с, 2H), 1,44 (с, 9H), 1,20-1,13 (6H)
Пример получения 63: трет-бутил 3-(2-аминопиридин-4-ил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 62, применяя 2-хлор-4-метилпиридин (3,00 г, 23,5 ммоль). (выход на 4 стадии 3%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,94 (д, J=5,5 Гц, 1H), 6,47 (д, J=5,5 Гц, 1H), 6,30 (с, 1H), 4,30 (с, 2H), 2,70 (с, 2H), 1,44 (с, 9H), 1,14 (с, 6H)
Пример получения 64: трет-бутил 3-амино-1H-пиразол-1-карбоксилат
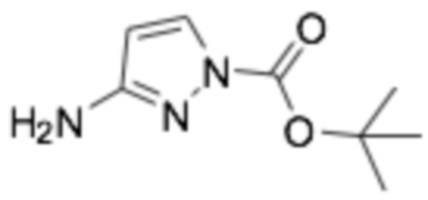
После растворения 1H-пиразол-3-амина (0,500 г, 6,02 ммоль), TEA (1,677 мл, 12,03 ммоль) и 4-диметиламинопиридина (0,049 г, 0,403 ммоль) в 1,4-диоксане (20,06 мл), ди-трет-бутилдикарбоната (1,590 мл, 6,92 ммоль) добавляли по каплям при комнатной температуре. После перемешивания при комнатной температуре в течение 4 часов, органический растворитель удаляли при пониженном давлении. Смесь разбавляли этилацетатом и промывали соляным раствором. Органический растворитель сушили над сульфатом магния и применяли в следующей реакции без дополнительной очистки. (выход 84%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,86 (д, J=2,7 Гц, 1H), 5,84 (д, J=2,7 Гц, 1H), 4,01 (с, 2H), 1,64 (с, 9H)
Пример получения 65: Этил 1-(6-аминопиридин-2-ил)пиперидин-3-карбоксилат
Требуемый продукт получали способом, аналогичным примеру получения 29, применяя этилпиперидин-3-карбоксилат (0,500 г, 3,18 ммоль). (выход на 3 стадии 24%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,49 (т, J=8,4 Гц, 1H), 5,97 (дд, J=20,1, 8,2 Гц, 2H), 4,18 (кв, J=7,1 Гц, 2H), 4,05-3,93 (м, 1H), 3,86 (д, J=13,1 Гц, 1H), 3,38 (дд, J=13,1, 9,8 Гц, 1H), 3,19 (дд, J=13,0, 9,9 Гц, 1H), 2,84-2,59 (м, 1H), 2,16 (д, J=9,5 Гц, 1H), 1,89 (с, 1H), 1,83-1,65 (м, 2H), 1,28 (т, J=7,2 Гц, 3H)
Пример получения 66: Метил 3-(3-амино-1H-пиразол-1-ил)-2,2-диметилпропаноат
Применяя метил 3-гидрокси-2,2-диметилпропаноат (0,70 г, 5,31 ммоль) и 3-нитро-1H-пиразол (0,50 г, 4,42 ммоль), последовательно применяли способ, аналогичный стадии 1 примера получения 1 и стадии 3 примера получения 94, получая требуемый продукт. (выход 63%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 7,09 (д, J=2,3 Гц, 1H), 5,55 (д, J=2,3 Гц, 1H), 4,07 (с, 2H), 3,69 (с, 3H), 1,19 (с, 6H)
Пример получения 67: Метил 3-(3-(3-амино-1H-пиразол-1-ил)фенил)-2,2-диметилпропаноат
1H-пиразол-3-амин (0,20 г, 2,41 ммоль), йодид меди (I) (0,046 г, 0,24 ммоль), карбонат цезия (1,186 г, 3,61 ммоль) и трет-бутил 3-(3-бромфенил)-2,2-диметилпропаноат (0,75 г, 2,41 ммоль), полученный на стадии 1 примера получения 79, добавляли к DMF (2,4 мл) и перемешивали при 120°C в течение 12 часов. Добавляли воду к реакционной смеси, с последующей экстракцией этилацетатом. Органический слой промывали соляным раствором и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и очищали колоночной хроматографией, получая заявленное в заголовке соединение. (выход 59%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 7,66 (д, J=2,3 Гц, 1H), 7,48-7,33 (м, 2H), 7,30-7,25 (м, 1H), 6,99 (д, J=7,8 Гц, 1H), 5,83 (д, J=2,3 Гц, 1H), 3,31 (с, 2H), 2,86 (с, 2H), 1,43 (с, 9H), 1,15 (с, 6H)
Пример получения 68: Этил 2-(3-(2-аминопиримидин-4-ил)фенокси)-2-метилпропаноат
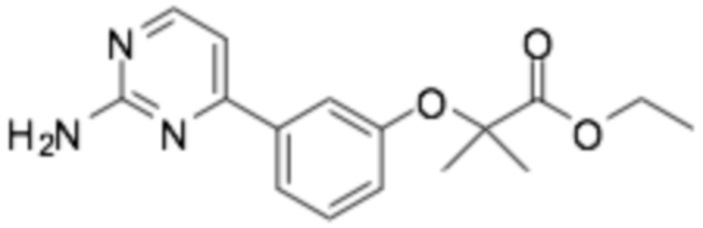
Стадия 1: Этил 2-(3-бромфенокси)-2-метилпропаноат
3-бромфенол (1 г, 5,78 ммоль), этил 2-бром-2-метилпропаноат (1,24 г, 6,36 ммоль) и карбонат калия (1,598 г, 11,56 ммоль) растворяли в 10 мл DMF и перемешивали при комнатной температуре в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 42%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,13-6,92 (м, 3H), 6,79-6,67 (м, 1H), 4,24-4,13 (м, 2H), 1,71-1,43 (м, 6H), 1,25-1,15 (м, 3H)
Стадия 2: Этил 2-(3-(2-аминопиримидин-4-ил)фенокси)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 53 (стадия 1, стадия 2) и примеру получения 19 (стадия 3, стадия 4), применяя этил 2-(3-бромфенокси)-2-метилпропаноат (0,7 г, 2,56 ммоль), полученный на стадии 1. (выход на 4 стадии 34%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,39-8,25 (1H), 7,66-7,58 (м, 1H), 7,55-7,50 (м, 1H), 7,40-7,26 (м, 1H), 7,03-6,87 (2H), 5,01 (д, J=31,6 Гц, 2H), 4,34-4,16 (м, 2H), 1,62 (с, 6H), 1,28-1,19 (м, 3H)
Пример получения 69: Этил 2-(4-(2-аминопиримидин-4-ил)фенокси)-2-метилпропаноат
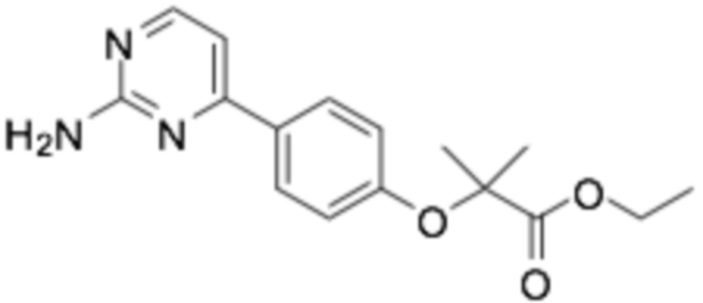
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 68, пример получения 53 (стадия 1, стадия 2) и пример получения 19 (стадия 3, стадия 4), применяя 4-бромфенол (1 г, 5,78 ммоль). (выход на 5 стадий 21%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,32-8,19 (м, 1H), 7,96-7,81 (м, 2H), 6,98-6,89 (м, 1H), 6,89-6,77 (м, 2H), 5,34 (с, 2H), 4,29-4,14 (м, 2H), 1,63-1,54 (м, 6H), 1,25-1,14 (м, 3H)
Пример получения 70: Метил 2-(3-(2-аминопиримидин-4-ил)фенил)ацетат
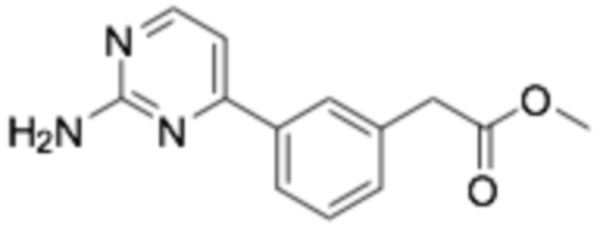
Стадия 1: Метил 2-(3-бромфенил)ацетат
2-(3-Бромфенил)уксусную кислоту (2 г, 9,30 ммоль) и 2,79 мл серной кислоты растворяли в 18,6 мл метанола и перемешивали при 80°C в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 96%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,46-7,38 (м, 1H), 7,38-7,26 (м, 1H), 7,26-7,02 (м, 2H), 3,71-3,59 (м, 3H), 3,59-3,48 (м, 2H)
Стадия 2: Метил 2-(3-(2-аминопиримидин-4-ил)фенил)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 53 (стадия 1, стадия 2) и примеру получения 19 (стадия 3, стадия 4), применяя метил 2-(3-бромфенил)ацетат (2,042 г, 8,94 ммоль), полученный на стадии 1. (выход на 4 стадии 21%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,37-8,30 (м, 1H), 7,94 (д, J=14,6 Гц, 1H), 7,90-7,81 (м, 1H), 7,44-7,36 (м, 2H), 7,00 (т, J=5,7 Гц, 1H), 5,26 (т, J=43,7 Гц, 2H), 3,69 (с, 5H)
Пример получения 71: трет-бутил 3-(4-(2-аминопиридин-4-ил)фенил)-2,2-диметилпропаноат
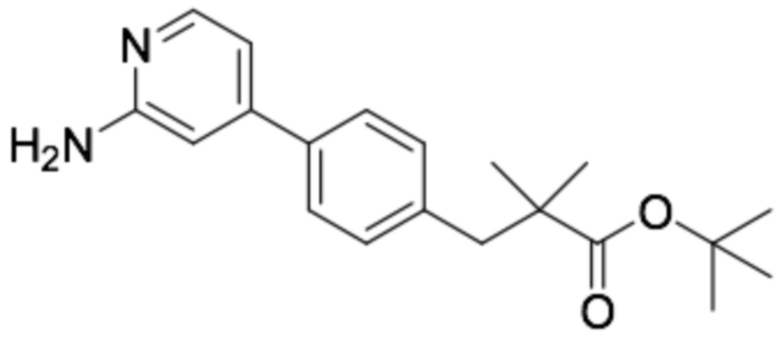
Стадия 1: трет- бутил 2,2-диметил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат
Требуемый продукт получали способом, аналогичным примеру получения 58 (стадия 1, стадия 2), применяя 1-бром-4-(бромметил)бензол (2,00 г, 8,00 ммоль) и трет-бутилизобутират (1,39 г, 9,60 ммоль). (выход на 2 стадии 64%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,70 (д, J=7,6 Гц, 2H), 7,16 (д, J=7,9 Гц, 2H), 2,84 (с, 2H), 1,43 (с, 9H), 1,34 (с, 12H), 1,11 (с, 6H)
Стадия 2: трет- бутил 3-(4-(2-аминопиридин-4-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52, применяя 4-бромпиридин-2-амин (106 мг, 0,611 ммоль) и трет-бутил 2,2-диметил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (220 мг, 0,611 ммоль), полученный на стадии 1. (выход 86%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,11 (д, J=5,2 Гц, 1H), 7,49 (д, J=7,6 Гц, 2H), 7,24 (д, J=7,6 Гц, 2H), 6,88 (д, J=5,2 Гц, 1H), 6,70 (с, 1H), 4,46 (с, 2H), 2,87 (с, 2H), 1,52-1,36 (м, 9H), 1,21-1,07 (м, 6H)
Пример получения 72: Этил 6-(2-аминопиримидин-4-ил)пиколинат
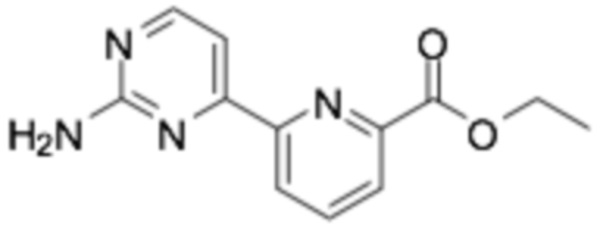
Стадия 1: Этил 6-(трибутилстаннил)пиколинат
Этил 6-бромпиколинат (300 мг, 1,304 ммоль) растворяли в толуоле, и добавляли бис(трибутилолово) (791 мкл, 1,57 ммоль) и ацетат калия (384 мг, 3,91 ммоль). После удаления растворенного кислорода из реакционной смеси, ее заполняли азотом, и блокировали приток внешнего воздуха. Добавляли дихлорметановый комплекс дихлорида 1,1'-бис(дифенилфосфино)ферроценпалладия (II) (53,2 мг, 0,065 ммоль) и реагировали при 90°C в течение 18 часов. После завершения реакции, ее фильтровали через целит и концентрировали при пониженном давлении, и смесь непосредственно применяли в следующей реакции.
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,90 (дд, J=7,8, 1,4 Гц, 1H), 7,59 (т, J=7,5 Гц, 1H), 7,51 (дд, J=7,3, 1,4 Гц, 1H), 4,42 (кв, J=7,2 Гц, 2H), 1,68-1,45 (м, 9H), 1,41 (т, J=7,1 Гц, 3H), 1,33 (тд, J=14,8, 7,5 Гц, 6H), 1,25-1,02 (м, 6H), 0,88 (кв, J=7,3 Гц, 10H)
Стадия 2: Этил 6-(2-хлорпиримидин-4-ил)пиколинат
Этил 6-(трибутилстаннил)пиколинат, полученный на стадии 1, растворяли в толуоле и добавляли 2,4-дихлорпиримидин (18,6 мг, 0,125 ммоль) и карбонат натрия (39,7 мг, 0,375 ммоль). После удаления растворенного кислорода из реакционной смеси, ее заполняли азотом и блокировали приток внешнего воздуха. Добавляли (трифенилфосфин)палладий (0) (14,4 мг, 0,012 ммоль), устройство для охлаждения обратным холодильником присоединяли при 130°C и нагревали в течение 12 часов. После завершения реакции, ее фильтровали через целит и концентрировали при пониженном давлении, и смесь очищали колоночной хроматографией (гексан : этилацетат), получая требуемое соединение. (выход 49%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,76 (д, J=5,0 Гц, 1H), 8,66 (дд, J=7,8, 0,9 Гц, 1H), 8,47 (д, J=5,0 Гц, 1H), 8,23 (дд, J=7,5, 1,1 Гц, 1H), 8,02 (т, J=7,8 Гц, 1H), 4,58-4,40 (2H), 1,46 (т, J=7,1 Гц, 3H)
Стадия 3: Этил 6-(2-аминопиримидин-4-ил)пиколинат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя этил 6-(2-хлорпиримидин-4-ил)пиколинат (76 мг, 0,288 ммоль), полученный на стадии 2. (выход на 2 стадии 24%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,52 (дд, J=7,8, 0,9 Гц, 1H), 8,46 (д, J=5,0 Гц, 1H), 8,17 (дд, J=7,8, 0,9 Гц, 1H), 7,96 (т, J=7,8 Гц, 1H), 7,81 (д, J=5,0 Гц, 1H), 5,19 (с, 2H), 4,48 (кв, J=7,2 Гц, 2H), 1,46 (т, J=7,1 Гц, 3H)
Пример получения 73: трет-бутил (6-бромпиридин-2-ил)карбамат
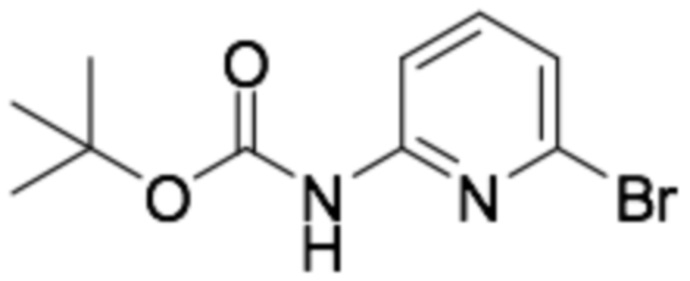
6-Бромпиридин-2-амин (15,0 г, 87,0 ммоль) и 1,3 M гексаметилдисилазид лития (147 мл, 191 ммоль) растворяли в THF 93 мл, и ди-трет-бутилдикарбоната (21,9 мл, 95,0 ммоль), который разбавляли в 100 мл THF при -78°C при продувке азотом, добавляли по каплям. После перемешивания при комнатной температуре в течение ночи, органический растворитель удаляли при пониженном давлении, разбавляли этилацетатом, промывали 1 N водным раствором хлористоводородной кислоты, сушили над сульфатом магния, и очищали колонкой с силикагелем (этилацетат : гексан), получая требуемый продукт. (выход 98%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,88 (д, J=8,2 Гц, 1H), 7,50 (т, J=7,9 Гц, 1H), 7,24-7,16 (1H), 7,12 (д, J=7,6 Гц, 1H), 1,52-1,50 (9H)
Пример получения 74: Метил 2-(4-(2-аминопиримидин-4-ил)фенил)ацетат
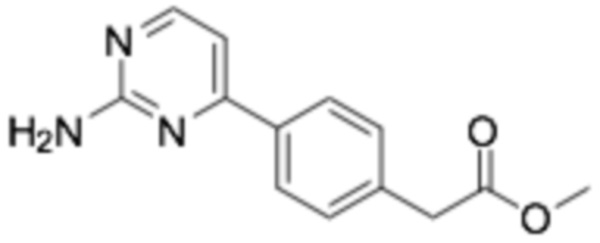
Стадия 1: Метил 2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)ацетат
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 53, применяя метил 2-(4-бромфенил)ацетат (2,07 г, 9,04 ммоль). (выход 96%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,76 (дд, J=23,1, 15,3 Гц, 2H), 7,34-7,26 (м, 2H), 3,67 (с, 3H), 3,61 (т, J=7,5 Гц, 2H), 1,43-1,29 (м, 12H)
Стадия 2: Метил 2-(4-(2-хлорпиримидин-4-ил)фенил)ацетат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 53, применяя метил 2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)ацетат (2,4 г, 8,69 ммоль), полученный на стадии 1. (выход 14%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,62 (д, J=5,5 Гц, 1H), 8,13-7,97 (м, 2H), 7,62 (д, J=5,0 Гц, 1H), 7,43 (д, J=8,2 Гц, 2H), 3,71 (дд, J=15,8, 14,4 Гц, 5H)
Стадия 3: Метил 2-(4-(2-аминопиримидин-4-ил)фенил)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя метил 2-(4-(2-хлорпиримидин-4-ил)фенил)ацетат (0,32 г, 1,218 ммоль), полученный на стадии 2. (выход на 2 стадии 28%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,63 (кв, J=2,6 Гц, 1H), 8,04-7,96 (м, 2H), 7,79 (д, J=13,3 Гц, 1H), 7,39 (д, J=8,2 Гц, 2H), 7,36-7,29 (м, 2H), 3,69 (с, 3H), 3,68 (с, 2H)
Пример получения 75: Метил 2-(4-(6-амино-3-(трифторметил)пиридин-2-ил)фенил)-2-метилпропаноат
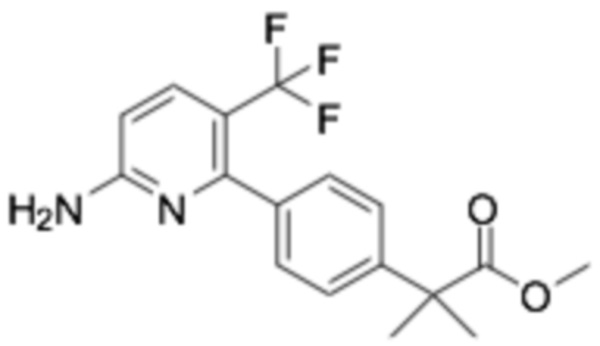
Стадия 1: Метил 2-(4-(6-хлор-3-(трифторметил)пиридин-2-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 53, применяя метил 2-метил-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (0,5 г, 1,644 ммоль), полученный на стадии 1 примера получения 54, и 2,6-дихлор-3-(трифторметил)пиридин (0,426 г, 1,972 ммоль). (выход 78%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,08-8,01 (м, 1H), 7,99 (дт, J=8,7, 2,1 Гц, 2H), 7,72 (д, J=8,2 Гц, 1H), 7,48-7,41 (м, 2H), 3,66 (с, 3H), 1,66-1,61 (м, 6H)
Стадия 2: Метил 2-(4-(6-амино-3-(трифторметил)пиридин-2-ил)фенил)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя метил 2-(4-(6-хлор-5-(трифторметил)пиридин-2-ил)фенил)-2-метилпропаноат (0,46 г, 1,286 ммоль), полученный на стадии 1. (выход на 2 стадии 41%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,90 (д, J=8,7 Гц, 2H), 7,74 (д, J=8,2 Гц, 1H), 7,41 (дд, J=21,5, 12,8 Гц, 2H), 7,17-7,03 (м, 1H), 5,05 (д, J=43,0 Гц, 2H), 3,72-3,56 (м, 3H), 1,62 (д, J=15,1 Гц, 6H)
Пример получения 76: Метил 3-(4-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат
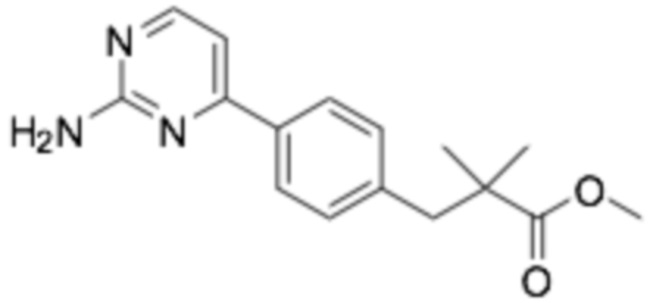
Стадия 1: трет- бутил 3-(4-(2-(( трет- бутоксикарбонил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52 и стадии 3 примера получения 19, применяя 2,4-дихлорпиримидин (4,30 г, 28,9 ммоль) и трет-бутил 2,2-диметил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (10,4 г, 28,9 ммоль), полученный на стадии 1 примера получения 71. (выход на 2 стадии 9%)
m/z (M+H)+ рассчитанная для C24H34N3O4: 428, найденная 428
Стадия 2: Метил 3-(4-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат
Трет-бутил 3-(4-(2-((трет-бутоксикарбонил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропаноат (1,63 г, 3,81 ммоль), полученный на стадии 1, растворяли в 63,5 мл метанола, и медленно добавляли по каплям серную кислоту (1,02 мл, 19,1 ммоль). Ее перемешивали при кипячении с обратным холодильником при 100°C в течение 2 часов, охлаждали, и промывали раствором гидрокарбоната натрия. Органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан). (выход 73%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,33 (д, J=5,0 Гц, 1H), 7,98-7,82 (м, 2H), 7,21 (д, J=8,2 Гц, 2H), 7,02 (д, J=5,5 Гц, 1H), 5,03 (с, 2H), 3,67 (с, 3H), 2,92 (с, 2H), 1,20 (с, 6H)
Пример получения 77: трет-бутил 3-(4-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат
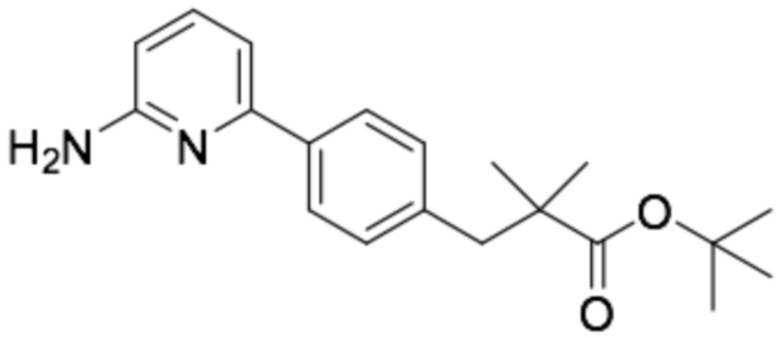
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52, применяя 6-хлорпиридин-2-амин (143 мг, 1,11 ммоль) и трет-бутил 2,2-диметил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (500 мг, 1,39 ммоль), полученный на стадии 1 примера получения 71. (выход 40%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,82 (д, J=8,7 Гц, 2H), 7,49 (т, J=7,8 Гц, 1H), 7,23 (д, J=6,4 Гц, 2H), 7,15-6,99 (1H), 6,44 (д, J=7,8 Гц, 1H), 4,46 (с, 2H), 2,87 (с, 2H), 1,45 (с, 9H), 1,13 (с, 6H)
Пример получения 78: Метил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат
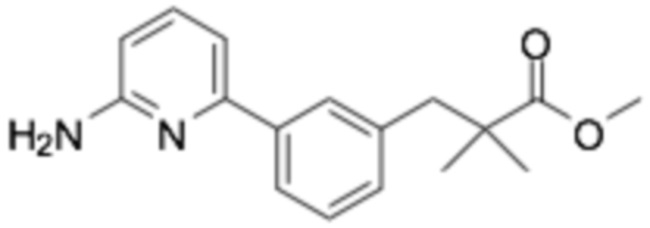
Стадия 1: Метил 3-(3-(6-(( трет- бутоксикарбонил)амино)пиридин-2-ил)-фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52, применяя трет-бутил (6-бромпиридин-2-ил)карбамат (17,3 г, 63,5 ммоль), полученный в примере получения 73, и метил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (20,2 г, 63,5 ммоль), полученный на стадии 2 примера получения 58. (выход 66%).
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,85 (д, J=8,2 Гц, 1H), 7,79 (д, J=7,8 Гц, 1H), 7,75-7,67 (м, 2H), 7,35 (кв, J=7,8 Гц, 2H), 7,14 (д, J=7,3 Гц, 1H), 3,66 (с, 3H), 2,93 (с, 2H), 1,54 (с, 9H), 1,22 (с, 6H)
Стадия 2: Метил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 4 примера получения 19, применяя метил 3-(3-(6-((трет-бутоксикарбонил)амино)пиридин-2-ил)-фенил)-2,2-диметилпропаноат (16,2 г, 42,1 ммоль), полученный на стадии 1. (выход 86%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,78 (д, J=7,8 Гц, 1H), 7,67 (с, 1H), 7,57-7,40 (м, 1H), 7,32 (т, J=7,8 Гц, 1H), 7,11 (д, J=7,3 Гц, 1H), 7,08-6,99 (м, 1H), 6,53-6,37 (м, 1H), 4,45 (с, 2H), 3,67 (с, 3H), 3,00-2,85 (2H), 1,21 (с, 6H)
Пример получения 79: трет-бутил 3-(3-(2-хлор-5-фторпиримидин-4-ил)фенил)-2,2-диметилпропаноат
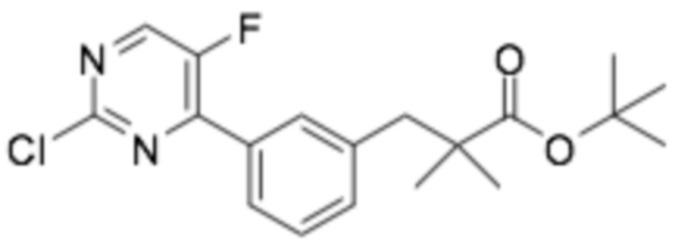
Стадия 1: трет- бутил 3-(3-бромфенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 1 примера получения 58, применяя 1-бром-3-(бромметил)бензол (5 г, 20,01 ммоль) и трет-бутил изобутират (4,00 мл, 24,01 ммоль). (выход 70%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,40-7,27 (м, 2H), 7,11 (т, J=7,3 Гц, 1H), 7,08-6,99 (м, 1H), 2,84-2,70 (2H), 1,43 (с, 9H), 1,12 (с, 6H)
Стадия 2: трет- бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 58, применяя трет-бутил 3-(3-бромфенил)-2,2-диметилпропаноат (4,38 г, 13,98 ммоль), полученный на стадии 1. (выход 72%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,69-7,54 (2H), 7,23 (д, J=1,4 Гц, 2H), 2,82 (с, 2H), 1,55 (д, J=1,4 Гц, 2H), 1,43 (с, 9H), 1,31 (с, 12H), 1,12 (с, 6H)
Стадия 3: трет- бутил 3-(3-(2-хлор-5-фторпиримидин-4-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 52, применяя трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (500 мг, 1,39 ммоль), полученный на стадии 2. (выход 46%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,49 (д, J=3,2 Гц, 1H), 8,00-7,88 (м, 2H), 7,49-7,31 (м, 2H), 2,92 (с, 2H), 1,43 (с, 9H), 1,15 (с, 6H)
Пример получения 80: трет-бутил 3-(3-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат
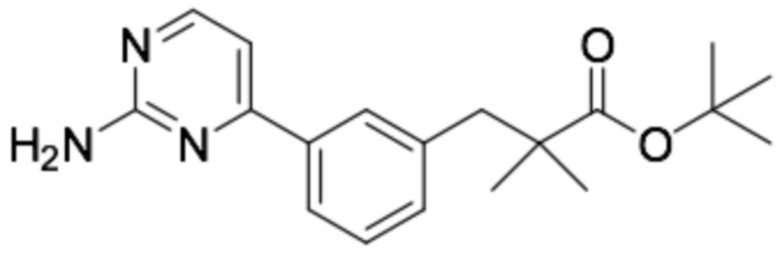
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52 и примера получения 19 (стадия 3, стадия 4), применяя 2,4-дихлорпиримидин (0,620 г, 4,16 ммоль) и трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (1,50 г, 4,16 ммоль), полученный на стадии 2 примера получения 79. (выход на 3 стадии 49%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,34 (с, 1H), 7,83 (д, J=8,8 Гц, 2H), 7,36 (с, 1H), 7,28 (с, 1H), 7,03 (с, 1H), 5,02 (с, 2H), 2,91 (с, 2H), 1,43 (с, 9H), 1,16 (с, 6H)
Пример получения 81: трет-бутил 3-(4-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат
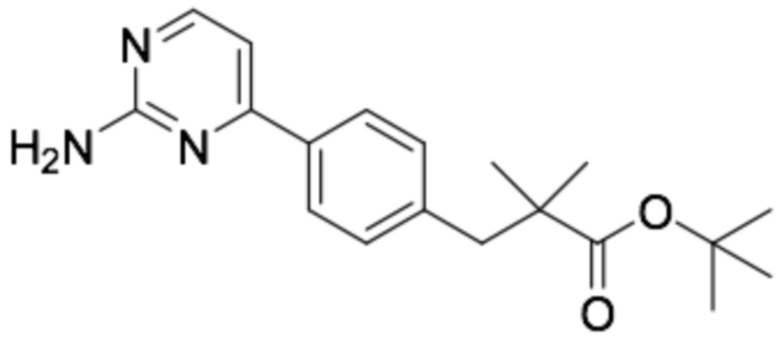
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52 и примера получения 19 (стадия 3, стадия 4), применяя 2,4-дихлорпиримидин (182 мг, 1,22 ммоль) и трет-бутил 2,2-диметил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (440 мг, 1,22 ммоль), полученный на стадии 1 примера получения 71. (выход на 3 стадии 19%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,33 (д, J=5,5 Гц, 1H), 7,98-7,82 (м, 2H), 7,28 (с, 2H), 7,03 (д, J=5,5 Гц, 1H), 5,04 (с, 2H), 2,88 (д, J=9,1 Гц, 2H), 1,44 (с, 9H), 1,14 (с, 6H)
Пример получения 82: трет-бутил 3-(3-(6-аминопиразин-2-ил)фенил)-2,2-диметилпропаноат
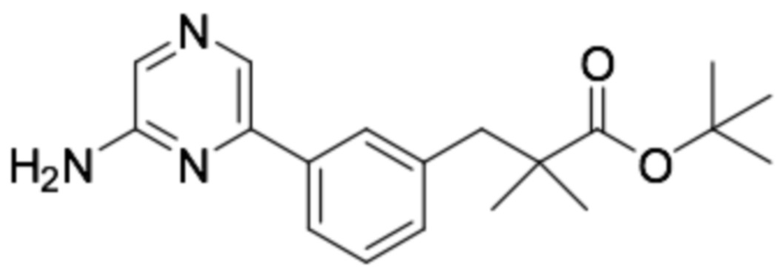
Стадия 1: трет- бутил 3-(3-(6-хлорпиразин-2-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52, применяя 2,6-дихлорпиразин (124 мг, 0,833 ммоль) и трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (300 мг, 0,833 ммоль), полученный на стадии 2 примера получения 79. (выход 52%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,90 (с, 1H), 8,50 (с, 1H), 7,93-7,78 (м, 2H), 7,49-7,34 (м, 1H), 7,30 (д, J=7,3 Гц, 1H), 2,93 (с, 2H), 1,45 (с, 9H), 1,24-1,10 (6H)
Стадия 2: трет- бутил 3-(3-(6-аминопиразин-2-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя трет-бутил 3-(3-(6-хлорпиразин-2-ил)фенил)-2,2-диметилпропаноат (151 мг, 0,435 ммоль), полученный на стадии 1. (выход на 2 стадии 69%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,35 (с, 1H), 7,92 (с, 1H), 7,77 (т, J=7,3 Гц, 2H), 7,36 (т, J=7,8 Гц, 1H), 7,23 (д, J=7,8 Гц, 1H), 4,57 (с, 2H), 2,91 (с, 2H), 1,43 (с, 9H), 1,16 (с, 6H)
Пример получения 83: Метил 3-(3-(5-аминопиридин-3-ил)фенил)-2,2-диметилпропаноат
Стадия 1: трет- бутил 3-(3-(5-бромпиридин-3-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52, применяя 3,5-бромпиридин (197 мг, 0,833 ммоль) и трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (300 мг, 0,833 ммоль), полученный на стадии 2 примера получения 79. (выход 54%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,73 (д, J=1,8 Гц, 1H), 8,64 (д, J=2,3 Гц, 1H), 7,99 (т, J=2,1 Гц, 1H), 7,44-7,32 (м, 3H), 7,23 (д, J=6,9 Гц, 1H), 2,91 (с, 2H), 1,43 (с, 9H), 1,16 (с, 6H)
Стадия 2: Метил 3-(3-(5-аминопиридин-3-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 3 примера получения 19 и стадии 2 примера получения 76, применяя трет-бутил 3-(3-(5-бромпиридин-3-ил)фенил)-2,2-диметилпропаноат (176 мг, 0,451 ммоль), полученный на стадии 1. (выход на 2 стадии 13%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,23 (д, J=1,8 Гц, 1H), 8,14-8,00 (1H), 7,40 (дд, J=7,8, 1,4 Гц, 1H), 7,34 (т, J=7,5 Гц, 1H), 7,28 (с, 1H), 7,12 (кв, J=2,3 Гц, 2H), 3,78 (с, 2H), 3,66 (с, 3H), 2,92 (с, 2H), 1,22 (с, 6H)
Пример получения 84: трет-бутил 3-(3-(6-амино-4-(трифторметил)пиридин-2-ил)фенил)-2,2-диметилпропаноат
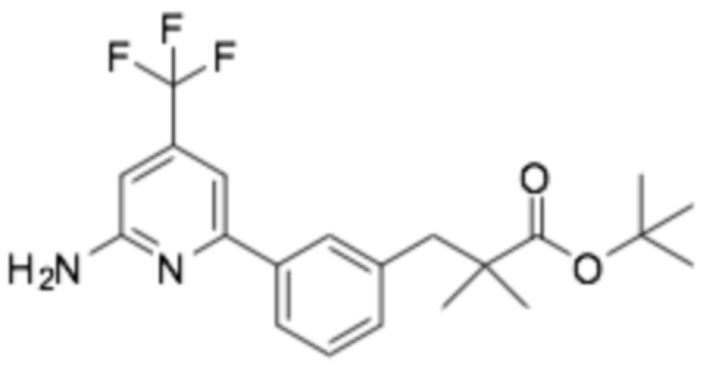
Стадия 1: трет- бутил 3-(3-(6-хлор-4-(трифторметил)пиридин-2-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52, применяя 2,6-дихлор-4-(трифторметил)пиридин (0,115 мл, 0,799 ммоль) и трет-бутил 2,2-диметил-3-(3-(4, 4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (288 мг, 0,799 ммоль), полученный на стадии 2 примера получения 79. (выход 66%).
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,87 (д, J=8,7 Гц, 2H), 7,81 (с, 1H), 7,46 (с, 1H), 7,40 (т, J=7,5 Гц, 1H), 7,28 (д, J=7,8 Гц, 1H), 2,94 (с, 2H), 1,45 (с, 9H), 1,17 (с, 6H)
Стадия 2: трет- бутил 3-(3-(6-амино-4-(трифторметил)пиридин-2-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя трет-бутил 3-(3-(6-хлор-4-(трифторметил)пиридин-2-ил)фенил)-2,2-диметилпропаноат (218 мг, 0,527 ммоль), полученный на стадии 1. (выход на 2 стадии 63%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,79 (дд, J=7,8, 1,4 Гц, 1H), 7,75 (с, 1H), 7,35 (т, J=7,5 Гц, 1H), 7,22 (д, J=8,2 Гц, 2H), 6,62 (с, 1H), 4,74 (с, 2H), 2,91 (с, 2H), 1,44 (с, 9H), 1,16 (с, 6H)
Пример получения 85: трет-бутил 3-(3-(6-амино-5-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат
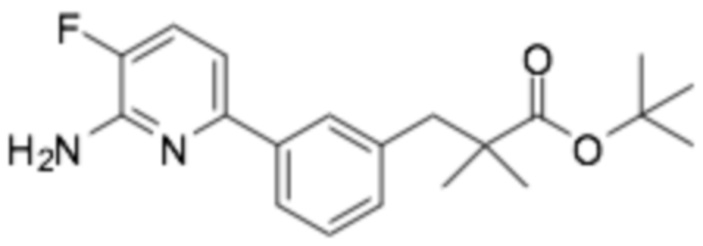
Стадия 1: трет- бутил 3-(3-(6-хлор-5-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали тем же способом, как на стадии 2 примера получения 52, применяя трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (500 мг, 1,39 ммоль), полученный на стадии 2 примера получения 79, и 2,6-дихлор-3-фторпиридин (230 мг, 1,39 ммоль). (выход 10%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,79 (д, J=8,5 Гц, 2H), 7,66 (дд, J=8,4, 3,2 Гц, 1H), 7,60-7,46 (1H), 7,38 (т, J=7,5 Гц, 1H), 7,27-7,18 (1H), 2,94 (с, 2H), 1,45 (д, J=9,8 Гц, 9H), 1,19 (с, 6H)
Стадия 2: трет- бутил 3-(3-(6-амино-5-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя трет-бутил 3-(3-(6-хлор-5-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат (500 мг, 1,39 ммоль), полученный на стадии 1. (выход на 2 стадии 49%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,74 (д, J=7,6 Гц, 1H), 7,70 (с, 1H), 7,34 (т, J=7,8 Гц, 1H), 7,32-7,25 (м, 1H), 7,19 (д, J=7,6 Гц, 1H), 7,04 (дд, J=7,9, 3,1 Гц, 1H), 4,83 (с, 2H), 2,92 (д, J=6,7 Гц, 2H), 1,49-1,41 (м, 9H), 1,18 (с, 6H)
Пример получения 86: трет-бутил 3-(3-(2-амино-5-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат
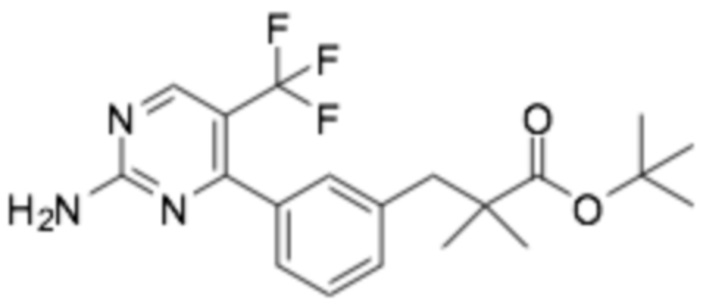
Стадия 1: трет- бутил 3-(3-(2-хлор-5-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали тем же способом, как на стадии 2 примера получения 52, применяя трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилпропаноат (500 мг, 1,39 ммоль), полученный на стадии 2 примера получения 79, и 2,6-дихлор-5-(трифторметил)пиримидин (301 мг, 1,39 ммоль). (выход 13%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,79 (д, J=8,5 Гц, 2H), 7,66 (дд, J=8,4, 3,2 Гц, 1H), 7,60-7,46 (1H), 7,38 (т, J=7,5 Гц, 1H), 7,27-7,18 (1H), 2,94 (с, 2H), 1,45 (д, J=9,8 Гц, 9H), 1,19 (с, 6H)
Стадия 2: трет- бутил 3-(3-(2-амино-5-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали тем же способом, как в примере получения 19 (стадия 3, стадия 4), применяя трет-бутил 3-(3-(2-хлор-5-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат (232 мг, 0,64 ммоль), полученный на стадии 1. (выход на 2 стадии 43%)
m/z (M+H)+ рассчитанная для C20H25F3N3O2: 396, найденная 396
Пример получения 87: трет-бутил 3-(3-(6-амино-3-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат
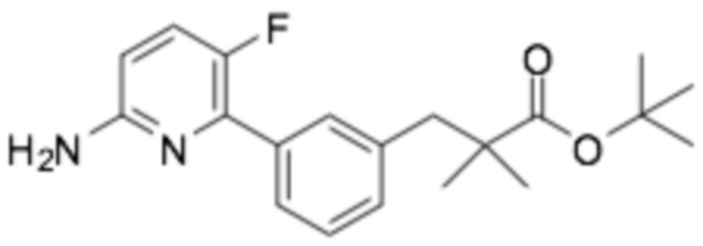
Стадия 1: трет- бутил 3-(3-(6-хлор-3-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали тем же способом, как на стадии 2 примера получения 52, применяя трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (500 мг, 1,39 ммоль), полученный на стадии 2 примера получения 79, и 2,6-дихлор-3-фторпиридин (230 мг, 1,39 ммоль). (выход 68%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,81 (дд, J=7,9, 1,5 Гц, 1H), 7,78 (д, J=1,8 Гц, 1H), 7,44 (дд, J=10,1, 8,2 Гц, 1H), 7,36 (т, J=7,8 Гц, 1H), 7,24 (д, J=2,7 Гц, 1H), 7,22 (д, J=3,2 Гц, 0H), 2,91 (с, 2H), 1,46-1,33 (м, 9H), 1,16 (д, J=8,2 Гц, 6H)
Стадия 2: трет- бутил 3-(3-(6-амино-3-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя трет-бутил 3-(3-(6-хлор-3-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат (192 мг, 0,53 ммоль), полученный на стадии 1. (выход на 2 стадии 12%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,85 (д, J=7,6 Гц, 1H), 7,82 (с, 1H), 7,57 (д, J=8,5 Гц, 1H), 7,46 (т, J=9,6 Гц, 1H), 7,41 (т, J=7,6 Гц, 2H), 7,26 (с, 1H), 2,96 (с, 2H), 1,50-1,43 (м, 11H), 1,22 (д, J=8,5 Гц, 6H)
Пример получения 88: Этил 2-(3-(6-аминопиридин-2-ил)фенокси)-2-метилпропаноат
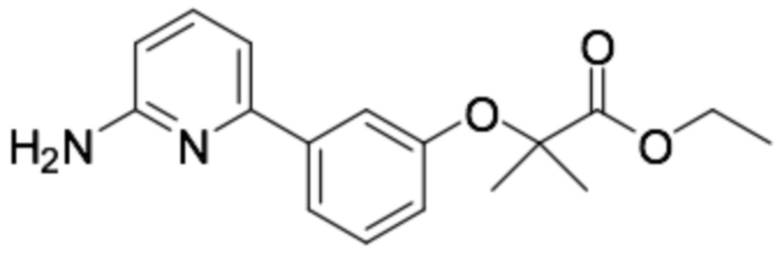
Стадия 1: Этил 2-(3-бромфенокси)-2-метилпропаноат
3-Бромфенол (2,00 г, 11,6 ммоль), этил 2-бром-2-метилпропаноат (2,48 г, 12,7 ммоль) и карбонат калия (3,20 г, 23,1 ммоль) растворяли в 23,1 мл DMF и перемешивали при комнатной температуре в течение ночи. После экстракции этилацетатом, органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан). (выход 42%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,16-7,05 (м, 2H), 7,03 (т, J=2,1 Гц, 1H), 6,76 (тд, J=4,6, 2,6 Гц, 1H), 4,24 (кв, J=7,0 Гц, 2H), 1,59 (с, 6H), 1,25 (т, J=7,1 Гц, 3H)
Стадия 2: этил 2-метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пропаноат
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 52, применяя этил 2-(3-бромфенокси)-2-метилпропаноат (1,39 г, 4,84 ммоль), полученный на стадии 1. (выход 80%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,43 (д, J=7,3 Гц, 1H), 7,30 (д, J=2,7 Гц, 1H), 7,23 (д, J=7,8 Гц, 1H), 6,94 (дкв, J=8,2, 1,2 Гц, 1H), 4,25 (кв, J=7,2 Гц, 2H), 1,58 (с, 6H), 1,32 (с, 12H), 1,27-1,25 (3H)
Стадия 3: Этил 2-(3-(6-аминопиридин-2-ил)фенокси)-2-метилпропаноат
Требуемый продукт получали способом, аналогичным примеру получения 78 (стадия 1, стадия 2), применяя трет-бутил (6-бромпиридин-2-ил)карбамат (1,06 г, 3,89 ммоль), полученный в примере получения 73, и этил 2-метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пропаноат (1,30 г, 3,89 ммоль), полученный на стадии 2. (выход на 2 стадии 53%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,57 (д, J=7,8 Гц, 1H), 7,53-7,40 (2H), 7,29 (т, J=7,8 Гц, 1H), 7,04 (д, J=7,3 Гц, 1H), 6,92-6,77 (м, 1H), 6,45 (д, J=8,2 Гц, 1H), 4,45 (с, 2H), 4,25 (кв, J=7,2 Гц, 2H), 1,62 (с, 6H), 1,25 (т, J=7,1 Гц, 3H)
Пример получения 89: трет-бутил 3-(3-(6-аминопиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат
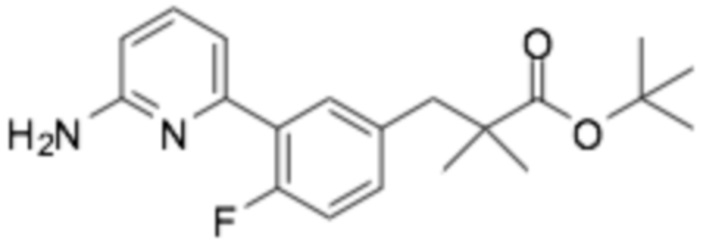
Стадия 1: трет- бутил 3-(3-бром-4-фторфенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 1 примера получения 58, применяя 2-бром-4-(бромметил)-1-фторбензол (5 г, 18,66 ммоль) и трет-бутил изобутират (3,73 мл, 22,39 ммоль). (выход 79%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,35 (дд, J=6,6, 2,1 Гц, 1H), 7,12-7,02 (1H), 6,98 (т, J=8,5 Гц, 1H), 2,75 (с, 2H), 1,47-1,34 (9H), 1,11 (с, 6H)
Стадия 2: трет- бутил 3-(4-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 58, применяя трет-бутил 3-(3-бром-4-фторфенил)-2,2-диметилпропаноат (4,86 г, 14,67 ммоль), полученный на стадии 1. (выход 58%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,52 (кв, J=2,7 Гц, 1H), 7,22-7,10 (м, 1H), 6,90 (т, J=8,7 Гц, 1H), 2,78 (с, 2H), 1,42 (д, J=6,4 Гц, 10H), 1,31 (д, J=15,1 Гц, 13H), 1,11 (д, J=4,1 Гц, 6H)
Стадия 3: трет- бутил 3-(3-(6-аминопиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 52, применяя трет-бутил 3-(4-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-2,2-диметилпропаноат (500 мг, 1,32 ммоль), полученный на стадии 2 и 6-хлорпиридин-2-амин (170 мг, 1,32 ммоль). (выход 76%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,78 (д, J=7,3 Гц, 1H), 7,74-7,60 (м, 1H), 7,07 (дд, J=11,2, 8,5 Гц, 2H), 6,71 (д, J=8,7 Гц, 1H), 2,98-2,89 (2H), 1,42 (с, 11H), 1,15 (с, 6H)
Пример получения 90: Метил 3-(3-(4-аминопиримидин-2-ил)фенил)-2,2-диметилпропаноат
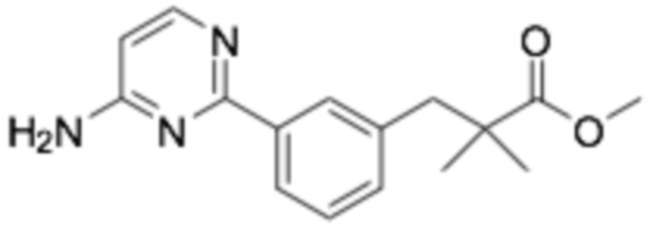
Стадия 1: трет- бутил (2-хлорпиримидин-4-ил)карбамат
2-Хлорпиримидин-4-амин (15,0 г, 116 ммоль) и ди-трет-бутилдикарбоната (31,9 мл, 139 ммоль) растворяли в 257 мл безводного DCM, и затем добавляли 4-диметиламинопиридин (2,83 г, 23,2 ммоль) и перемешивали при комнатной температуре в течение ночи. После удаления органический растворитель, ее очищали колонкой с силикагелем (DCM), получая требуемый продукт. (выход 5%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,42 (д, J=5,8 Гц, 1H), 7,86 (д, J=5,8 Гц, 1H), 7,35 (с, 1H), 1,53 (с, 9H)
Стадия 2: Метил 3-(3-(4-аминопиримидин-2-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52 и стадии 4 примера получения 19, применяя трет-бутил (2-хлорпиримидин-4-ил)карбамат (361 мг, 1,57 ммоль), полученный на стадии 1, и метил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (500 мг, 1,57 ммоль), полученный на стадии 2 примера получения 58. (выход на 2 стадии 14%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,34 (д, J=4,1 Гц, 1H), 8,26 (д, J=6,9 Гц, 1H), 8,16 (с, 1H), 7,44-7,35 (м, 1H), 7,20 (с, 1H), 6,46 (с, 1H), 5,30 (с, 2H), 3,68 (с, 3H), 2,96 (с, 2H), 1,22 (с, 6H)
Пример получения 91: трет-бутил 3-(3-(6-амино-3-метилпиридин-2-ил)фенил)-2,2-диметилпропаноат
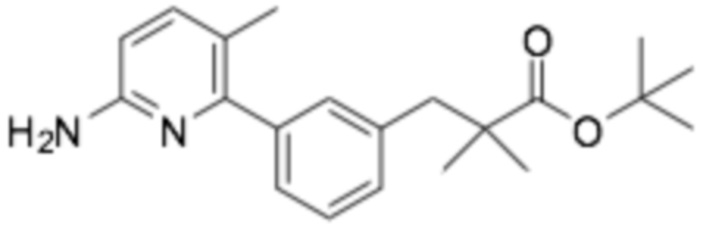
Стадия 1: трет- бутил 3-(3-(6-хлор-3-метилпиридин-2-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали тем же способом, как на стадии 2 примера получения 52, применяя трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (289 мг, 0,80 ммоль), полученный на стадии 2 примера получения 79, и 2,6-дихлор-3-метилпиридин (260 мг, 1,61 ммоль). (выход 16%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,51 (д, J=8,2 Гц, 1H), 7,42-7,26 (м, 3H), 7,18 (дд, J=7,5, 2,5 Гц, 2H), 2,87 (с, 2H), 2,30 (с, 3H), 1,40 (с, 9H), 1,12 (д, J=5,5 Гц, 6H)
Стадия 2: трет- бутил 3-(3-(6-амино-3-метилпиридин-2-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя трет-бутил 3-(3-(6-хлор-3-метилпиридин-2-ил)фенил)-2,2-диметилпропаноат (47 мг, 0,13 ммоль), полученный на стадии 1. (выход на 2 стадии 54%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,39 (дд, J=8,2, 2,7 Гц, 1H), 7,36-7,29 (м, 2H), 7,19 (д, J=6,1 Гц, 1H), 6,56-6,40 (м, 1H), 4,70 (с, 2H), 2,90 (с, 2H), 2,20 (с, 3H), 1,46 (д, J=13,4 Гц, 9H), 1,24-1,08 (м, 6H)
Пример получения 92: Этил 2-(3-(6-аминопиридин-2-ил)-4-фторфенокси)-2-метилпропаноат
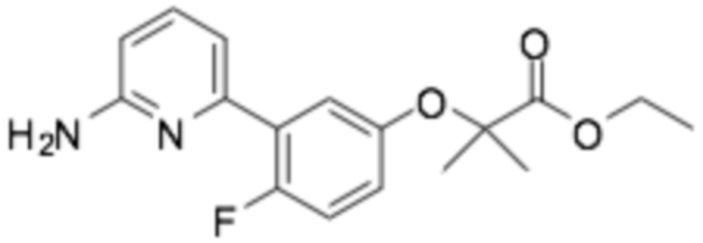
Стадия 1: Этил 2-(3-бром-4-фторфенокси)-2-метилпропаноат
3-Бром-4-фторфенол (2 г, 10,47 ммоль) растворяли в DMF, добавляли этил 2-бром-2-метилпропаноат (2,25 г, 11,52 ммоль) и карбонат цезия (6,82 г, 20,94 ммоль), и перемешивали при комнатной температуре в течение 12 часов. После завершения реакции, добавляли воду, экстрагировали этилацетатом и промывали соляным раствором, удаляя избыток DMF. После удаления воды сульфатом магния и отгонкой при пониженном давлении, смесь очищали колоночной хроматографией (гексан : этилацетат), получая требуемое соединение. (выход 58%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,09 (кв, J=2,9 Гц, 1H), 6,98 (т, J=8,5 Гц, 1H), 6,86-6,70 (м, 1H), 4,23 (кв, J=7,0 Гц, 2H), 1,55 (с, 6H), 1,26 (т, J=7,1 Гц, 3H)
Стадия 2: Этил 2-(4-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)-2-метилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 1 примера получения 52, применяя этил 2-(3-бром-4-фторфенокси)-2-метилпропаноат (1,86 г, 6,10 ммоль), полученный на стадии 1. (выход 91%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,22 (дд, J=4,6, 3,2 Гц, 1H), 7,01-6,80 (2H), 4,23 (кв, J=7,2 Гц, 2H), 1,54 (с, 6H), 1,32 (с, 12H), 1,24 (д, J=7,8 Гц, 7H)
Стадия 3: Этил 2-(3-(6-аминопиридин-2-ил)-4-фторфенокси)-2-метилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 52, применяя этил 2-(4-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)-2-метилпропаноат (400 мг, 1,136 ммоль), полученный на стадии 2. (выход 59%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,57-7,39 (м, 2H), 7,10 (дд, J=7,5, 2,1 Гц, 1H), 6,98 (дд, J=10,5, 8,7 Гц, 1H), 6,90-6,75 (1H), 6,49 (д, J=8,2 Гц, 1H), 4,73 (с, 2H), 4,24 (кв, J=7,2 Гц, 2H), 1,65-1,43 (6H), 1,26 (т, J=7,1 Гц, 3H)
Пример получения 93: Метил 3-(3-(2-амино-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат
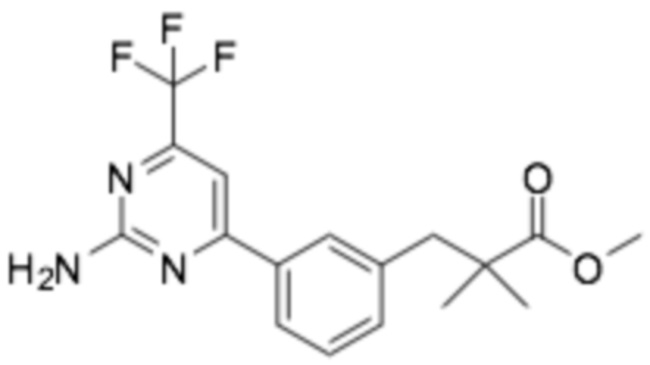
Стадия 1: Метил 3-(3-(2-хлор-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали тем же способом, как на стадии 2 примера получения 52, применяя метил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (1 г, 3,14 ммоль), полученный на стадии 2 примера получения 58, и 2,4-дихлор-6-(трифторметил)пиримидин (682 мг, 3,14 ммоль). (выход 63%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,95 (дд, J=7,8, 1,8 Гц, 1H), 7,93-7,83 (2H), 7,44 (т, J=7,5 Гц, 1H), 7,34 (д, J=7,8 Гц, 1H), 3,77-3,58 (м, 3H), 2,96 (с, 2H), 1,21 (д, J=5,9 Гц, 6H)
Стадия 2: Метил 3-(3-(2-амино-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя метил 3-(3-(2-хлор-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат (735 мг, 1,97 ммоль), полученный на стадии 1. (выход на 2 стадии 29%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,86 (д, J=7,8 Гц, 1H), 7,78 (д, J=6,9 Гц, 1H), 7,47-7,33 (м, 1H), 7,28 (с, 1H), 7,27 (с, 1H), 5,49 (с, 2H), 3,65 (д, J=6,4 Гц, 3H), 2,94 (с, 2H), 1,23 (кв, J=7,8 Гц, 6H)
Пример получения 94: трет-бутил 3-(3'-амино-[1,1'-бифенил]-4-ил)-2,2-диметилпропаноат
Стадия 1: трет- бутил 2,2-диметил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 71, применяя 1-бром-4-(бромметил)бензол (2 г, 8 ммоль). (выход на 2 стадии 77%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,70 (д, J=7,6 Гц, 2H), 7,16 (д, J=7,9 Гц, 2H), 2,84 (с, 2H), 1,43 (с, 9H), 1,34 (с, 12H), 1,11 (с, 6H)
Стадия 2: трет- бутил 2,2-диметил-3-(3'-нитро-[1,1'-бифенил]-4-ил)пропаноат
Трет-бутил 2,2-диметил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (0,15 г, 0,416 ммоль), полученный на стадии 1, 1-бром-3-нитробензол (0,084 г, 0,416 ммоль), дихлорметановый комплекс 1,1'-бис(дифенилфосфино)ферроцендихлорпалладия (II) (0,007 г, 8,33 мкмоль) и 0,555 мл 2N карбоната натрия растворяли в 1,4 мл диметиловом эфире этиленгликоля и перемешивали при 90°C в течение 15 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (60 мл), ее промывали соляным раствором (20 мл) и сушили над сульфатом магния, органический растворитель концентрировали при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1: 9). (выход 88%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,43 (д, J=1,8 Гц, 1H), 8,21-8,13 (м, 1H), 7,90 (т, J=7,3 Гц, 1H), 7,64-7,55 (м, 1H), 7,55-7,48 (м, 2H), 7,32-7,26 (м, 2H), 2,90 (д, J=15,1 Гц, 2H), 1,45 (с, 9H), 1,16 (с, 6H)
Стадия 3: трет- бутил 3-(3'-амино-[1,1'-бифенил]-4-ил)-2,2-диметилпропаноат
Трет-бутил 2,2-диметил-3-(3'-нитро-[1,1'-бифенил]-4-ил)пропаноат (0,255 г, 0,717 ммоль), полученный на стадии 2, растворяли в 2 мл метанола, добавляли Pd/C (3,82 мг, 0,036 ммоль), и затем реакцию восстановления проводили, применяя баллон с водородом. После подтверждения того, что реакция завершилась, ее фильтровали через целитный фильтр, и органический растворитель удаляли при пониженном давлении, получая требуемый продукт. (выход 73%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,53-7,44 (м, 2H), 7,28-7,17 (м, 3H), 7,05-6,96 (1H), 6,94-6,87 (м, 1H), 6,72-6,62 (м, 1H), 3,73 (с, 2H), 2,96-2,74 (м, 2H), 1,54-1,38 (9H), 1,26-1,12 (м, 6H)
Пример получения 95: Этил 2-(3-(4-аминопиримидин-2-ил)фенокси)-2-диметилпропаноат
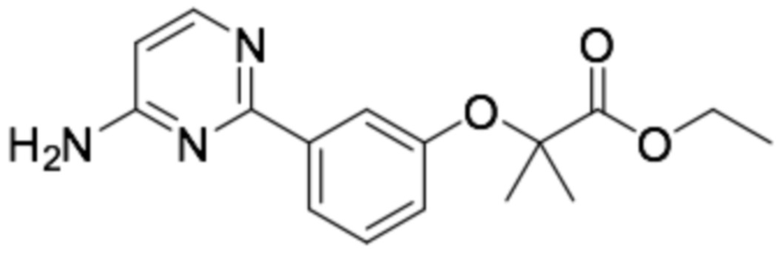
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52 и стадии 4 примера получения 19, применяя трет-бутил (2-хлорпиримидин-4-ил)карбамат (344 мг, 1,50 ммоль) полученный на стадии 1 примера получения 90, и этил 2-метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пропаноат (500 мг, 1,50 ммоль) полученный на стадии 2 примера получения 88. (выход на 2 стадии 22%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,33 (д, J=5,8 Гц, 1H), 8,01 (д, J=7,9 Гц, 1H), 7,92 (д, J=1,8 Гц, 1H), 7,33 (т, J=7,9 Гц, 1H), 6,96 (дд, J=8,1, 2,6 Гц, 1H), 6,34 (д, J=5,8 Гц, 1H), 4,90 (с, 2H), 4,27 (кв, J=7,1 Гц, 2H), 1,64 (с, 6H), 1,27 (т, J=7,0 Гц, 3H)
Пример получения 96: Метил 3-(4-(4-аминопиримидин-2-ил)фенил)-2,2-диметилпропаноат
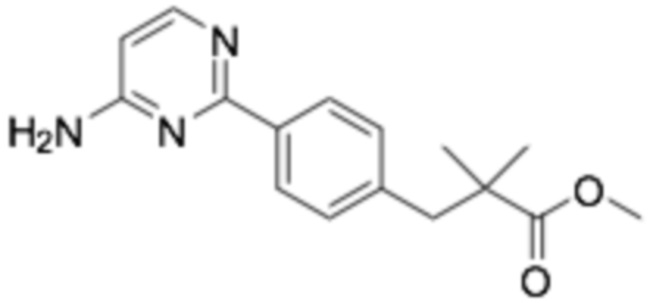
Стадия 1: Метил 2,2-диметил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат
Требуемый продукт получали способом, аналогичным примеру получения 58 (стадия 1, стадия 2), применяя 1-бром-4-(бромметил)бензол (30,0 г, 120 ммоль). (выход на 2 стадии 75%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,70 (д, J=8,2 Гц, 2H), 7,10 (д, J=7,8 Гц, 2H), 3,64 (с, 3H), 2,86 (с, 2H), 1,34 (с, 12H), 1,17 (с, 6H)
Стадия 2: Метил 3-(4-(4-аминопиримидин-2-ил)фенил)-2,2-диметилпропаноат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52 и стадии 4 примера получения 19, применяя трет-бутил (2-хлорпиримидин-4-ил)карбамат (578 мг, 2,51 ммоль) полученный на стадии 1 примера получения 90, и метил 2,2-диметил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (800 мг, 2,51 ммоль), полученный на стадии 1. (выход на 2 стадии 68%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,33 (д, J=5,9 Гц, 1H), 8,25 (д, J=8,2 Гц, 2H), 7,20 (д, J=8,2 Гц, 2H), 6,37 (д, J=5,9 Гц, 1H), 5,12 (с, 2H), 3,66 (с, 3H), 2,91 (с, 2H), 1,20 (с, 6H)
Пример получения 97: Этил 2-(4-(6-аминопиридин-2-ил)фенокси)-2-метилпропаноат
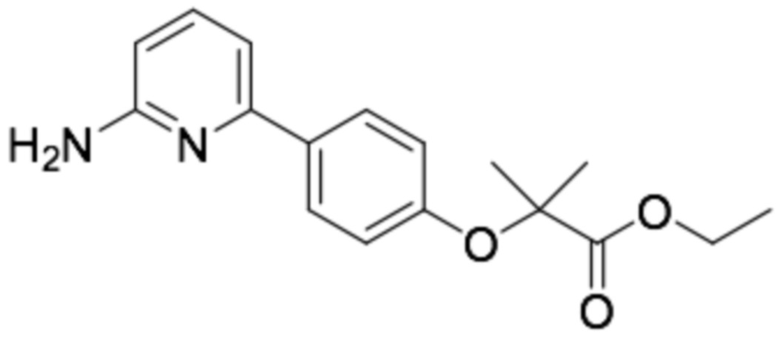
Требуемый продукт получали способом, аналогичным примеру получения 88, применяя 4-бромфенол (2,00 г, 11,6 ммоль). (выход на 4 стадии 24%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,82 (дт, J=9,6, 2,5 Гц, 2H), 7,55-7,38 (м, 1H), 7,10-6,96 (м, 1H), 6,89 (дт, J=9,5, 2,5 Гц, 2H), 6,49-6,33 (м, 1H), 4,44 (с, 2H), 4,24 (кв, J=7,0 Гц, 2H), 1,62 (с, 6H), 1,25 (т, J=7,3 Гц, 3H)
Пример получения 98: Этил 2-((4-(6-аминопиридин-2-ил)фенил)амино)-2-метилпропаноат
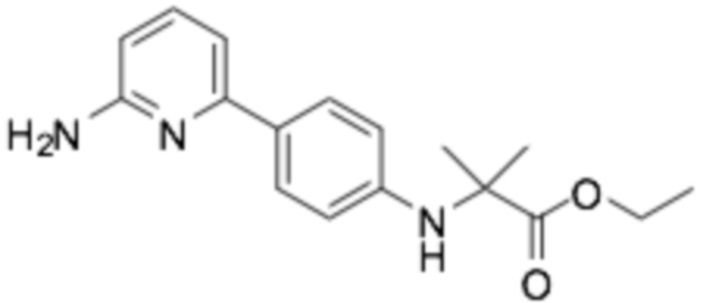
Стадия 1: Этил 2-((4-бромфенил)амино)-2-метилпропаноат
4-Броманилин (3,00 г, 17,44 ммоль) растворяли в DMF, добавляли этил 2-бром-2-метилпропаноат (3,40 г, 17,44 ммоль) и карбонат калия (3,62 г, 26,2 ммоль) и перемешивали при 100°C в течение 6 часов. После завершения реакции, ее охлаждали до комнатной температуры и добавляли воду, экстрагировали этилацетат, промывали соляным раствором, и удаляли избыток DMF. После удаления воды сульфатом магния и отгонкой при пониженном давлении, смесь очищали колоночной хроматографией (гексан : этилацетат), получая требуемое соединение. (выход 22%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,25 (д, J=8,5 Гц, 2H), 6,50 (д, J=8,5 Гц, 2H), 4,19 (кв, J=7,0 Гц, 2H), 1,59 (д, J=22,3 Гц, 7H), 1,22 (т, J=7,2 Гц, 3H)
Стадия 2: Этил 2-метил-2-((4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)амино)пропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 1 примера получения 52, применяя этил 2-((4-бромфенил)амино)-2-метилпропаноат (1,82 г, 6,36 ммоль), полученный на стадии 1. (выход 65%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,64-7,49 (2H), 6,58-6,38 (2H), 4,44-4,20 (1H), 4,20-4,11 (2H), 1,32-1,27 (12H), 1,19-1,07 (3H)
Стадия 3: Этил 2-((4-(6-аминопиридин-2-ил)фенил)амино)-2-метилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 52, применяя этил 2-метил-2-((4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)амино)пропаноат (500 мг, 1,50 ммоль), полученный на стадии 2, и 6-хлорпиридин-2-амин (183 мг, 1,422 ммоль). (выход 34%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,83 (д, J=8,5 Гц, 2H), 7,54 (т, J=7,9 Гц, 1H), 6,99 (д, J=7,6 Гц, 1H), 6,65 (д, J=8,5 Гц, 2H), 6,45 (д, J=8,2 Гц, 1H), 4,63-4,33 (1H), 4,20 (кв, J=7,0 Гц, 2H), 1,61 (с, 6H), 1,22 (т, J=7,2 Гц, 3H)
Пример получения 99: Этил 2-((4-(2-аминопиримидин-4-ил)фенил)амино)-2-метилпропаноат
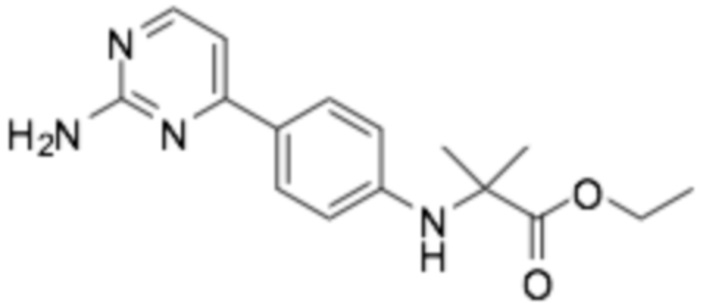
Стадия 1: Этил 2-((4-(2-хлорпиримидин-4-ил)фенил)амино)-2-метилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 52, применяя этил 2-метил-2-((4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)амино)пропаноат (400 мг, 1,20 ммоль), полученный на стадии 2 примера получения 98, и 2,4-дихлорпиримидин (179 мг, 1,20 ммоль). (выход 59%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,47-8,38 (1H), 8,00-7,88 (2H), 7,74-7,66 (1H), 6,64-6,49 (2H), 4,21-4,02 (2H), 1,58-1,48 (6H), 1,22-1,07 (3H)
Стадия 2: Этил 2-((4-(2-аминопиримидин-4-ил)фенил)амино)-2-метилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя этил 2-((4-(2-хлорпиримидин-4-ил)фенил)амино)-2-метилпропаноат (83 мг, 0,21 ммоль), полученный на стадии 1. (выход на 2 стадии 27%)
m/z (M+H)+ рассчитанная для C16H21N4O2: 301, найденная 301
Пример получения 100: Этил (4-(6-аминопиридин-2-ил)фенил)глицинат
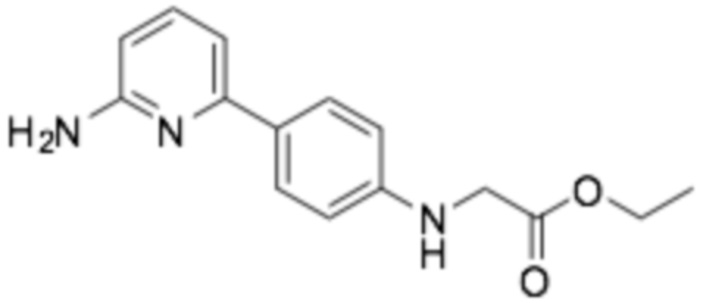
Стадия 1: Этил (4-бромфенил)глицинат
Заявленное в заголовке соединение получали способом, аналогичным стадии 1 примера получения 98, применяя 4-броманилин (3,00 г, 17,44 ммоль). (выход 44%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,32-7,23 (м, 2H), 6,59-6,45 (м, 2H), 4,34-4,19 (м, 2H), 4,12 (с, 1H), 3,89 (с, 2H), 1,39-1,23 (м, 3H)
Стадия 2: Этил (4-(4,4,5,5- тетраметил-1,3,2-диоксаборолан-2-ил)фенил)глицинат
Заявленное в заголовке соединение получали способом, аналогичным стадии 1 примера получения 52, применяя этил (4-бромфенил)глицинат (1,99 г, 7,71 ммоль), полученный на стадии 1. (выход 44%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,73-7,58 (м, 2H), 6,63 (д, J=8,2 Гц, 2H), 4,24 (т, J=7,1 Гц, 2H), 4,22-4,04 (м, 1H), 3,93 (д, J=1,4 Гц, 2H), 1,31 (с, 12H), 1,28 (т, J=7,1 Гц, 3H)
Стадия 3: Этил (4-(6-аминопиридин-2-ил)фенил)глицинат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 52, применяя этил (4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)глицинат (700 мг, 2,30 ммоль), полученный на стадии 2, и 6-хлорпиридин-2-амин (295 мг, 2,30 ммоль). (выход 32%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,63 (дт, J=9,3, 2,3 Гц, 2H), 7,42 (т, J=7,8 Гц, 1H), 6,87 (д, J=6,9 Гц, 1H), 6,63 (дт, J=9,3, 2,3 Гц, 2H), 6,47-6,32 (1H), 4,18 (кв, J=7,2 Гц, 2H), 3,93 (с, 2H), 1,24 (т, J=7,1 Гц, 3H)
Пример получения 101: Метил 5-(2-аминопиримидин-4-ил)бицикло[2,2,1]гептан-2-карбоксилат
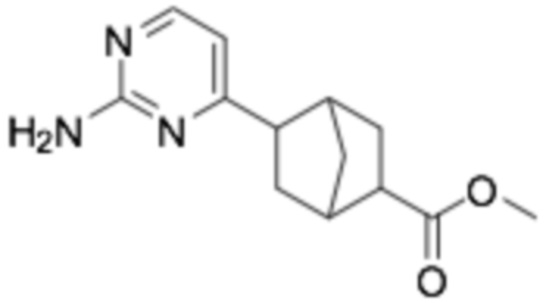
Стадия 1: Метил бицикло[2,2,1]гепт-5-ен-2-карбоксилат
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 50, применяя бицикло[2,2,1]гепт-5-ен-2-карбоновая кислота (1 г, 7,24 ммоль). (выход 100%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 6,18 (кв, J=3,0 Гц, 1H), 5,91 (кв, J=2,9 Гц, 1H), 3,61 (с, 3H), 3,18 (д, J=1,4 Гц, 1H), 2,98-2,76 (м, 2H), 1,97-1,81 (м, 1H), 1,57 (т, J=1,6 Гц, 1H), 1,45-1,37 (2H)
Стадия 2: Метил 5-(2-хлорпиримидин-4-ил)бицикло[2,2,1]гептан-2-карбоксилат
2,4-дихлорпиримидин (0,775 г, 5,20 ммоль) растворяли в THF (23,6 мл) и добавляли метил бицикло[2,2,1]гепт-5-ен-2-карбоксилат (0,720 г, 4,73 ммоль), полученный на стадии 1. Ацетат палладия (II) (0,212 г, 0,946 ммоль), трифенилфосфин (0,496 г, 1,892 ммоль) и муравьиную кислоту (0,907 мл, 23,65 ммоль) добавляли к реакционному раствору, и TEA (4,29 мл, 30,8 ммоль) добавляли по каплям. После перемешивания при 60°C в течение 16 часов, реакцию прекращали водой, разбавляли этилацетатом, промывали соляным раствором, и органический растворитель сушили над сульфатом магния. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 24%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,42 (кв, J=2,6 Гц, 1H), 7,08 (кв, J=4,9 Гц, 1H), 3,77-3,62 (м, 3H), 3,01-2,80 (м, 2H), 2,80-2,66 (м, 1H), 2,52-2,39 (м, 1H), 2,10-1,85 (м, 1H), 1,85-1,67 (м, 4H), 1,41-1,31 (м, 1H)
Стадия 3: Метил 5-(2-аминопиримидин-4-ил)бицикло[2,2,1]гептан-2-карбоксилат
Требуемый продукт получали способом, аналогичным примеру получения 2, применяя метил 5-(2-хлорпиримидин-4-ил)бицикло[2,2,1]гептан-2-карбоксилат (0,428 г, 1,605 ммоль), полученный на стадии 2. (выход на 2 стадии 13%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,48 (кв, J=5,3 Гц, 1H), 7,49 (с, 1H), 6,81 (тд, J=14,5, 5,2 Гц, 1H), 4,51 (с, 1H), 3,73 (д, J=11,3 Гц, 3H), 2,93-2,80 (м, 2H), 2,80-2,61 (м, 1H), 2,53-2,35 (м, 1H), 2,11-1,97 (м, 1H), 1,85-1,77 (м, 2H), 1,77-1,67 (м, 2H), 1,40-1,20 (м, 1H)
Пример получения 102: Метил 3-(3-(5-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат
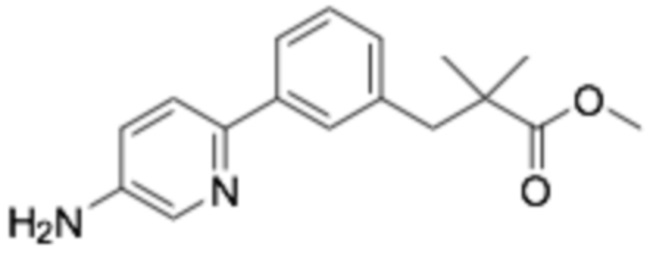
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 52, стадия 3 примера получения 19 и стадии 2 примера получения 76, применяя 2,5-дибромпиридин (189 мг, 0,799 ммоль) и трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (288 мг, 0,799 ммоль), полученный на стадии 2 примера получения 79. (выход на 3 стадии 20%).
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,17 (д, J=2,7 Гц, 1H), 7,74 (дт, J=7,8, 1,4 Гц, 1H), 7,65 (д, J=1,8 Гц, 1H), 7,51 (д, J=7,8 Гц, 1H), 7,31 (т, J=7,9 Гц, 1H), 7,14-6,97 (м, 2H), 3,72 (с, 2H), 3,66 (с, 3H), 2,99-2,85 (2H), 1,21 (с, 6H)
Пример получения 103: Метил 2-(4-((2-аминопиримидин-4-ил)окси)фенил)ацетат
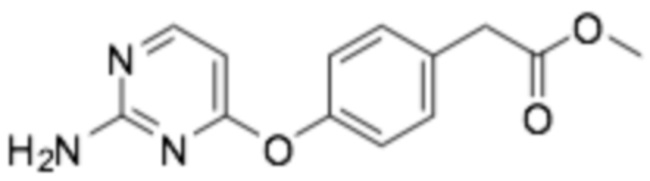
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 104 и примеру получения 19 (стадия 3, стадия 4), применяя метил 2-(4-гидроксифенил)ацетат (1 г, 6,02 ммоль). (выход на 3 стадии 57%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,11 (д, J=5,5 Гц, 1H), 7,30 (дд, J=8,9, 2,5 Гц, 2H), 7,08 (дт, J=9,1, 2,4 Гц, 2H), 6,18-6,02 (1H), 5,01 (с, 2H), 3,77-3,67 (3H), 3,62 (д, J=16,0 Гц, 2H)
Пример получения 104: Метил 4-((6-аминопиридин-2-ил)окси)бензоат
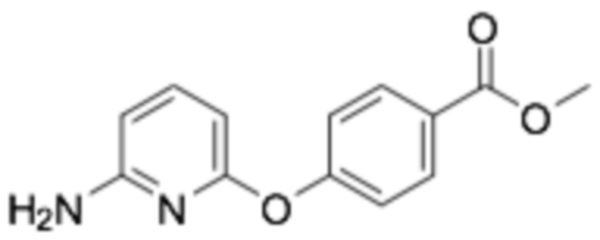
Стадия 1: Метил 4-((6-хлорпиридин-2-ил)окси)бензоат
Метил 4-гидроксибензоат (1 г, 6,57 ммоль), 2,6-дихлорпиридин (0,875 г, 5,92 ммоль) и карбонат цезия (2,57 г, 7,89 ммоль) растворяли в 27,4 мл DMF и перемешивали при 120°C в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 75%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,14-7,94 (м, 2H), 7,74-7,52 (м, 1H), 7,20-7,10 (м, 2H), 7,10-6,96 (м, 1H), 6,89-6,76 (м, 1H), 3,95-3,80 (м, 3H)
Стадия 2: Метил 4-((6-аминопиридин-2-ил)окси)бензоат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя метил 4-((6-хлорпиридин-2-ил)окси)бензоат (1,3 г, 4,93 ммоль), полученный на стадии 1. (выход на 2 стадии 76%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,15-7,89 (м, 2H), 7,52-7,37 (м, 1H), 7,12 (дт, J=9,3, 2,3 Гц, 2H), 6,33-6,10 (2H), 4,58-4,26 (м, 2H), 3,97-3,72 (м, 3H)
Пример получения 105: Метил 2-(4-((6-аминопиридин-2-ил)окси)фенил)ацетат
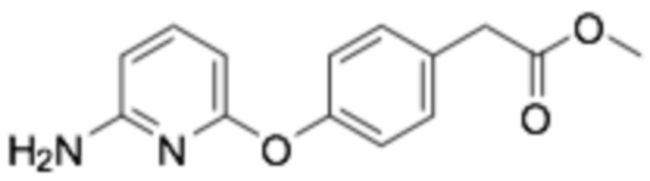
Стадия 1: Метил 2-(4-((6-хлорпиридин-2-ил)окси)фенил)ацетат
2,6-Дихлорпиридин (2,67 г, 18,1 ммоль), метил 2-(4-гидроксифенил)ацетат (3,00 г, 18,1 ммоль) и карбонат цезия (7,06 г, 21,7 ммоль) растворяли в 75,0 мл DMF и перемешивали при 120°C в течение ночи. Ее экстрагировали DCM, и органический растворитель сушили над сульфатом магния и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан). (выход 50%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,61 (т, J=7,8 Гц, 1H), 7,39-7,28 (2H), 7,10 (тд, J=5,7, 3,2 Гц, 2H), 7,03 (д, J=7,8 Гц, 1H), 6,75 (д, J=8,2 Гц, 1H), 3,72 (с, 3H), 3,64 (с, 2H)
Стадия 2: Метил 2-(4-((6-аминопиридин-2-ил)окси)фенил)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя метил 2-(4-((6-хлорпиридин-2-ил)окси)фенил)ацетат (1,25 г, 4,50 ммоль), полученный на стадии 1. (выход на 2 стадии 5%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,46 (т, J=8,0 Гц, 1H), 7,30 (д, J=8,7 Гц, 2H), 7,09 (дд, J=6,6, 2,1 Гц, 2H), 6,28-6,22 (1H), 6,02 (д, J=8,2 Гц, 1H), 3,72 (с, 3H), 3,66-3,60 (2H)
Пример получения 106: Метил 2-(4-((6-аминопиридин-2-ил)окси)фенил)-2-метилпропаноат
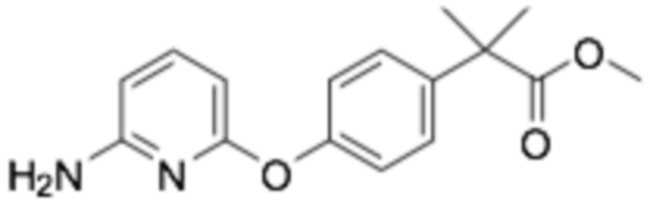
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 2, стадия 3, стадия 4), применяя метил 2-(4-((6-хлорпиридин-2-ил)окси)фенил)ацетат (1,25 г, 4,50 ммоль) полученный на стадии 1 примера получения 105. (выход на 3 стадии 41%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,40 (т, J=7,6 Гц, 1H), 7,37-7,29 (м, 2H), 7,09-7,00 (м, 2H), 6,23-6,14 (м, 1H), 6,06 (дд, J=7,9, 5,2 Гц, 1H), 3,67 (с, 3H), 1,59 (с, 6H)
Пример получения 107: Метил 3-((6-аминопиридин-2-ил)окси)бензоат
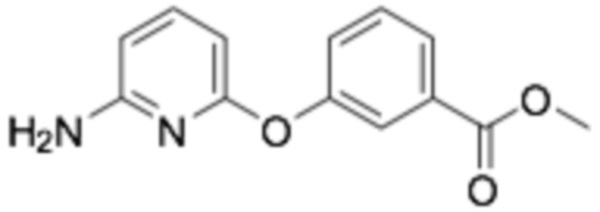
Стадия 1: Метил 3-((6-хлорпиридин-2-ил)окси)бензоат
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 104, применяя метил 3-гидроксибензоат (0,2 г, 1,315 ммоль). (выход 75%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,99-7,82 (м, 1H), 7,82-7,72 (м, 1H), 7,72-7,54 (м, 1H), 7,54-7,39 (м, 1H), 7,39-7,28 (1H), 7,08-6,95 (1H), 6,87-6,65 (1H), 3,96-3,81 (3H)
Стадия 2: Метил 3-((6-аминопиридин-2-ил)окси)бензоат
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя метил 3-((6-хлорпиридин-2-ил)окси)бензоат (0,26 г, 0,986 ммоль), полученный на стадии 1. (выход на 2 стадии 54%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,84 (дд, J=7,8, 1,4 Гц, 1H), 7,76 (т, J=1,8 Гц, 1H), 7,42 (тд, J=7,9, 3,4 Гц, 2H), 7,30 (дкв, J=8,0, 1,2 Гц, 1H), 6,21 (д, J=8,2 Гц, 1H), 6,10 (д, J=7,8 Гц, 1H), 3,89 (д, J=3,2 Гц, 3H)
Пример получения 108: Метил 2-(3-((6-аминопиридин-2-ил)окси)фенил)ацетат
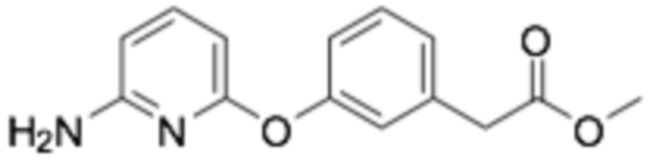
Стадия 1: Метил 2-(3-гидроксифенил)ацетат
Требуемый продукт получали способом, аналогичным стадии 2 примера получения 76, применяя 2-(3-гидроксифенил)уксусную кислоту (3,00 г, 19,7 ммоль). (выход 99%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,19 (т, J=7,8 Гц, 1H), 6,84 (д, J=7,3 Гц, 1H), 6,80-6,66 (м, 2H), 5,10-4,91 (м, 1H), 3,70 (с, 3H), 3,58 (с, 2H)
Стадия 2: Метил 2-(3-((6-аминопиридин-2-ил)окси)фенил)ацетат
Требуемый продукт получали способом, аналогичным примеру получения 105, применяя 2,6-дихлорпиридин (2,90 г, 19,6 ммоль) и метил 2-(3-гидроксифенил)ацетат (3,26 г, 19,6 ммоль), полученный на стадии 1. (выход на 3 стадии 12%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,44 (т, J=8,0 Гц, 1H), 7,33 (т, J=7,8 Гц, 1H), 7,11 (д, J=7,8 Гц, 1H), 7,09-6,96 (м, 2H), 6,23 (д, J=8,2 Гц, 1H), 6,05 (д, J=7,8 Гц, 1H), 3,70 (с, 3H), 3,65-3,62 (2H)
Пример получения 109: Метил 2-(3-((6-аминопиридин-2-ил)окси)фенил)-2-метилпропаноат
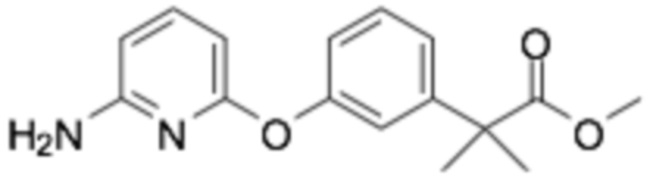
Требуемый продукт получали способом, аналогичным примеру получения 106, применяя метил 2-(3-гидроксифенил)ацетат (1,45 г, 5,22 ммоль), полученный на стадии 1 примера получения 108. (выход на 3 стадии 35%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,49-7,35 (м, 1H), 7,35-7,27 (м, 1H), 7,17-7,07 (м, 2H), 7,04-6,90 (м, 1H), 6,25-6,15 (м, 1H), 6,06 (д, J=7,8 Гц, 1H), 4,44 (с, 2H), 3,65 (с, 3H), 1,44-1,40 (6H)
Пример получения 110: Метил 4-(((6-аминопиридин-2-ил)окси)метил)бензоат
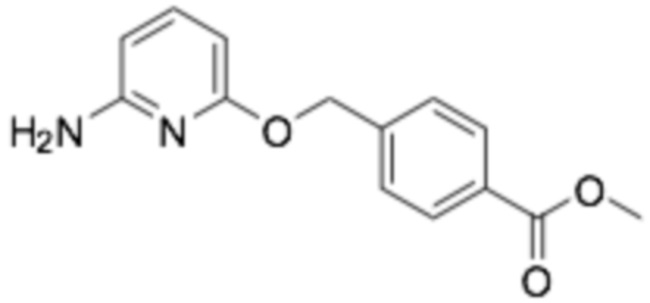
Стадия 1: Метил 4-(((6-хлорпиридин-2-ил)окси)метил)бензоат
Метил 4-(гидроксиметил)бензоат (0,5 г, 3,01 ммоль) и 2,6-дихлорпиридин (0,445 г, 3,01 ммоль), карбонат цезия (1,176 г, 3,61 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантин (0,244 г, 0,421 ммоль) и ацетат палладия (II) (0,054 г, 0,241 ммоль) растворяли в 12 мл толуола и перемешивали при 120°C в течение 4 часов. После подтверждения того, что реакция завершилась по ТСХ, органический растворитель удаляли при пониженном давлении. После экстракции этилацетатом (2×20 мл), ее промывали соляным раствором (20 мл), и органический растворитель сушили над сульфатом магния, и удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 1:9). (выход 24%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,07-7,98 (м, 2H), 7,53 (кв, J=7,8 Гц, 3H), 7,00-6,83 (м, 1H), 6,82-6,66 (м, 1H), 5,52-5,34 (м, 2H), 3,89 (д, J=16,0 Гц, 3H)
Стадия 2: Метил 4-(((6-аминопиридин-2-ил)окси)метил)бензоат
Способ получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя метил 4-(((6-хлорпиридин-2-ил)окси)метил)бензоат (0,2 г, 0,72 ммоль), полученный на стадии 1. (выход на 2 стадии 19%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,12-7,91 (м, 2H), 7,60-7,42 (м, 2H), 7,42-7,30 (м, 1H), 6,26-6,11 (м, 1H), 6,11-5,99 (м, 1H), 5,46-5,28 (м, 2H), 3,96-3,81 (м, 3H)
Пример получения 111: Метил 2-(3-(4-аминопиримидин-2-ил)фенил)-2-метилпропаноат
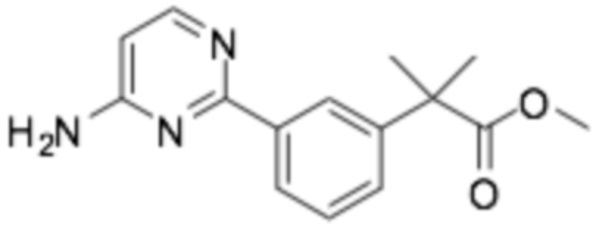
Требуемый продукт получали способом, аналогичным примеру получения 53 (стадия 1, стадия 2) и примеру получения 19 (стадия 3, стадия 4), применяя метил 2-(3-бромфенил)-2-метилпропаноат (0,25 г, 0,972 ммоль). (выход на 4 стадии 36%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,40-8,27 (м, 2H), 8,27-8,16 (м, 1H), 7,45-7,35 (м, 2H), 6,32 (д, J=5,9 Гц, 1H), 5,14 (с, 2H), 3,70-3,49 (м, 3H), 1,72-1,56 (м, 6H)
Пример получения 112: Метил 2-(4-(4-аминопиримидин-2-ил)фенил)-2-метилпропаноат
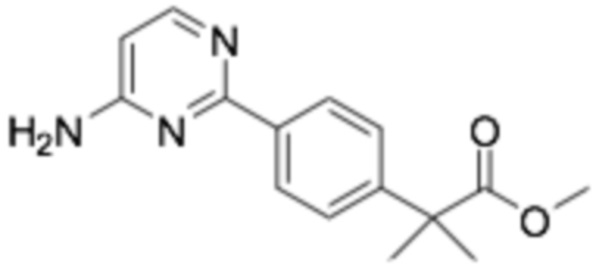
Требуемый продукт получали способом, аналогичным примеру получения 53 (стадия 1, стадия 2) и примеру получения 19 (стадия 3, стадия 4), применяя метил 2-(4-бромфенил)-2-метилпропаноат (5 г, 19,45 ммоль). (выход на 4 стадии 36%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,37-8,28 (м, 1H), 8,26 (д, J=8,2 Гц, 2H), 7,46-7,34 (м, 2H), 6,35-6,23 (м, 1H), 4,99 (с, 2H), 3,77-3,46 (м, 3H), 1,67-1,52 (м, 6H)
Пример получения 113: трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат
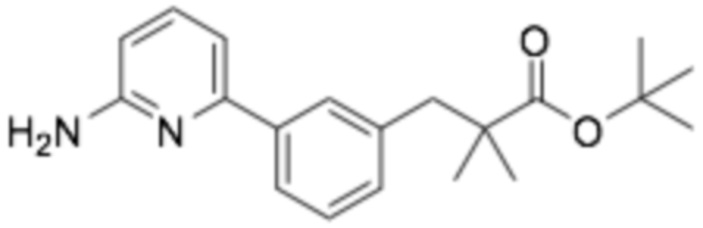
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 52, применяя трет-бутил 2,2-диметил-3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (500 мг, 1,39 ммоль), полученный на стадии 2 примера получения 79, и 6-хлорпиридин-2-амин (178 мг, 1,39 ммоль). (выход 66%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,86 (т, J=7,3 Гц, 1H), 7,71 (с, 1H), 7,66 (д, J=16,0 Гц, 1H), 7,38-7,30 (м, 1H), 7,02 (д, J=7,8 Гц, 1H), 6,64 (д, J=7,3 Гц, 2H), 6,36 (д, J=8,2 Гц, 1H), 4,52 (с, 2H), 2,91 (с, 2H), 1,40 (д, J=6,9 Гц, 9H), 1,14 (т, J=4,6 Гц, 6H)
Пример получения 114: трет-бутил 3-(3-(6-амино-3-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат
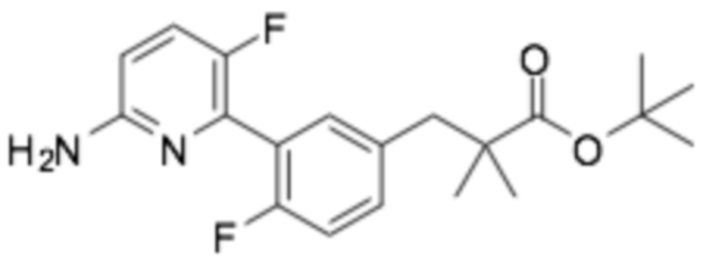
Стадия 1: трет- бутил 3-(3-(6-хлор-3-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 52, применяя трет-бутил 3-(4-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-2,2-диметилпропаноат (1,52 г, 4,01 ммоль), полученный на стадии 2 примера получения 89, и 2,6-дихлор-3-фторпиридин (799 мг, 4,81 ммоль). (выход 21%)
m/z (M+H)+ рассчитанная для C20H23ClF2NO2: 382, найденная 382
Стадия 2: трет- бутил 3-(3-(6-амино-3-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя трет-бутил 3-(3-(6-хлор-3-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат (327 мг, 0,86 ммоль), полученный на стадии 1. (выход на 2 стадии 17%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,66 (дд, J=7,5, 2,5 Гц, 1H), 7,34-7,15 (м, 1H), 7,15-7,04 (м, 2H), 7,04-6,90 (1H), 4,89-4,60 (2H), 2,84 (с, 2H), 1,40 (д, J=6,9 Гц, 9H), 1,17-1,03 (м, 6H)
Пример получения 115: трет-бутил 3-(3-(6-амино-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат
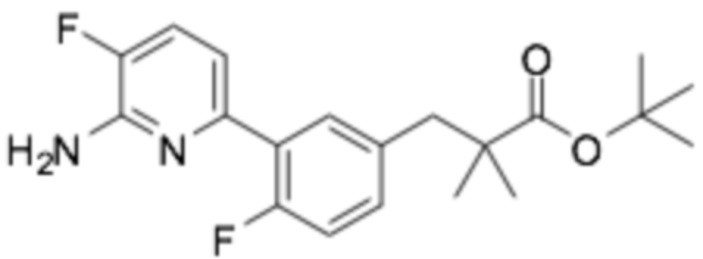
Стадия 1: трет- бутил 3-(3-(6-хлор-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера получения 52, применяя трет-бутил 3-(4-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-2,2-диметилпропаноат (1,52 г, 4,01 ммоль), полученный на стадии примера получения 89, и 2,6-дихлор-3-фторпиридин (799 мг, 4,81 ммоль). (выход 49%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,46 (т, J=8,5 Гц, 1H), 7,38 (дд, J=7,1, 2,5 Гц, 1H), 7,32 (дд, J=8,7, 3,2 Гц, 1H), 7,22 (тд, J=5,5, 2,7 Гц, 1H), 7,04 (дд, J=9,8, 8,5 Гц, 1H), 2,85 (с, 2H), 1,54 (с, 2H), 1,40 (д, J=7,8 Гц, 9H), 1,14 (с, 6H)
Стадия 2: трет- бутил 3-(3-(6-амино-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат
Заявленное в заголовке соединение получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя трет-бутил 3-(3-(6-хлор-3-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат (756 мг, 1,98 ммоль), полученный на стадии 1. (выход на 2 стадии 38%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,57-7,41 (м, 2H), 7,39 (дд, J=6,9, 1,8 Гц, 1H), 7,22-7,11 (м, 1H), 7,06 (т, J=9,1 Гц, 1H), 6,70 (дд, J=8,9, 3,0 Гц, 1H), 4,38 (д, J=22,9 Гц, 1H), 2,86 (с, 2H), 1,42-1,34 (9H), 1,16-1,06 (6H)
Пример получения 116: Метил 3-(4-(6-аминопиридин-2-ил)-1H-пиразол-1-ил)-2,2-диметилпропаноат
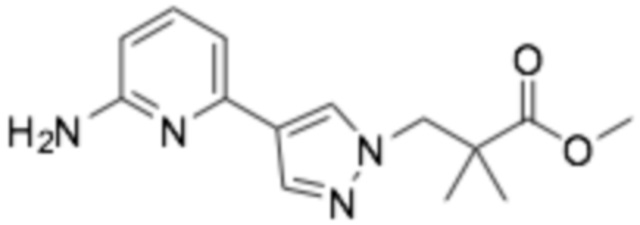
Применяя метил 3-гидрокси-2,2-диметилпропаноат (1,08 г, 8,16 ммоль) и 4-бром-1H-пиразол (1,00 г, 6,80 ммоль), последовательно применяли способ, аналогичный стадии 1 примера получения 1, стадии 2 примера получения 58 и примеру получения 19 (стадия 3 и стадия 4), получая требуемый продукт. (выход на 4 стадии 0,3%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 7,84 (д, J=7,8 Гц, 2H), 7,43-7,30 (м, 1H), 6,84-6,75 (м, 1H), 6,30 (д, J=7,8 Гц, 1H), 4,52 (с, 2H), 4,27 (с, 2H), 3,70 (с, 3H), 1,21 (с, 6H)
Пример получения 117: Этил 4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат
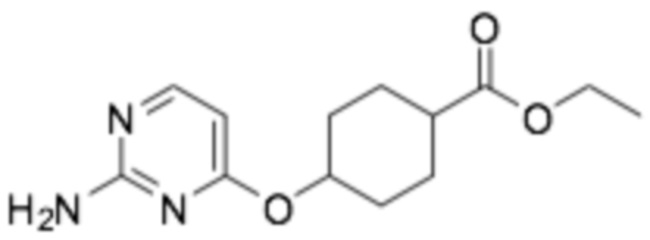
Стадия 1: Этил 4-((2-хлорпиримидин-4-ил)окси)циклогексан-1-карбоксилат
2,4-дихлорпиримидин (0,300 г, 2,014 ммоль) растворяли в DMF (10 мл), и добавляли затем этил 4-гидроксициклогексан-1-карбоксилат (0,357 мл, 2,215 ммоль) и карбонат цезия (1,640 г, 5,03 ммоль). После перемешивания при 80°C в течение 3 часов, ее разбавляли диэтиловым эфиром и промывали водой. После сушки органического растворителя сульфатом магния, ее очищали колонкой с силикагелем, получая требуемый продукт. (выход 29%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,29-8,17 (м, 1H), 6,64-6,46 (м, 1H), 5,46-4,97 (м, 1H), 4,18-4,00 (м, 2H), 2,46-2,21 (м, 1H), 2,14 (дт, J=9,0, 3,5 Гц, 1H), 2,08-1,89 (м, 2H), 1,89-1,79 (м, 1H), 1,79-1,70 (1H), 1,70-1,51 (м, 2H), 1,51-1,32 (м, 1H), 1,29-1,12 (м, 3H)
Стадия 2: Этил 4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат
Требуемый продукт получали способом, аналогичным примеру получения 2, применяя этил 4-((2-хлорпиримидин-4-ил)окси)циклогексан-1-карбоксилат (0,165 г, 0,579 ммоль), полученный на стадии 1. (выход на 2 стадии 98%)
m/z (M+H)+ рассчитанная для C13H20N3O3: 266,32, найденная 266,1
Пример получения 118: (R)-2-хлор-6-(3-(2-этокси-4-фторфенокси)пиперидин-1-ил)пиразин
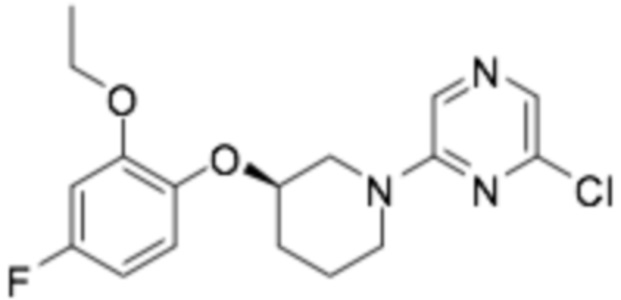
Стадия 1: 1-(Бензилокси)-2-этокси-4-фторбензол
2-(Бензилокси)-5-фторфенол (1,00 г, 4,58 ммоль), йодэтан (0,44 мл, 5,5 ммоль) и карбонат цезия (2,24 г, 6,87 ммоль) добавляли к 6,74 мл ацетона и перемешивали в течение 24 часов при комнатной температуре. Реакционную смесь фильтровали и добавляли воду, с последующей экстракцией этилацетатом. После промывки водой и соляным раствором, органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 82%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,43 (д, J=7,3 Гц, 2H), 7,40-7,33 (м, 2H), 7,33-7,27 (м, 1H), 6,82 (дд, J=9,1, 5,5 Гц, 1H), 6,64 (дд, J=10,1, 2,7 Гц, 1H), 6,51 (тд, J=8,3, 3,0 Гц, 1H), 5,09 (с, 2H), 4,08 (кв, J=7,0 Гц, 2H), 1,47 (т, J=7,1 Гц, 3H)
Стадия 2: 2-Этокси-4-фторфенол
1-(бензилокси)-2-этокси-4-фторбензол (921 мг, 3,74 ммоль), полученный на стадии 1, растворяли в метаноле и добавляли Pd/C (19,9 мг, 0,187 ммоль), с последующим перемешиванием в атмосфере водорода. После завершения реакции, ее фильтровали через целит, получая требуемый продукт. (выход 92%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 6,83 (дд, J=8,7, 5,5 Гц, 1H), 6,68-6,48 (м, 2H), 5,45-5,31 (1H), 4,09 (кв, J=7,0 Гц, 2H), 1,50-1,37 (3H)
Стадия 3: ( R )-2-хлор-6-(3-(2-этокси-4-фторфенокси)пиперидин-1-ил)пиразин
Требуемый продукт получали способом, аналогичным примеру получения 1 (стадия 1, стадия 2, стадия 3), применяя 2-этокси-4-фторфенол (539 мг, 3,45 ммоль), полученный на стадии 2. (выход на 3 стадии 37%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,95 (с, 1H), 7,74 (д, J=5,0 Гц, 1H), 6,92 (дд, J=8,7, 5,9 Гц, 1H), 6,70-6,47 (м, 2H), 4,28-4,14 (1H), 4,07-3,89 (3H), 3,72 (кв, J=6,4 Гц, 1H), 3,67-3,46 (м, 2H), 2,15-1,85 (м, 3H), 1,59 (квд, J=8,5, 4,3 Гц, 1H), 1,41 (т, J=7,1 Гц, 3H)
Пример получения 119: Метил 2-(4-(4-аминопиримидин-2-ил)фенокси)-2-метилпропаноат
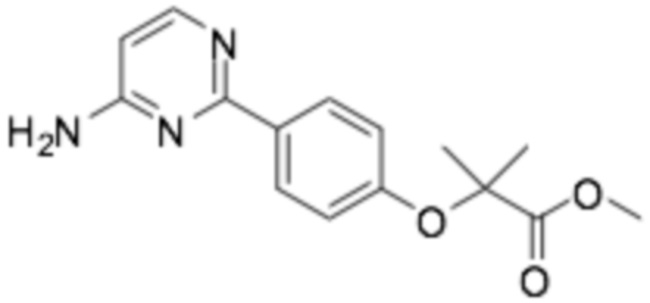
Требуемый продукт получали способом, аналогичным стадии 1 примера получения 68, примеру получения 53 (стадия 1, стадия 2), и примеру получения 19 (стадия 4), применяя 4-бромфенол (1 г, 5,78 ммоль). (выход на 4 стадии 6%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,31-8,00 (м, 3H), 6,96-6,60 (м, 2H), 6,33-6,07 (м, 1H), 5,26 (д, J=44,4 Гц, 2H), 4,22-4,09 (м, 2H), 1,63-1,50 (м, 6H), 1,29-1,07 (м, 3H)
Пример 1: (R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)тиазол-5-карбоновая кислота
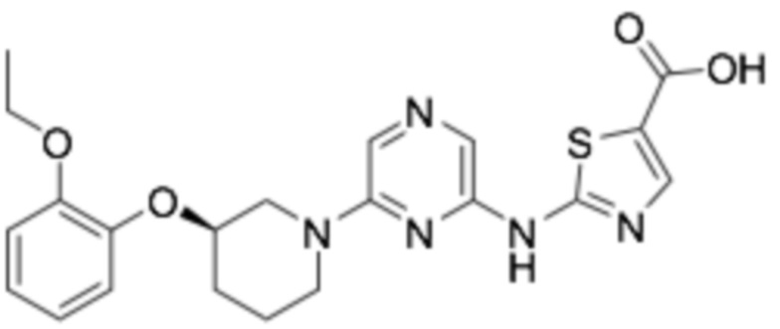
(R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (20 мг, 0,06 ммоль), полученный в примере получения 1, и метил 2-аминотиазол-5-карбоксилат (0,011 г, 0,072 ммоль) растворяли в 1,4-диоксане, добавляли карбонат цезия (49 мг, 0,150 ммоль), трис(дибензилиденацетон)дипалладий(0) (4,39 мг, 0,005 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантин (3,47 мг, 0,006 ммоль), и затем кипятили с обратным холодильником и перемешивали в течение 4 часов. После завершения реакции, реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, промывали водным раствором гидрокарбоната натрия и соляным раствором, и затем сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (гексан : этилацетат = 2:1). (выход 81%)
Полученное эфирное соединение (22 мг, 0,05 ммоль) растворяли в THF : вода : метанол = 1:1:1, и добавляли гидроксид лития (2 мг, 0,074 ммоль), с последующим перемешиванием при 60°C в течение 12 часов. После охлаждения реакции до комнатной температуры, pH доводили до 4,5, с последующей экстракцией органическим растворителем. Органический слой сушили над сульфатом магния, удаляли при пониженном давлении, и затем получали очисткой хроматографией колонкой с силикагелем.
1H NMR (300 МГц, Метанол-D): δ 11,5 (уш с, 1H), 7,77 (с, 1H), 7,70 (с, 1H), 7,01 (д, 1H), 6,78-6,87 (м, 3H), 4,36 (уш с, 1H), 3,75-3,91 (м, 8H), 1,82-1,97 (м, 4H), 1,55 (м, 1H), 1,18 (м, 5H)
Пример 2: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-4,5-диметилтиазол-2-амин
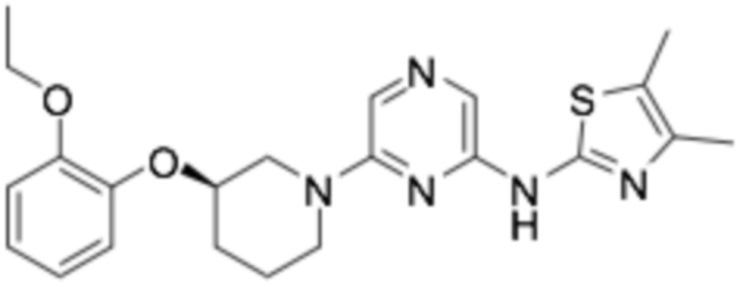
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,10 г, 0,30 ммоль) полученный в примере получения 1, и 2-амино-4,5-диметилтиазол (0,038 г, 0,30 ммоль). (выход 63%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 8,80 (уш с, 1H), 7,61 (с, 1H), 7,41 (с, 1H), 6,82-7,01 (м, 4H), 4,30-4,36 (м, 2H), 3,98-4,05 (м, 3H), 3,49 (м, 1H), 3,38 (м, 1H), 2,21 (с, 3H), 2,19 (с, 3H), 2,20 (м, 1H), 1,78 (м, 1H), 1,61-1,69 (м, 2H), 1,39 (т, 3H)
Пример 3: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)тиазол-2-амин
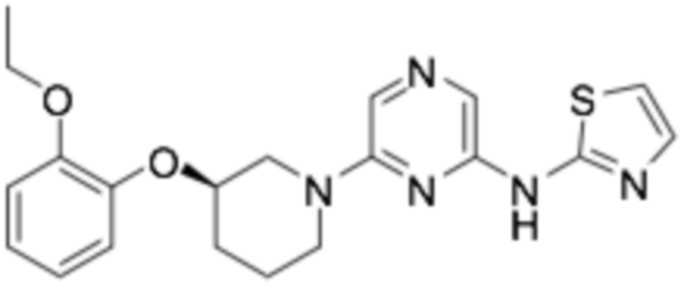
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,10 г, 0,30 ммоль), полученный в примере получения 1, и 2-аминотиазол (0,03 г, 0,30 ммоль). (выход 25%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 10,97 (с, 1H), 7,64 (с, 1H), 7,59 (с, 1H), 7,45 (с, 1H), 7,02 (м, 2H), 6,86 (м, 2H), 6,71 (с, 1H), 4,46 (м, 1H), 4,34 (м, 1H), 4,03 (м, 3H), 3,34-3,45 (м, 2H), 2,24 (м, 1H), 2,02 (м, 1H), 1,91 (м, 1H), 1,71 (м, 1H), 1,39 (т, 3H)
Пример 4: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-4-фенилтиазол-2-амин
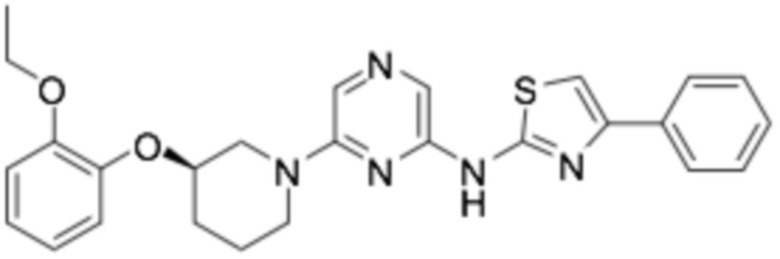
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,10 г, 0,30 ммоль), полученный в примере получения 1, и 2-амино-4-бензотиазол (0,053 г, 0,30 ммоль). (выход 28%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 8,72 (уш с, 1H), 7,85 (д, 2H), 7,63 (с, 1H), 7,40 (т, 2H), 7,35 (с, 1H), 7,29 (т, 1H), 7,02 (м, 2H), 6,87 (м, 3H), 4,44 (м, 1H), 4,33 (м, 1H), 3,95-4,06 (м, 3H), 3,35-3,47 (м, 2H), 2,23 (м, 1H), 2,02 (м, 1H), 1,89 (м, 1H), 1,70 (м, 1H), 1,39 (т, 3H)
Пример 5: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)бензо[d]тиазол-2-амин
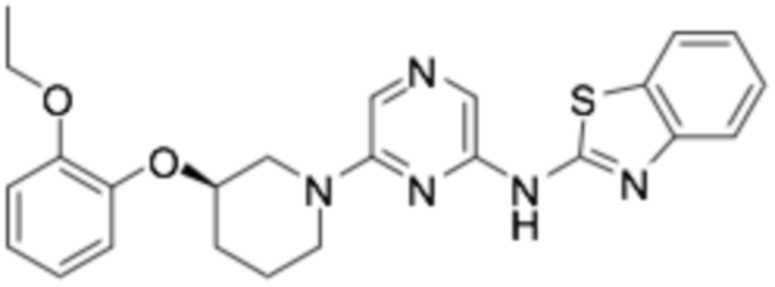
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,10 г, 0,30 ммоль), полученный в примере получения 1, и 2-аминобензотиазол (0,045 г, 0,30 ммоль). (выход 37%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 9,20 (уш с, 1H), 7,73 (с, 1H), 7,64-7,71 (м, 2H), 7,42 (с, 1H), 7,38 (м, 1H), 7,22 (м, 1H), 7,04 (д, 1H), 6,83-6,93 (м, 3H), 4,31-4,40 (м, 2H), 4,03 (м, 3H), 3,63 (м, 1H), 3,59 (м, 1H), 2,21 (м, 1H), 2,09 (м, 1H), 1,97 (м, 1H), 1,74 (м, 1H), 1,39 (т, 3H)
Пример 6: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-6-метоксибензо[d]тиазол-2-амин
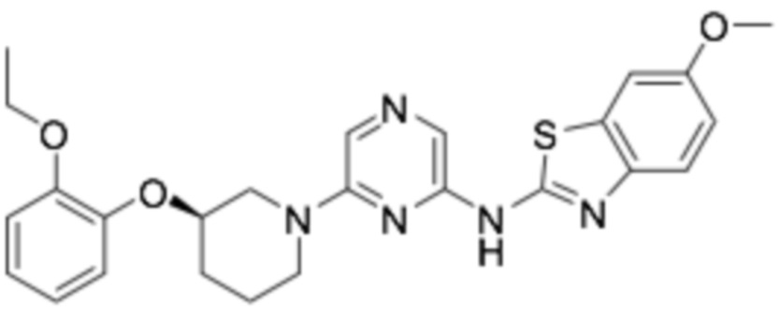
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,10 г, 0,30 ммоль), полученный в примере получения 1, и 2-амино-(6-метокси)бензотиазол (0,054 г, 0,30 ммоль). (выход 28%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 9,90 (уш с, 1H), 7,70 (с, 1H), 7,61 (д, 1H), 7,52 (с, 1H), 7,15 (с, 1H), 6,82-7,06 (м, 4H), 4,40 (м, 2H), 3,99-4,06 (м, 3H), 3,86 (с, 3H), 3,60 (м, 1H), 3,48 (м, 1H), 2,20 (м, 1H), 2,07 (м, 1H), 1,96 (м, 1H), 1,73 (м, 1H), 1,39 (т, 3H)
Пример 7: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-6-(метансульфонил)бензо[d]тиазол-2-амин
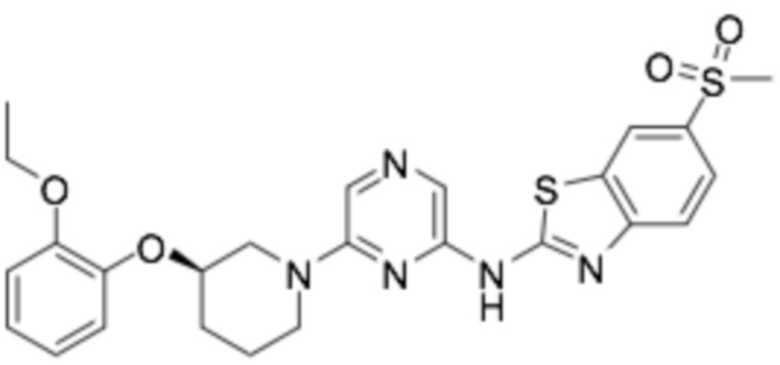
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,10 г, 0,3 ммоль), полученный в примере получения 1, и 2-амино-(6-метилсульфонил)бензотиазол (0,068 г, 0,30 ммоль). (выход 19%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 9,70 (уш с, 1H), 8,24 (с, 1H), 7,89 (м, 1H), 7,80 (с, 1H), 7,76 (м, 1H), 7,53 (с, 1H), 7,03 (д, 1H), 6,96 (м, 2H), 6,83 (м, 1H), 4,45 (м, 1H), 4,29 (м, 1H), 4,03 (м, 3H), 3,89 (м, 1H), 3,72 (м, 1H), 3,59 (м, 1H), 3,11 (с, 3H), 2,19 (м, 1H), 2,11 (м, 1H), 2,01 (м, 1H), 1,76 (м, 1H), 1,39 (т, 3H)
Пример 8: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-3-(1-(2-метоксиэтокси)-2-метилпропан-2-ил)изооксазол-5-амин
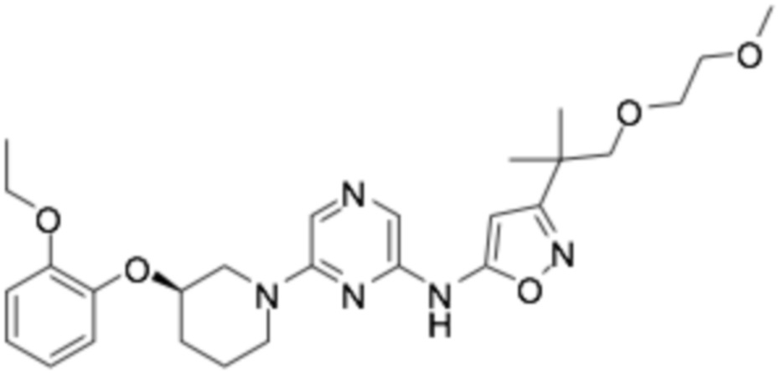
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,15 г, 0,45 ммоль), полученный в примере получения 1, и 3-(1-(2-метоксиэтокси)-2-метилпропан-2-ил)изооксазол-5-амин (0,1 г, 0,49 ммоль). (выход 57%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 7,73 (с, 1H), 7,69 (с, 1H), 7,59 (с, 1H), 7,03-6,90 (м, 2H), 6,89-6,75 (м, 2H), 5,99 (с, 1H), 4,36-4,25 (м, 1H), 4,08 (дд, J=12,8, 3,1 Гц, 1H), 4,03-3,88 (м, 2H), 3,88-3,76 (м, 1H), 3,59-3,52 (м, 3H), 3,52-3,46 (м, 4H), 3,46-3,38 (м, 1H), 3,33 (д, J=6,1 Гц, 3H), 2,17-2,07 (м, 1H), 1,99 (тд, J=6,6, 3,5 Гц, 1H), 1,90 (кв, J=4,3 Гц, 1H), 1,62 (кв, J=4,5 Гц, 1H), 1,36 (т, J=7,0 Гц, 3H), 1,29 (д, J=2,6 Гц, 6H)
Пример 9: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-4-фенилоксазол-2-амин
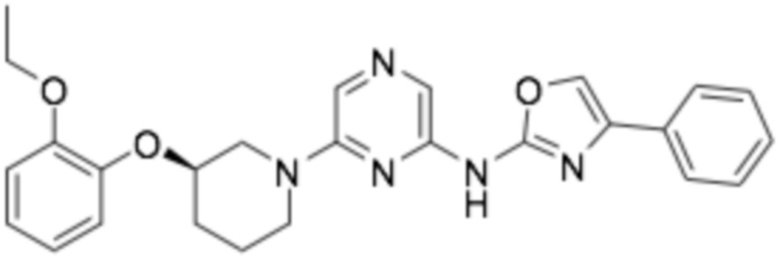
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,03 г, 0,09 ммоль), полученный в примере получения 1, и 4-фенилоксазол-2-амин (0,016 г, 0,099 ммоль), полученный в примере получения 25. (выход 4%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,92 (с, 1H), 7,87 (с, 1H), 7,72 (д, J=7,6 Гц, 1H), 7,66 (с, 1H), 7,41 (т, J=7,6 Гц, 1H), 7,34 (д, J=7,3 Гц, 1H), 7,28 (м, 2H), 7,01-6,84 (м, 3H), 6,84-6,74 (м, 1H), 4,29-4,18 (м, 1H), 4,06 (дд, J=13,4, 3,4 Гц, 1H), 4,01 (кв, J=7,0 Гц, 2H), 3,75 (тд, J=8,9, 4,3 Гц, 1H), 3,35 (дд, J=13,1, 8,2 Гц, 1H), 3,30-3,16 (м, 1H), 2,20-2,02 (м, 1H), 1,98-1,75 (м, 2H), 1,57-1,51 (м, 1H), 1,39 (т, J=6,9 Гц, 3H)
Пример 10: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)бензо[d]оксазол-2-амин
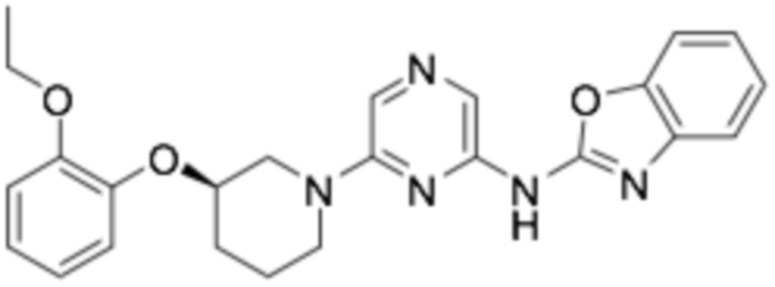
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,1 г, 0,30 ммоль), полученный в примере получения 1, и 2-аминобензоксазол (0,05 г, 0,36 ммоль). (выход 19%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,77 (с, 1H), 7,87 (с, 1H), 7,55 (д, J=7,3 Гц, 1H), 7,44-7,34 (м, 1H), 7,17 (т, J=7,6 Гц, 1H), 7,06 (д, J=16,5 Гц, 1H), 6,97 (т, J=7,9 Гц, 2H), 6,88 (кв, J=7,1 Гц, 2H), 4,32 (с, 1H), 4,10-3,90 (м, 3H), 3,78 (д, J=14,1 Гц, 1H), 3,62 (кв, J=6,9 Гц, 1H), 3,43 (д, J=9,8 Гц, 1H), 2,21-1,87 (м, 4H), 1,61 (с, 1H), 1,37 (т, J=7,0 Гц, 3H)
Пример 11: (R)-5-хлор-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)бензо[d]оксазол-2-амин
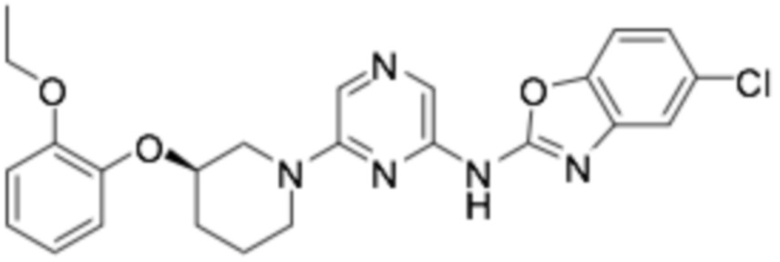
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,14 г, 0,42 ммоль), полученный в примере получения 1, и 2-амино-(5-хлор)бензотиазол (0,071 г, 0,42 ммоль). (выход 51%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 8,73 (с, 1H), 7,89 (с, 1H), 7,52 (с, 1H), 7,16 (м, 1H), 7,13 (м, 2H), 6,99 (м, 2h), 6,86-6,91 (м, 2H), 4,34 (м, 1H), 3,93-4,03 (м, 3H), 3,75 (м, 1H), 3,67 (м, 1H), 3,49 (м, 1H), 2,11 (м, 1H), 2,02 (м, 1H), 1,93 (м, 1H), 1,63 (м, 1H), 1,37 (т, 3H)
Пример 12: (R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)уксусная кислота
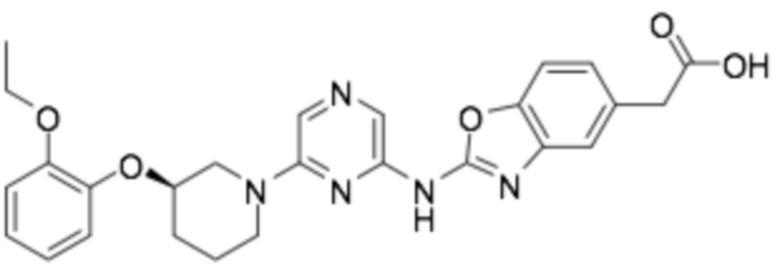
(R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,777 г, 2,328 ммоль), полученный в примере получения 1, и метил 2-(2-аминобензо[d]оксазол-5-ил)ацетат (0,4 г, 1,940 ммоль), полученный в примере получения 16, трис(дибензилиденацетон)дипалладий(0) (0,178 г, 0,194 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантин (0,135 г, 0,233 ммоль) и карбонат цезия (1,580 г, 4,85 ммоль) добавляли к 20 мл 1,4-диоксана и перемешивали при кипячении с обратным холодильником в течение 4 часов. После завершения реакции, реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, промывали водным раствором гидрокарбоната натрия и соляным раствором, и сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый сложноэфирный продукт получали очисткой колонкой с силикагелем (этилацетат : гексан = 4:1). (выход 36%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,81-8,66 (м, 1H), 8,03 (д, J=50,8 Гц, 1H), 7,95-7,77 (м, 1H), 7,54-7,38 (м, 1H), 7,26 (кв, J=7,8 Гц, 1H), 7,12-7,01 (м, 1H), 6,99-6,87 (м, 2H), 6,87-6,77 (м, 2H), 4,36-4,20 (м, 1H), 4,06-3,99 (м, 1H), 3,99-3,89 (м, 2H), 3,75 (тд, J=9,6, 3,8 Гц, 1H), 3,69 (д, J=9,6 Гц, 5H), 3,61-3,46 (м, 1H), 3,46-3,30 (м, 1H), 2,18-2,03 (м, 1H), 2,01-1,74 (м, 2H), 1,68-1,44 (м, 1H), 1,44-1,28 (м, 3H)
Полученное сложноэфирное соединение (0,330 г, 0,655 ммоль) растворяли в 5 мл THF, 2 мл MeOH и 2 мл воды. После добавления гидроксида натрия (0,786 г, 19,66 ммоль), смесь перемешивали при комнатной температуре в течение 15 часов. После подтверждения завершения реакции по ТСХ, титрование доводили до pH 4,5, применяя 1 N водный раствор хлористоводородной кислоты, разбавляли этилацетатом, и водный слой удаляли. После сушки реакционного продукта над сульфатом магния, органический растворитель удаляли при пониженном давлении, получая заявленное в заголовке соединение. (выход 3%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,51 (с, 1H), 7,68 (с, 1H), 7,44-7,34 (1H), 7,25 (д, J=8,2 Гц, 1H), 7,11 (кв, J=7,3 Гц, 1H), 6,96 (д, J=7,3 Гц, 1H), 6,86 (д, J=3,7 Гц, 2H), 6,84-6,71 (м, 2H), 4,40 (с, 1H), 3,89-3,83 (м, 2H), 3,82-3,74 (м, 2H), 3,62 (дд, J=16,9, 12,8 Гц, 1H), 3,55-3,50 (2H), 2,63 (с, 1H), 2,00 (дд, J=13,5, 3,4 Гц, 2H), 1,90 (д, J=8,2 Гц, 1H), 1,64-1,48 (м, 1H), 1,25 (т, J=6,9 Гц, 3H)
Пример 13: (R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)-2-метилпропановая кислота
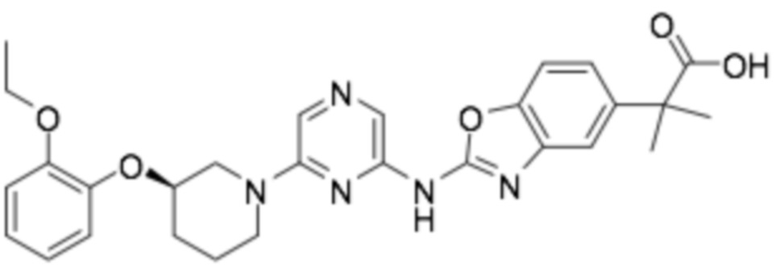
Сложноэфирный продукт получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,855 г, 2,56 ммоль), полученный в примере получения 1, и метил 2-(2-аминобензо[d]оксазол-5-ил)-2-метилпропаноат (0,5 г, 2,134 ммоль), полученное в примере получения 17. (выход 66%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,82 (кв, J=14,8 Гц, 1H), 8,62 (с, 1H), 7,86 (т, J=15,1 Гц, 1H), 7,56-7,46 (м, 1H), 7,34-7,20 (м, 1H), 7,21-7,03 (м, 1H), 7,03-6,83 (м, 2H), 6,83-6,69 (м, 2H), 4,33-4,15 (м, 1H), 4,16-3,97 (м, 1H), 3,90 (тд, J=15,4, 8,1 Гц, 2H), 3,82-3,68 (м, 1H), 3,68-3,58 (м, 3H), 3,58-3,45 (м, 1H), 3,45-3,29 (м, 1H), 2,16-2,02 (м, 1H), 1,98-1,87 (м, 1H), 1,87-1,71 (м, 1H), 1,68-1,56 (м, 6H), 1,56-1,48 (м, 1H), 1,30 (т, J=6,9 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения тем же способом, как в примере 12. (выход 56%)
m/z (M+H)+ рассчитанная для C28H32N5O5: 518, найденная 518
Пример 14: (R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)-2,2-диметилпропановая кислота
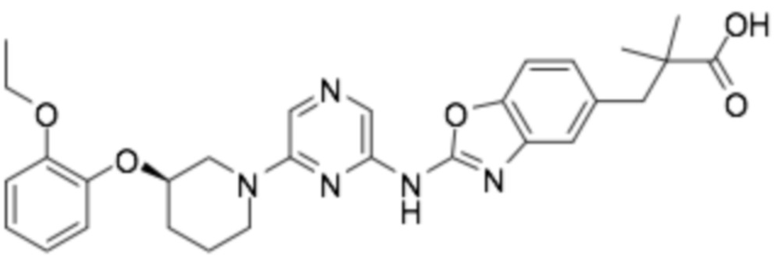
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,30 г, 0,90 ммоль), полученный в примере получения 1, и метил 3-(2-аминобензо[d]оксазол-5-ил)-2,2-диметилпропаноат (0,22 г, 0,90 ммоль), полученный в примере получения 21. (выход на 2 стадии 32%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,27 (с, 1H), 7,78 (с, 1H), 7,51 (с, 1H), 7,21 (д, J=8,2 Гц, 1H), 6,96 (д, J=8,2 Гц, 2H), 6,93-6,81 (м, 2H), 6,77 (т, J=7,5 Гц, 1H), 4,36-4,25 (м, 1H), 4,12 (д, J=16,5 Гц, 1H), 4,04-3,90 (м, 2H), 3,84 (д, J=13,3 Гц, 1H), 3,59 (дд, J=13,0, 7,5 Гц, 1H), 3,43 (т, J=9,6 Гц, 1H), 2,99 (с, 2H), 2,13 (т, J=5,9 Гц, 1H), 2,06-1,95 (м, 1H), 1,95-1,83 (м, 1H), 1,68-1,54 (м, 1H), 1,35 (т, J=6,9 Гц, 3H), 1,29 (с, 6H)
Пример 15: (R,E)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)акриловая кислота
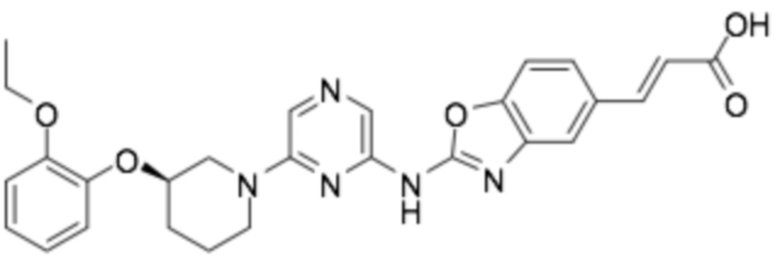
Сложноэфирный продукт получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,973 г, 2,91 ммоль), полученное в примере получения 1, и метил (E)-3-(2-аминобензо[d]оксазол-5-ил)акрилат (0,53 г, 2,429 ммоль), полученный в примере получения 22. (выход 6%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,74 (с, 1H), 7,88 (с, 1H), 7,80-7,68 (м, 2H), 7,35 (дд, J=10,5, 8,7 Гц, 2H), 7,23-7,18 (1H), 6,99-6,91 (м, 2H), 6,91-6,84 (м, 2H), 6,42 (дд, J=16,7, 6,6 Гц, 1H), 4,41-4,24 (м, 1H), 4,06-3,87 (м, 3H), 3,85-3,79 (м, 3H), 3,79-3,70 (м, 1H), 3,69-3,54 (м, 1H), 3,54-3,35 (м, 1H), 2,21-2,07 (м, 1H), 2,02-1,86 (2H), 1,70-1,58 (1H), 1,36 (т, J=7,1 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения тем же способом, как в примере 12. (выход 1%)
m/z (M+H)+ рассчитанная для C27H28N5O5: 502, найденная 502
Пример 16: (R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)пропановая кислота
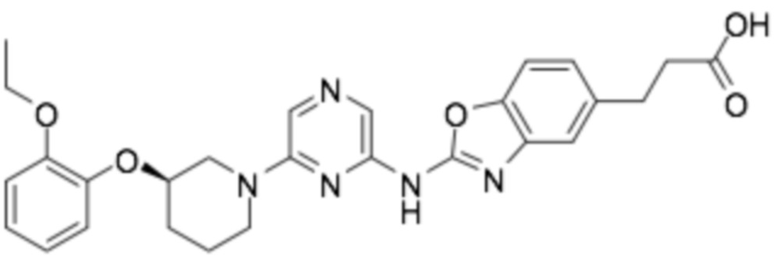
Сложноэфирный продукт получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (1 г, 3,00 ммоль), полученный в примере получения 1, и метил 3-(2-аминобензо[d]оксазол-5-ил)пропаноат (0,550 г, 2,496 ммоль), полученный в примере получения 23. (выход 28%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,61 (д, J=4,1 Гц, 1H), 7,81 (с, 1H), 7,43-7,32 (м, 1H), 7,27 (д, J=8,2 Гц, 1H), 7,04-6,90 (м, 3H), 6,84 (т, J=7,1 Гц, 2H), 4,34-4,22 (м, 1H), 4,20-4,09 (м, 1H), 4,09-3,87 (м, 3H), 3,88-3,70 (м, 1H), 3,65-3,49 (м, 3H), 3,50-3,32 (м, 1H), 3,14-2,97 (м, 2H), 2,71 (т, J=7,8 Гц, 2H), 2,27-2,11 (м, 1H), 2,02-1,81 (м, 2H), 1,72-1,52 (м, 1H), 1,36 (т, J=6,9 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения тем же способом, как в примере 12. (выход 5%)
m/z (M+H)+ рассчитанная для C27H30N5O5: 504, найденная 504
Пример 17: (R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-6-ил)-2-метилпропановая кислота
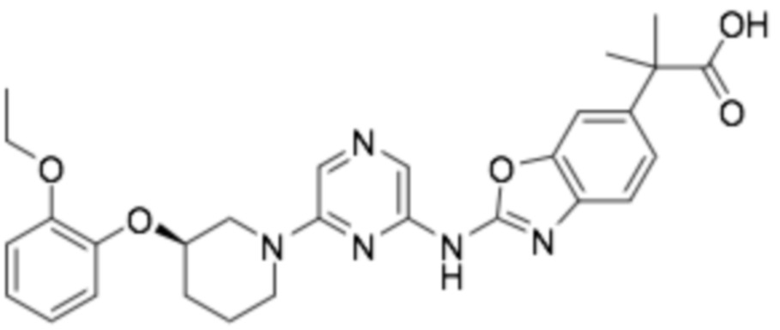
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,293 г, 0,878 ммоль), полученный в примере получения 1, и метил 2-(2-аминобензо[d]оксазол-6-ил)-2-метилпропаноат (0,187 г, 0,798 ммоль), полученный в примере получения 18. (выход на 2 стадии 7%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,55 (д, J=11,9 Гц, 1H), 7,82 (д, J=10,1 Гц, 1H), 7,55-7,44 (м, 1H), 7,44-7,36 (м, 1H), 7,31 (д, J=7,3 Гц, 1H), 7,02-6,87 (2H), 6,86-6,74 (м, 2H), 4,29 (т, J=3,4 Гц, 1H), 4,15-4,06 (м, 1H), 4,06-3,83 (м, 3H), 3,81-3,67 (м, 1H), 3,66-3,50 (1H), 3,50-3,35 (м, 1H), 2,15-2,04 (м, 1H), 2,03 (д, J=2,7 Гц, 1H), 2,01-1,82 (м, 2H), 1,62 (д, J=12,3 Гц, 6H), 1,37-1,28 (м, 3H)
Пример 18: (R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-6-ил)пропановая кислота
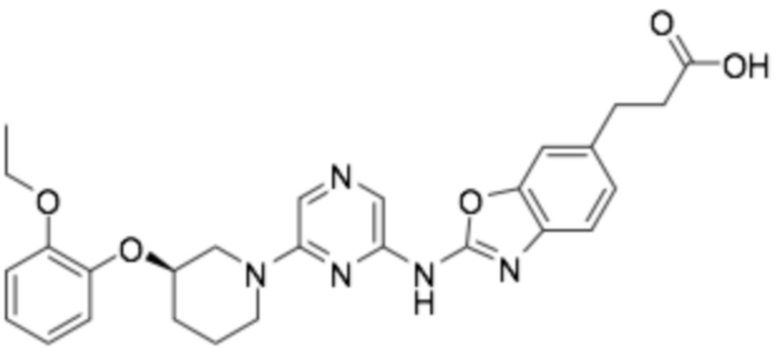
Продукт получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,8 г, 2,398 ммоль), полученный в примере получения 1, и метил 3-(2-аминобензо[d]оксазол-6-ил)пропаноат (0,44 г, 1,998 ммоль), полученный в примере получения 24. (выход 11%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,74 (с, 1H), 7,85 (с, 1H), 7,43 (д, J=8,2 Гц, 1H), 7,13-7,01 (м, 1H), 6,97 (т, J=7,1 Гц, 3H), 6,92-6,83 (м, 3H), 4,33 (д, J=4,1 Гц, 1H), 4,03-3,90 (3H), 3,79 (с, 1H), 3,66 (с, 3H), 3,60 (дд, J=13,0, 7,5 Гц, 2H), 3,03 (т, J=7,8 Гц, 2H), 2,71-2,60 (2H), 2,13-2,05 (1H), 1,98 (д, J=40,7 Гц, 2H), 1,75-1,63 (1H), 1,36 (т, J=7,1 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения тем же способом, как в примере 12. (выход 3%)
m/z (M+H)+ рассчитанная для C27H30N5O5: 504, найденная 504
Пример 19: (R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(1H-пиразол-3-ил)пиразин-2-амин
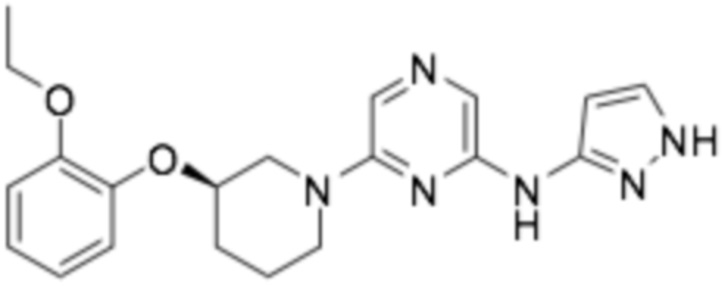
Стадия 1: трет- бутил ( R )-3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино-1 H -пиразол-1-карбоксилат
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (1,540 г, 4,61 ммоль), полученный в примере получения 1, и трет-бутил 3-амино-1H-пиразол-1-карбоксилат (0,930 г, 5,08 ммоль) полученный в примере получения 64. (выход 1%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 7,91 (д, J=2,7 Гц, 1H), 7,73-7,57 (м, 2H), 7,46-7,34 (1H), 7,07-6,95 (м, 2H), 6,95-6,80 (2H), 6,67-6,55 (1H), 4,30 (тд, J=8,2, 3,9 Гц, 1H), 4,21 (дд, J=13,0, 3,5 Гц, 1H), 4,09-3,95 (м, 2H), 3,93-3,78 (1H), 3,41 (дд, J=13,0, 8,1 Гц, 1H), 3,36-3,23 (м, 1H), 2,20 (дд, J=12,7, 5,0 Гц, 1H), 2,00 (дд, J=9,3, 4,1 Гц, 1H), 1,95-1,81 (1H), 1,66 (с, 10H), 1,40 (т, J=7,0 Гц, 3H)
Стадия 2: ( R )-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(1 H -пиразол-3-ил)пиразин-2-амин
Трет-бутил (R)-3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино-1H-пиразол-1-карбоксилат (0,0124 г, 0,026 ммоль), полученный на стадии 1, растворяли в DCM (0,2 мл), затем добавляли трифторуксусную кислоту (0,026 мл), растворенную в DCM, и перемешивали при комнатной температуре в течение 1 часа 30 минут. После удаления растворителя при пониженном давлении, ее растворяли в DCM и промывали водой, и очищали колонкой с силикагелем, получая заявленное в заголовке соединение. (выход 50%)
1H-ЯМР (500 МГц, MeOD) δ 7,49 (с, 1H), 7,45 (с, 1H), 7,40 (с, 1H), 7,02 (д, J=7,6 Гц, 1H), 6,95 (д, J=3,7 Гц, 2H), 6,87 (д, J=11,9 Гц, 1H), 6,31 (с, 1H), 4,60 (с, 1H), 4,46-4,34 (1H), 4,13-3,90 (м, 2H), 3,75-3,66 (1H), 3,66-3,52 (м, 2H), 2,18-1,85 (3H), 1,75-1,56 (1H), 1,32 (т, J=6,7 Гц, 3H)
Пример 20: (R)-2-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)уксусная кислота
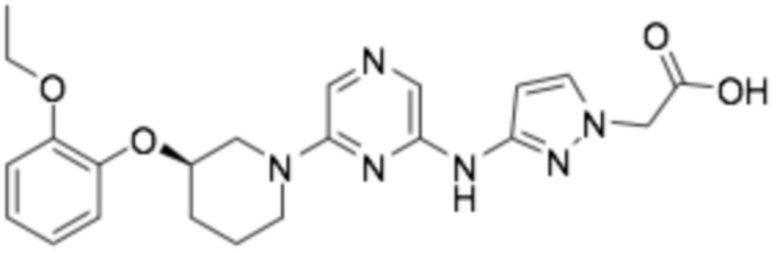
Стадия 1: этил ( R )-2-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)ацетат
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(1H-пиразол-3-ил)пиразин-2-амин (0,200 г, 0,526 ммоль), полученный в примере 19, и гидрид натрия (0,025 г, 0,631 ммоль) растворяли в тетрагидрофуране (2,63 мл) и перемешивали в течение 30 минут. Этил 2-бромацетат (0,087 мл, 0,789 ммоль), растворенный в тетрагидрофуране (2,63 мл), добавляли по каплям к реакционному раствору, с последующим перемешиванием в течение 2 часов. Добавляли воду по каплям, прекращая реакцию, затем растворяли в этилацетат и промывали соляным раствором. Органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем. (выход 3%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 7,69 (с, 1H), 7,59 (с, 1H), 7,32 (д, J=1,8 Гц, 1H), 7,09-6,81 (м, 4H), 6,66 (с, 1H), 6,36 (д, J=2,1 Гц, 1H), 4,83-4,70 (м, 2H), 4,37-4,18 (м, 4H), 4,05 (квд, J=6,8, 3,1 Гц, 2H), 3,99-3,83 (м, 1H), 3,35 (дд, J=13,0, 8,4 Гц, 1H), 3,31-3,18 (м, 1H), 2,29-2,12 (м, 1H), 1,98 (кв, J=4,5 Гц, 1H), 1,93-1,78 (м, 1H), 1,79-1,55 (м, 2H), 1,42 (т, J=7,0 Гц, 3H), 1,31 (т, J=7,2 Гц, 3H), 1,28 (с, 1H)
Стадия 2: ( R )-2-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1 H -пиразол-1-ил)уксусная кислота
Этил (R)-2-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)ацетат (0,0073 г, 0,016 ммоль), полученный на стадии 1, растворяли в 50% водном растворе этилового спирта (0,156 мл), и добавляли к нему гидроксид литий (1,124 мг, 0,047 ммоль), с последующим перемешиванием при 0°C в течение 1 часа. После удаления растворителя при пониженном давлении, его растворяли в этилацетате и промывали водой. Заявленный в заголовке продукт получали очисткой колонкой с силикагелем. (выход 26%)
m/z (M+H)+ рассчитанная для C22H27N6O4: 439, найденная 439
Пример 21: (R)-3-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)-2,2-диметилпропановая кислота
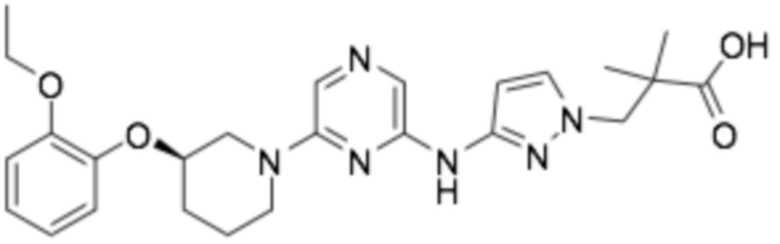
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,10 г, 0,30 ммоль), полученный в примере получения 1, и метил 3-(3-амино-1H-пиразол-1-ил)-2,2-диметилпропаноат (0,059 г, 0,30 ммоль), полученный в примере получения 66. (выход 45%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 9,32 (с, 1H), 7,45 (д, J=7,3 Гц, 2H), 7,13 (д, J=2,3 Гц, 1H), 7,06-6,77 (м, 5H), 6,47 (д, J=2,3 Гц, 1H), 4,35-4,14 (м, 4H), 4,06-3,89 (м, 2H), 3,89-3,78 (м, 1H), 3,37-3,08 (м, 2H), 2,17 (кв, J=4,3 Гц, 1H), 1,99-1,71 (м, 2H), 1,71-1,53 (м, 1H), 1,36 (т, J=6,9 Гц, 3H), 1,22-1,09 (м, 6H)
Пример 22: (R)-3-(3-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-фторпиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
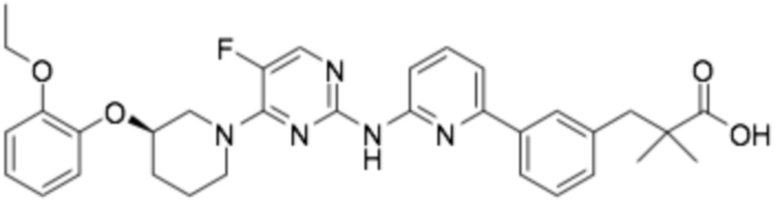
(R)-2-хлор-4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-фторпиримидин (54 мг, 0,15 ммоль), полученный в примере получения 8, и трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (50 мг, 0,15 ммоль), полученный в примере получения 113, растворяли в 1,4-диоксане, и растворенный кислород удаляли, и заполняли азотом, блокируя воздействие внешнего воздуха. Добавляли трис(дибензилиденацетон)дипалладий(0) (8,4 мг, 9,19 мкмоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантин (8,0 мг, 0,01 ммоль), карбонат цезия (125 мг, 0,38 ммоль), присоединяли устройство для охлаждения обратным холодильником и грели в течение 12 часов. После завершения реакции, реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (гексан : этилацетат). (выход 15%)
Полученное сложноэфирное соединение (15 мг, 0,02 ммоль) растворяли в DCM, добавляли трифторуксусную кислоту (36 мкл, 0,47 ммоль), с последующим перемешиванием при комнатной температуре в течение 2 часов. После завершения реакции, смесь отгоняли при пониженном давлении, удаляя избыток трифторуксусной кислоты, нейтрализовали 1 N гидроксидом натрия и экстрагировали этилацетатом. Органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (гексан : этилацетат). (выход 37%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,81 (с, 1H), 7,78 (д, J=7,8 Гц, 1H), 7,70 (т, J=7,8 Гц, 1H), 7,66-7,57 (1H), 7,54 (т, J=8,0 Гц, 1H), 7,45-7,23 (м, 5H), 7,23-7,11 (1H), 7,00-6,88 (м, 1H), 6,86 (д, J=4,1 Гц, 2H), 6,82-6,70 (м, 1H), 4,44 (д, J=2,7 Гц, 1H), 4,14-3,94 (м, 2H), 3,94-3,75 (м, 4H), 3,62 (д, J=8,7 Гц, 1H), 2,90 (с, 2H), 2,14-1,84 (м, 4H), 1,60 (д, J=7,3 Гц, 1H), 1,34-1,20 (м, 3H), 1,19-1,11 (м, 6H)
Пример 23: (R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(1-метил-1H-тетразол-5-ил)пиразин-2-амин
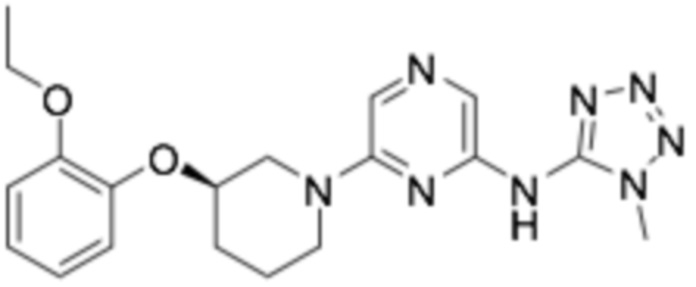
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,15 г, 0,45 ммоль), полученный в примере получения 1, и 1-метил-1H-тетразол-5-амин (0,049 г, 0,49 ммоль). (выход 44%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 8,18 (с, 1H), 7,79 (с, 1H), 7,41 (с, 1H), 7,01-6,89 (м, 2H), 6,88-6,75 (м, 2H), 4,34-4,23 (м, 1H), 4,06-3,91 (м, 2H), 3,88 (с, 3H), 3,86 (с, 1H), 3,70-3,56 (2H), 3,42 (кв, J=4,5 Гц, 1H), 2,13-2,03 (м, 1H), 2,02-1,95 (м, 1H), 1,90 (кв, J=4,1 Гц, 1H), 1,57 (кв, J=4,5 Гц, 1H), 1,34 (т, J=7,0 Гц, 3H)
Пример 24: (R)-N-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-фенилпиразин-2-амин
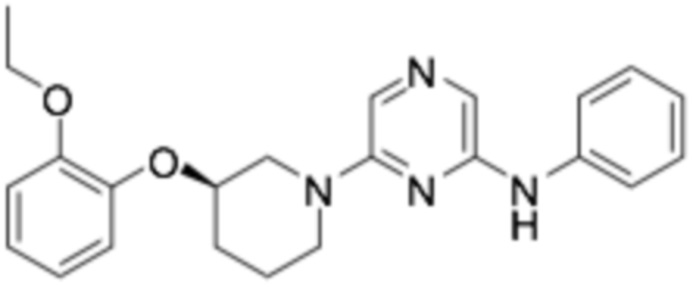
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,09 г, 0,27 ммоль), полученный в примере получения 1, и анилин (0,025 г, 0,27 ммоль).
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 7,56 (с, 1H), 7,52 (с, 1H), 7,36 (д, J=8 Гц, 2H), 7,03 (д, J=8 Гц, 2H), 6,94-7,03 (м, 3H), 6,82-6,91 (м, 2H), 6,20 (с, 1H), 4,31 (м, 1H), 4,19 (м, 1H), 4,04 (м, 3H), 3,89 (м, 1H), 3,43 (м, 1H), 3,29 (м, 1H), 2,15 (м, 1H), 1,96 (м, 1H), 1,86 (м, 1H), 1,64 (м, 1H), 1,39 (т, 3H)
Пример 25: (R)-N-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)метансульфонамид
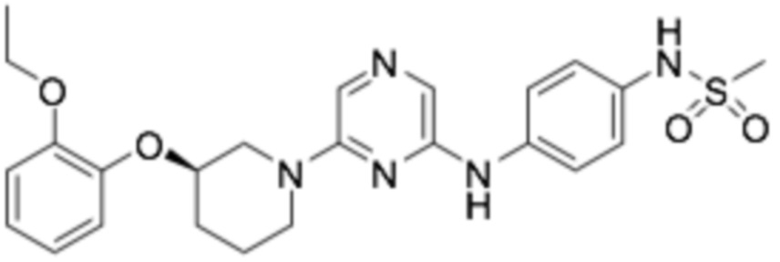
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,15 г, 0,45 ммоль), полученный в примере получения 1, и N-(4-аминофенил)метансульфонамид (0,092 г, 0,49 ммоль). (выход 69%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 7,57 (с, 1H), 7,45 (с, 1H), 7,42-7,33 (м, 2H), 7,13 (дд, J=9,6, 2,6 Гц, 2H), 7,03-6,93 (м, 2H), 6,89 (дд, J=7,9, 1,2 Гц, 1H), 6,82 (тд, J=7,5, 1,4 Гц, 1H), 6,48 (с, 1H), 6,28 (с, 1H), 4,35-4,24 (м, 1H), 4,16 (дд, J=13,1, 3,4 Гц, 1H), 4,07-3,95 (м, 2H), 3,83 (тд, J=8,9, 4,1 Гц, 1H), 3,43 (дд, J=13,4, 7,9 Гц, 1H), 3,37-3,24 (м, 1H), 2,96 (с, 3H), 2,23-2,09 (м, 1H), 1,98 (дд, J=9,8, 3,7 Гц, 1H), 1,93-1,80 (м, 1H), 1,69-1,61 (м, 1H), 1,38 (т, J=7,0 Гц, 3H)
Пример 26: (R)-2-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)-N-(пиридин-4-илметил)ацетамид
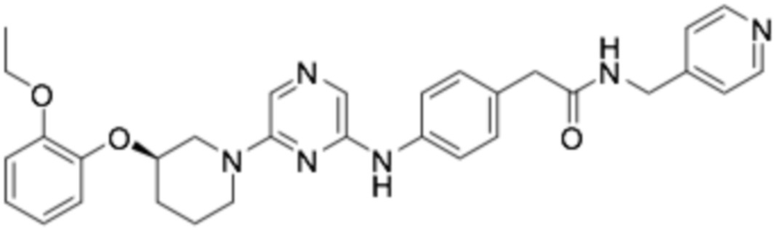
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,15 г, 0,45 ммоль), полученный в примере получения 1, и 2-(4-аминофенил)-N-(пиридин-4-ил-метил)ацетамид (0,11 г, 0,49 ммоль). (выход 54%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 8,49 (д, J=5,5 Гц, 2H), 7,54 (с, 1H), 7,46 (с, 1H), 7,38 (д, J=8,6 Гц, 2H), 7,15 (д, J=7,9 Гц, 2H), 7,07 (д, J=5,5 Гц, 2H), 7,01-6,96 (1H), 6,95-6,91 (м, 1H), 6,90-6,85 (м, 1H), 6,80 (тд, J=7,6, 1,4 Гц, 1H), 6,43 (с, 1H), 5,96 (с, 1H), 4,40 (д, J=6,1 Гц, 2H), 4,32-4,24 (м, 1H), 4,17 (дд, J=12,8, 3,1 Гц, 1H), 4,06-3,95 (м, 2H), 3,83 (тд, J=8,6, 4,1 Гц, 1H), 3,60 (с, 2H), 3,40 (дд, J=12,8, 8,0 Гц, 1H), 3,34-3,24 (м, 1H), 2,21-2,11 (м, 1H), 1,97 (дд, J=9,7, 3,8 Гц, 1H), 1,87 (дд, J=9,2, 3,7 Гц, 1H), 1,67-1,55 (м, 1H), 1,37 (т, J=7,0 Гц, 3H)
Пример 27: (R)-2-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)-2-метилпропановая кислота
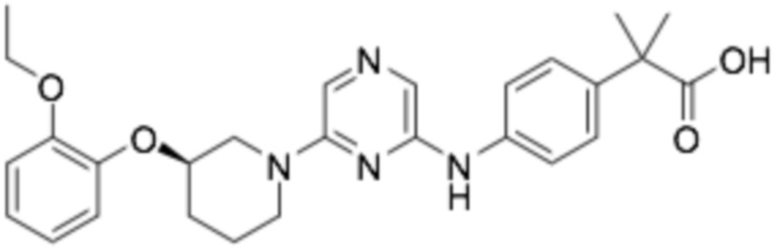
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,30 г, 0,90 ммоль), полученный в примере получения 1, и метил 2-(4-аминофенил)-2-метилпропаноат (0,19 г, 0,99 ммоль), полученный в примере получения 14. (выход 91%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,55 (с, 1H), 7,48 (с, 1H), 7,29-7,32 (м, 2H), 7,23 (дд, J=6,9, 1,8 Гц, 2H), 6,81-7,01 (м, 4H), 6,18 (с, 1H), 4,26-4,30 (м, 1H), 4,19 (дд, J=12,8, 3,7 Гц, 1H), 3,99-4,05 (м, 2H), 3,84-3,88 (м, 1H), 3,64 (с, 3H), 3,38 (дд, J=12,8, 8,2 Гц, 1H), 3,24-3,30 (м, 1H), 2,14-2,18 (м, 1H), 1,97 (кв, J=4,6 Гц, 1H), 1,87 (дд, J=9,4, 3,4 Гц, 1H), 1,60-1,64 (м, 1H), 1,56 (с, 6H), 1,38 (т, J=6,9 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения (0,40 г, 0,82 ммоль) тем же способом, как в примере 1. (выход 23%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,51 (с, 1H), 7,42 (с, 1H), 7,27-7,31 (м, 4H), 6,85-6,99 (м, 4H), 6,34 (с, 1H), 4,25-4,29 (м, 1H), 4,16 (д, J=12,8 Гц, 1H), 3,97-4,03 (м, 2H), 3,79-3,82 (м, 1H), 3,39 (дд, J=13,0, 8,0 Гц, 1H), 3,26 (т, J=10,1 Гц, 1H), 2,12-2,15 (м, 1H), 1,93-1,97 (м, 1H), 1,81-1,89 (м, 1H), 1,58 (с, 7H), 1,36 (т, J=6,9 Гц, 3H)
Пример 28: (R)-2-(4-((6-(3-(2-этоксифенокси)пиридин-1-ил)пиразин-2-ил)амино)фенил)-2-метилпропановая кислота
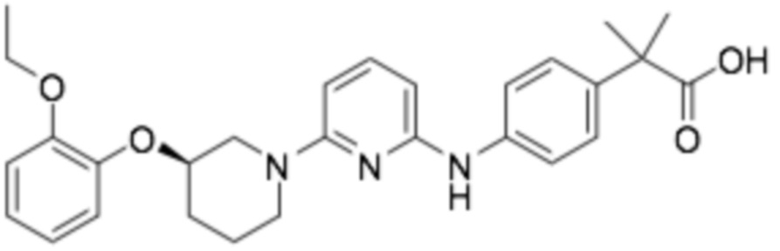
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин (0,30 г, 0,90 ммоль), полученный в примере получения 4, и метил 2-(4-аминофенил)-2-метилпропаноат (0,19 г, 0,99 ммоль), полученный в примере получения 14. (выход 88%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,30 (д, J=7,8 Гц, 2H), 7,24 (д, J=3,2 Гц, 1H), 7,20-7,22 (м, 2H), 7,04 (дд, J=8,0, 1,6 Гц, 1H), 6,82-6,96 (м, 3H), 6,19 (с, 1H), 6,11 (кв, J=8,4 Гц, 2H), 4,24-4,36 (м, 2H), 3,96-4,06 (м, 3H), 3,64 (с, 3H), 3,47 (д, J=7,3 Гц, 0H), 3,03-3,19 (м, 2H), 2,19 (дд, J=12,6, 4,3 Гц, 1H), 1,77-1,91 (м, 2H), 1,38-1,63 (м, 12H), 1,18-1,24 (м, 1H), -0,01 (т, J=3,2 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения (0,40 г, 0,82 ммоль) тем же способом, как в примере 1.
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,22-7,30 (м, 5H), 7,03 (д, J=7,8 Гц, 1H), 6,89 (дкв, J=28,9, 7,5 Гц, 3H), 6,14 (д, J=7,8 Гц, 1H), 6,08 (д, J=7,8 Гц, 1H), 4,24-4,32 (м, 2H), 4,03 (кв, J=6,9 Гц, 2H), 3,95 (д, J=12,8 Гц, 1H), 3,17 (дд, J=11,9, 8,2 Гц, 1H), 3,07 (т, J=10,5 Гц, 1H), 2,19 (д, J=8,2 Гц, 1H), 1,89 (кв, J=4,3 Гц, 1H), 1,78 (д, J=11,9 Гц, 1H), 1,57-1,65 (м, 7H), 1,39 (т, J=6,9 Гц, 3H)
Пример 29: (R)-2-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)-2-метилпропановая кислота
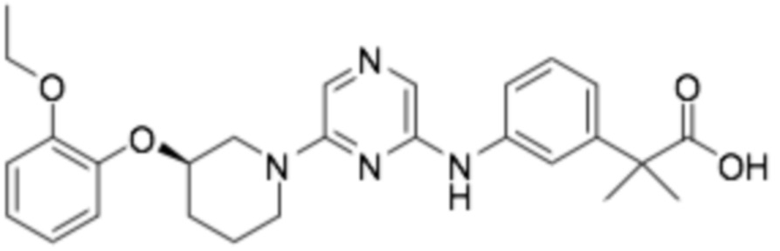
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (1,036 г, 3,10 ммоль), полученный в примере получения 1, и метил 2-(3-аминофенил)-2-метилпропаноат (0,5 г, 2,59 ммоль), полученный в примере получения 15. (выход на 2 стадии 4%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,63 (с, 1H), 7,50 (с, 1H), 7,45 (с, 1H), 7,22 (д, J=7,8 Гц, 1H), 7,07 (т, J=9,8 Гц, 2H), 7,00-6,89 (м, 2H), 6,89-6,76 (м, 2H), 6,42 (с, 1H), 4,44-4,21 (м, 2H), 4,05-3,91 (м, 2H), 3,83 (кв, J=4,4 Гц, 1H), 3,42-3,26 (1H), 3,26-3,05 (м, 1H), 2,25-2,06 (м, 1H), 1,93 (кв, J=4,6 Гц, 1H), 1,83-1,67 (1H), 1,67-1,59 (м, 1H), 1,59-1,48 (м, 6H), 1,35 (т, J=6,9 Гц, 3H)
Пример 30: (R)-3-(3'-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-[1,1'-бифенил]-4-ил)-2,2-диметилпропановая кислота
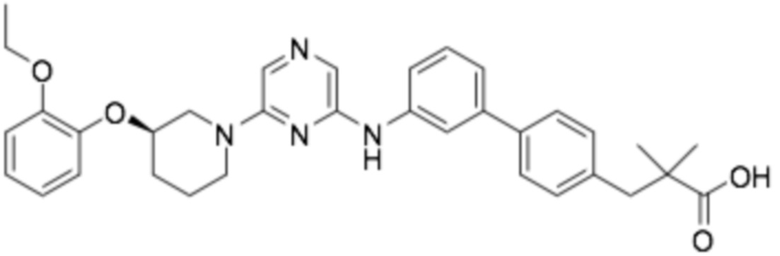
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,192 г, 0,575 ммоль), полученный в примере получения 1, и трет-бутил 3-(3'-амино-[1,1'-бифенил]-4-ил)-2,2-диметилпропаноат (0,17 г, 0,522 ммоль), полученный в примере получения 94. (выход на 2 стадии 12%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,58 (с, 1H), 7,55-7,48 (2H), 7,48-7,39 (м, 2H), 7,30-7,22 (2H), 7,18 (кв, J=7,6 Гц, 3H), 6,93 (кв, J=7,6 Гц, 2H), 6,88-6,83 (м, 1H), 6,83-6,73 (м, 1H), 6,53 (с, 1H), 4,37-4,18 (м, 1H), 4,18-4,06 (м, 1H), 4,05-3,89 (м, 2H), 3,83 (кв, J=4,3 Гц, 1H), 3,53-3,36 (1H), 3,36-3,19 (м, 1H), 2,90 (с, 2H), 2,25-2,06 (1H), 1,99-1,74 (м, 2H), 1,70-1,48 (м, 1H), 1,34 (кв, J=7,3 Гц, 3H), 1,23 (с, 6H)
Пример 31: (R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(пиридин-2-ил)пиразин-2-амин
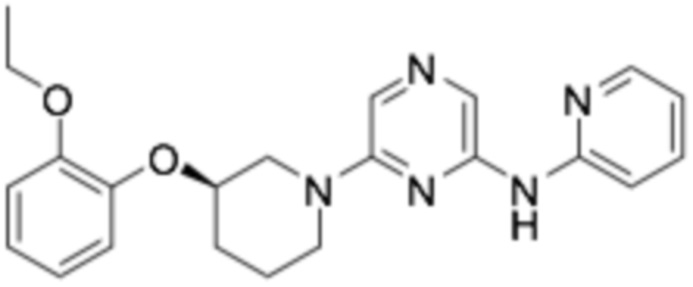
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,20 г, 0,60 ммоль), полученный в примере получения 1, и 2-аминопиридин (0,06 г, 0,66 ммоль). (выход 94%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 8,24 (д, J=4,9 Гц, 1H), 7,89 (с, 1H), 7,66 (с, 1H), 7,62 (д, J=8,6 Гц, 1H), 7,54-7,42 (м, 1H), 7,09 (с, 1H), 6,99 (д, J=7,9 Гц, 1H), 6,95 (т, J=7,0 Гц, 1H), 6,90-6,72 (м, 3H), 4,36-4,25 (м, 1H), 4,19 (дд, J=13,2, 3,3 Гц, 1H), 4,08-3,94 (м, 2H), 3,89-3,81 (м, 1H), 3,44 (дд, J=13,4, 7,9 Гц, 1H), 3,38-3,25 (м, 1H), 2,17 (т, J=5,8 Гц, 1H), 2,05-1,95 (1H), 1,93-1,79 (м, 1H), 1,67 (д, J=6,1 Гц, 1H), 1,37 (т, J=7,0 Гц, 3H)
Пример 32: (R)-6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)никотиновая кислота
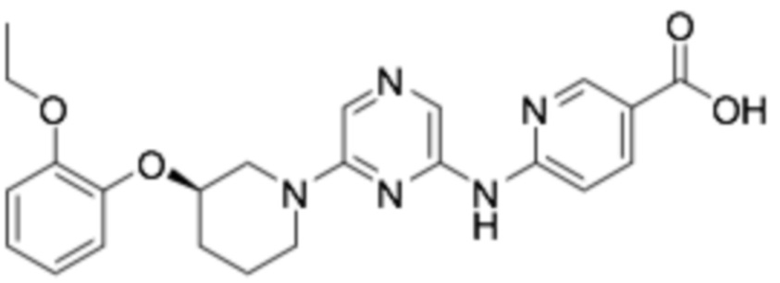
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,30 г, 0,90 ммоль), полученный в примере получения 1, и метил 6-аминоникотинат (0,15 г, 0,99 ммоль). (выход 72%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 8,87 (д, J=2,4 Гц, 1H), 8,08 (дд, J=8,9, 2,1 Гц, 1H), 7,90 (с, 1H), 7,73 (с, 1H), 7,65 (д, J=8,6 Гц, 1H), 7,36 (с, 1H), 7,04-6,92 (м, 2H), 6,90-6,68 (м, 2H), 4,32 (тд, J=7,9, 3,7 Гц, 1H), 4,12 (дд, J=13,1, 3,4 Гц, 1H), 4,07-3,95 (м, 2H), 3,91 (с, 3H), 3,80 (тд, J=9,2, 4,5 Гц, 1H), 3,53 (дд, J=13,1, 7,6 Гц, 1H), 3,46-3,31 (м, 1H), 2,27-2,11 (м, 1H), 2,09-1,99 (м, 1H), 1,97-1,84 (м, 1H), 1,66 (кв, J=4,5 Гц, 1H), 1,36 (т, J=6,7 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения (0,29 г, 0,65 ммоль) тем же способом, как в примере 1. (выход 21%)
1H-ЯМР (500 МГц, DMSO-D6): δ 12,99-12,26 (1H), 10,00 (с, 1H), 8,71 (с, 1H), 8,12 (с, 1H), 7,95 (д, J=7,9 Гц, 1H), 7,76 (с, 1H), 7,61 (д, J=8,6 Гц, 1H), 7,00 (д, J=7,9 Гц, 1H), 6,89 (д, J=6,7 Гц, 1H), 6,84 (д, J=7,3 Гц, 1H), 6,76 (т, J=7,0 Гц, 1H), 4,40-4,24 (1H), 4,03 (д, J=11,6 Гц, 1H), 3,96-3,80 (м, 2H), 3,68 (д, J=13,4 Гц, 1H), 3,57-3,39 (м, 2H), 2,12-1,94 (1H), 1,86 (с, 1H), 1,72 (д, J=9,2 Гц, 1H), 1,54 (с, 1H), 1,18 (т, J=7,0 Гц, 3H)
Пример 33: (R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)изоникотиновая кислота
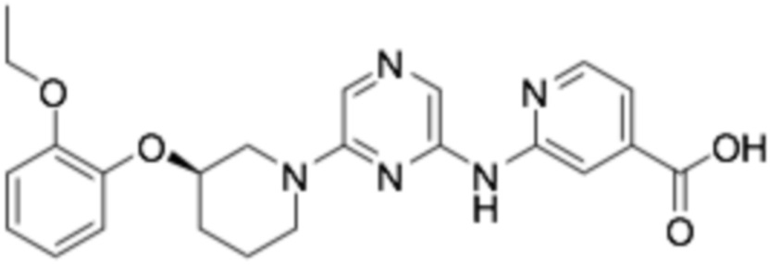
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,20 г, 0,60 ммоль), полученный в примере получения 1, и метил 2-аминоизоникотинат (0,10 г, 0,66 ммоль). (выход 71%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 8,46 (с, 1H), 8,36 (д, J=4,9 Гц, 1H), 7,80 (с, 1H), 7,68 (с, 1H), 7,40 (д, J=5,5 Гц, 1H), 7,22 (с, 1H), 6,94 (д, J=7,9 Гц, 1H), 6,92-6,88 (1H), 6,86-6,82 (м, 1H), 6,80-6,67 (м, 1H), 4,38-4,28 (1H), 4,11 (дд, J=13,1, 3,4 Гц, 1H), 4,05-3,96 (м, 2H), 3,92 (дт, J=13,4, 3,8 Гц, 1H), 3,88 (с, 3H), 3,60 (дд, J=13,1, 7,6 Гц, 1H), 3,51-3,35 (м, 1H), 2,13 (с, 1H), 2,04 (тд, J=6,6, 3,3 Гц, 1H), 1,93 (кв, J=4,1 Гц, 1H), 1,66 (кв, J=4,5 Гц, 1H), 1,36 (т, J=7,0 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения (0,18 г, 0,40 ммоль) тем же способом, как в примере 1. (выход 57%)
1H-ЯМР (500 МГц, DMSO-D6): δ 9,76 (с, 1H), 8,31 (д, J=5,5 Гц, 2H), 8,04 (с, 1H), 7,66 (с, 1H), 7,24 (д, J=5,5 Гц, 1H), 6,96 (д, J=7,3 Гц, 1H), 6,87 (с, 1H), 6,81 (т, J=7,6 Гц, 1H), 6,72 (т, J=7,6 Гц, 1H), 4,29 (с, 1H), 3,93 (д, J=13,4 Гц, 1H), 3,89-3,76 (м, 2H), 3,70 (д, J=15,9 Гц, 1H), 3,64-3,51 (м, 2H), 1,97 (с, 1H), 1,84 (с, 1H), 1,73 (д, J=7,9 Гц, 1H), 1,53 (д, J=4,3 Гц, 1H), 1,18 (кв, J=7,3 Гц, 3H)
Пример 34: (R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)никотиновая кислота
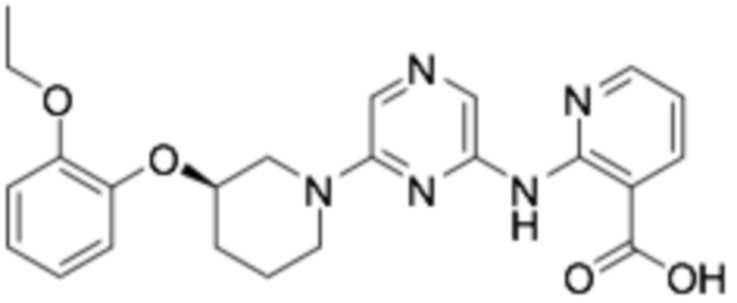
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,20 г, 0,60 ммоль), полученный в примере получения 1, и метил 2-аминоникотинат (0,10 г, 0,66 ммоль). (выход 85%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 10,40 (с, 1H), 9,10 (с, 1H), 8,46 (кв, J=2,2 Гц, 1H), 8,28 (дд, J=7,6, 2,1 Гц, 1H), 7,79 (с, 1H), 7,06 (кв, J=3,1 Гц, 1H), 6,99-6,91 (м, 2H), 6,88 (кв, J=3,3 Гц, 1H), 6,83 (кв, J=4,3 Гц, 1H), 4,31-4,22 (м, 2H), 4,04 (квд, J=6,9, 2,3 Гц, 2H), 3,98 (т, J=4,6 Гц, 1H), 3,95 (с, 3H), 3,36 (дд, J=14,1, 9,2 Гц, 1H), 3,33-3,23 (м, 1H), 2,22-2,13 (м, 1H), 1,95 (кв, J=4,5 Гц, 1H), 1,86 (д, J=10,4 Гц, 1H), 1,66-1,55 (м, 1H), 1,41 (т, J=7,0 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения (0,21 г, 0,47 ммоль) тем же способом, как в примере 1. (выход 74%)
1H-ЯМР (500 МГц, DMSO-D6): δ 10,63 (с, 1H), 8,91 (с, 1H), 8,48 (кв, J=2,2 Гц, 1H), 8,37-8,20 (1H), 7,90 (с, 1H), 7,11-6,97 (м, 2H), 6,87 (дт, J=12,2, 4,9 Гц, 3H), 4,43-4,20 (м, 1H), 4,04 (д, J=12,8 Гц, 1H), 3,95-3,79 (м, 2H), 3,76-3,62 (м, 1H), 3,59-3,42 (м, 2H), 2,08-1,94 (м, 1H), 1,83 (т, J=3,4 Гц, 1H), 1,75 (кв, J=4,1 Гц, 1H), 1,51 (кв, J=4,3 Гц, 1H), 1,20 (т, J=7,0 Гц, 3H)
Пример 35: (R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)-2-метилпропановая кислота
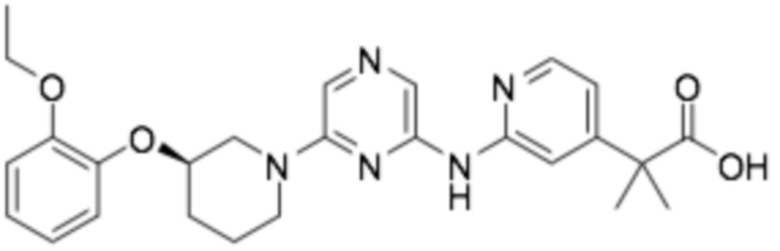
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (1,12 г, 3,35 ммоль), полученный в примере получения 1, и метил 2-(2-аминопиридин-4-ил)-2-метилпропаноат (650 мг, 3,35 ммоль), полученный в примере получения 60. (выход на 2 стадии 1%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,31 (с, 1H), 7,96 (д, J=4,6 Гц, 1H), 7,69 (с, 2H), 6,97-6,73 (5H), 4,36 (кв, J=4,1 Гц, 1H), 4,06-3,92 (м, 3H), 3,89-3,75 (1H), 3,46 (т, J=10,2 Гц, 1H), 3,38-3,22 (м, 1H), 2,12 (д, J=5,5 Гц, 1H), 2,05 (д, J=15,3 Гц, 1H), 1,96 (с, 1H), 1,80-1,54 (7H), 1,33 (т, J=7,0 Гц, 3H)
Пример 36: (R)-2-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)уксусная кислота
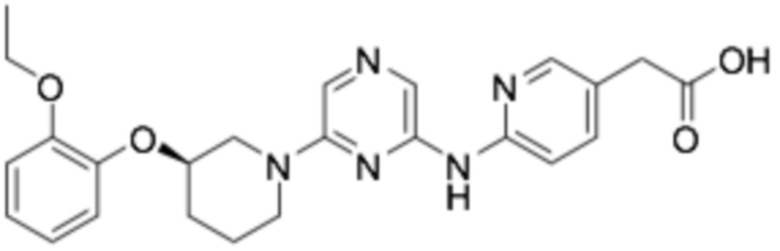
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,14 г, 0,42 ммоль), полученный в примере получения 1, и метил 2-(6-аминопиридин-3-ил)ацетат (0,08 г, 0,46 ммоль), полученный в примере получения 12. (выход 62%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 8,14(с, 1H), 7,87(с, 1H), 7,66(с, 1H), 7,62(д, J=8 Гц, 1H), 7,46(д, J=8 Гц, 1H), 7,08(с, 1H), 6,99(м, 2H), 6,88(м, 2H), 4,32(м, 1H), 4,29(м, 1H), 4,02(м, 2H), 3,87(м, 1H), 3,83(с, 1H), 3,56(с, 2H), 3,48(м, 1H), 3,34(м, 1H), 2,17(м, 1H), 2,02(м, 1H), 1,91(м, 1H), 1,66(м, 1H), 1,38(т, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения (0,11 г, 0,24 ммоль) тем же способом, как в примере 1. (выход 19%)
1H-ЯМР (400 МГц, DMSO-D6): δ 9,54(с, 1H), 8,10(с, 1H), 8,06(с, 1H), 7,67(с, 1H), 7,60(д, J=8 Гц, 1H), 7,41(д, J=6 Гц, 1H), 7,04(д, J=8 Гц, 1H), 6,95(м, 2H), 6,84(м, 1H), 4,33(м, 1H), 4,10(м, 1H), 3,95(м, 2H), 3,72(м, 1H), 3,51(с, 2H), 3,45(м, 2H), 2,04(м, 1H), 1,87(м, 1H), 1,75(м, 1H), 1,57(м, 1H), 1,25(т, 3H)
Пример 37: (R,E)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)акриловая кислота
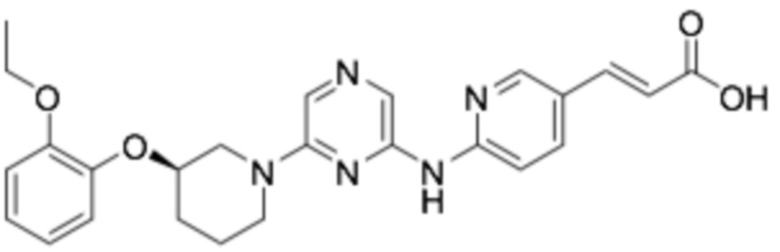
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,50 г, 1,50 ммоль), полученный в примере получения 1, и метил (E)-3-(6-аминопиридин-3-ил)акрилат (0,29 г, 1,65 ммоль), полученный в примере получения 13. (выход 70%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 8,35 (с, 1H), 7,95-7,81 (1H), 7,71 (с, 1H), 7,64 (д, J=2,4 Гц, 2H), 7,62 (д, J=15,9 Гц, 1H), 7,23 (с, 1H), 7,01-6,92 (м, 2H), 6,91-6,79 (м, 2H), 6,34 (д, J=16,5 Гц, 1H), 4,33 (д, J=4,3 Гц, 1H), 4,19-4,13 (м, 1H), 4,05-3,96 (м, 2H), 3,82 (д, J=7,9 Гц, 4H), 3,50 (дд, J=12,8, 7,9 Гц, 1H), 3,36 (д, J=9,8 Гц, 1H), 2,21-2,13 (1H), 2,06-1,97 (1H), 1,97-1,87 (1H), 1,66 (с, 1H), 1,37 (т, J=7,0 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения (0,15 г, 0,32 ммоль) тем же способом, как в примере 1. (выход 82%)
1H-ЯМР (500 МГц, DMSO-D6): δ 10,71 (с, 1H), 8,49 (с, 1H), 8,16 (с, 1H), 8,04 (д, J=6,7 Гц, 1H), 7,88 (с, 1H), 7,56-7,47 (м, 2H), 6,97 (д, J=6,1 Гц, 1H), 6,86-6,81 (1H), 6,80-6,70 (м, 2H), 6,47 (д, J=15,9 Гц, 1H), 4,45 (с, 1H), 3,92-3,72 (м, 5H), 3,61 (с, 1H), 1,96 (д, J=7,9 Гц, 1H), 1,84 (д, J=29,3 Гц, 2H), 1,55 (с, 1H), 1,13 (т, J=7,0 Гц, 3H)
Пример 38: (R)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)пропановая кислота
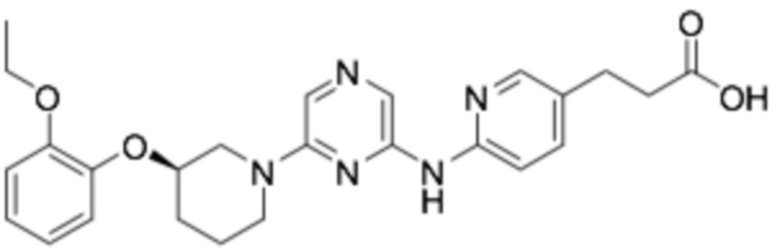
(R,E)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)акриловую кислоту (0,3 г, 0,63 ммоль), полученную в примере 37, и Pd/C (67 мг) растворяли в 20 мл метанола, и реакцию восстановления проводили, применяя баллон с водородом. После перемешивания при комнатной температуре в течение 2 часов, ее фильтровали, и органический растворитель удаляли при пониженном давлении, получая требуемый продукт. (выход 63%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 8,09 (с, 1H), 7,83 (с, 1H), 7,63 (с, 1H), 7,58 (д, J=8,6 Гц, 1H), 7,37-7,32 (м, 1H), 7,12 (с, 1H), 7,01-6,92 (м, 2H), 6,90-6,79 (м, 2H), 4,35-4,27 (м, 1H), 4,19 (д, J=12,8 Гц, 1H), 4,05-3,97 (м, 2H), 3,82 (д, J=11,6 Гц, 1H), 3,67 (с, 3H), 3,42 (дд, J=12,8, 7,9 Гц, 1H), 3,32 (д, J=12,8 Гц, 1H), 2,87 (т, J=7,6 Гц, 2H), 2,60 (т, J=7,6 Гц, 2H), 2,18 (с, 1H), 2,03-1,95 (1H), 1,88 (д, J=9,8 Гц, 1H), 1,69 (с, 1H), 1,37 (т, J=7,0 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения (0,15 г, 0,32 ммоль) тем же способом, как в примере 1. (выход 57%)
1H-ЯМР (500 МГц, DMSO-D6): δ 9,44 (с, 1H), 8,05 (д, J=1,8 Гц, 1H), 8,02 (с, 1H), 7,62 (с, 1H), 7,53 (д, J=8,6 Гц, 1H), 7,35 (дд, J=8,6, 2,4 Гц, 1H), 7,00 (дд, J=7,9, 1,8 Гц, 1H), 6,91 (дд, J=7,9, 1,2 Гц, 1H), 6,87 (тд, J=7,6, 1,8 Гц, 1H), 6,78 (тд, J=7,6, 1,6 Гц, 1H), 4,35-4,24 (м, 1H), 4,06 (д, J=12,8 Гц, 1H), 3,97-3,85 (м, 2H), 3,75-3,64 (м, 1H), 3,47-3,31 (м, 2H), 2,70 (т, J=7,6 Гц, 2H), 2,47 (т, J=1,5 Гц, 2H), 2,02 (с, 1H), 1,83 (с, 1H), 1,70 (д, J=9,2 Гц, 1H), 1,60-1,48 (м, 1H), 1,20 (т, J=7,0 Гц, 3H)
Пример 39: (R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)-2,2-диметилпропановая кислота
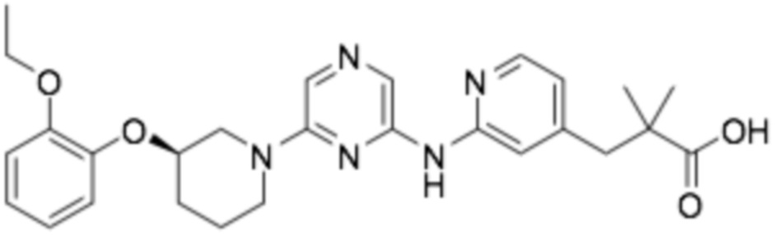
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (165 мг, 0,495 ммоль), полученный в примере получения 1, и трет-бутил 3-(2-аминопиридин-4-ил)-2,2-диметилпропаноат (124 мг, 0,495 ммоль), полученный в примере получения 63. (выход на 2 стадии 41%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,06 (с, 1H), 8,01-7,82 (м, 2H), 7,60 (с, 1H), 7,55-7,45 (1H), 7,02-6,80 (м, 3H), 6,80-6,65 (м, 2H), 4,40-4,21 (м, 1H), 4,19-4,05 (м, 1H), 4,05-3,94 (м, 2H), 3,81-3,69 (м, 1H), 3,46 (дд, J=13,3, 7,8 Гц, 1H), 3,40-3,22 (м, 1H), 2,81-2,61 (2H), 2,15-2,03 (м, 1H), 1,97 (дд, J=9,8, 3,4 Гц, 1H), 1,91-1,75 (м, 1H), 1,72-1,49 (м, 1H), 1,34 (т, J=7,1 Гц, 3H), 1,22 (д, J=3,2 Гц, 6H)
Пример 40: (R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(5-фенилпиридин-2-ил)пиразин-2-амин
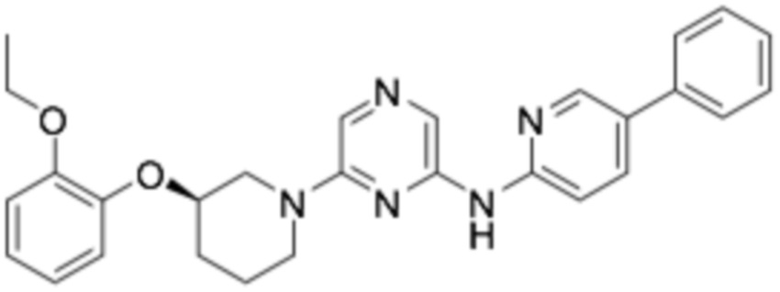
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,1 г, 0,30 ммоль), полученный в примере получения 1, и 2-амино-(5-фенил)пиридин (0,05 г, 0,30 ммоль). (выход 71%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,48 (д, J=2,4 Гц, 1H), 7,87 (с, 1H), 7,78-7,70 (2H), 7,67 (с, 1H), 7,61-7,52 (м, 2H), 7,51-7,42 (2H), 7,35 (т, J=7,3 Гц, 1H), 7,32 (с, 1H), 7,06-6,98 (1H), 6,93 (тд, J=7,6, 1,2 Гц, 1H), 6,88 (дд, J=7,9, 1,8 Гц, 1H), 6,82 (тд, J=7,5, 1,6 Гц, 1H), 4,41-4,29 (м, 1H), 4,22 (дд, J=12,8, 3,7 Гц, 1H), 4,10-3,94 (м, 2H), 3,86 (тд, J=8,9, 4,1 Гц, 1H), 3,46 (дд, J=12,8, 7,9 Гц, 1H), 3,39-3,31 (м, 1H), 2,27-2,12 (м, 1H), 2,08-1,98 (м, 1H), 1,96-1,85 (м, 1H), 1,83-1,51 (м, 3H), 1,38 (т, J=7,0 Гц, 3H), 1,29 (д, J=39,7 Гц, 1H), 0,87 (дд, J=26,3, 19,6 Гц, 0H)
Пример 41: (R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(4-фенилпиридин-2-ил)пиразин-2-амин
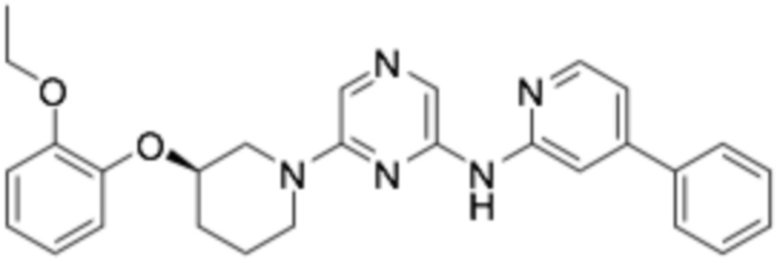
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,1 г, 0,30 ммоль), полученный в примере получения 1, и 2-амино-(4-фенил)пиридин (0,06 г, 0,36 ммоль), полученный в примере получения 11. (выход 45%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,35 (д, J=5,5 Гц, 1H), 7,92 (д, J=31,8 Гц, 1H), 7,86-7,82 (м, 3H), 7,65 (д, J=37,3 Гц, 1H), 7,50 (с, 1H), 7,35 (дт, J=19,0, 7,2 Гц, 3H), 7,29-7,26 (м, 1H), 6,92 (т, J=7,6 Гц, 2H), 6,84 (д, J=7,9 Гц, 1H), 6,78 (т, J=7,6 Гц, 1H), 5,53 (с, 1H), 4,41-4,26 (м, 1H), 4,11 (кв, J=7,1 Гц, 1H), 4,06-3,88 (м, 3H), 3,85-3,70 (м, 1H), 3,61 (кв, J=6,7 Гц, 1H), 3,54-3,39 (м, 1H), 2,18-2,06 (м, 2H), 2,05-1,98 (м, 2H), 1,97-1,85 (м, 1H), 1,63 (квд, J=8,8, 4,3 Гц, 1H), 1,44-1,30 (м, 3H), 1,29-1,14 (м, 2H)
Пример 42: (R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2-метилпропановая кислота
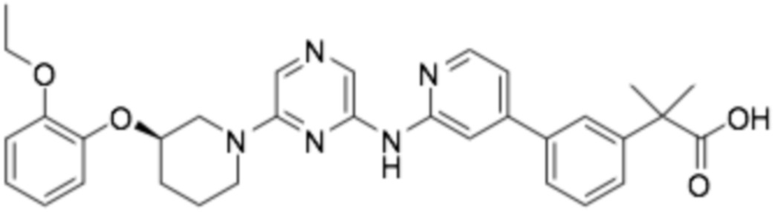
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,237 г, 0,709 ммоль), полученный в примере получения 1, и метил 2-(3-(2-аминопиридин-4-ил)фенил)-2-метилпропаноат (0,230 г, 0,851 ммоль), полученный в примере получения 27. (выход 56%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,27 (с, 1H), 8,16-8,05 (1H), 7,81 (с, 1H), 7,66 (с, 2H), 7,50 (д, J=8,5 Гц, 2H), 7,40 (т, J=7,6 Гц, 1H), 7,05 (д, J=5,5 Гц, 1H), 6,93-6,84 (м, 2H), 6,81 (д, J=7,0 Гц, 1H), 6,77-6,65 (м, 1H), 4,29 (д, J=3,7 Гц, 1H), 4,10 (д, J=3,1 Гц, 1H), 3,94 (т, J=7,0 Гц, 2H), 3,90-3,79 (1H), 3,58 (дд, J=13,1, 7,6 Гц, 1H), 3,42 (с, 1H), 2,08 (м, 1H), 1,94-1,84 (м, 2H), 1,71 (д, J=8,2 Гц, 6H), 1,67-1,55 (1H), 1,33 (т, J=7,0 Гц, 3H)
Пример 43: (R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2-метилпропановая кислота
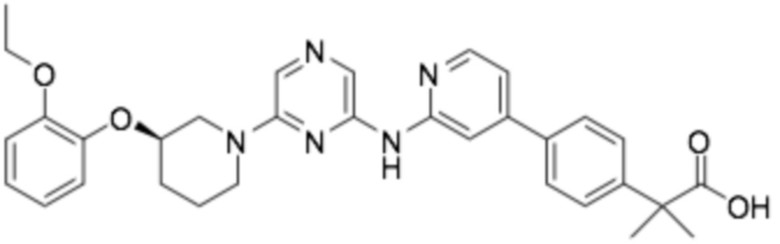
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,329 г, 0,986 ммоль), полученный в примере получения 1, и метил 2-(4-(2-аминопиридин-4-ил)фенил)-2-метилпропаноат (0,32 г, 1,184 ммоль), полученный в примере получения 26. (выход 1%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,51 (с, 1H), 8,45 (д, J=8,7 Гц, 1H), 8,13-7,99 (м, 1H), 7,78 (д, J=10,1 Гц, 1H), 7,71-7,62 (м, 1H), 7,59 (д, J=8,7 Гц, 2H), 7,49 (т, J=9,1 Гц, 2H), 7,13-7,01 (м, 1H), 6,93-6,66 (м, 4H), 4,36-4,23 (м, 1H), 4,16-4,02 (м, 1H), 3,99-3,87 (м, 2H), 3,87-3,77 (м, 1H), 3,57 (дд, J=13,0, 7,5 Гц, 1H), 3,47-3,36 (м, 1H), 2,16-1,79 (м, 3H), 1,61 (с, 7H), 1,35-1,25 (м, 3H)
Пример 44: (R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2,2-диметилпропановая кислота
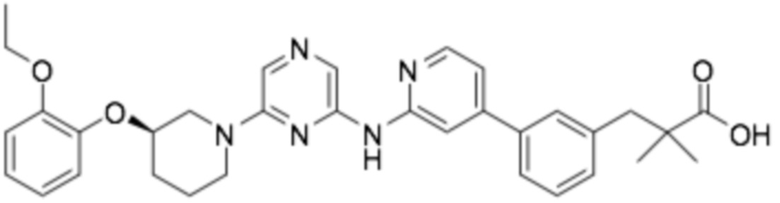
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (210 мг, 0,629 ммоль), полученный в примере получения 1, и метил 3-(3-(2-аминопиридин-4-ил)фенил)-2,2-диметилпропаноат (179 мг, 0,629 ммоль), полученный в примере получения 58. (выход на 2 стадии 4%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 10,10 (с, 1H), 8,27 (с, 1H), 7,68 (д, J=5,5 Гц, 1H), 7,62 (с, 1H), 7,52 (с, 1H), 7,37 (д, J=7,9 Гц, 1H), 7,33 (т, J=7,5 Гц, 1H), 7,20 (д, J=7,3 Гц, 1H), 6,93 (с, 1H), 6,80 (дд, J=14,6, 7,9 Гц, 2H), 6,74 (д, J=7,9 Гц, 1H), 6,63 (т, J=7,6 Гц, 1H), 6,51 (д, J=4,9 Гц, 1H), 4,37-4,29 (м, 1H), 4,00 (дд, J=13,1, 2,7 Гц, 1H), 3,93-3,87 (м, 2H), 3,86-3,79 (м, 1H), 3,65 (дд, J=12,4, 7,8 Гц, 1H), 3,56-3,47 (м, 1H), 2,94 (дд, J=29,1, 13,0 Гц, 2H), 2,16-2,11 (м, 1H), 2,07-1,90 (м, 2H), 1,73-1,62 (м, 1H), 1,36-1,29 (м, 9H)
Пример 45: (R)-3-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2,2-диметилпропановая кислота
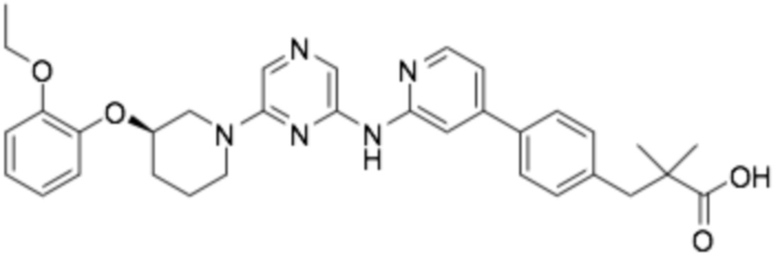
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (175 мг, 0,524 ммоль), полученный в примере получения 1, и трет-бутил 3-(4-(2-аминопиридин-4-ил)фенил)-2,2-диметилпропаноат (171 мг, 0,524 ммоль), полученный в примере получения 71. (выход на 2 стадии 20%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,13 (с, 1H), 8,43-8,28 (1H), 8,08 (д, J=5,5 Гц, 1H), 7,70 (с, 1H), 7,59 (с, 1H), 7,46 (д, J=8,2 Гц, 2H), 7,23 (д, J=8,2 Гц, 2H), 7,02 (д, J=5,5 Гц, 1H), 6,96-6,64 (м, 4H), 4,34-4,18 (м, 1H), 4,01 (д, J=12,8 Гц, 1H), 3,93 (кв, J=7,0 Гц, 2H), 3,79 (д, J=12,8 Гц, 1H), 3,50 (дд, J=12,8, 7,8 Гц, 1H), 3,43-3,25 (1H), 2,90 (с, 2H), 2,09-1,99 (м, 1H), 1,98-1,87 (м, 1H), 1,87-1,73 (м, 1H), 1,66-1,45 (м, 1H), 1,29 (кв, J=6,9 Гц, 9H)
Пример 46: (R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)пропановая кислота
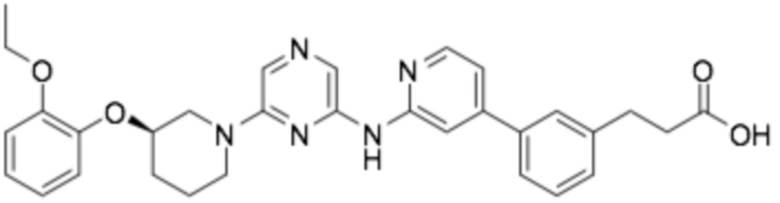
Стадия 1: Метил ( R )-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)пропаноат
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,189 г, 0,568 ммоль), полученный в примере получения 1, и метил 3-(3-(2-аминопиридин-4-ил)фенил)пропаноат (0,160 г, 0,624 ммоль), полученный в примере получения 56. (выход 64%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,32 (д, J=5,2 Гц, 1H), 8,03 (с, 1H), 7,92 (с, 1H), 7,75-7,63 (1H), 7,56-7,45 (м, 2H), 7,37 (т, J=7,5 Гц, 1H), 7,28-7,24 (1H), 7,22 (с, 1H), 7,17-7,02 (м, 1H), 7,01-6,89 (м, 2H), 6,89-6,83 (м, 1H), 6,79 (тд, J=7,6, 1,5 Гц, 1H), 4,40-4,25 (м, 1H), 4,22-4,09 (м, 1H), 4,04-3,95 (м, 2H), 3,93 (дт, J=13,1, 4,8 Гц, 1H), 3,70 (с, 3H), 3,58 (дд, J=13,1, 7,9 Гц, 1H), 3,51-3,37 (м, 1H), 3,03 (т, J=7,9 Гц, 2H), 2,69 (т, J=7,8 Гц, 2H), 2,24-2,11 (м, 1H), 2,05-1,97 (м, 1H), 1,97-1,84 (м, 1H), 1,76-1,66 (м, 1H), 1,37 (т, J=6,9 Гц, 3H)
Стадия 2: ( R )-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)пропановая кислота
Метил (R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)пропаноат (0,090 г, 0,163 ммоль), полученный на стадии 1, растворяли в метаноле (0,813 мл) и THF (0,813 мл), и затем добавляли к нему 7 N водный раствор гидроксида натрия (0,232 мл, 1,626 ммоль) и перемешивали при комнатной температуре в течение 4 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Заявленный в заголовке продукт получали очисткой колонкой с силикагелем. (выход 29%)
m/z (M+H)+ рассчитанная для C31H34N5O4: 540, найденная 540
Пример 47: (R)-3-(3-(5-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)фенил)-2,2-диметилпропановая кислота
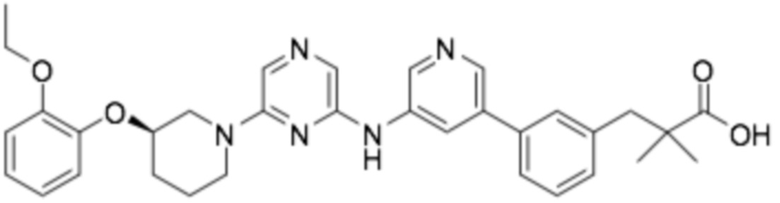
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (20,3 мг, 0,0610 ммоль), полученный в примере получения 1, и метил 3-(3-(5-аминопиридин-3-ил)фенил)-2,2-диметилпропаноат (17,3 мг, 0,0610 ммоль), полученный в примере получения 83. (выход на 2 стадии 29%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,50 (с, 1H), 8,24 (д, J=17,4 Гц, 2H), 7,81 (с, 1H), 7,47 (с, 1H), 7,43 (с, 1H), 7,32 (т, J=7,5 Гц, 2H), 7,24 (с, 1H), 7,14 (д, J=7,3 Гц, 1H), 6,90 (д, J=7,8 Гц, 1H), 6,84 (т, J=7,8 Гц, 1H), 6,77 (д, J=6,9 Гц, 1H), 6,74-6,61 (1H), 4,40 (с, 1H), 4,04-3,70 (м, 4H), 3,59 (д, J=12,8 Гц, 1H), 3,48 (д, J=6,9 Гц, 1H), 3,06-2,80 (м, 2H), 2,15-1,81 (м, 3H), 1,56 (д, J=4,6 Гц, 1H), 1,32-1,30 (3H), 1,29 (д, J=3,7 Гц, 6H)
Пример 48: (R)-3-(3-(5-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
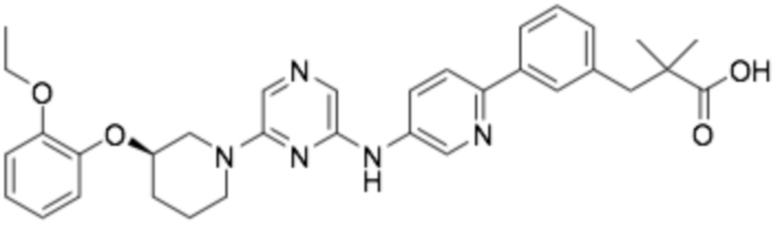
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (51,9 мг, 0,155 ммоль), полученный в примере получения 1, и метил 3-(3-(5-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (44,2 мг, 0,155 ммоль), полученный в примере получения 102. (выход на 2 стадии 60%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,54 (д, J=2,7 Гц, 1H), 7,87-7,70 (м, 3H), 7,41 (с, 1H), 7,40-7,31 (м, 2H), 7,20 (д, J=7,3 Гц, 1H), 7,14 (с, 1H), 6,98-6,84 (м, 3H), 6,84-6,74 (м, 1H), 6,70 (с, 1H), 4,37-4,19 (1H), 4,11-3,94 (м, 2H), 3,94-3,84 (м, 1H), 3,62-3,53 (м, 1H), 3,49 (дд, J=12,6, 7,5 Гц, 1H), 3,31-3,15 (м, 1H), 2,99 (дд, J=19,7, 13,3 Гц, 2H), 2,05 (д, J=4,6 Гц, 1H), 2,00-1,90 (м, 1H), 1,90-1,77 (м, 1H), 1,64-1,48 (м, 1H), 1,35 (т, J=7,1 Гц, 3H), 1,30 (д, J=4,6 Гц, 6H)
Пример 49: (R)-2-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)фенил)-2-метилпропановая кислота
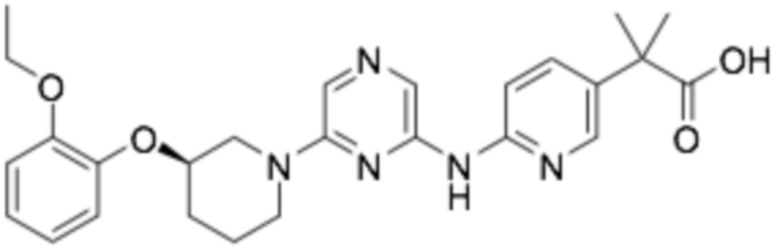
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (137 мг, 0,409 ммоль), полученный в примере получения 1, и метил 2-(6-аминопиридин-3-ил)-2-метилпропаноат (79,5 мг, 0,409 ммоль), полученный в примере получения 19. (выход на 2 стадии 30%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 10,36 (с, 1H), 8,21 (с, 1H), 8,07 (д, J=9,1 Гц, 1H), 7,71 (с, 1H), 7,67-7,51 (2H), 7,06-6,70 (м, 4H), 4,42-4,25 (м, 1H), 4,19 (дд, J=13,0, 3,4 Гц, 1H), 4,09-3,89 (м, 2H), 3,81 (тд, J=8,8, 4,1 Гц, 1H), 3,42 (дд, J=12,8, 8,2 Гц, 1H), 3,36-3,21 (м, 1H), 2,17 (т, J=6,2 Гц, 1H), 2,01 (дд, J=9,6, 3,7 Гц, 1H), 1,95-1,78 (м, 1H), 1,77-1,46 (м, 7H), 1,44-1,19 (м, 3H)
Пример 50: (R)-2-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-2-метилпропановая кислота
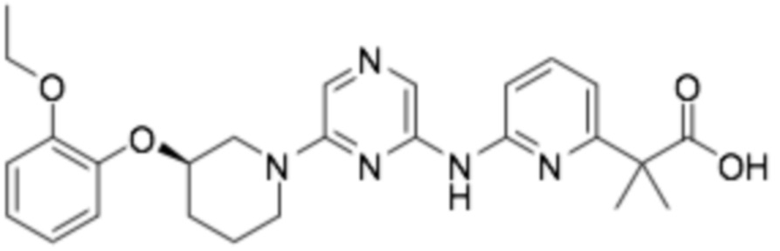
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (56,1 мг, 0,168 ммоль), полученный в примере получения 1, и этил 2-(6-аминопиридин-2-ил)-2-метилпропаноат (35,0 мг, 0,168 ммоль), полученный в примере получения 61. (выход на 2 стадии 39%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,05 (с, 1H), 7,65 (с, 1H), 7,62-7,49 (м, 2H), 7,45 (д, J=8,7 Гц, 1H), 7,06-6,73 (м, 5H), 4,41-4,22 (м, 1H), 4,11 (дд, J=13,0, 3,4 Гц, 1H), 4,06-3,87 (м, 2H), 3,77 (тд, J=8,9, 4,1 Гц, 1H), 3,51 (дд, J=13,3, 7,8 Гц, 1H), 3,44-3,26 (м, 1H), 2,24-2,10 (м, 1H), 2,04-1,94 (м, 1H), 1,94-1,79 (м, 1H), 1,65 (д, J=2,7 Гц, 6H), 1,63-1,44 (м, 1H), 1,40-1,30 (м, 3H)
Пример 51: (R)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-2,2-диметилпропановая кислота
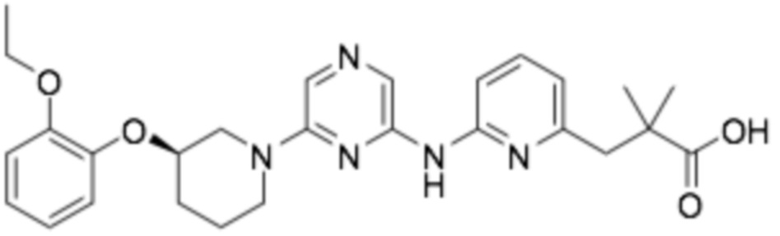
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (151 мг, 0,451 ммоль), полученный в примере получения 1, и трет-бутил 3-(6-аминопиридин-2-ил)-2,2-диметилпропаноат (113 мг, 0,451 ммоль), полученный в примере получения 62. (выход на 2 стадии 27%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 9,67 (с, 1H), 7,91 (д, J=8,2 Гц, 1H), 7,61 (с, 1H), 7,56 (с, 1H), 7,42 (т, J=7,9 Гц, 1H), 7,04-6,90 (м, 2H), 6,87 (д, J=7,6 Гц, 1H), 6,80 (т, J=7,6 Гц, 1H), 6,69 (д, J=7,3 Гц, 1H), 4,28 (тд, J=8,1, 4,0 Гц, 1H), 4,23-4,14 (м, 1H), 4,05-3,90 (м, 2H), 3,81 (кв, J=4,4 Гц, 1H), 3,37 (дд, J=13,0, 8,1 Гц, 1H), 3,26 (т, J=9,9 Гц, 1H), 2,99 (т, J=14,5 Гц, 2H), 2,18-2,11 (м, 1H), 1,97 (дд, J=9,2, 4,0 Гц, 1H), 1,92-1,78 (м, 1H), 1,72-1,54 (м, 1H), 1,36 (т, J=6,9 Гц, 3H), 1,26 (д, J=4,0 Гц, 6H)
Пример 52: 1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пирролидин-3-карбоновая кислота
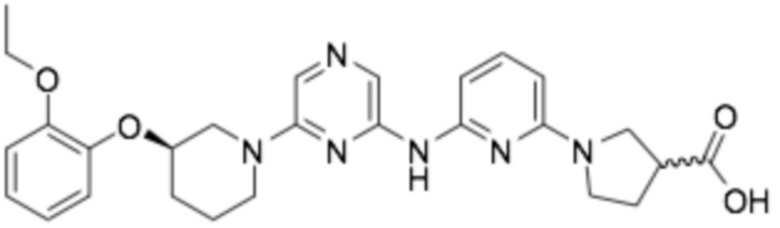
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,093 г, 0,280 ммоль), полученный в примере получения 1, и метил 1-(6-аминопиридин-2-ил)пирролидин-3-карбоксилат (0,065 г, 0,294 ммоль), полученный в примере получения 38. (выход 22%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,58 (с, 1H), 7,65 (с, 1H), 7,33 (т, J=7,9 Гц, 1H), 7,09-6,92 (м, 2H), 6,92-6,81 (м, 2H), 6,42 (д, J=6,4 Гц, 1H), 5,94 (д, J=8,2 Гц, 1H), 4,40-4,25 (1H), 4,16 (д, J=12,8 Гц, 1H), 4,10-3,97 (2H), 3,92 (т, J=9,0 Гц, 1H), 3,88-3,77 (м, 2H), 3,68-3,55 (м, 1H), 3,52-3,42 (м, 2H), 3,42-3,29 (м, 1H), 3,23 (т, J=7,0 Гц, 1H), 2,40 (дт, J=20,0, 7,6 Гц, 1H), 2,30 (тд, J=12,2, 7,0 Гц, 1H), 2,23-2,13 (м, 1H), 2,05-1,95 (м, 1H), 1,95-1,81 (м, 1H), 1,76-1,50 (м, 1H), 1,39 (т, J=7,0 Гц, 3H)
Пример 53: 1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-3-метилпирролидин-3-карбоновая кислота
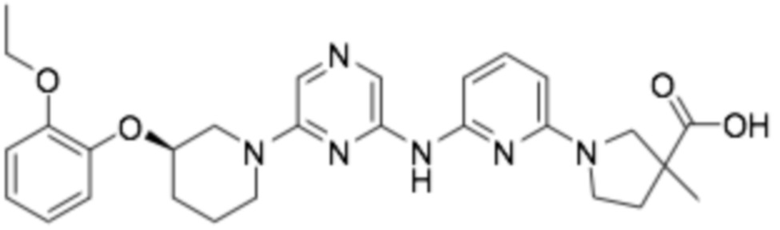
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,068 г, 0,202 ммоль), полученный в примере получения 1, и метил 1-(6-аминопиридин-2-ил)-3-метилпирролидин-3-карбоксилат (0,050 г, 0,213 ммоль), полученный в примере получения 49. (выход 40%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 11,21-9,78 (1H), 8,62 (д, J=16,5 Гц, 1H), 7,75-7,62 (м, 1H), 7,33 (т, J=7,9 Гц, 1H), 7,04-6,99 (м, 1H), 6,99-6,93 (м, 1H), 6,93-6,83 (2H), 6,48-6,32 (м, 1H), 6,02-5,86 (м, 1H), 4,40-4,24 (м, 1H), 4,17 (дд, J=13,1, 3,1 Гц, 1H), 4,12-3,91 (м, 3H), 3,82 (тд, J=8,8, 4,1 Гц, 1H), 3,66-3,53 (м, 2H), 3,50 (с, 1H), 3,48 (т, J=6,7 Гц, 1H), 3,43-3,25 (м, 1H), 2,70-2,53 (м, 1H), 2,16 (дд, J=12,4, 5,6 Гц, 1H), 2,03-1,80 (м, 3H), 1,75-1,57 (м, 1H), 1,47 (с, 3H), 1,39 (т, J=6,9 Гц, 3H)
Пример 54: 1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоновая кислота
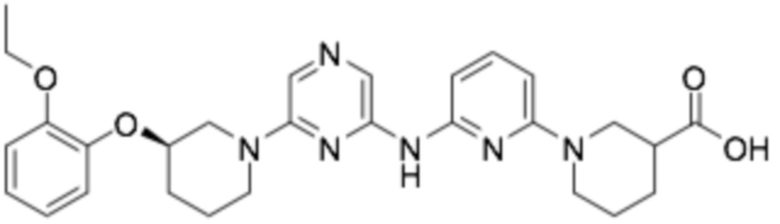
Стадия 1: Этил 1-(6-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоксилат
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,224 г, 0,670 ммоль), полученный в примере получения 1, и этил 1-(6-аминопиридин-2-ил)пиперидин-3-карбоксилат (0,192 г, 0,770 ммоль), полученный в примере получения 65. (выход 38%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,14 (д, J=23,8 Гц, 1H), 7,73-7,57 (1H), 7,42-7,32 (1H), 7,03 (д, J=7,9 Гц, 1H), 6,97 (т, J=7,6 Гц, 1H), 6,94-6,77 (м, 3H), 6,70 (д, J=7,9 Гц, 1H), 6,27 (д, J=8,2 Гц, 1H), 4,32 (д, J=10,4 Гц, 2H), 4,26-4,09 (м, 4H), 4,09-3,93 (м, 2H), 3,88 (д, J=12,8 Гц, 1H), 3,42 (дд, J=13,0, 8,1 Гц, 1H), 3,36-3,23 (м, 1H), 3,23-3,08 (м, 1H), 3,00 (т, J=11,9 Гц, 1H), 2,68-2,50 (1H), 2,19 (д, J=7,3 Гц, 1H), 2,09 (д, J=13,1 Гц, 1H), 1,99 (д, J=9,8 Гц, 1H), 1,94-1,84 (м, 1H), 1,84-1,70 (м, 2H), 1,70-1,48 (м, 2H), 1,40 (т, J=6,9 Гц, 3H), 1,34-1,12 (м, 3H)
Стадия 2: 1-(6-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоновая кислота
Этил 1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоксилат (0,140 г, 0,256 ммоль), полученный на стадии 1, растворяли в этаноле (1,280 мл) и THF (1,280 мл), и затем добавляли к нему 6N водный раствор гидроксида натрия (0,427 мл, 2,56 ммоль) и перемешивали при комнатной температуре в течение 6 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Заявленный в заголовке продукт получали очисткой колонкой с силикагелем. (выход 52%)
m/z (M+H)+ рассчитанная для C28H35N6O4: 519, найденная 519
Пример 55: (R)-1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоновая кислота
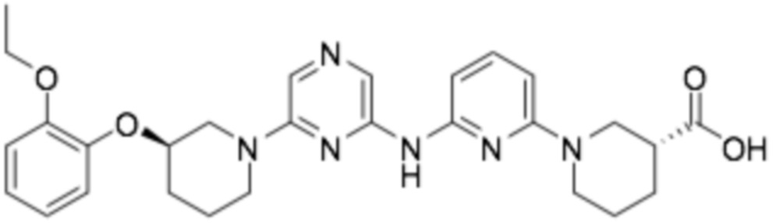
Стадия 1: Этил ( R )-1-(6-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоксилат
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,370 г, 1,108 ммоль), полученный в примере получения 1, и этил (R)-1-(6-аминопиридин-2-ил)пиперидин-3-карбоксилат (0,290 г, 1,163 ммоль), полученный в примере получения 31. (выход 33%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,13 (с, 1H), 7,65 (с, 1H), 7,37 (т, J=7,9 Гц, 1H), 7,08-6,84 (м, 4H), 6,78-6,64 (м, 2H), 6,28 (д, J=8,2 Гц, 1H), 4,42-4,27 (м, 2H), 4,27-4,09 (м, 4H), 4,04 (т, J=6,0 Гц, 2H), 3,91 (с, 1H), 3,43 (дд, J=13,0, 8,1 Гц, 1H), 3,31 (с, 1H), 3,24-3,09 (м, 1H), 3,01 (с, 1H), 2,60 (с, 1H), 2,19 (с, 1H), 2,10 (д, J=27,2 Гц, 1H), 2,05-1,95 (1H), 1,95-1,85 (1H), 1,81 (д, J=13,4 Гц, 2H), 1,66 (с, 2H), 1,46-1,38 (3H), 1,30 (т, J=7,2 Гц, 3H)
Стадия 2: ( R )-1-(6-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоновая кислота
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера 54, применяя этил (R)-1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоксилат (0,200 г, 0,366 ммоль), полученный на стадии 1. (выход 30%)
m/z (M+H)+ рассчитанная для C28H35N6O4: 519, найденная 519
Пример 56: (R)-1-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-4-карбоновая кислота
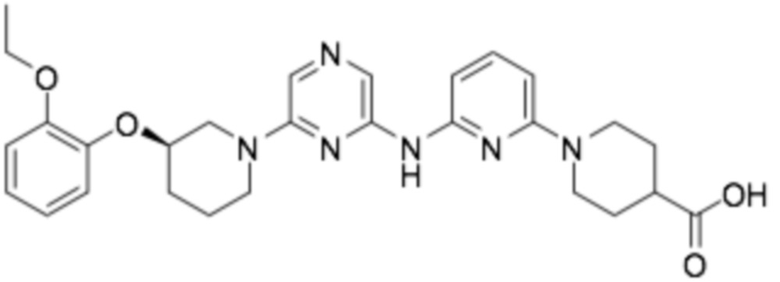
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,306 г, 0,917 ммоль), полученный в примере получения 1, и этил 1-(6-аминопиридин-2-ил)пиперидин-4-карбоксилат (0,240 г, 0,963 ммоль), полученный в примере получения 29. (выход 38%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,66 (с, 1H), 7,70-7,62 (1H), 7,39 (т, J=7,9 Гц, 1H), 7,05-6,87 (м, 4H), 6,73 (с, 1H), 6,25 (кв, J=4,1 Гц, 2H), 4,43-4,28 (м, 1H), 4,24 (дд, J=12,8, 4,3 Гц, 2H), 4,15 (кв, J=7,2 Гц, 2H), 3,82 (д, J=18,3 Гц, 1H), 3,54 (дд, J=12,8, 7,6 Гц, 1H), 3,46-3,30 (м, 1H), 3,04 (т, J=11,4 Гц, 2H), 2,60 (д, J=10,7 Гц, 1H), 2,16 (д, J=12,2 Гц, 3H), 2,02 (с, 1H), 1,96-1,79 (м, 3H), 1,65 (с, 1H), 1,40 (т, J=7,0 Гц, 3H)
Пример 57: (R)-2-(1-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-4-ил)уксусная кислота
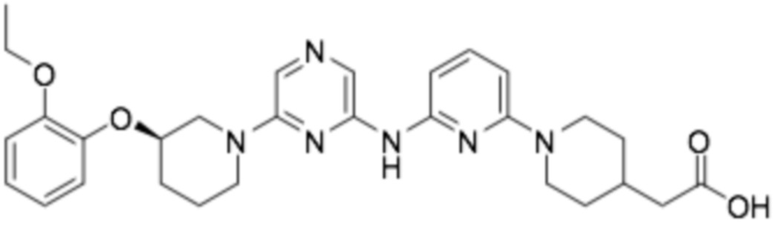
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,237 г, 0,710 ммоль), полученный в примере получения 1, и этил 2-(1-(6-аминопиридин-2-ил)пиперидин-4-ил)ацетат (0,17 г, 0,646 ммоль), полученный в примере получения 36. (выход на 2 стадии 11%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,25 (д, J=15,6 Гц, 1H), 7,63-7,54 (м, 1H), 7,33 (т, J=8,2 Гц, 1H), 7,05-6,90 (м, 2H), 6,90-6,78 (м, 2H), 6,58 (д, J=7,8 Гц, 1H), 6,24-6,16 (м, 1H), 5,28 (с, 1H), 4,39-4,25 (м, 1H), 4,24-4,10 (м, 3H), 4,07-3,91 (м, 2H), 3,88-3,75 (м, 1H), 3,53-3,36 (1H), 3,36-3,24 (м, 1H), 2,86 (т, J=11,7 Гц, 2H), 2,37-2,20 (м, 2H), 2,20-2,10 (м, 1H), 2,07-2,01 (м, 1H), 2,01-1,92 (1H), 1,92-1,77 (м, 3H), 1,73-1,53 (м, 1H), 1,44-1,29 (м, 5H)
Пример 58: (R)-2-(1-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-4-ил)-2-метилпропановая кислота
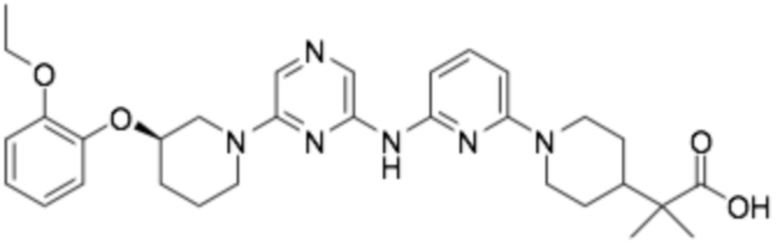
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,093 г, 0,278 ммоль), полученный в примере получения 1, и метил 2-(1-(6-аминопиридин-2-ил)пиперидин-4-ил)-2-метилпропаноат (0,07 г, 0,252 ммоль), полученный в примере получения 34. (выход на 2 стадии 49%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,20 (с, 1H), 7,59 (с, 1H), 7,38 (с, 1H), 7,32 (кв, J=8,1 Гц, 1H), 7,04-6,90 (м, 2H), 6,90-6,79 (2H), 6,64 (д, J=7,8 Гц, 1H), 6,20 (д, J=8,2 Гц, 1H), 4,29 (кв, J=4,1 Гц, 3H), 4,22-4,13 (м, 1H), 4,06-3,91 (м, 2H), 3,82 (кв, J=4,4 Гц, 1H), 3,42 (дд, J=13,0, 8,0 Гц, 1H), 3,36-3,23 (1H), 2,86-2,69 (м, 2H), 2,23-2,10 (м, 1H), 1,96 (дд, J=9,6, 3,7 Гц, 1H), 1,91-1,77 (м, 2H), 1,72 (д, J=11,9 Гц, 2H), 1,67-1,52 (м, 1H), 1,52-1,40 (м, 1H), 1,40-1,29 (м, 3H), 1,24 (кв, J=7,3 Гц, 1H), 1,15 (д, J=16,9 Гц, 6H)
Пример 59: 2-(((S)-1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-ил)уксусная кислота
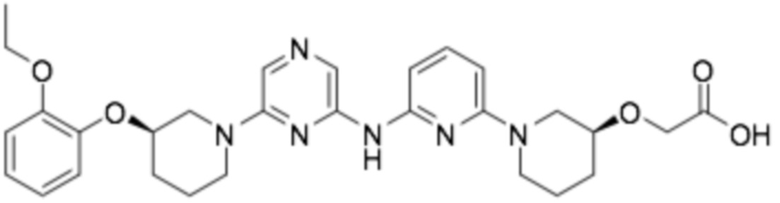
Требуемое заявленное в заголовке соединение получали тем же способом, как в примере 19, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,047 г, 0,139 ммоль), полученный в примере получения 1, и трет-бутил (S)-2-((1-(6-аминопиридин-2-ил)пиперидин-3-ил)окси)ацетат (0,045 г, 0,146 ммоль), полученный в примере получения 45. (выход 11,4%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,66 (с, 1H), 7,68 (с, 1H), 7,36 (т, J=7,9 Гц, 1H), 7,07-6,93 (2H), 6,89 (т, J=7,3 Гц, 2H), 6,34 (с, 1H), 6,25-6,15 (1H), 4,78-4,44 (1H), 4,31 (с, 2H), 4,19-4,06 (2H), 4,06-3,93 (2H), 3,77 (с, 1H), 3,64 (с, 1H), 3,59-3,44 (м, 2H), 3,44-3,28 (1H), 3,15 (с, 1H), 3,00 (с, 1H), 2,13 (с, 1H), 2,08 (д, J=13,1 Гц, 1H), 2,02-1,93 (1H), 1,93-1,80 (2H), 1,60 (с, 3H), 1,39 (т, J=7,0 Гц, 3H)
Пример 60: (R)-2-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2-метилпропановая кислота
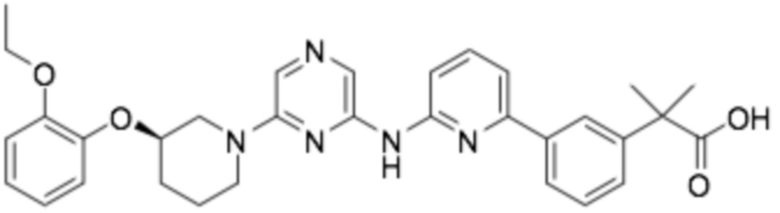
Требуемое заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (74,1 мг, 0,222 ммоль), полученный в примере получения 1, и метил 2-(3-(6-аминопиридин-2-ил)фенил)-2-метилпропаноат (60,0 мг, 0,222 ммоль), полученный в примере получения 52. (выход на 2 стадии 66%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,84 (с, 1H), 8,23 (с, 1H), 7,68 (д, J=9,1 Гц, 2H), 7,59 (т, J=8,0 Гц, 1H), 7,51-7,36 (м, 2H), 7,33 (с, 1H), 7,28 (с, 1H), 7,05-6,92 (м, 3H), 6,88 (дкв, J=9,7, 1,9 Гц, 2H), 4,33 (тд, J=7,8, 3,8 Гц, 1H), 4,14 (дд, J=12,8, 3,2 Гц, 1H), 4,08-3,90 (2H), 3,82 (кв, J=4,4 Гц, 1H), 3,52 (дд, J=12,8, 7,8 Гц, 1H), 3,46-3,28 (м, 1H), 2,00 (д, J=9,6 Гц, 2H), 1,95-1,80 (м, 1H), 1,74-1,53 (м, 7H), 1,38 (т, J=7,1 Гц, 3H)
Пример 61: (R)-2-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2-метилпропановая кислота
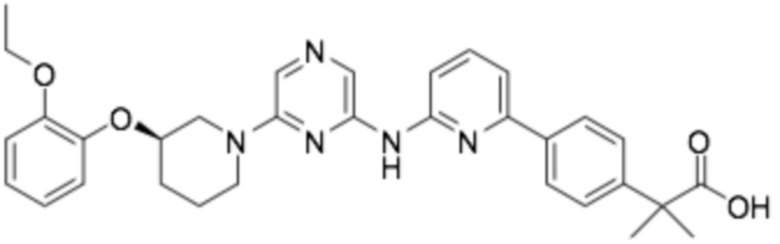
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (61,7 мг, 0,185 ммоль), полученный в примере получения 1, и метил 2-(4-(6-аминопиридин-2-ил)фенил)-2-метилпропаноат (50,0 мг, 0,185 ммоль), полученный в примере получения 54. (выход на 2 стадии 16%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,10 (с, 1H), 8,01 (с, 1H), 7,86-7,71 (м, 3H), 7,68 (с, 1H), 7,56 (т, J=8,0 Гц, 1H), 7,47 (д, J=8,2 Гц, 2H), 7,16 (д, J=7,3 Гц, 1H), 7,08-6,74 (м, 4H), 4,43-4,26 (м, 1H), 4,20 (дд, J=13,3, 3,2 Гц, 1H), 4,11-3,93 (м, 2H), 3,85 (кв, J=4,4 Гц, 1H), 3,49 (дд, J=13,0, 8,0 Гц, 1H), 3,43-3,26 (м, 1H), 2,28-2,09 (м, 1H), 2,09-1,97 (м, 1H), 1,96-1,80 (м, 1H), 1,78-1,65 (м, 1H), 1,63 (с, 6H), 1,38 (т, J=6,9 Гц, 3H)
Пример 62: (R)-2-(4-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2-метилпропановая кислота
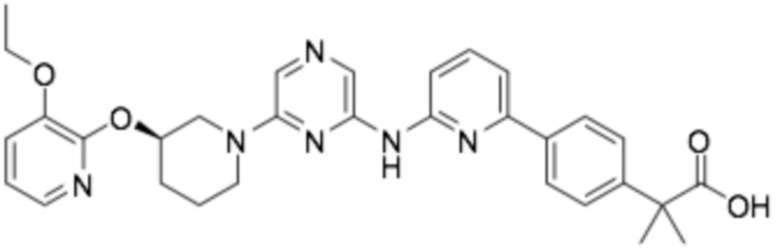
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,272 г, 0,814 ммоль), полученный в примере получения 3, и метил 2-(4-(6-аминопиридин-2-ил)фенил)-2-метилпропаноат (0,2 г, 0,740 ммоль), полученный в примере получения 54. (выход на 2 стадии 43%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,30-8,19 (м, 1H), 7,97 (тд, J=4,3, 2,3 Гц, 2H), 7,65-7,49 (м, 3H), 7,46 (дд, J=8,7, 2,3 Гц, 2H), 7,29 (ддд, J=19,4, 7,8, 2,5 Гц, 2H), 7,07-6,94 (м, 1H), 6,82-6,64 (м, 1H), 5,18 (д, J=2,7 Гц, 1H), 4,12-4,02 (м, 2H), 3,90-3,79 (м, 2H), 3,79-3,69 (м, 2H), 3,66-3,48 (1H), 2,20-2,00 (м, 2H), 1,96 (д, J=4,6 Гц, 1H), 1,70-1,60 (1H), 1,57 (д, J=2,3 Гц, 6H), 1,22-1,19 (м, 3H)
Пример 63: (R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
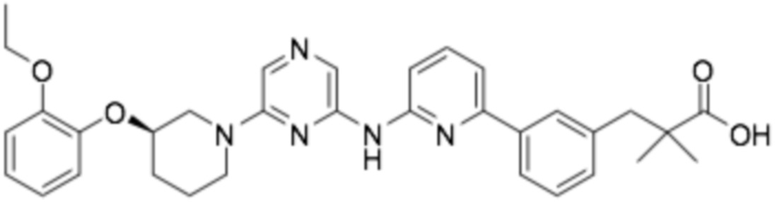
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (81,0 мг, 0,242 ммоль), полученный в примере получения 1, и трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (79,0 мг, 0,242 ммоль), полученный в примере получения 113. (выход на 2 стадии 77%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,57 (с, 1H), 8,22 (с, 1H), 7,68 (д, J=7,8 Гц, 1H), 7,65 (с, 1H), 7,60 (т, J=7,8 Гц, 1H), 7,33 (т, J=7,5 Гц, 2H), 7,15 (д, J=7,8 Гц, 1H), 7,08-6,82 (4H), 6,78 (с, 1H), 6,58 (д, J=8,2 Гц, 1H), 4,42-4,23 (м, 1H), 4,17-4,04 (м, 1H), 4,04-3,88 (м, 2H), 3,80 (дт, J=13,3, 4,9 Гц, 1H), 3,56 (дд, J=13,0, 7,5 Гц, 1H), 3,44-3,28 (м, 1H), 3,01 (с, 2H), 2,21-2,08 (м, 1H), 2,08-1,94 (м, 1H), 1,94-1,80 (м, 1H), 1,72-1,50 (м, 1H), 1,38 (т, J=7,1 Гц, 3H), 1,25 (с, 6H)
Пример 64: (R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
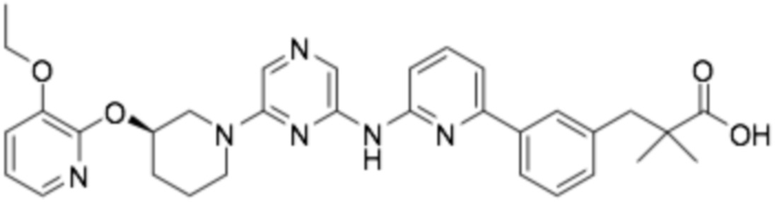
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (205 мг, 0,613 ммоль), полученный в примере получения 3, и трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (200 мг, 0,613 ммоль), полученный в примере получения 113. (выход на 2 стадии 39%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 9,54 (с, 1H), 8,24 (с, 1H), 7,77 (д, J=5,2 Гц, 1H), 7,70 (д, J=4,6 Гц, 2H), 7,62 (т, J=7,9 Гц, 1H), 7,36 (д, J=7,6 Гц, 2H), 7,18 (д, J=7,6 Гц, 1H), 6,93 (д, J=7,6 Гц, 1H), 6,83 (дд, J=7,6, 5,2 Гц, 1H), 6,61 (с, 1H), 6,55 (д, J=7,9 Гц, 1H), 5,30-5,14 (1H), 4,05-3,80 (4H), 3,80-3,68 (1H), 3,68-3,54 (1H), 3,12-2,90 (2H), 2,28-2,12 (1H), 2,12-1,93 (2H), 1,78-1,63 (1H), 1,33-1,29 (3H), 1,29-1,27 (3H), 1,27-1,24 (3H)
Пример 65: (R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
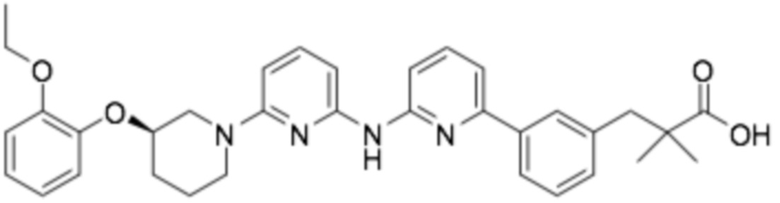
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин (204 мг, 0,613 ммоль), полученный в примере получения 4, и трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (200 мг, 0,613 ммоль), полученный в примере получения 113. (выход на 2 стадии 12%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,80 (д, J=8,7 Гц, 2H), 7,63-7,47 (м, 2H), 7,44 (т, J=8,0 Гц, 1H), 7,35 (т, J=7,8 Гц, 1H), 7,24 (д, J=7,8 Гц, 2H), 7,04-6,70 (м, 5H), 6,28 (д, J=8,2 Гц, 1H), 4,41-4,22 (м, 1H), 4,12 (д, J=11,4 Гц, 1H), 4,04-3,87 (м, 2H), 3,76 (д, J=12,8 Гц, 1H), 3,47-3,32 (м, 2H), 2,96 (с, 2H), 2,15-2,03 (м, 1H), 1,94 (тд, J=6,6, 3,2 Гц, 1H), 1,88-1,72 (м, 1H), 1,71-1,53 (м, 1H), 1,31 (т, J=6,9 Гц, 3H), 1,21 (с, 6H)
Пример 66: (R)-3-(3-(6-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
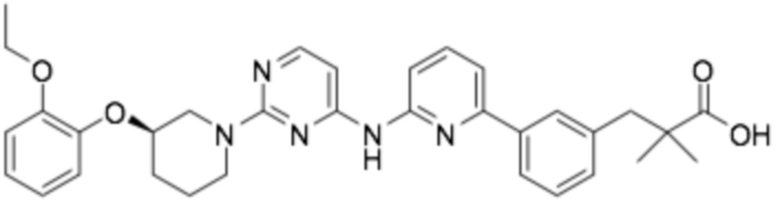
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-4-хлор-2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин (205 мг, 0,613 ммоль), полученный в примере получения 5 и трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (200 мг, 0,613 ммоль), полученный в примере получения 113. (выход на 2 стадии 49%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,28 (с, 1H), 7,98 (д, J=5,8 Гц, 1H), 7,76 (с, 1H), 7,67 (д, J=7,6 Гц, 1H), 7,45 (т, J=7,3 Гц, 2H), 7,33 (т, J=7,6 Гц, 1H), 7,20 (д, J=7,6 Гц, 1H), 7,12 (д, J=7,3 Гц, 1H), 7,04 (д, J=7,9 Гц, 1H), 6,96-6,86 (м, 2H), 6,83 (д, J=7,6 Гц, 1H), 6,46 (с, 1H), 4,51 (д, J=12,8 Гц, 1H), 4,39-4,24 (м, 1H), 4,19 (кв, J=4,5 Гц, 1H), 4,08-3,86 (м, 2H), 3,48 (д, J=21,4 Гц, 1H), 3,37 (д, J=12,8 Гц, 1H), 2,96 (с, 2H), 2,20 (дд, J=15,4, 4,1 Гц, 1H), 1,94 (дт, J=9,2, 3,8 Гц, 1H), 1,88 (дд, J=9,9, 3,5 Гц, 1H), 1,70-1,56 (м, 1H), 1,37 (т, J=6,9 Гц, 3H), 1,24 (с, 6H)
Пример 67: (R)-3-(3-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
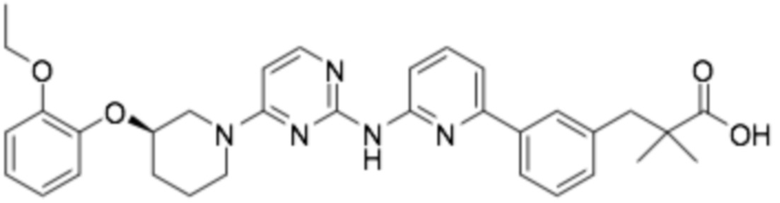
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин (205 мг, 0,613 ммоль), полученный в примере получения 6, и трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (200 мг, 0,613 ммоль), полученный в примере получения 113. (выход на 2 стадии 46%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,23 (д, J=6,4 Гц, 1H), 7,84 (с, 1H), 7,76 (т, J=7,1 Гц, 2H), 7,48 (т, J=7,3 Гц, 2H), 7,38 (т, J=7,5 Гц, 1H), 7,28 (д, J=7,8 Гц, 1H), 7,00 (д, J=7,3 Гц, 1H), 6,96-6,76 (м, 3H), 6,45 (д, J=5,9 Гц, 1H), 4,55 (с, 1H), 4,28-4,01 (м, 2H), 4,01-3,73 (м, 3H), 3,59 (д, J=9,1 Гц, 1H), 2,95 (с, 2H), 2,15-1,98 (м, 3H), 1,76-1,58 (м, 1H), 1,30 (т, J=6,9 Гц, 3H), 1,21 (с, 6H)
Пример 68: (R)-3-(3-(6-((4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
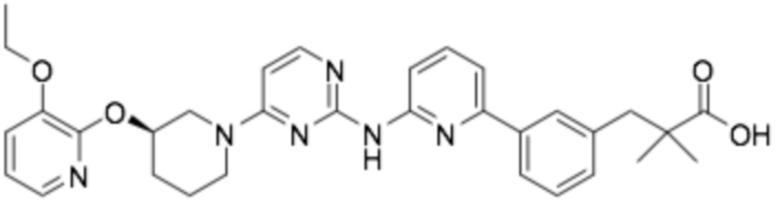
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин (205 мг, 0,613 ммоль), полученный в примере получения 7, и трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (200 мг, 0,613 ммоль), полученный в примере получения 113. (выход на 2 стадии 29%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,40 (с, 1H), 8,16 (с, 1H), 7,82 (с, 2H), 7,70 (д, J=7,8 Гц, 1H), 7,60 (с, 1H), 7,49 (д, J=20,1 Гц, 1H), 7,36-7,27 (м, 2H), 7,21 (д, J=7,3 Гц, 1H), 6,98 (д, J=7,3 Гц, 1H), 6,69 (с, 1H), 6,05 (с, 1H), 5,28 (т, J=2,7 Гц, 1H), 4,09-3,82 (м, 4H), 3,70 (с, 2H), 3,02 (д, J=13,3 Гц, 2H), 2,16-1,94 (м, 3H), 1,69 (с, 1H), 1,30 (т, J=7,1 Гц, 3H), 1,26 (д, J=1,4 Гц, 6H)
Пример 69: (R)-3-(3-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)фенил)-2,2-диметилпропановая кислота
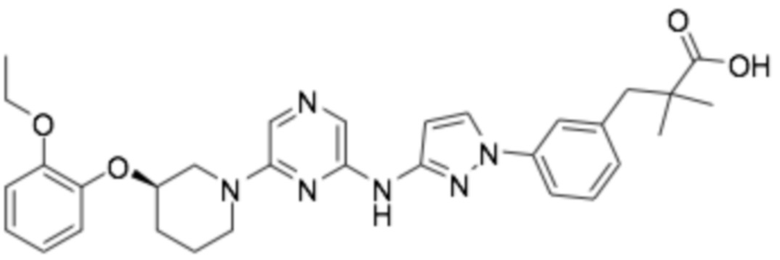
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,10 г, 0,30 ммоль), полученный в примере получения 1, и метил 3-(3-(3-амино-1H-пиразол-1-ил)фенил)-2,2-диметилпропаноат (0,094 г, 0,30 ммоль), полученный в примере получения 67. (выход 40%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D): δ 8,53 (с, 1H), 7,61 (с, 2H), 7,57 (с, 1H), 7,50 (с, 1H), 7,35-7,27 (м, 2H), 7,06 (т, J=2,5 Гц, 1H), 7,00-6,88 (м, 2H), 6,88-6,72 (м, 2H), 6,51 (д, J=2,3 Гц, 1H), 4,25 (т, J=3,9 Гц, 1H), 4,21-4,14 (м, 1H), 3,98 (квд, J=6,9, 1,5 Гц, 2H), 3,79 (кв, J=4,4 Гц, 1H), 3,42-3,17 (м, 2H), 2,99 (с, 2H), 2,20-2,08 (м, 1H), 1,99-1,77 (м, 2H), 1,64-1,54 (м, 1H), 1,35 (т, J=7,1 Гц, 3H), 1,26(с, 6H)
Пример 70: (R)-3-(3-(6-((2-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин-4-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
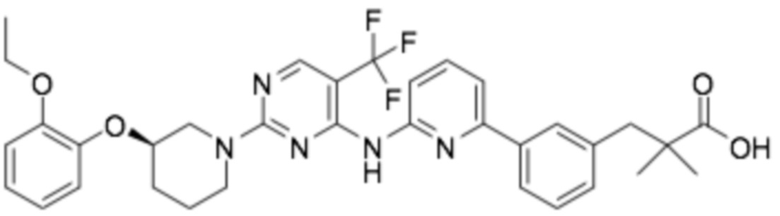
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-4-хлор-2-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин (79 мг, 0,20 ммоль) примера получения 9 и трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (64 мг, 0,20 ммоль), полученный в примере получения 113. (выход на 2 стадии 65%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,25 (с, 1H), 7,80 (д, J=7,8 Гц, 1H), 7,75 (с, 1H), 7,68 (с, 0H), 7,44 (д, J=4,1 Гц, 1H), 7,38-7,28 (1H), 7,24 (д, J=7,8 Гц, 1H), 7,06-6,43 (м, 5H), 4,46 (с, 1H), 4,07 (кв, J=7,2 Гц, 2H), 3,98-3,56 (м, 4H), 2,94 (с, 2H), 2,13-1,88 (м, 4H), 1,59 (д, J=3,7 Гц, 1H), 1,21 (т, J=7,1 Гц, 3H), 1,18 (с, 6H)
Пример 71: (R)-3-(3-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
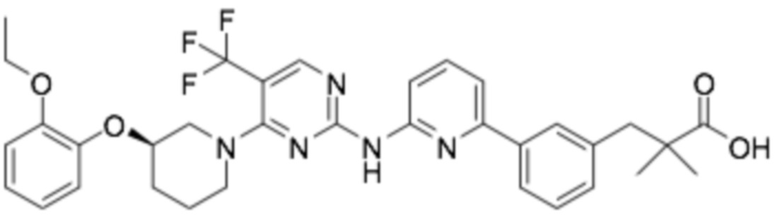
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин (135 мг, 0,38 ммоль), полученный в примере получения 10, и трет-бутил 3-(3-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (110 мг, 0,238 ммоль), полученный в примере получения 113. (выход на 2 стадии 18%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 9,34 (с, 1H), 8,89 (с, 1H), 8,85-8,74 (м, 1H), 8,23 (д, J=2,7 Гц, 1H), 7,91 (кв, J=1,4 Гц, 1H), 7,33-7,19 (м, 3H), 7,19-7,06 (м, 4H), 7,01 (т, J=7,5 Гц, 1H), 3,99 (кв, J=7,0 Гц, 2H), 3,72 (с, 2H), 2,82 (с, 2H), 1,18-1,01 (м, 9H)
Пример 72: (R)-3-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
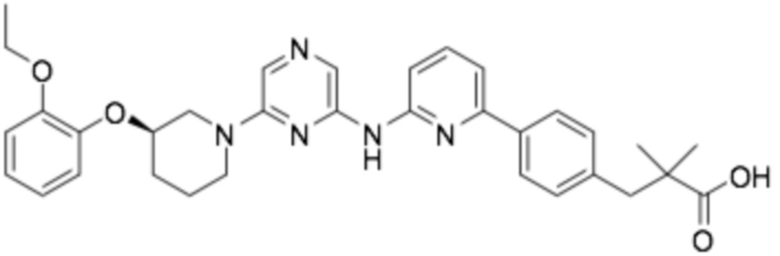
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (146 мг, 0,438 ммоль), полученный в примере получения 1, и трет-бутил 3-(4-(6-аминопиридин-2-ил)фенил)-2,2-диметилпропаноат (143 мг, 0,438 ммоль), полученный в примере получения 77. (выход на 2 стадии 71%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,16 (с, 1H), 8,02 (с, 1H), 7,85 (д, J=8,2 Гц, 2H), 7,67 (с, 1H), 7,55 (кв, J=8,1 Гц, 1H), 7,48 (д, J=8,2 Гц, 1H), 7,40-7,29 (м, 2H), 7,24-7,15 (м, 1H), 7,08-6,76 (м, 4H), 4,32 (тд, J=7,9, 4,0 Гц, 1H), 4,18 (дд, J=13,5, 3,4 Гц, 1H), 4,07-3,91 (м, 2H), 3,83 (тд, J=9,0, 4,1 Гц, 1H), 3,48 (дд, J=13,0, 8,0 Гц, 1H), 3,42-3,25 (м, 1H), 2,94 (с, 2H), 2,27-2,11 (м, 1H), 2,04-1,95 (м, 1H), 1,95-1,79 (м, 1H), 1,76-1,53 (м, 1H), 1,37 (т, J=7,1 Гц, 3H), 1,24 (с, 6H)
Пример 73: (R)-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)глицин
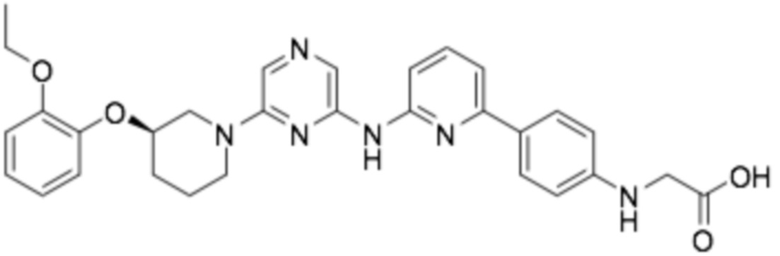
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (70 мг, 0,21 ммоль), полученный в примере получения 1, и этил (4-(6-аминопиридин-2-ил)фенил)глицинат (57 мг, 0,21 ммоль), полученный в примере получения 100, (выход на 2 стадии 25%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,20 (с, 1H), 7,90-7,75 (2H), 7,49 (с, 1H), 7,47 (д, J=8,5 Гц, 1H), 7,26 (д, J=8,2 Гц, 1H), 7,21 (д, J=7,8 Гц, 1H), 6,98 (д, J=7,8 Гц, 2H), 6,88 (д, J=4,1 Гц, 3H), 6,81 (дт, J=8,7, 3,9 Гц, 1H), 6,65 (д, J=8,7 Гц, 2H), 4,40 (т, J=3,4 Гц, 1H), 4,14-3,81 (м, 4H), 3,71 (д, J=6,9 Гц, 1H), 3,68 (с, 2H), 3,67-3,55 (м, 2H), 2,22-1,90 (м, 3H), 1,70-1,50 (м, 1H), 1,34-1,22 (м, 3H)
Пример 74: (R)-(4-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)глицин
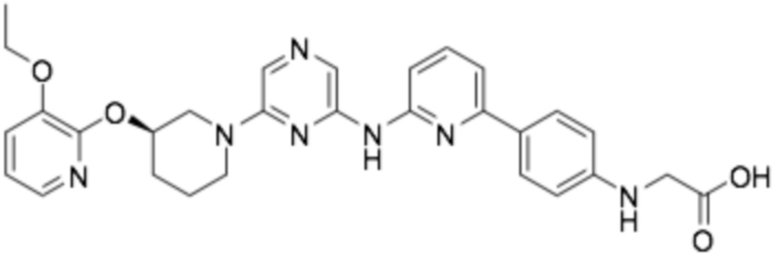
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (58 мг, 0,17 ммоль), полученный в примере получения 3, и этил (4-(6-аминопиридин-2-ил)фенил)глицинат (47 мг, 0,17 ммоль), полученный в примере получения 100. (выход на 2 стадии 21%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,19 (с, 1H), 7,82 (д, J=8,7 Гц, 2H), 7,58 (кв, J=2,3 Гц, 1H), 7,51 (с, 1H), 7,48 (т, J=8,0 Гц, 1H), 7,18 (кв, J=7,9 Гц, 2H), 7,02 (дд, J=7,8, 1,4 Гц, 1H), 6,72 (дд, J=7,8, 5,0 Гц, 1H), 6,65 (д, J=8,7 Гц, 2H), 5,18 (кв, J=2,9 Гц, 1H), 4,07 (дд, J=13,7, 5,5 Гц, 1H), 3,93-3,76 (м, 5H), 3,73 (д, J=7,3 Гц, 2H), 3,69-3,51 (м, 1H), 2,19-1,95 (м, 4H), 1,63 (дд, J=9,5, 6,5 Гц, 1H), 1,21 (т, J=7,1 Гц, 3H)
Пример 75: (R)-(4-(6-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиридин-2-ил)фенил)глицин
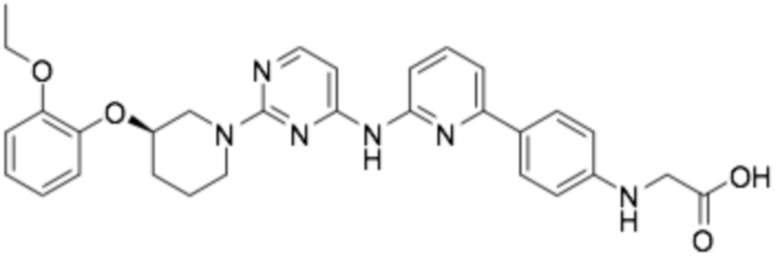
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-4-хлор-2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин (58 мг, 0,17 ммоль), полученный в примере получения 5, и этил (4-(6-аминопиридин-2-ил)фенил)глицинат (47 мг, 0,17 ммоль), полученный в примере получения 100. (выход на 2 стадии 18%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,98-7,85 (м, 2H), 7,81 (д, J=9,1 Гц, 2H), 7,53 (т, J=8,0 Гц, 1H), 7,39 (д, J=8,2 Гц, 1H), 7,31 (д, J=7,3 Гц, 1H), 6,95 (д, J=6,9 Гц, 1H), 6,92-6,80 (м, 3H), 6,80-6,68 (м, 2H), 6,66 (д, J=8,7 Гц, 2H), 4,41 (кв, J=3,2 Гц, 1H), 4,06-3,98 (1H), 3,97-3,84 (4H), 3,83 (с, 2H), 3,79 (д, J=13,7 Гц, 2H), 2,12-1,84 (м, 4H), 1,67-1,51 (м, 1H), 1,26 (т, J=6,9 Гц, 3H)
Пример 76: (R)-(4-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)глицин
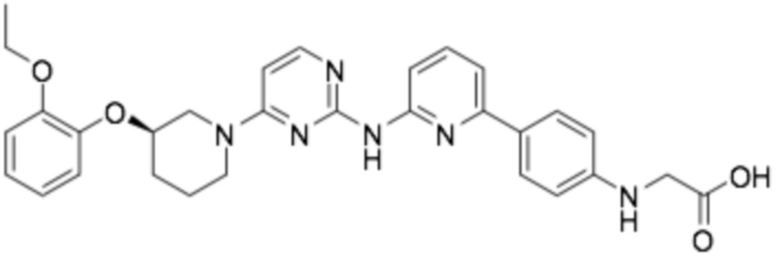
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин (58 мг, 0,17 ммоль), полученный в примере получения 6, и этил (4-(6-аминопиридин-2-ил)фенил)глицинат (47 мг, 0,17 ммоль), полученный в примере получения 100. (выход на 2 стадии 11%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,89 (д, J=6,4 Гц, 1H), 7,65 (д, J=8,2 Гц, 3H), 7,31 (д, J=8,2 Гц, 1H), 7,18 (с, 1H), 6,96 (д, J=8,2 Гц, 1H), 6,92-6,73 (м, 3H), 6,74-6,56 (2H), 6,39 (с, 1H), 4,51 (с, 1H), 4,30-3,98 (м, 1H), 3,97-3,81 (м, 2H), 3,79 (с, 1H), 3,67 (д, J=7,8 Гц, 2H), 3,50 (дд, J=11,4, 6,9 Гц, 1H), 2,00 (с, 3H), 1,59 (кв, J=7,5 Гц, 1H), 1,29-1,18 (м, 3H)
Пример 77: (R)-2-((4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)амино)-2-метилпропановая кислота
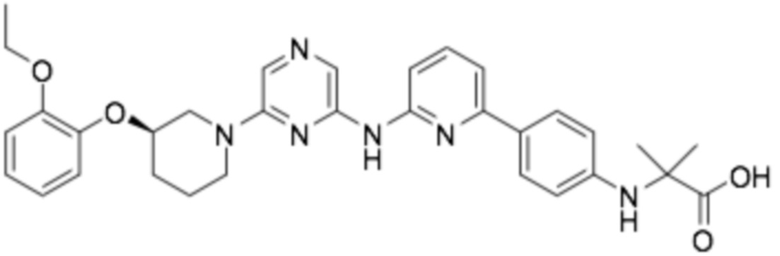
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,15 г, 0,45 ммоль), полученный в примере получения 1, и этил 2-((4-(6-аминопиридин-2-ил)фенил)амино)-2-метилпропаноат (146 мг, 0,49 ммоль), полученный в примере получения 98. (выход на 2 стадии 74%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,29 (с, 1H), 7,80 (д, J=8,2 Гц, 2H), 7,52-7,39 (2H), 7,24-7,12 (м, 2H), 6,97 (д, J=8,2 Гц, 1H), 6,87 (д, J=4,1 Гц, 2H), 6,84-6,72 (м, 1H), 6,59 (д, J=8,2 Гц, 2H), 4,38 (т, J=3,2 Гц, 1H), 4,14 (кв, J=7,0 Гц, 2H), 4,02-3,79 (м, 3H), 3,68 (кв, J=6,7 Гц, 1H), 3,62 (с, 2H), 2,05 (д, J=12,3 Гц, 2H), 1,88 (д, J=10,5 Гц, 1H), 1,60 (с, 1H), 1,52 (д, J=4,1 Гц, 7H), 1,34-1,23 (м, 3H), 1,19-1,15 (м, 3H)
Пример 78: (R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота
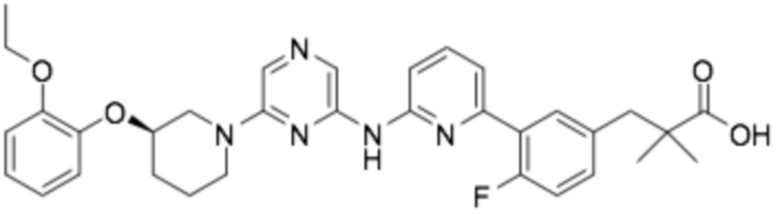
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (73 мг, 0,22 ммоль), полученный в примере получения 1, и трет-бутил 3-(3-(6-аминопиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат (69 мг, 0,20 ммоль), полученный в примере получения 89. (выход на 2 стадии 81%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,48 (с, 1H), 7,84 (дд, J=7,5, 2,5 Гц, 1H), 7,57 (т, J=8,0 Гц, 1H), 7,53 (с, 1H), 7,38-7,24 (м, 2H), 7,24-7,15 (м, 1H), 7,06 (дд, J=11,2, 8,5 Гц, 1H), 6,98 (д, J=7,3 Гц, 1H), 6,93-6,86 (м, 2H), 6,86-6,74 (м, 1H), 4,48-4,33 (м, 1H), 4,00-3,78 (м, 3H), 3,72 (кв, J=6,6 Гц, 1H), 3,64 (т, J=5,5 Гц, 2H), 2,91 (с, 2H), 2,14-1,99 (м, 2H), 1,89 (д, J=8,2 Гц, 1H), 1,61 (д, J=5,9 Гц, 1H), 1,26 (т, J=7,1 Гц, 4H), 1,18 (с, 6H)
Пример 79: (R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота
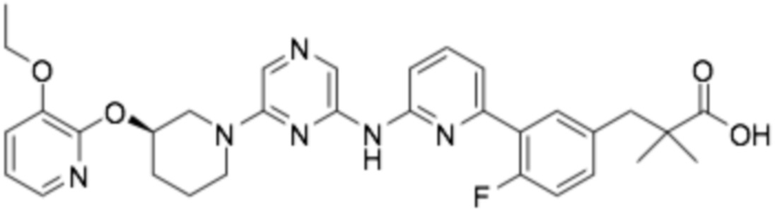
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (73 мг, 0,22 ммоль), полученный в примере получения 3, и трет-бутил 3-(3-(6-аминопиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат (69 мг, 0,20 ммоль), полученный в примере получения 89. (выход на 2 стадии 98%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,35 (с, 1H), 7,83-7,68 (2H), 7,65 (с, 1H), 7,59-7,44 (1H), 7,41-7,31 (м, 1H), 7,26 (с, 1H), 7,19 (д, J=8,2 Гц, 1H), 7,13 (дд, J=11,2, 8,5 Гц, 1H), 7,01 (дд, J=7,8, 1,4 Гц, 1H), 6,78-6,62 (1H), 5,15 (с, 1H), 4,19-4,09 (м, 1H), 3,97-3,85 (м, 1H), 3,85-3,72 (м, 2H), 3,69 (д, J=12,8 Гц, 1H), 3,57 (д, J=9,6 Гц, 1H), 2,93 (с, 2H), 2,15-1,99 (м, 3H), 1,62 (д, J=6,4 Гц, 1H), 1,25-1,15 (м, 9H)
Пример 80: (R)-2-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота
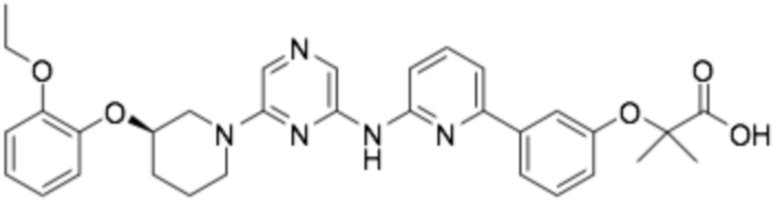
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (111 мг, 0,333 ммоль), полученный в примере получения 1, и этил 2-(3-(6-аминопиридин-2-ил)фенокси)-2-метилпропаноат (100 мг, 0,333 ммоль), полученный в примере получения 88. (выход на 2 стадии 61%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,42 (с, 1H), 7,99 (т, J=2,1 Гц, 1H), 7,62 (т, J=8,5 Гц, 2H), 7,51 (д, J=8,2 Гц, 1H), 7,44-7,28 (м, 2H), 7,09-6,93 (м, 3H), 6,89 (квд, J=7,5, 1,6 Гц, 2H), 6,79 (с, 1H), 6,61 (д, J=7,8 Гц, 1H), 4,42-4,24 (м, 1H), 4,07 (дд, J=13,3, 3,7 Гц, 1H), 4,04-3,88 (м, 2H), 3,87-3,70 (м, 1H), 3,58 (дд, J=13,0, 7,5 Гц, 1H), 3,48-3,30 (м, 1H), 2,25-2,08 (1H), 2,08-1,95 (м, 1H), 1,95-1,81 (м, 1H), 1,72-1,48 (м, 7H), 1,37 (т, J=7,1 Гц, 3H)
Пример 81: (R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота
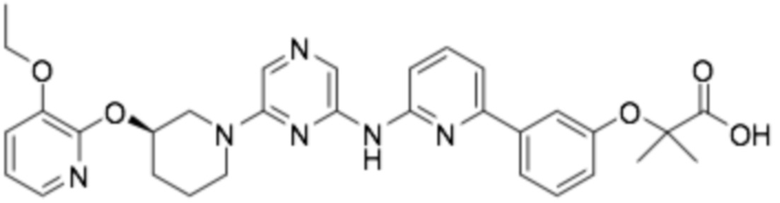
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (111 мг, 0,333 ммоль), полученный в примере получения 3, и этил 2-(3-(6-аминопиридин-2-ил)фенокси)-2-метилпропаноат (100 мг, 0,333 ммоль), полученный в примере получения 88. (выход на 2 стадии 76%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,36 (с, 1H), 7,99 (т, J=2,1 Гц, 1H), 7,74 (дд, J=5,0, 1,4 Гц, 1H), 7,65 (с, 1H), 7,60 (т, J=7,8 Гц, 1H), 7,51 (д, J=7,8 Гц, 1H), 7,43-7,29 (м, 2H), 7,03 (дд, J=7,8, 2,3 Гц, 1H), 6,94 (дд, J=7,8, 1,4 Гц, 1H), 6,81 (дд, J=7,8, 5,0 Гц, 1H), 6,64 (с, 1H), 6,57 (д, J=7,8 Гц, 1H), 5,23 (кв, J=3,5 Гц, 1H), 3,91 (д, J=5,0 Гц, 2H), 3,90-3,79 (м, 2H), 3,72 (кв, J=3,7 Гц, 1H), 3,59 (т, J=3,9 Гц, 1H), 2,16 (т, J=4,3 Гц, 1H), 2,10-1,94 (м, 2H), 1,73-1,55 (м, 7H), 1,27 (т, J=6,9 Гц, 3H)
Пример 82: (R)-2-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота
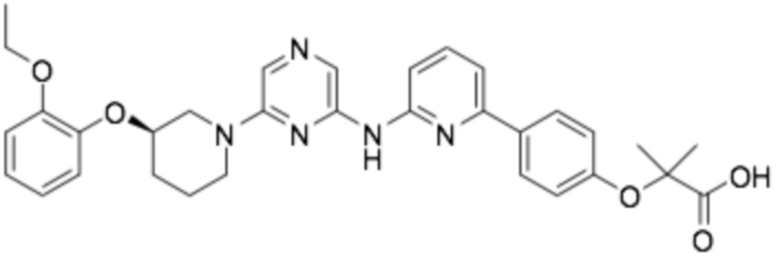
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (111 мг, 0,333 ммоль), полученный в примере получения 1, и этил 2-(4-(6-аминопиридин-2-ил)фенокси)-2-метилпропаноат (100 мг, 0,333 ммоль), полученный в примере получения 97. (выход на 2 стадии 69%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,07 (с, 1H), 7,74 (д, J=8,7 Гц, 2H), 7,67 (д, J=6,4 Гц, 2H), 7,62-7,48 (1H), 7,13 (д, J=7,3 Гц, 1H), 7,09-7,01 (2H), 7,01-6,96 (1H), 6,93 (тд, J=7,7, 1,4 Гц, 1H), 6,89-6,74 (м, 2H), 4,42-4,24 (м, 1H), 4,14 (дд, J=12,8, 3,2 Гц, 1H), 4,07-3,89 (м, 2H), 3,89-3,69 (м, 1H), 3,52 (дд, J=12,8, 7,8 Гц, 1H), 3,44-3,27 (м, 1H), 2,26-2,09 (м, 1H), 2,09-1,96 (м, 1H), 1,96-1,81 (м, 1H), 1,64 (т, J=16,0 Гц, 7H), 1,36 (т, J=6,9 Гц, 3H)
Пример 83: (R)-2-(4-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота
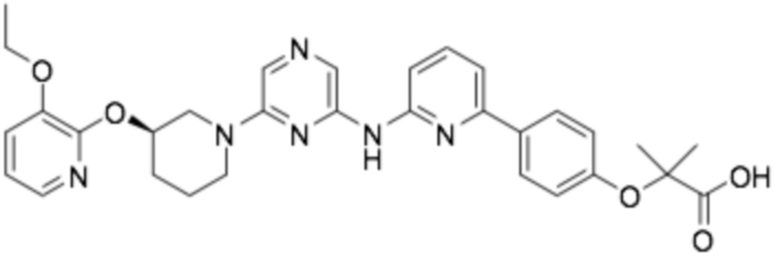
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (111 мг, 0,333 ммоль), полученный в примере получения 3, и этил 2-(4-(6-аминопиридин-2-ил)фенокси)-2-метилпропаноат (100 мг, 0,333 ммоль), полученный в примере получения 97. (выход на 2 стадии 71%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,05 (с, 1H), 7,75 (д, J=9,1 Гц, 2H), 7,71 (с, 1H), 7,66-7,46 (м, 3H), 7,12 (д, J=7,3 Гц, 1H), 7,05 (д, J=8,7 Гц, 2H), 6,95 (дд, J=7,8, 1,4 Гц, 1H), 6,70 (дд, J=7,8, 5,0 Гц, 1H), 5,26 (т, J=3,2 Гц, 1H), 3,99 (дд, J=13,5, 3,0 Гц, 1H), 3,94-3,81 (м, 3H), 3,75 (д, J=13,7 Гц, 1H), 3,65-3,46 (м, 1H), 2,27-2,11 (м, 1H), 2,11-1,89 (2H), 1,79-1,67 (м, 1H), 1,65 (д, J=1,8 Гц, 6H), 1,38-1,19 (м, 3H)
Пример 84: (R)-2-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенокси)-2-метилпропановая кислота
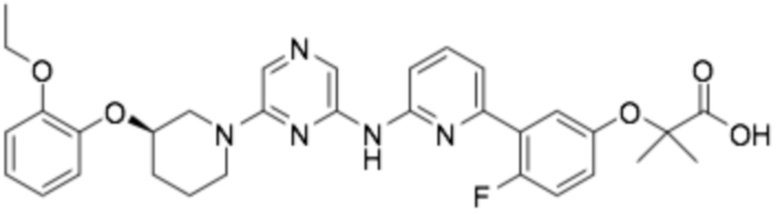
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (115 мг, 0,35 ммоль), полученный в примере получения 1, и этил 2-(3-(6-аминопиридин-2-ил)-4-фторфенокси)-2-метилпропаноат (100 мг, 0,31 ммоль), полученный в примере получения 92. (выход на 2 стадии 45%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,30 (с, 1H), 7,67-7,47 (м, 3H), 7,35 (д, J=8,2 Гц, 1H), 7,31 (дд, J=7,5, 2,1 Гц, 1H), 7,08 (дд, J=11,0, 9,1 Гц, 1H), 7,02-6,92 (м, 2H), 6,87 (д, J=4,1 Гц, 2H), 6,81 (кв, J=4,0 Гц, 1H), 4,42 (с, 1H), 4,01-3,82 (м, 3H), 3,76 (кв, J=6,7 Гц, 1H), 3,72-3,56 (м, 2H), 2,14-2,00 (2H), 1,91 (д, J=8,7 Гц, 1H), 1,70-1,58 (м, 1H), 1,56 (с, 6H), 1,26 (т, J=7,1 Гц, 3H)
Пример 85: (R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенокси)-2-метилпропановая кислота
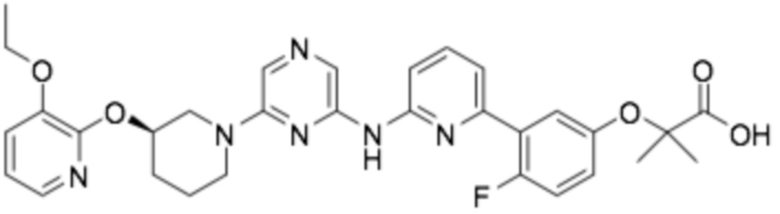
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (116 мг, 0,35 ммоль), полученный в примере получения 3, и этил 2-(3-(6-аминопиридин-2-ил)-4-фторфенокси)-2-метилпропаноат (100 мг, 0,31 ммоль), полученный в примере получения 92. (выход на 2 стадии 42%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,26 (с, 1H), 7,66-7,47 (м, 4H), 7,30 (дд, J=8,2, 2,7 Гц, 2H), 7,17-6,99 (м, 2H), 6,95 (дт, J=9,0, 3,5 Гц, 1H), 6,72 (дд, J=7,8, 5,0 Гц, 1H), 5,19 (кв, J=2,9 Гц, 1H), 4,17-3,98 (м, 2H), 3,93-3,70 (м, 4H), 3,67-3,51 (м, 1H), 2,17-2,00 (м, 2H), 1,96 (с, 1H), 1,64 (т, J=3,0 Гц, 1H), 1,56 (с, 6H), 1,21 (т, J=7,1 Гц, 3H)
Пример 86: (R)-3-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-1H-пиразол-1-ил)-2,2-диметилпропановая кислота
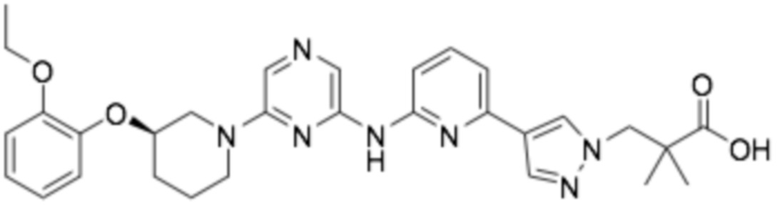
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,050 г, 0,15 ммоль), полученный в примере получения 1, и метил 3-(4-(6-аминопиридин-2-ил)-1H-пиразол-1-ил)-2,2-диметилпропаноат (0,041 г, 0,15 ммоль), полученный в примере получения 116. (выход 14%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4): δ 8,18 (с, 1H), 8,11 (с, 1H), 7,95 (с, 1H), 7,63-7,50 (м, 2H), 7,21-7,07 (м, 2H), 6,99-6,86 (м, 1H), 6,86-6,70 (м, 3H), 4,41 (д, J=9,1 Гц, 1H), 4,35 (с, 2H), 3,94-3,68 (м, 5H), 3,64-3,54 (м, 1H), 2,12-2,00 (м, 2H), 1,98-1,88 (м, 1H), 1,68-1,53 (м, 1H), 1,28-1,18 (м, 9H)
Пример 87: (R)-3-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота
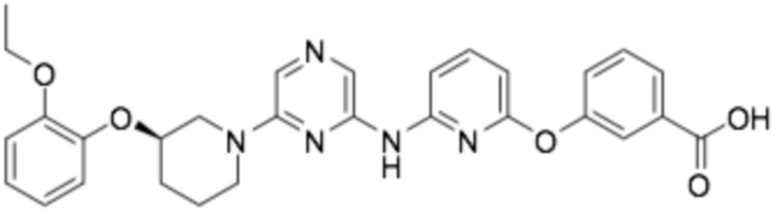
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,098 г, 0,293 ммоль), полученный в примере получения 1, и метил 3-((6-аминопиридин-2-ил)окси)бензоат (0,065 г, 0,266 ммоль), полученный в примере получения 107. (выход на 2 стадии 50%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,84 (д, J=7,8 Гц, 1H), 7,70 (т, J=2,1 Гц, 1H), 7,65 (с, 1H), 7,54 (т, J=8,0 Гц, 1H), 7,48 (т, J=8,0 Гц, 1H), 7,42 (с, 1H), 7,36-7,28 (м, 1H), 7,19 (д, J=7,8 Гц, 1H), 7,02-6,93 (м, 1H), 6,93-6,84 (м, 2H), 6,80 (дкв, J=8,6, 2,6 Гц, 1H), 6,45 (д, J=7,8 Гц, 1H), 4,40 (тд, J=6,6, 3,5 Гц, 1H), 3,98-3,76 (м, 3H), 3,71 (кв, J=6,7 Гц, 1H), 3,66-3,52 (м, 2H), 2,14-1,97 (м, 2H), 1,94-1,80 (м, 1H), 1,67-1,50 (м, 1H), 1,23 (т, J=6,9 Гц, 3H)
Пример 88: (R)-3-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота
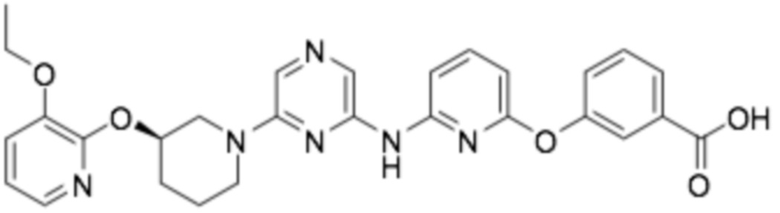
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,098 г, 0,293 ммоль), полученный в примере получения 3, и метил 3-((6-аминопиридин-2-ил)окси)бензоат (0,065 г, 0,266 ммоль), полученный в примере получения 107. (выход на 2 стадии 21%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,84 (дд, J=7,8, 1,4 Гц, 1H), 7,71 (т, J=2,1 Гц, 1H), 7,61 (с, 1H), 7,59-7,45 (м, 3H), 7,42 (с, 1H), 7,36-7,27 (м, 1H), 7,12 (д, J=8,2 Гц, 1H), 7,02 (дд, J=8,0, 1,6 Гц, 1H), 6,73 (дд, J=7,8, 5,0 Гц, 1H), 6,45 (д, J=7,8 Гц, 1H), 5,17 (кв, J=2,7 Гц, 1H), 4,15-4,01 (1H), 3,87-3,62 (4H), 3,61-3,47 (м, 1H), 2,12-1,91 (м, 3H), 1,65-1,53 (м, 1H), 1,15 (т, J=7,1 Гц, 3H)
Пример 89: (R)-4-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота
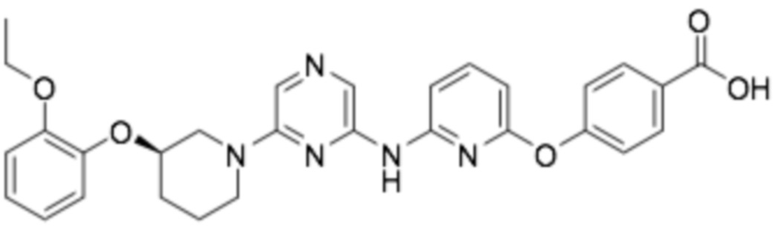
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,15 г, 0,45 ммоль), полученный в примере получения 1, и метил 4-((6-аминопиридин-2-ил)окси)бензоат (0,1 г, 0,409 ммоль), полученный в примере получения 104. (выход на 2 стадии 70%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,32-8,20 (м, 2H), 7,98 (с, 1H), 7,80 (д, J=8,2 Гц, 1H), 7,59 (кв, J=7,6 Гц, 1H), 7,27 (т, J=2,3 Гц, 1H), 7,04-6,78 (м, 5H), 6,62 (д, J=8,2 Гц, 1H), 6,60-6,47 (м, 1H), 4,37-4,22 (м, 1H), 4,05 (дд, J=13,3, 3,2 Гц, 1H), 4,01-3,83 (м, 2H), 3,72 (тд, J=9,3, 4,1 Гц, 1H), 3,54 (дд, J=13,3, 7,8 Гц, 1H), 3,42-3,33 (м, 1H), 2,19-2,05 (м, 1H), 2,01-1,81 (м, 2H), 1,57 (квд, J=8,8, 4,6 Гц, 1H), 1,37-1,28 (м, 3H)
Пример 90: (R)-4-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота
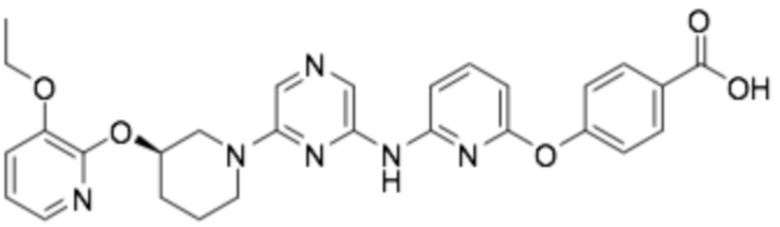
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,151 г, 0,450 ммоль), полученный в примере получения 3, и метил 4-((6-аминопиридин-2-ил)окси)бензоат (0,1 г, 0,409 ммоль), полученный в примере получения 104. (выход на 2 стадии 71%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,19 (т, J=8,9 Гц, 2H), 7,92 (д, J=17,8 Гц, 1H), 7,75-7,66 (м, 2H), 7,58 (т, J=7,8 Гц, 1H), 7,44-7,26 (м, 1H), 7,24-7,16 (м, 2H), 6,97-6,89 (м, 1H), 6,83-6,68 (м, 2H), 6,55 (т, J=8,5 Гц, 1H), 5,20 (с, 1H), 3,96-3,82 (м, 3H), 3,82-3,72 (м, 1H), 3,72-3,52 (м, 2H), 2,10 (кв, J=4,1 Гц, 1H), 2,01 (кв, J=5,3 Гц, 2H), 1,65 (с, 1H), 1,26-1,20 (3H)
Пример 91: (R)-2-(3-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота
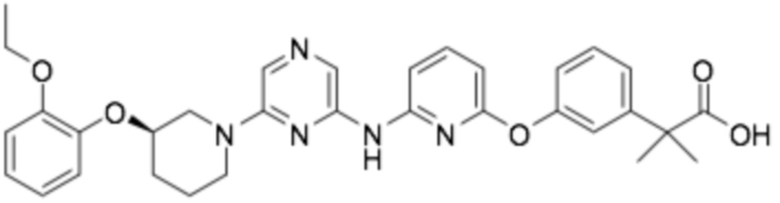
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (117 мг, 0,349 ммоль), полученный в примере получения 1, и метил 2-(3-((6-аминопиридин-2-ил)окси)фенил)-2-метилпропаноат (100 мг, 0,349 ммоль), полученный в примере получения 109. (выход на 2 стадии 47%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,72 (д, J=4,1 Гц, 1H), 7,62-7,50 (1H), 7,47 (с, 1H), 7,44-7,31 (1H), 7,25 (д, J=8,7 Гц, 1H), 7,22-7,16 (1H), 7,14 (т, J=2,1 Гц, 1H), 7,07-6,96 (м, 2H), 6,96-6,87 (2H), 6,87-6,75 (м, 1H), 6,41 (д, J=7,8 Гц, 1H), 4,41 (тд, J=6,7, 3,4 Гц, 1H), 4,02-3,80 (м, 3H), 3,71 (кв, J=6,6 Гц, 1H), 3,63 (т, J=5,3 Гц, 2H), 2,18-1,99 (м, 2H), 1,91 (квд, J=7,9, 3,9 Гц, 1H), 1,71-1,56 (м, 1H), 1,54 (с, 6H), 1,27 (т, J=6,9 Гц, 3H)
Пример 92: (R)-2-(3-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота
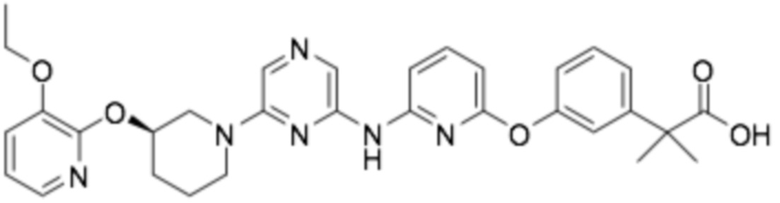
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (117 мг, 0,349 ммоль), полученный в примере получения 3, и метил 2-(3-((6-аминопиридин-2-ил)окси)фенил)-2-метилпропаноат (100 мг, 0,349 ммоль), полученный в примере получения 109. (выход на 2 стадии 56%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,68 (с, 1H), 7,61 (кв, J=2,3 Гц, 1H), 7,52 (т, J=8,0 Гц, 1H), 7,48 (с, 1H), 7,43-7,31 (м, 1H), 7,31-7,22 (м, 1H), 7,22-7,10 (м, 2H), 7,06 (дд, J=7,8, 1,4 Гц, 1H), 7,03-6,92 (м, 1H), 6,77 (дд, J=7,8, 5,0 Гц, 1H), 6,40 (д, J=7,3 Гц, 1H), 5,20 (кв, J=2,9 Гц, 1H), 4,04 (дд, J=13,7, 5,9 Гц, 1H), 3,96-3,69 (м, 4H), 3,69-3,53 (м, 1H), 2,22-1,89 (3H), 1,77-1,58 (м, 1H), 1,55 (с, 6H), 1,20 (т, J=7,1 Гц, 3H)
Пример 93: (R)-2-(4-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота
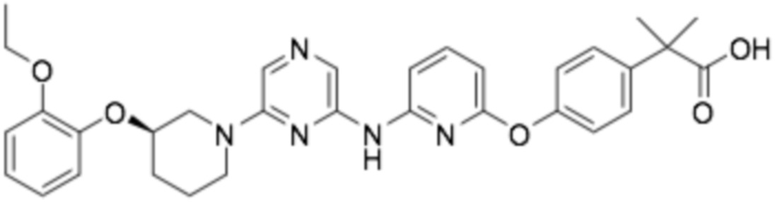
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (117 мг, 0,349 ммоль), полученный в примере получения 1, и метил 2-(4-((6-аминопиридин-2-ил)окси)фенил)-2-метилпропаноат (100 мг, 0,349 ммоль), полученный в примере получения 106. (выход на 2 стадии 58%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,66 (д, J=8,7 Гц, 1H), 7,52 (т, J=8,0 Гц, 1H), 7,49-7,41 (м, 3H), 7,29 (д, J=7,8 Гц, 1H), 7,07 (дт, J=9,5, 2,5 Гц, 2H), 6,99 (д, J=7,8 Гц, 1H), 6,94-6,87 (м, 2H), 6,87-6,74 (м, 1H), 6,40 (д, J=7,8 Гц, 1H), 4,51-4,33 (м, 1H), 4,05-3,81 (м, 3H), 3,73 (кв, J=6,6 Гц, 1H), 3,68-3,54 (2H), 2,22-1,98 (м, 2H), 1,97-1,82 (м, 1H), 1,73-1,53 (7H), 1,27 (т, J=7,1 Гц, 3H)
Пример 94: (R)-2-(4-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота
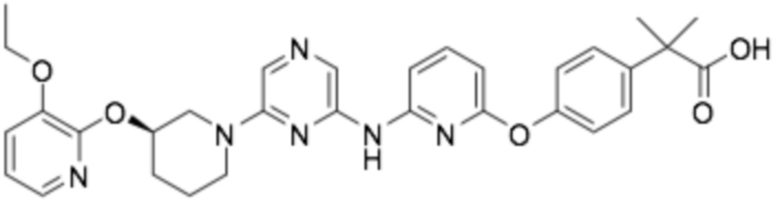
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (117 мг, 0,349 ммоль), полученный в примере получения 3, и метил 2-(4-((6-аминопиридин-2-ил)окси)фенил)-2-метилпропаноат (100 мг, 0,349 ммоль), полученный в примере получения 106. (выход на 2 стадии 71%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,68-7,55 (м, 2H), 7,55-7,35 (м, 4H), 7,21 (д, J=7,8 Гц, 1H), 7,13-6,98 (м, 3H), 6,76 (дд, J=7,8, 5,0 Гц, 1H), 6,39 (д, J=7,8 Гц, 1H), 5,29-5,12 (м, 1H), 4,04 (дд, J=13,7, 5,9 Гц, 1H), 3,96-3,67 (м, 4H), 3,67-3,50 (м, 1H), 2,20-1,89 (м, 3H), 1,73-1,59 (м, 1H), 1,57 (д, J=7,8 Гц, 6H), 1,20 (т, J=6,9 Гц, 3H)
Пример 95: (R)-2-(3-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота
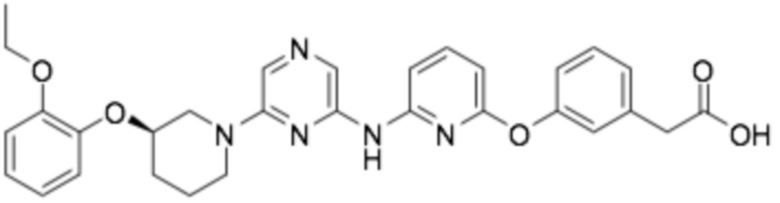
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (90,0 мг, 0,271 ммоль), полученный в примере получения 1, и метил 2-(3-((6-аминопиридин-2-ил)окси)фенил)ацетат (70,0 мг, 0,271 ммоль), полученный в примере получения 108. (выход на 2 стадии 27%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,04 (с, 1H), 7,66-7,46 (м, 2H), 7,37 (т, J=7,8 Гц, 1H), 7,30 (д, J=16,0 Гц, 1H), 7,23 (с, 1H), 7,08-6,90 (м, 4H), 6,90-6,76 (м, 2H), 6,69-6,45 (м, 2H), 4,30 (т, J=3,4 Гц, 1H), 4,06-3,84 (м, 3H), 3,74 (с, 2H), 3,65 (с, 2H), 3,42 (д, J=11,0 Гц, 1H), 2,08 (д, J=6,4 Гц, 1H), 2,04-1,81 (м, 2H), 1,58 (квд, J=8,5, 4,2 Гц, 1H), 1,33 (т, J=7,1 Гц, 3H)
Пример 96: (R)-2-(3-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота
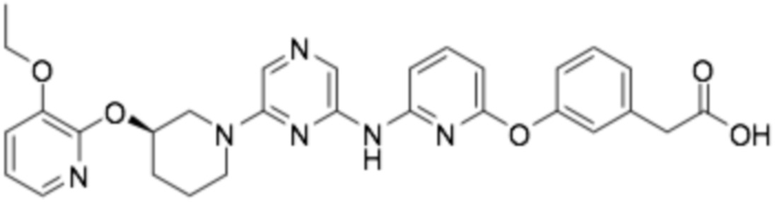
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (91,0 мг, 0,271 ммоль), полученный в примере получения 3, и метил 2-(3-((6-аминопиридин-2-ил)окси)фенил)ацетат (70,0 мг, 0,271 ммоль), полученный в примере получения 108. (выход на 2 стадии 13%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 7,69 (с, 1H), 7,61 (дд, J=5,0, 1,4 Гц, 1H), 7,52 (т, J=7,8 Гц, 1H), 7,47 (с, 1H), 7,40-7,28 (1H), 7,23-6,94 (м, 5H), 6,77 (дд, J=7,8, 5,0 Гц, 1H), 6,41 (д, J=7,8 Гц, 1H), 5,28-5,11 (м, 1H), 4,04 (дд, J=13,7, 5,9 Гц, 1H), 3,93-3,68 (м, 4H), 3,64 (с, 2H), 3,63-3,50 (м, 1H), 2,14-1,91 (м, 3H), 1,73-1,54 (м, 1H), 1,20 (т, J=7,1 Гц, 3H)
Пример 97: (R)-2-(4-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота
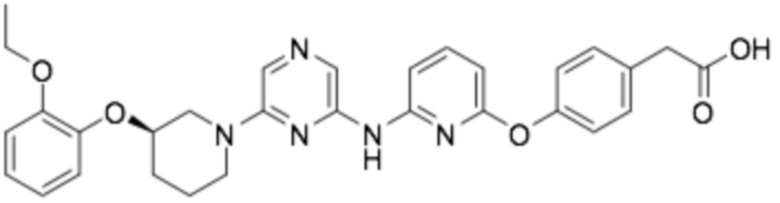
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (90,0 мг, 0,271 ммоль), полученный в примере получения 1, и метил 2-(4-((6-аминопиридин-2-ил)окси)фенил)ацетат (70,0 мг, 0,271 ммоль), полученный в примере получения 105. (выход на 2 стадии 17%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,57 (с, 1H), 7,52 (т, J=7,8 Гц, 1H), 7,49-7,42 (м, 1H), 7,37 (д, J=8,2 Гц, 2H), 7,10 (дт, J=9,3, 2,3 Гц, 2H), 7,08-6,98 (м, 1H), 6,94 (тд, J=8,5, 1,5 Гц, 2H), 6,90-6,81 (м, 2H), 6,78 (д, J=7,8 Гц, 1H), 6,50 (д, J=7,8 Гц, 1H), 4,30 (тд, J=7,5, 3,7 Гц, 1H), 4,07-3,88 (м, 3H), 3,76 (д, J=7,3 Гц, 2H), 3,69 (дд, J=8,5, 4,8 Гц, 1H), 3,59-3,45 (м, 1H), 3,44-3,26 (м, 1H), 2,21-2,05 (м, 1H), 2,03-1,92 (м, 1H), 1,91-1,77 (м, 1H), 1,58 (тт, J=13,0, 4,4 Гц, 1H), 1,34 (т, J=6,9 Гц, 3H)
Пример 98: (R)-2-(4-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота
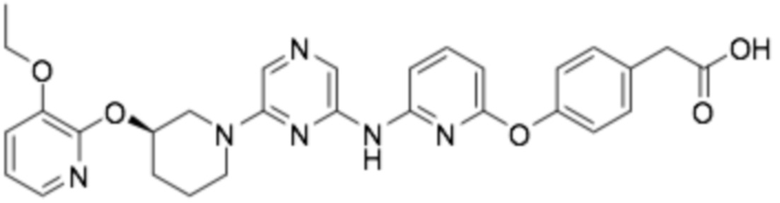
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (91,0 мг, 0,271 ммоль), полученный в примере получения 3, и метил 2-(4-((6-аминопиридин-2-ил)окси)фенил)ацетат (70,0 мг, 0,271 ммоль), полученный в примере получения 105. (выход на 2 стадии 25%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,70 (тд, J=3,0, 1,5 Гц, 1H), 7,62 (д, J=8,2 Гц, 1H), 7,52 (тд, J=7,9, 1,7 Гц, 1H), 7,44-7,33 (м, 3H), 7,09 (дд, J=8,9, 2,1 Гц, 2H), 6,94 (дд, J=7,8, 1,8 Гц, 1H), 6,90 (с, 1H), 6,78 (ддд, J=7,7, 4,9, 1,0 Гц, 1H), 6,68 (д, J=7,8 Гц, 1H), 6,51 (дд, J=7,8, 2,3 Гц, 1H), 5,25-5,09 (м, 1H), 3,96-3,86 (м, 2H), 3,86-3,75 (м, 4H), 3,75-3,61 (м, 1H), 3,59-3,36 (1H), 2,23-2,06 (м, 1H), 2,06-1,87 (м, 2H), 1,75-1,55 (м, 1H), 1,27 (т, J=7,1 Гц, 3H)
Пример 99: (R)-4-(((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)метил)бензойная кислота
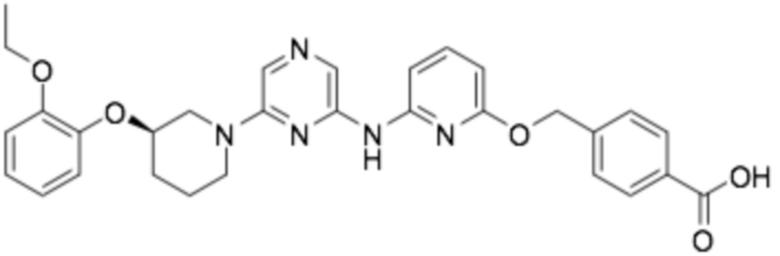
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,095 г, 0,285 ммоль), полученный в примере получения 1, и метил 4-(((6-аминопиридин-2-ил)окси)метил)бензоат (0,067 г, 0,259 ммоль), полученный в примере получения 110, (выход на 2 стадии 21%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,03 (с, 1H), 7,99 (д, J=8,2 Гц, 2H), 7,54 (дд, J=17,8, 8,2 Гц, 2H), 7,47 (с, 1H), 7,43 (т, J=8,0 Гц, 1H), 7,03 (д, J=8,2 Гц, 1H), 6,97 (д, J=7,3 Гц, 1H), 6,90-6,83 (м, 2H), 6,83-6,76 (м, 1H), 6,40-6,31 (м, 1H), 5,43 (с, 2H), 4,48-4,29 (м, 1H), 3,96-3,75 (м, 3H), 3,75-3,66 (м, 1H), 3,60 (дд, J=19,4, 4,8 Гц, 2H), 2,11-1,99 (м, 2H), 1,94-1,82 (м, 1H), 1,66-1,52 (м, 1H), 1,23 (т, J=7,1 Гц, 3H)
Пример 100: (R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота
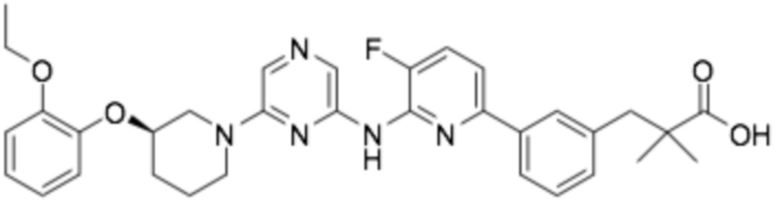
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-амин (44 мг, 0,14 ммоль), полученный в примере получения 2, и трет-бутил 3-(3-(6-хлор-5-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат (51 мг, 0,14 ммоль), полученный на стадии 1 примера получения 85. (выход на 2 стадии 12%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,91 (с, 1H), 7,83 (с, 1H), 7,79 (д, J=8,2 Гц, 1H), 7,68 (с, 1H), 7,56 (дд, J=10,5, 8,7 Гц, 1H), 7,43 (дд, J=8,5, 3,0 Гц, 1H), 7,35 (т, J=7,8 Гц, 1H), 7,22 (д, J=7,3 Гц, 1H), 6,97 (кв, J=3,2 Гц, 1H), 6,91-6,74 (м, 3H), 4,49 (д, J=2,5 Гц, 1H), 4,15-4,01 (м, 1H), 3,96 (д, J=8,2 Гц, 1H), 3,85 (tdd, J=16,8, 6,9, 2,7 Гц, 2H), 3,75 (д, J=14,2 Гц, 1H), 3,61-3,47 (м, 1H), 2,95 (с, 2H), 2,13-1,90 (м, 3H), 1,60 (д, J=5,9 Гц, 1H), 1,23 (т, J=6,9 Гц, 3H), 1,20-1,09 (6H)
Пример 101: (R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота
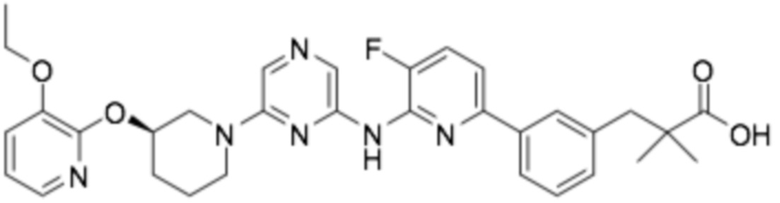
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (45 мг, 0,13 ммоль), полученный в примере получения 3, и трет-бутил 3-(3-(6-амино-5-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат (46 мг, 0,13 ммоль), полученный в примере получения 85. (выход на 2 стадии 24%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,99 (с, 1H), 7,86 (с, 1H), 7,79 (д, J=7,8 Гц, 1H), 7,71-7,58 (м, 2H), 7,48 (дд, J=10,5, 8,2 Гц, 1H), 7,41-7,34 (м, 1H), 7,31 (д, J=7,8 Гц, 1H), 7,19 (д, J=7,3 Гц, 1H), 6,96 (дд, J=7,8, 1,8 Гц, 1H), 6,78 (дд, J=7,8, 5,0 Гц, 1H), 5,16 (кв, J=2,6 Гц, 1H), 4,20 (дд, J=14,0, 5,3 Гц, 1H), 3,94-3,82 (м, 1H), 3,81-3,70 (м, 2H), 3,70-3,63 (м, 1H), 3,63-3,47 (м, 1H), 2,94 (дд, J=15,6, 13,3 Гц, 2H), 2,16-1,89 (м, 4H), 1,70-1,53 (м, 1H), 1,19 (д, J=5,9 Гц, 6H), 1,15 (д, J=6,9 Гц, 3H)
Пример 102: (R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота
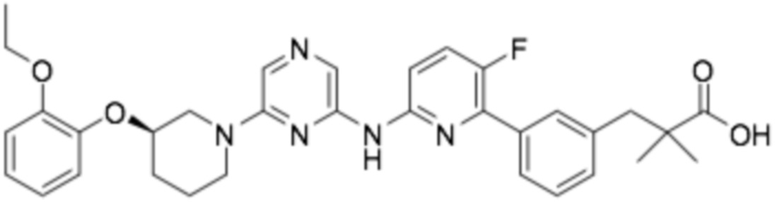
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-амин (43 мг, 0,14 ммоль), полученный в примере получения 2, и трет-бутил 3-(3-(6-хлор-3-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат (50 мг, 0,14 ммоль), полученный на стадии 1 примера получения 87. (выход на 2 стадии 55%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,40 (с, 1H), 7,78 (д, J=6,4 Гц, 2H), 7,55 (с, 1H), 7,49 (дд, J=10,5, 8,7 Гц, 1H), 7,42-7,33 (м, 1H), 7,33-7,17 (м, 2H), 6,95 (д, J=6,9 Гц, 1H), 6,90-6,73 (м, 3H), 4,51 (т, J=2,7 Гц, 1H), 4,04-3,93 (м, 2H), 3,93-3,80 (2H), 3,76 (д, J=14,2 Гц, 1H), 3,49 (тд, J=8,9, 4,1 Гц, 1H), 2,95 (с, 2H), 2,13-1,99 (м, 3H), 1,70-1,53 (м, 1H), 1,23 (т, J=6,9 Гц, 4H), 1,19 (с, 6H)
Пример 103: (R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота
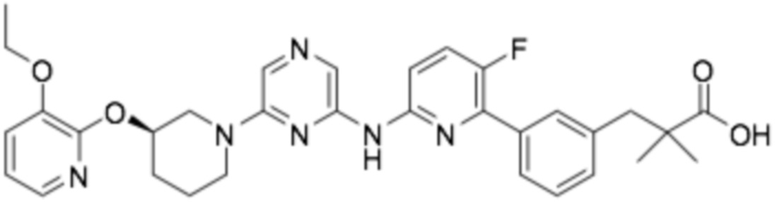
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (113 мг, 0,34 ммоль), полученный в примере получения 3, и трет-бутил 3-(3-(6-амино-3-фторпиридин-2-ил)фенил)-2,2-диметилпропаноат (68 мг, 0,23 ммоль), полученный в примере получения 87. (выход на 2 стадии 54%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,24 (с, 1H), 7,90-7,73 (м, 2H), 7,59 (дд, J=5,0, 1,4 Гц, 1H), 7,52 (с, 1H), 7,46-7,26 (м, 3H), 7,23 (д, J=7,3 Гц, 1H), 7,03 (дд, J=8,0, 1,6 Гц, 1H), 6,73 (дд, J=7,8, 5,0 Гц, 1H), 5,28-5,12 (м, 1H), 4,16-3,98 (м, 2H), 3,95-3,69 (м, 4H), 3,69-3,51 (м, 1H), 2,94 (с, 2H), 2,18-2,00 (м, 2H), 1,96 (д, J=9,1 Гц, 1H), 1,72-1,55 (м, 1H), 1,25-1,16 (м, 9H)
Пример 104: (R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенокси)-2-метилпропановая кислота
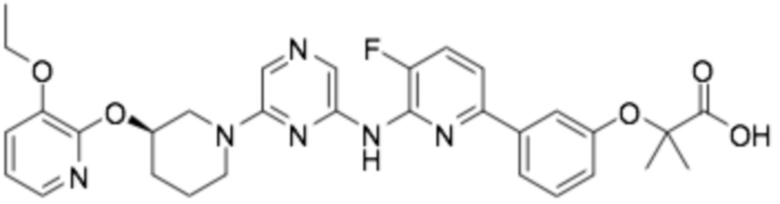
Стадия 1: ( R )-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-амин
Требуемый продукт получали способом, аналогичным примеру получения 19 (стадия 3, стадия 4), применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (5 г, 14,93 ммоль), полученный в примере получения 3. (выход на 2 стадии 90%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,72 (дд, J=4,8, 1,6 Гц, 1H), 7,31 (с, 1H), 7,28 (с, 1H), 7,02 (дд, J=7,8, 1,4 Гц, 1H), 6,82 (дд, J=7,8, 5,0 Гц, 1H), 5,27-5,09 (м, 1H), 4,03-3,77 (м, 4H), 3,77-3,66 (1H), 3,66-3,52 (1H), 2,20-1,89 (м, 4H), 1,74-1,56 (м, 1H), 1,39-1,27 (м, 3H)
Стадия 2: ( R )- N -(6-хлор-3-фторпиридин-2-ил)-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-амин
(R)-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-амин (2,91 г, 9,23 ммоль), полученный на стадии 1, и 2,6-дихлор-3-фторпиридин (1,84 г, 11,07 ммоль), трис(дибензилиденацетон)дипалладий(0) (507 мг, 0,55 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантин (481 мг, 0,83 ммоль) и карбонат цезия (7,52 г, 23,07 ммоль) растворяли в 1,4-диоксане и перемешивали при кипячении с обратным холодильником в течение 4 часов. После завершения реакции, реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, промывали водным раствором гидрокарбоната натрия и соляным раствором, и органический растворитель сушили над сульфатом магния, и затем удаляли при пониженном давлении. Требуемый продукт получали очисткой колонкой с силикагелем (гексан : этилацетат). (выход 39%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,84 (с, 1H), 7,90-7,78 (1H), 7,73 (кв, J=2,3 Гц, 1H), 7,36-7,26 (м, 1H), 6,95 (дд, J=7,8, 1,8 Гц, 1H), 6,87 (с, 1H), 6,84-6,71 (м, 2H), 5,28-5,12 (м, 1H), 4,04-3,81 (м, 4H), 3,77 (квд, J=6,8, 3,4 Гц, 1H), 3,63-3,44 (м, 1H), 2,16 (тд, J=8,8, 4,6 Гц, 1H), 2,02-1,89 (м, 2H), 1,67 (тд, J=8,3, 4,1 Гц, 1H), 1,30 (т, J=6,9 Гц, 3H)
Стадия 3: ( R )-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенокси)-2-метилпропановая кислота
(R)-N-(6-хлор-3-фторпиридин-2-ил)-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-амин (157 мг, 0,35 ммоль), полученный на стадии 2, и этил 2-метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пропаноат (142 мг, 0,423 ммоль), полученный на стадии 2 примера получения 88, растворяли в 1,4-диоксане и добавляли фосфат трикалия (225 мг, 1,059 ммоль). После удаления растворенного кислорода из реакционной смеси, ее заполняли азотом и блокировали приток внешнего воздуха. Добавляли ацетат палладия (4,75 мг, 0,021 ммоль), с последующим присоединением устройства для охлаждения обратным холодильником и нагреванием в течение 14 часов при 140°C. После завершения реакции, смесь фильтровали через целит и концентрировали при пониженном давлении, и смесь очищали колоночной хроматографией (гексан : этилацетат), получая требуемое соединение. (выход 12%)
Полученное сложноэфирное соединение (27 мг, 0,04 ммоль) растворяли в THF : метанол : вода = 1:1:1, и добавляли гидроксид лития (10 мг, 0,44 ммоль), с последующим перемешиванием при комнатной температуре в течение 12 часов. После завершения реакции, ее разбавляли водой, нейтрализовали 1 N раствором хлористоводородной кислоты, экстрагировали этилацетатом, и органический растворитель сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Заявленное в заголовке соединение получали очисткой колонкой с силикагелем (этилацетат:метанол). (выход 36%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,85 (с, 1H), 7,72-7,54 (м, 4H), 7,48 (дд, J=10,5, 8,7 Гц, 1H), 7,38-7,23 (м, 2H), 7,04-6,94 (1H), 6,94-6,89 (м, 1H), 6,78 (дд, J=7,8, 5,0 Гц, 1H), 5,16 (т, J=2,5 Гц, 1H), 4,18 (дд, J=13,7, 5,5 Гц, 1H), 3,92-3,63 (м, 4H), 3,57 (т, J=4,8 Гц, 1H), 2,15-2,00 (м, 2H), 1,97 (д, J=3,7 Гц, 1H), 1,62 (с, 1H), 1,59 (с, 6H), 1,16 (т, J=6,9 Гц, 3H)
Пример 105: (R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенокси)-2-метилпропановая кислота
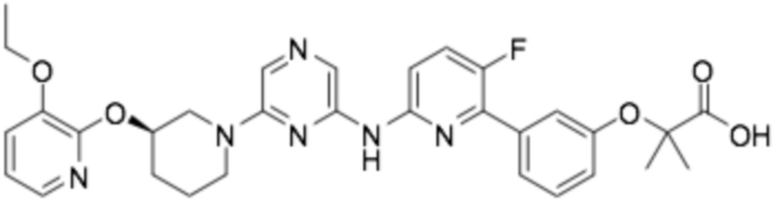
Стадия 1: ( R )-N-(6-хлор-5-фторпиридин-2-ил)-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-амин
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера 104, применяя (R)-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-амин (2,91 г, 9,23 ммоль), полученный на стадии 1 пример 104, и 2,6-дихлор-3-фторпиридин (1,84 г, 11,07 ммоль). (выход 8%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 7,69 (с, 1H), 7,68 (с, 1H), 7,66-7,61 (1H), 7,59 (дд, J=8,7, 2,7 Гц, 1H), 7,34-7,19 (м, 2H), 7,08 (д, J=21,5 Гц, 1H), 6,97 (дд, J=7,8, 1,4 Гц, 1H), 6,74 (дд, J=7,8, 5,0 Гц, 1H), 5,33-5,15 (1H), 4,07-4,01 (м, 1H), 4,01-3,83 (м, 2H), 3,83-3,65 (м, 2H), 3,61-3,41 (м, 1H), 2,16 (тд, J=8,6, 4,4 Гц, 1H), 2,11-1,95 (м, 4H), 1,81-1,59 (м, 1H), 1,31 (т, J=7,1 Гц, 3H)
Стадия 2: ( R )-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенокси)-2-метилпропановая кислота
Заявленное в заголовке соединение получали способом, аналогичным стадии 3 примера 104, применяя (R)-N-(6-хлор-5-фторпиридин-2-ил)-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-амин (170 мг, 0,38 ммоль), полученный на стадии 1, и этил 2-метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пропаноат (153 мг, 0,46 ммоль), полученный на стадии 2 примера получения 88. (выход на 2 стадии 4%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,08 (с, 1H), 7,68-7,45 (м, 5H), 7,44-7,25 (м, 3H), 7,03 (дд, J=7,8, 1,4 Гц, 1H), 6,96 (дд, J=8,2, 1,8 Гц, 1H), 6,78-6,63 (1H), 5,20 (с, 1H), 4,08 (т, J=7,1 Гц, 1H), 3,91-3,68 (м, 4H), 3,68-3,49 (1H), 2,17-2,02 (3H), 1,97 (д, J=8,7 Гц, 2H), 1,67-1,61 (1H), 1,58 (д, J=8,7 Гц, 6H), 1,20 (т, J=7,1 Гц, 3H)
Пример 106: (R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота
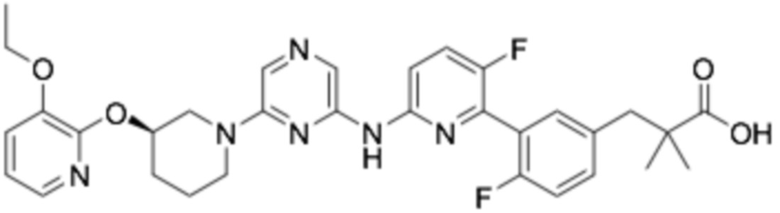
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (46 мг, 0,14 ммоль), полученный в примере получения 3, и трет-бутил 3-(3-(6-амино-3-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат (45 мг, 0,12 ммоль), полученный в примере получения 114. (выход на 2 стадии 57%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,96 (с, 1H), 7,80 (дд, J=7,8, 1,8 Гц, 1H), 7,65 (дд, J=5,0, 1,4 Гц, 1H), 7,63 (с, 1H), 7,48 (дд, J=10,7, 8,5 Гц, 1H), 7,41-7,28 (м, 1H), 7,27-7,12 (м, 1H), 7,07 (дд, J=11,4, 8,2 Гц, 1H), 6,97 (дд, J=7,8, 1,4 Гц, 1H), 6,78 (дд, J=7,8, 5,0 Гц, 1H), 5,15 (кв, J=2,7 Гц, 1H), 4,25-4,12 (1H), 3,92-3,62 (4H), 3,62-3,46 (м, 1H), 2,91 (с, 2H), 2,15-1,89 (м, 4H), 1,69-1,52 (1H), 1,20-1,17 (м, 6H), 1,15 (т, J=6,9 Гц, 3H)
Пример 107: (R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота
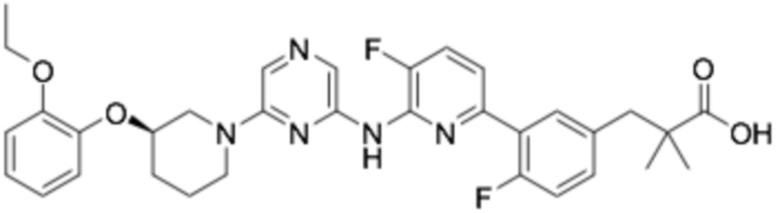
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (132 мг, 0,40 ммоль), полученный в примере получения 1, и трет-бутил 3-(3-(6-амино-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат (130 мг, 0,36 ммоль), полученный в примере получения 115. (выход на 2 стадии 37%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,15 (с, 1H), 7,51 (с, 1H), 7,49-7,41 (м, 2H), 7,37 (т, J=8,9 Гц, 1H), 7,32-7,19 (м, 1H), 7,08 (дд, J=10,1, 8,2 Гц, 1H), 6,97 (д, J=7,8 Гц, 1H), 6,92-6,85 (2H), 6,84-6,72 (м, 1H), 4,49-4,33 (м, 1H), 4,00-3,80 (м, 3H), 3,73 (кв, J=6,7 Гц, 1H), 3,63 (т, J=5,5 Гц, 2H), 2,90 (с, 2H), 2,16-2,00 (м, 2H), 1,95-1,81 (м, 1H), 1,61 (дд, J=9,6, 3,2 Гц, 1H), 1,35-1,23 (3H), 1,18 (с, 6H)
Пример 108: (R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота
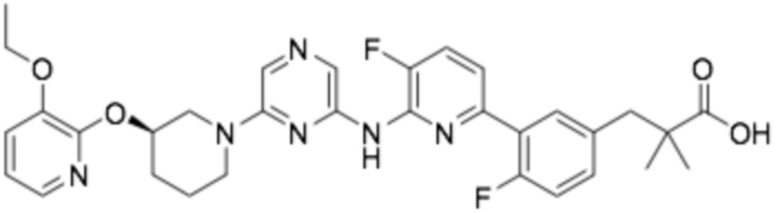
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (132 мг, 0,40 ммоль), полученный в примере получения 3, и трет-бутил 3-(3-(6-амино-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропаноат (130 мг, 0,36 ммоль), полученный в примере получения 115. (выход на 2 стадии 41%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,30 (с, 1H), 7,59 (дд, J=5,0, 1,4 Гц, 2H), 7,50 (т, J=9,1 Гц, 1H), 7,43 (дд, J=7,1, 2,1 Гц, 1H), 7,38-7,21 (2H), 7,11 (дд, J=10,1, 8,2 Гц, 1H), 7,03 (дд, J=7,8, 1,4 Гц, 1H), 6,75 (дд, J=7,8, 5,0 Гц, 1H), 5,25 (т, J=2,5 Гц, 1H), 4,21 (дд, J=14,2, 5,0 Гц, 1H), 3,94 (д, J=13,3 Гц, 1H), 3,89-3,66 (3H), 3,66-3,47 (м, 1H), 2,91 (с, 2H), 2,17-2,00 (м, 3H), 1,72-1,56 (м, 1H), 1,24-1,18 (м, 9H)
Пример 109: (R)-2-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-3-(трифторметил)пиридин-2-ил)фенил)-2-метилпропановая кислота
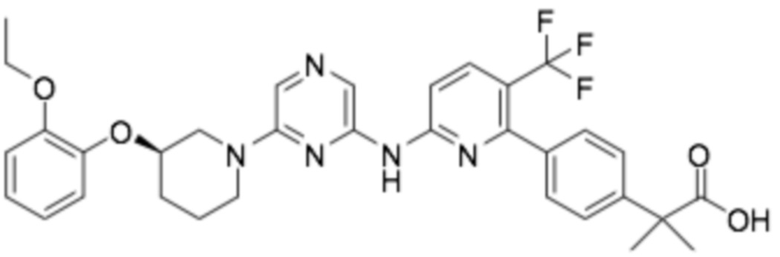
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,2 г, 0,598 ммоль), полученный в примере получения 1, и метил 2-(4-(6-амино-3-(трифторметил)пиридин-2-ил)фенил)-2-метилпропаноат (0,184 г, 0,544 ммоль), полученный в примере получения 75. (выход на 2 стадии 40%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 9,19 (с, 1H), 8,13 (д, J=8,5 Гц, 2H), 7,91 (д, J=8,2 Гц, 1H), 7,78 (с, 1H), 7,70 (д, J=8,5 Гц, 2H), 7,41 (д, J=8,2 Гц, 1H), 7,24 (с, 1H), 7,06-6,82 (м, 4H), 4,38-4,23 (м, 1H), 4,23-4,09 (м, 1H), 4,09-3,87 (2H), 3,81 (д, J=13,7 Гц, 1H), 3,56 (дд, J=13,1, 7,6 Гц, 1H), 3,50-3,31 (м, 1H), 2,17 (д, J=28,7 Гц, 1H), 2,05-1,98 (м, 1H), 1,98-1,88 (м, 2H), 1,64 (тд, J=9,0, 4,5 Гц, 6H), 1,39 (т, J=7,0 Гц, 3H)
Пример 110: (R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-4-(трифторметил)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота
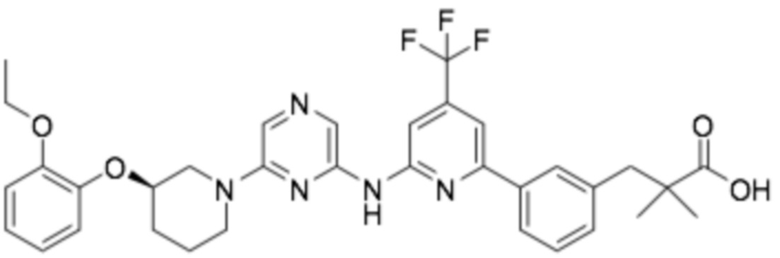
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (110 мг, 0,330 ммоль), полученный в примере получения 1, и трет-бутил 3-(3-(6-амино-4-(трифторметил)пиридин-2-ил)фенил)-2,2-диметилпропаноат (130 мг, 0,330 ммоль), полученный в примере получения 84. (выход на 2 стадии 80%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,44 (с, 1H), 8,19 (с, 1H), 7,79-7,62 (м, 2H), 7,55-7,43 (1H), 7,36 (т, J=7,8 Гц, 1H), 7,21 (д, J=7,8 Гц, 1H), 7,02-6,82 (м, 5H), 6,80 (с, 1H), 4,42-4,26 (м, 1H), 4,09-3,85 (м, 3H), 3,85-3,70 (м, 1H), 3,66 (кв, J=6,9 Гц, 1H), 3,53-3,34 (1H), 3,09-2,97 (2H), 2,16-2,08 (м, 1H), 2,08-1,96 (м, 1H), 1,96-1,84 (1H), 1,61 (квд, J=8,7, 4,5 Гц, 1H), 1,36 (т, J=7,1 Гц, 3H), 1,25 (д, J=1,4 Гц, 6H)
Пример 111: (R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-3-метилпиридин-2-ил)фенил)-2,2-диметилпропановая кислота
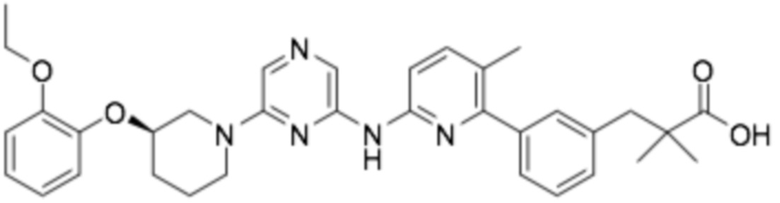
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (26 мг, 0,08 ммоль), полученный в примере получения 1, и трет-бутил 3-(3-(6-амино-3-метилпиридин-2-ил)фенил)-2,2-диметилпропаноат (24 мг, 0,07 ммоль), полученный в примере получения 91. (выход на 2 стадии 44%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,07 (с, 1H), 7,48 (с, 1H), 7,45-7,26 (м, 6H), 7,20 (д, J=7,3 Гц, 1H), 6,97 (д, J=7,8 Гц, 1H), 6,88 (д, J=3,7 Гц, 2H), 6,85-6,72 (м, 1H), 4,47-4,31 (м, 1H), 4,02-3,80 (м, 3H), 3,76-3,53 (м, 4H), 2,92 (с, 2H), 2,24 (д, J=9,1 Гц, 3H), 2,16-1,96 (м, 4H), 1,96-1,82 (м, 1H), 1,69-1,53 (м, 1H), 1,26 (т, J=7,1 Гц, 3H), 1,18 (с, 6H)
Пример 112: (R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиразин-2-ил)фенил)-2,2-диметилпропановая кислота
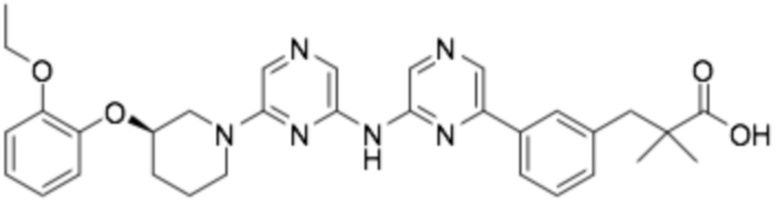
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (99,0 мг, 0,296 ммоль), полученный в примере получения 1, и трет-бутил 3-(3-(6-аминопиразин-2-ил)фенил)-2,2-диметилпропаноат (97,0 мг, 0,296 ммоль), полученный в примере получения 82. (выход на 2 стадии 88%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,37 (с, 1H), 8,60 (с, 1H), 8,21 (с, 1H), 8,07 (с, 1H), 7,89-7,78 (1H), 7,74 (д, J=6,9 Гц, 1H), 7,37 (т, J=7,8 Гц, 1H), 7,22 (д, J=7,3 Гц, 1H), 7,06-6,76 (м, 5H), 4,36 (д, J=4,1 Гц, 1H), 3,95 (ддд, J=30,9, 16,2, 7,5 Гц, 3H), 3,84-3,61 (2H), 3,62-3,42 (м, 1H), 3,01 (с, 2H), 2,21-1,85 (м, 3H), 1,61 (дд, J=21,5, 8,2 Гц, 1H), 1,36 (т, J=7,1 Гц, 3H), 1,26 (с, 6H)
Пример 113: (R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)пиримидин-2-амин
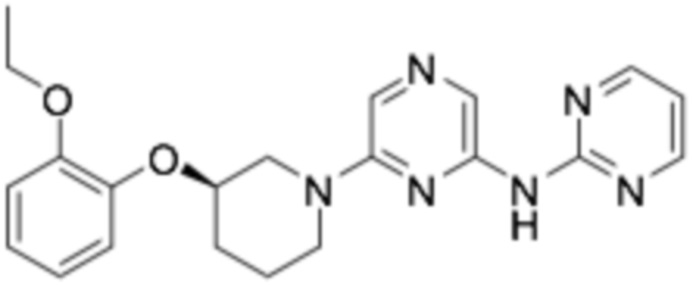
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,10 г, 0,30 ммоль), полученный в примере получения 1, и 2-аминопиримидин (0,03 г, 0,33 ммоль). (выход 72%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 8,93 (с, 1H), 8,49 (д, J=4,9 Гц, 2H), 7,79 (с, 1H), 7,61 (с, 1H), 7,05-6,99 (1H), 6,97-6,93 (м, 1H), 6,88 (т, J=7,3 Гц, 2H), 6,79 (т, J=4,9 Гц, 1H), 4,27 (тд, J=8,1, 3,9 Гц, 1H), 4,15 (дд, J=13,1, 3,4 Гц, 1H), 4,07-3,93 (м, 2H), 3,85 (тд, J=8,9, 4,1 Гц, 1H), 3,53-3,38 (м, 1H), 3,36-3,21 (м, 1H), 2,15 (дд, J=11,3, 3,4 Гц, 1H), 2,04-1,93 (м, 1H), 1,91-1,80 (м, 1H), 1,61 (тд, J=9,3, 4,3 Гц, 1H), 1,44-1,32 (м, 3H)
Пример 114: (R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-5-карбоновая кислота
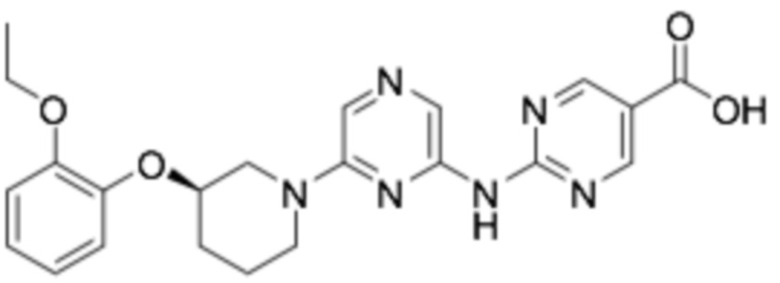
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,15 г, 0,45 ммоль), полученный в примере получения 1, и метил 2-аминопиримидин-5-карбоксилат (0,076 г, 0,49 ммоль). (выход 54%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D): δ 9,03 (с, 2H), 8,98-8,88 (1H), 7,85 (с, 1H), 7,71 (с, 1H), 6,97 (кв, J=8,4 Гц, 2H), 6,91-6,78 (м, 2H), 4,42-4,22 (м, 1H), 4,19-4,06 (м, 1H), 4,04-3,97 (м, 2H), 3,93 (д, J=1,2 Гц, 3H), 3,81 (кв, J=4,5 Гц, 1H), 3,63-3,51 (м, 1H), 3,43-3,32 (м, 1H), 2,13 (т, J=5,8 Гц, 1H), 2,07-1,96 (м, 1H), 1,91 (кв, J=4,3 Гц, 1H), 1,62 (д, J=4,3 Гц, 1H), 1,38 (т, J=6,4 Гц, 3H)
Заявленное в заголовке соединение получали реакцией гидролиза полученного сложноэфирного соединения (0,11 г, 0,24 ммоль) тем же способом, как в примере 1. (выход 75%)
1H-ЯМР (500 МГц, DMSO-D6): δ 13,39-12,85 (1H), 10,16 (с, 1H), 8,93 (д, J=17,7 Гц, 2H), 8,61 (с, 1H), 7,98-7,78 (1H), 7,01 (д, J=6,7 Гц, 1H), 6,94-6,85 (м, 2H), 6,80 (т, J=6,7 Гц, 1H), 4,29 (т, J=3,7 Гц, 1H), 4,08 (д, J=13,4 Гц, 1H), 3,99-3,80 (м, 2H), 3,72 (д, J=14,7 Гц, 1H), 3,47 (кв, J=6,7 Гц, 2H), 1,99 (д, J=9,2 Гц, 1H), 1,80 (с, 1H), 1,69 (т, J=4,3 Гц, 1H), 1,59-1,41 (м, 1H), 1,33-1,04 (м, 3H)
Пример 115: (R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)пиримидин-4-ил)-2-метилпропановая кислота
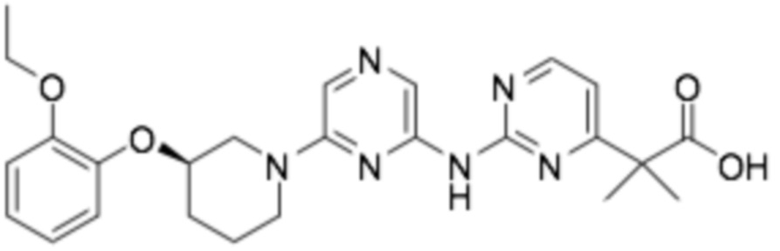
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (1,62 г, 4,85 ммоль), полученный в примере получения 1, и этил 2-(2-аминопиримидин-4-ил)-2-метилпропаноат (1,02 г, 4,85 ммоль), полученный в примере получения 20. (выход на 2 стадии 17%)
1H-ЯМР (400 МГц, DMSO-D6) δ 8,97 (с, 1H), 8,85 (с, 1H), 8,31 (д, 1H), 7,80 (с, 1H), 7,06 (д, 1H), 6,94-6,87 (м, 4H), 4,33 (м, 1H), 4,11 (д, 1H), 3,94 (м, 2H), 3,79 (м, 1H), 3,45 (м, 2H), 2,02 (м, 1H), 1,85 (м, 1H), 1,71 (м, 1H), 1,55 (м, 1H), 1,25 (т, 3H)
Пример 116: (R)-2-(2-((4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин-2-ил)пиримидин-4-ил)-2-метилпропановая кислота
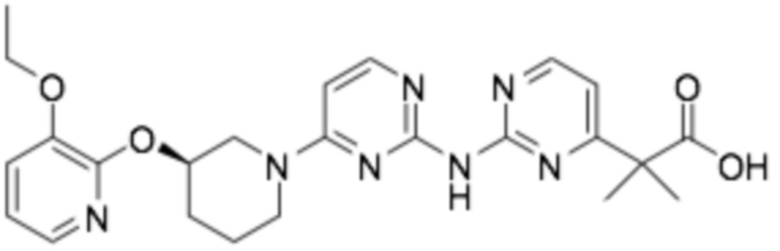
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,15 г, 0,49 ммоль), полученный в примере получения 3, и этил 2-(2-аминопиримидин-4-ил)-2-метилпропаноат (94 мг, 0,49 ммоль), полученный в примере получения 20. (выход на 2 стадии 54%)
1H-ЯМР (400 МГц, DMSO-D6) δ 8,93 (с, 1H), 8,22 (д, J=4,6 Гц, 1H), 7,96 (д, J=5,9 Гц, 1H), 7,65 (д, J=4,6 Гц, 1H), 7,22 (д, J=7,3 Гц, 1H), 6,99-6,80 (м, 2H), 6,30 (д, J=5,0 Гц, 1H), 5,06 (с, 1H), 4,12 (с, 1H), 4,04-3,75 (м, 3H), 3,55 (дд, J=12,6, 7,5 Гц, 2H), 2,09 (с, 1H), 1,77 (д, J=13,7 Гц, 2H), 1,52 (д, J=5,0 Гц, 1H), 1,30 (д, J=5,9 Гц, 6H), 1,23 (т, J=7,1 Гц, 3H)
Пример 117: (2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-L-пролин
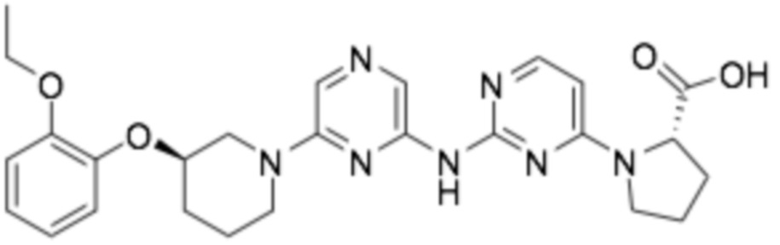
Стадия 1: Метил (2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-L-пролинат
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,172 г, 0,514 ммоль), полученный в примере получения 1, и метил (2-аминопиримидин-4-ил)-L-пролинат (0,120 г, 0,540 ммоль), полученный в примере получения 37. (выход 72%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 9,24-8,69 (1H), 8,07 (с, 1H), 8,02-7,79 (1H), 7,73 (д, J=6,4 Гц, 1H), 7,11-6,66 (м, 4H), 5,95 (с, 1H), 4,78 (с, 1H), 4,27 (д, J=7,6 Гц, 1H), 4,19 (д, J=13,1 Гц, 1H), 4,12 (дд, J=12,2, 7,0 Гц, 1H), 4,07-3,96 (м, 2H), 3,88 (с, 1H), 3,72 (д, J=7,9 Гц, 3H), 3,65-3,49 (1H), 3,35 (д, J=28,4 Гц, 2H), 3,21 (с, 1H), 2,34-2,21 (1H), 2,16 (д, J=5,8 Гц, 2H), 2,03-1,98 (1H), 1,91 (с, 1H), 1,90-1,72 (1H), 1,61 (с, 1H), 1,42-1,30 (м, 3H)
Стадия 2: (2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)- L -пролин
Метил (2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил-L-пролинат (0,191 г, 0,368 ммоль), полученный на стадии 1, растворяли в метаноле (1,8 мл) и THF (1,8 мл), и затем добавляли 6 N водный раствор гидроксида натрия (0,306 мл, 1,838 ммоль) и перемешивали при комнатной температуре в течение 4 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Заявленное в заголовке соединение получали очисткой колонкой с силикагелем. (выход 47%)
m/z (M+H)+ рассчитанная для C26H32N7O4: 506, найденная 506
Пример 118: 1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пирролидин-3-карбоновая кислота
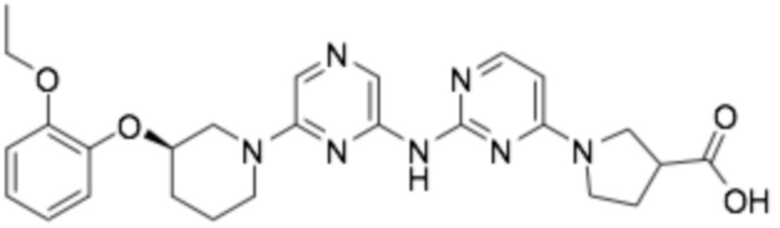
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,140 г, 0,446 ммоль), полученный в примере получения 1, и метил 1-(2-аминопиримидин-4-ил)пирролидин-3-карбоксилат (0,104 г, 0,468 ммоль), полученный в примере получения 39. (выход 53%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,94 (с, 1H), 8,90-8,36 (1H), 7,86 (с, 1H), 7,72 (с, 1H), 7,01 (д, J=7,9 Гц, 1H), 7,00-6,94 (1H), 6,89 (т, J=7,8 Гц, 2H), 5,89 (д, J=6,1 Гц, 1H), 4,36-4,24 (м, 1H), 4,18 (д, J=13,1 Гц, 1H), 4,12-3,94 (м, 3H), 3,87 (д, J=13,1 Гц, 2H), 3,84-3,70 (1H), 3,69-3,51 (1H), 3,51-3,40 (1H), 3,36 (д, J=9,8 Гц, 1H), 3,30-3,11 (1H), 2,58-2,37 (1H), 2,27 (с, 1H), 2,12 (с, 1H), 1,97 (д, J=13,7 Гц, 1H), 1,88 (с, 1H), 1,68-1,53 (м, 1H), 1,40 (т, J=7,0 Гц, 3H)
Пример 119: 1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпирролидин-3-карбоновая кислота
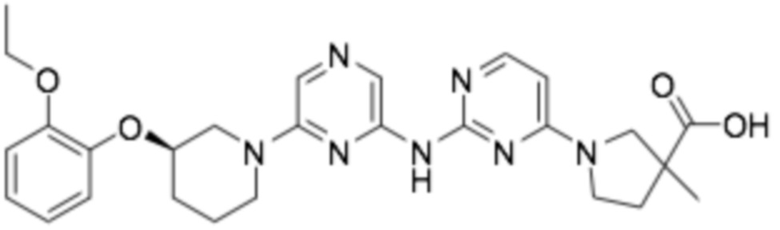
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,226 г, 0,677 ммоль), полученный в примере получения 1, и метил 1-(2-аминопиримидин-4-ил)-3-метилпирролидин-3-карбоксилат (0,168 г, 0,711 ммоль), полученный в примере получения 48. (выход 23%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,94 (с, 1H), 8,28-7,95 (1H), 7,85 (с, 1H), 7,67 (с, 1H), 7,02-6,82 (4H), 5,84 (д, J=6,4 Гц, 1H), 4,26 (д, J=4,1 Гц, 1H), 4,19-4,07 (м, 1H), 3,99 (квд, J=6,9, 3,3 Гц, 2H), 3,85 (с, 1H), 3,78-3,50 (2H), 3,49-3,35 (м, 2H), 3,30 (с, 1H), 3,22-3,04 (1H), 2,68-2,53 (1H), 2,10 (с, 1H), 1,92 (т, J=15,1 Гц, 3H), 1,57 (д, J=14,2 Гц, 1H), 1,46 (с, 3H), 1,37 (т, J=6,9 Гц, 3H)
Пример 120: 1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-карбоновая кислота
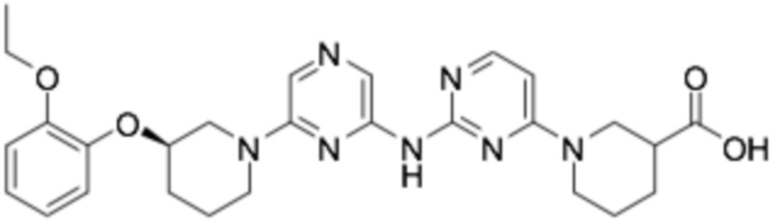
Заявленное в заголовке соединение получали тем же способом, как в примере 46, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,145 г, 0,436 ммоль), полученный в примере получения 1, и этил 1-(2-аминопиримидин-4-ил)пиперидин-3-карбоксилат (0,120 г, 0,479 ммоль), полученный в примере получения 43. (выход 31%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,74 (с, 1H), 7,90-7,55 (м, 2H), 7,02-6,78 (м, 4H), 6,20-6,00 (1H), 4,28-4,06 (м, 2H), 4,06-3,87 (м, 3H), 3,78 (с, 1H), 3,55-3,19 (м, 3H), 3,15 (с, 1H), 2,47 (с, 1H), 2,04 (д, J=11,9 Гц, 2H), 1,96-1,67 (м, 4H), 1,62-1,39 (м, 2H), 1,34 (т, J=6,9 Гц, 3H), 1,29-1,11 (м, 1H)
Пример 121: (R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-карбоновая кислота
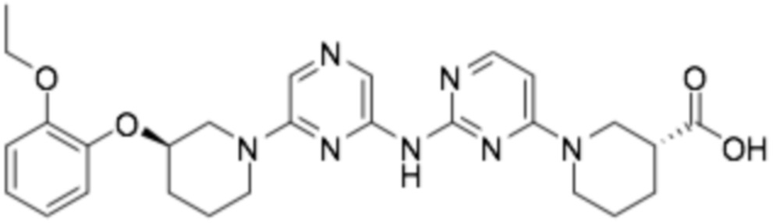
Стадия 1: Этил ( R )-1-(2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин -4-ил)пиперидин-3-карбоксилат
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,061 г, 0,182 ммоль), полученный в примере получения 1, и этил (R)-1-(2-аминопиримидин-4-ил)пиперидин-3-карбоксилат (0,050 г, 0,200 ммоль), полученный в примере получения 30, (выход 42%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,83 (с, 1H), 8,02 (д, J=6,4 Гц, 1H), 7,73 (с, 1H), 7,36 (с, 1H), 7,08-6,99 (1H), 6,99-6,93 (1H), 6,93-6,82 (м, 2H), 6,13 (д, J=6,4 Гц, 1H), 4,34-4,22 (м, 2H), 4,22-4,07 (м, 4H), 4,07-3,94 (м, 2H), 3,87 (дт, J=12,9, 4,6 Гц, 1H), 3,46-3,32 (м, 2H), 3,32-3,23 (м, 1H), 3,23-3,11 (м, 1H), 2,63-2,47 (м, 1H), 2,16 (дд, J=12,8, 4,6 Гц, 1H), 2,08 (тд, J=8,7, 4,3 Гц, 1H), 2,01-1,91 (м, 1H), 1,91-1,73 (м, 3H), 1,69-1,48 (м, 2H), 1,47-1,33 (м, 3H), 1,26 (т, J=7,2 Гц, 3H)
Стадия 2: ( R )-1-(2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-карбоновая кислота
Этил (R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-карбоксилат (0,042 г, 0,077 ммоль), полученный на стадии 1, растворяли в этаноле (0,4 мл) и THF (0,4 мл), и затем добавляли 7 N водный раствор гидроксида натрия (0,110 мл, 0,767 ммоль) и перемешивали при комнатной температуре в течение 4 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Заявленное в заголовке соединение получали очисткой колонкой с силикагелем. (выход 37%)
m/z (M+H)+ рассчитанная для C27H34N7O4: 520, найденная 520
Пример 122: 1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпиперидин-3-карбоновая кислота
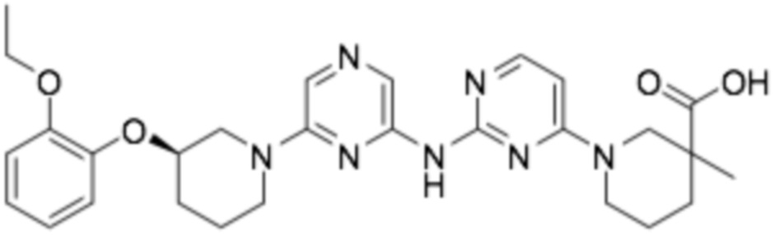
Стадия 1: Этил 1-(2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпиперидин-3-карбоксилат
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,111 г, 0,331 ммоль), полученный в примере получения 1, и этил 1-(2-аминопиримидин-4-ил)-3-метилпиперидин-3-карбоксилат (0,092 г, 0,348 ммоль), полученный в примере получения 40. (выход 63%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,88 (с, 1H), 8,01 (д, J=6,1 Гц, 1H), 7,84-7,72 (1H), 7,13 (с, 1H), 7,06 (т, J=8,4 Гц, 1H), 7,02-6,96 (1H), 6,96-6,87 (м, 2H), 6,30-6,14 (1H), 4,48-4,25 (2H), 4,25-4,18 (м, 1H), 4,18-4,08 (м, 2H), 4,08-3,96 (2H), 3,96-3,79 (1H), 3,52-3,34 (1H), 3,34-3,25 (м, 1H), 3,25-3,15 (м, 1H), 3,15-2,99 (м, 1H), 2,45-2,23 (м, 1H), 2,19-2,14 (м, 1H), 2,02-1,93 (м, 1H), 1,93-1,82 (1H), 1,82-1,60 (м, 3H), 1,55-1,46 (м, 2H), 1,43 (т, J=6,9 Гц, 3H), 1,24 (с, 3H), 1,20 (т, J=7,2 Гц, 3H)
Стадия 2: 1-(2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпиперидин-3-карбоновая кислота
Этил 1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпиперидин-3-карбоксилат (0,117 г, 0,208 ммоль), полученный на стадии 1, растворяли в этаноле (1 мл) и THF (1 мл), и затем добавляли 6N водный раствор гидроксида натрия (0,174 мл, 1,042 ммоль) и перемешивали при комнатной температуре в течение 7 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Заявленное в заголовке соединение получали очисткой колонкой с силикагелем. (выход 56%)
m/z (M+H)+ рассчитанная для C27H35N7O4: 520,62, найденная 520
Пример 123: (R)-1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-карбоновая кислота
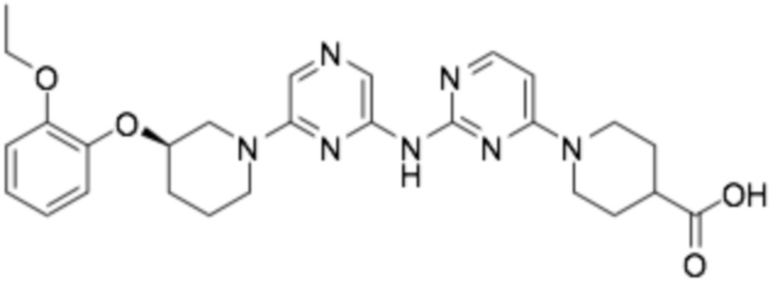
Стадия 1: Этил ( R )-1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-карбоксилат
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,242 г, 0,726 ммоль), полученный в примере получения 1, и этил 1-(2-аминопиримидин-4-ил)пиперидин-4-карбоксилат (0,200 г, 0,799 ммоль), полученный в примере получения 28. (выход 73%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 8,83 (с, 1H), 8,03 (д, J=6,1 Гц, 1H), 7,81-7,70 (1H), 7,16 (с, 1H), 7,13-7,02 (м, 1H), 7,02-6,96 (м, 1H), 6,96-6,85 (м, 2H), 6,13 (д, J=6,1 Гц, 1H), 4,38-4,25 (м, 3H), 4,24-4,10 (м, 4H), 3,97-3,82 (м, 1H), 3,41 (дд, J=13,0, 8,1 Гц, 1H), 3,36-3,23 (м, 1H), 3,20-3,04 (м, 2H), 2,70-2,55 (м, 1H), 2,25-2,12 (м, 1H), 2,06-1,95 (м, 3H), 1,95-1,83 (м, 1H), 1,83-1,71 (м, 2H), 1,71-1,61 (м, 2H), 1,43 (т, J=7,0 Гц, 3H), 1,29 (тд, J=7,2, 4,0 Гц, 3H)
Стадия 2: ( R )-1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-карбоновая кислота
Заявленное в заголовке соединение получали способом, аналогичным стадии 2 примера 122, применяя этил 1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпиперидин-3-карбоксилат (0,290 г, 0,530 ммоль), полученный на стадии 1. (выход 51%)
m/z (M+H)+ рассчитанная для C28H36N7O4: 534, найденная 534
Пример 124: 5-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)бицикло[2,2,1]гептан-2-карбоновая кислота
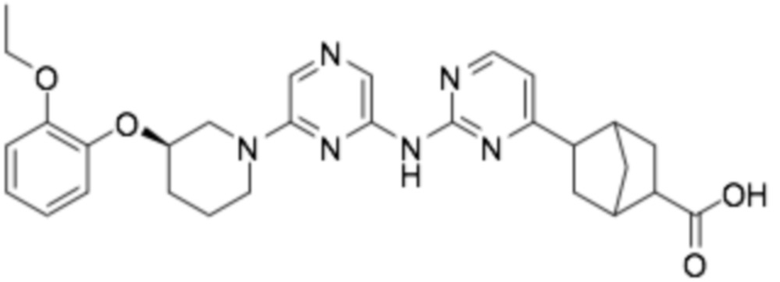
Заявленное в заголовке соединение получали тем же способом, как в примере 46, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,063 г, 0,187 ммоль), полученный в примере получения 1, и метил 5-(2-аминопиримидин-4-ил)бицикло[2,2,1]гептан-2-карбоксилат (0,051 г, 0,206 ммоль), полученный в примере получения 101. (выход 9%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 9,07-8,88 (м, 1H), 8,41-8,26 (м, 1H), 7,87-7,68 (м, 2H), 7,12-7,00 (1H), 6,97 (т, J=7,6 Гц, 1H), 6,90 (т, J=9,2 Гц, 2H), 6,79-6,64 (м, 1H), 4,38-4,25 (м, 1H), 4,25-4,10 (2H), 4,10-3,96 (м, 1H), 3,94-3,78 (м, 1H), 3,59-3,43 (м, 1H), 3,43-3,26 (м, 1H), 3,02-2,78 (м, 2H), 2,55-2,41 (м, 1H), 2,24-2,12 (м, 1H), 2,06-1,94 (м, 2H), 1,94-1,85 (м, 2H), 1,85-1,73 (м, 2H), 1,73-1,57 (м, 2H), 1,46-1,37 (м, 4H), 1,37-1,30 (1H)
Пример 125: (R)-2-(1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-ил)уксусная кислота
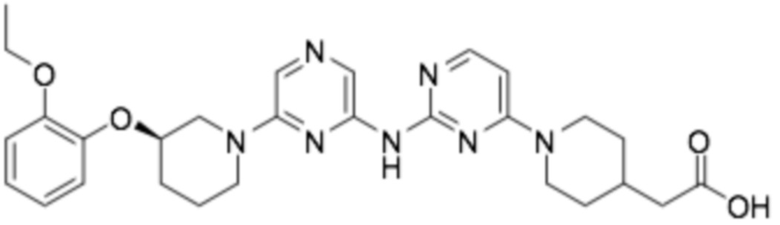
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,354 г, 1,061 ммоль), полученный в примере получения 1, и этил 2-(1-(2-аминопиримидин-4-ил)пиперидин-4-ил)ацетат (0,255 г, 0,965 ммоль), полученный в примере получения 32. (выход на 2 стадии 39%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,77 (д, J=6,4 Гц, 1H), 7,88 (д, J=6,4 Гц, 1H), 7,64 (д, J=14,2 Гц, 1H), 7,03-6,79 (м, 4H), 6,01 (д, J=6,4 Гц, 1H), 5,29 (с, 1H), 4,54-4,06 (м, 4H), 4,05-3,94 (м, 2H), 3,81 (д, J=12,8 Гц, 1H), 3,47-3,15 (м, 2H), 3,02-2,77 (2H), 2,22 (д, J=6,4 Гц, 2H), 2,16-1,97 (2H), 1,84 (дд, J=30,9, 21,3 Гц, 4H), 1,64-1,46 (м, 1H), 1,39-1,30 (м, 3H), 1,30-1,12 (2H)
Пример 126: (R)-2-(1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-ил)-2-метилпропановая кислота
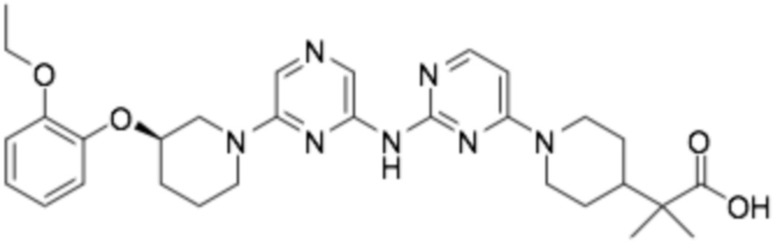
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,264 г, 0,79 ммоль), полученный в примере получения 1, и метил 2-(1-(2-аминопиримидин-4-ил)пиперидин-4-ил)-2-метилпропаноат (0,2 г, 0,719 ммоль), полученный в примере получения 33. (выход на 2 стадии 20%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,68 (с, 1H), 7,87-7,79 (м, 1H), 7,70 (д, J=10,5 Гц, 1H), 7,00-6,91 (м, 2H), 6,90-6,83 (м, 3H), 6,10 (д, J=6,9 Гц, 1H), 4,51 (с, 1H), 4,33-4,18 (м, 1H), 4,15-3,93 (м, 4H), 3,92-3,78 (м, 1H), 3,53-3,29 (м, 2H), 2,92 (т, J=12,1 Гц, 2H), 2,09 (д, J=15,1 Гц, 1H), 2,00-1,71 (м, 5H), 1,57 (тд, J=8,9, 4,9 Гц, 1H), 1,39-1,34 (м, 5H), 1,20-1,14 (6H)
Пример 127: (R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперазин-1-ил)уксусная кислота
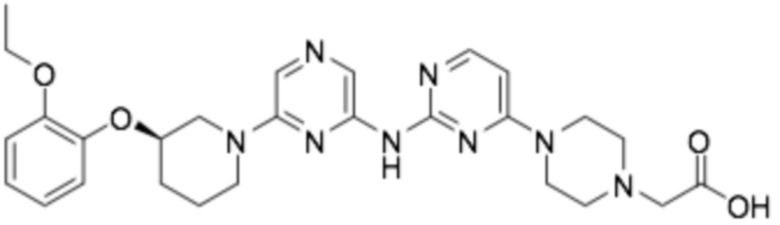
Стадия 1: Этил ( R )-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперазин-1-ил)ацетат
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,021 г, 0,063 ммоль), полученный в примере получения 1, и этил 2-(4-(2-аминопиримидин-4-ил)пиперазин-1-ил)ацетат (0,0175 г, 0,066 ммоль), полученный в примере получения 35. (выход 93%)
1H- NMR (400 МГц, ХЛОРОФОРМ-D) δ 8,78 (с, 1H), 8,01 (д, J=5,9 Гц, 1H), 7,71 (с, 1H), 7,15 (т, J=7,1 Гц, 1H), 7,09-6,83 (м, 4H), 6,06 (д, J=6,4 Гц, 1H), 4,53-4,11 (м, 4H), 4,11-3,94 (м, 2H), 3,94-3,80 (м, 1H), 3,71 (д, J=11,0 Гц, 4H), 3,51-3,33 (м, 1H), 3,27 (с, 2H), 2,66 (т, J =4,6 Гц, 4H), 2,14 (д, J=8,2 Гц, 1H), 2,06-1,84 (м, 2H), 1,82 (с, 1H), 1,69-1,50 (м, 1H), 1,50-1,33 (м, 3H), 1,27 (кв, J=6,9 Гц, 3H)
Стадия 2: ( R )-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперазин-1-ил)уксусная кислота
Этил (R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперазин-1-ил)ацетат (0,033 г, 0,059 ммоль), полученный на стадии 1, растворяли в этаноле (0,3 мл) и THF (0,3 мл), и затем добавляли 6 N водный раствор гидроксида натрия (0,049 мл, 0,293 ммоль) и перемешивали при комнатной температуре в течение 2 часов. После удаления растворителя при пониженном давлении, ее растворяли в этилацетате и промывали водой. Заявленное в заголовке соединение получали очисткой препаративной ТСХ. (выход 3%)
m/z (M+H)+ рассчитанная для C27H35N8O4: 535, найденная 535
Пример 128: 2-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)уксусная кислота
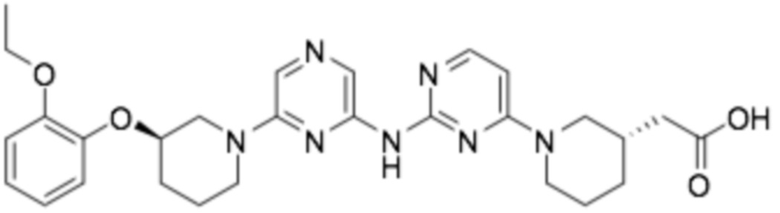
Стадия 1: Бензил 2-((S)-1-(2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)ацетат
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,056 г, 0,166 ммоль), полученный в примере получения 1, и бензил (S)-2-(1-(2-аминопиримидин-4-ил)пиперидин-3-ил)ацетат (0,057 г, 0,175 ммоль), полученный в примере получения 41. (выход 74%)
1H- NMR (500 МГц, ХЛОРОФОРМ-D) δ 8,85 (с, 1H), 7,98 (д, J=6,1 Гц, 1H), 7,79-7,70 (1H), 7,51-7,31 (м, 6H), 7,14-6,82 (4H), 6,12-5,96 (1H), 5,24-5,06 (2H), 4,45-4,24 (м, 2H), 4,24-4,18 (м, 1H), 4,14 (кв, J=7,1 Гц, 1H), 4,10-3,94 (м, 2H), 3,89 (тд, J=8,7, 4,2 Гц, 1H), 3,46-3,34 (1H), 3,34-3,20 (м, 1H), 3,14-3,01 (1H), 2,87 (дд, J=13,1, 10,1 Гц, 1H), 2,52-2,31 (2H), 2,23-2,08 (м, 2H), 2,02-1,82 (м, 3H), 1,76 (дт, J=13,4, 3,9 Гц, 1H), 1,71-1,52 (м, 2H), 1,42 (т, J=6,9 Гц, 3H), 1,39-1,30 (м, 1H)
Стадия 2: 2-(( S )-1-(2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)уксусная кислота
Бензил 2-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)ацетат (0,077 г, 0,123 ммоль), полученный на стадии 1, растворяли в метаноле (0,6 мл), и затем добавляли Pd/C (0,008 г, 0,075 ммоль) и перемешивали при комнатной температуре в течение 2 часов, применяя баллон с водородом. После фильтрования через слой целита и удаления растворителя при пониженном давлении, требуемое заявленное в заголовке соединение получали очисткой препаративной ТСХ. (выход 22%)
m/z (M+H)+ рассчитанная для C28H36N7O4: 534, найденная 534
Пример 129: (E)-3-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)акриловая кислота
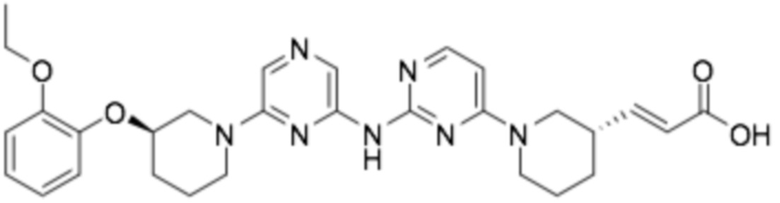
Заявленное в заголовке соединение получали тем же способом, как в примере 46, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,167 г, 0,500 ммоль), полученный в примере получения 1, и этил (S,E)-3-(1-(2-аминопиримидин-4-ил)пиперидин-3-ил)акрилат (0,145 г, 0,525 ммоль), полученный в примере получения 42. (выход 37%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,77 (с, 1H), 7,95 (д, J=5,9 Гц, 1H), 7,70 (с, 1H), 7,06-6,77 (м, 5H), 6,09 (д, J=6,4 Гц, 1H), 6,05-5,92 (1H), 4,65-4,39 (1H), 4,31-4,21 (м, 1H), 4,22-4,08 (м, 2H), 4,05-3,91 (м, 3H), 3,84 (д, J=12,8 Гц, 1H), 3,50-3,26 (м, 2H), 3,01 (т, J=11,7 Гц, 1H), 2,94-2,80 (м, 1H), 2,43 (с, 1H), 2,21-2,05 (м, 1H), 1,96 (с, 2H), 1,90-1,73 (м, 2H), 1,64-1,41 (м, 3H), 1,37 (т, J=7,1 Гц, 3H)
Пример 130: 3-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)пропановая кислота
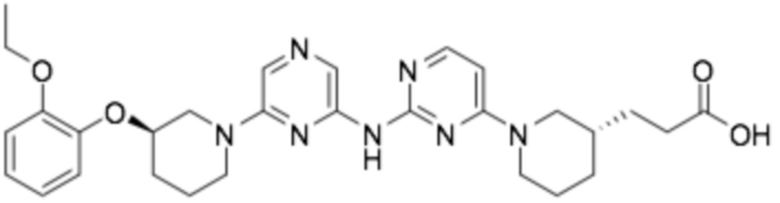
Стадия 1: Этил 3-(( S )-1-(2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)пропаноат
Этил (E)-3-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)акрилат (0,120 г, 0,209 ммоль), сложноэфирное промежуточное соединение, полученное в примере 129, растворяли в этаноле (1 мл) и затем добавляли Pd/C (0,012 г, 0,113 ммоль), и реакцию восстановления проводили, применяя баллон с водородом. После фильтрации через слой целита, растворитель удаляли при пониженном давлении, и очищали колонкой с силикагелем, получая требуемый продукт. (выход 80%)
1H- NMR (400 МГц, ХЛОРОФОРМ-D) δ 8,81 (кв, J=7,0 Гц, 1H), 7,98 (т, J=6,2 Гц, 1H), 7,71 (д, J=7,3 Гц, 1H), 7,58 (с, 1H), 7,24-7,03 (м, 1H), 7,03-6,89 (м, 2H), 6,89-6,78 (м, 2H), 6,12-5,98 (м, 1H), 4,32-4,20 (м, 2H), 4,17 (д, J=13,7 Гц, 2H), 4,13-4,04 (м, 2H), 4,04-3,92 (м, 2H), 3,92-3,76 (м, 1H), 3,35 (дд, J=13,0, 8,0 Гц, 1H), 3,30-3,17 (м, 1H), 3,03-2,84 (м, 1H), 2,74-2,58 (м, 1H), 2,45-2,27 (м, 2H), 2,13 (дд, J=12,3, 4,6 Гц, 1H), 1,98-1,78 (м, 3H), 1,78-1,68 (м, 1H), 1,68-1,41 (м, 5H), 1,41-1,31 (м, 3H), 1,31-1,09 (м, 4H)
Стадия 2: 3-(( S )-1-(2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)пропановая кислота
Заявленное в заголовке соединение получали способом гидролиза, аналогичным примеру 46, применяя этил 3-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)пропаноат (0,096 г, 0,167 ммоль), полученный на стадии 1. (выход 49%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,79 (с, 1H), 7,88 (т, J=3,1 Гц, 1H), 7,66 (д, J=8,5 Гц, 1H), 7,06-6,97 (1H), 6,95 (т, J=7,8 Гц, 1H), 6,91-6,80 (2H), 6,15-6,02 (1H), 4,62 (с, 1H), 4,34-4,20 (м, 1H), 4,13 (д, J=12,8 Гц, 1H), 4,07-3,92 (3H), 3,92-3,76 (м, 1H), 3,48 (с, 1H), 3,44 (дд, J=13,1, 7,9 Гц, 1H), 3,34 (дд, J=12,8, 9,8 Гц, 1H), 2,92 (т, J=11,6 Гц, 1H), 2,56 (т, J=11,9 Гц, 1H), 2,49 (т, J=6,6 Гц, 2H), 2,11 (с, 1H), 2,01-1,80 (3H), 1,76 (д, J=13,1 Гц, 1H), 1,72-1,43 (м, 5H), 1,38 (т, J=7,0 Гц, 3H), 1,32-1,17 (м, 1H)
Пример 131: 2-(((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)окси)уксусная кислота
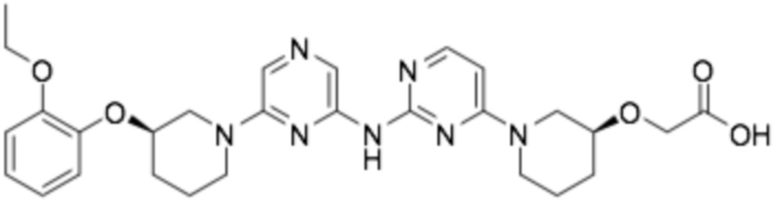
Заявленное в заголовке соединение получали тем же способом, как в примере 19, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,275 г, 0,825 ммоль), полученный в примере получения 1, и трет-бутил (S)-2-((1-(2-аминопиримидин-4-ил)пиперидин-3-ил)окси)ацетат (0,267 г, 0,866 ммоль), полученный в примере получения 44. (выход 31%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 8,97-8,80 (м, 1H), 7,94 (т, J=6,3 Гц, 1H), 7,85-7,56 (м, 2H), 7,10-6,75 (м, 4H), 6,15-6,01 (м, 1H), 5,24-4,77 (м, 1H), 4,45-4,27 (м, 1H), 4,27-4,16 (м, 1H), 4,16-3,86 (м, 4H), 3,80-3,51 (м, 2H), 3,51-3,43 (м, 2H), 3,43-3,31 (1H), 3,30-3,10 (м, 1H), 3,10-2,89 (м, 1H), 2,22-1,96 (м, 3H), 1,95-1,76 (2H), 1,65-1,41 (м, 3H), 1,40-1,29 (м, 3H)
Пример 132: 2-(((R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)окси)уксусная кислота
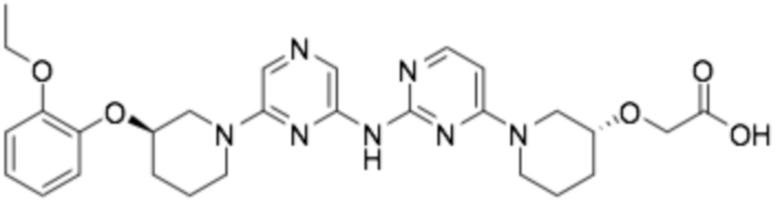
Заявленное в заголовке соединение получали тем же способом, как в примере 19, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,235 г, 0,704 ммоль), полученный в примере получения 1, и трет-бутил (R)-2-((1-(2-аминопиримидин-4-ил)пиперидин-3-ил)окси)ацетат (0,228 г, 0,739 ммоль), полученный в примере получения 46. (выход 75%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,71-8,49 (1H), 7,74 (д, J=14,6 Гц, 2H), 7,03-6,80 (м, 5H), 6,19 (с, 1H), 4,41-4,18 (м, 2H), 4,12 (с, 1H), 4,04-3,89 (м, 3H), 3,74 (д, J=5,5 Гц, 2H), 3,64-3,38 (м, 4H), 3,33 (с, 2H), 2,06 (д, J=5,0 Гц, 2H), 2,02-1,81 (м, 3H), 1,73 (с, 1H), 1,64-1,41 (м, 2H), 1,35 (т, J=6,9 Гц, 3H)
Пример 133: 2-(((R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)окси)-2-метилпропановая кислота
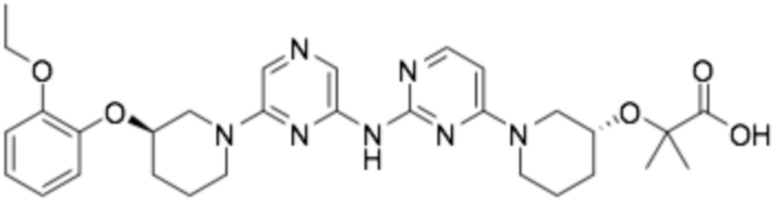
Заявленное в заголовке соединение получали тем же способом, как в примере 19, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,077 г, 0,232 ммоль), полученный в примере получения 1, и трет-бутил (R)-2-((1-(2-аминопиримидин-4-ил)пиперидин-3-ил)окси)-2-метилпропаноат (0,082 г, 0,244 ммоль), полученный в примере получения 47. (выход 19%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,79 (с, 1H), 7,79 (с, 1H), 7,66 (с, 1H), 7,03-6,88 (м, 2H), 6,85 (дд, J=7,1, 2,5 Гц, 2H), 6,22 (д, J=46,7 Гц, 1H), 5,28 (с, 1H), 4,24 (кв, J=3,8 Гц, 1H), 4,10 (кв, J=7,2 Гц, 1H), 4,04-3,92 (м, 2H), 3,83 (д, J=12,3 Гц, 1H), 3,57 (с, 1H), 3,45 (дд, J=12,6, 8,0 Гц, 1H), 3,32 (т, J=9,8 Гц, 1H), 2,94 (с, 2H), 2,10 (с, 1H), 2,02-1,99 (0H), 1,94 (дд, J=9,6, 3,7 Гц, 1H), 1,89-1,72 (м, 2H), 1,64-1,47 (м, 3H), 1,43 (д, J=12,8 Гц, 6H), 1,39-1,30 (м, 4H)
Пример 134: (R)-4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота
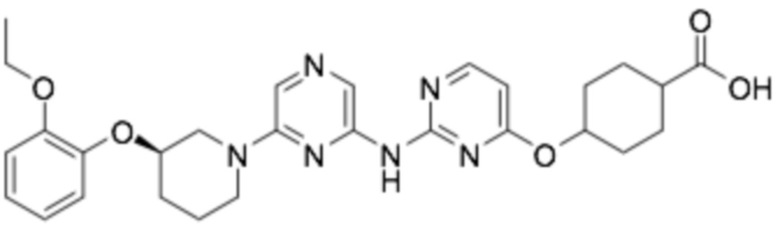
Заявленное в заголовке соединение получали тем же способом, как в примере 46, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,172 г, 0,514 ммоль), полученный в примере получения 1, и этил 4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат (0,150 г, 0,565 ммоль), полученный в примере получения 117. (выход 38%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,79 (д, J=5,5 Гц, 1H), 8,15 (т, J=5,7 Гц, 1H), 7,74 (д, J=12,3 Гц, 1H), 7,57-7,38 (м, 1H), 7,04-6,81 (м, 4H), 6,23 (дд, J=9,8, 5,7 Гц, 1H), 5,21 (д, J=70,0 Гц, 1H), 4,35-4,20 (м, 1H), 4,19-4,06 (м, 1H), 4,06-3,90 (м, 2H), 3,90-3,72 (м, 1H), 3,60-3,24 (м, 2H), 2,59-2,24 (м, 2H), 2,15 (д, J=11,0 Гц, 2H), 2,10-1,93 (м, 3H), 1,92-1,83 (м, 1H), 1,78 (т, J=12,6 Гц, 2H), 1,68-1,46 (3H), 1,38 (тд, J=7,1, 5,0 Гц, 3H)
Пример 135: (1R,4r)-4-((2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота
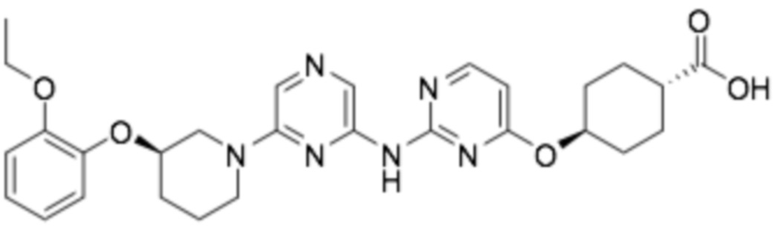
Стадия 1: Метил (1 R ,4 r )-4-((2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоксилат
Требуемый продукт получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,080 г, 0,239 ммоль), полученный в примере получения 1, и метил (1r,4r)-4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат (0,066 г, 0,263 ммоль), полученный в примере получения 50, (выход 49%)
1H- NMR (400 МГц, ХЛОРОФОРМ-D) δ 8,80 (с, 1H), 8,16 (д, J=5,9 Гц, 1H), 7,77 (с, 1H), 7,07-6,83 (м, 4H), 6,20 (д, J=5,9 Гц, 1H), 5,05 (с, 1H), 4,26 (т, J=4,1 Гц, 1H), 4,14 (д, J=15,6 Гц, 1H), 4,08-3,91 (м, 2H), 3,84 (д, J=13,7 Гц, 1H), 3,67 (д, J=10,1 Гц, 3H), 3,43 (дд, J=13,3, 8,2 Гц, 1H), 3,32 (с, 1H), 2,36 (с, 1H), 2,24 (д, J=16,9 Гц, 2H), 2,19-2,04 (м, 3H), 2,03 (с, 1H), 1,92-1,79 (1H), 1,64 (дд, J=32,7, 13,0 Гц, 4H), 1,39 (т, J=6,9 Гц, 3H), 1,25 (д, J=6,4 Гц, 1H)
Стадия 2: 2-((S)-1-(2-((6-(( R )-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)уксусная кислота
Заявленное в заголовке соединение получали способом гидролиза, аналогичным примеру 46, применяя метил (1R,4r)-4-((2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоксилат (0,064 г, 0,117 ммоль), полученный на стадии 1. (выход 19%)
m/z (M+H)+ рассчитанная для C28H35N6O5: 535, найденная 535
Пример 136: (1R,4r)-4-((2-((6-((R)-3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота
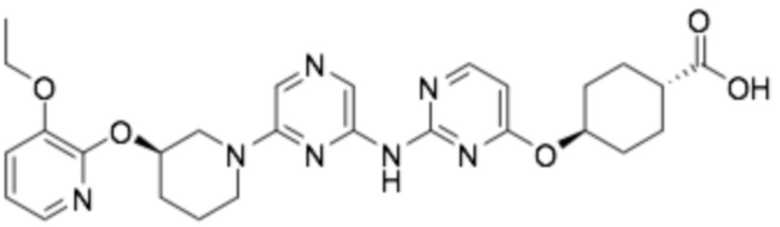
Заявленное в заголовке соединение получали тем же способом, как в примере 46, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,080 г, 0,239 ммоль), полученный в примере получения 3, и метил (1r,4r)-4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат (0,066 г, 0,263 ммоль), полученный в примере получения 50. (выход 16%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,77 (с, 1H), 8,17-8,09 (1H), 7,73 (т, J=2,5 Гц, 2H), 7,35 (с, 1H), 6,97 (д, J=7,8 Гц, 1H), 6,80 (дд, J=7,8, 5,0 Гц, 1H), 6,21 (д, J=5,5 Гц, 1H), 5,25-5,06 (2H), 4,09-3,97 (м, 1H), 3,97-3,84 (м, 2H), 3,80 (д, J=13,3 Гц, 1H), 3,73 (кв, J=6,7 Гц, 1H), 3,47 (т, J=9,4 Гц, 1H), 2,41-2,24 (м, 4H), 2,15 (д, J=8,2 Гц, 2H), 2,04-1,89 (2H), 1,84-1,72 (3H), 1,51 (кв, J=12,3 Гц, 2H), 1,30 (т, J=6,9 Гц, 3H)
Пример 137: (1S,4s)-4-((2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота
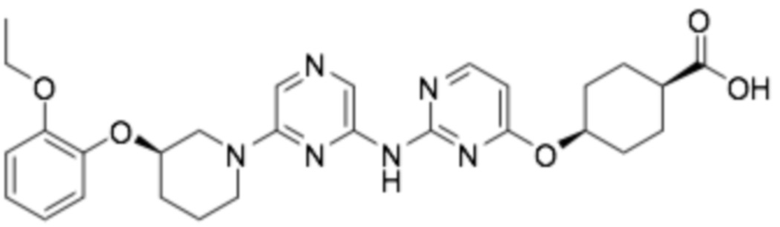
Заявленное в заголовке соединение получали тем же способом, как в примере 46, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,184 г, 0,551 ммоль), полученный в примере получения 1, и метил (1s,4s)-4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат (0,180 г, 0,716 ммоль), полученный в примере получения 51. (выход 62%)
1H-ЯМР (400 МГц, DMSO-D6) δ 9,20 (с, 1H), 8,59 (с, 1H), 8,21 (д, J=5,5 Гц, 1H), 7,78 (с, 1H), 7,01 (дд, J=7,5, 1,6 Гц, 1H), 6,95-6,77 (м, 3H), 6,32 (д, J=5,5 Гц, 1H), 5,17 (с, 1H), 4,28 (кв, J=3,7 Гц, 1H), 4,13-3,99 (м, 1H), 3,98-3,82 (м, 2H), 3,71 (д, J=14,6 Гц, 1H), 3,45 (кв, J=6,6 Гц, 3H), 2,35 (с, 1H), 1,98 (с, 1H), 1,89-1,60 (м, 9H), 1,58-1,40 (м, 1H), 1,20 (т, J=6,9 Гц, 3H)
Пример 138: (1S,4s)-4-((2-((6-((R)-3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота
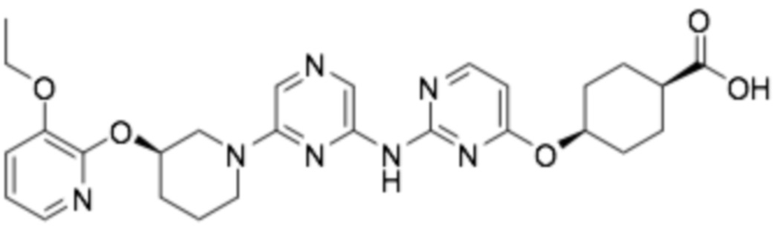
Заявленное в заголовке соединение получали тем же способом, как в примере 46, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,137 г, 0,410 ммоль), полученный в примере получения 3, и метил (1s,4s)-4-((2-аминопиримидин-4-ил)окси)циклогексан-1-карбоксилат (0,134 г, 0,533 ммоль), полученный в примере получения 51. (выход 62%)
1H-ЯМР (400 МГц, DMSO-D6) δ 9,13 (с, 1H), 8,60 (с, 1H), 8,20 (д, J=5,5 Гц, 1H), 7,86-7,75 (1H), 7,65 (дд, J=4,8, 1,6 Гц, 1H), 7,18 (дд, J=7,8, 1,4 Гц, 1H), 6,85 (дд, J=7,8, 5,0 Гц, 1H), 6,32 (д, J=5,9 Гц, 1H), 5,17 (с, 1H), 5,13-5,00 (м, 1H), 4,07 (дд, J=13,5, 3,0 Гц, 1H), 3,95-3,83 (м, 2H), 3,78 (д, J=11,4 Гц, 1H), 3,50 (дд, J=13,3, 7,8 Гц, 1H), 3,46-3,38 (м, 2H), 2,36 (с, 1H), 2,06 (д, J=11,0 Гц, 1H), 1,88-1,59 (м, 9H), 1,53 (кв, J=4,1 Гц, 1H), 1,27-1,15 (м, 3H)
Пример 139: (R)-6-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиколиновая кислота
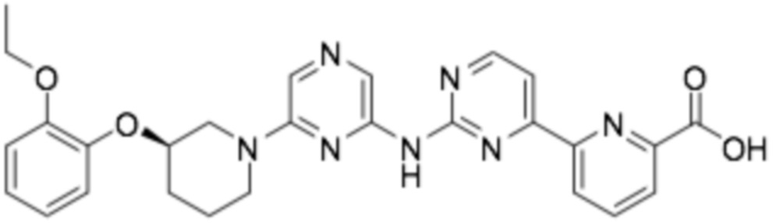
(R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (23,2 мг, 0,07 ммоль), полученный в примере получения 1, и этил 6-(2-аминопиримидин-4-ил)пиколинат (17 мг, 0,07 ммоль), полученный в примере получения 72, трис(дибензилиденацетон)дипалладий(0) (3,8 мг, 4,18 мкмоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантин (3,62 мг, 6,26 мкмоль) и карбонат цезия (56,7 мг, 0,17 ммоль) растворяли в 1,4-диоксане и перемешивали при кипячении с обратным холодильником в течение 4 часов. После завершения реакции, реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, промывали водным раствором гидрокарбоната натрия и соляным раствором, и сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Заявленное в заголовке соединение получали очисткой колонкой с силикагелем (гексан : этилацетат). (выход 21%)
Полученное сложноэфирное соединение (7,8 мг, 0,014 ммоль) растворяли в THF : метанол : вода = 1:1:1, и добавляли гидроксид лития (1,0 мг, 0,04 ммоль), с последующим перемешиванием при комнатной температуре в течение 12 часов. После завершения реакции, ее разбавляли водой, нейтрализовали 1 N раствором хлористоводородной кислоты, экстрагировали этилацетатом и сушили над сульфатом магния, и органический растворитель удаляли при пониженном давлении. Заявленное в заголовке соединение получали очисткой колонкой с силикагелем (этилацетат:метанол). (выход 27%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,89-8,80 (1H), 8,66-8,61 (1H), 8,52-8,45 (1H), 8,24-8,20 (1H), 8,14-8,08 (1H), 8,04-7,96 (1H), 7,71-7,63 (1H), 7,06-6,96 (1H), 6,95-6,79 (4H), 4,47-4,33 (1H), 4,07-3,81 (5H), 3,80-3,51 (3H), 2,20-1,89 (3H), 1,70-1,50 (1H), 1,37-1,28 (1H), 1,28-1,23 (3H)
Пример 140: (R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота
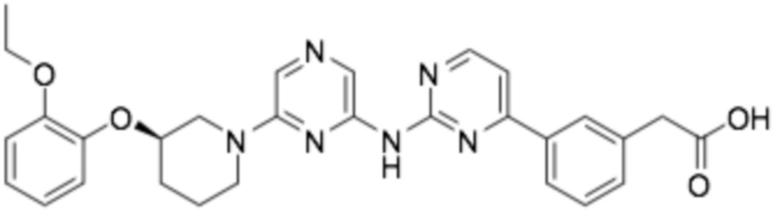
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,574 г, 1,718 ммоль), полученный в примере получения 1, и метил 2-(3-(2-аминопиримидин-4-ил)фенил)ацетат (0,38 г, 1,562 ммоль), полученный в примере получения 70, (выход на 2 стадии 8%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,87 (т, J=15,1 Гц, 1H), 8,55-8,46 (м, 1H), 8,16-8,02 (м, 1H), 8,02-7,92 (м, 1H), 7,73-7,55 (м, 1H), 7,55-7,43 (м, 1H), 7,43-7,31 (м, 2H), 7,07-6,93 (м, 1H), 6,93-6,76 (м, 3H), 5,43 (д, J=14,6 Гц, 1H), 4,36 (тд, J=6,4, 3,2 Гц, 1H), 3,90-3,83 (м, 2H), 3,73 (кв, J=6,7 Гц, 1H), 3,69-3,59 (м, 2H), 3,56 (д, J=8,7 Гц, 2H), 2,13-1,91 (м, 2H), 1,92-1,79 (м, 1H), 1,68-1,44 (м, 1H), 1,24 (т, J=6,9 Гц, 3H)
Пример 141: (R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота
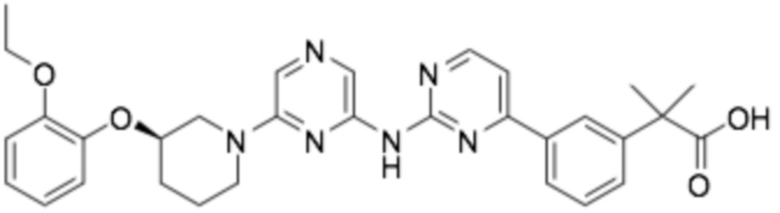
Заявленное в заголовке соединение получали тем же способом, как в примере 46, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,097 г, 0,292 ммоль), полученный в примере получения 1, и метил 2-(3-(2-аминопиримидин-4-ил)фенил)-2-метилпропаноат (0,087 г, 0,321 ммоль), полученный в примере получения 53. (выход 53%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 9,10 (с, 1H), 8,53 (д, J=5,2 Гц, 1H), 8,40 (с, 1H), 7,79 (д, J=7,9 Гц, 1H), 7,74 (с, 1H), 7,59 (д, J=7,9 Гц, 1H), 7,55-7,43 (м, 2H), 7,09-6,86 (м, 4H), 4,33 (тд, J=7,9, 3,7 Гц, 1H), 4,19-4,10 (м, 1H), 4,10-3,96 (м, 2H), 3,84 (дт, J=12,9, 4,8 Гц, 1H), 3,55 (дд, J=13,1, 7,9 Гц, 1H), 3,51-3,37 (м, 1H), 2,18 (д, J=18,9 Гц, 1H), 2,06-1,98 (м, 1H), 1,98-1,91 (м, 1H), 1,73-1,60 (м, 7H), 1,41 (т, J=7,0 Гц, 3H)
Пример 142: (R)-2-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота
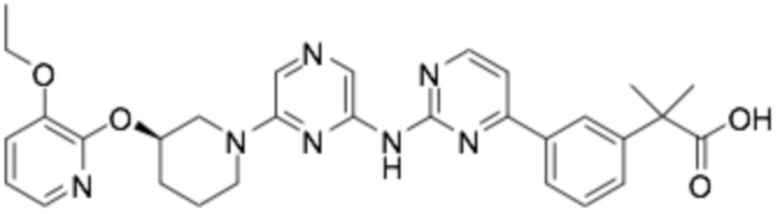
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,081 г, 0,243 ммоль), полученный в примере получения 3, и метил 2-(3-(2-аминопиримидин-4-ил)фенил)-2-метилпропаноат (0,06 г, 0,221 ммоль), полученный в примере получения 53. (выход на 2 стадии 52%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,97 (с, 1H), 8,51-8,42 (м, 1H), 8,28 (с, 1H), 8,01-7,81 (м, 1H), 7,81-7,75 (м, 2H), 7,75-7,67 (м, 1H), 7,60-7,49 (м, 1H), 7,48-7,37 (м, 1H), 7,20 (дд, J=5,5, 1,8 Гц, 1H), 7,00-6,92 (м, 1H), 6,82-6,74 (м, 1H), 5,24-5,11 (м, 1H), 4,02 (дд, J=13,3, 2,7 Гц, 1H), 3,98-3,83 (м, 2H), 3,83-3,67 (м, 2H), 3,49 (т, J=9,4 Гц, 1H), 2,27-2,09 (м, 1H), 2,02-1,83 (м, 2H), 1,66 (д, J=5,0 Гц, 1H), 1,63 (с, 6H), 1,35-1,25 (м, 3H)
Пример 143: (R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота
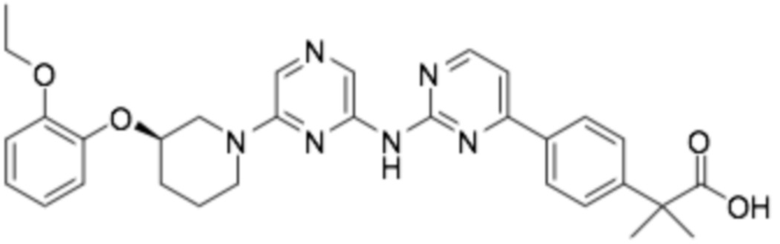
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,271 г, 0,811 ммоль), полученный в примере получения 1, и метил 2-(4-(2-аминопиримидин-4-ил)фенил)-2-метилпропаноат (0,2 г, 0,737 ммоль), полученный в примере получения 55. (выход на 2 стадии 27%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,12 (с, 1H), 8,48 (т, J=4,3 Гц, 1H), 8,12 (д, J=8,2 Гц, 2H), 7,89 (д, J=13,7 Гц, 1H), 7,71 (с, 1H), 7,66 (д, J=8,2 Гц, 2H), 6,95 (ддд, J=13,4, 7,7, 1,7 Гц, 2H), 6,90-6,79 (м, 2H), 4,42-4,23 (м, 1H), 4,11-3,88 (м, 3H), 3,84-3,69 (м, 1H), 3,69-3,54 (м, 1H), 3,44 (т, J=9,8 Гц, 1H), 2,18-2,05 (1H), 2,05-1,79 (м, 2H), 1,71 (д, J=14,6 Гц, 6H), 1,65-1,47 (м, 1H), 1,41-1,30 (м, 3H)
Пример 144: (R)-2-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота
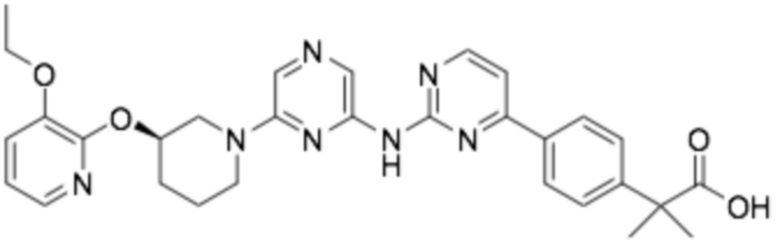
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,271 г, 0,811 ммоль), полученный в примере получения 3, и метил 2-(4-(2-аминопиримидин-4-ил)фенил)-2-метилпропаноат (0,2 г, 0,737 ммоль), полученный в примере получения 55. (выход на 2 стадии 42%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,08 (с, 1H), 8,47 (д, J=5,0 Гц, 1H), 8,11 (д, J=8,7 Гц, 2H), 7,79 (с, 1H), 7,74 (д, J=5,0 Гц, 2H), 7,65 (д, J=8,7 Гц, 2H), 7,24 (с, 1H), 6,93 (д, J=7,8 Гц, 1H), 6,86-6,72 (м, 1H), 5,19 (с, 1H), 3,97 (д, J=13,3 Гц, 1H), 3,93-3,71 (м, 4H), 3,62-3,42 (м, 1H), 2,23-2,08 (м, 1H), 2,08-1,88 (м, 2H), 1,71 (д, J=17,4 Гц, 6H), 1,64 (д, J=6,9 Гц, 1H), 1,31-1,22 (м, 3H)
Пример 145: (R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)пропановая кислота
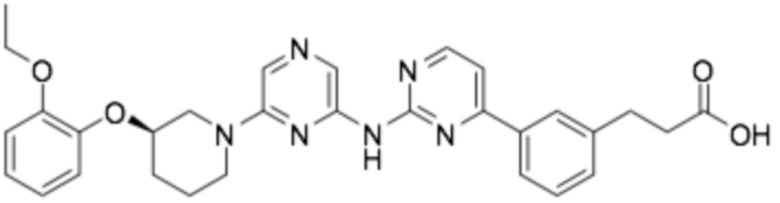
Заявленное в заголовке соединение получали тем же способом, как в примере 46, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,090 г, 0,269 ммоль), полученный в примере получения 1, и метил 3-(3-(2-аминопиримидин-4-ил)фенил)пропаноат (0,076 г, 0,295 ммоль), полученный в примере получения 57. (выход 37%)
1H-ЯМР (500 МГц, ХЛОРОФОРМ-D) δ 9,38 (с, 1H), 8,53 (д, J=5,2 Гц, 1H), 8,37 (с, 1H), 7,73 (д, J=5,8 Гц, 2H), 7,50 (д, J=7,3 Гц, 1H), 7,42 (т, J=7,6 Гц, 1H), 7,35 (д, J=7,6 Гц, 1H), 7,01 (кв, J=8,1 Гц, 2H), 6,92 (дд, J=13,9, 7,5 Гц, 2H), 4,34 (кв, J=3,9 Гц, 1H), 4,14 (дд, J=13,3, 3,5 Гц, 1H), 4,08-3,97 (м, 2H), 3,85 (д, J=17,4 Гц, 1H), 3,55 (дд, J=13,3, 7,8 Гц, 1H), 3,43 (д, J=9,5 Гц, 1H), 3,16 (т, J=6,1 Гц, 2H), 2,71 (т, J=6,3 Гц, 2H), 2,19 (с, 1H), 2,04 (м, 1H), 1,94 (м, J=1H), 1,67-1,62 (1H), 1,49-1,35 (3H)
Пример 146: (R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
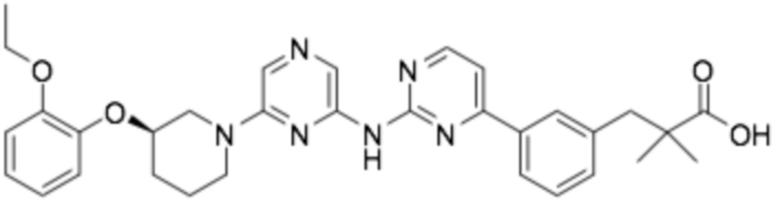
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (329 мг, 0,985 ммоль), полученный в примере получения 1, и метил 3-(3-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (281 мг, 0,985 ммоль), полученный в примере получения 59. (выход на 2 стадии 27%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,43 (д, J=1,4 Гц, 1H), 8,51 (д, J=5,0 Гц, 1H), 8,32 (с, 1H), 7,71 (д, J=8,7 Гц, 2H), 7,36 (т, J=7,5 Гц, 1H), 7,23 (кв, J=2,9 Гц, 2H), 7,08-6,79 (м, 4H), 4,40-4,21 (м, 1H), 4,20-4,07 (м, 1H), 4,07-3,90 (м, 2H), 3,90-3,72 (1H), 3,52 (дд, J=12,8, 7,8 Гц, 1H), 3,37 (т, J=10,7 Гц, 1H), 3,02 (с, 2H), 2,15 (кв, J=5,5 Гц, 1H), 2,04-1,79 (м, 2H), 1,73-1,50 (м, 1H), 1,39 (т, J=7,1 Гц, 3H), 1,24 (с, 6H)
Пример 147: (R)-3-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
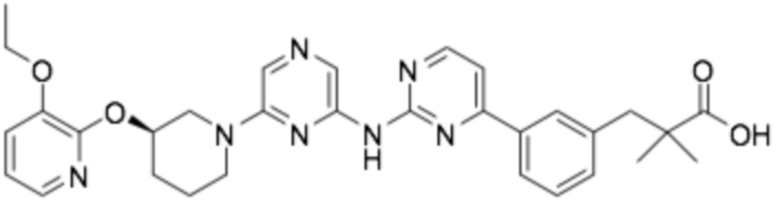
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (123 мг, 0,366 ммоль), полученный в примере получения 3, и трет-бутил 3-(3-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (120 мг, 0,366 ммоль), полученный в примере получения 80. (выход на 2 стадии 85%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,39 (с, 1H), 8,49 (д, J=5,0 Гц, 1H), 8,33 (с, 1H), 7,82-7,64 (м, 3H), 7,37 (т, J=7,8 Гц, 2H), 7,25 (с, 2H), 6,95 (дд, J=7,8, 1,4 Гц, 1H), 6,82 (дд, J=7,8, 5,0 Гц, 1H), 5,21 (тд, J=6,7, 3,4 Гц, 1H), 4,06-3,69 (5H), 3,64-3,50 (м, 1H), 3,02 (дд, J=16,9, 13,3 Гц, 2H), 2,26-2,12 (м, 1H), 2,09-1,92 (м, 2H), 1,77-1,59 (м, 1H), 1,39-1,27 (м, 3H), 1,24 (д, J=5,9 Гц, 6H)
Пример 148: (R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
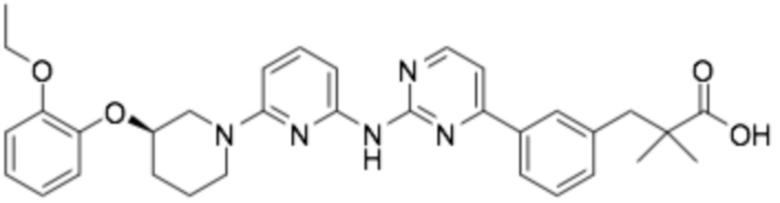
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин (122 мг, 0,366 ммоль), полученный в примере получения 4, и трет-бутил 3-(3-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (120 мг, 0,366 ммоль), полученный в примере получения 80. (выход на 2 стадии 12%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,49 (с, 1H), 8,23 (д, J=5,5 Гц, 1H), 7,69-7,46 (м, 2H), 7,42-7,26 (м, 3H), 7,10 (д, J=9,1 Гц, 1H), 7,06-6,93 (м, 1H), 6,89-6,78 (м, 1H), 6,78-6,62 (м, 3H), 6,15 (д, J=8,7 Гц, 1H), 4,56 (с, 1H), 3,91-3,63 (м, 3H), 3,54 (д, J=13,7 Гц, 1H), 3,45 (д, J=11,9 Гц, 1H), 3,29 (с, 1H), 3,00 (дд, J=24,5, 13,0 Гц, 2H), 2,15-1,89 (м, 3H), 1,62 (д, J=15,6 Гц, 1H), 1,26 (д, J=8,2 Гц, 6H), 1,16 (т, J=7,1 Гц, 3H)
Пример 149: (R)-3-(3-(2-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
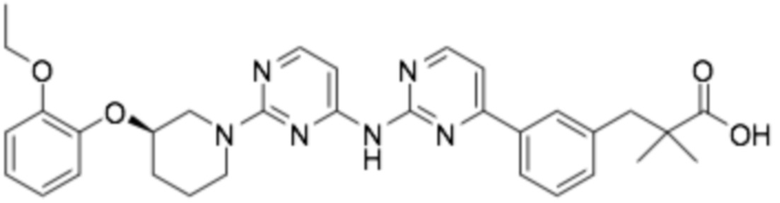
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-4-хлор-2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин (122 мг, 0,366 ммоль), полученный в примере получения 5, и трет-бутил 3-(3-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (120 мг, 0,366 ммоль), полученный в примере получения 80. (выход на 2 стадии 74%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,68 (д, J=5,5 Гц, 1H), 8,13-7,95 (м, 4H), 7,65 (д, J=5,5 Гц, 1H), 7,55-7,33 (м, 2H), 7,00 (д, J=7,8 Гц, 1H), 6,94-6,79 (3H), 4,68 (с, 1H), 4,35 (д, J=11,9 Гц, 1H), 4,02-3,84 (м, 2H), 3,78 (д, J=12,3 Гц, 1H), 3,61-3,42 (м, 1H), 3,40-3,32 (м, 1H), 3,00 (с, 2H), 2,19-1,92 (м, 3H), 1,67 (кв, J=4,6 Гц, 1H), 1,27 (т, J=6,9 Гц, 3H), 1,24-1,15 (6H)
Пример 150: (R)-3-(3-(2-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
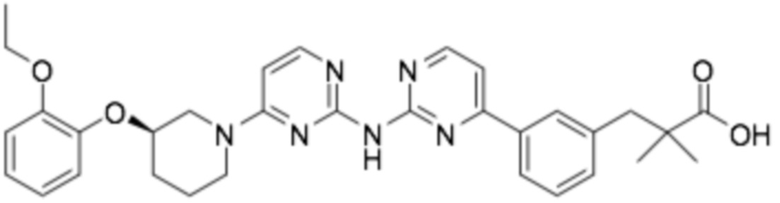
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин (122 мг, 0,366 ммоль), полученный в примере получения 6, и трет-бутил 3-(3-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (120 мг, 0,366 ммоль), полученный в примере получения 80. (выход на 2 стадии 70%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,52 (с, 1H), 8,33 (с, 1H), 7,66 (д, J=7,8 Гц, 1H), 7,35 (т, J=7,3 Гц, 2H), 7,27 (д, J=7,3 Гц, 2H), 7,05-6,71 (м, 5H), 6,31 (с, 1H), 4,40 (д, J=4,1 Гц, 1H), 4,06-3,81 (м, 3H), 3,69 (д, J=21,0 Гц, 1H), 2,95 (с, 2H), 2,04 (с, 5H), 1,68 (д, J=9,1 Гц, 1H), 1,36 (т, J=6,9 Гц, 3H), 1,25 (с, 6H)
Пример 151: (R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота
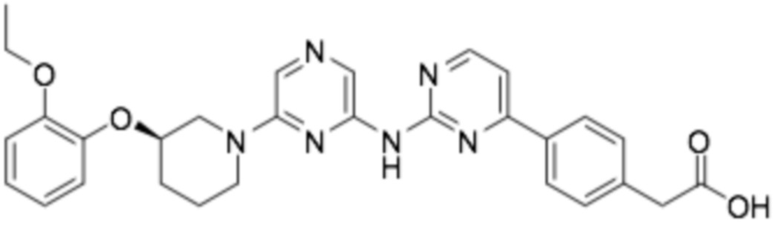
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,106 г, 0,317 ммоль), полученный в примере получения 1, и метил 2-(4-(2-аминопиримидин-4-ил)фенил)ацетат (0,07 г, 0,288 ммоль), полученный в примере получения 74. (выход на 2 стадии 4%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,86 (с, 1H), 8,54-8,46 (м, 1H), 8,07 (д, J=8,7 Гц, 2H), 7,65 (с, 1H), 7,51-7,43 (2H), 7,40 (д, J=5,5 Гц, 1H), 7,05-6,96 (1H), 6,96-6,80 (м, 3H), 4,41 (кв, J=3,2 Гц, 1H), 3,99-3,77 (м, 4H), 3,74 (дт, J=13,6, 3,9 Гц, 1H), 3,69-3,57 (м, 1H), 3,54 (с, 2H), 2,19-2,05 (м, 1H), 2,05-1,96 (м, 2H), 1,96-1,88 (м, 1H), 1,26 (т, 3H)
Пример 152: (R)-2-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота
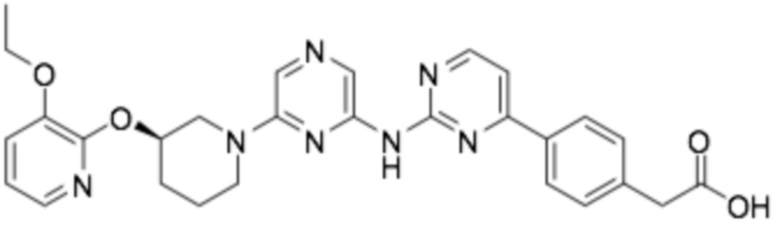
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,143 г, 0,428 ммоль), полученный в примере получения 3, и метил 2-(4-(2-аминопиримидин-4-ил)фенил)ацетат (0,1 г, 0,389 ммоль), полученный в примере получения 74. (выход на 2 стадии 1%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,07 (с, 1H), 8,53-8,41 (1H), 8,11 (д, J=8,2 Гц, 2H), 7,80-7,70 (м, 2H), 7,51 (д, J=8,2 Гц, 2H), 7,46 (с, 1H), 7,22 (д, J=5,0 Гц, 1H), 6,99-6,91 (м, 1H), 6,85-6,75 (м, 1H), 5,20 (т, J=3,4 Гц, 1H), 4,03-3,97 (м, 1H), 3,94-3,83 (м, 2H), 3,79 (кв, J=7,0 Гц, 2H), 3,74 (с, 2H), 3,56-3,42 (м, 1H), 2,17 (д, J=10,1 Гц, 1H), 2,06-1,93 (м, 2H), 1,66 (с, 1H), 1,27 (т, J=6,9 Гц, 3H)
Пример 153: (R)-3-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
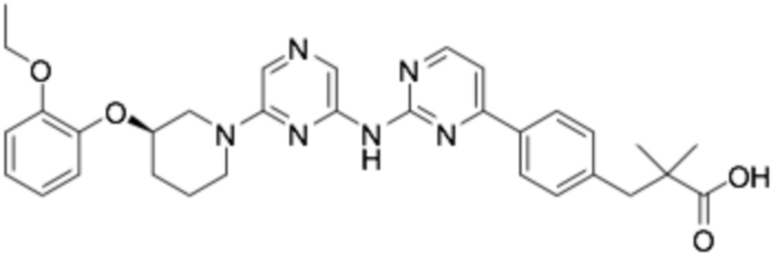
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (73,9 мг, 0,221 ммоль), полученный в примере получения 1, и трет-бутил 3-(4-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (72,5 мг, 0,221 ммоль), полученный в примере получения 81. (выход на 2 стадии 61%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 9,07 (с, 1H), 8,49 (д, J=5,2 Гц, 1H), 7,98 (д, J=7,9 Гц, 2H), 7,83 (с, 1H), 7,81-7,73 (1H), 7,34 (д, J=7,9 Гц, 2H), 7,24 (д, J=5,2 Гц, 1H), 7,04-6,79 (м, 4H), 4,33 (д, J=7,6 Гц, 1H), 4,11-4,02 (м, 1H), 4,02-3,89 (м, 2H), 3,82-3,69 (м, 1H), 3,64 (дд, J=13,4, 7,3 Гц, 1H), 3,56-3,42 (1H), 2,97 (д, J=15,0 Гц, 2H), 2,16-2,06 (м, 1H), 2,01 (д, J=14,0 Гц, 1H), 1,93 (д, J=11,9 Гц, 1H), 1,67-1,51 (м, 1H), 1,37 (т, J=6,9 Гц, 3H), 1,26 (д, J=5,2 Гц, 6H)
Пример 154: (R)-3-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
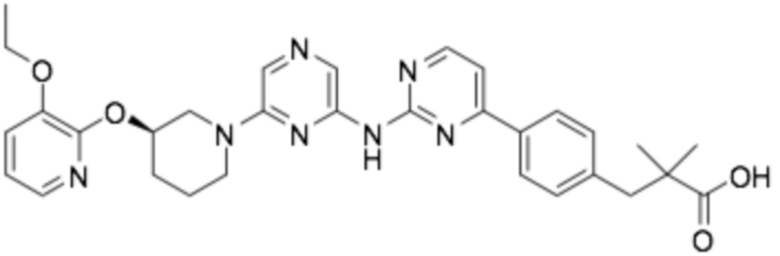
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (70,4 мг, 0,210 ммоль), полученный в примере получения 3, и метил 3-(4-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (60,0 мг, 0,210 ммоль), полученный в примере получения 76. (выход на 2 стадии 63%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,87 (с, 1H), 8,60-8,43 (м, 1H), 8,08 (д, J=8,2 Гц, 2H), 7,70 (кв, J=2,3 Гц, 2H), 7,49-7,26 (м, 3H), 7,04 (дд, J=7,8, 1,4 Гц, 1H), 6,84 (дд, J=7,8, 5,0 Гц, 1H), 5,29-5,12 (1H), 4,14 (дд, J=13,7, 5,5 Гц, 1H), 3,97-3,69 (м, 4H), 3,64 (т, J=9,4 Гц, 1H), 3,03-2,94 (2H), 2,20-1,95 (м, 3H), 1,75-1,56 (м, 1H), 1,25-1,14 (м, 9H)
Пример 155: (R)-3-(4-(2-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
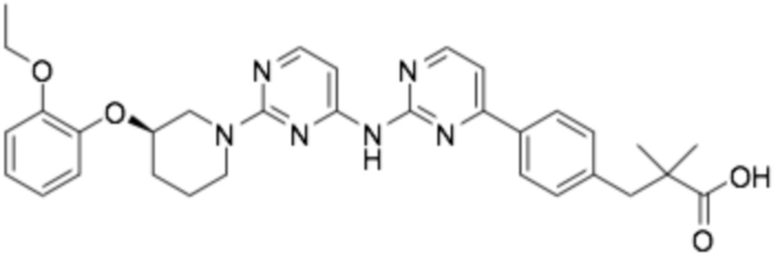
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-4-хлор-2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин (70,2 мг, 0,210 ммоль), полученный в примере получения 5, и метил 3-(4-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (60,0 мг, 0,210 ммоль), полученный в примере получения 76. (выход на 2 стадии 64%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,55 (д, J=5,5 Гц, 1H), 8,15 (д, J=5,9 Гц, 1H), 8,11-8,02 (2H), 7,70 (д, J=5,9 Гц, 1H), 7,46 (д, J=5,5 Гц, 1H), 7,37 (д, J=8,7 Гц, 2H), 7,13-6,98 (м, 1H), 6,98-6,80 (м, 3H), 4,35 (тд, J=7,2, 3,5 Гц, 1H), 4,24 (дд, J=13,3, 3,2 Гц, 1H), 4,05-3,89 (м, 3H), 3,86-3,72 (1H), 3,66 (тд, J=8,7, 4,0 Гц, 1H), 2,96 (с, 2H), 2,20-2,04 (м, 1H), 2,01-1,92 (м, 1H), 1,92-1,78 (м, 1H), 1,67-1,48 (м, 1H), 1,32 (т, J=7,1 Гц, 3H), 1,20 (с, 6H)
Пример 156: (R)-3-(4-(2-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
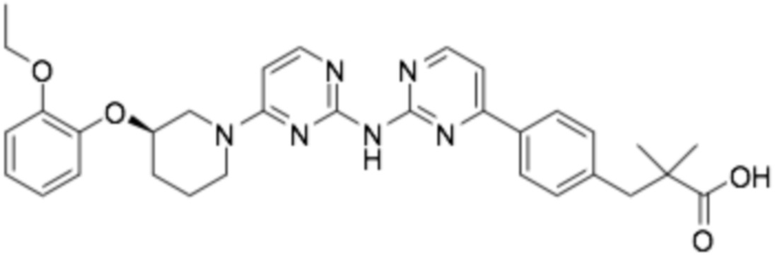
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин (70,2 мг, 0,210 ммоль), полученный в примере получения 6, и метил 3-(4-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (60,0 мг, 0,210 ммоль), полученный в примере получения 76. (выход на 2 стадии 36%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,59 (д, J=5,5 Гц, 1H), 8,08 (д, J=8,2 Гц, 2H), 7,95 (д, J=6,9 Гц, 1H), 7,61 (д, J=5,5 Гц, 1H), 7,39 (д, J=8,2 Гц, 2H), 7,06-6,96 (м, 1H), 6,96-6,76 (м, 3H), 6,54 (д, J=6,4 Гц, 1H), 4,56 (с, 1H), 4,37-4,17 (1H), 4,06-3,86 (м, 2H), 3,86-3,73 (м, 1H), 3,66-3,51 (м, 1H), 3,34 (д, J=5,5 Гц, 1H), 2,93 (с, 2H), 2,17-1,96 (м, 3H), 1,76-1,57 (м, 1H), 1,29 (т, J=6,9 Гц, 3H), 1,15 (с, 6H)
Пример 157: (R)-3-(4-(2-((4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
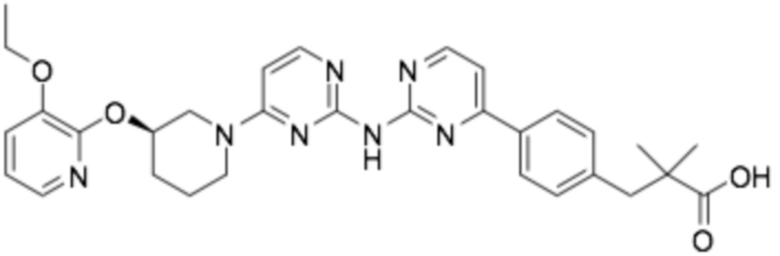
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин (70,4 мг, 0,210 ммоль), полученный в примере получения 7, и метил 3-(4-(2-аминопиримидин-4-ил)фенил)-2,2-диметилпропаноат (60,0 мг, 0,210 ммоль), полученный в примере получения 76. (выход на 2 стадии 60%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,61 (д, J=5,5 Гц, 1H), 8,17-8,01 (2H), 7,94 (д, J=6,9 Гц, 1H), 7,68 (д, J=3,7 Гц, 1H), 7,63 (д, J=5,5 Гц, 1H), 7,38 (д, J=8,2 Гц, 2H), 7,21-7,04 (1H), 6,93-6,76 (м, 1H), 6,57 (д, J=4,6 Гц, 1H), 5,32 (с, 1H), 4,62-4,04 (1H), 4,02-3,74 (3H), 3,73-3,54 (м, 1H), 2,94 (с, 2H), 2,19-1,96 (м, 3H), 1,82-1,63 (м, 1H), 1,30 (кв, J=6,9 Гц, -1H), 1,27-1,20 (м, 3H), 1,17 (с, 6H)
Пример 158: (R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота
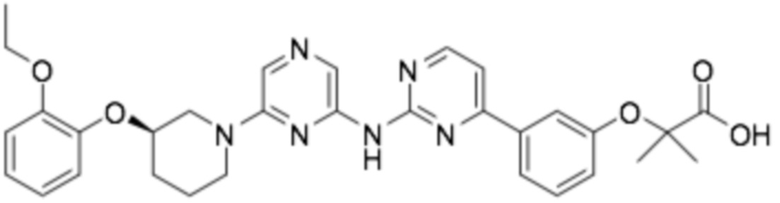
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,175 г, 0,525 ммоль), полученный в примере получения 1, и этил 2-(3-(2-аминопиримидин-4-ил)фенокси)-2-метилпропаноат (0,19 г, 0,631 ммоль), полученный в примере получения 68. (выход на 2 стадии 62%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,85 (с, 1H), 8,49 (д, J=5,0 Гц, 1H), 7,76-7,55 (м, 3H), 7,40-7,26 (м, 2H), 7,05 (д, J=7,3 Гц, 2H), 6,99 (д, J=5,9 Гц, 1H), 6,87 (с, 3H), 4,74-4,49 (1H), 4,49-4,32 (1H), 3,90 (д, J=14,2 Гц, 2H), 3,83-3,69 (м, 2H), 3,65 (с, 1H), 2,08-1,97 (2H), 1,92 (с, 1H), 1,63-1,59 (1H), 1,56 (с, 6H), 1,26 (с, 3H)
Пример 159: (R)-2-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота
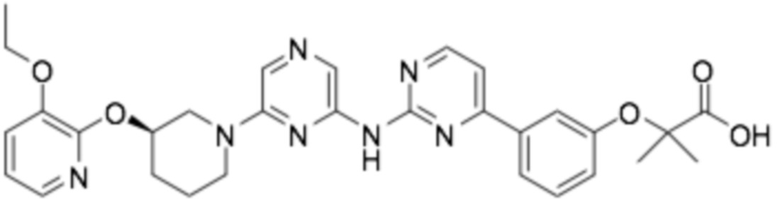
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (78,0 мг, 0,232 ммоль), полученный в примере получения 3, и этил 2-(3-(2-аминопиримидин-4-ил)фенокси)-2-метилпропаноат (70,0 мг, 0,232 ммоль), полученный в примере получения 68. (выход на 2 стадии 64%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 9,24 (с, 1H), 8,51 (д, J=5,2 Гц, 1H), 8,09 (с, 1H), 7,79-7,74 (1H), 7,71 (с, 1H), 7,55 (д, J=7,6 Гц, 1H), 7,37 (т, J=7,8 Гц, 1H), 7,33-7,27 (1H), 7,16-7,07 (1H), 6,97 (д, J=7,6 Гц, 1H), 6,88-6,76 (1H), 5,22 (кв, J=3,4 Гц, 1H), 3,99 (д, J=13,4 Гц, 1H), 3,96-3,83 (м, 3H), 3,83-3,71 (м, 1H), 3,66-3,50 (м, 1H), 2,25-2,12 (м, 1H), 2,09-1,95 (м, 2H), 1,78-1,67 (м, 1H), 1,67-1,58 (6H), 1,29 (т, J=6,9 Гц, 3H)
Пример 160: (R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота
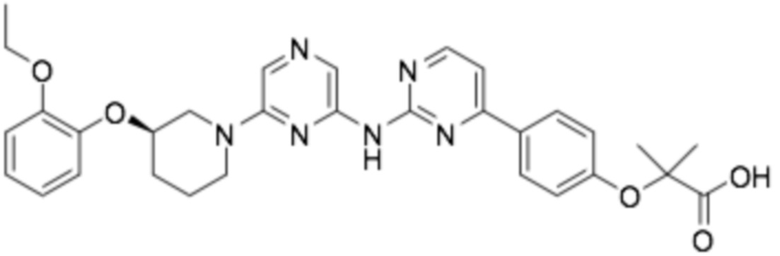
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,277 г, 0,83 ммоль), полученный в примере получения 1, и этил 2-(4-(2-аминопиримидин-4-ил)фенокси)-2-метилпропаноат (0,3 г, 0,996 ммоль), полученный в примере получения 69. (выход на 2 стадии 33%)
1H-ЯМР (MeOD) δ 8,89 (с, 1H), 8,43 (д, J=4,9 Гц, 1H), 7,97 (д, J=8,2 Гц, 2H), 7,61 (с, 1H), 7,19 (д, J=5,2 Гц, 1H), 7,00 (д, J=7,0 Гц, 2H), 6,93 (д, J=7,6 Гц, 1H), 6,89-6,68 (м, 3H), 4,33 (т, J=3,2 Гц, 1H), 3,95-3,77 (м, 3H), 3,64 (кв, J=6,7 Гц, 1H), 3,59-3,49 (м, 2H), 2,06-1,98 (м, 2H), 1,94 (д, J=4,6 Гц, 1H), 1,89-1,74 (м, 1H), 1,61 (д, J=13,7 Гц, 6H), 1,24 (т, J=7,0 Гц, 3H)
Пример 161: (R)-2-((4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)амино)-2-метилпропановая кислота
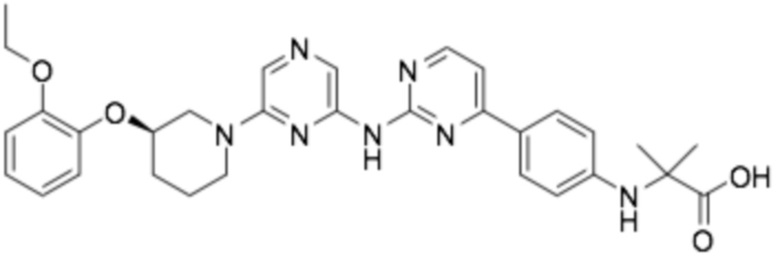
Требуемое заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,15 г, 0,45 ммоль), полученный в примере получения 1, и этил 2-((4-(2-аминопиримидин-4-ил)фенил)амино)-2-метилпропаноат (45 мг, 0,75 ммоль), полученный в примере получения 99. (61% выход)
1H-ЯМР (MeOD) δ 8,92 (с, 1H), 8,39 (д, J=5,5 Гц, 1H), 7,99 (д, J=8,8 Гц, 2H), 7,68 (с, 1H), 7,30 (д, J=5,5 Гц, 1H), 7,04 (д, J=7,6 Гц, 1H), 6,99-6,84 (м, 3H), 6,70 (д, J=8,8 Гц, 2H), 4,46 (с, 1H), 4,03-3,83 (м, 4H), 3,83-3,71 (1H), 3,71-3,55 (1H), 2,06 (д, J=24,4 Гц, 2H), 1,99-1,88 (1H), 1,65 (с, 1H), 1,59 (с, 6H), 1,37-1,28 (м, 3H)
Пример 162: (R)-2-(4-((2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)фенил)уксусная кислота
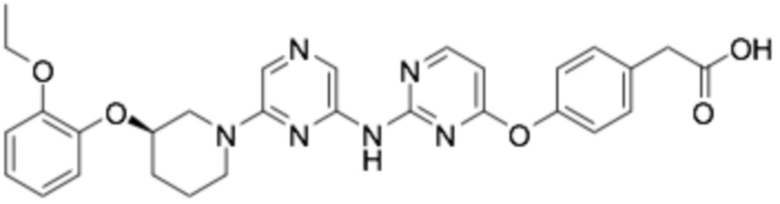
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,142 г, 0,424 ммоль), полученный в примере получения 1, и метил 2-(4-((2-аминопиримидин-4-ил)окси)фенил)ацетат (0,1 г, 0,386 ммоль), полученный в примере получения 103. (выход на 2 стадии 29%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,31 (д, J=5,5 Гц, 1H), 7,70-7,61 (1H), 7,55 (с, 1H), 7,45 (д, J=8,2 Гц, 2H), 7,42-7,37 (1H), 7,13-7,07 (2H), 6,92 (дд, J=7,1, 1,6 Гц, 2H), 6,89-6,79 (м, 2H), 6,53 (д, J=5,5 Гц, 1H), 4,33-4,18 (м, 1H), 4,04-3,87 (м, 3H), 3,80 (с, 2H), 3,71-3,52 (2H), 3,48-3,35 (м, 1H), 2,09-2,00 (м, 1H), 2,00-1,84 (м, 2H), 1,61-1,49 (м, 1H), 1,39-1,30 (3H)
Пример 163: (R)-2-(4-((2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота
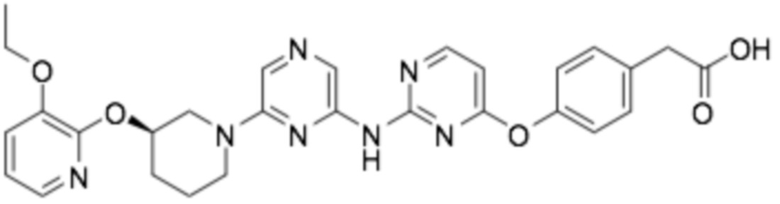
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (0,142 г, 0,424 ммоль), полученный в примере получения 3, и метил 2-(4-((2-аминопиримидин-4-ил)окси)фенил)ацетат (0,1 г, 0,386 ммоль), полученный в примере получения 103. (выход на 2 стадии 14%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,31 (д, J=5,5 Гц, 1H), 7,77-7,69 (м, 2H), 7,50-7,42 (м, 3H), 7,32 (с, 1H), 7,09 (дд, J=6,4, 1,8 Гц, 2H), 6,95 (дд, J=7,8, 1,4 Гц, 1H), 6,80 (дд, J=7,8, 5,0 Гц, 1H), 6,55 (д, J=5,9 Гц, 1H), 5,14 (кв, J=3,5 Гц, 1H), 3,96-3,79 (м, 5H), 3,74 (кв, J=7,0 Гц, 2H), 3,52 (с, 1H), 2,11 (дд, J=15,8, 8,9 Гц, 1H), 2,01-1,90 (м, 2H), 1,68-1,57 (м, 1H), 1,26 (д, J=6,9 Гц, 3H)
Пример 164: (R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
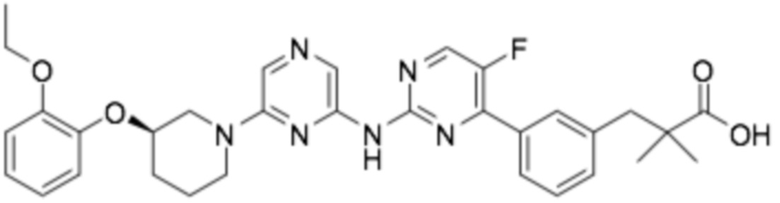
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (129 мг, 0,41 ммоль), полученный в примере получения 1, и трет-бутил 3-(3-(2-хлор-5-фторпиримидин-4-ил)фенил)-2,2-диметилпропаноат (150 мг, 0,41 ммоль), полученный в примере получения 79. (выход на 2 стадии 32%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,79 (с, 1H), 8,49 (д, J=3,0 Гц, 1H), 7,94 (д, J=11,4 Гц, 2H), 7,65 (с, 1H), 7,42 (т, J=7,5 Гц, 1H), 7,36 (д, J=7,8 Гц, 1H), 7,04-6,93 (м, 1H), 6,92-6,76 (м, 3H), 4,48 (с, 1H), 3,95 (д, J=5,9 Гц, 2H), 3,87 (тдд, J=16,9, 6,9, 2,7 Гц, 2H), 3,78 (д, J=13,7 Гц, 1H), 3,60-3,42 (м, 1H), 2,96 (с, 2H), 2,11-1,88 (м, 3H), 1,59 (с, 1H), 1,33-1,20 (м, 3H), 1,19 (с, 6H)
Пример 165: (R)-3-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
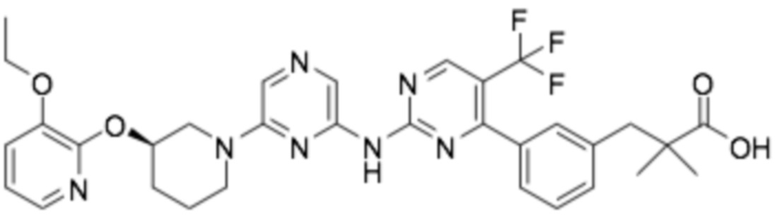
Заявленное в заголовке соединение получали тем же способом, как в примере 22, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (36 мг, 0,11 ммоль), полученный в примере получения 3, и трет-бутил 3-(3-(2-амино-5-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат (42 мг, 0,11 ммоль), полученный в примере получения 86. (выход на 2 стадии 15%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,81 (с, 1H), 8,45 (д, J=4,1 Гц, 1H), 7,98 (с, 1H), 7,94 (д, J=7,8 Гц, 1H), 7,73-7,63 (м, 2H), 7,41 (т, J=7,5 Гц, 1H), 7,35 (д, J=7,8 Гц, 1H), 7,03 (дд, J=7,8, 1,4 Гц, 1H), 6,80 (дд, J=7,8, 5,0 Гц, 1H), 5,15 (кв, J=2,9 Гц, 1H), 4,06-3,94 (м, 1H), 3,94-3,70 (м, 5H), 3,62 (д, J=8,2 Гц, 1H), 2,96 (с, 2H), 2,16-1,88 (м, 4H), 1,69-1,54 (м, 1H), 1,21-1,10 (м, 9H)
Пример 166: (R)-3-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
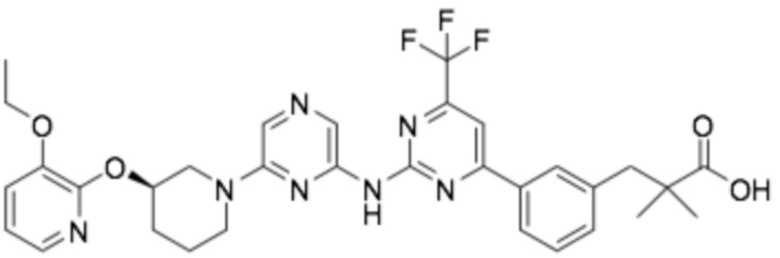
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (104 мг, 0,31 ммоль), полученный в примере получения 3, и метил 3-(3-(2-амино-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат (100 мг, 0,28 ммоль), полученный в примере получения 93. (выход на 2 стадии 65%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,81 (с, 1H), 8,07 (с, 1H), 8,04 (д, J=7,3 Гц, 1H), 7,70 (с, 1H), 7,69 (с, 1H), 7,67 (дд, J=5,0, 1,4 Гц, 1H), 7,48-7,34 (м, 2H), 7,00 (дд, J=7,8, 1,4 Гц, 1H), 6,79 (дд, J=7,8, 5,0 Гц, 1H), 5,17 (кв, J=2,7 Гц, 1H), 4,12 (дд, J=13,0, 4,8 Гц, 1H), 3,96-3,68 (м, 4H), 3,60 (тд, J=9,0, 4,1 Гц, 1H), 2,98 (с, 2H), 2,17-1,99 (м, 2H), 1,95 (с, 1H), 1,71-1,54 (м, 1H), 1,24-1,15 (м, 9H)
Пример 167: (R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота
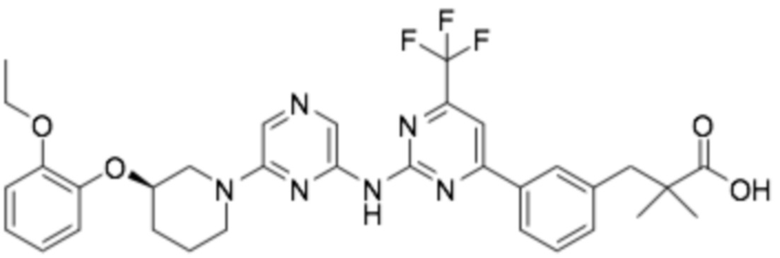
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (104 мг, 0,31 ммоль), полученный в примере получения 1, и метил 3-(3-(2-амино-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропаноат (100 мг, 0,28 ммоль), полученный в примере получения 93. (выход на 2 стадии 49%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,85 (с, 1H), 8,07 (с, 1H), 8,06-7,96 (м, 1H), 7,70 (с, 1H), 7,69 (с, 1H), 7,49-7,31 (м, 2H), 6,99 (дд, J=7,5, 2,1 Гц, 1H), 6,93-6,77 (м, 3H), 4,42 (т, J=3,4 Гц, 1H), 3,99-3,82 (4H), 3,82-3,69 (м, 1H), 3,69-3,52 (1H), 2,98 (с, 2H), 2,12-2,00 (2H), 1,93 (т, J=8,9 Гц, 1H), 1,60 (д, J=3,7 Гц, 1H), 1,23 (т, J=7,1 Гц, 3H), 1,19 (с, 6H)
Пример 168: (R)-2-(3-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2-метилпропановая кислота
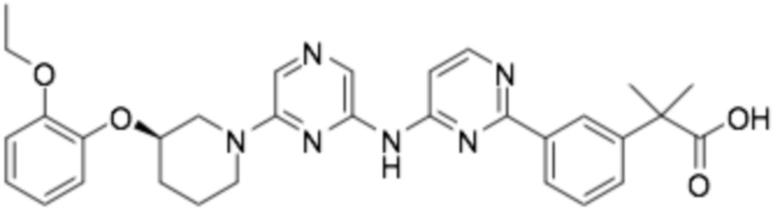
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,108 г, 0,324 ммоль), полученнЫЙ в примере получения 1, и метил 2-(3-(4-аминопиримидин-2-ил)фенил)-2-метилпропаноат (0,08 г, 0,295 ммоль), полученнЫЙ в примере получения 111. (выход на 2 стадии 94%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,40 (д, J=1,8 Гц, 1H), 8,27 (т, J=6,4 Гц, 1H), 8,22-8,11 (м, 2H), 7,62 (д, J=8,7 Гц, 1H), 7,51 (д, J=7,8 Гц, 1H), 7,46-7,37 (м, 1H), 7,32 (с, 1H), 6,96 (т, J=6,9 Гц, 1H), 6,84 (д, J=4,6 Гц, 2H), 6,82-6,75 (м, 1H), 4,43 (с, 1H), 3,94-3,77 (м, 4H), 3,77-3,63 (1H), 3,56 (д, J=9,1 Гц, 1H), 2,10-2,00 (2H), 1,92 (д, J=8,7 Гц, 1H), 1,61 (с, 6H), 1,60-1,55 (1H), 1,24 (дд, J=6,2, 2,1 Гц, 3H)
Пример 169: (R)-2-(4-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2-метилпропановая кислота
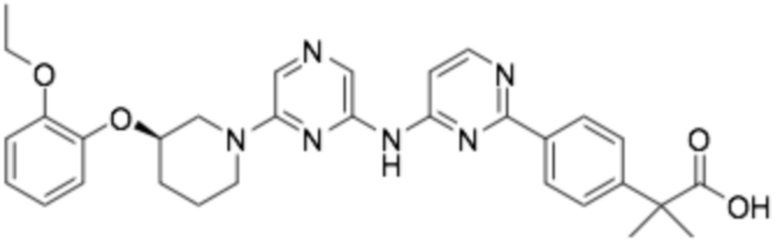
Заявленное в заголовке соединение получали тем же способом, как в примере 12, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (0,095 г, 0,284 ммоль), полученный в примере получения 1, и метил 2-(4-(4-аминопиримидин-2-ил)фенил)-2-метилпропаноат (0,07 г, 0,258 ммоль), полученный в примере получения 112. (выход на 2 стадии 87%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,31-8,21 (м, 3H), 8,16 (с, 1H), 7,61 (д, J=2,3 Гц, 1H), 7,52-7,44 (2H), 7,29 (д, J=3,7 Гц, 1H), 6,95 (д, J=7,8 Гц, 1H), 6,86-6,81 (м, 2H), 6,81-6,75 (м, 1H), 4,41 (д, J=2,3 Гц, 1H), 3,96-3,74 (4H), 3,67 (д, J=13,7 Гц, 1H), 3,60-3,45 (м, 1H), 2,10-1,99 (м, 2H), 1,95-1,84 (м, 1H), 1,63 (д, J=15,1 Гц, 1H), 1,57 (с, 6H), 1,25 (т, J=7,8 Гц, 3H)
Пример 170: (R)-3-(3-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота
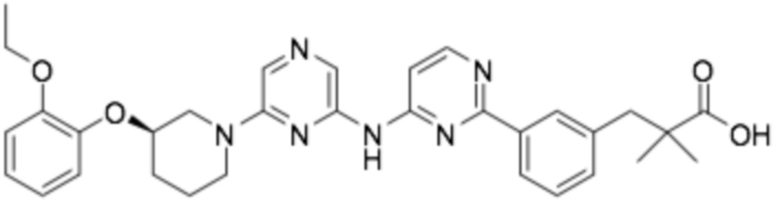
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (82,0 мг, 0,245 ммоль), полученный в примере получения 1, и метил 3-(3-(4-аминопиримидин-2-ил)фенил)-2,2-диметилпропаноат (70,0 мг, 0,245 ммоль), полученный в примере получения 90, (выход на 2 стадии 65%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,36 (с, 1H), 8,34-8,26 (м, 1H), 8,26-8,13 (м, 2H), 7,70 (с, 1H), 7,39 (т, J=7,5 Гц, 1H), 7,36-7,22 (м, 2H), 7,01 (д, J=7,8 Гц, 1H), 6,94-6,75 (м, 3H), 4,47 (т, J=3,4 Гц, 1H), 4,02-3,84 (м, 4H), 3,84-3,72 (м, 1H), 3,71-3,55 (м, 1H), 2,99 (с, 2H), 2,22-2,02 (м, 2H), 2,00-1,81 (м, 1H), 1,75-1,54 (м, 1H), 1,27 (т, J=6,9 Гц, 3H), 1,21 (с, 6H)
Пример 171: (R)-3-(3-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота
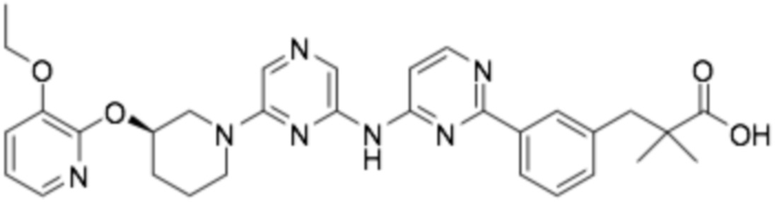
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (71,6 мг, 0,214 ммоль), полученный в примере получения 3, и метил 3-(3-(4-аминопиримидин-2-ил)фенил)-2,2-диметилпропаноат (61,0 мг, 0,214 ммоль), полученный в примере получения 90, (выход на 2 стадии 45%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,30 (с, 1H), 8,40 (д, J=5,9 Гц, 1H), 8,35-8,18 (м, 2H), 7,80-7,62 (м, 2H), 7,47-7,31 (1H), 7,24 (д, J=7,3 Гц, 1H), 7,09 (с, 1H), 6,91 (дд, J=7,8, 1,8 Гц, 1H), 6,79 (дд, J=7,8, 5,0 Гц, 1H), 6,50 (д, J=5,5 Гц, 1H), 5,21 (кв, J=3,2 Гц, 1H), 4,02-3,72 (м, 4H), 3,63 (с, 1H), 3,57 (с, 1H), 3,01 (дд, J=23,3, 13,7 Гц, 2H), 2,22-2,07 (м, 1H), 2,02 (кв, J=5,0 Гц, 2H), 1,75-1,53 (м, 1H), 1,29-1,22 (м, 9H)
Пример 172: (R)-3-(4-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота
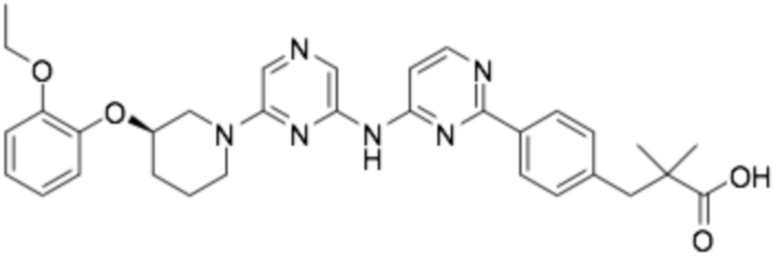
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (82,0 мг, 0,245 ммоль), полученный в примере получения 1, и метил 3-(4-(4-аминопиримидин-2-ил)фенил)-2,2-диметилпропаноат (70,0 мг, 0,245 ммоль), полученный в примере получения 96. (выход на 2 стадии 59%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,30 (д, J=5,9 Гц, 1H), 8,24 (д, J=8,2 Гц, 3H), 7,69 (с, 1H), 7,42-7,24 (м, 3H), 7,00 (д, J=7,3 Гц, 1H), 6,94-6,74 (м, 3H), 4,48 (т, J=3,4 Гц, 1H), 4,02-3,82 (м, 4H), 3,82-3,70 (м, 1H), 3,70-3,53 (м, 1H), 2,95 (с, 2H), 2,22-1,87 (м, 3H), 1,74-1,55 (м, 1H), 1,36-1,23 (3H), 1,20 (с, 6H)
Пример 173: (R)-3-(4-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота
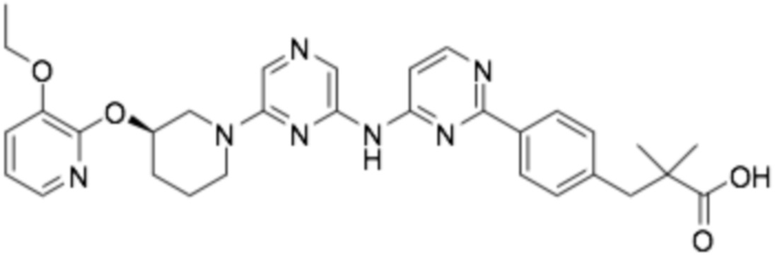
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (82,0 мг, 0,245 ммоль), полученный в примере получения 3, и метил 3-(4-(4-аминопиримидин-2-ил)фенил)-2,2-диметилпропаноат (70,0 мг, 0,245 ммоль), полученный в примере получения 96. (выход на 2 стадии 52%)
1H-ЯМР (400 МГц, МЕТАНОЛ-D4) δ 8,31 (д, J=5,5 Гц, 1H), 8,28-8,22 (2H), 8,20 (с, 1H), 7,70 (с, 1H), 7,60 (дд, J=5,0, 1,4 Гц, 1H), 7,40-7,20 (3H), 7,02 (дд, J=7,8, 1,4 Гц, 1H), 6,71 (дд, J=7,8, 5,0 Гц, 1H), 5,26 (т, J=2,7 Гц, 1H), 4,23 (дд, J=13,7, 5,5 Гц, 1H), 4,00-3,68 (м, 4H), 3,70-3,51 (м, 1H), 2,95 (с, 2H), 2,23-1,91 (м, 3H), 1,67 (дд, J=9,1, 3,2 Гц, 1H), 1,23-1,12 (м, 9H)
Пример 174: (R)-2-(3-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота
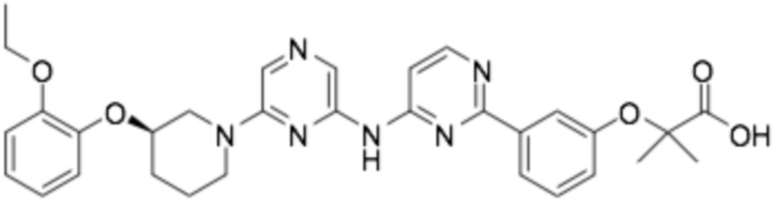
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (53,2 мг, 0,159 ммоль), полученный в примере получения 1, и этил 2-(3-(4-аминопиримидин-2-ил)фенокси)-2-метилпропаноат (48,0 мг, 0,159 ммоль), полученный в примере получения 95. (выход на 2 стадии 47%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 9,25 (с, 1H), 8,54-8,41 (1H), 8,11 (д, J=7,9 Гц, 2H), 7,71 (д, J=5,8 Гц, 1H), 7,45-7,34 (1H), 7,17-7,04 (1H), 7,04-6,93 (м, 3H), 6,93-6,79 (м, 2H), 6,57 (д, J=5,5 Гц, 1H), 4,36 (т, J=3,4 Гц, 1H), 4,06-3,84 (м, 3H), 3,80-3,61 (2H), 3,51 (т, J=8,8 Гц, 1H), 2,18-2,06 (м, 1H), 2,06-1,98 (м, 1H), 1,95 (дд, J=12,2, 4,3 Гц, 1H), 1,68-1,64 (1H), 1,64 (с, 6H), 1,35 (т, J=7,0 Гц, 3H)
Пример 175: (R)-2-(3-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота
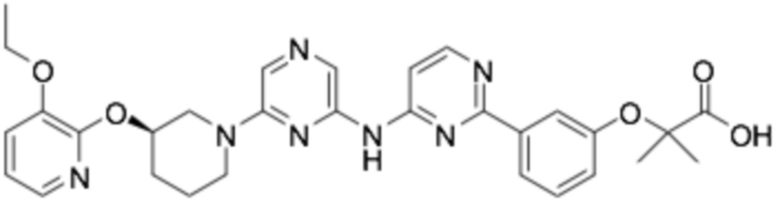
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (53,3 мг, 0,159 ммоль), полученный в примере получения 3, и этил 2-(3-(4-аминопиримидин-2-ил)фенокси)-2-метилпропаноат (48,0 мг, 0,159 ммоль), полученный в примере получения 95. (выход на 2 стадии 51%)
1H-ЯМР (ХЛОРОФОРМ-D) δ 9,22 (с, 1H), 8,47 (д, J=5,8 Гц, 1H), 8,20-8,05 (м, 2H), 7,83-7,68 (м, 2H), 7,39 (т, J=7,9 Гц, 1H), 7,12 (д, J=7,3 Гц, 1H), 6,95 (д, J=7,6 Гц, 1H), 6,87 (с, 1H), 6,82 (дд, J=7,6, 4,9 Гц, 1H), 6,55 (д, J=5,8 Гц, 1H), 5,28-5,17 (1H), 4,05-3,77 (м, 4H), 3,77-3,66 (м, 1H), 3,66-3,56 (м, 1H), 2,24-2,10 (м, 1H), 2,10-1,96 (м, 2H), 1,76-1,63 (м, 7H), 1,27 (т, J=7,0 Гц, 3H)
Пример 176: (R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота
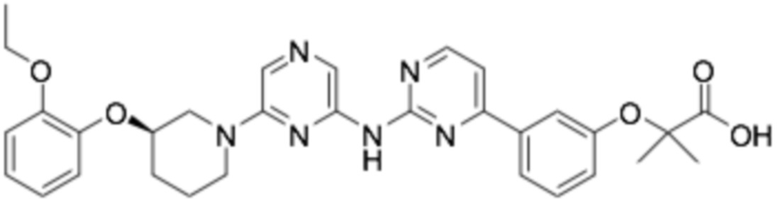
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (107 мг, 0,322 ммоль), полученный в примере получения 1, и этил 2-(3-(2-аминопиримидин-4-ил)фенокси)-2-метилпропаноат (97,0 мг, 0,322 ммоль), полученный в примере получения 68. (выход на 2 стадии 62%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 9,29 (с, 1H), 8,52 (д, J=5,5 Гц, 1H), 8,09 (т, J=1,8 Гц, 1H), 7,69 (с, 1H), 7,65 (с, 1H), 7,55 (д, J=7,8 Гц, 1H), 7,37 (т, J=7,8 Гц, 1H), 7,29 (д, J=5,0 Гц, 1H), 7,19-7,07 (м, 1H), 7,07-6,94 (м, 2H), 6,94-6,80 (м, 2H), 4,41-4,23 (м, 1H), 4,12-4,05 (м, 1H), 4,05-3,88 (м, 2H), 3,80 (кв, J=4,4 Гц, 1H), 3,67-3,51 (1H), 3,44 (т, J=9,6 Гц, 1H), 2,16-2,08 (м, 1H), 2,07-1,96 (1H), 1,95-1,82 (м, 1H), 1,68-1,53 (7H), 1,38 (т, J=6,9 Гц, 3H)
Пример 177: (R)-2-(4-(6-((6-(3-(2-этокси-4-фторфенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота
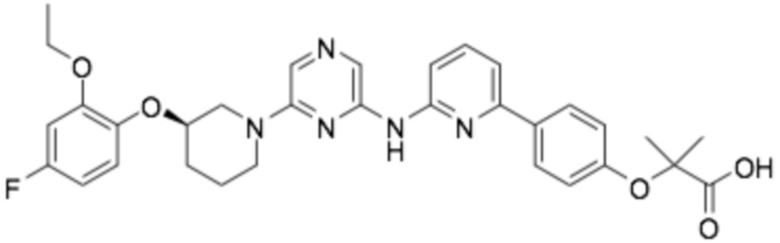
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этокси-4-фторфенокси)пиперидин-1-ил)пиразин (94,0 мг, 0,266 ммоль), полученный в примере получения 118, и этил 2-(4-(6-аминопиридин-2-ил)фенокси)-2-метилпропаноат (80,0 мг, 0,266 ммоль), полученный в примере получения 97. (выход на 2 стадии 59%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,05 (с, 1H), 7,82-7,64 (м, 4H), 7,64-7,46 (1H), 7,14 (д, J=7,8 Гц, 1H), 7,09-6,96 (м, 2H), 6,88 (т, J=7,1 Гц, 1H), 6,58 (дд, J=10,1, 2,7 Гц, 1H), 6,53-6,38 (1H), 4,31-4,17 (м, 1H), 4,04 (д, J=11,9 Гц, 1H), 3,99-3,84 (м, 2H), 3,75 (т, J=6,6 Гц, 1H), 3,53 (дд, J=13,0, 7,5 Гц, 1H), 3,47-3,31 (м, 1H), 2,16-2,05 (м, 1H), 2,00 (кв, J=3,4 Гц, 1H), 1,94-1,82 (м, 1H), 1,65 (с, 6H), 1,60 (кв, J=4,6 Гц, 1H), 1,36 (т, J=7,1 Гц, 3H)
Пример 178: (R)-2-(4-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота
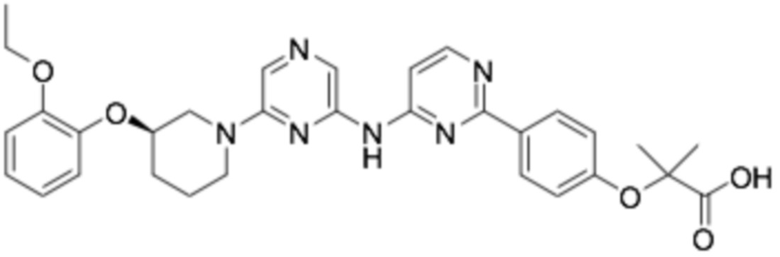
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин (110 мг, 0,329 ммоль), полученный в примере получения 1, и метил 2-(4-(4-аминопиримидин-2-ил)фенокси)-2-метилпропаноат (90 мг, 0,299 ммоль), полученный в примере получения 119. (выход на 2 стадии 64%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,37 (д, J=5,9 Гц, 1H), 8,25-8,07 (м, 3H), 7,79 (с, 1H), 7,75 (с, 1H), 7,23 (д, J=5,9 Гц, 1H), 7,00-6,88 (4H), 6,88-6,77 (2H), 4,39-4,27 (м, 1H), 4,06-3,86 (м, 3H), 3,76-3,67 (м, 1H), 3,67-3,58 (м, 1H), 3,45 (т, J=9,4 Гц, 1H), 2,18-2,09 (м, 1H), 2,02-1,96 (м, 1H), 1,96-1,86 (м, 1H), 1,68 (с, 6H), 1,65-1,56 (м, 1H), 1,31 (кв, J=7,5 Гц, 3H)
Пример 179: (R)-2-(4-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота
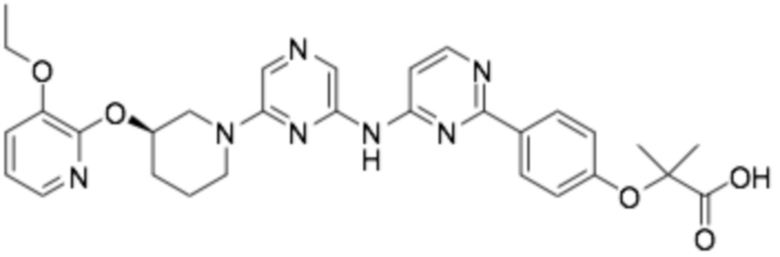
Заявленное в заголовке соединение получали тем же способом, как в примере 1, применяя (R)-2-хлор-6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин (98 мг, 0,292 ммоль), полученный в примере получения 3, и метил 2-(4-(4-аминопиримидин-2-ил)фенокси)-2-метилпропаноат (80 мг, 0,265 ммоль), полученный в примере получения 119. (выход на 2 стадии 66%)
1H-ЯМР (400 МГц, ХЛОРОФОРМ-D) δ 8,42-8,29 (м, 1H), 8,15 (д, J=8,2 Гц, 3H), 7,80 (с, 1H), 7,75 (с, 1H), 7,65 (дд, J=4,8, 1,6 Гц, 1H), 7,24-7,15 (1H), 7,04-6,94 (м, 2H), 6,91 (дд, J=7,8, 1,4 Гц, 1H), 6,78-6,67 (1H), 5,22 (кв, J=3,2 Гц, 1H), 4,01-3,91 (м, 1H), 3,91-3,76 (м, 3H), 3,68 (д, J=5,9 Гц, 1H), 3,60-3,45 (м, 1H), 2,23-2,08 (м, 1H), 2,00 (т, J=5,0 Гц, 2H), 1,71 (д, J=30,2 Гц, 6H), 1,58 (с, 1H), 1,25 (тд, J=7,0, 5,2 Гц, 3H)
Экспериментальный пример: измерение ингибирующего эффекта относительно DGAT2 ферментативной активности
Ингибирующий эффект на DGAT2 ферментативную активность исследовали проведением следующего эксперимента на соединениях формулы (1) согласно настоящему изобретению.
1. Получение DGAT2 экспрессирующего вектора
Для получения pBacPAK9-DGAT2, который представляет собой вектор экспрессии DGAT2, ген DGAT2 человека, амплифицированный полимеразной цепной реакцией (ПЦР), клонировали по сайтам EcoR1 и Xho1 вектора pBacPAK9 (clonctech). Нуклеотидная последовательность праймеров, применяемых в ПЦР, представляла собой прямой праймер 5' CTATAAATACGGATCCCGGGAATTCATGGACTACAAGGACGACGATGACAAGCTTAAGACCCTCATAGCCGCC и обратный праймер 5' TAAGCGGCCGCCCTGCAGGCCTCGAGTCAGTTCACCTCCAGGAC. Состав реакционного раствора содержал 50 нг клона кДНК (OriGene), 200 мкМ дАТФ, дЦТФ, дТТФ, дГТФ, 200 нМ каждого праймера, 1 ед. Tag ДНК полимеразы (Toyobo), 1x PCR буфер, конечный объем доводили до 20 мкл. Реакционные условия денатурировали при 95°С в течение 5 минут, затем 30 раз при 94°С по 20 секунд, 60°С по 20 секунд и 72°С по 90 секунд с последующей дополнительной реакцией при 72°С в течение 7 минут.
2. DGAT2 экспрессия и получение мембранного белка
Рекомбинантный человеческий белок DGAT2 экспрессировали в клетках Sf-21, которые представляют собой клетки насекомых, применяя бакуловирусную экспрессионную систему BacPack (Clontech). Вкратце, способ получения выглядит следующим образом. Сначала вектор экспрессии pBacPAK9-DGAT2 трансфицировали с ДНК вирусом BacPAK6 (Bsu36I лизат) в клетки sf21 с применением Bacfectin для получения рекомбинантного бакуловируса, экспрессирующего DGAT2. Полученным таким образом бакуловирусом инфицировали клетки Sf-21 при 10 MOI (множественность заражения), и через 72 часа собирали зараженные клетки насекомых и выделяли мембранные белки.
Для разделения мембранных белков клеточный осадок растворяли в растворе сахарозы, содержащем 250 мМ сахарозы, 10 мМ Трис (pH 7,4) и 1 мМ этилендиаминтетрауксусную кислоту (ЭДТА), и затем гомогенизировали, применяя гомогенизатор Dounce, и надосадочную жидкость отбирали центрифугированием при 600×g в течение 15 минут и центрифугировали при 100000×g в течение 1 часа для удаления надосадочной жидкости, и оставшийся осадок ресуспендировали в 20 мМ буфере HEPES (pH 7,4). Полученный сверхэкспрессирующий мембранный белок DGAT2 разливали по 100 мкл и хранили при -80°C до применения. Концентрацию белка определяли количественно, применяя набор для анализа белка BCA (Thermo Scientific).
3. Измерение ингибирующего эффекта относительно DGAT2 ферментативной активности
In vitro DGAT2 анализ проводили, применяя флэш-пластинка с фосфолипидами (PerkinElmer), основанная на принципе SPA (сцинтилляционный бесконтактный анализ). Сначала соединения, ингибирующие DGAT2, последовательно разбавленные в 5 раз от 3 нМ до 10 мкМ (конечная концентрация, 1% ДМСО), смешивали в буферном растворе, содержащем 2 мкг DGAT2-мембранного белка и 20 мМ HEPES, 20 мМ MgCl2, 1 мг/мл BSA, 50 мкМ 1,2 sn-олеоилглицерина (Sigma), затем помещали в 96-луночный флэш-планшет (FlashPlate) и подвергали реакции при 37°C в течение 20 минут, и 1 мкМ [14C] олеоил-CoA (PerkinElmer, NEC651050UC) добавляли до конечного объема 100 мкл и дополнительно подвергали реакции при 37°С в течение 15 минут. После завершения ферментативной реакции добавляли 100 мкл изопропанола, планшет герметично запечатывали пленкой и медленно встряхивали на шейкере.
На следующий день измеряли амплифицированный сцинтилляционный сигнал (имп/мин) в Topcounter (Packard) для измерения степени образования [14C]-меченого триацилглицерина (ТГ) в качестве продукта реакции. Измеренное значение, когда не обрабатывали соединением, применяли в качестве положительного контроля, и измеренное значение для группы, обработанной соединением, рассчитывали как относительный % для измерения ингибирующего эффекта соединения на продукцию TG. Значение IC50, которое представляет собой концентрацию соединения, которая ингибирует продукцию TG на 50%, определяли путем обработки значения ответа в зависимости от концентрации соединения с помощью кривой нелинейной регрессии, применяя (Graphpad Inc.).
Как результат измерения ингибирующий эффект на DGAT2 ферментативную активность для соединение формулы (1), специфические величины IC50 отдельных соединения примеров показаны в таблице 1 ниже.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ БИАРИЛЬНОЕ ПРОИЗВОДНОЕ, ПРИМЕНЯЕМОЕ В КАЧЕСТВЕ ИНГИБИТОРА ДИАЦИЛГЛИЦЕРОЛ-АЦИЛТРАНСФЕРАЗЫ 2, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2808433C1 |
| НОВОЕ АМИДНОЕ ПРОИЗВОДНОЕ, ИСПОЛЬЗУЕМОЕ В КАЧЕСТВЕ ИНГИБИТОРА ДИАЦИЛГЛИЦЕРОЛ O-АЦИЛТРАНСФЕРАЗЫ 2, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2810064C1 |
| СОЕДИНЕНИЕ, СОДЕРЖАЩЕЕ ОКСАДИАЗОЛ, И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2019 |
|
RU2789456C2 |
| ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2833354C1 |
| НОВОЕ СОЕДИНЕНИЕ, ПРОЯВЛЯЮЩЕЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ЭНТЕРОПЕПТИДАЗЫ | 2019 |
|
RU2768755C1 |
| ПРОИЗВОДНЫЕ ТИЕНО[3,2-d]ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ПРОТЕИНКИНАЗ | 2012 |
|
RU2705577C2 |
| ПРОИЗВОДНЫЕ АМИНОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2826628C1 |
| ПРОИЗВОДНЫЕ ДИАМИНОПИРИМИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2587981C2 |
| СОЕДИНЕНИЯ ИНДОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ КЛЕТОЧНОГО НЕКРОЗА | 2008 |
|
RU2477282C2 |
| БИАРИЛЬНОЕ ПРОИЗВОДНОЕ В КАЧЕСТВЕ АГОНИСТА GPR120 | 2015 |
|
RU2683648C2 |
Изобретение относится к аминоарильному производному общей формулы (1) или его фармацевтически приемлемой соли или стереоизомеру, обладающему ингибирующей активностью по отношению к диацилглицеролацилтрансферазе 2 (DGAT2). В указанной формуле каждый A и D независимо представляет собой CH или N; каждый B и E независимо представляет собой CH, C-галоген, C-галогенС1-С7алкил или N; R1 представляет собой С1-С7алкил; R2 представляет собой водород или галоген; R3 представляет собой -G-J; где G представляет собой С6-С10арил, С6-С10арилен, С6-С10арилен-С1-С7алкилен, 5-12-членный гетероарил или 5-12-членный гетероарилен; J представляет собой водород, амино, аминокарбонил, С1-С7алкокси-С1-С7алкил, С3-С10циклоалкил, С3-С10циклоалкилокси, 5-12-членный гетероциклоалкил, С6-С10арил, С6-С10арилокси, С6-С10арил-С1-С7алкокси, 5-12-членный гетероарил, 5-12-членный гетероариламино, карбокси-С1-С7алкил, карбокси-С2-С7алкенил, карбокси-С1-С7алкил-С6-С10арил, карбокси-С1-С7алкокси-С6-С10арил, карбокси-С1-С7алкил-5-12-членный гетероциклоалкил, карбокси-С2-С7алкенил-5-12-членный гетероциклоалкил, карбокси-С1-С7алкокси-5-12-членный гетероциклоалкил, карбокси-С1-С7алкиламино-С6-С10арил, карбокси-С1-С7алкил-С6-С10арилокси или карбокси-С1-С7алкил-5-12-членный гетероарил; где амино, алкил, алкокси, циклоалкил, арил, гетероциклоалкил, гетероарил или гетероарилен необязательно замещен 1-4 заместителями, выбранными из галогена, -COOH, С1-С7алкила, С1-С7алкокси, галоген-С1-С7алкила, С1-С7алкилсульфонила и 5-12-членного гетероарил-С1-С7алкила; и гетероциклоалкил, гетероарил и гетероарилен содержат 1-5 гетероатомов, выбранных из N, O и S. Изобретение также относится к фармацевтической композиции для лечения заболеваний, связанных с диацилглицеролацилтрансферазой 2 (DGAT2), содержащей соединение формулы (1) или его фармацевтически приемлемую соль или стереоизомер в качестеве активного ингредиента вместе с фармацевтически приемлемым носителем. 2 н. и 2 з.п. ф-лы, 1 табл., 180 пр.
[формула (1)]
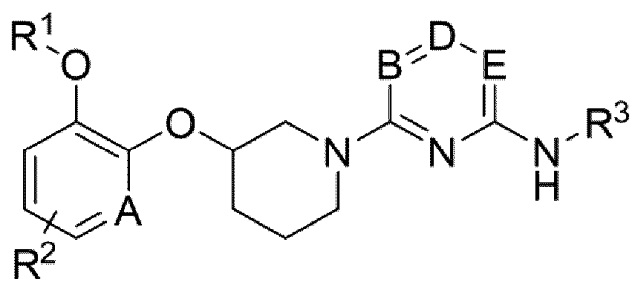
1. Соединение следующей формулы (1) или его фармацевтически приемлемая соль или стереоизомер:
[формула (1)]
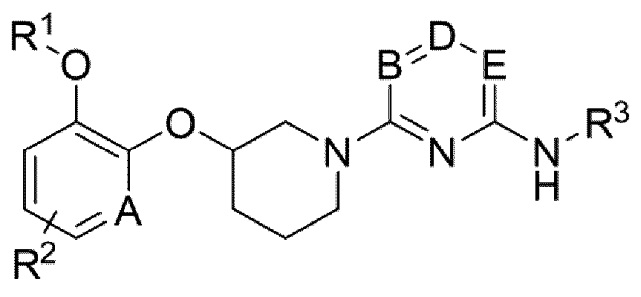 ,
,
где
каждый A и D независимо представляет собой CH или N;
каждый B и E независимо представляет собой CH, C-галоген, C-галогенС1-С7алкил или N;
R1 представляет собой С1-С7алкил;
R2 представляет собой водород или галоген;
R3 представляет собой -G-J;
где G представляет собой С6-С10арил, С6-С10арилен, С6-С10арилен-С1-С7алкилен, 5-12-членный гетероарил или 5-12-членный гетероарилен;
J представляет собой водород, амино, аминокарбонил, С1-С7алкокси-С1-С7алкил, С3-С10циклоалкил, С3-С10циклоалкилокси, 5-12-членный гетероциклоалкил, С6-С10арил, С6-С10арилокси, С6-С10арил-С1-С7алкокси, 5-12-членный гетероарил, 5-12-членный гетероариламино, карбокси-С1-С7алкил, карбокси-С2-С7алкенил, карбокси-С1-С7алкил-С6-С10арил, карбокси-С1-С7алкокси-С6-С10арил, карбокси-С1-С7алкил-5-12-членный гетероциклоалкил, карбокси-С2-С7алкенил-5-12-членный гетероциклоалкил, карбокси-С1-С7алкокси-5-12-членный гетероциклоалкил, карбокси-С1-С7алкиламино-С6-С10арил, карбокси-С1-С7алкил-С6-С10арилокси или карбокси-С1-С7алкил-5-12-членный гетероарил; где амино, алкил, алкокси, циклоалкил, арил, гетероциклоалкил, гетероарил или гетероарилен необязательно замещен 1-4 заместителями, выбранными из галогена, -COOH, С1-С7алкила, С1-С7алкокси, галоген-С1-С7алкила, С1-С7алкилсульфонила и 5-12-членного гетероарил-С1-С7алкила; и
гетероциклоалкил, гетероарил и гетероарилен содержат 1-5 гетероатомов, выбранных из N, O и S.
2. Соединение или его фармацевтически приемлемая соль или стереоизомер по п. 1, где соединение выбрано из следующей группы:
(R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)тиазол-5-карбоновая кислота;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-4,5-диметилтиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)тиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-4-фенилтиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)бензо[d]тиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-6-метоксибензо[d]тиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-6-(метансульфонил)бензо[d]тиазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-3-(1-(2-метоксиэтокси)-2-метилпропан-2-ил)изооксазол-5-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)-4-фенилоксазол-2-амин;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)бензо[d]оксазол-2-амин;
(R)-5-хлор-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)бензо[d]оксазол-2-амин;
(R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)уксусная кислота;
(R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)-2-метилпропановая кислота;
(R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)-2,2-диметилпропановая кислота;
(R,E)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)акриловая кислота;
(R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-5-ил)пропановая кислота;
(R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-6-ил)-2-метилпропановая кислота;
(R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)бензо[d]оксазол-6-ил)пропановая кислота;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(1H-пиразол-3-ил)пиразин-2-амин;
(R)-2-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)уксусная кислота;
(R)-3-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-фторпиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(1-метил-1H-тетразол-5-ил)пиразин-2-амин;
(R)-N-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-фенилпиразин-2-амин;
(R)-N-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)метансульфонамид;
(R)-2-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)-N-(пиридин-4-илметил)ацетамид;
(R)-2-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)-2-метилпропановая кислота;
(R)-2-(4-((6-(3-(2-этоксифенокси)пиридин-1-ил)пиразин-2-ил)амино)фенил)-2-метилпропановая кислота;
(R)-2-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)фенил)-2-метилпропановая кислота;
(R)-3-(3’-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-[1,1’-бифенил]-4-ил)-2,2-диметилпропановая кислота;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(пиридин-2-ил)пиразин-2-амин;
(R)-6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)никотиновая кислота;
(R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)изоникотиновая кислота;
(R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)никотиновая кислота;
(R)-2-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)-2-метилпропановая кислота;
(R)-2-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)уксусная кислота;
(R,E)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)акриловая кислота;
(R)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)пропановая кислота;
(R)-3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)-2,2-диметилпропановая кислота;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(5-фенилпиридин-2-ил)пиразин-2-амин;
(R)-6-(3-(2-этоксифенокси)пиперидин-1-ил)-N-(4-фенилпиридин-2-ил)пиразин-2-амин;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2-метилпропановая кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-4-ил)фенил)пропановая кислота;
(R)-3-(3-(5-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(5-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-3-ил)фенил)-2-метилпропановая кислота;
(R)-2-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-2-метилпропановая кислота;
(R)-3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-2,2-диметилпропановая кислота;
1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пирролидин-3-карбоновая кислота;
1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-3-метилпирролидин-3-карбоновая кислота;
1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоновая кислота;
(R)-1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-карбоновая кислота;
(R)-1-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-4-карбоновая кислота;
(R)-2-(1-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-4-ил)уксусная кислота;
(R)-2-(1-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-4-ил)-2-метилпропановая кислота;
2-((S)-1-(6-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)пиперидин-3-ил)уксусная кислота;
(R)-2-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(3-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-1H-пиразол-1-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((2-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин-4-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)-5-(трифторметил)пиримидин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)глицин;
(R)-(4-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)глицин;
(R)-(4-(6-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиридин-2-ил)фенил)глицин;
(R)-(4-(6-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)глицин;
(R)-2-((4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенил)амино)-2-метилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенокси)-2-метилпропановая кислота;
(R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-4-фторфенокси)-2-метилпропановая кислота;
(R)-3-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)-1H-пиразол-1-ил)-2,2-диметилпропановая кислота;
(R)-3-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота;
(R)-3-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота;
(R)-4-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота;
(R)-4-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)бензойная кислота;
(R)-2-(3-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота;
(R)-2-(3-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота;
(R)-2-(4-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота;
(R)-2-(4-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)-2-метилпропановая кислота;
(R)-2-(3-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота;
(R)-2-(3-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота;
(R)-2-(4-((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота;
(R)-2-(4-((6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)фенил)уксусная кислота;
(R)-4-(((6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)окси)метил)бензойная кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-3-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиридин-2-ил)-4-фторфенил)-2,2-диметилпропановая кислота;
(R)-2-(4-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-3-(трифторметил)пиридин-2-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-4-(трифторметил)пиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-3-метилпиридин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(6-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиразин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-N-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)пиримидин-2-амин;
(R)-2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-5-карбоновая кислота;
(R)-2-(2-(6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)пиримидин-4-ил)-2-метилпропановая кислота;
(R)-2-(2-(4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин-2-ил)пиримидин-4-ил)-2-метилпропановая кислота;
(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-L-пролин;
1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пирролидин-3-карбоновая кислота;
1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпирролидин-3-карбоновая кислота;
1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-карбоновая кислота;
(R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-карбоновая кислота;
1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)-3-метилпиперидин-3-карбоновая кислота;
(R)-1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-карбоновая кислота;
5-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)бицикло[2,2,1]гептан-2-карбоновая кислота;
(R)-2-(1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-ил)уксусная кислота;
(R)-2-(1-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-4-ил)-2-метилпропановая кислота;
(R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперазин-1-ил)уксусная кислота;
2-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)уксусная кислота;
(E)-3-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)акриловая кислота;
3-((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)пропановая кислота;
2-(((S)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)окси)уксусная кислота;
2-(((R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)окси)уксусная кислота;
2-(((R)-1-(2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиперидин-3-ил)окси)-2-метилпропановая кислота;
(R)-4-((2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(1R,4r)-4-((2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(1R,4r)-4-((2-((6-((R)-3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(1S,4s)-4-((2-((6-((R)-3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(1S,4s)-4-((2-((6-((R)-3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)циклогексан-1-карбоновая кислота;
(R)-6-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)пиколиновая кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота;
(R)-2-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)пропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиридин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота;
(R)-2-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота;
(R)-3-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((2-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-4-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((4-(3-(2-этоксифенокси)пиперидин-1-ил)пиримидин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(2-((4-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиримидин-2-ил)амино)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота;
(R)-2-((4-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)амино)-2-метилпропановая кислота;
(R)-2-(4-((2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)окси)фенил)уксусная кислота;
(R)-2-(4-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенил)уксусная кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-5-фторпиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-5-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)-6-(трифторметил)пиримидин-4-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2-метилпропановая кислота;
(R)-2-(4-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2-метилпропановая кислота;
(R)-3-(3-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(3-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-3-(4-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенил)-2,2-диметилпропановая кислота;
(R)-2-(3-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(3-(2-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-4-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(6-((6-(3-(2-этокси-4-фторфенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиридин-2-ил)фенокси)-2-метилпропановая кислота;
(R)-2-(4-(4-((6-(3-(2-этоксифенокси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота; и
(R)-2-(4-(4-((6-(3-((3-этоксипиридин-2-ил)окси)пиперидин-1-ил)пиразин-2-ил)амино)пиримидин-2-ил)фенокси)-2-метилпропановая кислота.
3. Фармацевтическая композиция для лечения заболеваний, связанных с диацилглицеролацилтрансферазой 2 (DGAT2), содержащая соединение формулы (1) или его фармацевтически приемлемую соль или стереоизомер по п. 1 или 2 в качестве активного ингредиента, вместе с фармацевтически приемлемым носителем.
4. Фармацевтическая композиция по п. 3, где заболевание, связанное с DGAT2, выбрано из группы, состоящей из жировой дистрофии печени, неалкогольного стеатогепатита (НАСГ), неалкогольной жировой болезни печени (НАЖБП), сахарного диабета, ожирения, гиперлипидемии, атеросклероза и гиперхолестеринемии.
| WO 2010022055 A2, 25.02.2010 | |||
| KR 20160115997 A, 06.10.2016 | |||
| KR 20190035897 A, 03.04.2019 | |||
| WO 2010056506 A1, 20.05.2010 | |||
| WO 2013068328 A1, 16.05.2013 | |||
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА/ПИПЕРАЗИНА | 2008 |
|
RU2478628C2 |
| WO 2013092976 A1, 27.06.2013. | |||
Авторы
Даты
2023-07-12—Публикация
2020-12-22—Подача