Предшествующий уровень техники
Болезнь Альцгеймера (AD; от англ. "Alzheimer's disease") представляет собой нейродегенеративное расстройство центральной нервной системы и является ведущей причиной прогрессирующей деменции у населения старшего возраста. Ее клиническими симптомами являются ухудшение памяти, познавательной способности, временной и пространственной ориентации, суждения и мышления, а также тяжелые эмоциональные нарушения. В настоящее время нет доступных способов лечения, которые могут предупреждать это заболевание или его прогрессирование, либо вызывать стабильную реверсию его клинических симптомов. AD стала значительной проблемой здравоохранения во всех обществах с высокой средней продолжительностью жизни, а также значительным экономическим грузом для их систем здравоохранения.
AD характеризуется 2 основными патологическими изменениями в центральной нервной системе (ЦНС): возникновением амилоидных бляшек и нейрофибриллярных клубков (Hardy et al., The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics, Science. 2002 Jul 19;297(5580): 353-6, Selkoe, Cell biology of the amyloid beta-protein precursor and the mechanism of Alzheimer's disease, Annu Rev Cell Biol. 1994; 10: 373-403). Оба вида патологических изменений также часто наблюдают у пациентов с синдромом Дауна (трисомией 21), у которых также развиваются AD-подобные симптомы на ранних этапах жизни. Нейрофибриллярные клубки представляют собой внутриклеточные агрегаты ассоциированного с микротрубочками белка tau (МАРТ; microtubule-associated protein tau). Амилоидные бляшки возникают во внеклеточном пространстве, их основными компонентами являются Aβ-пептиды. Последние представляют собой группу протеолитических фрагментов, образованных от белка-предшественника β-амилоида (АРР; β-amyloid precursor protein) посредством серии стадий протеолитического расщепления. Идентифицировано несколько форм АРР, из которых наиболее широко представлены белки длиной 695, 751 и 770 аминокислот. Все они имеют происхождение от одного гена посредством дифференциального сплайсинга. Aβ-пептиды образованы из одного и того же домена АРР, но отличаются на их N- и С-концах, где основные виды молекул имеют длину 40 и 42 аминокислоты. Существует несколько направлений данных, которые позволяют с большой вероятностью предположить, что агрегированные Aβ-пептиды являются существенными молекулами в патогенезе AD: 1) амилоидные бляшки, формируемые Aβ-пептидами, составляют неизменную часть патологии AD; 2) Aβ-пептиды токсичны для нейронов; 3) при семейной форме болезни Альцгеймера (FAD; Familial Alzheimer's Disease) мутации в генах, обуславливающих это заболевание, АРР, PSN1, PSN2, приводят к повышенным уровням Aβ-пептидов и к раннему амилоидозу головного мозга; 4) у трансгенных мышей, которые экспрессируют такие гены FAD, развивается патология, которая имеет много сходств с заболеванием у человека. Aβ-пептиды вырабатываются из АРР посредством последовательного действия 2 протеолитических ферментов, называемых β- и γ-секретазой. Сначала β-секретаза отщепляет примерно 28 аминокислот во внеклеточном домене АРР снаружи от трансмембранного домена (ТМ; transmembrane domain) с образованием С-концевого фрагмента АРР, содержащего ТМ и цитоплазматический домен (CTFβ). CTFβ является субстратом для γ-секретазы, которая расщепляет его в нескольких соседних положениях внутри ТМ с образованием Аβ пептидов и цитоплазматического фрагмента. γ-Секретаза представляет собой комплекс, состоящий из по меньшей мере 4 различных белков, и ее каталитической субъединицей весьма вероятно является белок пресенилин (PSEN1, PSEN2). β-Секретаза (ВАСЕ1, Asp2; ВАСЕ обозначает β-сайт АРР-расщепляющего фермента) представляет собой аспартилпротеазу, заякоренную в мембране посредством трансмембранного домена (Vassar et al., Beta-secretase cleavage of Alzheimer's amyloid precursor protein by the transmembrane aspartic protease BACE, Science, 1999 Oct 22; 286(5440): 735). Она экспрессируется во многих тканях организма человека, но ее уровень особенно высок в ЦНС. Удаление гена ВАСЕ1 генетическими методами у мышей четко показала, что его активность существенна для процессинга АРР, приводящего к образованию Аβ-пептидов, в отсутствие ВАСЕ1 Аβ-пептиды не вырабатываются (Luo et al., Mice deficient in ВАСЕ1, the Alzheimer's beta-secretase, have normal phenotype and abolished beta-amyloid generation, Nat Neurosci. 2001 Mar;4(3):231-2, Roberds et al., BACE knockout mice are healthy despite lacking the primary beta-secretase activity in brain: implications for Alzheimer's disease therapeutics, Hum Mol Genet. 2001 Jun 1;10(12):1317-24). Мыши, у которых генно-инженерными методами получена экспрессия гена АРР человека, и у которых формируются обширные амилоидные бляшки и подобные болезни Альцгеймера патологические изменения при старении, этого не происходит при снижении активности β-секретазы в результате удаления генетическими методами одного из аллелей ВАСЕ1 (McConlogue et al., Partial reduction of BACE1 has dramatic effects on Alzheimer plaque and synaptic pathology in APP Transgenic Mice. J Biol Chem. 2007 Sep 7; 282(36): 26326). Следовательно, предполагают, что ингибиторы активности BACE1 могут быть полезными агентами для терапевтического вмешательства в болезнь Альцгеймера (AD). Подано несколько заявок на патенты, в которых описываются ингибиторы ВАСЕ 1 различных структур, например WO 2009103626, WO 2010128058, WO 2011020806, WO 2011029803, WO 2011069934, WO 2011070029, WO 2011138293, WO 2012019966, WO 2012028563, WO 2012098064, WO 2012104263, WO 2012107371, WO 2012110459, WO 2012119883, WO 2012126791, WO 2012136603, WO 2012139993, WO 2012156284, WO 2012163790, WO 2012168164, WO 2012168175, WO 2013004676, WO 2013041499, WO 2013110622, WO 2013174781, WO 2014001228, WO 2014114532, WO 2014150331, WO 2014150340 и WO 2014150344. Кроме того, в WO 2012139425 и WO 2013028670 описаны некоторые иминотиазины в качестве ингибиторов BACE1.
Кроме того, образование или образование и отложение β-амилоидных пептидов внутри, на поверхности или вокруг нервной ткани (например, головного мозга) ингибируется настоящими соединениями, то есть происходит ингибирование образования Аβ из APP или фрагмента APP.
В настоящем изобретении предложены новые соединения формулы I, их получение, лекарственные средства на основе соединений в соответствии с изобретением и их получение, а также применение соединений формулы I при контроле или профилактике заболеваний, таких как болезнь Альцгеймера.
Область изобретения
В настоящем изобретении предложены 1-метилимино-1-оксо-2Н-1,4-тиазин-амины, обладающие свойствами ингибиторов BACE1, их получение, содержащие их фармацевтические композиции и их применение в качестве терапевтически активных веществ.
Краткое изложение сущности изобретения
В настоящем изобретении предложено соединение формулы I,

где заместители и переменные являются такими, как описано ниже и в формуле изобретения, или его фармацевтически приемлемая соль.
Настоящие соединения обладают активностью ингибирования Asp2 (β-секретазы, ВАСЕ1 или мемапсина-2) и, следовательно, их можно применять при терапевтическом и/или профилактическом лечении заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидных бляшек и дополнительных отложений, в частности, болезни Альцгеймера.
Подробное описание изобретения
В настоящем изобретении предложено соединение формулы I и его фармацевтически приемлемые соли, получение указанных выше соединений, содержащие их лекарственные средства и их получение, а также применение указанных выше соединений в терапевтическом и/или профилактическом лечении заболеваний и расстройств, связанных с ингибированием ВАСЕ1, таких как болезнь Альцгеймера. Кроме того, образование или образование и отложение β-амилоидных бляшек внутри, на поверхности или вокруг нервной ткани (например, головного мозга) ингибируется настоящими соединениями, то есть происходит ингибирование образования Аβ из АРР или фрагмента АРР.
Приведенные ниже определения общих терминов, используемых в настоящем описании, применяют независимо от того, встречаются ли обсуждаемые термины отдельно или в сочетании с другими группами.
Если не указано иное, следующие термины, используемые в данном документе, включая описание и формулу изобретения, имеют приведенные ниже значения. Необходимо отметить, что при использовании в описании и прилагаемой формуле изобретения формы единственного числа включают в себя ссылки на множественное число, если контекст явным образом не требует иного.
Термин «C1-6-алкил», отдельно или в комбинации с другими группами, означает углеводородный радикал, который может быть нормальным или разветвленным, с одиночным или множественным разветвлением, где алкильная группа, как правило, содержит от 1 до 6 атомов углерода, например, метил (Me), этил (Et), пропил, изопропил (i-пропил), н-бутил, i-бутил (изобутил), 2-бутил (втор-бутил), t-бутил (трет-бутил), изопентил, 2-этил-пропил (2-метил-пропил), 1,2-диметил-пропил и т.п. Конкретным «C1-6-алкилом» является «C1-3-алкил». Определенными группами являются метил и этил. Наиболее определенной группой является метил.
Термин «галоген-С1-6-алкил» или «C1-6-алкил-галоген», отдельно или в комбинации с другими группами, относится к C1-6-алкилу, как определено в настоящем документе, замещенному одним или множественными атомами галогена, в частности, 1-5 атомами галогена, более конкретно 1-3 атомами галогена. Конкретным атомом галогена является атом фтора. Конкретным «галоген-C1-6-алкилом» является фтор-С1-6-алкил, а конкретным «галоген-С1-3-алкилом» является фтор-С1-3-алкил. Примерами являются трифторметил, дифторметил, фторметил и т.п. Конкретной группой является фторметил.
Термин «циано», отдельно или в комбинации с другими группами, относится к группе N≡C-(NC-).
Термин «галоген», отдельно или в комбинации с другими группами, означает атом хлора (Cl), йода (I), фтора (F) и брома (Br). Конкретным «галогеном» являются Cl, I и F. Конкретной группой является F.
Термин «гетероарил», отдельно или в комбинации с другими группами, относится к ароматической карбоциклической группе, имеющей единственное 4-8-членное, в частности, 5-8-членное кольцо или множественные конденсированные кольца, содержащие от 6 до 14, в частности, от 6 до 10 кольцевых атомов и содержащие 1, 2 или 3 гетероатома, отдельно выбранных из N, О и S, в частности, 1N или 2N, где по меньшей мере одно гетероциклическое кольцо в этой группе является ароматическим. Примеры «гетероарила» включают бензофурил, бензоимидазолил, 1Н-бензоимидазолил, бензооксазинил, бензоксазолил, бензотиазинил, бензотиазолил, бензотиенил, бензотриазолил, фурил, имидазолил, индазолил, 1H-индазолил, индолил, изохинолинил, изотиазолил, изоксазолил, оксазолил, пиразинил, пиразолил (пиразил), 1H-пиразолил, пиразоло[1,5-а]пиридинил, пиридазинил, пиридинил (пиридил), пиримидинил (пиримидил), пирролил, хинолинил, тетразолил, тиазолил, тиенил, триазолил и т.п. Примерами «гетероарильных» групп являются пиридил, пиразинил и имидазо[1,2-а]пиридинил. Примеры «5-членных гетероарильных групп» включают триазолил, тиенил, фурил, имидазолил, изотиазолил, изоксазолил, оксазолил, пиразолил (пиразил), 1Н-пиразолил, пирролил, тетразолил, тиазолил, триазолил и т.п. Конкретными «5-членными гетероарильными группами» являются изоксазолил и триазолил. Определенными «5-членными гетероарильными группами» являются изоксазол-5-ил, изоксазол-3-ил, триазол-1-ил и триазол-4-ил. Примеры «6-членных гетероарильных групп» включают пиразинил, пиридазинил, пиридинил и пиримидинил. Конкретными «6-членными гетероарильными группами» являются пиразинил, пиридинил и пиримидинил. Определенными «6-членными гетероарильными группами» являются пиразин-2-ил, пиридин-2-ил и пиримидин-2-ил.
Термин «фармацевтически приемлемые соли» относится к солям, приемлемым для применения в контакте с тканями людей и животных. Примерами приемлемых солей с неорганическими и органическими кислотами являются, без ограничений, соли с уксусной кислотой, лимонной кислотой, муравьиной кислотой, фумаровой кислотой, соляной кислотой, молочной кислотой, малеиновой кислотой, яблочной кислотой, метансульфоновой кислотой, азотной кислотой, фосфорной кислотой, пара-толуолсульфоновой кислотой, янтарной кислотой, серной кислотой (сернистой кислотой), винной кислотой, трифторуксусной кислотой и т.п. Конкретными кислотами являются муравьиная кислота, трифторуксусная кислота и соляная кислота. Определенной кислотой является трифторуксусная кислота.
Термин «амино», отдельно или в комбинации с другими группами, относится к группе -NH2.
Термин «гидроксил» или «гидроксил», отдельно или в комбинации с другими группами, относится к группе -ОН.
Термин «С2-6-алкинил-С1-6-алкокси», отдельно или в комбинации с другими группами, относится к C1-6-алкокси, как определено в настоящем документе, замещенному одной или множественными группами «С2-6-алкинил», как определено в настоящем документе, в частности, 1 группой С2-6-алкинил.
Термин «С2-6-алкинил», отдельно или в комбинации с другими группами, означает одновалентную нормальную или разветвленную насыщенную углеводородную группу из атомов углерода в количестве от 2 до 6, в частности, из атомов углерода в количестве от 2 до 4, и содержащую одну, две или три тройных связи. Примеры С2-6-алкинила включают этинил, пропинил и н-бутинил.
Термин «С1-6-алкокси-С1-6-алкил», отдельно или в комбинации с другими группами, относится к C1-6-алкилу, как определено в настоящем документе, замещенному одной или множественными группами «C1-6-алкокси», как определено в настоящем документе, в частности, 1 группой С1-6-алкокси. Конкретным «C1-6-алкокси-С1-6-алкилом» является метокси-С1-6-алкил. Примерами являются метоксиметил, метоксиэтил и т.п.
Термин «C1-6-алкокси», отдельно или в комбинации с другими группами, означает -O-C1-6-алкильный радикал, который может быть нормальным или разветвленным, с одиночным или множественным разветвлением, где алкильная группа, как правило, содержит от 1 до 6 атомов углерода, например, метокси (ОМе, МеО), этокси (OEt), пропокси, изопропокси (i-пропокси), н-бутокси, i-бутокси (изобутокси), 2-бутокси (втор-бутокси), t-бутокси (трет-бутокси), изопентилокси (i-пентилокси) и т.п. Конкретными группами «C1-6-алкокси» являются группы с атомами углерода в количестве от 1 до 4. Определенными группами являются этокси и метокси.
Термин «галоген-С1-6-алкокси», отдельно или в комбинации с другими группами, относится к C1-6-алкокси, как определено в настоящем документе, замещенному одним или множественными атомами галогена, в частности, атомами фтора. Конкретной группой «галоген-С1-6-алкокси» является группа фтор-C1-6-алкокси. Определенными группами «галоген-С1-6-алкокси» являются группы CHF2-CF2-CH2-O-, CHF2-O- и CF2-O-.
Термины «фармацевтически приемлемый носитель» и «фармацевтически приемлемое вспомогательное вещество» относятся к носителям и вспомогательным веществам, таким как разбавители или вспомогательные вещества, совместимые с другими ингредиентами препарата.
Термин «фармацевтическая композиция» включает в себя препарат, содержащий указанные ингредиенты в предопределенных количествах или долях, а также любой препарат, который получают в результате прямого или косвенного объединения указанных ингредиентов в указанных количествах. В частности, он включает препарат, содержащий один или более активных ингредиентов и необязательный носитель, содержащий инертные ингредиенты, а также любой препарат, полученный в результате прямого или косвенного объединения, комплексообразования или агрегации любых двух или более ингредиентов, либо диссоциации одного или более ингредиентов, либо других типов реакций или взаимодействий одного или более ингредиентов.
Термин «ингибитор» означает соединение, конкурирующее за связывание, уменьшающее или предотвращающее связывание конкретного лиганда с конкретным рецептором, либо уменьшающее ли предотвращающее ингибирование функции конкретного белка.
Термин «половинная максимальная ингибирующая концентрация» (IC50) означает концентрацию конкретного соединения, необходимую для получения 50% ингибирования биологического процесса in vitro. Значения IC50 можно логарифмически преобразовать в значения pIC50 (-log IC50), в которых более высокие значения указывают на экспоненциально более высокую эффективность. Значение IC50 не является абсолютной величиной, а зависит от экспериментальных условий, например, от используемых концентраций. Значение IC50 можно преобразовать в абсолютную константу ингибирования (Ki), используя уравнение Ченга-Прусоффа (Biochem. Pharmacol. (1973) 22:3099). Термин «константа ингибирования» (Ki) означает абсолютное сродство связывания конкретного ингибитора с рецептором. Ее измеряют, используя анализы конкурентного связывания, и она равна концентрации, при которой конкретный ингибитор занимал бы 50% рецепторов в отсутствии какого-либо конкурирующего лиганда (например, радиолиганда). Значения Ki можно логарифмически преобразовать в значения pKi (-log Ki), в которых более высокие значения указывают на экспоненциально более высокую эффективность.
«Терапевтически эффективное количество» означает количество соединения, которое при введении субъекту для лечения болезненного состояния является достаточным для осуществления такого лечения болезненного состояния. «Терапевтически эффективное количество» будет изменяться в зависимости от соединения, тяжести подлежащего лечению заболевания, возраста и относительного состояния здоровья пациента, пути и формы введения, усмотрения лечащего врача или ветеринара и от других факторов.
Термины «как определено в настоящем документе» и «как описано в настоящем документе» со ссылкой на переменную включают путем ссылки как широкое определение переменной, так и ее конкретные определения при их наличии.
Термины «обработка», «приведение в контакт» и «взаимодействие» по отношению к химической реакции означают добавление или смешивание двух или более реагентов в соответствующих условиях для получения указанного и/или желаемого продукта. Должно быть понятно, что реакция, приводящая к получению указанного и/или желаемого продукта, может необязательно быть результатом непосредственного объединения двух реагентов, которые были исходно добавлены, т.е. может существовать одно или более промежуточных соединений, которые образуются в смеси, в конечном счете, приводящей к образованию указанного и/или желаемого продукта.
Термин «ароматический» означает традиционную идею ароматичности, определенную в литературе, в частности, в номенклатуре ИЮПАК (IUPAC - Compendium of Chemical Terminology, 2nd, A.D. McNaught and A. Wilkinson (Eds)), Blackwell Scientific Publications, Oxford (1997).
Термин «фармацевтически приемлемое вспомогательное вещество» означает любой ингредиент, не обладающий терапевтической активностью и являющийся нетоксичным, такой как разрыхлители, связующие вещества, наполнители, растворители, буферы, тонические агенты, стабилизаторы, антиоксиданты, поверхностно-активные вещества или смазывающие вещества, используемые при получении фармацевтических препаратов.
В любом случае, когда в химической структуре присутствует хиральный атом углерода, подразумевают, что все стереоизомеры, связанные с этим хиральным атомом углерода, включены в объем данной структуры в виде чистых стереоизомеров, а также их смесей.
В изобретении также предложены фармацевтические композиции, способы применения и способы получения указанных выше соединений.
Все отдельные воплощения изобретения могут быть объединены.
В одном воплощении изобретения предложено соединение формулы I,
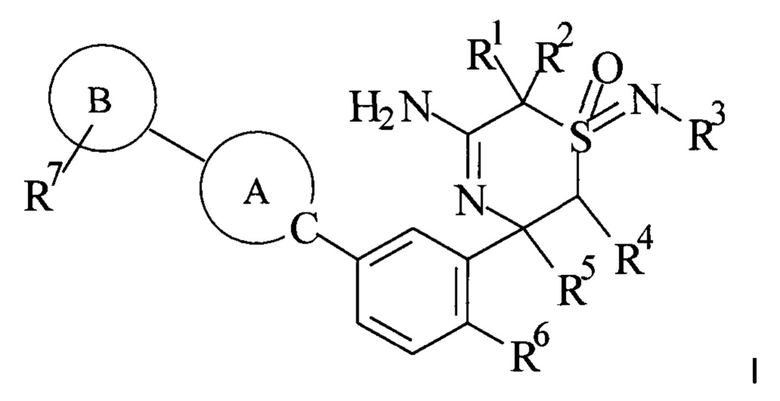
А представляет собой гетероарильную группу,
В представляет собой гетероарильную группу,
R1 выбран из группы, состоящей из
i) C1-6алкила и
ii) галоген-С1-6алкила;
R2 выбран из группы, состоящей из
i) C1-6алкила и
ii) галоген-С1-6алкила;
или R1 и R2 вместе с С-атомом, к которому они присоединены, образуют С3-6-циклоалкил-, где С3-6-циклоалкил- необязательно замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
R3 выбран из группы, состоящей из
i) атома водорода,
ii) С3-6циклоалкила;
iii) галоген-С1-6алкила и
iv) C1-6алкила;
R4 выбран из группы, состоящей из
i) атома водорода и
ii) C1-6алкила;
R5 выбран из группы, состоящей из
i) C1-6алкила и
ii) галоген-C1-6алкила;
R6 представляет собой атом галогена;
R7 выбран из группы, состоящей из
i) амино,
ii) циано,
iii) атома водорода,
iv) ОН,
v) атома галогена,
vi) С1-6алкила,
vii) С1-6-алкил-С3-6-циклоалкила,
viii) галоген-С1-6алкила,
ix) С1-6алкокси-С1-6алкила,
х) С2-6алкинила,
xi) С2-6алкинил-С1-6алкила,
xii) С2-6алкинил-С1-6алкокси,
xiii) C1-6алкокси и
xiv) галоген-С1-6алкокси;
или его фармацевтически приемлемые соли.
В определенном воплощении изобретения предложено соединение формулы I, где
А представляет собой гетероарильную группу,
В представляет собой гетероарильную группу,
R1 выбран из группы, состоящей из
i) C1-6алкила и
ii) галоген-С1-6алкила;
R2 выбран из группы, состоящей из
i) C1-6алкила и
ii) галоген-С1-6алкила;
или R1 и R2 вместе с С-атомом, к которому они присоединены, образуют С3-6-циклоалкил-, где С3-6-циклоалкил- необязательно замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
R3 выбран из группы, состоящей из
i) атома водорода,
ii) галоген-C1-6алкила и
iii) C1-6алкила;
R4 выбран из группы, состоящей из
i) атома водорода и
ii) C1-6алкила;
R5 выбран из группы, состоящей из
i) С1-6алкила и
ii) галоген-С1-6алкила;
R6 представляет собой атом галогена;
R7 выбран из группы, состоящей из
i) амино,
ii) циано,
iii) атома водорода,
iv) атома галогена,
v) C1-6алкила,
vi) галоген-С1-6алкила,
vii) С1-6алкокси-С1-6алкила,
viii) С2-6алкинила,
ix) С2-6алкинил-С1-6алкила,
х) С2-6алкинил-С1-6алкокси,
xi) C1-6алкокси и
xii) галоген-С1-6алкокси;
или его фармацевтически приемлемые соли.
В конкретном воплощении изобретения предложено соединение формулы I, представляющее собой соединение формулы Ia, где А, В, R1, R2, R3, R4, R5, R6 и R7 являются такими, как определено в настоящем документе,
 .
.
В определенном воплощении изобретения предложено соединение формулы I, как определено в настоящем документе, где А представляет собой 5-членную гетероарильную группу.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где А представляет собой изоксазолил или триазолил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где В представляет собой 6-членную гетероарильную группу.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где В представляет собой пиримидинил, пиразинил или пиридинил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R1 представляет собой C1-6-алкил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R1 представляет собой метил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R2 представляет собой C1-6-алкил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R2 представляет собой метил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R1 и R2 вместе с С-атомом, к которому они присоединены, образуют С3-6-циклоалкил-.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R1 и R2 вместе с С-атомом, к которому они присоединены, образуют циклопентил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R3 представляет собой C1-6-алкил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R3 представляет собой метил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R3 представляет собой Н, СН3, CD3, CH2CF3 или циклопропил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R4 представляет собой атом водорода.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R5 представляет собой C1-6-алкил или галоген-С1-6-алкил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R5 представляет собой метил или -CH2F.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R5 представляет собой метил.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R5 представляет собой -CH2F.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R6 представляет собой F.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R7 представляет собой Br, СН2-циклопропил, Cl, CN, Et, Me, OCH2CF2CHF2, OCH2CF3, OCH2CHF2, ОН или ОМе.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R7 выбран из группы, состоящей из циано, атома галогена, C1-6-алкокси и галоген-С1-6-алкокси.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где R7 выбран из группы, состоящей из атома хлора, циано, метокси и 2,2-дифторэтокси.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где А представляет собой 5-членную гетероарильную группу, В представляет собой 5-членную гетероарильную группу, R1 представляет собой метил, R2 представляет собой метил, R3 представляет собой метил, R4 представляет собой атом водорода, R5 представляет собой метил или -CH2F, R6 представляет собой F и R7 выбран из группы, состоящей из циано, атома галогена, С1-6-алкокси и галоген-С1-6-алкокси.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, где А выбран из группы, состоящей из изоксазолила и триазолила, В выбран из группы, состоящей из пиримидинила, пиразинила и пиридинила, R1 представляет собой метил, R2 представляет собой метил, R3 представляет собой метил, R4 представляет собой атом водорода, R5 представляет собой метил или -CH2F, R6 представляет собой F и R7 выбран из группы, состоящей из циано, атома галогена, С1-6-алкокси и галоген-С1-6-алкокси.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, которое выбрано из группы, состоящей из
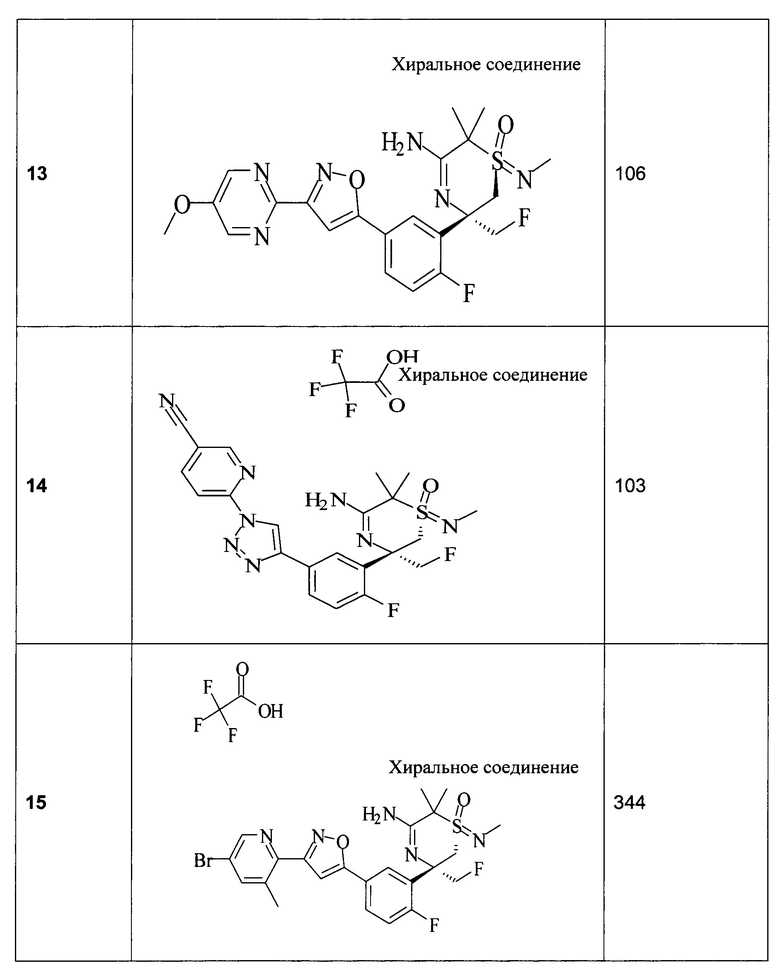
(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты,
(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1R,3R)-3-[2-фтор-5-[3-[5-(2,2,3,3-тетрафторпропокси)пиримидин-2-ил]изоксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1R,3R)-3-[5-[1-(5-хлор-2-пиридил)триазол-4-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты,
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты,
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-1-циклопропилимино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-6-амина 2,2,2-трифторацетата,
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-1-имино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты; 2,2,2-трифторацетата,
(1R,3R)-3-[5-[3-(5-этилпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1R,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиразин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты,
(1R,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиримидин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина,
(1R,3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-(2,2,2-трифторэтокси)пиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-гидроксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-1-имино-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(5-(3-(5-(циклопропилметокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3S)-3-[2-фтор-5-[3-(5-метоксипиримидин-2-ил)изоксазол-5-ил]фенил]-3-(фторметил)-6,6-диметил-1-метилимино-1-оксо-2H-1,4-тиазин-5-амина,
(1R,3S)-5-амино-3-(5-(1-(5-хлорпиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3S)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3S)-5-амино-3-(5-(3-(5-бром-3-метилпиридин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3S)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-1-имино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1S,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-1-имино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1S,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиримидин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина,
(1S,3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-1-(циклопропилимино)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3S)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3-(фторметил)-6,6-диметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты,
(1S,3S)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3-(фторметил)-6,6-диметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты,
(1S,3S)-5-амино-3-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида,
(6R,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетата,
(6R,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетата,
(6R,8R)-10-амино-8-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида,
(6R,8R)-10-амино-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетата,
(6S,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетата,
(6S,8R)-10-амино-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетата,
2-[5-[3-[(1R,3R)-5-амино-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-3-ил]-4-фтор-фенил]изоксазол-3-ил]пиримидин-5-карбонитрила; 2,2,2-трифторуксусной кислоты,
6-(4-(3-((1R,3S)-5-амино-3-(фторметил)-6,6-диметил-1-(метилимино)-1-оксидо-3,6-дигидро-2Н-1,4-тиазин-3-ил)-4-фторфенил)-1Н-1,2,3-триазол-1-ил)никотинонитрила 2,2,2-трифторацетата и
6-[4-[3-[(1R,3R)-5-амино-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-3-ил]-4-фтор-фенил]триазол-1-ил]пиридин-3-карбонитрила, 2,2,2-трифторуксусной кислоты.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, которое выбрано из группы, состоящей из
(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-метилимино-1-оксо-2H-1,4-тиазин-5-амина трифторацетата,
(1R,3R)-3-[5-[1-(5-хлор-2-пиридил)триазол-4-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина трифторацетата,
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина трифторацетата,
(1R,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиразин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина трифторацетата,
(1R,3S)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида трифторацетата,
(1R,3S)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида трифторацетата,
(1S,3S)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3-(фторметил)-6,6-диметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина трифторацетата,
(1S,3S)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3-(фторметил)-6,6-диметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина трифторацетата,
2-[5-[3-[(1R,3R)-5-амино-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-3-ил]-4-фтор-фенил]изоксазол-3-ил]пиримидин-5-карбонитрила трифторацетата и
6-[4-[3-[(1R,3R)-5-амино-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-3-ил]-4-фтор-фенил]триазол-1-ил]пиридин-3-карбонитрила трифторацетата.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, которое выбрано из группы, состоящей из
(1R,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиразин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты
(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты и
(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетата.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, которое выбрано из группы, состоящей из
(1R,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиразин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина трифторацетата,
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина трифторацетата и
(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина трифторацетата.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, представляющее собой (1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-метилимино-1-оксо-21-1-1,4-тиазин-5-амина трифторацетат.
В определенном воплощении изобретения предложено соединение формулы I, полученное способом, описанным в настоящем документе.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, для применения в качестве терапевтически активного вещества.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, для применения в качестве ингибитора активности ВАСЕ1.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, для применения в качестве терапевтически активного вещества для терапевтического и/или профилактического лечения заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидных бляшек и дополнительных отложений, или болезни Альцгеймера.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, для применения в качестве терапевтически активного вещества для терапевтического и/или профилактического лечения болезни Альцгеймера.
В определенном воплощении изобретения предложена фармацевтическая композиция, содержащая соединение формулы I, как описано в настоящем документе, и фармацевтически приемлемый носитель и/или фармацевтически приемлемое вспомогательное вещество.
В определенном воплощении изобретения предложено применение соединения формулы I, как описано в настоящем документе, для изготовления лекарственного средства для применения в качестве ингибитора активности ВАСЕ1.
В определенном воплощении изобретения предложено применение соединения формулы I, как описано в настоящем документе, для получения лекарственного средства для терапевтического и/или профилактического лечения заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидных бляшек и дополнительных отложений, или болезни Альцгеймера.
В определенном воплощении изобретения предложено применение соединения формулы I, как описано в настоящем документе, для получения лекарственного средства для терапевтического и/или профилактического лечения болезни Альцгеймера.
В определенном воплощении изобретения предложено применение соединения формулы I, как описано в настоящем документе, для получения лекарственного средства для терапевтического и/или профилактического лечения болезни Альцгеймера.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, для применения при ингибировании активности ВАСЕ1.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, для применения в терапевтическом и/или профилактическом лечении заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидными бляшками и дополнительными отложениями, или болезни Альцгеймера.
В определенном воплощении изобретения предложено соединение формулы I, как описано в настоящем документе, для применения в терапевтическом и/или профилактическом лечении болезни Альцгеймера.
В определенном воплощении изобретения предложен способ для применения в ингибировании активности ВАСЕ1, в частности, для терапевтического и/или профилактического лечения заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидных бляшек и дополнительных отложений или болезни Альцгеймера. включающий введение соединения формулы I, как описано в настоящем документе, человеку или животному.
В определенном воплощении изобретения предложен способ для применения в терапевтическом и/или профилактическом лечении болезни Альцгеймера, включающий введение соединения формулы I, как описано в настоящем документе, человеку или животному.
Кроме того, изобретение включает все оптические изомеры, т.е. диастереомеры, диастереомерные смеси, рацемические смеси, все их соответствующие энантиомеры и/или таутомеры, а также их сольваты, соединений формулы I.
Изобретение также включает различные дейтирированные формы различных соединений формулы I или их фармацевтически приемлемых солей. Каждый доступный атом водорода, присоединенный к атому углерода, может быть независимо замещен атомом дейтерия, в частности, группа СН3 может быть замещена группой CD3. Специалисту в данной области техники известно, как синтезировать дейтирированные формы соединений формулы I или их фармацевтически приемлемых солей.
Специалисту в данной области техники известно, что соединения формулы I могут существовать в таутомерной форме
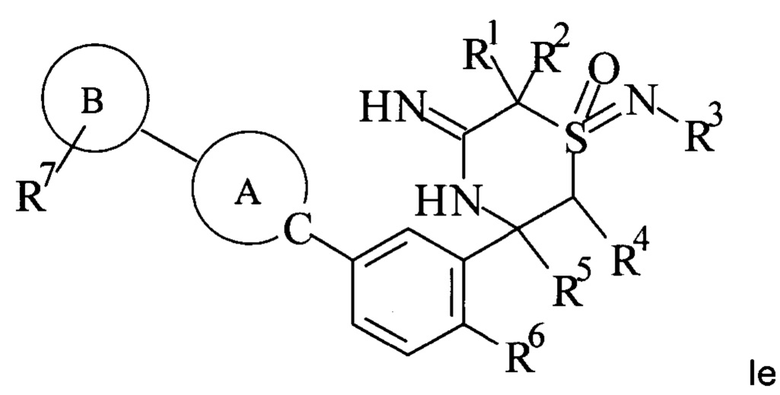 .
.
Все таутомерные формы включены в объем настоящего изобретения.
Соединения формулы I могут содержать один или более асимметрических центров, и могут, таким образом, встречаться в виде рацематов, рацемических смесей, отдельных энантиомеров, диастереомерных смесей и отдельных диастереомеров. В зависимости от природы различных заместителей на молекуле могут присутствовать дополнительные асимметрические центры. Из каждого такого асимметрического центра будут независимо образовываться два оптических изомера, и подразумевают, что все возможные оптические изомеры и диастереомеры в смесях и в виде чистых или частично очищенных соединений включены в данное изобретение. Подразумевают, что настоящее изобретение охватывает все такие изомерные формы этих соединений. Независимые варианты синтеза этих диастереомеров или их хроматографического разделения можно осуществить, как известно в данной области техники, путем соответствующей модификации методологии, раскрытой в настоящем документе. Их абсолютная стереохимия может быть определена с помощью рентгеновской хроматографии кристаллических продуктов или кристаллических промежуточных соединений, которые при необходимости преобразуют с помощью реагентов, содержащих асимметрический центр с известной абсолютной конфигурацией. При желании рацемические смеси соединений могут быть разделены таким образом, чтобы выделить отдельные энантиомеры. Разделение может быть проведено способами, хорошо известными в данной области техники, такими как сочетание рацемической смеси соединения с энантиомерно чистым соединением с образованием диастереомерной смеси с последующим разделением отдельных диастереомеров стандартными способами, такими как фракционная кристаллизация или хроматография.
В некоторых воплощениях изобретения находятся следующие определенные формы:
 ,
, 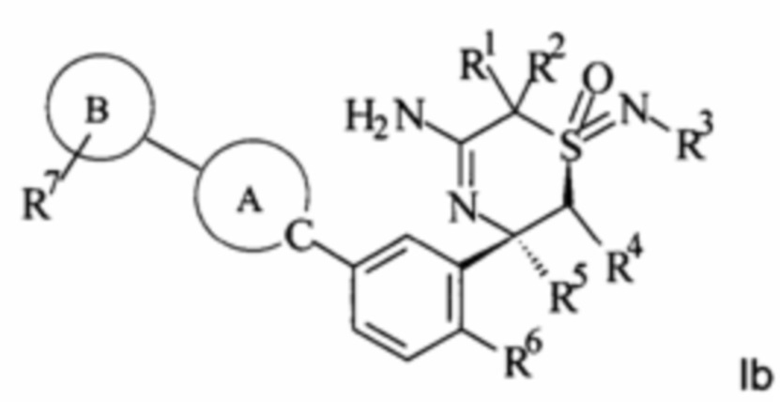 ,
,
 .
.
В тех воплощениях изобретения, где предложены оптически чистые энантиомеры, оптически чистый энантиомер означает, что соединение содержит более 90% желаемого изомера по массе, в частности, более 95% желаемого изомера по массе или более конкретно более 99% желаемого изомера по массе, причем, данный процент по массе основан на суммарной массе изомера (изомеров) соединения. Хирально чистые или хирально обогащенные соединения могут быть получены путем стереоселективного синтеза или путем разделения энантиомеров. Разделение энантиомеров может быть выполнено на конечном продукте или альтернативно на подходящем промежуточном соединении.
Синтез соединения формулы (I) проиллюстрирован на схеме 1.
Схема 1
LG: уходящая группа, например I, Br
PG: защитная группа, например ВОС, DMTr
R: алкил, например Me

Исходные вещества (II) известны или могут быть получены по аналогии с известными способами (например, описанными в публикации Bioorg. Med. Chem. Lett. 2013, 23, 4239-4243). Исходные вещества (III) известны или могут быть получены по аналогии с известными способами (например, описанными в документе WO 2014/150331). Исходное вещество (II) можно подвергать взаимодействию с сульфоксиимином (III) в присутствии сильного основания, например, гексаметилдисилазида щелочного металла, такого как гексаметилдисилазид лития, диизопропиламида щелочного металла, такого как диизопропиламид лития, или алкиллития, такого как н-бутиллитий, в безводных условиях в приемлемом апротонном растворителе, например в тетрагидрофуране или дихлорметане, с образованием соединения (IV) в виде смеси стереоизомеров. Отдельные стереоизомеры можно разделить на этом или на более позднем этапе путем хроматографии, и можно следовать пути, изображенному на схеме 1, аналогично использованию отдельных разделенных изомеров.
Сульфинамидная группировка (IV) может быть отщеплена минеральной кислотой, например серной кислотой или, в частности, соляной кислотой в растворителе, таком как простой эфир, например диэтиловый эфир, тетрагидрофуран или, более конкретно, 1,4-диоксан, с получением соответствующего амина (V). Впоследствии соединение (V) можно подвергать реакции замыкания цикла с амидинами (VI), используя способы, известные в данной области техники, например, используя стехиометрические количества солей меди (I), например хлорида меди (I) или бромида меди (I), в приемлемых растворителях, например спиртах, таких как этанол, при повышенных температурах, например от 20°С до 130°С, предпочтительно при температуре от 70°С до 90°С. Альтернативно это преобразование можно осуществить с использованием стехиометрических количеств кислоты Льюиса, такой как триметилалюминий, в приемлемом апротонном растворителе, таком как толуол.
Соединения (VI) могут быть преобразованы в соединения (VII), содержащие уходящую группу, такую как йодид или бромид, например, путем йодирования, используя йодирующий агент, такой как N-йодсукцинимид, в присутствии кислоты, такой как трифторметансульфоновая кислота или тетрафторборная кислота, в растворителе, таком как дихлорметан, при температуре от 0°С до температуры образования флегмы растворителя, или путем бромирования, используя бромирующий агент, такой как N-бромсукцинимид, в присутствии кислоты или смесей кислот, таких как трифторуксусная кислота и серная кислота. Защита аминогруппы в соединениях формулы (VII) с получением соединений формулы (VIII) может быть выполнена способами, известными в данной области техники, например, как описано в кн. Т.W. Greene and P.G. M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991. В том случае, когда защитная группа (PG) представляет собой трет-бутоксикарбонил (ВОС), преобразование можно осуществить путем обработки ди-трет-бутилдикарбонатом в растворителе, таком как дихлорметан, при температурах от 0°С до температуры образования флегмы растворителя. В том случае, когда PG представляет собой триарилметил, преобразование можно осуществить путем обработки триарилметилхлоридами, такими как трифенилметилхлорид (Tr-Cl), ди(пара-метоксифенил)фенилметилхлорид (DMTr-Cl), используя основные условия, например, в присутствии амина, такого как триэтиламин или диизопропилэтиламин, в хлорированном растворителе, таком как дихлорметан или хлороформ, при температурах от 0°С до температуры окружающей среды.
Сочетание по Соногашира концевых алкинов (IX) с соединениями формулы (VIII), в которых уходящая группа (LG) предпочтительно представляет собой йодид, с получением соединений формулы (X) можно осуществить с палладиевым катализатором, например, с бис(трифенилфосфин)палладия (II) хлоридом, сокатализатором соединением меди (I), например йодидом меди (I), и аминным основанием, например триэтиламином, в условиях, известных специалистам в данной области техники.
Удаление группы R3Si соединений (X) с получением концевых ацетиленов (XI) можно осуществить способами, хорошо известными в данной области техники, например, путем обработки фторидсодержащими реагентами, такими как тетрабутиламмония фторид, в растворителе, таком как дихлорметан или ТГФ, при температуре от 0°С до температуры окружающей среды, или путем обработки карбонатом калия в растворителе, таком как этанол или метанол, при температуре окружающей среды.
Преобразование ацетиленов (XI) в изоксазоны (XIII) можно осуществить путем 1,3-диполярного циклоприсоединения с системой реагентов, состоящей из гетероарил-карбоксимидоилхлорида (XII) и основания, такого как бикарбонат натрия или триэтиламин, в растворителе, таком как ТГФ или изопропанол, при температурах от 0°С до температуры образования флегмы растворителя.
Преобразование ацетиленов (XI) в триазолы (XV) можно осуществить путем катализируемого соединением меди (I) циклоприсоединения с гетероарилазидами (XIV), используя либо реагент меди (I), такой как CuI, либо комплекс трифторметансульфоната меди (I) с бензолом, либо реагент меди (II), такой как CuSO4, в присутствии восстанавливающего агента, такого как аскорбат натрия, и основания, такого как NaHCO3, в растворителе или смеси растворителей, таких как толуол, ТГФ или ДМФ, при температуре от температуры окружающей среды до температуры образования флегмы растворителя.
Удаление амин-защитной группы PG в соединениях (XIII) и соединениях (XV) с получением соединений формулы (I) можно осуществить способами, хорошо известными в данной области техники, например, путем обработки сильными карбоновыми кислотами, например трифторуксусной кислотой, в растворителе, например в дихлорметане, при температурах от 0°С до 23°С. Продукт формулы (I) можно выделить либо в виде соли, например в виде соли трифторуксусной кислоты, либо в виде свободного основания. Свободное основание соединений формулы (I) может быть получено из соответствующих солей путем обработки основанием и при желании может быть преобразовано в соль с другой кислотой путем обработки соответствующей кислотой.
Схема 2

Гетероарил-карбоксимидоилхлориды (XII) известны или могут быть получены по аналогии со способами, известными в данной области техники, или используя способы, проиллюстрированные на схеме 2. Гетероарилнитрилы (XVI) могут быть преобразованы в гетероариламидоксимы (XVII) путем обработки гидроксиламином или солью гидроксиламина, такой как гидрохлорид гидроксиламина, в присутствии основания, такого как гидроксид натрия или триэтиламин, в растворителе или в смеси растворителей, таких как вода и этанол, при температурах от 0°С до температуры образования флегмы растворителя. Преобразование соединений (XVII) в гетероарил-карбоксимидоилхлориды (XII) может быть выполнено путем реакции типа реакции Сандмейера обработкой нитритом, таким как нитрит натрия, в присутствии водного раствора соляной кислоты, предпочтительно при температуре ниже 10°С.
Схема 3
LG: уходящая группа, например I, Br
PG: защитная группа, например ВОС, DMTr
М: производное металла, например B(OH)2, B(pin), B(MDA)

На схеме 3 изображен альтернативный синтез соединений формулы (I): соединения (VIII), содержащие уходящую группу, такую как I или Br, можно подвергать сочетанию с производными металлов, такими как бороновые кислоты или сложные эфиры бороновых кислот (XVIII), используя хорошо известные условия реакции кроссочетания. В частности, сочетание соединений (VIII) с бороновой кислотой или сложным эфиром бороновой кислоты (XVIII) с получением соединения формулы (XIX) может быть выполнено с ферроценовым катализатором, в частности, с комплексом 1,1'-бис(дифенилфосфино)-ферроцен-палладия (II) дихлорида с дихлорметаном, и карбонатом металла, в частности, с карбонатом цезия, в смеси растворителей простого эфира и воды, в частности, ТГФ и воды, при повышенной температуре, в частности, при 80-90°С.
Удаление амин-защитной группы PG с получением соединений формулы (I) можно осуществить способами, хорошо известными в данной области техники, например, путем обработки сильными карбоновыми кислотами, например трифторуксусной кислотой, в растворителе, например в дихлорметане, при температурах от 0°С до 23°С. Продукт формулы (I) можно выделить либо в виде соли, например в виде соли трифторуксусной кислоты, либо в виде свободного основания. Свободное основание соединений формулы (I) может быть получено из соответствующих солей путем обработки основанием и при желании может быть преобразовано в соль с другой кислотой путем обработки соответствующей кислотой.
Соответствующие фармацевтически приемлемые соли с кислотами могут быть получены стандартными способами, известными специалистам в данной области техники, например, путем растворения соединения формулы I в подходящем растворителе, таком как, например, диоксан или ТГФ, и добавления необходимого количества соответствующей кислоты. Продукты могут быть обычно выделены путем фильтрования или путем хроматографии. Преобразование соединения формулы I в фармацевтически приемлемую соль с основанием может быть выполнено путем обработки такого соединения таким основанием. Одним из возможных способов образования такой соли является, например, добавление 1/n эквивалентов основной соли, такой как, например, M(OH)n, где М - катион металла или аммония и n - число анионов гидроксида, к раствору соединения в подходящем растворителе (например, в этаноле, в смеси этанол-вода, в смеси тетрагидрофуран-вода) и удаление растворителя путем выпаривания или лиофилизации. Конкретными солями являются гидрохлорид, формиат и трифторацетат. Определенным является трифторацетат.
В том случае, если их получение не описано в примерах, соединения формулы I, а также все промежуточные продукты могут быть получены аналогичными способами или способами, раскрытыми в данном описании. Исходные вещества имеются в продаже, известны в данной области техники или могут быть получены способами, известными в данной области техники, или по аналогии с ними.
Должно быть понятно, что соединения, имеющие общую формулу I, по данному изобретению могут быть дериватизированы по функциональным группам с получением производных, способных к обратному преобразованию в исходное соединение in vivo.
Фармакологические тесты
Соединения формулы I и их фармацевтически приемлемые соли обладают ценными фармакологическими свойствами. Обнаружено, что соединения по настоящему изобретению связаны с ингибированием активности ВАСЕ1. Эти соединения были исследованы в соответствии с тестом, приведенным ниже.
Клеточный анализ снижения Аβ
Для этого анализа можно использовать набор реагентов Abeta 40 AlphaLISA. Клетки эмбриональной почки человека (HEK) 293, экспрессирующие АРР, высевали в 96-луночные микротитрационные планшеты в питательной среде для клеточных культур (среда Исков с добавлением 10% (об./об.) фетальной бычьей сыворотки, пенициллина/стрептомицина) до около 80% конфлюэнтности и добавляли соединения в 3-кратной (3х) концентрации в 1/3 объема питательной среды (конечную концентрацию диметилсульфоксида (ДМСО) поддерживали при 1% об./об.). После 18-20 ч инкубации при 37°С и 5% CO2 в увлажненном инкубаторе супернатанты культуры собирали для определения концентраций Аβ40 с использованием набора реагентов высокой специфичности для определения амилоида бета 1-40 человека от компании Perkin-Elmer (№ по каталогу AL275C).
В планшетах White Optiplate-384 от компании Perkin-Elmer (№ по каталогу 6007290) объединяли 2 мкл супернатантов культуры с 2 мкл 10× смеси акцепторных гранул с антителом к Аβ человека (hAβ) (Acceptor AlphaLISA) и биотинилированного антитела к Aβ1-40 (50 мкг/мл/5 нМ). После 1-часовой инкубации при комнатной температуре добавляли 16 мкл 1,25× препарата донорных гранул со стрептавидином (SA) (25 мкг/мл) и инкубировали в течение 30 минут в темноте. Затем регистрировали испускание света при 615 нм, используя считывающее устройство EnVision-Alpha. Уровни Аβ40 в супернатантах культуры рассчитывали в виде процентной доли максимального сигнала (клетки, обработанные 1% ДМСО без ингибитора). Значения IC50 рассчитывали с использованием программного обеспечения Excel XLfit.
Снижение уровня Аβ40 в головном мозге мышей дикого типа
Животные и условия содержания. Животных содержали при световом цикле 12 ч свет/12 ч темнота, при этом светлый цикл начинался в 6 часов утра, и эксперименты проводили в светлой фазе. Содержание животных и методики проведения экспериментов соответствовали этическим и законодательным руководствам и были разрешены местными ветеринарными регулирующими органами.
Эксперимент. Самкам мышей C57BI/6J вводили соединения в дозе 30 мг/кг, 3-4 животных на экспериментальную группу. Исследуемое соединение растворяли в смеси 5% EtOH, 10% солютола и применяли внутрь в объеме 10 мл/кг. Через 4 ч животных умерщвляли и собирали головной мозг и плазму крови. Головной мозг разрезали пополам и немедленно замораживали на сухом льду. Головной мозг использовали для количественного определения Аβ40, а плазму крови использовали для определения экспозиции соединения. Способ определения Аβ40 в лизатах головного мозга соответствовал известной методике (Lanz, Т.А.; Schachter, J.В. Demonstration of a common artifact in immunosorbent assays of brain extracts: development of a solidphase extraction protocol to enable measurement of amyloid-β from wild-type rodent brain. J. Neurosci. Methods 2006, 157, 71-81.). Ткань головного мозга гомогенизировали в буферном 2% растворе диэтаноламина (DEA) в гомогенизаторе Roche MagnaLyser (20'', 4000 об/мин) и впоследствии центрифугировали в течение 1 ч при 100000g. Концентрацию DEA уменьшали до 0,2% в 50 мМ NaCl, и половину лизата в DEA пропускали через пластину для твердофазной экстракции Oasis Solid (Waters; № по каталогу 186000679), активированную МеОН и уравновешенную в dH2O (1 мл каждого вещества). После промывания в 10% и 30% МеОН (1 мл каждого) пептиды Аβ элюировали в 0,8 мл 2% NH4OH в 90% МеОН. Элюат высушивали в потоке N2, и высушенный образец восстанавливали в 30 мкл аналитического буфера AlphaLISA. Aβ40 определяли с помощью набора реагентов AlphaLISA (Perkin-Elmer). В белом 96-луночном микропланшете с половинным объемом лунок (Perkin-Elmer № по каталогу 6005561) 20 мкл восстановленного образца смешивали с 5 мкл биотинилированного антитела ВАР-24 (специфичного к С-концу Aβ40) (Brockhaus, M.; Grunberg, J.; Rohrig, S.; Loetscher, H.; Wittenburg, N.; Baumeister, R.; Jacobsen, H.; Haass, C. Caspasemediated cleavage is not required for the activity of presenilins in amyloidogenesis and NOTCH signaling. NeuroReport 1998, 9, 1481-1486), исходный раствор равен 4,4 мг/мл, конечная концентрация 5,5 мкг/мл) и 5 мкл акцепторных гранул 252Q6 (антитело 252Q6, Invitrogen AMB0062), предварительно конъюгированное с акцепторными гранулами AlphaLISA (Perkin-Elmer, № по каталогу 6772002); конечное разведение 1:500). Смесь инкубировали в течение 1 ч при комнатной температуре (КГ) в темноте. Затем добавляли 20 мкл донорных гранул, покрытых стрептавидином (Perkin-Elmer № по каталогу 6760002, конечное разведение 1:125), и конечную смесь инкубировали в темноте еще в течение 30 мин при КГ, после чего измеряли флуоресценцию в относительных единицах флуоресценции (RFU) в считывающем устройстве AlphaScreen (Perkin-Elmer Envision 2104). Значение, полученное для Aβ40 у экспериментальных животных, соотносили со значением, полученным для группы, получавшей носитель, и приводили в виде процентной доли (%). Альтернативно для определения Ab40 использовали коммерческий набора реагентов для твердофазного иммуносорбентного анализа (ELISA) (Wako ELISA: (набор реагентов для ELISA для определения β амилоида (40) человека/крысы Wako II; № по каталогу 294-64701), следуя инструкциям производителя. Эффективность снижения Ab в данном случае также рассчитывали в виде процентной доли от его содержания в группе, получавшей носитель.








Анализ ингибирования CYP
Ингибирование цитохромов Р450 (CYP) 2C9, 2D6 и 3А4 оценивали с использованием микросом печени человека и реакции метаболизма CYP-селективного субстрата. Инкубации проводили в объеме 50 мкл, и смеси содержали (конечная концентрация) 0,2 мг/мл пула микросом печени человека, 5 мкм субстрата (диклофенака для CYP2C9 [4'-гидроксилазы], декстрометорфана CYP2D6 [O-деметилазы] или мидазолама для CYP3A4 [1'-гидроксилазы]), 0,25 мкл ДМСО, содержащего исследуемый ингибитор и регенерирующую систему никотинамиддифосфата-Н (НАДФ-Н). Проводили оценку концентраций исследуемого ингибитора 50, 16,7, 5,6, 1,9, 0,6 и 0,2 мкМ в одной повторности. Смеси для инкубации подогревали до 37°С в течение 10 минут, после чего реакцию инициировали добавлением регенерирующей системы НАДФ-Н. Инкубационные смеси гасили через 5 минут (20 минут для декстрометорфана) добавлением 50 мкл холодного ацетонитрила, содержащего 20 нг/мл 4-OH-диклoфeнaк-13C6, 20 нг/мл дектрорфана-D3 и 20 нг/мл 1-ОН-мидазолама-D4. Погашенные проинкубированные смеси хранили при -20°С в течение по меньшей мере 1 часа до центрифугирования (20000xg, 20 минут). Супернатанты отбирали и разводили 1:1 водой, после чего анализировали, используя систему для ввода образца RapidFire и масс-спектрометр API4000. Площади пика для субстрата, метаболита и стабильно меченого стандарта метаболита определяли, используя тандемную масс-спектрометрию (МС/МС). В последующих расчетах использовали отношения площади пика между метаболитом, образованным в результате ферментативной реакции, и внутренним стандартом. Для каждой проинкубированной смеси рассчитывали процентную долю от контрольной активности (в ДМСО) и проводили оценку значений IC50 методом нелинейной регрессии. В каждом эксперименте по ингибированию CYP2C9, CYP2D6 или CYP3A4 соответственно проверяли сульфафеназол, хинидин или кетоконазол для гарантии чувствительности и воспроизводимости анализа. (Validated assays for human cytochrome P450 activities, R.L. Walsky and R.S. Obach, Drug Metabolism and Disposition 32: 647-660, 2004. and S. Fowler and H. Zhang, The AAPS Journal, Vol. 10, No. 2, 410-424, 2008)
Анализ кинетики флуоресцентного субстрата катепсина D и катепсина Е
Общий принцип анализа
Флуоресцентные анализы MR121, описанные ниже, основаны на том факте, что MR121 образует комплекс с триптофаном в основном состоянии в отсутствие флуоресценции. В растворе образование этого комплекса происходит при миллимолярных концентрациях триптофана. Этот механизм можно использовать для разработки общего биохимического анализа для протеаз. Пептидный субстрат метят по N-концу триптофаном и по С-концу флуорофором MR121 (для катепсина D использовали 10-аминокислотный пептид WTSVLMAAPC-MR121; для катепсина Е использовали MR121-CKLVFFAEDW). В отсутствие протеазной активности субстраты остаются интактными, и флуоресценция MR121 снижается высокой локальной концентрацией Trp. Если субстраты расщепляются ферментами, флуоресценция MR121 восстанавливается.
Методика анализа
Кинетические анализы флуоресцентных субстратов катепсина D и катепсина Е проводили при комнатной температуре в 384-луночных микротитрационных планшетах (черных планшетах с прозрачным плоским дном и с несвязывающей поверхностью от компании Corning) в конечном объеме 51 мкл. Исследуемые соединения серийно разводили в ДМСО (15 концентраций, стадии разведения 1/3), и 1 мкл разведенных соединений смешивали в течение 10 мин с 40 мкл катепсина D (из печени человека, Calbiochem), разведенного в аналитическом буфере (100 мМ ацетат натрия, 0,05% БСА, рН 5,5; конечная концентрация: 200 нМ) или с 40 мкл рекомбинантного катепсина Е человека (R&D Systems), разведенного в аналитическом буфере (100 мМ ацетат натрия, 0,05% БСА, рН 4,5; конечная концентрация: 0,01 нМ). После добавления 10 мкл субстрата катепсина D WTSVLMAAPC-MR121, разведенного в аналитическом буфере катепсина D (конечная концентрация: 300 нМ) или 10 мкл субстрата катепсина Е MR121-CKLVFFAEDW, разведенного в аналитическом буфере катепсина Е (конечная концентрация: 300 нМ), планшеты сильно встряхивали в течение 2 минут. Ферментативную реакцию наблюдали в планшете: считывающее устройство видимого света (Perkin Elmer) (длина волны возбуждения: 630 нм; испускания: 695 нм) в течение по меньшей мере 30 минут при кинетическом измерении обнаруживает повышение флуоресценции MR121 в течение периода реакции. Рассчитывали наклон линейного диапазона кинетики, и IC50 исследуемых соединений определяли, используя четырехпараметрическое уравнение для приведения в соответствие с кривой.
Эксперименты по транспорту in vitro
(Двунаправленный трансцеллюлярный транспорт с использованием клеток LLC-PK1 и L-MDR1 LLC-PK1, экзогенно экспрессирующих MDR1 человека)
Способ, используемый для экспериментов по транспорту, описан в публикациях Schwab D, Schrag P, Portmann R,  S. Operation procedure: LLC-PK1 cell lines, parental and transfected with human (MDR1) or mouse (mdr1a) Pglycoprotein to study transcellular transport by P-glycoprotein. Report No. 1008708. 01 июля 2002 г., и Schwab D, Schrag P, Portmann R. Validation report on in vitro P-glycoprotein transport of 16 reference compounds in LLC-PK1 cells (parental) and MDR1 or mdr1a (Mouse multidrug resistance protein 1a) transfected LLC-PK1 cells and correlation to in vivo brain penetration in mice). Эксперименты проводили на автоматизированной системе транспорта жидкостей от компании TECAN. Кратко, питательную среду извлекали из всех компартментов, и среду приемной стороны заменяли питательной средой для культивирования. Измерения трансцеллюлярного транспорта инициировали добавлением субстрата вместе с внеклеточным маркером Lucifer yellow на донорной стороне. Ингибиторы (1 мкМ элакридар) добавляли с обеих сторон. Эксперименты по транспорту проводили как в базолатерально-апикальном, так и в апикально-базолатеральном направлении, по 3 лунки на каждое. Планшеты инкубировали при 37°С и 5% CO2 в инкубаторе Liconic. Образцы отбирали с донорной и с противоположной (акцепторной) стороны после 2 часов инкубации. Концентрации субстрата в обоих компартментах определяли с помощью сцинтилляционного счета (дигоксин) или с помощью жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ-МС/МС). Внеклеточный маркер (Lucifer yellow) количественно определяли, используя считывающее устройство Spectrafluor plus при 430/535 нм (Ex/Em). В каждом эксперименте использовали 3 различные вставки для каждого условия и вычисляли среднее значение.
S. Operation procedure: LLC-PK1 cell lines, parental and transfected with human (MDR1) or mouse (mdr1a) Pglycoprotein to study transcellular transport by P-glycoprotein. Report No. 1008708. 01 июля 2002 г., и Schwab D, Schrag P, Portmann R. Validation report on in vitro P-glycoprotein transport of 16 reference compounds in LLC-PK1 cells (parental) and MDR1 or mdr1a (Mouse multidrug resistance protein 1a) transfected LLC-PK1 cells and correlation to in vivo brain penetration in mice). Эксперименты проводили на автоматизированной системе транспорта жидкостей от компании TECAN. Кратко, питательную среду извлекали из всех компартментов, и среду приемной стороны заменяли питательной средой для культивирования. Измерения трансцеллюлярного транспорта инициировали добавлением субстрата вместе с внеклеточным маркером Lucifer yellow на донорной стороне. Ингибиторы (1 мкМ элакридар) добавляли с обеих сторон. Эксперименты по транспорту проводили как в базолатерально-апикальном, так и в апикально-базолатеральном направлении, по 3 лунки на каждое. Планшеты инкубировали при 37°С и 5% CO2 в инкубаторе Liconic. Образцы отбирали с донорной и с противоположной (акцепторной) стороны после 2 часов инкубации. Концентрации субстрата в обоих компартментах определяли с помощью сцинтилляционного счета (дигоксин) или с помощью жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ-МС/МС). Внеклеточный маркер (Lucifer yellow) количественно определяли, используя считывающее устройство Spectrafluor plus при 430/535 нм (Ex/Em). В каждом эксперименте использовали 3 различные вставки для каждого условия и вычисляли среднее значение.
Анализ данных
Двунаправленный трансцеллюлярный транспорт с использованием клеток LLC-PK1 и L-MDR1
Для оценки данных по трансцеллюлярному транспорту использовали следующее уравнение:
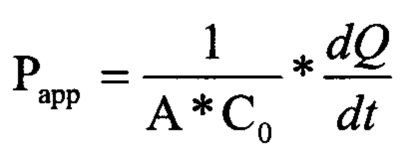
где Рарр, А, С0 и dQ/dt представляют собой кажущуюся проницаемость, площадь поверхности фильтра, исходную концентрацию и количество, транспортируемое за период времени, соответственно. Значения Рарр вычисляли на основании единственной временной точки (2 ч).
Значения отношения транспорта к эффлюксу (ER) рассчитывали следующим образом: 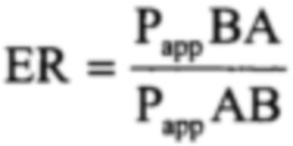
где РаррВА представляет собой значение проницаемости в базолатерально-апикальном направлении, и РаррАВ представляет собой значение проницаемости в апикально-базолатеральном направлении. Корректировку значения Рарр по току внеклеточного матрикса Lucifer yellow, используемого для оценки качества монослоев клеток, не проводили.
Результаты

Таблица 2: Фармакологические данные, NF - значимое количество аддукта по сравнению с контролем не образуется in vitro, A - образуется менее 60% от контроля при дозе 30 мг/кг на мышь, В - образуется менее 90% от контроля при дозе 30 мг/кг на мышь, С - IC50 более 10 мкМ
Фармацевтические композиции
Соединения формулы (I) и их фармацевтически приемлемые соли можно применять в качестве терапевтически активных веществ, например, в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение можно, однако, также выполнять ректально, например, в форме суппозиториев, или парентерально, например, в форме инъекционных растворов.
Соединения формулы I и их фармацевтически приемлемые соли можно обрабатывать с фармацевтически инертными, неорганическими или органическими носителями для приготовления фармацевтических препаратов. Лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и тому подобное можно использовать, например, в качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Тем не менее в зависимости от природы активного вещества в случае мягких желатиновых капсул носители обычно не требуются. Подходящими носителями для приготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и т.п. Подходящими носителями для суппозиториев являются, например, натуральные или отвержденные масла, виды воска, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать фармацевтически приемлемые вспомогательные вещества, такие как консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для варьирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать другие терапевтически ценные вещества.
В настоящем изобретении также предложены лекарственные средства, содержащие соединения формулы I или их фармацевтически приемлемые соли и терапевтически инертный носитель, а также способ их получения, включающий приведение одного или более соединений формулы I и/или их фармацевтически приемлемых солей и при желании одного или более из других терапевтически ценных веществ в галенову форму введения вместе с одним или более терапевтически инертных носителей.
Дозировка может варьировать в широких пределах и, конечно, ее приходится корректировать в соответствии с индивидуальными потребностями в каждом конкретном случае. В случае перорального введения доза для взрослых может варьировать от приблизительно 0,01 мг до приблизительно 1000 мг соединения общей формулы I в сутки или соответствующего количества его фармацевтически приемлемой соли. Суточную дозу можно вводить в виде однократной дозы или в разделенных дозах и, кроме того, верхний предел может быть также превышен, если обнаружены показания к этому.
Приведенные ниже примеры иллюстрируют настоящее изобретение без его ограничения и служат исключительно как репрезентативные. Фармацевтические препараты обычно содержат примерно 1-500 мг, в частности, 1-100 мг соединения формулы I. Примерами композиций в соответствии с изобретением являются:
Пример А
Таблетки следующей композиции готовили обычным способом:
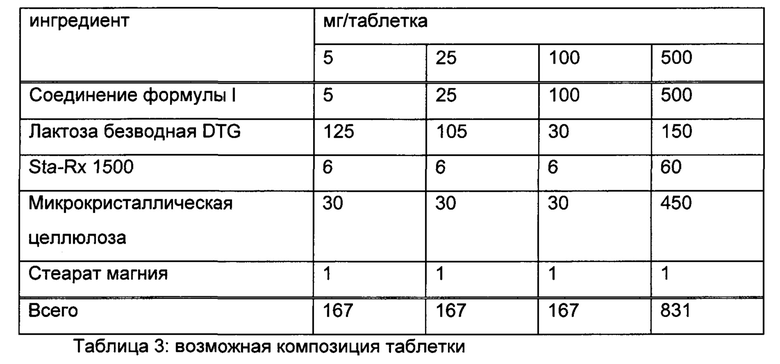
Методика изготовления
1. Смешивают ингредиенты 1, 2, 3 и 4 и гранулируют с очищенной водой.
2. Гранулы высушивают при 50°С.
3. Пропускают гранулы через подходящее оборудование для измельчения.
4. Добавляют ингредиент 5 и смешивают в течение трех минут; прессуют на подходящем прессе.
Пример В-1
Готовят капсулы следующей композиции:
Методика изготовления
1. Смешивают ингредиенты 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют ингредиенты 4 и 5 и смешивают в течение 3 минут.
3. Заполняют в подходящую капсулу.
Сначала соединение формулы I, лактозу и кукурузный крахмал смешивают в смесителе, а затем в измельчителе. Смесь возвращают в смеситель; добавляют к ней тальк и тщательно смешивают. Смесь заполняют с помощью аппарата в подходящие капсулы, например в твердые желатиновые капсулы.
Пример В-2
Готовят мягкие желатиновые капсулы следующей композиции:


Методика изготовления
Соединение формулы I растворяют в теплом расплаве остальных ингредиентов, и смесь заполняют в мягкие желатиновые капсулы соответствующего размера. Заполненные мягкие желатиновые капсулы обрабатывают в соответствии с обычными методиками.
Пример С
Готовят суппозитории следующей композиции:

Методика изготовления
Суппозиторную массу плавят в стеклянном или стальном сосуде, тщательно смешивают и охлаждают до 45°С. После этого к ней добавляют тонкоизмельченное соединение формулы I и перемешивают до его полного диспергирования. Смесь заливают в формы для суппозиториев подходящего размера, оставляют до охлаждения; затем суппозитории извлекают из форм и упаковывают каждый отдельно в вощеную бумагу или металлическую фольгу.
Пример D
Готовят инъекционные растворы следующей композиции:

Методика изготовления
Соединение формулы I растворяют в смеси полиэтиленгликоля 400 и воды для инъекций (часть). Доводят рН до 5,0 уксусной кислотой. Объем доводят до 1,0 мл добавлением остального количества воды. Раствор фильтруют, заполняют во флаконы с использованием допустимого избытка и стерилизуют.
Пример Е
Готовят пакетики-саше следующей композиции:

Методика изготовления
Соединение формулы I смешивают с лактозой, микрокристаллической целлюлозой и натриевой солью карбоксиметилцеллюлозы и гранулируют со смесью поливинилпирролидона в воде. Гранулят смешивают со стеаратом магния, добавляют добавки корригентов и заполняют в пакетики-саше.
Экспериментальный раздел
Следующие примеры приведены для иллюстрации изобретения. Их не следует считать ограничивающими объем изобретения, а исключительно репрезентативными.
Экспериментальный раздел
Синтез промежуточных соединений
Промежуточные соединения I1А и I1В
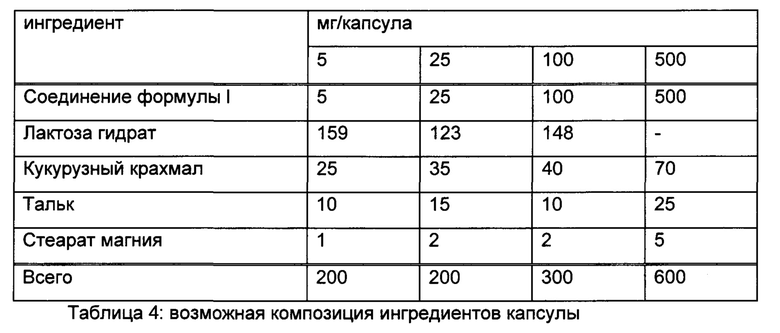
2-((S,2S)-2-Амино-3-фтор-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил (I1А) и 2-((R,2S)-2-амино-3-фтор-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил (I1В)

Стадия 1: (R)-N-(2-фтор-1-(2-фторфенил)этилиден)-2-метилпропан-2-сульфинамид (CAS №1404337-92-3, 2,8 г) и 2-(N,S-диметилсульфонимидоил)-2-метилпропаннитрил (CAS №1629090-52-3, 2,6 г) растворяли в тетрагидрофуране (65 мл) и охлаждали до -75°С. Добавляли по каплям бис(триметилсилил)амид лития (1,0 М в ТГФ/этилбензол, 16,2 мл), и смесь перемешивали в течение 4 ч при -75°С. После добавления полуконцентрированного водного раствора хлорида аммония охлаждающую баню удаляли, и перемешивание продолжали в течение 10 мин. Смесь экстрагировали EtOAc, высушивали над сульфатом натрия, фильтровали и концентрировали до сухого состояния. Неочищенное вещество очищали флэш-хроматографией (силикагель, от 0% до 100% EtOAc в н-гептане) с получением (R)-N-((2S)-1-(2-циано-N-метилпропан-2-илсульфонимидоил)-3-фтор-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамида (1,05 г, смесь эпимеров) в виде желтого вязкого масла. МС: m/z равно 420,2 [М+Н]+.
Стадия 2: (R)-N-((2S)-1-(2-циано-N-метилпропан-2-илсульфонимидоил)-3-фтор-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (1,0 г, смесь эпимеров) растворяли в МеОН (9,8 мл) и охлаждали до 0-5°С. После добавления HCl (4 М в диоксане, 1,79 мл) смесь перемешивали в течение 3 ч при 0-5°С и перемешивали в течение ночи при 4°С. Реакционную смесь наливали в водный насыщенный раствор бикарбоната натрия и экстрагировали 3 раза дихлорметаном. Органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Неочищенное вещество очищали флэш-хроматографией (силикагель, от 0% до 100% EtOAc в н-гептане) с получением изомера первого элюирования 2-((S,2S)-2-амино-3-фтор-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрила (211 мг) в виде светло-желтого вязкого масла, МС: m/z равно 316,1 [М+Н]+ и изомера второго элюирования 2-((R,2S)-2-амино-3-фтор-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрила (296 мг) в виде светло-желтого вязкого масла, МС: m/z равно 316,1 [М+Н]+.
Промежуточное соединение I2A
(1S,3S)-5-амино-3-(фторметил)-3-(2-фторфенил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид

2-((2S)-2-амино-3-фтор-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил (промежуточное соединение I1А, 200 мг) и йодид меди (I) (65,3 мг) объединяли в атмосфере аргона с этанолом (6,04 мл) с получением желтой суспензии. Реакционную смесь перемешивали в течение 1,5 ч при 75°С. Реакционную смесь охлаждали до комнатной температуры и наливали в 25% водный раствор аммиака (3 мл) и воды (12 мл) и экстрагировали дихлорметаном. Органические слои высушивали над MgSO4 и концентрировали в вакууме. Остаток разбавляли EtOAc, фильтровали через колонку 20 г силикагель-NН2, выпаривали и высушивали с получением (1S,3S)-5-амино-3-(фторметил)-3-(2-фторфенил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида (173 мг) в виде желтого твердого вещества. МС: m/z равно 316,1 [М+Н]+.
Промежуточное соединение I3А
трет-Бутил-((1S,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: Раствор (1S,3S)-5-амино-3-(фторметил)-3-(2-фторфенил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида (промежуточного соединения I2A, 165 мг) в дихлорметане (7,27 мл) охлаждали в атмосфере аргона в ледяной бане. Добавляли трифторметансульфоновую кислоту (1,57 г), и раствор оставляли для подогрева до комнатной температуры. Добавляли N-йодсукцинимид (141 мг), и смесь перемешивали в течение 3,5 ч при комнатной температуре. Добавляли дополнительное количество N-йодсукцинимида (23,5 мг), и перемешивание продолжали в течение 2 ч. Добавляли дополнительное количество N-йодсукцинимида (23,5 мг) и перемешивали в течение ночи. Смесь темно-пурпурного цвета добавляли к насыщенному водному раствору NaHCO3 (25 мл). Водный слой отделяли и экстрагировали один раз дихлорметаном. Органические слои промывали водным 0,1 М раствором тиосульфата натрия, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (NH2-модифицированный силикагель, от 0% до 100% EtOAc в н-гептане) с получением (1S,3S)-5-амино-3-(2-фтор-5-йодфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида (150 мг) в виде беловатого твердого вещества. МС: m/z равно 442,1 [М+Н]+.
Стадия 2: (1S,3S)-5-амино-3-(2-фтор-5-йодфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида (145 мг) растворяли в дихлорметане (4,1 мл) в атмосфере аргона. После добавления ВОС-ангидрида (75,3 мг) смесь перемешивали в течение 1 дня. Реакционную смесь выпаривали, и неочищенное вещество очищали флэш-хроматографией (силикагель, от 0% до 50% EtOAc в н-гептане) с получением трет-бутил-((1S,5S)-5-(2-фтор-5-йодфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамата (150 мг) в виде беловатого твердого вещества. МС: m/z равно 542,2 [М+Н]+.
Стадия 3: трет-бутил-((1S,5S)-5-(2-фтор-5-йодфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,б-дигидро-2Н-1,4-тиазин-3-ил)карбамат (162 мг), этинилтриметилсилан (58,8 мг), бис(трифенилфосфин)палладия (II) хлорид (14,7 мг), йодид меди (I) (2,28 мг) и триэтиламин (90,8 мг) смешивали в атмосфере аргона с ТГФ (2,66 мл) и перемешивали в течение 1 ч при комнатной температуре. Смесь разбавляли EtOAc и фильтровали через стекловолоконный фильтр. Фильтрат выпаривали, и неочищенное вещество очищали флэш-хроматографией (силикагель, от 0% до 100% EtOAc в н-гептане) с получением трет-бутил-((1S,5S)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамата (150 мг) в виде беловатого твердого вещества. МС: m/z равно 512,2 [М+Н]+.
Стадия 4: Для удаления следов Cu и Pd исходное вещество обрабатывали поглотителем:
трет-Бутил-((1S,5S)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (142 мг) растворяли в дихлорметане (4 мл) в атмосфере аргона. После добавления силикагеля с 3-меркаптопропилэтилсульфидом (96,4 мг) смесь перемешивали в атмосфере аргона в течение ночи. Поглотитель отфильтровывали и хорошо промывали этилацетатом. Почти бесцветный раствор выпаривали, снова растворяли в дихлорметане (4,04 мл) и охлаждали до 0°C. После добавления тетрабутиламмония фторида (1 M в ТГФ, 305 мкл) смесь перемешивали в течение 45 мин при 0°C. Смесь разбавляли дихлорметаном и промывали водой. Органический слой высушивали над сульфатом натрия, фильтровали и выпаривали с получением трет-бутил-(1S,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамата (122 мг) в виде беловатого твердого вещества. МС: m/z равно 440,2 [М+Н]+. Этот продукт использовали в следующей стадии без дополнительной очистки.
Промежуточное соединение I2B
(1R,3S)-5-амино-3-(фторметил)-3-(2-фторфенил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид

По аналогии с синтезом промежуточного соединения I2A 2-((R,2S)-2-амино-3-фтор-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил (промежуточное соединение I1B) преобразовывали в (1R,3S)-5-амино-3-(фторметил)-3-(2-фторфенил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4- тиазин-1-оксид путем обработки CuCl в этаноле при 75°C в течение 5 ч. Светло-желтое твердое вещество. МС: m/z равно 316,1 [М+Н]+
Промежуточное соединение I3B
трет-Бутил-((1R,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 1, (1R,3S)-5-амино-3-(фторметил)-3-(2-фторфенил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид (промежуточное соединение I2B) преобразовывали в (1R,3S)-5-амино-3-(2-фтор-5-йодфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки N-йодсукцинимидом в дихлорметане в присутствии трифторметансульфоновой кислоты.
Светло-желтое твердое вещество. МС: m/z равно 442,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 2, (1R,3S)-5-амино-3-(2-фтор-5-йодфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид (промежуточное соединение I2B) преобразовывали в трет-бутил-((1R,5S)-5-(2-фтор-5-йодфенил) 5 (фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки ВОС-ангидридом в дихлорметане. Беловатое твердое вещество. МС: m/z равно 542,0 [М+Н]+.
Стадия 3: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((1R,5S)-5-(2-фтор-5-йодфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1R,5S)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Беловатое твердое вещество. МС: m/z равно 512,2 [М+Н]+.
Стадия 4: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-((1R,5S)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I2B) преобразовывали в трет-бутил-((1R,5S)-5-(5-этинил-2-фторфенил)-5 (фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Беловатое твердое вещество. МС: m/z равно 440,2 [М+Н]+.
Промежуточные соединения I4A и I4B
(R)-N-((R)-1-((R)-2-циано-N-метилпропан-2-илсульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (I4A) и (R)-N-((R)-1-((S)-2-циано-N-метилпропан-2-илсульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (I4B)

2-(N,S-диметилсульфонимидоил)-2-метилпропаннитрил (CAS №1629090-52-3, 2,93 г) растворяли в дихлорметане (60 мл) и охлаждали до -75°C в атмосфере аргона. Бис(триметилсилил)амид лития, 1,0 М в ТГФ/этилбензоле (18,3 мл) добавляли по каплям, и смесь перемешивали в течение 1 ч при -70°C. Добавляли по каплям раствор (R)-N-(1-(2-фторфенил)этилиден)-2-метилпропан-2-сульфинамида (CAS №1606166-80-6, 3,4 г) в дихлорметане (17,5 мл) в течение 5 мин при -75°C. Перемешивание продолжали при -75°C в течение 80 мин. Добавляли по каплям бис(триметилсилил)амид лития, 1,0 М в ТГФ/этилбензоле (10,5 мл), и смесь перемешивали в течение 70 мин при -70°C. Реакционную смесь гасили добавлением полуконцентрированного водного раствора хлорида аммония. Дожидались повышения температуры до +5°C. Слои разделяли, и органический слой промывали 3 раза водой, высушивали над сульфатом натрия и концентрировали. Неочищенное вещество очищали флэш-хроматографией (силикагель, от 0% до 100% EtOAc в н-гептане) с получением изомера первого элюирования (R)-N-((R)-1-((R)-2-циано-N-метилпропан-2-ил-сульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамида (промежуточное соединение I4A, 1,135 г, содержит приблизительно 5% промежуточного соединения I4B) в виде светло-желтого воскового твердого вещества, МС: m/z равно 402,2 [М+Н]+ и изомера второго элюирования (R)-N-((R)-1-((S)-2-циано-3-N-метилпропан-2-илсульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамида (промежуточное соединение I4B, 0,692 г, содержит приблизительно 10% промежуточного соединения I4A) в виде светло-желтого масла, МС: m/z равно 402,2 [М+Н]+.
Промежуточное соединение I5A
(1R,3R)-5-амино-3-(2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид

Стадия 1: По аналогии с синтезом промежуточных соединений I1A и I1B, стадия 2, (R)-N-((R)-1-((R)-2-циано-N-метилпропан-2-илсульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (промежуточное соединение I4A) преобразовывали в 2-((R,2R)-2-амино-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил путем обработки HCl в метаноле и диоксане при 0-5°C. Бесцветное масло. МС: m/z равно 298,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I2A, 2-((R,2R)-2-амино-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил преобразовывали в (1R,3R)-5-амино-3-(2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки CuCl в этаноле при 75°C в течение 2 ч. Беловатое твердое вещество. МС: m/z равно 298,1 [М+Н]+.
Промежуточное соединение I6A
трет-Бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 1, (1R,3R)-5-амино-3-(2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид (промежуточное соединение I5A) преобразовывали в (1R,3R)-5-амино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки N-йодсукцинимидом в дихлорметане в присутствии трифторметансульфоновой кислоты. Светло-желтое твердое вещество. МС: m/z равно 424,0 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 2, (1R,3R)-5-амино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид преобразовывали в трет-бутил-((1R,5R)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки ВОС-ангидридом в дихлорметане. Беловатое твердое вещество. МС: m/z равно 522,2 [М-Н]-.
Стадия 3: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((1R,5R)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1R,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Светло-коричневое твердое вещество. МС: m/z равно 394,2 [М+Н-ВОС]+.
Стадия 4: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-((1R,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Бесцветная пена. МС: m/z равно 420,2 [М-Н]-.
Промежуточное соединение I5B
(1S,3R)-5-амино-3-(2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид

Стадия 1: По аналогии с синтезом промежуточных соединений I1A и I1B, стадия 2, (R)-N-((R)-1-((S)-2-циано-N-метилпропан-2-илсульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (промежуточное соединение I4B) преобразовывали в 2-((S,2R)-2-амино-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил путем обработки HC1 в метаноле и диоксане при 0-5°C. Бесцветное масло. МС: m/z равно 298,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I2A, 2-((S,2R)-2-амино-2-(2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил преобразовывали в (1S,3R)-5-амино-3-(2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки CuCl в этаноле при 75°C в течение 2 ч. Беловатая пена. МС: m/z равно 298,1 [М+Н]+.
Промежуточное соединение I6B
трет-Бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 1, (1S,3R)-5-амино-3-(2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид (промежуточное соединение I5B) преобразовывали в (1S,3R)-5-амино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки N-йодсукцинимидом в дихлорметане в присутствии трифторметансульфоновой кислоты. Беловатое твердое вещество. МС: m/z равно 424,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 2, (1S,3R)-5-амино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид преобразовывали в трет-бутил-((1S,5R)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки ВОС-ангидридом в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 522,2 [М-Н]-.
Стадия 3: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((1S,5R)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1S,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Светло-желтое твердое вещество. МС: m/z равно 494,2 [М+Н]+.
Стадия 4: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-((1S,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Бесцветная пена. МС: m/z равно 322,1 [М+Н-ВОС]+.
Промежуточное соединение I7A
N-[(1R)-2-[S-(1-циано-1-метил-этил)-N-(тридейтериометил)сульфонимидоил]-1-(2-фторфенил)-1-метил-этил]-2-метил-пропан-2-сульфинамид

Стадия 1: 2-Метил-2-(S-метилсульфонимидоил)пропаннитрил (6,68 г) растворяли в диметоксиэтане (109 мл) и охлаждали до 0-5°C. После добавления гидрида натрия (60% дисперсия в минеральном масле, 1,89 г) смесь перемешивали в течение 15 мин при 0-5°C, охлаждающую баню удаляли, и смесь перемешивали в течение 1 ч при комнатной температуре. Смесь снова охлаждали до 0-5°C. После добавления йодметана-D3 (6,56 г) перемешивание продолжали в течение 1 ч при комнатной температуре с последующим перемешиванием в течение 18 ч при 50°C. Смесь оставляли для охлаждения до комнатной температуры. После добавления насыщенного водного раствора бикарбоната натрия смесь экстрагировали этилацетатом. Органические слои промывали соляным раствором, объединяли, высушивали над сульфатом натрия и концентрировали. Неочищенное вещество очищали флэш-хроматографией (силикагель, от 0% до 100% EtOAc в н-гептане) с получением 2-метил-2-[S-метил-N-(тридейтериометил)сульфонимидоил]пропаннитрилав виде светло-коричневого масла. МС: m/z равно 164,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I4A 2-метил-2-[S-метил-N-(тридейтериометил)сульфонимидоил]пропаннитрила сначала подвергали взаимодействию с бис(триметилсилил)амидом с последующей обработкой (R)-N-(1-(2-фторфенил)этилиден)-2-метилпропан-2-сульфинамидом с получением после хроматографии (силикагель, от 0% до 100% EtOAc в н-гептане) изомера первого элюирования N-[(1R)-2-[S-(1-циано-1-метил-этил)-N-(тридейтериометил)сульфонимидоил]-1-(2-фторфенил)-1-метил-этил]-2-метил-пропан-2-сульфинамида (промежуточное соединение I7A, содержит приблизительно 5% изомера второго элюирования) в виде светло-желтого твердого вещества, МС: m/z равно 405,2 [М+Н]+
Промежуточное соединение I8A
(1R,3R)-3-(2-фторфенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амин

Стадия 1: По аналогии с синтезом промежуточных соединений I1A и I1B, стадия 2, N-[(1R)-2-[S-(1-циано-1-метил-этил)-N-(тридейтериометил)сульфонимидоил]-1-(2-фторфенил)-1-метил-этил]-2-метил-пропан-2-сульфинамид (промежуточное соединение I7A) преобразовывали в 2-[S-[(2R)-2-амино-2-(2-фторфенил)пропил]-N-(тридейтериометил)сульфонимидоил]-2-метил-пропаннитрил путем обработки HCl в метаноле и диоксане при 0-5°C. Бесцветное масло. МС: m/z равно 301,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I2A, 2-[S-[(2R)-2-амино-2-(2-фторфенил)пропил]-N-(тридейтериометил)сульфонимидоил]-2-метил-пропаннитрил преобразовывали в (1R,3R)-3-(2-фторфенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амин путем обработки CuCl в этаноле при 75°C. Беловатое твердое вещество. МС: m/z равно 301,1 [М+Н]+.
Промежуточное соединение I9A
трет-Бутил-N-[(1R,3R)-3-(5-этинил-2-фтор-фенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 1, (1R,3R)-3-(2-фторфенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амин (промежуточное соединение I8A) преобразовывали в (1R,3R)-3-(2-фтор-5-йод-фенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амин путем обработки N-йодсукцинимидом в дихлорметане в присутствии трифторметансульфоновой кислоты. Беловатое твердое вещество. МС: m/z равно 427,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 2, (1R,3R)-3-(2-фтор-5-йод-фенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амин преобразовывали в трет-бутил-N-[(1R,3R)-3-(2-фтор-5-йод-фенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат путем обработки ВОС-ангидридом в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 527,2 [М+Н]+.
Стадия 3: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-N-[(1R,3R)-3-(2-фтор-5-йод-фенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат преобразовывали в трет-бутил-N-[(1R,3R)-3-[2-фтор-5-(2-триметилсилилэтинил)фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Светло-коричневое твердое вещество. МС: m/z равно 497,3 [М+Н]+.
Стадия 4: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-N-[(1R,3R)-3-[2-фтор-5-(2-триметилсилилэтинил)фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат преобразовывали в трет-бутил-N-[(1R,3R)-3-(5-этинил-2-фтор-фенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 425,3 [М+Н]+.
Промежуточные соединения I10A и I10B
(R)-N-((R)-1-((R)-1-циано-N-метилциклопентансульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (I10A) и (R)-N-((R)-1-((S)-1-циано-N-метилциклопентансульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (I10B)

Стадия 1: К перемешанному раствору 1-(метилтио)циклопентанкарбонитрила (7,91 г) в дихлорметане (128 мл) добавляли 3-хлорнадбензойную кислоту (10,9 г) одной порцией при 0°C. Белую суспензию перемешивали при 0°C в течение 30 мин. Смесь фильтровали. 1 М раствор карбоната калия (1/3) смешивали с полунасыщенным раствором тиосульфата натрия (2/3). Органический слой сразу экстрагировали 1×20 мл этого раствора. Водный слой подвергали обратной экстракции 1×30 мл дихлорметана. Объединенные органические слои высушивали над Na2SO4 и концентрировали. Неочищенный 1-(метилсульфинил)циклопентанкарбонитрил использовали в следующей стадии без дополнительной очистки.
Стадия 2: 1-(Метилсульфинил)циклопентанкарбонитрил (6,749 г), 4-нитробензолсульфонамид (9,37 г), нитрат серебра (525 мг) и 4,4',4''-три-трет-бутил-2,2':6',2''-терпиридин (1,24 г) объединяли в MeCN (129 мл). Через 20 мин добавляли (диацетоксийод)бензол (18,7 г) и перемешивали в течение 24 ч при 60°C. Раствор фильтровали, и осадок промывали дихлорметаном. Фильтрат концентрировали, и неочищенное вещество очищали флэш-хроматографией (силикагель, 80 г, 100% ДХМ) с получением N-[(1-цианоциклопентил)-метил-оксо-λ6-сульфанилиден]-4-нитро-бензолсульфонамида (12,816 г).
Стадия 3: К раствору N-[(1-цианоциклопентил)-метил-оксо-λ6-сульфанилиден]-4-нитро-бензолсульфонамида (13,192 г) в ацетонитриле (246 мл) добавляли при 23°C карбоната цезия (21,6 г) с последующим добавлением тиофенола (6,51 г), и реакционную смесь перемешивали при 23°C в течение 6 ч. Смесь наливали в соляной раствор (100 мл), экстрагировали дважды этилацетатом (50 мл), высушивали органические слои над Na2SO4, фильтровали и концентрировали до сухого состояния. Неочищенное вещество очищали флэш-хроматографией (силикагель, 80 г, от 20% до 100% EtOAc в н-гептане) с получением 1-(S-метилсульфонимидоил]циклопентанкарбонитрила (5,433 г) в виде светло-желтого масла. МС: m/z равно 172,9 [М+Н]+.
Стадия 4: По аналогии с синтезом промежуточного соединения I7A, стадия 1, 1-(3-метилсульфонимидоил)циклопентанкарбонитрил алкилировали метилйодидом в присутствии гидрида натрия с получением 1-(N,S-диметилсульфонимидоил)циклопентан-1-карбонитрила в виде светло-желтого масла. МС: m/z равно 186,1 [М]+.
Стадия 5: По аналогии с синтезом промежуточного соединения I4A, 1-(N,S-диметилсульфонимидоил)циклопентан-1-карбонитрил сначала подвергали взаимодействию с бис(триметилсилил)амидом с последующей обработкой (R)-N-(1-(2-фторфенил)этилиден)-2-метилпропан-2-сульфинамидом с получением после хроматографии (силикагель, от 0% до 100% EtOAc в н-гептане) изомера первого элюирования (R)-N-((R)-1-((R)-1-циано-N-метилциклопентансульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамида (промежуточного соединения I10A) в виде светло-коричневого твердого вещества, МС: m/z равно 428,2 [М+Н]+; и изомера второго элюирования (R)-N-((R)-1-((S)-1-циано-N-метилциклопентансульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамида (промежуточного соединения I10B) в виде светло-желтого твердого вещества, МС: m/z равно 428,3 [М+Н]+.
Промежуточное соединение I11A
(6R,8R)-10-амино-8-(2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксид

Стадия 1: По аналогии с синтезом промежуточных соединений I1A и I1B, стадия 2, (R)-N-((R)-1-((R)-1-циано-N-метилциклопентансульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (промежуточное соединение I10) преобразовывали в 1-((R,2R)-2-амино-2-(2-фторфенил)-N-метилпропилсульфонимидоил)циклопентанкарбонитрил путем обработки HCl в метаноле и диоксане при 0-5°C. Бесцветное масло. МС: m/z равно 324,2 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I2A 1-((R,2R)-2-амино-2-(2-фторфенил)-N-метилпропилсульфонимидоил)циклопентанкарбонитрил преобразовывали в (6R,8R)-10-амино-8-(2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен 6-оксид путем обработки CuCl в этаноле при 75°C. Светло-коричневая смола МС: m/z равно 324,2 [М+Н]+.
Промежуточное соединение I12A
трет-Бутил-((6R,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат
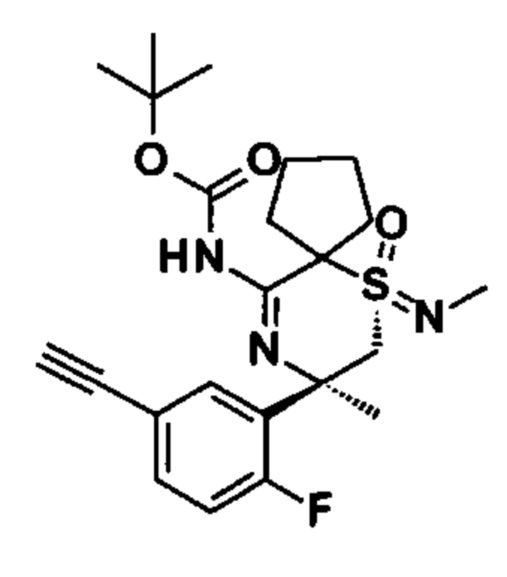
Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 1, (6R,8R)-10-aминo-8-(2-фтopфeнил)-8-мeтил-6-(мeтилиминo)-6-тиa-9-азаспиро[4.5]дец-9-ен-6-оксид (промежуточное соединение I11A) преобразовывали в (6R,9R)-10-амино-8-(2-фтор-5-йодфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен 6-оксид путем обработки N-йодсукцинимид в дихлорметане в присутствии трифторметансульфоновой кислоты. Коричневая пена. МС: m/z равно 450,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 2, (6R,8R)-10-амино-8-(2-фтор-5-йодфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен 6-оксид преобразовывали в трет-бутил-((6R,8R)-8-(2-фтор-5-йодфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-en-10-ил)карбамат путем обработки ВОС-ангидридом в дихлорметане. Беловатое твердое вещество. МС: m/z равно 550,3 [М+Н]+.
Стадия 3: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((6R,8R)-8-(2-фтор-5-йодфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-en-10-ил)карбамат преобразовывали в трет-бутил-((6R,8R)-8-(2-фтор-5-((триметилсилил)этинил)фенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Бесцветное твердое вещество. МС: m/z равно 520,4 [М+Н]+.
Стадия 4: По аналогии с синтезом промежуточного соединения I3A, стадия 4, тpeт-бyтил-((6R,8R)-8-(2-фтop-5-((тpимeтилcилил)этинил)фeнил)-8-мeтил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат преобразовывали в трет-бутил-((6R,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 448,3 [М+Н]+.
Промежуточное соединение I11B
(6S,8R)-10-амино-8-(2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксид

Стадия 1: По аналогии с синтезом промежуточных соединений I1A и I1B, стадия 2, (R)-N-((R)-1-((S)-1-циано-N-метилциклопентансульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (промежуточное соединение I10B) преобразовывали в 1-((S,2R)-2-амино-2-(2-фторфенил)-N-метилпропилсульфонимидоил)циклопентанкарбонитрил путем обработки HCl в метаноле и диоксане при 0-5°C. Бесцветное масло. МС: m/z равно 324,2 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I2A, 1-((S,2R)-2-амино-2-(2-фторфенил)-N-метилпропилсульфонимидоил)циклопентанкарбонитрил преобразовывали в (6S,8R)-10-амино-8-(2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксид путем обработки CuCl в этаноле при 75°C.Светло-коричневая смола. МС: m/z равно 324,2 [М+Н]+.
Промежуточное соединение I12B
трет-Бутил-((6S,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 1, (6S,8R)-10-амино-8-(2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксид (промежуточное соединение I11B) преобразовывали в (6S,8R)-10-амино-8-(2-фтор-5-йодфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксид путем обработки N-йодсукцинимидом в дихлорметане в присутствии трифторметансульфоновой кислоты. Коричневая смола. МС: m/z равно 450,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 2, (6S,8R)-10-амино-8-(2-фтор-5-йодфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксид преобразовывали в трет-бутил-((6S,8R)-8-(2-фтор-5-йодфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-en-10-ил)карбамат путем обработки ВОС-ангидридом в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 550,2 [М+Н]+.
Стадия 3: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((6S,8R)-8-(2-фтор-5-йодфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат преобразовывали в трет-бутил-((6S,8R)-8-(2-фтор-5-((триметилсилил)этинил)фенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Беловатое твердое вещество. МС: m/z равно 520,4 [М+Н]+.
Стадия 4: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-((6S,8R)-8-(2-фтор-5-((триметилсилил)этинил)фенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат преобразовывали в трет-бутил-((6S,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 448,3 [М+Н]+.
Промежуточные соединения I14A и I14B
трет-Бутил-N-[(1R,3R)-1-циклопропилимино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-ил]карбамат (I14A) и трет-бутил-N-[(1S,3R)-1-циклопропилимино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-ил]карбамат (I14B)
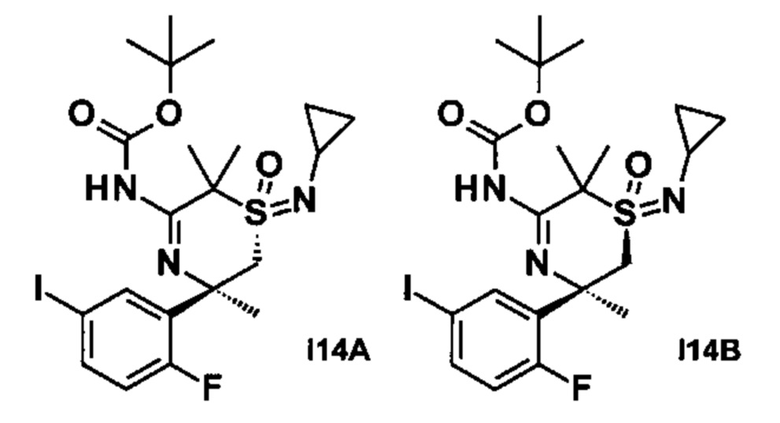
Стадия 1: 1-(2-Фтор-5-йодфенил)этанон (5 г) и (R)-(+)-2-метил-2-пропансульфинамид (4,59 г) растворяли в ТГФ (38,6 мл). После добавления этоксида титана (IV) (8,64 г) смесь перемешивали при комнатной температуре в течение ночи, затем подогревали до 70°C и перемешивали в течение 5 ч. После охлаждения до комнатной температуры добавляли воду (3 мл), этилацетат (50) и дикалит, и смесь перемешивали в течение 10 мин и фильтровали. Фильтрат концентрировали, и остаточное жидкое масло очищали хроматографией (силикагель, от 0% до 60% EtOAc в н-гептане) с получением (R)-N-(1-(2-фтор-5-йодфенил)этилиден)-2-метилпропан-2-сульфинамида в виде светло-желтого твердого вещества. МС: m/z равно 368,1 [М+Н]+.
Стадия 2: К перемешанному раствору 2-метил-2-(S-метилсульфонимидоил)пропаннитрила (5 г) в 1,2-дихлорэтане (33,3 мл) добавляли циклопропилбороновую кислоту (6,76 г), ацетат меди (II) (6,21 г), 2,2'-дипиридин (4,27 г) и карбонат натрия (10,9 г). Реакционную смесь перемешивали в воздушной атмосфере в течение 5 мин, затем нагревали до 90°C и перемешивали в течение 3 ч. Реакционную смесь охлаждали до комнатной температуре и перемешивали в течение ночи, фильтровали через колонку 50 г силикагеля. Фильтрат концентрировали с получением неочищенного продукта. Продукт очищали с использованием флэш-хроматографии (силикагель, от 0% до 100% EtOAc в н-гептане) с получением 2-2-(N-циклопропил-S-метилсульфонимидоил)-2-метилпропаннитрила в виде светло-желтого масла. МС: m/z равно 187,1 [М+Н]+.
Стадия 3: По аналогии с синтезом промежуточного соединения I4A, 2-(N-циклопропил-S-метилсульфонимидоил)-2-метилпропаннитрил подвергали взаимодействию сначала с бис(триметилсилил)амидом, а затем обрабатывали (R)-N-(1-(2-фтор-5-йодфенил)этилиден)-2-метилпропан-2-сульфинамидом с получением (R)-N-((2R)-1-(2-циaнo-N-циклoпpoпилпpoпaн-2-илcyльфoнимидoил)-2-(2-фтop-5-йодфенил)пропан-2-ил)-2-метилпропан-2-сульфинамида (смесь 2 изомеров в виде светло-желтого масла, МС: m/z равно 554,3 [М+Н]+.
Стадия 4: По аналогии с синтезом промежуточных соединений I1A и I1B, стадия 2, (R)-N-((2R)-1-(2-циано-N-цикпопропилпропан-2-илсульфонимидоил)-2-(2-фтор-5-йодфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид преобразовывали в 2-((2R)-2-aминo-N-циклoпpoпил-2-(2-фтop-5-йoдфeнил)пpoпилcyльфoнимидoил)-2-метилпропаннитрил (смесь 2 изомеров) путем обработки HCl в метаноле и диоксане при 0-5°C светло-желтое масло. МС: m/z равно 450,3 [М+Н]+.
Стадия 5: По аналогии с синтезом промежуточного соединения I2A 2-((2R)-2-амино-N-циклопропил-2-(2-фтор-5-йодфенил)пропилсульфонимидоил)-2-метилпропаннитрил преобразовывали в (3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-йодфенил)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксид (смесь 2 изомеров, неочищенная) путем обработки CuCl в этаноле. Светло-зеленое масло. МС: m/z равно 450,3 [М+Н]+.
Стадия 6: По аналогии с синтезом промежуточного соединения I3A, стадия 2, (3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-йодфенил)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксид обрабатывали ВОС-ангидридом в дихлорметане с получением после хроматографии (силикагель, от 0% до 80% EtOAc в н-гептане) изомера первого элюирования трет-бутил-N-[(1R,3R)-1-циклопропилимино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-ил]карбамата (промежуточное соединение I14A, беловатое твердое вещество, МС: m/z равно 550,4 [М+Н]+) и изомера второго элюирования трет-бутил-N-[(1S,3R)-1-циклопропилимино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-ил]карбамата (промежуточное соединение I14B, беловатое твердое вещество, МС: m/z равно 550,4 [М+Н]+)
Промежуточное соединение I15A
трет-Бутил-((1R,5R)-1-(циклопропилимино)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((1R,5R)-1-(циклопропилимино)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I14A) преобразовывали в трет-бутил-((1R,5R)-1-(циклопропилимино)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Желтое твердое вещество. МС: m/z равно 520,5 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 4, тpeт-бyтил-((1R,5R)-1-(циклoпpoпилиминo)-5-(2-фтop-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1R,5R)-1-(циклопропилимино)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Беловатое твердое вещество. МС: m/z равно 448,4 [М+Н]+.
Промежуточное соединение I15B
трет-Бутил-((1S,5R)-1-(циклопропилимино)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((1S,5R)-1-(циклопропилимино)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I14B) преобразовывали в трет-бутил-((1S,5R)-1-(циклопропилимино)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Беловатое твердое вещество. МС: m/z равно 520,5 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-((1S,5R)-1-(циклопропилимино)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1S,5R)-1-(циклопропилимино)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 448,4 [М+Н]+.
Промежуточные соединения I16A и I16B
(R)-N-((1R)-1-((S)-2-циано-N-(2,2,2-трифторэтил)пропан-2-илсульфонимидоил)-2-(2-фтор-5-йодфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (I16A) и (R)-N-((R)-1-((R)-2-циано-N-(2,2,2-трифторэтил)пропан-2-илсульфонимидоил)-2-(2-фтор-5-йодфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (I16B)

Стадия 1: 2-Метил-2-(S-метилсульфонимидоил)пропаннитрил (250 мг) растворяли в трифторуксусной кислоте (16,3 г) и охлаждали в ледяной бане. Боргидрид натрия (388 мг) добавляли одной порцией. Охлаждающую баню удаляли, и смесь перемешивали в течение 3,5 ч при комнатной температуре. Добавляли вторую порцию боргидрида натрия (259 мг), и перемешивание продолжали в течение 2 ч. Смесь концентрировали и растворяли в концентрированном растворе гидрокарбоната натрия и дихлорметане. Добавляли дополнительное количество гидрокарбоната натрия до рН>7. После перемешивания в течение 5 мин слои разделяли. Водный слой экстрагировали еще два раза дихлорметаном. Органические слои высушивали над сульфатом натрия и концентрировали. Продукт очищали, используя флэш-хроматографию (силикагель, от 0% до 100% дихлорметан в н-гептане) с получением 2-метил-2-(S-метил-N-(2,2,2-трифторэтил)сульфонимидоил)пропаннитрила (161 мг) в виде бесцветного твердого вещества. МС: m/z равно 229,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I4A 2-метил-2-(S-метил-N-(2,2,2-трифторэтил)сульфонимидоил)пропаннитрил сначала подвергали взаимодействию с бис(триметилсилил)амидом с последующей обработкой (R)-N-(1-(2-фтор-5-йодфенил)этилиден)-2-метилпропан-2-сульфинамидом с получением после хроматографии (силикагель, от 0% до 100% EtOAc в н-гептане) изомера первого элюирования (R)-N-((R)-1-((S)-2-циано-N-(2,2,2-трифторэтил)пропан-2-илсульфонимидоил)-2-(2-фтор-5-йодфенил)пропан-2-ил)-2-метилпропан-2-сульфинамида (промежуточное соединение I16A, бесцветное масло, МС: m/z равно 596,2 [М+Н]+) и изомера второго элюирования (R)-N-((R)-1-((R)-2-циано-N-(2,2,2-трифторэтил)пропан-2-илсульфонимидоил)-2-(2-фтор-5-йодфенил)пропан-2-ил)-2-метилпропан-2-сульфинамида (промежуточное соединение I16B, бесцветное твердое вещество, МС: m/z равно 596,2 [М+Н]+).
Промежуточное соединение I17A
трет-Бутил-((1S,5R)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточных соединений I1A и I1B, стадия 2, (R)-N-((R)-1-((S)-2-циано-N-(2,2,2-трифторэтил)пропан-2-илсульфонимидоил)-2-(2-фтор-5-йодфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (промежуточное соединение I16A) преобразовывали в 2-((S,2R)-2-амино-2-(2-фтор-5-йодфенил)-N-(2,2,2-трифторэтил)пропилсульфонимидоил)-2-метилпропаннитрил путем обработки HCl в смеси метанола и диоксана при 0-5°C. Бесцветная смола. МС: m/z равно 492,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I2A 2-((S,2R)-2-амино-2-(2-фтор-5-йодфенил)-N-(2,2,2-трифторэтил)пропилсульфонимидоил)-2-метилпропаннитрил преобразовывали в (1S,3R)-5-амино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки CuCl в этаноле. Бесцветное твердое вещество. МС: m/z равно 492,1 [М+Н]+.
Стадия 3: По аналогии с синтезом промежуточного соединения I3A, стадия 2, (1S,3R)-5-амино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид обрабатывали ВОС-ангидридом в дихлорметане с получением трет-бутил-((1S,5R)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамата в виде бесцветной пены. МС: m/z равно 592,07 [М+Н]+
Промежуточное соединение I18A
трет-Бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат
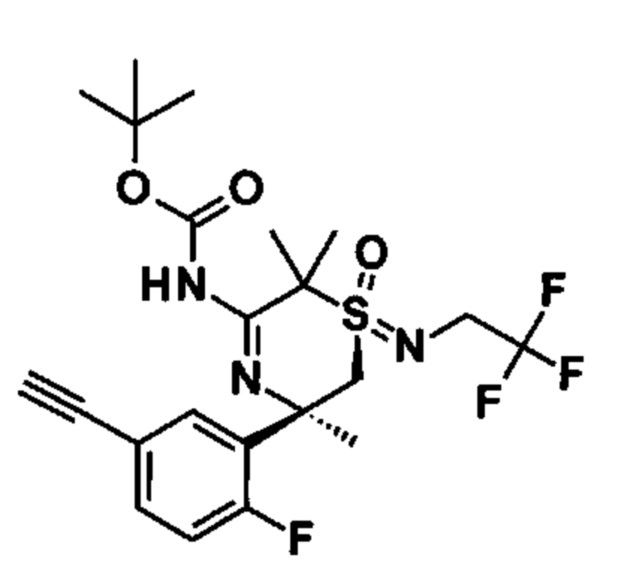
Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((1S,5R)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I17A) преобразовывали в трет-бутил-((1S,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Светло-коричневое твердое вещество. МС: m/z равно 560,3 [М-Н]-.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-((1S,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 488,3 [М-Н]-.
Промежуточное соединение I17B
трет-Бутил-((1R,5R)-5-(2-фтор-5-йодфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточных соединений I1A и I1B, стадия 2, (R)-N-((R)-1-(R)-2-циано-N-(2,2,2-трифторэтил)пропан-2-илсульфонимидоил)-2-(2-фтор-5-йодфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид (промежуточное соединение I16B) преобразовывали в 2-((R,2R)-2-амино-2-(2-фтор-5-йодфенил)-N-(2,2,2-трифторэтил)пропилсульфонимидоил)-2-метилпропаннитрил путем обработки HCl в смеси метанола и диоксана при 0-5°C. Бесцветное масло. МС: m/z равно 492,1 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I2A 2-((R,2R)-2-амино-2-(2-фтор-5-йодфенил)-N-(2,2,2-трифторэтил)пропилсульфонимидоил)-2-метилпропаннитрил преобразовывали в (1R,3R)-5-амино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки CuCl в этаноле. Бесцветное твердое вещество. МС: m/z равно 492,1 [М+Н]+.
Стадия 3: По аналогии с синтезом промежуточного соединения I3A, стадия 2, (1R,3R)-5-амино-3-(2-фтор-5-йодфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид обрабатывали ВОС-ангидридом в дихлорметане с получением тpeт-бyтил-((1R,5R)-5-(2-фтop-5-йодфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамата в виде бесцветной пены. МС: m/z равно 590,3 [М-Н]-
Промежуточное соединение I18B
трет-Бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 3, тpeт-бyтил-((1R,5R)-5-(2-фтop-5-йoдфeнил)-2,2)5-тpимeтил-1-oкcидo-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I17B) преобразовывали в трет-бутил-((1R,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Светло-желтое твердое вещество. МС: m/z равно 560,3 [М-Н]-.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-((1R,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Светло-желтое твердое вещество. МС: m/z равно 488,4 [М-Н]-.
Промежуточные соединения I19A и I19B
трет-Бутил-((1R,5R)-5-(2-фтор-5-йодфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (I19A) и трет-бутил-((1S,5R)-5-(2-фтор-5-йодфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (I19B)

Стадия 1: По аналогии с синтезом промежуточного соединения I4A 2-(N-циклопропил-3-метилсульфонимидоил)-2-метилпропаннитрил сначала подвергали взаимодействию с бис(триметилсилил)амидом с последующей обработкой (R,E)-N-(1-(2-фторфенил)этилиден)-2-метилпропан-2-сульфинамидом с получением (R)-N-((2R)-1-(2-циано-N-циклопропилпропан-2-илсульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамида в виде смеси двух изомеров. Светло-желтое масло, МС: m/z равно 428,4 [М+Н]+)
Стадия 2: По аналогии с синтезом промежуточных соединений I1A и I1B, стадия 2, (R)-N-((2R)-1-(2-циано-N-циклопропилпропан-2-илсульфонимидоил)-2-(2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид преобразовывали в 2-((2R)-2-амино-N-циклопропил-2-(2-фторфенил)пропилсульфонимидоил)-2-метилпропаннитрил (смесь двух изомеров) путем обработки HCl в смеси метанола и диоксана при 0-5°C. Беловатое масло. МС: m/z равно 324,3 [М+Н]+.
Стадия 3: По аналогии с синтезом промежуточного соединения I2A 2-((2R)-2-амино-N-циклопропил-2-(2-фторфенил)пропилсульфонимидоил)-2-метилпропаннитрил преобразовывали в (3R)-5-амино-1-(циклопропилимино)-3-(2-фторфенил)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксид (смесь двух изомеров) путем обработки CuCl в этаноле при 75°C. Светло-зеленое твердое вещество. МС: m/z равно 324,2 [М+Н]+.
Стадия 4: По аналогии с синтезом промежуточного соединения I3A, стадия 1, (3R)-5-aминo-1-(циклoпpoпилиминo)-3-(2-фтopфeнил)-3,6,6-тpимeтил-3,6-дигидpo-2Н-1,4-тиазин-1-оксид обрабатывали N-йодсукцинимидом в дихлорметане в присутствии трифторметансульфоновой кислоты с получением в виде непредусмотренного продукта (3R)-5-амино-3-(2-фтор-5-йодфенил)-1-имино-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксида (смесь двух изомеров невозможно было получить в чистом виде, и ее использовали в виде неочищенного продукта для следующей стадии).
Стадия 5: По аналогии с синтезом промежуточного соединения I3A, стадия 2, неочищенный (3R)-5-амино-3-(2-фтор-5-йодфенил)-1-имино-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксид обрабатывали ВОС-ангидридом в дихлорметане с получением после хроматографии (силикагель, от 0% до 100% EtOAc в н-гептане) изомера первого элюирования трет-бутил-((1R,5R)-5-(2-фтор-5-йодфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамата (промежуточное соединение I19A, светло-коричневое твердое вещество, МС: m/z равно 510,2 [М+Н]+) и изомера второго элюирования трет-бутил-((1S,5R)-5-(2-фтор-5-йодфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамата (промежуточное соединение I19B, светло-коричневое твердое вещество, МС: m/z равно 510,2 [М+Н]+)
Промежуточное соединение I20A
трет-Бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((1R,5R)-5-(2-фтор-5-йодфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1R,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Беловатое твердое вещество. МС: m/z равно 480,3 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-((1R,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Беловатое твердое вещество. МС: m/z равно 408,2 [М+Н]+.
Промежуточное соединение I20B
трет-Бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат

Стадия 1: По аналогии с синтезом промежуточного соединения I3A, стадия 3, трет-бутил-((1S,5R)-5-(2-фтор-5-йодфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1S,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки этинилтриметилсиланом в ТГФ в присутствии бис(трифенилфосфин)палладия (II) хлорида, йодида меди (I) и триэтиламина. Беловатое твердое вещество. МС: m/z равно 480,3 [М+Н]+.
Стадия 2: По аналогии с синтезом промежуточного соединения I3A, стадия 4, трет-бутил-((1S,5R)-5-(2-фтор-5-((триметилсилил)этинил)фенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в трет-бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки тетрабутиламмония фторидом в дихлорметане. Беловатое твердое вещество. МС: m/z равно 408,2 [М+Н]+.
Экспериментальный раздел
Примеры
Пример 1
(1S,3S)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазине 1-оксид 2,2,2-трифторацетат
Стадия 1: 5-Хлорпиримидин-2-карбонитрил (CAS №38275-56-8, 10 г) и гидроксиламина гидрохлорид (5,23 г) объединяли в этаноле (107 мл) и перемешивали в течение 5 мин. Добавляли гидроксид натрия (1 M в воде, 72,4 мл) при комнатной температуре. Смесь перемешивали в течение 35 мин. Смесь разбавляли льдом и водой. Выпавшее в осадок твердое вещество собирали фильтрованием, промывали холодной водой и высушивали с получением 5-хлор-N'-гидроксипиримидин-2-карбоксимидамида (10,14 г) в виде бесцветного твердого вещества. МС: m/z равно 173,0 [М+Н]+.
Стадия 2: К суспензии 5-хлор-N'-гидроксипиримидин-2-карбоксимидамида (5,05 г) в 3,7 М водном растворе соляной кислоты (82,3 мл) добавляли по каплям раствор нитрита натрия (2,5 г) в воде (13,2 мл) при перемешивании при 0°C. Реакционную смесь перемешивали при 0°C в течение 2 ч. Суспензию фильтровали через стеклокерамический фильтр, остаток промывали холодной водой и высушивали с получением 5-хлор-N-гидроксипиримидин-2-карбимидоилхлорида (4,93) в виде беловатого твердого вещества. МС: m/z равно 192,0 [М+Н]+.
Стадия 3: трет-бутил-((1S,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I3A, 77 мг) растворяли в ТГФ (3,58 мл) при комнатной температуре в атмосфере аргона. После добавления 5-хлор-N-гидроксипиримидин-2-карбимидоилхлорида (67,3 мг) и бикарбоната натрия (29,4 мг) смесь перемешивали в течение 4 дней. Смесь разбавляли этилацетатом, фильтровали через колонку 20 г силикагеля-NH2, выпаривали и очищали хроматографией (силикагель, от 0% до 100% EtOAc в н-гептане) с получением трет-бутил-((1S,5S)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамата (83 мг) в виде беловатого твердого вещества. МС: m/z равно 593,3 [М-Н]-.
Стадия 4: ((1S,5S)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (80 мг) объединяли в атмосфере аргона с дихлорметаном (1 мл). Добавляли трифторуксусную кислоту (920 мг), и смесь перемешивали в течение 2 ч. Реакционную смесь выпаривали, остаточную смолу выпаривали со смесью дихлорметан/н-гексан и 4х с н-гексаном и высушивали с получением (1S,3S)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата (81 мг) в виде бесцветного твердого вещества. МС: m/z равно 495,1 [М+Н]+.
Пример 2
(1S,3S)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 2, N'-гидрокси-6-метоксипиразин-2-карбоксимидамид (CAS №1344885-60-4) преобразовывали в N-гидрокси-5-метоксипиразин-2-карбимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C. Беловатое твердое вещество. МС: m/z равно 188,3 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I3A) преобразовывали в трет-бутил-((1S,5S)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-6-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 589,3 [М-Н]-.
Стадия 3: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5S)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3S)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 491,2 [М+Н]+.
Пример 3
(1R,3S)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I3B) преобразовывали в трет-бутил-((1R,5S)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 593,3 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5S)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3S)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 495,1 [М+Н]+.
Пример 4
(1R,3S)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 1, 5-(2,2-дифторэтокси)пиразин-2-карбонитрил (CAS №1544861-08-6) преобразовывали в 5-(2,2-дифторэтокси)-N'-гидроксипиразин-2-карбоксимидамид путем обработки гидроксиламина гидрохлоридом в присутствии водного раствора гидроксида натрия. Беловатое твердое вещество. МС: m/z равно 219,1 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 2, 5-(2,2-дифторэтокси)-N'-гидроксипиразине-2-карбоксимидамид преобразовывали в 5-(2,2-дифторэтокси)-N-гидроксипиразин-2-карбимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C. Желтое твердое вещество.
Стадия 3: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I3B) преобразовывали в трет-бутил-((1R,5S)-5-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-(2,2-дифторэтокси)-N-гидроксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 639,3 [М-Н]-.
Стадия 4: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5S)-5-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3S)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 541,1 [М+Н]+.
Пример 5
(1R,3R)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6A) преобразовывали в трет-бутил-((1R,5R)-5-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-(2,2-дифторэтокси)-N-гидроксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 621,4 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 523,2 [М+Н]+.
Пример 6
(1R,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6A) преобразовывали в трет-бутил-((1R,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 575,3 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 477,1 [М+Н]+.
Пример 7
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6A) преобразовывали в трет-бyтил-((1R,5R)-5-(2-фтop-5-(3-(5-мeтoкcипиpaзин-2-ил)изoкcaзoл-5-ил)фeнил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки М-гидрокси-5-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 575,3 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазине 1-оксид 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 473,2 [М+Н]+.
Пример 8
2-(5-(3-((1R,3R)-5-амино-3,6,6-триметил-1-(метилимино)-1-оксидо-3,6-дигидро-2Н-1,4-тиазин-3-ил)-4-фторфенил)изоксазол-3-ил)пиримидин-5-карбонитрила 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 1, пиримидин-2,5-дикарбонитрил (CAS №38275-58-0) преобразовывали в 5-циано-N'-гидроксипиримидин-2-карбоксимидамид путем обработки гидроксиламина гидрохлоридом в присутствии водного раствора гидроксида натрия. Светло-коричневое твердое вещество. МС: m/z равно 164,057 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 2, 5-циано-N'-гидроксипиримидин-2-карбоксимидамид преобразовывали в 5-циано-N-гидроксипиримидин-2-карбимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C. Беловатое твердое вещество.
Стадия 3: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6A) преобразовывали в трет-бyтил-((1R,5R)-5-(5-(3-(5-циaнoпиpимидин-2-ил)изoкcaзoл-5-ил)-2-фтopфeнил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-циано-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 566,3 [М-Н]-.
Стадия 4: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(5-(3-(5-цианопиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в 2-(5-(3-((1R,3R)-5-aминo-3,6,6-тpимeтил-1-(мeтилиминo)-1-oкcидo-3,6-дигидpo-2H-1,4-тиазин-3-ил)-4-фторфенил)изоксазол-3-ил)пиримидин-5-карбонитрила 2,2,2-трифторацетата путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 468,2 [М+Н]+.
Пример 9
(1R,3R)-5-амино-3-(5-(1-(5-хлорпиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: трет-бутил-((1R,5R)-5-(5-этинил-2-фтopфeнил)-2,2,5-тpимeтил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6A, 50 мг) и 2-азидо-5-хлорпиридин (CAS №242815-95-8, 18,3 мг) смешивали в атмосфере аргона с толуолом (1,5 мл). После добавления комплекса трифторметансульфоната меди (I) с бензолом (5,97 мг) реакционную смесь перемешивали в течение 2 дней при КТ в запаянной трубке. Смесь разбавляли этилацетатом, фильтровали через стекловолоконный фильтр, выпаривали и очищали хроматографией (силикагель, от 0% до 80% EtOAc в н-гептане) с получением трет-бутил-((1R,5R)-5-(5-(1-(5-хлорпиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамата (49,8 мг) в виде бесцветного твердого вещества. МС: m/z равно 574,4 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(5-(1-(5-хлорпиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-3-(5-(1-(5-хлорпиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 476,1 [М+Н]+.
Пример 10
6-(4-(3-((1R,3R)-5-амино-3,6,6-триметил-1-(метилимино)-1-оксидо-3,6-дигидро-2Н-1,4-тиазин-3-ил)-4-фторфенил)-1Н-1,2,3-триазол-1-ил)никотинонитрила 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 9, стадия 1, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6A) преобразовывали в трет-бутил-((1R,5R)-5-(5-(1-(5-цианопиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 6-азидоникотиннитрилом (CAS №1139703-59-5) в присутствии комплекса трифторметансульфоната меди (I) с бензолом. Бесцветное твердое вещество. МС: m/z равно 467,2 [М+Н-ВОС]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(5-(1-(5-цианопиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в 6-(4-(3-((1R,3R)-5-амино-3,6,6-триметил-1-(метилимино)-1-оксидо-3,6-дигидро-2Н-1,4-тиазин-3-ил)-4-фторфенил)-1Н-1,2,3-триазол-1-ил)никотинонитрил 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 467,1 [М+Н]+.
Пример 11
(1S,3R)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6B) преобразовывали в трет-бутил-((1S,5R)-5-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-(2,2-дифторэтокси)-N-гидроксипиразине-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 621,3 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5R)-5-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3R)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазине 1-оксид 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 523,2 [М+Н]+.
Пример 12
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6B) преобразовывали в трет-бутил-((1S,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 575,2 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетата путем обработки трифторуксусной кислоты в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 477,1 [М+Н]+.
Пример 13
(1S,3S)-5-амино-3-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид
Стадия 1: По аналогии с примером 1, стадия 2, N'-гидрокси-6-метоксипиримидин-2-карбоксимидамид (CAS №143031-89-4) преобразовывали в N-гидрокси-5-метоксипиримидин-2-карбимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C. Беловатое твердое вещество. МС: m/z равно 188,1 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I3A) преобразовывали в трет-бутил-((1S,5S)-5-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-5-метоксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 589,3 [М-Н]-.
Стадия 3: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5S)-5-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3S)-5-амино-3-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 491,2 [М+Н]+.
Пример 14
6-(4-(3-((1R,3S)-5-амино-3-(фторметил)-6,6-диметил-1-(метилимино)-1-оксидо-3,6-дигидро-2Н-1,4-тиазин-3-ил)-4-фторфенил)-1Н-1,2,3-триазол-1-ил)никотинонитрила 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 9, стадия 1, трет-бутил-((1R,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I3B) преобразовывали в трет-бутил-((1R,5S)-5-(5-(1-(5-цианопиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 6-азидоникотиннитрилом (CAS №1139703-59-5) в присутствии комплекса трифторметансульфоната меди (I) с бензолом. Бесцветное твердое вещество. МС: m/z равно 585,2 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5S)-5-(5-(1-(5-цианопиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в 6-(4-(3-((1R,3S)-5-амино-3-(фторметил)-6,6-диметил-1-(метилимино)-1-оксидо-3,6-дигидро-2Н-1,4-тиазин-3-ил)-4-фторфенил)-1Н-1,2,3-триазол-1-ил)никотинонитрила 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 485,2 [М+Н]+.
Пример 15
(1R,3S)-5-амино-3-(5-(3-(5-бром-3-метилпиридин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 1, 5-бром-3-метилпиколиннитрил (CAS №156072-86-5) преобразовывали в 5-бром-N'-гидрокси-3-метилпиколинимидамид путем обработки гидроксиламина гидрохлоридом в присутствии водного раствора гидроксида натрия. Беловатое твердое вещество. МС: m/z равно 230,0 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 2, 5-бром-N'-гидрокси-3-метилпиколинимидамид преобразовывали в 5-бром-N-гидрокси-3-метилпиколинимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C. Беловатое твердое вещество.
Стадия 3: По аналогии с примером 1, стадия 3, трет-бутил ((1R,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I3B) преобразовывали в трет-бутил-((1R,5S)-5-(5-(3-(5-бром-3-метилпиридин-2-ил)изоксазол-5-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 6-бром-N-гидрокси-3-метилпиколинимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 652,4 [М-Н]-.
Стадия 4: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5S)-5-(5-(3-(5-бром-3-метилпиридин-2-ил)изоксазол-5-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3S)-5-амино-3-(5-(3-(5-бром-3-метилпиридин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 554,1 [М+Н]+.
Пример 16
(1R,3S)-5-амино-3-(5-(1-(5-хлорпиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 9, стадия 1, трет-бутил-((1R,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I3B) преобразовывали в трет-бутил-((1R,5S)-5-(5-(1-(5-хлорпиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 2-азидо-5-хлорпиридином (CAS №242815-95-8) в присутствии комплекса трифторметансульфоната меди (I) с бензолом. Бесцветное твердое вещество. МС: m/z равно 594,2 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5S)-5-(5-(1-(5-хлорпиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3S)-5-амино-3-(5-(1-(5-хлорпиридин-2-ил)-1Н-1,2,3-триазол-4-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазине 1-оксид 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 494,2 [М+Н]+.
Пример 17
(1R,3S)-3-[2-фтор-5-[3-(5-метоксипиримидин-2-ил)изоксазол-5-ил]фенил]-3-(фторметил)-6,6-диметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амин
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5S)-5-(5-этинил-2-фторфенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I3B) преобразовывали в трет-бутил-((1R,5S)-5-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-5-метоксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Светло-желтое твердое вещество. МС: m/z равно 589,3 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5S)-5-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-5-(фторметил)-2,2-диметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3S)-3-[2-фтор-5-[3-(5-метоксипиримидин-2-ил)-1,2-oxazol-5-ил]фенил]-3-(фторметил)-6,6-диметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амин путем обработки трифторуксусной кислотой в дихлорметане с последующей хроматографией на амино-модифицированном силикагеле. Бесцветное твердое вещество. МС: m/z равно 491,2 [М+Н]+.
Пример 18
(1R,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиримидин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амин
Стадия 1: К раствору 2-(метилтио)пиримидин-5-ола (CAS №4874-33-3, 2 г) в ацетоне (50 мл) добавляли карбонат калия (2,92 г) и 2,2-дифторэтилтрифторметансульфоната (3,46 г), и смесь перемешивали в течение 3 ч при комнатной температуре. Добавляли диэтиловый эфир (200 мл), и смесь фильтровали. Фильтрат концентрировали, и неочищенное вещество очищали флэш-хроматографией (силикагель, от 0% до 50% EtOAc в н-гептане) с получением 5-(2,2-дифторэтокси)-2-(метилтио)пиримидина (2,65 г) в виде светло-желтого твердого вещества. МС: m/z равно 207,0 [М+Н]+.
Стадия 2: 5-(2,2-Дифторэтокси)-2-(метилтио)пиримидин (2,46 г) растворяли в дихлорметане (45 мл). После добавления 3-хлорпербензойной кислоты (8,02 г) смесь перемешивали в течение 90 мин при комнатной температуре. Смесь разбавляли дихлорметаном, промывали насыщенным водным раствором карбоната натрия и водой. Органический слой высушивали над сульфатом натрия и концентрировали. Неочищенный продукт очищали фильтрованием с дихлорметаном через колонку 50 г силикагеля-NH2 с получением 5-(2,2-дифторэтокси)-2-(метилсульфонил)пиримидина (2,73 г) в виде бесцветного твердого вещества. МС: m/z равно 239,1 [М+Н]+.
Стадия 3: 5-(2,2-Дифторэтокси)-2-(метилсульфонил)пиримидин (2,31 г) растворяли в дихлорметане (26,4 мл). После добавления тетрабутиламмония цианида (3,25 г) смесь перемешивали в течение 18 ч при комнатной температуре. Смесь выпаривали до меньшего объема и непосредственно очищали хроматографией (силикагель, дихлорметан) с получением 5-(2,2-дифторэтокси)пиримидин-2-карбонитрила (2,19 г) в виде светло-желтой жидкости.
Стадия 4: По аналогии с примером 1, стадия 1, 5-(2,2-дифторэтокси)пиримидин-2-карбонитрил преобразовывали в 5-(2,2-дифторэтокси)-N'-гидроксипиримидин-2-карбоксимидамид путем обработки гидроксиламина гидрохлоридом в присутствии водного раствора гидроксида натрия. Бесцветное твердое вещество. МС: m/z равно 219,1 [М+Н]+.
Стадия 5: По аналогии с примером 1, стадия 2, 5-(2,2-дифторэтокси)-N'-гидроксипиримидин-2-карбоксимидамид преобразовывали в 5-(2,2-дифторэтокси)-N-гидроксипиримидин-2-карбимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C. Бесцветное твердое вещество.
Стадия 6: 1-(2-Фтор-5-гидроксифенил)этанон (6,17 г) и пиридин (6,33 г) объединяли с дихлорметаном (60 мл) и охлаждали в ледяной бане. Добавляли по каплям трифторметансульфоновый ангидрид (13,5 г). Через 15 мин ледяную баню удаляли, и смесь перемешивали при комнатной температуре в течение 1 ч. Смесь снова охлаждали в ледяной бане и гасили добавлением насыщенного раствора NaHCO3 и воды. Органическую фазу отделяли, промывали водой, высушивали (MgSO4) и фильтровали. Фильтрат концентрировали до сухого состояния и высушивали с получением 3-ацетил-4-фторфенилтрифторметансульфоната в виде светло-коричневой жидкости (11,17 г).
Стадия 7: Раствор 3-ацетил-4-фторфенилтрифторметансульфонат (5,018 г) в N,N-диметилформамиде (30 мл) и триэтиламине (10,9 г) продували аргоном в течение 10 мин. Добавляли йодид меди (I) (334 мг), триметилсилилацетилен (3,44 г) и бис(трифенилфосфин)палладия (II) хлорида (615 мг), и смесь нагревали до 80°C в течение 110 мин. После охлаждения до комнатной температуры добавляли воду, и смесь экстрагировали EtOAc. Органические слои высушивали над MgSO4, фильтровали через слой SiO2 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (SiO2, от 0% до 30% EtOAc в н-гептане) с получением 1-(2-фтор-5-((триметилсилил)этинил)фенил)этанона (4,08 г) в виде светло-коричневой жидкости.
Стадия 8: 1-(2-Фтор-5-((триметилсилил)этинил)фенил)этанон (1 г) растворяли в дихлорметане (60,1 мл) в атмосфере аргона и охлаждали до 0°C. После добавления тетрабутиламмония фторида (TBAF) (1 М в ТГФ, 4,69 мл) смесь перемешивали в течение 85 мин при 0°C. Смесь разбавляли дихлорметаном и промывали водой, Объединенные органические слои высушивали над сульфатом натрия и концентрировали. Неочищенное вещество очищали флэш-хроматографией (SiO2, от 0% до 50% EtOAc в н-гептане) с получением 1-(5-этинил-2-фторфенил)этанона в виде светло-желтого твердого вещества (590 мг).
Стадия 9: По аналогии с примером 1, стадия 3, 1-(5-этинил-2-фторфенил)этанон преобразовывали в 1-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)этанон путем обработки 5-(2,2-дифторэтокси)-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Светло-желтое твердое вещество. МС: m/z равно 364,1 [М+Н]+.
Стадия 10: 1-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)этанон (1,15 г) и (R)-(+)-2-метил-2-пропансульфинамид (767 мг) растворяли в атмосфере аргона в ТГФ (6,42 мл). После добавления этоксида титана (IV) (1,44 г) реакционную смесь перемешивали в течение 3 недель. После добавления 0,5 мл воды, 25 мл этилацетата и дикалита смесь перемешивали в течение 10 мин, фильтровали и хорошо промывали этилацетатом. Фильтрат концентрировали и очищали хроматографией (SiO2, от 0% до 100% EtOAc в н-гептане) с получением (R)-N-(1-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)этилиден)-2-метилпропан-2-сульфинамида (305 мг) в виде беловатого твердого вещества. МС: m/z равно 467,2 [М+Н]+.
Стадия 11: По аналогии с синтезом промежуточного соединения I1A, стадия 1, (R)-N-(1-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)этилиден)-2-метилпропан-2-сульфинамид преобразовывали в (R)-N-((2R)-1-(2-циано-N-метилпропан-2-илсульфонимидоил)-2-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид путем обработки 2-(N,S-диметилсульфонимидоил)-2-метилпропаннитрилом (предварительно обработан бис(триметилсилил)амидом). Светло-желтое твердое вещество. МС: m/z равно 627,1 [М+Н]+.
Стадия 12: По аналогии с синтезом промежуточного соединения I1A, стадия 2, (R)-N-((2R)-1-(2-циано-N-метилпропан-2-илсульфонимидоил)-2-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)пропан-2-ил)-2-метилпропан-2-сульфинамид подвергали взаимодействию с HCl в смеси диоксан/метанол с получением после хроматографии (SiO2, от 0% до 100% EtOAc в н-гептане) 2-((2R)-2-амино-2-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрила (изомера первого элюирования, беловатое твердое вещество, МС: m/z равно 523,2 [М+Н]+) и 2-((2R)-2-амино-2-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрила (изомер второго элюирования, беловатое твердое вещество, МС: m/z равно 523,2 [М+Н]+).
Стадия 13: По аналогии с синтезом промежуточного соединения I2A, стадия 1, 2-((2R)-2-амино-2-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил обрабатывали хлоридом меди (I) с получением (1R,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиримидин-2-ил]-1,2-оксазол-5-ил]-2-фторфенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина в виде беловатого твердого вещества, МС: m/z равно 523,2 [М+Н]+.
Пример 19
(1S,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиримидин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амин
Стадия 1: По аналогии с синтезом промежуточного соединения I2A, стадия 1, 2-((2R)-2-амино-2-(5-(3-(5-(2,2-дифторэтокси)пиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-N-метилпропилсульфонимидоил)-2-метилпропаннитрил обрабатывали хлоридом меди (I) с получением (1S,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиримидин-2-ил]-1,2-оксазол-5-ил]-2-фторфенил]-3,6,6-триметил-1-метилимино-1-оксо-2Н-1,4-тиазин-5-амина в виде беловатого твердого вещества, МС: m/z равно 523,2 [М+Н]+.
Пример 20
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6A) преобразовывали в трет-бутил-((1R,5R)-5-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-5-метоксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Неочищенный продукт невозможно было получить в чистом виде, и его использовали непосредственно в следующей стадии.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 473,2 [М+Н]+.
Пример 21
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-(2,2,2-трифторэтокси)пиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 2, N'-гидрокси-5-(2,2,2-трифторэтокси)пиразин-2-карбоксимидамид (CAS №1344794-41-7) преобразовывали в N-гидрокси-5-(2,2,2-трифторэтокси)пиразин-2-карбимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C.Беловатое твердое вещество.
Стадия 2: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6A) преобразовывали в трет-бутил-((1R,5R)-5-(2-фтор-5-(3-(5-(2,2,2-трифторэтокси)пиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-5-(2,2,2-трифторэтокси)пиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 639,4 [М-Н]-.
Стадия 3: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(2-фтор-5-(3-(5-(2,2,2-трифторэтокси)пиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-3-(2-фтор-5-(3-(5-(2,2,2-трифторэтокси)пиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 541,2 [М+Н]+.
Пример 22
(1R,3R)-5-амино-3-(5-(3-(5-(циклопропилметокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид
Стадия 1: По аналогии с примером 1, стадия 2, 5-(циклопропилметокси)-N'-гидроксипиразин-2-карбоксимидамид (CAS №1344867-87-3) преобразовывали в 5-(циклопропилметокси)-N-гидроксипиразин-2-карбимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C. Беловатое твердое вещество.
Стадия 2: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I6A) преобразовывали в трет-бутил-((1R,5R)-5-(5-(3-(5-(циклопропилметокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-(циклопропилметокси)-N-гидроксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 611,4 [М-Н]-.
Стадия 3: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(5-(3-(5-(циклопропилметокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-(метилимино)-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-3-(5-(3-(5-(циклопропилметокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 513,3 [М+Н]+.
Пример 23
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-гидроксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид
В качестве побочного продукта при образовании примера 22, стадия 3, (1R,3R)-5-амино-3-(2-фтор-5-(3-(5-гидроксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2Н-1,4-тиазин-1-оксид был выделен в виде беловатого твердого вещества. МС: m/z равно 459,2 [М+Н]+.
Пример 24
(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-N-[(1R,3R)-3-(5-этинил-2-фтор-фенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат (промежуточное соединение I9A) преобразовывали в трет-бутил-N-[(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат путем обработки N-гидрокси-5-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 576,3 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-N-[(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат преобразовывали в (1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)-1,2-охаго1-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 476,3 [М+Н]+.
Пример 25
(1R,3R)-3-[2-фтор-5-[3-[5-(2,2,3,3-тетрафторпропокси)пиримидин-2-ил]изоксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат
Стадия 1: 2-Хлорпиримидин-5-ол (5,3 г) растворяли в атмосфере аргона в ацетоне (144 мл). После добавления карбоната калия (8,42 г) и 2,2,3,3-тетрафторпропилтрифторметансульфоната (12,3 г) смесь перемешивали в течение 18 ч. Смесь разбавляли около 200 мл эфира, перемешивали в течение 10 мин и фильтровали. Фильтрат концентрировали, растворяли в дихлорметане, снова фильтровали и концентрировали до сухого состояния с получением 2-хлор-5-(2,2,3,3-тетрафторпропокси)пиримидина (8,99 г, не полностью очищен) в виде оранжевого масла. МС: m/z равно 245,0 [М+Н]+.
Стадия 2: 2-Хлор-5-(2,2,3,3-тетрафторпропокси)пиримидин (1,5 г) растворяли в N,N-диметилацетамиде (25 мл). После добавления цианида цинка (864 мг) и тетракис-трифенилфосфин-палладия (709 мг) смесь перемешивали в течение 45 мин при 160°C в атмосфере аргона.
Смесь разбавляли водой, перемешивали в течение 5 мин и фильтровали. Фильтрат экстрагировали EtOAc, органические слои промывали водой, объединяли, высушивали над сульфатом натрия и концентрировали. Неочищенное вещество очищали флэш-хроматографией (силикагель, от 0% до 30% EtOAc в н-гептане) с получением 5-(2,2,3,3-тетрафторпропокси)пиримидин-2-карбонитрила (944 мг) в виде бесцветного масла. МС: m/z равно 236,1 [М+Н]+.
Стадия 3: По аналогии с примером 1, стадия 1, 5-(2,2,3,3-тетрафторпропокси)пиримидин-2-карбонитрил преобразовывали в N'-гидрокси-5-(2,2,3,3-тетрафторпропокси)пиримидин-2-карбоксимидамид путем обработки гидроксиламина гидрохлоридом в присутствии водного раствора гидроксида натрия. Бесцветное твердое вещество. МС: m/z равно 269,1 [М+Н]+.
Стадия 4: По аналогии с примером 1, стадия 2, N'-гидрокси-5-(2,2,3,3-тетрафторпропокси)пиримидин-2-карбоксимидамид преобразовывали в N-гидрокси-5-(2,2,3,3-тетрафторпропокси)пиримидин-2-карбимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C. Бесцветное твердое вещество.
Стадия 5: По аналогии с примером 1, стадия 3, трет-бутил-N-[(1R,3R)-3-(5-этинил-2-фтор-фенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат (промежуточное соединение I9A) преобразовывали в трет-бутил-N-[(1R,3R)-3-[2-фтор-5-[3-[5-(2,2,3,3-тетрафторпропокси)пиримидин-2-ил]-1,2-оксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат путем обработки N-гидрокси-5-(2,2,3,3-тетрафторпропокси)пиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 674,5 [М-Н]-.
Стадия 6: По аналогии с примером 1, стадия 4, трет-бутил-N-[(1R,3R)-3-[2-фтор-5-[3-[5-(2,2,3,3-тетрафторпропокси)пиримидин-2-ил]-1,2-оксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат преобразовывали в (1R,3R)-3-[2-фтор-5-[3-[5-(2,2,3,3-тетрафторпропокси)пиримидин-2-ил]-1,2-оксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 576,3 [М+Н]+.
Пример 26
(1R,3R)-3-[5-[3-(5-этилпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 1, 5-этилпиримидин-2-карбонитрил (CAS №1622073-68-0) преобразовывали в 5-этил-N'-гидроксипиримидин-2-карбоксимидамид путем обработки гидроксиламина гидрохлоридом в присутствии водного раствора гидроксида натрия. Беловатое твердое вещество. МС: m/z равно 167,1 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 2, 5-этил-N'-гидроксипиримидин-2-карбоксимидамид преобразовывали в 5-этил-N-гидроксипиримидин-2-карбимидоилхлорид путем обработки нитритом натрия в смеси вода/HCl при 0°C. бесцветное твердое вещество. МС: m/z равно 186,1 [М+Н]+.
Стадия 3: По аналогии с примером 1, стадия 3, трет-бутил-N-[(1R,3R)-3-(5-этинил-2-фтор-фенил)-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат (промежуточное соединение I9A) преобразовывали в трет-бутил-N-[(1R,3R)-3-[5-[3-(5-этилпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат путем обработки 5-этил-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 572,5 [М-Н]-.
Стадия 4: По аналогии с примером 1, стадия 4, трет-бутил-N-[(1R,3R)-3-[5-[3-(5-этилпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-ил]карбамат преобразовывали в (1R,3R)-3-[5-[3-(5-этилпиримидин-2-ил)-1,2-оксазол-5-ил]-2-фторфенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 474,4 [М+Н]+.
Пример 27
(6R,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((6R,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-en-10-ил)карбамат (промежуточное соединение I12A) преобразовывали в трет-бутил-((6R,8R)-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-en-10-ил)карбамат путем обработки N-гидрокси-5-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 599,3 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((6R,8R)-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат преобразовывали в (6R,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Светло-желтое твердое вещество. МС: m/z равно 499,3 [М+Н]+.
Пример 28
(6R,8R)-10-амино-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, тpeт-бyтил-((6R,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат (промежуточное соединение I12A) преобразовывали в трет-бyтил-((6R,8R)-8-(5-(3-(5-xлopпиpимидин-2-ил)изoкcaзoл-5-ил)-2-фтopфeнил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 603,3 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((6R,8R)-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат преобразовывали в (6R,8R)-10-амино-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 503,2 [М+Н]+.
Пример 29
(6R,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((6R,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат (промежуточное соединение I12A) преобразовывали в трет-бyтил-((6R,8R)-8-(2-фтop-5-(3-(5-мeтoкcипиpимидин-2-ил)изoкcaзoл-5-ил)фeнил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат путем обработки N-гидрокси-5-метоксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Светло-желтое твердое вещество. МС: m/z равно 599,4 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((6R,8R)-8-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат преобразовывали в (6R,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Светло-желтое твердое вещество. МС: m/z равно 499,3 [М+Н]+.
Пример 30
(6R,8R)-10-амино-8-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксид
Стадия 1: По аналогии с примером 1, стадия 3, тpeт-бyтил-((6R,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат (промежуточное соединение I12A) преобразовывали в трет-бутил-((6R,8R)-8-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат путем обработки 5-(2,2-дифторэтокси)-N-гидроксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Продукт не был получен в чистом виде и был использован непосредственно в следующей стадии.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((6R,8R)-8-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат преобразовывали в (6R,8R)-10-амино-8-(5-(3-(5-(2,2-дифторзтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксид путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 549,3 [М+Н]+.
Пример 31
(6S,8R)-10-амино-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((6S,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат (промежуточное соединение I12B) преобразовывали в трет-бутил-((6S,9R)-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 601,5 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((6S,8R)-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат преобразовывали в (6S,8R)-10-амино-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 503,3 [М+Н]+.
Пример 32
(6S,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((6S,8R)-8-(5-этинил-2-фторфенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат (промежуточное соединение I12B) преобразовывали в трет-бутил-((6S,8R)-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат путем обработки N-гидрокси-5-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 599,3 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((6S,8R)-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-оксидо-6-тиа-9-азаспиро[4.5]дец-9-ен-10-ил)карбамат преобразовывали в (6S,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 499,3 [М+Н]+.
Пример 33
(1R,3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксид
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-1-(циклопропилимино)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I15A) преобразовывали в трет-бутил-((1R,5R)-1-(циклопропилимино)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-5-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 599,5 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-1-(циклопропилимино)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 499,4 [М+Н]+.
Пример 34
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-1-циклопропилимино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-1-(циклопропилимино)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I15A) преобразовывали в трет-бутил-((1R,5R)-5-(5-(3-(5-xлopпиpимидин-2-ил)изoкcaзoл-5-ил)-2-фторфенил)-1-(циклопропилимино)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 601,7 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-1-(циклопропилимино)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)-1,2-оксазол-5-ил]-2-фторфенил]-1-циклопропилимино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 503,4 [М+Н]+.
Пример 35
(1S,3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5R)-1-(циклопропилимино)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I15B) преобразовывали в трет-бутил-((1S,5R)-1-(циклопропилимино)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-5-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 599,5 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5R)-1-(циклопропилимино)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 499,4 [М+Н]+.
Пример 36
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-1-(циклопропилимино)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5R)-1-(циклопропилимино)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I15B) преобразовывали в трет-бутил-((1S,5R)-5-(5-(3-(5-xлopпиpимидин-2-ил)изoкcaзoл-5-ил)-2-фторфенил)-1-(циклопропилимино)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 601,7 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-1-(циклопропилимино)-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3R)-5-aминo-3-(5-(3-(5-xлopпиpимидин-2-ил)изoкcaзoл-5-ил)-2-фтopфeнил)-1-(циклопропилимино)-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 503,4 [М+Н]+.
Пример 37
(1S,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I18A) преобразовывали в трет-бутил-((1S,5R)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-6-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 639,3 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5R)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 541,2 [М+Н]+.
Пример 38
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I18A) преобразовывали в трет-бутил-((1S,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 6-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 643,3 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 545,1 [М+Н]+.
Пример 39
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I18B) преобразовывали в трет-бутил-((1R,5R)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-6-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 639,4 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Бесцветное твердое вещество. МС: m/z равно 541,2 [М+Н]+.
Пример 40
(1R,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазин-1-оксида 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I18B) преобразовывали в трет-бутил-((1R,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Бесцветное твердое вещество. МС: m/z равно 643,3 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-2,2,5-триметил-1-оксидо-1-((2,2,2-трифторэтил)имино)-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-aминo-3-(5-(3-(5-xлopпиpимидин-2-ил)изoкcaзoл-5-ил)-2-фторфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2Н-1,4-тиазине 1-оксид 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 545,2 [М+Н]+.
Пример 41
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-1-имино-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксид
Стадия 1: По аналогии с примером 1, стадия 3, тpeт-бyтил-((1R,5R)-5-(5-этинил-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I20A) преобразовывали в трет-бутил-((1R,3R)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки М-гидрокси-5-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 559,3 [М+Н]+.
Стадия 2: По аналогии с примером 1, стадия 4, тpeт-бyтил-((1R,5R)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-1-имино-3,6,6-триметил-3,6-дигидро-2Н-1,4-тиазин-1-оксид путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 459,3 [М+Н]+.
Пример 42
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-1-имино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амин; соль 2,2,2-трифторуксусной кислоты 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1R,5R)-5-(5-этинил-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I20A) преобразовывали в трет-бутил-((1R,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 561,5 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1R,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)-1,2-оксазол-5-ил]-2-фторфенил]-1-имино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 463,3 [М+Н]+.
Пример 43
(1S,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-1-имино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I20B) преобразовывали в трет-бутил-((1S,5R)-5-(2-фтop-5-(3-(5-мeтoкcипиpaзин-2-ил)изoкcaзoл-5-ил)фeнил)-1-иминo-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки N-гидрокси-5-метоксипиразин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 557,5 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5R)-5-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)-1,2-оксазол-5-ил]фенил]-1-имино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 459,3 [М+Н]+.
Пример 44
(1S,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-1-имино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат
Стадия 1: По аналогии с примером 1, стадия 3, трет-бутил-((1S,5R)-5-(5-этинил-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат (промежуточное соединение I20B) преобразовывали в трет-бутил-((1S,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат путем обработки 5-хлор-N-гидроксипиримидин-2-карбимидоилхлоридом в присутствии бикарбоната натрия. Беловатое твердое вещество. МС: m/z равно 561,5 [М-Н]-.
Стадия 2: По аналогии с примером 1, стадия 4, трет-бутил-((1S,5R)-5-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-1-имино-2,2,5-триметил-1-оксидо-5,6-дигидро-2Н-1,4-тиазин-3-ил)карбамат преобразовывали в (1S,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)-1,2-оксазол-5-ил]-2-фторфенил]-1-имино-3,6,6-триметил-1-оксо-2Н-1,4-тиазин-5-амина 2,2,2-трифторацетат путем обработки трифторуксусной кислотой в дихлорметане. Беловатое твердое вещество. МС: m/z равно 463,3 [М+Н]+.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2,2,2-ТРИФТОРЭТИЛ-ТИАДИАЗИНЫ | 2015 |
|
RU2692102C2 |
| ИНГИБИТОРЫ АКТИВНОСТИ АКТ | 2010 |
|
RU2579513C2 |
| НОВОЕ ПРОИЗВОДНОЕ НИКОТИНАМИДА ИЛИ ЕГО СОЛЬ | 2011 |
|
RU2576623C2 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ АМИНОДИГИДРОТИАЗИНА | 2009 |
|
RU2476431C2 |
| 2-АМИНО-5,5-ДИФТОР-5,6-ДИГИДРО-4Н-ОКСАЗИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ВАСЕ 1 И(ИЛИ) ВАСЕ 2 | 2010 |
|
RU2515221C2 |
| ЗАМЕЩЕННЫЕ ТИОФЕНКАРБОКСАМИДЫ И АНАЛОГИ В КАЧЕСТВЕ АНТИБАКТЕРИАЛЬНЫХ СРЕДСТВ | 2019 |
|
RU2799335C2 |
| ПИРИДАЗИНОНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ PARP | 2008 |
|
RU2490265C2 |
| 2,5,6,7-ТЕТРАГИДРО-[1,4]ОКСАЗЕПИН-3-ИЛАМИНЫ ИЛИ 2,3,6,7-ТЕТРАГИДРО-[1,4]ОКСАЗЕПИН-5-ИЛАМИНЫ | 2011 |
|
RU2570796C2 |
| НОВОЕ СОЕДИНЕНИЕ БИФЕНИЛА ИЛИ ЕГО СОЛЬ | 2016 |
|
RU2726622C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2019 |
|
RU2821941C2 |
Изобретение относится к соединениям формулы I, а также к фармацевтическим композициям на их основе. Технический результат: получены новые соединения, обладающее активностью ингибитора ВАСЕ1, полезные в терапевтическом и/или профилактическом лечении опосредованных заболеваний. 4 н. и 18 з.п. ф-лы, 9 табл., 44 прим.
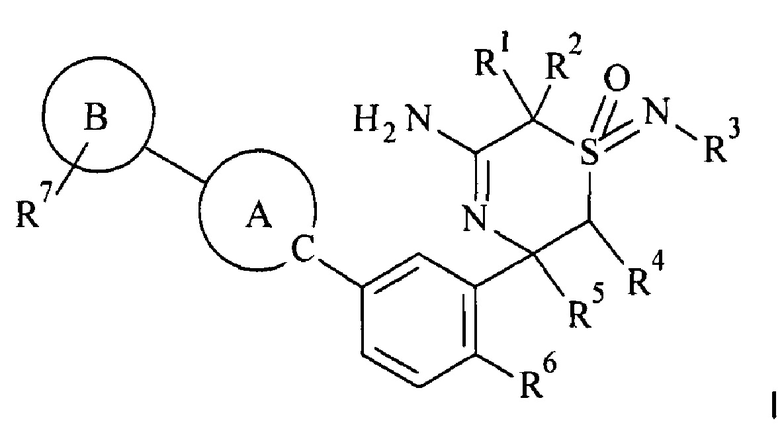
1. Соединение формулы I

где:
A представляет собой 5-членную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из O, N,
B представляет собой 6-членную гетероарильную группу, содержащую 1-2 гетероатома N,
R1 представляет собой C1-6алкил;
R2 представляет собой C1-6алкил;
или R1 и R2 вместе с C-атомом, к которому они присоединены, образуют C3-5-циклоалкил;
R3 выбран из группы, состоящей из
i) атома водорода,
ii) C3циклоалкила;
iii) галоген-C1-6алкила и
iv) C1-6алкила;
R4 представляет собой атом водорода;
R5 выбран из группы, состоящей из i) C1-6алкила и
ii) галоген-C1-6алкила;
R6 представляет собой атом галогена;
R7 выбран из группы, состоящей из
i) циано,
ii) OH,
iii) атома галогена,
iv) C1-6алкила,
v) C1-6алкокси-C1-6алкила,
vi) C1-6алкокси и
vii) галоген-C1-6алкокси;
или его фармацевтически приемлемые соли.
2. Соединение формулы I по п. 1, где:
A представляет собой 5-членную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из O, N,
B представляет собой 6-членную гетероарильную группу, содержащую 1 -2 гетероатома N,
R1 представляет собой C1-6алкил;
R2 представляет собой C1-6алкил;
или R1 и R2 вместе с C-атомом, к которому они присоединены, образуют C3-5-циклоалкил -;
R3 выбран из группы, состоящей из
i) атома водорода,
ii) галоген-C1-6алкила и
iii) C1-6алкила;
R4 представляет собой атом водорода;
R5 выбран из группы, состоящей из
i) C1-6алкила и
ii) галоген-C1-6алкила;
R6 представляет собой атом галогена;
R7 выбран из группы, состоящей из
i) циано,
ii) атома галогена,
iii) C1-6алкила,
iv) C1-6алкокси-C1-6алкила,
v) C1-6алкокси и
vi) галоген-C1-6алкокси;
или его фармацевтически приемлемые соли.
3. Соединение формулы I по п. 1 или 2, которое имеет формулу Ia, где A, B, R1, R2, R3, R4, R5, R6 и R7 являются такими, как определено в любом из п п. 1 или 2

4. Соединение формулы I по любому из пп. 1–3, где A представляет собой изоксазолил или триазолил.
5. Соединение формулы I по любому из пп. 1–4, где B представляет собой пиразинил, пиримидинил или пиридинил.
6. Соединение формулы I по любому из пп. 1–5, где R1 представляет собой C1-6-алкил.
7. Соединение формулы I по любому из пп. 1–6, где R1 представляет собой метил.
8. Соединение формулы I по любому из пп. 1-7, где R2 представляет собой C1-6-алкил.
9. Соединение формулы I по любому из пп. 1-8, где R2 представляет собой метил.
10. Соединение формулы I по любому из пп. 1–5, где R1 и R2 вместе с C-атомом, к которому они присоединены, образуют C3-5-циклоалкил-.
11. Соединение формулы I по любому из пп. 1–5 или 10, где R1 и R2 вместе с C-атомом, к которому они присоединены, образуют циклопентил.
12. Соединение формулы I по любому из пп. 1–11, где R3 представляет собой H, CH3, CD3, CH2CF3 или циклопропил.
13. Соединение формулы I по любому из пп. 1-11, где R3 представляет собой C1-6-алкил.
14. Соединение формулы I по любому из пп. 1-13, где R3 представляет собой метил.
15. Соединение формулы I по любому из пп. 1–14, где R5 представляет собой метил или –CH2F.
16. Соединение формулы I по любому из пп. 1–15, где R6 представляет собой F.
17. Соединение формулы I по любому из пп. 1–16, где R7 представляет собой Br, Cl, CN, Et, Me, OCH2CF2CHF2, OCH2CF3, OCH2CHF2, OH или OMe.
18. Соединение, выбранное из группы, состоящей из:
(1R,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2H-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1R,3R)-3-[2-фтор-5-[3-[5-(2,2,3,3-тетрафторпропокси)пиримидин-2-ил]изоксазол-5-ил]фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2H-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-1-циклопропилимино-3,6,6-триметил-1-оксо-2H-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1R,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-1-имино-3,6,6-триметил-1-оксо-2H-1,4-тиазин-5-амина; 2,2,2-трифторуксусной кислоты 2,2,2-трифторацетата,
(1R,3R)-3-[5-[3-(5-этилпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-оксо-1-(тридейтериометилимино)-2H-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1R,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиримидин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2H-1,4-тиазин-5-амина,
(1R,3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-3,6-дигидро-2H-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-(2,2,2-трифторэтокси)пиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-гидроксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-1-имино-3,6,6-триметил-3,6-дигидро-2H-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(5-(3-(5-(циклопропилметокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида,
(1R,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3S)-3-[2-фтор-5-[3-(5-метоксипиримидин-2-ил)изоксазол-5-ил]фенил]-3-(фторметил)-6,6-диметил-1-метилимино-1-оксо-2H-1,4-тиазин-5-амина,
(1R,3S)-5-амино-3-(5-(1-(5-хлорпиридин-2-ил)-1H-1,2,3-триазол-4-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3S)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3S)-5-амино-3-(5-(3-(5-бром-3-метилпиридин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1R,3S)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-3-[2-фтор-5-[3-(5-метоксипиразин-2-ил)изоксазол-5-ил]фенил]-1-имино-3,6,6-триметил-1-оксо-2H-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1S,3R)-3-[5-[3-(5-хлорпиримидин-2-ил)изоксазол-5-ил]-2-фтор-фенил]-1-имино-3,6,6-триметил-1-оксо-2H-1,4-тиазин-5-амина 2,2,2-трифторацетата,
(1S,3R)-3-[5-[3-[5-(2,2-дифторэтокси)пиримидин-2-ил]изоксазол-5-ил]-2-фтор-фенил]-3,6,6-триметил-1-метилимино-1-оксо-2H-1,4-тиазин-5-амина,
(1S,3R)-5-амино-1-(циклопропилимино)-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-1-(циклопропилимино)-3,6,6-триметил-3,6-дигидро-2H-1,4-тиазин-1-
оксида 2,2,2-трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-((2,2,2-трифторэтил)имино)-3,6-дигидро-2H-1,4-тиазин-1-оксида 2,2,2-трифторацетата,
(1S,3S)-5-амино-3-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида,
(6R,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетата,
(6R,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиримидин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетата,
(6R,8R)-10-амино-8-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-
2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида,
(6R,8R)-10-амино-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетата,
(6S,8R)-10-амино-8-(2-фтор-5-(3-(5-метоксипиразин-2-ил)изоксазол-5-ил)фенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2 -трифторацетата,
(6S,8R)-10-амино-8-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-8-метил-6-(метилимино)-6-тиа-9-азаспиро[4.5]дец-9-ен-6-оксида 2,2,2-трифторацетата, и
6-(4-(3-((1R,3S)-5-амино-3-(фторметил)-6,6-диметил-1-(метилимино)-1-оксидо-3,6-дигидро-2H-1,4-тиазин-3-ил)-4-фторфенил)-1H-1,2,3-триазол-1-ил)никотинонитрила 2,2,2-трифторацетата.
19. Соединение, выбранное из группы, состоящей из:
(1R,3S)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида трифторацетата,
(1R,3S)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3-(фторметил)-6,6-диметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида трифторацетата,
(1S,3R)-5-амино-3-(5-(3-(5-(2,2-дифторэтокси)пиразин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида трифторацетата, и
(1S,3R)-5-амино-3-(5-(3-(5-хлорпиримидин-2-ил)изоксазол-5-ил)-2-фторфенил)-3,6,6-триметил-1-(метилимино)-3,6-дигидро-2H-1,4-тиазин-1-оксида трифторацетата.
20. Соединение формулы I по любому из пп. 1–19 для применения в качестве ингибитора BACE1.
21. Соединение формулы I по любому из пп. 1–19 для применения в качестве терапевтически активного вещества для терапевтического и/или профилактического лечения заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидных бляшек и дополнительных отложений, или болезни Альцгеймера.
22. Фармацевтическая композиция, обладающая ингибиторной активностью в отношении BACE1, содержащая эффективное количество соединения, раскрытого в любом из пп. 1–19, и фармацевтически приемлемый носитель.
| WO2013028670 A1, 28.02.2013 | |||
| WO2012139425 A1, 18.10.2012 | |||
| WO2014150331A1, 25.09.2014 | |||
| ЗАМЕЩЕННЫЕ ОКСАЗОЛИДИНОНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ ЗАМЕЩЕННЫХ ОКСАЗОЛИДИНОНОВ | 2000 |
|
RU2297415C2 |
Авторы
Даты
2020-01-28—Публикация
2016-03-16—Подача