Область техники
Изобретение относится к области медицины, в частности к фармацевтической промышленности, и описывает антибактериальную фармацевтическую композицию, выполненную в виде таблетки, включающую эффективное количество этамбутола и вспомогательных веществ, отличающуюся отсутствием канцерогенных веществ в своем составе.
Уровень техники
Туберкулез (от лат. tuberculum - бугорок) - широко распространенное в мире инфекционное заболевание человека и животных, вызываемое различными видами микобактерий, как правило, Mycobacterium tuberculosis. Туберкулез обычно поражает легкие, реже затрагивая другие органы и системы.
Туберкулез в настоящее время остается одной из главных проблем здравоохранения во всем мире, от него ежегодно умирают около трех миллионов человек. По оценке ВОЗ, Российская Федерация включена в список стран с высоким бременем туберкулеза, где отмечается 80% всех предполагаемых новых случаев туберкулеза в мире (22 страны). На долю РФ приходится 1,7% от общего числа заболевших во всем мире. [World Health Organization. Global Tuberculosis Control: WHO Report 2018. New York: World Health Organization, WHO/CDS/CPC/TB/2018.25].
В настоящее время одной из самых актуальных и сложных проблем фтизиатрии является химиотерапия больных туберкулезом легких, вызванным лекарственно-резистентными штаммами Mycobacterium tuberculosis. Для этой категории пациентов принципиально важным является включение в схемы химиотерапии противотуберкулезных препаратов резервного ряда.
В настоящее время Центры по контролю и профилактике заболеваний США (CDC), Американское торакальное общество и Американское общество по инфекционным болезням (IDSA) рекомендуют несколько возможных режимов на основе комплекса препаратов для лечения туберкулеза легких. Данные режимы имеют минимальную продолжительность 6 месяцев (26 недель) и состоят из начальной интенсивной фазы (2 месяца) и фазы продолжения (обычно от 4 до 7 месяцев). Этамбутол в этих режимах считается препаратом первой линии. Кроме того, Федеральное агентство США по контролю за медикаментами и пищевыми продуктами (FDA) поместило этамбутол в разряд орфанных препаратов.
Этамбутол ((+)-N,N-Этилен-бис-(2-аминобутан-1-ола), или (+)-N,N-бис[1-(оксиметил)-пропил]-этилендиимина дигидрохлорид) оказывает выраженное туберкулостатическое действие, подавляет размножение микобактерий туберкулеза, устойчивых к стрептомицину, изониазиду, пароаминосалициловой кислоте (ПАСК), этионамиду, канамицину. Устойчивость микобактерий туберкулеза к этамбутолу развивается относительно медленно.
Активность препарата связана с ингибированием ферментов, участвующих в синтезе клеточной стенки микобактерий. Этамбутол активен только в отношении размножающихся микобактерий, эффект наблюдается через 1-2 дня.
В целом, имеющийся на сегодняшний день многолетний опыт применения этамбутола позволяет рассматривать данный препарат как весьма перспективный для дальнейшего использования в клинической физиатрической практике.
Из уровня техники известны следующие, зарегистрированные в РФ, таблетированные лекарственные препараты этамбутола:
- «Этамбутол» таблетки в дозировке 100, 200, 400, 600, 800, 1000 мг, производства ООО «Виренд Интернэйшнл» (Россия), регистрационное удостоверение ЛП-004898 от 25.06.2018, который был принят за прототип предлагаемого технического решения;
- «Этамбутол-Акри»® таблетки в дозировке 400 мг, производства ООО «Химико-фармацевтический комбинат «АКРИХИН»» (Россия), регистрационное удостоверение N000043/01 от 19.01.2012;
- «Этамбусин»® таблетки в дозировке 200 и 400 мг, производства ОАО «Акционерное Курганское общество медицинских препаратов и изделий «Синтез»» (Россия), регистрационное удостоверение Р N000809/01-2001 от 13.04.2010;
- «Комбутол» таблетки в дозировке 100, 200, 400, 600, 800, 1000 мг, производства фирмы «Люпин Лимитед» (Индия), регистрационное удостоверение П N015660/01 от 25.05.2009;
- «ЕМБ-Фатол 400» таблетки покрытые оболочкой в дозировке 400 мг, производства фирмы «Римзер Арцнаймиттель АГ» (Германия), регистрационное удостоверение П N014969/01 от 13.05.2009;
- «Этамбутол» таблетки в дозировке 200, 400, 600, 800, 1000 мг, производства фирмы «Шрея Лайф Сайенсиз Пвт. Лтд» (Индия), регистрационное удостоверение П N014625/01-2002 от 15.12.2008;
- «Этамбутол ШТАДА» таблетки в дозировке 400 мг, производства ОАО «Нижегородский химико-фармацевтический завод» (Россия), регистрационное удостоверение Р N001508/01 от 13.08.2008;
- «Екокс» таблетки покрытые пленочной оболочкой в дозировке 400 мг, производства фирмы «Маклеодз Фармасьютикалз Лтд» (Индия), регистрационное удостоверение П N013049/01 от 07.09.2007;
- «Этамбутол» таблетки в дозировке 400 мг; производства АО «Фармасинтез» (Россия), регистрационное удостоверение ЛСР-002624/07 от 07.09.2007;
- «Ли-бутол» таблетки в дозировке 400 мг, производства ЗАО «Фармгид» (Россия), регистрационное удостоверение П N016310/01 от 27.05.2005;
Указанные препараты этамбутола обладают хорошей эффективностью, однако вместе с тем оказывают токсическое воздействие на организм. Так, среди побочных действий этамбутола могут проявляться периферические невриты и полинейропатии, атрофия зрительного нерва; ухудшение остроты зрения, усиление кашля, диспептические явления (тошнота, рвота, диарея), боль в животе, нарушение функции печени, кожная сыпь, лейкопения, обострение (приступ) подагры и другие.
Кроме того, в состав 8 из 10 указанных препаратов в качестве вспомогательного вещества входит тальк, отнесенный Международным агентством по изучению рака (МАИР) Всемирной организации здравоохранения (ВОЗ) к 1 группе веществ и группы веществ для которых существуют достоверные сведения о канцерогенности для человека.
Опасность талька обусловлена тем, что это природный минерал, который зачастую соседствует и образует примеси с месторождениями асбеста, известного своей канцерогенностью.
Некоторые исследования указывают на возможность того, что тальк сам по себе увеличивает риск рака легкого. В пользу этого говорит тайваньский мета-анализ 14 исследований, который показал повышенный риск рака у работников шахт, добывающих тальк.
Вместе с тем, в научном сообществе на сегодняшний день существуют различные точки зрения о безопасности применения талька в фармацевтике и косметологии. Мнения ученых в этом вопросе расходятся.
Сегодня использование талька ограничивается в товарах для детей и косметике только в Канаде и ЕС. Международные организации ждут более определенных научных данных, прежде чем принимать радикальные решения. В настоящее время тальк не включен в список потенциальных канцерогенов Национальной токсикологической программы США.
Тем не менее, учитывая наличие легочной патологии у пациентов, принимающих этамбутол и вышеуказанные данные о потенциальной опасности талька, логичным и обоснованным представляется создание таблетированных лекарственных форм, не содержащих указанное вспомогательное вещество.
Так же вышеуказанный перечень, зарегистрированных в РФ, таблетированных лекарственных форм этамбутола, содержит 2 препарата, в составе которых отсутствует тальк, однако данные препараты выпускаются лишь в дозировке 400 мг и представлены лишь двумя производителями, один из которых иностранный.
Таблетированных препаратов, содержащих этамбутол в дозировках 100, 200, 400, 600, 800 и 1000 мг, отличающихся отсутствием талька в своем составе, из предшествующего уровня техники выявить не удалось.
Таким образом, существует потребность в разработке качественных и доступных фармацевтических композиций этамбутола в дозировках от 100 до 1000 мг, отечественного производства, предпочтительно в виде таблеток, удобных для применения и стабильных при хранении, отличающихся отсутствием канцерогенных веществ в своем составе.
Технической задачей настоящего изобретения является расширение перечня безопасных лекарственных средств отечественного производства.
Техническим результатом (целью) изобретения является создание фармацевтических композиций этамбутола, содержащих 100, 200, 400, 600, 800, 1000 мг активного действующего вещества, выполненных в виде таблеток, удобных для применения и фармацевтически эквивалентных прототипу, при этом отличающихся отсутствием канцерогенных веществ в своем составе.
Для достижения указанной цели авторами настоящего изобретения была предпринята попытка разработки препарата-аналога - Этамбутол таблетки 100, 200, 400, 600, 800, 1000 мг (разрабатываемый препарат, изобретение) в сравнении с препаратом «Этамбутол» таблетки 100, 200, 400, 600, 800, 1000 мг, производства ООО «Виренд Интернэйшнл» (препарат сравнения, рефетентный препарат), а так же проведены исследования фармакокинетики и биоэквивалентности препарата сравнения и разрабатываемого препарата.
Раскрытие изобретения.
Поскольку вопрос о безопасности применения талька в настоящее время остается дискуссионным, при разработке фармацевтической композиции этамбутола, авторами настоящего изобретения была поставлена задача исключения из состава препарата талька, при сохранении необходимых, препятствующих прилипанию, свойств таблетируемой массы, а так же соблюдению необходимых параметров фармакокинетики и биоэквивалентности.
Лекарственны епрепараты считаются фармацевтически эквивалентами, если они не отличаются по составу активных ингредиентов, имеют одинаковую лекарственную форму и способ введения [Dissolution Testing of Immediate Release Solid Oral Dosage Forms: Guidance for Industry, U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research. - 1997.].
Оценка биоэквивалентности (фармакокинетической эквивалентности) лекарственных средств является основным видом медико-биологического контроля воспроизведенных (генерических) лекарственных средств, не отличающихся лекарственной формой и содержанием действующих веществ от соответствующих оригинальных лекарственных средств [Марцевич С.Ю. Еще раз о проблеме взаимозаменяемости лекарств. Взгляд на дженерики с позиций доказательной медицины / С.Ю. Марцевич, Н.П. Кутишенко, В.В. Якусевич // Вести - кардиологии. - 2010. - С. 11-21.].
Биоэквивалентность - это эквивалентность воспроизведенного лекарственного средства оригинальному препарату по фармакокинетическим параметрам, т.е. биоэквивалентыми признаются два препарата, если они обладают одинаковыми степенью и скоростью всасывания, распределения и вывода лекарственного средства из организма в равных экспериментальных условиях. Учитываются три основных фармакокинетических параметра:
- биодоступность препарата (доля от общей дозы активного вещества, которая попадает в системный кровоток, - системная экспозиция) - площадь под фармакокинетической кривой - AUC;
- максимальная концентрация в плазме крови - Tmax;
- время достижения максимальной концентрации от приема препарата - Cmax.
Исследования включают определение скорости и степени всасывания оригинального и воспроизведенного препаратов при приеме в одинаковых дозах и лекарственных формах внутрь или другими способами на основании определения концентрации в жидкостях и тканях организма.
Биоэквивалентность изучается на 18-24 здоровых добровольцах с помощью рандомизированного перекрестного метода. Исследования лекарственных препаратов осуществляются по открытой рандомизированной и перекрестной сбалансированной схеме - каждый испытуемый последовательно получает исследуемый препарат (Т) и препарат сравнения ® или наоборот (схема RT/TR). Оценка биоэквивалентности всех лекарственных средств, за исключением психотропных и средств применяемых при ВИЧ-инфекции, проводится на здоровых добровольцах. Биоэквивалентность, как правило, изучается при однократном введении лекарственного препарата.
Считается, что 90% значений AUC генерического препарата не должны выходить за пределы 80-125% от таких же показателей для оригинального препарата. Для показателей Cmax и Cmax/AUC, характеризующихся большей вариабельностью, эти пределы составляют 75-133% [Марцевич С.Ю. Еще раз о проблеме взаимозаменяемости лекарств. Взгляд на дженерики с позиций доказательной медицины / С.Ю. Марцевич, Н.П. Кутишенко, В.В. Якусевич // Вести - кардиологии. - 2010. - С. 11-21.]. Если это условие соблюдается, то делается вывод о биоэквивалентности препаратов. Исследование биоэквивалетности предполагает, что фармакокинетически эквивалентные оригиналу воспроизведенные препараты обеспечивают одинаковые эффективность и безопасность фармакотерапии.
Заявляемый состав фармацевтической композиции разрабатываемого препарата найден экспериментальным путем, является оптимальным и позволяет получить технический результат, соответствующий поставленной задаче и обеспечивающей достижение технического результата.
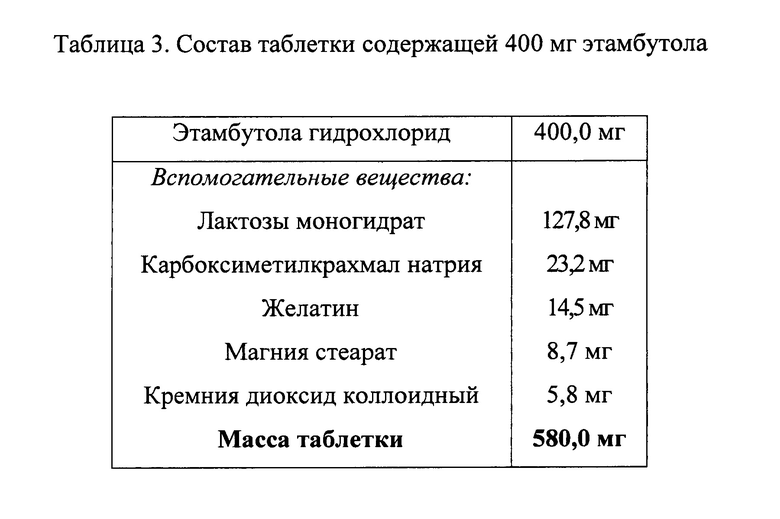
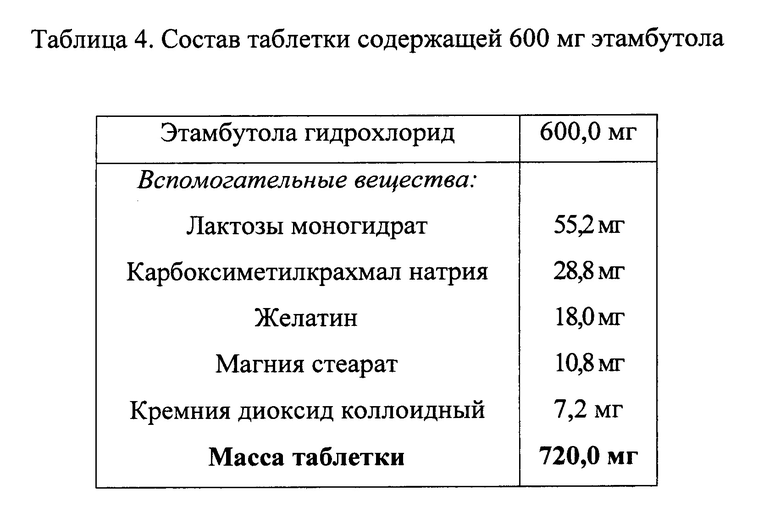
Исходя из цели исследования, экспериментальным путем были подобраны вспомогательные вещества, которые выполняют следующее функциональное назначение в препарате:
- лактозы моногидрат - наполнитель;
- карбоксиметилкрахмал натрия - дезинтегрант;
- желатин - связующий агент;
- магния стеарат - смазывающее вещество, препятствующее прилипанию;
- кремния диоксид коллоидный - вещество, улучшающее сыпучесть.
Наиболее предпочтительным является следующее содержание компонентов в мас. %:

В таблицах 1-6 приведены конкретные варианты рецептур заявленных составов.
Так же с целью сравнительного изучения свойств разработанного препарата и препарата сравнения, было проведено исследование их фармакокинетики и биоэквивалентности.
Фармакокинетические параметры были рассчитаны с применением внемодельных методов (как того требуют Методические указания [Оценка биоэквивалентности лекарственных средств: Методические указания. Министерство здравоохранения и социального развития РФ, Федеральная служба по надзору в сфере здравоохранения и социального развития, ФГУ «Научный центр экспертизы средств медицинского применения». - М., 2008. - 33 с.]) с использованием программы PK Solution 2.0 [Программный комплекс «Биоэквивалентность» (версия 2.2) // Васильев С.В. - 2012. - URL: http://биостатистика.рф/page3.html.].
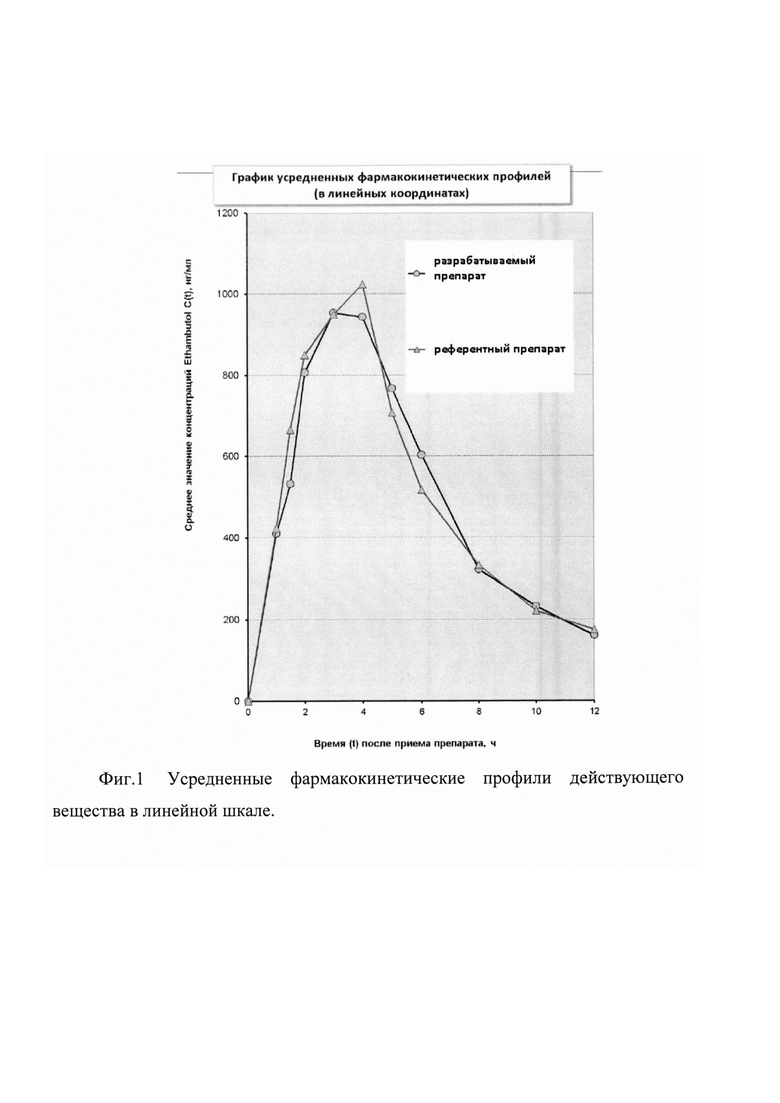
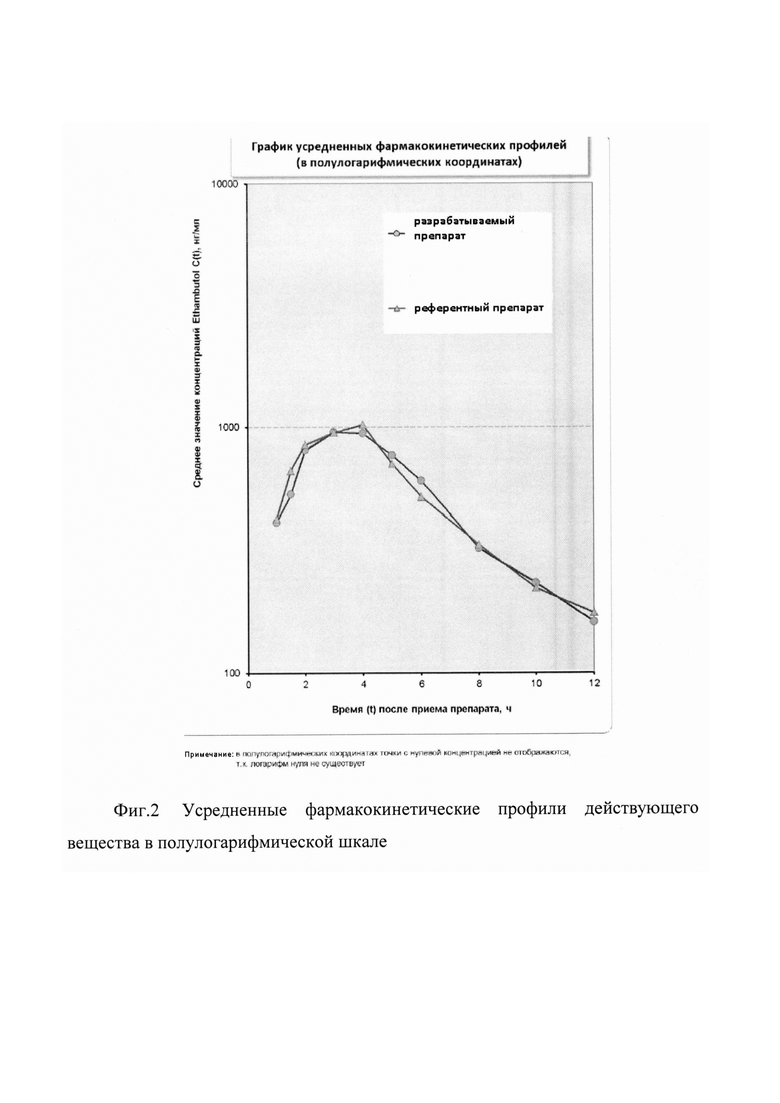
На фиг. 1-2 представлены две диаграммы усредненных фармакокинетических профилей исследуемых препаратов, содержащие графики в линейных и полулогарифмических координатах.
Как видно из представленных фармакокинетических кривых, характер зависимости «средняя концентрация действующего вещества - время» для сравниваемых препаратов практически не отличается.
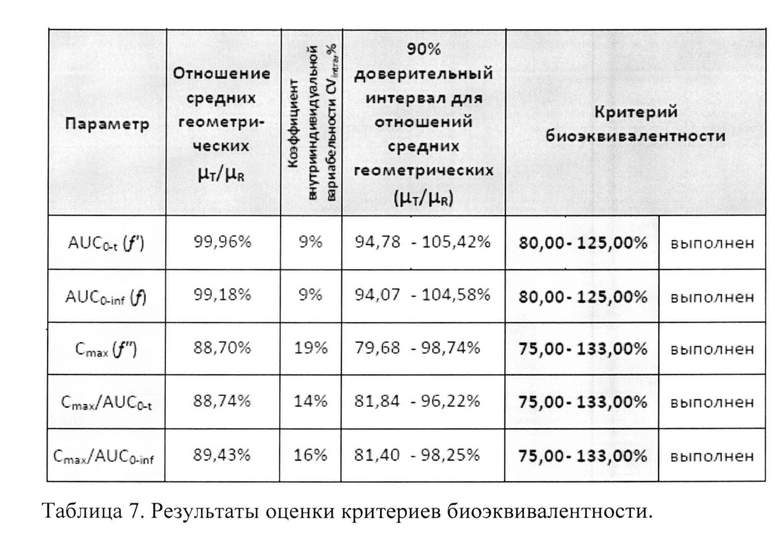
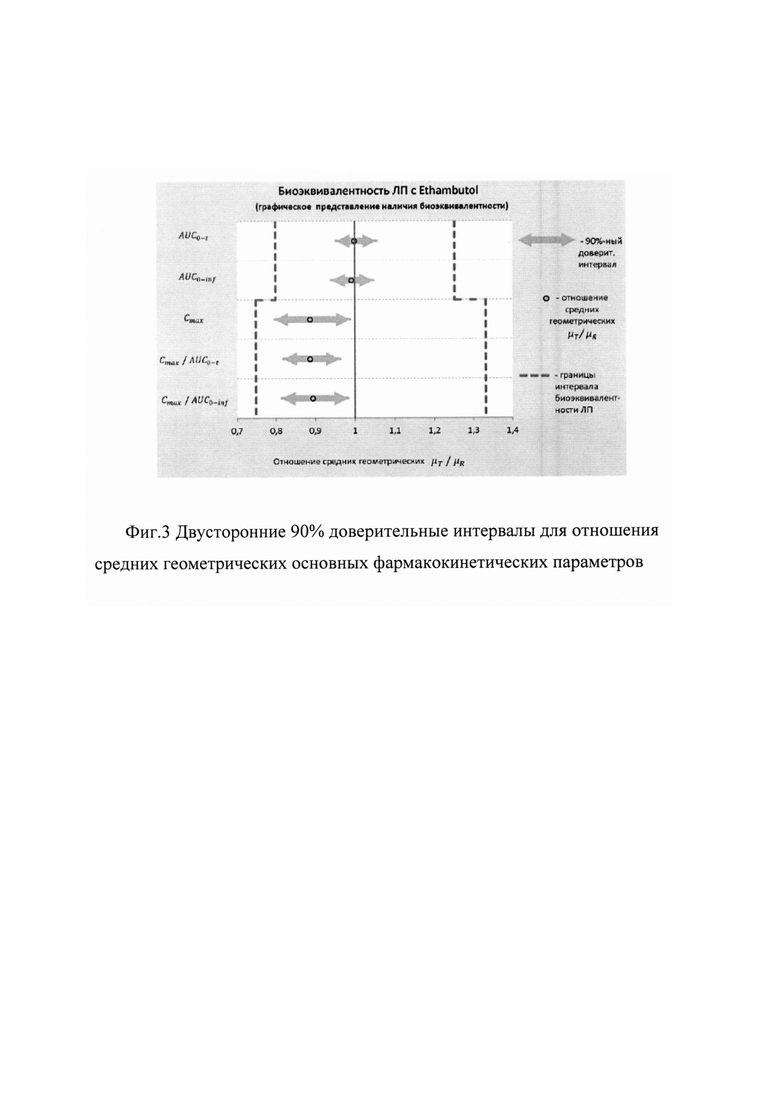
Для подтверждающей проверки биоэквивалентности лекарственных препаратов по параметрам AUC0-t и AUC0-inf использовались стандартные пределы биоэквивалентности от 80,00% до 125,00% для 90% доверительного интервала оцениваемого отношения средних геометрических μT/μR. Для параметров Cmax, Cmax/AUC0-t, Cmax/AUC0-inf - от 75,00% до 133,00%.
Рассчитанные границы двусторонних 90% доверительных интервалов для отношений средних геометрических μТ/μR фармакокинетических параметров AUC0-t, AUC0-inf, Cmax, Cmax/AUC0-t, Cmax/AUC0-inf действующего вещества, а также коэффициенты внутрииндивидуальной вариабельности Cvintra этих параметров представлены ниже - в таблице 7 и на фиг. 3.
Как видно из данных, представленных выше, 90% доверительные интервалы для всех параметров (AUC0-t, AUC0-inf, Cmax, Cmax/AUC0-t, Cmax/AUC0-inf) не выходят за рамки биоэквивалентности, установленные Методическими указаниями [Оценка биоэквивалентности лекарственных средств: Методические указания. Министерство здравоохранения и социального развития РФ, Федеральная служба по надзору в сфере здравоохранения и социального развития, ФГУ «Научный центр экспертизы средств медицинского применения». - М., 2008. - 33 с.].
Заявляемые фармацевтические композиции могут быть изготовлены способами известными специалисту в данной области путем прямого прессования в таблетки вышеуказанных действующего и вспомогательных веществ.
Таким образом, авторам настоящего изобретения удалось создать фармацевтические композиции этамбутола, содержащие 100, 200, 400, 600, 800, 1000 мг активного действующего вещества, выполненные в виде таблеток, фармацевтически эквивалентные прототипу, при этом отличающихся отсутствием канцерогенных веществ в своем составе.




| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая композиция валганцикловира | 2019 |
|
RU2720805C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ РЕИНА ИЛИ ДИАЦЕРЕИНА | 2008 |
|
RU2484816C2 |
| СИНЕРГИЧЕСКАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЦИКЛОСЕРИН И ЦИНКОСОДЕРЖАЩЕЕ СОЕДИНЕНИЕ | 2016 |
|
RU2620857C1 |
| ПРЕПАРАТЫ МЕТАКСАЛОНА | 2014 |
|
RU2684914C2 |
| КОМБИНИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ПРОТИВОТУБЕРКУЛЁЗНЫМ ДЕЙСТВИЕМ | 2003 |
|
RU2247561C1 |
| КОМБИНИРОВАННОЕ ПРОТИВОТУБЕРКУЛЕЗНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2182483C1 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ С ПРОТИВОТУБЕРКУЛЕЗНЫМ ДЕЙСТВИЕМ | 2009 |
|
RU2420288C1 |
| КОМБИНИРОВАННОЕ ПРОТИВОТУБЕРКУЛЕЗНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2431487C2 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, ОБЛАДАЮЩИЙ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2332216C2 |
| ТАКРОЛИМУС ДЛЯ УЛУЧШЕННОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ С ТРАНСПЛАНТАТАМИ | 2009 |
|
RU2574006C2 |
Изобретение относится к области медицины, а именно к фармацевтической композиции этамбутола, выполненной в виде таблетки, включающей активное вещество и комбинацию вспомогательных веществ, имеющей следующий состав в г/100 г: этамбутола гидрохлорид - 55,55-83,33; лактозы моногидрат - 35,44-7,6; карбоксиметилкрахмал натрия - 4; желатин - 2,5; магния стеарат - 1,5; кремния диоксид коллоидный - 1. Изобретение обеспечивает получение фармацевтических композиций этамбутола, содержащих 100, 200, 400, 600, 800, 1000 мг активного действующего вещества, выполненных в виде таблеток, удобных для применения, при этом отличающихся отсутствием канцерогенных веществ в своем составе. 3 ил., 7 табл.
Фармацевтическая композиция этамбутола, выполненная в виде таблетки, включающая активное вещество и комбинацию вспомогательных веществ, имеющая следующий состав в г/100 г:
| ФАРМАЦЕВТИЧЕСКАЯ ТВЕРДАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОТУБЕРКУЛЕЗНЫМ ДЕЙСТВИЕМ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2002 |
|
RU2207846C1 |
| КОМБИНИРОВАННОЕ ПРОТИВОТУБЕРКУЛЕЗНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2182483C1 |
| CN 102552204, 11.07.2012. | |||
Авторы
Даты
2020-02-04—Публикация
2019-07-25—Подача