Область техники, к которой относится изобретение
Изобретение относится к области химико-фармацевтической промышленности и касается синергической фармацевтической композиции, обладающей противотуберкулезной активностью, которая содержит в качестве активного начала циклосерин и цинкосодержащее соединение. Данная композиция содержит терапевтически эффективное количество активного начала и может быть выполнена в виде пероральной лекарственной формы. Заявленная композиция характеризуется повышенной противотуберкулезной активностью, фармакокинетикой и сниженной токсичностью.
Уровень техники
На сегодняшний день остро стоит проблема смертности от туберкулеза (ТБ). По данным Всемирной организации здравоохранения (ВОЗ) в 2007 г. во всем мире насчитывалось 9,27 миллиона случаев заболевания ТБ. Это представляет собой увеличение по сравнению с 9,24 миллиона случаев в 2006 г., 8,3 миллиона случаев в 2000 г. и 6,6 миллиона случаев в 1990 году. Большинство предполагаемых случаев в 2007 г. произошли в Азии (55%) и Африке (31%), с небольшой долей случаев в Регионе Восточного Средиземноморья (6%), Европейском регионе (5%) и Регионе стран Америки (3%). Пятью первыми странами по общему числу случаев заболевания в 2007 г. являются Индия (2,0 миллиона), Китай (1,3 миллиона), Индонезия (0,53 миллиона), Нигерия (0,46 миллиона) и Южная Африка (0,46 миллиона). Согласно оценкам, из 9,27 миллиона случаев заболевания 1,37 миллиона (15%) были ВИЧ-положительными; 79% из этих ВИЧ-положительных случаев были в Африканском регионе и 11% - в Регионе Юго-Восточной Азии.
Хотя общее число случаев заболевания ТБ в абсолютном выражении увеличивается в результате роста численности населения, число таких случаев на душу населения падает. Темпы этого снижения являются медленными, менее чем на 1% в год. Частота случаев заболевания в мире в 2004 г. достигла пика и составляла 142 случая на 100000 человек. В 2007 г. эта цифра составляла приблизительно 139 случаев заболевания на 100000 человек. Частота случаев заболевания падает в пяти из шести регионов ВОЗ (исключением является Европейский регион, в котором коэффициенты являются практически стабильными).
В 2007 г. насчитывалось приблизительно 0,5 миллиона случаев ТБ с множественной лекарственной устойчивостью (ТБ-МЛУ). На 27 стран (из которых 15 - в Европейском регионе) приходится 85% таких случаев. Пятью странами с наибольшим числом случаев ТБ-МЛУ являются Индия (131000), Китай (112000), Российская Федерация (43000), Южная Африка (16000) и Бангладеш (15000). К концу 2008 г. 55 стран и территорий сообщили по крайней мере об одном случае ТБ с широкой лекарственной устойчивостью (ТБ-ШЛУ) [доклад Всемирной организации здравоохранения (ВОЗ) за 2009 г. (найдено в сети Интернет по адресу http://www.who.int/tb/publications/global_report/2009/key_points/ru/index.html)].
Наиболее важные достижения в лечении больных ТБ связаны с химиотерапией. В настоящее время из уровня техники известно большое количество противотуберкулезных средств. Первые химиопрепараты появились в конце 40-х годов (стрептомицин, натрия пара-аминосалицилат, тибон). Затем были созданы фтивазид, изониазид и новые эффективные химиопрепараты - этионамид, канамицин, флоримицин, циклосерин, протионамид. Это позволило осуществлять выбор химиопрепаратов, наиболее показанных для лечения конкретных больных. Далее появились очень эффективные препараты - рифампицин, этамбутол, микобутин. Однако одновременно с появлением новых противотуберкулезных препаратов (ПТП) расширяется развитие устойчивости микобактерий туберкулеза (МБТ) к ним.
Революцией в лечении туберкулеза с широкой лекарственной устойчивостью явилось выведение на фармацевтический рынок компанией АО «Фармасинтез» нового лекарственного препарата «Перхлозон®» (RU 2423977), который в качестве активного вещества содержит 4-тиоуреидоиминометилпиридиния перхлорат (см. структурную формулу ниже).
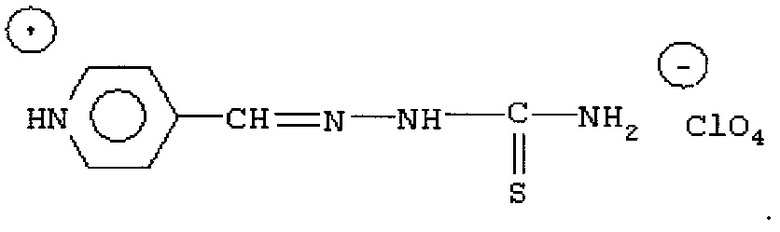
Перхлозон позволил снизить смертность больных туберкулезом, у которых выявлены МБТ с широкой лекарственной устойчивостью.
Также эффективному лечению МБТ способствуют комбинированные ПТП. В настоящее время используют двух-, трех- и четырехкомбинированные препараты.
В патенте RU 2182483 известна эффективная противотуберкулезная композиция изониазида и протионамида или этамбутола.
В патенте RU 2417087 известна эффективная противотуберкулезная композиция изониазида и соли пара-аминосалициловой кислоты (ПАСК).
В патенте RU 2247560 известна эффективная противотуберкулезная композиция ломефлоксацина, пиразинамида, протионамида, этамбутола и пиридоксина.
В патенте RU 2247561 известна эффективная противотуберкулезная композиция изониазида, пиразинамида, рифампицина, этамбутола и пиридоксина.
В патенте RU 2247559 известна эффективная противотуберкулезная композиция изониазида, ломефлоксацина, пиразинамида, этамбутола и пиридоксина.
Однако по-прежнему существует необходимость в разработке лекарственных препаратов, в том числе и комбинированных, от туберкулеза с различными видами лекарственной устойчивости.
Циклосерин ((R)-4-Амино-3-изоксазолидинон) - противотуберкулезный препарат (см. структурную формулу ниже), полученный в 50-ых годах 20 века.

Известно, что циклосерин используется в комбинации с противотуберкулезными препаратами первого и второго ряда при лечении туберкулеза (М.Д. Машковский. "Лекарственные средства", М., 1993, т. 2, с. 381).
На российском рынке препараты циклосерина представлены в виде капсул и практически не содержат каких-либо вспомогательных веществ. Так известен препарат «циклосерин» в виде капсул производства компании «Эли Лилли Восток С.А.» (Швейцария), который выбран в качестве прототипа настоящего изобретения. Данный препарат содержит 250 мг циклосерина, в качестве вспомогательного вещества содержит тальк, а капсула состоит из желатина, диоксида титана и красителей.
Наибольшая значимость циклосерина заключается в том, что он позволяет уменьшить или полностью исключить имеющуюся резистентность у микобактерий туберкулеза в отношении многих противотуберкулезных препаратов.
Известно, что циклосерин уменьшает резистентность микобактерий туберкулеза к изониазиду, стрептомицину и ПАСКу (А.Е. Рабухин в кн.: "Химиотерапия больных туберкулезом", М., 1970; Н.М. Рудой в кн.: "Лекарственная устойчивость микобактерий туберкулеза (значение в клинике и эпидемиологии туберкулеза), М., 1969; Meissner G. Prax. Pneumol., 1965, Н. 19, S. 387).
Из патента RU 2185162 известно, что циклосерин уменьшает резистентность у микобактерий туберкулеза к рифампицину и этамбутолу.
В связи с этим, разработка синергических композиций с циклосерином позволит более эффективно снижать резистентность у микобактерий туберкулеза в отношении различных противотуберкулезных препаратов.
Известно, что больные туберкулезом испытывают большой недостаток по содержанию в крови цинка (Jpn. J. Infect. Dis., 2008, 61(3), p.p. 202-204).
В связи с этим, применение цинкосодержащих соединений является эффективным при борьбе с туберкулезом (J. Indian Med. Assoc., 2010, 108(2), p.p. 92-93; J. Infect. Dev. Ctries, 2009, 3(5), p.p. 365-368).
Из патента RU 2253460 известно применение сульфата цинка совместно с изониазидом или изониазидом и рифампицином для лечения туберкулеза.
Из патента RU 2430724 известна эффективная противотуберкулезная композиция изониазида, пиразинамида, рифампицина и цинкосодержащего соединения.
Противотуберкулезные композиции циклосерина и цинкосодержащих соединений не раскрываются в уровне техники. Также отсутствуют сведения о возможном синергическом действии композиции циклосерина с цинкосодержащими соединениями.
Раскрытие изобретения
В настоящем изобретении авторы неожиданно обнаружили синергическое действие композиции циклосерина с цинкосодержащими соединениями. Синергическое действие при использовании композиции циклосерина и цинкосодержащих соединений проявляется в неожиданном снижении токсичности циклосерина, повышении противотуберкулезной активности и фармакокинетики циклосерина, а также большей эффективности циклосерина в комбинированном лечении туберкулеза по сравнению с использованием циклосерина без цинкосодержащих соединений.
В связи с этим, настоящее изобретение направлено на синергическую противотуберкулезную фармацевтическую композицию, содержащую циклосерин или его фармацевтически приемлемую соль (например, гидрохлорид циклосерина или сульфат циклосерина) и цинкосодержащее соединение.
В одном варианте изобретения циклосерин или его фармацевтически приемлемая соль и цинкосодержащее соединение могут быть представлены в композиции исходя из массового соотношения циклосерин : цинк от 1:1 до 200:1, более предпочтительно от 10:1 до 100:1, особенно предпочтительно от 25:1 до 50:1.
В одном варианте изобретения циклосерин или его фармацевтически приемлемая соль представлены в композиции, из расчета на свободное основание циклосерина, в количестве от 20 до 1500 мг, особо предпочтительно от 125 до 1000 мг.
В одном варианте изобретения цинкосодержащее соединение может быть представлено в композиции, из расчета на чистый цинк, в количестве от 2,5 до 30 мг, особо предпочтительно от 5 до 15 мг.
В одном предпочтительном варианте изобретения цинкосодержащее соединение выбирают из группы соединений цинка, включающей фторид цинка, хлорид цинка, бромид цинка, йодид цинка, сульфат цинка, нитрат цинка, ацетат цинка, дигидрофосфат цинка, гидрофосфат цинка, перхлорат цинка и хлорат цинка.
В наиболее предпочтительном варианте изобретения цинкосодержащее соединение представляет собой сульфат цинка, особо предпочтительно сульфат цинка представлен в форме моногидрата.
В одном варианте изобретения противотуберкулезная композиция циклосерина и цинкосодержащего соединения может дополнительно содержать терапевтически эффективное количество пиридоксина или его фармацевтически приемлемой соли (например, пиридоксина гидрохлорид), чтобы снизить токсическое действие циклосерина, поскольку общеизвестно, что пиридоксин снижает токсическое действие противотуберкулезных препаратов (см., например, патент RU 2247560). Обычно пиридоксин используется в массовом соотношении с противотуберкулезным средством от 1:100 до 1:1. В предпочтительном варианте изобретения пиридоксин или его фармацевтически приемлемая соль представлены в композиции, из расчета на свободное основание пиридоксина, в количестве от 0,5 до 15 мг, особо предпочтительно от 1 до 10 мг.
В еще одном варианте изобретения противотуберкулезная композиция циклосерина и цинкосодержащего соединения может дополнительно содержать обычные фармацевтически приемлемые вспомогательные вещества, принятые в технологии приготовления лекарственных средств, такие как связующие, наполнители, консерванты, регуляторы текучести, смягчители, смачиватели, диспергаторы, эмульгаторы, растворители, антиокислители и/или пропелленты, пролонгаторы действия [Sucker et al.: Pharmazeutische Technologie, Thieme-Verlag, Stuttgard, 1991 г.].
Поскольку субстанция циклосерина обладает приемлемыми физико-химическими свойствами, то нет большой необходимости добавлять чрезвычайно большое количество наполнителей. В одном варианте изобретения суммарное содержание наполнителей составляет от 2% до 40% от массы циклосерина в композиции, особо предпочтительно от 8% до 19% от массы циклосерина в композиции.
В качестве предпочтительных фармацевтически приемлемых вспомогательных веществ могут быть использованы стеариновая кислота и ее соли, тальк, коповидон, диоксид кремния, твины (например, твин-80), оксид магния, циклодекстрины (например, β-циклодекстрин), натрия карбоксиметилцеллюлоза, микрокристаллическая целлюлоза, крахмал, карбонат кальция, основный карбонат магния, фосфат кальция, желатин, лактоза, крахмал прежелатинизированный, каолин, маннит, сорбит.
Более предпочтительными вспомогательными веществами являются тальк, диоксид кремния, лактоза, крахмал, коповидон, крахмал прежелатинизированный, натрия карбоксиметилцеллюлоза и микрокристаллическая целлюлоза.
Наиболее предпочтительными вспомогательными веществами являются тальк, коповидон, лактоза и крахмал прежелатинизированный. Авторы изобретения неожиданно обнаружили, что использование в противотуберкулезной композиции циклосерина и цинкосодержащего соединения таких наполнителей как тальк, коповидон, лактоза и крахмал прежелатинизированный позволяет добиться наибольшей биодоступности циклосерина и цинка, а также лучшей стабильности циклосерина.
В наиболее предпочтительном варианте изобретения противотуберкулезная композиция циклосерина и цинкосодержащего соединения, содержащая обычные фармацевтически приемлемые вспомогательные вещества, может быть выполнена в виде пероральной лекарственной формы, например, в виде таблетки необязательно покрытой оболочкой, раствора или суспензии для перорального приема или капсулы.
Наиболее предпочтительно, чтобы композиция циклосерина и цинкосодержащего соединения, содержащая обычные фармацевтически приемлемые вспомогательные вещества, была выполнена в виде капсулы.
Оболочки капсул по настоящему изобретению могут быть выполнены по стандартным методикам и содержать общепринятые в данной области компоненты, например, желатин, диоксид титана, поверхностно-активные вещества (например, лаурилсульфат натрия), а также, при необходимости, по меньшей мере один краситель.
Краткое описание фигур и чертежей
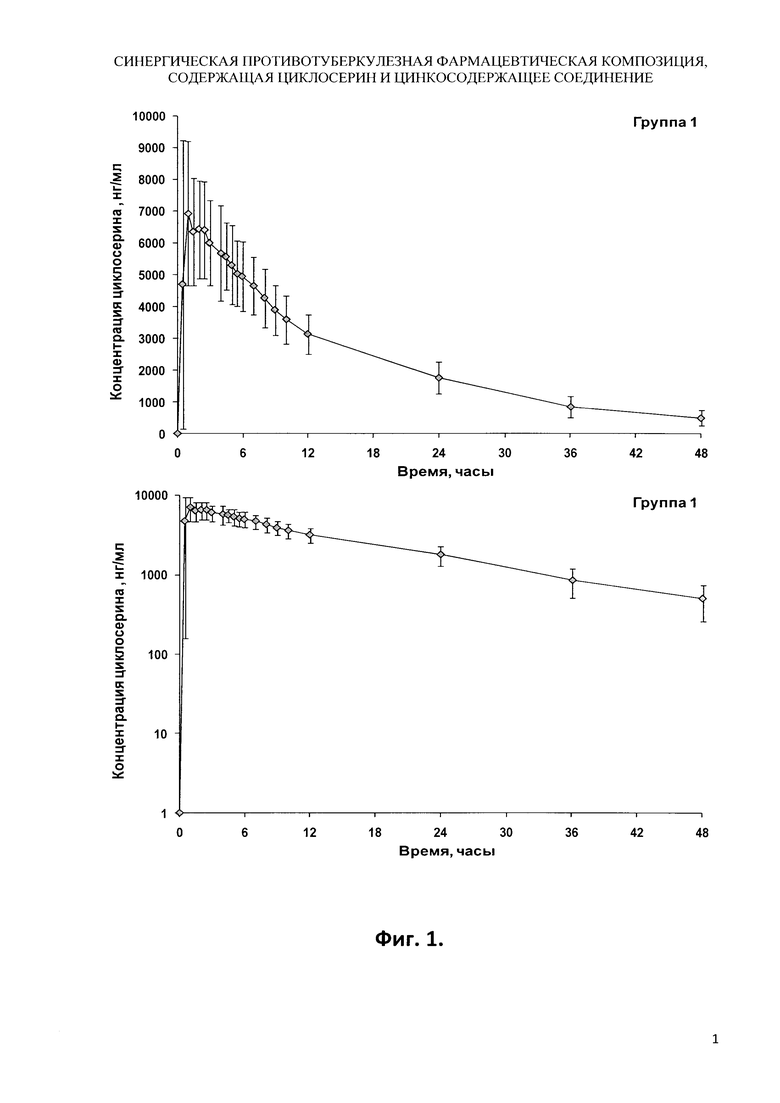
На фигуре 1 представлен усредненный фармакокинетический профиль концентрации циклосерина в плазме крови здоровых добровольцев (М±SD) после однократного приема композиции (в виде желатиновой капсулы) 250 мг циклосерина и 13,72 мг сульфата цинка моногидрата (соответствует 5 мг цинка; массовое соотношение циклосерина и цинка 50:1) в линейных и полулогарифмических координатах.
На фигуре 2 представлен усредненный фармакокинетический профиль концентрации циклосерина в плазме крови здоровых добровольцев (М±SD) после однократного приема композиции (в виде желатиновой капсулы) 250 мг циклосерина и 27,44 мг сульфата цинка моногидрата (соответствует 10 мг цинка; массовое соотношение циклосерина и цинка 25:1) в линейных и полулогарифмических координатах.
Осуществление изобретения
Представленные ниже примеры иллюстрируют (без ограничения объема притязаний) наиболее предпочтительные варианты осуществления изобретения, а также подтверждают возможность получения заявляемой противотуберкулезной фармацевтической композиции и достижения указанных технических результатов.
Пример 1
Примеры композиций по настоящему изобретению
Ниже представлены примеры предпочтительных композиций циклосерина и цинкосодержащего соединения по настоящему изобретению.
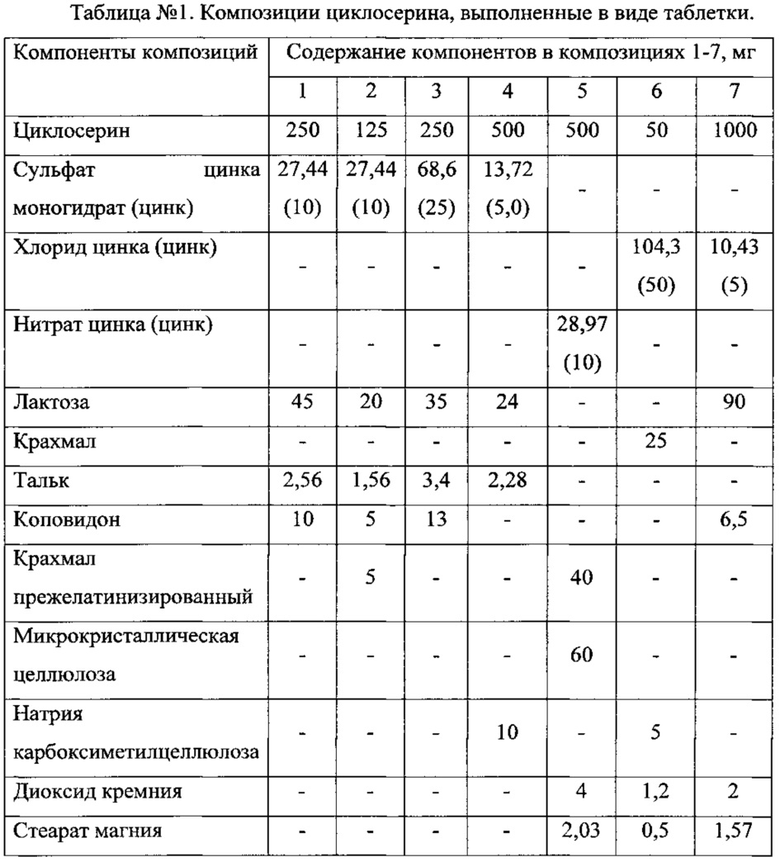
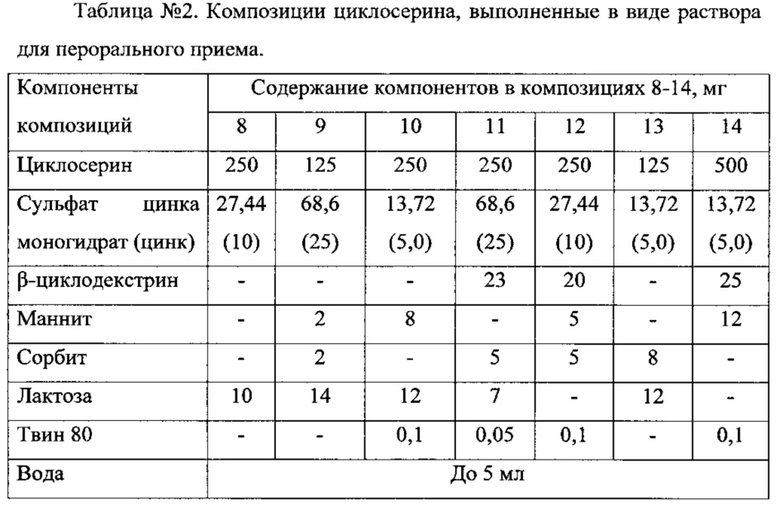
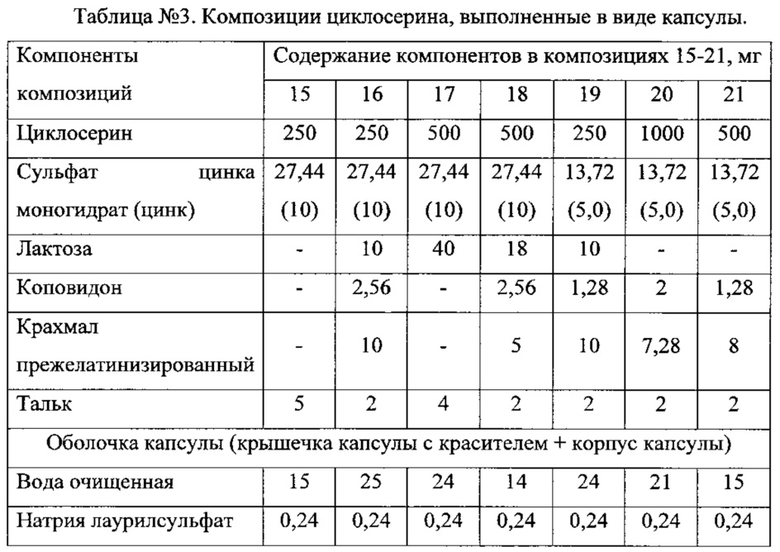
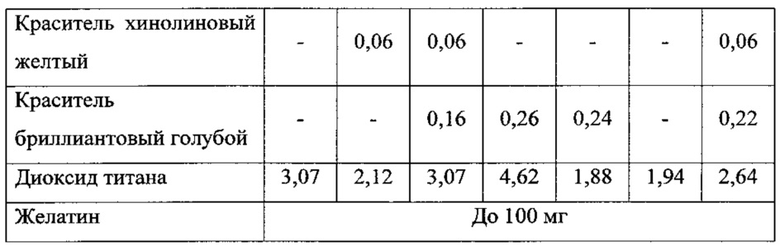
Пример 2
Методика получения композиций по настоящему изобретению в виде капсул.
В данном примере приведена методика получения композиций циклосерина и цинкосодержащего соединения под номерами 16 и 19 из таблицы №3 примера 1. Названная методика включает следующие стадии.
1. Подготовка сырья и материалов
Стадия подготовки сырья состоит из нескольких этапов:
Просеивание сырья:
Полученное со склада сырье, в количестве (в зависимости от дозировки):


взвешивается в полиэтиленовые мешки и герметизируется.
Взвешенное сырье в чистой маркированной таре доставляется на тележке в рабочую зону, где подвергается просеву от посторонних включений покомпонентно. Просеивание проводят на вибросите. Сырье, вручную, совком из нержавеющей стали, периодически загружают в бункер вибросита, избегая пылеобразования. Выгрузка непрерывная в приемник. Просеянное сырье собирают в чистые сухие емкости и определяют массу. На емкость приклеивают этикетку с наименованием сырья, количеством, № загрузки, датой просеивания и закрывают крышкой.
В процессе просеивания сырья наиболее важными контрольными точками являются следующие параметры:
№ ячейки сита вибросита должен составлять 0,25 мм (60 меш).
Проверяют качество просева, в просеянном сырье должны отсутствовать механические включения.
Выход на стадии просева сырья должен составлять для дозировок:
250 мг + 5 мг: от 33,25 до 34,29 кг;
250 мг + 10 мг: от 34,86 до 35,94 кг.
Приготовление увлажнителя:
В процессе приготовления увлажнителя используется следующее сырье:

Увлажнение проводят раствором, содержащим коповидон.
В емкость для приготовления увлажнителя загружают коповидон, воду очищенную и тщательно перемешивают лопаткой из нержавеющей стали до образования прозрачного, однородного бледно-желтого цвета раствора. На аппарате для просеивания и фильтрации проводят фильтрацию раствора. Определяют массу полученного раствора.
В процессе приготовления увлажнителя наиболее важными контрольными точками являются следующие параметры:
Внешний вид полученного раствора, раствор должен быть прозрачным, однородным, бледно-желтого цвета.
Температура приготовленного раствора должна составлять 30-40°C.
Размер ячейки фильтра для фильтрации приготовленного раствора должен составлять 0,075 мм.
Выход на стадии приготовления увлажнителя должен составлять от 1,23 кг до 1,27 кг.
2. Получение массы для наполнения капсул
Смешивание проводят в смесителе конусном двойном. Сырье загружают в смеситель, избегая пылеобразования. Приготовление смесей сырья производят в следующем порядке:
Цинк сульфат моногидрат и лактозу увлажняют.
Полученную влажную массу сушат до влаги менее 1,0%.
Полученную сухую смесь цинка сульфата моногидрата с лактозой перемешивают с циклосерином и прежелатинизированным крахмалом.
Полученную смесь перемешивают с тальком.
В процессе получения массы для наполнения капсул важными контрольными точками являются следующие параметры:
Время смешения, на каждой стадии, должно составлять не менее 10 минут.
Температура сушки влажной массы 50°C.
Влага сухой смеси цинка сульфата моногидрата с лактозой менее 1,0%
Выход на стадии получения массы для наполнения капсул должен составлять для дозировок:
250 мг + 5 мг: от 33,95 до 35,0 кг;
250 мг + 10 мг: от 35,40 до 36,50 кг.
3. Получение капсул
Наполнение капсул проводят на наполнителе капсул автоматическом.
В процессе получения капсул наиболее важными контрольными точками являются следующие параметры:
Внешний вид капсулы должен соответствовать следующему описанию:
250 мг + 5 мг: твердые желатиновые капсулы №«1». Корпус капсулы белого цвета, крышка капсулы желтого цвета.
250 мг + 10 мг: твердые желатиновые капсулы №«1». Корпус капсулы белого цвета, крышка капсулы зеленого цвета.
Средняя масса капсул:
250 мг + 5 мг: 363 мг ± 10%;
250 мг + 10 мг: 378 мг ± 10%.
Средняя масса содержимого капсул:
250 мг + 5 мг: 287 мг ± 10%;
250 мг + 10 мг: 302 мг ± 10%.
Количественное содержание активной фармацевтической субстанции:
250 мг + 5 мг:
225,0 мг - 275,0 мг/капс циклосерина;
4,50 мг - 5,50 мг/капс цинка.
250 мг + 10 мг:
225,0 мг - 275,0 мг/капс циклосерина;
9,0 мг - 11,0 мг/капс цинка.
Растворимость препарата должна составлять не менее 80% (Q) циклосерина через 45 мин.
Выход на стадии получения капсул должен составлять для дозировок:
250 мг + 5 мг: от 33,95 до 35,0 кг;
250 мг + 10 мг: от 35,40 до 36,50 кг.
Пример 3
Сравнение токсичности препарата циклосерина компании «Эли Лилли» (прототип) и композиций циклосерина и цинкосодержащего соединения по настоящему изобретению на примере крыс.
Доклинические исследования токсичности композиций циклосерина и цинкосодержащего соединения (на примере моногидрата сульфата цинка) по настоящему изобретению были проведены на моделях крыс в НИИ биофизики ФГБОУ ВПО «Ангарская государственная техническая академия» Минобразования и науки РФ. Для исследования были выбраны композиции под номерами 16 (250 мг циклосерина и 10 мг цинка, массовое соотношение циклосерина и цинка 25:1) и 19 (250 мг циклосерина и 5 мг цинка, массовое соотношение циклосерина и цинка 50:1) из таблицы №3 примера 1.
Дозирование препарата производилось по циклосерину. Организация и проведение экспериментов осуществлялись на основе требований Руководства по доклиническому исследованию новых фармакологических веществ (2005 г.).
В качестве препарата сравнения использован прототип изобретения - циклосерин в капсулах, 250 мг, не содержащий соединений цинка (производства компании Эли Лилли Восток С.А., Швейцария).
Согласно литературным данным (Antibiotiki, 1965, vol. 10, №12, p.p. 1127-1134), значение острой токсичности циклосерина ЛД50 на моделях крыс составляет чуть больше 6500 мг/кг.
Для установления параметров острой токсичности исследуемые препараты в виде свежеприготовленной взвеси вводили крысам (самцы и самки) внутрижелудочно через атравматичный металлический зонд в диапазоне доз от 5000 до 9500 мг/кг. Расчет средних смертельных доз проводили по Керберу. Контрольные животные получали аналогичные по объемам количества растворителя - прокипяченной и охлажденной дистиллированной воды. Дозирование проводилось по циклосерину. Объем вводимой взвеси для крыс не более 5 мл.
Период наблюдения составлял 14 суток.
Регистрируемые показатели: смертность, срок наступления гибели, клиника отравления, ежедневное наблюдение за общим состоянием и поведением, вскрытие всех погибших животных, а в конце периода наблюдения - всех выживших. Усыпление проводилось серным эфиром. По результатам исследований определяли значения ЛД50 для каждой композиции, т.е. значения доз препарата, при которых погибает 50% леченых особей.
Результаты количественной оценки параметров острой токсичности препарата циклосерина компании «Эли Лилли» представлены в таблицах №4 и №5.

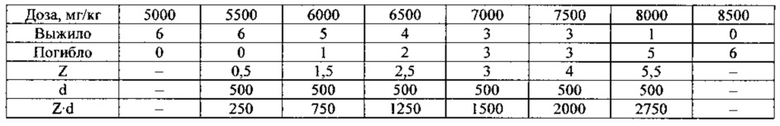
ЛД50 для крыс-самцов при внутрижелудочном однократном введении препарата сравнения в дозах 5000-8500 мг/кг составила 7084±217 мг/кг.
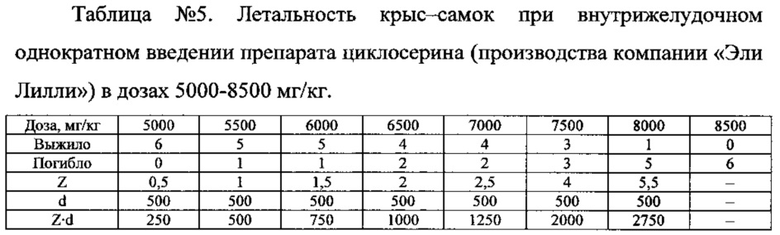
ЛД50 для крыс-самок при внутрижелудочном однократном введении препарата по прототипу в дозах 5000-8500 мг/кг составила 7084±242 мг/кг.
Результаты количественной оценки параметров острой токсичности для композиций по настоящему изобретению под номерами 16 (250 мг циклосерина и 10 мг цинка, массовое соотношение циклосерина и цинка 25:1) и 19 (250 мг циклосерина и 5 мг цинка, массовое соотношение циклосерина и цинка 50:1) из таблицы №3 примера 1 представлены ниже.
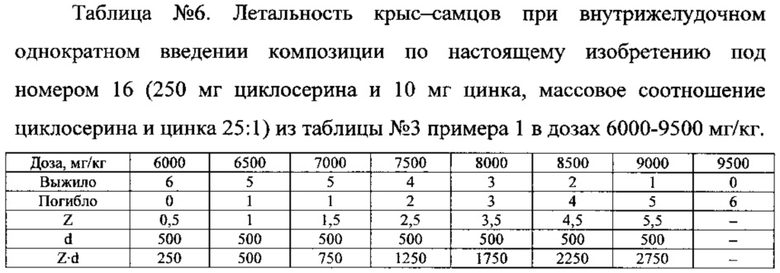
ЛД50 для крыс-самцов при внутрижелудочном однократном введении композиции по настоящему изобретению (250 мг циклосерина и 10 мг цинка, массовое соотношение циклосерина и цинка 25:1) в дозах 6000-9500 мг/кг составила 7917±242 мг/кг.

ЛД50 для крыс-самок при внутрижелудочном однократном введении композиции по настоящему изобретению (250 мг циклосерина и 10 мг цинка, массовое соотношение циклосерина и цинка 25:1) в дозах 6000-9500 мг/кг составила 8083±217 мг/кг.
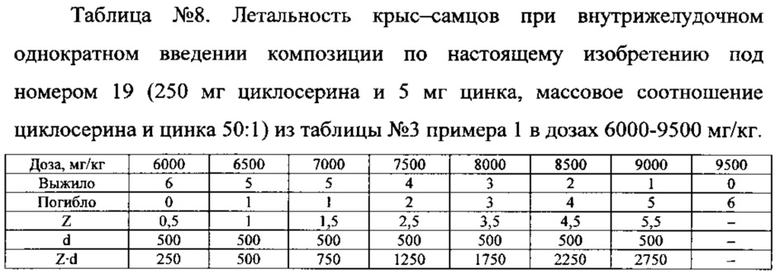
ЛД50 для крыс-самцов при внутрижелудочном однократном введении композиции по настоящему изобретению (250 мг циклосерина и 5 мг цинка, массовое соотношение циклосерина и цинка 50:1) в дозах 6000-9500 мг/кг составила 7917±242 мг/кг.
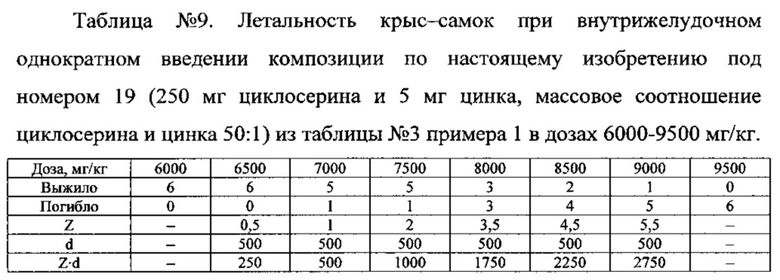
ЛД50 для крыс-самок при внутрижелудочном однократном введении композиции по настоящему изобретению (250 мг циклосерина и 5 мг цинка, массовое соотношение циклосерина и цинка 50:1) в дозах 6000-9500 мг/кг составила 8083±217 мг/кг.
Как видно из данного примера, композиции циклосерина и цинкосодержащего соединения по настоящему изобретению неожиданно оказались менее токсичнее, чем препарат циклосерина по прототипу, не содержащий цинка, поскольку для достижения одинакового 50%-ного уровня смертности у животных композиции по настоящему изобретению надо брать в существенно больших дозах, чем препарат циклосерина по прототипу (8083±217 мг/кг и 7917±242 мг/кг против 7084±217 мг/кг и 7084±242 мг/кг).
Любопытным и неожиданным оказался еще тот факт, что композиции по настоящему изобретению оказались менее токсичны, чем препарат циклосерина вместе с пиридоксином (согласно статьи из Сибирского медицинского журнала, 2013, №5, стр. 64-66, ЛД50 комбинации циклосерина и пиридоксина около 7400 мг/кг), поскольку пиридоксин является общеизвестным средством в противотуберкулезной терапии для снижения токсического эффекта противотуберкулезных препаратов.
Пример 4
Сравнение бактериостатической активности препарата циклосерина компании «Эли Лилли» (прототип) и композиций циклосерина и цинкосодержащего соединения по настоящему изобретению в отношении микобактерий туберкулеза in vitro.
Бактериостатическая активность прототипа - циклосерина (производства компании «Эли Лилли») и композиций циклосерина и цинкосодержащего соединения по настоящему изобретению была изучена в опытах in vitro на 4 видах микобактерий туберкулеза, в концентрации препаратов по циклосерину от 100 до 0,39 мкг/мл, используя метод последовательных серийных разведений (Першин Г.Н. Методы экспериментальной химиотерапии. М., «Медицина», 1971, с. 171-192).
За титр активности изучаемого вещества принимали то его наибольшее разведение, или ту наименьшую концентрацию, которые полностью подавляли рост микобактерий туберкулеза. Основными параметрами для оценки действия циклосерина (производства компании «Эли Лилли») и композиций циклосерина и цинкосодержащего соединения по настоящему изобретению служила способность микобактерий к росту и размножению. Оценка ростовых свойств микобактерий определялась по скорости и количеству выросших колоний. Оценка числа колоний определялась в крестах по схеме, предложенной Г.Н. Першиным: обильный рост (+++); глубинный рост штаммов менее обилен, осадок меньших размеров, комочки культуры меньше, чем в контроле (++); глубинный рост в виде слабозаметного осадка, зерна мелкие в небольшом количестве (+); полный бактерицидный эффект, засеянная культура не дает роста (-). Результаты исследования бактериостатической активности циклосерина (производства компании «Эли Лилли») и композиций циклосерина и цинкосодержащего соединения под номерами 16 (250 мг циклосерина и 10 мг цинка, массовое соотношение циклосерина и цинка 25:1) и 19 (250 мг циклосерина и 5 мг цинка, массовое соотношение циклосерина и цинка 50:1) из таблицы №3 примера 1 отражены в таблице №10.

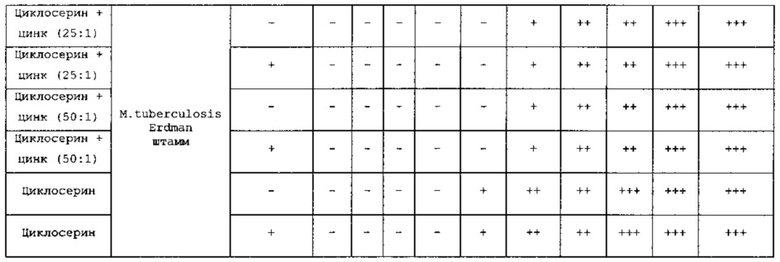
Из данных таблицы №10 видно, что бактериостатическая активность композиций циклосерина и цинкосодержащего соединения по настоящему изобретению достаточно приемлема и превосходит активность циклосерина по прототипу (производства «Эли Лилли»). Композиции циклосерина и цинкосодержащего соединения в концентрации 6,25 мкг/мл оказывали полное бактериостатическое подавляющее действие на штаммы 14 M. bovis и M. tuberculosis штамм H37Rv, в то время, как минимальная ингибирующая концентрация (МИК) для циклосерина по прототипу в отношении данных штаммов составляла 25 мкг/мл. МИК композиций циклосерина и цинкосодержащего соединения по настоящему изобретению в отношении штамма M. tuberculosis «Academia» и штамма M. tuberculosis Erdman равна 6,25 мкг/мл, а для циклосерина по прототипу она была выше и составила 12,5 мкг/мл.
Таким образом, из приведенных выше данных следует, что композиции циклосерина и цинкосодержащего соединения по изобретению обладают повышенной, по сравнению с циклосерином по прототипу, бактериостатической активностью в отношении микобактерий туберкулеза.
Пример 5
Сравнение фармакокинетики циклосерина у препарата циклосерина компании «Эли Лилли» (прототип) и композиций циклосерина и цинкосодержащего соединения по настоящему изобретению на примере здоровых добровольцев.
Согласно инструкции к препарату циклосерина по прототипу (производства «Эли Лилли»), при приеме в день одной капсулы 250 мг циклосерина достигаются средние значения следующих фармакокинетических параметров: Cmax=6 мкг/мл, Tmax=3-4 часа.
Оценка фармакокинетических параметров композиций циклосерина и цинкосодержащего соединения по настоящему изобретению проводилась на здоровых добровольцах, согласно разработанному протоколу исследования.
● Материалы и методы:
Исследуемые препараты:
Исследованию фармакокинетики были подвергнуты композиции циклосерина и цинкосодержащего соединения под номерами 19 (250 мг циклосерина и 5 мг цинка, массовое соотношение циклосерина и цинка 50:1) и 16 (250 мг циклосерина и 10 мг цинка, массовое соотношение циклосерина и цинка 25:1) из таблицы №3 примера 1.
Добровольцы для исследования:
В исследовании участвовало 26 здоровых добровольцев, которые были разбиты на 2 группы (по 10 испытуемых и 3 дублера). Исследование было открытым и рандомизированным. Первая группа принимала композицию под номером 19 (250 мг циклосерина и 5 мг цинка, массовое соотношение циклосерина и цинка 50:1) из таблицы №3 примера 1. Вторая группа принимала композицию под номером 16 (250 мг циклосерина и 10 мг цинка, массовое соотношение циклосерина и цинка 25:1) из таблицы №3 примера 1. В ходе исследования ни один испытуемый не выбыл.
Добровольцы для исследования были подобраны на основании следующих критериев:
- Добровольцы мужского и женского пола в возрасте от 18 до 45 лет.
- Верифицированный диагноз «здоров»: отсутствие патологии со стороны желудочно-кишечного тракта (ЖКТ), печени, почек, сердечно-сосудистой системы (ССС), центральной нервной системы (ЦНС), бронхолегочной системы, крови и кроветворных органов.
- Гемодинамические показатели в пределах нормы: САД в пределах 110-130 мм рт.ст., ДАД в пределах 60-90 мм рт.ст., ЧСС - 60-80 уд/мин.
- Отрицательные результаты анализов на ВИЧ (вирус иммунодефицита человека), сифилис (RW), гепатит В (HbsAg) и гепатит С (HCV РНК).
- Индекс массы тела (ИМТ) составляет от 18,5 до 30 кг/м2.
- Отрицательный результат анализа крови на беременность у женщин репродуктивного возраста и согласие придерживаться адекватных методов контрацепции (в случае использования гормональных контрацептивов, они должны быть отменены не менее чем за 2 месяца до начала исследования).
- Способность предоставить письменное информированное согласие до начала каких-либо процедур скрининга, а также способность, по мнению Исследователя, следовать всем требованиям исследования.
График исследования включал следующие этапы:
1. Изучение документации, скрининг (Дни -14÷0/21-34)
2. Госпитализация добровольцев (Дни 1-3, 4-6, 7-9, 35-37, 39-44, 43-48)
3. Прием препарата (День 1, 4, 7, 35, 38, 42)
4. Отбор проб крови для изучения ФК (Дни 1-3, 4-6, 7-9, 35-37, 38-40, 42-44)
5. Анализы безопасности (Дни 1, 2, 4, 5, 7, 8, 13, 10 14, 17, 20)
6. Оценка СНЯ и НЯ (Дни 1-55)
7. Составление промежуточного/окончательного отчета, решение о повышении дозировки (День 14, 17, 20, 48, 51, 55)
Общая продолжительность исследования составила для каждого добровольца 14 дней.
Взятие анализов:
Для фармакокинетического исследования в каждом периоде отбирались 19 проб крови по 4 мл
График забора: 0 ч (до приема лекарственного средства) и через 0,5 ч; 1 ч; 1,5 ч; 2 ч; 2,5 ч; 3 ч; 4 ч; 4,5 ч; 5 ч; 5,5 ч; 6 ч; 7 ч; 8 ч; 9 ч; 10 ч; 12 ч; 24 ч; 36 ч; 48 ч после приема препарата.
Критерии оценки:
Для оценки фармакокинетики композиций по настоящему изобретению измерялись и рассчитывались следующие параметры - AUC, Cmax, Tmax, Cmin, 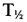 , MRT, Cmax/AUC.
, MRT, Cmax/AUC.
• Результаты исследования:
Профиль зависимости концентрации циклосерина от времени для группы 1 (принимали композицию 250 мг циклосерина и 5 мг цинка) представлен на Фиг. 1.
Профиль зависимости концентрации циклосерина от времени для группы 2 (принимали композицию 250 мг циклосерина и 10 мг цинка) представлен на Фиг. 2.
Ниже в таблице №11 представлены значения измеренных и рассчитанных фармакокинетических параметров для исследуемых групп 1 (принимали композицию 250 мг циклосерина и 5 мг цинка) и 2 (принимали композицию 250 мг циклосерина и 10 мг цинка).


Средние значения (М±SD) максимальных концентраций циклосерина (Cmax), определяемых в плазме крови добровольцев первой группы составили 7605±2207 нг/мл (диапазон от 5270 до 11000 нг/мл), второй группы - 7918±731 нг/мл (диапазон от 6490 до 8760 нг/мл).
Медианы времени достижения максимальной концентрации циклосерина (Tmax) для первой и второй группы были равны 1,00 ч. Средние значения данного показателя (М±SD) составили 1,25±0,59 ч и 1,20±0,75 ч для первой и второй группы соответственно.
Средние значения максимальных концентраций циклосерина (Cmax) и времени достижения максимальной концентрации циклосерина (Tmax) для групп 1 и 2 оказались выше, чем для препарата по прототипу.
Таким образом, на основании данного примера, можно утверждать, что комбинирование с цинкосодержащим соединением циклосерина неожиданно позволяет существенно повысить фармакокинетические параметры последнего.
Пример 6
Сравнение эффективности циклосерина компании «Эли Лилли» (прототип) и композиций циклосерина и цинкосодержащего соединения по настоящему изобретению при лечении туберкулеза в составе комбинированной терапии.
Циклосерин сам по себе является достаточно слабым противотуберкулезным средством, зачастую его используют для усиления действия других противотуберкулезных препаратов и для уменьшения возникновения мутаций микобактерий туберкулеза.
В свете вышеизложенного, для сравнения эффективности циклосерина по прототипу и композиций циклосерина с цинкосодержащим соединением при лечении туберкулеза, исследуемые препараты циклосерина использовали в составе комбинированной терапии с изониазидом и рифампицином.
Для оценки эффективности комбинированной терапии использовали индекс эффективности лечения ИЭ (%) - долевая разница показателей тяжести течения туберкулезной инфекции в контрольных группах и в группах животных, получавших средство по изобретению.
Индекс эффективности определяли по формуле:
 ,
,
где nк и n0 - средние значения показателей соответственно в контрольной и опытной группах.
Положительное значение ИЭ (плюс-эффект) указывает на снижение показателя пораженности или повышение терапевтической активности композиции противотуберкулезных препаратов под действием средства по изобретению.
Отрицательное значение ИЭ (минус-эффект) свидетельствует об увеличении показателя пораженности или ослаблении терапевтического действия композиции противотуберкулезных препаратов под влиянием средства по изобретению.
Исследование эффективности комбинированной терапии выполнено на 72 белых нелинейных мышах-самцах массой 18-20 г, которые были разбиты на 4 группы.
Группа 1 (группа контроля) - нелеченые мыши, n=24;
Группа 2 (опытная группа) - мыши, леченные изониазидом и рифампицином с добавкой циклосерина по прототипу (производства компании «Эли Лилли»), n=16;
Группа 3 (опытная группа) - мыши, леченные изониазидом и рифампицином с добавкой композиции циклосерина и цинкосодержащего соединения (массовое соотношение циклосерина и цинка 50:1), n=16;
Группа 4 (опытная группа) - мыши, леченные изониазидом и рифампицином с добавкой композиции циклосерина и цинкосодержащего соединения (массовое соотношение циклосерина и цинка 25:1), n=16.
У мышей штамм М. bovis bovinus 8 вызывал клиническую картину генерализованного туберкулеза, на 10 день после инфицирования в легких визуализированы очаги специфического воспаления. С этого дня животным опытных групп (группы 2-4) начато введение исследуемых препаратов.
На 61-й день после заражения летальность в группе контроля (зараженные, нелеченые животные, n=24) составила 95,8%.
В опытных группах случаев летальности не было выявлено, однако в группах, использовавших для лечения цинк, было отмечено более благоприятное течение болезни.

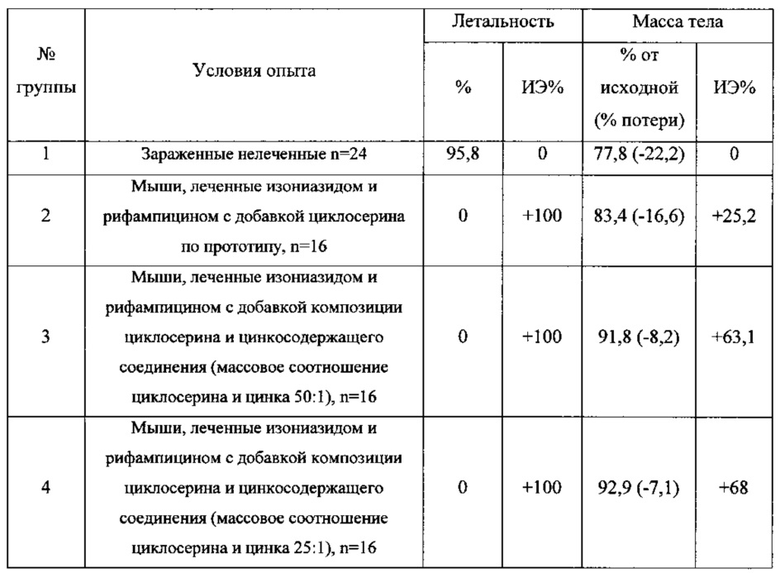
Как видно из вышеприведенной таблицы, добавление цинкосодержащего соединения к циклосерину при противотуберкулезной терапии позволяет существенно облегчить течение заболевания в сравнении с циклосерином без цинкосодержащего соединения, о чем свидетельствует более высокий индекс эффективности. Поэтому композиции циклосерина и цинкосодержащего соединения по настоящему изобретению являются более эффективными в лечении, чем циклосерин в отдельности.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМБИНИРОВАННАЯ КОМПОЗИЦИЯ | 2011 |
|
RU2478389C2 |
| КОМБИНИРОВАННЫЙ ПРОТИВОТУБЕРКУЛЕЗНЫЙ ПРЕПАРАТ | 2007 |
|
RU2354378C1 |
| КОМБИНИРОВАННАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2468802C2 |
| ПРОТИВОТУБЕРКУЛЕЗНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ 4-ТИОУРЕИДОИМИНОМЕТИЛПИРИДИНИЯ ПЕРХЛОРАТА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ | 2010 |
|
RU2423977C1 |
| КОМБИНИРОВАННАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2413517C1 |
| КОМБИНИРОВАННЫЙ СОСТАВ С ПРОТИВОТУБЕРКУЛЁЗНЫМ ДЕЙСТВИЕМ | 2003 |
|
RU2247560C1 |
| КОМБИНИРОВАННЫЙ ПРОТИВОТУБЕРКУЛЕЗНЫЙ ПРЕПАРАТ | 2009 |
|
RU2430724C2 |
| ПРОТИВОТУБЕРКУЛЁЗНОЕ СРЕДСТВО | 2003 |
|
RU2247559C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ТУБЕРКУЛЕЗА | 2009 |
|
RU2484819C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТИОАЦЕТАЗОН | 2015 |
|
RU2627611C2 |

Изобретение относится к области химико-фармацевтической промышленности и касается синергической фармацевтической композиции, обладающей противотуберкулезной активностью, которая содержит в качестве активного начала циклосерин и цинкосодержащее соединение. Композиция по изобретению характеризуется повышенной противотуберкулезной активностью, фармакокинетикой и сниженной токсичностью. 16 з.п. ф-лы, 6 пр., 12 табл., 2 ил.
1. Синергическая противотуберкулезная фармацевтическая композиция, содержащая циклосерин или его фармацевтически приемлемую соль и цинкосодержащее соединение, выбранное из группы, включающей фторид цинка, хлорид цинка, бромид цинка, йодид цинка, сульфат цинка, нитрат цинка, ацетат цинка, дигидрофосфат цинка, гидрофосфат цинка, перхлорат цинка и хлорат цинка.
2. Композиция по п. 1, в которой циклосерин или его фармацевтически приемлемая соль и цинкосодержащее соединение представлены исходя из массового соотношения циклосерин:цинк от 1:1 до 200:1.
3. Композиция по п. 2, в которой циклосерин или его фармацевтически приемлемая соль и цинкосодержащее соединение представлены исходя из массового соотношения циклосерин:цинк от 10:1 до 100:1.
4. Композиция по п. 3, в которой циклосерин или его фармацевтически приемлемая соль и цинкосодержащее соединение представлены исходя из массового соотношения циклосерин:цинк от 25:1 до 50:1.
5. Композиция по п. 1, в которой цинкосодержащее соединение представляет собой сульфат цинка.
6. Композиция по п. 5, в которой сульфат цинка представлен в форме моногидрата.
7. Композиция по п. 1, в которой фармацевтически приемлемая соль циклосерина выбрана из гидрохлорида циклосерина или сульфата циклосерина.
8. Композиция по любому из пп. 1-7, которая дополнительно содержит терапевтически эффективное количество пиридоксина или его фармацевтически приемлемой соли.
9. Композиция по любому из пп. 1-7, которая дополнительно содержит фармацевтически приемлемые вспомогательные вещества.
10. Композиция по п. 9, в которой вспомогательные вещества выбирают из группы вспомогательных веществ, включающей стеариновую кислоту и ее соли, тальк, коповидон, диоксид кремния, твины, оксид магния, циклодекстрины, натрия карбоксиметилцеллюлозу, микрокристаллическую целлюлозу, крахмал, карбонат кальция, основный карбонат магния, фосфат кальция, желатин, лактозу, крахмал прежелатинизированный, каолин, маннит и сорбит.
11. Композиция по п. 10, в которой вспомогательные вещества выбирают из группы вспомогательных веществ, включающей тальк, диоксид кремния, лактозу, крахмал, коповидон, крахмал прежелатинизированный, натрия карбоксиметилцеллюлозу и микрокристаллическую целлюлозу.
12. Композиция по п. 11, в которой вспомогательные вещества представляют собой тальк, коповидон, лактозу и крахмал прежелатинизированный.
13. Композиция по п. 9, которая выполнена в виде пероральной лекарственной формы.
14. Композиция по п. 13, которая выполнена в виде таблетки, капсулы, раствора или суспензии для перорального приема.
15. Композиция по. 14, в которой таблетка покрыта пленочной оболочкой.
16. Композиция по п. 14, которая выполнена в виде капсулы.
17. Композиция по п. 16, в которой капсула имеет оболочку, содержащую желатин, диоксид титана, поверхностно-активное вещество и по меньшей мере один краситель.
| Инструкция по медицинскому применению препарата "Цикломицин плюс", ЛСР-001130/07, 09.06.2007 | |||
| СПОСОБ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА ЛЕГКИХ | 2004 |
|
RU2253460C1 |
| Л.В.Мохирева | |||
| Особенности течения и лечения туберкулеза в условиях естественного дефицита цинка / Автореферат, Москва, 2006 | |||
| Д.А.Харкевич | |||
| Фармакология, 9-ое изд., перераб., дополн | |||
| и испр | |||
| / Москва "ГЭОТАР-Медиа", 2006, стр | |||
| Способ крашения тканей | 1922 |
|
SU62A1 |
Авторы
Даты
2017-05-30—Публикация
2016-03-01—Подача