Область техники
Изобретение относится к области медицины, в частности к фармацевтической промышленности, и описывает пероральную фармацевтическую композицию, выполненную в виде таблетки, включающую валганцикловир и способ ее изготовления.
Уровень техники
Цитомегаловирусная инфекция (ЦМВИ) представляет собой хроническую антропонозную инфекционную болезнь вирусной этиологии, характеризующуюся многообразием форм патологического процесса от латентной инфекции до клинически выраженного генерализованного заболевания (цитомегаловирусная болезнь).
Доля серопозитивных лиц среди взрослого населения в РФ составляет 73-98%. Заболеваемость ЦМВИ в г. Москве в 2009 г. составила 0,93 на 100 тысяч населения (у детей в возрасте до 14 лет - 3,86, среди взрослого населения - 0,44 на 100 тысяч).
Клинически выраженная генерализованная ЦМВИ занимает одно из первых мест в структуре оппортунистических заболеваний у больных ВИЧ-инфицией. В международных классификациях ВИЧ-инфекции «цитомегало-вирусное поражение органов (за исключением или помимо печени, селезенки, лимфатических узлов) у больного старше 1 месяца» включено в перечень 24 точно диагностирующих СПИД заболеваний». Данная патология имеет место у 10-40% больных СПИДом, не получающих антиретровирусную терапию (АРВТ) и в 3-7% случаев в популяции больных ВИЧ-инфекцией при ее назначении.
Проблема клинически выраженной ЦМВИ актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих корти-костероидную, туберкулостатическую терапию, перенесших ожоговую травму. ЦМВ может быть причиной посттрансфузионных гепатитов, разнообразной гинекологической патологии. Предполагается роль ЦМВ, как одного из кофакторов, в развитии системных васкулитов, хронических диссеминиро-ванных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма. Возможно развитие клинически выраженной ЦМВИ у взрослых лиц, не имеющих выраженных иммунологических нарушений, в следствие стрессовых и иных ситуаций.
Принципы лечения пациентов с цитомегаловирусной болезнью предусматривают одно-временное решение нескольких задач:
- предупреждение дальнейшего развития патологического процесса;
- предупреждение развития осложнений;
- предупреждение формирования остаточных явлений и инвалидизации.
Лечение больных включает назначение этиотропных препаратов, применение симптоматических средств и посиндромную терапию при развитии осложнений.
Выбор метода лечения цитомегаловирусной болезни проводится дифференцированно в зависимости от клинической картины (от формы, периода, тяжести течения болезни), степени проявлений симптомов, наличия осложнений, сопутствующих заболеваний, беременности, возраста больного и лабораторных маркеров активности ЦМВИ.
Основными задачами этиотропной терапии является подавление ре-пликативной активности вируса, снижение тяжести и продолжительности болезни и предотвращение развития осложнений.
В настоящее время лекарственными средствами с доказанной антици-томегаловирусной активностью и разрешенными к применению в РФ, являются ганцикловир и валганцикловир.
Ганцикловир - противовирусный эффект обусловлен образованием в пораженных вирусом клетках ганцикловиртрифосфата, тормозящего синтез вирусной ДНК в результате двух механизмов: конкурентного ингибирования ДНК-полимеразы и прямого включения в вирусную ДНК (последнее прекращает ее элонгацию). Фосфорилированный ганцикловир сохраняется в цитоплазме в течение нескольких дней.
Валганцикловир представляет собой L-валиловый эфир (пролекарство) ганцикловира, после приема внутрь быстро превращающийся в ганцикловир под действием кишечных и печеночных эстераз.
Наиболее широко применяемыми препаратами валганцикловира, зарегистрированными в России, являются:
- «Вальцит®» в лекарственной форме таблеток покрытых пленочной оболочкой, содержащих валганцикловир в дозировке 450 мг, производства Ф. Хоффманн-Ля Рош Лтд (Швейцария), регистрационное удостоверение П №015446/01 от 18.11.2009, который является наиболее близким аналогом (прототипом) заявляемого изобретения;
- «Цивалган» в лекарственной форме таблеток покрытых пленочной оболочкой, содержащих валганцикловир в дозировке 450 мг, производства ООО «Изварино Фарма» (Россия), регистрационное удостоверение ЛП-003056 от 24.06.2015;
- «Валганцикловир-Тева» в лекарственной форме таблеток покрытых пленочной оболочкой, содержащих валганцикловир в дозировке 450 мг, производства компании Тева Фармацевтические Предприятия Лтд (Израиль), регистрационное удостоверение ЛП-003443 от 04.02.2016;
- «Валганцикловир» в лекарственной форме таблеток, покрытых пленочной оболочкой, содержащих валганцикловир в дозировке 450 мг, производства компании Ауробиндо Фарма Лтд (Индия), регистрационное удостоверение ЛП-003665 от 06.06.2016.
Также из уровня техники известен патент RU 2440118 «Порошкообразный препарат валганцикловир», патентообладатель Ф. Хоффманн-Ля Рош (Швейцария). Согласно изобретению заявлена твердая фармацевтическая дозированная форма, предназначенная для перорального введения после восстановления в воде, включающая терапевтически эффективное количество валганцикловира гидрохлорида и фумаровую кислоту, содержащуюся в количестве, достаточном для снижения рН восстановленного раствора валган-цикловиргидрохлорида до рН, равного примерно 3,8 или ниже.
Вместе с тем, вышеуказанные препараты имеют различный состав вспомогательных веществ для придания им необходимых свойств.
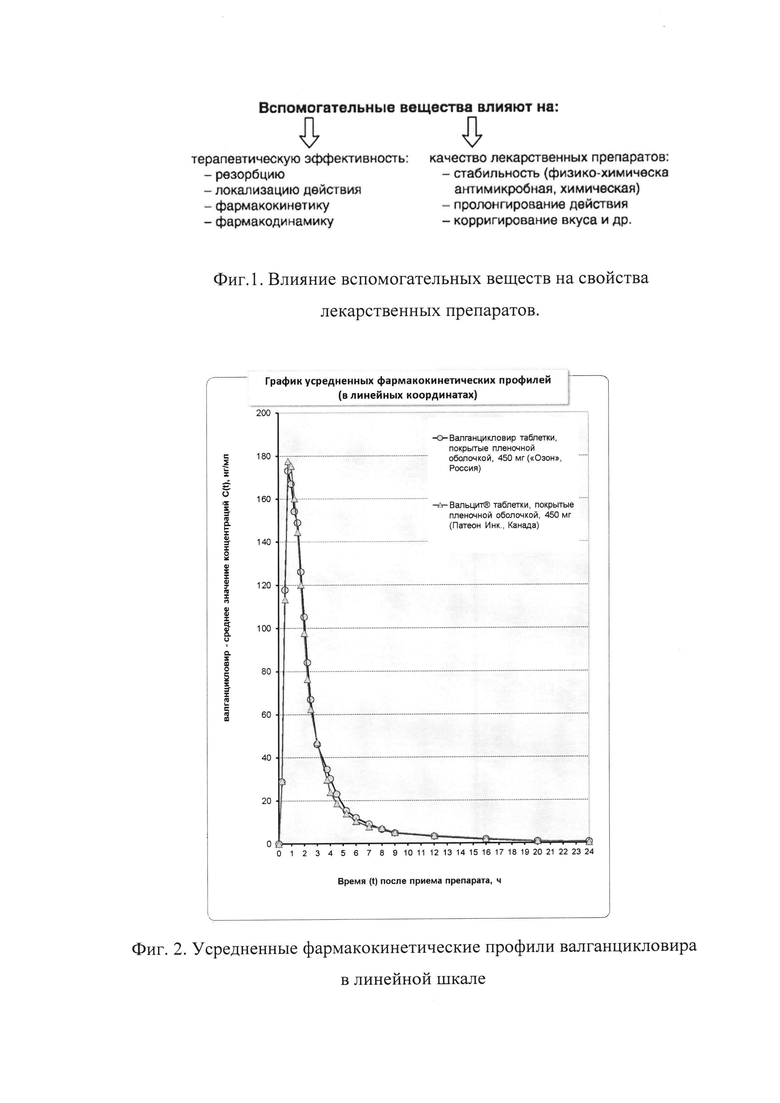
Данные экципиенты могут в значительной степени влиять на фармакологическую активность лекарственных веществ: усиливать действие лекарственных веществ или снижать их активность, изменять характер действия под влиянием разных причин, а именно комплексообразования, молекулярных реакций, интерференции и др. Биофармацевтические факторы, на которые оказывают влияние вспомогательные вещества, представлены на фиг. 1.
То есть вспомогательные вещества позволяют регулировать константы фармакокинетики (изменение концентрации вещества во времени) и фарма-кодинамики (совокупность эффектов, вызываемых лекарством), повышая (либо понижая) эффективность лекарственной терапии [Фармацевтическая технология. Изготовление лекарственных препаратов: учебник / А.С. Гаврилов. 2010. - 624 с. : ил.].
Кроме того, лечение ЦМВИ актуально так же для беременных и кормящих женщин, однако маннитол, входящий в значительных количествах в состав некоторых из вышеуказанных препаратов («Цивалган» и «Валганцикловир-Тева») согласно справочника лекарственных средств [https://www.rlsnet.ru/mnn_index_id_2364.htm] имеет ограничения к применению при беременности и лактации.
Таким образом, присутствующие на отечественном рынке препараты валганцикловира содержат в своих составах вспомогательные вещества, имеющие противопоказания для некоторых категорий пациентов, а так же различные по составу и содержанию, что может влиять на эффективность и качество готовой таблетированной лекарственной формы. Кроме того, указанные препараты в подавляющем большинстве представлены иностранными производителями.
В этой связи существует потребность в разработке безопасных, качественных и доступных таблетированных лекарственных форм валганцикловира отечественного производства, лишенных вышеуказанных недостатков.
Технической задачей настоящего изобретения является расширение арсенала и ассортимента лекарственных средств отечественного производства.
Техническим результатом (целью) изобретения является создание фармацевтической композиции валганцикловира, предпочтительно в виде таблетки, стабильной при получении и длительном хранении, а так же фармацевтически эквивалентной прототипу, но при этом отличающегося уникальным и оптимальным содержанием вспомогательных веществ, а так же свободным от маннитола.
Раскрытие изобретения.
Для достижения указанной цели авторами настоящего изобретения была предпринята попытка разработки препарата-аналога - Валганцикловир таблетки, покрытые пленочной оболочкой, 450 мг (разрабатываемый препарат), который по эффективности, безвредности и показателям качества не уступал бы препарату «Валъцит®» таблетки, покрытые пленочной оболочкой, 450 мг производства Патеон Инк., Канада (референтный препарат, препарат сравнения, прототип).
Несмотря на отсутствие маннитола в составе прототипа, данный препарат является препаратом иностранного производства, поэтому создание авторами настоящего изобретения оригинального состава отечественного препарата-аналога, представляется технически обоснованным.
Лекарственный препарат является по существу аналогичным оригинальному препарату (препаратом-генериком), если он удовлетворяет критериям одного и того же количественного и качественного состава относительно действующих веществ, одной и той же лекарственной формы и является биоэквивалентным. Лекарственные препараты фармацевтически эквивалентны, если они содержат одно и то же количество одного и того же действующего вещества в одних и тех же лекарственных формах, которые соответствуют требованиям одних и тех же или сопоставимых стандартов (Фармацевтический сектор: Директива 2001/83/ЕС Европейского Парламента и Совета ЕС.- К.: МОРИОН, 2013. - 120 с.; CPMP/EWG/QWP/1401/98. Note for guidance on the investigation of bioavailability and bioequivalence. - London: CPMP/EMEA, 26 July 2001). Лекарственный препарат является терапевтически эквивалентным другому препарату, если он содержит то же действующее вещество или его терапевтически активную часть и клинически проявляет такую же эффективность и безопасность, как и препарат, эффективность и безопасность которого установлена (CPMP/EWG/QWP/1401/98. Note for guidance on the investigation of bioavailability and bioequivalence. - London: CPMP/EMEA, 26 July 2001).
Референтный препарат «Вальцит®» таблетки, покрытые пленочной оболочкой, 450 мг содержит следующие компоненты (мг):
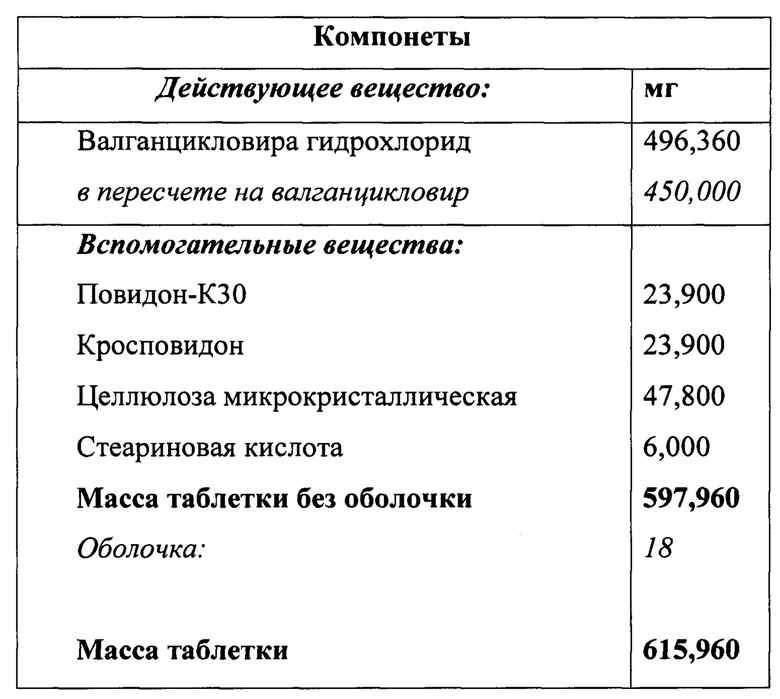
В указанном составе в качестве связующего вспомогательного вещества используется повидон с индексом вязкости 30 для облегчения процесса прессования при производстве таблеток. Однако этот же эксципиент используется в фармацевтической промышленности одновременно и как пролонгатор, то есть чем выше его индекс вязкости, тем медленнее растворимость таблетки и скорость высвобождения действующего вещества.
С целью улучшения показателей кинетики растворения авторами настоящего изобретения было принято решение об использовании в качестве связующего вещества повидона с более низким индексом вязкости 25 и одновременным увеличением количества целлюлозы микрокристаллической.
Однако сложность разработки измененного состава веществ заключается в соблюдении качественных показателей аналогичных референтному препарату. Существенное изменение состава вспомогательных веществ зачастую влечет изменение физико-химических характеристик лекарственных форм в процессе их изготовления и хранения. Так, например, введение в состав таблеток нитроглицерина до 1% повидона значительно снижает пористость таблетки и, как следствие, способность нитроглицерина испаряться. В результате срок хранения таблеток в открытой упаковке повышается с 2 недель до нескольких месяцев.
С целью достижения технического результата авторами настоящего изобретения экспериментальным путем был подобран уникальный состав вспомогательных веществ, обеспечивающих оптимальную скорость растворения и высвобождения действующего вещества из разработанной фармацевтической композиции, а так же идентичные референтному препарату показатели биоэквивалентности.
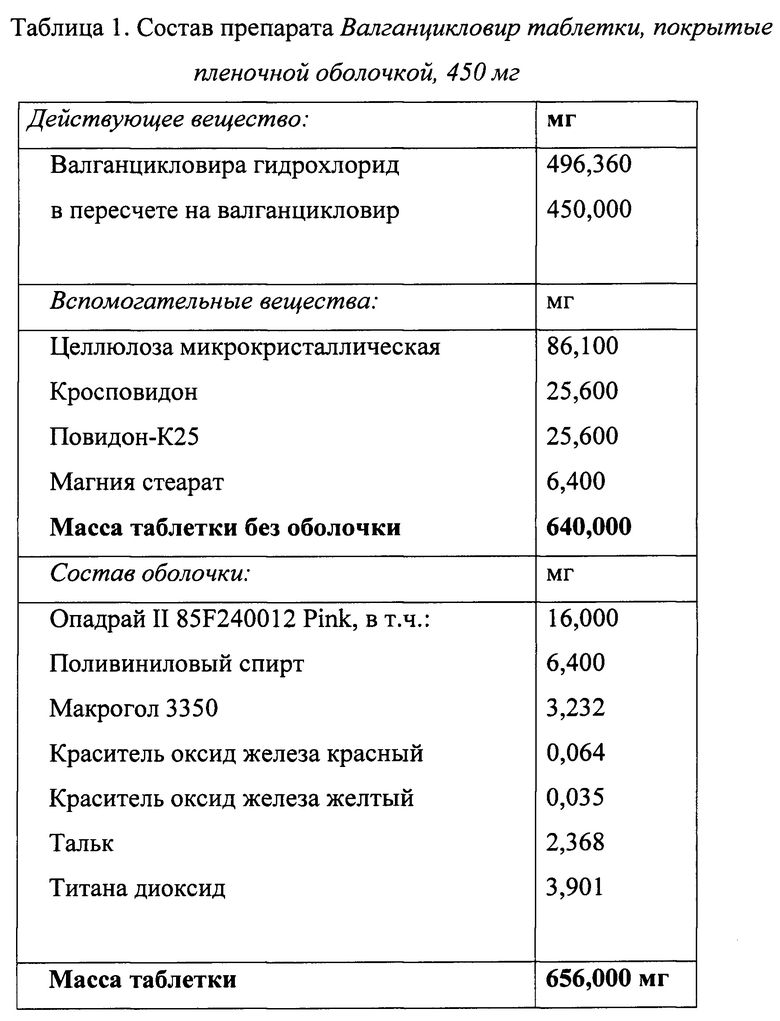
С учетом изложенного выше был выбран оптимальный состав препарата Валганцикловир таблетки, покрытые пленочной оболочкой, 450 мг представленный в таблице 1.
Также в соответствии с целями, заявляемыми в настоящем изобретении, было необходимо исследовать кинетику растворения разработанного препарата.
Было проведено проспективное открытое рандомизированное перекрестное исследование сравнительной фармакокинетики и биоэквивалентности препаратов Валганцикловир таблетки, покрытые пленочной оболочкой, 450 мг производства ООО «Озон», Россия и Вальцит таблетки, покрытые пленочной оболочкой, 450 мг производства Патеон Инк., Канада с участием здоровых добровольцев при приеме после еды.
Фармакокинетические параметры рассчитаны с применением в соответствии с Методическими указаниями и Руководством по экспертизе лекарственных средств [Оценка биоэквивалентности лекарственных средств: Методические указания. Министерство здравоохранения и социального развития РФ, Федеральная служба по надзору в сфере здравоохранения и социального развития, ФГУ «Научный центр экспертизы средств медицинского применения». - М., 2008. - 33 с.].
Значения параметров Cmax и TCmax были оценены непосредственно из полученных данных «концентрация-время», а значения площадей под фармакокинетическими кривыми AUC0-t были вычислены с использованием метода трапеций [25. РК Solution 2.0. Non compartmental Pharmacokinetics Data Analysis. User Guide / David S. Farrior, Ph.D. - Summit Research Services, Montrose, Colorado, USA, 2000. - 18 c. URL:].
На основе статистической обработки фармакокинетических профилей были проведены исследования в результате которых были рассчитаны средние значения концентраций валганцикловира в зависимости от времени после однократного приема препаратов, их стандартные отклонения, коэффициенты вариации и другие статистические показатели.
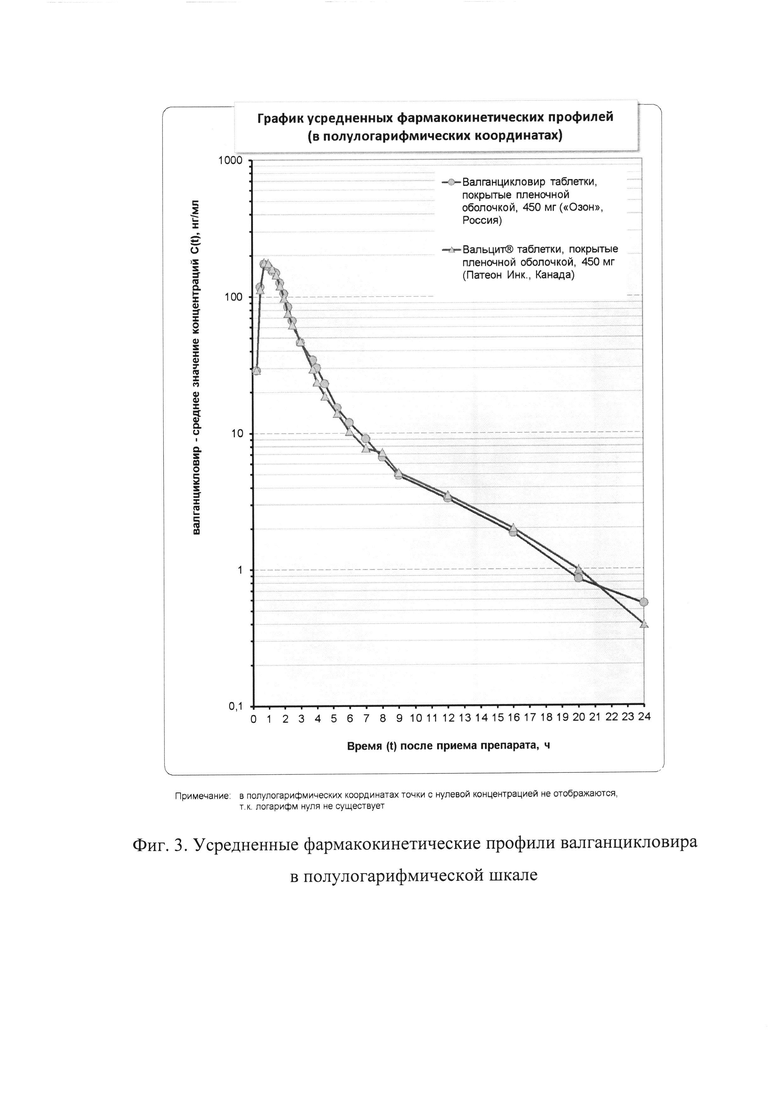
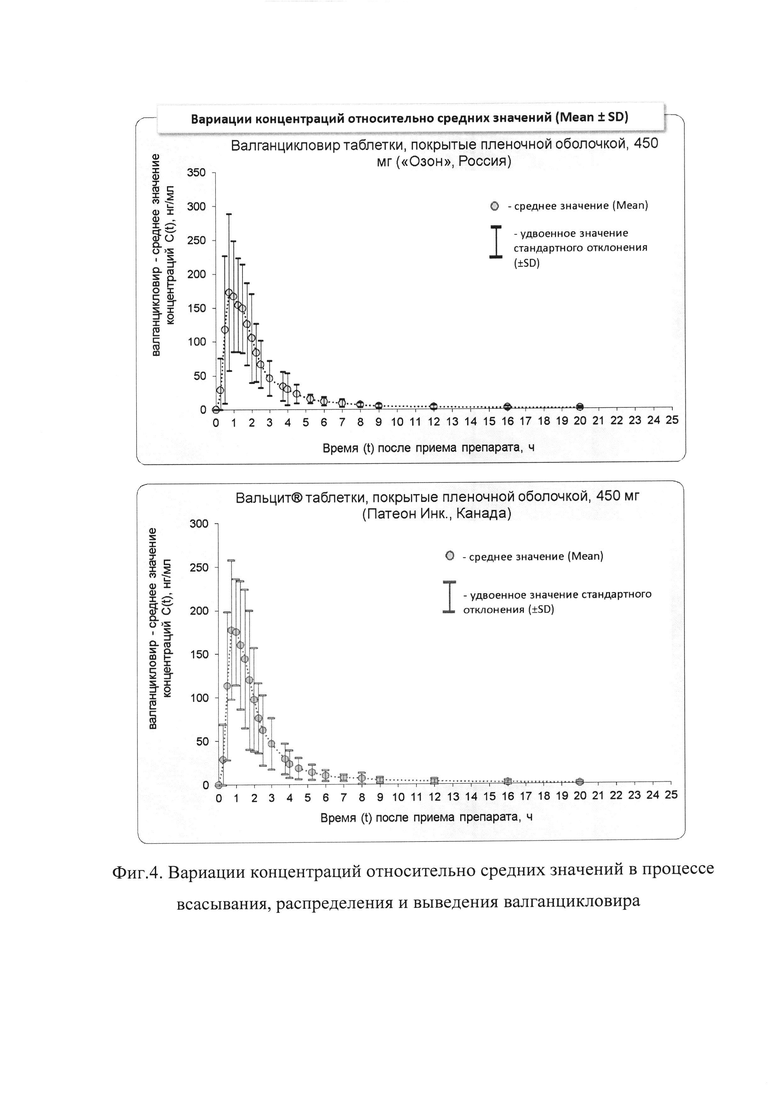
На фиг. 2-3 представлены диаграммы усредненных фармакокинетических профилей валганцикловира. Данные диаграммы иллюстрируют изменение средних концентраций со временем, содержат графики в линейных и полулогарифмических координатах соответственно. На фиг. 4 (в линейных координатах) представлены вариации концентраций относительно средних значений в различные моменты времени проиллюстрированы в виде вертикальных линий, равных стандартному отклонению. Как видно из представленных фармакокинетических кривых, характер зависимости «средняя концентрация действующего вещества - время» для сравниваемых препаратов практически не отличается.
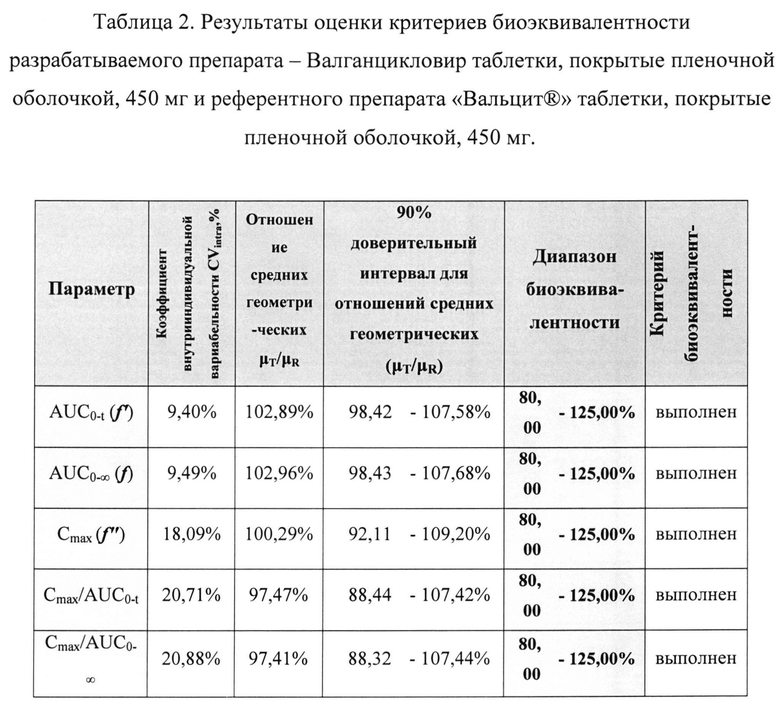
С целью подтверждающей проверки биоэквивалентности лекарственных препаратов по основным параметрам фармакокинетики AUC0-t, AUC0-∞, Cmax, Cmax/AUC0-t, Cmax/AUCo-∞ использовались стандартные пределы биоэквивалентности от 80,00% до 125,00% для 90% доверительного интервала оцениваемого отношения средних геометрических μT/μR.
В таблице 2 приведены результаты оценки критериев биоэквивалентности разрабатываемого препарата - Валганцикловир таблетки, покрытые пленочной оболочкой, 450 мг и референтного препарата «Вальцит®» таблетки, покрытые пленочной оболочкой, 450 мг.
Как видно из данных, представленных выше, 90% доверительные интервалы для всех параметров (AUC0-t, AUC0-∞, Cmax, Cmax/AUC0-t, Cmax/AUCo-∞) не выходят за рамки биоэквивалентности, установленные Методическими указаниями и протоколом. Следовательно, сравниваемые лекарственные препараты являются биоэквивалентными.
Таким образом, в соответствии с целями настоящего изобретения авторам удалось создать фармацевтическую композицию валганцикловира, в виде таблетки, свободную от маннитола и фармацевтически эквивалентную прототипу, но при этом отличающуюся уникальным и оптимальным содержанием вспомогательных веществ.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая композиция этамбутола | 2019 |
|
RU2713197C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КАЛЬЦИЕВУЮ СОЛЬ РОЗУВАСТАТИНА (ВАРИАНТЫ) | 2015 |
|
RU2606592C1 |
| Система доставки 2-этил-6-метил-3-гидроксипиридина сукцината для перорального применения в форме гастроретентивной таблетки | 2019 |
|
RU2734970C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ЭНТАКАПОНА, ЛЕВОДОПЫ И КАРБИДОПЫ С УЛУЧШЕННОЙ БИОДОСТУПНОСТЬЮ | 2009 |
|
RU2485947C2 |
| Комбинация, ее применение и способы лечения с использованием указанной комбинации | 2018 |
|
RU2755710C2 |
| Лекарственная форма в виде капсулы, содержащая таблетки с диметилфурмаратом | 2019 |
|
RU2742745C1 |
| ТВЕРДЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ, СОДЕРЖАЩИЕ ТАДАЛАФИЛ | 2008 |
|
RU2456989C2 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ ДЛЯ КОРРЕКЦИИ ПСИХОСОМАТИЧЕСКИХ ПРОЯВЛЕНИЙ | 2009 |
|
RU2424807C2 |
| Фармацевтическая композиция пролонгированного действия на основе 5-этокси-2-[2-(морфолино)-этилтио] бензимидазола дигидрохлорида и/или основания (Афобазола) | 2017 |
|
RU2694837C2 |
| ТАБЛЕТКИ НА ОСНОВЕ УЛИПРИСТАЛА АЦЕТАТА | 2009 |
|
RU2492853C2 |
Изобретение относится к фармацевтической промышленности, в частности к фармацевтической композиции валганцикловира. Фармацевтическая композиция валганцикловира выполненна в виде таблетки, покрытой оболочкой, включающей действующее вещество – валганцикловир, вспомогательные вещества: целлюлозу микрокристаллическую, кросповидон, повидон-К25, магния стеарат и оболочку, причем все компоненты взяты в определённом соотношении. Вышеописанная таблетка стабильна при длительном хранении, отличается уникальным и оптимальным содержанием вспомогательных веществ, а также свободна от маннитола. 4 ил., 2 табл.
Фармацевтическая композиция валганцикловира, выполненная в виде таблетки, покрытой оболочкой, включающая активное вещество и комбинацию вспомогательных веществ, имеющая следующий состав, мг:
при этом оболочка имеет следующий состав, мг:
| Вальцит | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА АЗИТРОМИЦИНА | 2012 |
|
RU2498805C1 |
| US 20080146591 A1, 19.06.2008 | |||
| ANAIZI N.H | |||
| et al., "Stability of valgancyclovir in an extemporaneously compounded oral liquid", American Journal of health-system pharmacy, 2002, v.59, n13, | |||
Авторы
Даты
2020-05-13—Публикация
2019-05-22—Подача