Изобретение относится к медицинской биотехнологии, онкологии и может быть использовано для получения белка, прочно связывающего ионы Gd3+. Комплекс белка с ионами Gd3+, в свою очередь, может быть использован для получения физиологически приемлемого Gd3+- содержащего агента, необходимого для контрастирования опухолей с помощью спектроскопии парамагнитного резонанса и для радиотерапии опухолей по принципу термоаблации.
Ион гадолиния (Gd3+) обладает уникальными парамагнитными свойствами, которые широко используются в медицинской диагностике для магнитно-резонансной визуализации и для поражения опухолевых клеток вторичным тепловым излучением [Goischke H.K. MRI with gadolinium-based contrast agents: practical help to ensure patient safety // J. Am. Coll. Radiol. 2016. Vol. 1546-1440(16), P. 30315-30315]. Время релаксации электронно-спиновой решетки контрастирующих агентов на основе Gd3+ Т1 составляет около 0,1 нсек, что на порядок меньше времени релаксации протонов в воде [Dinger S.C., Fridjhon P., Rubin D.M. Thermal Excitation of Gadolinium-Based Contrast Agents Using Spin Resonance //PLoSOne. 2016. Vol. 11(6), P. e0158194]. Поскольку сам по себе ион Gd3+ токсичен даже в низких концентрациях (достаточных для контрастирования биологических структур с учётом высокой парамагнитной активности ионов Gd3+), его используют в хелатированной форме с комплексообразователями, которые обладают высокими константами связывания, например, этоксибензил-диэтилентриаминопентауксусной кислотой [Saito K., Yoshimura N., Shirota N., Saguchi T., Sugimoto K., Tokuuye K. Distinguishing liver haemangiomas froм Мetastatic tumours using gadolinium ethoxybenzyl diethylenetriaminepentaacetic acid-enhanced diffusion-weighted imaging at 1.5 TMRI // J. Med. Imaging Radiat. Oncol. 2016. [Epub ahead of print] PubMedPMID: 27324436]. Наночастицы, содержащие хелатированную форму Gd3+, рутинно применяются для прижизненного контрастирования тонкой инфраструктуры при выполнении МРТ в интересах клинической диагностики самых различных тканей: структур мозга [Hu H.H., Pokorney A., Towbin R.B., Miller J.H. Increased signal intensities in the dentate nucleus and globus pallidus on unenhanced T1-weighted images: evidence in children undergoing multiple gadoliniuм МRI exams //Pediatr.Radiol. 2016. [Epub ahead of print] PubMed PMID: 27282825], сосудистых плексусов [Schnell S., Wu C., Ansari S.A. Four-dimensional MRI flow examinations in cerebral and extracerebral vessels - ready for clinical routine? // Curr.Opin.Neurol. 2016. [Epub ahead of print] PubMed PMID: 27262148], миокарда и коронарных сосудов [Swoboda P.P., McDiarmid A.K., Erhayiem B., Haaf P., Kidambi A., Fent G.J., Dobson L.E., Musa T.A., Garg P., Law G.R., Kearney M.T., Barth J.H., Ajjan R., Greenwood J.P., Plein S. A novel and practical screening tool for the detection of silent myocardial infarction in patients with type 2 diabetes // J. Clin. Endocrinol. Metab. 2016. [Epub ahead of print] PubMed PMID: 27300573].
В работе [Kang M.K., LeeG.H., JungK.H., JungJ.C., KimH.K., KimY.H., LeeJ., RyeomH.K., KimT.J., ChangY. Gadolinium Nanoparticles Conjugated with Therapeutic Bifunctional Chelate as a Potential T1 Theranostic Magnetic Resonance Imaging Agent // J. Biomed. Nanotechnol. 2016. Vol. 12(5). P. 894-908] описан метод получения наночастиц оксида гадолиния Gd@SiO2-DO3AиGd@SiO2-DO2A-BTA размером 50-60 нм. Наночастицы изготавливались из тетраэтилортосиликата (TEOS) и (3-аминопропил) триэтоксисилана (APTES) с последующей функционализацией аминопропилсилановых групп 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксуснойкислотой (DOTA) или 1,4,7,10-тетраазациклододекан-1,4,7-трсуксуснойкислотой, конъюгированной с бензотиазолом (DO3A-BTA). Наночастицы Gd@SiO2-DO3A и Gd@SiO2-DO2A-BTA отличались высокой растворимостью и стабильностью коллоидного раствора. Релаксивность r1 наночастиц Gd@SiO2-DO3A и Gd@SiO2-DO2A-BTA оказалась намного выше, чем у низкомолекулярных контрастных веществ, а соотношение r2/r1 [DeLeon-Rodriguez L.M., Martins A.F., Pinho M.C., Rofsky N.M., SherryA.D. Basic MR Relaxation Mechanisms and Contrast Agent Design // JMRI. 2015. Vol. 42, Issue 3. Pp. 545-565] для них приближалось к 1, что позволяет использовать их в МРТ [Yang C.-T., Chuang K.-H. Gd(III) chelates for MRI contrast agents: from high relaxivity to ‘‘smart’’, from blood pool to blood–brain barrier permeable // Med. Chem. Commun., 2012, Vol. 3.P. 552]. Исследование биораспределения наночастиц показало, что Gd@SiO2-DO2A-BTA выводится из организма преимущественно с желчью и мочой. Наночастицы Gd@SiO2-DO2A-BTA накапливались в опухолевых клетках и оказались пригодны для уничтожения in vivo таких перевиваемых клеточных линий, как SK-HEP-1, MDA-MB-231, HeLa и Hep-3B. Хотя имеются сообщения о кумулятивной токсичности наноструктурированных контрастных веществ на основе гадолиния [Maximova N., Gregori M., Zennaro F., Sonzogni A., Simeone R., Zanon D. Hepatic gadolinium deposition and reversibility after contrast agent-enhanced MR imaging of pediatric hematopoietic stem cell transplant recipients // Radiology. 2016 [Epub ahead of print] PubMed PMID: 27276243], в частности нефротоксичности [Ersoy H., Rybicki F.J. Biochemical Safety Profiles of Gadolinium-Based Extracellular Contrast Agents and Nephrogenic Systemic Fibrosis // J. Magn. Reson. Imaging. 2007. November. Vol. 26(5). P. 1190–1197], их применение в МРТ-диагностике самых различных заболеваний, а также перспектива использования для терапии опухолей рассматривается как актуальная задача, что подтверждается публикациями на эту тему [Le Duc G., Roux S., Paruta-Tuarez A., Dufort S., Brauer E., Marais A., Truillet C., Sancey L., Perriat P., Lux F., Tillement O. Advantages of gadolinium based ultrasmall nanoparticles vs molecular gadolinium chelates for radiotherapy guided by MRI for glioma treatment // Cancer Nanotechnology Basic, Translational and Clinical Research. 2014. 5:4].
Известны результаты, свидетельствующие о возможности использования белковых носителей для доставки ионов Gd3+in vivo. В статье [Chataigner L.; Guo J.; Erskine P.T.; Coker A.R.; Wood S.P., Gombos Z., Cooper J.B. (2016) Binding of Gd3+ to the neuronal signalling protein calexcitin identifies an exchangeable Ca2+-binding site. / Acta Crystallographica Section F: Structural Biology and Crystallization Communications, F72 (4) pp. 276-281. 10.1107/S2053230X16003526] для этой цели использован кальэкситин - белковый нейротоксин из морской змеи Hermissen dacrassicornis.
Известен патент РФ №2015514 «Способ получения кальмодулина», раскрывающий способ очистки кальмодулина из естественного источника - семенников крупного рогатого скота.
В публикации [Le Clainche L. и Vita C. «Binding Toxic Metals to New Calmodulin Peptides» в сборнике Environmental Chemistry pp 133-143] сообщается о создании синтетических пептидов с вторичной структурой типа «спираль-петля-спираль», стабилизированной дисульфидной связью, на основе кальмодулина инфузории Paramecium tetraurelia. Этот пептид образует прочные комплексы с ионами Ca2+ и Cd2+: константы диссоциации этих комплексов составляют 30±1 мкM и 8±4 мкM, соответственно.
Известен патент США N 20180134810 Uranium-chelating peptides and uses thereof, патентообладатель Coм Мissariat A L'energie Atomique Et Aux Energies Alternatives May 17, 2018, раскрывающий структуру пептидов, обладающих высоким сродством к ионам Gd3+, в том числе, на основе кальмодулина.
Наиболее близким аналогом заявляемого изобретения является работа [Позднякова Н.В., Григорьева Е.Ю., Шевелев А.Б. Мицеллярные композиции на основе функционализованных α фетопротеином амфифильных блок-сополимеров, содержащих гадолиний и куркумин. Вестник Российского государственного медицинского университета. 2016. № 3. С. 30-37]. В ней раскрывается методика получения мицеллярных композиций на основе трёхблочных амфифильных сополимеров полиэтиленгликоля и полипропиленгликоля Pluronic®F127 и Pluronic®P123, включающих хелатированный комплекс Gd3+ c природным гидрофобным комплексоном куркумином, поверхность которых функционализована рекомбинантным производным α-фетопротеина человека. Методом динамического светорассеяния определен размер наночастиц, показано, что мицеллы характеризуются узким диапазоном распределения по размеру. При этом средний диаметр мицелл существенно зависел от состава композиции, но никогда не превышал 100 нм. Предварительные эксперименты in vivo на животных по оценке переносимости мицеллярной композиции показали отсутствие явно выраженной токсичности при введении максимально возможной концентрации гадолиния.
Проблема, решаемая настоящим изобретением, состоит в разработке технологически эффективного способа получения Gd3+-связывающего лиганда на основе искусственного рекомбинантного белка, обладающего способностью прочно удерживать ион металла в условиях, приближенных к физиологическим, обеспечивая его детоксикацию и адресную доставку в опухолевую ткань.
Решение задачи в сравнении с прототипом достигается путём выполнения следующих операций:
1) Генно-инженерное конструирование:
Разрабатывают и получают генно-экспрессионную ДНК-конструкцию рW4, кодирующую искусственный белок в составе семи последовательно расположенных от N-конца к С-концу элементов первичной структуры: (1) His-таг для дополнительной очистки белка методом металл-хелатной хроматографии; (2) лидерный пептид гена 10 бактериофага T7 для улучшения эффективности трансляции в E. coli; (3) Xpress™ epitopetag - сайт расщепления пептида энтерокиназой; (4) пептид F3, обладающий сродством к перспективному поверхностному онкомаркеру нуклеолину для обеспечения адресной доставки в опухолевые клетки; (5) линкерный пептид «Small antibody fragment linker»; (6) основной блок гетероповторов состава [Е2-М-Е4-М*-E2], где E- эластиноподобный пептид, а М - N-концевой кальций-связывающий мотив кальмодулина человека; (7) зелёный флуоресцентный белок EmGFP;
2) Получение и первичная переработка биомассы штамма-продуцента:
Конструкцию вводят в штамм E. coli BL21 (DE3), нарабатывают биомассу методом поверхностного культивирования на агаризованной среде Агар LB по Lennox (ООО Диаэм, каталожный номер 3139.0250), содержащей 100 мкг/мл ампициллина в течение 16 часов при 37°С. При культивировании штамма-продуцента в указанных условиях происходит автоиндукция синтеза целевого белка без внесения в среду какого-либо искусственного индуктора. Биомассу собирают с поверхности чашки шпателем, проводят гомогенизацию, суспендируют в буфере состава Трис-HCl, 50 мМ, рН 8,0, ЭДТА 2 мМ, 4-(2-аминоэтил) бензилсульфонил фторид гидрохлорид (AEBSF) 1,5 мМ, лизоцим куриного яйца 0,2 мг/мл, NaCl 0,1 М из расчета 50 мл буфера на 1 г сырой биомассы, инкубируют при 37°С, проводят ультразвуковую дезинтеграцию с помощью 10 кратной обработки в аппарате Soniprep 150 plus (MSE, Южная Корея) при мощности излучения 300 ватт в течение 45 сек с промежуточным охлаждением в ледяной бане.
3) Очистка целевого белка W4 из лизата штамма E. coli, содержащего конструкцию рW4:
(1) лизат, полученный на предыдущей стадии, подвергают предварительной очистке с помощью ионнообменной хроматографии и диализа; (2) устанавливают невозможность получения целевого продукта с высокой степенью очистки за счёт использования металлохелатной хроматографии на агарозных сорбентах, содержащих нитрилтриацетатную группу, что объясняется высокой аффинностью белка W4 к ионам Ni2+, входящим в состав сорбента; (3) устанавливают возможность избирательного осаждения белка W4 из предварительно очищенного лизата путем внесения ионов Gd3+ до конечной концентрации 2 мМ, образовавшийся преципитат осаждают с помощью низкоскоростного центрифугирования; устанавливают неэффективность использования других многозарядных катионов металлов помимо Gd3+ для избирательного белка W4 в связи с тем, что они либо обладают недостаточной аффинностью к белку и не обеспечивают полноты и избирательности осаждения (например, ион Ca2+), либо обладают чрезмерной аффинностью и приводят к образованию комплексов с металлом, нерастворимых в присутствии ЭДТА (Cu2+, Ni2+, Co2+); (4) целевой продукт - белок W4 переводят Gd3+-преципитата в раствор добавлением ЭДТА (N,N’-этилендиаминтетраацетат) до конечной концентрации 10-50 мМ в присутствии нейтрального или слабокислого физиологического буфера; (5) окончательно обессоливают белок с помощью диализа.
Следующие фигуры чертежей поясняют сущность изобретения:
Фиг. 1. Генетическая карта расположения функциональных элементов вспомогательной конструкции pB7 с участком гетероповторов состава E(Y)-M-E-M*.
Фиг. 2. Генетическая карта расположения функциональных элементов промежуточной конструкции pFL16. Объёмной стрелкой FL-16 показан участок, кодирующий F3-пептид, слитый с линкером.
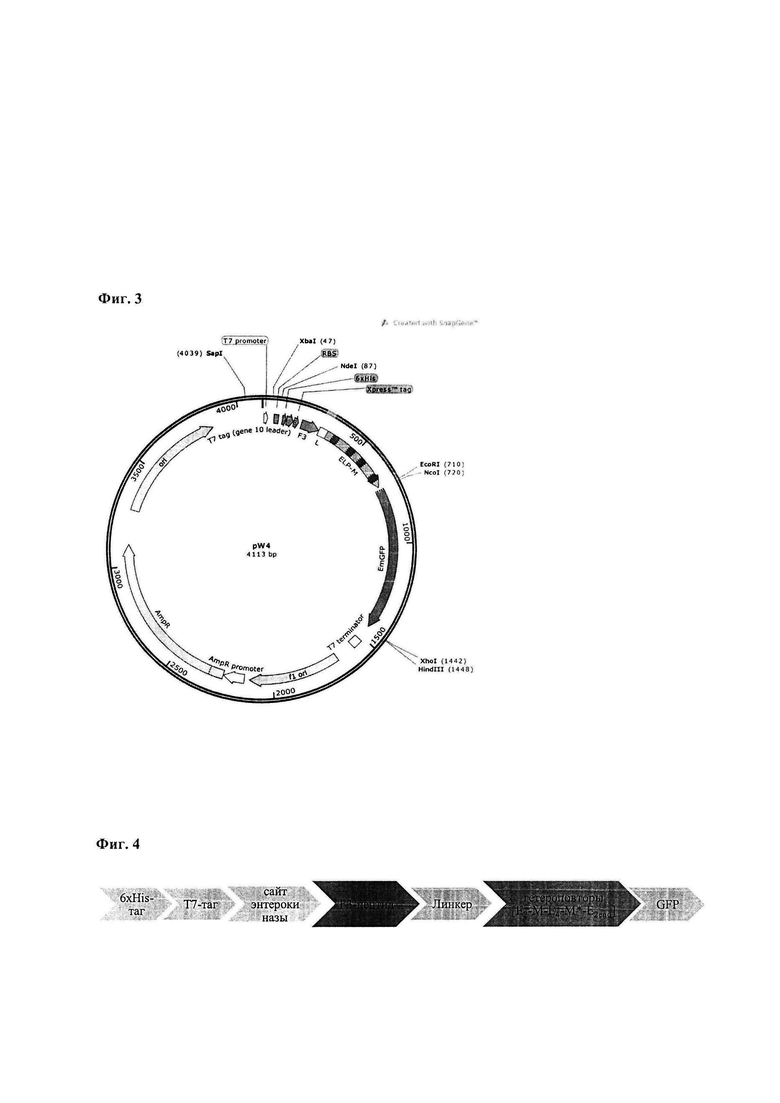
Фиг. 3. Генетическая карта расположения функциональных элементов конструкции pW4. Показаны F3-пептид (F3), линкер (L), блок гетероповторов (ELP-M) и зелёный флуоресцентный белок (EmGFP).
Фиг. 4. Расположение функциональных элементов в первичной структуре искусственного Gd3+-связывающего белка W4.
Фиг. 5. Анализ фракций, полученных при переработке лизата E. coli BL21 (DE3), несущего экспрессионную конструкцию pW4, при щелочных значениях рН (в буфере Tрис-HCl, pH 8,0), с помощью денатурирующего диск-электрофореза в 12,5% полиакриламидном геле (окрашен Кумасси R-250). На дорожки геля нанесены:
1 - растворимая фракция лизата биомассы E. coli BL21 (DE3, pW4), полученного в условиях автоиндукции (супернатант после центрифугирования лизата при 13 тыс. g);
2 - нерастворимая фракция лизата биомассы E. coli BL21 (DE3, pW4), полученного в условиях автоиндукции (осадок после центрифугирования лизата при 13 тыс. g);
3 - преципитат, полученный в результате внесения CaCl2 до конечной концентрации 90 мМ в растворимую фракцию лизата биомассы E. coli BL21 (DE3, pW4) с последующим центрифугированием при 13 тыс. g;
4 - преципитат, полученный в результате внесения Gd(NO3)3 до конечной концентрации 2 мМ в растворимую фракцию лизата биомассы E. coli BL21 (DE3, pW4) после осветления в присутствии CaCl2, с последующим центрифугированием при 13 тыс. g;
5 - растворимая фракция белков, полученная в результате внесения Gd(NO3)2 до конечной концентрации 2 мМ в растворимую фракцию лизата биомассы E. coli BL21 (DE3, pW4) после осветления в присутствии CaCl2, с последующим центрифугированием при 13 тыс. g;
6, 7, 8 - фракция, полученная в результате солюбилизации преципитата (4) в щелочном буфере Tрис-HCl, pH 8,0 с ЭДТА 10 мМ с последующим осветлением центрифугированием при 13 тыс. g, 2, 4, 6 мкл, соответственно;
L - Стандарт молекулярных масс (ThermoFisher Scientific). Стрелкой показано расположение целевого белка W4 (теоретически рассчитанная молекулярная масса 47,4 кДа).
Фиг. 6. Анализ фракций, полученных при переработке лизата E. coli BL21 (DE3), несущего экспрессионную конструкцию pW4, при кислых значениях рН (в буфере PIPES, pH 6,5), с помощью денатурирующего диск-электрофореза в 12,5% полиакриламидном геле (окрашен Кумасси R-250). На дорожки геля нанесены:
1 - растворимая фракция лизата биомассы E. coli BL21 (DE3, pW4), полученного в условиях автоиндукции (супернатант после центрифугирования лизата при 13 тыс. g);
2 - нерастворимая фракция лизата биомассы E. coli BL21 (DE3, pW4), полученного в условиях автоиндукции (осадок после центрифугирования лизата при 13 тыс. g);
3 - преципитат, полученный в результате внесения CaCl2 до конечной концентрации 90 мМ в растворимую фракцию лизата биомассы E. coli BL21 (DE3, pW4) с последующим центрифугированием при 13 тыс. g;
4 - растворимая фракция, полученная в результате внесения CaCl2 до конечной концентрации 90 мМ в лизат биомассы E. coli BL21 (DE3, pW4) с последующим центрифугированием при 13 тыс. g;
5 - растворимая фракция, полученная в результате внесения Gd(NO3)3 до конечной концентрации 2 мМ в растворимую фракцию лизата биомассы E. coli BL21 (DE3, pW4) после осветления в присутствии CaCl2, с последующим центрифугированием при 13 тыс. g;
6 - фракция, полученная в результате солюбилизации в кислом буфере PIPES, pH 6,5 с 10 мМ ЭДТА, преципитата, полученного при осаждении 2 мМ Gd(NO3)3 растворимой фракции лизата биомассы E. coli BL21 (DE3, pW4);
7 - фракция, полученная в результате солюбилизации в щелочном буфере Tрис-HCl, pH 8,0 с 10 мМ ЭДТА, преципитата, полученного при осаждении 2 мМ Gd(NO3)3 растворимой фракции лизата биомассы E. coli BL21 (DE3, pW4);
L - Стандарт молекулярных масс (ThermoFisher Scientific). Стрелкой показано расположение целевого белка W4 (теоретически рассчитанная молекулярная масса 47,4 кДа).
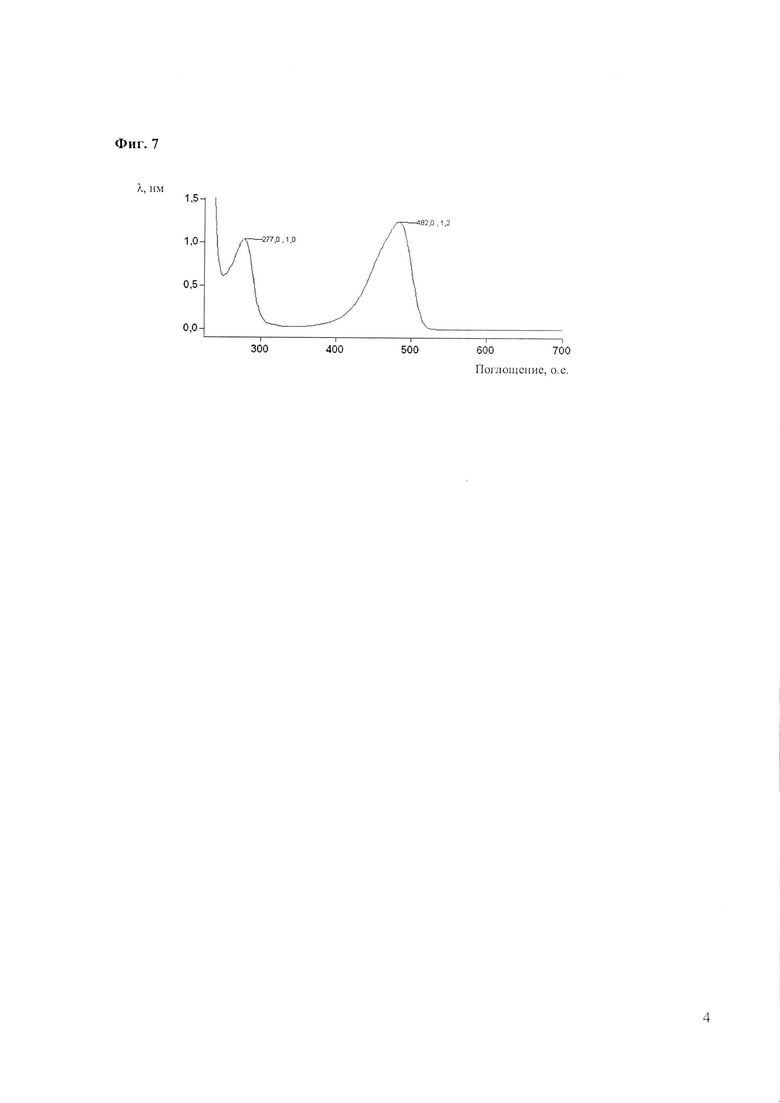
Фиг. 7. Спектр поглощения белка W4, очищенного по вышеописанной методике: фракция, полученная в результате солюбилизации в буфере Tрис-HCl, pH 8,0 с 10 мМ ЭДТА, преципитата, полученного при осаждении 2 мМ Gd(NO3)3 растворимой фракции лизата биомассы E. coli BL21 (DE3, pW4). Максимум поглощения при 277 нм соответствует ароматическим аминокислотам, при 482 нм - хромофору зелёного флуоресцентного белка EmGFP.
К описанию изобретения прилагаются последовательности:
SEQ ID NO: 1 - полная нуклеотидная последовательность экспрессионной конструкции pW4;
SEQ ID NO: 2 - аминокислотная последовательность Gd3+-связывающего белка W4
Осуществление изобретения иллюстрируется следующими примерами.
Пример 1. Получение экспрессионной конструкции pW4
Все конструкции получают и поддерживают в штамме E. coli BL21 (DE3), культивируемом на полноценной среде LB при 37°С в присутствии ампициллина в концентрации 100 мкг/мл. С целью повышения эффективности экспрессии гена искусственного белка при проведении ферментаций все искусственные кодирующие последовательности создают с преимущественным использованием наиболее часто встречающихся в E. coli кодонах.
Для получения экспрессионной конструкции pW4 создают промежуточные конструкции pB7 и pFL16.
1. Получение вспомогательной конструкции pB7
Плазмидную конструкцию pB7, кодирующая аминокислотный блок состава [ELP(Y)-ELP(S)-M-ELP(S)-ELP(S)-ELP(S)-ELP(S)-M*] или сокращенно [Е6-М2], где ELP(Y), ELP(S) - ELP-повторы с «гостевыми» аминокислотами Tyr и Ser, соответственно, а M и M* - инвариантные кальций-связывающие мотивы кальмодулина человека, получают на базе коммерчески доступного вектора pJET1.2/blunt (CloneJET PCR Cloning Kit, каталожный номер K1231).
Исходный мономер двунитевой ДНК, кодирующей блок указанного состава, получают, смешивая в эквимолярных соотношениях синтетические олигонуклеотиды E(Y) (5'-gtcccaggctatggcgtgccaggttctggt), E(Y)1 (5'-tggcacgccatagcctgggac), M (5'-gacaaagacggtgacggcaccatcaccaccaaagaactg), EME (5'-acccggaaccagttctttggtggtgatggtgccgtcaccgtctttgtcaccagaacc), E (5'-gttccgggttctggtgtgccaggcagtggtgtacctgggtcaggcgttccgggttctggt), E2 (5'-agaccacacggtccgtcaccacatggacccagtccgcaaggc), M* (5'-gacaaagacggtgacggcacgatcacgacgaaggagtta) и EME* (5'-ccaagaccactgtttctgccactgccgtgctagtgctgcttcctcaat) с последующей ПЦР-амплификацией полученного фрагмента ДНК с праймерами Bgl-E(Y) (5'-gcatcagatctgtcccaggctatggcg) и Bam-M* (5'-gcatcggatcctaactccttcgtcgtgatcgt). Продукт ПЦР клонируют в вектор pJET1.2/blunt (CloneJET PCR Cloning Kit, каталожный номер K1231) в соответствии с инструкцией производителя вектора.
Карта функциональных элементов конструкции pB7 представлена на Фиг. 1.
2. Получение вспомогательной конструкции pFL16
Вспомогательную конструкцию pFL16 получают на базе вектора pJET1.2/blunt. Она содержит вставку, кодирующую последовательно расположенные пептид F3 и пептидный линкер.
Получение конструкции включает следующие этапы:
• олигонуклеотиды F3-1for (5'-aaagacgagccgcagcgtcgctccgcccgcctcagcgccaaaccggcaccgccaaaaccc), и F3-1rev (5'-ttttttggctggcgcttttttcggctttggctcgggttttggcggtgccggtttggcgctgag) смешивают в эквимолярных соотношениях (3 пмоль каждого), после чего проводят достройку одноцепочечных участков с помощью высокоточной теромостабильной ДНК-полимеразы (Q5® High-Fidelity DNA Polymerase (NEB, каталожный номер M0491S) в присутствии dNTP согласно инструкции производителя фермента;
• проводят амплификацию двухцепочечного фрагмента, получение которого описано в предыдущем пункте, с помощью ПЦР с праймерами F3-2for (5'-aaagacgagccgcagcg) и F3-2rev (5'-ttttttggctggcgctttttt) (продукт ПЦР 1),
• проводят амплификацию продукта ПЦР 1, получение которого описано в предыдущем пункте, с помощью ПЦР с праймером FL for (5'-cgaaaaaagcgccagccaaaaaaggtggtggtggttctggtggcggcggctctggtggt) с последующей достройкой одноцепочечных участков (продукт ПЦР 2),
• проводят амплификацию продукта ПЦР 2, получение которого описано в предыдущем пункте, с праймерами F3-2for (5'-aaagacgagccgcagcg) и BamLrev (5'-gcatcggatccaccaccagagccgcc) (продукт ПЦР 3),
• проводят клонирование продукта ПЦР 3 в вектор pJET1.2/blunt в соответствии с инструкцией производителя вектора.
Карта конструкции pFL16 представлена на Фиг. 2
3. Получение экспрессионного вектора pW4
С использованием в качестве исходного материала вспомогательных конструкций pFL16 и pB7, добиваются последовательной экспансии числа блоков [Е6-М2]. В качестве реципиентного вектора используют конструкцию pFL16, кодирующую пептид F3 с пептидным линкером.
Единичный блок, кодирующий пептидный мономер состава [Е6-М2], получают с помощью ПЦР на матрице плазмиды pB7 с праймерами Bgl-E(Y)for (5'-gcatcagatctgtcccaggctatggcg) и Bam-M*rev (5'-gcatcggatcctaactccttcgtcgtgatcgt).
В качестве экспрессионного вектора используют вектор pRSET-EmGFP (ThermoFisher Scientific, каталожный номер V35320), и трансляционно слитый с ним зелёный флуоресцентный белок, необходимый для визуального наблюдения за продуктом в процессе биосинтеза, очистки и анализа.
Получение конструкции включает следующие этапы:
• проводят амплификацию блока [Е6-М2] в реакции ПЦР с праймерами Bgl-E(Y)for (5'-gcatcagatctgtcccaggctatggcg) и Bam-M*rev (5'-gcatcggatcctaactccttcgtcgtgatcgt) с использованием в качестве матрицы плазмиды pB7 (продукт ПЦР 4),
• продукт ПЦР 4 после обработки рестриктазой BamHI, лигируют с ДНК плазмиды pFL16, расщепленной по сайту BamHI; продукт лигирования вновь расщепляют рестриктазой BamHI и повторно лигируют с продуктом ПЦР 4, предварительно обработанным рестриктазой BamHI;
• получают фланкирующий концевой фрагмент экспрессионной единицы, содержащий два ELP-повтора, с использованием комплементарных олигонуклеотидов End-for (5'gatctgttccgggttctggtgtgcctggtagcggtg) и End-rev (5'gatccaccgctaccaggcacaccagaacccggaaca) с последующим клонированием его в полученный на предыдущем этапе вектор, расщепленный по сайту рестрикции BamHI: продукт ПЦР 5;
• проводят ПЦР-амплификацию продукта ПЦР 5 с использованием праймеров Bgl-Ffor (5'gcatcagatctaaagacgagccgcag) и EcoW4rev (5'gcactagaattcaccgctaccaggc) с последующим клонированием ПЦР-продукта в экспрессионный вектор pRSET-EmGFP по сайтам рестрикции BamHI и EcoRI.
Полученная конструкция представлена на Фиг. 3
Пример 2. Очистка рекомбинантного продукта конструкции pW4 - белка W4
Этапы:
Получение штамма-продуцента
Штамм-продуцент получают химической трансформацией клеток E. coli BL21 (DE3) плазмидной ДНК pW4. Для этого 0,1 мкг очищенной плазмидной ДНК добавляют к аликвоте компетентных клеток E. coli BL21(DE3) объемом 70 мкл, приготовленных по методике, предложенной в работе (Cohen et al., 1972). Суспензию клеток высевают на агаризованную среду LB, содержащую ампициллин (100 мкг/мл), и культивируют при 37°С в течение 16 часов.
Одну из выросших колоний со свежей трансформации переносят микробиологической петлей на полноценную питательную среду LB объемом 2-3 мл, содержащую ампициллин (100 мкг/мл), культивируют на микробиологической качалке при ротации со скоростью 220 об/мин при 37°С в течение 2 часов, затем высевают на агаризованную среду LB, содержащую ампициллин (100 мкг/мл), и культивируют при 37°С в течение 16-20 часов. Биомассу собирают с поверхности чашки шпателем. При необходимости хранят при -20°С в течение месяца. Выход биомассы с четырёх чашек Петри диаметром 9 см, содержащих по 12 мл среды на чашке, составляет 0,3-0,5 г сырой биомассы.
Лизис клеток методом ультразвуковой дезинтеграции
Биомассу суспендируют в буфере [50 мМ Трис, рН 8,0, 2 мМ ЭДТА, 1,5 мМ AEBSF, 0,2 мг/мл лизоцима, 0,1 М NaCl] из расчета 50 мл буфера на 1 г сырой биомассы, инкубируют 30 мин при 37°С. Затем проводят ультразвуковую обработку на дезинтеграторе Soniprep 150 plus (MSE, Корея) при мощности излучения 250-300 Вт в течение 45 секунд с перерывом на охлаждение в ледяной бане. Процедуру повторяют около 10 раз (до полного осветления лизата). Затем лизат центрифугируют при 13 000 об/мин, в течение 20 мин. Супернатант диализуют против 100-кратного избытка буфера состава 50 мМ Трис, рН 8,0, 50 мМ NaCl при +4°С в течение 16 часов, затем еще раз осветляют центрифугированием при 13 000 об./мин в течение 20 мин. Супернатант используют для дальнейшей очистки.
Предварительная очистка белка W4
Проводят предварительную очистку белка W4 с помощью одноступенчатой ионообменной хроматографии на DEAE Sepharose CL-6B.
• колонку уравновешивают буфером 50 мМ Трис, рН 8,0, 2 мМ ЭДТА, 0,1 М NaCl,
• наносят осветленный лизат E. coli BL21(DE3, pW4) на колонку с сорбентом DEAE Sepharose CL-6B объёмом 10 мл,
• удаляют не связавшийся с колонкой материал промыванием сорбента буфером 50 мМ Трис-HCl 8,0, 0,05 М NaCl объемом 50 мл;
• проводят элюцию целевого материала буфером состава 50 мМ Трис-HCl 8,0, 0,2 M NaCl объемом 5 мл.
Очистка белка дробным переосаждением солями Gd3+ в щелочном буфере Трис-HCl, рН 8,0
К 1 мл раствору осветленного и очищенного на ионообменной колонке лизата E. coli BL21(DE3, pW4) в буфере 50 мМ Трис-HCl, рН 8,0, 0,2 M NaCl при комнатной температуре добавляют водный раствор 0,9 М CaCl2 до конечной концентрации Ca2+ 80-100 мМ, инкубируют при 37°С 30 мин, осветляют центрифугированием при 13 000 об/мин при +4°С в течение 20 мин. К супернатанту добавляют водный раствор нитрата гадолиния до конечной концентрации Gd3+ 2 мМ, инкубируют при 37°С 5 мин, центрифугируют при 13 000 об/мин, в течение 20 мин. Супернатант отбрасывают, осадок растворяют в 100 мкл буфера [Трис-HCl 50 мМ, рН 8,0, NaCl 50 мМ, ЭДТА 10 мМ], центрифугируют при 13 000 об/мин, в течение 20 мин. Осадок, содержащий нерастворимые примеси клеточных белков, удаляют, а супернатант, обогащенный фракцией белка W4, диализуют против 100-кратного избытка буфера состава 50 мМ Трис-HCl, рН 8,0, 50 мМ NaCl, 0,002% NaN3 при +4°С в течение 16 часов. Процедуру переосаждения ионом Gd3+ повторяют дважды. Очистку белка от примесей ионов металлов осуществляют путём многократного диализа при 100-кратном избытке диализного буфера.
• Диализ 1 - буфер [50 мм Трис-HCl, рH 8,0, 100 мм ЭДТА, 0,1 М NaCl, 0,002% NaN3], 24 часа при комнатной температуре,
• Диализ 2 - буфер [50 мм Трис-HCl, рH 8,0, 100 мм ЭДТА, 0,1 М NaCl], 24 часа при +4°C,
• Диализ 3 - буфер [50 мм Трис-HCl, рH 8,0, 0,1 М NaCl], 24 часа при +4°C,
• Диализ 4 - буфер [50 мМ Трис-HCl, рН 8,0, 0,1 М NaCl], 24 часа при +4°С.
Очистка белка дробным переосаждением солями Gd3+ при кислых значениях рН (в буфере PIPES, pH 6,5)
После предварительной очистки белок диализуют при 100-кратном избытке буфера [50 мМ PIPES, pH 6,5, 50 мМ NaCl] 24 часа при +4°C. Затем проводят процедуру очистки с использованием тех же условий, что и при очистке при щелочных значениях рН. Конечную солюбилизацию в буфере с ЭДТА проводят и в щелочном буфере [50 мм Трис-HCl, рH 8,0, 10 мм ЭДТА, 50 мМ NaCl], и в кислом буфере [50 мМ PIPES, pH 6,5, 10 мм ЭДТА, 50 мМ NaCl].
Приготовление проб для диск-электрофореза в денатурирующем ПААГ
10 мкл образца соответствующей фракции смешивают с 10 мкл 2×кратного буфера для приготовления проб (Sample Buffer, Laemmli 2× Concentrate, Sigma, каталожный номер S3401-10VL) и прогревают при 99°С в течение 4 мин. Подготовленные пробы наносят на дорожку в объеме, пропорциональном объему каждой фракции.
Анализ результатов фракционирования лизата E. coli BL21(DE3, pW4) методом диск-электрофореза в денатурирующем ПААГ проводят с использованием бесплатного программного обеспечения GelAnalyzer2010a.
По результатам анализа фракций, полученных при дробном осаждении лизата E. coli BL21(DE3, pW4), делают вывод о том, что разработан способ очистки белка W4, основанный на его способности избирательно связывать ионы Gd3+ в концентрации 2 мМ с последующей солюбилизацией в присутствии ЭДТА в концентрации 10 мМ. По данным определения А482 (молярный коэффициент экстинкции при длине волны 482 нм принимают равным 57 500 ОЕ/моль, т.е. соответствующим табличному коэффициенту экстинкции белка EmGFP) проводят расчет общего содержания целевого белка. Выход целевого продукта составляет 1 мг с 400 мг сырой биомассы при электрофоретической чистоте 60%.
--->
Перечень нуклеотидной и аминокислотной последовательностей к заявке на патент на изобретение «Способ получения Gd3+-связывающего белка»
CGCGAAATTA ATACGACTCA CTATAGGGAG ACCACAACGG TTTCCCTCTA GAAATAATTT 60
TGTTTAACTT TAAGAAGGAG ATATACATAT GCGGGGTTCT CATCATCATC ATCATCATGG 120
TATGGCTAGC ATGACTGGTG GACAGCAAAT GGGTCGGGAT CTGTACGACG ATGACGATAA 180
GGATCGATGG GgatctAAAG ACGAGCCGCA GCGTCGCTCC GCCCGCCTCA GCGCCAAACC 240
GGCACCGCCA AAACCCGAGC CAAAGCCGAA AAAAGCGCCA GCCAAAAAAG GTGGTGGTGG 300
TTCTGGTGGC GGCGGCTCTG GTGGTGGATC TGTCCCAGGC TATGGCGTGC CAGGTTCTGG 360
TGACAAAGAC GGTGACGGCA CCATCACCAC CAAAGAACTG GTTCCGGGTT CTGGTGTGCC 420
AGGCAGTGGT GTACCTGGGT CAGGCGTTCC GGGTTCTGGT GACAAAGACG GTGACGGCAC 480
GATCACGACG AAGGAGTTAG GATCTGTCCC AGGCTATGGC GTGCCAGGTT CTGGTGACAA 540
AGACGGTGAC GGCACCATCA CCACCAAAGA ACTGGTTCCG GGTTCTGGTG TGCCAGGCAG 600
TGGTGTACCT GGGTCAGGCG TTCCGCGTTC TGGTGACAAA GACGGTGACG GCACGATCAC 660
GACGAAGGAG TTAGGATCTG TTCCGGGTTC TGGTGTGCCT GGTAGCGGTG AATTCGCCAC 720
CATGGTGAGC AAGGGCGAGG AGCTGTTCAC CGGGGTGGTG CCCATCCTGG TCGAGCTGGA 780
CGGCGACGTA AACGGCCACA AGTTCAGCGT GTCCGGCGAG GGCGAGGGCG ATGCCACCTA 840
CGGCAAGCTG ACCCTGAAGT TCATCTGCAC CACCGGCAAG CTGCCCGTGC CCTGGCCCAC 900
CCTCGTGACC ACCTTGACCT ACGGCGTGCA GTGCTTCGCC CGCTACCCCG ACCACATGAA 960
GCAGCACGAC TTCTTCAAGT CCGCCATGCC CGAAGGCTAC GTCCAGGAGC GCACCATCTT 1020
CTTCAAGGAC GACGGCAACT ACAAGACCCG CGCCGAGGTG AAGTTCGAGG GCGACACCCT 1080
GGTGAACCGC ATCGAGCTGA AGGGCATCGA CTTCAAGGAG GACGGCAACA TCCTGGGGCA 1140
CAAGCTGGAG TACAACTACA ACAGCCACAA GGTCTATATC ACCGCCGACA AGCAGAAGAA 1200
CGGCATCAAG GTGAACTTCA AGACCCGCCA CAACATCGAG GACGGCAGCG TGCAGCTCGC 1260
CGACCACTAC CAGCAGAACA CCCCCATCGG CGACGGCCCC GTGCTGCTGC CCGACAACCA 1320
CTACCTGAGC ACCCAGTCCG CCCTGAGCAA AGACCCCAAC GAGAAGCGCG ATCACATGGT 1380
CCTGCTGGAG TTCGTGACCG CCGCCGGGAT CACTCTCGGC ATGGACGAGC TGTACAAGTA 1440
ACTCGAGAAG CTTGATCCGG CTGCTAACAA AGCCCGAAAG GAAGCTGAGT TGGCTGCTGC 1500
CACCGCTGAG CAATAACTAG CATAACCCCT TGGGGCCTCT AAACGGGTCT TGAGGGGTTT 1560
TTTGCTGAAA GGAGGAACTA TATCCGGATC TGGCGTAATA GCGAAGAGGC CCGCACCGAT 1620
CGCCCTTCCC AACAGTTGCG CAGCCTGAAT GGCGAATGGG ACGCGCCCTG TAGCGGCGCA 1680
TTAAGCGCGG CGGGTGTGGT GGTTACGCGC AGCGTGACCG CTACACTTGC CAGCGCCCTA 1740
GCGCCCGCTC CTTTCGCTTT CTTCCCTTCC TTTCTCGCCA CGTTCGCCGG CTTTCCCCGT 1800
CAAGCTCTAA ATCGGGGGCT CCCTTTAGGG TTCCGATTTA GTGCTTTACG GCACCTCGAC 1860
CCCAAAAAAC TTGATTAGGG TGATGGTTCA CGTAGTGGGC CATCGCCCTG ATAGACGGTT 1920
TTTCGCCCTT TGACGTTGGA GTCCACGTTC TTTAATAGTG GACTCTTGTT CCAAACTGGA 1980
ACAACACTCA ACCCTATCTC GGTCTATTCT TTTGATTTAT AAGGGATTTT GCCGATTTCG 2040
GCCTATTGGT TAAAAAATGA GCTGATTTAA CAAAAATTTA ACGCGAATTT TAACAAAATA 2100
TTAACGCTTA CAATTTAGGT GGCACTTTTC GGGGAAATGT GCGCGGAACC CCTATTTGTT 2160
TATTTTTCTA AATACATTCA AATATGTATC CGCTCATGAG ACAATAACCC TGATAAATGC 2220
TTCAATAATA TTGAAAAAGG AAGAGTATGA GTATTCAACA TTTCCGTGTC GCCCTTATTC 2280
CCTTTTTTGC GGCATTTTGC CTTCCTGTTT TTGCTCACCC AGAAACGCTG GTGAAAGTAA 2340
AAGATGCTGA AGATCAGTTG GGTGCACGAG TGGGTTACAT CGAACTGGAT CTCAACAGCG 2400
GTAAGATCCT TGAGAGTTTT CGCCCCGAAG AACGTTTTCC AATGATGAGC ACTTTTAAAG 2460
TTCTGCTATG TGGCGCGGTA TTATCCCGTA TTGACGCCGG GCAAGAGCAA CTCGGTCGCC 2520
GCATACACTA TTCTCAGAAT GACTTGGTTG AGTACTCACC AGTCACAGAA AAGCATCTTA 2580
CGGATGGCAT GACAGTAAGA GAATTATGCA GTGCTGCCAT AACCATGAGT GATAACACTG 2640
CGGCCAACTT ACTTCTGACA ACGATCGGAG GACCGAAGGA GCTAACCGCT TTTTTGCACA 2700
ACATGGGGGA TCATGTAACT CGCCTTGATC GTTGGGAACC GGAGCTGAAT GAAGCCATAC 2760
CAAACGACGA GCGTGACACC ACGATGCCTG TAGCAATGGC AACAACGTTG CGCAAACTAT 2820
TAACTGGCGA ACTACTTACT CTAGCTTCCC GGCAACAATT AATAGACTGG ATGGAGGCGG 2880
ATAAAGTTGC AGGACCACTT CTGCGCTCGG CCCTTCCGGC TGGCTGGTTT ATTGCTGATA 2940
AATCTGGAGC CGGTGAGCGT GGGTCTCGCG GTATCATTGC AGCACTGGGG CCAGATGGTA 3000
AGCCCTCCCG TATCGTAGTT ATCTACACGA CGGGGAGTCA GGCAACTATG GATGAACGAA 3060
ATAGACAGAT CGCTGAGATA GGTGCCTCAC TGATTAAGCA TTGGTAACTG TCAGACCAAG 3120
TTTACTCATA TATACTTTAG ATTGATTTAA AACTTCATTT TTAATTTAAA AGGATCTAGG 3180
TGAAGATCCT TTTTGATAAT CTCATGACCA AAATCCCTTA ACGTGAGTTT TCGTTCCACT 3240
GAGCGTCAGA CCCCGTAGAA AAGATCAAAG GATCTTCTTG AGATCCTTTT TTTCTGCGCG 3300
TAATCTGCTG CTTGCAAACA AAAAAACCAC CGCTACCAGC GGTGGTTTGT TTGCCGGATC 3360
AAGAGCTACC AACTCTTTTT CCGAAGGTAA CTGGCTTCAG CAGAGCGCAG ATACCAAATA 3420
CTGTTCTTCT AGTGTAGCCG TAGTTAGGCC ACCACTTCAA GAACTCTGTA GCACCGCCTA 3480
CATACCTCGC TCTGCTAATC CTGTTACCAG TGGCTGCTGC CAGTGGCGAT AAGTCGTGTC 3540
TTACCGGGTT GGACTCAAGA CGATAGTTAC CGGATAAGGC GCAGCGGTCG GGCTGAACGG 3600
GGGGTTCGTG CACACAGCCC AGCTTGGAGC GAACGACCTA CACCGAACTG AGATACCTAC 3660
AGCGTGAGCT ATGAGAAAGC GCCACGCTTC CCGAAGGGAG AAAGGCGGAC AGGTATCCGG 3720
TAAGCGGCAG GGTCGGAACA GGAGAGCGCA CGAGGGAGCT TCCAGGGGGA AACGCCTGGT 3780
ATCTTTATAG TCCTGTCGGG TTTCGCCACC TCTGACTTGA GCGTCGATTT TTGTGATGCT 3840
CGTCAGGGGG GCGGAGCCTA TGGAAAAACG CCAGCAACGC GGCCTTTTTA CGGTTCCTGG 3900
CCTTTTGCTG GCCTTTTGCT CACATGTTCT TTCCTGCGTT ATCCCCTGAT TCTGTGGATA 3960
ACCGTATTAC CGCCTTTGAG TGAGCTGATA CCGCTCGCCG CAGCCGAACG ACCGAGCGCA 4020
GCGAGTCAGT GAGCGAGGAA GCGGAAGAGC GCCCAATACG CAAACCGCCT CTCCCCGCGC 4080
GTTGGCCGAT TCATTAATGC AGGATCTCGA TCC 4113
Met Arg Gly Ser His His His His His His Gly Met Ala Ser Met Thr Gly Gly Gln Gln
Met Gly Arg Asp Leu Tyr Asp Asp Asp Asp Lys Asp Arg Trp Gly Ser Lys Asp Glu Pro
Gln Arg Arg Ser Ala Arg Leu Ser Ala Lys Pro Ala Pro Pro Lys Pro Glu Pro Lys Pro
Lys Lys Ala Pro Ala Lys Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
Ser Val Pro Gly Tyr Gly Val Pro Gly Ser Gly Asp Lys Asp Gly Asp Gly Thr Ile Thr
Thr Lys Glu Leu Val Pro Gly Ser Gly Val Pro Gly Ser GlyVal Pro Gly Ser GlyVal
Pro Gly Ser Gly Asp Lys Asp Gly Asp Gly Thr Ile Thr Thr Lys Glu Leu Gly Ser Val
Pro Gly Tyr Gly Val Pro Gly Ser Gly Asp Lys Asp Gly Asp Gly Thr Ile Thr Thr Lys
Glu Leu Val Pro Gly Ser Gly Val Pro Gly Ser Gly Val Pro Gly Ser Gly Val Pro Arg
Ser Gly Asp Lys Asp Gly Asp Gly Thr Ile Thr Thr Lys Glu Leu Gly Ser Val Pro Gly
Ser Gly Val Pro Gly Ser Gly Glu Phe Ala Thr Met Val Ser Lys Gly Glu Glu Leu Phe
Thr Gly Val Val Pro Ile Leu Val Glu Leu Asp Gly Asp Val Asn Gly His Lys Phe Ser
Val Ser Gly Glu Gly Glu Gly Asp Ala Thr Tyr Gly Lys Leu Thr Leu Lys Phe Ile Cys
Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr Leu Thr Tyr Gly Val
Gln Cys Phe Ala Arg Tyr Pro Asp His Met Lys Gln His Asp Phe Phe Lys Ser Ala Met
Pro Glu Gly Tyr Val Gln Glu Arg Thr Ile Phe Phe Lys Asp Asp Gly Asn Tyr Lys Thr
Arg Ala Glu Val Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly Ile
Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr Asn Tyr Asn Ser His
Lys Val Tyr Ile Thr Ala Asp Lys Gln Lys Asn Gly Ile Lys Val Asn Phe Lys Thr Arg
His Asn Ile Glu Asp Gly Ser Val Gln Leu Ala Asp His Tyr Gln Gln Asn Thr Pro Ile
Gly Asp Gly Pro Val Leu Leu Pro Asp Asn His Tyr Leu Ser Thr Gln Ser Ala Leu Ser
Lys Asp Pro Asn Glu Lys Arg Asp His Met Val Leu Leu Glu Phe Val Thr Ala Ala Gly
Ile Thr Leu Gly Met Asp Glu Leu Tyr Lys
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм бактерий Escherichia Coli - продуцент рекомбинантного белка IL-29 | 2020 |
|
RU2760585C1 |
| Способ получения пептида, модулирующего активность пуринергических рецепторов | 2019 |
|
RU2714114C1 |
| Рекомбинантная плазмидная ДНК pET19b-Surv-OL, обеспечивающая синтез гибридного белка сурвивин-обелин (Surv-OL) и гибридный белок, связываемый анти-сурвивин антителами и обладающий биолюминесцентной активностью | 2021 |
|
RU2770490C1 |
| ШТАММ ESCHERICHIA COLI BL21(DE3)PLYSS/PET15B-HISCPF1 - ПРОДУЦЕНТ РНК-НАПРАВЛЯЕМОЙ ЭНДОНУКЛЕАЗЫ CRISPR/CPF1 | 2021 |
|
RU2774120C1 |
| Рекомбинантная плазмидная ДНК pERIG-PGS, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием антиангиогенного пептида пигастина - производного фрагмента [44-77] фактора роста пигментного эпителия человека, штамм Escherichia coli BL21(DE3)/pERIG-PGS - продуцент указанного белка, и способ получения рекомбинантного антиангиогенного пептида | 2017 |
|
RU2664199C1 |
| Последовательность ДНК-аптамера, связывающаяся с пептидогликан-ассоциированным липопротеином Legionella pneumophila | 2019 |
|
RU2737829C1 |
| Рекомбинантная плазмидная ДНК pET19b-SAV, обеспечивающая синтез полноразмерного белка стрептавидина Streptomyces avidinii, штамм бактерий Escherichia coli - продуцент растворимого полноразмерного белка стрептавидина Streptomyces avidinii | 2019 |
|
RU2728652C1 |
| КОМПОЗИЦИЯ ПО ПРЕДУПРЕЖДЕНИЮ ИНФЕКЦИИ Mycoplasma spp. | 2013 |
|
RU2646137C2 |
| ПЛАЗМИДНЫЙ ВЕКТОР pET-His8-TrxL-Acip1, ШТАММ БАКТЕРИИ Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1 ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АЦИПЕНСИНА-1 И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2015 |
|
RU2580031C2 |
| СПОСОБ ЭКСПРЕССИИ БЕЛКА CRM197 | 2019 |
|
RU2803949C1 |


Изобретение относится к области биотехнологии, в частности к способу получения Gd3+-связывающего белка. Комплекс белка с ионами Gd3+, в свою очередь, может быть использован для получения физиологически приемлемого Gd3+-содержащего агента, пригодного для контрастирования опухолей с помощью спектроскопии парамагнитного резонанса и для радиотерапии опухолей по принципу термоаблации. Техническим результатом данного изобретения является способ получения Gd3+-связывающего лиганда на основе искусственного рекомбинантного белка, обладающего способностью прочно удерживать ион металла в условиях, приближенных к физиологическим, обеспечивая его детоксикацию и адресную доставку в опухолевую ткань. 2 з.п. ф-лы, 7 ил., 2 пр.
1. Способ получения Gd3+-связывающего белка, включающий создание экспрессионной конструкции с нуклеотидной последовательностью SEQ ID NO 1, её введение в штамм E. coli BL21 (DE3), наращивание биомассы, ультразвуковую дезинтеграцию биомассы, осветление лизата низкоскоростным центрифугированием, предварительную очистку с помощью ионообменной хроматографии и диализа, удаление примесей путем добавления CaCl2 до 90-100 мМ, осаждение целевого белка добавлением нитрата гадолиния с последующим низкоскоростным центрифугированием, солюбилизация целевого продукта добавлением к осадку раствора ЭДТА с последующим центрифугированием с целью удаления нерастворимых примесей, обессоливание целевого продукта диализом.
2. Способ по п. 1, отличающийся тем, что осаждение целевого белка из обессоленного лизата проводят добавлением 2 мМ нитрата гадолиния.
3. Способ по п. 1, отличающийся тем, что солюбилизация целевого продукта после осаждения ионами Gd3+ с последующим центрифугированием проводится путём добавления к осадку раствора ЭДТА с концентрацией 10 мМ.
| ПОЗДНЯКОВА Н.В | |||
| и др., Мицеллярные композиции на основе функционализированных α-фетопротеином амфифильных блок-сополимеров, содержащих гадолиний и куркумин, Вестник Российского государственного медицинского университета, 2016, н.3, стр.30-37 | |||
| GIZZATOV A | |||
| et al., Surfactant-free Gd3+-ion-containing carbon nanotube MRI contrast agents for stem cell |
Авторы
Даты
2020-02-07—Публикация
2019-03-14—Подача