Группа изобретений относится к биотехнологии, генной и белковой инженерии. Сконструирована плазмида pET19b-Surv-OL, обеспечивающая в клетках Escherichia coli синтез рекомбинантного гибридного белка сурвивин-обелин, способного связываться с анти-сурвивин антителами и обладающего биолюминесцентной активностью Са2+-регулируемого фотопротеина обелина и может быть использована в медицине. Указанная плазмида содержит последовательность ДНК SEQ ID NO: 1 Изобретения относятся также к белку Surv-OL, выделенный из клеток Escherichia coli, трансформированных плазмидой pET19b-Surv-OL, с молекулярной массой 39,7 кДа; состоящий из сурвивина, коннекторного пептида - LEENLYFQGTA и апофотопротеина обелина Obelia longissima, имеющего аминокислотную последовательность, кодируемую нуклеотидной последовательностью SEQ ID NO: 1.
Сурвивин - низкомолекулярный (16,5 кДа) мультифункциональный белок, способный ингибировать апоптоз, регулировать деление клеток и способствовать ангиогенезу [Mita, A.C. Survivin: Key regulator of mitosis and apoptosis and novel target for cancer therapeutics / A.C., Mita, M.M., Mita, S.T., Nawrocki, F.J., Giles // Clin. Cancer Res. - 2008-Vol.14, No.16, - P. - 5000-5005]. Сурвивин практически отсутствует в нормальных тканях, но при этом сверхэкспрессируется практически во всех злокачественных опухолях, в настоящее время его рассматривают как важный диагностический онкомаркер, а также как белок имеющий определенный терапевтический потенциал [Ryan, B.M. Survivin: a new target for anti-cancer therapy / B.M., Ryan, N., O'Donovan, M.J., Duffy, // Cancer Treat. Rev. - 2009 - Vol. 35, No 7, - Р. - 553-562]. Поэтому высокочувствительное выявление этого белка в организме необходимо для диагностики онкологических заболеваний.
Са2+-регулируемый фотопротеин обелин Obelia longissima представляет собой стабильный фермент-субстратный комплекс, состоящий из апофотопротеина (одноцепочечного полипептида с молекулярной массой 22.2 кДа) и молекулы 2-гидропероксицелентеразина, прочно, но нековалентно иммобилизованной в гидрофобной полости белка. При присоединении ионов Са2+ происходит декарбоксилирование субстрата с образованием целентерамида в возбужденном состоянии. Переход этого соединения в основное состояние сопровождается излучением света в видимом диапазоне (λmax=482 нм).
Ген, кодирующий фотопротеин обелин был клонирован и далее получен и изучен рекомбинантный обелин дикого типа [Illarionov, B.A. Recombinant obelin: cloning and expression of cDNA, purification and characterization as a calcium indicator. / B.A., Illarionov, L.A., Frank V.A., Illarionova, V.S., Bondar, E.S., Vysotski, J.R., Blinks // Meth. Enzymol. - 2000 - Vol. 227, - P. - 223-249]. В литературе описаны бифункциональные гибридные белки на основе обелина, слитого с другими белками, например, стрептавидином [Bashmakova, E.E. Hybrid minimal core streptavidin-obelin as a versatile reporter for bioluminescence-based bioassay / E.E., Bashmakova, V.V., Krasitskaya, A.N., Kudryavtsev, V.G., Grigorenko, L.A., Frank // Photochem. Photobiol. - 2017 - Vol. 93, No 2, - Р. - 548-552], который используется как высокочувствительная биолюминесцентная метка для выявления биотинилированных соединений; фрагментом ZZ иммуноглобулин-связывающего домена белка А [Krasitskaya, V.V. The hybrid protein ZZ-OL as an analytical tool for biotechnology research. / V.V., Krasitskaya, E.E., Bashmakova, A.N., Kudryavtsev, M.A., Vorobjeva, E.A., Shatunova, L.A., Frank // J. Bioorg. Chem. -2020- Vol. 46, - Р. - 1004-1010] которые используются как высокочувствительная метка для выявления антител, оценки их аффинности; зеленым флуоресцентным белком (GFP) медузы Clytia [Eremeeva, E.V. Ca2+-regulated photoprotein obelin as N-terminal partner in the fusion proteins / E.V., Eremeeva, L.A., Frank, S.V., Markova, E.S. Vysotski // Journal of SFU. Biology. - 2010- Vol. 3, No 4, - Р. - 4372-4383], который использовали для научных исследований.
Наиболее близким аналогом - прототипом к заявляемой группе изобретений является рекомбинантная плазмидная ДНК pG1-Rm7, обеспечивающая синтез гибридного белка G1-Rm7 в клетках Escherichia coli, который связывает фактор некроза опухолей человека и обладает биолюминесцентной активностью люциферазы Renilla muelleri, где указанная плазмидная ДНК с физической картой, представленной на фиг. 1, имеет размер 6161 п.о., молекулярную массу 3.69 МДа, уникальные сайты рестрикции HindIII (235), SfiI (328), NcoI (332), AvaI (2939), PstI (986), NotI (1076), BamHI (1737), ClaI (2045) и включает нуклеотидную последовательность SEQ ID NO: 1, кодирующую гибридный белок с аминокислотной последовательностью SEQ ID NO: 2, состоящий из одноцепочечного антитела против фактора некроза опухолей, пептида GGSGGS и модифицированной люциферазы Renilla muelleri.
И гибридный белок G1-Rm7, связывающий фактор некроза опухолей человека и обладающий биолюминесцентной активностью, полученный из клеток Escherichia coli, трансформированных рекомбинантной плазмидной ДНК pG1-Rm7, имеющий молекулярную массу 65,4 кДа, состоящий из одноцепочечного антитела против фактора некроза опухолей, пептида GGSGGS и модифицированной люциферазы Renilla muelleri, имеющий аминокислотную последовательность SEQ ID NO: 2, представленную на фиг. 2 [п. 2513686, МПК C12N15/62, C12N15/13, опубл. 20.04.2014, бюл. №11].
Технический результатом группы изобретений является получение бифункционального гибридного белка, состоящего из рекомбинантного сурвивина, обладающего способностью связываться с соответствующими антителами к сурвивину и одновременно биолюминесцентной активностью, как потенциального высокочувствительного биолюминесцентного репортера для выявления онкомаркера сурвивина методом биолюминесцентного иммуноанализа конкурентного типа.
Указанный технический результат достигается тем, что рекомбинантная плазмидная ДНК pET19b-Surv-OL обеспечивающая синтез гибридного белка Surv-OL имеющая молекулярную массу 4 МДа и размер 6766 п.о. и содержащая в соответствии с физической и генетической картой плазмиды приведенной на Фиг. 1 сайты рестрикции NcoI, XhoI, BamHI, фрагмент ДНК NcoI-XhoI размером 427 п.о., представляющий собой последовательность, кодирующую сурвивин, фрагмент ДНК XhoI-BamHI размером 614 п.о., представляющий собой последовательность, кодирующую обелин и линкер, SEQ ID No.1; фрагмент amp - ген ампициллин- резистентности (ген β-лактамазы), определяющий резистентность к ампициллину при трансформации E. coli, плазмидная ДНК pET19b-Surv-OL имеет нуклеотидную последовательность SEQ ID NO.1 представленную на фиг. 2.
Указанный технический результат достигается также и тем, что гибридный белок сурвивин-обелин (Surv-OL), обладающий способностью связываться с антителами к сурвивину и одновременно биолюминесцентной активностью, полученный из клеток Escherichia coli BL21-Codon Plus(DE3), трансформированных плазмидной ДНК pET19b-Surv-OL, имеющий молекулярную массу 39,7 кДа, состоящий из сурвивина, коннекторного пептида - LEENLYFQGTA и фотопротеина обелина Obelia longissima, имеющий аминокислотную последовательность SEQ ID NO.2, представленную на фиг. 3.
Заявляемая группа изобретений соответствует требованию единства изобретения, поскольку образует единый изобретательский замысел, т.к. один из заявляемых объектов - рекомбинантная плазмидная ДНК pET19b-Surv-OL, предназначена для получения гибридного белка сурвивин-обелин (Surv-OL), полученного из клеток Escherichia coli BL21-Codon Plus(DE3), трансформированных плазмидной ДНК pET19b-Surv-OL, при этом оба объекта группы изобретений направлены на получение единого технического результата.
Сопоставительный анализ с прототипом позволил выявить совокупность существенных по отношению к техническому результату отличительных признаков для каждого из заявляемых объектов группы, изложенных в формулах. Следовательно, каждый из объектов группы изобретений соответствует критерию «новизна».
В доступных источниках информации не обнаружено сведений о рекомбинантных белках, состоящих из сурвивна, который распознается анти-сурвивин антителами и при этом обладающих Са2+-зависимой биолюминесцентной активностью.
Конструирование, получение и использование гибридных белков для иммуноанализа сурвивина конкурентного типа с применением фотопротеина обелина Obelia longissima или его аналогов в качестве репортеров в литературе также не описано, что позволяет сделать вывод о соответствии заявляемого решения критерию «изобретательский уровень».
Сущность группы изобретений заключается в следующем.
Генно-инженерными методами получают плазмидную ДНК pET19b- Surv-OL, несущую фрагмент ДНК, кодирующий сурвивин, коннекторный пептид LEENLYFQGTA и апофотопротеин обелин.
Гибридный белок сурвивин - обелин, состоящий из белка сурвивина, способного связываться с анти-сурвивин антителами и апофотопротеина обелина, обладающего биолюминесцентной активностью после активации субстратом - целентеразином получают синтезом в клетках Е. coli BL21-Codon Plus(DE3), трансформированных вышеуказанной плазмидой с последующим выделением из телец включения и хроматографической очистки.
Исходным генетическим материалом для конструирования рекомбинантной плазмиды pET19b- Surv-OL являются:
а) плазмидный вектор pET-19b (Novagen), обеспечивающий встраивание гена, кодирующего сурвивин;
б) ДНК плазмиды pMAL-c5X-Surv (Evrogen) - источник гена, кодирующего полноразмерный сурвивин.
в) ДНК плазмиды pET19b-OL8 [7], кодирующей фотопротеин обелин
Полученная в результате плазмидная ДНК pET19b-Surv-OL характеризуется следующими признаками:
имеет молекулярную массу 4,4 МДа и размер 6766 п.о.
кодирует гибридный белок сурвивин-обелин;
состоит из следующих элементов:
фрагмент ДНК NcoI-XhoI размером 427 п.о., представляющий собой последовательность, кодирующую сурвивин;
фрагмент ДНК XhoI-BamHI размером 614 п.о., представляющий собой последовательность, кодирующую обелин и коннекторный пептид;
содержащий генетический маркер: amp - ген ампициллин- резистентности (ген β-лактамазы), определяющий резистентность к ампициллину при трансформации E. coli.
Для получения продуцента полноразмерного стрептавидина компетентные клетки Е. coli BL21-Codon Plus(DE3) - RIPL (Novagen) трансформируют сконструированной плазмидой pET19b-Surv-OL
Штамм Е. coli BL21-Codon Plus(DE3)/pET19b-Surv-OL обеспечивает индуцируемый изопропилтиогалактозидом (ИПТГ) синтез белка полноразмерного стрептавидина. Индикацию экспрессии определяют с помощью гель-электрофореза в денатурирующих условиях (SDS-PAGE). Уровень экспрессии и степень очистки определяют с помощью денситометрии полиакриламидного геля, окрашенного Кумасси-R-250 с помощью системы гель-документации AlphaImager с соответствующим программным обеспечением (AlphaInnotech, США). Уровень экспрессии составляет 70 % от суммарного клеточного белка.
Весь целевой белок локализован в тельцах включения. Его препарат высокой степени очистки (98%) получают с помощью ионообменной хроматографии. Инкубированием в растворе с субстратом - целентеразином с последующей ионообменной хроматографией получают гибридный белок обладающий Са2+- зависимой биолюминесцентной активностью. Степень очистки определяют сканированием геля прибором AlphaImager (AlphaInnotech, США). Концентрацию белка определяют спектрофотометрически, с помощью набора DC Protein Assay (Bio-Rad, США) по протоколу производителя.
Биолюминесцентную активность определяли с помощью кюветного люминометра (модель БЛМ 8802, СКБ Наука, Красноярск) в буфере следующего состава: 50 мМ Трис-HCl рН 7.0, 5 мМ ЭДТА сразу после внесения CaCl2 (0.1 М растворав 50 мМ Трис-HCl рН 7.0). При проведении биолюминесцентного иммуноанализа измерения проводили с помощью планшетного люминометра Mithras LB 940 (Berthold, Германия). Биолюминесценцию инициировали внесением вышеуказанного раствора CaCl2.
Полученный гибридный белок обладает способностью специфично связываться с анти-сурвивин антителами, что было показано с помощью прямого твердофазного биолюминесцентного иммуноанализа.
Таким образом впервые получена плазмида pET19b-Surv-OL, содержащую в одной рамке считывания ген, кодирующий сурвивин, способного связываться с анти-сурвивин антителами, последовательность, кодирующую пептид LEENLYFQGTA и ген, кодирующий апофотопротеин обелин; получен гибридный белок - сурвивин-обелин (Surv - OL), который связывается с анти-сурвивин антителами и одновременно обладает биолюминесцентной активностью, который обеспечивает выявление онкомаркера сурвивина биолюминесцентным иммуноанализом конкурентного типа.
Изобретение иллюстрируется следующими чертежами.
Фиг. 1 Общая схема структурной организации плазмиды pET19b-Surv-OL. Обозначения: Surv - ген, кодирующий сурвивин; OL - ген, кодирующий обелин; T7lac - область промотора; amp - ген устойчивости к ампициллину; указаны некоторые сайты рестрикции.
Фиг. 2 Нуклеотидная последовательность кодирующая гибридный белок сурвивин-обелин SEQ ID NO.1
Фиг. 3. Аминокислотная последовательность гибридного белка сурвивин-обелин SEQ ID NO.2
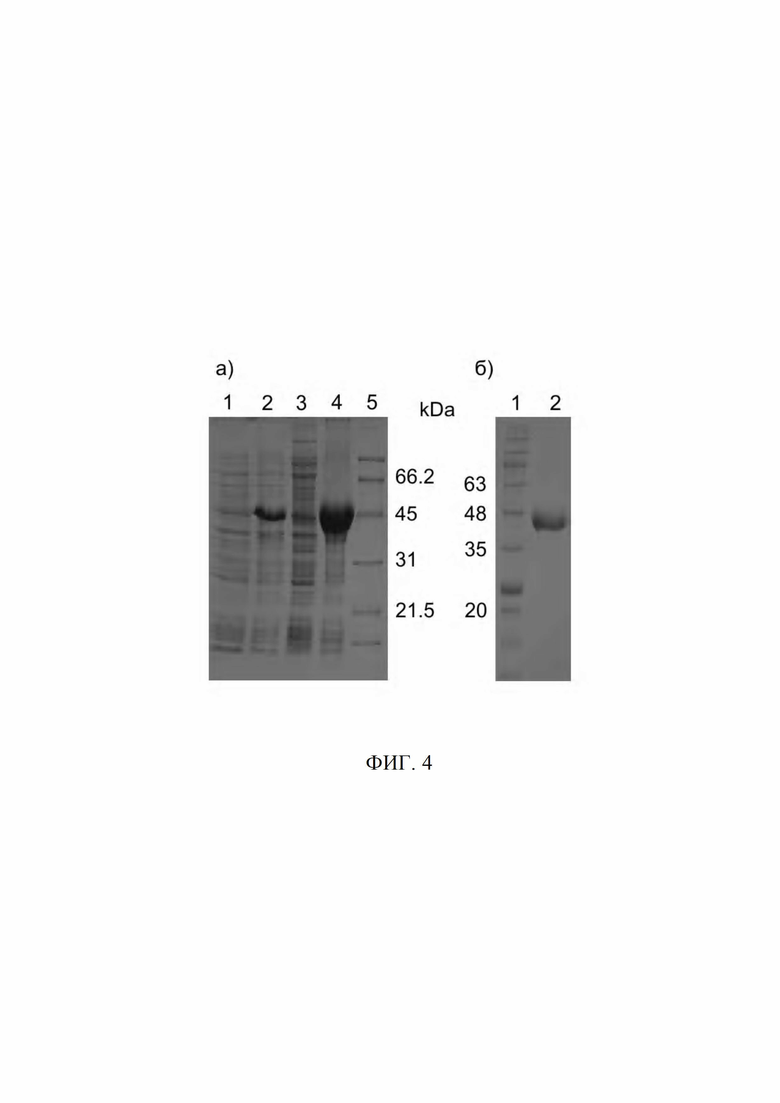
Фиг. 4 (а) Электрофоретический анализ фракций при получении гибридного белка сурвивин-апообелин в 12.5% SDS-PAGE, где дорожки: 1,2 - лизат рекомбинантных клеток до и после индукции ИПТГ; 3 - цитоплазматическая фракция; 4 - фракция телец включения (раствор в 6М мочевине); 5 - стандартные белки.
(б) Электрофоретический анализ полученного препарата гибридного белка сурвивин-обелин после хроматографической очистки: 1 - стандартные белки 2 - образец гибридного белка сурвивин-обелин. Молекулярная масса стандартов показана цифрами.
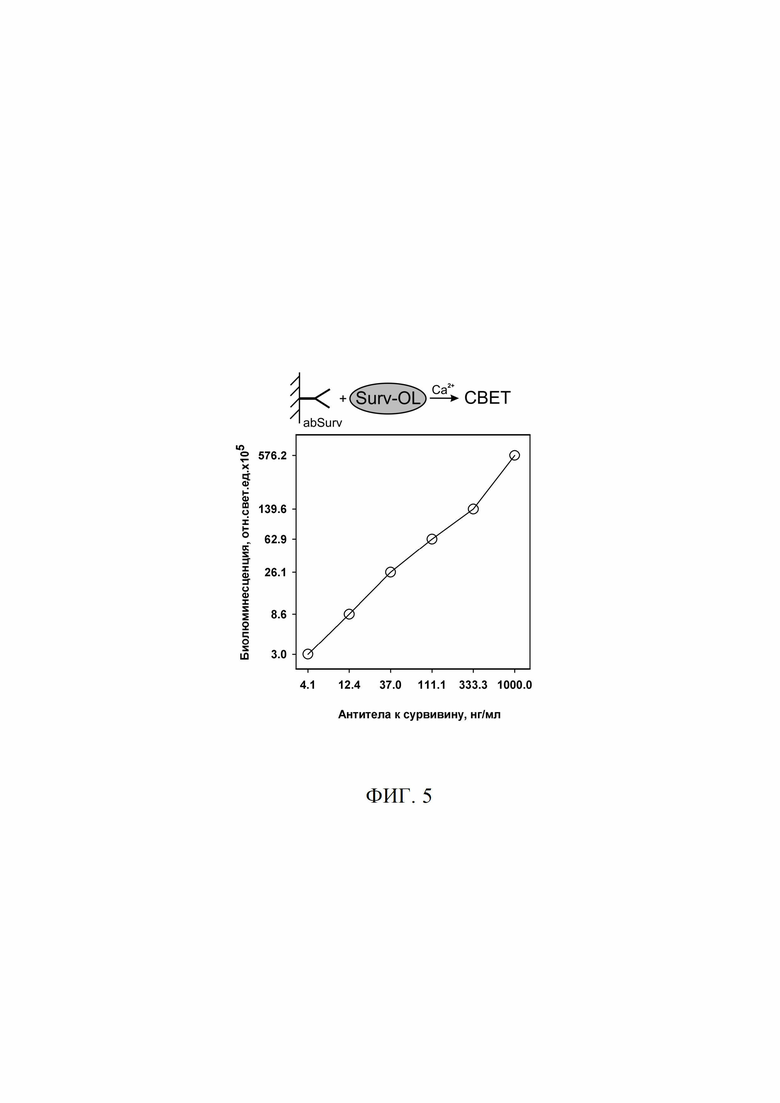
Фиг. 5 Анализ взаимодействия гибридного белка сурвивин-обелин с антителами к сурвивину, сорбированными на поверхности иммунологического микропланшета. Обозначения: Surv-OL - гибридный белок сурвивин-обелин, abSurv- коммерческий препарат антител к сурвивину (ab469, Abcam, Великобритания).
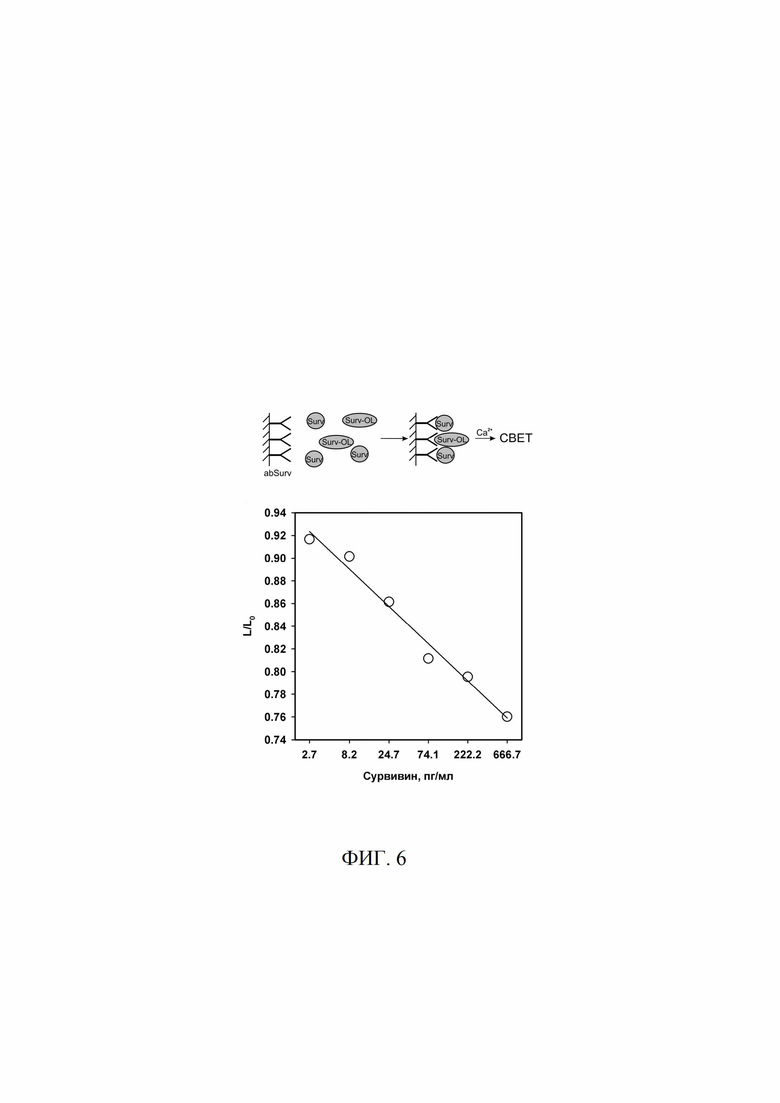
Фиг. 6 Биолюминесцентный твердофазный иммуноанализ сурвивина конкурентного типа. Surv - сурвивин; Surv-OL - гибридный белок сурвивин-обелин. L/L0 - отношение биолюминесцентного сигнала от данного образца к сигналу от образца, не содержащего сурвивин.
Для понимания сущности группы изобретений они иллюстрируются следующими примерами.
Пример 1. Конструирование плазмидной ДНК pET19b-S.
Последовательность гена, кодирующего сурвивин, оптимизированная для бактериальной экспрессии была синтезирована и клонирована в вектор pMALc5x (NEB, Великобритания) фирмой Евроген, Россия.
Фрагмент ДНК, кодирующий сурвивин (427 п.о.) с сайтами рестрикции на 5'- (NcoI) и 3'- (XhoI) концах, получают ПЦР с использованием Pfu-ДНК-полимеразы (SibEnzyme, Россия) и следующих праймеров:
Up 5'-GCACCATGGGTGCACCGACCCTTCCG-3'
Dn 5'-GCACTCGAGTTAGTCCATCGCTGCCAGCTGTTCAA-3'
Условия ПЦР: 95°С в течение 30 сек; 25 циклов (95°С - 30 с, 66°С - 30 с, 72°С - 1 мин); 72°С в течение 7 мин.
Последовательность ДНК, кодирующую обелин (OL) и линкер (614 п.о.) с сайтами рестрикции на 5'- (XhoI) и 3'- (BamHI) концах, синтезировали ПЦР, где в качестве матрицы использовали плазмиду pET19b-OL8 [Markova, S.V. Obelin from the bioluminescent marine hydroid Obelia geniculata: cloning, expression, and comparison of some properties with those of other Ca2+-regulated photoproteins / S.V. Markova, E.S. Vysotski, J.R. Blinks, L.P. Burakova, B.C. Wang, J. Lee // Biochemistry. - 2002. - V. 41, - P. 2227-2236.] и следующие праймеры
Up 5'- CAGCTCGAGGAAAACCTGTATTTTCAGGGTACCGCTTCAAAATACG-3'
Dn 5'- TTCGGATCCTTAGGGAACTCCGTTGCCAT-3').
Условия ПЦР: 95°С в течение 30 сек; 25 циклов (95°С - 30 с, 60°С - 30 с, 72°С - 1 мин); 72°С в течение 7 мин.
Продукты амплификации расщепляют ферментами рестрикции NcoI и XhoI и BamHI в реакционной смеси, содержащей 10mM Трис-HCl, pH 8.6, 10 mM MgCl2, 100 mM NaCl, 1 mM DTT, 0.1 мг/мл бычьего сывороточного альбумина (BSA) и по 20 ед. активности соответствующих ферментов. Реакцию проводят в течение 2 часов при 37°C, заключительная стадия - 20 минут при 65°C.
Обработку ДНК векторной плазмиды pET-19b (Novagen) проводят рестриктазами NcoI и BamHI в аналогичных условиях, после чего дефосфорилируют щелочной фосфатазой CIP (NEB, США) в течение 1 часа при 37°C.
Далее ПЦР-фрагменты и линеаризованный вектор очищают электрофоретически в 1% агарозном геле с последующим выделением ДНК набором QIAquick™ Gel Extraction Kit (Quiagen, США) в соответствии с рекомендациями производителя.
Лигирование проводят в стандартном буфере. Полученной лигазной смесью трансформируют клетки Escherichia coli XL1Blue. С помощью полимеразной цепной реакции отбирают клоны, содержащие вставку нужного размера. Полученную таким образом целевую плазмиду обозначают как pET19b-Surv-OL. Схема плазмидной ДНК pET19b- Surv-OL представлена на Фиг. 1.
Последовательность клонированных фрагментов подтверждена секвенированием Фиг. 2.
Пример 2 Получение штамма Е. coli BL21-Codon Plus(DE3)/pET19b-Surv-OL и экспрессия гибридного белка сурвивин-апообелин.
Клетки Е. coli BL21-Codon Plus(DE3) трансформируют плазмидой pET19b-Surv-OL, инкубируют в колбах при активном перемешивании в LB среде с добавлением 200 мМ ампициллина при температуре 37°C до оптической плотности ОД600= 0.6-0.8. и добавляют индуктор изопропил-β-D-тио-галактопиранозид (ИПТГ) до концентрации 1 мМ. Через 4 ч клетки осаждают центрифугированием. Осадок ресуспендируют в буфере 20 мМ Трис-HCl рН 7.0, 6 М мочевина и 5 мМ CaCl2 и хроматографируют на колонке DEAE-Sepharose FF (GE Healthcare), уравновешенной тем же буфером в градиенте концентрации NaOAc (0- 0.5 М ). Полученную после очистки фракцию белка разводили в 10 раз активационным буфером (20 мМ Трис-HCl рН 7.0, 5 мМ EDTA, 10 мМ дитиотреитол), добавляли 1.2 молярный избыток синтетического целентеразина (NanoLight Technologies, США), инкубировали в течение ночи при 8°C и очищали ионообменной хроматографией на колонке Mono Q HP в градиенте NaCl (0- 0.7 М) в 20 мМ Tris-HCl pH 7.0, 5 мМ ЭДТА.
Состав белков во фракциях при получении гибридного белка анализировали с помощью гель-электрофореза (Фиг. 4а). Чистоту финального препарата гибридного белка Surv-OL анализировали так же (Фиг. 4б).
Пример 3 Взаимодействие гибридного белка с антителами к сурвивину
В лунки планшета вносили по 100 мкл раствора антител к сурвивину (ab469, Abcam, Великобритания) в концентрациях 1000, 333.3, 111.1, 37, 12.4, 4.1 и 0 (контрольные лунки) нг/мл (в 0.1 М фосфатном буфере рН 7.0, 0.15 М NaCl, - PBS) и инкубировали 1 ч при 37°С. После промывки (трижды, PBS, 0.1% Tween20, 5 мМ ЭДТА) блокировали не занятые места на поверхности 1% раствором BSA в PBS (1 ч при 37°С). После промывки в лунки вносили по 60 мкл раствора гибридного белка Surv-OL (260 нг/мл) в 20 мМ Трис-HCl, pH 7.0, 0.15 М NaCl, 5мМ ЭДТА. Инкубировали планшет в течение часа со встряхиванием (350 об/мин) при 23°С, затем промывали. Биолюминесцентный сигнал связавшегося белка Surv-OL измеряли с помощью планшетного люминометра Mithras LB 940 (Berthold, Германия), сразу после впрыска 100 мкл раствора CaCl2 (0.1 М CaCl2, 0.1 М Трис-HCl, pH 8.8) в течение 5 с. Все эксперименты проводили в 2-х повторностях. Усредненный сигнал от контрольных лунок вычитали от усредненных сигналов рабочих лунок. Результат проведенного эксперимента показан на Фиг. 5.
Пример 4 Конкурентный анализ сурвивина в модельных растворах
В лунки планшета вносили по 100 мкл раствора антител к сурвивину (ab469, Abcam, Великобритания) в концентрации 1 мкг/мл (в PBS) и инкубировали при 4°C в течение ночи. После промывки (трижды, PBS, 0.1% Tween20, 5 мМ ЭДТА) вносили растворы, содержащие рекомбинантный сурвивин [5] в концентрациях от 666,7 пг/мл до 2,7 пг/мл и 0 пг/мл - контрольные лунки, а также гибридный белок Surv-OL в концентрации 390 пг/мл в 20 мМ Трис-HCl, pH 7.0, 0.15М NaCl, 5мМ ЭДТА, 0.1% BSA. Инкубировали планшет 40 мин со встряхиванием (600 об/мин) при 23°C, затем тщательно промывали. Биолюминесценцию сформированных на поверхности комплексов измеряли с помощью планшетного люминометра Mithras LB 940 (Berthold, Германия), сразу после впрыска 100 мкл раствора 0.1 М CaCl2, 0.1 М Трис-HCl, pH 8.8 в течение 5 с. Все эксперименты проводили в 2-х повторностях. Для построения зависимости сигнала от концентрации сурвивина по оси ординат откладывали отношение значения усредненного биолюминесцентного сигнала от рабочих лунок к усредненному сигналу от нулевых лунок. Обратную зависимость биолюминесцентного сигнала от содержания свободного сурвивина наблюдали в диапазоне концентраций последнего от 666,7 до 2,7 пг/мл. Результат проведенного эксперимента показан на Фиг. 6.
Таким образом впервые получена плазмидная ДНК pET19b-Surv-OL, содержащая ген гибридного белка сурвивин-обелин; обеспечивающая синтез в клетках бактерий E.coli белка сурвивин-апообелин; рекомбинантный гибридный белок-сурвивин-обелин (Surv-OL), обладающий способностью связываться с антителами к сурвивину и биолюминесцентной активностью, что делает возможным его применение в качестве репортера при выявлении онкомаркера сурвивина в твердофазном иммуноанализе конкурентного типа.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Mita, A.C. Survivin: Key regulator of mitosis and apoptosis and novel target for cancer therapeutics / A.C., Mita, M.M., Mita, S.T., Nawrocki, F.J., Giles // Clin. Cancer Res. - 2008-Vol.14, No.16, - P. - 5000-5005.
2. Ryan, B.M. Survivin: a new target for anti-cancer therapy / B.M., Ryan, N., O'Donovan, M.J., Duffy, // Cancer Treat. Rev. - 2009 - Vol. 35, No 7, - Р. - 553-562.
3. Illarionov, B.A. Recombinant obelin: cloning and expression of cDNA, purification and characterization as a calcium indicator. / B.A., Illarionov, L.A., Frank V.A., Illarionova, V.S., Bondar, E.S., Vysotski, J.R., Blinks // Meth. Enzymol. - 2000 -Vol. 227, - P.- 223-249.
4. Bashmakova, E.E. Hybrid minimal core streptavidin-obelin as a versatile reporter for bioluminescence-based bioassay / E.E., Bashmakova, V.V., Krasitskaya, A.N., Kudryavtsev, V.G., Grigorenko, L.A., Frank // Photochem. Photobiol. - 2017- Vol. 93, No 2, - Р. - 548-552.
5. Krasitskaya, V.V. The hybrid protein ZZ-OL as an analytical tool for biotechnology research. / V.V., Krasitskaya, E.E., Bashmakova, A.N., Kudryavtsev, M.A., Vorobjeva, E.A., Shatunova, L.A., Frank // J. Bioorg. Chem. -2020- Vol. 46, - Р. - 1004-1010.
6. Eremeeva, E.V. Ca2+-regulated photoprotein obelin as N-terminal partner in the fusion proteins / E.V., Eremeeva, L.A., Frank, S.V., Markova, E.S. Vysotski // Journal of SFU. Biology. - 2010 - Vol. 3, No 4, - Р. - 4372-4383.
7. Markova, S. V. Obelin from the bioluminescent marine hydroid Obelia geniculata: cloning, expression, and comparison of some properties with those of other Ca2+-regulated photoproteins / S.V. Markova, E.S. Vysotski, J.R. Blinks, L. P. Burakova, B.C. Wang, J. Lee // Biochemistry. - 2002. - V. 41, - P. 2227-2236.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Федеральное государственное бюджетное научное учреждение
«Федеральный исследовательский центр «Красноярский научный
центр Сибирского отделения Российской академии наук»
<120> Рекомбинантная плазмидная ДНК pET19b-Surv-OL, обеспечивающая
синтез гибридного белка сурвивин-обелин, штамм бактерий Escherichia
coli - продуцент гибридного белка сурвивин-обелин
<160> Номер SEQ ID NO 1
<210> 1
<211> 1041
<212> DNA
<213> Obelia longissima, Homo sapiens
<400> 1
atg ggt gca ccg acc ctt ccg cca gcg tgg caa ccg ttt ctg aaa 45
Met Gly Ala Pro Thr Leu Pro Pro Ala Trp Gln Pro Phe Leu Lys
1 5 10 15
gat cat cgc atc agc acc ttc aag aac tgg ccg ttt ctg gaa ggt 90
Asp His Arg Ile Ser Thr Phe Lys Asn Trp Pro Phe Leu Glu Gly
20 25 30
tgt gcg tgc act cca gaa cgc atg gct gaa gca ggc ttc att cac 135
Cys Ala Cys Thr Pro Glu Arg Met Ala Glu Ala Gly Phe Ile His
35 40 45
tgt ccg acc gaa aac gaa cca gat ctt gcg cag tgt ttc ttc tgc 180
Cys Pro Thr Glu Asn Glu Pro Asp Leu Ala Gln Cys Phe Phe Cys
50 55 60
ttc aaa gaa ctg gaa ggc tgg gaa ccg gac gat gat ccg att gag 225
Phe Lys Glu Leu Glu Gly Trp Glu Pro Asp Asp Asp Pro Ile Glu
65 70 75
gaa cac aag aaa cac agc tct ggc tgt gcg ttt ctg agc gtg aag 270
Glu His Lys Lys His Ser Ser Gly Cys Ala Phe Leu Ser Val Lys
80 85 90
aaa cag ttt gag gaa ctg acc ctt ggt gag ttt ctg aaa ctc gat 315
Lys Gln Phe Glu Glu Leu Thr Leu Gly Glu Phe Leu Lys Leu Asp
95 100 105
cgt gaa cgt gcg aag aac aag att gcg aaa gag acg aac aac aag 360
Arg Glu Arg Ala Lys Asn Lys Ile Ala Lys Glu Thr Asn Asn Lys
110 115 120
aag aaa gag ttc gaa gag act gcg aag aaa gtt cgt cgt gcg att 405
Lys Lys Glu Phe Glu Glu Thr Ala Lys Lys Val Arg Arg Ala Ile
125 130 135
gaa cag ctg gca ccg atg gaa ctc gag gaa aac ctg tat ttt cag 450
Glu Gln Leu Ala Pro Met Glu Leu Glu Glu Asn Leu Tyr Phe Gln
140 145 150
ggt acc gct tca aaa tac gca gtt aaa ctc aag act gac ttt gat 495
Gly Thr Ala Ser Lys Tyr Ala Val Lys Leu Lys Thr Asp Phe Asp
155 160 165
aat cca cga tgg atc aaa aga cac aag cac atg ttt gat ttc ctc 540
Asn Pro Arg Trp Ile Lys Arg His Lys His Met Phe Asp Phe Leu
170 175 180
gac atc aat gga aat gga aaa atc acc ctc gat gaa att gtg tcc 585
Asp Ile Asn Gly Asn Gly Lys Ile Thr Leu Asp Glu Ile Val Ser
185 190 195
aag gca tct gat gac ata tgt gcc aag cta gaa gcc aca cca gaa 630
Lys Ala Ser Asp Asp Ile Cys Ala Lys Leu Glu Ala Thr Pro Glu
200 205 210
caa aca aaa cgc cat caa gtt tgt gtt gaa gct ttc ttt aga gga 675
Gln Thr Lys Arg His Gln Val Cys Val Glu Ala Phe Phe Arg Gly
215 220 225
tgt gga atg gaa tat ggt aaa gaa att gcc ttc cca caa ttc ctc 720
Cys Gly Met Glu Tyr Gly Lys Glu Ile Ala Phe Pro Gln Phe Leu
230 235 240
gat gga tgg aaa caa tta gcg act tca gaa ctc aag aaa tgg gca 765
Asp Gly Trp Lys Gln Leu Ala Thr Ser Glu Leu Lys Lys Trp Ala
245 250 255
aga aac gaa cct act ctc att cgt gaa tgg gga gat gct gtc ttt 810
Arg Asn Glu Pro Thr Leu Ile Arg Glu Trp Gly Asp Ala Val Phe
260 265 270
gat att ttc gac aaa gat gga agt ggt aca atc act ttg gac gaa 855
Asp Ile Phe Asp Lys Asp Gly Ser Gly Thr Ile Thr Leu Asp Glu
275 280 285
tgg aaa gct tat gga aaa atc tct ggt atc tct cca tca caa gaa 900
Trp Lys Ala Tyr Gly Lys Ile Ser Gly Ile Ser Pro Ser Gln Glu
290 295 300
gat tgt gaa gcg aca ttt cga cat tgc gat ttg gac aac agt ggt 945
Asp Cys Glu Ala Thr Phe Arg His Cys Asp Leu Asp Asn Ser Gly
305 310 315
gac ctt gat gtt gac gag atg aca aga caa cat ctt gga ttc tgg 990
Asp Leu Asp Val Asp Glu Met Thr Arg Gln His Leu Gly Phe Trp
320 325 330
tac act ttg gac cca gaa gct gat ggt ctc tat ggc aac gga gtt 1035
Tyr Thr Leu Asp Pro Glu Ala Asp Gly Leu Tyr Gly Asn Gly Val
335 340 345
ccc taa 1041
Pro Och*
<110> Федеральное государственное бюджетное научное учреждение
«Федеральный исследовательский центр «Красноярский научный
центр Сибирского отделения Российской академии наук»
<120> Рекомбинантная плазмидная ДНК pET19b-Surv-OL, обеспечивающая
синтез гибридного белка сурвивин-обелин, штамм бактерий Escherichia
coli - продуцент гибридного белка сурвивин-обелин, гибридный
белок - сурвивин-обелин, связывающийся с антителами к сурвивину и
обладающий биолюминесцентной активностью
<160> Номер SEQ ID NO 2
<210> 2
<211> 456
<212> PRT
<213> Obelia longissima, Homo sapiens
<400> 2
Met Gly Ala Pro Thr Leu Pro Pro Ala Trp Gln Pro Phe Leu Lys
1 5 10 15
Asp His Arg Ile Ser Thr Phe Lys Asn Trp Pro Phe Leu Glu Gly
20 25 30
Cys Ala Cys Thr Pro Glu Arg Met Ala Glu Ala Gly Phe Ile His
35 40 45
Cys Pro Thr Glu Asn Glu Pro Asp Leu Ala Gln Cys Phe Phe Cys
50 55 60
Phe Lys Glu Leu Glu Gly Trp Glu Pro Asp Asp Asp Pro Ile Glu
65 70 75
Glu His Lys Lys His Ser Ser Gly Cys Ala Phe Leu Ser Val Lys
80 85 90
Lys Gln Phe Glu Glu Leu Thr Leu Gly Glu Phe Leu Lys Leu Asp
95 100 105
Arg Glu Arg Ala Lys Asn Lys Ile Ala Lys Glu Thr Asn Asn Lys
110 115 120
Lys Lys Glu Phe Glu Glu Thr Ala Lys Lys Val Arg Arg Ala Ile
125 130 135
Glu Gln Leu Ala Pro Met Glu Leu Glu Glu Asn Leu Tyr Phe Gln
140 145 150
Gly Thr Ala Ser Lys Tyr Ala Val Lys Leu Lys Thr Asp Phe Asp
155 160 165
Asn Pro Arg Trp Ile Lys Arg His Lys His Met Phe Asp Phe Leu
170 175 180
Asp Ile Asn Gly Asn Gly Lys Ile Thr Leu Asp Glu Ile Val Ser
185 190 195
Lys Ala Ser Asp Asp Ile Cys Ala Lys Leu Glu Ala Thr Pro Glu
200 205 210
Gln Thr Lys Arg His Gln Val Cys Val Glu Ala Phe Phe Arg Gly
215 220 225
Cys Gly Met Glu Tyr Gly Lys Glu Ile Ala Phe Pro Gln Phe Leu
230 235 240
Asp Gly Trp Lys Gln Leu Ala Thr Ser Glu Leu Lys Lys Trp Ala
245 250 255
Arg Asn Glu Pro Thr Leu Ile Arg Glu Trp Gly Asp Ala Val Phe
260 265 270
Asp Ile Phe Asp Lys Asp Gly Ser Gly Thr Ile Thr Leu Asp Glu
275 280 285
Trp Lys Ala Tyr Gly Lys Ile Ser Gly Ile Ser Pro Ser Gln Glu
290 295 300
Asp Cys Glu Ala Thr Phe Arg His Cys Asp Leu Asp Asn Ser Gly
305 310 315
Asp Leu Asp Val Asp Glu Met Thr Arg Gln His Leu Gly Phe Trp
320 325 330
Tyr Thr Leu Asp Pro Glu Ala Asp Gly Leu Tyr Gly Asn Gly Val
335 340 345
ccc taa
Pro Och*
346
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантная плазмидная ДНК pET19b-SAV, обеспечивающая синтез полноразмерного белка стрептавидина Streptomyces avidinii, штамм бактерий Escherichia coli - продуцент растворимого полноразмерного белка стрептавидина Streptomyces avidinii | 2019 |
|
RU2728652C1 |
| Рекомбинантный слитый белок | 2019 |
|
RU2732795C1 |
| Антитело моноклональное мышиное 1Е10 и антитело рекомбинантное химерное (мышь-человек) xi1E10, нейтрализующие летальный токсин Bacillus anthracis, и штамм гибридных культивируемых клеток животных Mus musculus 1E10 | 2020 |
|
RU2745116C1 |
| Генетическая конструкция, кодирующая предшественник белка YB-1 человека, штамм Escherichia coli - продуцент предшественника белка YB-1 человека, способ микробиологического синтеза этого предшественника | 2019 |
|
RU2728237C1 |
| Антитела против белка р17 ВИЧ-1 субтипа А | 2019 |
|
RU2727673C1 |
| МУКОАДГЕЗИВНЫЙ МИКРООРГАНИЗМ | 2017 |
|
RU2762940C2 |
| УНИВЕРСАЛЬНЫЙ АНТИТЕЛООПОСРЕДОВАННЫЙ БИОСЕНСОР | 2016 |
|
RU2746486C2 |
| Искусственные гены, кодирующие белки-иммуногены EV.CTL и EV.Th, рекомбинантные плазмидные ДНК pEV.CTL и pEV.Th, обеспечивающие экспрессию искусственных генов, и искусственные Т-клеточные полиэпитопные белки-иммуногены EV.CTL и EV.Th, содержащие эпитопы антигенов вируса Эбола, используемые для создания вакцины против вируса Эбола | 2018 |
|
RU2713723C1 |
| Способ микробиологического синтеза прохимозина быка с использованием рекомбинантного штамма Pichia pastoris, содержащего синтетический ген варианта препрохимозина с модифицированной сигнальной последовательностью секреции | 2020 |
|
RU2779307C2 |
| СПОСОБ УВЕЛИЧЕНИЯ ФОТОСИНТЕТИЧЕСКОЙ ФИКСАЦИИ УГЛЕРОДА С ИСПОЛЬЗОВАНИЕМ БЕЛКА СЛИЯНИЯ ИЗ МНОГИХ СУБЪЕДИНИЦ ГЛИКОЛАТДЕГИДРОГЕНАЗЫ | 2011 |
|
RU2651501C2 |





Группа изобретений относится к биотехнологии, генной и белковой инженерии. Сконструирована плазмида pET19b-Surv-OL, обеспечивающая в клетках Escherichia coli синтез рекомбинантного гибридного белка сурвивин-обелин, способного связываться с анти-сурвивин антителами и обладающего биолюминесцентной активностью Са2+-регулируемого фотопротеина обелина, и может быть использована в медицине. Указанная плазмида содержит последовательность ДНК SEQ ID NO: 1. Изобретение относится также к белку Surv-OL, выделенному из клеток Escherichia coli, трансформированных плазмидой pET19b-Surv-OL, с молекулярной массой 39,7 кДа; состоящему из сурвивина, коннекторного пептида - LEENLYFQGTA и апофотопротеина обелина Obelia longissima, имеющего аминокислотную последовательность, кодируемую нуклеотидной последовательностью SEQ ID NO: 1. Изобретение позволяет обеспечить получение бифункционального гибридного белка, состоящего из рекомбинантного сурвивина, обладающего способностью связываться с соответствующими антителами к сурвивину и одновременно биолюминесцентной активностью, как потенциального высокочувствительного биолюминесцентного репортера для выявления онкомаркера сурвивина методом биолюминесцентного иммуноанализа конкурентного типа. 2 н.п. ф-лы, 6 ил., 4 пр.
1. Рекомбинантная плазмидная ДНК pET19b-Surv-OL, обеспечивающая синтез гибридного белка Surv-OL, имеющая молекулярную массу 4 МДа и размер 6766 п.о. и содержащая в соответствии с физической и генетической картой плазмиды, приведенной на Фиг.1, сайты рестрикции NcoI, XhoI, BamHI, фрагмент ДНК NcoI-XhoI размером 427 п.о., представляющий собой последовательность, кодирующую сурвивин, фрагмент ДНК XhoI-BamHI размером 614 п.о., представляющий собой последовательность, кодирующую обелин и линкер, SEQ ID NО: 1; фрагмент amp – ген ампициллин-резистентности (ген β-лактамазы), определяющий резистентность к ампициллину при трансформации E. coli, плазмидная ДНК pET19b-Surv-OL имеет нуклеотидную последовательность SEQ ID NO: 1, представленную на фиг.2.
2. Гибридный белок сурвивин-обелин (Surv-OL), обладающий способностью связываться с антителами к сурвивину и одновременно биолюминесцентной активностью, полученный из клеток Escherichia coli BL21-Codon Plus(DE3), трансформированных плазмидной ДНК pET19b-Surv-OL, имеющий молекулярную массу 39,7 кДа, состоящий из сурвивина, коннекторного пептида — LEENLYFQGTA и фотопротеина обелина Obelia longissima, имеющий аминокислотную последовательность SEQ ID NO: 2, представленную на фиг. 3.
| ДНК-ВАКЦИНЫ ПРОТИВ ОПУХОЛЕВОГО РОСТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2343195C2 |
| ФОТОБЕЛОК С ПОВЫШЕННОЙ БИОЛЮМИНЕСЦЕНЦИЕЙ | 2003 |
|
RU2340629C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pG1-Rm7, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА G1-Rm7, И ГИБРИДНЫЙ БЕЛОК, СВЯЗЫВАЮЩИЙ ФАКТОР НЕКРОЗА ОПУХОЛЕЙ И ОБЛАДАЮЩИЙ БИОЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2513686C2 |
| Illarionov, B.A | |||
| et al | |||
| Recombinant obelin: cloning and expression of cDNA, purification and characterization as a calcium indicator | |||
| Meth | |||
| Enzymol | |||
| Vol | |||
| Ротационный колун | 1919 |
|
SU227A1 |
| Способ исправления пайкой сломанных алюминиевых предметов | 1921 |
|
SU223A1 |
Авторы
Даты
2022-04-18—Публикация
2021-07-14—Подача