1. ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает преимущество приоритета предварительной заявки США № 62/912986, поданной 9 октября 2019 года, раскрытие которой включено в данный документ посредством ссылки во всей своей полноте.
2. ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
В данном документе предусмотрены новые соединения на основе 2-азаспиро[3.4]октана, которые действуют в качестве агонистов рецептора M4, а также фармацевтические композиции на их основе, пути применения для лечения состояний, заболеваний и нарушений, связанных с рецептором M4, которые включают без ограничения психоз, гиперкинетические двигательные расстройства, когнитивную дисфункцию и расстройства, связанные с употреблением психоактивных веществ.
3. УРОВЕНЬ ТЕХНИКИ
Ацетилхолин, основной нейромедиатор в центральной и периферической нервной системе, передает сигнал путем активирования его ионотропных (никотиновых) и связанных с G-белком (мускариновых) рецепторов. Были идентифицированы пять мускариновых рецепторов (M1-M5) с отличиями в экспрессии и передаче сигнала. M1, M3 и M5 рецепторы связаны с Gq белками, которые активируют фосфолипазу C. Фосфолипаза C гидролизирует фосфоинозитиды мембраны до инозитолтрифосфата (IP3) и диацилглицерина (DAG), которые повышают содержание внутриклеточного кальция и активируют ряд путей передачи сигнала. Рецепторы M2 и M4 связаны с Gi/o белками, которые подавляют продуцирование аденилатциклазы и понижают уровни циклического аденозинмонофосфата (cAMP), оказывая подавляющий эффект на функцию клеток. Рецепторы M1 преимущественно экспрессируются в переднем мозге (коре головного мозга, гиппокампе, полосатом теле и таламусе) и слюнных железах (Brain Res Mol Brain Res 2005, 133(1):6-11; Br. J. Pharmacol 2006, 148, 565-578; Pharmacol Ther 2008, 117: 232-243). Рецепторы M2 экспрессируются в головном мозге, а также экспрессируются на высоком уровне в сердце, где они опосредуют иннервацию блуждающего нерва и могут влиять на частоту сердечных сокращений (Br. J. Pharmacol 2006, 148, 565-578; Pharmacol Ther 2008, 117: 232-243). Рецепторы M3 главным образом экспрессируются в гладких мышцах периферических тканей, в том числе желудочно-кишечного тракта, мочевого пузыря, глаза и потовых и слюнных желез (Br. J. Pharmacol 2006, 148, 565-578). Рецепторы M4 в увеличенном количестве присутствуют в головном мозге и в основном экспрессируются в полосатом теле, области головного мозга, вовлеченной в высвобождение дофамина и передачу сигнала с помощью дофамина (J Neurosci 1994 14(5):3351-3363; Proc Natl Acad Sci USA 1999, 96(18): 10483-10488; Pharmacol Ther 2008, 117: 232-243). Рецепторы M5 экспрессируются в сосудистой системе, в том числе в церебральных кровеносных сосудах (Proc Natl Acad Sci USA 2001, 98(24):14096-14101).
Было показано, что в центральной нервной системе мускариновые рецепторы играют центральную роль в когнитивной функции и регуляции дофаминергической передаче сигнала (Neuron 2017, 94(3): 431-446). Особый интерес представляют рецепторы M4, которые экспрессируются на высоком уровне в полосатом теле. Генетическая делеция рецепторов M4 вызывает гипер-дофаминергический фенотип у грызунов. Было показано, что мыши с нокаутом M4 характеризуются повышенными уровнями дофамина в полосатом теле и повышенной локомоторной активностью (Proc Natl Acad Sci USA 1999, 96(18): 10483-10488.; FASEB J 2004, 18(12):1410-1412). В соответствии с такими наблюдениями фармакологическая активация рецепторов M4 снижает высвобождение дофаминa, индуцированное амфетамином, и способствует обращению амфетаминовой гиперлокомоции у мышей (Neuropsychopharm 2004, 39: 1578-1593). Таким образом, такие результаты указывают на то, что рецепторы M4 могут действовать в качестве отрицательного регулятора высвобождения дофамина и передачи сигнала с помощью дофамина в полосатом теле.
Повышенный уровень дофамина в полосатом теле тесно связан с психотическими симптомами при шизофрении и других нарушениях, в том числе психотической депрессии, биполярном расстройстве, болезни Хантингтона и болезни Альцгеймера (Lancet 1988, 2:119-125; Schizophr Bull 2009, 35:549-562). Современные антипсихотические лекарственные средства действуют прежде всего путем блокирования воздействия дофамина на рецепторы D2. Однако, они характеризуются ограниченной эффективностью и опасными побочными эффектами, в том числе паркинсонизмом, индуцированным лекарственным средством, поздней дискинезией, пролонгацией Q-Tc, увеличением веса и метаболическим синдромом, которые приводят к недостаточному соблюдению пациентами инструкций по приему препарата (N Engl J Med 2005, 353:1209-23).
Было показано, что активация мускариновых рецепторов M4 подавляет передачу сигнала с помощью дофамина в полосатом теле и тем самым может обеспечить альтернативный способ лечения психоза. В подтверждение этой идеи агонист мускариновых рецепторов ксаномелин продемонстрировал устойчивую антипсихотическую эффективность при тестировании в двух клинических испытаниях в отношении пациентов, страдающих болезнью Альцгеймера (Arch Neurol 1997, 54(4):465-473) и шизофренией (Am J Psychiatry 2008, 165(8):1033-1039). Однако, лечение с его помощью было связано с рядом побочных эффектов, в том числе тошнотой, рвотой, избыточным выделением слюны, диспепсией и лихорадкой, которые остановили его клинические исследования. Ксаномелин представляет собой общий агонист мускариновых рецепторов, который активирует все подтипы мускариновых рецепторов. Исследования указывают на то, что антипсихотическая эффективность ксаномелина прежде всего опосредована активацией рецепторов M4. Рецепторы M4 экспрессируются на высоком уровне в полосатом теле у человека (Schizophr Res 2015, 169: 83-88.), и антипсихотически-подобные эффекты ксаномелина на дофамин-опосредованные варианты поведения ограничены у мышей с нокаутом M4 (Eur J Pharmacol 2009, 603: 147-149; J Neurosci 2011, 31(16):5905-5908.). Напротив, побочные эффекты ксаномелина наиболее вероятно обусловлены активацией рецепторов M2 и M3, которые экспрессируются в сердце, пищеварительном тракте и слюнных железах (CNS Drug Rev 2003, 9:159-186; Br. J. Pharmacol 2006, 148, 565-578). Таким образом, селективные агонисты M4 вероятно сохраняют антипсихотическую эффективность ксаномелина, не оказывая холинергические побочные эффекты.
Следовательно, соединения, которые действуют в качестве агонистов рецепторов M4, могут быть пригодными для лечения состояний, связанных с M4.
4. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (I),
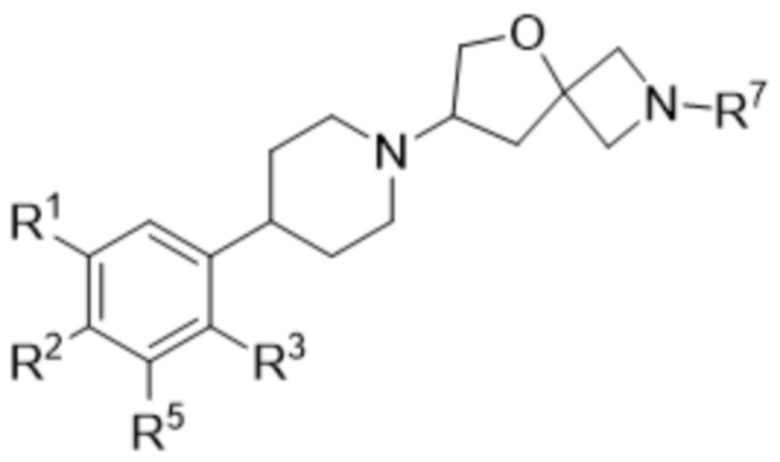
(I),
или его фармацевтически приемлемая соль, где
R1 представляет собой галоген или водород;
R2 представляет собой галоген или водород;
R3 представляет собой
необязательно замещенный C1-3алкил, при этом указанный алкил необязательно замещен одним 4-6-членным гетероциклоалкилом,
необязательно замещенный 5-6-членный гетероарил, при этом указанный гетероарил необязательно замещен одним C1-3алкилом, 4-6-членным гетероциклоалкилом или
-OR4;
R4 представляет собой
необязательно замещенный C1-5алкил, при этом указанный алкил необязательно замещен одним или двумя R6,
необязательно замещенный 3-9-членный гетероциклоалкил, при этом указанный гетероциклоалкил необязательно замещен одним или двумя R6, или
необязательно замещенный 4-6-членный циклоалкил, при этом указанный циклоалкил необязательно замещен одним, двумя или тремя R6;
R5 представляет собой галоген или водород;
каждый R6 независимо представляет собой
галоген,
-OH,
-OCH3,
-C(CH3)2OH,
-CH2OH,
циано,
необязательно замещенный C1-C4алкил, при этом указанный алкил необязательно замещен -OH,
необязательно замещенный 4-7-членный гетероциклоалкил, при этом указанный гетероциклоалкил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -OCH3 и C1-3алкила, или
необязательно замещенный 5-6-членный гетероарил, при этом указанный гетероарил необязательно замещен одним C1-3алкилом; и
R7 представляет собой 5-членный гетероарил.
В одном варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (Ia),
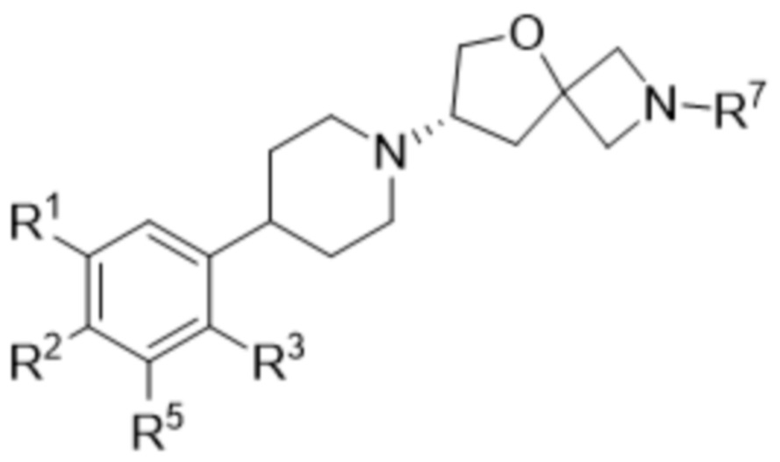
(Ia),
или его фармацевтически приемлемая соль или стереоизомер.
В одном варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (Ib)
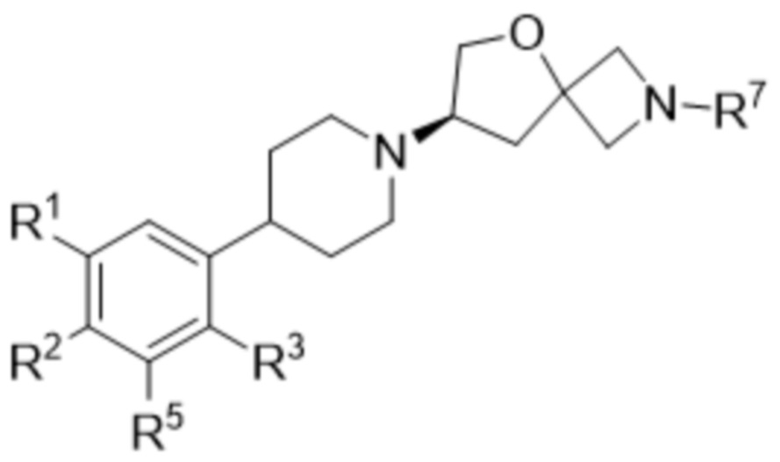
(Ib),
или его фармацевтически приемлемая соль или стереоизомер.
В одном варианте осуществления R1 выбран из группы, состоящей из H, хлора и фтора. В другом варианте осуществления R1 представляет собой фтор.
В одном варианте осуществления R2 представляет собой H или фтор.
В одном варианте осуществления R5 представляет собой H или фтор.
В одном варианте осуществления R1, R2 и R5 представляют собой H.
В одном варианте осуществления R2 и R5 представляют собой H.
В одном варианте осуществления R3 выбран из группы, состоящей из:  ,
, 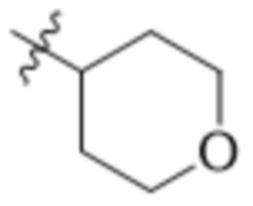 ,
, 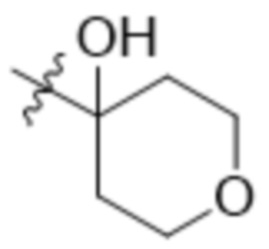 ,
, 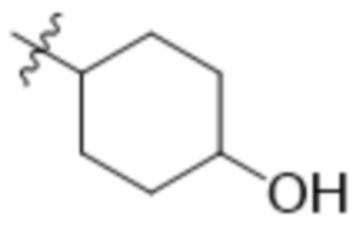 ,
, 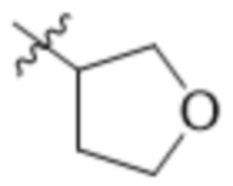 ,
,  ,
,  и
и 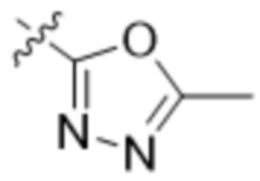 . В некоторых вариантах осуществления R3 представляет собой -OR4.
. В некоторых вариантах осуществления R3 представляет собой -OR4.
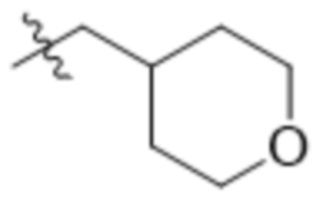
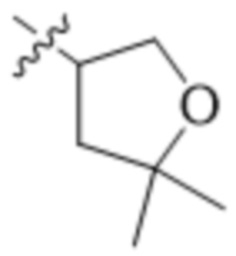
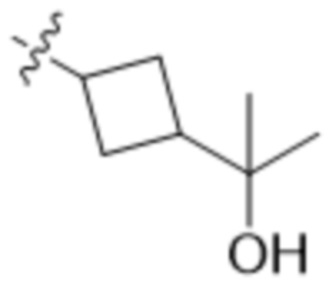
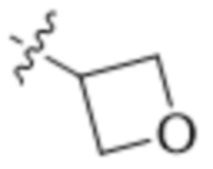
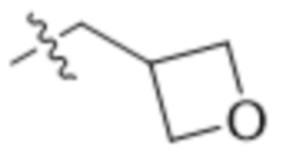
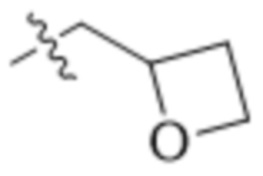
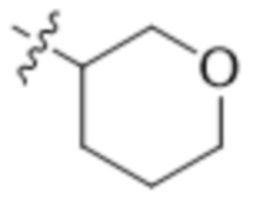
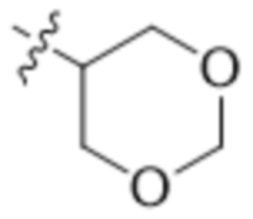
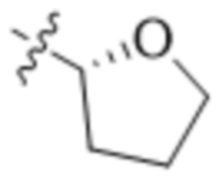
В одном варианте осуществления R4 выбран из группы, состоящей из CH3, -CH2CH2C(CH3)2OH, -CH2CH2C(CH3)2OCH3, -CH2CH2OCH3 и -CH2C(CH3)2OH. В некоторых вариантах осуществления R4 выбран из группы, состоящей из:
 ,
, 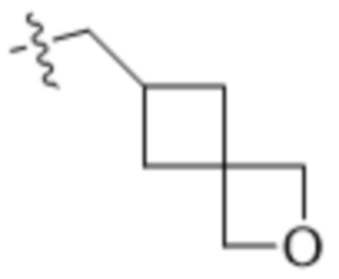 ,
, 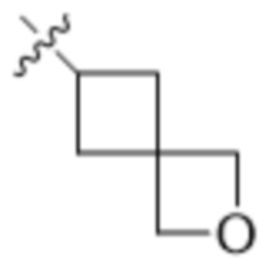 ,
, 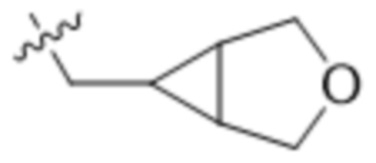 ,
, 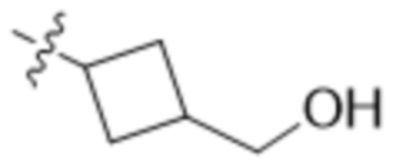 ,
,  ,
,  ,
,  ,
,  ,
, 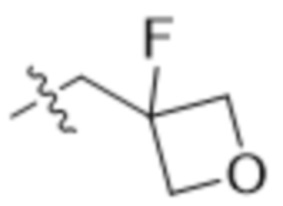 ,
, 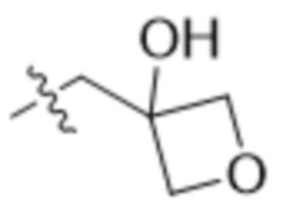 ,
, 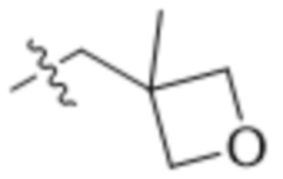 ,
, 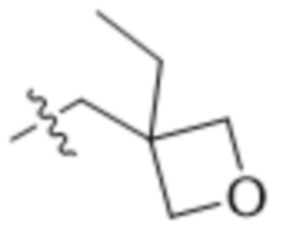 ,
, 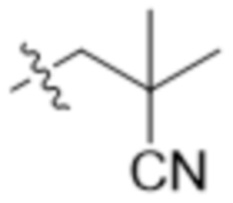 ,
, 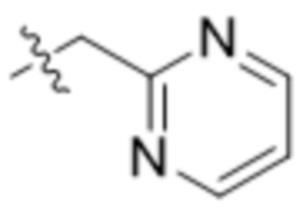 ,
, 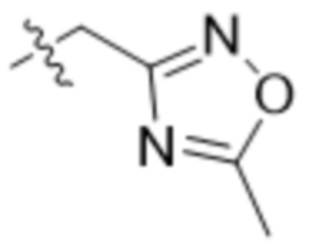 ,
, 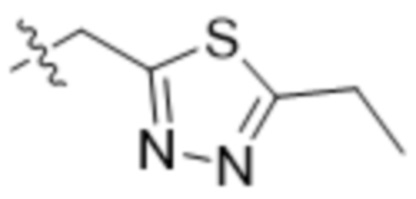 ,
, 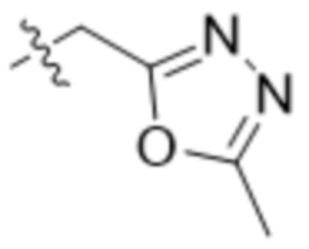 ,
, 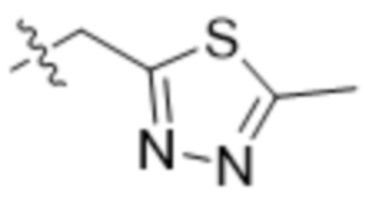 ,
, 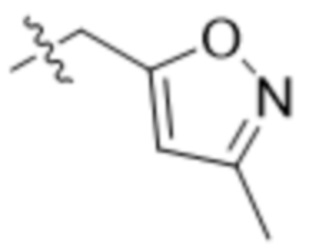 ,
, 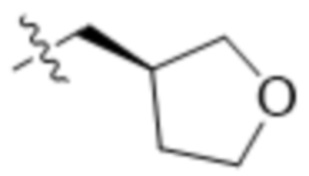 ,
, 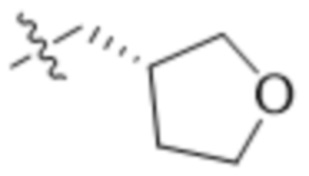 ,
, 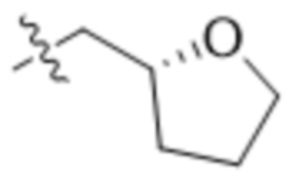 ,
, 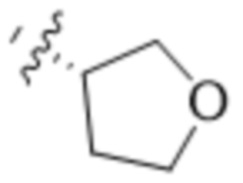 ,
, 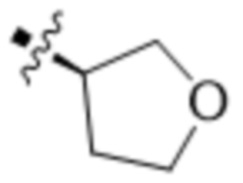 ,
, 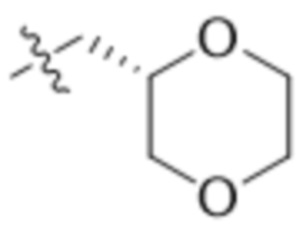 ,
, 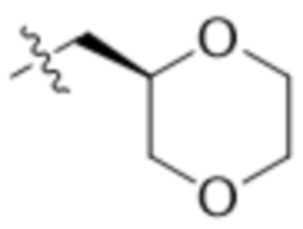 ,
, 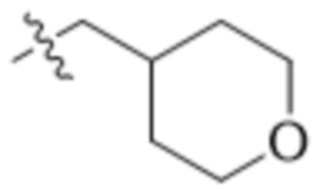 ,
, 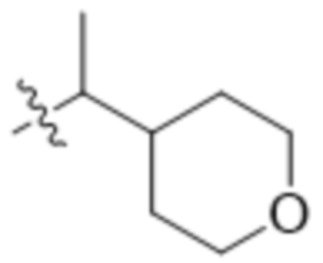 ,
,  ,
,  и
и 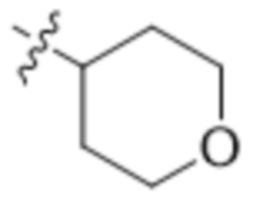 .
.
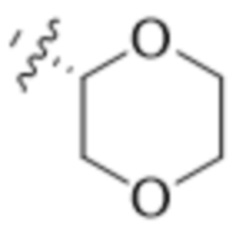
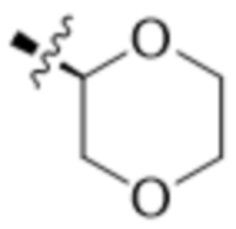
В другом варианте осуществления R4 представляет собой C1-C5алкил и R6 представляет собой независимую циано-группу, -OH, -OCH3, 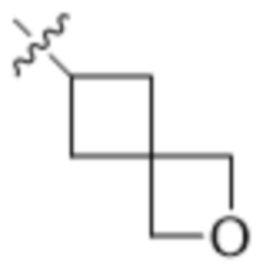 ,
, 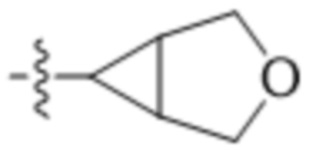 ,
,  ,
, 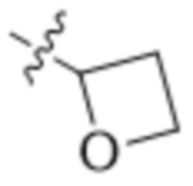 ,
, 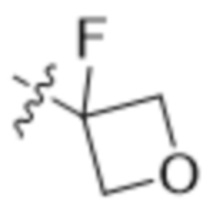 ,
, 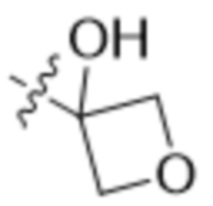 ,
, 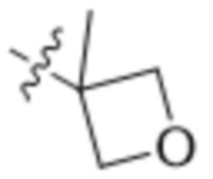 ,
, 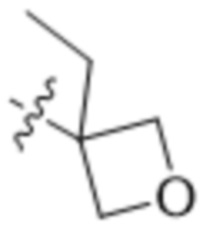 ,
, 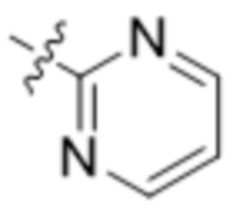 ,
, 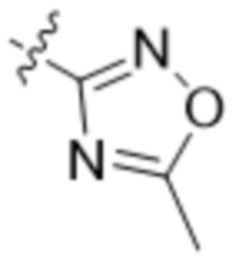 ,
, 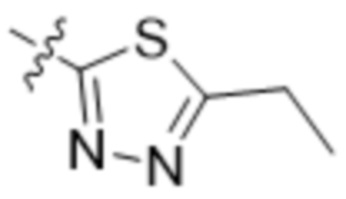 ,
, 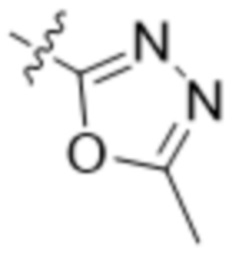 ,
, 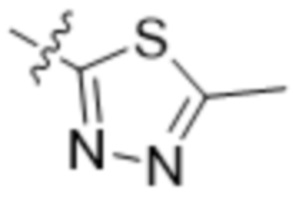 ,
, 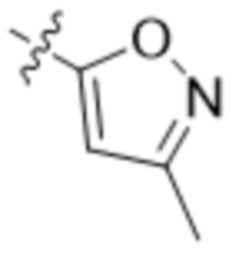 ,
,  ,
,  ,
,  ,
,  ,
,  и
и  .
.
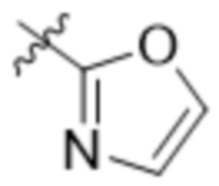
В одном варианте осуществления R7 выбран из группы, состоящей из: 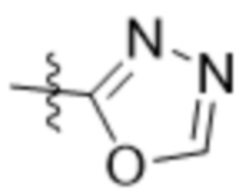 ,
, 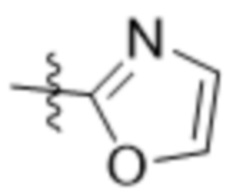 ,
, 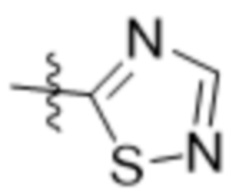 ,
, 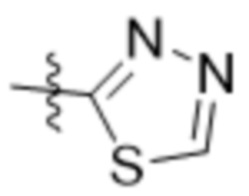 и
и 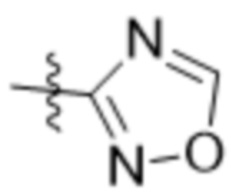 .
.
В одном варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (I),

(I),
или его фармацевтически приемлемая соль, где
R1 представляет собой галоген или водород;
R2 представляет собой галоген или водород;
R3 представляет собой
необязательно замещенный C1-3алкил, при этом указанный алкил необязательно замещен одним 4-6-членным гетероциклоалкилом,
необязательно замещенный 5-6-членный гетероарил, при этом указанный гетероарил необязательно замещен одним C1-3алкилом,
необязательно замещенный 4-6-членный гетероциклоалкил, при этом указанный гетероциклоалкил необязательно замещен одним -OH,
необязательно замещенный 4-6-членный циклоалкил, при этом указанный циклоалкил необязательно замещен одним -OH; или
-OR4;
R4 представляет собой
необязательно замещенный C1-5алкил, при этом указанный алкил необязательно замещен одним или двумя R6,
необязательно замещенный 3-9-членный гетероциклоалкил, при этом указанный гетероциклоалкил необязательно замещен одним или двумя R6, или
необязательно замещенный 4-6-членный циклоалкил, при этом указанный циклоалкил необязательно замещен одним, двумя или тремя R6;
R5 представляет собой галоген или водород;
каждый R6 независимо представляет собой
галоген,
-OH,
-OCH3,
-C(CH3)2OH,
-CH2OH,
циано,
необязательно замещенный C1-C4алкил, при этом указанный алкил необязательно замещен -OH,
необязательно замещенный 4-7-членный гетероциклоалкил, при этом указанный гетероциклоалкил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -OCH3 и C1-3алкила, или
необязательно замещенный 5-6-членный гетероарил, при этом указанный гетероарил необязательно замещен одним C1-3алкилом; и
R7 представляет собой 5-членный гетероарил.
В одном варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (Ia),

(Ia),
или его фармацевтически приемлемая соль или стереоизомер.
В одном варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (Ib)

(Ib),
или его фармацевтически приемлемая соль или стереоизомер.
В одном варианте осуществления R1 выбран из группы, состоящей из H, хлора и фтора. В другом варианте осуществления R1 представляет собой фтор.
В одном варианте осуществления R2 представляет собой H или фтор.
В одном варианте осуществления R5 представляет собой H или фтор.
В одном варианте осуществления R1, R2 и R5 представляют собой H.
В одном варианте осуществления R2 и R5 представляют собой H.
В одном варианте осуществления R3 выбран из группы, состоящей из:  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  . В некоторых вариантах осуществления R3 представляет собой -OR4.
. В некоторых вариантах осуществления R3 представляет собой -OR4.
В одном варианте осуществления R4 выбран из группы, состоящей из CH3, -CH2CH2C(CH3)2OH, -CH2CH2C(CH3)2OCH3, -CH2CH2OCH3 и -CH2C(CH3)2OH. В некоторых вариантах осуществления R4 выбран из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  .
.
В другом варианте осуществления R4 представляет собой C1-C5алкил и R6 представляет собой независимую циано-группу, -OH, -OCH3,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  .
.
В одном варианте осуществления R7 выбран из группы, состоящей из:  ,
,  ,
,  ,
,  и
и  .
.
В одном варианте осуществления в данном документе предусмотрено соединение, которое выбрано из группы, состоящей из:
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
этил-5-((S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]octan-2-ил)-1,3,4-оксадиазол-2-карбоксилата;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-3-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2,2-диметилпропаннитрила;
(S)-7-(4-(2-(((S)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((1,3-диоксан-5-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-4-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ола;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-4-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ола;
(S)-1-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(оксазол-2-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(5-метил-1,3,4-оксадиазол-2-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-метилоксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((R)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((S)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((R)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((S)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((5-метил-1,3,4-тиадиазол-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((5-метил-1,3,4-оксадиазол-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-метилизоксазол-5-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(пиримидин-2-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-фтороксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-метилоксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((S)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((S)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((3-этилоксетан-3-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((5-этил-1,3,4-тиадиазол-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-3-((2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)метил)оксетан-3-ола;
2-((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
2-((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
2-((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
2-((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
(S)-7-(4-(5-фтор-2-((S)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((S)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(7S)-7-(4-(2-((3-оксабицикло[3.1.0]гексан-6-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-3,5-дифторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(1R,4s)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1R,4s)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1R,4s)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1R,4s)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-метоксифенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(4-фтор-2-(1-(2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-((3-фтороксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
2-((1R,3s)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
2-((1S,3r)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
2-((1R,3s)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
2-((1S,3r)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
(S)-2-(оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-хлор-2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(2-(1-(2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((5-метил-1,2,4-оксадиазол-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((S)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-4-(2-(1-(2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]oктан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ола;
формиатной соли (S)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(2-(1-(2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола;
(S)-4-(2-(1-(2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ола;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(2-(1-(2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октана и
(S)-7-(4-(2-((2-оксапиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октана, или его фармацевтически приемлемая соль.
В одном варианте осуществления соединение выбрано из группы, состоящей из:
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
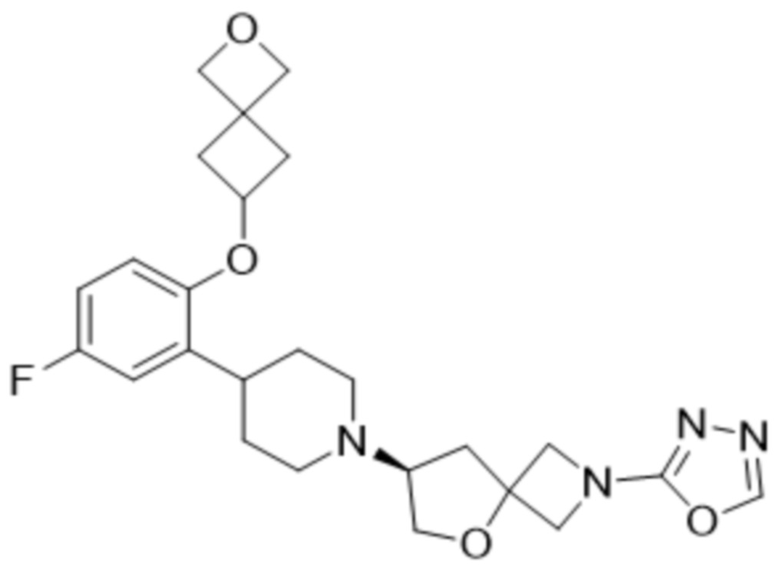 ;
;
(R)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
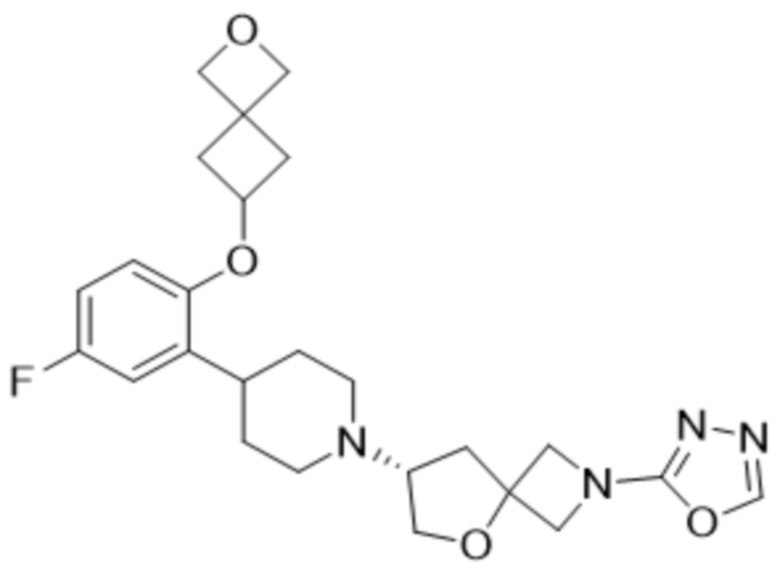 ;
;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
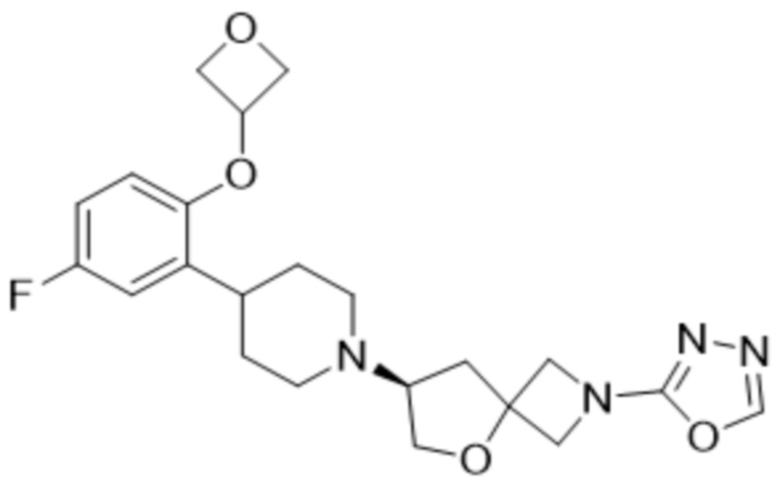 ; и
; и
(S)-2-(оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
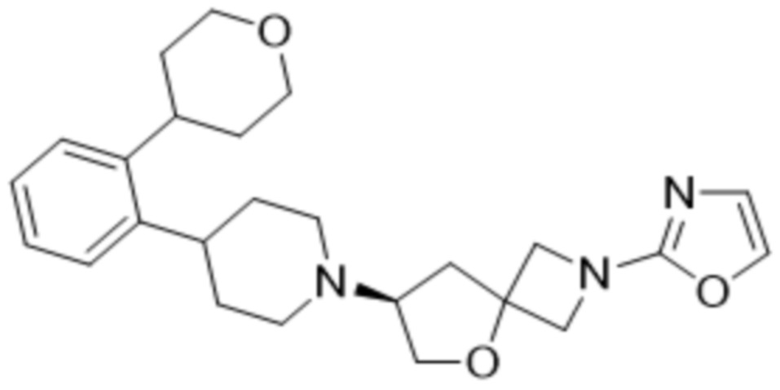 , или его фармацевтически приемлемой соли.
, или его фармацевтически приемлемой соли.
В определенных вариантах осуществления соединение представляет собой (S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:  , или его фармацевтически приемлемую соль.
, или его фармацевтически приемлемую соль.
В определенных вариантах осуществления соединение представляет собой (R)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:
 , или его фармацевтически приемлемую соль.
, или его фармацевтически приемлемую соль.
В определенных вариантах осуществления соединение представляет собой (S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:
 , или его фармацевтически приемлемую соль.
, или его фармацевтически приемлемую соль.
В определенных вариантах осуществления соединение представляет собой (S)-2-(оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:
 , или его фармацевтически приемлемую соль.
, или его фармацевтически приемлемую соль.
В одном варианте осуществления в данном документе предусмотрена фармацевтическая композиция, содержащая соединение, предусмотренное в данном документе, или его фармацевтически приемлемую соль.
В одном варианте осуществления в данном документе предусмотрен способ лечения связанных с M4 состояния, заболевания или нарушения, включающий введение терапевтически эффективного количества соединения, предусмотренного в данном документе, или его фармацевтически приемлемой соли пациенту, нуждающемуся в таком лечении.
В одном варианте осуществления в данном документе предусмотрен способ лечения психоза, включающий введение терапевтически эффективного количества соединения, предусмотренного в данном документе, или его фармацевтически приемлемой соли пациенту, нуждающемуся в таком лечении. В некоторых вариантах осуществления психоз ассоциирован с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В другом варианте осуществления психоз ассоциирован с болезнью Альцгеймера.
В одном варианте осуществления в данном документе предусмотрен способ лечения когнитивной дисфункции, включающий введение терапевтически эффективного количества соединения, предусмотренного в данном документе, или его фармацевтически приемлемой соли субъекту, нуждающемуся в таком лечении. В некоторых вариантах осуществления когнитивная дисфункция ассоциирована с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В другом варианте осуществления когнитивная дисфункция ассоциирована с болезнью Альцгеймера.
В одном варианте осуществления в данном документе предусмотрен способ лечения гиперкинетического двигательного расстройства, включающий введение терапевтически эффективного количества соединения, предусмотренного в данном документе, или его фармацевтически приемлемой соли субъекту, нуждающемуся в таком лечении. В некоторых вариантах осуществления гиперкинетическое двигательное расстройство ассоциировано с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В другом варианте осуществления гиперкинетическое двигательное расстройство ассоциировано с болезнью Альцгеймера. В некоторых вариантах осуществления гиперкинетическое двигательное расстройство представляет собой синдром Туретта, хорею или позднюю дискинезию.
В одном варианте осуществления в данном документе предусмотрен способ лечения расстройств, связанных с употреблением психоактивных веществ, включающий введение терапевтически эффективного количества соединения, предусмотренного в данном документе, или его фармацевтически приемлемой соли субъекту, нуждающемуся в таком лечении.
В одном варианте осуществления в данном документе предусмотрен способ лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, включающий введение терапевтически эффективного количества соединения, предусмотренного в данном документе, или его фармацевтически приемлемой соли и антидепрессанта субъекту, нуждающемуся в таком лечении.
В одном варианте осуществления в данном документе предусмотрен способ лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, включающий введение терапевтически эффективного количества соединения, предусмотренного в данном документе, или его фармацевтически приемлемой соли в сочетании с компьютеризированной психосоциальной или поведенческой терапией.
В одном варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли в терапии. В дополнительном варианте осуществления терапия выбрана для состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4.
В другом варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли при связанных с M4 состоянии, заболевании или нарушении.
В другом варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли при психозе. В некоторых вариантах осуществления психоз ассоциирован с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В другом варианте осуществления психоз ассоциирован с болезнью Альцгеймера.
В одном варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли при когнитивной дисфункции. В некоторых вариантах осуществления когнитивная дисфункция ассоциирована с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В другом варианте осуществления когнитивная дисфункция ассоциирована с болезнью Альцгеймера.
В одном варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли при гиперкинетическом двигательном расстройстве. В некоторых вариантах осуществления гиперкинетическое двигательное расстройство ассоциировано с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В другом варианте осуществления гиперкинетическое двигательное расстройство ассоциировано с болезнью Альцгеймера. В некоторых вариантах осуществления гиперкинетическое двигательное расстройство представляет собой синдром Туретта, хорею или позднюю дискинезию.
В одном варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли при расстройствах, связанных с употреблением психоактивных веществ.
В одном варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли при состоянии, заболевании или нарушении, которые поддаются лечению с помощью агониста рецептора M4. В вариантах осуществления применение осуществляют в сочетании с компьютеризированной психосоциальной и поведенческой терапией.
В одном варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата. В дополнительном варианте осуществления лекарственный препарат предназначен для лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора М4. В другом варианте осуществления состояние, заболевание или нарушение представляют собой психоз, включающий без ограничения психоз, ассоциированный с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера и лобно-височной деменцией.
В одном варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения гиперкинетического двигательного расстройства. В некоторых вариантах осуществления гиперкинетическое двигательное расстройство ассоциировано с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В другом варианте осуществления гиперкинетическое двигательное расстройство ассоциировано с болезнью Альцгеймера.
В одном варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения когнитивной дисфункции. В некоторых вариантах осуществления когнитивная дисфункция ассоциирована с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В другом варианте осуществления когнитивная дисфункция ассоциирована с болезнью Альцгеймера.
В одном варианте осуществления в данном документе предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения расстройств, связанных с употреблением психоактивных веществ.
5. КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1 продемонстрирован эффект от примера 1A и примера 2L на гиперактивность у мышей, индуцированную стимулятором d-амфетамином, с применением анализа индуцированной амфетамином гиперлокомоции у мышей.
На фиг. 2 продемонстрирован эффект примера 3C и примера 3D на гиперактивность у мышей, индуцированную стимулятором d-амфетамином, с применением анализа индуцированной амфетамином гиперлокомоции у мышей.
На фиг. 3 продемонстрирован эффект примера 4A и примера 5G на гиперактивность у мышей, индуцированную стимулятором d-амфетамином, с применениемнализа индуцированной амфетамином гиперлокомоции у мышей.
6. ПОДРОБНОЕ ОПИСАНИЕ
1. Определения
"Алкил", применяемый в данном документе, относится к одновалентной насыщенной углеводородной цепи, содержащей указанное число атомов углерода. Например, C1-3алкил относится к алкильной группе, содержащей от 1 до 3 атомов углерода. Алкильные группы могут быть необязательно замещены одним или несколькими заместителями, определенными в формуле (I). Алкильные группы могут быть прямыми или разветвленными. Типичные разветвленные алкильные группы содержат одну, две или три ветви. Примеры алкильных групп включают без ограничения, метил, этил, пропил (н-пропил и изопропил), бутил (н-бутил, изобутил, втор-бутил и трет-бутил), пентил (н-пентил, изопентил и неопентил) и гексил.
"Циклоалкил", применяемый в данном документе, относится к насыщенной углеводородной кольцевой системе, содержащей указанное число атомов углерода. Циклоалкильные группы представляют собой моноциклические или бициклические кольцевые системы. Например, C3-7циклоалкил относится к циклоалкильной группе, содержащей от 3 до 7 атомов углерода. Циклоалкильные группы могут быть необязательно замещены одним или несколькими заместителями, определенными в формуле (I). Примеры циклоалкильных групп включают без ограничения циклопропил, циклобутил, циклопентил и циклогексил.
"Галогено" или "галоген", применяемый в данном документе, относится к группе фтора, хлора или брома.
"Галогеналкил", применяемый в данном документе, относится к алкильной группе, содержащей указанное число атомов углерода, где по меньшей мере один атом водорода, присоединенный к атому углерода в алкильной группе, заменен на атом галогена. Количество заместителей, представляющих собой атом галогена, включает без ограничения 1, 2, 3, 4, 5 или 6 заместителей. Галогеналкил включает без ограничения монофторметил, дифторэтил и трифторметил.
"Гетероарил", применяемый в данном документе, относится к ароматической кольцевой системе, содержащей один или несколько гетероатомов. Гетероарильные группы, содержащие более чем один гетероатом, могут содержать разные гетероатомы. Гетероарильные группы могут быть необязательно замещены одним или несколькими заместителями, определенными в формуле (I). Гетероарильные группы могут представлять собой моноциклические кольцевые системы или конденсированные бициклические кольцевые системы. Моноциклические гетероарильные кольца содержат от 5 до 6 атомов в кольце. Бициклические гетероарильные кольца содержат от 8 до 10 атомов в своем составе. Бициклические гетероарильные кольца включают те кольцевые системы, где гетероарильное кольцо конденсировано с фенильным кольцом. Гетероарил включает без ограничения пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, оксадиазолил (в том числе 1,3,4-оксадиазолил и 1,2,4-оксадиазолил), тиазолил, изотиазолил, тиадиазолил (в том числе 1,3,4-тиадиазолил), фуранил, фуранзанил, тиенил, триазолил, пиридинил (в том числе 2-, 3- и 4-пиридинил), пиримидинил, пиридазинил, пиразинил, тразинил, тетразинил, тетразолил, индонил, изоиндолил, индолизинил, индазолил, пуринил, хинолинил, изохинолинил, хиноксалинил, хиназолинил, бензимидазолил, бензопиранил, бензопиранил, бензоксазолил, бензoизоксазолил, бензофуранил, бензотиазолил, бензотиенил, нафтиридинил, 1H-пирроло[2,3-b]пиридинил, тетразоло[1,5-a]пиридинил, имидазо[2,1-b][1,3,4]тиадиазолил и т. п.
"5-6-членный гетероарил", применяемый в данном документе, относится к определенной выше гетероарильной группе, содержащей 5 или 6 атомов в кольце и содержащей 1-4 гетероатома. Примеры 5-6-членного гетероарила включают без ограничения тиазол, оксазол, изоксазол, 1,3,4-тиадиазол, 1,2,4-оксадиазол, 1,2,4-оксадиазол, 1,3,4-оксадиазол, 1,2,5-тиадиазол, 1H-имидазол, 1H-пиразол, пиридин, пиримидин, 1,3,5-триазин и т. п.
"Гетероатом", применяемый в данном документе, относится к атому азота, кислорода или серы.
"Гетероциклическая группа" или "гетероциклоалкил", применяемые в данном документе, относятся к насыщенному или ненасыщенному моноциклическому или бициклическому кольцу, содержащему от 1 до 4 гетероатомов. Гетероциклические кольцевые системы не являются ароматическими. Гетероциклические группы, содержащие более одного гетероатома, могут содержать разные гетероатомы. Гетероциклические группы включают кольцевые системы, где атом серы окислен с образованием SO или SO2. Гетероциклические группы могут быть необязательно замещены одним или несколькими заместителями, определенными в формуле (I). Гетероциклические группы представляют собой моноциклические, бициклические, спиро- или конденсированные или мостиковые бициклические кольцевые системы. Моноциклические гетероциклические кольца содержат 3-7 атомов в кольце. Примеры моноциклических гетероциклических групп включают пиранил, тетрагидропиранил, оксетанил, тетрагидрофуранил, дигидрофуранил, 1,4-диоксанил, морфолинил, 1,4-дитианил, пиперазинил, пиперидинил, 1,3-диоксанил, имидазолидинил, имидазолинил, пирролинил, пирролидинил, тетрагидропиранил, дигидропиранил, оксатиоланил, дитиоланил, 1,3-диоксанил, 1,4-диоксанил, 1,3-дитианил, оксатианил, тиоморфолинил, тетрагидро-тиопиран-1,1-диоксид, 1,4-диазепанил и т. п. Примеры бициклических гетероциклических групп включают 3-оксабицикло[3.1.0]гексан и т. п. Примеры мостиковых гетероциклических групп включают 2-азабицикло[2.2.1]гептанил и т. п. Примеры спирогетероциклических групп включают 2-оксаспиро[3.3]гептанил и т. п.
"4-6-членная гетероциклическая группа" или "4-6-членный гетероциклоарил", применяемые в данном документе, относятся к определенной выше гетероциклической группе, содержащей от 4 до 6 атомов в кольце и содержащей от 1 до 3 гетероатомов. Примеры 4-6-членной гетероциклической группы включают без ограничения оксетанил, пирролидинил, морфолинил, пиперазинил, пиперидинил, 1,4-диазепанил, 3-оксабицикло[3.1.0]гексанил и т. п.
"5-6-членная гетероциклическая группа" или "5-6-членный гетероциклоарил", применяемые в данном документе, относятся к определенной выше гетероциклической группе, содержащей от 5 до 6 атомов в кольце и содержащей от 1 до 3 гетероатомов. Примеры 5-6-членной гетероциклической группы включают без ограничения пирролидинил, морфолинил, пиперазинил, пиперидинил, 1,4-диазепанил, 3-оксабицикло[3.1.0]гексанил и т. п.
"3-9-членная гетероциклическая группа" или "3-9-членный гетероциклоарил", применяемые в данном документе, относятся к определенной выше гетероциклической группе, соедржащей от 3 до 9 атомов в кольце и содержащей от 1 до 3 гетероатомов. Примеры 3-9-членной гетероциклической группы включают без ограничения пирролидинил, морфолинил, пиперазинил, пиперидинил, 1,4-диазепанил, 2-оксаспиро[3.3]гептанил, 3-оксабицикло[3.1.0]гексанил и т. п.
"Необязательно замещенный", применяемый в данном документе, указывает на то, что группа, такая как алкил, гетероарил и гетероциклическая группа, может быть не замещена или группа может быть замещена одним или несколькими заместителями, определенными в формуле (I).
"Соль" или "соли", применяемые в данном документе, относятся к соли присоединения кислоты или присоединения основания соединения, предусмотренного в данном документе. "Соли" включают в частности "фармацевтически приемлемые соли". "Фармацевтически приемлемые соли", применяемые в данном документе, относятся к солям, которые сохраняют биологическую эффективность и свойства соединений в соответствии с формулой (I) и которые, как правило, не являются нежелательными с биологической или иной точки зрения. Во многих случаях соединения в соответствии с формулой (I) способны к образованию солей с кислотой и/или основанием за счет присутствия аминогрупп и/или карбоксильных групп или подобных им групп. Специалисту в данной области техники будет понятно, что могут быть получены соли, в том числе фармацевтически приемлемые соли, соединений в соответствии с формулой (I). Такие соли могут быть получены in situ в ходе окончательного выделения и очистки соединения или посредством осуществления отдельной реакции очищенного соединения в форме его свободных кислоты или основания с подходящими основанием или кислотой соответственно.
Фармацевтически приемлемые соли присоединения кислоты могут быть образованы с помощью неорганических кислот и органических кислот. Неорганические кислоты, из которых могут быть получены соли, включают, например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислота, фосфорную кислоту и т. п. Органические кислоты, из которых могут быть получены соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, толуолсульфоновую кислоту, сульфосалициловую кислоту и т. п.
Фармацевтически приемлемые соли присоединения основания могут быть образованы с неорганическими и органическими основаниями, такими как карбоксилатные, сульфонатные и фосфатные соли.
В определенных вариантах осуществления в данном документе предусмотрены соединения в соответствии с формулой (I) в форме соли, представляющей собой ацетат, аскорбат, адипат, аспартат, бензоат, безилат, бромид/гидробромид, бикарбонат/карбонат, бисульфат/сульфат, камфорасульфонат, капрат, хлорид/гидрохлорид, хлортеофиллонат, цитрат, этандисульфонат, формиат, фумарат, глюцептат, глюконат, глюкуронат, глутамат, глутарат, гликолят, гиппурат, гидройодид/йодид, изетионат, лактат, лактобионат, лаурилсульфат, малат, малеат, малонат, манделат, мезилат, метилсульфат, мукат, нафтоат, напсилат, никотинат, нитрат, октадеканоат, олеат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, полигалактуронат, пропионат, себацат, стеарат, сукцинат, сульфосалицилат, сульфат, тартрат, тозилат, трифенатат, трифторацетат или ксинафоат. В определенных вариантах осуществления в данном документе предусмотрены соединения в соответствии с формулой (I) в форме соли, представляющей собой формиат или цитрат.
"Изомеры" относятся к разным соединениям в соответствии с формулой (I), которые характеризуются одинаковой молекулярной формулой, но различаются расположением и конфигурацией атомов.
"Оптический изомер" или "стереоизомер" относятся к любой из различных стереоизомерных конфигураций, которые могут существовать для данного соединения, предусмотренного в данном документе, и включают геометрические изомеры. Понятно, что заместитель может быть присоединен при хиральном центре атома углерода. Следовательно, соединения, предусмотренные в данном документе, включают энантиомеры, диастереомеры или рацематы соединения.
В зависимости от выбора исходных материалов и процедур соединения в соответствии с формулой (I) могут находиться в форме одного из возможных стереоизомеров или в виде их смесей, например, в виде чистых оптических изомеров, или в виде смесей стереоизомеров, таких как рацематы и смеси диастереоизомеров, в зависимости от числа асимметрических атомов углерода. Подразумевается, что соединения в соответствии с формулой (I), предусмотренные в данном документе, включают все такие возможные стереоизомеры, в том числе рацемические смеси, смеси диастереоизомеров и оптически чистые формы. Оптически активные (R)- и (S)-стереоизомеры можно получать с использованием хиральных синтонов или хиральных реагентов или выделять с применением традиционных методик. Если соединение содержит двойную связь, заместитель может иметь E- или Z-конфигурацию. Если соединение содержит дизамещенный циклоалкил, то циклоалкильный заместитель может иметь цис- или транс-конфигурацию. Также предполагается включение всех таутомерных форм.
Любой асимметричный атом (например, углерод или т. п.) соединений в соответствии с формулой (I) может находиться в рацемической или энантиомерно обогащенной форме, например, в (R)-, (S)- или (R,S)-конфигурации. В определенных вариантах осуществления каждый асимметричный атом характеризуется по меньшей мере 50% энантиомерным избытком, по меньшей мере 60% энантиомерным избытком, по меньшей мере 70% энантиомерным избытком, по меньшей мере 80% энантиомерным избытком, по меньшей мере 90% энантиомерным избытком, по меньшей мере 95% энантиомерным избытком или по меньшей мере 99% энантиомерным избытком в (R)- или (S)-конфигурации. Заместители при атомах с ненасыщенными двойными связями могут, если это возможно, находиться в цис- (Z)- или транс- (E)-форме.
Соответственно, соединение, предусмотренное в данном документе, может находиться в форме одного из возможных стереоизомеров, ротамеров, атропоизомеров, таутомеров или их смесей, например, в виде практически чистых геометрических (цис или транс) стереоизомеров, диастереомеров, оптических изомеров (антиподов), рацематов или их смесей.
Любые полученные в результате смеси стереоизомеров могут быть разделены на основании физико-химический отличий составляющих на чистые или практически чистые геометрические или оптические изомеры, диастереомеры, рацематы, например, с помощью хроматографии и/или фракционной кристаллизации.
Любые полученные рацематы соединений в соответствии с формулой (I) или их промежуточных соединений можно разделять на оптические антиподы с помощью известных способов, например, посредством разделения их диастереоизомерных солей, полученных с помощью оптически активных кислоты или основания, и выделения оптически активного кислотного или основного соединения. В частности, основной фрагмент можно использовать таким образом для разделения соединений в соответствии с формулой (I) на их оптические антиподы, например, с помощью фракционной кристаллизации соли, образованной с оптически активной кислотой, например, винной кислотой, дибензоилвинной кислотой, диацетилвинной кислотой, ди-O,O'-п-толуоилвинной кислотой, миндальной кислотой, яблочной кислотой или камфора-10-сульфоновой кислотой. Рацемические соединения в соответствии с формулой (I) или рацемические промежуточные соединения также могут быть разделены с помощью хиральной хроматографии, например, жидкостной хроматографии высокого давления (HPLC) с применением хирального адсорбента.
Подразумевается, что любая формула, приведенная в данном документе, также представляет собой как немеченные формы, так и изотопно-меченные формы соединений. Изотопно-меченные соединения имеют структуры, изображенные посредством формул, приведенных в данном документе, за исключением того, что один или несколько атомов заменены атомом, характеризующимся выбранными атомной массой или массовым числом. Изотопы, которые могут быть включены в состав соединений в соответствии с формулой (I), включают, например, изотопы водорода.
Кроме того, включение определенных изотопов, в частности дейтерия (т. е. 2H или D) может обеспечивать определенные терапевтические преимущества, обусловленные более высокой метаболической устойчивостью, например увеличенным периодом полувыведения in vivo, или снижением требующейся дозы, или улучшением терапевтического индекса или переносимости. Известно, что дейтерий в данном контексте рассматривается в качестве заместителя соединения, предусмотренного в данном документе. Концентрация дейтерия может быть определена с помощью коэффициента изотопного обогащения. "Коэффициент изотопного обогащения", применяемый в данном документе, означает соотношение содержания изотопа к распространенности в природе указанного изотопа. Если заместитель в соединении, предусмотренном в данном документе, указан как дейтерий, то такое соединение характеризуется коэффициентом изотопного обогащения для каждого обозначенного атома дейтерия, составляющим по меньшей мере 3500 (включение 52,5% дейтерия по каждому обозначенному атому дейтерия), по меньшей мере 4000 (включение 60% дейтерия), по меньшей мере 4500 (включение 67,5% дейтерия), по меньшей мере 5000 (включение 75% дейтерия), по меньшей мере 5500 (включение 82,5% дейтерия), по меньшей мере 6000 (включение 90% дейтерия), по меньшей мере 6333,3 (включение 95% дейтерия), по меньшей мере 6466,7 (включение 97% дейтерия), по меньшей мере 6600 (включение 99% дейтерия) или по меньшей мере 6633,3 (включение 99,5% дейтерия). Следует понимать, что термин "коэффициент изотопного обогащения" можно применять в отношении любого изотопа таким же способом, как описано для дейтерия.
Например, соединение формулы (I) может быть дейтерированным, как представлено в формуле (Ic):
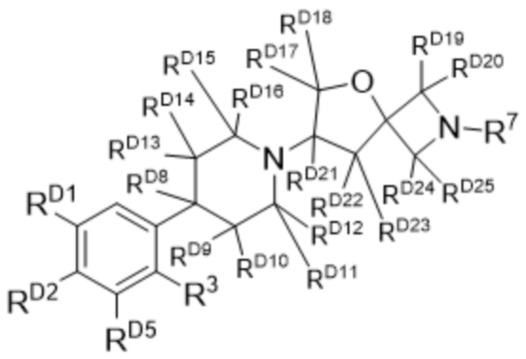
(Ic),
или его фармацевтически приемлемая соль, где R3 и R7 определены в формуле (I); и каждый из RD1, RD2, RD5 и RD8-RD27 независимо представляют собой D или галоген.
Другие примеры изотопов, которые можно включать в соединения в соответствии с формулой (I), включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 3H, 11C, 13C, 14C, 15N, 18F 31P, 32P, 35S, 36Cl, 123I, 124I, 125I соответственно. Соответственно, следует понимать, что соединения в соответствии с формулой (I) включают соединения, в состав которых включены один или несколько из любых вышеуказанных изотопов, в том числе, например, радиоактивные изотопы, такие как 3H и 14C, или соединения, в которых присутствуют нерадиоактивные изотопы, такие как 2H и 13C. Такие изотопно-меченные соединения пригодны в исследованиях метаболизма (с применением 14C), в исследованиях кинетики реакций (с применением, например 2H или 3H), в методиках обнаружения или визуализации, таких как позитронно-эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография (SPECT), в том числе в анализах распределения лекарственного средства или субстрата в тканях или при радиационной терапии пациентов. В частности, меченное 18F соединение может быть особенно пригодным для исследований с помощью PET или SPECT. Изотопно-меченные соединения в соответствии с формулой (I), как правило можно получать с помощью традиционных методик, известных специалистам в данной области техники, или посредством способов, аналогичных описанным в сопутствующих примерах и способах получения с применением подходящих изотопно-меченных реагентов вместо немеченого реагента, используемого ранее.
"Введение" и "осуществление введения", и "вводить", применяемые в данном документе, относятся к способу, с помощью которого соединение, предусмотренное в данном документе (например, соединение в соответствии с формулой (I)), предоставляется субъекту.
"Субъект" или "пациент", применяемые в данном документе, относятся к живому организму, страдающему от одного или нескольких заболеваний или нарушений, описанных в данном документе, который можно подвергнуть лечению путем введения фармацевтической композиции, описанной в данном документе. Примеры субъектов включают млекопитающих (например, людей и животных, таких как собаки, коровы, лошади, обезьяны, свиньи, морские свинки, овцы, козы, кошки, мыши, кролики, крысы и трансгенные животные, отличные от человека). В определенных вариантах осуществления субъект является приматом. В определенных вариантах осуществления, субъект является человеком, например, человеком, страдающим от заболевания, описанного в данном документе, с риском его развития или потенциально способный страдать от него. В конкретных вариантах осуществления субъект является взрослым человеком в возрасте по меньшей мере приблизительно 18 лет. В конкретных вариантах осуществления субъект является взрослым человеком в возрасте от приблизительно 18 до приблизительно 75 лет. В конкретных вариантах осуществления субъект является человеческим ребенком в возрасте до приблизительно 18 лет.
"Лечить", "осуществление лечения" или "лечение" любого заболевания или нарушения, применяемые в данном документе, относятся к ослаблению, облегчению, задержке, уменьшению, обращению или улучшению по меньшей мере одного симптома состояния у субъекта. Термин "осуществлять лечение" может также означать приостановку, задержку наступления (т. е., периода до клинического проявления заболевания) и/или снижение риска развития или ухудшения состояния. В определенных вариантах осуществления термин "осуществлять лечение" относится к ослаблению, облегчению, задержке прогрессирования, уменьшению, обращению или улучшению по меньшей мере одного симптома состояния, выбранного из психоза, в том числе психоза, ассоциированного с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера, болезнью Паркинсона, посттравматическим стрессовым расстройством и лобно-височной деменцией, гиперкинетического двигательного расстройства, включающего без ограничения синдромом Туретта, хорею и позднюю дискинезию, когнитивной дисфункции, включающей без ограничения когнитивную дисфункцию, ассоциированную с шизофренией, болезнью Альцгеймера, лобно-височной деменцией, шизоаффективным расстройством и депрессией; и/или расстройств, связанных с употреблением психоактивных веществ.
"Предупреждать", "осуществлять предупреждение" или "предупреждение" любого заболевания или нарушения, применяемые в данном документе, относятся к профилактическому лечению заболевания или нарушения; или обеспечению задержки наступления или прогрессирования заболевания или нарушения.
"Фармацевтическая композиция", применяемая в данном документе относится к соединению, предусмотренному в данном документе, или его фармацевтически приемлемой соли, вместе с по меньшей мере одним фармацевтически приемлемым носителем, в подходящей для перорального или парентерального введения форме.
"Фармацевтически приемлемый носитель", применяемый в данном документе, относится к веществу, пригодному в получении или применении фармацевтической композиции и включает, например, подходящие разбавители, растворители, дисперсионные среды, поверхностно-активные вещества, антиоксиданты, консерванты, изотонические средства, буферные средства, эмульгаторы, средства, замедляющие всасывание, соли, стабилизаторы лекарственных средств, связующие вещества, наполнители, разрыхлители, смазывающие средства, смачивающие средства, подсластители, ароматизирующие средства, красители и их комбинации, которые должны быть известны специалистам в данной области техники (см., например, Remington The Science and Practice of Pharmacy, 22nd Ed. Pharmaceutical Press, 2013, pp. 1049-1070).
"Терапевтически эффективное количество" предусмотренного в данном документе соединения, применяемое в данном документе, относится к количеству соединения, которое будет вызывать биологический или медицинский ответ у субъекта, например, повышать активность фермента или белка или уменьшать тяжесть симптомов, облегчать состояния, замедлять или сдерживать прогрессирование заболевания или предупреждать заболевание и т. д. В одном варианте осуществления термин "терапевтически эффективное количество" относится к количеству соединения, предусмотренному в данном документе, которое при введении субъекту является эффективным в отношении (1) по меньшей мере частичного облегчения, предупреждения и/или уменьшения тяжести состояния, или нарушения, или заболевания (i), опосредованного M4, или (ii) ассоциированного с активностью M4 , или (iii) характеризуется активностью (нормальной или анормальной) M4; или (2) повышает активность M4. В другом варианте осуществления термин "терапевтически эффективное количество" относится к количеству предусмотренного в данном документе соединения, которое при введении в клетку, или ткань, или неклеточный биологический материал, или среду, является эффективным для увеличения активности M4.
"Подавлять", "подавление" или "подавляющий", применяемые в данном документе, относятся к снижению выраженности или супрессии данного условия, симптома или нарушения, или заболевания, или значительному уменьшению исходного уровня активности в отношении биологической активности или процесса.
Субъект является "нуждающимся" в лечении, если в результате такого лечения такой субъект получит пользу с биологической, медицинской точки зрения или улучшится качество его жизни.
"Расстройство, связанное с употреблением психоактивных веществ" или "SUD", применяемое в данном документе, определяется на основе критериев DSM-5 (т. е., в соответствии с Диагностическим и статистическим руководством по психическим расстройствам. 5th Edition, Washington, DC: American Psychiatric Association, 2013; далее в данном документе "DSM-5"), полное содержание которого включено в данный документ посредством ссылки. Термин "расстройство, связанное с употреблением психоактивных веществ", применяемый в данном документе, относится к ситуации, когда периодическое употребление алкоголя и/или лекарственных средств вызывает клинически и функционально значимое нарушение, такое как проблемы со здоровьем, нарушение функций, и неспособность выполнять основные обязанности на работе, в школе или дома. В соответствии с DSM-5 диагноз расстройства, связанного с употреблением психоактивных веществ, основывается на свидетельствах нарушения контроля, снижения социальной активности, рискованного применения и фармакологических критериях. Расстройство, связанное с употреблением психоактивных веществ, включает, например, расстройство, связанное с употреблением алкоголя, расстройство, связанное с употреблением табака, расстройство, связанное с употреблением каннабиса, расстройство, связанное с употреблением стимуляторов, расстройство, связанное с употреблением галлюциногенных веществ, и расстройство, связанное с употреблением опиоидов.
"Психосоциальная или поведенческая терапия", применяемые в данном документе, относятся без ограничения к когнитивно-поведенческой терапии (например, как описано в Arch. Gen. Psychiatry 1999; 56:493-502), межличностной терапии (например, как описано в Psychol Addict Behav 2009; 23(1): 168-174), терапии, основанной на положительном подкреплении, например, как описано в Psychol Addict Behav 2009; 23(1): 168-174; в J. Consul. Clin. Psychol. 2005; 73(2): 354-59; или в Case Reports in Psychiatry, Vol. 2012, Article ID 731638), терапии, основанной на подходе поддержки сообществом, (например, как описано в Drug Alcohol Depend 2004; 74:1-13), терапии, основанной на мотивационном консультировании (например, как описано в J. Consul. Clin. Psychol. 2001; 69(5): 858-62), терапии, основанной на мотивационном улучшении (например, как описано в Drug Alcohol Depend 2007, 91:97-101), или терапии, основанной на медитации, такой как терапия, основанная на трансцендентальной медитации (например как описано в Addiction 2004; 99(7):862-874 или J. Consul. Clin. Psychol. 2000; 68(3): 515-52); в частности терапии, основанной на положительном подкреплении.
"Стандартизированное психологическое лечение" или "стандартизированная психологическая поддержка", применяемые в данном документе, относятся к стандартным сеансам консультации, например один раз в неделю, в частности консультации, при которой уделяют большое внимание вопросу о приеме кокаина.
"Компьютеризированный" или "компьютерное обеспечение", применяемые в данном документе, относятся к психосоциальной или поведенческой терапии, предусматривающей применение электронных или цифровых инструментов, таких как онлайн инструменты, смартфоны, ноутбуки, планшеты, беспроводные устройства или приложения для здоровья.
Если не указано иное, "соединение, предусмотренное в данном документе" или "соединения, предусмотренные в данном документе" относятся к соединениям формулы (I) и их подформул, в том числе формулы (Ia), (Ib), (Ic), и любым иллюстративным соединениям и их солям, а также ко всем стереоизомерам (в том числе диастереоизомерам и энантиомерам), ротамерам, таутомерам и изотопно-меченным соединениям (в том числе замещенные дейтерием), а также образованным природным путем фрагментам.
Применяемые в данном документе термины в форме единственного числа и аналогичные термины, применяемые в данном документе (особенно в контексте формулы изобретения), следует истолковывать как охватывающие как форму единственного числа, так и форму множественного числа, если в данном документе не указано иное или если это явно не противоречит контексту.
На протяжении всего настоящего описания и формулы изобретения, которая следует далее, если контекст не предусматривает иное, слово "содержать" или его такие варианты, как "содержит" или "содержащий", следует понимать как подразумевающие включение указанных целого числа или стадии, или группы целых чисел или стадий, но не исключение любых других целого числа или стадии, или группы целых чисел или стадий.
Если существует несоответствие между изображенной структурой и химическим названием, данным этой структуре, изображенной структуре следует предоставить большее предпочтение. Кроме того, если стереохимия структуры или части структуры не обозначена, например, жирными или пунктирными линиями, структура или часть структуры должны интерпретироваться как охватывающие все стереоизомеры структуры или части структуры.
Все способы, описанные в данном документе, можно осуществлять в любом подходящем порядке, если в данном документе не указано иное или это иным образом явно не противоречит контексту. Применение всех возможных примеров или вводных слов перед примерами (например, "такой как"), предусмотренных в данном документе, предназначено исключительно для лучшего объяснения настоящего изобретения и не накладывает ограничений на объем настоящего изобретения, заявленного иным образом.
2. Соединения
В одном варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (I),

(I),
или его фармацевтически приемлемая соль, где
R1 представляет собой галоген или водород;
R2 представляет собой галоген или водород;
R3 представляет собой
необязательно замещенный C1-3алкил, при этом указанный алкил необязательно замещен одним 4-6-членным гетероциклоалкилом,
необязательно замещенный 5-6-членный гетероарил, при этом указанный гетероарил необязательно замещен одним C1-3алкилом,
необязательно замещенный 4-6-членный гетероциклоалкил, при этом указанный гетероциклоалкил необязательно замещен одним -OH,
необязательно замещенный 4-6-членный циклоалкил, при этом указанный циклоалкил необязательно замещен одним -OH; или
-OR4;
R4 представляет собой
необязательно замещенный C1-5алкил, при этом указанный алкил необязательно замещен одним или двумя R6,
необязательно замещенный 3-9-членный гетероциклоалкил, при этом указанный гетероциклоалкил необязательно замещен одним или двумя R6, или
необязательно замещенный 4-6-членный циклоалкил, при этом указанный циклоалкил необязательно замещен одним, двумя или тремя R6;
R5 представляет собой галоген или водород;
каждый R6 независимо представляет собой
галоген,
-OH,
-OCH3,
-C(CH3)2OH,
-CH2OH,
циано,
необязательно замещенный C1-C4алкил, при этом указанный алкил необязательно замещен -OH,
необязательно замещенный 4-7-членный гетероциклоалкил, при этом указанный гетероциклоалкил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -OCH3 и C1-3алкила, или
необязательно замещенный 5-6-членный гетероарил, при этом указанный гетероарил необязательно замещен одним C1-3алкилом; и
R7 представляет собой 5-членный гетероарил.
В одном варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (Ia),

(Ia),
или его фармацевтически приемлемая соль или стереоизомер.
В одном варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (Ib)

(Ib),
или его фармацевтически приемлемая соль или стереоизомер.
В одном варианте осуществления R1 выбран из группы, состоящей из H, хлора и фтора. В другом варианте осуществления R1 представляет собой фтор.
В одном варианте осуществления R2 представляет собой H или фтор.
В одном варианте осуществления R5 представляет собой H или фтор.
В одном варианте осуществления R1, R2 и R5 представляют собой H.
В одном варианте осуществления R2 и R5 представляют собой H.
В одном варианте осуществления R3 выбран из группы, состоящей из:  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  . В некоторых вариантах осуществления R3 представляет собой -OR4.
. В некоторых вариантах осуществления R3 представляет собой -OR4.
В одном варианте осуществления R4 выбран из группы, состоящей из CH3, -CH2CH2C(CH3)2OH, -CH2CH2C(CH3)2OCH3, -CH2CH2OCH3 и -CH2C(CH3)2OH. В некоторых вариантах осуществления R4 выбран из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  .
.
В другом варианте осуществления R4 представляет собой C1-C5алкил и R6 представляет собой независимую циано-группу, -OH, -OCH3,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  .
.
В одном варианте осуществления R7 выбран из группы, состоящей из:  ,
,  ,
,  ,
,  и
и  .
.
В одном варианте осуществления в данном документе предусмотрено соединение, которое выбрано из группы, состоящей из:
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
этил-5-((S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]octan-2-ил)-1,3,4-оксадиазол-2-карбоксилата;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-3-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2,2-диметилпропаннитрила;
(S)-7-(4-(2-(((S)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((1,3-диоксан-5-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-4-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ола;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-4-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ола;
(S)-1-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(оксазол-2-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(5-метил-1,3,4-оксадиазол-2-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-метилоксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((R)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((S)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((R)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((S)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((5-метил-1,3,4-тиадиазол-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((5-метил-1,3,4-оксадиазол-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-метилизоксазол-5-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(пиримидин-2-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-фтороксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-метилоксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((S)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((S)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((3-этилоксетан-3-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((5-этил-1,3,4-тиадиазол-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-3-((2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)метил)оксетан-3-ола;
2-((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
2-((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
2-((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
2-((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
(S)-7-(4-(5-фтор-2-((S)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((S)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(7S)-7-(4-(2-((3-оксабицикло[3.1.0]гексан-6-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-3,5-дифторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(1R,4s)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1R,4s)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1R,4s)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1R,4s)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-метоксифенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(4-фтор-2-(1-(2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-((3-фтороксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
2-((1R,3s)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
2-((1S,3r)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
2-((1R,3s)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
2-((1S,3r)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
(S)-2-(оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-хлор-2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(2-(1-(2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((5-метил-1,2,4-оксадиазол-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((S)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-4-(2-(1-(2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]oктан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ола;
формиатной соли (S)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(2-(1-(2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола;
(S)-4-(2-(1-(2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ола;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(2-(1-(2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октана и
(S)-7-(4-(2-((2-оксапиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октана или его фармацевтически приемлемая соль.
В одном варианте осуществления соединение выбрано из группы, состоящей из:
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
 ;
;
(R)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
 ;
;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
 ; и
; и
(S)-2-(оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
 , или его фармацевтически приемлемая соль.
, или его фармацевтически приемлемая соль.
В определенных вариантах осуществления соединение представляет собой (S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:  , или его фармацевтически приемлемую соль.
, или его фармацевтически приемлемую соль.
В определенных вариантах осуществления соединение представляет собой (R)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:
 , или его фармацевтически приемлемую соль.
, или его фармацевтически приемлемую соль.
В определенных вариантах осуществления соединение представляет собой (S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:
 , или его фармацевтически приемлемую соль.
, или его фармацевтически приемлемую соль.
В определенных вариантах осуществления соединение представляет собой (S)-2-(оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:
 , или его фармацевтически приемлемую соль.
, или его фармацевтически приемлемую соль.
В одном варианте осуществления в данном документе предусмотрена фармацевтическая композиция, содержащая соединение, предусмотренное в данном документе, или его фармацевтически приемлемую соль.
3. Фармацевтические композиции
В одном варианте осуществления в данном документе предусмотрена фармацевтическая композиция, содержащая соединение, предусмотренное в данном документе, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В другом варианте осуществления в данном документе предусмотрена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В другом варианте осуществления в данном документе предусмотрена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В дополнительном варианте осуществления композиция содержит по меньшей мере два фармацевтически приемлемых носителя, такие как те, которые описаны в данном документе. Фармацевтическая композиция может быть составлена для конкретных путей введения, таких как пероральное введение, парентеральное введение (например, посредством инъекции, инфузии, чрескожного или местного введения) и ректальное введение. Местное введение может также относиться к ингаляционному или интраназальному применению. Фармацевтические композиции, предусмотренные в данном документе, можно получать в твердой форме (включающей без ограничения капсулы, таблетки, пилюли, гранулы, порошки или суппозитории) или в жидкой форме (включающей без ограничения растворы, суспензии или эмульсии). Таблетки могут быть покрыты либо пленочной оболочкой, либо кишечнорастворимой оболочкой в соответствии со способами, известными в данной области техники. Как правило, фармацевтические композиции представляют собой таблетки или желатиновые капсулы, содержащие активный ингредиент вместе с одним или несколькими из следующих компонентов:
a) разбавителей, например, с лактозой, декстрозой, сахарозой, маннитом, сорбитом, целлюлозой и/или глицином;
b)смазывающих веществ, например, с диоксидом кремния, тальком, стеариновой кислотой, ее магниевой или кальциевой солью и/или полиэтиленгликолем; также в случае таблеток
c) связующих веществ, например, с алюмосиликатом магния, крахмальной пастой, желатином, трагакантом, метилцеллюлозой, натрий-карбоксиметилцеллюлозой и/или поливинилпирролидоном; при необходимости
d) разрыхлителей, например, с видами крахмала, агаром, альгиновой кислотой или ее натриевой солью или шипучими смесями; и
e) абсорбентов, красящих веществ, ароматизаторов и подсластителей.
Фармацевтические композиции, предусмотренные в данном документе, могут быть представлены в однократной дозировке, составляющей приблизительно 1-1000 мг активного(активных) ингредиента(ингредиентов) для субъекта весом приблизительно 50-70 кг, или приблизительно 1-500 мг, или приблизительно 1-250 мг, или приблизительно 1-150 мг, или приблизительно 0,5-100 мг, или приблизительно 1-50 мг активных ингредиентов. Терапевтически эффективная дозировка соединения или фармацевтической композиции на его основе зависит от вида субъекта, веса тела, возраста и индивидуального состояния, нарушения или заболевания, лечение которых осуществляют, или их тяжести. Врач, клиницист или ветеринар средней квалификации может легко определить эффективное количество каждого из активных ингредиентов, необходимое для предупреждения, лечения или подавления прогрессирования нарушения или заболевания.
Вышеупомянутые параметры дозировки являются очевидными в тестах in vitro и in vivo с применением преимущественно млекопитающих, например, мышей, крыс, собак, нечеловекообразных обезьян или выделенных органов, тканей и их препаратов. Соединения, предусмотренные в данном документе, можно применять in vitro в форме растворов, например, водных растворов, и in vivo либо парентерально, преимущественно внутривенно, например, в виде суспензии или водного раствора. Дозировка in vitro может находиться в диапазоне значений молярной концентрации от приблизительно 10-3 до 10-9. В зависимости от пути введения терапевтически эффективное количество in vivo может находиться в диапазоне приблизительно 0,1-500 мг/кг или приблизительно 1-100 мг/кг.
4. Способы применения
В одном варианте осуществления соединения, предусмотренные в данном документе, представлены в свободной форме или в форме фармацевтически приемлемой соли и обладают активностью в качестве агонистов мускариновых рецепторов M4. В конкретном варианте осуществления в данном документе предусмотрены соединения в соответствии с формулой (I) в свободной форме или в форме фармацевтически приемлемой соли, обладающие активностью в качестве агонистов мускариновых рецепторов M4. Значительное преимущество соединений, предусмотренных в данном документе, состоит в том, что они являются высокоселективными в отношении рецептора M4 по сравнению с подтипами рецепторов M1, M2 и M3 и, таким образом считается, что они сохраняют их необходимую активность в головном мозге, но не приводят к нежелательным холинергическим побочным эффектам. Активность соединений, предусмотренных в данном документе, в отношении мускариновых рецепторов можно определить с применением анализа потока Ca++ с использованием CHRM4, описанного ниже в разделе 8.2.
За счет их активности в качестве агониста рецептора M4 соединения, предусмотренные в данном документе, могут быть пригодными для лечения:
психоза, в том числе психоза, ассоциированного с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотичнескими чертами, болезнью Альцгеймера, болезнью Паркинсона, посттравматическим стрессовым расстройством и лобно-височной деменцией;
гиперкинетических двигательных расстройств, включающих без ограничения синдром Туретта, хорею и позднюю дискинезию;
когнитивной дисфункции, включающей без ограничения когнитивную дисфункцию, ассоциированную с шизофренией, болезнью Альцгеймера, лобно-височной деменцией, шизоаффективным расстройством и депрессией; и/или
расстройств, свзяанных с употреблением психоактивных веществ.
В одном варианте осуществления в данном документе предусмотрен способ осуществления лечения состояния, заболевания или нарушения, которое поддается лечению с помощью агониста рецептора M4, включающем введение терапевтически эффективного количества соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли субъекту, нуждающемуся в таком лечении. В дополнительном варианте осуществления состояние, заболевание или нарушение представляет собой психоз, включающий без ограничения психоз, ассциированный с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера, болезнью Паркинсона, посттравматическим стрессовым расстройством и лобно-височной деменцией. В конкретном варианте осуществления психоз ассоциирован с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрен способ лечения гиперкинетического двигательного расстройства, такого как синдром Туретта, хорея или поздняя дискинезия, включающий введение терапевтически эффективного количества соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли субъекту, нуждающемуся в таком лечении. В некоторых вариантах осуществления гиперкинетическое двигательное расстройство ассоциировано с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В конкретном варианте осуществления гиперкинетическое двигательное расстройство ассоциировано с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрен способ лечения когнитивной дисфункции, такой как когнитивная дисфункция, ассоциированная с шизофренией, болезнью Альцгеймера, лобно-височной деменцией, шизоаффективным расстройством или депрессией, включающий введение терапевтически эффективного количества соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли субъекту, нуждающемуся в таком лечении. В конкретном варианте осуществления когнитивная дисфункция ассоциирована с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрен способ лечения расстройств, связанных с употреблением психоактивных веществ, включающий введение терапевтически эффективного количества соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли субъекту, нуждающемуся в таком лечении.
В одном варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли в терапии. В дополнительном варианте осуществления терапия выбрана для состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4. В другом варианте осуществления состояние, заболевание или нарушение выбраны из вышеупомянутого списка, в частности психоза, включающего без ограничения психоз, ассоциированный с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера, болезнью Паркинсона, посттравматическим стрессовым расстройством и лобно-височной деменцией.
В другом варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли при гиперкинетическом двигательном расстройстве, таком как синдром Туретта, хорея или поздняя дискинезия. В некоторых вариантах осуществления гиперкинетическое двигательное расстройство ассоциировано с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В конкретном варианте осуществления гиперкинетическое двигательное расстройство ассоциировано с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли при когнитивной дисфункции, например когнитивной дисфункции, ассоциированной с шизофренией, болезнью Альцгеймера, лобно-височной деменцией, шизоаффективным расстройством или депрессией. В конкретном варианте осуществления когнитивная дисфункция ассоциирована с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли при расстройствах, связанных с употреблением психоактивных веществ.
В другом варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата. В дополнительном варианте осуществления лекарственный препарат предназначен для лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4. В другом варианте осуществления состояние, заболевание или нарушение представляют собой психоз, включающий без ограничения психоз, ассоциированный с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера, болезнью Паркинсона, посттравматическим стрессовым расстройством и лобно-височной деменцией.
В другом варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения гиперкинетического двигательного расстройства, такого как синдром Туретта, хорея или поздняя дискинезия. В некоторых вариантах осуществления гиперкинетическое двигательное расстройство ассоциировано с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В конкретном варианте осуществления гиперкинетическое двигательное расстройство ассоциировано с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения когнитивной дисфункции, например когнитивной дисфункции, ассоциированной с шизофренией, болезнью Альцгеймера, лобно-височной деменцией, шизоаффективным расстройством или депрессией. В конкретном варианте осуществления когнитивная дисфункция ассоциирована с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения расстройств, связанных с употреблением психоактивных веществ.
В другом варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (I) или его фармацевтически приемлемая соль для применения в лечении состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецепторов M4. В дополнительном варианте осуществления состояние, заболевание или нарушение выбрано из вышеуказанного списка, в частности психоза, включающего без ограничения психоз, ассоциированным с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера, болезнью Паркинсона, посттравматическим стрессовым расстройством, и лобно-височной деменцией. В конкретном варианте осуществления психоз ассоциирован с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрено соединение в соответствии с формулой (I) или его фармацевтически приемлемая соль для применения в лечении гиперкинетического двигательного расстройства, такого как синдром Туретта, хорея или поздняя дискинезия. В некоторых вариантах осуществления гиперкинетическое двигательное расстройство ассоциировано с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. В конкретном варианте осуществления гиперкинетическое двигательное расстройство ассоциировано с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении когнитивной дисфункции, например когнитивной дисфункции, ассоциированной с шизофренией, болезнью Альцгеймера, лобно-височной деменцией, шизоаффективным расстройством или депрессией. В конкретном варианте осуществления когнитивная дисфункция ассоциирована с болезнью Альцгеймера.
В другом варианте осуществления в данном документе предусмотрено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении расстройств, связанных с употреблением психоактивных веществ.
Соединение в соответствии с формулой (I) или его фармацевтически приемлемую соль можно вводить либо одновременно с одним или несколькими другими терапевтическими средствами, либо до или после них. Соединения в соответствии с формулой (I) можно вводить по отдельности с помощью того же или различного пути введения или совместно в составе одной и той же фармацевтической композиции, что и другие средства. Терапевтическое средство представляет собой, например, химическое соединение, пептид, антитело, фрагмент антитела или нуклеиновую кислоту, которые являются терапевтически активными или повышают терапевтическую активность при введении субъекту в комбинации с соединением, предусмотренном в данном документе.
В видах комбинированной терапии, предусмотренных в данном документе, соединение в соответствии с формулой (I) и другое терапевтическое средство могут быть изготовлены и/или составлены одними и теми же или различными производителями. Более того, соединения, предусмотренные в данном документе, и другое терапевтическое средство могут быть объединены в комбинированной терапии: (i) до передачи врачам комбинированного продукта (например, в случае набора, содержащего соединение, предусмотренное в данном документе, и другое терапевтическое средство); (ii) самими врачами (или под руководством врача) незадолго до введения; (iii) самими пациентами, например, во время последовательного введения соединения, предусмотренного в данном документе, и другого терапевтического средства.
Соединение в соответствии с формулой (I) или его фармацевтически приемлемую соль можно вводить с антипсихотическим средством, в частности с антипсихотическим средством первого поколения, таким как хлорпромазин (торазин), галоперидол, мезоридазин, тиоридазин, тиотиксен, пимозид, флуфеназин или перфеназин, с антипсихотическим средством второго поколения, таким как клозапин, оланзапин, рисперидон, кветиапин, арипипразол, азенапин, брекспипразол, карипразин, илоперидон, зипрасидон, луразидон, пимавансерин или палиперидон. В определенных вариантах осуществления соединение в соответствии с формулой (I) или его фармацевтически приемлемую соль можно вводить с антипсихотическим средством и ингибитором холинэстеразы, таким как донепезил, тартрат ривастигмина, галантамин, такрин или мемантин. В определенных вариантах осуществления соединение в соответствии с формулой (I) или его фармацевтически приемлемую соль можно вводить с антипсихотическим средством и нормотимиком, таким как препараты лития, дивалпрекс натрия, карбамазепин или ламотриджин.
Соединение в соответствии с формулой (I) или его фармацевтически приемлемую соль можно вводить с антидепрессантом, в частности с селективным ингибитором обратного захвата серотонина, таким как сертралин, флуоксетин, флувоксамин, эсциталопрам, пароксетин или циталопрам, с ингибитором обратного захвата серотонина-норэпинефрина, таким как вортиоксетин, венлафаксин, десвенлафаксин, милнаципран, дулоксетин или левомилнаципран, с антидепрессантом на основе фенилпиперазина, таким как нефазодон, вилазодон или тразодон, с обратимыми ингибиторами моноаминоксидазы, такими как моклобемид, с агонистами мелатонина, такими как агомелатин, с агонистами серотонина, такими как миртазапин, с антагонистами рецептора N-метил-D-аспартата, такими как эскетамин и кетамин, и ингибиторами моноаминоксидазы, такими как транилципромин, фенелзин, трансдермальный селегилин или изокарбоксазид.
Соединение в соответствии с формулой (I) или его фармацевтически приемлемую соль можно вводить в сочетании со стандартизированным психологическим лечением, например, при индивидуальной или групповой терапии. В другом варианте осуществления соединение в соответствии с формулой (I) или его фармацевтически приемлемую соль можно вводить в сочетании с психосоциальной или поведенческой терапией либо с помощью стандартизированного психологического лечения, либо с помощью компьютерного обеспечения. В определенном варианте осуществления компьютерное обеспечение осуществляется с помощью цифрового или электронного устройства, такого как онлайн инструменты, смартфоны, ноутбуки, планшеты, беспроводные устройства или приложения для здоровья.
В дополнительном варианте осуществления в данном документе предусмотрен способ лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, включающий введение терапевтически эффективного количества соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли и антипсихотического средства, субъекту, нуждающемуся в таком лечении. В определенных вариантах осуществления в данном документе предусмотрен способ лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, включающий введение терапевтически эффективного количества соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли, антипсихотического средства и ингибитора холинэстеразы субъекту, нуждающемуся в таком лечении. В определенных вариантах осуществления в данном документе предусмотрен способ лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, включающий введение терапевтически эффективного количества соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли, антипсихотического средства и нормотимика субъекту, нуждающемуся в таком лечении.
В дополнительном варианте осуществления в данном документе предусмотрен способ лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, включающий введение терапевтически эффективного количества соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли и антидепрессанта субъекту, нуждающемуся в таком лечении.
В дополнительном варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли при состоянии, заболевании или нарушении, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с антипсихотическим средством. В определенных вариантах осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли при состоянии, заболевании или нарушении, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с антипсихотическим средством и ингибитором холинэстеразы. В определенных вариантах осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли при состоянии, заболевании или нарушении, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с антипсихотическим средством и нормотимиком.
В дополнительном варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли при состоянии, заболевании или нарушении, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с антидепрессантом.
В дополнительном варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с антипсихотическим средством. В определенных вариантах осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с антипсихотическим средством и ингибитором холинэстеразы. В определенных вариантах осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с антипсихотическим средством и нормотимиком.
В дополнительном варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с антидепрессантом.
В дополнительном варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли при состоянии, заболевании или нарушении, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с компьютеризированной психосоциальной или поведенческой терапией.
В дополнительном варианте осуществления в данном документе предусмотрено способ лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, включающий введение терапевтически эффективного количества соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли в сочетании с компьютеризированной психосоциальной или поведенческой терапией.
В дополнительном варианте осуществления в данном документе предусмотрено применение соединения в соответствии с формулой (I) или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения состояния, заболевания или нарушения, которые поддаются лечению с помощью агониста рецептора M4, где применение объединено с компьютеризированной психосоциальной или поведенческой терапией.
5. Способы получения
Соединения, предусмотренные в данном документе, можно получать посредством различных способов, включая стандартную химию. Подходящие пути синтеза указаны на схемах ниже.
Соединения, предусмотренные в данном документе, можно получать способами, известными в области органического синтеза, частично изложенными в следующих схемах синтеза. В схемах, описанных ниже, подразумевается, что при необходимости используются защитные группы для неустойчивых или реакционноспособных групп в соответствии с общими принципами или химией. С защитными группами проводят действия в соответствии со стандартными способами органического синтеза (см., T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis" Third edition, Wiley, New York 1999). Такие группы удаляют на подходящей стадии синтеза соединения с использованием способов, очевидных для специалистов в данной области техники. Способы отбора, а также условия проведения реакции и порядок их проведения должны соответствовать получению соединений, предусмотренных в данном документе.
Специалисты в данной области техники смогут определить наличие стереоцентра в соединениях, предусмотренных в данном документе. Соответственно, соединения, предусмотренные в данном документе, включают оба возможных стереоизомера и также включают не только рацемические соединения, но и отдельные энантиомеры и/или диастереомеры. Если соединение, предусмотренное в данном документе, необходимо в виде отдельного энантиомера или диастереоизомера, его можно получать посредством стереоспецифического синтеза или выделения конечного продукта или любого подходящего промежуточного соединения. Выделение конечного продукта, промежуточного соединения или исходного материала можно выполнять посредством любого подходящего способа, известного из уровня техники. См., например, "Stereochemistry of Organic Compounds" E. L. Eliel, S. H. Wilen, and L. N. Mander (Wiley-Interscience, 1994).
Соединения, предусмотренные в данном документе, можно получать в соответствии с последовательностью, представленной на схеме 1 ниже.
Схема 1
На схеме 1 фенолы, такие как 1, можно подвергнуть реакции присоединения защитной группы в виде бензилового эфира и опосредовать образование защищенных фенолов, таких как 2. Альдегид затем может быть дважды алкилирован алкилтриметилсиланом в присутствии активирующей кислоты Льюиса, такой как хлорид иттербия. Полученные бис-олефины, такие как 3, затем могут быть окислены озоновым газом с последующим применением восстановителя, такого как борогидрид натрия, с получением диолов, таких как 4. Спирты затем могут быть активированы в виде пара-толуолсульфоновых сложных эфиров с получением активированных диолов, таких как 5, который может быть заменен амином, таким как 6, с получением третичных аминов, таких как 7. Бензиловая защитная группа может быть удалена посредством палладиевого катализа в присутствии водорода с получением свободных фенолов, таких как 8, которые затем могут быть алкилированы с помощью алифатического галогенида или тозилата в присутствии основания, такого как карбонат цезия, с получением замещенных фенолов, таких как 9. Затем амин можно подвергнуть реакции удаления защитной группы с помощью кислоты, такой как TFA с образованием свободных аминов, которые могут реагировать с гетероароматическими галогенидами в условиях реакции Бухвальда-Хартвига или в условиях нуклеофильного ароматического замещения с получением примеров, таких как 12. В качестве альтернативы, амины, такие как 10, можно подвергнуть реакции с гетероароматическими галогенидами, которые содержат сложный эфир, с образованием гетероароматических соединений, таких как 11. Затем сложный эфир можно гидролизовать с помощью водного раствора основания, такого как гидроксид лития, и полученную кислоту можно декарбоксилировать с помощью водного раствора кислоты, такой как HCl, с получением примеров, таких как 12.
Схема 2
В схеме 2 фенолы, такие как 9, можно подвергнуть реакции удаления защитной группы с помощью кислоты, такой как TFA, и полученный амин можно подвергнуть реакции с гетероароматическим галогенидом в условиях реакции Бухвальда-Хартвига или в условиях нуклеофильного ароматического замещения с образованием гетероароматических соединений, таких как 15. В качестве альтернативы, амин можно подвергнуть реакции с гетероароматическим галогенидом, который содержит сложный этиловый эфир, с получением сложных эфиров, таких как 14. Затем сложный эфир можно гидролизовать с помощью водного раствора основания, такого как гидроксид лития, и полученную кислоту можно декарбоксилировать кислотой, такой как HCl с получением гетероароматических галогенидов, таких как 15. В качестве альтернативы, соединения, предусмотренные в данном документе, можно получать как показано на схеме 3.
Схема 3
В схеме 3, арилборные кислоты, такие как 17, можно подвергнуть реакции с ненасыщенными лактонами, такими как 18, в условиях применения родиевого катализа с получением насыщенных лактонов, таких как 19. Затем лактон можно восстановить с помощью восстановителя, такого как алюмогидрид лития, с получением диолов, таких как 4. Затем данные диолы можно дополнительно обработать, как изображено на схеме 1 или схеме 2. В качестве альтернативы, соединения, предусмотренные в данном документе, можно получать как показано на схеме 4 ниже.
Схема 4
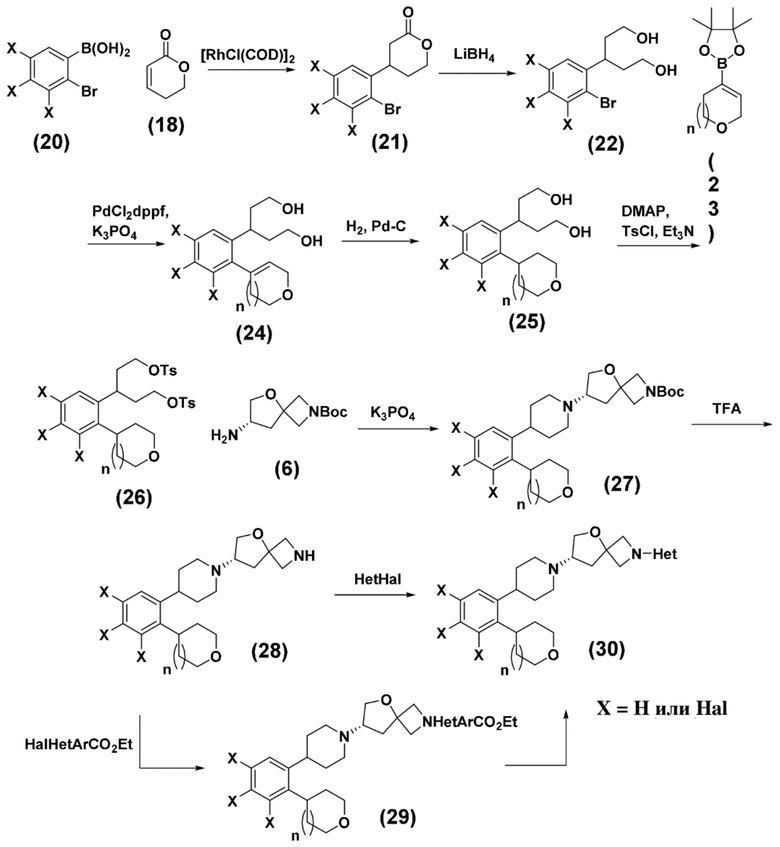
На схеме 4 арилборные кислоты, такие как 20, можно подвергнуть реакции с ненасыщенным лактоном, таким как 19, в условиях применения родиевого катализа и полученный насыщенный лактон 21 можно восстановить с помощью восстановителя, такого как борогидрид лития, с получением диолов, таких как 22. Затем полученный диол можно подвергнуть реакции со сложным бороновым эфиром, таким как 23, в условиях реакции Сузуки-Мияуры с образованием ненасыщенных колец, таких как 24. Затем олефин можно восстановить с помощью палладиевого катализа в присутствии водорода с получением насыщенных колец, таких как 25, и затем можно активировать гидроксильную группу с помощью тозилхлорида с образованием активированных диолов, таких как 26. Затем тозильные группы можно заменить амином, таким как 6, в присутствии основания, такого как фосфат калия, с получением третичного амина, такого как 27. Амин можно подвергнуть реакции удаления защитной группы с помощью кислоты, такой как TFA, и полученный амин 28 можно подвергнуть реакции с гетероароматическим галогенидом в условиях реакции Бухвальда-Хартвига или в условиях нуклеофильного ароматического замещения с получением примеров, таких как 30. В качестве альтернативы, амин можно подвергнуть реакции с гетероароматическим галогенидом, который содержит сложный эфир, с получением сложных этиловых эфиров, таких как 29, и сложный эфир можно гидролизовать с помощью водного раствора кислоты, такой как гидроксид лития, и полученную кислоту можно декарбоксилировать водным раствором кислоты, такой как HCl, с получением примеров, таких как 30. В качестве альтернативы, соединения, предусмотренные в данном документе, можно получать как показано на схеме 5, показанной ниже.
Схема 5
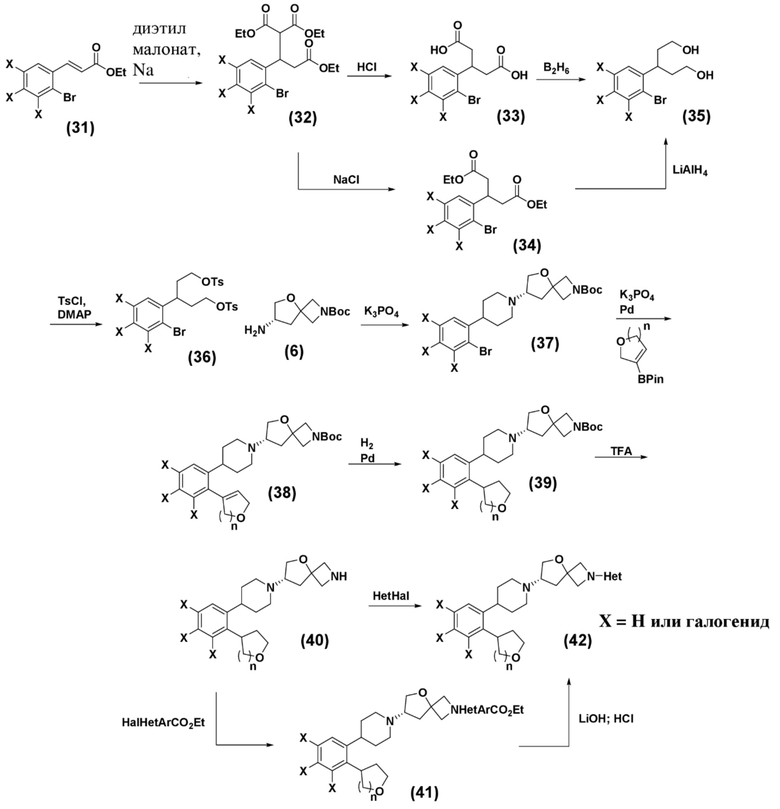
На схеме 5 ненасыщенные сложные эфиры, такие как 31, можно подвергать реакции с диэтилмалонатом в присутствии металла-восстановителя, такого как натрий, с получением трехосновных сложных эфиров, таких как 32. Затем сложный эфир можно гидролизовать и декарбоксилировать кислотой, такой как HCl, с получением двухосновных кислот, таких как 33. Затем кислоты можно восстановить бораном с получением диолов, таких как 35. В качестве альтернативы, сложный эфир может быть декарбоксилирован с получением двухосновных сложных эфиров, таких как 34, и сложные эфиры можно восстановить восстановителем, таким как борогидрид лития, с получением диолов, таких как 35. Диолы, такие как 35, затем могут быть активированы в виде тозилaтов с помощью тозил хлорида и активированные диолы 36 можно подвергнуть реакции с амином, таким как 6 , с получением третичных аминов, таких как 37. Бромиды, такие как 37, затем можно подвергнуть реакции со сложными пинаколбороновыми эфирами с получением ненасыщенных колец, таких как 38. Затем олефин можно восстановить с помощью водорода и палладиевого катализа с получением насыщенных колец, таких как 39, и затем амин можно подвергнуть реакции удаления защитной группы с помощью кислоты, такой как TFA. Затем свободные амины, такие как 40, можно подвергнуть реакции с гетероароматическим галогенидом в условиях реакции Бухвальда-Хартвига или условиях нуклеофильного ароматического замещения с получением примеров, таких как 42. В качестве альтернативы, свободный амин можно подвергнуть реакции с гетероароматическим галогенидом, который содержит сложный этиловый эфир. Затем сложные эфиры, такие как 41, можно гидролизовать с помощью раствора водной кислоты, такого как гидроксид лития, с образованием кислоты, которую затем можно декарбоксилировать кислотой, такой как HCl, с образованием примеров, таких как 42. В качестве альтернативы, соединения, предусмотренные в данном документе, можно получить как описано на схеме 6 ниже.
Схема 6
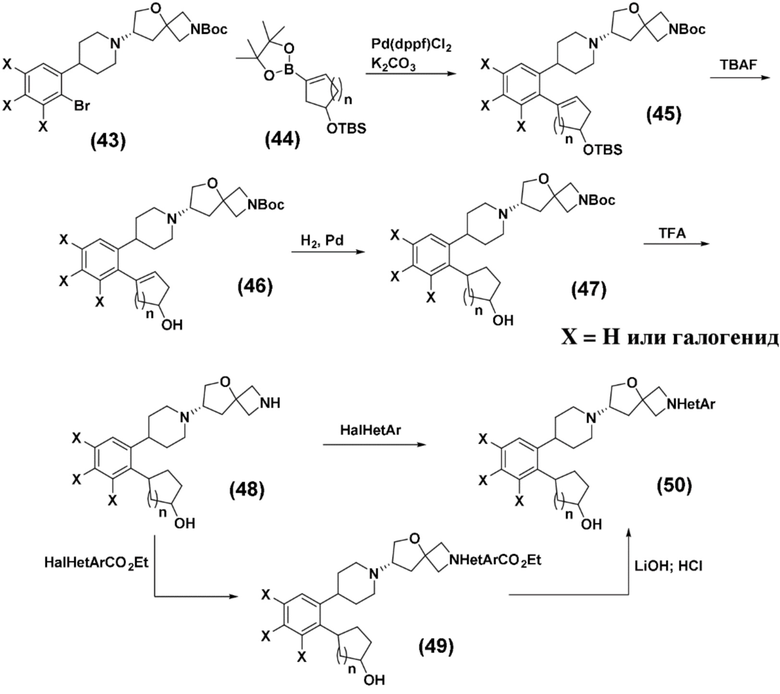
На схеме 6 арилбромиды, такие как 43, можно объединить со сложными пинаколбороновыми эфирами, такими как 44, в условиях реакции кросс-сочетания Сузуки-Мияуры с получением ненасыщенных колец, таких как 45. Затем спирт можно подвергнуть реакции удаления защитной группы с помощью источника фторида, такого как TBAF, с получением свободных спиртов, таких как 46, и затем олефин можно восстановить с помощью водорода и палладиевого катализа с получением насыщенных колец, таких как 47. Затем амин можно подвергнуть реакции удаления защитной группы с помощью кислоты, такой как TFA, и затем свободный амин можно подвергнуть реакции с гетероароматическим галогенидом в условиях реакции Бухвальда-Хартвига или в условиях нуклеофильного ароматического замещения с получением примеров, таких как 50. В качестве альтернативы, свободные амины, такие как 48, можно подвергнуть реакции с гетероароматическими галогенидами, которые содержат сложный этиловый эфир, с получением сложных эфиров, таких как 49. Затем сложный эфир можно гидролизовать с помощью водного раствора основания, такого как гидроксид лития, и затем полученную кислоту можно декарбоксилировать водным раствором кислоты, такой как HCl, с получением примеров, таких как 50. В качестве альтернативы, соединения, предусмотренные в данном документе, можно получить как описано на схеме 7 ниже.
Схема 7
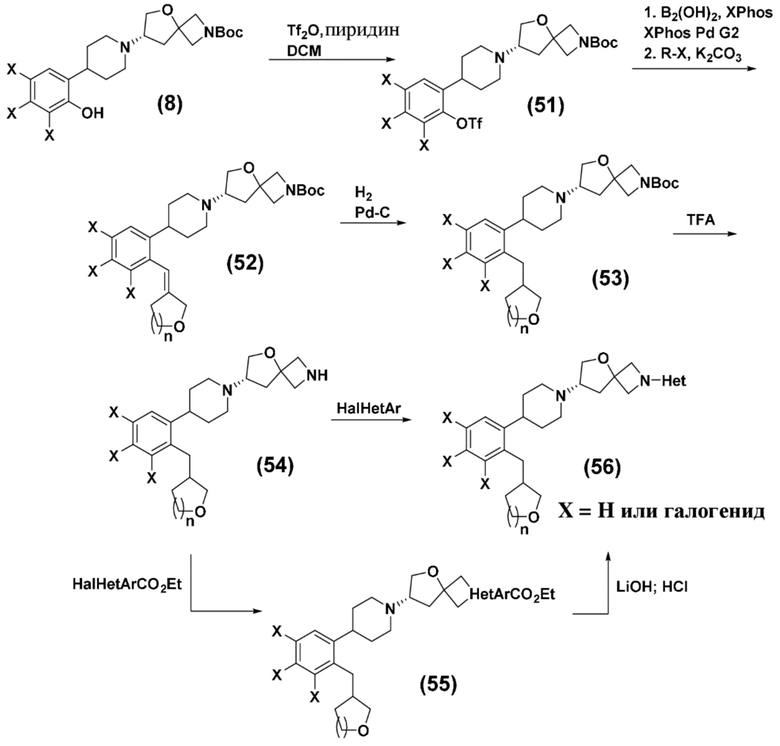
На схеме 7 фенолы, такие как 8, можно активировать, например трифторметансульфоновым ангидридом в присутствии основания, такого как пиридин, с образованием сложного сульфонилового эфира, такого как 51. Затем трифторметилсульфониловый сложный эфир можно превращать в бороновую кислоту с помощью тетрагидроксидибора в присутствии a палладиевого катализатора и соответствующую бороновую кислоту можно подвергнуть реакции с галогенидом в присутствии основания с образованием олефина, такого как 52. Впоследствии соединение можно восстановить с помощью водорода посредством палладиевого катализа с получением насыщенных соединений, таких как 53, и впоследствии соединение можно подвергнуть реакции удаления защитной группы с помощью кислоты, такой как TFA, с получением аминов, таких как 54. Амин можно подвергнуть реакции с арилгалогенидом в условиях реакции Бухвальда-Хартвига или в условиях нуклеофильного ароматического замещения с образованием примеров, таких как 56. В качестве альтернативы, амины, такие как 51, можно подвергнуть реакции с гетероароматическим галогенидом, содержащим сложный этиловый эфир, с получением сложных эфиров, таких как 55. Затем сложный эфир можно гидролизовать с помощью водного раствора основания, такого как гидроксид лития, и полученную кислоту можно декарбоксилировать водным раствором кислоты, такой как HCl, с образованием примеров, таких как 56. В качестве альтернативы, соединения, предусмотренные в данном документе, можно получать как показано на схеме 8 ниже.
Схема 8
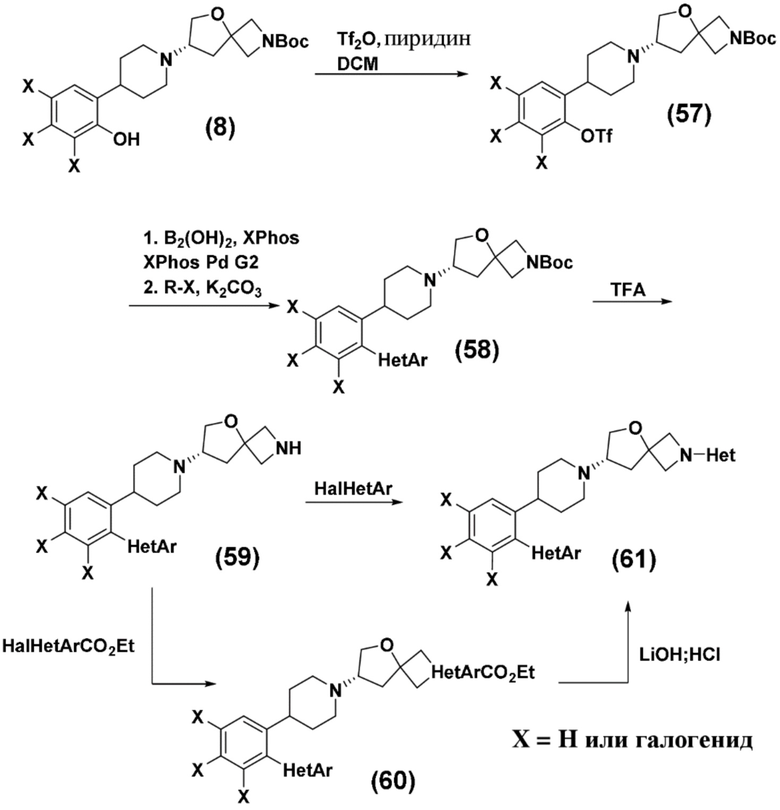
На схеме 8 фенолы, такие как 8, можно активировать в виде трифторметилсульфониловых сложных эфиров, таких как 57, с применением трифлатного ангидрида. Затем полученный активированный сложный эфир затем можно преобразовать в бороновую кислоту с применением тетрагидроксидибора в присутствии палладия, и полученную бороновую кислоту можно подвергнуть реакции в условиях реакции Сузуки-Мияуры с гетероароматическим галогенидом с образованием гетероароматических соединений, таких как 58. Затем амин можно подвергнуть реакции удаления защитной группы с помощью кислоты, такой как TFA, и полученные свободные амины, такие как 59, можно подвергнуть реакции с гетероароматическим галогенидом в условиях реакции Бухвальда-Хартвига или в условиях нуклеофильного ароматического замещения с образованием гетероароматических соединений, таких как 61. В качестве альтернативы амины, такие как 59, можно подвергнуть реакции с гетероароматическими галогенидами, содержащими сложный этиловый эфир, с получением сложных эфиров, таких как 60. Затем сложный эфир можно гидролизовать с помощью водного раствора основания, такого как гидроксид лития, и затем полученную кислоту можно декарбоксилировать водным раствором кислоты, такой как HCl, с образованием гетероароматических соединений, таких как 61. В качестве альтернативы, соединения, предусмотренные в данном документе, можно получать как показано на схеме 9 ниже.
Схема 9
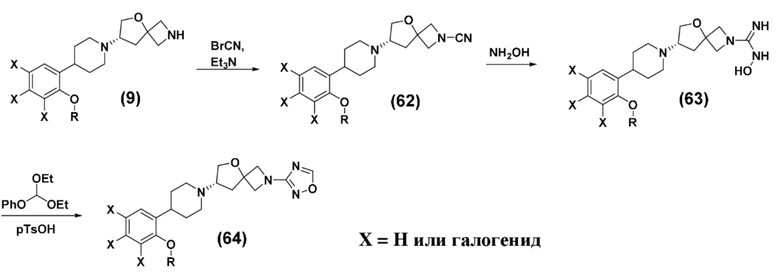
На схеме 9 свободные амины, такие как 9, можно алкилировать таким реагентом как бромистый циан с получением нитрилов, таких как 62. Затем нитрил можно подвергать реакции с гидроксиламином с получением гидроксиламинов, таких как 63, которые затем можно конденсировать с дегидратирующими средствами, такими как диэтилфенилортоформиат и тозиновая кислота с получением оксадиазолов, таких как 64. В качестве альтернативы, соединения можно получать как показано на схеме 10 ниже.
Схема 10
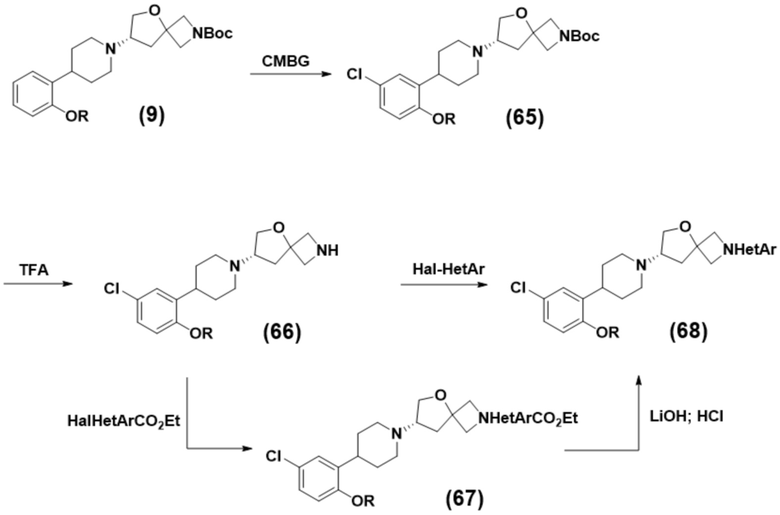
На схеме 10 замещенные фенолы, такие как 9, можно хлорировать хлорирующим средством, таким как 2-хлор-1,3-бис(метоксикарбонил)гуанидин, с получением арилхлорида, такого как 65. Затем группу Boc можно удалить с помощью кислоты, такой как TFA, с образованием свободных аминов, таких как 56, которые затем можно дополнительно подвергнуть реакции с гетероарильным галогенидом в условиях нуклеофильного ароматического замещения или в условиях реакции Бухвальда-Хартвига с образованием соединений, таких как 68. В качестве альтернативы, амин можно подвергнуть реакции с гетероароматическим галогенидом, который содержит сложный этиловый эфир, с получением сложного эфира, такого как 67. Сложный эфир можно гидролизовать водным раствором основания, такого как гидроксид лития, и полученную кислоту можно декарбоксилировать кислотой, такой как HCl, с получением примеров, таких как 68. В качестве альтернативы, соединения, предусмотренные в данном документе, можно получать как показано на схеме 11 ниже.
Схема 11
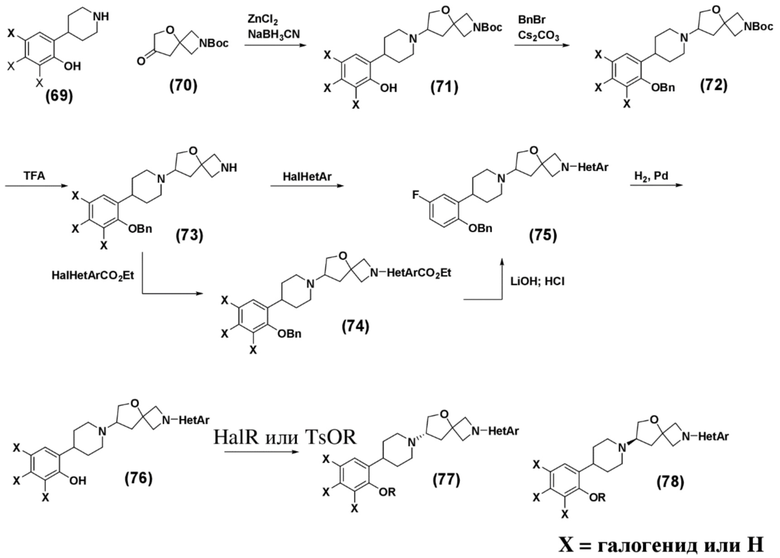
На схеме 11 пиперидины, такие как 69, можно подвергать реакции с кетонами, такими как 70, в условиях восстановительного аминирования, например обработки хлоридом цинка и цианоборгидридом натрия, с образованием углерод-азотных связей, таких как в 71. Затем фенол можно подвергнуть реакции присоединения защитной группы в виде бензильной группы с применением бензилбромида и основания, такого как карбонат цезия, и затем амин можно подвергнуть реакции удаления защитной группы с помощью кислоты, такой как TFA. Затем свободные амины, такие как 73, можно подвергнуть реакции с гетероароматическими галогенидами в условиях нуклеофильного ароматического замещения или в условиях реакции Бухвальда-Хартвига. В качестве альтернативы, свободные амины, такие как 73, можно подвергнуть реакции со сложным эфиром, содержащим гетероароматические галогениды, с образованием сложных эфиров, таких как 74. Затем сложный эфир можно гидролизовать с помощью водного раствора основания, такого как гидроксид лития, и полученную кислоту можно декарбоксилировать кислотой, такой как HCl, с получением гетероароматического соединения, такого как 75. Затем бензильную группу можно удалить с помощью гидрогенизации с применением палладиевого катализа и полученный фенол 76 можно подвергнуть реакции с галогенидом или тозилатом в присутствии основания, такого как карбонат цезия. Затем рацемическую смесь можно разделить с помощью, например, хиральной хроматографии с образованием отдельных энантиомеров 77 и 78.
7. ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Полное раскрытие каждого из патентных документов и научных статей, цитируемых в данном документе, включено посредством ссылки для всех целей.
8. ПРИМЕРЫ
Настоящее изобретение дополнительно проиллюстрировано с помощью следующих примеров, которые предназначены только для иллюстрации и не для ограничения каким-либо образом. Следует понимать, что можно прибегнуть к разнообразным другим вариантам осуществления, их модификациям и эквивалентам, которые могут предложить специалисты в данной области техники, не отступая от сущности настоящего изобретения и/или объема прилагаемой формулы изобретения.
1. Синтез промежуточных соединений и примеры
Используемые сокращения являются общепринятыми в области техники или означают приведенное ниже.
Å ангстрем(ангстремы)
AcOH уксусная кислота
водн. водный
ATP аденозинтрифосфат
AUC площадь под кривой
BOC трет-бутилоксикарбонил
tBu трет-бутил
C градусы Цельсия
CDI карбонилдиимидазол
CMBG 2-хлор-1,3-бис(метоксикарбонил)гуанидин
DCE 1,2-дихлорэтан
DCM дихлорметан
DIPEA N, N-диизопропилэтиламин
DME 1,4-диметоксиэтан
DMEM среда Игла, модифицированная по Дульбекко
DMF N, N-диметилформамид
DMSO диметилсульфоксид
DPBS фосфатно-солевой буферный раствор по Дульбекко
EtOAc этилацетат
EtOH этиловый спирт
FBS фетальная бычья сыворотка
FCC колоночная флэш-хроматография
г грамм(граммы)
ч. час(часы)
HATU 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3- оксида гексафторфосфат
HBSS сбалансированный солевой раствор Хенкса
HBTU 1-[бис(диметиламино)метилен]-1H-бензoтриазолия гексафторфосфат(1-)-3-оксид
Гц герц
HOBt 1-гидрокси-7-азабензотриазол
HPLC жидкостная хроматография высокого давления
IP внутрибрюшинный
IPA изопропиловый спирт
J константа взаимодействия
кг килограмм(килограммы)
л литр(литры)
LCMS жидкостная хроматография и масс-спектрометрия
LED светодиод
Me метил
MГц мегагерц
мМ ммоль
MTBE метил-трет-бутиловый эфир
MS масс-спектрометрия
мин. минута(минуты)
мг миллиграмм(миллиграммы)
мл миллилитр(миллилитры)
ммоль миллимоль(миллимоли)
масса/заряд соотношение массы и заряда
нм нанометр(нанометры)
нМ нмоль/л
ЯМР ядерный магнитный резонанс
Pd/C, Pd-C палладий на угле
Pd(dba)2 бис(дибензилиденацетон)палладий(0)
Pd2(dba)3 трис(дибензилиденацетон)дипалладий(0)
Pd(dppf)Cl2 дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II)
PO перорально(пероральное введение)
фунты/кв. дюйм фунты на квадратный дюйм
pTSCl пара-толуолсульфонилхлорид
rac рацемический
RB круглодонный
об./мин. обороты в минуту
к. т. комнатная температура
Rt время удерживания
SFC сверхкритическая флюидная хроматография
SC подкожный
TBTU 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметиламиния тетрафторборат
TC культивирование тканей
TEA триэтиламин
TFA трифторуксусная кислота
THF тетрагидрофуран
TPGS-750-M раствор сукцината DL-α-токоферола-метоксиполиэтиленгликоля
TTMSS трис(триметилсилил)силан
мкл микролитр(микролитры)
мкМ мкмоль/л
UPLC сверхэффективная жидкостная хроматография
УФ ультрафиолетовое излучение
Xantphos 4,5-бис(дифенилфосфино)-9,9-диметилксантен
XPhosPd G2 хлор(2-дициклогексилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил)[2-(2′-амино-1,1′-бифенил)]палладий(II)
Общие процедуры
Если путь получения не описан, материал является коммерчески доступным. Коммерческие реагенты применяли без дополнительной очистки, если не указано иное. Комнатная температура (к. т.) составляет примерно 20-25°C. 1H ЯМР регистрировали при 400 МГц на приборе Bruker и обрабатывали с помощью mNOVA. Химические сдвиги приведены в виде частей на миллион (ppm) относительно тетраметилсилана, и константы взаимодействия (J) приведены в герцах. Сокращения для мультиплетности являются следующими: s=синглет, d=дублет, t=триплет, q=квартет, dd=дублет дублетов, dt=дублет триплетов, br=широкий.
Способ 1 LCMS.
Прибор: Waters Acquity UPLC, детектор с фотодиодной матрицей; колонка: AcQuity UPLC BEH C18 1,7 мкм, 21×30 мм; время прогона 2 мин., 2% растворитель B от 0 до 0,1 мин., 2 → 98% растворитель B:растворитель A от 0,1 до 1,8 мин., 98% растворитель B в течение 0,2 мин. Растворители: растворитель A=0,1% муравьиная кислота в воде (об./об.), растворитель B=0,1% муравьиная кислота в ацетонитриле (об./об.). Объем вводимой пробы 2-5 мкл; матрица для ультрафиолетового обнаружения 210-400, диапазон определяемой массы 120-1250 (ионизация электрораспылением); колонка при 50°C; скорость потока 1,0 мл/мин.
Способ 2 LCMS.
Прибор: Waters Acquity UPLC, детектор с фотодиодной матрицей; колонка: AcQuity UPLC BEH C18 1,7 мкм, 21×50 мм; время прогона 2 мин., 2% растворитель B от 0 до 0,1 мин., 2 → 98% растворитель B:растворитель A от 0,1 до 1,8 мин., 98% растворитель B в течение 0,2 мин. Растворители: растворитель A=5 мM гидроксид аммония в воде, растворитель B=5 мM гидроксид аммония в ацетонитриле. Объем вводимой пробы 2-5 мкл; матрица для ультрафиолетового обнаружения 210-400, диапазон определяемой массы 120-1250 (ионизация электрораспылением); колонка при 50°C; скорость потока 1,0 мл/мин.
Способ 3 LCMS.
Прибор: Waters Acquity UPLC, детектор с фотодиодной матрицей; колонка AcQuity UPLC BEH C18 1,7 мкм, 21×30 мм; время прогона 5,2 мин., 2 → 98% растворитель B:растворитель A от 0 до 5,15 мин., 98% растворитель B от 5,15 до 5,20 мин. Растворители: растворитель A=0,1% муравьиная кислота в воде (об./об.), растворитель B=0,1% муравьиная кислота в ацетонитриле (об./об.). Объем вводимой пробы 2-5 мкл; матрица для ультрафиолетового обнаружения 210-400, диапазон определяемой массы 120-1600; колонка при 50°C, скорость потока 1,0 мл/мин.
Способ 4 LCMS.
Прибор: Waters Acquity UPLC, детектор с фотодиодной матрицей; колонка AcQuity UPLC BEH C18 1,7 мкм, 21×30 мм; время прогона 5,2 мин., 2 → 98% растворитель B:растворитель A от 0 до 5,15 мин., 98% растворитель B от 5,15 до 5,20 мин. Растворители: растворитель A=5 мM гидроксид аммония в воде, растворитель B=5 мM гидроксид аммония в ацетонитриле. Объем вводимой пробы 2-5 мкл; матрица для ультрафиолетового обнаружения 210-400, диапазон определяемой массы 120-1600; колонка при 50°C, скорость потока 1,0 мл/мин.
Промежуточное соединение 1A. 3-(2-(Бензилокси)фенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
Стадия 1. 4-(2-(Бензилокси)фенил)тетрагидро-2H-пиран-2-он
Гидроксид калия (3,95 г, 70,3 ммоль) в воде (17,50 мл) добавляли по каплям к раствору [RhCl(COD)]2 (0,347 г, 0,703 ммоль), (2-(бензилокси)фенил)бороновой кислоты (коммерчески доступной, 22,46 г, 98 ммоль) и 5,6-дигидро-2H-пиран-2-она (коммерчески доступного, 6,06 мл, 70,3 ммоль) в 1,4-диоксане (175 мл) при 0°C в течение периода 2 минут. Затем температуру реакционной смеси повышали до 35°C и перемешивали в течение 16 ч. Реакционную смесь разбавляли с помощью EtOAc и 2 M HCl. Водный раствор разделяли и снова экстрагировали с помощью EtOAc. Объединенные органические слои высушивали над MgSO4 и растворитель удаляли при пониженном давлении. Неочищенную смесь затем очищали с помощью FCC (0 → 60% EtOAc/гептаны) с получением указанного в заголовке соединения (19,49 г, 68,3 ммоль).
LCMS: Rt= 1,03 мин. (способ 1 LCMS); MS масса/заряд 281,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,49-7,27 (m, 5H), 7,20 (ddd, J=14,8, 7,5, 1,8 Гц, 2H), 7,05 (dd, J=8,1, 1,2 Гц, 1H), 6,99-6,89 (m, 1H), 5,13 (s, 2H), 4,49-4,27 (m, 2H), 3,71-3,50 (m, 1H), 2,85 (dd, J=17,2, 6,4 Гц, 1H), 2,68 (dd, J=17,2, 9,8 Гц, 1H), 2,10 (m, 2H).
Стадия 2. 3-(2-(Бензилокси)фенил)пентан-1,5-диол
Алюмогидрид лития (76 мл, 76 ммоль, 1 M в THF) добавляли к перемешиваемому раствору 4-(2-(бензилокси)фенил)тетрагидро-2H-пиран-2-она (19,49 г, 69,0 ммоль) в безводном THF (400 мл) при 0°C и затем реакционную смесь перемешивали в течение 2 ч. при 0°C. Реакционную смесь гасили водой при -5°C до тех пор, пока не прекращалось образование газа, и затем к смеси порциями добавляли раствор NaOH (25 г) в воде (25 мл) при 0°C. Затем добавляли к реакционной смеси Na2SO4 (300 г) и перемешивали в течение 60 мин. Смесь фильтровали и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью FCC (0-10% MeOH/DCM) с получением указанного в заголовке соединения (19,3 г, 64,1 ммоль).
LCMS: Rt= 0,85 мин. (способ 1 LCMS); MS масса/заряд 287,3 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,51-7,31 (m, 5H), 7,26-7,16 (m, 2H), 7,07-6,95 (m, 2H), 5,11 (s, 2H), 3,61-3,35 (m, 5H), 1,92 (m, 4H), 1,66 (s, 2H).
Стадия 3. 3-(2-(Бензилокси)фенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
К раствору 3-(2-(бензилокси)фенил)пентан-1,5-диoла (19,31 г, 67,4 ммоль) и триэтиламина (41,4 мл, 297 ммоль) в MeCN (40 мл) при -5°C добавляли pTsCl (28,3 г, 148 ммоль) и DMAP (0,824 г, 6,74 ммоль). После добавления реакционную смесь перемешивали при к. т. в течение ночи. Растворитель удаляли при пониженном давлении. Неочищенный продукт растворяли в DCM и промывали водой и солевым раствором, затем высушивали над Na2SO4 и фильтровали. DCM удаляли при пониженном давлении и неочищенный продукт очищали с помощью FCC (0 → 50% EtOAc/гептаны) с получением указанного в заголовке соединения.
LCMS: Rt= 1,37 мин.
1H ЯМР (400 МГц, CDCl3) δ 7,74-7,63 (m, 4H), 7,46-7,33 (m, 5H), 7,30 (s, 4H), 7,20-7,13 (m, 1H), 6,99-6,72 (m, 3H), 5,00 (s, 2H), 4,01-3,61 (m, 4H), 3,15 (m, 1H), 2,45 (s, 6H), 2,03 (m, 2H), 1,89 (m, 2H).
Промежуточное соединение 1B. 3-(2-(Бензилокси)-5-фторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
Стадия 1. 4-(2-(Бензилокси)-5-фторфенил)тетрагидро-2H-пиран-2-он
(5-(Бензилокси)-2-фторфенил)бороновую кислоту (коммерчески доступную, 24 г, 98 ммоль), 5,6-дигидро-2H-пиран-2-он (коммерчески доступный, 6,06 мл, 70,3 ммоль) и [RhCl(COD)]2 (0,5 г, 1,014 ммоль) растворяли в диоксане (180 мл) и охлаждали до -10°C. Затем гидроксид калия (4,38 г, 78 ммоль) растворяли в воде (17,8 мл) и добавляли к раствору в диоксане по каплям в течение 10 мин. Затем реакционную смесь нагревали до 35°C и перемешивали в течение 2 часов. Реакционную смесь нейтрализовали с помощью 1 M HCl (до pH 3), затем концентрировали под вакуумом с удалением диоксана. Затем остаток разбавляли водой и экстрагировали с помощью EtOAc, органические вещества объединяли и концентрировали под вакуумом. Неочищенный продукт очищали с помощью FCC (0 → 100% EtOAc/гептаны) с получением указанного в заголовке соединения (19,65 г, 78 ммоль).
LCMS: RT= 1,07 мин. (способ 2 LCMS); MS масса/заряд 301,4 [M+H]+.
Стадия 2. 3-(2-(Бензилокси)-5-фторфенил)пентан-1,5-диoл
Алюмогидрид лития (31,2 мл, 71,8 ммоль) добавляли к перемешиваемому раствору 4-(2-(бензилокси)-5-фторфенил)тетрагидро-2H-пиран-2-она (19,6 г, 65,3 ммоль) в сухом THF (384 мл) при 0°C. Реакционную смесь перемешивали в течение 2 ч. при -5°C в атмосфере N2. Реакционную смесь гасили H2O (10 мл) при -5°C до тех пор, пока не прекращалось образование газа, и затем порциями добавляли раствор NaOH (25 г) в воде (25 мл) к смеси при 0°C. К реакционной смеси добавляли Na2SO4 (300 г) и перемешивали в течение 60 мин. Смесь фильтровали и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью FCC (0-10% MeOH/DCM) с получением указанного в заголовке соединения (17,8 г, 55,6 ммоль).
LCMS: Rt= 0,90 мин. (способ 2 LCMS); MS масса/заряд 304,4 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,47-7,33 (m, 5H), 6,97-6,84 (m, 3H), 5,06 (s, 2H), 3,60-3,47 (m, 2H), 3,41 (m, 2H), 2,06-1,91 (m, 3H), 1,77 (m, 2H).
Стадия 3. 3-(2-(Бензилокси)-5-фторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
3-(2-(Бензилокси)-5-фторфенил)пентан-1,5-диoл (17,8 г, 58,5 ммоль) и TEA (35,9 мл, 257 ммоль) растворяли в MeCN (200 мл) и охлаждали до -5°C. Добавляли pTsCl (24,53 г, 129 ммоль) и DMAP (0,714 г, 5,85 ммоль), и реакционную смесь нагревали до к. т., и перемешивали в течение ночи. Растворитель удаляли при пониженном давлении. Неочищенный продукт растворяли в DCM и промывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали с помощью FCC (0 → 50% EtOAc/гептаны) с получением указанного в заголовке соединения (22,8 г, 37,2 ммоль).
LCMS Rt= 1,37 мин. (способ 2 LCMS); MS масса/заряд 630,4 [M+NH4]+.
Промежуточное соединение 1C. 3-(2-(Бензилокси)-4-фторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
Стадия 1. 2-(Бензилокси)-4-фтор-1-(гепта-1,6-диeн-4-ил)бензол
В круглодонную колбу объемом 250 мл загружали 2-(бензилокси)-4-фторбензальдегид (коммерчески доступный, 23,90 г, 104 ммоль) с последующим добавлением нитрометана (250 мл). Затем к реакционной смеси добавляли хлорид иттербия(III) (7,25 г, 26,0 ммоль) и смесь перемешивали в течение 15 мин. при к. т. После 15 мин. перемешивания медленно добавляли аллилтриметилсилан (41,2 мл, 260 ммоль) в течение 5 мин. Смесь перемешивали в течение ночи при к. т. Реакционную смесь концентрировали и неочищенный продукт очищали с помощью FCC (0 → 30% EtOAc/гептаны) с получением указанного в заголовке соединения в виде прозрачного бесцветного масла (22,64 г, 72,6 ммоль).
LCMS: Rt= 1,43 мин. (Способ 1 LCMS).
1H ЯМР (400 МГц, CDCl3) δ 7,38-7,19 (m, 5H), 6,97 (dd, 1H), 6,61-6,47 (m, 2H), 5,57 (m, 2H), 4,95 (s, 2H), 4,90-4,78 (m, 4H), 3,19 (t, 1H), 2,29 (m, 4H).
Стадия 2. 3-(2-(Бензилокси)-4-фторфенил)пентан-1,5-диoл
2-(Бензилокси)-4-фтор-1-(гепта-1,6-диeн-4-ил)бензол (22,64 г, 76 ммоль) растворяли в MeOH (450 мл) и охлаждали до -78°C. Далее барботировали озон через реакционную смесь в течение 120 мин., на протяжении этого времени реакционная смесь становилась бледно-пурпурного цвета. Затем барботировали азот через реакционную смесь в течение 20 мин. и затем нагревали ее до 0°C, и NaBH4 (28,9 г, 764 ммоль) добавляли частями к реакционной смеси в течение 4 ч., и затем реакционную смесь перемешивали в течение 16 часов при к. т. Затем реакционную смесь выливали в DCM и добавляли насыщенный NH4Cl, и смесь перемешивали при к. т. в течение 1 ч. Органический слой разделяли и промывали водой и солевым раствором, затем высушивали над Na2SO4 и фильтровали. Растворитель удаляли при пониженном давлении. Полученный продукт (15,22 г, 50,0 ммоль) переносили на следующую стадию без дополнительной очистки.
LCMS: Rt= 0,90 мин. (способ 1 LCMS); MS масса/заряд 305,2 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,36-7,22 (m, 6H), 7,03 (m, 1H), 6,64-6,57 (m, 2H), 4,95 (s, 2H), 3,42 (m, 2H), 3,31 (m, 2H), 1,92-1,81 (m, 2H), 1,79-1,64 (m, 2H).
Стадия 3. 3-(2-(Бензилокси)-4-фторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
3-(2-(Бензилокси)-4-фторфенил)пентан-1,5-диoл (6,96 г, 22,87 ммоль) растворяли в MeCN (150 мл), и добавляли TEA (13,63 мл, 98 ммоль), и реакционную смесь охлаждали до 0°C. Реакционную смесь инкубировали в течение 10 мин. и затем добавляли pTsCl (9,59 г, 50,3 ммоль) и DMAP (0,559 г, 4,57 ммоль). Реакционную смесь медленно нагревали до к. т. и перемешивали в течение ночи. Затем реакционную смесь разбавляли водой и экстрагировали с помощью DCM. Объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали. Затем остаток очищали с помощью FCC (0 → 60% EtOAc/гептаны) с получением указанного в заголовке соединения (8,91 г, 14,54 ммоль).
LCMS: Rt= 1,35 мин. (способ 1 LCMS); MS масса/заряд 630,3 [M+NH4]+.
1H ЯМР (400 МГц, CDCl3) δ 7,68-7,61 (m, 4H), 7,42-7,32 (m, 5H), 7,27 (m, 4H), 6,57 (dd, J=10,9, 2,4 Гц, 1H), 6,46 (td, J=8,3, 2,4 Гц, 1H), 4,93 (s, 2H), 3,90-3,80 (m, 2H), 3,74 (m, 2H), 3,08 (m, 1H), 2,43 (s, 6H), 1,98 (m, 3H), 1,92-1,80 (m, 2H).
Промежуточное соединение 1D. 3-(2-(Бензилокси)-4,5-дифторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
Стадия 1. 4,5-Дифтор-2-(гепта-1,6-диен-4-ил)фенол
В трехгорлую колбу объемом 1 л загружали YbCl3•6H2O (20 г, 51 ммоль), который обезвоживали посредством нагревания в вакууме. Затем в колбу при 25°С добавляли 4,5-дифтор-2-гидроксибензальдегид (20 г, 126 ммоль) в нитрометане (200 мл). После 30-минутного перемешивания по каплям добавляли аллилтриметилсилан (51 г, 443 ммоль) при 25°C. Затем смесь нагревали до 60°С и перемешивали в течение 16 часов. Затем реакционную смесь охлаждали до 25°С, фильтровали и концентрировали. Затем к неочищенной реакционной смеси добавляли MeCN (200 мл) и 2 н. HCl (200 мл) и полученный раствор перемешивали в течение 30 мин. при 25°C. MeCN удаляли in vacuo, а оставшуюся водную фазу экстрагировали EtOAc, высушивали над Na2SO4, фильтровали и концентрировали. Неочищенное вещество очищали с помощью FCC (0-10% EtOAc/петролейный эфир) с получением указанного в заголовке соединения в виде желтой жидкости (14,5 г, 64,66 ммоль).
1H ЯМР (400 МГц, CDCl3) δ 6,90 (dd, J=8,9, 11,6 Гц, 1H), 6,62 (dd, J=6,8, 11,2 Гц, 1H), 5,68 (m, 2H), 5,56 (br s, 1H), 5,07-4,92 (m, 4H), 3,16-3,03 (m, 1H), 2,48-2,24 (m, 4H).
Стадия 2. 3-(4,5-Дифтор-2-гидроксифенил)пентан-1,5-диол
К перемешиваемому раствору 4,5-дифтор-2-(гепта-1,6-диен-4-ил)фенола (14,5 г, 64,66 ммоль) в MeOH (150 мл) при -78°C барботировали озон через реакционную смесь в течение 3 ч. до израсходования исходного материала и становления реакционной смеси бледно-фиолетовой. Барботирование озоном прекращали и избыток озона в реакционной смеси удаляли посредством барботирования N2 через реакционную смесь в течение 10 мин. Затем реакционную смесь нагревали до -20°C и порциями добавляли NaBH4 (14,68 г, 387,96 ммоль), реакционную смесь нагревали до 0°C и перемешивали в течение 2 часов. Реакционную смесь гасили насыщенным водным раствором NH4Cl и удаляли MeOH при пониженном давлении. Водный слой затем экстрагировали с помощью EtOAc и объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали. Остаток очищали посредством FCC (0-75% EtOAc/петролейный эфир). Выделенный материал затем дополнительно очищали (0-5% MeOH/DCM) с получением указанного в заголовке соединения (3,1 г, 13,35 ммоль) в виде желтого твердого вещества.
1H ЯМР (400 МГц, DMSO-d6) δ 9,58 (s, 1H), 7,09 (dd, J=9,5, 12,1 Гц, 1H), 6,70 (dd, J=7,3, 12,4 Гц, 1H), 4,28 (t, J=5,1 Гц, 2H), 3,27-3,18 (m, 3H), 3,07 (m, 1H), 1,76-1,64 (m, 3H).
Стадия 3. 3-(2-(Бензилокси)-4,5-дифторфенил)пентан-1,5-диол
3-(4,5-Дифтор-2-гидроксифенил)пентан-1,5-диол (3,46 г, 14,90 ммоль) добавляли в круглодонную колбу объемом 250 мл и растворяли в ацетоне (100 мл). Добавляли K2CO3 (3,09 г, 22,35 ммоль) и бензилбромид (1,86 мл, 15,64 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 3 ч. Затем реакционную смесь охлаждали до комнатной температуры и ацетон выпаривали при пониженном давлении. Остаток растворяли в DCM и промывали водой, а затем водный слой снова экстрагировали с помощью DCM. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. Затем неочищенное вещество очищали посредством FCC (0-10% MeOH/DCM) с получением указанного в заголовке соединения (4,75 г, 14,74 ммоль).
LCMS: Rt= 0,89 мин. (способ 2 LCMS); MS масса/заряд 321,2 [M-H]-.
Стадия 4. 3-(2-(Бензилокси)-4,5-дифторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
3-(2-(Бензилокси)-4,5-дифторфенил)пентан-1,5-диол (4,72 г, 14,64 ммоль) и pTsCl (6,42 г, 33,7 ммоль) растворяли в MeCN (70 мл) при комнатной температуре. Затем к раствору добавляли DMAP (0,179 г, 1,464 ммоль) и триэтиламин (8,16 мл, 58,6 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем MeCN выпаривали, а остаток разбавляли водой и экстрагировали с помощью DCM. Органические экстракты объединяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали. Неочищенное вещество очищали посредством FCC (0-10% MeOH/DCM) с получением указанного в заголовке соединения (7,47 г, 11,8 ммоль).
LCMS: Rt= 1,36 мин. (способ 1 LCMS); MS масса/заряд 648,6 [M+NH4]+.
Промежуточное соединение 1E. 3-(2-(Тетрагидро-2H-пиран-4-ил)фенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
Стадия 1. 4-(2-Бромфенил)тетрагидро-2H-пиран-2-он
Раствор гидроксида калия (5,15 г, 92 ммоль) в воде (10 мл) добавляли по каплям к раствору [RhCl(COD)]2 (0,452 г, 0,917 ммоль), (2-бромфенил)бороновой кислоты (27,6 г, 138 ммоль) и 5,6-дигидро-2H-пиран-2-она (8,78 мл, 92 ммоль) в 1,4-диоксане (200 мл) при 0°C в течение 10 мин. Затем температуру реакционной смеси повышали до 35°С и реакционную смесь перемешивали в течение 16 часов. Реакционную смесь разбавляли с помощью EtOAc и 3 M HCl. Водный раствор разделяли и снова экстрагировали с помощью EtOAc. Объединенные органические слои высушивали над MgSO4 и растворитель удаляли при пониженном давлении. Остаток очищали с помощью FCC (0-60% EtOAc/гептаны) с получением указанного в заголовке соединения (12,9 г, 50,4 ммоль).
LCMS: Rt= 0,85 мин. (способ 2 LCMS); MS масса/заряд 255,3 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,53 (t, J=6,9 Гц, 1H), 7,34-7,21 (m, 1H), 7,17 (dd, J=7,8, 2,2 Гц, 1H), 7,09 (q, J=6,9 Гц, 1H), 4,39 (m, 2H), 3,66 (m, 1H), 2,93 (m, 1H), 2,57-2,47 (m, 1H), 2,16 (m, 1H), 1,98 (m, 1H).
Стадия 2. 3-(2-Бромфенил)пентан-1,5-диол
Раствор борогидрида лития (16,66 мл, 33,3 ммоль, 2 М в THF) добавляли к перемешиваемому раствору 4-(2-бромфенил)тетрагидро-2Н-пиран-2-она (5,00 г, 19,60 ммоль) в смеси THF (50 мл) и МеОН (0,50 мл) при 0°С. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 18 ч. Затем THF удаляли при пониженном давлении и реакционную смесь разбавляли EtOAc и водой. pH водной фазы регулировали до 7 уксусной кислотой и затем экстрагировали с помощью EtOAc. Затем объединенные органические слои высушивали над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали с помощью FCC (0-10% MeOH/DCM) с получением указанного в заголовке промежуточного соединения (4,70 г, 18,1 ммоль).
LCMS: Rt= 1,27 мин. (способ 3 LCMS); MS масса/заряд 241,2 [M-H2O]+.
1H ЯМР (400 МГц, DMSO-d6) δ 7.55 (d, J=7,7 Гц, 1H), 7,39-7,31 (m, 2H), 7,11 (dt, J=8,6, 4,4 Гц, 1H), 4,35 (t, J=4,9 Гц, 2H), 3,34-3,14 (m, 5H), 1,85-1,66 (m, 4H).
Стадия 3. 3-(2-(3,6-Дигидро-2H-пиран-4-ил)фенил)пентан-1,5-диол
3-(2-Бромфенил)пентан-1,5-диол (14,0 г, 54,0 ммоль), 2-(3,6-дигидро-2Н-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (17,02 г, 81 ммоль), [1,1'-бис(ди-трет-бутилфосфино)ферроцен]дихлорпалладий(II) (1,761 г, 2,70 ммоль) и трехосновный фосфат калия (20,64 г, 97 ммоль) суспендировали в дегазированном 1,4-диоксане (150 мл) и воде (15,00 мл) и реакционную смесь перемешивали при к. т. в течение 16 ч. Затем реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc. Органический слой высушивали над MgSO4, фильтровали и концентрировали. Неочищенное вещество очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно очищали посредством перекристаллизации из EtOAc/гептанов (1:1) с получением указанного в заголовке соединения в виде белого твердого вещества (9,85 г, 37,5 ммоль).
LCMS: Rt= 0,70 мин. (способ 2 LCMS); MS масса/заряд 261,3 [M-H]-.
1H ЯМР (400 МГц, DMSO-d6) δ 7,25 (d, J=7,6 Гц, 2H), 7,12 (t, J=7,5 Гц, 1H), 7,02 (d, J=7,7 Гц, 1H), 5,51 (s, 1H), 4,27 (t, J=5,0 Гц, 2H), 4,15 (q, J=2,9 Гц, 2H), 3,79 (t, J=5,3 Гц, 2H), 3,19 (m, 4H), 3,04 (m,1H), 2,24 (m, 2H), 1,71 (m, 4H).
Стадия 4. 3-(2-(Тетрагидро-2H-пиран-4-ил)фенил)пентан-1,5-диол
3-(2-(3,6-Дигидро-2H-пиран-4-ил)фенил)пентан-1,5-диол (7,60 г, 29,0 ммоль) растворяли в MeOH (75 мл) и добавляли 10% палладий на угле (3,08 г, 2,90 ммоль). Колбу продували водородом из 3 баллонов, а затем реакционную смесь перемешивали в атмосфере водорода из баллона в течение 18 ч. Реакционную смесь фильтровали через слой целита и концентрировали с получением неочищенного продукта в виде белого твердого вещества. Этот материал объединяли с параллельной реакционной смесью исходного 3-(2-(3,6-дигидро-2H-пиран-4-ил)фенил)пентан-1,5-диола (3,30 г, 12,6 ммоль) для перекристаллизации. Объединенные твердые вещества перекристаллизовывали из смеси EtOH/гептаны с получением указанного в заголовке соединения (9,95 г, 37,6 ммоль) в виде белого твердого вещества.
LCMS: 1,29 мин. (способ 3 LCMS); MS масса/заряд 265,3 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,26-7,18 (m, 2H), 7,14 (m, 2H), 3,93 (dd, J=11,1, 3,6 Гц, 2H), 3,43 (t, J=11,6, 3H), 3,31 (bs, 1H), 3,30-3,20 (m, 3H), 3,15 (m, 3H), 1,79 (m, 2H), 1,68 (m, 4H), 1,56 (m, 2H).
Стадия 4. 3-(2-(Тетрагидро-2H-пиран-4-ил)фенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
3-(2-(Тетрагидро-2Н-пиран-4-ил)фенил)пентан-1,5-диол (7050 мг, 26,7 ммоль) суспендировали в MeCN (70 мл) и THF (70 мл) и охлаждали до 0°С. Затем добавляли DMAP (326 мг, 2,67 ммоль) и TEA (16,4 мл, 117 ммоль). Реакционную смесь охлаждали до 0°C и перемешивали в течение 15 минут, затем четырьмя порциями добавляли тозилангидрид (19,19 г, 58,7 ммоль) и неоднородную коричневую реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 16 часов. Затем добавляли дополнительное количество тозилангидрида (4,5 г, 13,8 ммоль) и реакционную смесь перемешивали еще в течение часа. Затем реакционную смесь концентрировали и остаток растворяли в EtOAc и органическую фазу промывали водой и солевым раствором. Объединенные водные тонкие слои повторно экстрагировали с помощью EtOAc и объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали на целите. Неочищенное вещество затем очищали с помощью FCC (0-60% EtOAc/гептаны) с получением указанного в заголовке промежуточного соединения в виде бледно-желтого твердого вещества (10336 мг, 18,05 ммоль).
LCMS: Rt= 2,96 мин. (способ 3 LCMS); MS масса/заряд 573,3 [M+H]+ .
1H ЯМР (400 МГц, DMSO-d6) δ 7,73-7,65 (m, 4H), 7,44 (d, J=8,3 Гц, 4H), 7,23 (d, J=7,4 Гц, 1H), 7,21-7,07 (m, 3H), 3,86 (m, 4H), 3,69 (m, 2H), 3,35 (d, J=10,3 Гц, 5H), 3,23 (s, 1H), 2,97 (t, J=11,6 Гц, 1H), 2,41 (s, 6H), 1,91 (m, 2H), 1,86-1,73 (m, 2H), 1,62 (m, 2H), 1,41 (d, J=12,1 Гц, 2H).
Промежуточное соединение 1F. 3-(2-(Бензилокси)-3,5-дифторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
Стадия 1. 4-(2-(Бензилокси)-3,5-дифторфенил)тетрагидро-2H-пиран-2-он
В круглодонной колбе раствор 5,6-дигидро-2Н-пиран-2-она (0,298 мл, 3,47 ммоль), (3,5-дифтор-2-метоксифенил)бороновой кислоты (0,915 г, 3,47 ммоль) и [RhCl(COD)]2 (0,034 г, 0,069 ммоль) в 1,4-диоксане (8,6 мл) охлаждали до 0°С и раствор гидроксида калия (0,194 г, 3,47 ммоль) в воде (0,9 мл) добавляли по каплям. Затем реакционную смесь нагревали до 35°C и перемешивали в течение 15 минут. Реакционную смесь затем разбавляли с помощью EtOAc и 1 M HCl. Слои разделяли и водн. фазу экстрагировали с помощью EtOAc (2×50 мл). Объединенные органические слои высушивали над MgSO4, фильтровали и концентрировали, а неочищенное вещество очищали с помощью FCC (0-100% EtOAc/гептаны) с получением указанного в заголовке промежуточного соединения в виде прозрачного бесцветного масла (784 мг, 2,46 ммоль).
LCMS: Rt: 1,07 мин. (способ 1 LCMS); MS масса/заряд 319,2 [M+H]+.
Стадия 2. 3-(2-(Бензилокси)-3,5-дифторфенил)пентан-1,5-диол
В круглодонной колбе к раствору 4-(2-(бензилокси)-3,5-дифторфенил)тетрагидро-2Н-пиран-2-она (0,533 г, 1,674 ммоль) в THF (10 мл) при -5°C в атмосфере азота добавляли по каплям LiAlH4 (1,0 М в THF, 1,84 мл, 1,842 ммоль) в течение ~2 минут. После перемешивания в течение 35 минут реакционную смесь гасили водой (0,25 мл) при -5°C до прекращения образования газа, затем по каплям добавляли раствор NaOH (614 мг) в воде (0,614 мл) с последующим добавлением Na2SO4 (7,38 г). Реакционную смесь перемешивали в течение 1 часа и затем фильтровали через целит, промывая с помощью THF, и фильтрат концентрировали. Неочищенное вещество очищали с помощью FCC (0-20% MeOH (10% NH4OH)/DCM) с получением указанного в заголовке промежуточного соединения в виде прозрачного бесцветного масла (501 мг, 1,55 ммоль).
LCMS: Rt: 0,90 мин. (способ 1 LCMS); MS масса/заряд 323,5 [M+H]+.
Стадия 3. 3-(2-(Бензилокси)-3,5-дифторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
В круглодонной колбе к раствору 3-(2-(бензилокси)-3,5-дифторфенил)пентан-1,5-диола (0,501 г, 1,554 ммоль) в ацетонитриле (9,0 мл) добавляли триэтиламин (1,08 мл, 7,77 ммоль), и pTsCl (0,741 г, 3,89 ммоль), и DMAP (0,019 г, 0,155 ммоль). Реакционную смесь перемешивали в течение 16 часов и затем реакционную смесь концентрировали и остаток растворяли в DCM (50 мл) и промывали водой (2×10 мл) и солевым раствором (1×10 мл), высушивали над MgSO4, фильтровали и концентрировали. Остаток очищали с помощью FCC (0-80% EtOAc/гептаны) с получением указанного в заголовке соединения в виде желтого масла (772 мг, 1,22 ммоль).
LCMS: Rt: 1,38 мин. (способ 1 LCMS); MS масса/заряд 648,5 [M+NH4]+.
1H ЯМР (400 МГц, CD3OD) δ 7,71-7,60 (m, 4H), 7,47-7,32 (m, 9H), 6,88 (m, 1H), 6,58 (dt, J=9,3, 2,5 Гц, 1H), 3,83 (m, 2H), 3,69 (m, 2H), 3,22 (m, 1H), 2,45 (s, 6H), 1,92-1,66 (m, 4H). Два протона перекрыты пиком, соответствующим растворителю.
Промежуточное соединение 1G. 3-(2-Бром-5-фторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
Стадия 1. Триэтил-2-(2-бром-5-фторфенил)пропан-1,1,3-трикарбоксилат
Металлический натрий (25,25 г, 1,10 моль) добавляли несколькими партиями к EtOH (1,5 л) в потоке газообразного N2 и реакционную смесь перемешивали при 25°C до растворения твердого вещества. Затем к смеси добавляли диэтилмалонат (176 г, 1,10 моль) и перемешивали при 25°C в течение 30 минут, добавляли этил-(E)-3-(2-бром-5-фторфенил)акрилат (150 г, 0,55 моль; получение согласно Org. Biomol. Chem. 2012, 10, 3655-3661) к реакционной смеси и реакционную смесь перемешивали в течение 16 часов при 80°C. Затем реакционную смесь концентрировали и остаток очищали с помощью FCC (2-10% EtOAc/петролейный эфир) с получением указанного в заголовке промежуточного соединения (140 г, 323 ммоль) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ 7,51 (dd, J=5,5, 8,8 Гц, 1H), 7,02 (dd, J=3,1, 9,8 Гц, 1H), 6,83 (m, 1H), 4,38 (q, J=7,4, Гц, 1H), 4,24-4,18 (m, 2H), 4,10-3,97 (m, 4H), 3,92 (m, 1H), 2,91 (d, J=7,1 Гц, 2H), 1,23 (t, J=7,2 Гц, 3H), 1,13 (t, J=7,2 Гц, 6H).
Стадия 2. 3-(2-Бром-5-фторфенил)пентандиовая кислота
Триэтил-2-(2-бром-5-фторфенил)пропан-1,1,3-трикарбоксилат (140 г, 323 ммоль) растворяли в HCl (36,5%, 1 л) и перемешивали при 100°C в течение 48 часов. Раствор концентрировали с получением указанного в заголовке промежуточного соединения (109 г, 358 ммоль, неочищенный) в виде светло-желтого твердого вещества, которое применяли без дополнительной очистки.
1H ЯМР (400 МГц, DMSO-d6) δ 7,61 (m, 1H), 7,47-7,28 (m, 1H), 7,20-6,98 (m, 1H), 3,91-3,80 (m, 1H), 2,61 (m, 4H).
Стадия 3. 3-(2-Бром-5-фторфенил)пентан-1,5-диoл
К раствору 3-(2-бром-5-фторфенил)пентандиовой кислоты (105 г, неочищенная) в THF (1000 мл) по каплям добавляли B2H6 (172 мл, 17,2 ммоль, 10 M в диметилсульфиде) при 0°C. Затем раствор нагревали до к. т. и перемешивали в течение 2 часов. Реакционную смесь охлаждали до 0°C и гасили с помощью MeOH (500 мл) и HCl (250 мл, 4 M в EtOAc), и затем раствор концентрировали. Остаток очищали с помощью FCC (5-100% EtOAc: DCM (3:1)/петролейный эфир) с получением указанного в заголовке промежуточного соединения (43,3 г, 156 ммоль) в виде белого твердого вещества.
1H ЯМР (400 МГц, CD3OD) δ 7,58-7,54 (m, 1H), 7,12 (m, 1H), 6,89 (m, 1H), 3,55-3,38 (m, 5H), 2,00-1,79 (m, 4H).
Стадия 4. 3-(2-Бром-5-фторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
3-(2-Бром-5-фторфенил)пентан-1,5-диoл (5000 мг, 18,04 ммоль) помещали в круглодонную колбу объемом 250 мл и растворяли его в MeCN (100 мл). Затем добавляли TEA (11,1 мл, 79 ммоль) и DMAP (220 мг, 1,804 ммоль) и реакционную смесь и реакционную смесь охлаждали до 0°C. Реакционную смесь перемешивали в течение 10 минут при 0°C, и затем добавляли тозилангидрид (13000 мг, 39,8 ммоль), и реакционную смесь медленно нагревали до к. т., и реакционную смесь перемешивали в течение ночи. Затем материал концентрировали на целите для очистки с помощью FCC (0-60% EtOAc/гептаны) с получением указанного в заголовке промежуточного соединения в виде светло-коричневого масла (9700 мг, 16,57 ммоль).
LCMS: Rt: 3,00 мин. (способ 1 LCMS); MS масса/заряд 604,1 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,67 (m, 4H), 7,42 (dd, J=8,8, 5,5 Гц, 1H), 7,31 (d, J=8,0 Гц, 4H), 6,78 (m, 1H), 6,73-6,62 (m, 1H), 3,88 (m, 2H), 3,80 (dt, J=10,1, 6,9 Гц, 2H), 3,34 (s, 1H), 2,44 (s, 6H), 2,05-1,93 (m, 2H), 1,89 (bs, 2H).
Промежуточное соединение 1H. 3-(2-Бромфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
Стадия 1. Триэтил-2-(2-бромфенил)пропан-1,1,3-трикарбоксилат
Na (27,04 г, 1180 моль) добавляли несколькими партиями к EtOH (1,5 л) в потоке газообразного N2 и реакционную смесь перемешивали при 25°C до исчезновения твердого вещества. Затем добавляли диэтилмалонат (188 г, 1180 ммоль) и реакционную смесь перемешивали при 25°С в течение 30 мин. Затем к смеси добавляли этил-(Е)-3-(2-бромфенил)акрилат (150 г, 588 ммоль). Затем смесь перемешивали в течение 16 часов при 80°С. Реакционную смесь затем концентрировали и остаток очищали с помощью FCC (остаток очищали посредством колоночной хроматографии (2-20% EtOAc/петролейный эфир) с получением указанного в заголовке соединения (133 г, 320 ммоль) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ 7,57-7,48 (m, 1H), 7,30-7,18 (m, 2H), 7,11-7,00 (m, 1H), 4,48-4,36 (m, 1H), 4,24-4,13 (m, 2H), 4,07-3,90 (m, 5H), 3,00-2,84 (m, 2H), 1,26-1,20 (m, 3H), 1,13-0,99 (m, 6H).
Стадия 2. Диэтил-3-(2-бромфенил)пентандиоат
К раствору триэтил-2-(2-бромфенил)пропан-1,1,3-трикарбоксилата (133 г, 320 ммоль) в DMSO (500 мл) добавляли NaCl (56 г, 960 ммоль) и H2O (17 г, 960 ммоль). Смесь перемешивали при 160°C в течение 6 часов. Затем реакционную смесь гасили H2O (500 мл) и экстрагировали с помощью МТВЕ (3×500 мл) и объединенные органические фазы промывали солевым раствором (500 мл), затем высушивали над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке соединения в виде желтого масла, которое использовали без дополнительной очистки (105 г, 305 ммоль).
1H ЯМР (400 МГц, CDCl3) δ 7,58-7,55 (m, 1H), 7,28-7,25 (m, 2H), 7,10-7,08 (m, 1H), 4,20-4,15 (m, 1H), 4,09-4,04 (m, 4H), 2,79-2,70 (m, 4H), 1,19-1,15 (m, 6H).
Стадия 3. 3-(2-Бромфенил)пентан-1,5-диол
К суспензии алюмогидрида лития (29 г, 765 ммоль) в THF (800 мл) добавляли по каплям раствор диэтил-3-(2-бромфенил)пентандиоата (105 г, 305 ммоль) в THF (200 мл) при 0°С. Реакционную смесь перемешивали при 25°C в течение 2 часов, затем реакционную смесь по каплям добавляли к раствору 2 н. HCl (2 л) и затем экстрагировали с помощью EtOAc (3×500 мл). Объединенные органические фазы промывали солевым раствором (500 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с помощью FCC (10-100% EtOAc/DCM (3:1)/петролейный эфир) с получением белого твердого вещества. Затем твердое вещество растирали с EtOAc (100 мл) и фильтровали, осадок на фильтре промывали с помощью охлажденного EtOAc (2×50 мл) с получением указанного в заголовке соединения в виде белого твердого вещества (47,2 г, 182 ммоль).
1H ЯМР (400 МГц, CD3OD) δ 7,55-7,53 (m, 1H), 7,33-7,32 (m, 2H), 7,10-7,06 (m, 1H), 3,47-3,39 (m, 5H), 1,96-1,86 (m, 4H).
Стадия 4. 3-(2-Бромфенил)пентан-1,5-диилбис(4-метилбензолсульфонат)
3-(2-Бромфенил)пентан-1,5-диол (10 г, 38,6 ммоль) и DMAP (0,471 г, 3,86 ммоль) добавляли в круглодонную колбу объемом 500 мл и растворяли в MeCN (200 мл). Реакционную смесь охлаждали до 0°C и добавляли TEA (32,1 мл, 232 ммоль), реакционную смесь перемешивали в течение 10 минут, а затем добавляли pTsCl (16,92 г, 89 ммоль). Реакционную смесь затем медленно нагревали до к. т. и перемешивали в течение ночи. Реакционную смесь концентрировали, остаток растворяли в DCM и промывали 1 н. HCl (4×50 мл), и объединенные водные слои снова экстрагировали 1×50 мл DCM (1×50 мл). Объединенные органические слои промывали солевым раствором (1 × 10 мл), высушивали над сульфатом натрия и концентрировали. Затем неочищенное вещество очищали с помощью FCC (0-50% EtOAc/гептаны) с получением указанного в заголовке соединения (19,52 г, 34,4 ммоль) в виде желтого масла.
1H ЯМР (400 МГц, DMSO-d6) δ 7,70-7,62 (m, 4H), 7,49 (dd, J=8,2, 1,4 Гц, 1H), 7,41 (d, J=8,2, Гц, 4H), 7,25 (m, 1H), 7,20-7,13 (m, 1H), 7,13-7,07 (m, 1H), 3,83 (dt, J=9,8, 5,9 Гц, 2H), 3,70 (dt, J=9,9, 6,6 Гц, 2H), 3,20 (dd, J=14,0, 7,0 Гц, 1H), 2,40 (s, 6H), 1,97-1,77 (m, 4H).
Промежуточное соединение 2A. трет-Бутил-(S)-7-амино-5-окса-2-азаспиро[3.4]октан-2-карбоксилата гидрохлорид
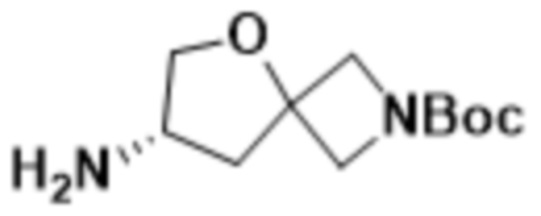
трет-Бутил-7-оксо-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (коммерчески доступный, 200 г, 0,88 моль), изопропиламина гидрохлорид (845 г, 8,89 моль) и пиридоксаль-5'-фосфатгидрат (10 г, 0,04 моль) растворяли в DMSO (800 мл) и 0,1 М боратном буфере (6200 мл, рН 9,0). Затем реакционную смесь нагревали до 40°C и добавляли раствор ATA412 (Codexis, 20 г) в 0,1 М боратном буфере (400 мл, pH 9,0). N2 барботировали через раствор и реакционную смесь перемешивали до достижения полного превращения. Затем реакционную смесь охлаждали до 26°C и добавляли лимонную кислоту до тех пор, пока pH не достиг значения 4,88. Добавляли DCM (1500 мл) и слой DCM фильтровали через микрокристаллическую целлюлозу для удаления фермента. Водный слой обрабатывали NaCl (1200 мг, 20,5 моль) и регулировали pH с помощью 32% раствора NaOH до 9,9. Водный слой экстрагировали с помощью DCM (3 × 2000 мл). Экстракты DCM и фильтрат объединяли и концентрировали при пониженном давлении, а остаток помещали в EtOAc (1500 мл) и промывали солевым раствором (2×100 мл). Затем EtOAc концентрировали досуха, и остаток суспендировали в EtOAc (1000 мл) и фильтровали для удаления NaCl и фермента. EtOAc концентрировали с получением свободного основания указанного в заголовке соединения (146,9 г, 0,643 моль). Свободное основание растворяли в EtOAc (870 мл) и добавляли HCl в EtOAc (2 М, 390 мл) в течение часа. Реакционную смесь перемешивали в течение 2 часов, затем фильтровали и осадок на фильтре промывали EtOAc (100 мл). Осадок на фильтре затем высушивали с получением указанного в заголовке промежуточного соединения (169 г, 0,639 ммоль).
[α]D25=-0,478° (c=1,0330% вес./об., CH3OH).
1H ЯМР (400 МГц, CD3OD) δ 4,11 (d, J=4,8 Гц, 2H), 4,01-3,89 (m, 5H), 2,71 (m, 1H), 2,27-2,17 (m, 1H), 1,46 (s, 9H).
Промежуточное соединение 3A. трет-Бутил-(S)-7-(4-(2-(бензилокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
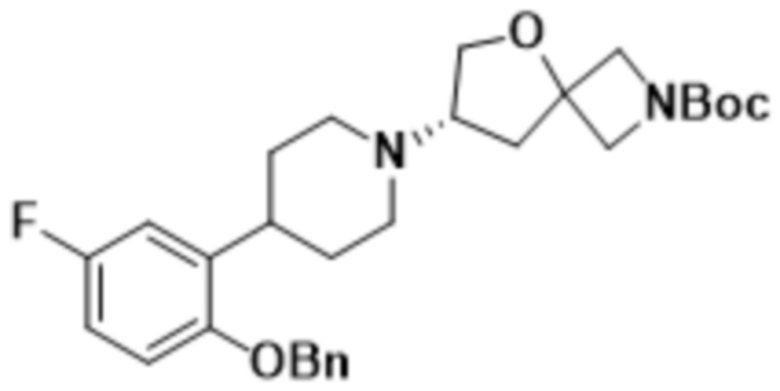
3-(2-(Бензилокси)-5-фторфенил)пентан-1,5-диилбис(4-метилбензолсульфонат) (промежуточное соединение 1B, 35,41 г, 54,8 ммоль) и трет-бутил(S)-7-амино-5-окса-2-азаспиро[3.4]октан-2-карбоксилата гидрохлорид (промежуточное соединение 2, 14,50 г, 54,8 ммоль) суспендировали в MeCN (500 мл) и к раствору добавляли трехосновный фосфат калия (34,9 г, 164 ммоль). Реакционную смесь перемешивали при 90°C в течение 72 часов. Далее растворитель удаляли in vacuo и твердый остаток суспендировали в EtOAc. Взвесь фильтровали и фильтрат концентрировали с получением неочищенного продукта в виде оранжевого масла. Неочищенный продукт очищали с помощью FCC (0-10% MeOH (1% NH4OH)/DCM) с получением указанного в заголовке соединения (17,09 г, 33,9 ммоль).
LCMS: Rt= 1,33 мин. (способ 2 LCMS); MS масса/заряд 497,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,47-7,26 (m, 5H), 7,23-7,09 (m, 2H), 7,04-6,84 (m, 1H), 5,09 (s, 2H), 4,11-3,78 (m, 5H), 3,70 (dd, J=8,7, 7,4 Гц, 2H), 3,05 (m, 3H), 2,96-2,72 (m, 1H), 2,42 (dd, J=12,9, 7,5 Гц, 1H), 2,18 (m, 2H), 2,03 (dd, J=12,9, 8,5 Гц, 1H), 1,91-1,60 (m, 4H), 1,43 (s, 9H).
Следующие соединения в таблице 1 получали с применением подобной процедуры и соответствующих исходных материалов.
Таблица 1. Промежуточные соединения 3B - 3H
способ
масса
масса
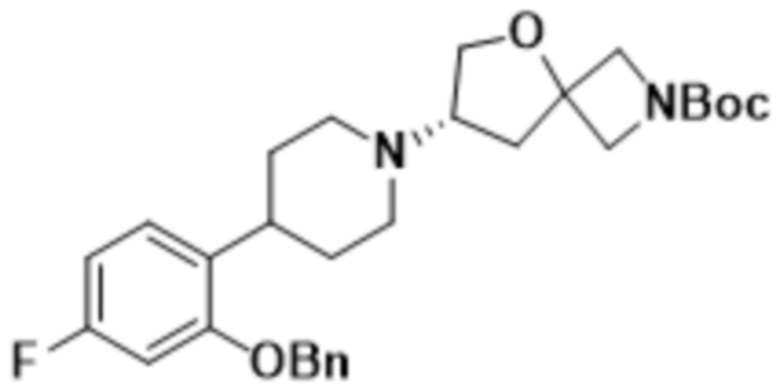
Способ 2 LCMS
[M+H]+
[M+H]+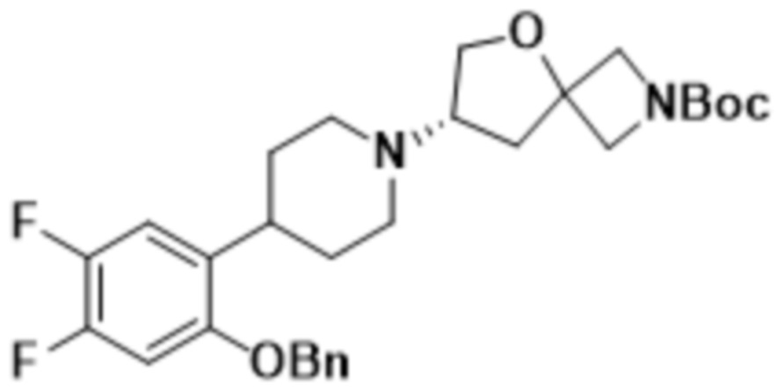
Способ 2 LCMS
[M+H]+
[M+H]+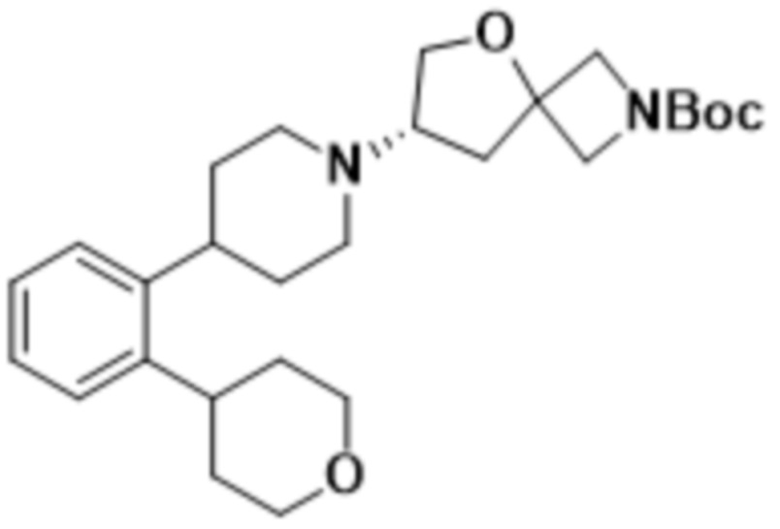
Способ 4 LCMS
[M+H]+
[M+H]+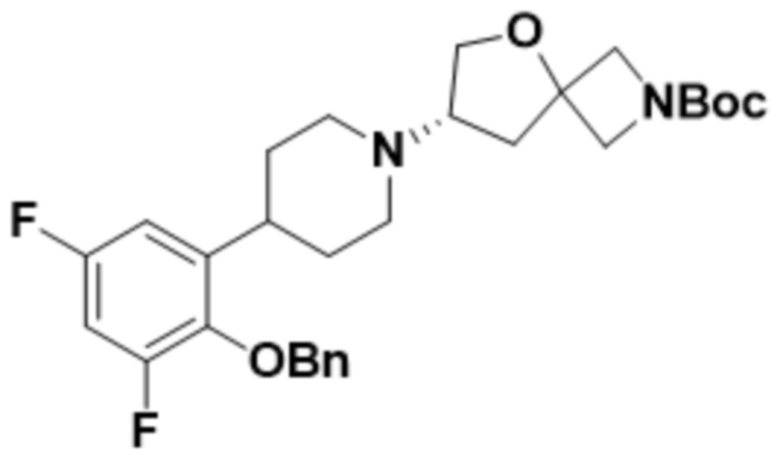
Способ 2 LCMS
[M+H]+
[M+H]+
Способ 4 LCMS
[M+H]+
[M+H]+
Способ 2 LCMS
[M+H]+
[M+H]+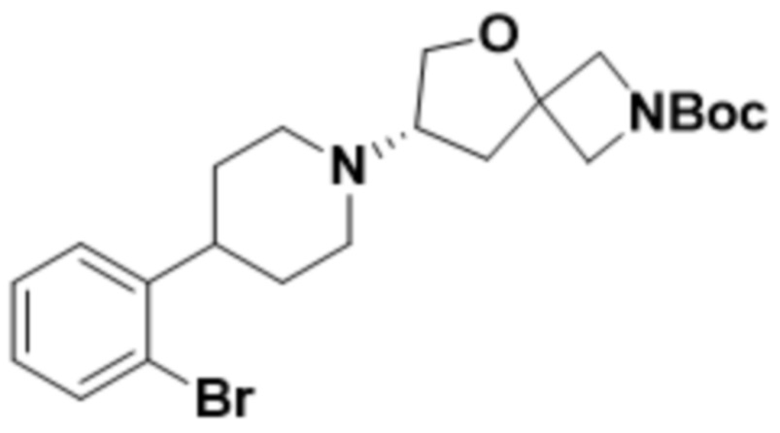
Способ 1 LCMS
[M+H]+
[M+H]+
Промежуточное соединение 4A. трет-Бутил-(S)-7-(4-(5-фтор-2-гидроксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
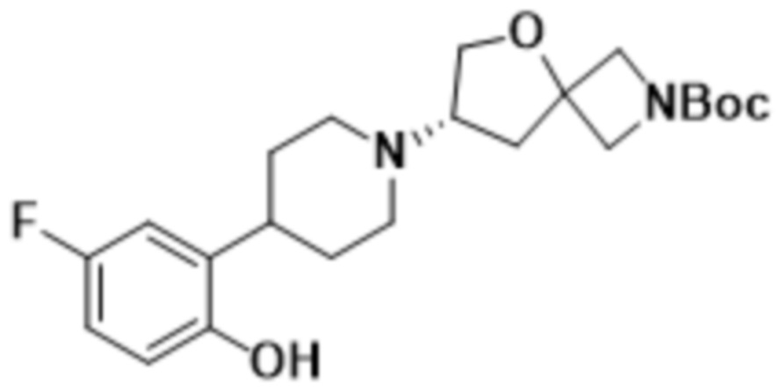
К перемешиваемому раствору трет-бутил-(S)-7-(4-(2-(бензилокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилата (промежуточное соединение 3А, 7,67 г, 15,44 ммоль) в этаноле (150 мл) добавляли 10% палладий на угле (213 мг, 0,201 ммоль). Реакционную смесь затем перемешивали в атмосфере водорода из баллона в течение 5 часов. Затем реакционную смесь фильтровали через слой целита и растворитель удаляли при пониженном давлении с получением прозрачного масла. Добавляли диэтиловый эфир (100 мл) и растворитель удаляли in vacuo. Это повторяли еще два раза с получением указанного в заголовке соединения в виде белого твердого вещества (5,48 г, 13,48 ммоль).
LCMS: Rt= 2,24 мин. (способ 4 LCMS); MS масса/заряд 407,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 6,90-6,80 (m, 1H), 6,79-6,66 (m, 2H), 4,15-3,81 (m, 5H), 3,74 (dd, J=8,7, 7,4 Гц, 1H), 3,16-2,81 (m, 4H), 2,45 (dd, J=12,9, 7,5 Гц, 1H), 2,23 (m, 2H), 2,07 (dd, J=12,9, 8,5 Гц, 1H), 1,93-1,61 (m, 4H), 1,46 (s, 9H).
Следующие соединения в таблице 2 получали с применением подобной процедуры и соответствующих исходных материалов.
Таблица 2. Промежуточные соединения 4B - 4E
способ
масса
масса
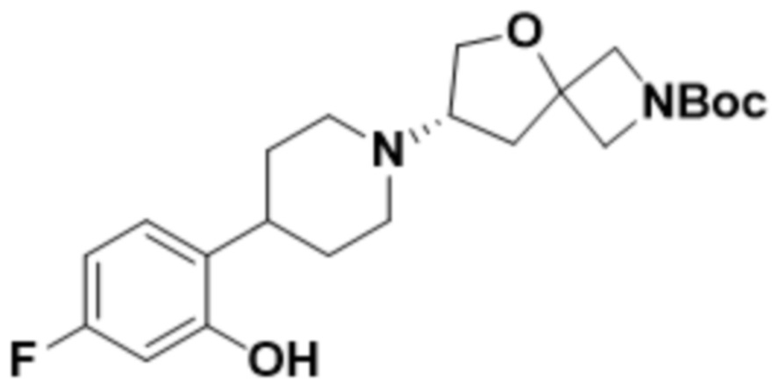
Способ 1 LCMS
[M+H]+
[M+H]+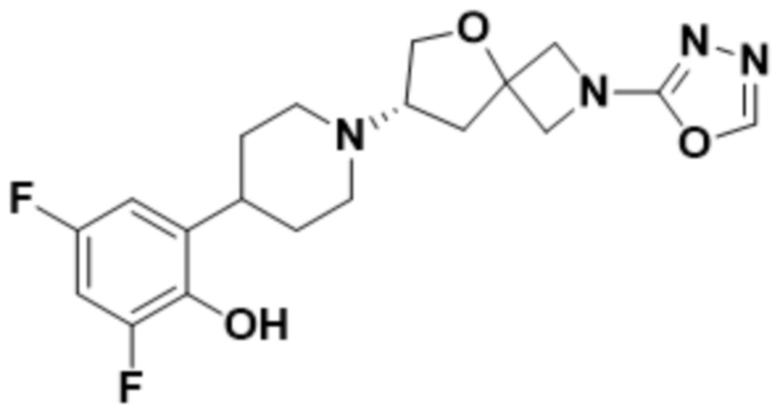
Способ 1 LCMS
[M+H]+
[M+H]+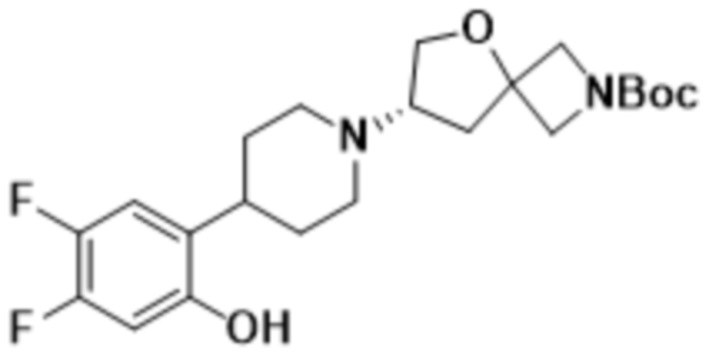
Способ 2 LCMS
[M+H]+
[M+H]+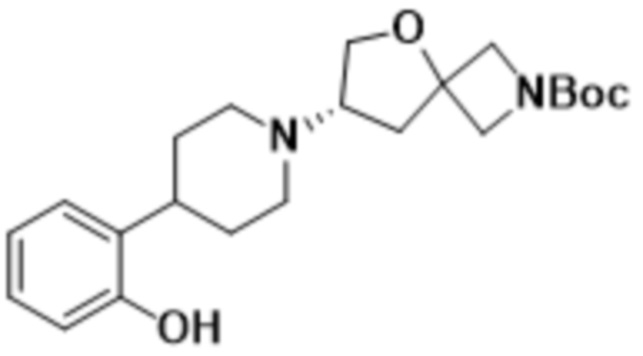
Способ 2 LCMS
[M+H]+
[M+H]+
Промежуточное соединение 4F. (S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол
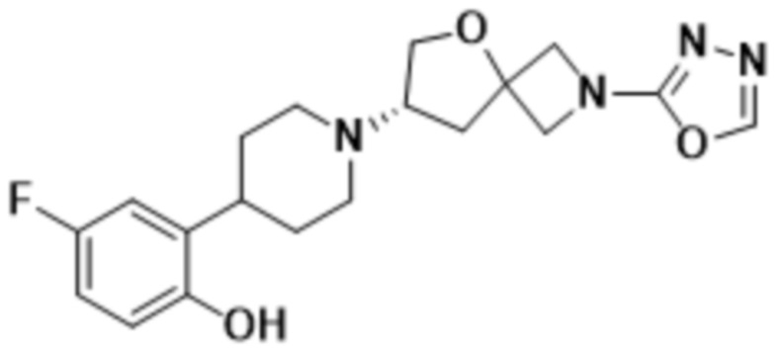
(S)-7-(4-(2-(Бензилокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 8B, 1680 мг, 3,62 ммоль) растворяли в этаноле (200 мл) и добавляли 10% Pd/C (43 мг, 0,362 ммоль). Затем содержимое колбы перемешивали в атмосфере водорода, которым был наполнен баллон, в течение шести часов. Затем суспензию фильтровали через слой целита и осадок промывали DCM. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке промежуточного соединения (1300 мг, 3,47 ммоль).
LCMS: Rt: 0,75 мин. (способ 2 LCMS); MS масса/заряд 375,3 [M+H]+.
Промежуточное соединение 5A. (2-Оксаспиро[3.3]гептан-6-ил)метил-4-метилбензолсульфонат
К раствору (2-оксаспиро[3.3]гептан-6-ил)MeOH (50 мг, 0,390 ммоль), DMAP (4,77 мг, 0,039 ммоль) и триэтиламина (0,136 мл, 0,975 ммоль) в DCM (5 мл) добавляли pTsCl (78 мг, 0,410 ммоль). Реакционную смесь перемешивали при к. т. в течение ночи и затем разбавляли с помощью DCM и промывали 1 н. раствором HCl, насыщ. раствором NaHCO3, водой и солевым раствором, затем высушивали над Na2SO4. Растворитель удаляли при пониженном давлении и неочищенный продукт очищали с помощью FCC (0-60% EtOAc/гептаны) с получением указанного в заголовке соединения (71 мг, 0,226 ммоль).
LCMS: Rt: 0,92 мин. (способ 1 LCMS).
1H ЯМР (400 МГц, CD3OD) δ 7,80 (d, J=8,5 Гц, 2H), 7,47 (d, J=8,4 Гц, 2H), 4,66 (s, 2H), 4,54 (s, 2H), 3,95 (d, J=5,9 Гц, 2H), 2,48 (s, 3H), 2,46-2,27 (m, 3H), 2,01-1,89 (m, 2H).
Следующие соединения в таблице 3 получали с применением подобной процедуры и соответствующих исходных материалов.
Таблица 3. Промежуточные соединения 5B - 5T
способ
масса
масса
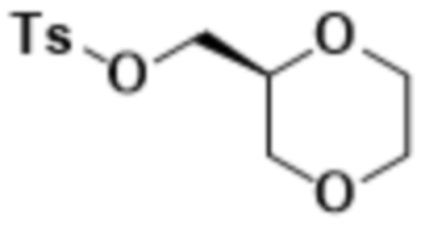
Способ 2 LCMS
[M+H]+
(M+H)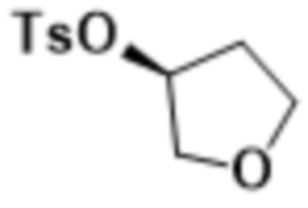
Способ 1 LCMS
[M+H]+
(M+H)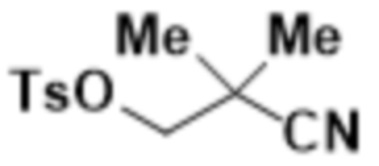
Способ 1 LCMS
[M+H]+
(M+H)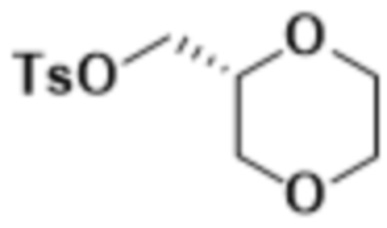
Способ 1 LCMS
[M+H]+
(M+H)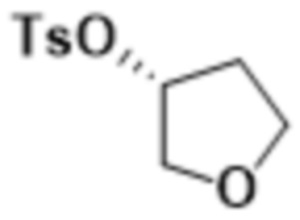
Способ 2 LCMS
[M+NH4]+
[M+NH4]+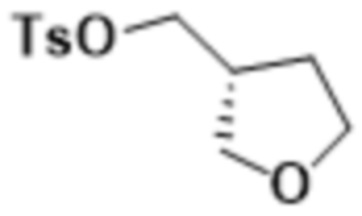
Способ 1 LCMS
[M+H]+
[M+H]+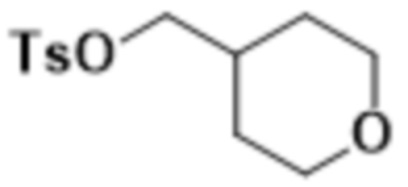
Способ 2 LCMS
[M-H]-
[M-H]-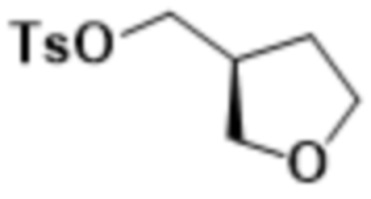
Способ 1 LCMS
[M+H]+
[M+H]+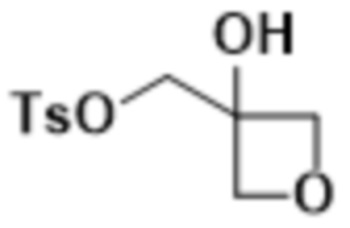
Способ 1 LCMS
[M+H]+
[M+H]+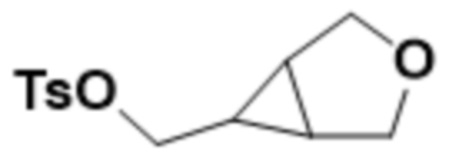
Способ 1 LCMS
[M+NH4]+
[M+NH4]+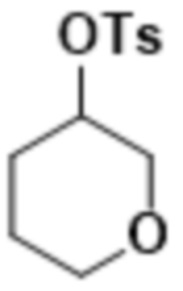
Способ 1 LCMS
[M+H]+
[M+H]+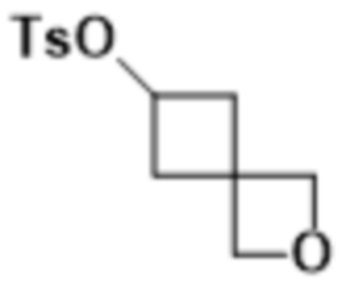
Способ 2 LCMS
[M+H]+
[M+H]+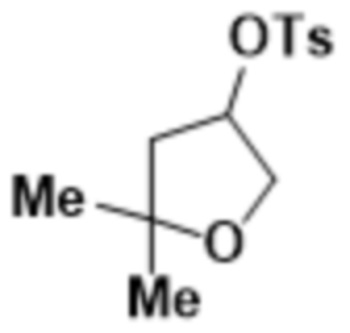
Способ 1 LCMS
[M+NH4]+
[M+NH4]+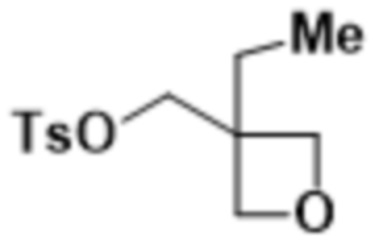
Способ 1 LCMS
[M+H]+
[M+H]+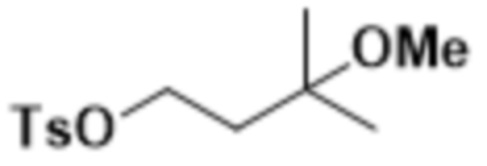
Способ 2 LCMS
[M+H]+
[M+H]+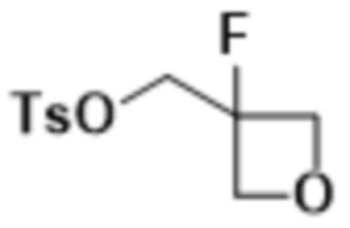
Способ 1 LCMS
[M+NH4]+
[M+NH4]+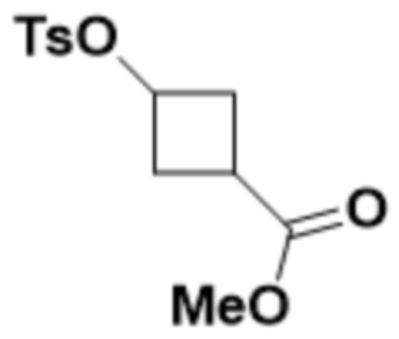
Способ 1 LCMS
[M+H]+
[M+H]+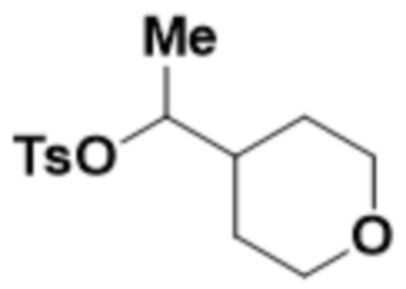
Способ 2 LCMS
[M+NH4]+
[M+NH4]+
Промежуточное соединение 6A. трет-Бутил-(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
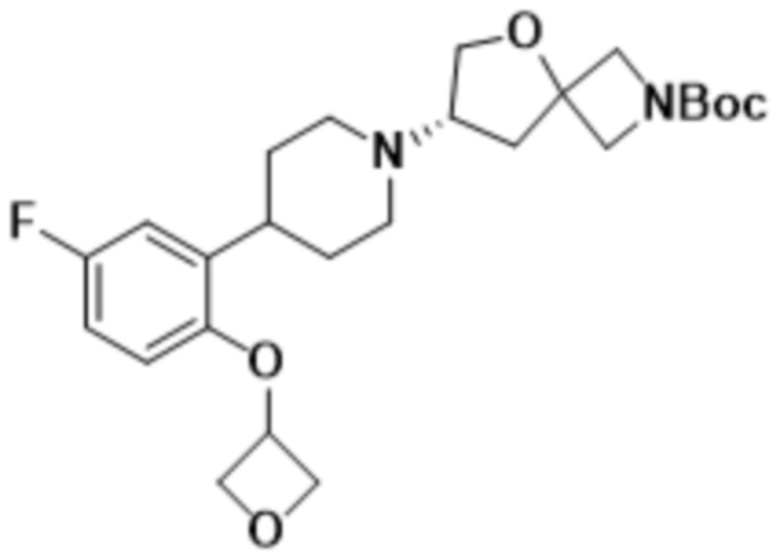
трет-Бутил-(S)-7-(4-(5-фтор-2-гидроксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 4A, 549 мг, 1,35 ммоль), карбонат цезия (1,32 г, 4,05 ммоль) и оксетан-3-ил-4-метилбензолсульфонат (коммерчески доступный, 308 мг, 1,35 ммоль) растворяли в DMF (5,6 мл) и реакционную смесь перемешивали при 80°С в течение ночи. Смесь разбавляли с помощью EtOAc и промывали водой, высушивали над MgSO4 и концентрировали in vacuo. Остаток очищали с помощью FCC (0-10% MeOH/DCM) с получением указанного в заголовке промежуточного соединения (412 мг, 0,891 ммоль).
LCMS: Rt: 1,08 мин. (способ 2 LCMS); MS масса/заряд 463,3 [M+H]+.
Следующие соединения в таблице 4 получали с применением подобной процедуры и соответствующих исходных материалов.
Таблица 4. Промежуточные соединения 6B - 6AA
способ
масса
масса
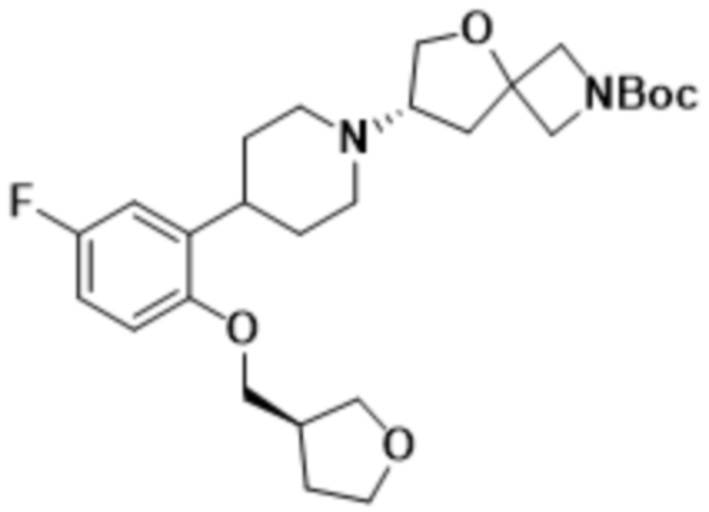
Способ 2 LCMS
[M+H]+
[M+H]+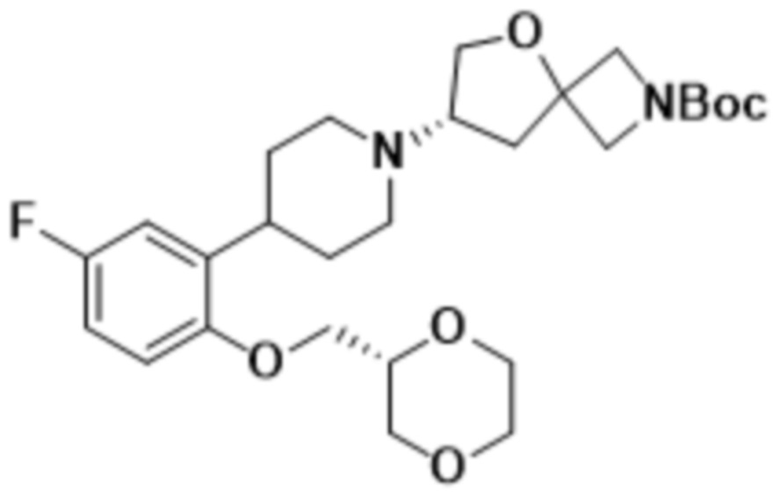
Способ 1 LCMS
[M+H]+
[M+H]+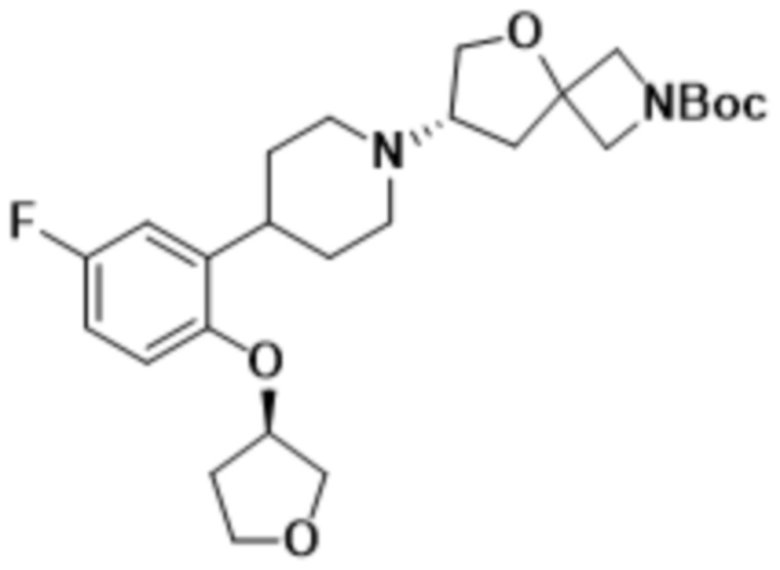
Способ 1 LCMS
[M+H]+
[M+H]+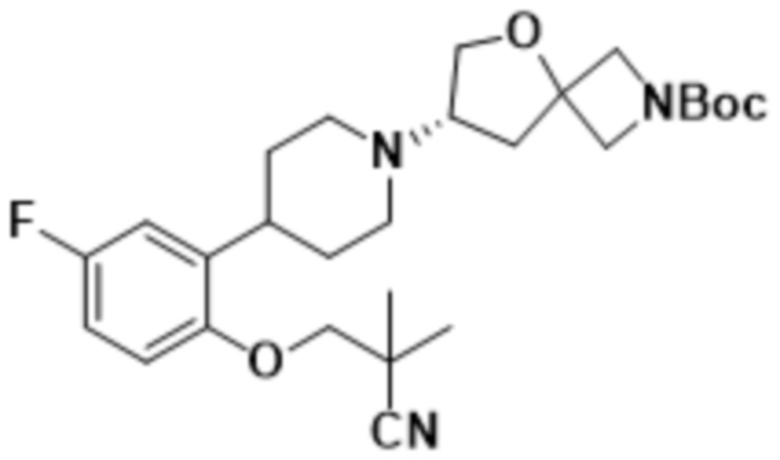
Способ 2 LCMS
[M+H]+
[M+H]+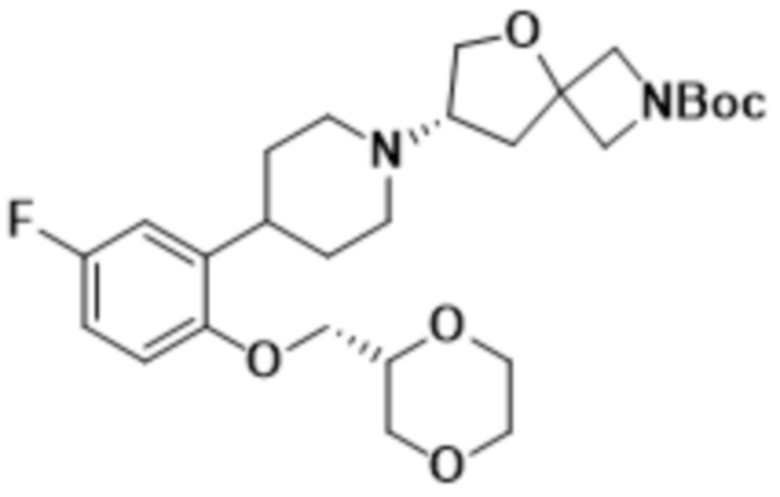
Способ 2 LCMS
[M+H]+
[M+H]+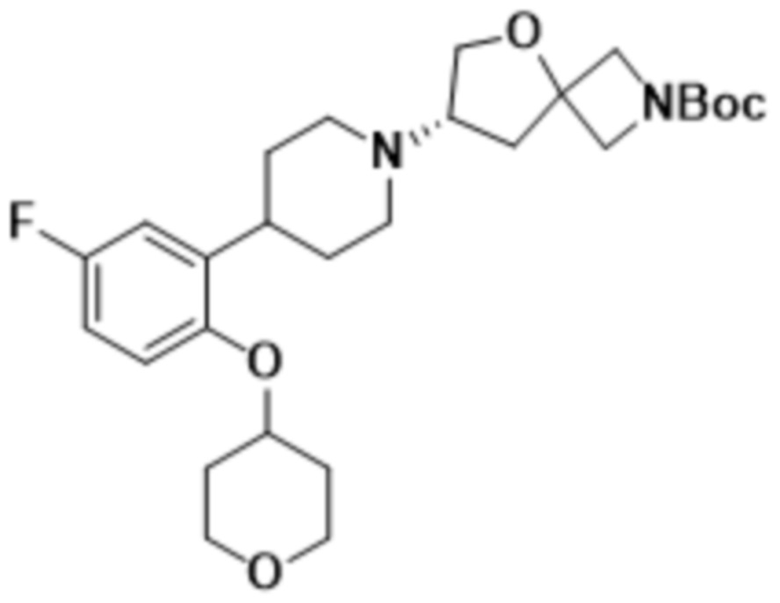
Способ 2 LCMS
[M+H]+
[M+H]+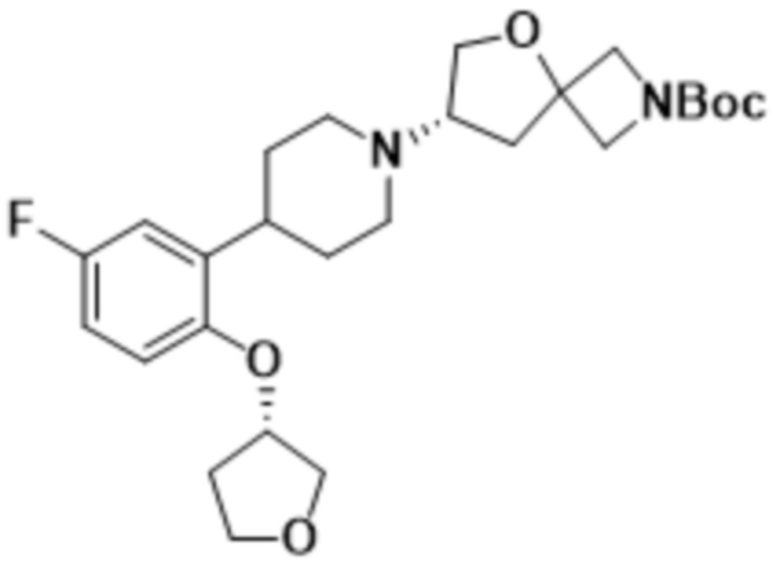
Способ 2 LCMS
[M+H]+
[M+H]+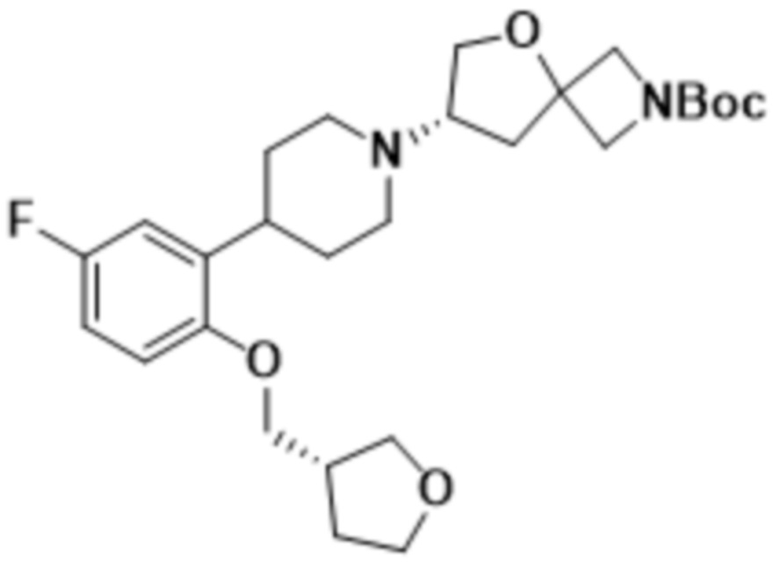
Способ 2 LCMS
[M+H]+
[M+H]+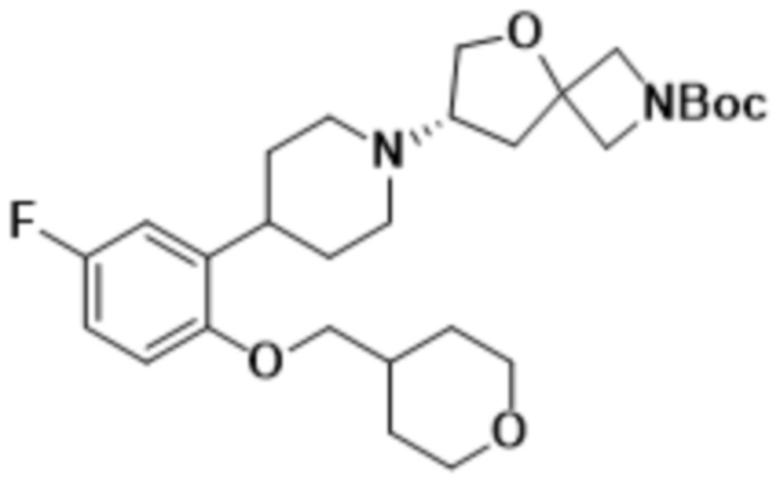
Способ 2 LCMS
[M+H]+
[M+H]+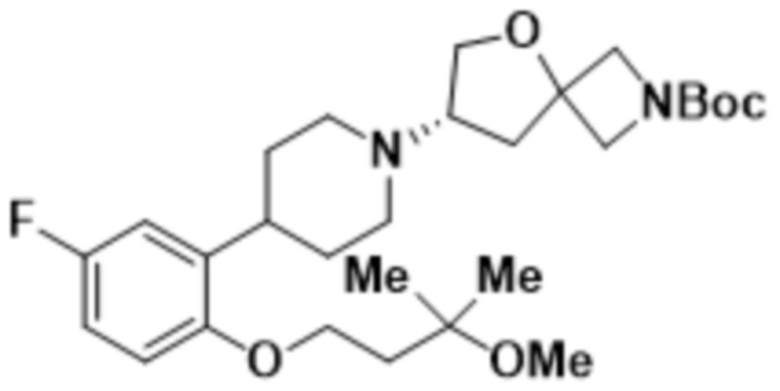
Способ 2 LCMS
[M+H]+
[M+H]+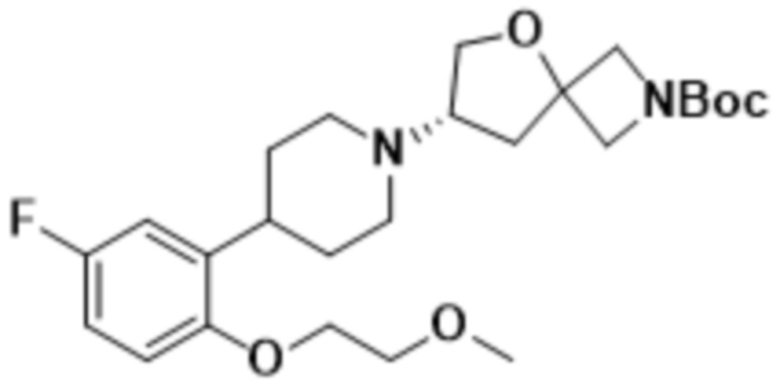
Способ 2 LCMS
[M+H]+
[M+H]+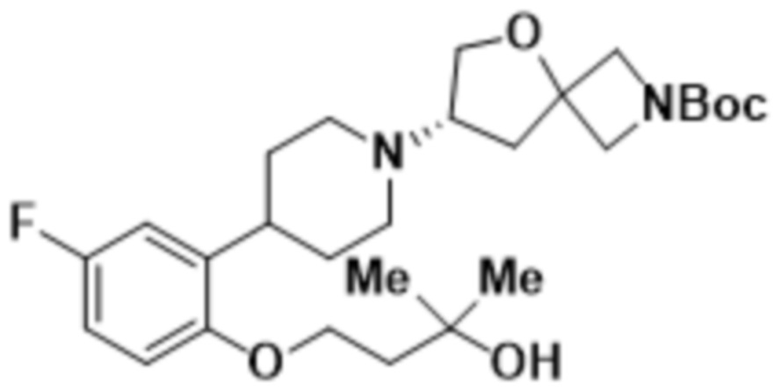
Способ 2 LCMS
[M+H]+
[M+H]+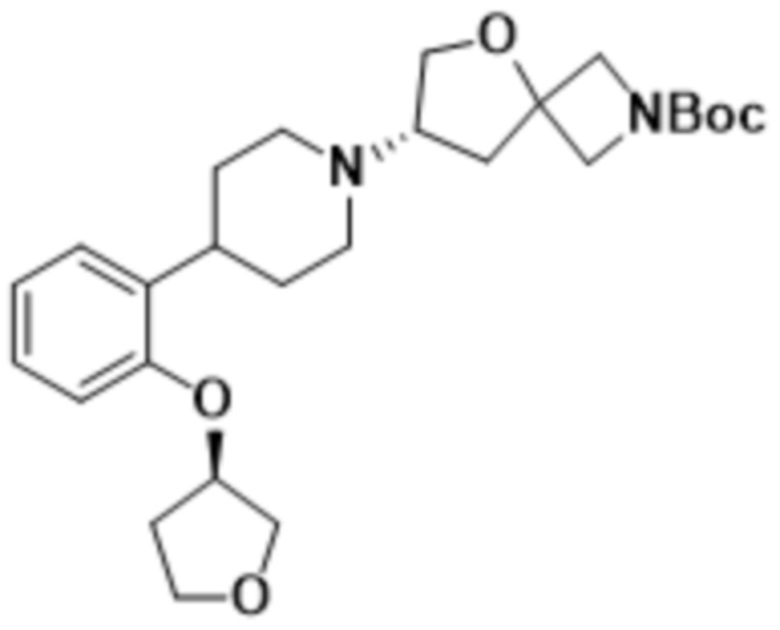
Способ 2 LCMS
[M+H]+
[M+H]+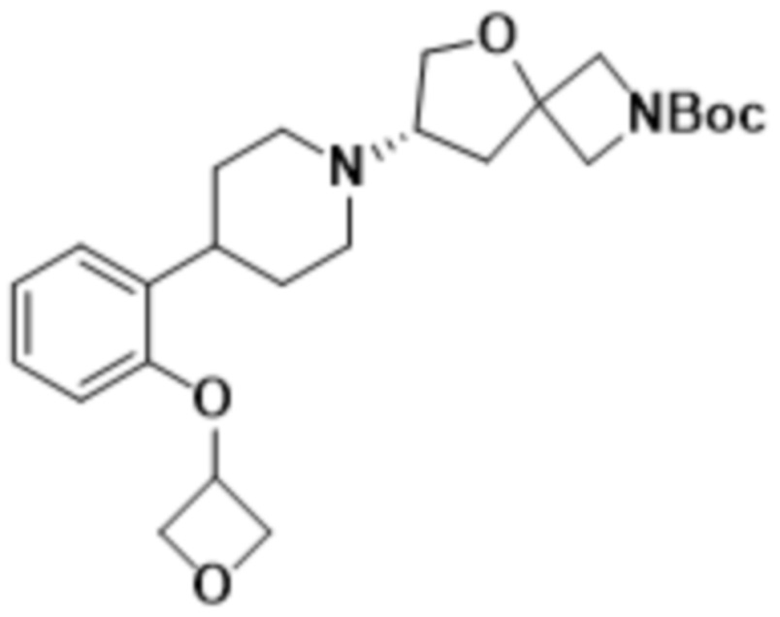
Способ 1 LCMS
[M+H]+
[M+H]+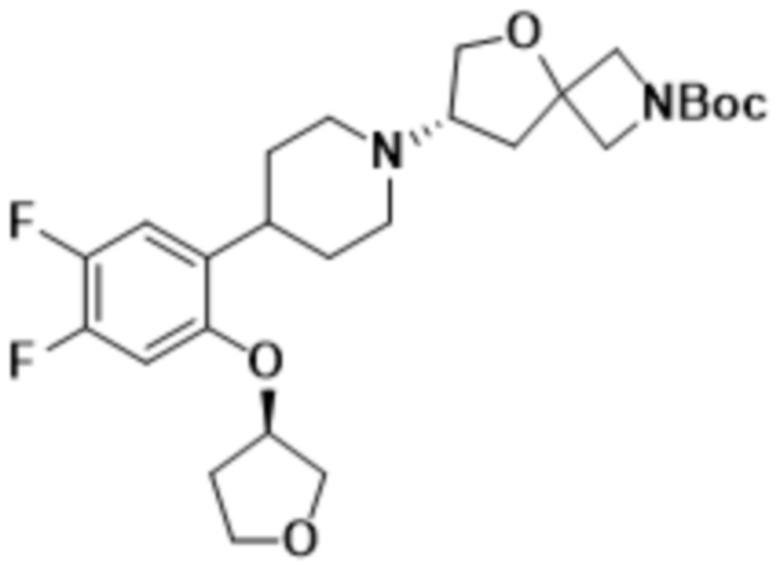
Способ 2 LCMS
[M+H]+
[M+H]+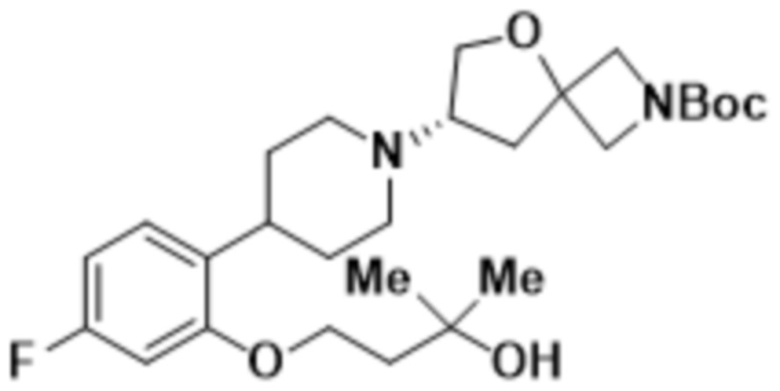
Способ 1 LCMS
[M+H]+
[M+H]+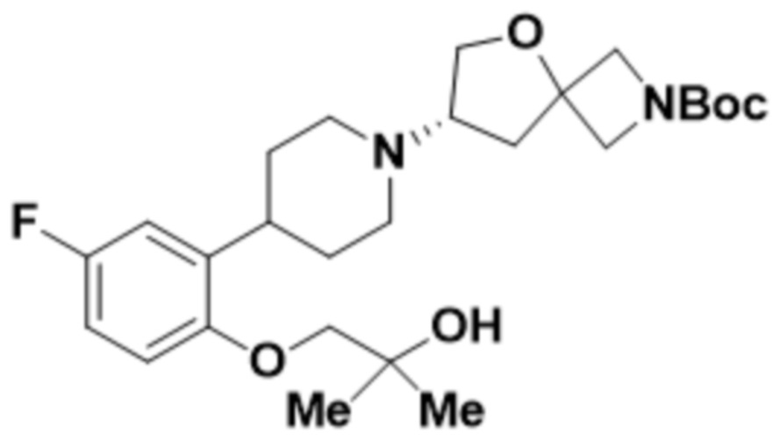
Способ 4 LCMS
[M+H]+
[M+H]+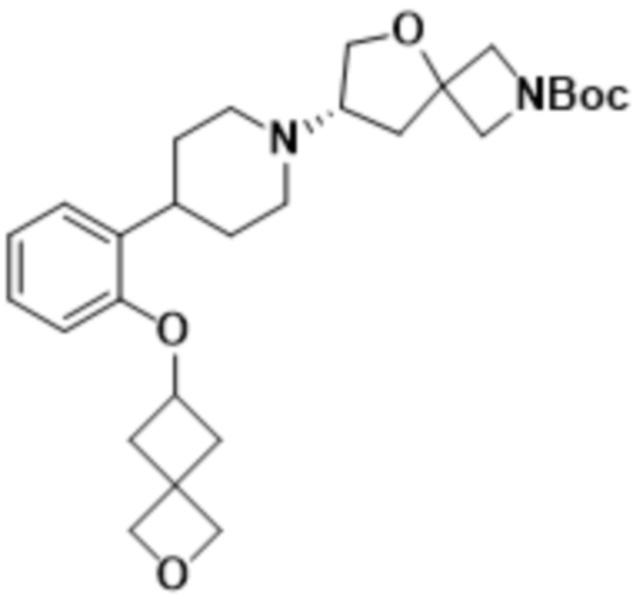
Способ 2 LCMS
[M+H]+
[M+H]+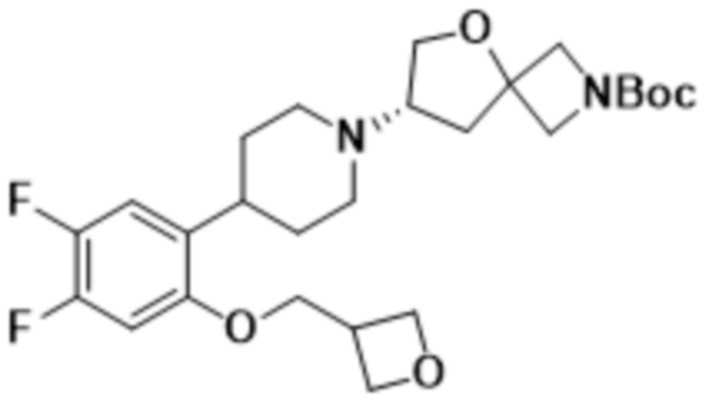
Способ 2 LCMS
[M+H]+
[M+H]+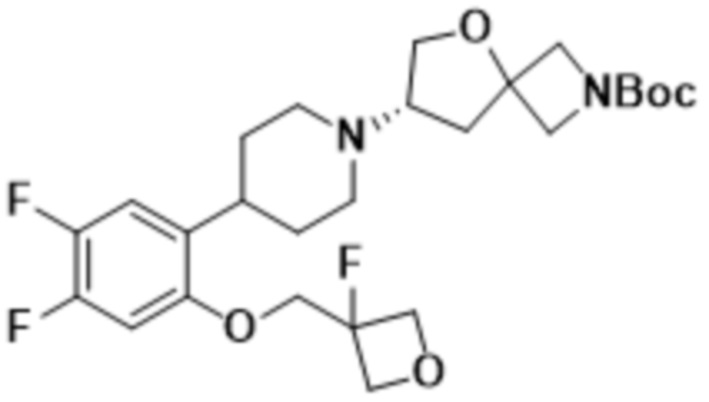
Способ 2 LCMS
[M+H]+
[M+H]+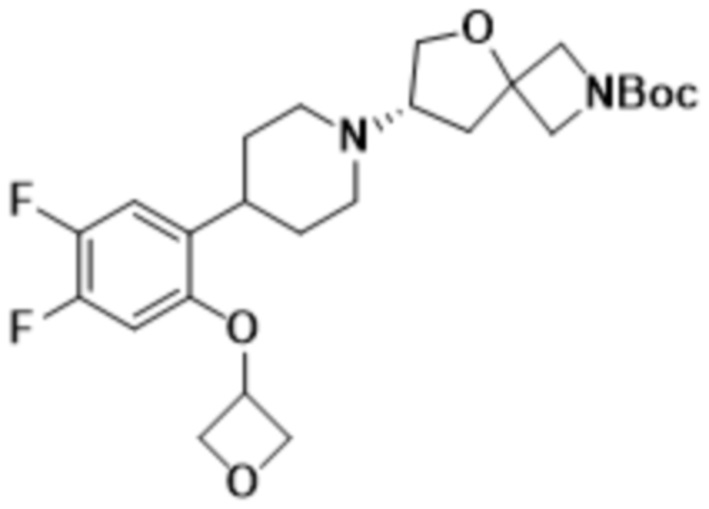
Способ 2 LCMS
[M+H]+
[M+H]+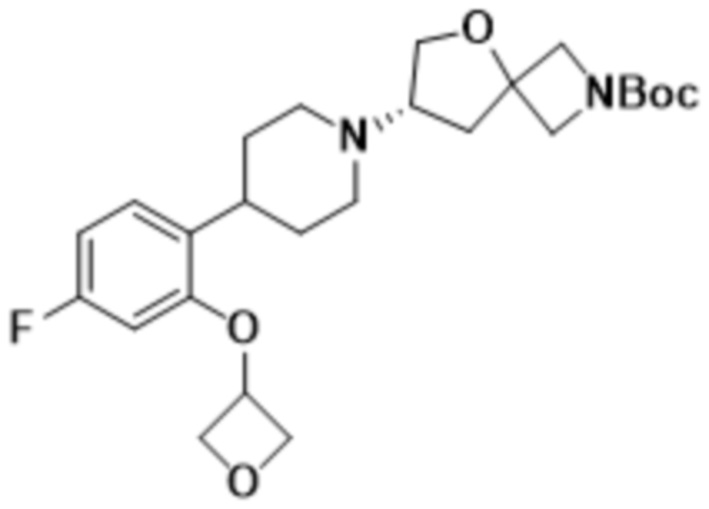
Способ 2 LCMS
[M+H]+
[M+H]+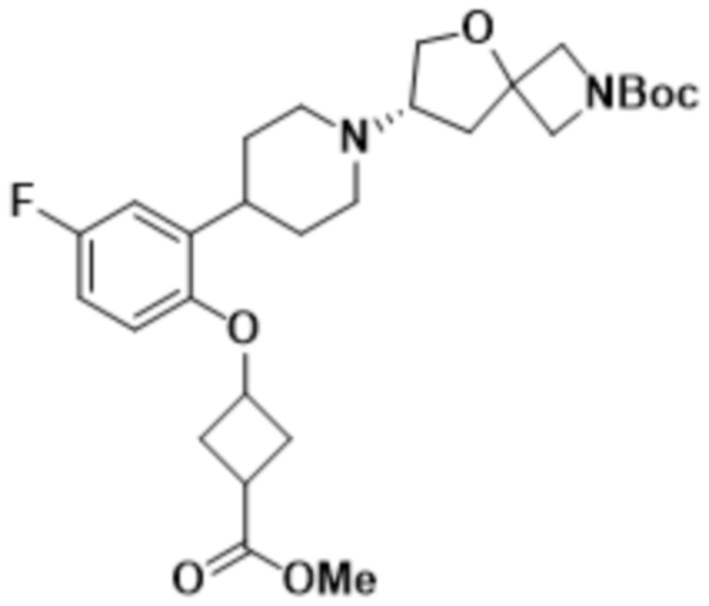
Способ 2 LCMS
[M+H]+
[M+H]+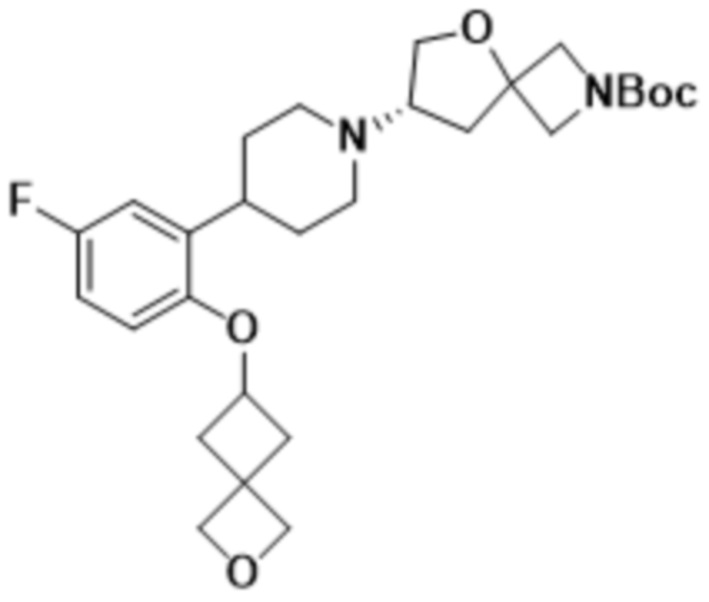
Способ 1 LCMS
[M+H]+
[M+H]+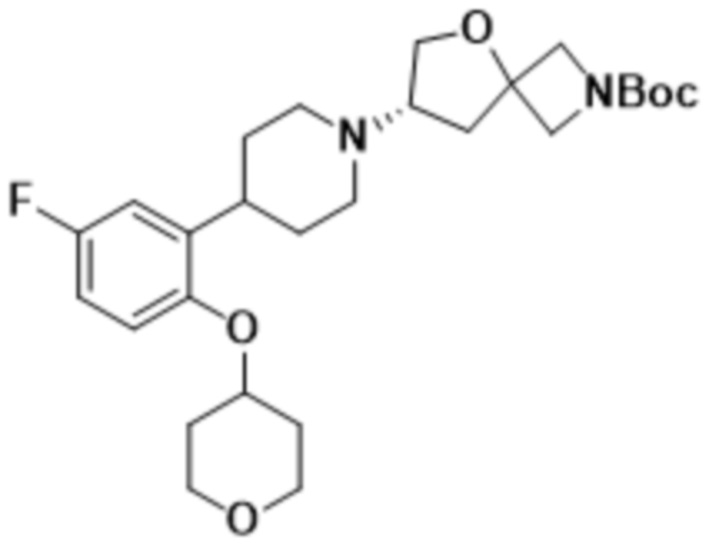
Способ 1 LCMS
[M+H]+
[M+H]+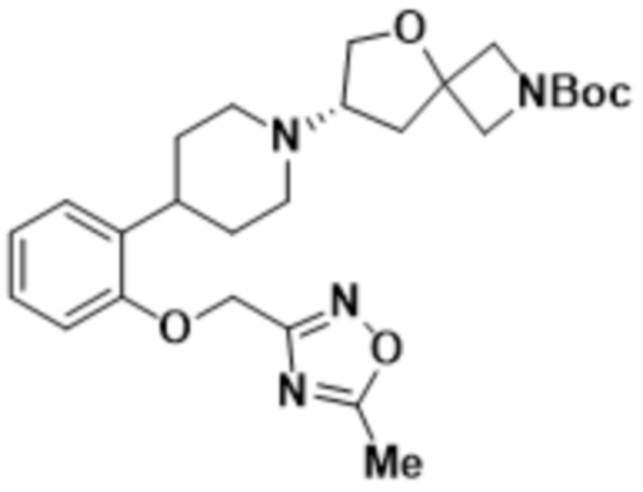
Способ 2 LCMS
[M+H]+
[M+H]+
Промежуточное соединение 6Z. трет-Бутил-(S)-7-(4-(5-фтор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
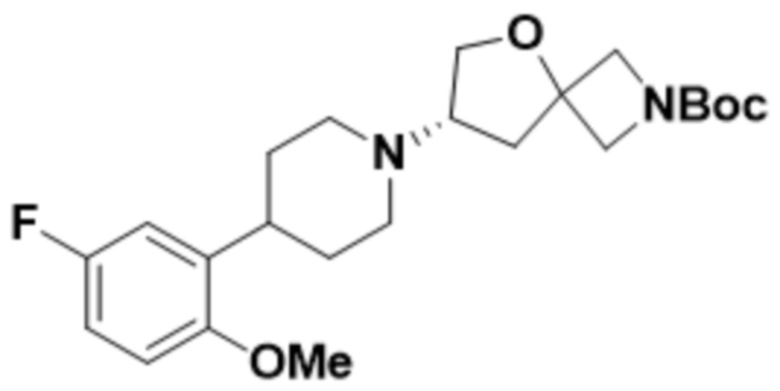
(S)-трет-Бутил-7-(4-(5-фтор-2-гидроксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 4A, 200 мг, 0,49 ммоль) растворяли в THF (4,9 мл) и добавляли безводный МеОН (975 мкл, 24,1 ммоль) с последующим добавлением трифенилфосфиновой смолы (3 ммоль/г, 821 мг, 2,46 ммоль) и ди-трет-бутилазодикарбоксилата (566 мг, 2,460 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней, фильтровали и промывали с помощью EtOAc. Фильтрат концентрировали и очищали с помощью FCC (0-10% MeOH/DCM) с получением указанного в заголовке промежуточного соединения (216 мг, 0,49 ммоль).
LCMS: Rt: 1,18 мин. (способ 2 LCMS); MS масса/заряд 421,2 [M+H]+.
Следующие соединения в таблице 5 получали подобным образом с применением соответствующих исходных материалов.
Таблица 5. Промежуточные соединения 6BB - 6DD
способ
масса
масса
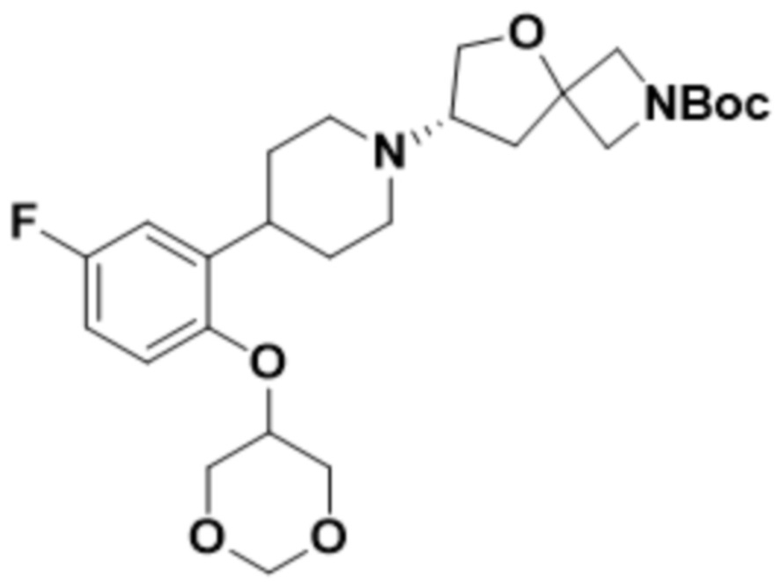
Способ 2 LCMS
[M+H]+
[M+H]+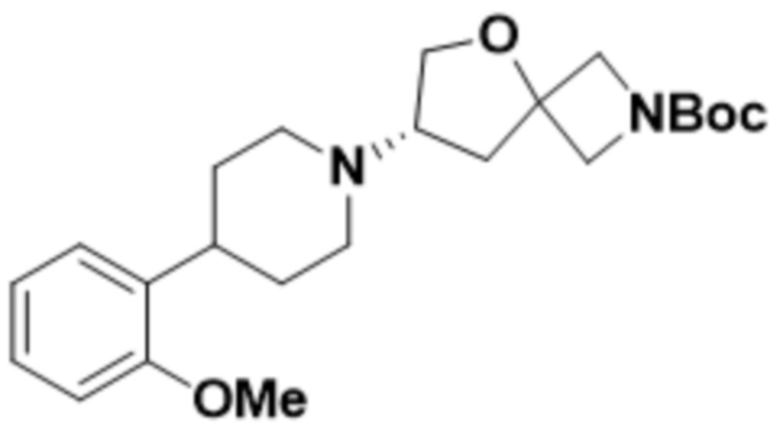
Способ 2 LCMS
[M+H]+
[M+H]+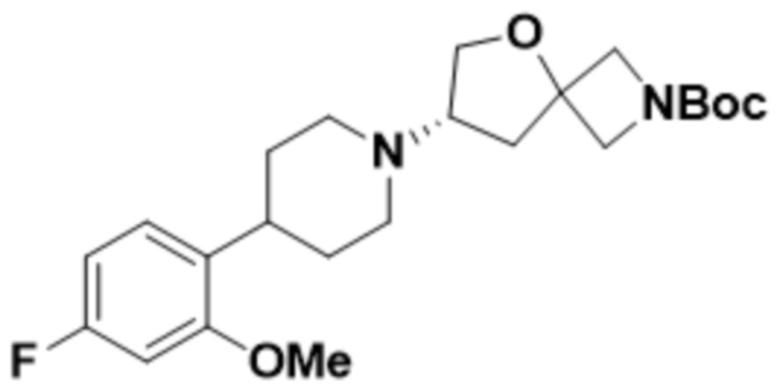
Способ 2 LCMS
[M+H]+
[M+H]+
Промежуточное соединение 7A. (S)-7-(4-(5-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
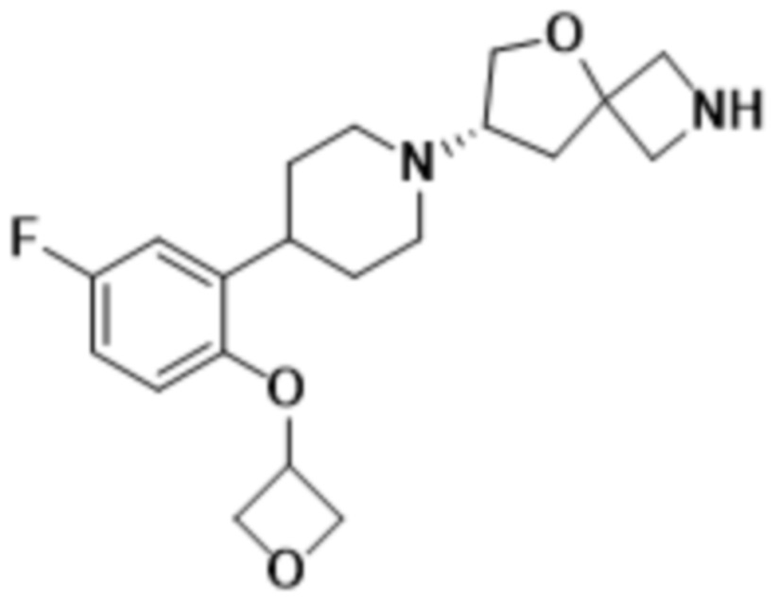
трет-Бутил-(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 6А, 825 мг, 1,78 ммоль) растворяли в DCM (18 мл), охлаждали до 0°С и добавляли TFA (1,3 мл, 17 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, концентрировали in vacuo и остаток растворяли в DCM, промывали 1 н. NaOH и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали с получением указанного в заголовке промежуточного соединения (582 мг, 1,61 ммоль).
LCMS: Rt: 0,44 мин. (способ 1 LCMS); MS масса/заряд 363,3 [M+H]+.
Промежуточное соединение 7B. (S)-7-(4-(2-(Бензилокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
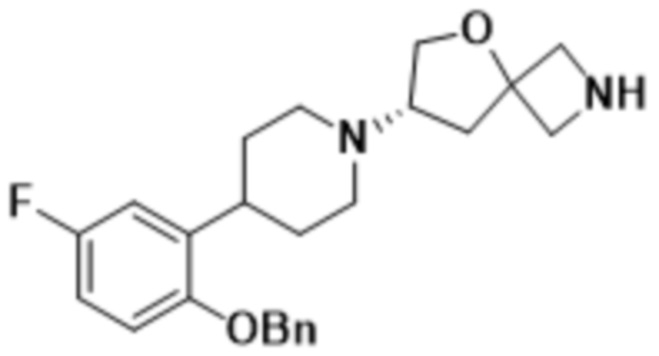
К перемешиваемому раствору трет-бутил-(S)-7-(4-(2-(бензилокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилата (промежуточное соединение 3А, 2000 мг, 4,03 ммоль) в DCM (5 мл) добавляли TFA (6,2 мл). Реакционную смесь перемешивали при к. т. в течение 3 часов и затем удаляли растворитель при пониженном давлении. Остатки разбавляли в EtOAc и воде и рН водной фазы регулировали до 8-9 4 н. NaOH. Слои разделяли и водную фазу экстрагировали с помощью EtOAc, объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали. Полученную коричневую пену использовали без дополнительной очистки (1500 мг, 3,78 ммоль).
LCMS: Rt: 0,61 мин. (способ 1 LCMS); MS масса/заряд 397,4 [M+H]+.
Следующие соединения в таблице 6 получали подобным образом с применением соответствующих исходных материалов.
Таблица 6. Промежуточные соединения 7C - 7QQ
способ
масса
масса
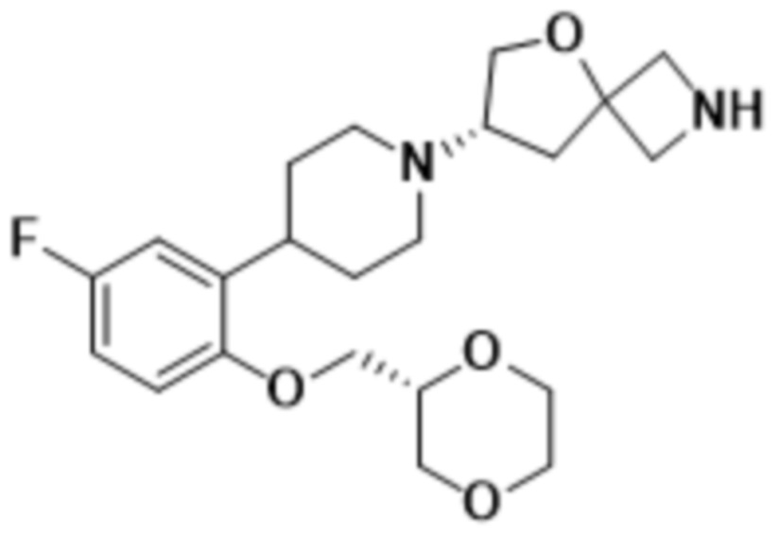
Способ 1 LCMS
[M+H]+
[M+H]+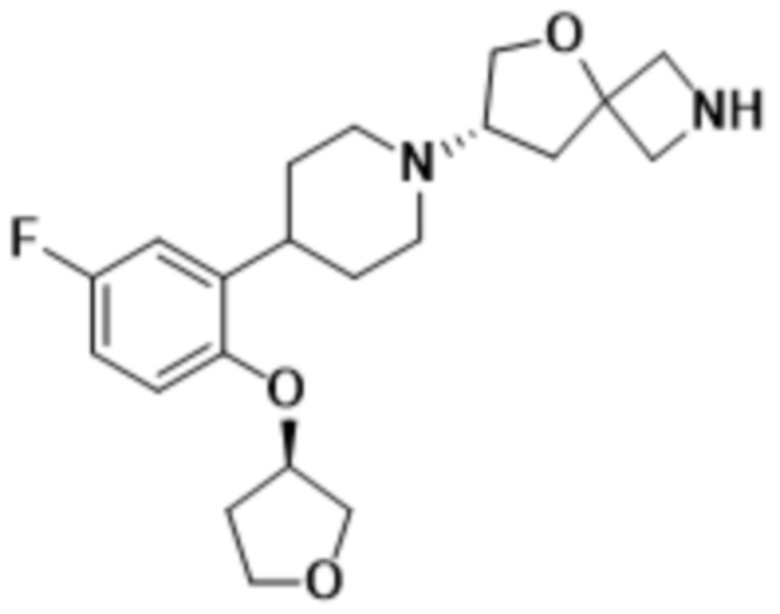
Способ 2 LCMS
[M+H]+
[M+H]+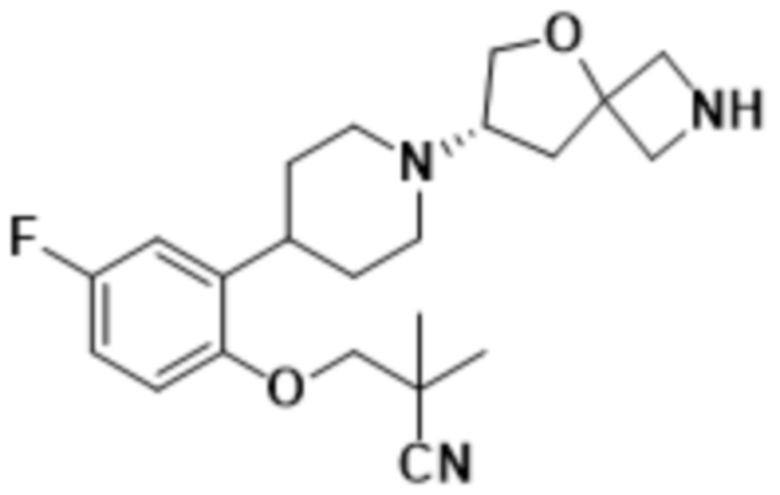
Способ 1 LCMS
[M+H]+
[M+H]+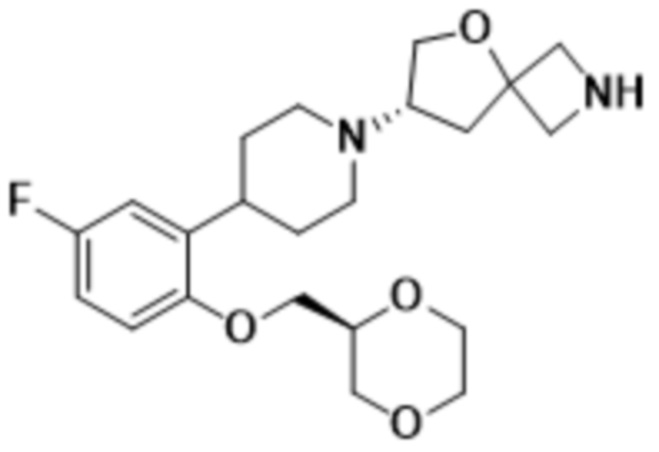
Способ 1 LCMS
[M+H]+
[M+H]+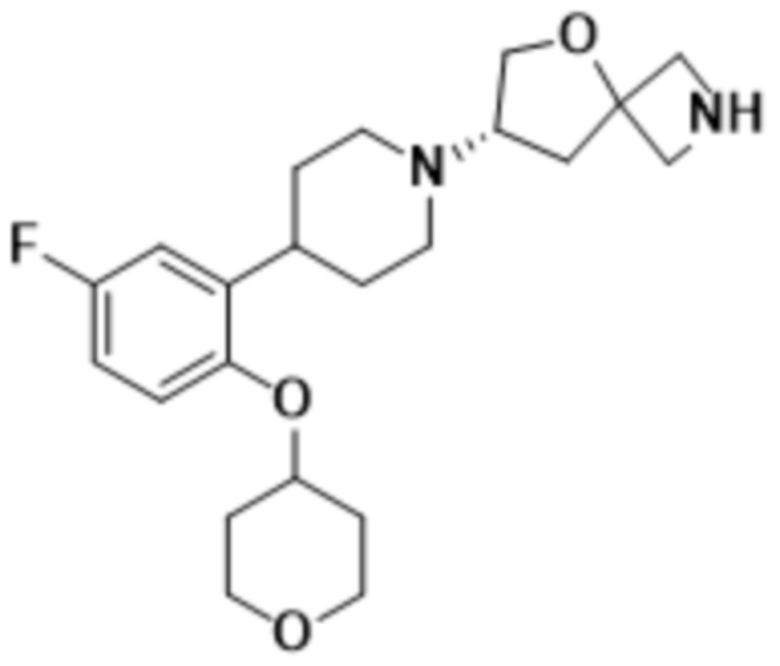
Способ 2 LCMS
[M+H]+
[M+H]+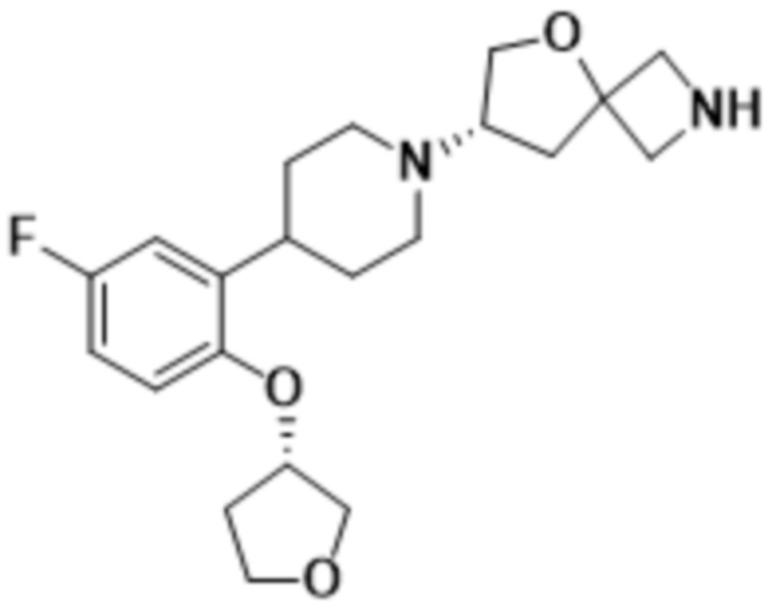
Способ 1 LCMS
[M+H]+
[M+H]+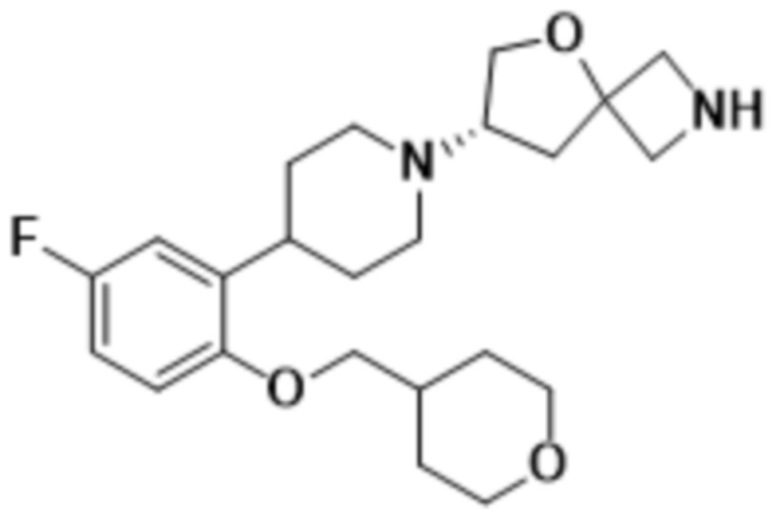
Способ 1 LCMS
[M+H]+
[M+H]+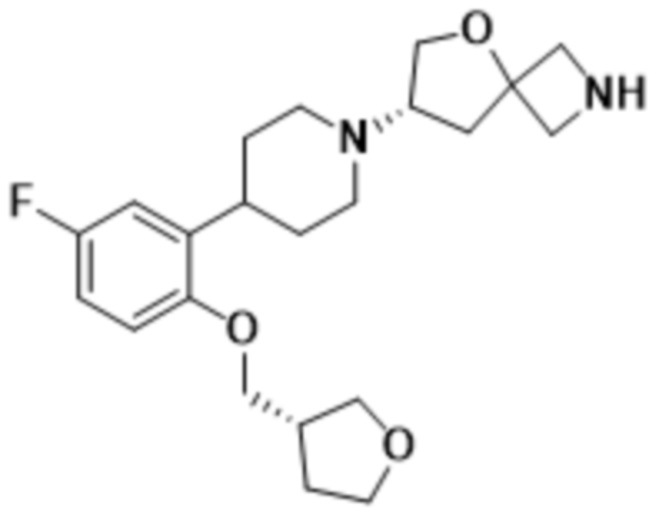
Способ 2 LCMS
[M+H]+
[M+H]+
Способ 1 LCMS
[M+H]+
[M+H]+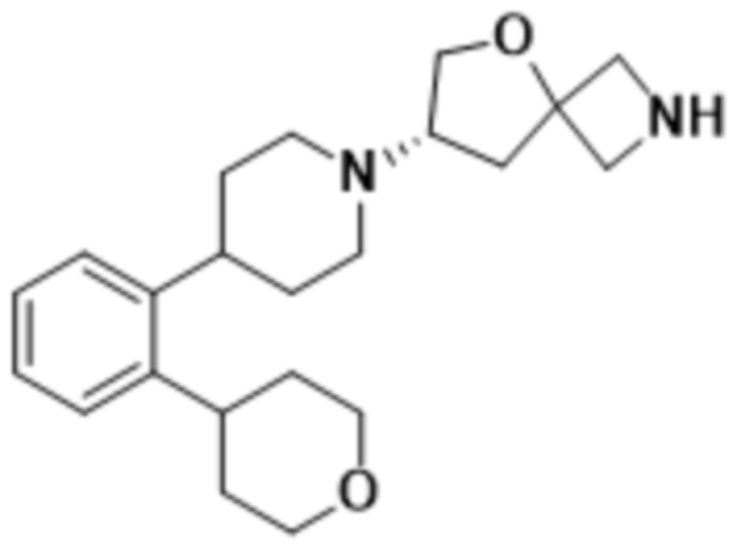
Способ 1 LCMS
[M+H]+
[M+H]+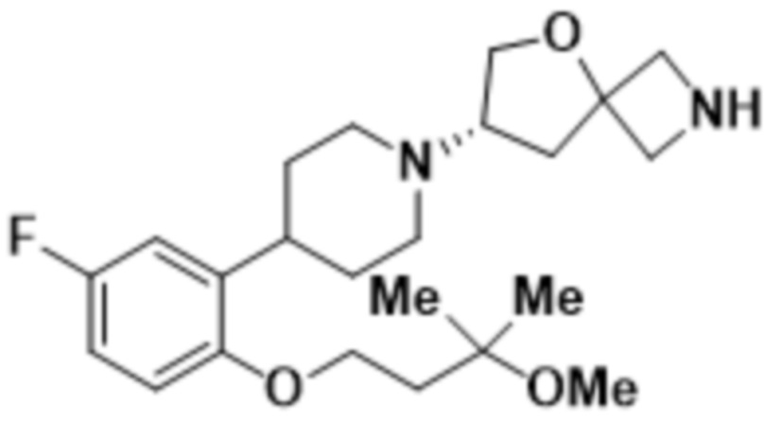
Способ 2 LCMS
[M+H]+
[M+H]+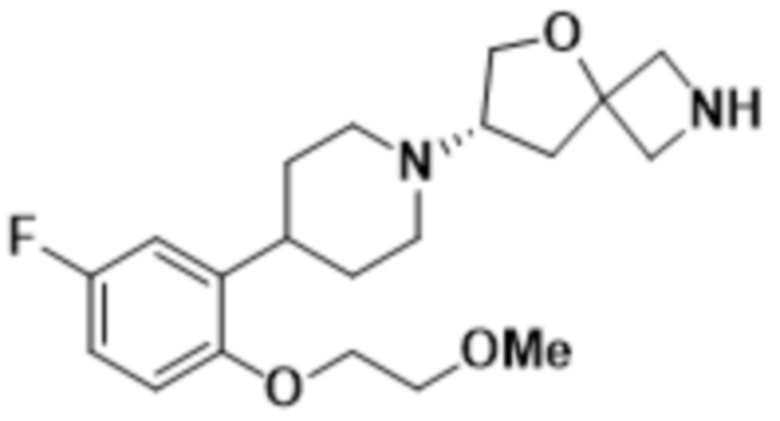
Способ 2 LCMS
[M+H]+
[M+H]+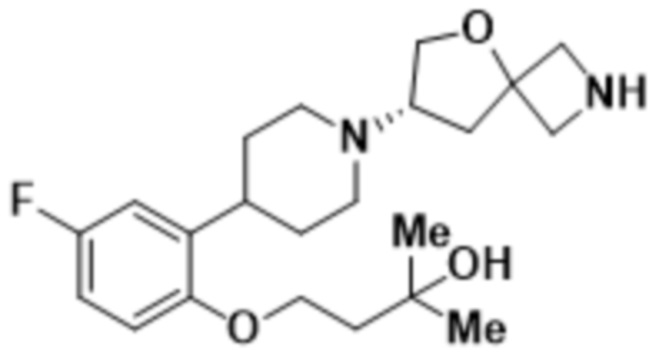
Способ 1 LCMS
[M+H]+
[M+H]+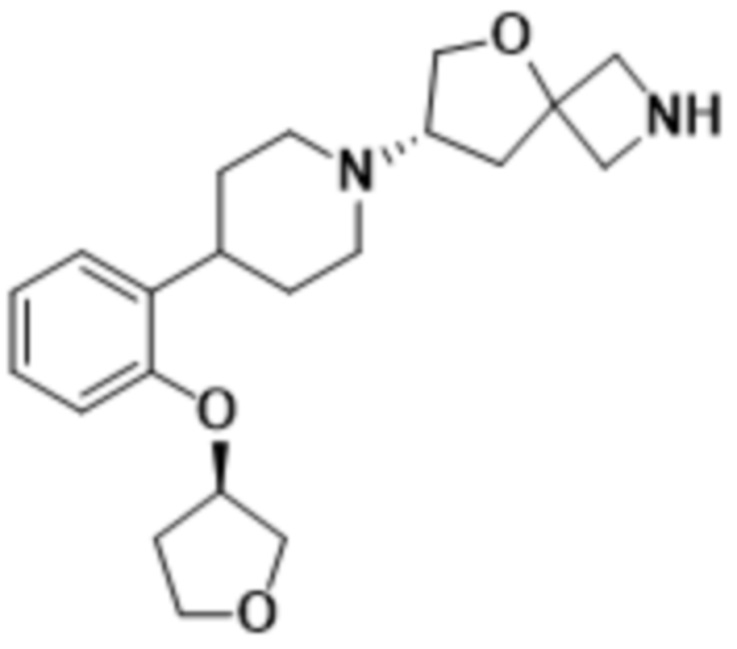
Способ 1 LCMS
[M+H]+
[M+H]+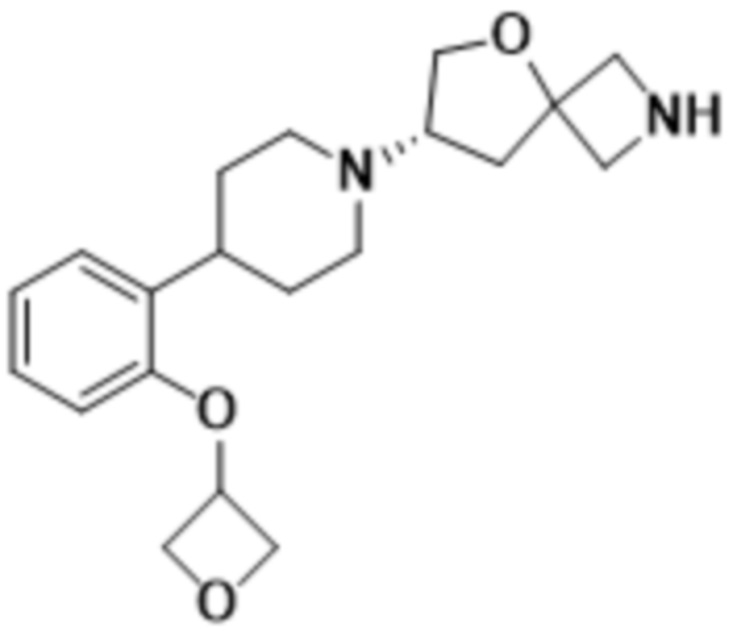
Способ 1 LCMS
[M+H]+
[M+H]+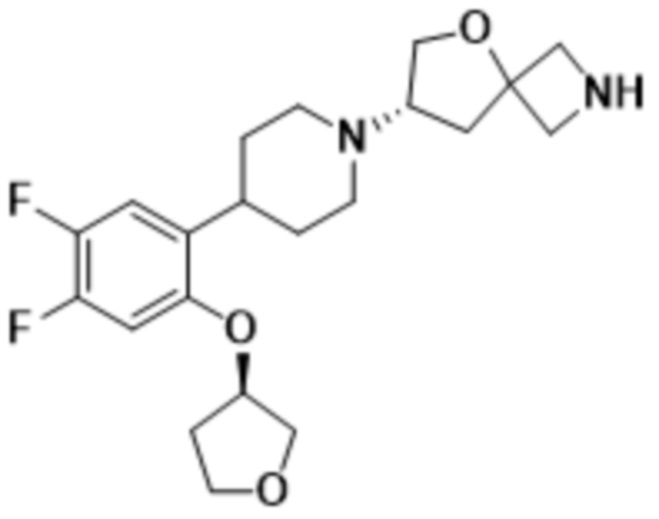
Способ 1 LCMS
[M+H]+
[M+H]+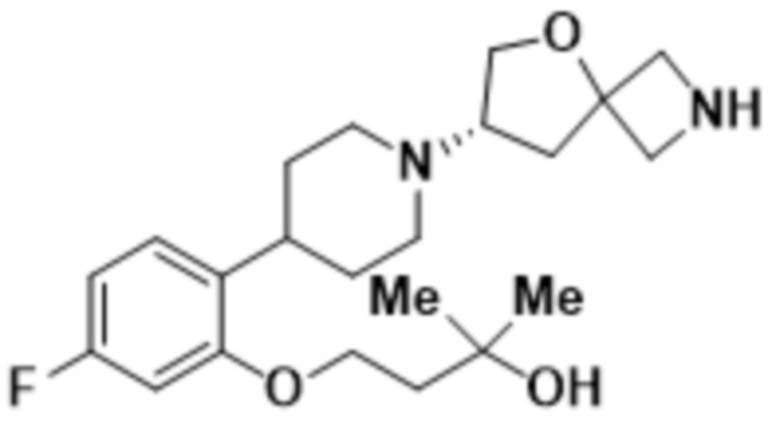
Способ 1 LCMS
[M+H]+
[M+H]+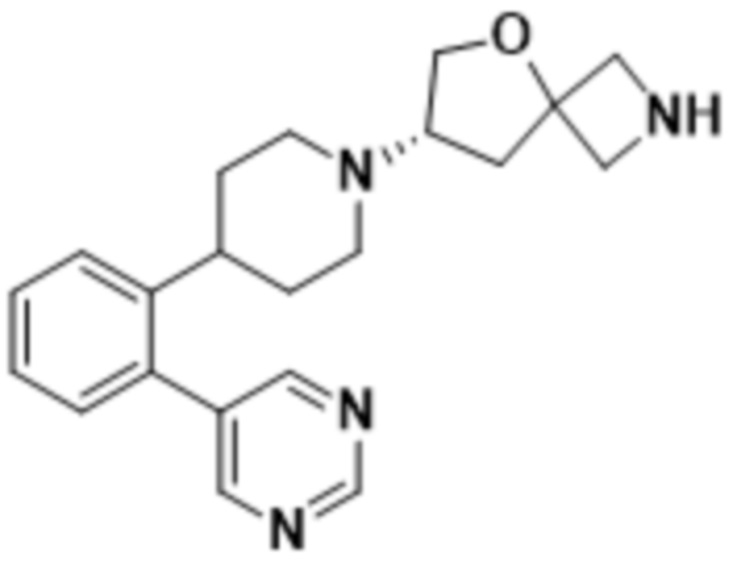
Способ 2 LCMS
[M+H]+
[M+H]+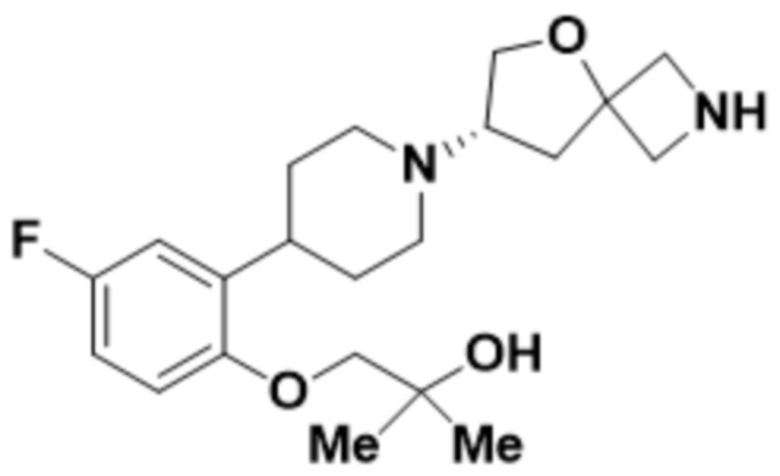
Способ 1 LCMS
[M+H]+
[M+H]+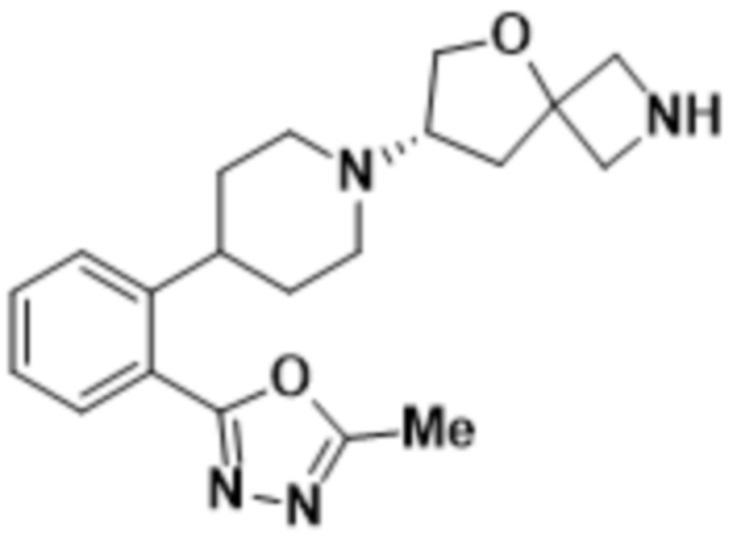
Способ 1 LCMS
[M+H]+
[M+H]+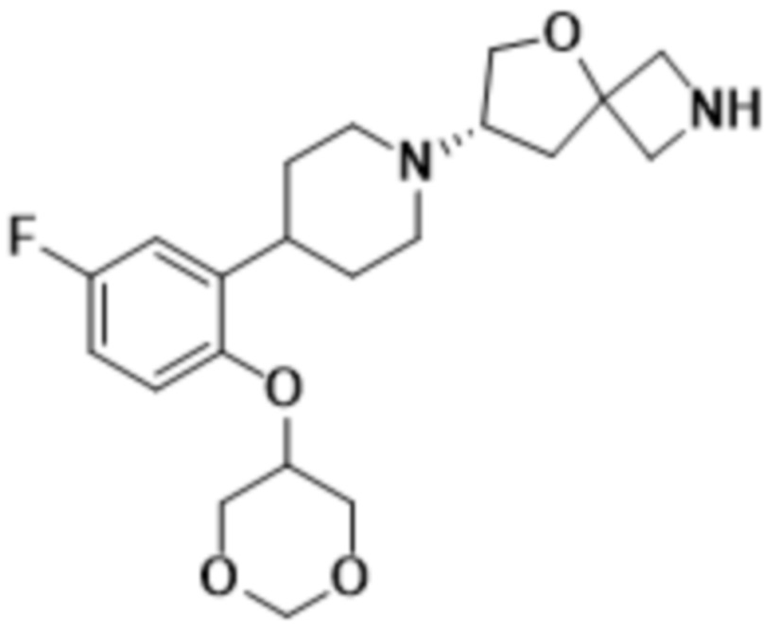
Способ 1 LCMS
[M+H]+
[M+H]+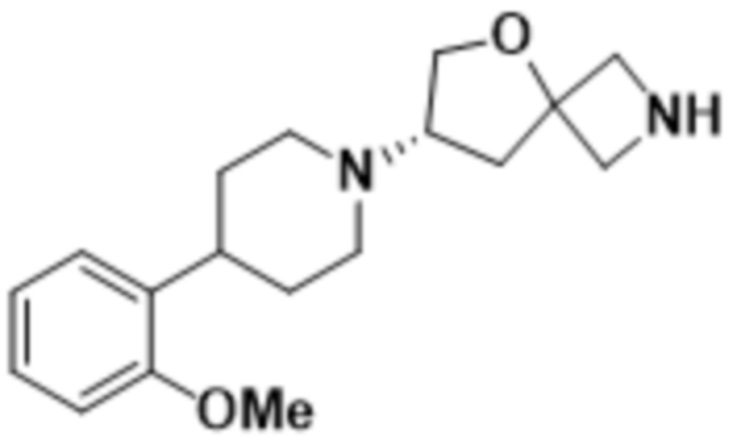
Способ 2 LCMS
[M+H]+
[M+H]+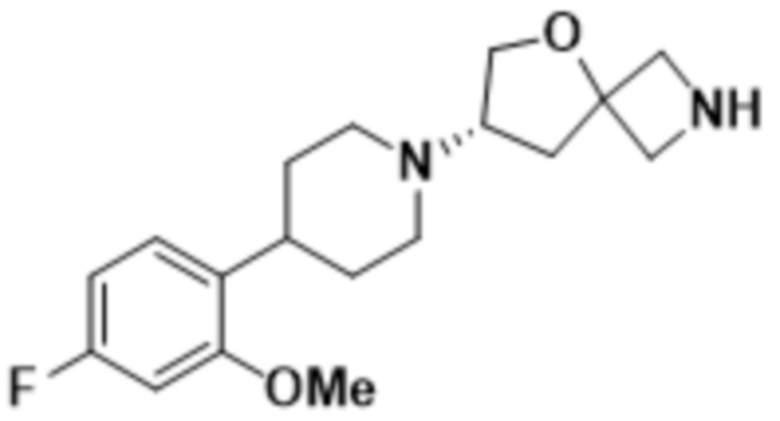
Способ 1 LCMS
[M+H]+
[M+H]+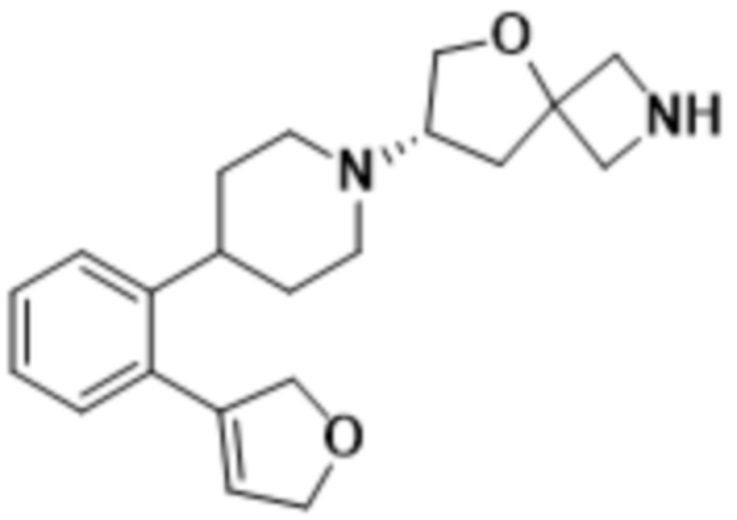
Способ 2 LCMS
[M+H]+
[M+H]+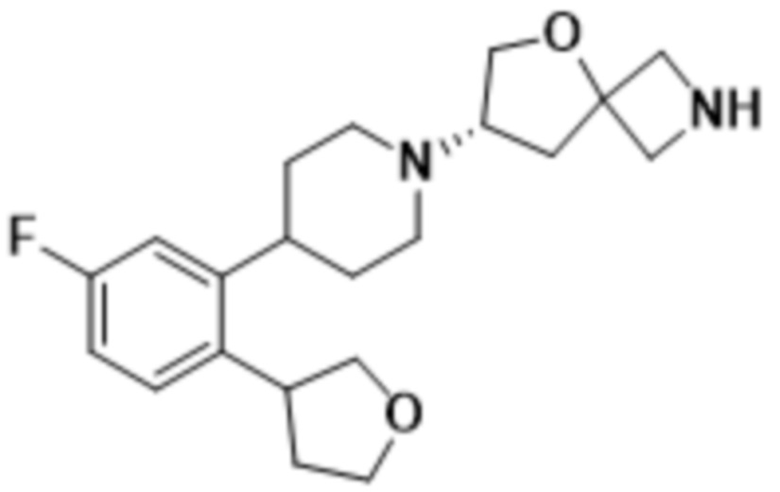
Способ 1 LCMS
[M+H]+
[M+H]+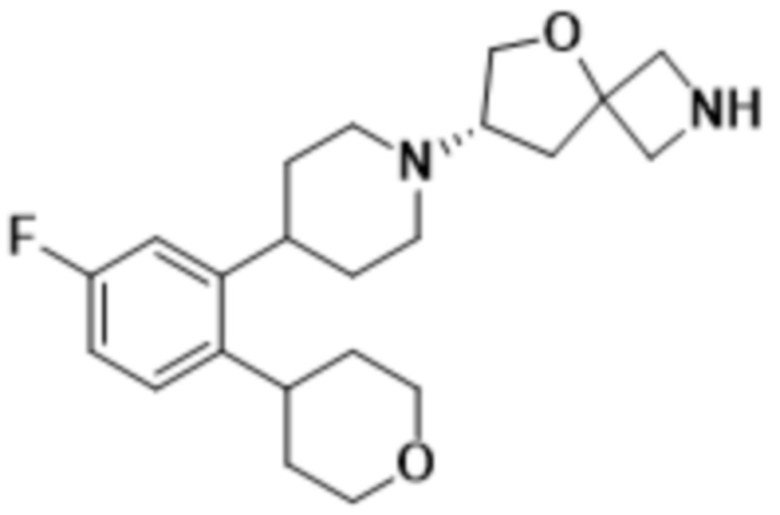
Способ 1 LCMS
[M+H]+
[M+H]+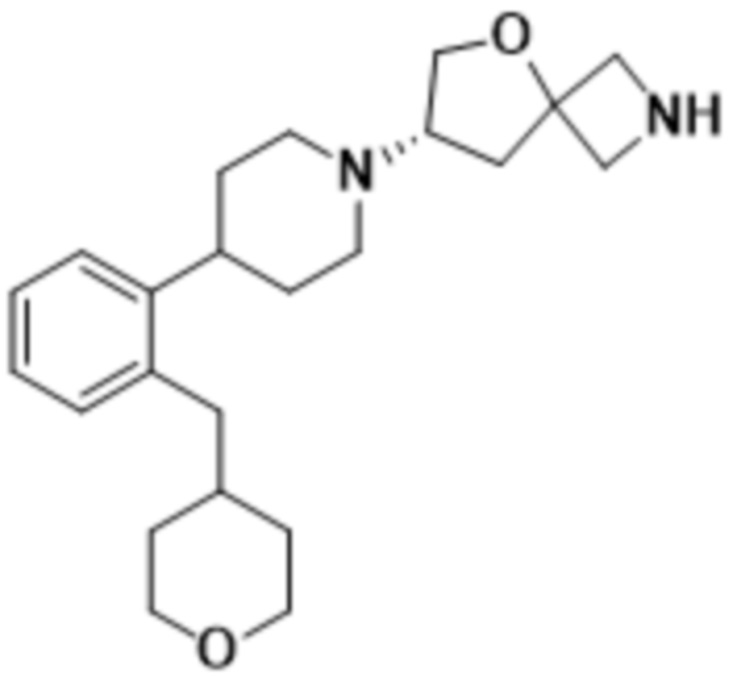
Способ 1 LCMS
[M+H]+
[M+H]+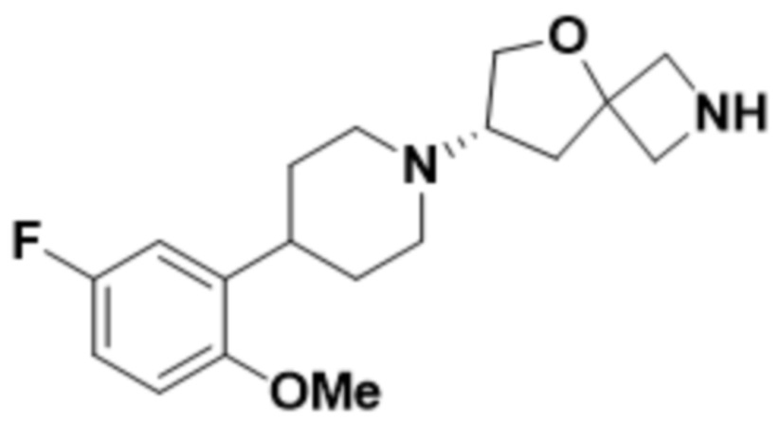
Способ 1 LCMS
[M+H]+
[M+H]+
Способ 1 LCMS
[M+H]+
[M+H]+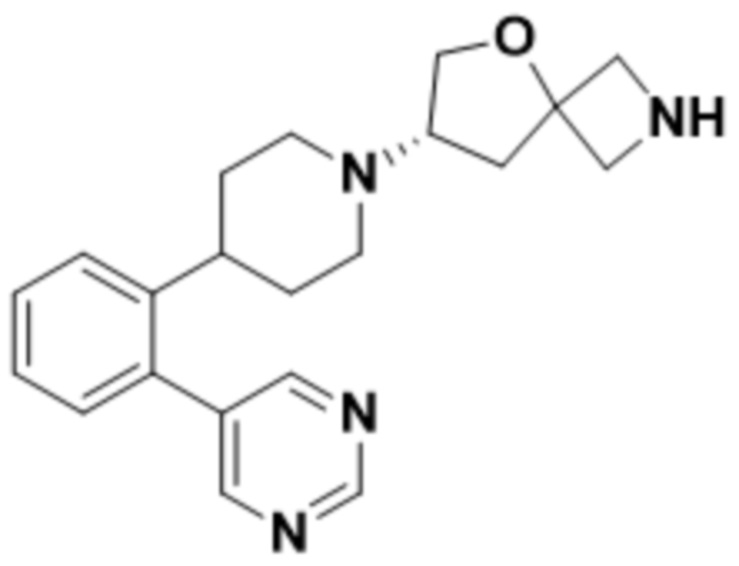
Способ 1 LCMS
[M+H]+
[M+H]+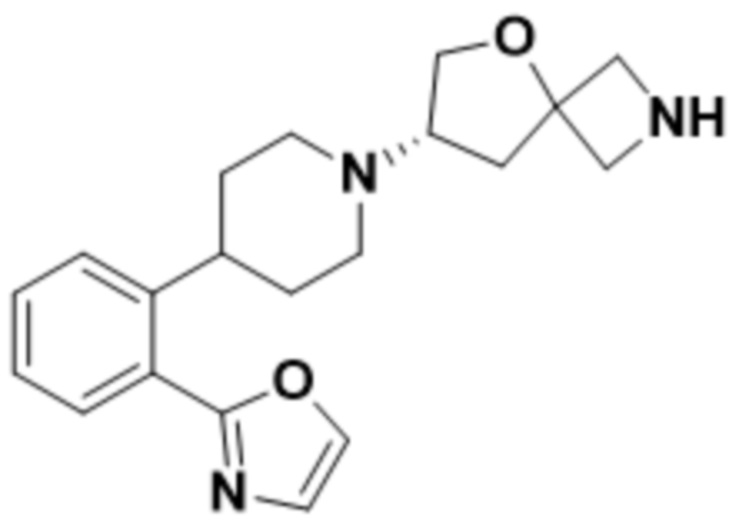
Способ 1 LCMS
[M+H]+
[M+H]+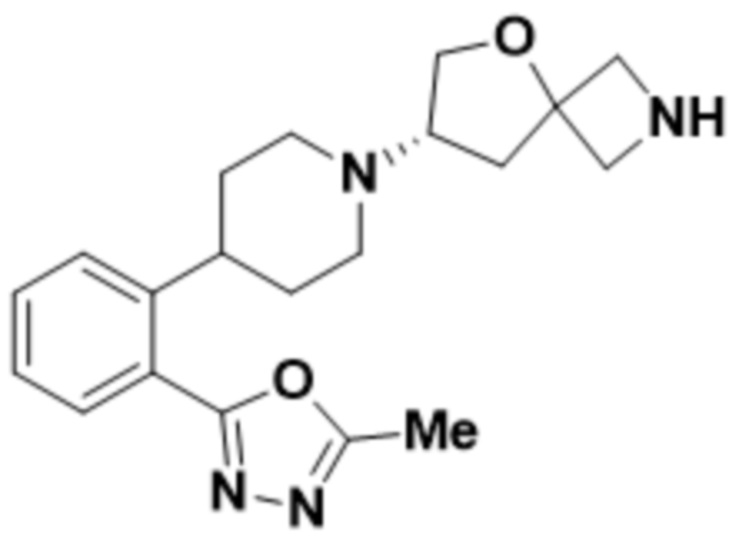
Способ 1 LCMS
[M+H]+
[M+H]+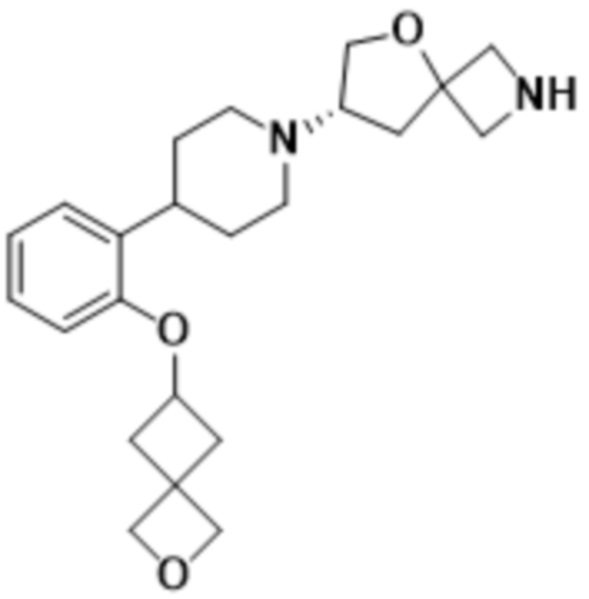
Способ 1 LCMS
[M+H]+
[M+H]+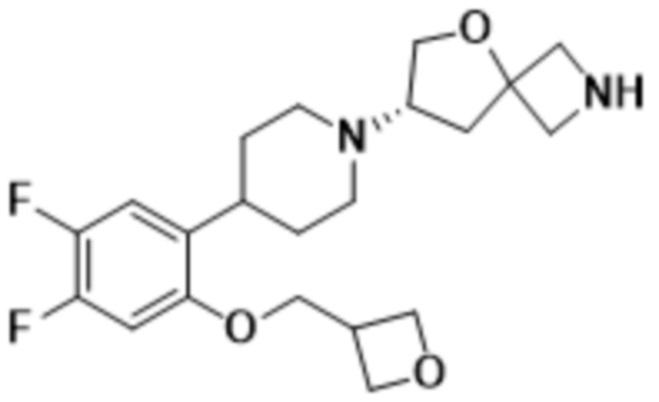
Способ 1 LCMS
[M+H]+
[M+H]+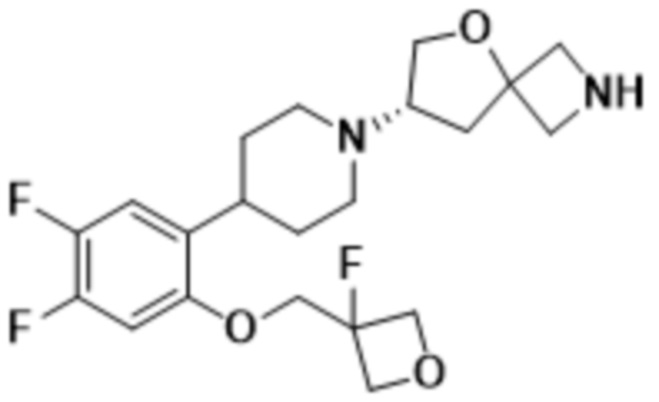
Способ 1 LCMS
[M+H]+
[M+H]+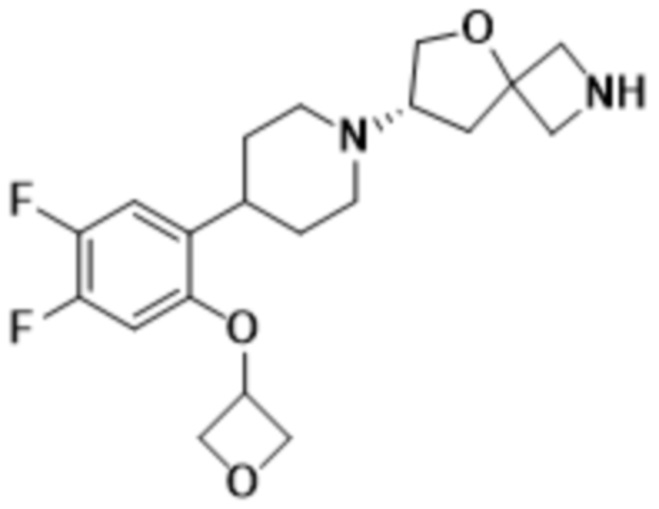
Способ 1 LCMS
[M+H]+
[M+H]+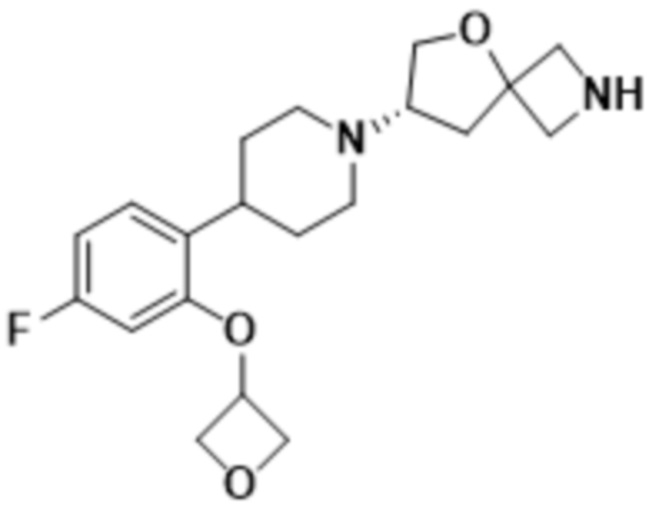
Способ 1 LCMS
[M+H]+
[M+H]+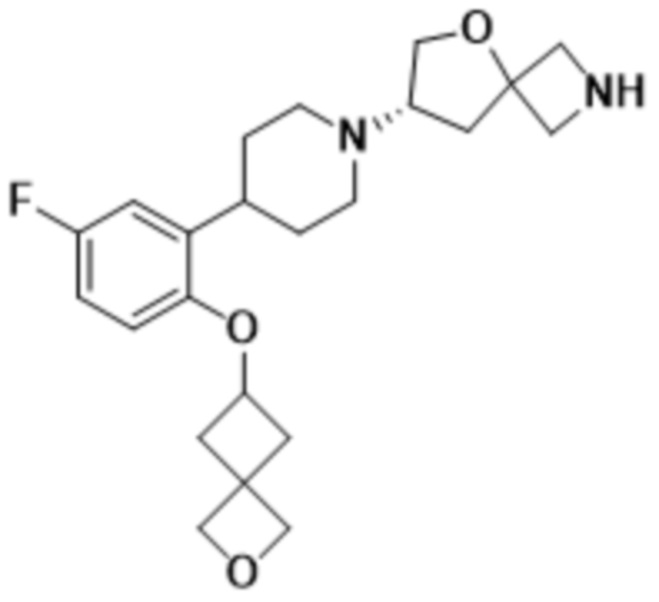
Способ 1 LCMS
[M+H]+
[M+H]+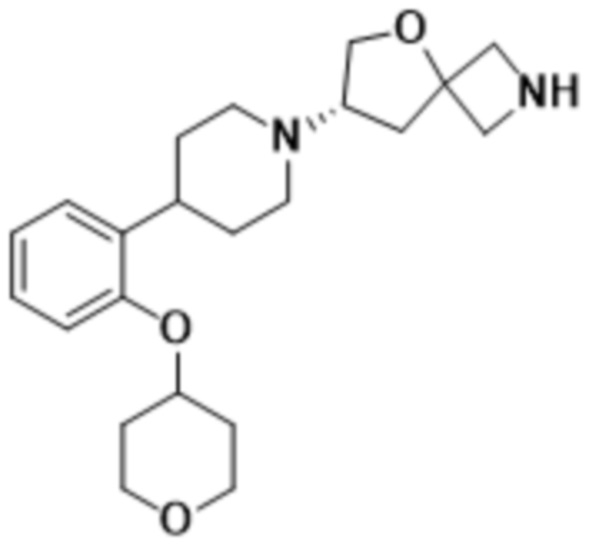
Способ 1 LCMS
[M+H]+
[M+H]+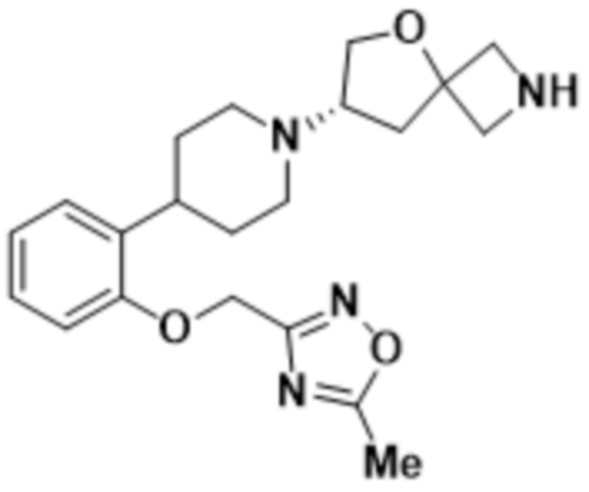
Способ 1 LCMS
[M+H]+
[M+H]+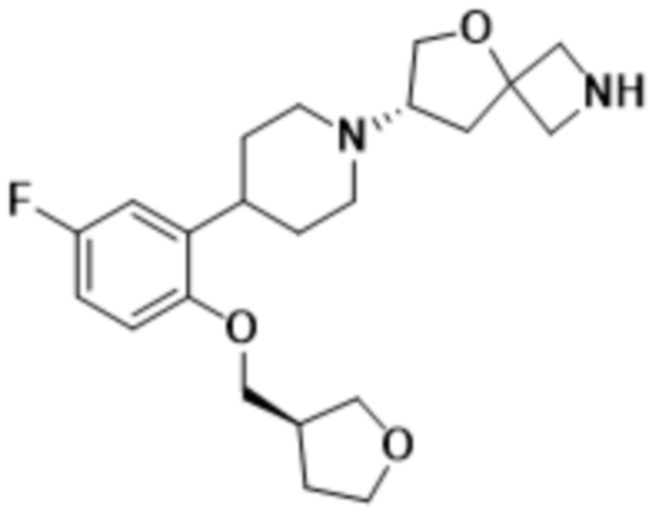
Способ 2 LCMS
[M+H]+
[M+H]+
Промежуточное соединение 8A. (S)-2-(1-(2-(1,3,4-Тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол
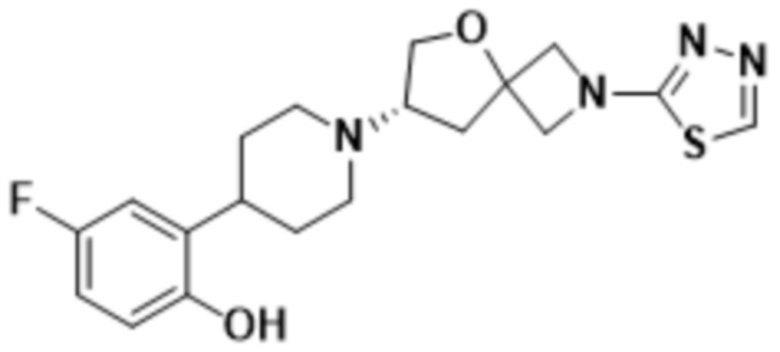
трет-Бутил-(S)-7-(4-(5-фтор-2-гидроксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилатфторфенол (промежуточное соединение 4A, 619 мг, 1,523 ммоль) растворяли в DCM (3 мл) и добавляли TFA (1,0 мл). Реакционную смесь перемешивали при к. т. в течение одного часа, добавляли дополнительное количество TFA (1,0 мл) и реакционную смесь перемешивали в течение еще одного часа при к. т. Затем реакционную смесь концентрировали и неочищенное вещество растворяли в 2% водном растворе TPGS-750-M (6,8 мл) и добавляли THF (0,76 мл), K3PO4 (970 мг, 4,57 ммоль) и 2-бром-1,3,4-тиадиазол (503 мг, 3,05 ммоль). Реакционную смесь перемешивали при 60°C в течение 40 минут, а затем охлаждали до комнатной температуры, разбавляли насыщенным водным раствором NaHCO3 и экстрагировали с помощью EtOAc. Объединенные органические слои высушивали над MgSO4, фильтровали и концентрировали. Неочищенное вещество очищали с помощью FCC (0-10% MeOH (10% NH4OH)/DCM) с получением указанного в заголовке промежуточного соединения (78 мг, 0,200 ммоль) в виде белого твердого вещества.
LCMS: Rt= 0,75 мин. (способ 2 LCMS); MS масса/заряд 391,1 [M+H]+.
1H ЯМР (CD3OD) δ 8,66 (s, 1H), 6,90-6,79 (m, 1H), 6,77-6,62 (m, 2H), 4,36-4,03 (m, 5H), 3,84-3,72 (m, 1H), 3,17-3,05 (m, 3H), 3,03-2,82 (m, 2H), 2,62-2,50 (m, 1H), 2,35-2,13 (m, 3H), 1,93-1,79 (m, 2H), 1,79-1,61 (m, 2H).
Промежуточное соединение 8B. (S)-7-(4-(2-(Бензилокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
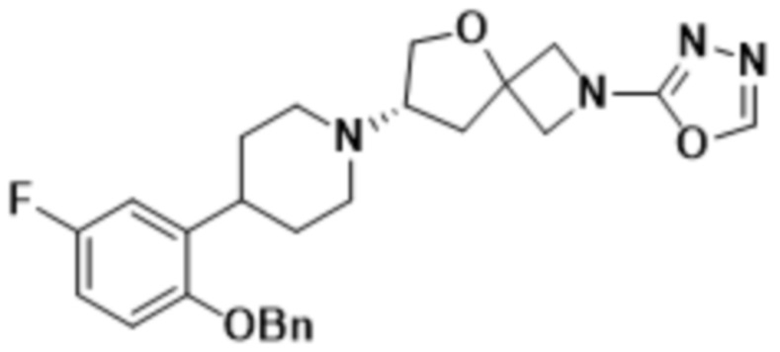
(S)-7-(4-(2-(Бензилокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7B, 1,00 г, 2,52 ммоль) растворяли в THF (25 мл). Реакционный раствор охлаждали до -5°С на бане со льдом и ацетоном. Добавляли DIPEA (0,97 мл, 5,55 ммоль) с последующим добавлением этил-5-бром-1,3,4-оксадиазол-2-карбоксилата (0,725 г, 3,28 ммоль) в виде твердого вещества. Смесь перемешивали в течение 30 мин. при -5°С и затем реакционную смесь концентрировали при пониженном давлении. К остатку добавляли EtOAc, органическую фазу промывали водой и водный слой экстрагировали с помощью EtOAc. Объединенные органические вещества промывали солевым раствором, высушивали над сульфатом натрия и концентрировали. Остаток растворяли в THF (25 мл) и обрабатывали с помощью LiOH (0,36 г, 15,1 ммоль), растворенного в воде (8,3 мл), по каплям в течение 3 минут. Затем реакционную смесь перемешивали при к. т. в течение ночи. Затем реакционную смесь охлаждали до -10°C и добавляли 1 M водный раствор HCl в течение 3 часов до достижения pH 2. Затем реакционную смесь выливали в EtOAc и повышали основность, используя 2 M Na2CO3. Органический слой отделяли и высушивали над сульфатом магния, фильтровали и концентрировали. Остаток затем очищали с помощью FCC (0-10% MeOH (1% NH4OH)/DCM) с получением указанного в заголовке промежуточного соединения (655 мг, 1,325 ммоль).
LCMS: Rt: 2,60 мин. (способ 4 LCMS); MS масса/заряд 465,4 [M+H]+.
Следующее соединение в таблице 7 получали с применением подобной процедуры и соответствующих исходных материалов.
Таблица 7. Промежуточное соединение 8C
способ
масса
масса
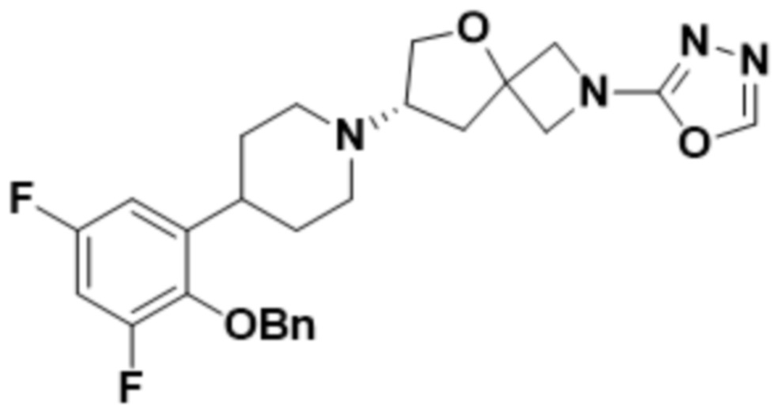
Способ 1 LCMS
[M+H]+
[M+H]+
Промежуточное соединение 9A. (S)-трет-Бутил-7-(4-(2-(((трифторметил)сульфонил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
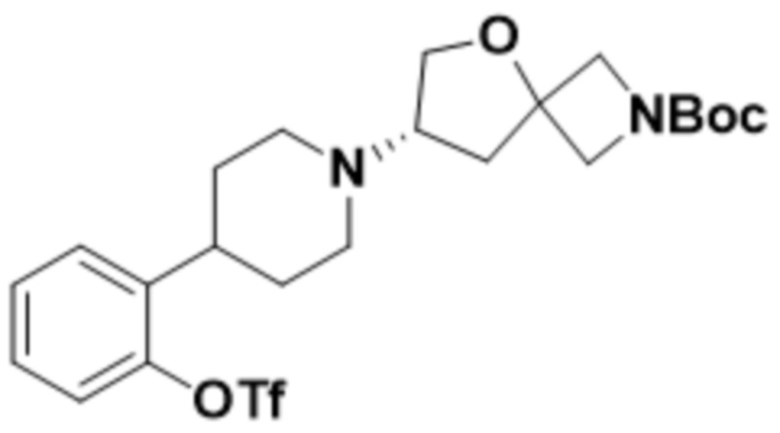
(S)-трет-Бутил-7-(4-(2-гидроксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 4E, 1,00 г, 2,60 ммоль) растворяли в DCM (10 мл) и добавляли пиридин (0,42 мл, 5,2 ммоль) и раствор охлаждали до 0°С. Реакционную смесь перемешивали при 0°С в течение 10 мин., а затем по каплям добавляли трифторметансульфоновый ангидрид (2,337 мл, 2,337 ммоль, 1 М в DCM). Смесь нагревали до комнатной температуры и затем перемешивали в течение 2 часов. Добавляли дополнительное количество пиридина (0,21 мл, 2,6 ммоль), реакционную смесь охлаждали до 0°C и перемешивали в течение 10 мин. Затем по каплям добавляли трифторметансульфоновый ангидрид (1,17 мл, 1,17 ммоль, 1 М в DCM). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, затем добавляли пиридин (0,21 мл, 2,6 ммоль) и реакционную смесь охлаждали до 0°С и перемешивали в течение 10 мин. При 0°С добавляли трифторметансульфоновый ангидрид (1,17 мл, 1,17 ммоль, 1 М в DCM) и реакционную смесь нагревали и перемешивали при комнатной температуре в течение 20 минут. Затем реакционную смесь охлаждали до 0°С, разбавляли с помощью DCM, гасили 10% водным раствором HCl. Слои разделяли и слой DCM промывали насыщ. водн. раствором NaHCO3, солевым раствором, высушивали с помощью MgSO4, фильтровали и выпаривали. Остаток очищали с помощью FCC (0-10% МеОН/DCM) с получением указанного в заголовке промежуточного соединения (1,30 г, 2,28 ммоль).
LCMS: Rt: 3,01 мин. (способ 4 LCMS); MS масса/заряд 521,5 [M+H]+.
Следующее соединение в таблице 8 получали с применением подобной процедуры и соответствующих исходных материалов.
Таблица 8. Промежуточное соединение 9B
способ
масса
масса
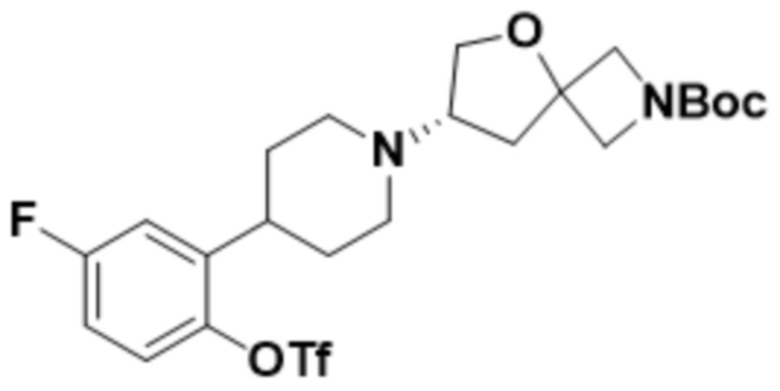
Способ 2 LCMS
[M+H]+
[M+H]+
Промежуточное соединение 10A. трет-Бутил-(S)-7-(4-(2-(пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
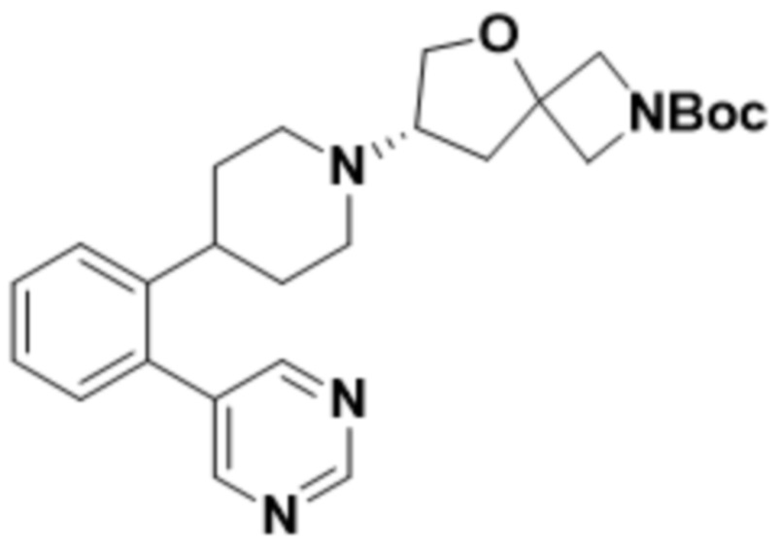
В стеклянный флакон для микроволновой обработки, высушенный в печи, добавляли XPhos Pd G2 (12 мг, 0,015 ммоль), XPhos (15 мг, 0,031 ммоль), тетрагидроксидибор (44 мг, 0,46 ммоль) и ацетат калия (37 мг, 0,62 ммоль). Сосуд запечатывали, затем вакуумировали и снова заполняли газообразным азотом (процесс повторяли четыре раза). С помощью шприца добавляли EtOH (3 мл), с последующим добавлением раствора трет-бутил-(S)-7-(4-(2-(((трифторметил)сульфонил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилата (промежуточное соединение 9А, 80 мг, 0,15 ммоль) в EtOH (3 мл). Реакционную смесь перемешивали в микроволновой печи при 80°С в течение 2 часов. Затем добавляли карбонат калия (64 мг, 0,46 ммоль) в воде (1 мл, предварительно дегазированный), с последующим добавлением раствора 5-бромпиримидина (37 мг, 0,23 ммоль) в THF (2 мл, дегазированный). Реакционную смесь перемешивали в микроволновой печи при 80°С в течение 14 часов, затем фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью FCC (0-100% EtOAc (1% (10% NH4OH в MeOH))/гептан) с получением указанного в заголовке промежуточного соединения (53 мг, 0,12 ммоль).
LCMS: Rt: 0,97 мин. (способ 2 LCMS); MS масса/заряд 451,3 [M+H]+.
Следующие соединения в таблице 9 получали с применением подобной процедуры и соответствующих исходных материалов.
Таблица 9. Промежуточные соединения 10B - 10E
способ
масса
масса
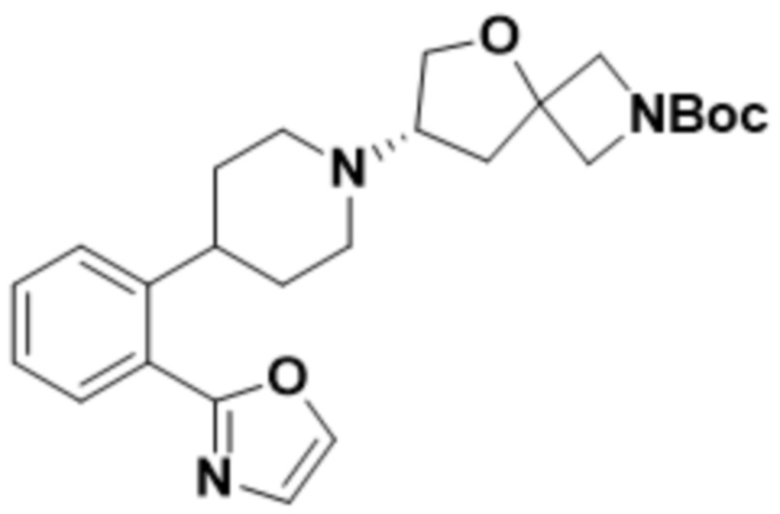
Способ 2 LCMS
[M+H]+
[M+H]+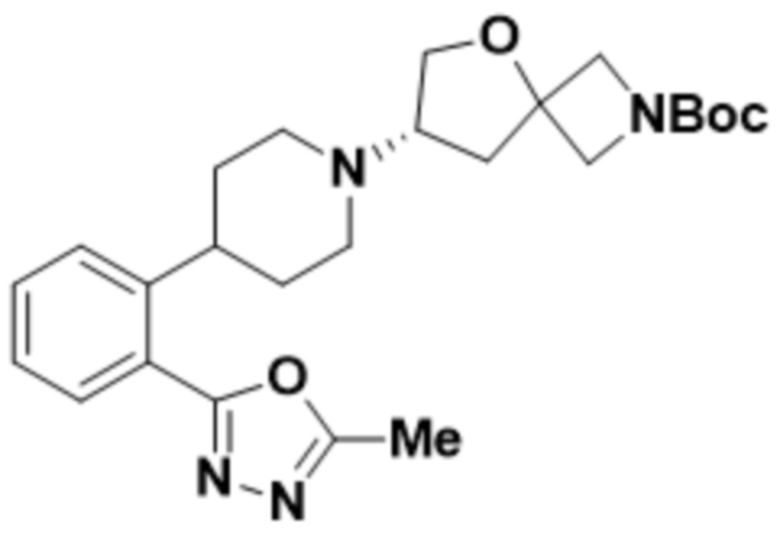
Способ 2 LCMS
[M+H]+
[M+H]+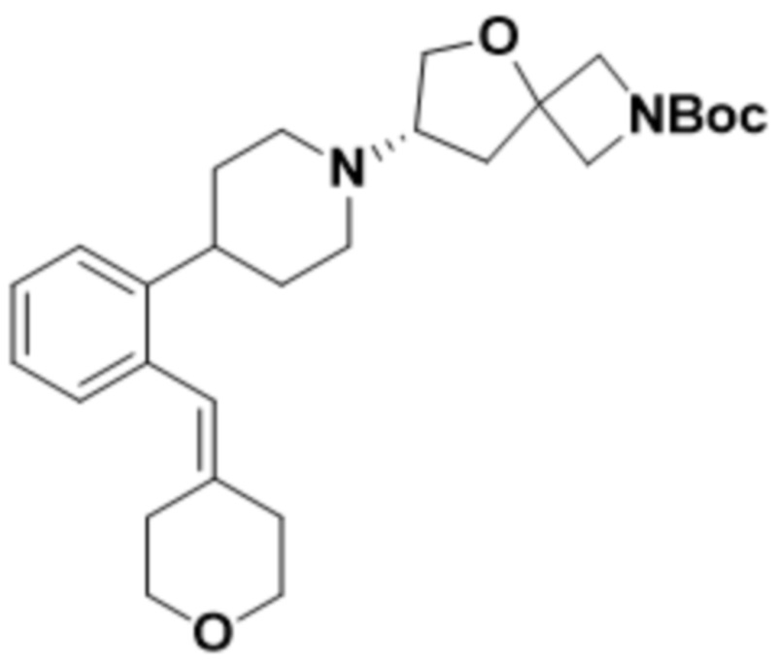
Способ 2 LCMS
[M+H]+
[M+H]+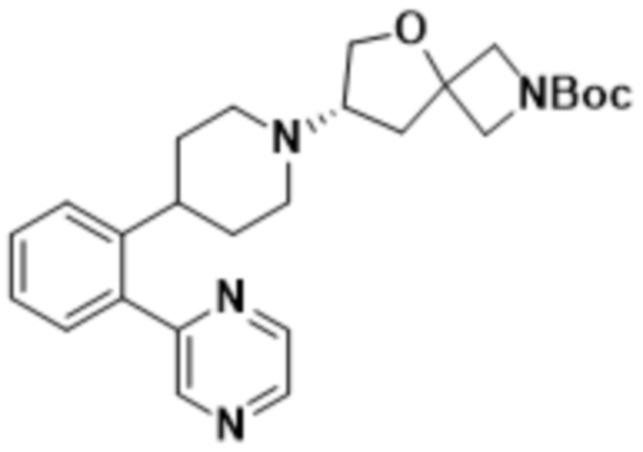
Способ 2 LCMS
[M+H]+
[M+H]+
Промежуточное соединение 11A. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбонитрил
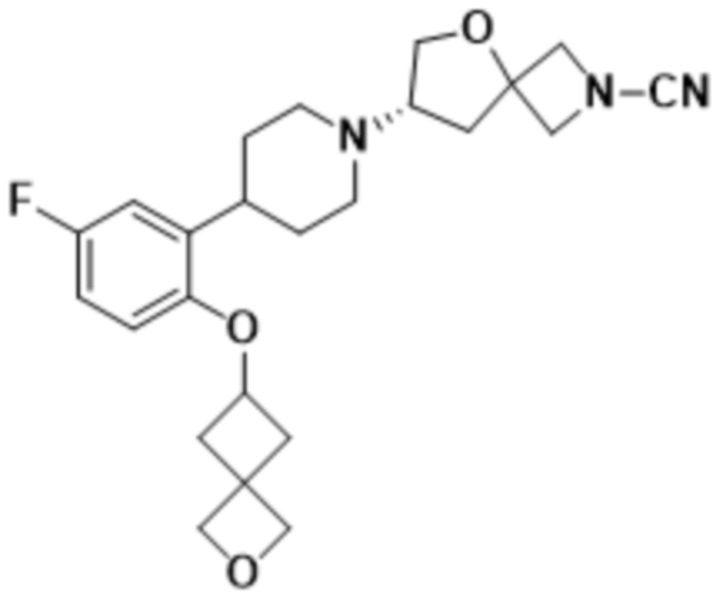
В круглодонной колбе раствор (S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7NN, 0,136 г, 0,338 ммоль) в DCM (3,4 мл) помещали в атмосферу азота. Добавляли триэтиламин (0,240 мл, 1,689 ммоль) с последующим добавлением бромистого цианогена (0,054 г, 0,507 ммоль). Реакционную смесь перемешивали в течение 2,5 часа, а затем гасили 0,1 н. раствором NaOH до рН>12 и экстрагировали с помощью DCM. Объединенные органические слои промывали 0,1 н. раствором NaOH и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали. Остаток очищали с помощью FCC (0-100% 10% 7 н. NH3 в MeOH/DCM) с получением указанного в заголовке промежуточного соединения в виде белого твердого вещества (115 мг, 0,269 ммоль).
LCMS: Rt: 0,95 мин. (способ 2 LCMS); MS масса/заряд 428,5 [M+H]+.
Следующие соединения в таблице 10 получали подобным образом с применением соответствующих исходных материалов.
Таблица 10. Промежуточные соединения 11B - 11C
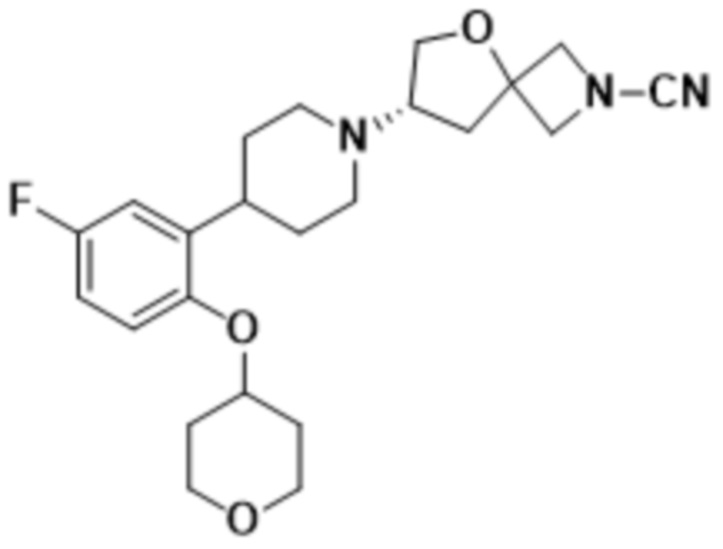
Способ 2 LCMS
[M+H]+
[M+H]+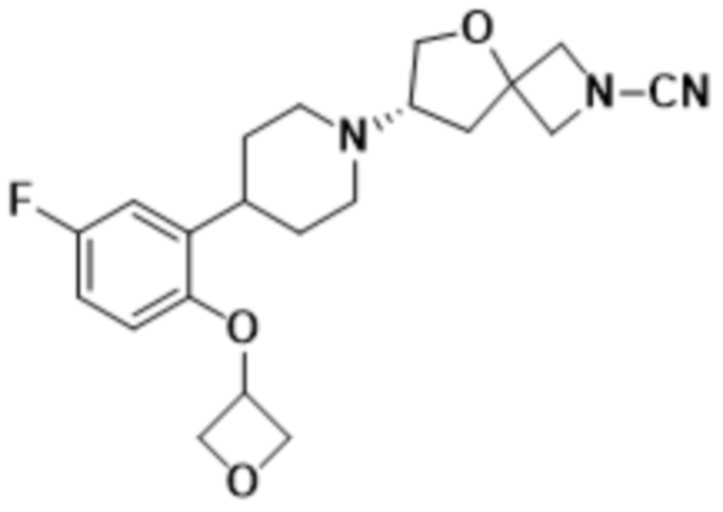
Способ 2 LCMS
[M+H]+
[M+H]+
Промежуточное соединение 12A. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-N-гидрокси-5-окса-2-азаспиро[3.4]октан-2-карбоксимидамид
В круглодонной колбе объемом 100 мл к раствору (S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбонитрила (промежуточное соединение 11A, 115 мг, 0,269 ммоль) в THF (2,7 мл) добавляли K2CO3 (112 мг, 0,807 ммоль) с последующим добавлением гидрохлорида гидроксиламина (33,6 мг, 0,484 ммоль). Реакционную смесь перемешивали при 50°С в течение 5 часов, а затем при к. т. в течение 17 часов. Добавляли дополнительное количество гидрохлорида гидроксиламина (6,6 мг, 0,09 ммоль) и реакционную смесь перемешивали при 50°С в течение 40 минут и затем реакционную смесь концентрировали и остаток поглощали в 10:1 DCM:МеОН, фильтровали через целит и концентрировали. Полученное прозрачное масло высушивали в условиях высокого вакуума в течение ночи с получением желтого твердого вещества, которое использовали без дополнительной очистки (119 мг, 0,259 ммоль).
LCMS: Rt: 0,84 мин. (способ 2 LCMS); MS масса/заряд 461,4 [M+H]+.
Следующие соединения в таблице 11 получали подобным образом с применением соответствующих исходных материалов.
Таблица 11. Промежуточные соединения 12B - 12C
Способ 2 LCMS
[M+H]+
[M+H]+
Способ 2 LCMS
[M+H]+
[M+H]+
Пример 1A. (S)-7-(4-(5-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
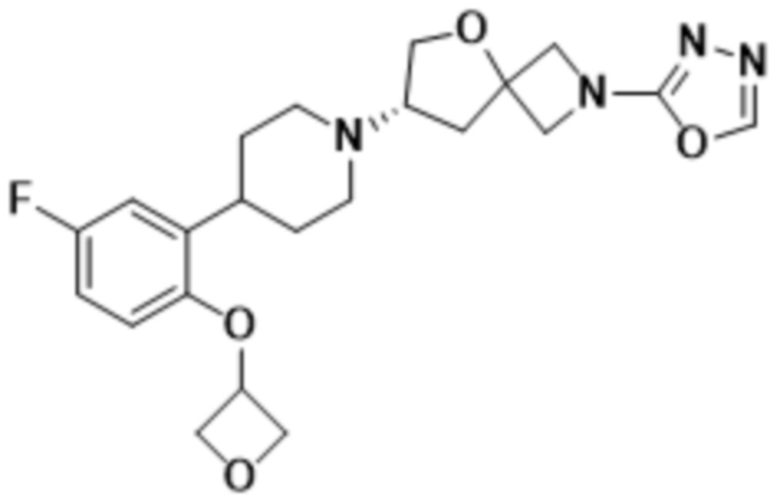
(S)-7-(4-(5-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7A, 540 мг, 1,49 ммоль) растворяли в 2% водном растворе TPGS-750-M (2,6 мл) и THF (0,3 мл). Затем добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (329 мг, 1,49 ммоль) и трехосновный фосфат калия (949 мг, 4,47 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, затем добавляли 2 М LiOH (2,2 мл, 4,5 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли MeOH (6 мл) с последующим добавлением 4 н. раствор HCl для регулирования реакционной смеси до pH=2; затем перемешивали при комнатной температуре в течение 4 часов. Затем рН реакционной смеси регулировали до >8, водный слой экстрагировали с помощью DCM, объединенные органические слои высушивали над MgSO4, фильтровали и концентрировали in vacuo. Остаток очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно очищали с помощью препаративной HPLC (XBridge 30×50 мм, 5 мкм, 15-40% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (214 мг, 0,495 ммоль).
LCMS: Rt: 1,77 мин. (способ 4 LCMS); MS масса/заряд 431,1 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,65 (s, 1H), 7,04 (dd, J=9,8, 2,9 Гц, 1H), 6,98-6,86 (m, 1H), 6,56 (dd, J=8,9, 4,6 Гц, 1H), 5,30-5,19 (m, 1H), 4,91 (t, J=6,6 Гц, 2H), 4,59-4,47 (m, 2H), 4,22 (d, J=8,7 Гц, 1H), 4,18-4,09 (m, 2H), 4,02 (d, J=8,6 Гц, 1H), 3,94 (t, J=7,6 Гц, 1H), 3,62 (t, J=7,8 Гц, 1H), 3,05-2,74 (m, 4H), 2,45-2,36 (m, 1H), 2,17-2,00 (m, 3H), 1,81-1,51 (m, 4H).
Пример 1B. (S)-7-(4-(5-Фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
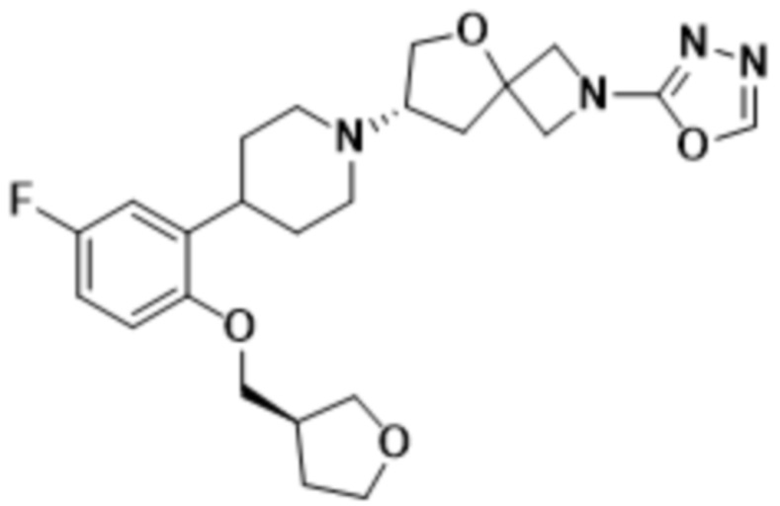
(S)-трет-Бутил-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 6В, 217 мг, 0,442 ммоль) растворяли в DCM (4,4 мл) и добавляли TFA (0,68 мл, 8,85 ммоль). Реакционную смесь перемешивали в течение 4 часов и затем ее концентрировали и остаток растворяли в DCM. Органическую фазу промывали 1 н. NaOH и солевым раствором и концентрировали. Затем часть этого материала (97 мг, 0,248 ммоль) растворяли в THF (0,05 мл), добавляли 2% водный раствор TPGS-750-М (0,45 мл) и этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (54 мг, 0,248 ммоль) и K3PO4 (52,7 мг, 0,248 ммоль). Реакционную смесь обрабатывали так же, как в примере 1А, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и препаративной HPLC (колонка C18 OBD 30×50 мм, 5 мкм, 75 мл/мин., 25-50% MeCN/H2O (5 мМ NH4OH) с получением указанного в заголовке соединения (43 мг, 0,092 ммоль).
LCMS: Rt: 2,05 мин. (способ 4 LCMS); MS масса/заряд 459,1 [M+H]+.
1H ЯМР (DMSO-d6) δ: 8,64 (s, 1H), 6,92-7,02 (m, 3H), 4,22 (d, J=8,8 Гц, 1H), 4,13 (dd, J=8,6, 2,7 Гц, 2H), 4,02 (d, J=8,3 Гц, 1H), 3,98-3,91 (m, 2H), 3,90-3,80 (m, 2H), 3,76 (td, J=8,1, 5,4 Гц, 1H), 3,72-3,65 (m, 1H), 3,65-3,58 (m, 1H), 3,53 (dd, J=8,3, 5,9 Гц, 1H), 3,04-2,91 (m, 2H), 2,89-2,74 (m, 2H), 2,70-2,61 (m, 1H), 2,45-2,37 (m, 1H), 2,13-1,97 (m, 4H), 1,74-1,63 (m, 3H), 1,63-1,51 (m, 2H).
Пример 1C. Этил-5-((S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-ил)-1,3,4-оксадиазол-2-карбоксилат
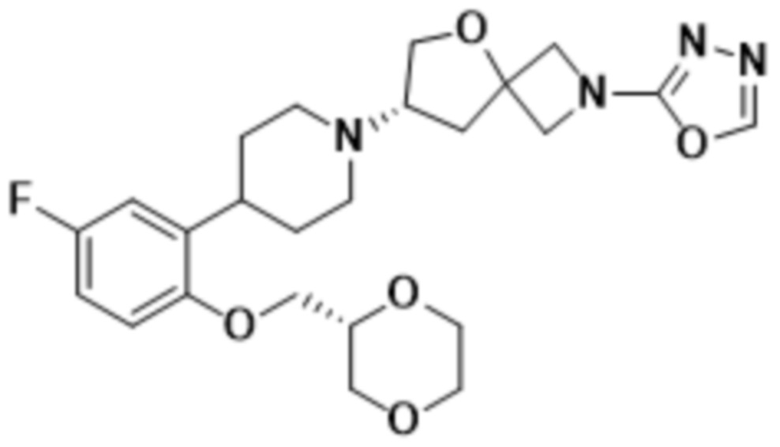
(S)-7-(4-(2-(((R)-1,4-Диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7C, 84 мг, 0,21 ммоль) растворяли в 2% водном растворе TPGS-750-M (372 мкл) и THF (41 мкл). Добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (46 мг, 0,21 ммоль) и трехосновный фосфат калия (44 мг, 0,21 ммоль) и реакционную смесь обрабатывали аналогично примеру 1А. Неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и препаративной HPLC (XBridge 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (28 мг, 0,058 ммоль).
LCMS: Rt: 1,90 мин. (способ 4 LCMS); MS масса/заряд 475,2 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,02-6,92 (m, 3H), 4,22 (d, J=8,8 Гц, 1H), 4,13 (dd, J=8,3, 3,9 Гц, 2H), 4,04-3,89(m, 4H), 3,81-3,88 (m, 2H), 3,80-3,74 (m, 1H), 3,71-3,65 (m, 1H), 3,64-3,58 (m, 2H), 3,53-3,43 (m, 2H), 3,03-2,92 (m, 2H), 2,88-2,75 (m, 2H), 2,41 (dd, J=12,7, 7,3 Гц, 1H), 2,12-2,01 (m, 3H), 1,75-1,66 (m, 2H), 1,65-1,51(m, 2H).
Пример 1D. (S)-7-(4-(5-Фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
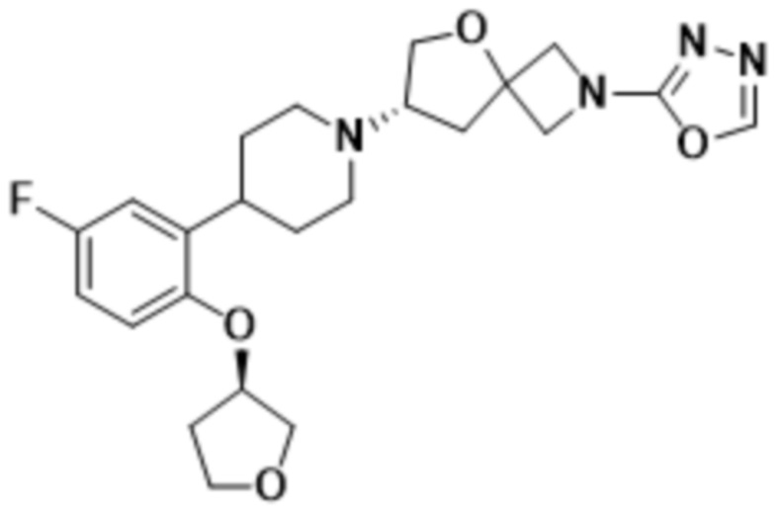
(S)-7-(4-(2-(((R)-1,4-Диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7D, 84 мг, 0,21 ммоль) растворяли в 2% водном растворе TPGS-750-M (372 мкл) и THF (41 мкл). Добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (46 мг, 0,21 ммоль) и трехосновный фосфат калия (44 мг, 0,21 ммоль) и реакционную смесь обрабатывали аналогично примеру 1А. Неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) с последующим применением препаративной HPLC (XBridge 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (36 мг, 0,058 ммоль).
LCMS: Rt: 1,91 мин. (способ 4 LCMS); MS масса/заряд 445,1 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,65 (s, 1H), 7,07-6,88 (m, 3H), 5,01 (t, J=5,3 Гц, 1H), 4,22 (d, J=8,7 Гц, 1H), 4,18-4,09 (m, 2H), 4,02 (d, J=8,4 Гц, 1H), 3,93 (t, J=7,6 Гц, 1H), 3,89-3,71 (m, 4H), 3,67-3,57 (m, 1H), 3,03-2,90 (m, 2H), 2,80 (t, J=12,7 Гц, 2H), 2,40 (dd, J=12,8, 7,9 Гц, 1H), 2,18 (m, 1H), 2,12-1,89 (m, 4H), 1,63 (m, 4H).
Пример 1E. (S)-3-(2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2,2-диметилпропаннитрил
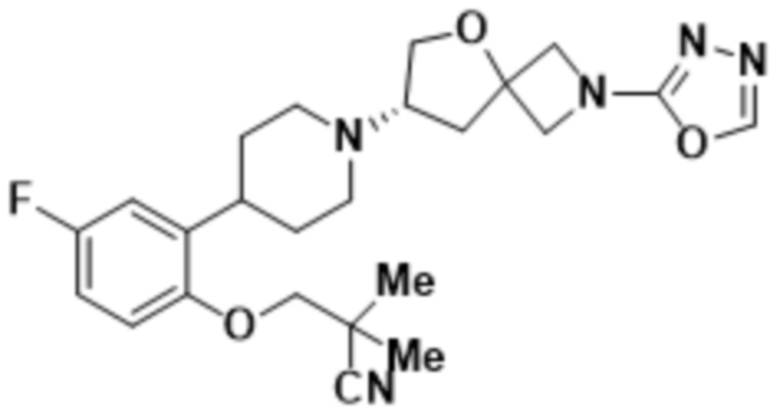
(S)-3-(2-(1-(5-Окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2,2-диметилпропаннитрил (промежуточное соединение 7E, 20 мг, 0,052 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (14 мг, 0,062 ммоль) и трехосновный фосфат калия (13 мг, 0,062 ммоль) растворяли в 2% водном растворе TPGS-750-М (0,7 мл) и THF (0,18 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 дней, затем добавляли 0,5 мл MeOH и моногидрата LiOH (13 мг, 0,31 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли 6 M HCl для регулирования pH до 4 и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Затем повышали основность реакционной смеси раствором бикарбоната натрия, экстрагировали с помощью EtOAc и концентрировали при пониженном давлении. Остаток очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (2,8 мг, 0,0060 ммоль).
LCMS: Rt: 2,09 мин. (способ 4 LCMS); MS масса/заряд 456,3 [M+H]+.
1H ЯМР (CD3OD) δ 8,39 (s, 1H), 7,02-6,81 (m, 3H), 4,35-4,24 (m, 2H), 4,23-4,12 (m, 2H), 4,11-4,03 (m, 1H), 3,95 (s, 2H), 3,81-3,71 (m, 1H), 3,12-3,04 (m, 3H), 2,95-2,85 (m, 1H), 2,62-2,51 (m, 1H), 2,34-2,20 (m, 2H), 2,18-2,08 (m, 1H), 1,98-1,85 (m, 2H), 1,77-1,62 (m, 2H), 1,50 (s, 6H).
Пример 1F. (S)-7-(4-(2-(((S)-1,4-Диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
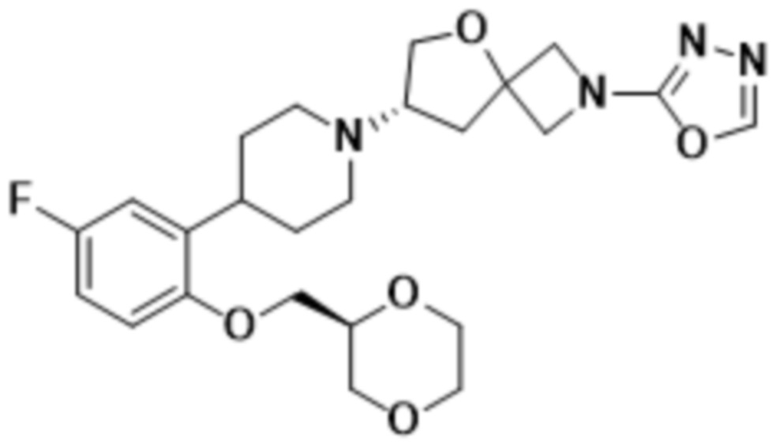
(S)-7-(4-(2-(((S)-1,4-Диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7F, 84 мг, 0,21 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (46 мг, 0,21 ммоль) и трехосновный фосфат калия (44 мг, 0,21 ммоль) растворяли в 2% водном растворе TPGS-750-M (0,37 мл) и THF (0,041 мл). Реакционную смесь обрабатывали аналогично примеру 1А. Неочищенное вещество очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (29 мг, 0,059 ммоль).
LCMS: Rt: 1,90 мин. (способ 4 LCMS); MS масса/заряд 475,1 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,03-6,92 (m, 3H), 4,22 (d, J=8,8 Гц, 1H), 4,16-4,09 (m, 2H), 4,05-3,89 (m, 4H), 3,88-3,80 (m, 2H), 3,80-3,74 (m, 1H), 3,72-3,58 (m, 3H), 3,53-3,43 (m, 2H), 3,03-2,92 (m, 2H), 2,88-2,75 (m, 2H), 2,41 (dd, J=13,0, 7,1 Гц, 1H), 2,13-2,01 (m, 3H), 1,78-1,63 (m, 2H), 1,63-1,51 (m, 2H).
Пример 1G. (S)-7-(4-(5-Фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
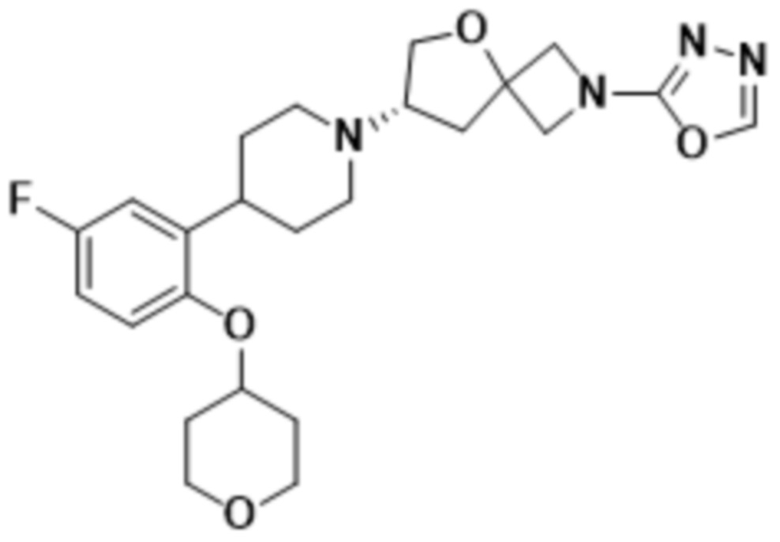
(S)-7-(4-(5-Фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7G, 70 мг, 0,18 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (40 мг, 0,18 ммоль) и трехосновный фосфат калия (38 мг, 0,18 ммоль) растворяли в 2% водном растворе TPGS-750-M (0,32 мл) и THF (0,036 мл). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (21 мг, 0,044 ммоль).
LCMS: Rt: 1,58 мин. (способ 4 LCMS); MS масса/заряд 459,3 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,07-6,90 (m, 3H), 4,53 (m, 1H), 4,22 (d, J=8,8 Гц, 1H), 4,15-4,10 (m, 2H), 4,02 (d, J=8,3 Гц, 1H), 3,94 (dd, J=8,3, 6,8 Гц, 1H), 3,85-3,76 (m, 2H), 3,66-3,59 (m, 1H), 3,50 (m, 2H), 3,02-2,93 (m, 2H), 2,92-2,77 (m, 2H), 2,40 (dd, J=12,7, 7,3 Гц, 1H), 2,12-2,02 (m, 3H), 1,98-1,88 (m, 2H), 1,75-1,65 (m, 2H), 1,64-1,53 (m, 4H).
Пример 1H. (S)-7-(4-(5-Фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
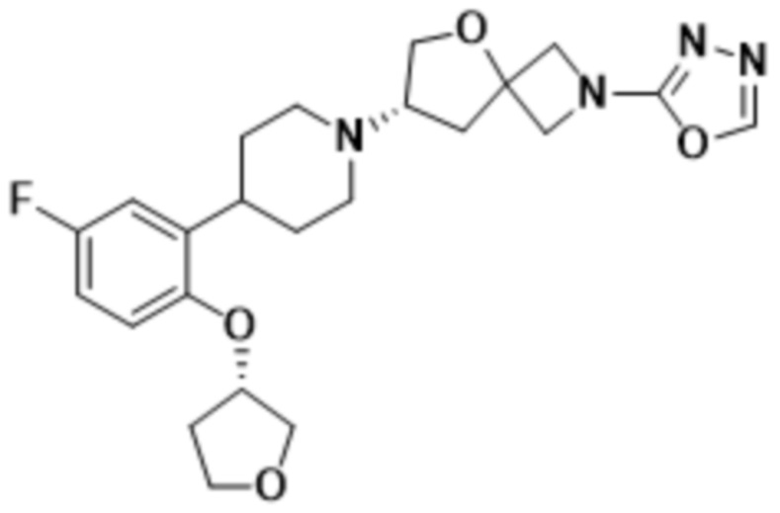
(S)-трет-Бутил-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 7H, 91 мг, 0,24 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (53 мг, 0,24 ммоль) и трехосновный фосфат калия (51 мг, 0,24 ммоль) растворяли в 2% водном растворе TPGS-750-М (0,44 мл) и THF (0,048 мл). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (42 мг, 0,092 ммоль).
LCMS: Rt: 1,91 мин. (способ 4 LCMS); MS масса/заряд 445,1 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,65 (s, 1H), 7,04-6,90 (m, 3H), 5,05-4,98 (m, 1H), 4,22 (d, J=8,8 Гц, 1H), 4,15-4,09 (m, 2H), 4,02 (d, J=8,5 Гц, 1H), 3,96-3,90 (m, 1H), 3,89-3,82 (m, 1H), 3,82-3,71 (m, 3H), 3,66-3,57 (m, 1H), 3,02-2,91 (m, 2H), 2,85-2,74 (m, 2H), 2,42-2,36 (m, 1H), 2,26-2,12 (m, 1H), 2,10-1,90 (m, 4H), 1,75-1,48 (m, 4H).
Пример 1I. (S)-7-(4-(5-Фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
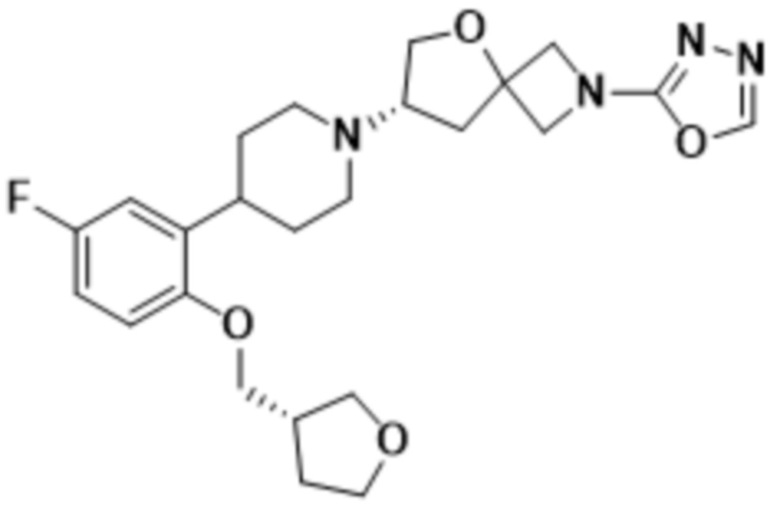
(S)-7-(4-(5-Фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7J, 81 мг, 0,21 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (46 мг, 0,21 ммоль) и трехосновный фосфат калия (44 мг, 0,21 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (0,37 мл) и THF (0,042 мл) и реакционную смесь обрабатывали аналогично примеру 1А. Остаток очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (30 мг, 0,064 ммоль).
LCMS: Rt: 2,05 мин. (способ 4 LCMS); MS масса/заряд 459,5 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,01-6,93 (m, 3H), 4,21 (d, J=8,8 Гц, 1H), 4,12 (dd, J=8,3, 2,4 Гц, 2H), 4,02 (d, J=8,3 Гц, 1H), 3,97-3,91 (m, 2H), 3,90-3,80 (m, 2H), 3,79-3,73 (m, 1H), 3,72-3,65 (m, 1H), 3,64-3,58 (m, 1H), 3,52 (dd, J=8,6, 6,1 Гц, 1H), 3,01-2,92 (m, 2H), 2,88-2,76 (m, 2H), 2,71-2,59 (m, 1H), 2,40 (dd, J=13,0, 7,1 Гц, 1H), 2,11-1,96 (m, 4H), 1,75-1,63 (m, 3H), 1,62-1,51 (m, 2H).
Пример 1J. (S)-7-(4-(5-Фтор-2-((тетрагидро-2H-пиран-4-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
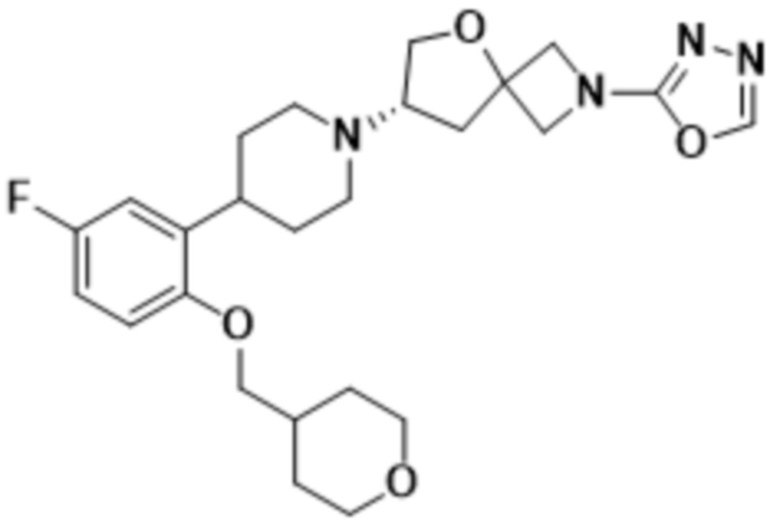
(S)-7-(4-(5-Фтор-2-((тетрагидро-2H-пиран-4-ил)метокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7I, 197 мг, 0,453 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (120 мг, 0,54 ммоль) и DIPEA (0,16 мл, 0,91 ммоль) растворяли в THF (2,3 мл). Реакционную смесь перемешивали в течение 2 ч., а затем выпаривали при пониженном давлении. Остаток растворяли в EtOAc, промывали водой, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в смеси THF (2 мл) и воды (1 мл) и добавляли LiOH (114 мг, 2,72 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем добавляли 6 М водный раствор HCl (0,76 мл) для регулирования pH до 2, и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Затем повышали основность реакционной смеси (pH >8) насыщенным раствором карбоната натрия. Остаток разбавляли с помощью EtOAc, промывали солевым раствором и выпаривали при пониженном давлении. Остаток очищали с помощью FCC (0-10% MeOH (10% NH4OH)/DCM) с получением указанного в заголовке соединения (157 мг, 0,33 ммоль).
LCMS: Rt: 2,16 мин. (способ 4 LCMS); MS масса/заряд 473,7 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,88 (m, 3H), 4,29 (q, J=8,8 Гц, 2H), 4,16 (q, J=8,6 Гц, 2H), 4,10-4,03 (m, 1H), 3,99 (dd, J=10,8, 3,4 Гц, 2H), 3,83 (d, J=6,0 Гц, 2H), 3,78-3,71 (m, 1H), 3,52-3,43 (m, 2H), 3,14-2,84 (m, 4H), 2,54 (dd, J=12,9, 7,4 Гц, 1H), 2,28-1,99 (m, 4H), 1,91-1,59 (m, 6H), 1,51 (m, 2H).
Пример 1K. (S)-7-(4-(5-Фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
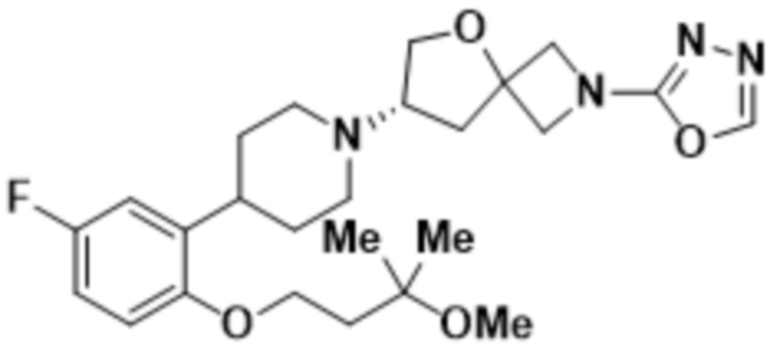
(S)-7-(4-(5-Фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7M, 79 мг, 0,19 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (43 мг, 0,19 ммоль) и K3PO4 растворяли в смеси 2% водного раствора TPGS-750-M (0,35 мл) и THF (0,039 мл). Реакционную смесь обрабатывали аналогично примеру 1A и затем очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 10-30% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (11 мг, 0,022 ммоль).
LCMS: Rt: 2,38 мин. (способ 4 LCMS); MS масса/заряд 475,4 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,01-6,9 (m, 3H), 4,21 (d, J=8,8 Гц, 1H), 4,12 (dd, J=8,6, 2,2 Гц, 2H), 4,05-3,97 (m, 3H), 3,93 (dd, J=8,3, 6,8 Гц, 1H), 3,61 (t, J=7,8 Гц, 1H), 3,11 (s, 3H), 3,01-2,90 (m, 2H), 2,90-2,75 (m, 2H), 2,40 (dd, J=12,7, 7,3 Гц, 1H), 2,10-1,98 (m, 3H), 1,91 (t, J=6,8 Гц, 2H),1,73-1,51 (m, 4H), 1,17 (s, 6H).
Пример 1L. (S)-7-(4-(5-Фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
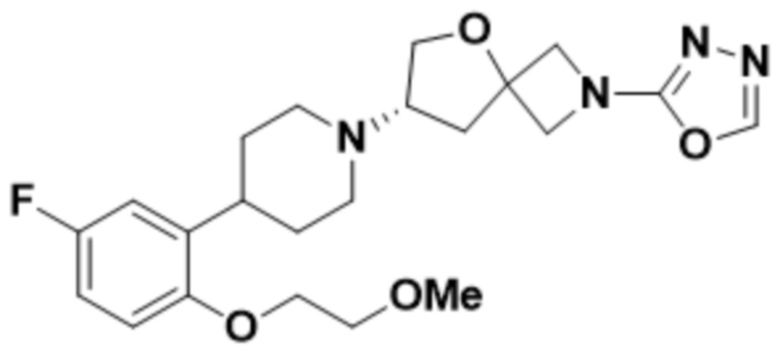
В раствор (S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7N, 61 мг, 0,17 ммоль) в смеси 2% водного TPGS-750-M (0,30 мл) и THF (0,034 мл) добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (37 мг, 0,17 ммоль) с последующим добавлением трехосновного фосфата калия (36 мг, 0,17 ммоль). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (16 мг, 0,036 ммоль).
LCMS: Rt: 1,95 мин. (способ 4 LCMS); MS масса/заряд 433,2 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,64 (s, 1H), 7,04-6,91 (m, 3H), 4,27-3,89 (m, 7H), 3,71-3,57 (m, 3H), 3,33 (s, 3H), 3,01-2,74 (m, 4H), 2,40 (dd, J=12,8, 7,3 Гц, 1H), 2,04 (m, 3H), 1,77-1,65 (m, 2H), 1,56 (m, 2H).
Пример 1M. (S)-7-(4-(2-((1,3-Диоксан-5-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
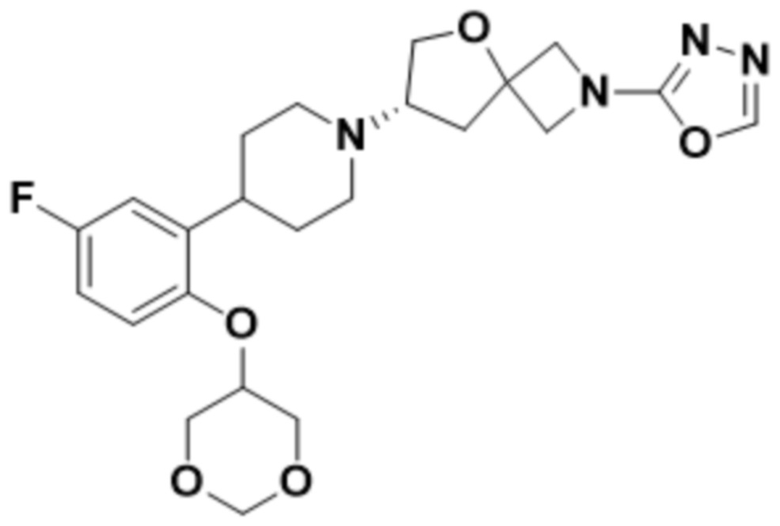
В раствор (S)-7-(4-(2-((1,3-диоксан-5-ил)окси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7W, 99 мг, 0,25 ммоль) в смеси 2% водного раствора TPGS-750-M (0,454 мл) и THF (0,05 мл) добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (56 мг, 0,25 ммоль) с последующим добавлением трехосновного фосфата калия (161 мг, 0,757 ммоль). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (9,0 мг, 0,018 ммоль).
LCMS: Rt: 0,87 мин. (способ 4 LCMS); MS масса/заряд 461,5 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,03-6,93 (m, 3H), 4,99-4,85 (m, 2H), 4,41-4,33 (m, 1H), 4,21 (d, J=8,3 Гц, 1H), 4,16-4,09 (m, 2H), 4,05-3,99 (m, 4H), 3,98-3,90 (m, 1H), 3,76-3,68 (m, 1H), 3,61 (t, J=7,8 Гц, 1H), 3,02-2,90 (m, 2H), 2,88-2,75 (m, 2H), 2,40 (dd, J=13,2, 7,3 Гц, 1H), 2,12-1,98 (m, 3H), 1,77-1,65 (m, 2H), 1,64-1,49 (m, 2H).
Пример 1N. (S)-4-(2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ол
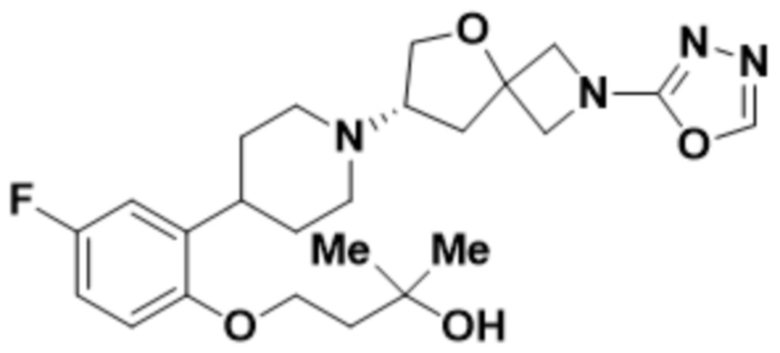
В раствор (S)-4-(2-(1-(5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ола (промежуточное соединение 7O, 147 мг, 0,38 ммоль) в смеси 2% водного раствора TPGS-750-M (0,674 мл) и THF (75 мкл) добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (83 мг, 0,38 ммоль) с последующим добавлением трехосновного фосфата калия (79 мг, 0,38 ммоль). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 10-30% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (88 мг, 0,19 ммоль).
LCMS: Rt: 1,93 мин. (способ 4 LCMS); MS масса/заряд 461,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,02-6,77 (m, 3H), 4,36-4,22 (m, 2H), 4,17 (q, J=8,7 Гц, 2H), 4,07 (dd, J=8,7, 6,9 Гц, 1H), 3,76 (d, J=4,7 Гц, 3H), 3,08 (m, 3H), 2,90 (d, J=11,3 Гц, 1H), 2,55 (dd, J=13,0, 7,4 Гц, 1H), 2,24 (m, 2H), 2,14 (dd, J=13,0, 8,4 Гц, 1H), 1,85 (d, J=10,9 Гц, 2H), 1,80-1,60 (m, 2H), 1,34 (s, 6H).
Пример 1O. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
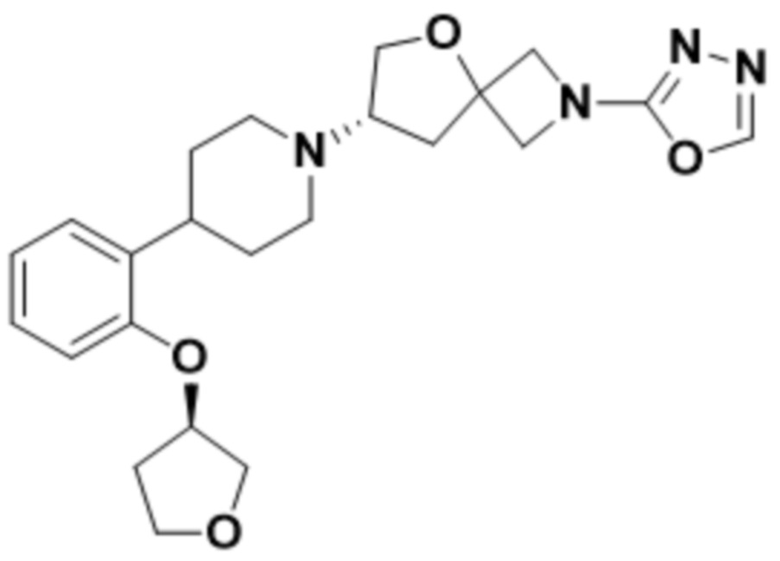
В раствор (S)-7-(4-(2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7P, 179 мг, 0,499 ммоль) в смеси 2% водного раствора TPGS-750-M (890 мкл) и THF (100 мкл) добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (110 мг, 0,499 ммоль) с последующим добавлением трехосновного фосфата калия (106 мг, 0,499 ммоль). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (58 мг, 0,13 ммоль).
LCMS: Rt: 1,87 мин. (способ 4 LCMS); MS масса/заряд 427,2 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,20-7,10 (m, 2H), 6,96-6,85 (m, 2H), 5,07-5,00 (m, 1H), 4,22 (d, J=8,8 Гц, 1H), 4,12 (dd, J=8,3, 2,9 Гц, 2H), 4,02 (d, J=8,3 Гц, 1H), 3,97-3,85 (m, 2H), 3,84-3,72 (m, 3H), 3,62 (t, J=7,8 Гц, 1H), 3,01-2,91 (m, 2H), 2,87-2,74 (m, 2H), 2,40 (dd, J=12,7, 7,3 Гц, 1H), 2,26-2,15 (m, 1H), 2,12-2,00 (m, 3H), 2,00-1,92 (m, 1H), 1,74-1,51(m, 4H).
Пример 1P. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
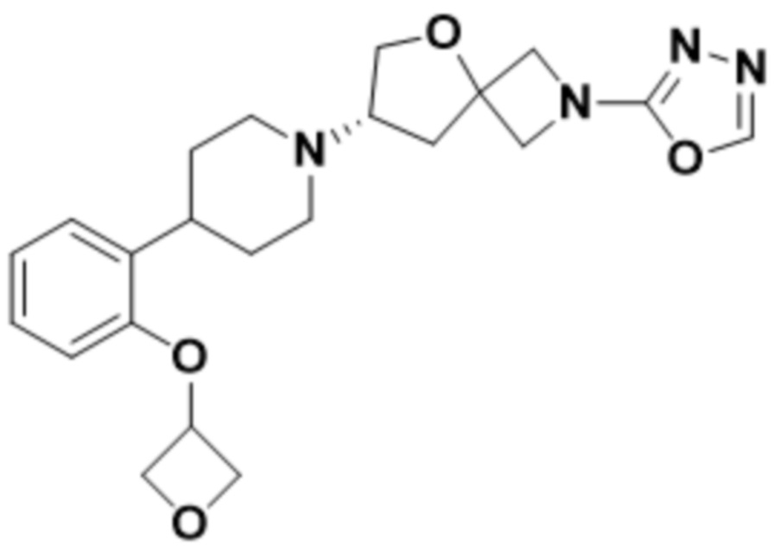
В раствор (S)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7Q, 97 мг, 0,28 ммоль) в смеси 2% водного раствора TPGS-750-M (510 мкл) и THF (60 мкл) добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (62 мг, 0,28 ммоль) с последующим добавлением трехосновного фосфата калия (60 мг, 0,28 ммоль). Реакционную смесь обрабатывали аналогично примеру 1A, и затем неочищенное вещество очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 15-40% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (27 мг, 0,062 ммоль).
LCMS: Rt: 1,74 мин. (способ 4 LCMS); MS масса/заряд 413,2 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,65 (s, 1H), 7,24-7,18 (m, 1H), 7,15-7,07 (m, 1H), 6,98-6,88 (m, 1H), 6,53 (d, J=8,3 Гц, 1H), 5,32-5,22 (m, 1H), 4,93 (t, J=6,6 Гц, 2H), 4,58-4,47 (m, 2H), 4,27-4,19 (m, 1H), 4,17-4,09 (m, 2H), 4,16-4,00 (m, 1H), 3,98-3,91 (m, J=7,6, 7,6 Гц, 1H), 3,69-3,59 (m, 1H), 3,04-2,85 (m, 3H), 2,85-2,77 (m, 1H), 2,46-2,37 (m, 1H), 2,17-2,02 (m, 3H), 1,81-1,68 (m, 2H), 1,68-1,56 (m, 2H).
Пример 1Q. (S)-7-(4-(2-Метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
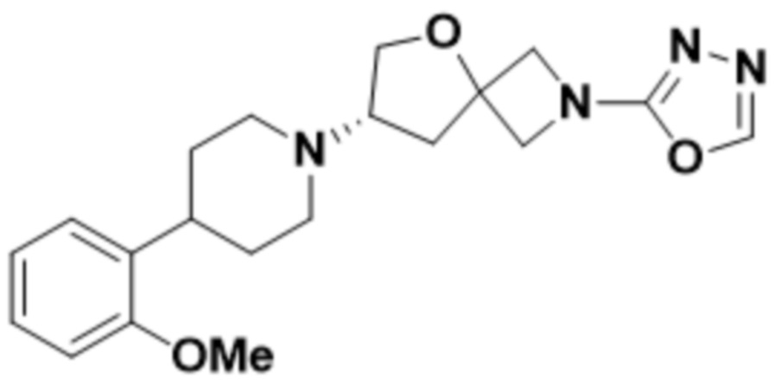
В раствор (S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7X, 81 мг, 0,27 ммоль) в смеси 2% водного раствора TPGS-750-M (480 мкл) и THF (50 мкл) добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (59 мг, 0,27 ммоль) с последующим добавлением трехосновного фосфата калия (57 мг, 0,27 ммоль). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 15-40% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (10 мг, 0,026 ммоль).
LCMS: Rt: 1,94 мин. (способ 4 LCMS); MS масса/заряд 371,0 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,22-7,11 (m, 2H), 6,99-6,83 (m, 2H), 4,22 (d, J=8,8 Гц, 1H), 4,13 (dd, J=8,1, 3,2 Гц, 2H), 4,02 (d, J=8,3 Гц, 1H), 3,93 (dd, J=8,3, 6,8 Гц, 1H), 3,77 (s, 3H), 3,62 (t, J=7,8 Гц, 1H), 3,03-2,91 (m, 2H), 2,90-2,81 (m, 1H), 2,80-2,73 (m, 1H), 2,39 (dd, J=12,7, 7,3 Гц, 1H), 2,12-1,97 (m, 3H), 1,74-1,47 (m, 4H).
Пример 1R. (S)-7-(4-(4,5-Дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
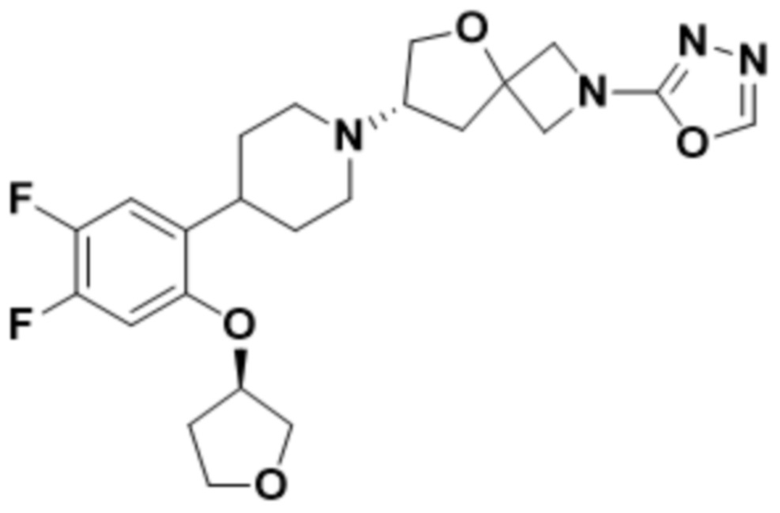
В раствор (S)-7-(4-(4,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7R, 96 мг, 0,24 ммоль) в смеси 2% водного раствора TPGS-750-M (440 мкл) и THF (50 мкл) добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (54 мг, 0,24 ммоль) с последующим добавлением трехосновного фосфата калия (52 мг, 0,24 ммоль). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (35 мг, 0,073 ммоль).
LCMS: Rt: 2,01 мин. (способ 4 LCMS); MS масса/заряд 463,1 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,64 (s, 1H), 7,22 (dd, J=12,1, 9,2 Гц, 1H), 7,12 (dd, J=12,8, 7,2 Гц, 1H), 5,08-5,01 (m, 1H), 4,21 (d, J=8,7 Гц, 1H), 4,12 (dd, J=8,5, 2,5 Гц, 2H), 4,02 (d, J=8,4 Гц, 1H), 3,93 (dd, J=8,5, 6,6 Гц, 1H), 3,86 (dd, J=10,3, 4,4 Гц, 1H), 3,83-3,71 (m, 3H), 3,60 (dd, J=8,6, 7,0 Гц, 1H), 3,01-2,91 (m, 2H), 2,82-2,70 (m, 2H), 2,39 (dd, J=12,9, 7,2 Гц, 1H), 2,27-2,14 (m, 1H), 2,09-1,89 (m, 4H), 1,72-1,48 (m, 4H).
Пример 1S. (S)-7-(4-(4-Фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
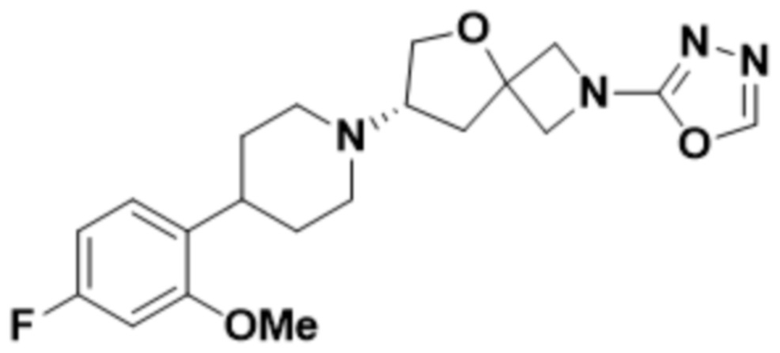
В раствор (S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7Y, 279 мг, 0,87 ммоль) в смеси 2% водного раствора TPGS-750-M (1,6 мл) и THF (175 мкл) добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (192 мг, 0,87 ммоль) с последующим добавлением трехосновного фосфата калия (185 мг, 0,87 ммоль). Смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (105 мг, 0,27 ммоль).
LCMS: Rt: 2,04 мин. (способ 4 LCMS); MS масса/заряд 389,2 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,16 (dd, J=8,3, 7,3 Гц, 1H), 6,84 (dd, J=11,2, 2,4 Гц, 1H), 6,74-6,62 (m, 1H), 4,22 (d, J=8,8 Гц, 1H), 4,16-4,08 (m, 2H), 4,02 (d, J=8,3 Гц, 1H), 3,97-3,89 (m, 1H), 3,78 (s, 3H), 3,68-3,56 (m, 1H), 3,03-2,89 (m, 2H), 2,86-2,72 (m, 2H), 2,43-2,36 (m,1H), 2,13-1,95 (m, 3H), 1,74-1,51 (m, 4H).
Пример 1T. (S)-4-(2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ол
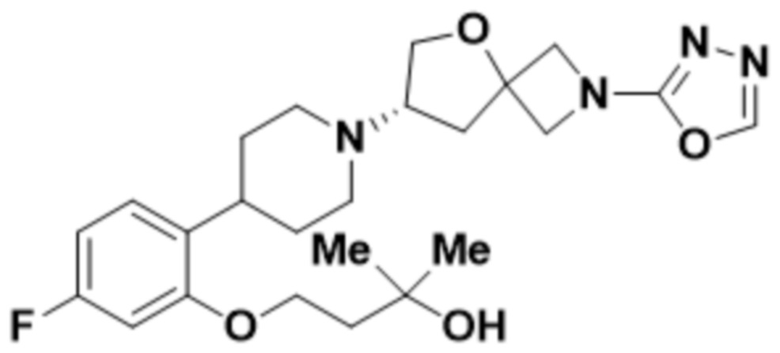
В раствор (S)-4-(2-(1-(5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ола (промежуточное соединение 7S, 141 мг, 0,36 ммоль) в смеси 2% водного раствора TPGS-750-M (0,65 мл) и THF (70 мкл) добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (79 мг, 0,36 ммоль), с последующим добавлением трехосновного фосфата калия (76 мг, 0,36 ммоль). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (44 мг, 0,094 ммоль).
LCMS: Rt: 1,97 мин. (способ 4 LCMS); MS масса/заряд 461,4 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,60-8,67 (m, 1H), 7,20-7,09 (m, 1H), 6,89-6,79 (m, 1H), 6,71-6,63 (m, 1H), 4,41-4,34 (m, 1H), 4,27-3,99 (m, 7H), 3,98-3,88 (m, 1H), 3,67-3,57 (m, 1H), 3,30-3,28 (m, 1H), 3,05-2,89 (m, 2H), 2,87-2,71 (m, 2H), 2,45-2,36 (m, 1H), 2,13-1,96 (m, 3H), 1,75-1,48 (m, 4H), 1,22-1,12 (m, 6H).
Пример 1U. (S)-1-(2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ол
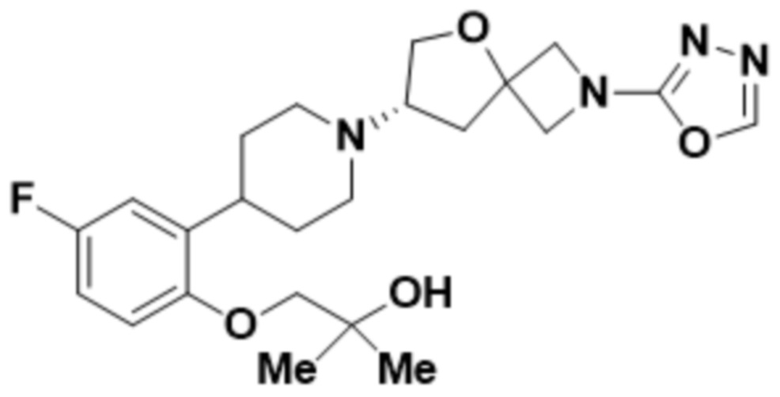
(S)-1-(2-(1-(5-Окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ол (промежуточное соединение 7U, 67 мг, 0,18 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (39 мг, 0,18 ммоль) и трехосновный фосфат калия (38 мг, 0,18 ммоль) суспендировали в смеси 2% водного раствора TPGS-750-M (1,6 мл) и THF (0,16 мл). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (6,2 мг, 0,013 ммоль).
LCMS: Rt: 1,85 мин. (способ 4 LCMS); MS масса/заряд 447,6 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,94-6,83 (m, 3H), 4,35-4,24 (m, 2H), 4,17 (q, J=8,7 Гц, 2H), 4,07 (dd, J=8,7, 6,9 Гц, 1H), 3,76 (d, J=4,7 Гц, 3H), 3,15-3,04 (m, 3H), 2,90 (d, J=11,3 Гц, 1H), 2,55 (dd, J=13,0, 7,4 Гц, 1H), 2,24 (m, 2H), 2,14 (dd, J=13,0, 8,4 Гц, 1H), 1,93-1,81 (m, 2H), 1,77-1,62 (m, 2H), 1,34 (s, 6H).
Пример 1V. (S)-7-(4-(5-Фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
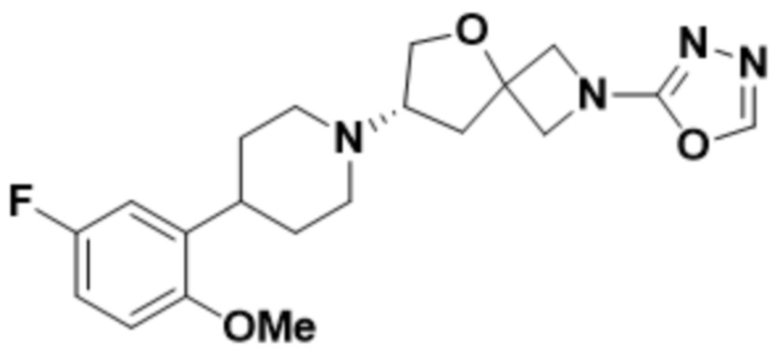
(S)-7-(4-(5-Фтор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7DD, 116 мг, 0,362 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (80 мг, 0,362 ммоль) и трехосновный фосфат калия (77 мг, 0,362 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (0,65 мл) и THF (0,07 мл). Реакционную смесь обрабатывали аналогично примеру 1A, и остаток очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (39 мг, 0,097 ммоль).
LCMS: Rt: 1,98 мин. (способ 4 LCMS); MS масса/заряд 389,3 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,64 (s, 1H), 7,13-6,82 (m, 3H), 4,22 (d, J=8,6 Гц, 1H), 4,15-4,09 (m, 2H), 4,02 (d, J=8,4 Гц, 1H), 3,93 (dd, J=8,6, 6,8 Гц, 1H), 3,76 (s, 3H), 3,62 (dd, J=8,5, 7,1 Гц, 1H), 3,04-2,90 (m, 2H), 2,90-2,72 (m, 2H), 2,39 (dd, J=12,9, 7,3 Гц, 1H), 2,12-1,99 (m, 3H), 1,73-1,51 (m, 4H).
Пример 1W. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-(пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
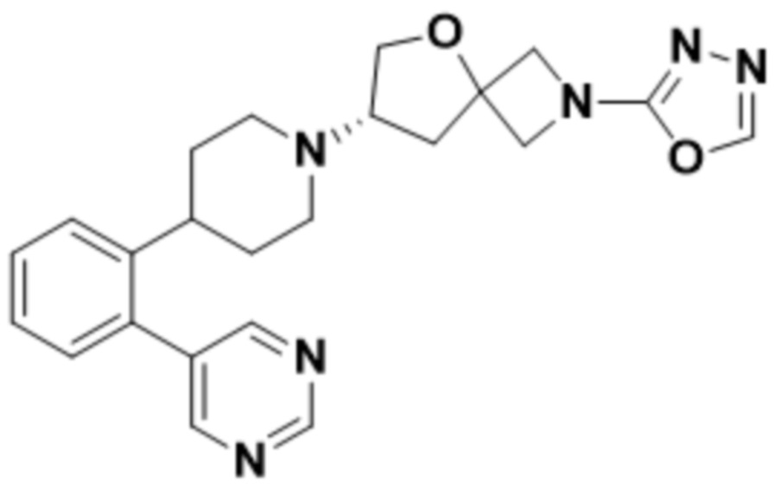
(S)-7-(4-(2-(Пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7FF, 34 мг, 0,097 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (28 мг, 0,13 ммоль) и трехосновный фосфат калия (31 мг, 0,15 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (0,30 мл) и THF (0,030 мл). Реакционную смесь обрабатывали аналогично примеру 1A, и остаток очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-40% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (17 мг, 0,041 ммоль).
LCMS: Rt: 1,52 мин. (способ 4 LCMS); MS масса/заряд 419,4 [M+H]+.
1H ЯМР (400 МГц, CD2Cl2) δ 9,23 (s, 1H), 8,72 (s, 2H), 7,96 (s, 1H), 7,49 (m, 2H), 7,41-7,30 (m, 1H), 7,22 (dd, J=7,6, 1,2 Гц, 1H), 4,21 (s, 2H), 4,20-4,07 (m, 2H), 4,00 (dd, J=8,5, 6,7 Гц, 1H), 3,73 (t, J=8,0 Гц, 1H), 3,07-2,90 (m, 2H), 2,85-2,68 (m, 1H), 2,54 (m, 1H), 2,40 (dd, J=12,9, 7,1 Гц, 1H), 2,13 (dd, J=12,6, 8,1 Гц, 1H), 1,96 (q, J=11,1, 10,6 Гц, 2H), 1,84 (d, J=13,2 Гц, 2H), 1,77-1,67 (m, 2H).
Пример 1X. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-(оксазол-2-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
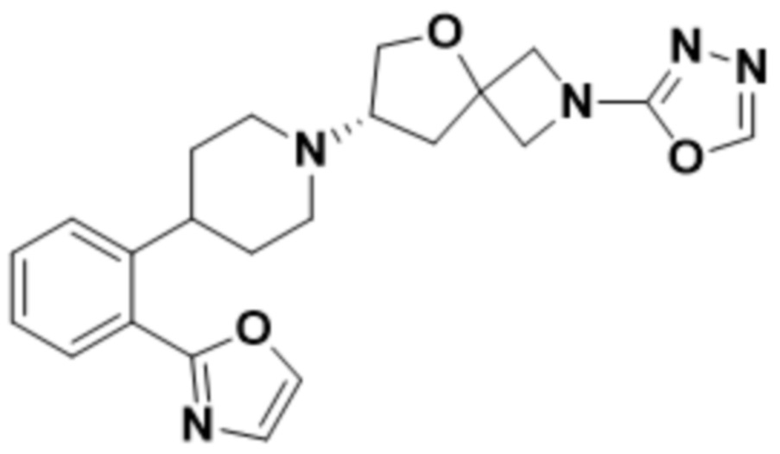
(S)-7-(4-(2-(Оксазол-2-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7GG, 25 мг, 0,074 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (21 мг, 0,096 ммоль) и трехосновный фосфат калия (20 мг, 0,096 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (0,30 мл) и THF (0,030 мл). Реакционную смесь обрабатывали аналогично примеру 1A, неочищенное вещество очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (13 мг, 0,032 ммоль).
LCMS: Rt: 1,78 мин. (способ 4 LCMS); MS масса/заряд 408,6 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 8,01 (s, 1H), 7,76 (d, J=7,3 Гц, 1H), 7,49 (d, J=4,0 Гц, 2H), 7,38-7,22 (m, 2H), 4,36-4,23 (m, 2H), 4,16 (q, J=8,6 Гц, 2H), 4,06 (dd, J=8,7, 6,9 Гц, 1H), 3,76 (dd, J=8,6, 7,4 Гц, 1H), 3,55-3,40 (m, 1H), 3,09 (m, 2H), 2,88 (dd, J=11,5, 2,3 Гц, 1H), 2,53 (dd, J=13,1, 7,4 Гц, 1H), 2,30-2,05 (m, 3H), 1,82 (m, 4H).
Пример 1Y. (S)-7-(4-(2-(5-Метил-1,3,4-оксадиазол-2-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
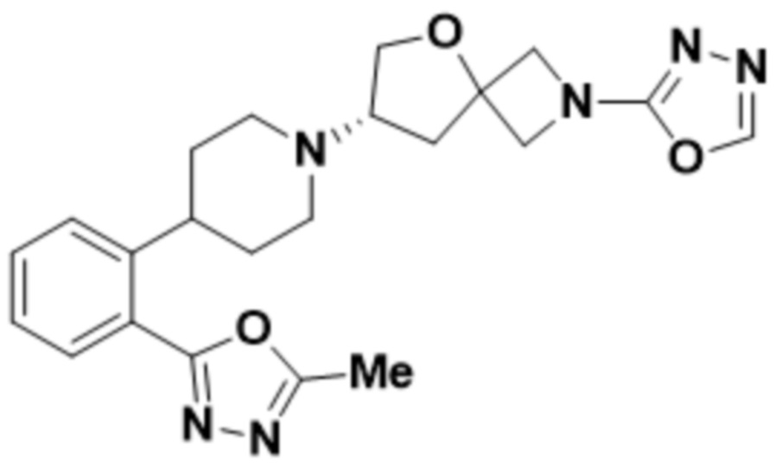
(S)-7-(4-(2-(5-Метил-1,3,4-оксадиазол-2-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-октан (промежуточное соединение 7HH, 7,0 мг, 0,020 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (5,7 мг, 0,026 ммоль) и трехосновный фосфат калия (5,5 мг, 0,026 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (0,60 мл) и THF (0,060 мл). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью препаративной HPLC (XBridge Peptide BEH C18, 5 мкм, 19×150 мм, 25-40% MeCN/H2O (5 мМ NH4OH), 30 мл/мин.) с получением указанного в заголовке соединения (1 мг, 0,002 ммоль).
LCMS: Rt: 1,58 мин. (способ 4 LCMS); MS масса/заряд 423,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,81 (d, J=8,2 Гц, 1H), 7,63-7,48 (m, 2H), 7,38 (m, 1H), 4,36-4,24 (m, 2H), 4,18 (t, J=8,7 Гц, 2H), 4,07 (dd, J=8,8, 6,9 Гц, 1H), 3,77 (dd, J=8,7, 7,4 Гц, 1H), 3,62-3,45 (m, 1H), 3,18-3,03 (m, 2H), 2,96-2,83 (m, 1H), 2,63 (s, 3H), 2,55 (dd, J=13,0, 7,4 Гц, 1H), 2,33-2,07 (m, 3H), 1,86 (m, 4H).
Пример 2A. (S)-7-(4-(5-Фтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
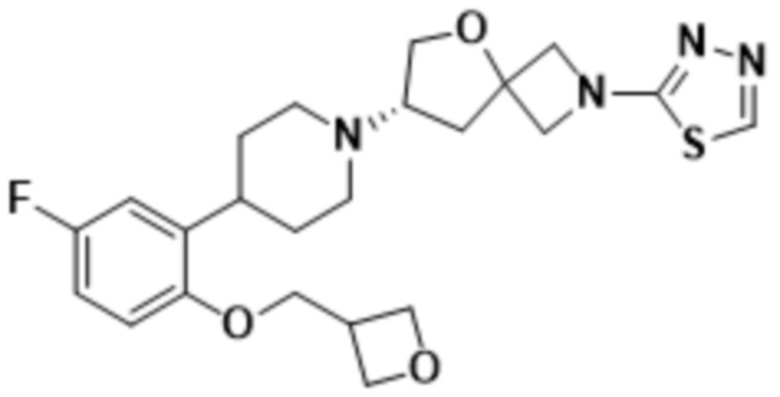
(S)-2-(1-(2-(1,3,4-Тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 8A, 11 мг, 0,028 ммоль), 3-(йодметил)оксетан (14 мг, 0,070 ммоль) и карбонат цезия (14 мг, 0,042 ммоль) растворяли в MeCN (0,5 мл). Реакционную смесь перемешивали 60°C в течение ночи и затем концентрировали при пониженном давлении, и неочищенное вещество очищали с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (6,2 мг, 0,013 ммоль).
LCMS: Rt: 1,91 мин. (способ 4 LCMS); MS масса/заряд 461,1 [M+H]+.
1H ЯМР (CD3OD) δ 8,66 (s, 1H), 6,94 (d, J=4,4 Гц, 3H), 4,92-4,87 (m, 2H), 4,71-4,59 (m, 2H), 4,33-4,01 (m, 7H), 3,86-3,73 (m, 1H), 3,53-3,41 (m, 1H), 3,15-2,95 (m, 3H), 2,93-2,84 (m, 1H), 2,61-2,47 (m, 1H), 2,32-2,11 (m, 3H), 1,93-1,79 (m, 2H), 1,78-1,58 (m, 2H).
Пример 2B. (S)-7-(4-(5-Фтор-2-((3-метилоксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
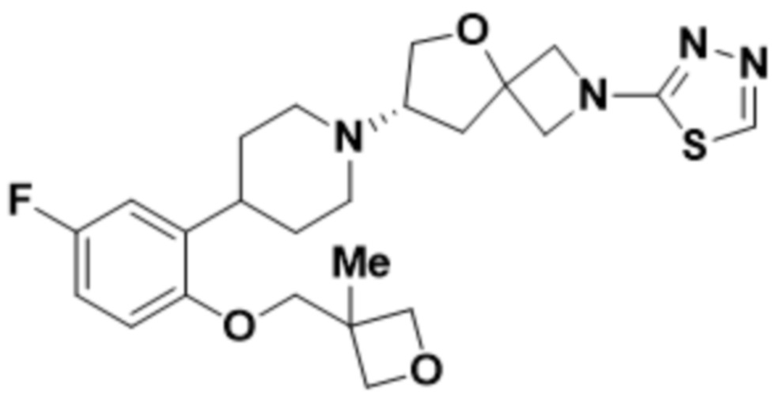
(S)-2-(1-(2-(1,3,4-Тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 8A, 15 мг, 0,038 ммоль) растворяли в ацетонитриле (0,75 мл) и добавляли 3-(бромметил)-3-метилоксетан (13 мг, 0,077 ммоль) с последующим добавлением карбоната цезия (19 мг, 0,058 ммоль). Реакционную смесь перемешивали при 60°C в течение ночи, концентрировали при пониженном давлении и очищали с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (4,5 мг, 0,0093 ммоль).
LCMS: Rt: 2,08 мин. (способ 4 LCMS); MS масса/заряд 475,2 [M+H]+.
1H ЯМР (CD3OD) δ 8,66 (s, 1H), 7,03-6,82 (m, 3H), 4,73-4,66 (m, 2H), 4,51-4,43 (m, 2H), 4,33-4,05 (m, 5H), 4,01 (s, 2H), 3,83-3,72 (m, 1H), 3,16-2,98 (m, 3H), 2,95-2,85 (m, 1H), 2,65-2,47 (m, 1H), 2,30-2,08 (m, 3H), 1,94-1,81 (m, 2H), 1,79-1,60 (m, 2H), 1,45 (s, 3H).
Пример 2C. Трифторацетат (S)-7-(4-(5-фтор-2-(((R)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана или трифторацетат (S)-7-(4-(5-фтор-2-(((S)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана и пример 2D. Трифторацетат (S)-7-(4-(5-фтор-2-(((R)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана или трифторацетат (S)-7-(4-(5-фтор-2-(((S)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана
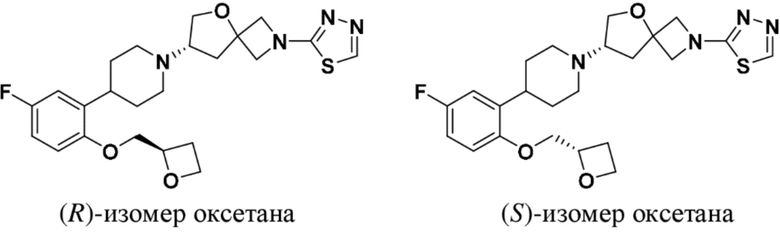
(S)-2-(1-(2-(1,3,4-Тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 8A, 30 мг, 0,077 ммоль) растворяли в ацетонитриле (1,2 мл), и добавляли 2-(бромметил)оксетан (10 мг, 0,066 ммоль) и карбонат цезия (38 мг, 0,12 ммоль). Реакционную смесь перемешивали при 60°С в течение ночи, затем добавляли дополнительное количество 2-(бромметил)оксетана (20 мг, 0,13 ммоль) и реакционную смесь нагревали при 60°С в течение ночи. Добавляли дополнительное количество 2-(бромметил)оксетана (40 мг, 0,077 ммоль) с последующим добавлением карбоната цезия (25 мг, 0,077 ммоль) и реакционную смесь нагревали при 75°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении и очищали с помощью препаративной HPLC (XBridge Peptide BEH C18, 5 мкм, 19×150 мм, 30-45% MeCN/H2O (10 мМ NH4OH), 30 мл/мин.) с получением отдельных диастереоизомеров в виде солей TFA: пик 1 (пример 2C, 4,5 мг, 0,0093 ммоль) и пик 2 (пример 2D, 3,6 мг, 0,0061 ммоль).
Пример 2C.
LCMS: Rt: 1,92 мин. (способ 4 LCMS); MS масса/заряд 461,2 [M+H]+.
1H ЯМР (CD3OD) δ 8,66 (s, 1H), 6,96-6,90 (m, 2H), 6,90-6,83 (m, 1H), 4,33-4,21 (m, 2H), 4,20-4,03 (m, 5H), 3,82-3,73 (m, 1H), 3,18-2,97 (m, 4H), 2,95-2,86 (m, 1H), 2,85-2,79 (m, 1H), 2,61-2,51 (m, 2H), 2,30-2,02 (m, 4H), 1,98-1,79 (m, 3H), 1,70 (br s, 2H).
Пример 2D.
LCMS: Rt: 2,02 мин. (способ 4 LCMS); MS масса/заряд 461,6 [M+H]+.
1H ЯМР (CD3OD) δ 8,66 (s, 1H), 6,99-6,92 (m, 2H), 6,91-6,83 (m, 1H), 5,25-5,09 (m, 1H), 4,79-4,63 (m, 2H), 4,32-4,21 (m, 2H), 4,19-4,03 (m, 5H), 3,83-3,73 (m, 1H), 3,18-3,05 (m, 3H), 2,96-2,88 (m, 1H), 2,87-2,69 (m, 2H), 2,62-2,50 (m, 1H), 2,30-2,10 (m, 3H), 1,99-1,82 (m, 2H), 1,79-1,62 (m, 2H).
Пример 2E. (S)-7-(4-(5-Фтор-2-((5-метил-1,3,4-тиадиазол-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
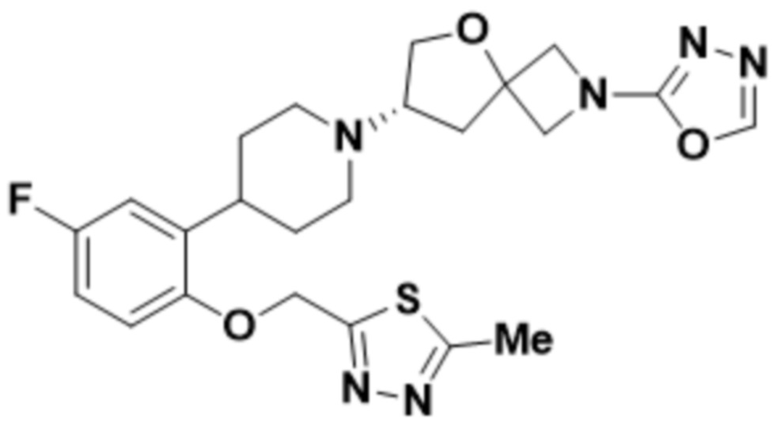
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 14 мг, 0,037 ммоль) растворяли в ацетонитриле (1 мл) и добавляли 2-(хлорметил)-5-метил-1,3,4-тиадиазол (7,2 мг, 0,049 ммоль) с последующим добавлением карбоната цезия (18 мг, 0,056 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и затем концентрировали при пониженном давлении и очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 15-40% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (9,8 мг, 0,020 ммоль) в виде белого твердого вещества.
LCMS: Rt: 1,78 мин. (способ 4 LCMS); MS масса/заряд 487,3 [M+H]+.
1H ЯМР (CD3OD) δ 8,39 (s, 1H), 7,09-7,04 (m, 1H), 7,01-6,95 (m, 1H), 6,95-6,87 (m, 1H), 5,49 (d, J=3,4 Гц, 2H), 4,35-4,23 (m, 2H), 4,22-4,12 (m, 2H), 4,10-4,02 (m, 1H), 3,81-3,70 (m, 1H), 3,17-2,95 (m, 3H), 2,94-2,86 (m, 1H), 2,79 (s, 3H), 2,61-2,47 (m, 1H), 2,29-2,08 (m, 3H), 1,93-1,78 (m, 2H), 1,77-1,61 (m, 2H).
Пример 2F. (S)-7-(4-(5-Фтор-2-((5-метил-1,3,4-оксадиазол-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
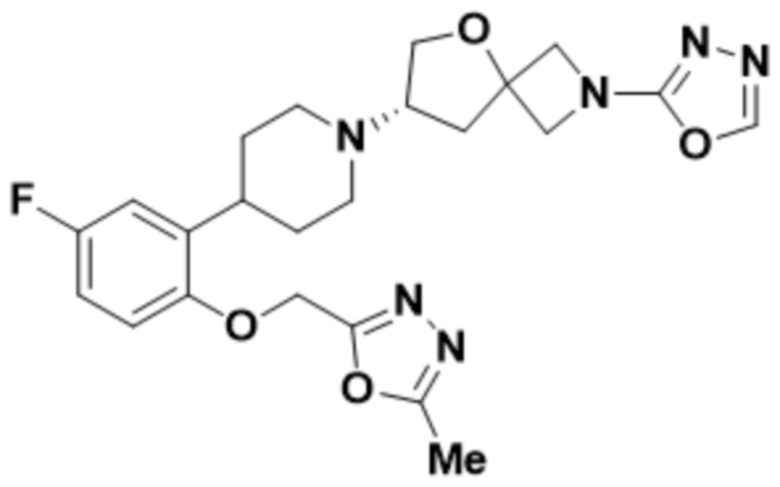
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 20,2 мг, 0,054 ммоль) растворяли в DMF (0,5 мл) и добавляли 2-(хлорметил)-5-метил-1,3,4-оксадиазол (8,9 мг, 0,065 ммоль) и карбонат цезия (35,2 мг, 0,108 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Затем ее разбавляли с помощью EtOAc, промывали водой и органический слой концентрировали при пониженном давлении. Остаток очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 15-40% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (15 мг, 0,032 ммоль).
LCMS: Rt: 0,87 мин. (способ 3 LCMS); MS масса/заряд 471,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,08 (dd, J=9,0, 4,6 Гц, 1H), 6,97 (dd, J=9,7, 3,1 Гц, 1H), 6,93-6,86 (m, 1H), 5,29 (s, 2H), 4,34-4,23 (m, 2H), 4,16 (q, J=8,6 Гц, 2H), 4,05 (dd, J=8,6, 7,0 Гц, 1H), 3,75 (dd, J=8,4, 7,6 Гц, 1H), 3,13-2,94 (m, 3H), 2,87 (d, J=10,8 Гц, 1H), 2,56 (s, 3H), 2,55-2,48 (m, 1H), 2,26-2,09 (m, 3H), 1,80 (m, 2H), 1,76-1,62 (m, 2H).
Пример 2G. (S)-7-(4-(5-Фтор-2-((3-метилизоксазол-5-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
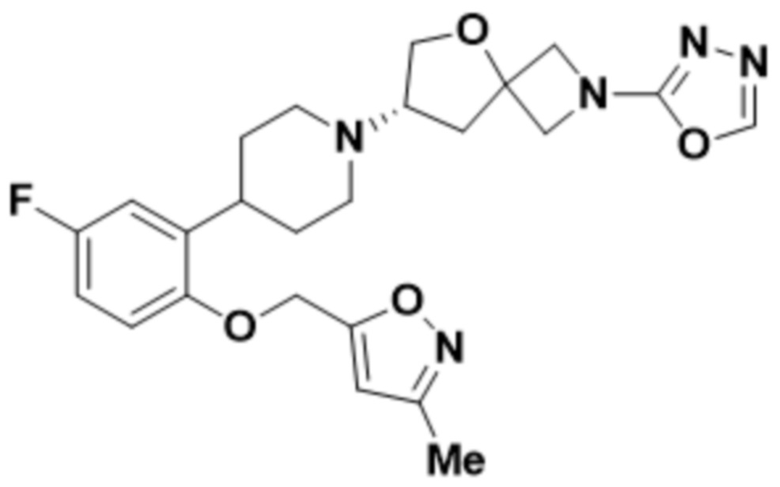
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 18,6 мг, 0,050 ммоль) растворяли в DMF (0,5 мл) и затем добавляли 5-(хлорметил)-3-метилизоксазол (8,26 мг, 0,060 ммоль) и карбонат цезия (32,4 мг, 0,099 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь затем разбавляли с помощью EtOAc, промывали водой и органический слой концентрировали при пониженном давлении. Остаток очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (13,8 мг, 0,029 ммоль).
LCMS: Rt: 1,08 мин. (способ 3 LCMS); MS масса/заряд 470,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,03 (dd, J=9,0, 4,6 Гц, 1H), 6,97-6,84 (m, 2H), 6,33 (s, 1H), 5,17 (s, 2H), 4,34-4,24 (m, 2H), 4,16 (q, J=8,8 Гц, 2H), 4,06 (dd, J=8,6, 7,0 Гц, 1H), 3,75 (dd, J=8,5, 7,6 Гц, 1H), 3,14-3,03 (m, 2H), 2,98 (m, 1H), 2,87 (d, J=10,6 Гц, 1H), 2,53 (dd, J=13,0, 7,4 Гц, 1H), 2,28 (s, 3H), 2,25-2,08 (m, 3H), 1,84-1,75 (m, 2H), 1,68 (m, 2H).
Пример 2H. (S)-7-(4-(5-Фтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
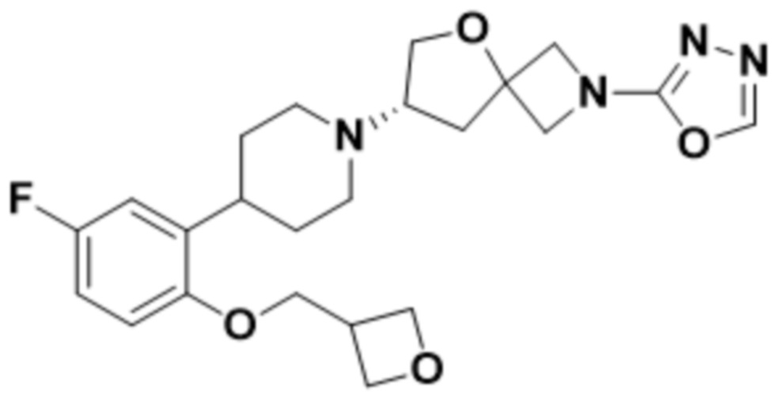
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 18,3 мг, 0,049 ммоль) растворяли в 0,5 мл DMF и добавляли 3-(йодметил)оксетан (19,36 мг, 0,098 ммоль) и карбонат цезия (31,8 мг, 0,098 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь затем разбавляли с помощью EtOAc и промывали водой и концентрировали при пониженном давлении. Остаток затем очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (12,1 мг, 0,027 ммоль).
LCMS: Rt: 0,97 мин. (способ 3 LCMS); MS масса/заряд 445,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,02-6,78 (m, 3H), 4,88 (dd, J=8,0, 6,1 Гц, 2H), 4,64 (t, J=6,0 Гц, 2H), 4,34-4,23 (m, 2H), 4,17 (dd, J=8,9, 7,4 Гц, 4H), 4,06 (dd, J=8,6, 7,0 Гц, 1H), 3,75 (dd, J=8,4, 7,6 Гц, 1H), 3,47 (m, 1H), 3,14-2,97 (m, 3H), 2,88 (d, J=10,8 Гц, 1H), 2,53 (dd, J=13,0, 7,4 Гц, 1H), 2,27-2,08 (m, 3H), 1,84 (m, 2H), 1,68 (m, 2H).
Пример 2I. (S)-7-(4-(5-Фтор-2-(пиримидин-2-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
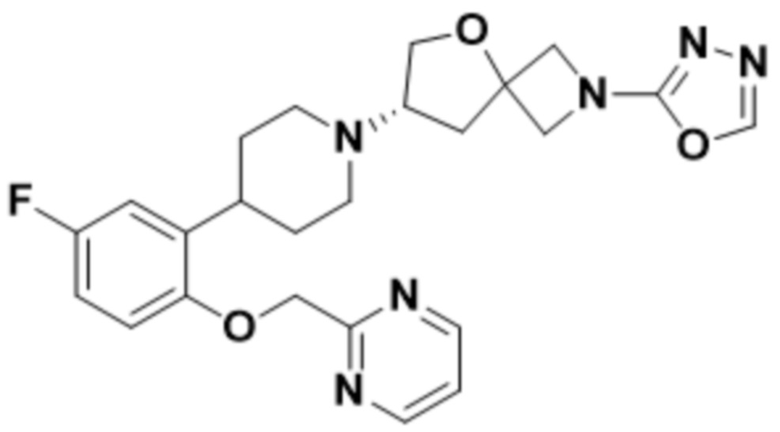
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 20,5 мг, 0,055 ммоль) растворяли в 0,5 мл DMF и затем добавляли 2-(хлорметил)пиримидин (8,89 мг, 0,066 ммоль) и карбонат цезия (35,7 мг, 0,110 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 18 часов и затем ее разбавляли с помощью EtOAc, промывали водой и концентрировали при пониженном давлении. Остаток очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 15-40% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (16 мг, 0,034 ммоль).
LCMS: Rt: 0,92 мин. (способ 3 LCMS); MS масса/заряд 467,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,81 (d, J=4,9 Гц, 2H), 8,38 (s, 1H), 7,44 (t, J=4,9 Гц, 1H), 6,97-6,90 (m, 2H), 6,81 (m, 1H), 5,27 (s, 2H), 4,34-4,23 (m, 2H), 4,16 (q, J=8,6 Гц, 2H), 4,05 (dd, J=8,6, 7,0 Гц, 1H), 3,80-3,70 (m, 1H), 3,10 (m, 3H), 2,87 (d, J=10,7 Гц, 1H), 2,53 (dd, J=13,0, 7,4 Гц, 1H), 2,28-2,08 (m, 3H), 1,88 (m, 2H), 1,69 (m, 2H).
Пример 2J. (S)-7-(4-(5-Фтор-2-((3-фтороксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
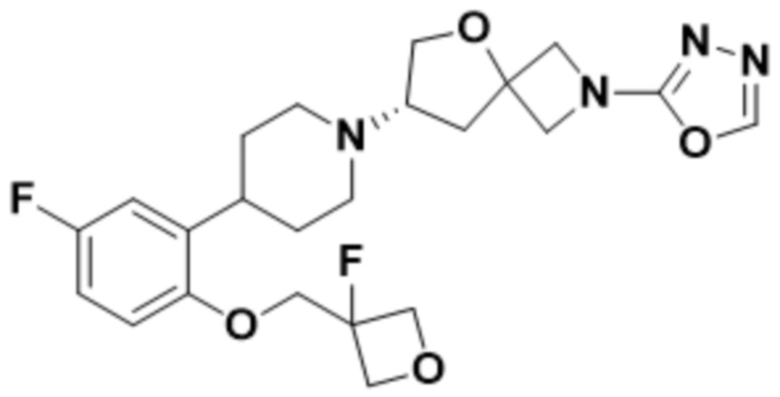
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 17,4 мг, 0,046 ммоль) растворяли в DMF (0,5 мл) и затем добавляли 3-фтороксетан-3-ил)метил-4-метилбензолсульфонат (коммерчески доступный, 13,3 мг, 0,051 ммоль) и карбонат цезия (30,3 мг, 0,093 ммоль). Полученную реакционную смесь перемешивали при 50°C в течение ночи и затем ее разбавляли с помощью EtOAc, промывали водой и концентрировали при пониженном давлении. Остаток очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (2,7 мг, 0,0058 ммоль).
LCMS: Rt: 1,01 мин. (способ 3 LCMS); MS масса/заряд 463,7 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,03-6,84 (m, 3H), 4,84-4,72 (m, 4H), 4,39-4,23 (m, 4H), 4,16 (q, J=8,6 Гц, 2H), 4,06 (dd, J=8,6, 7,0 Гц, 1H), 3,75 (dd, J=8,4, 7,6 Гц, 1H), 3,13-3,04 (m, 2H), 2,97 (m, 1H), 2,89 (d, J=10,9 Гц, 1H), 2,54 (dd, J=13,0, 7,4 Гц, 1H), 2,27-2,07 (m, 3H), 1,84 (m, 2H), 1,67 (m, 2H).
Пример 2K. (S)-7-(4-(5-Фтор-2-((3-метилоксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
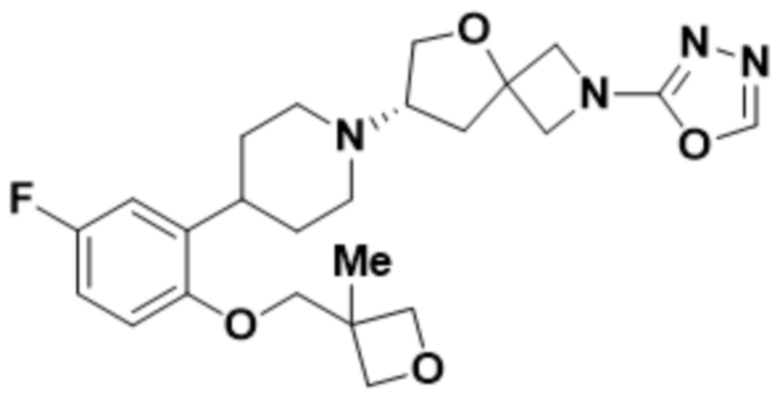
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 19 мг, 0,051 ммоль) растворяли в ацетонитриле (1,0 мл) и добавляли 3-(бромметил)-3-метилоксетан (16,8 мг, 0,101 ммоль) и карбонат цезия (25 мг, 0,076 ммоль). Реакционную смесь перемешивали при 80°C в течение ночи. Затем ее концентрировали при пониженном давлении и очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (10,7 мг, 0,023 ммоль).
LCMS: Rt: 2,00 мин. (способ 4 LCMS); MS масса/заряд 459,2 [M+H]+.
1H ЯМР (CD3OD) δ 8,39 (s, 1H), 6,81-7,02 (m, 3H), 4,66-4,72 (m, 2H), 4,48 (s, 2H), 4,24-4,35 (m, 2H), 4,12-4,21 (m, 2H), 4,03-4,10 (m, 1H), 4,01 (s, 2H), 3,71-3,80 (m, 1H), 2,98-3,17 (m, 3H), 2,83-2,95 (m, 1H), 2,47-2,60 (m, 1H), 2,08-2,29 (m, 3H), 1,80-1,93 (m, 2H), 1,59-1,76 (m, 2H), 1,45 (s, 3H).
Пример 2L. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
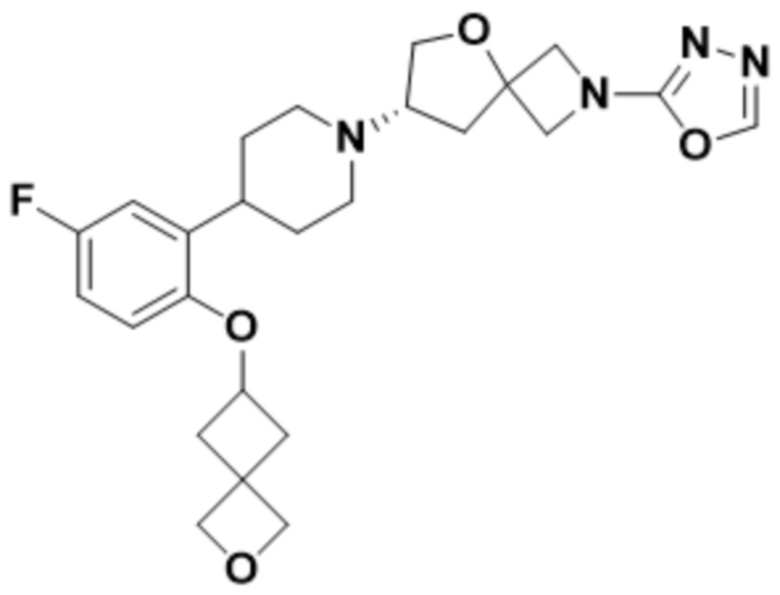
Стадия 1. 2-Оксаспиро[3.3]гептан-6-ил-4-метилбензолсульфонат
В раствор 2-оксаспиро[3.3]гептан-6-ола (500 мг, 4,38 ммоль), DMAP (53 мг, 0,438 ммоль) и триэтиламина (1,53 мл, 10,95 ммоль) в DCM (15 мл) при 0°C добавляли 4-метилбензол-1-сульфонилхлорид (877 мг, 4,60 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь затем промывали с помощью 1 н. раствора HCl, высушивали над MgSO4 и концентрировали при пониженном давлении. Остаток очищали с помощью FCC (0 → 60% EtOAc/гептаны) с получением указанного в заголовке промежуточного соединения (1,04 г, 3,68 ммоль) в виде белого твердого вещества.
LCMS: Rt: 0,87 мин. (способ 2 LCMS); MS масса/заряд 269,3 [M+H]+.
Стадия 2. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
В раствор MeCN (5 мл) (S)-2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенола (промежуточное соединение 4F, 100 мг, 0,267 ммоль) и 2-оксаспиро[3.3]гептан-6-ил-4-метилбензолсульфоната (79 г, 0,294 ммоль) добавляли Cs2CO3 (348 мг, 1,07 ммоль). Полученную смесь перемешивали при 80°C в течение 18 часов. Неочищенное вещество концентрировали при пониженном давлении и затем его разбавляли с помощью EtOAc и промывали водой. Объединенные органические вещества концентрировали при пониженном давлении и неочищенное вещество очищали с помощью FCC (0-8% MeOH (1% NH4OH)/DCM). Выделенный материал растворяли в смеси MeCN:вода в соотношении 3:7 и лиофилизировали с получением указанного в заголовке соединения (52 мг, 0,105 ммоль) в виде белого твердого вещества. Стереохимическую конфигурацию данного соединения подтверждали посредством рентгеноструктурной кристаллографии.
[α]D25=-11,04° (c=1,0400% вес./об., CH3OH).
LCMS: Rt: 1,96 мин. (способ 4 LCMS); MS масса/заряд 471,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,90 (dd, J=9,8, 3,0 Гц, 1H), 6,82 (td, J=8,5, 3,1 Гц, 1H), 6,70 (dd, J=9,0, 4,6 Гц, 1H), 4,75, (s, 2H), 4,68 (s, 2H), 4,53 (p, J=6,6 Гц, 1H), 4,38-4,23 (m, 2H), 4,16 (q, J=8,6 Гц, 2H), 4,06 (dd, J=8,7, 6,9 Гц, 1H), 3,76 (t, J=8,0 Гц, 1H), 3,17-3,04 (m, 2H), 3,03-2,85 (m, 2H), 2,85-2,75 (m, 2H), 2,54 (dd, J=13,2, 7,6 Гц, 1H), 2,36-2,09 (m, 5H), 1,87-1,74 (m, 2H), 1,67 (m, 2H).
Пример 2M. (S)-7-(4-(5-Фтор-2-(((R)-тетрагидрофуран-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
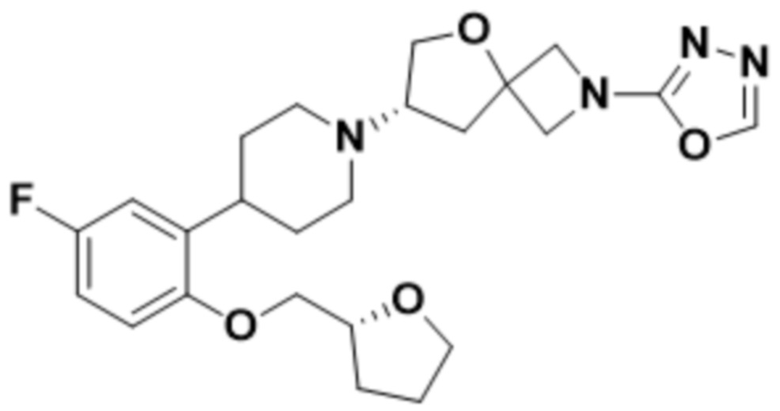
Стадия 1. (R)-(Тетрагидрофуран-2-ил)метил-4-метилбензолсульфонат
(R)-(Тетрагидрофуран-2-ил)метанол (400 мг, 3,92 ммоль) растворяли в DCM (6 мл) и добавляли 4-метилбензолсульфонилхлорид (896 мг, 4,70 ммоль), триэтиламин (0,82 мл, 5,9 ммоль) и DMAP (24 мг, 0,20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь нейтрализовали с помощью насыщенного раствора NH4Cl и экстрагировали с помощью DCM. Объединенные слои DCM высушивали над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью FCC (0-50% EtOAc/гептаны) с получением указанного в заголовке промежуточного соединения (925 мг, 3,61 ммоль) в виде бесцветного масла.
LCMS: Rt: 0,92 мин. (способ 1 LCMS); MS масса/заряд 257,1 [M+H]+.
Стадия 2. (S)-7-(4-(5-Фтор-2-(((R)-тетрагидрофуран-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 15 мг, 0,040 ммоль) растворяли в ацетонитриле (1 мл) и добавляли (R)-(тетрагидрофуран-2-ил)метил-4-метилбензолсульфонат (13 мг, 0,052 ммоль) с последующим добавлением карбоната цезия (20 мг, 0,060 ммоль). Реакционную смесь перемешивали при 75°C в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении и очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 10-30% MeCN/H2O (0,1% муравьиной кислоты), 75 мл/мин.) с получением указанного в заголовке соединения (4,9 мг, 0,0011 моль) в виде белого твердого вещества.
LCMS: Rt: 2,09 мин. (способ 4 LCMS); MS масса/заряд 459,4 [M+H]+.
1H ЯМР (CD3OD) δ 8,39 (s, 1H), 6,99-6,77 (m, 3H), 4,35-4,23 (m, 3H), 4,21-4,12 (m, 2H), 4,11-4,04 (m, 1H), 4,02-3,89 (m, 3H), 3,87-3,72 (m, 2H), 3,15-2,98 (m, 3H), 2,94-2,85 (m, 1H), 2,60-2,50 (m, 1H), 2,29-1,80 (m, 9H), 1,76-1,59 (m, 2H).
Пример 2N. (S)-7-(4-(2-(((R)-5,5-Диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан или (S)-7-(4-(2-(((S)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан и пример 2O. (S)-7-(4-(2-(((R)-5,5-Диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан или (S)-7-(4-(2-(((S)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
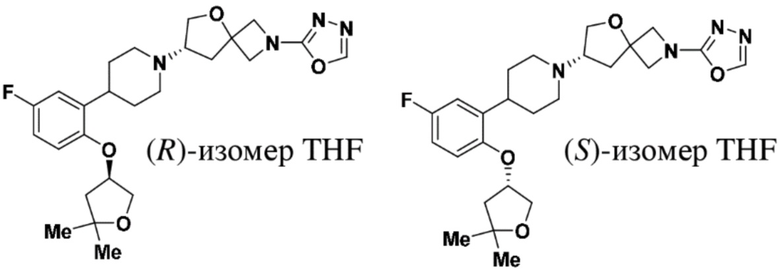
В раствор DMF (1,1 мл) (S)-2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенола (промежуточное соединение 4F, 100 мг, 0,267 ммоль) и карбоната цезия (261 мг, 0,801 ммоль) добавляли 5,5-диметилтетрагидрофуран-3-ил-4-метилбензолсульфонат (промежуточное соединение 5N, 72,2 мг, 0,267 ммоль). Полученную смесь перемешивали при 80°C в течение 18 часов. Неочищенное вещество разбавляли с помощью EtOAc, промывали водой и концентрировали при пониженном давлении. Остаток очищали с помощью FCC (0-10% MeOH/DCM), затем с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.). Два диастереомера затем разделяли с помощью препаративной SFC (колонка ChiralPak IG, 21×250 мм, 30% IPA, скорость потока: 80 г в минуту). Выделяли и концентрировали продукт, соответствующий пику 1, с получением примера 2N (19 мг, 0,039 ммоль) и выделяли продукт, соответствующий пику 2, с получением примера 2O (9 мг, 0,019 ммоль).
Пример 2N.
SFC: Rt: 3,29 мин. (Chiralpak IG, 4,6×100 мм, 5 мкм, 5→55% IPA с 10 мМ NH4OH/CO2, 5 мл/мин.). LCMS: Rt: 2,21 мин. (способ 4 LCMS); MS масса/заряд 473,3 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,65 (s, 1H), 7,04-6,86 (m, 3H), 5,01 (m, 1H), 4,22 (d, J=8,9 Гц, 1H), 4,13 (dd, J=8,3, 2,7 Гц, 2H), 4,09-3,99 (m, 2H), 3,94 (dd, J=8,5, 6,6 Гц, 1H), 3,83-3,74 (m, 1H), 3,68-3,57 (m, 1H), 3,06-2,91 (m, 2H), 2,91-2,75 (m, 2H), 2,41 (dd, J=12,9, 7,2 Гц, 1H), 2,13 (dd, J=13,7, 6,7 Гц, 1H), 2,09-1,98 (m, 3H), 1,89 (dd, J=13,8, 1,6 Гц, 1H), 1,76-1,65 (m, 2H), 1,59 (m, 2H), 1,31 (s, 3H), 1,22 (s, 3H).
Пример 2O.
SFC: Rt: 3,41 мин. (Chiralpak IG, 4,6×100 мм, 5 мкм, 5→55% IPA с 10 мМ NH4OH/CO2, 5 мл/мин.). LCMS: Rt: 2,23 мин. (способ 4 LCMS); MS масса/заряд 473,5 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,65 (s, 1H), 7,12-6,80 (m, 3H), 5,01 (m, 1H), 4,22 (d, J=8,7 Гц, 1H), 4,13 (dd, J=8,5, 4,6 Гц, 2H), 4,08-3,98 (m, 2H), 3,94 (dd, J=8,5, 6,7 Гц, 1H), 3,78 (dt, J=10,1, 1,3 Гц, 1H), 3,65-3,57 (m, 1H), 2,95 (p, J=7,0 Гц, 2H), 2,92-2,75 (m, 2H), 2,41 (dd, J=12,9, 7,2 Гц, 1H), 2,13 (dd, J=13,6, 6,6 Гц, 1H), 2,09-1,97 (m, 3H), 1,94-1,85 (m, 1H), 1,70 (m, 2H), 1,57 (m, 2H), 1,31 (s, 3H), 1,22 (s, 3H).
Пример 2P. (S)-7-(4-(2-((3-Этилоксетан-3-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
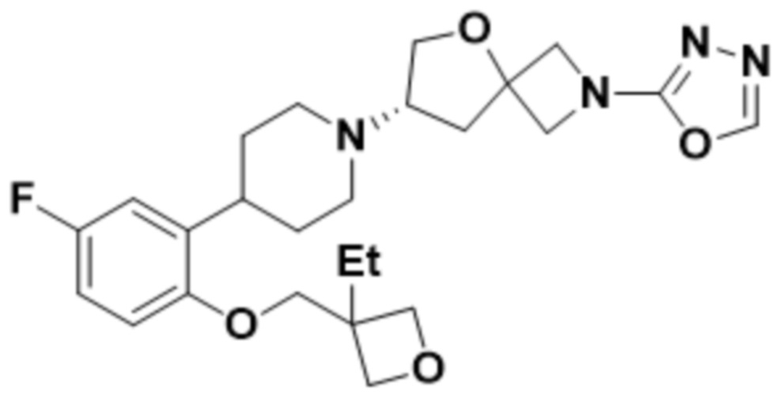
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 16 мг, 0,042 ммоль) растворяли в ацетонитриле (1,0 мл) и добавляли (3-этилоксетан-3-ил)метил-4-метилбензолсульфонат (промежуточное соединение 5N, 15 мг, 0,055 ммоль) и карбонат цезия (21 мг, 0,064 ммоль). Реакционную смесь перемешивали при 80°C в течение 18 часов и затем реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в DCM и насыщенном растворе бикарбоната натрия. Слои разделяли и водный слой экстрагировали с помощью DCM и объединенные органические вещества концентрировали при пониженном давлении. Остаток затем очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (13,4 мг, 0,027 ммоль) в виде белого твердого вещества.
LCMS: Rt: 2,18 мин. (способ 4 LCMS); MS масса/заряд 473,5 [M+H]+.
1H ЯМР (CD3OD) δ 8,39 (s, 1H), 7,03-6,82 (m, 3H), 4,67-4,61 (m, 2H), 4,54-4,47 (m, 2H), 4,34-4,24 (m, 2H), 4,21-4,12 (m, 2H), 4,08 (s, 3H), 3,80-3,70 (m, 1H), 3,16-2,96 (m, 3H), 2,94-2,85 (m, 1H), 2,60-2,48 (m, 1H), 2,28-2,09 (m, 3H), 1,91 (d, J=7,3 Гц, 4H), 1,76-1,59 (m, 2H), 0,98 (t, J=7,6 Гц, 3H).
Пример 2Q. (S)-7-(4-(5-Фтор-2-(((S)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан или (S)-7-(4-(5-фтор-2-(((R)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан и пример 2R. (S)-7-(4-(5-Фтор-2-(((S)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан или (S)-7-(4-(5-фтор-2-(((R)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
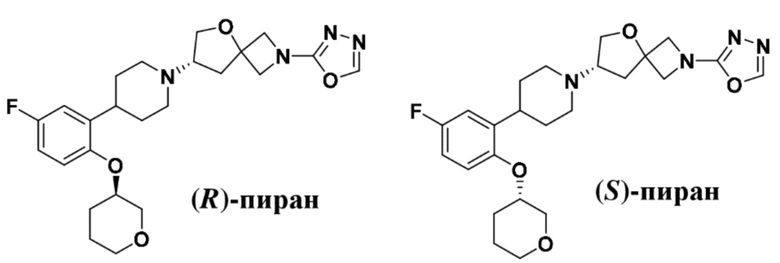
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 100 мг, 0,267 ммоль) растворяли в DMF (1,1 мл) и добавляли карбонат цезия (261 мг, 0,801 ммоль) с последующим добавлением тетрагидро-2H-пиран-3-ил-4-метилбензолсульфоната (промежуточное соединение 5L, 68,5 мг, 0,267 ммоль). Полученную смесь перемешивали при 80°C в течение 18 часов и затем ее разбавляли с помощью EtOAc, промывали водой и концентрировали при пониженном давлении. Остаток очищали с помощью FCC (0-10% MeOH/DCM) и дополнительно с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.). Диастереомеры затем разделяли с помощью SFC (колонка ChiralPak IG, 21×250 мм, 21% MeOH, скорость потока: 80 г в минуту). Выделяли продукт, соответствующий пику 1, с получением примера 2Q (8,0 мг, 0,017 ммоль) и выделяли продукт, соответствующий пику 2, с получением примера 2R (7,0 мг, 0,015 ммоль)
Пример 2Q.
SFC: Rt: 3,14 мин. (Chiralpak IA, 4,6×100 мм, 5 мкм, 5→55% MeOH с 10 мМ NH4OH/CO2, 5 мл/мин.). LCMS: Rt: 2,10 мин. (способ 4 LCMS); MS масса/заряд 459,5 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,03-6,90 (m, 3H), 4,36-4,28 (m, 1H), 4,24-4,19 (m, 1H), 4,15-4,10 (m, 2H), 4,05-4,00 (m, 1H), 3,97-3,90 (m, 1H), 3,75-3,69 (m, 1H), 3,65-3,54 (m, 3H), 3,54-3,47 (m, 1H), 3,03-2,84 (m, 3H), 2,83-2,74 (m, 1H), 2,45-2,36 (m, 1H), 2,11-1,93 (m, 4H), 1,86-1,65 (m, 4H), 1,65-1,46 (m, 3H).
Пример 2R.
SFC: Rt: 3,35 мин. (Chiralpak IA, 4,6×100 мм, 5 мкм, 5→55% MeOH с 10 мМ NH4OH/CO2, 5 мл/мин.). LCMS: Rt: 2,09 мин. (способ 4 LCMS); MS масса/заряд 459,1 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,66-8,62 (m, 1H), 7,04-6,89 (m, 3H), 4,27-4,28 (m, 1H), 4,25-4,19 (m, 1H), 4,16-4,09 (m, 2H), 4,05-4,00 (m, 1H), 3,97-3,90 (m, 1H), 3,76-3,70 (m, 1H), 3,65-3,55 (m, 3H), 3,55-3,47 (m, 1H), 3,01-2,84 (m, 3H), 2,84-2,75 (m, 1H), 2,45-2,37 (m, 1H), 2,11-1,93 (m, 4H), 1,87-1,64 (m, 4H), 1,64-1,47 (m, 3H).
Пример 2S. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
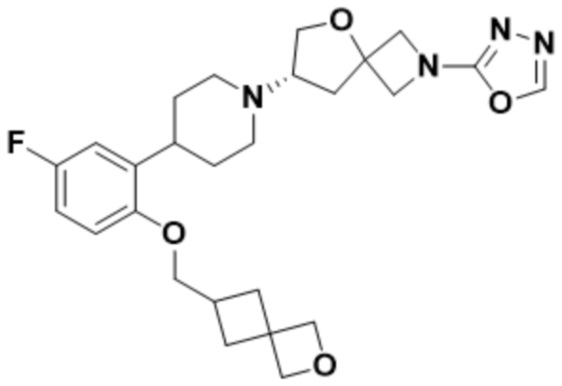
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 40 мг, 0,11 ммоль), карбонат цезия (139 мг, 0,427 ммоль) и (2-оксаспиро[3.3]гептан-6-ил)метил-4-метилбензолсульфонат (промежуточное соединение 5A, 36,2 мг, 0,128 ммоль) растворяли в DMF (10 мл). Полученную смесь перемешивали при 80°C в течение 16 часов. Неочищенное вещество разбавляли с помощью EtOAc, промывали водой и органический слой концентрировали при пониженном давлении. Остаток очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 35-60% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (23 мг, 0,047 ммоль).
LCMS: Rt: 2,18 мин. (способ 4 LCMS); MS масса/заряд 485,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,29 (s, 1H), 6,89-6,64 (m, 3H), 4,66 (s, 2H), 4,54 (s, 2H), 4,20 (d, J=10,3 Гц, 2H), 4,07 (d, J=8,6 Гц, 2H), 4,02-3,92 (m, 1H), 3,82-3,60 (m, 3H), 3,07-2,73 (m, 4H), 2,56-2,40 (m, 2H), 2,33 (m, 2H), 2,19-1,97 (m, 5H), 1,80-1,48 (m, 4H).
Пример 2T. (S)-7-(4-(2-((5-Этил-1,3,4-тиадиазол-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
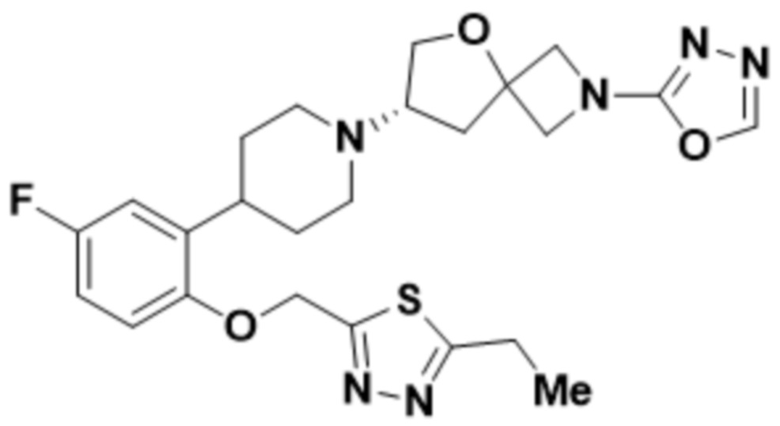
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 13 мг, 0,035 ммоль) растворяли в ацетонитриле (1,0 мл) и добавляли 2-(хлорметил)-5-этил-1,3,4-тиадиазол (11,3 мг, 0,069 ммоль) и карбонат цезия (17 мг, 0,052 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов и затем растворитель концентрировали при пониженном давлении и остаток очищали с помощью препаративной HPLC (XBridge 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (4,0 мг, 0,0080 ммоль) в виде белого твердого вещества.
LCMS: Rt: 1,93 мин. (способ 4 LCMS); MS масса/заряд 501,7 [M+H]+.
1H ЯМР (CD3OD) δ 8,39 (s, 1H), 7,10-7,04 (m, 1H), 7,01-6,96 (m, 1H), 6,95-6,88 (m, 1H), 5,49 (s, 2H), 4,37-4,25 (m, 2H), 4,22-4,13 (m, 2H), 4,11-4,02 (m, 1H), 3,82-3,72 (m, 1H), 3,18 (s, 4H), 3,06-2,95 (m, 1H), 2,93-2,84 (m, 1H), 2,62-2,48 (m, 1H), 2,30-2,10 (m, 3H), 1,93-1,79 (m, 2H), 1,77-1,62 (m, 2H), 1,48-1,38 (m, 3H).
Пример 2U. (S)-3-((2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)метил)оксетан-3-ол
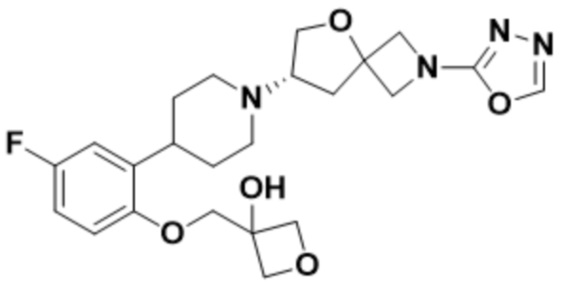
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 36 мг, 0,096 ммоль) растворяли в MeCN (1,5 мл) и добавляли (3-гидроксиоксетан-3-ил)метил 4-метилбензолсульфонат (промежуточное соединение 5J, 30 мг, 0,12 ммоль) и карбонат цезия (47 мг, 0,14 ммоль). Реакционную смесь перемешивали при 70°C в течение 3 дней и затем удаляли растворитель при пониженном давлении. Остаток разбавляли с помощью DCM и насыщенного раствора NaHCO3. Слои разделяли и водный слой экстрагировали с помощью DCM и объединенные органические слои концентрировали при пониженном давлении. Остаток очищали с помощью препаративной HPLC (XBridge, 30×50 мм, 5 мкм, 15-40% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (12,4 мг, 0,027 ммоль) в виде белого твердого вещества.
LCMS: Rt: 1,54 мин. (способ 4 LCMS); MS масса/заряд 461,4 [M+H]+.
1H ЯМР (CD3OD) δ 8,39 (s, 1H), 7,05-6,83 (m, 3H), 4,74-4,69 (m, 2H), 4,68-4,63 (m, 2H), 4,36-4,25 (m, 2H), 4,22-4,13 (m, 2H), 4,12-4,03 (m, 3H), 3,81-3,72 (m, 1H), 3,15-3,04 (m, 3H), 2,94-2,83 (m, 1H), 2,60-2,49 (m, 1H), 2,33-2,06 (m, 3H), 1,94-1,80 (m, 2H), 1,77-1,60 (m, 1H).
Пример 2V. 2-((1S,3r)-3-(2-(1-((S)-2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ол или 2-((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ол и пример 2W 2-((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ол или 2-((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ол
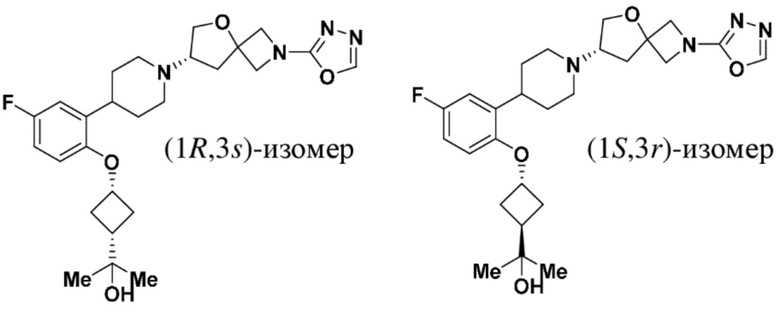
Стадия 1. Метил-(S)-3-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутан-1-карбоксилат
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 50 мг, 0,13 ммоль) и метил-3-(тозилокси)циклобутан-1-карбоксилат (промежуточное соединение 5Q, 102 мг, 0,200 ммоль) растворяли в ацетонитриле (2 мл) и добавляли карбонат цезия (218 мг, 0,668 ммоль). Реакционную смесь перемешивали при 80°C в течение 16 часов и затем концентрировали и разбавляли с помощью EtOAc, промывали водой и концентрировали при пониженном давлении. Остаток очищали с помощью FCC (0-5% MeOH/DCM) с получением указанного в заголовке промежуточного соединения (56 мг, 0,11 ммоль).
LCMS: Rt: 0,97 мин. (способ 2 LCMS); MS масса/заряд 487,4 [M+H]+.
Стадия 2. 2-((1S,3r)-3-(2-(1-((S)-2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ол или 2-((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ол
Метил-(S)-3-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутан-1-карбоксилат (50 мг, 0,078 ммоль) растворяли в THF (2 мл) при -10°C и добавляли метилмагния хлорид (0,057 мл, 0,173 ммоль, 3 M THF). Реакционную смесь медленно нагревали до 0°C и перемешивали в течение 1 часа. Реакционную смесь затем нейтрализовали с помощью насыщенного раствора хлорида аммония и экстрагировали с помощью EtOAc. Объединенные органические слои концентрировали при пониженном давлении и остаток очищали с помощью препаративной HPLC (X-Bridge, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением разделенных диастереомеров. Продукт, соответствующий исходному пику, представляет собой пример 2V (5,0 мг, 0,0099 ммоль) и продукт, соответствующий следующему пику, представляет собой пример 2W (8 мг, 0,016 ммоль).
Пример 2V.
LCMS: Rt: 2,11 мин. (способ 4 LCMS); MS масса/заряд 487,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,97-6,75 (m, 2H), 6,64 (dd, J=9,0, 4,6 Гц, 1H), 4,63 (m, 1H), 4,41-4,26 (m, 2H), 4,23-4,14 (m, 2H), 4,07 (dd, J=8,7, 6,9 Гц, 1H), 3,77 (dd, J=8,7, 7,4 Гц, 1H), 3,17-2,86 (m, 4H), 2,64-2,53 (m, 1H), 2,51-2,33 (m, 3H), 2,31-2,09 (m, 5H), 1,95-1,59 (m, 4H), 1,16 (s, 6H).
Пример 2W.
LCMS: Rt: 2,14 мин. (способ 4 LCMS); MS масса/заряд 487,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,97-6,65 (m, 3H), 4,59-4,40 (m, 1H), 4,37-4,24 (m, 2H), 4,17 (q, J=8,6 Гц, 2H), 4,06 (dd, J=8,6, 7,0 Гц, 1H), 3,76 (dd, J=8,6, 7,3 Гц, 1H), 3,17-2,79 (m, 4H), 2,54 (dd, J=13,0, 7,4 Гц, 1H), 2,40 (m, 2H), 2,28-2,10 (m, 3H), 2,09-1,92 (m, 3H), 1,83 (m, 2H), 1,68 (m, 2H), 1,12 (s, 6H).
Пример 2X. (S)-7-(4-(5-Фтор-2-((S)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан или (S)-7-(4-(5-фтор-2-((R)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан и пример 2Y. (S)-7-(4-(5-Фтор-2-((S)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан или (S)-7-(4-(5-фтор-2-((R)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
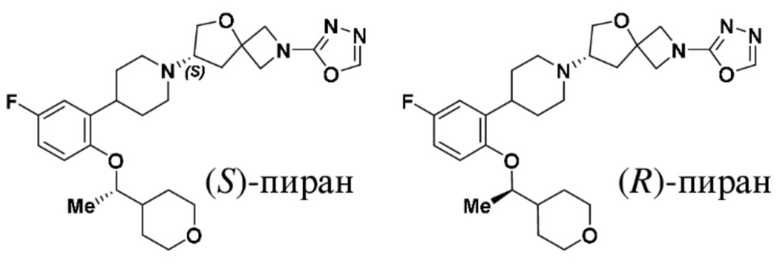
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 73 мг, 0,20 ммоль), 1-(тетрагидро-2H-пиран-4-ил)этил-4-метилбензолсульфонат (промежуточное соединение 5R, 83 мг, 0,29 ммоль) растворяли в ацетонитриле (8 мл) и добавляли карбонат цезия (127 мг, 0,390 ммоль). Реакционную смесь перемешивали при 80°C в течение 16 часов и затем фильтровали. Фильтрат выпаривали при пониженном давлении и остаток очищали с помощью FCC (0-100% EtOAc (0,1% 7N NH3 в MeOH)/DCM; затем 0-3% DCM/MeOH). Диастереомеры затем разделяли с помощью хиральной SFC (колонка ChiralPak IF, 21×250 мм, 30% MeOH:IPA 1:1 с 10 мМ NH4OH, скорость потока: 80 г в минуту). Выделяли продукт, соответствующий исходному пику, с получением примера 2X (17 мг, 0,034 ммоль) и выделяли продукт, соответствующий следующему пику, с получением примера 2Y (17 мг, 0,034 ммоль).
Пример 2X.
SFC: Rt: 2,78 мин. (Chiralpak IF, 3×100 мм, 5 мкм, 5→55% MeOH:IPA 1:1 с 10 мМ NH4OH/CO2, 2,5 мл/мин.).
LCMS: Rt: 2,28 мин. (способ 4 LCMS); MS масса/заряд 487,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,06-6,56 (m, 3H), 4,35-4,21 (m, 3H), 4,17 (q, J=8,6 Гц, 2H), 4,11-3,94 (m, 3H), 3,76 (dd, J=8,5, 7,4 Гц, 1H), 3,44 (m, 2H), 3,21-2,85 (m, 4H), 2,55 (dd, J=12,9, 7,3 Гц, 1H), 2,32-2,07 (m, 3H), 1,92-1,77 (m, 4H), 1,76-1,42 (m, 5H), 1,21 (d, J=6,0 Гц, 3H).
Пример 2Y.
SFC: Rt: 2,93 мин. (Chiralpak IF, 3×100 мм, 5 мкм, 5→55% MeOH:IPA 1:1 с 10 мМ NH4OH/CO2, 2,5 мл/мин.).
LCMS: Rt: 2,33 мин. (способ 4 LCMS); MS масса/заряд 487,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,31-6,49 (m, 3H), 4,38-4,22 (m, 3H), 4,17 (q, J=8,6 Гц, 2H), 4,10-3,92 (m, 3H), 3,76 (dd, J=8,7, 7,4 Гц, 1H), 3,44 (m, 2H), 3,22-2,75 (m, 4H), 2,55 (dd, J=13,1, 7,3 Гц, 1H), 2,38-2,08 (m, 3H), 2,01-1,79 (m, 4H), 1,76-1,43 (m, 5H), 1,22 (d, J=6,0 Гц, 3H).
Пример 2Z. (7S)-7-(4-(2-((3-Оксабицикло[3.1.0]гексан-6-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
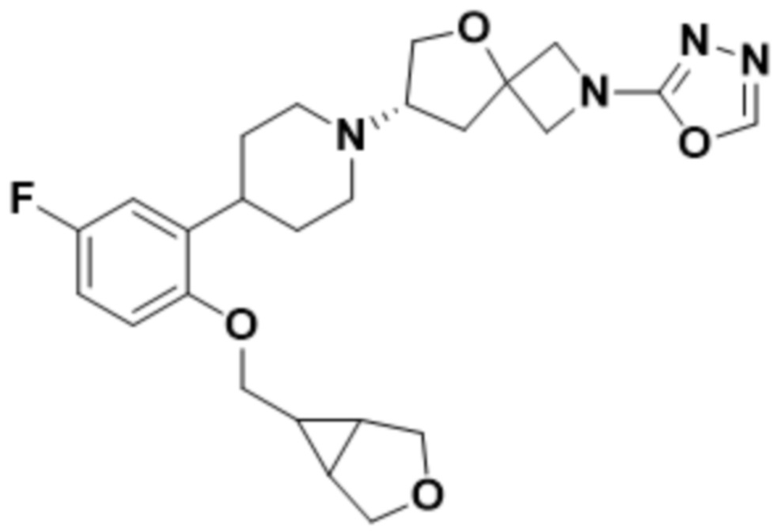
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол (промежуточное соединение 4F, 38 мг, 0,10 ммоль) и (3-оксабицикло[3.1.0]гексан-6-ил)метил-4-метилбензолсульфонат (промежуточное соединение 5K, 55 мг, 0,15 ммоль) растворяли в ацетонитриле (2 мл) и добавляли карбонат цезия (66 мг, 0,20 ммоль). Реакционную смесь перемешивали при 80°C в течение 16 часов и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (19 мг, 0,040 ммоль).
LCMS: Rt: 2,11 мин. (способ 4 LCMS); MS масса/заряд 471,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,03-6,29 (m, 3H), 4,36-4,23 (m, 2H), 4,17 (q, J=8,5 Гц, 2H), 4,07 (dd, J=8,7, 6,9 Гц, 1H), 3,96-3,84 (m, 4H), 3,81-3,64 (m, 3H), 3,17-2,96 (m, 3H), 2,90 (m, 1H), 2,55 (dd, J=13,1, 7,3 Гц, 1H), 2,31-2,07 (m, 3H), 1,84 (m, 2H), 1,77-1,59 (m, 4H), 1,16 (m, 1H).
Пример 2AA. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-3,5-дифторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
Во флакон объемом 40 мл в раствор (S)-2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4,6-дифторфенола (промежуточное соединение 4C, 0,082 г, 0,209 ммоль) в MeCN (2,1 мл) в атмосфере азота добавляли раствор 2-оксаспиро[3.3]гептан-6-ил-4-метилбензолсульфоната (стадия 1 из примера 2K, 0,062 г, 0,230 ммоль) в MeCN (0,5 мл) с последующим добавлением Cs2CO3 (0,272 г, 0,836 ммоль) и его перемешивали при 80°C в течение 6 часов. Реакционную смесь затем охлаждали до к. т. и разбавляли с помощью EtOAc и воды. Слои разделяли, водную фазу экстрагировали с помощью EtOAc, объединенные органические слои высушивали над MgSO4, фильтровали и концентрировали. Остаток очищали с помощью FCC (0-15% MeOH (10% NH4OH)/EtOAc) с получением указанного в заголовке соединения в виде белого твердого вещества.
LCMS: Rt: 1,20 мин. (способ 3 LCMS); MS масса/заряд 489,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,89-6,74 (m, 2H), 4,67 (d, J=1,8 Гц, 4H), 4,42-4,24 (m, 3H), 4,17 (q, J=8,6 Гц, 2H), 4,06 (dd, J=8,8, 6,9 Гц, 1H), 3,77 (dd, J=8,8, 7,3 Гц, 1H), 3,17-3,05 (m, 2H), 3,05-2,86 (m, 2H), 2,69 (m, 2H), 2,55 (dd, J=13,0, 7,4 Гц, 1H), 2,39 (ddd, J=10,2, 7,2, 3,4 Гц, 2H), 2,31-2,09 (m, 3H), 1,85-1,58 (m, 4H).
Пример 2BB. (S)-7-(4-(3,5-Дифтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
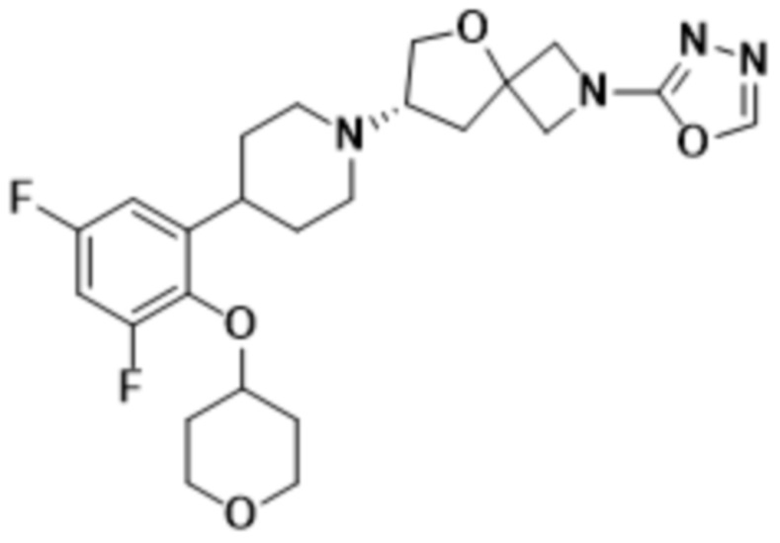
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4,6-дифторфенол (промежуточное соединение 4C, 32 мг, 0,082 ммоль), тетрагидро-2H-пиран-4-ил-4-метилбензолсульфонат (23 мг, 0,090 ммоль) и карбонат цезия (106 мг, 0,326 ммоль) суспендировали в ацетонитриле (0,8 мл). Реакционную смесь перемешивали при 80°C в течение ночи и затем охлаждали до комнатной температуры и разбавляли с помощью EtOAc и воды. Водный слой экстрагировали с помощью EtOAc и объединенные органические слои высушивали с помощью сульфата магния, фильтровали и концентрировали. Остаток очищали с помощью FCC (0-20% MeOH(10% NH4OH)/EtOAc) и с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (27 мг, 0,058 ммоль) в виде белого твердого вещества.
LCMS: Rt: 1,98 мин. (способ 4 LCMS); MS масса/заряд 477,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,90-6,77 (m, 2H), 4,35-4,12 (m, 5H), 4,06 (dd, J=8,6, 6,9 Гц, 1H), 3,97 (dt, J=12,0, 4,3 Гц, 2H), 3,76 (dd, J=8,7, 7,3 Гц, 1H), 3,48 (m, 2H), 3,16-3,01 (m, 3H), 2,90 (m, 1H), 2,54 (dd, J=12,9, 7,4 Гц, 1H), 2,27-2,09 (m, 3H), 2,03-1,93 (m, 2H), 1,87-1,58 (m, 6H).
Пример 2CC. (S)-7-(4-(3,5-Дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
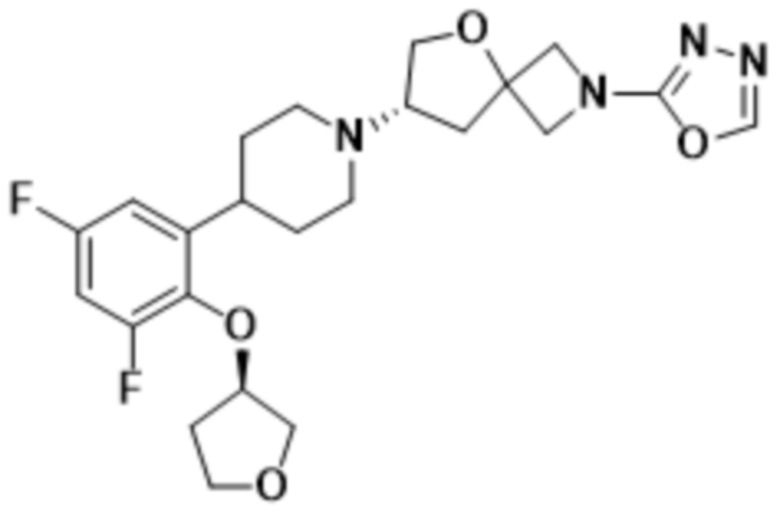
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4,6-дифторфенол (промежуточное соединение 4C, 32 мг, 0,082 ммоль), (S)-тетрагидрофуран-3-ил-4-метилбензолсульфонат (промежуточное соединение 5C) 22 мг, 0,090 ммоль) и карбонат цезия (106 мг, 0,326 ммоль) суспендировали в ацетонитриле (0,8 мл). Реакционную смесь перемешивали при 80°C в течение 80 минут, затем охлаждали при комнатной температуре и разбавляли с помощью EtOAc и воды. Водный слой экстрагировали с помощью EtOAc и объединенные органические слои высушивали с помощью сульфата магния, фильтровали и концентрировали. Остаток очищали с помощью FCC (0-20% MeOH (10% NH4OH)/EtOAc) с получением указанного в заголовке соединения (27 мг, 0,058 ммоль) в виде белого твердого вещества.
LCMS: Rt: 1,98 мин. (способ 4 LCMS); MS масса/заряд 463,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,94-6,75 (m, 2H), 5,03-4,94 (m, 1H), 4,35-4,23 (m, 2H), 4,17 (q, J=8,6 Гц, 2H), 4,10-3,99 (m, 2H), 3,96-3,86 (m, 2H), 3,80-3,69 (m, 2H), 3,15-2,98 (m, 3H), 2,95-2,84 (m, 1H), 2,55 (dd, J=13,0, 7,4 Гц, 1H), 2,27-2,08 (m, 5H), 1,85-1,56 (m, 4H).
Пример 2DD. (S)-7-(4-(3,5-Дифтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
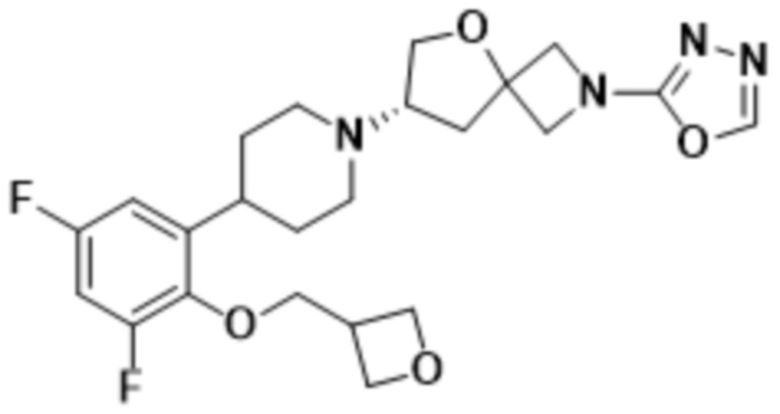
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4,6-дифторфенол (промежуточное соединение 4C, 32 мг, 0,082 ммоль), оксетан-3-илметил-4-метилбензолсульфонат (22 мг, 0,090 ммоль) и карбонат цезия (106 мг, 0,326 ммоль) суспендировали в ацетонитриле (0,8 мл). Реакционную смесь перемешивали при 80°C в течение 20 минут, затем охлаждали при комнатной температуре и разбавляли с помощью EtOAc и воды. Водный слой экстрагировали с помощью EtOAc и объединенные органические слои высушивали с помощью сульфата магния, фильтровали и концентрировали. Остаток очищали с помощью FCC (0-20% MeOH (10% NH4OH)/EtOAc) с получением указанного в заголовке соединения (23 мг, 0,049 ммоль) в виде белого твердого вещества.
LCMS: Rt: 1,89 мин. (способ 4 LCMS); MS масса/заряд 463,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,92-6,77 (m, 2H), 4,88 (dd, J=8,0, 6,1 Гц, 2H), 4,63 (t, J=6,0 Гц, 2H), 4,35-4,23 (m, 2H), 4,23-4,12 (m, 4H), 4,06 (dd, J=8,7, 6,8 Гц, 1H), 3,76 (dd, J=8,7, 7,2 Гц, 1H), 3,44 (m, 1H), 3,17-2,95 (m, 3H), 2,95-2,86 (m, 1H), 2,54 (dd, J=13,1, 7,4 Гц, 1H), 2,28-2,09 (m, 3H), 1,88-1,62 (m, 4H).
Пример 2EE. (S)-7-(4-(3,5-Дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
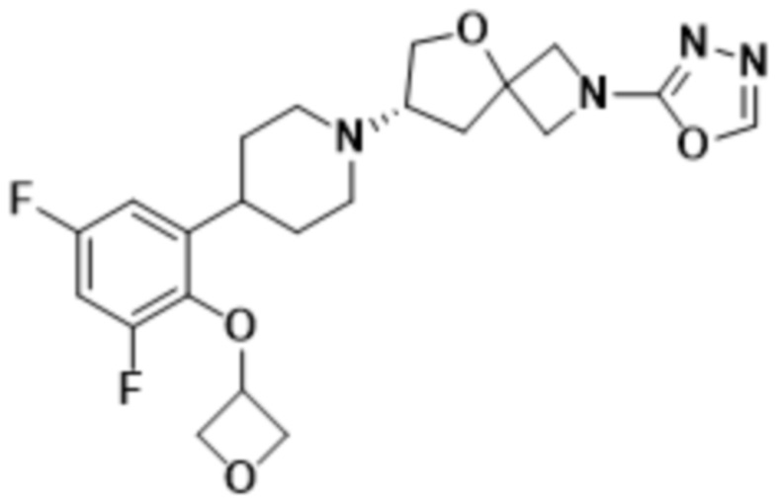
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4,6-дифторфенол (промежуточное соединение 4C, 32 мг, 0,082 ммоль), оксетан-3-ил-4-метилбензолсульфонат (коммерчески доступный, 20 мг, 0,090 ммоль) и карбонат цезия (106 мг, 0,326 ммоль) суспендировали в ацетонитриле (0,8 мл). Реакционную смесь перемешивали при 80°C в течение 6 часов, затем охлаждали при комнатной температуре и разбавляли с помощью EtOAc и воды. Водный слой экстрагировали с помощью EtOAc и объединенные органические слои высушивали с помощью сульфата магния, фильтровали и концентрировали. Остаток очищали с помощью FCC (0-20% MeOH (10% NH4OH)/EtOAc) с получением указанного в заголовке соединения (15 мг, 0,033 ммоль) в виде белого твердого вещества.
LCMS: Rt: 1,87 мин. (способ 4 LCMS); MS масса/заряд 449,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,93-6,75 (m, 2H), 5,15-5,00 (m, 1H), 4,91 (dd, J=7,5, 6,1 Гц, 2H), 4,83-4,77 (m, 2H), 4,35-4,22 (m, 2H), 4,17 (q, J=8,7 Гц, 2H), 4,06 (dd, J=8,8, 6,9 Гц, 1H), 3,77 (dd, J=8,8, 7,3 Гц, 1H), 3,16-2,95 (m, 3H), 2,95-2,85 (m, 1H), 2,54 (dd, J=13,0, 7,4 Гц, 1H), 2,23 (m, 2H), 2,14 (dd, J=13,0, 8,3 Гц, 1H), 1,86-1,59 (m, 4H).
Пример 2FF. (S)-7-(4-(4,5-Дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
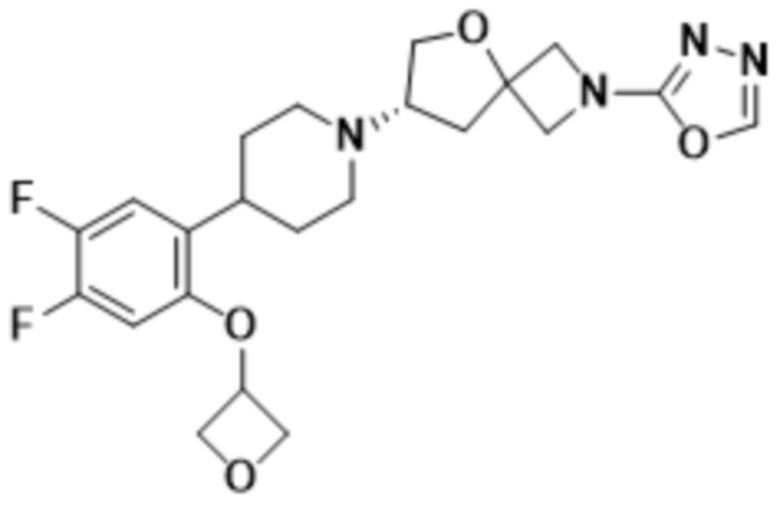
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4,5-дифторфенол (промежуточное соединение 4D, 28 мг, 0,071 ммоль), оксетан-3-ил-4-метилбензолсульфонат (21 мг, 0,093 ммоль) и карбонат цезия (70 мг, 0,21 ммоль) суспендировали в ацетонитриле (2 мл). Реакционную смесь перемешивали при 80°C в течение ночи, охлаждали до комнатной температуры, фильтровали и концентрировали. Остаток очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.), затем с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 10-30% MeCN/H2O (0,1% муравьиная кислота), 75 мл/мин.) с получением указанного в заголовке соединения (6 мг, 0,012 ммоль) в виде формиатной соли.
LCMS: Rt: 1,87 мин. (способ 4 LCMS); MS масса/заряд 449,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (d, J=6,3 Гц, 1H), 7,13 (dd, J=11,7, 8,9 Гц, 1H), 6,53 (dd, J=12,2, 6,8 Гц, 1H), 5,26 (m, 1H), 5,02 (t, J=6,8 Гц, 2H), 4,67 (dd, J=7,5, 4,8 Гц, 2H), 4,42-4,00 (m, 5H), 3,86 (dd, J=9,1, 6,7 Гц, 1H), 3,29-2,78 (m, 4H), 2,61 (dd, J=13,3, 7,5 Гц, 1H), 2,43 (m, 2H), 2,22 (dd, J=13,3, 7,8 Гц, 1H), 1,96-1,51 (m, 4H).
Пример 2GG. (S)-7-(4-(4,5-Дифтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
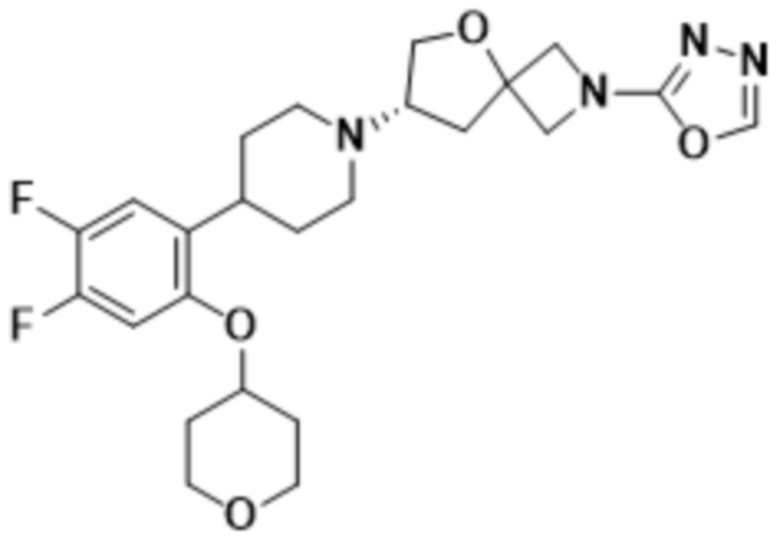
(S)-2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4,5-дифторфенол (промежуточное соединение 4D, 28 мг, 0,071 ммоль), тетрагидро-2H-пиран-4-ил-4-метилбензолсульфонат (коммерчески доступный, 24 мг, 0,093 ммоль) и карбонат цезия (70 мг, 0,21 ммоль) суспендировали в ацетонитриле (2 мл). Реакционную смесь перемешивали при 80°C в течение ночи, затем охлаждали до комнатной температуры, фильтровали и концентрировали. Остаток очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) и дополнительно с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 10-30% MeCN/H2O (0,1% муравьиная кислота), 75 мл/мин.) с получением указанного в заголовке соединения (14 мг, 0,027 ммоль).
LCMS: Rt: 2,11 мин. (способ 4 LCMS); MS масса/заряд 477,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,39 (s, 1H), 7,07 (dd, J=11,8, 9,2 Гц, 1H), 7,02-6,88 (m, 1H), 4,54 (m, 1H), 4,40-4,25 (m, 2H), 4,23-4,04 (m, 3H), 4,02-3,77 (m, 3H), 3,61 (m, 2H), 3,29-3,14 (m, 2H), 3,01 (m, 2H), 2,59 (dd, J=13,2, 7,4 Гц, 1H), 2,36 (m, 2H), 2,19 (dd, J=13,3, 7,9 Гц, 1H), 2,03 (m, 2H), 1,87 (m, 2H), 1,72 (m, 4H).
Пример 2HH. ((1S,3r)-3-(2-(1-((S)-2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанол или ((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанол и пример 2II ((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанол или ((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанол
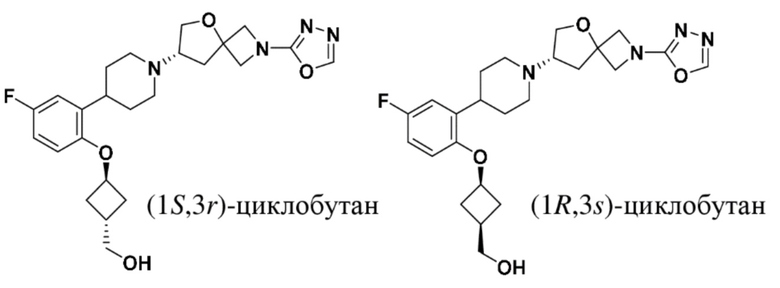
Метил-(S)-3-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутан-1-карбоксилат (пример 2U, стадия 1, 29 мг, 0,060 ммоль) растворяли в THF (2 мл) и добавляли LiBH4 (2,6 мг, 0,12 ммоль) при 0°C. Реакционную смесь медленно нагревали до комнатной температуры, перемешивали в течение ночи и нейтрализовали с помощью насыщенного раствора хлорида аммония, экстрагировали с помощью EtOAc и объединенные органические слои концентрировали. Остаток очищали с помощью препаративной HPLC (колонка XSelect CSH C18, 5 мкм, 19×150 мм, 15-30% MeCN/H2O (0,1% TFA), 25 мл/мин.) с получением продукта, соответствующего пику 1 и пику 2. Продукт, соответствующий пику 1, получали в виде свободного основания на колонке со смолой PL-HCO3 MP (элюирование метанолом) и концентрировали с получением соединения примера 2HH (2,0 мг, 0,0043 ммоль). Продукт, соответствующий пику 2, дополнительно очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 35-60% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением примера 2II (2 мг, 0,0043 ммоль).
Пример 2HH.
LCMS: Rt: 1,88 мин. (способ 4 LCMS); MS масса/заряд 459,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,90 (dd, J=9,8, 3,1 Гц, 1H), 6,81 (td, J=8,4, 3,1 Гц, 1H), 6,65 (dd, J=8,9, 4,5 Гц, 1H), 4,73 (p, J=6,4 Гц, 1H), 4,36-4,24 (m, 2H), 4,17 (q, J=8,7 Гц, 2H), 4,07 (dd, J=8,7, 6,9 Гц, 1H), 3,76 (dd, J=8,7, 7,4 Гц, 1H), 3,62 (d, J=6,7 Гц, 2H), 3,09 (t, J=7,6 Гц, 2H), 3,06-2,94 (m, 1H), 2,90 (d, J=11,2 Гц, 1H), 2,55 (dd, J=13,0, 7,5 Гц, 1H), 2,53-2,40 (m, 1H), 2,39-2,29 (m, 2H), 2,29-2,09 (m, 5H), 1,84 (m, 2H), 1,78-1,61 (m, 2H).
Пример 2II.
LCMS: Rt: 1,84 мин. (способ 4 LCMS); MS масса/заряд 459,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,41 (s, 1H), 6,92 (dd, J=9,8, 3,0 Гц, 1H), 6,84 (td, J=8,3, 3,1 Гц, 1H), 6,77 (dd, J=8,9, 4,8 Гц, 1H), 4,58 (p, J=7,0 Гц, 1H), 4,40-4,26 (m, 2H), 4,19 (q, J=8,7 Гц, 2H), 4,09 (dd, J=8,8, 6,9 Гц, 1H), 3,85-3,75 (m, 1H), 3,57 (d, J=5,9 Гц, 2H), 3,19-3,08 (m, 2H), 3,00 (m, 1H), 2,92 (d, J=11,4 Гц, 1H), 2,57 (m, 3H), 2,36-2,12 (m, 4H), 1,87 (m, 4H), 1,71 (m, 2H).
Пример 3A. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан или (S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан и пример 3B. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан или (S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
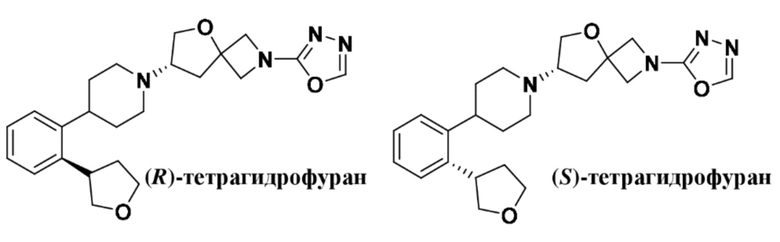
Стадия 1. трет-Бутил-(S)-7-(4-(2-(2,5-дигидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(S)-7-(4-(2-(((трифторметил)сульфонил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 9A, 330 мг, 0,634 ммоль), 2-(2,5-дигидрофуран-3-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (124 мг, 0,634 ммоль) и трехосновный фосфат калия (404 мг, 1,90 ммоль) растворяли в смеси диоксана (1,4 мл) и воды (140 мкл). Pd(dppf)Cl2•CH2Cl2 (25 мг, 0,032 ммоль) добавляли и смесь дегазировали азотом в течение 2 минут и перемешивали при 80°C в течение 5 часов. Растворитель выпаривали при пониженном давлении и остаток разбавляли смесью DCM и воды. Слои разделяли и органическую фазу промывали водой, солевым раствором, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью FCC (0-40% EtOAc/гептан) с получением указанного в заголовке промежуточного соединения (246 мг, 0,558 ммоль).
LCMS: Rt: 1,10 мин. (способ 2 LCMS); MS масса/заряд 441,2 [M+H]+.
Стадия 2. (S)-7-(4-(2-(2,5-Дигидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
трет-Бутил-(S)-7-(4-(2-(2,5-дигидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (246 мг, 0,558 ммоль) растворяли в DCM (5,5 мл) и охлаждали до 0°C и перемешивали в течение 10 минут и затем добавляли TFA (637 мг, 5,58 ммоль), и реакционную смесь перемешивали в течение 16 часов при к. т. Реакционную смесь затем разбавляли с помощью DCM и промывали 1 н. NaOH. Слой DCM высушивали над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке промежуточного соединения (187 мг, 0,549 ммоль), которое применяли без дополнительной очистки.
LCMS: Rt: 0,80 мин. (способ 2 LCMS); MS масса/заряд 341,1 [M+H]+.
Стадия 3. (S)-7-(4-(2-(2,5-Дигидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
(S)-7-(4-(2-(2,5-Дигидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (187 мг, 0,55 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (121 мг, 0,55 ммоль) и трехосновный фосфат калия (350 мг, 1,65 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (1,0 мл) и THF (0,11 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли 4 н. HCl для регулирования pH до 2. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов и затем повышали основность с помощью 2 M LiOH до pH > 8. Раствор затем экстрагировали с помощью DCM и объединенные органические слои выпаривали при пониженном давлении. Остаток очищали с помощью FCC (0-7% MeOH/DCM) с получением указанного в заголовке промежуточного соединения (38 мг, 0,089 ммоль).
LCMS: Rt: 1,85 мин. (способ 4 LCMS); MS масса/заряд 409,7 [M+H]+.
Стадия 4. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан или (S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
(S)-7-(4-(2-(2,5-Дигидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан (143 мг, 0,35 ммоль) и 10% Pd-C (37 мг) растворяли в MeOH и реакционную смесь перемешивали в течение 16 часов в атмосфере водорода. Реакционную смесь затем фильтровали и неочищенное вещество очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.). Два диастереомера затем разделяли с помощью хиральной SFC (колонка ChiralPak ID, 21×250 мм, 40% IPA с 10 мМ NH4OH, скорость потока: 80 г в минуту) с получением продукта, соответствующего пику 1 (пример 3A, 32 мг, 0,076 ммоль), и продукта, соответствующего пику 2 (пример 3B, 27 мг, 0,064 ммоль).
Пример 3A.
SFC: Rt: 3,99 мин. (Chiralpak ID, 4,6×100 мм, 5 мкм, 5→55% IPA с 10 мМ NH4OH/CO2, 5 мл/мин.). LCMS: Rt: 1,81 мин. (способ 4 LCMS); MS масса/заряд 411,2 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,66-8,63 (m, 1H), 7,30-7,20 (m, 2H), 7,19-7,13 (m, 2H), 4,26-4,20 (m, 1H), 4,16-4,10 (m, 2H), 4,05-3,91 (m, 4H), 3,85-3,77 (m, 1H), 3,69-3,59 (m, 2H), 3,58-3,52 (m, 1H), 3,04-2,93 (m, 2H), 2,89-2,75 (m, 2H), 2,44-2,36 (m, 1H), 2,31-2,23 (m, 1H), 2,19-2,04 (m, 3H), 1,95-1,83 (m, 1H),1,72-1,57 (m, 4H).
Пример 3B.
SFC: Rt: 4,65 мин. (Chiralpak ID, 4,6×100 мм, 5 мкм, 5→55% IPA с 10 мМ NH4OH/CO2, 5 мл/мин.). LCMS: Rt: 1,82 мин. (способ 4 LCMS); MS масса/заряд 411,5 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,64 (s, 1H), 7,31-7,21 (m, 2H), 7,20-7,12 (m, 2H), 4,26-4,20 (m, 1H), 4,16-4,10 (m, 2H), 4,06-3,90 (m, 4H), 3,86-3,77 (m, 1H), 3,69-3,60 (m, 2H), 3,58-3,52 (m, 1H), 3,05-2,92 (m, 2H), 2,90-2,75 (m, 2H), 2,44-2,36 (m, 1H), 2,34-2,22 (m, 1H), 2,19-2,04 (m, 3H), 1,94-1,81 (m, 1H), 1,73-1,59 (m, 4H)
Пример 3C. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
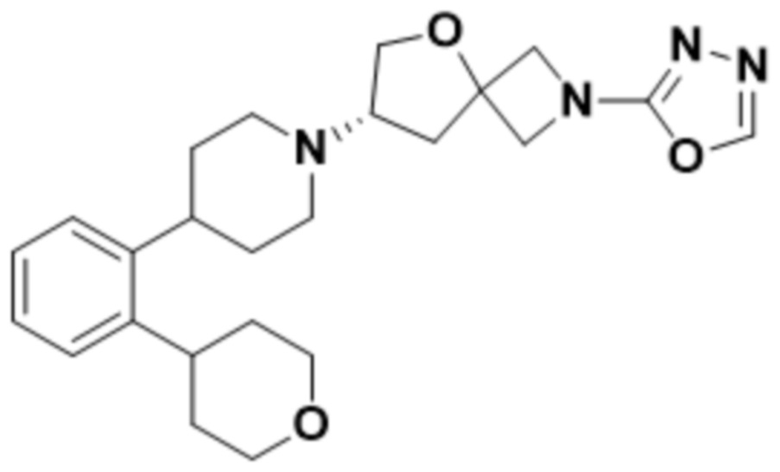
Стадия 1. трет-Бутил-(S)-7-(4-(2-(3,6-дигидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(S)-7-(4-(2-(((трифторметил)сульфонил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 9A, 237 мг, 0,455 ммоль), пинаколовый сложный эфир 3,6-дигидро-2H-пиран-4-бороновой кислоты (143 мг, 0,683 ммоль), Cs2CO3 (445 мг, 1,366 ммоль) и XPhosPd G2 (35,8 мг, 0,046 ммоль) добавляли во флакон объемом 40 мл. Добавляли диоксан (5 мл) и воду (1 мл), и раствор вакуумировали и заново заполняли газом N2 трижды. Затем его перемешивали при 80°C в течение 4 ч. Затем реакционную смесь охлаждали и экстрагировали с помощью EtOAc. Объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали. Неочищенное вещество очищали с помощью FCC (0-5% MeOH (10% NH4OH)/DCM) с получением указанного в заголовке промежуточного соединения (250 мг, 0,455 ммоль).
LCMS: Rt: 1,16 мин. (способ 2 LCMS); MS масса/заряд 455,5 [M+H]+.
Стадия 2. трет-Бутил-(S)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(S)-7-(4-(2-(3,6-дигидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (250 мг, 0,55 ммоль) и 10% Pd-C (117 мг) растворяли в EtOH (10 мл). Колбу продували водородом и затем реакционную смесь перемешивали в течение 16 часов в атмосфере водорода из баллона. Раствор фильтровали и концентрировали с получением указанного в заголовке промежуточного соединения (250 мг, 0,547 ммоль).
LCMS: Rt: 0,77 мин. (способ 1 LCMS); MS масса/заряд 457,5 [M+H]+.
Стадия 3. (S)-7-(4-(2-(Тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
трет-Бутил-(S)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (250 мг, 0,547 ммоль) растворяли в DCM (10 мл) и добавляли TFA (3 мл, 17,6 ммоль). Реакционную смесь перемешивали в течение 2 часов и затем растворитель концентрировали и остаток поглощали в DCM. Раствор DCM промывали насыщ. раствором NaHCO3 и слой DCM высушивали над MgSO4 и концентрировали с получением указанного в заголовке промежуточного соединения (195 мг, 0,547 ммоль).
LCMS: Rt: 0,50 мин. (способ 1 LCMS); MS масса/заряд 357,3 [M+H]+.
Стадия 4. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
(S)-7-(4-(2-(Тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (195 мг, 0,547 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (157 мг, 0,711 ммоль) и K3PO4 (151 мг, 0,711 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (6,0 мл) и THF (0,6 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли 2 M раствор LiOH (2,73 мл, 5,47 ммоль) и реакционную смесь перемешивали в течение 2 часов. Добавляли MeOH и 4 н. раствор HCl для регулирования pH до 2. Его перемешивали при комнатной температуре в течение 3 часов, затем повышали основность с помощью 2 M раствора LiOH (pH > 8), экстрагировали 3 раза с помощью DCM и объединенные органические слои выпаривали при пониженном давлении. Остаток очищали с помощью FCC (0-7% EtOAc/гептан с 1% 7 н. NH4OH/MeOH), и дополнительно с помощью препаративной HPLC (XBridge Peptide BEH C18, 5 мкм, 19×150 мм, 30-45% MeCN/H2O (5 мМ NH4OH), 30 мл/мин.) с получением указанного в заголовке соединения (59 мг, 0,14 ммоль).
LCMS: Rt: 1,89 мин. (способ 4 LCMS); MS масса/заряд 425,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,39 (s, 1H), 7,34-6,98 (m, 4H), 4,38-4,25 (m, 2H), 4,17 (q, J=8,6 Гц, 2H), 4,11-3,98 (m, 3H), 3,79 (dd, J=8,8, 7,3 Гц, 1H), 3,60 (td, J=11,8, 1,9 Гц, 2H), 3,19-3,06 (m,3H), 2,92 (dd, J=11,7, 3,6 Гц, 2H), 2,56 (dd, J=13,0, 7,5 Гц, 1H), 2,29 (m, 2H), 2,16 (dd, J=13,1, 8,3 Гц, 1H), 1,91-1,69 (m, 6H), 1,67-1,56 (m, 2H).
Пример 3D. (S)-7-(4-(5-Фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
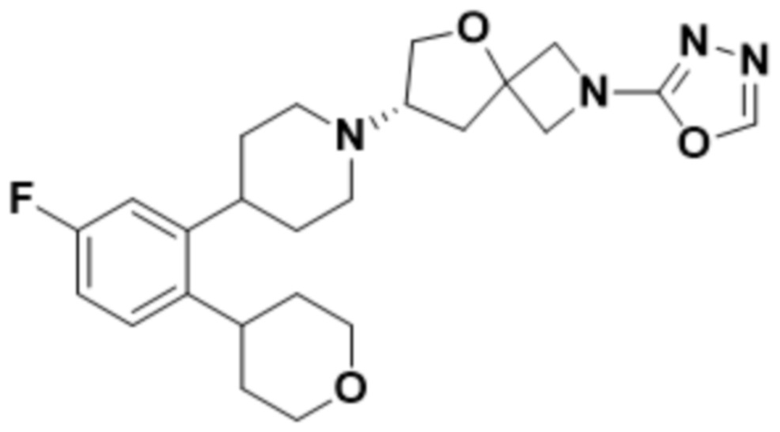
Стадия 1. трет-Бутил-(S)-7-(4-(2-(3,6-дигидро-2H-пиран-4-ил)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(S)-7-(4-(5-фтор-2-(((трифторметил)сульфонил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 9B, 300 мг, 0,557 ммоль), 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (117 мг, 0,557 ммоль), K3PO4 (355 мг, 1,671 ммоль) и Pd(dppf)Cl2•CH2Cl2 (22,75 мг, 0,028 ммоль) растворяли в диоксане (1,2 мл) и воде (0,12 мл). Флакон вакуумировали и заполняли азотом и это повторяли дважды. Затем реакционную смесь перемешивали в герметичном сосуде при 80°C в течение 5 часов. Растворитель концентрировали и остаток поглощали в DCM и промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали (250 мг, 0,529 ммоль).
LCMS: Rt: 1,16 мин. (способ 1 LCMS); MS масса/заряд 473,2 [M+H]+.
Стадия 2. трет-Бутил-(S)-7-(4-(5-фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(S)-7-(4-(2-(3,6-дигидро-2H-пиран-4-ил)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (250 мг, 0,529 ммоль) и 10% Pd-C (56 мг) растворяли в MeOH (5,2 мл) и перемешивали в течение 16 часов в атмосфере водорода. Реакционную смесь фильтровали через слой целита и растворитель удаляли с получением указанного в заголовке соединения (231 мг, 0,487 ммоль).
LCMS: Rt: 1,14 мин. (способ 2 LCMS); MS масса/заряд 475,6 [M+H]+.
Стадия 3. (S)-7-(4-(5-Фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
трет-Бутил-(S)-7-(4-(5-фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (231 мг, 0,487 ммоль) растворяли в DCM (4,8 мл) и охлаждали до 0°C. После инкубирования в течение 10 мин. при 0°C добавляли TFA (0,75 мл, 9,73 ммоль) и реакционную смесь нагревали до к. т. и перемешивали в течение 16 часов. Раствор концентрировали и остаток растворяли в DCM и промывали 1 н. NaOH и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали с получением указанного в заголовке промежуточного соединения (111 мг, 0,296 ммоль).
LCMS: Rt: 0,53 мин. (способ 1 LCMS); MS масса/заряд 375,1 [M+H]+.
Стадия 4. (S)-7-(4-(5-Фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
(S)-7-(4-(5-Фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (111 мг, 0,296 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (66 мг, 0,30 ммоль) и K3PO4 (189 мг, 0,889 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (0,53 мл) и THF (0,059 мл). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (60 мг, 0,13 ммоль).
LCMS: Rt: 1,33 мин. (способ 4 LCMS); MS масса/заряд 443,3 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,67-8,60 (m, 1H), 7,32-7,23 (m, 1H), 7,06-6,92 (m, 2H), 4,26-4,20 (m, 1H), 4,16-4,10 (m, 2H), 4,06-4,00 (m, 1H), 3,99-3,89 (m, 3H), 3,68-3,59 (m, 1H), 3,53-3,42 (m, 2H), 3,06-2,92 (m, 3H), 2,88-2,74 (m, 2H), 2,46-2,36 (m, 1H), 2,19-2,02 (m, 3H), 1,79-1,49 (m, 8H).
Пример 3E. (S)-7-(4-(5-Фтор-2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан или (S)-7-(4-(5-фтор-2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан и пример 3F. (S)-7-(4-(5-Фтор-2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан или (S)-7-(4-(5-фтор-2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
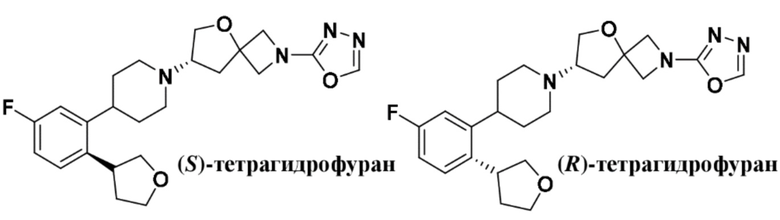
Стадия 1. трет-Бутил-(S)-7-(4-(2-(2,5-дигидрофуран-3-ил)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(S)-7-(4-(5-фтор-2-(((трифторметил)сульфонил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 9B, 250 мг, 0,464 ммоль), 2-(2,5-дигидрофуран-3-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (91 мг, 0,464 ммоль) и K3PO4 (296 мг, 1,393 ммоль) суспендировали в диоксане (1,0 мл) и воде (0,1 мл). Добавляли Pd(dppf)Cl2•CH2Cl2 (18,95 мг, 0,023 ммоль) и флакон вакуумировали и снова заполняли азотом. Это повторяли дважды. Содержимое пробирки затем перемешивали при 80°C в течение 5 ч. Затем реакционную смесь концентрировали и остаток растворяли в DCM и промывали водой и солевым раствором. Органический слой высушивали над сульфатом натрия и концентрировали и остаток очищали с помощью FCC (0-40% EtOAc/гептаны) с получением указанного в заголовке промежуточного соединения (207 мг, 0,451 ммоль).
LCMS: Rt: 1,16 мин. (способ 2 LCMS); MS масса/заряд 459,3 [M+H]+.
Стадия 2. трет-Бутил-(7S)-7-(4-(5-фтор-2-(тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(S)-7-(4-(2-(2,5-дигидрофуран-3-ил)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (207 мг, 0,451 ммоль) и 10% Pd-C (50 мг) растворяли в MeOH (4,5 мл) и перемешивали в атмосфере водорода из баллона в течение 16 часов. Раствор фильтровали и промывали с помощью MeOH и фильтрат концентрировали с получением указанного в заголовке промежуточного соединения (171 мг, 0,371 ммоль).
LCMS: Rt: 1,11 мин. (способ 2 LCMS); MS масса/заряд 461,6 [M+H]+.
Стадия 3. (7S)-7-(4-(5-Фтор-2-(тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
трет-Бутил-(7S)-7-(4-(5-фтор-2-(тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (171 мг, 0,371 ммоль) растворяли в DCM (3,7 мл) и охлаждали до 0°C. Реакционную смесь перемешивали в течение 10 минут и затем добавляли TFA (0,5 мл, 2,94 ммоль) и реакционную смесь перемешивали в течение 5 ч. при 0°C. Реакционную смесь затем концентрировали и растворяли в DCM и промывали 1 н. NaOH и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке промежуточного соединения (134 мг, 0,371 ммоль).
LCMS: Rt: 0,49 мин. (способ 1 LCMS); MS масса/заряд 361,3 [M+H]+.
Стадия 4. (S)-7-(4-(5-Фтор-2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан или (S)-7-(4-(5-фтор-2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
(7S)-7-(4-(5-Фтор-2-(тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (134 мг, 0,371 ммоль), этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (90 мг, 0,41 ммоль) и K3PO4 (260 мг, 1,22 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (0,73 мл) и THF (0,082 мл) и реакционную смесь обрабатывали аналогично примеру 1A. Неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением диастереомерной смеси. Два диастереомера затем разделяли с помощью SFC (ChiralPak IG, 21×250 мм, сорастворитель: 35% IPA с 10 мМ NH3, скорость потока: 80 г в минуту) с получением продукта, соответствующего исходному пику примера 3E (18 мг, 0,41 ммоль) и продукта, соответствующего следующему пику примера 3F (17 мг, 0,038 ммоль).
Пример 3E.
SFC: Rt: 3,63 мин. (Chiralpak IG, 4,6×100 мм, 5 мкм, 5→55% IPA с 10 мМ NH4OH/CO2, 5 мл/мин.). LCMS: Rt: 1,89 мин. (способ 4 LCMS); MS масса/заряд 429,5 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,65 (s, 1H), 7,34-7,28 (m, 1H), 7,06-6,94 (m, 2H), 4,27-4,20 (m, 1H), 4,17-4,10 (m, 2H), 4,06-4,00 (m, 1H), 4,00-3,90 (m, 3H), 3,84-3,75 (m, 1H), 3,68-3,56 (m, 2H), 3,56-3,50 (m, 1H), 3,06-2,91 (m, 2H), 2,90-2,74 (m, 2H), 2,45-2,35 (m, 1H), 2,32-2,23 (m, 1H), 2,20-2,02 (m, 3H), 1,92-1,79 (m, 1H), 1,71-1,57 (m, 4H).
Пример 3F.
SFC Rt: 3,85 мин. (Chiralpak IG, 4,6×100 мм, 5 мкм, 5→55% IPA с 10 мМ NH4OH/CO2, 5 мл/мин.). LCMS: Rt: 1,89 мин. (способ 4 LCMS); MS масса/заряд 429,3 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,62 (s, 1H), 7,35-7,27 (m, 1H), 7,07-6,94 (m, 2H), 4,27-4,20 (m, 1H), 4,17-4,10 (m, 2H), 4,06-4,00 (m, 1H), 4,00-3,90 (m, 3H), 3,85-3,75 (m, 1H), 3,69-3,56 (m, 2H), 3,56-3,50 (m, 1H), 3,07-2,90 (m, 2H), 2,90-2,74 (m, 2H), 2,46-2,36 (m, 1H), 2,31-2,23 (m, 1H), 2,20-2,01 (m, 3H), 1,91-1,79 (m, 1H), 1,71-1,59 (m, 4H).
Пример 3G. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
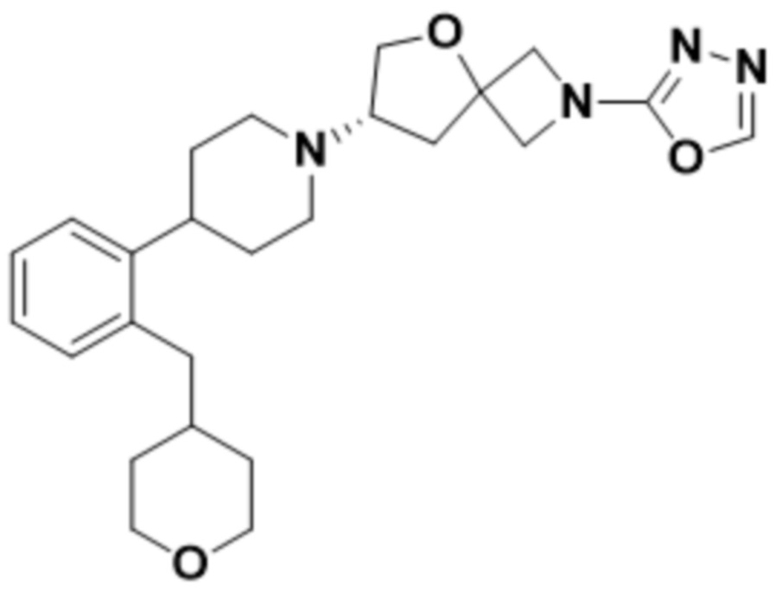
Стадия 1. трет-Бутил-(S)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(S)-7-(4-(2-((тетрагидро-4H-пиран-4-илиден)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 10D, 80 мг, 0,17 ммоль) и Pd(OH)2/C (24 мг, 0,034 ммоль) растворяли в EtOH (10 мл). Реакционный раствор продували водородом, перемешивали в атмосфере водорода из баллона в течение ночи, фильтровали через слой целита и выпаривали при пониженном давлении. Остаток очищали с помощью FCC (0-80% EtOAc/гептан) с получением указанного в заголовке соединения (45 мг, 0,083 ммоль).
LCMS: Rt: 1,20 мин. (способ 2 LCMS); MS масса/заряд 471,6 масса/заряд [M+H]+.
Стадия 2. (S)-7-(4-(2-((Тетрагидро-2H-пиран-4-ил)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
трет-Бутил-(S)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (45 мг, 0,096 ммоль) растворяли в DCM (1 мл) и добавляли TFA (0,5 мл, 2,94 ммоль). Реакционную смесь перемешивали в течение 2 часов и затем растворитель удаляли и остаток растворяли в DCM и промывали 1 M NaOH. Слой DCM концентрировали с получением указанного в заголовке промежуточного соединения (35 мг, 0,094 ммоль).
LCMS: Rt: 0,51 мин. (способ 1 LCMS); MS масса/заряд 371,4 масса/заряд [M+H]+.
Стадия 3. (S)-2-(1,3,4-Оксадиазол-2-ил)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
(S)-7-(4-(2-((Тетрагидро-2H-пиран-4-ил)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (27 мг, 0,12 ммоль) и трехосновный фосфат калия (26 мг, 0,12 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (0,6 мл) и THF (0,06 мл). Реакционную смесь обрабатывали аналогично примеру 1A, и неочищенное вещество очищали с помощью препаративной HPLC (XBridge Peptide BEH C18, 5 мкм, 19×150 мм, 40-55% MeCN/H2O (5 мМ NH4OH), 30 мл/мин.) и с помощью FCC (0-15% MeOH/DCM) с получением указанного в заголовке соединения (13 мг, 0,030 ммоль).
LCMS: Rt: 2,07 мин. (способ 4 LCMS); MS масса/заряд 439,6 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 7,30-7,22 (m, 1H), 7,19-7,13 (m, 1H), 7,11-7,05 (m, 2H), 4,37-4,26 (m, 2H), 4,18 (t, J=8,1 Гц, 2H), 4,07 (dd, J=8,8, 6,9 Гц, 1H), 3,91 (m, 2H), 3,78 (dd, J=8,8, 7,3 Гц, 1H), 3,35 (dd, J=11,8, 2,0 Гц, 2H), 3,19-3,07 (m, 2H), 3,00-2,77 (m, 2H), 2,58 (m, 3H), 2,38-2,07 (m, 3H), 1,91-1,63 (m, 5H), 1,56 (m, 2H), 1,46-1,09 (m, 2H).
Пример 3H. (1R,4s)-4-(2-(1-((S)-2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ол или (1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ол и пример 3I. (1R,4s)-4-(2-(1-((S)-2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ол или (1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ол
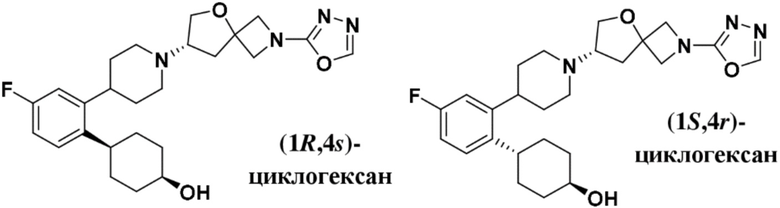
Стадия 1. трет-Бутил-(6R)-6-(4-(4'-((трет-бутилдиметилсилил)окси)-2',3',4',5'-тетрагидро-[1,1'-бифенил]-2-ил)пиперидин-1-ил)-2-азаспиро[3.4]октан-2-карбоксилат
В смесь трет-бутил-(R)-6-(4-(2-бромфенил)пиперидин-1-ил)-2-азаспиро[3.4]октан-2-карбоксилата (промежуточное соединение 3F, 219 мг, 0,487 ммоль), трет-бутилдиметил((4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклогекс-3-ен-1-ил)окси)силана (198 мг, 0,585 ммоль), аддукта дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) дихлорметана (17,83 мг, 0,024 ммоль) и фосфата калия (310 мг, 1,462 ммоль) добавляли диоксан (3 мл) и воду (0,3 мл). Реакционную смесь перемешивали при к. т. в течение 16 часов и ее затем концентрировали. Остаток добавляли в воду (50 мл) и экстрагировали с помощью EtOAc (x3). Органические экстракты высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток затем очищали с помощью FCC (0-20% EtOAc (5% 7 н. NH3 в аммиаке)/гептаны). Материал затем дополнительно очищали с помощью FCC (0-5% MeOH/DCM) с получением указанного в заголовке соединения (266 мг, 0,441 ммоль) в виде прозрачного твердого вещества.
LCMS: Rt: 1,78 мин. (способ 2 LCMS); MS масса/заряд 581,0 [M+H]+.
Стадия 2. трет-Бутил-(7S)-7-(4-(4-фтор-4'-гидрокси-2',3',4',5'-тетрагидро-[1,1'-бифенил]-2-ил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(7S)-7-(4-(4'-((трет-бутилдиметилсилил)окси)-4-фтор-2',3',4',5'-тетрагидро-[1,1'-бифенил]-2-ил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (254 мг, 0,423 ммоль) растворяли в THF (3 мл) и добавляли TBAF (1 M в THF, 2,114 мл, 2,114 ммоль) и реакционную смесь перемешивали при 40°C в течение 16 часов. Реакционную смесь концентрировали и остаток очищали с помощью FCC (0-30% EtOAc (8% 7 н. NH3 в аммиаке)/гептаны) с получением указанного в заголовке соединения в виде желтого масла (200 мг, 0,411 ммоль).
LCMS: Rt: 1,11 мин. (способ 2 LCMS); MS масса/заряд 487,6 [M+H]+.
Стадия 3. трет-Бутил-(S)-7-(4-(5-фтор-2-(4-гидроксициклогексил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(7S)-7-(4-(4-фтор-4'-гидрокси-2',3',4',5'-тетрагидро-[1,1'-бифенил]-2-ил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (200 мг, 0,411 ммоль) растворяли в MeOH (1 мл) и добавляли Pd-C (4 мг, 0,041 ммоль) и реакционную смесь перемешивали в атмосфере водорода в течение 72 часов. Реакционную смесь концентрировали и неочищенное вещество очищали с помощью FCC (0-32% EtOAc (8% 7 н. NH3 в MeOH)/гептаны) с получением указанного в заголовке соединения в виде желтого масла (107 мг, 0,197 ммоль).
LCMS: Rt: 1,11 мин. (способ 2 LCMS); MS масса/заряд 489,5 [M+H]+.
Стадия 4. (S)-4-(2-(1-(5-Окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ол
В раствор DCM (750 мкл) трет-бутил-(S)-7-(4-(5-фтор-2-(4-гидроксициклогексил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилата (107 мг, 0,219 ммоль) добавляли TFA (422 мкл, 5,47 ммоль). Обеспечивали перемешивание реакционной смеси при к. т. в течение двух часов. Реакционную смесь концентрировали, разбавляли с помощью DCM и промывали 1 н. NaOH с получением указанного в заголовке соединения, которое применяли без дополнительной очистки (91 мг, 0,181 ммоль).
LCMS: Rt: 0,78 мин. (способ 2 LCMS); MS масса/заряд 389,4 [M+H]+.
Стадия 5. (1R,4s)-4-(2-(1-((S)-2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ол или (1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ол и пример 3I. (1R,4s)-4-(2-(1-((S)-2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ол
В раствор THF (1 мл) (S)-4-(2-(1-(5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола (91 мг, 0,145 ммоль) при 0°C добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (48,0 мг, 0,174 ммоль) и DIEA (0,056 мл, 0,319 ммоль). Полученную суспензию перемешивали при к. т. в течение 2 ч., и ее затем концентрировали и разбавляли с помощью EtOAc. Неочищенное органическое вещество промывали водой и солевым раствором. Затем объединенные органические вещества высушивали над MgSO4, фильтровали и концентрировали. Концентрированную реакционную смесь разбавляли в THF (1 мл) и добавляли LiOH (36,5 мг, 0,869 ммоль) в воде (1 мл) и реакционную смесь перемешивали в течение 72 часов. Затем 6 н. HCl (0,241 мл, 1,449 ммоль) добавляли в реакционную смесь при -5°C и раствор становился прозрачным. Его перемешивали при к. т. в течение 2 ч. и затем добавляли твердый Na2CO3 до тех пор, пока раствор не становился основным и затем раствор концентрировали под вакуумом. Остаток разбавляли с помощью EtOAc и промывали с помощью солевого раствора, и органический слой высушивали над сульфатом магния и концентрировали. Неочищенное вещество очищали с помощью FCC (0-40% EtOAc (10% 7N NH3 в MeOH)/гептаны) с получением белого твердого вещества. Затем разделяли два диастереомера с помощью препаративной HPLC (XBridge C18, 30×50 мм, 10-30% MeCN/H2O (1% муравьиная кислота), 75 мл/мин.). Продукт, соответствующий исходному пику, выделяли в качестве примера 3H (27,9 мг, 0,055 ммоль) в виде формиатной соли и продукт, соответствующий следующему пику, выделяли в качестве примера 3I (1,7 мг, 0,003 ммоль) в виде формиатной соли.
Пример 3H.
LCMS: Rt: 0,97 мин. (способ 3 LCMS); MS масса/заряд 457,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,40 (s, 1H), 8,32 (d, J=3,6 Гц, 1H), 7,31 (dd, J=8,6, 6,1 Гц, 1H), 6,94 (dd, J=10,9, 2,7 Гц, 1H), 6,89 (td, J=8,5, 2,8 Гц, 1H), 4,41-4,27 (m, 2H), 4,19 (q, J=8,7 Гц, 2H), 4,13-4,03 (m, 2H), 3,94 (m, 1H), 3,45 (dt, J=13,6, 6,0 Гц, 1H), 3,28 (d, J=5,9 Гц, 1H), 3,18-3,09 (m, 1H), 3,03 (p, J=7,8 Гц, 1H), 2,82 (m, 1H), 2,62 (m, 3H), 2,29 (m, 1H), 2,00-1,79 (m, 8H), 1,77-1,62 (m, 2H), 1,53-1,42 (m, 2H).
Пример 3I.
LCMS: Rt: 1,10 мин. (способ 3 LCMS); MS масса/заряд 457,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,40 (s, 1H), 8,31 (s, 1H), 7,26 (dd, J=8,6, 6,0 Гц, 1H), 7,00-6,81 (m, 2H), 4,46-4,25 (m, 2H), 4,19 (q, J=8,7 Гц, 2H), 4,15-4,02 (m, 2H), 3,92 (dd, J=9,3, 6,8 Гц, 1H), 3,64 (m, 1H), 3,12 (m, 1H), 3,07-2,94 (m, 1H), 2,91-2,73 (m, 1H), 2,63 (m, 3H), 2,34-2,18 (m, 1H), 2,13-1,98 (m, 2H), 1,97-1,37 (m, 12H).
Пример 4A. (S)-7-(4-(5-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
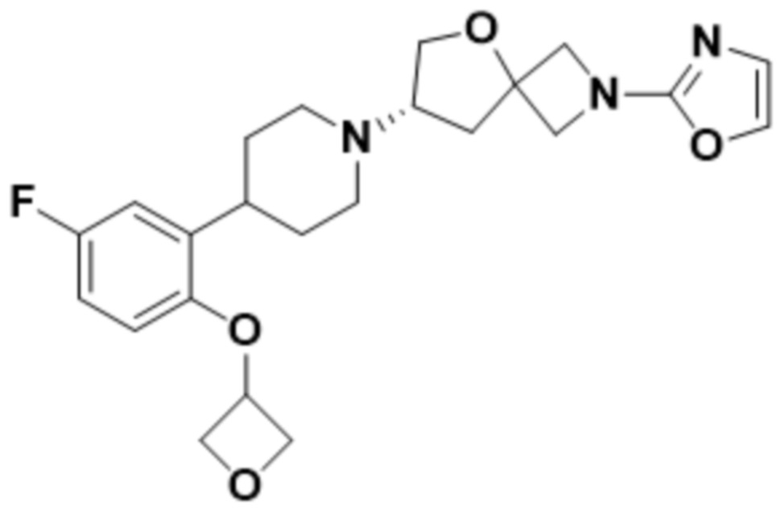
(S)-7-(4-(5-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7A, 200 мг, 0,552 ммоль) и 2-бромоксазол (98 мг, 0,66 ммоль) растворяли в диоксане (5,5 мл) и смесь продували азотом. Добавляли Pd2(dba)3 (31,7 мг, 0,055 ммоль), XantPhos (38 мг, 0,066 ммоль) и трет-бутоксид натрия (159 мг, 1,66 ммоль). Реакционную смесь перемешивали при 75°C в течение ночи, фильтровали колонкой с целитом, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью FCC (0-10% MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (63 мг, 0,14 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 1,99 мин. (способ 4 LCMS); MS масса/заряд 430,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=1,4 Гц, 1H), 6,96 (dd, J=9,8, 3,2 Гц, 1H), 6,88-6,78 (m, 2H), 6,49 (dd, J=8,8, 4,4 Гц, 1H), 5,25 (m, 1H), 5,05-4,95 (m, 2H), 4,68 (dd, J=7,4, 4,8 Гц, 2H), 4,25-4,16 (m, 2H), 4,13-4,02 (m, 3H), 3,80-3,73 (m, 1H), 3,16-3,03 (m, 3H), 2,91 (d, J=11,5 Гц, 1H), 2,53 (dd, J=13,0, 7,4 Гц, 1H), 2,32-2,19 (m, 2H), 2,13 (dd, J=12,9, 8,4 Гц, 1H), 1,86 (t, J=10,2 Гц, 2H), 1,81-1,64 (m, 2H).
Пример 4B. (S)-7-(4-(2-(((R)-1,4-Диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
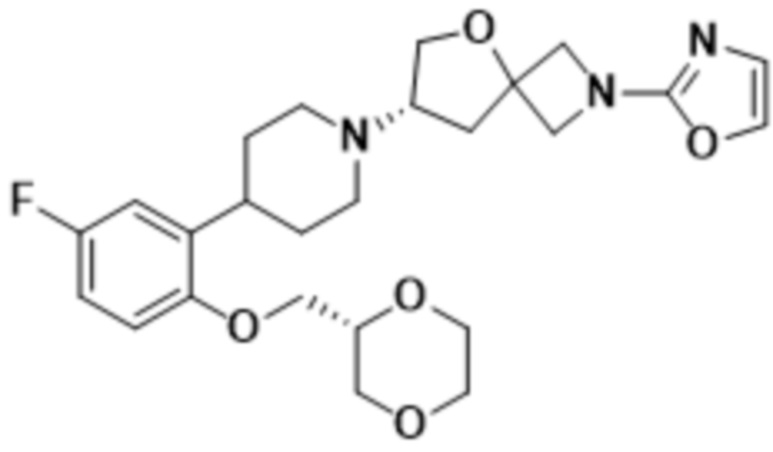
(S)-7-(4-(2-(((R)-1,4-Диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7C, 90 мг, 0,22 ммоль) и 2-бромоксазол (39 мг, 0,27 ммоль) растворяли в диоксане (2,2 мл) и смесь продували азотом. Добавляли Pd2(dba)3 (12,7 мг, 0,022 ммоль), XantPhos (15 мг, 0,027 ммоль) и трет-бутоксид натрия (64 мг, 0,66 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (32 мг, 0,064 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 2,12 мин. (способ 4 LCMS); MS масса/заряд 474,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=1,2 Гц, 1H), 6,94-6,83 (m, 3H), 6,81 (d, J=1,0 Гц, 1H), 4,26-4,15 (m, 2H), 4,14-4,03 (m, 3H), 4,02-3,87 (m, 4H), 3,87-3,68 (m, 4H), 3,68-3,50 (m, 2H), 3,16-3,06 (m, 2H), 3,06-2,95 (m, 1H), 2,90 (d, J=11,4 Гц, 1H), 2,53 (dd, J=13,0, 7,4 Гц, 1H), 2,23 (m, 2H), 2,12 (dd, J=13,0, 8,5 Гц, 1H), 1,92-1,80 (m, 2H), 1,78-1,57 (m, 2H).
Пример 4C. (S)-2-(Оксазол-2-ил)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
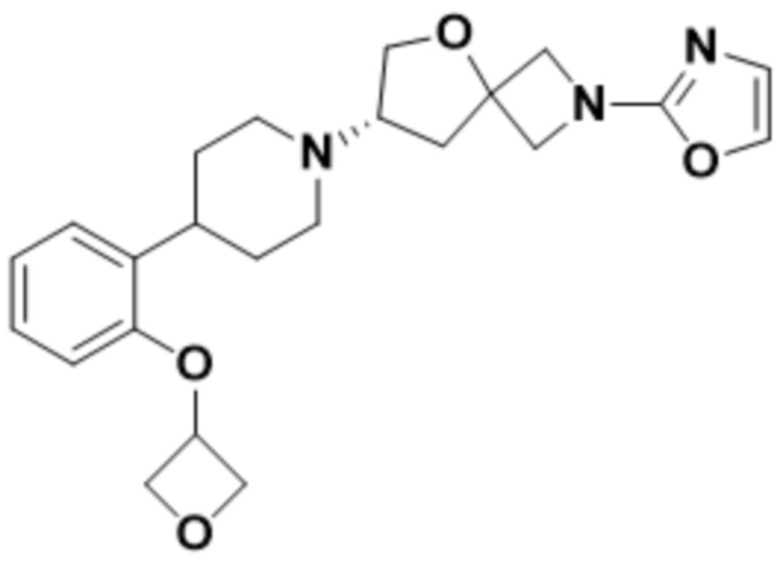
(S)-7-(4-(2-(Оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7Q, 130 мг, 0,38 ммоль) и 2-бромоксазол (67 мг, 0,45 ммоль) растворяли в диоксане (3,8 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (22 мг, 0,038 ммоль), XantPhos (26 мг, 0,045 ммоль) и трет-бутоксид натрия (109 мг, 1,13 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через слой целита и промывали с помощью EtOAc и затем концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (73 мг, 0,17 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 1,96 мин. (способ 4 LCMS); MS масса/заряд 412,7 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=1,0 Гц, 1H), 7,22 (dd, J=7,4, 1,8 Гц, 1H), 7,11 (m, 1H), 6,93 (m, 1H), 6,84-6,79 (m, 1H), 6,48 (dd, J=8,3, 1,0 Гц, 1H), 5,27 (m, 1H), 5,06-4,98 (m, 2H), 4,69 (dd, J=7,3, 4,8 Гц, 2H), 4,26-4,16 (m, 2H), 4,14-4,02 (m, 3H), 3,76 (dd, J=8,6, 7,5 Гц, 1H), 3,16-3,00 (m, 3H), 2,90 (m, 1H), 2,53 (dd, J=12,9, 7,4 Гц, 1H), 2,25 (m, 2H), 2,13 (dd, J=12,9, 8,5 Гц, 1H), 1,91-1,71 (m, 4H).
Пример 4D. (S)-7-(4-(5-Фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
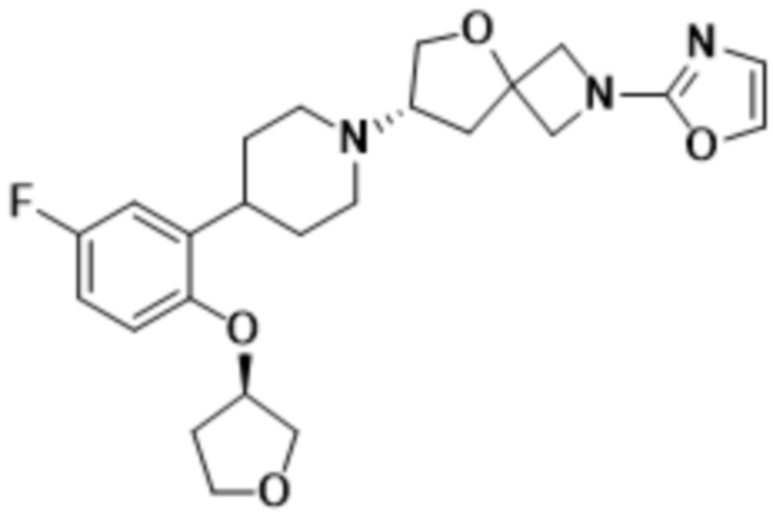
(S)-7-(4-(5-Фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7D, 90 мг, 0,24 ммоль) и 2-бромоксазол (42 мг, 0,29 ммоль) растворяли в диоксане (2,4 мл) и смесь продували азотом. Добавляли Pd2(dba)3 (14 мг, 0,024 ммоль), XantPhos (17 мг, 0,029 ммоль) и трет-бутоксид натрия (69 мг, 0,72 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (13 мг, 0,029 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 2,14 мин. (способ 4 LCMS); MS масса/заряд 444,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=0,9 Гц, 1H), 6,93 (dd, J=9,8, 2,6 Гц, 1H), 6,90-6,84 (m, 2H), 6,81 (d, J=1,2 Гц, 1H), 5,01 (m, 1H), 4,20 (q, J=8,7 Гц, 2H), 4,13-4,01 (m, 3H), 4,01-3,84 (m, 4H), 3,74 (dd, J=8,7, 7,4 Гц, 1H), 3,08 (m, 2H), 3,03-2,92 (m, 1H), 2,89 (d, J=11,5 Гц, 1H), 2,52 (dd, J=12,9, 7,4 Гц, 1H), 2,30-2,16 (m, 3H), 2,11 (dd, J=13,1, 8,3 Гц, 2H), 1,87-1,74 (m, 2H), 1,67 (m, 2H).
Пример 4E. (S)-7-(4-(5-Фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
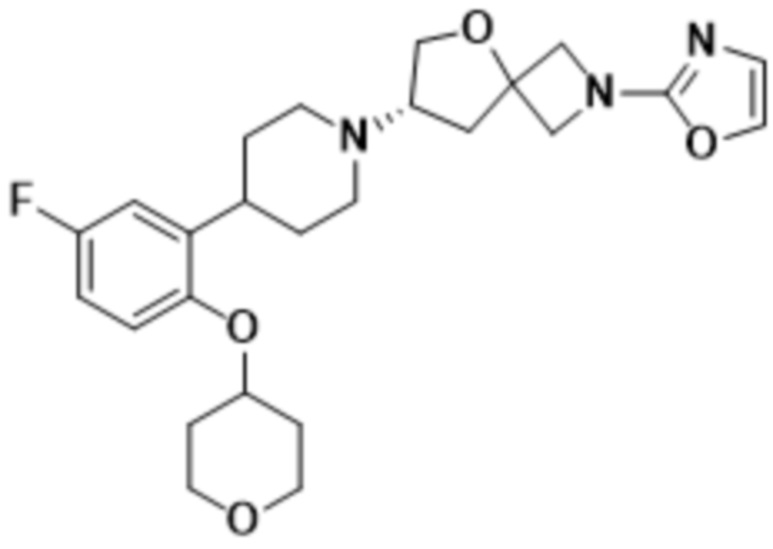
(S)-7-(4-(5-Фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7G, 90 мг, 0,23 ммоль) и 2-бромоксазол (41 мг, 0,28 ммоль) растворяли в диоксане (2,3 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (13 мг, 0,023 ммоль), XantPhos (16 мг, 0,028 ммоль) и трет-бутоксид натрия (66 мг, 0,69 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) и с помощью препаративной HPLC (X-Bridge Peptide BEH C18, 5 мкм, 19×150 мм, 40-55% MeCN/H2O (10 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (12 мг, 0,026 ммоль) в виде белого порошка.
LCMS: Rt: 2,22 мин. (способ 4 LCMS); MS масса/заряд 458,7 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (s, 1H), 6,94 (m, 2H), 6,89-6,80 (m, 2H), 4,52 (m, 1H), 4,20 (q, J=8,7 Гц, 2H), 4,14-4,01 (m, 3H), 3,93 (ddd, J=11,6, 6,1, 3,9 Гц, 2H), 3,79-3,71 (m, 1H), 3,60 (ddd, J=11,7, 8,3, 3,3 Гц, 2H), 3,16-2,98 (m, 3H), 2,95-2,85 (m, 1H), 2,53 (dd, J=12,9, 7,4 Гц, 1H), 2,22 (m, 2H), 2,12 (dd, J=12,9, 8,4 Гц, 1H), 2,07-1,96 (m, 2H), 1,83 (m, 2H), 1,71 (m, 4H).
Пример 4F. (S)-2-(Оксазол-2-ил)-7-(4-(2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
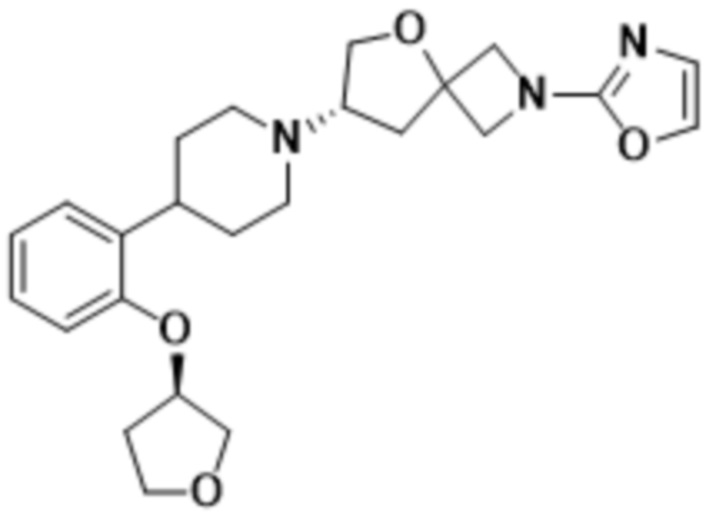
(S)-7-(4-(2-(((R)-Тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7P, 78 мг, 0,22 ммоль) и 2-бромоксазол (39 мг, 0,26 ммоль) растворяли в диоксане (2,2 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (13 мг, 0,022 ммоль), XantPhos (15 мг, 0,026 ммоль) и трет-бутоксид натрия (63 мг, 0,65 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (37 мг, 0,083 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 2,10 мин. (способ 4 LCMS); MS масса/заряд 426,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=1,0 Гц, 1H), 7,21-7,11 (m, 2H), 6,94-6,86 (m, 2H), 6,81 (d, J=1,2 Гц, 1H), 5,05 (m, 1H), 4,25-4,16 (m, 2H), 4,12-4,02 (m, 3H), 4,00-3,86 (m, 4H), 3,78-3,71 (m, 1H), 3,15-3,04 (m, 2H), 2,98 (m,1H), 2,92-2,85 (m, 1H), 2,53 (dd, J=12,9, 7,4 Гц, 1H), 2,30-2,18 (m, 3H), 2,12 (ddd, J=13,0, 7,6, 4,8 Гц, 2H), 1,87-1,66 (m, 4H).
Пример 4G. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
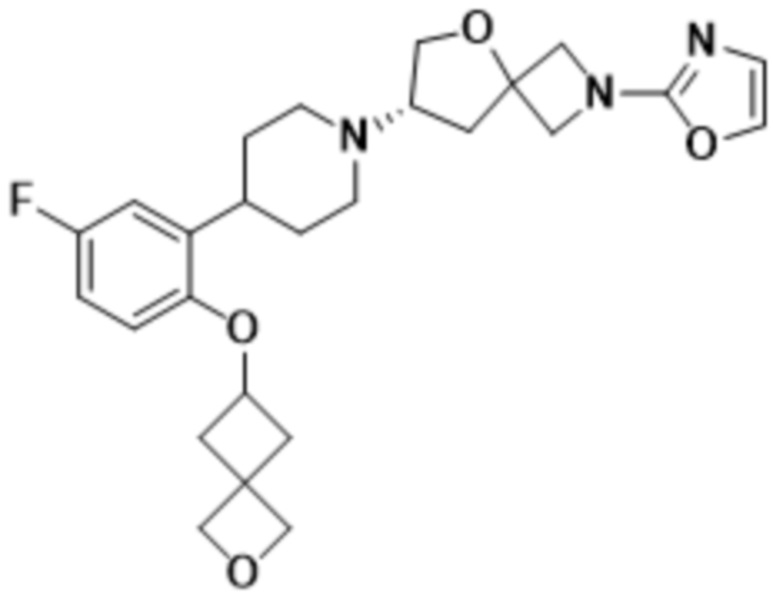
(S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7NN, 90 мг, 0,22 ммоль) и 2-бромоксазол (40 мг, 0,27 ммоль) растворяли в диоксане (2,2 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (13 мг, 0,022 ммоль), XantPhos (16 мг, 0,028 ммоль) и трет-бутоксид натрия (65 мг, 0,67 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (10 мг, 0,021 ммоль) в виде белого порошка.
LCMS: Rt: 2,24 мин. (способ 4 LCMS); MS масса/заряд 470,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (s, 1H), 6,90 (dd, J=9,8, 3,0 Гц, 1H), 6,87-6,77 (m, 2H), 6,70 (dd, J=9,0, 4,6 Гц, 1H), 4,72 (d, J=30,8 Гц, 4H), 4,53 (p, J=6,7 Гц, 1H), 4,20 (q, J=8,7 Гц, 2H), 4,13-4,01 (m, 3H), 3,75 (dd, J=8,7, 7,4 Гц, 1H), 3,13-3,04 (m, 2H), 2,99-2,85 (m, 2H), 2,85-2,76 (m, 2H), 2,52 (dd, J=13,0, 7,4 Гц, 1H), 2,34-2,26 (m, 2H), 2,21 (m, 2H), 2,11 (dd, J=12,9, 8,5 Гц, 1H), 1,85-1,75 (m, 2H), 1,75-1,61 (m, 2H).
Пример 4H. (S)-2-(Оксазол-2-ил)-7-(4-(2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
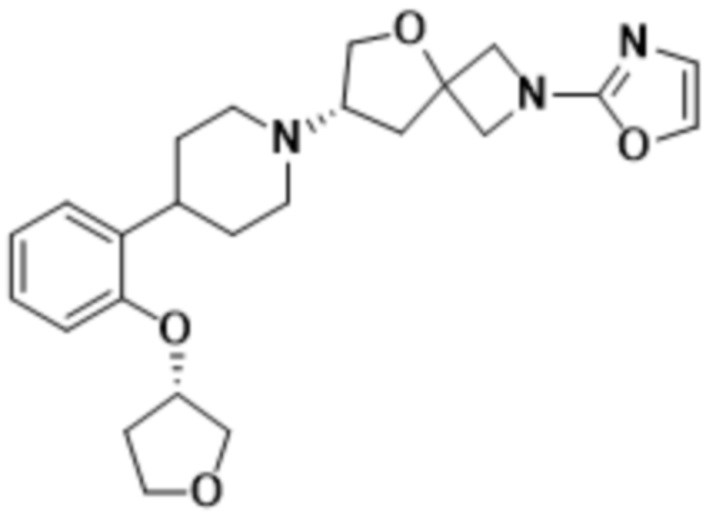
(S)-7-(4-(2-(((S)-Тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7H, 78 мг, 0,22 ммоль) и 2-бромоксазол (39 мг, 0,26 ммоль) растворяли в диоксане (2,2 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (12 мг, 0,022 ммоль), XantPhos (15 мг, 0,026 ммоль) и трет-бутоксид натрия (63 мг, 0,65 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (18 мг, 0,041 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 2,08 мин. (способ 4 LCMS); MS масса/заряд 426,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (s, 1H), 7,21-7,12 (m, 2H), 6,94-6,86 (m, 2H), 6,81 (s, 1H), 5,05 (m, 1H), 4,25-4,16 (m, 2H), 4,13-4,03 (m, 3H), 4,00-3,87 (m, 4H), 3,78-3,72 (m, 1H), 3,14-3,06 (m, 2H), 2,98 (m, 1H), 2,89 (d, J=11,4 Гц, 1H), 2,53 (dd, J=13,0, 7,4 Гц, 1H), 2,30-2,17 (m, 3H), 2,12 (ddd, J=13,0, 7,4, 3,8 Гц, 2H), 1,74 (m, 4H).
Пример 4I. (S)-7-(4-(5-Фтор-2-метоксифенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
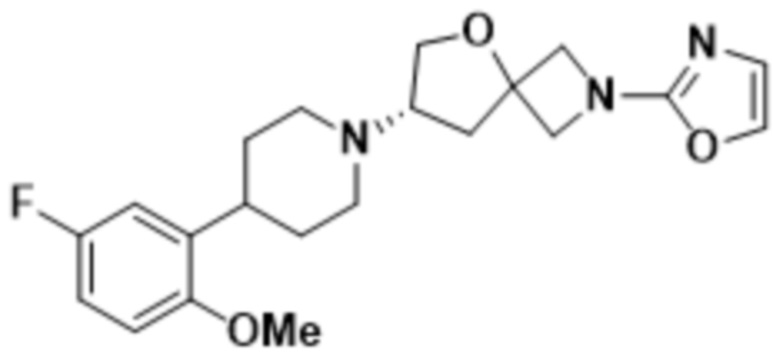
(S)-7-(4-(5-Фтор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7DD, 70 мг, 0,22 ммоль) и 2-бромоксазол (39 мг, 0,26 ммоль) растворяли в диоксане (2,2 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (12 мг, 0,022 ммоль), XantPhos (15 мг, 0,026 ммоль) и трет-бутоксид натрия (42 мг, 0,44 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и ацетонитрила и затем концентрировали. Остаток очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (45 мг, 0,11 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 2,27 мин. (способ 4 LCMS); MS масса/заряд 388,8 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (s, 1H), 6,93-6,85 (m, 3H), 6,81 (d, J=1,0 Гц, 1H), 4,20 (q, J=8,7 Гц, 2H), 4,12-4,02 (m, 3H), 3,80 (s, 3H), 3,74 (dd, J=8,7, 7,4 Гц, 1H), 3,14-3,04 (m, 2H), 2,98 (tt, J=12,2, 3,7 Гц, 1H), 2,92-2,84 (m, 1H), 2,52 (dd, J=13,0, 7,4 Гц, 1H), 2,21 (m, 2H), 2,11 (dd, J=13,0, 8,5 Гц, 1H), 1,80 (m, 2H), 1,69 (m, 2H).
Пример 4J. (S)-2-(Оксазол-2-ил)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
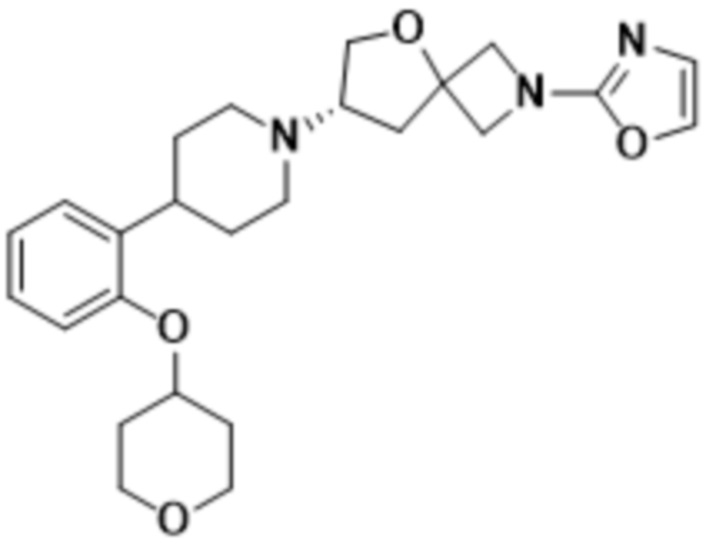
(S)-7-(4-(2-((Тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7OO, 148 мг, 0,40 ммоль) и 2-бромоксазол (71 мг, 0,48 ммоль) растворяли в диоксане (5,0 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (23 мг, 0,040 ммоль), XantPhos (28 мг, 0,048 ммоль) и трет-бутоксид натрия (115 мг, 1,19 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc, концентрировали. Остаток очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (68 мг, 0,15 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 1,04 мин. (способ 3 LCMS); MS масса/заряд 440,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,30 (s, 1H), 7,12-6,99 (m, 2H), 6,90-6,76 (m, 2H), 6,72 (d, J=1,0 Гц, 1H), 4,50 (tt, J=7,6, 3,8 Гц, 1H), 4,11 (q, J=8,7 Гц, 2H), 4,05-3,92 (m, 3H), 3,84 (ddd, J=11,5, 6,2, 3,7 Гц, 2H), 3,70-3,60 (m, 1H), 3,52 (ddd, J=11,4, 8,1, 3,3 Гц, 2H), 3,09-2,87 (m, 3H), 2,80 (m, 1H), 2,44 (dd, J=12,8, 7,4 Гц, 1H), 2,24-1,86 (m, 5H), 1,83-1,55 (m, 6H).
Пример 4K. (S)-1-(4-Фтор-2-(1-(2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)-2-метилпропан-2-ол
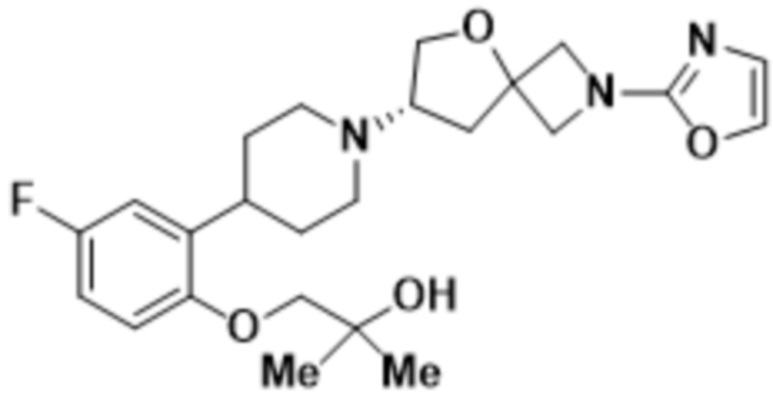
(S)-1-(2-(1-(5-Окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ол (промежуточное соединение 7U, 45 мг, 0,12 ммоль) и 2-бромоксазол (21 мг, 0,14 ммоль) растворяли в диоксане (1,2 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (6,8 мг, 0,012 ммоль), XantPhos (8,3 мг, 0,014 ммоль) и трет-бутоксид натрия (23 мг, 0,24 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и ацетонитрила и фильтрат концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (25 мг, 0,053 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 2,09 мин. (способ 4 LCMS); MS масса/заряд 446,6 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (s, 1H), 6,95-6,83 (m, 3H), 6,81 (s, 1H), 4,20 (q, J=8,7 Гц, 2H), 4,12-4,03 (m, 3H), 3,75 (s, 3H), 3,14-3,04 (m, 3H), 2,90 (dd, J=11,4, 4,4 Гц, 1H), 2,53 (dd, J=13,0, 7,4 Гц, 1H), 2,24 (m, 2H), 2,11 (dd, J=13,0, 8,5 Гц, 1H), 1,86 (m, 2H), 1,69 (m, 3H), 1,34 (s, 6H).
Пример 4L. (S)-7-(4-(5-Фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
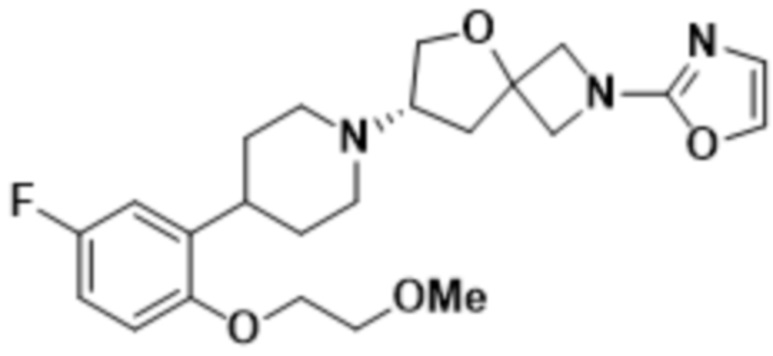
(S)-7-(4-(5-Фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7N, 65 мг, 0,18 ммоль) и 2-бромоксазол (32 мг, 0,21 ммоль) растворяли в диоксане (1,8 мл) и смесь продували азотом. Добавляли Pd2(dba)3 (10 мг, 0,018 ммоль), XantPhos (12 мг, 0,021 ммоль) и трет-бутоксид натрия (34 мг, 0,36 ммоль) и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и ацетонитрила и фильтрат концентрировали. Остаток очищали с помощью FCC (0-7% MeOH/DCM) и с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 35-60% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (25 мг, 0,057 ммоль).
LCMS: Rt: 2,20 мин. (способ 4 LCMS); MS масса/заряд 432,3 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 7,57 (s, 1H), 7,03-6,92 (m, 3H), 6,83 (d, J=0,6 Гц, 1H), 4,13 (d, J=8,5 Гц, 1H), 4,09-4,01 (m, 5H), 3,96-3,89 (m, 2H), 3,68-3,63 (m, 2H), 3,62-3,56 (m, 1H), 3,03-2,73 (m, 5H), 2,42-2,34 (m, 1H), 2,11-1,96 (m, 4H), 1,80-1,64 (m, 2H), 1,57 (m, 2H).
Пример 4M. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
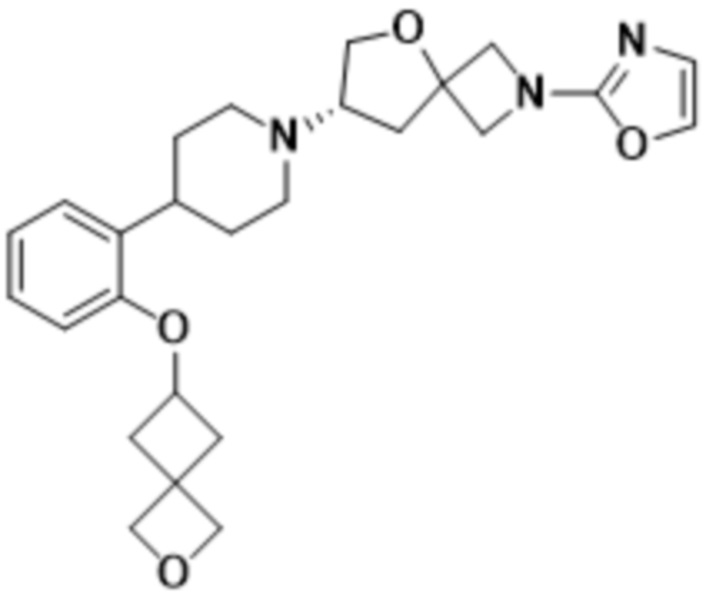
(S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7II, 110 мг, 0,29 ммоль) и 2-бромоксазол (51 мг, 0,34 ммоль) растворяли в диоксане (2,9 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (16 мг, 0,029 ммоль), XantPhos (20 мг, 0,034 ммоль) и трет-бутоксид натрия (82 мг, 0,86 ммоль), и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) и с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (9,5 мг, 0,021 ммоль).
LCMS: Rt: 2,18 мин. (способ 4 LCMS); MS масса/заряд 452,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=1,0 Гц, 1H), 7,19-7,06 (m, 2H), 6,88 (dd, J=8,1, 6,9 Гц, 1H), 6,81 (d, J=1,0 Гц, 1H), 6,72 (d, J=8,2 Гц, 1H), 4,72 (d, J=31,9 Гц, 4H), 4,62-4,52 (m, 1H), 4,21 (q, J=8,8 Гц, 2H), 4,11 (s, 3H), 3,75 (t, J=8,1 Гц, 1H), 3,15-3,04 (m, 2H), 3,02-2,85 (m, 2H), 2,85-2,77 (m, 2H), 2,53 (dd, J=12,9, 7,4 Гц, 1H), 2,37-2,26 (m, 2H), 2,26-2,16 (m, 2H), 2,12 (dd, J=12,9, 8,5 Гц, 1H), 1,76 (m, 4H).
Пример 4N. (S)-7-(4-(2-Метоксифенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
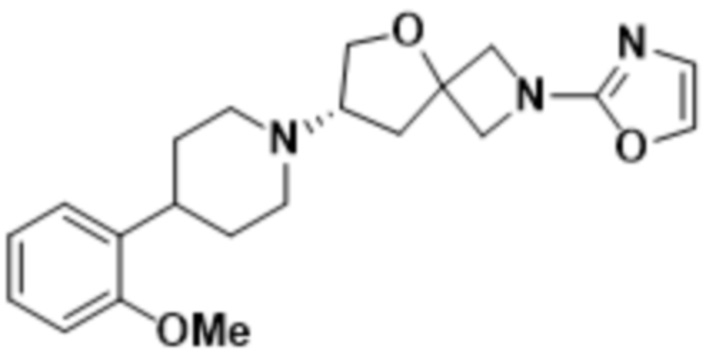
(S)-7-(4-(2-Метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7X, 52 мг, 0,17 ммоль) и 2-бромоксазол (31 мг, 0,21 ммоль) растворяли в диоксане (1,7 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (9,9 мг, 0,017 ммоль), XantPhos (12 мг, 0,021 ммоль) и натрия трет-бутоксид натрия (31 мг, 0,34 ммоль), и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и ацетонитрила и концентрировали. Остаток очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 35-60% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (9,4 мг, 0,024 ммоль).
LCMS: Rt: 2,19 мин. (способ 4 LCMS); MS масса/заряд 370,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=1,3 Гц, 1H), 7,21-7,10 (m, 2H), 6,89 (dd, J=14,1, 7,7 Гц, 2H), 6,81 (d, J=1,0 Гц, 1H), 4,32-4,13 (m, 2H), 4,14-4,01 (m, 3H), 3,81 (s, 3H), 3,80-3,70 (m, 1H), 3,08 (t, J=7,7 Гц, 3H), 2,88 (d, J=11,9 Гц, 1H), 2,52 (dd, J=13,0, 7,4 Гц, 1H), 2,27-2,17 (m, 2H), 2,12 (dd, J=13,1, 8,4 Гц, 1H), 1,90-1,66 (m, 4H).
Пример 4O. (S)-7-(4-(4,5-Дифтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
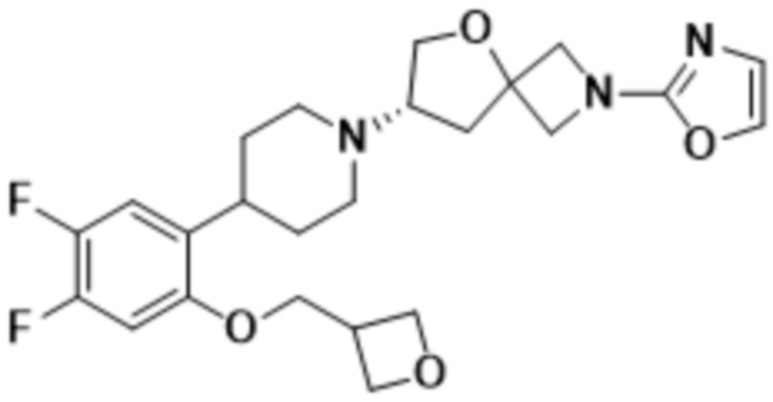
(S)-7-(4-(4,5-Дифтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7JJ, 100 мг, 0,254 ммоль) и 2-бромоксазол (45 мг, 0,30 ммоль) растворяли в диоксане (2,5 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (15 мг, 0,025 ммоль), XantPhos (18 мг, 0,030 ммоль) и трет-бутоксид натрия (73 мг, 0,76 ммоль), и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) и с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (20 мг, 0,041 ммоль).
LCMS: Rt: 2,15 мин. (способ 4 LCMS); MS масса/заряд 462,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=1,3 Гц, 1H), 7,08 (dd, J=11,9, 9,1 Гц, 1H), 6,94 (dd, J=12,6, 6,9 Гц, 1H), 6,81 (s, 1H), 4,93-4,87 (m, 2H), 4,63 (t, J=6,1 Гц, 2H), 4,26-4,11 (m, 4H), 4,11-3,99 (m, 3H), 3,74 (dd, J=8,7, 7,4 Гц, 1H), 3,47 (m, 1H), 3,15-3,04 (m, 2H), 3,04-2,91 (m, 1H), 2,88 (m, 1H), 2,51 (dd, J=12,9, 7,4 Гц, 1H), 2,21 (m, 2H), 2,11 (dd, J=13,0, 8,5 Гц, 1H), 1,82 (m, 2H), 1,66 (m, 2H).
Пример 4P. (S)-7-(4-(4,5-Дифтор-2-((3-фтороксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
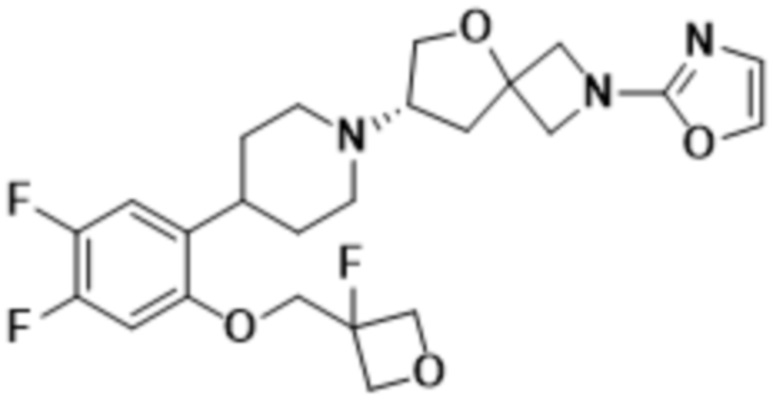
(S)-7-(4-(4,5-Дифтор-2-((3-фтороксетан-3-ил)метокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7KK, 100 мг, 0,242 ммоль) и 2-бромоксазол (43 мг, 0,29 ммоль) растворяли в диоксане (2,5 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (14 мг, 0,024 ммоль), XantPhos (17 мг, 0,029 ммоль) и трет-бутоксид натрия (70 мг, 0,73 ммоль), и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и фильтрат концентрировали. Остаток очищали с помощью FCC (0-10% MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (33 мг, 0,069 ммоль).
LCMS: Rt: 2,22 мин. (способ 4 LCMS); MS масса/заряд 480,1 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=0,9 Гц, 1H), 7,10 (dd, J=11,8, 9,1 Гц, 1H), 7,00 (dd, J=12,3, 6,8 Гц, 1H), 6,83-6,80 (m, 1H), 4,84-4,71 (m, 4H), 4,38 (s, 1H), 4,33 (s, 1H), 4,20 (q, J=8,7 Гц, 2H), 4,14-4,00 (m, 3H), 3,74 (dd, J=8,7, 7,4 Гц, 1H), 3,07 (p, J=7,0 Гц, 2H), 2,99-2,83 (m, 2H), 2,52 (dd, J=12,8, 7,4 Гц, 1H), 2,19 (m, 2H), 2,10 (dd, J=12,9, 8,5 Гц, 1H), 1,82 (m, 2H), 1,65 (m, 2H).
Пример 4Q. (S)-7-(4-(4,5-Дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
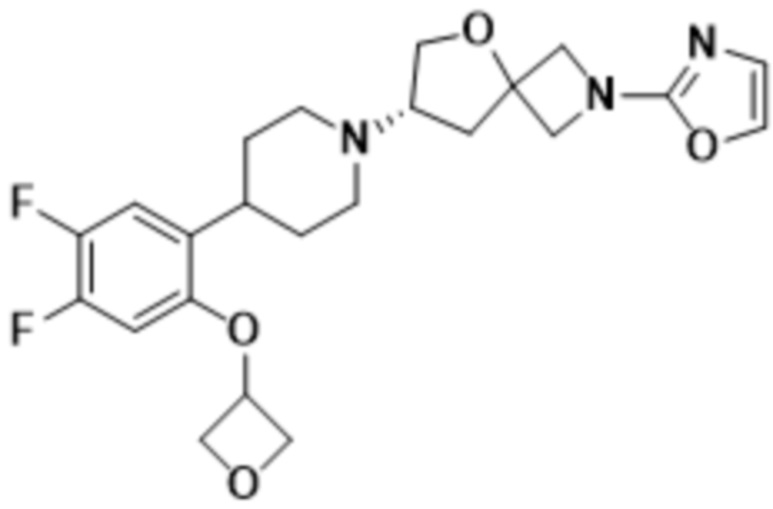
(S)-7-(4-(4,5-Дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7LL, 140 мг, 0,368 ммоль) и 2-бромоксазол (65 мг, 0,44 ммоль) растворяли в диоксане (3,7 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (21 мг, 0,037 ммоль), XantPhos (26 мг, 0,044 ммоль) и трет-бутоксид натрия (106 мг, 1,10 ммоль), и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через колонку с целитом, промывали с помощью EtOAc и фильтрат концентрировали. Остаток очищали с помощью FCC (0-10% MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (36 мг, 0,076 ммоль).
LCMS: Rt: 2,10 мин. (способ 4 LCMS); MS масса/заряд 448,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (s, 1H), 7,12 (dd, J=11,8, 9,1 Гц, 1H), 6,81 (d, J=0,9 Гц, 1H), 6,52 (dd, J=12,2, 6,8 Гц, 1H), 5,29-5,21 (m, 1H), 5,01 (dd, J=7,4, 5,7 Гц, 2H), 4,67 (dd, J=7,6, 4,9 Гц, 2H), 4,26-4,14 (m, 2H), 4,14-3,99 (m, 3H), 3,75 (dd, J=8,7, 7,4 Гц, 1H), 3,16-3,07 (m, 2H), 3,07-2,94 (m, 1H), 2,90 (dd, J=11,6, 2,6 Гц, 1H), 2,53 (dd, J=13,0, 7,4 Гц, 1H), 2,24 (m, 2H), 2,12 (dd, J=13,0, 8,4 Гц, 1H), 1,91-1,80 (m, 2H), 1,71 (m, 2H).
Пример 4R. (S)-2-(Оксазол-2-ил)-7-(4-(2-(пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
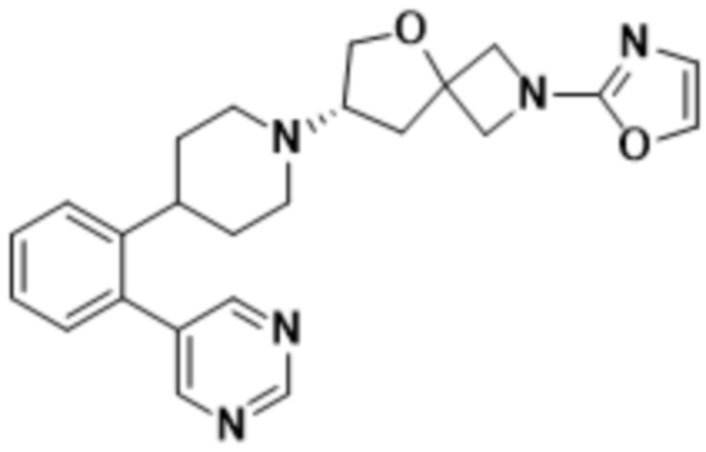
(S)-7-(4-(2-(Пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7FF, 12 мг, 0,034 ммоль) и 2-бромоксазол (15 мг, 0,10 ммоль) растворяли в диоксане (3 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (3,1 мг, 0,0031 ммоль), XantPhos (2,4 мг, 0,0041 ммоль) и трет-бутоксид натрия (19 мг, 0,17 ммоль). Реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через слой силикагеля, промывали с помощью EtOAc и фильтрат концентрировали. Остаток очищали с помощью препаративной HPLC (X-Bridge Peptide BEH C18, 5 мкм, 19×150 мм, 30-45% MeCN/H2O (10 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (4,0 мг, 0,0094 ммоль).
LCMS: Rt: 1,15 мин. (способ 4 LCMS); MS масса/заряд 418,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 9,18 (s, 1H), 8,76 (s, 2H), 7,54-7,43 (m, 2H), 7,38 (d, J=1,0 Гц, 1H), 7,36-7,30 (m, 1H), 7,23 (dd, J=7,6, 1,2 Гц, 1H), 6,80 (s, 1H), 4,18 (q, J=8,8 Гц, 2H), 4,11-3,96 (m, 3H), 3,70 (dd, J=8,9, 7,2 Гц, 1H), 3,07-2,91 (m, 2H), 2,87-2,74 (m, 1H), 2,57-2,40 (m, 2H), 2,13-1,65 (m, 7H).
Пример 4S. (S)-7-(4-(4-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
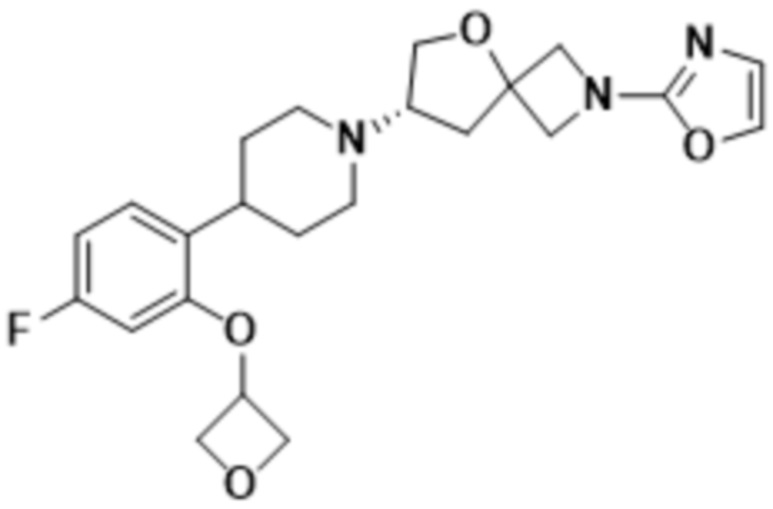
(S)-7-(4-(4-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7MM, 100 мг, 0,276 ммоль) и 2-бромоксазол (49 мг, 0,33 ммоль) растворяли в диоксане (2,8 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (16 мг, 0,028 ммоль), XantPhos (19 мг, 0,033 ммоль) и трет-бутоксид натрия (80 мг, 0,83 ммоль), и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через слой целита, промывали с помощью EtOAc и фильтрат концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (65 мг, 0,14 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 2,02 мин. (способ 4 LCMS); MS масса/заряд 430,6 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (s, 1H), 7,20 (dd, J=8,5, 6,6 Гц, 1H), 6,82 (d, J=1,0 Гц, 1H), 6,67 (m, 1H), 6,32 (dd, J=10,6, 2,6 Гц, 1H), 5,28 (ddd, J=10,8, 5,9, 4,9 Гц, 1H), 5,12-4,98 (m, 2H), 4,68 (dd, J=7,5, 4,7 Гц, 2H), 4,31-4,13 (m, 2H), 4,13-4,00 (m, 3H), 3,76 (dd, J=8,7, 7,4 Гц, 1H), 3,21-3,07 (m, 2H), 3,07-2,96 (m, 1H), 2,96-2,85 (m, 1H), 2,53 (dd, J=12,9, 7,4 Гц, 1H), 2,25 (m, 2H), 2,13 (dd, J=13,0, 8,4 Гц, 1H), 1,92-1,66 (m, 4H).
Пример 4T. 2-((1R,3s)-3-(4-Фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ол или 2-((1S,3r)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ол и пример 4U. 2-((1R,3s)-3-(4-Фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ол или 2-((1S,3r)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ол
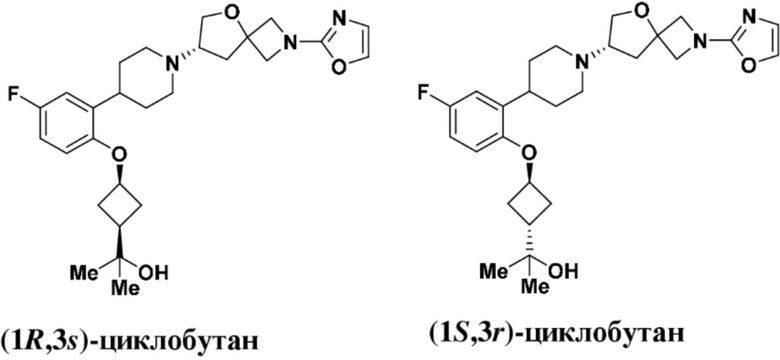
Стадия 1. трет-Бутил-(S)-7-(4-(5-фтор-2-(3-(2-гидроксипропан-2-ил)циклобутокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-(S)-7-(4-(5-фтор-2-(3-(метоксикарбонил)циклобутокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 6X, 130 мг, 0,251 ммоль) растворяли в THF (2,5 мл), и раствор охлаждали до 0°C. Метилмагния бромид (0,33 мл, 1,0 ммоль, 3 M в THF) добавляли медленно в течение 5 минут. Реакционную смесь постепенно нагревали до комнатной температуры, перемешивали при комнатной температуре в течение 6 часов, затем охлаждали до 0°С и нейтрализовали добавлением насыщенного раствора хлорида аммония, перемешивали в течение 10 минут и затем разбавляли дополнительным количеством насыщенного раствора хлорида аммония. Водный слой экстрагировали с помощью DCM. Объединенные органические слои промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью FCC (0-10%MeOH (1% NH3)/DCM) с получением указанного в заголовке промежуточного соединения (100 мг, 0,193 ммоль).
LCMS: Rt: 2,81 и 2,84 мин. (способ 4 LCMS); MS масса/заряд 519,3 [M+H]+.
Стадия 2. (S)-2-(3-(2-(1-(5-Окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ол
трет-Бутил-(S)-7-(4-(5-фтор-2-(3-(2-гидроксипропан-2-ил)циклобутокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (100 мг, 0,193 ммоль) растворяли в DCM (3 мл) и добавляли TFA (0,450 мл, 5,78 ммоль). Реакционную смесь перемешивали в течение 20 минут и затем реакционную смесь концентрировали и растворяли в DCM и 1 н. NaOH. Слои разделяли и водн. слой экстрагировали с помощью DCM (3×25 мл) и объединенные органические слои промывали солевым раствором (1×10 мл), высушивали над сульфатом магния, фильтровали и концентрировали. Материал переносили далее на следующую стадию без дополнительной очистки.
LCMS: Rt: 0,58 и 0,63 (способ 1 LCMS); MS масса/заряд 419,5 [M+H]+.
Стадия 3. 2-((1R,3s)-3-(4-Фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ол и 2-((1S,3r)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ол
(S)-2-(3-(2-(1-(5-Окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ол (70 мг, 0,17 ммоль) и 2-бромоксазол (30 мг, 0,20 ммоль) растворяли в диоксане (1,7 мл), и смесь продували азотом. Добавляли Pd2(dba)3 (9,6 мг, 0,017 ммоль), XantPhos (12 мг, 0,020 ммоль) и трет-бутоксид натрия (48 мг, 0,50 ммоль), и реакционную смесь перемешивали при 75°C в течение ночи. Реакционную смесь фильтровали через слой целита, промывали с помощью EtOAc и концентрировали. Остаток очищали с помощью FCC (0-10%MeOH (1% NH4OH)/DCM). Диастереомеры затем разделяли с помощью препаративной HPLC (X-Bridge Peptide BEH C18, 5 мкм, 19×150 мм, 40-55% MeCN/H2O (10 мМ NH4OH), 30 мл/мин.) с получением продукта, соответствующего пику 1 примера 4T (5,3 мг, 0,0011 ммоль), и продукта, соответствующего пику 2 примера 4U (9,5 мг, 0,167 ммоль), в виде белых порошков.
Пик 1, пример 4T
LCMS: Rt: 2,33 мин. (способ 4 LCMS); MS масса/заряд 486,7 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (s, 1H), 6,90 (dd, J=9,8, 3,2 Гц, 1H), 6,87-6,78 (m, 2H), 6,64 (dd, J=9,0, 4,6 Гц, 1H), 4,68-4,60 (m, 1H), 4,29-4,14 (m, 2H), 4,14-4,02 (m, 3H), 3,83-3,72 (m, 1H), 3,12 (d, J=9,0 Гц, 2H), 3,01 (t, J=12,0 Гц, 1H), 2,91 (d, J=11,0 Гц, 1H), 2,60-2,36 (m, 4H), 2,26 (q, J=10,7 Гц, 2H), 2,14 (m, 3H), 1,85 (s, 2H), 1,70 (m, 2H), 1,16 (s, 6H).
Пик 2, пример 4U
LCMS: Rt: 2,41 мин. (способ 4 LCMS); MS масса/заряд 486,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,40 (d, J=0,9 Гц, 1H), 6,89 (dd, J=9,8, 3,0 Гц, 1H), 6,86-6,73 (m, 3H), 4,52-4,42 (m, 1H), 4,26-4,15 (m, 2H), 4,13-4,02 (m, 3H), 3,80-3,71 (m, 1H), 3,10 (q, J=7,0 Гц, 2H), 3,04-2,93 (m, 1H), 2,89 (d, J=11,3 Гц, 1H), 2,53 (dd, J=12,8, 7,4 Гц, 1H), 2,47-2,34 (m, 2H), 2,22 (m, 2H), 2,12 (dd, J=13,0, 8,5 Гц, 1H), 2,08-1,96 (m, 3H), 1,83 (s, 2H), 1,68 (m, 2H), 1,12 (s, 6H).
Пример 4V. (S)-2-(Оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
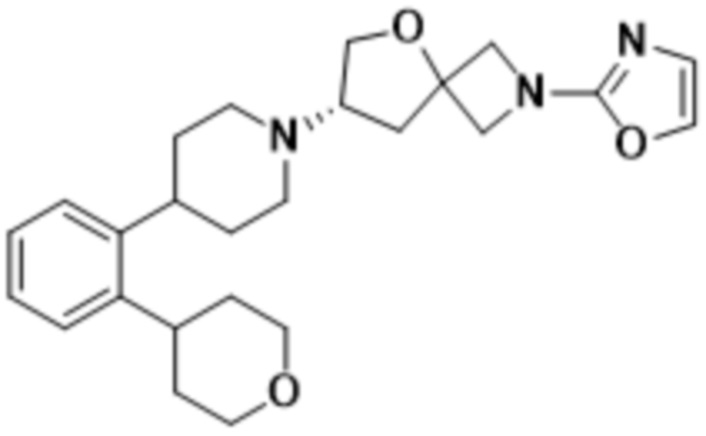
В перемешиваемый раствор (S)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7L, 3,00 г, 8,41 ммоль) и 2-йодоксазола (2,051 г, 10,52 ммоль) в THF (3,0 мл) добавляли TPGS-750-M (30 мл) с последующим добавлением трехосновного фосфата калия (10,72 г, 50,5 ммоль). Реакционную смесь перемешивали при 55°C в течение 48 часов и затем реакционную смесь охлаждали до к. т. и разбавляли водой. Смесь экстрагировали с помощью DCM и объединенные органические слои промывали водой, высушивали над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью FCC (0-10% MeOH (10% NH4OH)/DCM) с получением указанного в заголовке соединения в виде светло-желтой пены (2,1 г, 4,96 ммоль).
LCMS: Rt: 2,13 мин. (способ 4 LCMS); MS масса/заряд 424,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 7,57 (s, 1H), 7,23 (dt, J=7,0, 2,5 Гц, 2H), 7,20-7,10 (m, 2H), 6,84 (s, 1H), 4,14 (d, J=8,5 Гц, 1H), 4,04 (d, J=8,4 Гц, 2H), 3,99-3,89 (m, 4H), 3,67-3,58 (m, 1H), 3,48 (m, 2H), 3,10-2,97 (m, 2H), 2,97-2,93 (m, 1H), 2,80 (m, 2H), 2,38 (dd, J=13,0, 7,3 Гц, 1H), 2,21-1,98 (m, 3H), 1,74 (dd, J=12,7, 4,3 Гц, 1H), 1,71-1,58 (m, 5H), 1,54 (dd, J=13,2, 3,4 Гц, 2H).
Пример 4W. (S)-7-(4-(5-Фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан
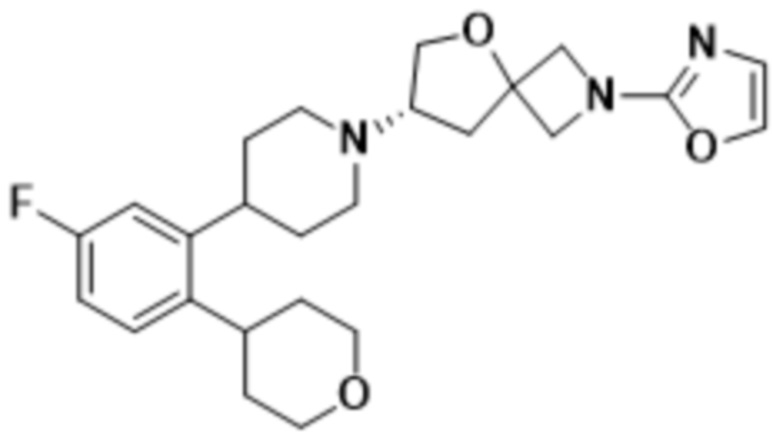
(S)-7-(4-(5-Фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7BB, 90 мг, 0,24 ммоль) и 2-йодоксазол (51,5 мг, 0,264 ммоль) растворяли в смеси THF (0,3 мл) и TPGS-750-M (9 мл). Добавляли трехосновный фосфат калия (306 мг, 1,44 ммоль) и реакционную смесь перемешивали при 55°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали с помощью DCM. Объединенные органические вещества промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали. Остаток очищали с помощью FCC (0-10% MeOH (1% NH3)/DCM) с получением указанного в заголовке соединения (20 мг, 0,045 ммоль).
LCMS: Rt: 2,20 мин. (способ 4 LCMS); MS масса/заряд 442,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,31 (d, J=1,3 Гц, 1H), 7,17 (dd, J=8,6, 6,0 Гц, 1H), 6,88 (dd, J=10,8, 2,9 Гц, 1H), 6,80 (td, J=8,4, 2,8 Гц, 1H), 6,72 (d, J=1,3 Гц, 1H), 4,19-4,06 (m, 2H), 4,06-3,88 (m, 5H), 3,67 (dd, J=8,8, 7,3 Гц, 1H), 3,50 (td, J=11,8, 1,9 Гц, 2H), 3,00 (m, 3H), 2,81 (d, J=12,2 Гц, 2H), 2,44 (dd, J=12,9, 7,4 Гц, 1H), 2,25-2,10 (m, 2H), 2,04 (dd, J=12,9, 8,4 Гц, 1H), 1,78-1,59 (m, 6H), 1,58-1,46 (m, 2H).
Пример 5A. (S)-7-(4-(5-Хлор-2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан
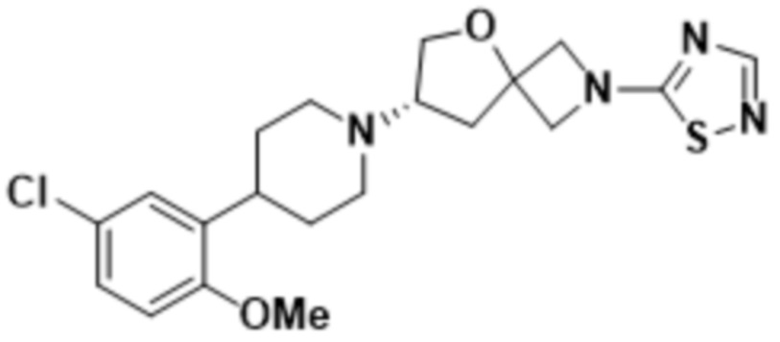
Стадия 1. трет-Бутил-(S)-7-(4-(5-хлор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
(S)-трет-Бутил-7-(4-(2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (промежуточное соединение 6C, 109 мг, 0,271 ммоль) растворяли в DMF (2,7 мл) и в атмосфере азота добавляли CBMG (0,142 г, 0,677 ммоль) и HCl (4,0 M в диоксане, 0,237 мл, 0,948 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и затем раствор разбавляли водой и EtOAc. Повышали основность раствора с помощью 1 н. NaOH до pH 13. Водный слой экстрагировали с помощью EtOAc и объединенные органические вещества разбавляли гептанами, промывали водой и высушивали над сульфатом магния, фильтровали и концентрировали. Неочищенный материал поглощали в DCM, фильтровали для удаления осажденных твердых веществ и очищали с помощью флеш-хроматографии (0-10% MeOH (10% NH4OH)/DCM) с получением указанного в заголовке промежуточного соединения (18 мг, 0,271 ммоль).
LCMS: Rt: 0,82 мин. (способ 1 LCMS); MS масса/заряд 437,4 [M+H]+.
Стадия 2. (S)-7-(4-(5-Хлор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
(S)-трет-Бутил-7-(4-(5-хлор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (100 мг, 0,229 ммоль) растворяли в DCM (1,6 мл) и добавляли TFA (0,529 мл, 6,87 ммоль). Реакционную смесь перемешивали в течение 45 минут и ее затем концентрировали. Остаток растворяли в MeOH (5 мл), и добавляли смолу Isolute на основе Si-пропилсульфоновой кислоты (SCX-2) (1,073 г, 0,687 ммоль) и полученное перемешивали в течение 1 часа. Смолу фильтровали и промывали с помощью MeOH и затем смолу промывали с помощью 7 н. аммиака в MeOH. 7 н. аммиак во фракциях MeOH затем концентрировали с получением указанного в заголовке промежуточного соединения (73 мг, 0,217 ммоль).
LCMS: Rt: 0,49 мин. (способ 1 LCMS); MS масса/заряд 337,5 [M+H]+.
Стадия 3. (S)-7-(4-(5-Хлор-2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан
(S)-7-(4-(5-Хлор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (24 мг, 0,071 ммоль) и 5-бром-1,2,4-тиадиазол (0,018 г, 0,11 ммоль) растворяли в 2-пропаноле (0,65 мл) и добавляли DIPEA (0,02 мл, 0,11 ммоль). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 10 минут, и затем концентрировали и очищали с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 35-60% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (19 мг, 0,045 ммоль) в виде светло-желтого твердого вещества.
LCMS: Rt: 2,47 мин. (способ 4 LCMS); MS масса/заряд 421,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,93 (s, 1H), 7,20-7,07 (m, 2H), 6,90 (d, J=8,5 Гц, 1H), 4,36-4,23 (m, 2H), 4,23-4,11 (m, 2H), 4,08 (dd, J=8,8, 6,9 Гц, 1H), 3,84-3,74 (m, 3H), 3,16-3,04 (m, 3H), 3,02-2,83 (m, 2H), 2,55 (dd, J=13,1, 7,5 Гц, 1H), 2,28-2,12 (m, 3H), 1,87-1,61 (m, 4H).
Пример 5B. (S)-7-(4-(2-Метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан
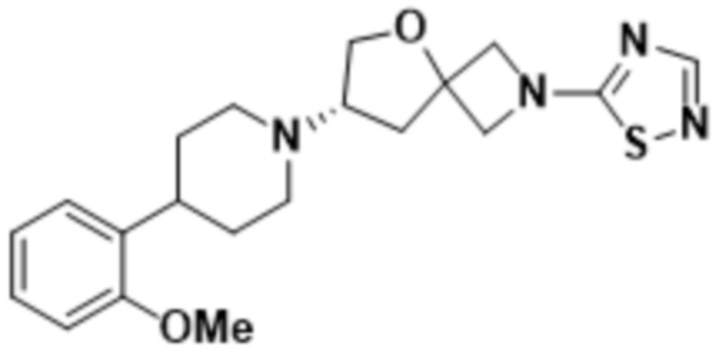
(S)-7-(4-(2-Метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7X, 60 мг, 0,20 ммоль) и 5-бром-1,2,4-тиадиазол (0,049 г, 0,30 ммоль) растворяли в 2-пропаноле (2,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи в атмосфере азота, концентрировали и очищали с помощью FCC (0-10% MeOH (1% NH4OH)/DCM) с получением указанного в заголовке соединения (34 мг, 0,086 ммоль). LCMS: Rt: 2,20 мин. (способ 4 LCMS); MS масса/заряд 387,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,93 (s, 1H), 7,15 (td, J=7,1, 1,7 Гц, 2H), 6,96-6,85 (m, 2H), 4,38-4,23 (m, 2H), 4,23-4,03 (m, 3H), 3,81 (s, 4H), 3,17-3,05 (m, 2H), 3,05-2,94 (m, 1H), 2,94 -2,84 (m, 1H), 2,56 (dd, J=13,0, 7,5 Гц, 1H), 2,31-2,12 (m, 3H), 1,77 (m, 4H).
Пример 5C. (S)-1-(2-(1-(2-(1,2,4-Тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ол
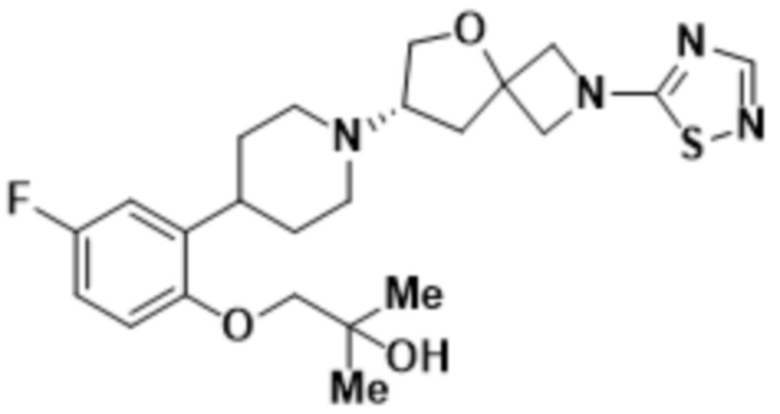
(S)-1-(2-(1-(5-Окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ол (промежуточное соединение 7O, 64 мг, 0,17 ммоль) и 5-бром-1,2,4-тиадиазол (0,042 г, 0,25 ммоль) растворяли в 2-пропаноле (2,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов в атмосфере азота, затем нагревали при 40°C в течение 3 часов, концентрировали и очищали с помощью FCC (0-10%MeOH (1% NH4OH)/DCM) с получением указанного в заголовке соединения (40 мг, 0,085 ммоль).
LCMS: Rt: 2,06 мин. (способ 4 LCMS); MS масса/заряд 463,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,93 (s, 1H), 6,96-6,81 (m, 3H), 4,37-4,05 (m, 5H), 3,79 (dd, J=8,8, 7,4 Гц, 1H), 3,75 (s, 2H), 3,17-3,05 (m, 3H), 2,91 (m, 1H), 2,56 (dd, J=13,1, 7,4 Гц, 1H), 2,30-2,12 (m, 3H), 1,86 (m, 2H), 1,69 (m, 2H), 1,34 (s, 6H).
Пример 5D. (S)-7-(4-(5-Фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан
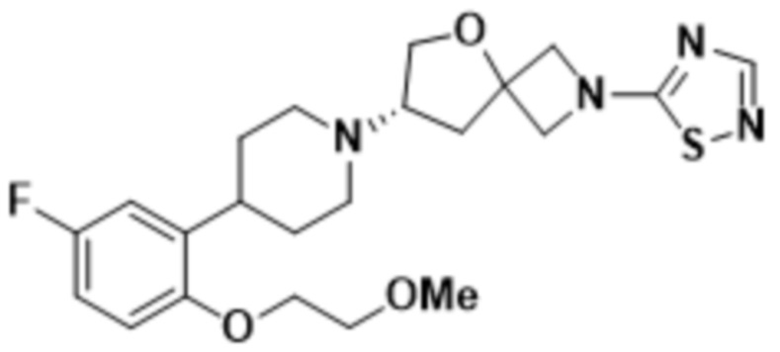
(S)-7-(4-(5-Фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7N, 65 мг, 0,18 ммоль) и 5-бром-1,2,4-тиадиазол (0,044 г, 0,27 ммоль) растворяли в THF (1,8 мл). Реакционную смесь перемешивали при комнатной температуре в течение 90 минут в атмосфере азота, концентрировали и очищали с помощью FCC (0-7% MeOH/DCM) с получением указанного в заголовке соединения (14 мг, 0,031 ммоль).
LCMS: Rt: 1,12 мин. (способ 3 LCMS); MS масса/заряд 449,1 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,02 (s, 1H), 6,92-7,04 (m, 3H), 4,26 (d, J=8,8 Гц, 1H), 4,16 (t, J=7,8 Гц, 2H), 4,03-4,10 (m, 3H), 3,96 (dd, J=8,8, 6,8 Гц, 1H), 3,61-3,69 (m, 3H), 3,33 (s, 3H), 2,93-3,04 (m, 2H), 2,76-2,91 (m, 2H), 2,39-2,44 (m, 1H), 1,99-2,14 (m, 3H), 1,66-1,77 (m, 2H), 1,51-1,64 (m, 2H).
Пример 5E. (S)-7-(4-(4-Фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан
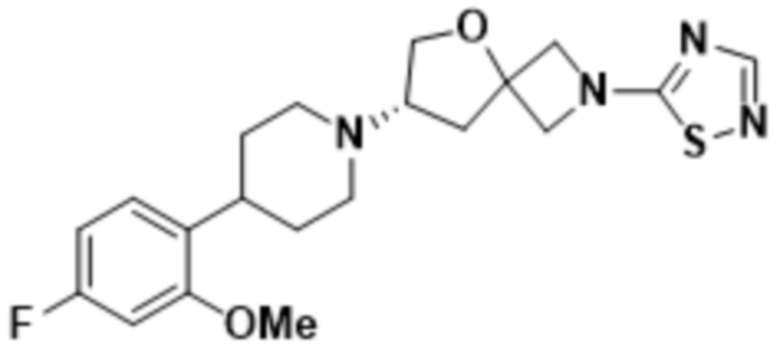
(S)-7-(4-(4-Фтор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7Y, 85 мг, 0,27 ммоль) и 5-бром-1,2,4-тиадиазол (0,066 г, 0,40 ммоль) растворяли в IPA (3,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи в атмосфере азота, концентрировали и очищали с помощью FCC (0-10%MeOH (1% NH4OH)/DCM) с получением указанного в заголовке соединения (59 мг, 0,14 ммоль).
LCMS: Rt: 2,29 мин. (способ 4 LCMS); MS масса/заряд 405,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,93 (s, 1H), 7,14 (dd, J=8,6, 6,6 Гц, 1H), 6,71 (dd, J=11,2, 2,5 Гц, 1H), 6,61 (m, 1H), 4,35-4,23 (m, 2H), 4,23-4,12 (m, 2H), 4,08 (dd, J=8,7, 6,9 Гц, 1H), 3,81 (s, 3H), 3,78 (dd, J=8,8, 7,4 Гц, 1H), 3,13-3,06 (m, 2H), 2,91 (m, 2H), 2,55 (dd, J=13,0, 7,5 Гц, 1H), 2,27-2,13 (m, 3H), 1,84-1,67 (m, 4H).
Пример 5F. (S)-7-(4-(2-((5-Метил-1,2,4-оксадиазол-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
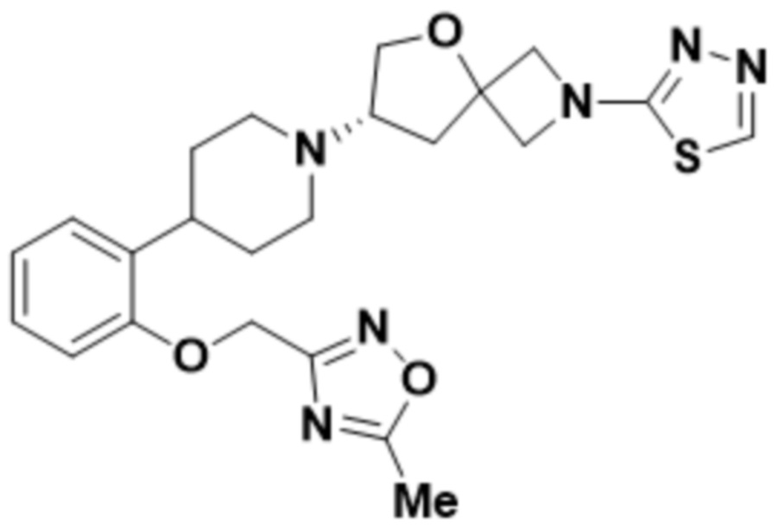
(S)-7-(4-(2-((5-Метил-1,2,4-оксадиазол-3-ил)метокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7PP, 32 мг, 0,083 ммоль), 2-бром-1,3,4-тиадиазол (14 мг, 0,083 ммоль) и трехосновный фосфат калия (18 мг, 0,083 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (150 мкл) и THF (20 мкл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали при пониженном давлении и очищали с помощью FCC (0-5% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 10-30% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (19 мг, 0,040 ммоль).
LCMS: Rt: 1,92 мин. (способ 4 LCMS); MS масса/заряд 469,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,65 (s, 1H), 7,24-7,11 (m, 2H), 7,05 (d, J=7,3 Гц, 1H), 6,96 (m, 1H), 5,19 (s, 2H), 4,32-4,21 (m, 2H), 4,18-4,09 (m, 2H), 4,06 (dd, J=8,6, 7,1 Гц, 1H), 3,81-3,72 (m, 1H), 3,06 (m, 3H), 2,87 (d, J=10,4 Гц, 1H), 2,61 (s, 3H), 2,54 (dd, J=13,0, 7,4 Гц, 1H), 2,27-2,11 (m, 3H), 1,89-1,64 (m, 4H).
Пример 5G. (S)-7-(4-(5-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
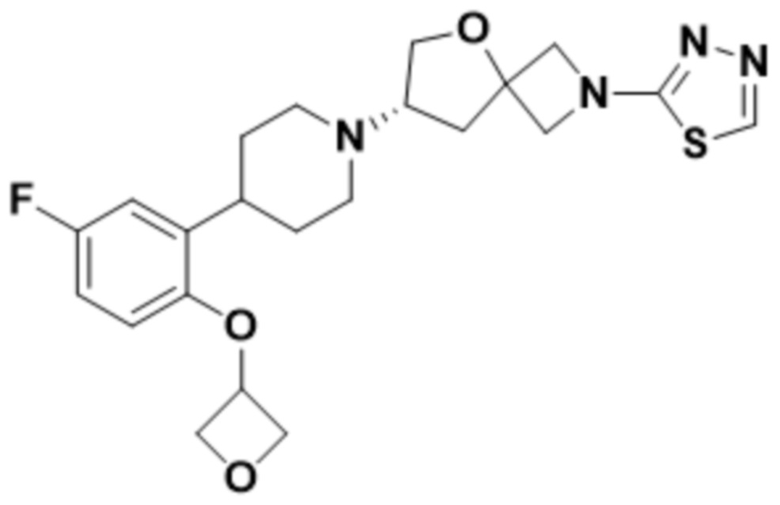
В раствор (S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7A, 95 мг, 0,26 ммоль) в смеси 2% водного раствора TPGS-750-M (470 мкл) /THF (50 мкл) добавляли 2-бром-1,3,4-тиадиазол (43 мг, 0,26 ммоль) с последующим добавлением трехосновного фосфата калия (56 мг, 0,26 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и неочищенное вещество затем экстрагировали с помощью DCM (3×25 мл), и органические слои объединяли и выпаривали при пониженном давлении. Остаток очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (49 мг, 0,11 ммоль).
LCMS: Rt: 1,79 мин. (способ 4 LCMS); MS масса/заряд 447,3 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,80 (s, 1H), 7,04 (dd, J=9,9, 3,1 Гц, 1H), 6,98-6,87 (m, 1H), 6,56 (dd, J=9,0, 4,6 Гц, 1H), 5,31-5,17 (m, 1H), 4,91 (t, J=6,6 Гц, 2H), 4,52 (dd, J=7,3, 4,9 Гц, 2H), 4,21 (d, J=8,4 Гц, 1H), 4,16-4,05 (m, 2H), 4,03-3,91 (m, 2H), 3,69-3,57 (m, 1H), 3,07-2,74 (m, 4H), 2,42 (dd, J=13,0, 7,3 Гц, 1H), 2,10 (dt, J=13,1, 8,1 Гц, 3H), 1,82-1,68 (m, 2H), 1,61 (m, 2H).
Пример 5H. (S)-7-(4-(5-Фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
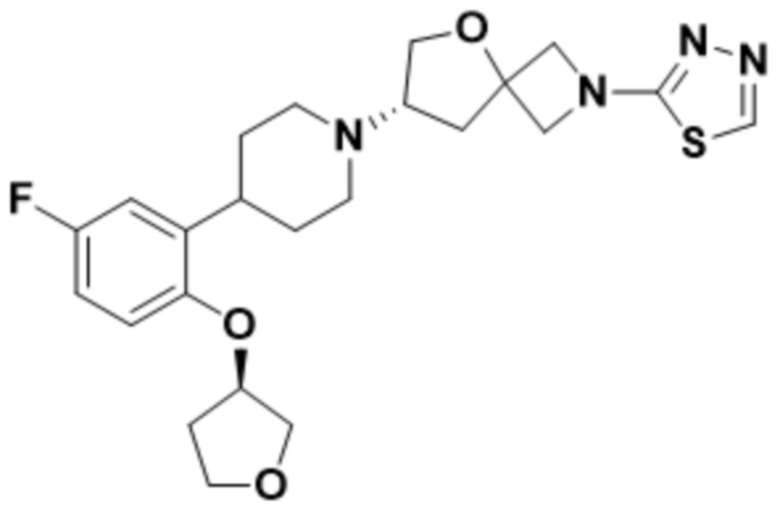
В раствор (S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7D, 73 мг, 0,19 ммоль) в смеси 2% водного раствора TPGS-750-M (350 мкл)/THF (40 мкл) добавляли 2-бром-1,3,4-тиадиазол (32 мг, 0,19 ммоль) с последующим добавлением трехосновного фосфата калия (41 мг, 0,19 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (31 мг, 0,066 ммоль).
LCMS: Rt: 1,98 мин. (способ 4 LCMS); MS масса/заряд 461,1 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,07-6,91 (m, 3H), 5,01 (br s, 1H), 4,20 (d, J=8,8 Гц, 1H), 4,10 (dd, J=8,1, 5,1 Гц, 2H), 4,04-3,98 (m, 1H), 3,97-3,91 (m, 1H), 3,90-3,71 (m, 4H), 3,63 (t, J=7,6 Гц, 1H), 3,03-2,92 (m, 2H), 2,85-2,75 (m, 2H), 2,41 (dd, J=13,0, 7,1 Гц, 1H), 2,25-2,12 (m, 1H), 2,12-1,91 (m, 4H), 1,74-1,49 (m, 4H).
Пример 5I. (S)-7-(4-(5-Фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
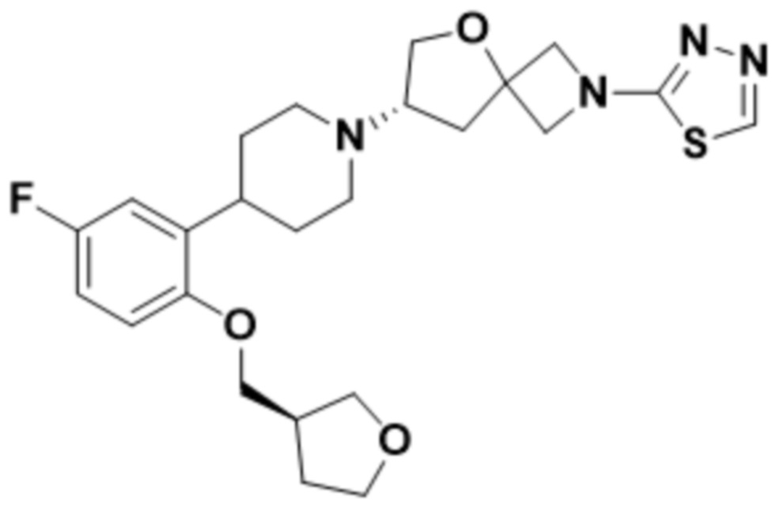
В раствор (S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7QQ, 85 мг, 0,22 ммоль) в смеси 2% водного раствора TPGS-750-M (390 мкл)/THF (45 мкл) добавляли 2-бром-1,3,4-тиадиазол (36 мг, 0,22 ммоль) с последующим добавлением трехосновного фосфата калия (46 мг, 0,22 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (36 мг, 0,074 ммоль).
LCMS: Rt: 1,16 мин. (способ 3 LCMS); MS масса/заряд 475,2 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,02-6,93 (m, 3H), 4,20 (d, J=8,8 Гц, 1H), 4,14-4,08 (m, 2H), 4,00 (d, J=8,3 Гц, 1H), 3,98-3,91 (m, 2H), 3,90-3,80 (m, 2H), 3,80-3,73 (m, 1H), 3,72-3,67 (m, 1H), 3,66-3,59 (m, 1H), 3,53 (dd, J=8,3, 5,9 Гц, 1H), 3,03-2,93 (m, 2H), 2,88-2,76 (m, 2H), 2,71-2,61 (m, 1H), 2,42 (dd, J=13,0, 7,1 Гц, 1H), 2,13-1,97 (m, 4H), 1,74-1,64 (m, 3H), 1,63-1,53 (m, 2H).
Пример 5J. (S)-7-(4-(5-Фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
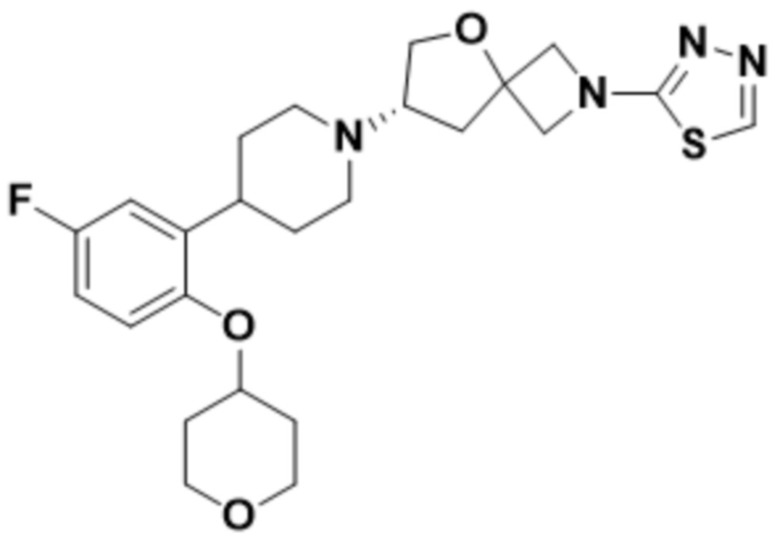
В раствор (S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7G, 60 мг, 0,15 ммоль) в смеси 2% водного раствора TPGS-750-M (280 мкл)/THF (30 мкл) добавляли 2-бром-1,3,4-тиадиазол (25 мг, 0,15 ммоль) с последующим добавлением трехосновного фосфата калия (33 мг, 0,15 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 15-40% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (19 мг, 0,038 ммоль).
LCMS: Rt: 2,09 мин. (способ 4 LCMS); MS масса/заряд 475,5 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,07-6,90 (m, 3H), 4,60-4,48 (m, 1H), 4,20 (d, J=8,3 Гц, 1H), 4,15-4,06 (m, 2H), 4,04-3,90 (m, 2H), 3,86-3,75 (m, 2H), 3,67-3,57 (m, 1H), 3,55-3,45 (m, 2H), 3,05-2,93 (m, 2H), 2,92-2,77 (m, 2H), 2,42 (dd, J=12,7, 7,3 Гц, 1H), 2,14-2,01 (m, 3H), 1,99-1,89 (m, 2H), 1,77-1,64 (m, 2H), 1,64-1,54 (m, 4H).
Пример 5K. (S)-7-(4-(2-(((R)-1,4-Диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
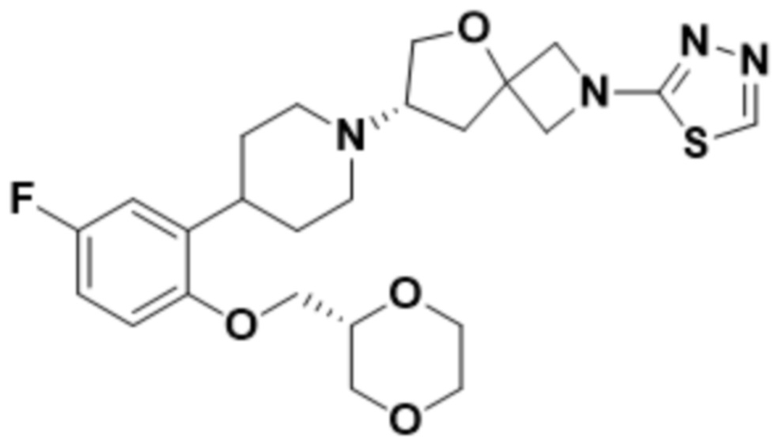
В раствор (S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7C, 80 мг, 0,20 ммоль) в смеси 2% водного раствора TPGS-750-M (350 мкл)/THF (40 мкл) добавляли 2-бром-1,3,4-тиадиазол (33 мг, 0,19 ммоль) с последующим добавлением трехосновного фосфата калия (42 мг, 0,19 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (35 мг, 0,070 ммоль).
LCMS: Rt: 1,94 мин. (способ 4 LCMS); MS масса/заряд 491,3 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,02-6,92 (m, 3H), 4,20 (d, J=8,8 Гц, 1H), 4,11 (t, J=7,3 Гц, 2H), 4,03-3,90 (m, 4H), 3,88-3,81 (m, 2H), 3,77 (dd, J=11,2, 2,0 Гц, 1H), 3,72-3,59 (m, 3H), 3,53-3,43 (m, 2H), 3,03-2,95 (m, 2H), 2,88-2,77 (m, 2H), 2,42 (dd, J=12,7, 7,3 Гц, 1H), 2,13-2,02 (m, 3H), 1,75-1,67 (m, 2H), 1,65-1,51 (m, 2H).
Пример 5L. (S)-7-(4-(2-(((S)-1,4-Диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
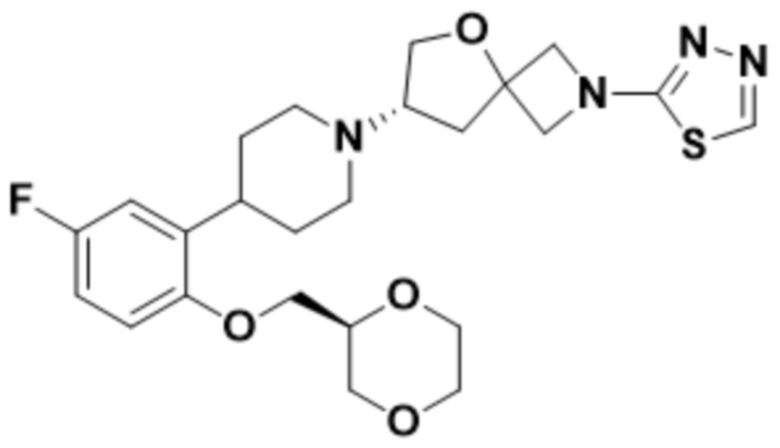
В раствор (S)-7-(4-(2-(((S)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7F, 86 мг, 0,21 ммоль) в смеси 2% водного раствора TPGS-750-M (380 мкл)/THF (40 мкл) добавляли 2-бром-1,3,4-тиадиазол (35 мг, 0,21 ммоль) с последующим добавлением трехосновного фосфата калия (45 мг, 0,21 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (41 мг, 0,082 ммоль).
LCMS: Rt: 1,95 мин. (способ 4 LCMS); MS масса/заряд 491,5 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,02-6,92 (m, 3H), 4,20 (d, J=8,8 Гц, 1H), 4,15-4,08 (m, 2H), 4,04-3,89 (m, 4H), 3,88-3,81 (m, 2H), 3,80-3,74 (m, 1H), 3,72-3,59 (m, 3H), 3,53-3,44 (m, 2H), 3,05-2,94 (m, 2H), 2,89-2,76 (m, 2H), 2,46-2,38 (m, 1H), 2,14-2,01 (m, 3H), 1,80-1,49 (m, 4H).
Пример 5M. (S)-7-(4-(4,5-Дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
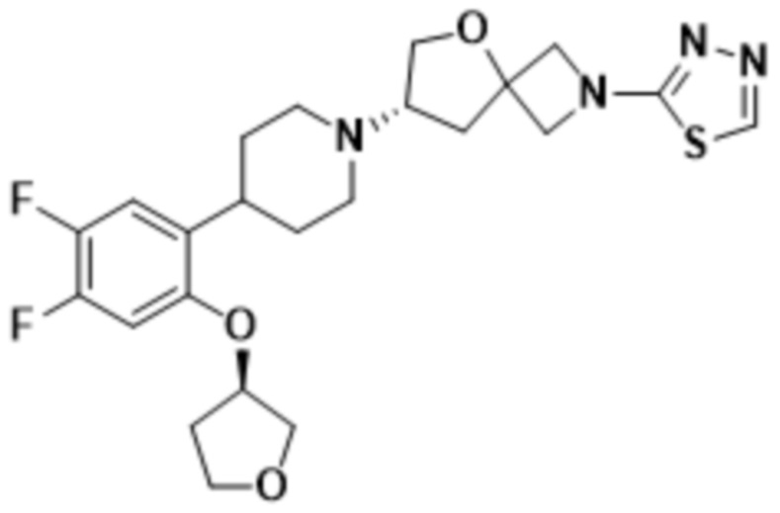
В раствор (S)-7-(4-(4,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7R, 91 мг, 0,23 ммоль) в смеси 2% водного раствора TPGS-750-M (415 мкл)/THF (45 мкл) добавляли 2-бром-1,3,4-тиадиазол (38 мг, 0,23 ммоль) с последующим добавлением трехосновного фосфата калия (49 мг, 0,23 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (29 мг, 0,059 ммоль).
LCMS: Rt: 2,09 мин. (способ 4 LCMS); MS масса/заряд 479,1 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,22 (dd, J=11,7, 9,3 Гц, 1H), 7,12 (dd, J=13,0, 7,1 Гц, 1H), 5,08-5,02 (m, 1H), 4,20 (d, J=8,8 Гц, 1H), 4,13-4,07 (m, 2H), 4,00 (d, J=8,8 Гц, 1H), 3,94 (dd, J=8,3, 6,8 Гц, 1H), 3,90-3,84 (m, 1H), 3,83-3,72 (m, 3H), 3,62 (t, J=7,8 Гц, 1H), 3,02-2,91 (m, 2H), 2,83-2,71 (m, 2H), 2,45-2,37 (m, 1H), 2,26-2,14 (m, 1H), 2,12-1,99 (m, 3H), 1,98-1,91 (m, 1H), 1,71-1,49 (m, 4H).
Пример 5N. (S)-7-(4-(5-Фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
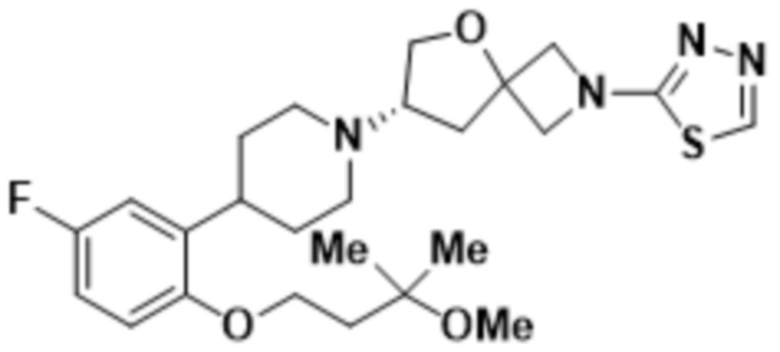
В раствор (S)-7-(4-(5-фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7M, 74 мг, 0,18 ммоль) в смеси 2% водного раствора TPGS-750-M (330 мкл)/THF (35 мкл) добавляли 2-бром-1,3,4-тиадиазол (30 мг, 0,18 ммоль) с последующим добавлением трехосновного фосфата калия (39 мг, 0,18 ммоль). Реакционную смесь обрабатывали аналогично примеру 6B, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 35-60% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (39 мг, 0,076 ммоль).
LCMS: Rt: 1,34 мин. (способ 3 LCMS); MS масса/заряд 491,0 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,82 (s, 1H), 7,02-6,92 (m, 3H), 4,23-4,16 (m, 1H), 4,14-4,06 (m, 2H), 4,03-3,91 (m, 4H), 3,66-3,59 (m, 1H), 3,13-3,09 (m, 3H), 3,02-2,91 (m, 2H), 2,92-2,75 (m, 2H), 2,45-2,37 (m, 1H), 2,12-1,98 (m, 3H), 1,95-1,88 (m, 2H), 1,74-1,49 (m, 4H), 1,20-1,15 (m, 6H).
Пример 5O. (S)-7-(4-(5-Фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
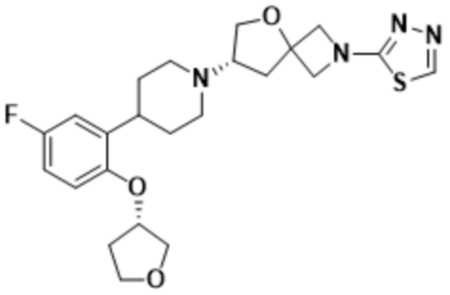
В раствор (S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7H, 89 мг, 0,24 ммоль) в смеси 2% водного раствора TPGS-750-M (425 мкл)/THF (50 мкл) добавляли 2-бром-1,3,4-тиадиазол (39 мг, 0,24 ммоль) с последующим добавлением трехосновного фосфата калия (50 мг, 0,24 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (34 мг, 0,072 ммоль).
LCMS: Rt: 1,96 мин. (способ 4 LCMS); MS масса/заряд 461,6 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,80 (s, 1H), 7,04-6,91 (m, 3H), 5,05-4,98 (m, 1H), 4,26-4,17 (m, 1H), 4,15-4,07 (m, 2H), 4,01 (d, J=8,5 Гц, 1H), 3,95 (dd, J=8,6, 6,7 Гц, 1H), 3,90-3,70 (m, 4H), 3,69-3,57 (m, 1H), 3,05-2,91 (m, 2H), 2,88-2,73 (m, 2H), 2,46-2,37 (m, 1H), 2,25-1,91 (m, 5H), 1,76-1,49 (m, 4H).
Пример 5P. (S)-4-(2-(1-(2-(1,3,4-Тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ол
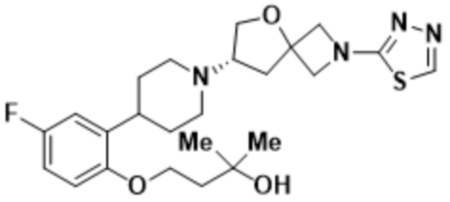
В раствор (S)-4-(2-(1-(5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ола (промежуточное соединение 7O, 143 мг, 0,36 ммоль) в смеси 2% водного раствора TPGS-750-M (655 мкл)/THF (70 мкл) добавляли 2-бром-1,3,4-тиадиазол (60 мг, 0,36 ммоль) с последующим добавлением трехосновного фосфата калия (77 мг, 0,36 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (75 мг, 0,15 ммоль). LCMS: Rt: 1,91 мин. (способ 4 LCMS); MS масса/заряд 477,1 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,02-6,91 (m, 3H), 4,36 (s, 1H), 4,20 (d, J=8,3 Гц, 1H), 4,10 (dd, J=8,3, 4,9 Гц, 2H), 4,07-3,98 (m, 3H), 3,94 (dd, J=8,3, 6,8 Гц, 1H), 3,62 (dd, J=8,3, 7,3 Гц, 1H), 2,97 (quin, J=7,2 Гц, 2H), 2,90-2,75 (m, 2H), 2,41 (dd, J=13,0, 7,1 Гц, 1H), 2,12-1,98 (m, 3H), 1,84 (t, J=6,8 Гц, 2H), 1,74-1,50 (m, 4H), 1,17 (s, 6H).
Пример 5Q. Формиатная соль (S)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана
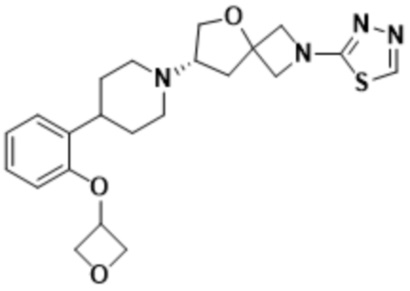
В раствор (S)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7Q, 21 мг, 0,061 ммоль) в смеси 2% водного раствора TPGS-750-M (275 мкл) /THF (30 мкл) добавляли 2-бром-1,3,4-тиадиазол (10 мг, 0,061 ммоль) с последующим добавлением трехосновного фосфата калия (19 мг, 0,061 ммоль). Реакционную смесь обрабатывали аналогично примеру 6B, и неочищенное вещество очищали с помощью препаративной HPLC (колонка X-bridge, 30×50 мм, 5 мкм, 30-30% MeCN/H2O (0,1% муравьиной кислоты), 75 мл/мин.) с получением указанного в заголовке соединения (2 мг, 0,004 ммоль) в виде формиатной соли.
LCMS: Rt: 1,79 мин. (способ 4 LCMS); MS масса/заряд 429,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,68 (s, 1H), 8,32 (s, 1H), 7,22 (dd, J=7,5, 1,7 Гц, 1H), 7,15 (td, J=7,8, 1,7 Гц, 1H), 7,01-6,90 (m, 1H), 6,51 (d, J=8,0 Гц, 1H), 5,29 (p, J=5,4 Гц, 1H), 5,07-5,00 (m, 2H), 4,70 (dd, J=7,5, 5,0 Гц, 2H), 4,35 (d, J=8,9 Гц, 1H), 4,28 (d, J=8,9 Гц, 1H), 4,22-4,07 (m, 3H), 3,98 (dd, J=9,6, 6,1 Гц, 1H), 3,68-3,45 (m, 2H), 3,25-3,08 (m, 2H), 2,77-2,60 (m, 3H), 2,33 (dd, J=13,6, 7,4 Гц, 1H), 2,09-1,78 (m, 4H).
Пример 5R. (S)-7-(4-(2-Метоксифенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
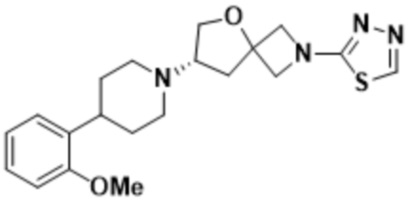
В раствор (S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7X, 87 мг, 0,29 ммоль) в смеси 2% водного раствора TPGS-750-M (520 мкл) /THF (60 мкл) добавляли 2-бром-1,3,4-тиадиазол (48 мг, 0,29 ммоль) с последующим добавлением трехосновного фосфата калия (61 мг, 0,29 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (41 мг, 0,10 ммоль).
LCMS: Rt: 2,00 мин. (способ 4 LCMS); MS масса/заряд 387,3 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,22-7,12 (m, 2H), 7,00-6,84 (m, 2H), 4,21 (d, J=8,8 Гц, 1H), 4,15-4,08 (m, 2H), 4,00 (d, J=8,8 Гц, 1H), 3,94 (dd, J=8,8, 6,8 Гц, 1H), 3,77 (s, 3H), 3,64 (t, J=7,3 Гц, 1H), 3,04-2,91 (m, 2H), 2,91-2,73 (m, 2H), 2,44-2,37 (m, 1H), 2,15-2,00 (m, 3H), 1,74-1,53 (m, 4H).
Пример 5S. (S)-7-(4-(5-Фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
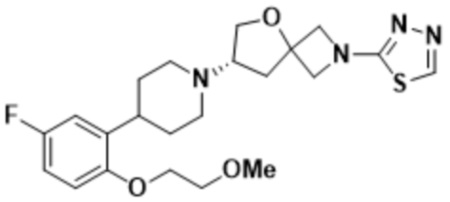
В раствор (S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7N, 54 мг, 0,15 ммоль) в смеси 2% водного раствора TPGS-750-M (270 мкл) /THF (30 мкл) добавляли 2-бром-1,3,4-тиадиазол (24 мг, 0,15 ммоль) с последующим добавлением трехосновного фосфата калия (31 мг, 0,15 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (24 мг, 0,052 ммоль).
LCMS: Rt: 2,03 мин. (способ 4 LCMS); MS масса/заряд 449,3 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) δ 8,80 (s, 1H), 7,02-6,90 (m, 3H), 4,20 (d, J=8,3 Гц, 1H), 4,13-4,05 (m, 4H), 4,03-3,98 (m, 1H), 3,95 (dd, J=8,5, 6,6 Гц, 1H), 3,68-3,59 (m, 3H), 3,33 (s, 3H), 3,03-2,93 (m, 2H), 2,92-2,75 (m, 2H), 2,41 (dd, J=12,8, 7,3 Гц, 1H), 2,13-1,99 (m, 3H), 1,77-1,65 (m, 2H), 1,64-1,49 (m, 2H).
Пример 5T. (S)-7-(4-(4-Фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
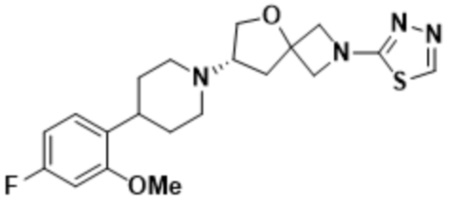
В раствор (S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана (промежуточное соединение 7Y, 85 мг, 0,27 ммоль) в смеси 2% водного раствора TPGS-750-M (2,4 мл) /THF (265 мкл) добавляли 2-бром-1,3,4-тиадиазол (44 мг, 0,27 ммоль) с последующим добавлением трехосновного фосфата калия (56 мг, 0,27 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и остаток очищали с помощью FCC (0-10% MeOH(1% NH4OH)/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (26 мг, 0,064 ммоль).
LCMS: Rt: 2,10 мин. (способ 4 LCMS); MS масса/заряд 405,5 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,66 (s, 1H), 7,14 (dd, J=8,6, 6,6 Гц, 1H), 6,71 (dd, J=11,1, 2,7 Гц, 1H), 6,61 (td, J=8,4, 2,5 Гц, 1H), 4,33-4,20 (m, 2H), 4,20-4,10 (m, 2H), 4,08 (dd, J=8,8, 7,0 Гц, 1H), 3,81 (s, 4H), 3,19-3,06 (m, 2H), 3,02-2,86 (m, 2H), 2,56 (dd, J=13,1, 7,4 Гц, 1H), 2,33-2,12 (m, 3H), 1,86-1,67 (m, 4H).
Пример 5U. (S)-1-(2-(1-(2-(1,3,4-Тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ол
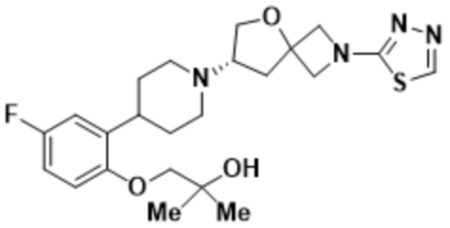
В раствор (S)-1-(2-(1-(5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола (промежуточное соединение 7U, 67 мг, 0,18 ммоль) в смеси 2% водного раствора TPGS-750-M (1,6 мл) /THF (160 мкл) добавляли 2-бром-1,3,4-тиадиазол (29 мг, 0,18 ммоль) с последующим добавлением трехосновного фосфата калия (38 мг, 0,18 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-10%MeOH(1% NH4OH)/DCM) с получением указанного в заголовке соединения (14 мг, 0,030 ммоль).
LCMS: Rt: 1,91 мин. (способ 4 LCMS); MS масса/заряд 463,6 [M+H]+.
1H (400 MГц, DMSO-d6) δ 8,80 (s, 1H), 7,04-6,90 (m, 3H), 4,36 (s, 1H), 4,20 (d, J=8,6 Гц, 1H), 4,10 (dd, J=8,4, 5,0 Гц, 2H), 4,08-3,98 (m, 3H), 3,94 (dd, J=8,5, 6,7 Гц, 1H), 3,62 (dd, J=8,5, 7,1 Гц, 1H), 2,97 (p, J=7,4 Гц, 2H), 2,91-2,75 (m, 2H), 2,41 (dd, J=12,9, 7,2 Гц, 1H), 2,15-1,96 (m, 3H), 1,84 (t, J=6,8 Гц, 2H), 1,68 (m, 2H), 1,56 (m, 2H), 1,17 (s, 6H).
Пример 5V. (S)-4-(2-(1-(2-(1,3,4-Тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ол
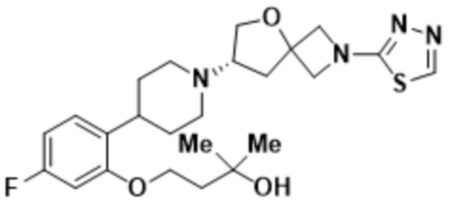
В раствор (S)-4-(2-(1-(5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ола (промежуточное соединение 7S, 140 мг, 0,36 ммоль) в смеси 2% водного раствора TPGS-750-M (0,64 мл)/THF (70 мкл) добавляли 2-бром-1,3,4-тиадиазол (59 мг, 0,36 ммоль) с последующим добавлением трехосновного фосфата калия (76 мг, 0,36 ммоль). Реакционную смесь обрабатывали аналогично примеру 5G, и неочищенное вещество очищали с помощью FCC (0-7% MeOH/DCM) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (61 мг, 0,13 ммоль).
LCMS: Rt: 2,04 мин. (способ 4 LCMS); MS масса/заряд 477,3 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,15 (dd, J=8,3, 7,3 Гц, 1H), 6,84 (dd, J=11,7, 2,4 Гц, 1H), 6,73-6,58 (m, 1H), 4,20 (d, J=8,3 Гц, 1H), 4,14-4,04 (m, 4H), 4,03-3,98 (m, 1H), 3,98-3,91 (m, 1H), 3,62 (t, J=7,6 Гц, 1H), 3,30-3,27 (m, 1H), 3,30-2,91 (m, 2H), 2,86-2,73 (m, 2H), 2,47-2,37 (m, 1H), 2,13-1,96 (m, 3H), 1,89-1,81 (m, 2H), 1,73-1,50 (m, 4H), 1,21-1,15 (m, 6H).
Пример 5W. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
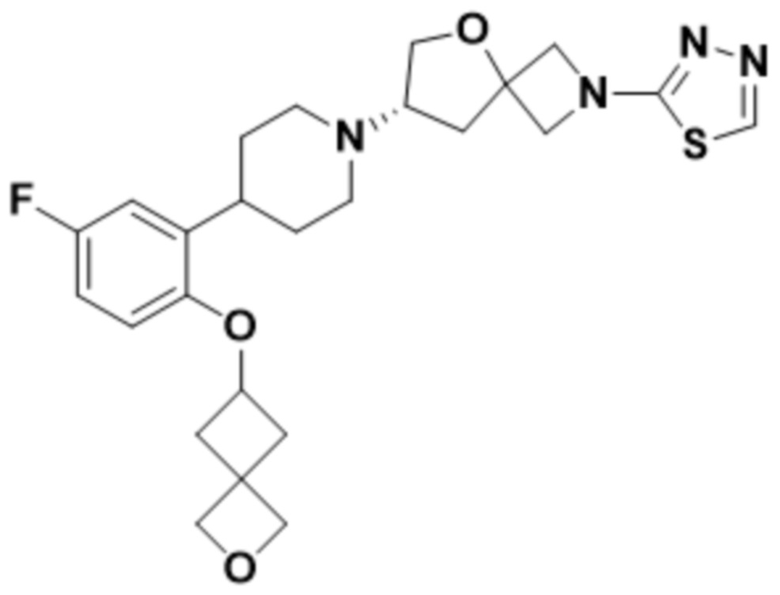
(S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (25 мг, 0,062 ммоль) растворяли в THF (0,62 мл) при -5°C и добавляли 2-бром-1,3,4-тиадиазол (промежуточное соединение 7NN, 15 мг, 0,086 ммоль). Реакционную смесь перемешивали при комнатной температуре 4 дня, затем концентрировали и разбавляли смесью EtOAc и воды. Слои разделяли и водный слой экстрагировали с помощью EtOAc, и объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью FCC (0-15% MeOH(10% NH4OH)/EtOAc) и с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (6,7 мг, 0,014 ммоль).
LCMS: Rt: 2,06 мин. (способ 4 LCMS); MS масса/заряд 487,3.
1H ЯМР (400 МГц, CD3OD) δ 8,66 (s, 1H), 6,91 (dd, 1H), 6,83 (m, 1H), 6,71 (dd, J=8,9, 4,6 Гц, 1H), 4,75 (s, 2H), 4,68 (s, 2H), 4,53 (p, J=6,6 Гц, 1H), 4,25 (q, 2H), 4,13 (m, 2H), 4,10-4,05 (m, 1H), 3,77 (dd, J=8,7, 7,3 Гц, 1H), 3,13-3,06 (m, 2H), 2,93 (m, 2H), 2,84-2,78 (m, 2H), 2,55 (dd, J=13,0, 7,4 Гц, 1H), 2,29 (m, 2H), 2,24-2,12 (m, 3H), 1,86-1,75 (m, 2H), 1,75-1,60 (m, 2H).
Пример 5X. (S)-7-(4-(5-Фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
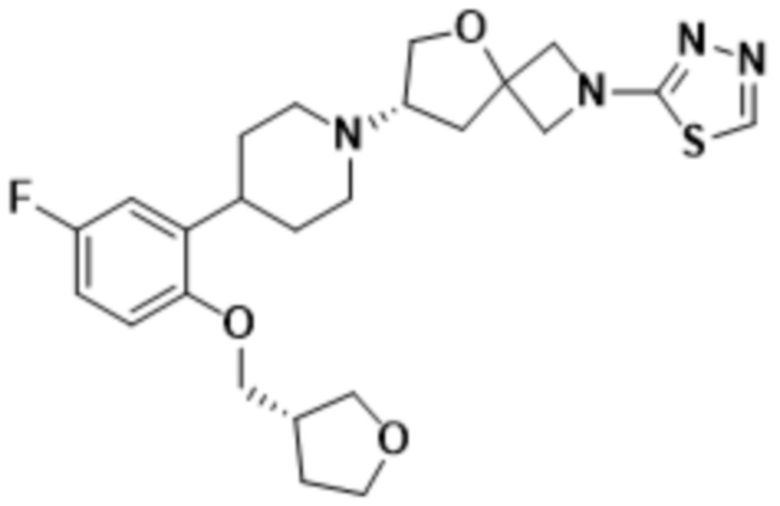
(S)-7-(4-(5-Фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан (промежуточное соединение 7J, 74 мг, 0,19 ммоль) растворяли в смеси 2% водного раствора TPGS-750-M (340 мкл) /THF (40 мкл) и добавляли дополнительное количество 2-бром-1,3,4-тиадиазола (31 мг, 0,19 ммоль) с последующим добавлением трехосновного фосфата калия (40 мг, 0,19 ммоль), и реакционную смесь обрабатывали аналогично примеру 5G. Остаток очищали с помощью FCC (0-7% метанол/дихлорметан) и дополнительно с помощью препаративной HPLC (X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (32 мг, 0,066 ммоль).
LCMS: Rt: 2,12 мин. (способ 4 LCMS); MS масса/заряд 475,1 [M+H]+.
1H ЯМР (DMSO-d6) δ 8,80 (s, 1H), 7,03-6,92 (m, 3H), 4,20 (d, J=8,8 Гц, 1H), 4,13-4,07 (m, 2H), 4,00 (d, J=8,8 Гц, 1H), 3,98-3,91 (m, 2H), 3,90-3,80 (m, 2H), 3,79-3,73 (m, 1H), 3,72-3,66 (m, 1H), 3,66-3,59 (m, 1H), 3,53 (dd, J=8,3, 5,9 Гц, 1H), 3,03-2,93 (m, 2H), 2,88-2,76 (m, 2H), 2,71-2,60 (m, 1H), 2,46-2,38 (m, 1H), 2,12-1,96 (m, 4H), 1,75-1,63 (m, 3H), 1,63-1,51 (m, 2H).
Пример 5Y. (S)-1-(2-(1-(2-(1,2,4-Тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)-2-метилпропан-2-ол
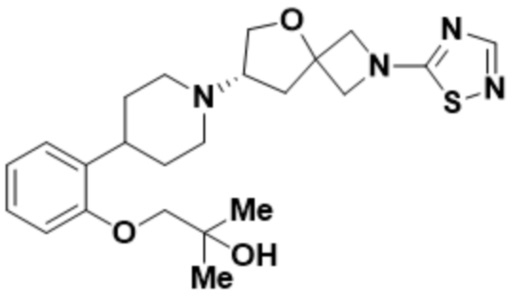
(S)-1-(2-(1-(5-Окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)-2-метилпропан-2-ол (110 мг, 0,305 ммоль) и 5-бром-1,2,4-тиадиазол (0,076 г, 0,46 ммоль) растворяли в 2-пропаноле (3,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи в атмосфере азота, концентрировали и очищали дважды с помощью FCC (0-10% MeOH (1% NH4OH)/DCM) с получением указанного в заголовке соединения (67 мг, 0,15 ммоль).
LCMS: Rt: 2,02 мин. (способ 4 LCMS); MS масса/заряд 445,7 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 7,93 (s, 1H), 7,24-7,10 (m, 2H), 6,90 (t, J=7,2 Гц, 2H), 4,36-4,03 (m, 5H), 3,82-3,74 (m, 3H), 3,19-3,04 (m, 3H), 2,91 (m, 1H), 2,56 (dd, J=13,1, 7,4 Гц, 1H), 2,32-2,11 (m, 3H), 1,87 (m, 2H), 1,74 (m, 2H), 1,35 (s, 6H).
Пример 6A. (S)-7-(4-(5-Фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октан
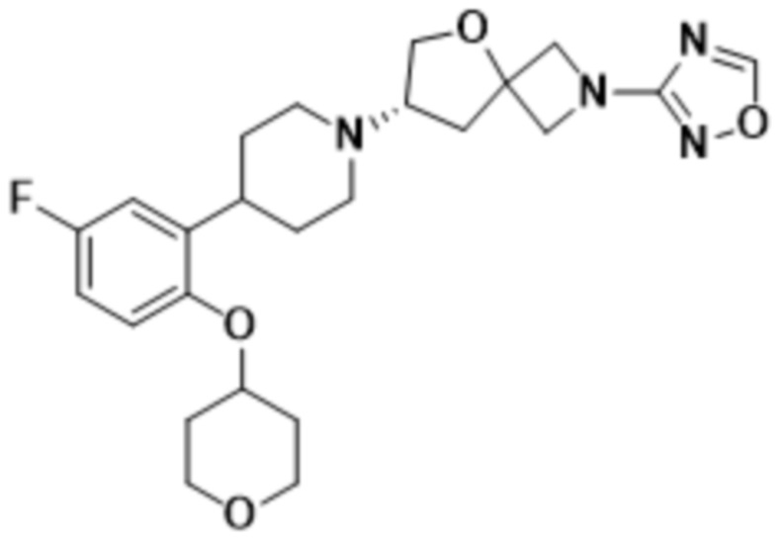
В атмосфере азота (S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-N-гидрокси-5-окса-2-азаспиро[3.4]октан-2-карбоксимидамид (промежуточное соединение 12B, 102 мг, 0,228 ммоль) растворяли в диэтилфенилортоформиате (2,3 мл) и добавляли молекулярные сита с размером пор 4Å (1 г) с последующим добавлением моногидрата p-толуолсульфоновой кислоты (131 мг, 0,684 ммоль). Реакционную смесь перемешивали при 80°C в атмосфере азота в течение ночи, затем охлаждали до комнатной температуры, фильтровали через целит, промывали с помощью DCM и затем концентрировали. Остаток очищали с помощью FCC (0-10% MeOH (10% NH4OH)/EtOAc), затем с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 35-60% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (11,5 мг, 0,024 ммоль).
LCMS: Rt: 2,24 мин. (способ 4 LCMS); MS масса/заряд 459,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,79 (s, 1H), 6,94 (td, J=9,5, 3,9 Гц, 2H), 6,89-6,79 (m, 1H), 4,59-4,46 (m, 1H), 4,21-4,11 (m, 2H), 4,09-3,99 (m, 3H), 3,97-3,90 (m, 2H), 3,75 (t, J=8,1 Гц, 1H), 3,60 (m, 2H), 3,12-2,99 (m, 3H), 2,89 (d, 1H), 2,54 (dd, J=12,8, 7,4 Гц, 1H), 2,28-2,17 (m, 2H), 2,12 (dd, J=13,0, 8,5 Гц, 1H), 2,06-1,98 (m, 2H), 1,90-1,78 (m, 2H), 1,78-1,64 (m, 4H).
Пример 6B. (S)-7-(4-(5-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октан
(S)-7-(4-(5-Фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-N-гидрокси-5-окса-2-азаспиро[3.4]октан-2-карбоксимидамид (промежуточное соединение 12C, 24,5 мг, 0,058 ммоль) растворяли в диэтилфенилортоформиате (0,8 мл) и добавляли молекулярные сита с размером пор 4Å (0,24 г) с последующим добавлением моногидрата p-толуолсульфоновой кислоты (34 мг, 0,18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем при 50°C в течение 5 часов и затем при 80°C в течение 35 минут. Реакционную смесь охлаждали при комнатной температуре, фильтровали через слой целита, промывали с помощью DCM и затем концентрировали. Остаток очищали с помощью FCC (0-10% MeOH (10% NH4OH)/EtOAc), затем с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (5,0 мг, 0,012 ммоль).
LCMS: Rt: 2,01 мин. (способ 4 LCMS); MS масса/заряд 431,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,78 (s, 1H), 6,97 (dd, J=9,7, 3,3 Гц, 1H), 6,83 (td, J=8,5, 3,0 Гц, 1H), 6,49 (dd, J=9,0, 4,6 Гц, 1H), 5,24 (m, 1H), 5,05-4,96 (m, 2H), 4,68 (dd, J=7,5, 5,0 Гц, 2H), 4,21-4,12 (m, 2H), 4,09-3,97 (m, 3H), 3,76 (dd, J=8,7, 7,4 Гц, 1H), 3,16-3,00 (m, 3H), 2,91 (m, 1H), 2,54 (dd, J=12,8, 7,4 Гц, 1H), 2,25 (m, 2H), 2,13 (dd, J=12,9, 8,5 Гц, 1H), 1,91-1,83 (m, 2H), 1,80-1,63 (m, 2H).
Пример 6C. (S)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октан
В круглодонной колбе объемом 100 мл (S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-N-гидрокси-5-окса-2-азаспиро[3.4]октан-2-карбоксимидамид (промежуточное соединение 12A, 119,4 мг, 0,259 ммоль) суспендировали в диэтилфенилортоформиате (2,6 мл). Далее добавляли молекулярные сита с размером пор 4Å (1 г) с последующим добавлением моногидрата p-толуолсульфоновой кислоты (149 мг, 0,778 ммоль). Реакционную смесь перемешивали при 60°C в атмосфере азота в течение 17 часов и затем в течение 5 часов при 80°C. Реакционную смесь охлаждали до к. т. и фильтровали через слой целита и промывали с помощью DCM, затем концентрировали. Остаток очищали с помощью FCC (0-15% MeOH (10% NH4OH)/EtOAc) и дополнительно с помощью препаративной HPLC (колонка X-bridge C18 OBD, 30×50 мм, 5 мкм, 25-50% MeCN/H2O (5 мМ NH4OH), 75 мл/мин.) с получением указанного в заголовке соединения (29 мг, 0,063 ммоль).
LCMS: Rt: 2,16 мин. (способ 4 LCMS); MS масса/заряд 471,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,78 (s, 1H), 6,90 (dd, J=9,7, 3,1 Гц, 1H), 6,82 (td, J=8,5, 3,0 Гц, 1H), 6,70 (dd, J=8,9, 4,5 Гц, 1H), 4,73 (s, 2H), 4,68 (s, 2H), 4,53 (m, 1H), 4,26-4,11 (m, 2H), 4,11-3,97 (m, 3H), 3,75 (dd, J=8,7, 7,4 Гц, 1H), 3,18-3,05 (m, 2H), 2,92 (m, 2H), 2,86-2,76 (m, 2H), 2,53 (dd, J=12,8, 7,4 Гц, 1H), 2,30 (m, 2H), 2,21 (m, 2H), 2,12 (dd, J=12,9, 8,5 Гц, 1H), 1,80 (m, 2H), 1,68 (m, 2H).
Пример 7A. (R)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
Стадия 1. трет-Бутил-7-(4-(5-фтор-2-гидроксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
4-Фтор-2-(пиперидин-4-ил)фенолгидрохлорид (см. WO 2012/062752 для синтеза, 511 мг, 2,205 ммоль) растворяли в MeOH (15 мл) и добавляли трет-бутил-7-оксо-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (526 мг, 2,316 ммоль) с последующим добавлением TEA (1,230 мл, 8,82 ммоль) и хлорида цинка (0,5 M в THF, 6,62 мл, 3,31 ммоль). Полученный раствор перемешивали при 50°C в течение 2 ч. Реакционную смесь затем охлаждали до 0°C и добавляли цианоборгидрид натрия (277 мг, 4,41 ммоль), и реакционную смесь перемешивали в течение 16 ч. Реакционную смесь затем концентрировали и остаток растворяли в DCM, промывали водой и высушивали над сульфатом натрия, фильтровали и концентрировали. Неочищенное вещество затем очищали с помощью FCC (0-8% 7 н. NH3 в MeOH/32% EtOAc/гептаны) с получением указанного в заголовке соединения (950 мг, 2,197 ммоль).
LCMS: Rt: 0,99 мин. (способ 2 LCMS); MS масса/заряд 407,3 [M+H]+.
Стадия 2. трет-Бутил-7-(4-(2-(бензилокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат
трет-Бутил-7-(4-(5-фтор-2-гидроксифенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат растворяли в MeCN (15 мл) и добавляли карбонат цезия (1432 мг, 4,39 ммоль) с последующим добавлением бензилбромида (0,276 мл, 2,307 ммоль). Реакционную смесь перемешивали при к. т. в течение 4 ч. и затем реакционную смесь фильтровали, промывали с помощью DCM и концентрировали. Неочищенное вещество затем очищали с помощью FCC (0-6% 7 н. NH3 в MeOH/24% EtOAc/гептаны) с получением указанного в заголовке соединения (986 мг, 1,985 ммоль).
LCMS: Rt: 1,30 мин. (способ 2 LCMS); MS масса/заряд 497,2 [M+H]+.
Стадия 3. 7-(4-(2-(Бензилокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан
трет-Бутил-7-(4-(2-(бензилокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-карбоксилат растворяли в DCM (3 мл) и добавляли TFA (3,01 мл, 39,1 ммоль). Реакционную смесь перемешивали при к. т. в течение 2 ч. и ее затем концентрировали и разбавляли с помощью DCM. Органический слой промывали с помощью 1 н. NaOH, высушивали над сульфатом натрия, фильтровали и концентрировали и применяли на следующей стадии без дополнительной очистки (775 мг, 1,955 ммоль).
LCMS: Rt: 2,32 мин. (способ 4 LCMS); MS масса/заряд 397,8 [M+H]+.
Стадия 4. 7-(4-(2-(Бензилокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
7-(4-(2-(Бензилокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан растворяли в THF (10 мл) и охлаждали до 0°C. Затем добавляли этил-5-бром-1,3,4-оксадиазол-2-карбоксилат (519 мг, 2,349 ммоль) с последующим добавлением DIPEA (0,82 мл, 4,70 ммоль). Реакционную смесь перемешивали в течение 2 ч. и затем реакционную смесь концентрировали и разбавляли с помощью DCM. Органический слой промывали водой и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток растворяли в THF (8 мл) и добавляли LiOH (493 мг, 11,74 ммоль) в воде (3 мл), и реакционную смесь перемешивали в течение 16 ч. Реакционную смесь охлаждали до -5°C и добавляли 6 н. HCl (3,26 мл, 19,57 ммоль), и реакционную смесь перемешивали в течение 2 ч. Карбонат натрия добавляли в реакционную смесь до достижения pH >12 и реакционную смесь концентрировали. Остаток растворяли в EtOAc и промывали солевым раствором и слой EtOAc концентрировали, и остаток очищали с помощью FCC (0-5% MeOH (1% 7 н. NH3 в MeOH)/DCM) с получением указанного в заголовке соединения (706 мг, 1,52 ммоль).
LCMS: Rt: 1,10 мин. (способ 2 LCMS); MS масса/заряд 465,4 [M+H]+.
Стадия 5. 2-(1-(2-(1,3,4-Оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенол
7-(4-(2-(Бензилокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан (706 мг, 1,52 ммоль) растворяли в MeOH (10 мл) и добавляли 10% Pd-C (162 мг) и реакционную смесь перемешивали в течение 16 ч. в атмосфере водорода. Реакционную смесь фильтровали и концентрировали и остаток очищали с помощью FCC (0-5% MeOH (1% NH3 в MeOH)/DCM) с получением указанного в заголовке соединения (385 мг, 1,018 ммоль).
LCMS: Rt: 0,74 мин. (способ 2 LCMS); MS масса/заряд 375,3 [M+H]+.
Стадия 6. (R)-7-(4-(2-((2-Оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан
В раствор DMF (4 мл) 2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенола (230 мг, 0,614 ммоль) добавляли 2-оксаспиро[3.3]гептан-6-ил-4-метилбензолсульфонат (промежуточное соединение 5M, 181 мг, 0,676 ммоль) и Cs2CO3 (400 мг, 1,229 ммоль). Полученную реакционную смесь перемешивали при 90°C в течение 3 ч. и затем неочищенное вещество разбавляли с помощью EtOAc, промывали водой и концентрировали. Неочищенное вещество затем очищали с помощью FCC (0-5% MeOH (7 н. NH3 в MeOH)/DCM) и дополнительно с помощью FCC (0-10% 7 н. NH3 в MeOH/40% EtOAc/гептаны) с получением рацемического продукта (210 мг, 0,437 ммоль). Некоторое количество этого материала (156 мг, 0,331 ммоль) затем подвергали хроматографии SFC для разделения двух энантиомеров (Lux Cellulose-4 (21×250 мм, 45% MeOH (10 мМ NH4OH), 80 г/мин.) с получением двух энантиомеров. Сравнение времени удерживания при SFC примера 2L (Rt: 3,41 мин. Lux-Cellulose-4, 3×100 мм, 3 мкм, 5→55% MeOH с 10 мМ NH4OH/CO2, 2,5 мл/мин.) продемонстрировало, что следующий пик при хиральном разделении (Rt: 3,43 мин. Lux-Cellulose-4, 3×100 мм, 3 мкм, 5→55% MeOH с 10 мМ NH4OH/CO2, 2,5 мл/мин.) имеет такую же стереохимию, как пример 2L. На основе этих данных продукт, соответствующий исходному пику при хиральном разделении, представляет собой указанный в заголовке пример (69 мг, 0,144 ммоль).
SFC: Rt: 3,17 мин.; Lux-Cellulose-4, 3×100 мм, 3 мкм, 5→55% MeOH с 10 мМ NH4OH/CO2, 2,5 мл/мин.
LCMS: Rt: 1,99 мин. (способ 4 LCMS); MS масса/заряд 471,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) δ 8,38 (s, 1H), 6,90 (dd, J=9,8, 3,1 Гц, 1H), 6,87-6,79 (m, 1H), 6,71 (dd, J=8,9, 4,5 Гц, 1H), 4,75 (s, 2H), 4,67 (s, 2H), 4,53 (p, J=6,5 Гц, 1H), 4,35-4,24 (m, 2H), 4,17 (q, J=8,6 Гц, 2H), 4,06 (dd, J=8,8, 6,9 Гц, 1H), 3,76 (dd, J=8,8, 7,3 Гц, 1H), 3,15-3,04 (m, 2H), 3,00-2,85 (m, 2H), 2,85-2,76 (m, 2H), 2,54 (dd, J=13,0, 7,4 Гц, 1H), 2,32-2,11 (m, 5H), 1,80 (m, 2H), 1,68 (m, 2H).
2. Биологическая активность и селективность нового химического вещества в отношении стабильных клеточных линий M1, M2, M3, M4, и M5
Вышеописанные примеры характеризовали с помощью измерения внутриклеточной мобилизации ионов Ca++, обусловленной событиями передачи сигнала, опосредованной рецептором. Уровни потока внутриклеточного кальция улавливали с помощью высокочувствительного индикатора для Ca++, набора для анализа кальция (BD Biosciences, номер по каталогу 640178). Мониторинг флуоресцентной активности всех рецепторов проводили с помощью флуоресцентного визуализатора, FDSS 7000EX (Hamamatsu), в течение промежутка времени, составляющего 3 минуты. Изменение потока кальция легко улавливали при активации мускариновым ортостерическим агонистом, карбахолом.
Поддержание клеточной линии CHRM4
Клетки CHO-K1, стабильно экспрессирующие клонированный рецептор человека CHRM4 (клетки M4_CHO), выращивали и поддерживали в монослойной культуре с F12/HAM (Life Technologies) с добавлением 10% фетальной бычьей сыворотки, 1X пенициллина-стрептомицина и 0,4 мг/мл генетицина в увлажненной атмосфере (5% CO2) при 37°C. Культуры выращивали до 80-90% конфлюентности в колбах T150 (Corning) и промывали с помощью 1X DPBS, затем отделяли 0,05% трипсином (Life Technologies). Клетки собирали в среду для роста, затем осаждали (1 тысяча об./мин., 3 минуты) и криоконсервировали с применением среды для восстановления замороженной культуры клеток (Gibco Technologies). Клетки хранили в жидком азоте и размораживали за один день перед анализом.
Поддержание клеточной линии CHRM1
Клонированный рецептор человека M1 (CHRM1) стабильно экспрессировался в клетках HEK293 и такие клетки выращивали и поддерживали в монослойной культуре с DMEM с высоким содержанием глюкозы (Life Technologies) с добавлением 10% фетальной бычьей сыворотки, 1X пенициллина-стрептомицина и 0,5 мг/мл генетицина в увлажненной атмосфере (5% CO2) при 37°C. Культуры выращивали до 90% конфлюентности в колбах T150 (Corning) и промывали с помощью 1X DPBS и отделяли 0,05% трипсином (Life Technologies). Затем клетки осаждали (1 тысяча об./мин., 3 минуты) и замораживали с применением среды для восстановления замороженной культуры клеток (Gibco Technologies). Клетки хранили в жидком азоте и размораживали за один день перед анализом.
Поддержание клеточной линии CHRM2
Клетки CHO-K1, стабильно экспрессирующие клонированный рецептор человека CHRM2 (клетки M2_CHO), выращивали и поддерживали в монослойной культуре F12/HAM (Life Technologies) с добавлением 10% фетальной бычьей сыворотки, 1X пенициллина-стрептомицина и 0,4 мг/мл генетицина в увлажненной атмосфере (5% CO2) при 37°C. Культуры выращивали до 80-90% конфлюентности в колбах T150 (Corning) и промывали с помощью 1X DPBS, и отделяли 0,05% трипсином (Life Technologies). Затем клетки осаждали (1 тысяча об./мин., 3 минуты) и замораживали с применением среды для восстановления замороженной культуры клеток (Gibco Technologies). Клетки хранили в жидком азоте и размораживали за один день перед анализом.
Поддержание клеточных линий CHRM3 и CHRM5
Клетки CHO-K1, стабильно экспрессирующие клонированный рецептор человека CHRM3 (клетки M3_CHO), выращивали и поддерживали в монослойной культуре F12/HAM (Life Technologies) с добавлением 10% фетальной бычьей сыворотки, 1X пенициллина-стрептомицина и 0,4 мг/мл генетицина в увлажненной атмосфере (5% CO2) при 37°C. Культуры выращивали до 80-90% конфлюентности в колбах T150 (Corning) и промывали с помощью 1X DPBS, и отделяли 0,05% трипсином (Life Technologies). Затем клетки осаждали (1 тысяча об./мин., 3 минуты) и замораживали с применением среды для восстановления замороженной культуры клеток (Gibco Technologies). Клетки хранили в жидком азоте и размораживали за один день перед анализом. Подобную процедуру применяли в отношении клеток, стабильно экспрессирующих клонированный рецептор человека CHRM5 (M5_CHO).
Анализ потока Ca++ в линии клеток CHRM4
За день до анализа стабильно экспрессирующие клетки M4_CHO размораживали и высевали в черные 384-луночные планшеты с прозрачным дном, обработанные для ТС (Greiner кат. № 781091), при 12000 клеток/лунка с применением среды F12/HAM с добавлением 10% FBS (Life Technologies), и оставляли на ночь в увлажненной атмосфере (5% CO2) при 37°C. На следующий день к клеткам помещали 20 мкл красителя Ca++ (BD Biosciences) с применением буфера для загрузки (HBSS +Ca/+Mg, 20 мМ HEPES, 2,5 мМ пробенецид) и их снова помещали в инкубатор для клеток в течение как минимум 1 часа. После инкубации краситель заменяли 45 мкл буфера для анализа (HBSS -Ca/-Mg, 20 мМ HEPES, 2,5 мМ пробенецид) с добавлением 20 мкМ ATP (Sigma Aldrich) и оставляли при комнатной температуре в темноте в течение 60 минут перед осуществлением прогона в устройстве для визуализации клеток. FDSS 7000EX (Hamamatsu) применяли для улавливания следов Ca++ в течение промежутка времени, составляющего 3 минуты, из клеток, обработанных 11 разовыми дозами соединения в трех повторностях, с целью получения кривых доза-ответ в агонистическом способе. Все соединения последовательно разбавляли в DMSO, затем готовили в буфере для анализа для исследований потока Ca++. Кривые доза-ответ получали из среднего для трех повторностей лунок, полученных для каждой точки данных, и применяли нелинейный регрессионный анализ четырех параметров алгоритма доза-ответ. Процент активности (PA) измеряли по отношению к EC100 карбахола.
Анализ потока Ca++ в линии клеток CHRM1
За день до анализа стабильно экспрессирующие M1 клетки HEK293 размораживали и высевали в черные 384-луночные планшеты с прозрачным дном, обработанные для ТС (Greiner кат. № 781091), при 25000 клеток/лунка с DMEM с высоким содержанием глюкозы с добавлением 10% FBS (Hyclone) пенициллина-стрептомицина (Life Technologies) и оставляли на ночь в увлажненной атмосфере (5% CO2) при 37°C. На следующий день к клеткам помещали 20 мкл красителя Ca++ (BD Biosciences) с применением буфера для загрузки (HBSS +Ca/+Mg, 20 мМ HEPES) и их снова помещали в инкубатор для клеток в течение как минимум 1 часа. Краситель заменяли 45мкл буфера для анализа (HBSS -Ca/-Mg, 20мМ HEPES) и оставляли при комнатной температуре перед осуществлением прогона в клеточном визуализаторе. Соединения готовили в буфере для анализа и добавляли 5 мкл к клеткам. FDSS 7000EX (Hamamatsu) применяли для обнаружения следов Ca++ в течение 3 минут из клеток, обработанных 11 разовыми дозами в трех повторностях, с целью получения кривых доза-ответ в агонистическом способе. Все соединения последовательно разбавляли в DMSO, затем готовили в буфере для анализа для исследований потока Ca++. Кривые доза-ответ получали из среднего для трех повторностей лунок, полученных для каждой точки данных, и применяли нелинейный регрессионный анализ четырех параметров алгоритма доза-ответ. Процент активности (PA) измеряли по отношению к EC100 карбахола.
Анализ потока Ca++ в линии клеток CHRM2
За день до анализа стабильно экспрессирующие M2 клетки CHO размораживали и высевали в 384-луночный планшет Greiner, обработанный для TC, при плотности 12000 клеток/лунка, и оставляли на ночь в увлажненной атмосфере (5% CO2) при 37°C. На следующий день к клеткам помещали краситель Ca++ (BD Biosciences) с применением буфера для загрузки (HBSS +Ca/+Mg, 20 мМ HEPES, 2,5 мМ пробенецид) и их снова помещали в инкубатор для клеток в течение как минимум 1 часа и в течение как максимум 2 часов. После инкубации краситель заменяли буфером для анализа (HBSS -Ca/-Mg, 20 мМ HEPES, 2,5 мМ пробенецид) с добавлением 20 мкМ ATP (Sigma Aldrich) и оставляли при комнатной температуре в течение 60 минут до осуществления прогона в устройстве для визуализации клеток. FDSS 7000EX (Hamamatsu) применяли для обнаружения следов Ca++ из клеток в ответ на обработку соединением и данные применяли для получения кривых доза-ответ в агонистическом способе. Все соединения последовательно разбавляли в DMSO, затем готовили в буфере для анализа для исследований потока Ca++. Кривые доза-ответ получали из среднего для трех повторностей лунок, полученных для каждой точки данных, и применяли нелинейный регрессионный анализ четырех параметров алгоритма доза-ответ. Процент активности (PA) измеряли по отношению к EC100 карбахола.
Анализ потока Ca++ в линии клеток CHRM3 и CHRM5
За день до анализа стабильно экспрессирующие клетки M3_CHO или M5_CHO размораживали и высевали в черные 384-луночные планшеты Greiner, обработанные для TC, при 12000 клеток/лунка в F12/DMEM с добавлением 10% FBS (Hyclone), и оставляли на ночь в увлажненной атмосфере (5% CO2) при 37°C. На следующий день к клеткам помещали краситель Ca++ (BD Biosciences) с применением буфера для загрузки (HBSS +Ca/+Mg, 20 мМ HEPES, 2,5 мМ пробенецид) и их снова помещали в инкубатор для клеток в течение как минимум 1 часа. После инкубации краситель заменяли буфером для анализа (HBSS -Ca/-Mg, 20 мМ HEPES, 2,5 мМ пробенецид) и оставляли при комнатной температуре в темноте до осуществления прогона в устройстве для визуализации клеток. FDSS 7000EX (Hamamatsu) применяли для обнаружения следов Ca++ из клеток, обработанных 11 разовыми дозами, соответствующих ответу на соединения, в трех повторностях с целью получения кривых доза-ответ в агонистическом способе. Все соединения последовательно разбавляли в DMSO, затем готовили в буфере для анализа для исследований потока Ca++. Кривые доза-ответ получали из среднего для трех повторностей лунок, полученных для каждой точки данных, и применяли нелинейный регрессионный анализ четырех параметров алгоритма доза-ответ. Процент активности (PA) измеряли по отношению к EC100 карбахола.
Если пример тестировали при проведении анализа более одного раза, тогда значения, указанные ниже, представляют собой среднее геометрическое результатов из каждого независимого эксперимента.
Таблица 12. Общий обзор биологической активности
(мкМ)
PA
%
(мкМ)
%
(мкМ)
%
(мкМ)
%
(мкМ)
%
Тестирование новых соединений в анализе гиперлокомоции у индуцированной амфетамином мыши
Целью такого исследования является определение эффекта тестируемого соединения на гиперактивность у мышей, индуцированную стимулятором d-амфетамином. Клинически эффективные мускариновые антипсихотические средства, такие как ксаномелин, являются активными в данном анализе и, следовательно, они рассматриваются в качестве подходящего теста для новых агонистов M4. Исследования, описанные в данном отчете, проводили способом, одобренным Институтом биомедицинских исследований Novartis, в том числе Комитетом по уходу за животными и их использованию. Группы обработки рандомизировали и компенсировали с помощью камеры и прогона. Локомоторную активность оценивали в условиях теста "открытое поле" (40 см x 40 см). Каждую камеру огораживали светоизоляционными шторками и освещали светом LED. Мышей акклиматизировали к помещению в течение как минимум 60 минут и подвергали введению тестируемого препарата (носитель, доза 1, доза 2, доза 3, PO) прямо перед помещением в камеру для фазы привыкания (1-30 минут). После фазы привыкания мышам вводили либо d-амфетамин (2,0 мг/кг) или солевой раствор (IP), а также ксаномелин в качестве положительного контроля (1,0 мг/кг, SC), если они ранее не получали инъекцию PO тестируемого препарата. Объем вводимой пробы для всех вводимых проб составлял 10 мл/кг. Измерения получали посредством прерывания инфракрасных лучей с помощью аппаратного обеспечения Accuscan и программного обеспечения Superflex 5.6. Мониторинг локомоторной активности проводили в течение дополнительной 2-часовой фазы теста (31-150 минута) после инъекций амфетамина. Животных возвращали в их клетку для проживания и жилую локацию после получения заключения касательно теста.
Анализ данных
Все статистические анализы проводили с помощью Graphpad Prism 7.04. Значения AUC рассчитывали с помощью суммирования расстояния, пройденного во время каждых 10-минутных отрезков с лучами, и сравнивали посредством t-критерия или однофакторного ANOVA. Сравнение t-критерия AUC30-150 для группы, подвергнутой инъекции d-амфетамин-носитель, с таковым для группы, подвергнутой инъекции носитель-носитель, определило вызывает ли d-амфетамин эффективную стимуляцию активности. Проводили обычный однофакторный ANOVA для сравнения каждой группы, обработанной тестируемым соединением, с группой, обработанной d-амфетамином-средой-носителем, с применением критерия множественных сравнений Даннетта. Поскольку d-амфетамин прежде всего активен в течение первого часа фазы теста, такие анализы проводят в первую половину (31-90 минута). P-значение <0,05 считали статистически значимым. Данные для примера 1A и примера 2L показаны на фигуре 1. Данные для примера 3C и примера 3D показаны на фигуре 2. Данные для примера 4A и примера 5G показаны на фигуре 3.
В целом экспериментальные данные, представленные в данном документе, указывают на то, что раскрытые соединения являются сильными и высокоселективными агонистами рецептора M4 (см. таблица 12) и эффективными in vivo, как показала их эффективность в виде снижения гиперактивности, индуцированной стимулятором d-амфетамином, у мышей дозозависимым образом (см. фиг. 1-3).
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНДАЗОЛИЛИЗОКСАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ТАКИХ КАК ЗЛОКАЧЕСТВЕННОЕ НОВООБРАЗОВАНИЕ | 2020 |
|
RU2836662C2 |
| ОКСАДИАЗОЛЫ В КАЧЕСТВЕ АГОНИСТОВ МУСКАРИНОВОГО РЕЦЕПТОРА M1 И/ИЛИ M4 | 2019 |
|
RU2817018C2 |
| ИНГИБИТОРЫ ИОННОГО КАНАЛА, ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ И ПРИМЕНЕНИЕ | 2016 |
|
RU2746188C2 |
| ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ СПИРОПИПЕРИДИНИЛА И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2021 |
|
RU2839891C1 |
| КЛАСС БИФУНКЦИОНАЛЬНЫХ ХИМЕРНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ НАПРАВЛЕННОГО РАЗРУШЕНИЯ АНДРОГЕННЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2825000C2 |
| ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ МЕНИН-MLL | 2017 |
|
RU2799820C2 |
| Бициклические азотсодержащие соединения как агонисты М1 мускариновых рецепторов | 2019 |
|
RU2811601C1 |
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ЦИКЛИЧЕСКОЙ СТРУКТУРОЙ | 2018 |
|
RU2795119C2 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКИХ АМИНОВ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА ЕР4 | 2011 |
|
RU2565596C2 |
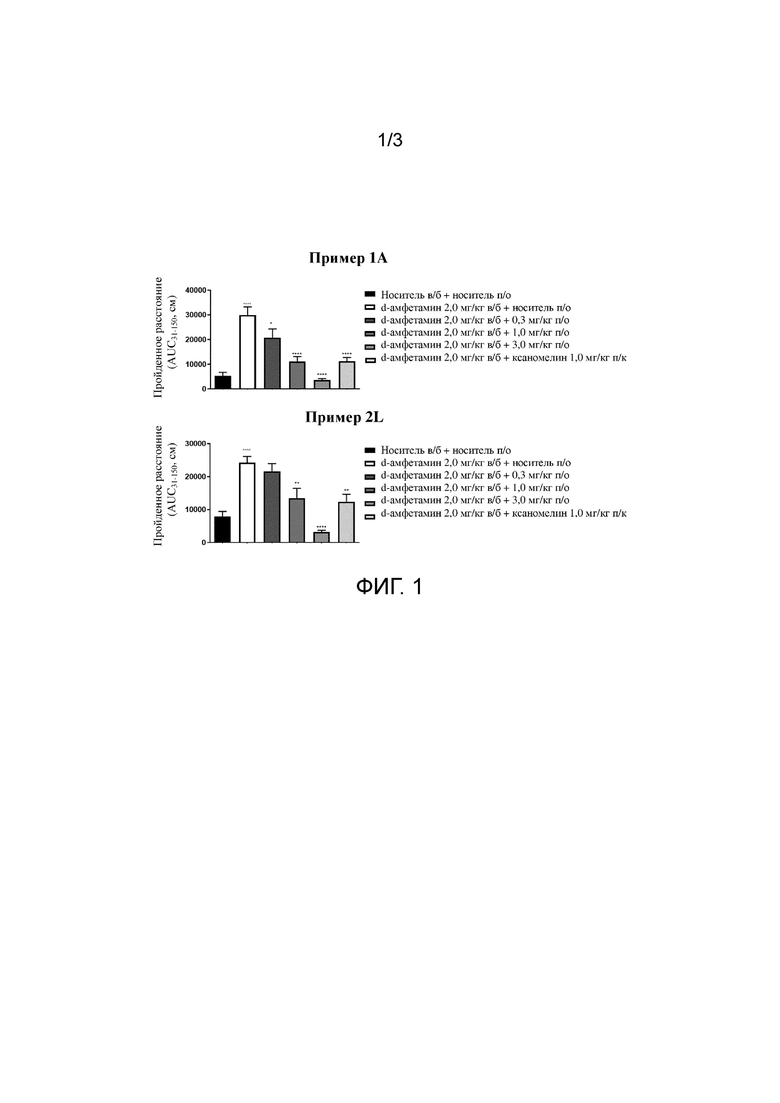
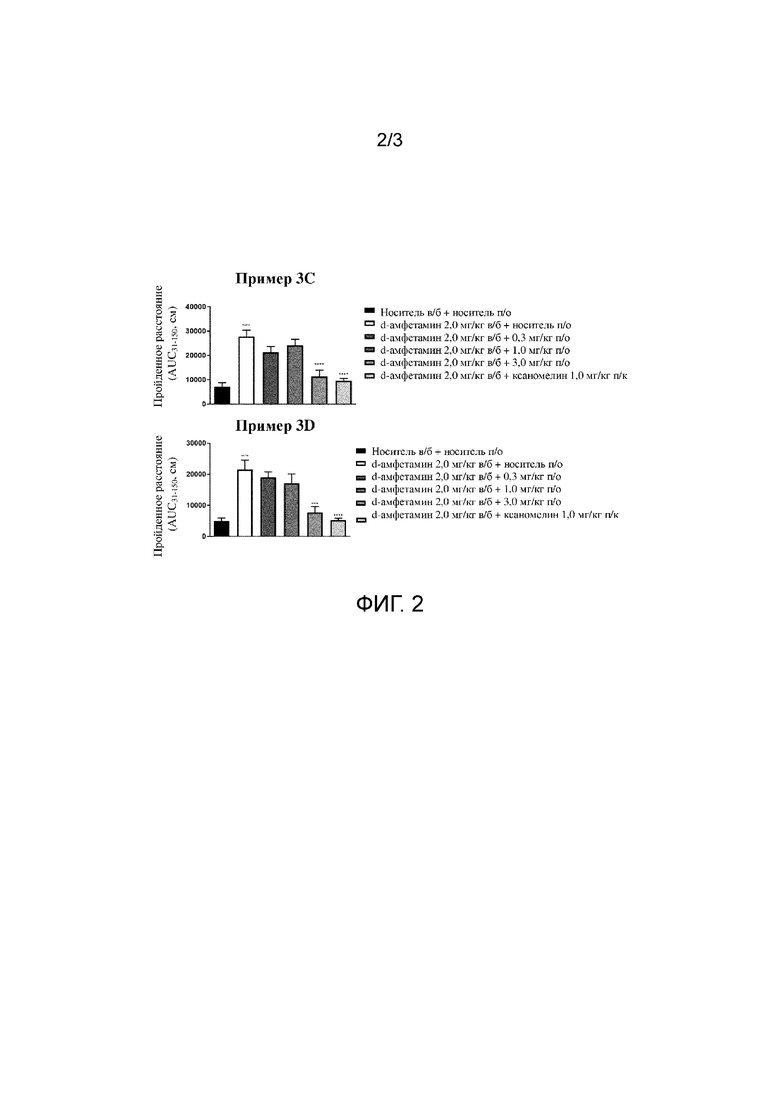
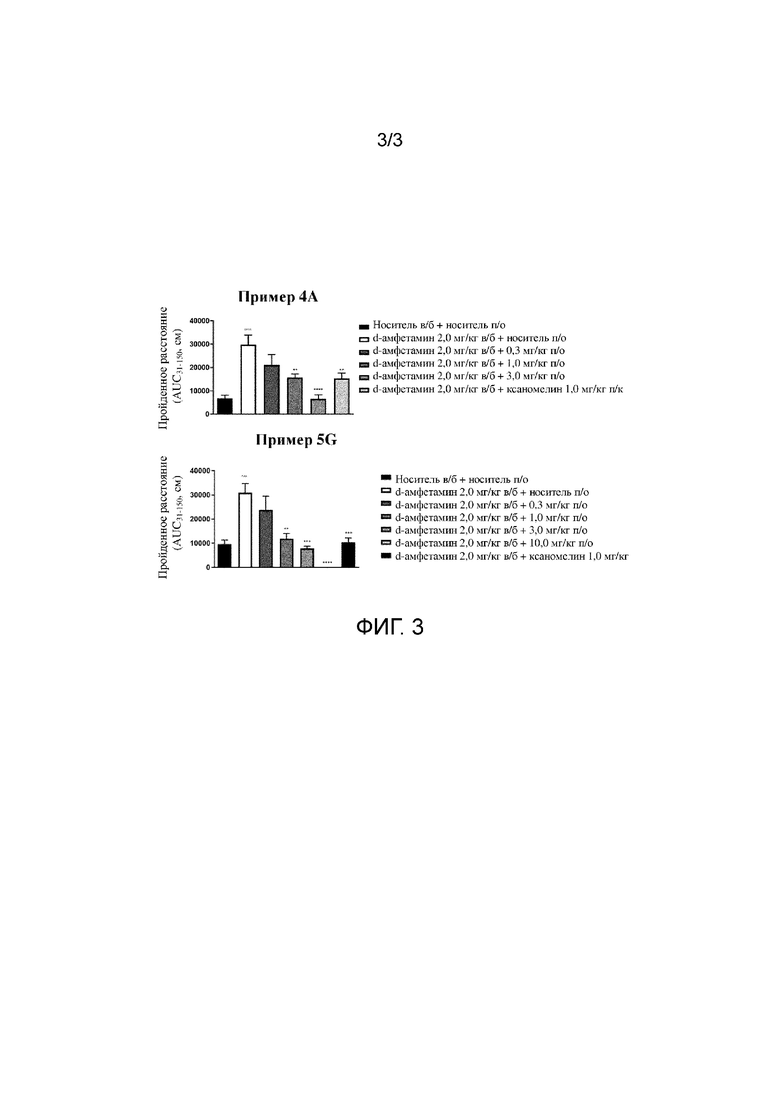
Изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где R1 представляет собой галоген или водород; R2 представляет собой галоген или водород; R3 представляет собой необязательно замещенный C1-3алкил, при этом указанный алкил необязательно замещен тетрагидропиранилом, необязательно замещенный 5-6-членный гетероарил, выбранный из группы, состоящей из пиримидинила, 1,3,4-оксадиазолила и оксазолила, при этом указанный гетероарил необязательно замещен одним C1-3алкилом, необязательно замещенный 4-6-членный гетероциклоалкил, выбранный из группы, состоящей из тетрагидрофуранила и тетрагидропиранила, при этом указанный гетероциклоалкил необязательно замещен одним -OH, необязательно замещенный 4-6-членный циклоалкил, при этом указанный циклоалкил необязательно замещен одним -OH; или -OR4; R4 представляет собой необязательно замещенный C1-5алкил, при этом указанный алкил необязательно замещен одним или двумя R6, необязательно замещенный 3-9-членный гетероциклоалкил, выбранный из группы, состоящей из оксетанила, тетрагидрофуранила, тетрагидропиранила, 1,3-диоксанила и 2-оксаспиро[3.3]гептанила, при этом указанный гетероциклоалкил необязательно замещен одним или двумя R6, или необязательно замещенный 4-6-членный циклоалкил, при этом указанный циклоалкил необязательно замещен одним, двумя или тремя R6; R5 представляет собой галоген или водород; каждый R6 независимо представляет собой галоген, -OH, -OCH3, -C(CH3)2OH, -CH2OH, циано, необязательно замещенный C1-4алкил, при этом указанный алкил необязательно замещен -OH, необязательно замещенный 4-7-членный гетероциклоалкил, выбранный из группы, состоящей из тетрагидрофуранила, 1,4-диоксанила, тетрагидропиранила, оксетанила, 2-оксаспиро[3.3]гептанила и 3-оксабицикло[3.1.0]гексанила, при этом указанный гетероциклоалкил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -OCH3 и C1-3алкила, или необязательно замещенный 5-6-членный гетероарил, выбранный из группы, состоящей из 1,3,4-тиадиазолила, 1,3,4-оксадиазолила, изоксазолила, пиримидинила и 1,2,4-оксадиазолила, при этом указанный гетероарил необязательно замещен одним C1-3алкилом; и R7 представляет собой 5-членный гетероарил, выбранный из группы, состоящей из 1,3,4-оксадиазолила, 1,3,4-тиадиазолила, оксазолила, 1,2,4-тиадиазолила и 1,2,4-оксадиазолила. Также изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) и к применению соединения формулы (I) для лечения психоза, ассоциированного с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией. Технический результат – соединение формулы (I), применяемое в качестве агониста рецептора М4. 3 н. и 21 з.п. ф-лы, 3 ил., 122 пр., 12 табл.
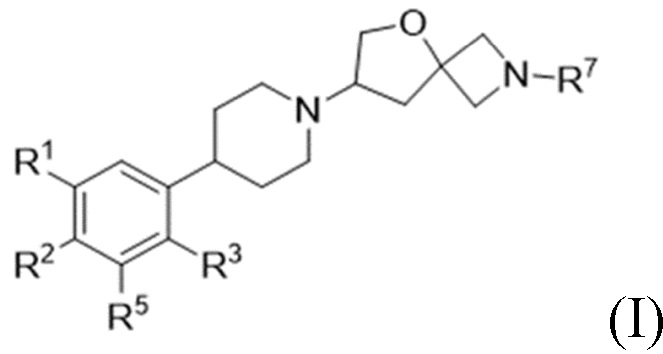
1. Соединение в соответствии с формулой (I)
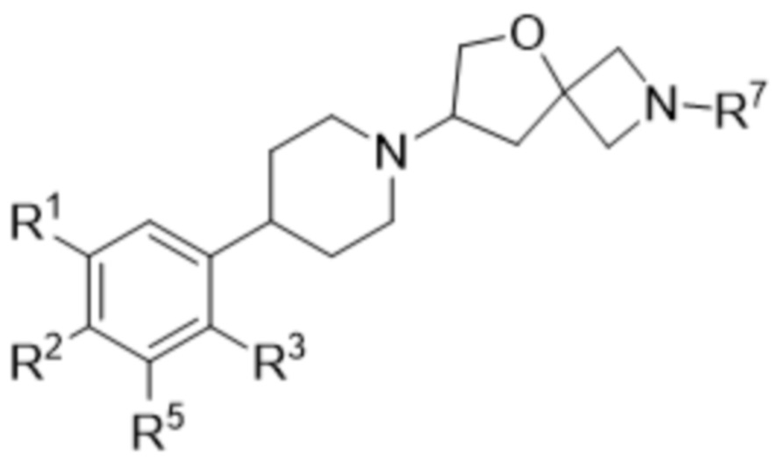 (I)
(I)
или его фармацевтически приемлемая соль,
где R1 представляет собой галоген или водород;
R2 представляет собой галоген или водород;
R3 представляет собой
необязательно замещенный C1-3алкил, при этом указанный алкил необязательно замещен тетрагидропиранилом,
необязательно замещенный 5-6-членный гетероарил, выбранный из группы, состоящей из пиримидинила, 1,3,4-оксадиазолила и оксазолила, при этом указанный гетероарил необязательно замещен одним C1-3алкилом,
необязательно замещенный 4-6-членный гетероциклоалкил, выбранный из группы, состоящей из тетрагидрофуранила и тетрагидропиранила, при этом указанный гетероциклоалкил необязательно замещен одним -OH,
необязательно замещенный 4-6-членный циклоалкил, при этом указанный циклоалкил необязательно замещен одним -OH; или
-OR4;
R4 представляет собой
необязательно замещенный C1-5алкил, при этом указанный алкил необязательно замещен одним или двумя R6,
необязательно замещенный 3-9-членный гетероциклоалкил, выбранный из группы, состоящей из оксетанила, тетрагидрофуранила, тетрагидропиранила, 1,3-диоксанила и 2-оксаспиро[3.3]гептанила, при этом указанный гетероциклоалкил необязательно замещен одним или двумя R6, или
необязательно замещенный 4-6-членный циклоалкил, при этом указанный циклоалкил необязательно замещен одним, двумя или тремя R6;
R5 представляет собой галоген или водород;
каждый R6 независимо представляет собой
галоген,
-OH,
-OCH3,
-C(CH3)2OH,
-CH2OH,
циано,
необязательно замещенный C1-C4алкил, при этом указанный алкил необязательно замещен -OH,
необязательно замещенный 4-7-членный гетероциклоалкил, выбранный из группы, состоящей из тетрагидрофуранила, 1,4-диоксанила, тетрагидропиранила, оксетанила, 2-оксаспиро[3.3]гептанила и 3-оксабицикло[3.1.0]гексанила, при этом указанный гетероциклоалкил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -OCH3 и C1-3алкила, или
необязательно замещенный 5-6-членный гетероарил, выбранный из группы, состоящей из 1,3,4-тиадиазолила, 1,3,4-оксадиазолила, изоксазолила, пиримидинила и 1,2,4-оксадиазолила, при этом указанный гетероарил необязательно замещен одним C1-3алкилом; и
R7 представляет собой 5-членный гетероарил, выбранный из группы, состоящей из 1,3,4-оксадиазолила, 1,3,4-тиадиазолила, оксазолила, 1,2,4-тиадиазолила и 1,2,4-оксадиазолила.
2. Соединение по п. 1 формулы (Ia)
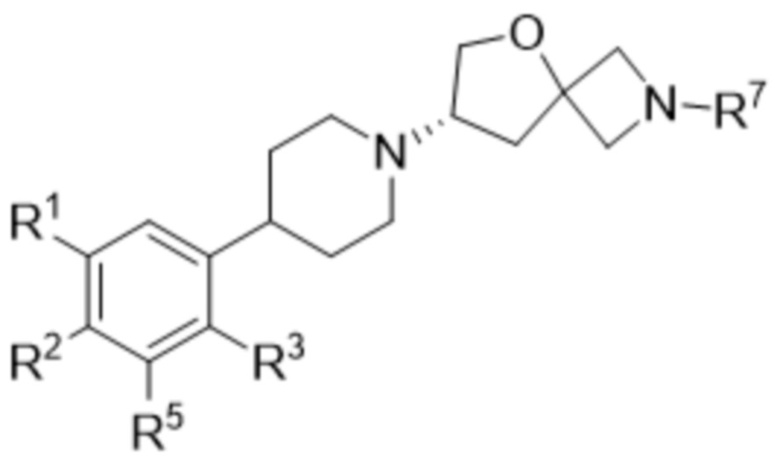
(Ia)
или его фармацевтически приемлемая соль или стереоизомер.
3. Соединение по п. 1 формулы (Ib)
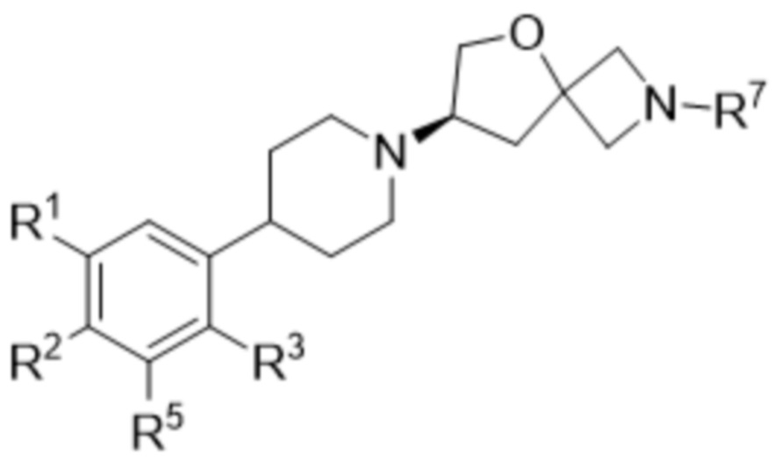
(Ib)
или его фармацевтически приемлемая соль или стереоизомер.
4. Соединение по любому из пп. 1-3, где R1 выбран из группы, состоящей из H, хлора и фтора.
5. Соединение по любому из пп. 1-4, где R1 представляет собой фтор.
6. Соединение по любому из пп. 1-5, где R2 представляет собой H или фтор.
7. Соединение по любому из пп. 1-6, где R5 представляет собой H или фтор.
8. Соединение по любому из пп. 1-3, где R1, R2 и R5 представляют собой H.
9. Соединение по любому из пп. 1-3, где R2 и R5 представляют собой H.
10. Соединение по любому из пп. 1-9, где R3 выбран из группы, состоящей из: 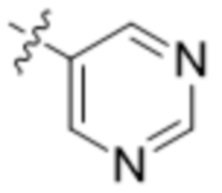 ,
, 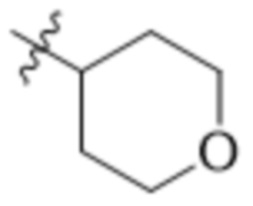 ,
, 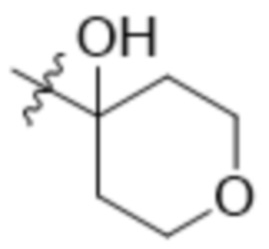 ,
, 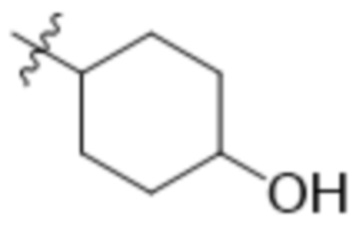 ,
, 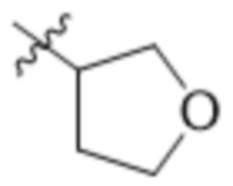 ,
, 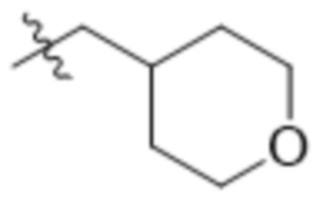 ,
, 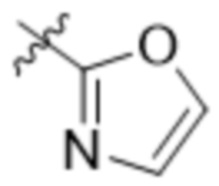 и
и 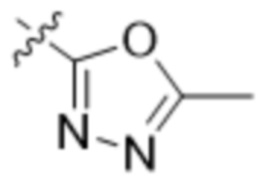 .
.
11. Соединение по любому из пп. 1-9, где R3 представляет собой -OR4.
12. Соединение по любому из пп. 1-11, где R4 выбран из группы, состоящей из CH3, -CH2CH2C(CH3)2OH, -CH2CH2C(CH3)2OCH3, -CH2CH2OCH3 и -CH2C(CH3)2OH.
13. Соединение по любому из пп. 1-11, где R4 выбран из группы, состоящей из: 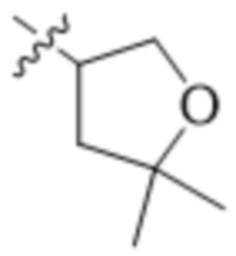 ,
, 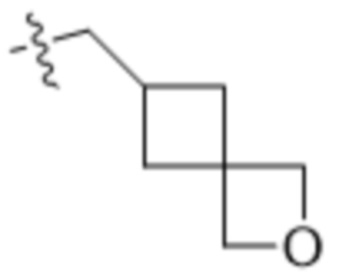 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 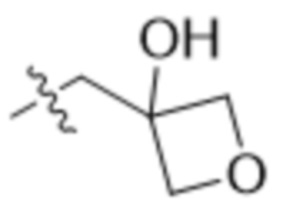 ,
, 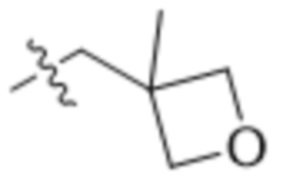 ,
, 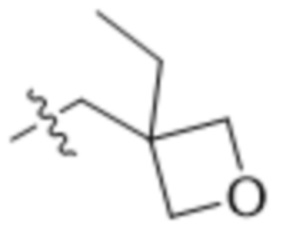 ,
, 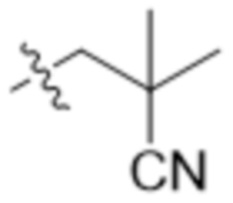 ,
, 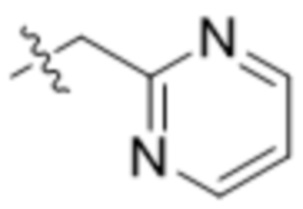 ,
, 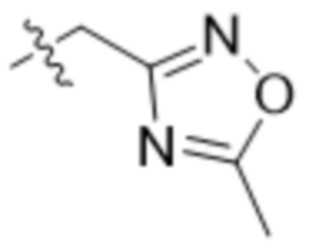 ,
, 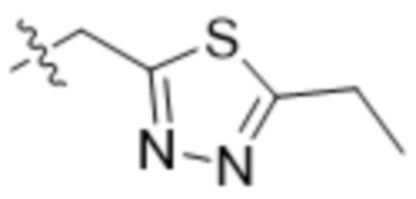 ,
, 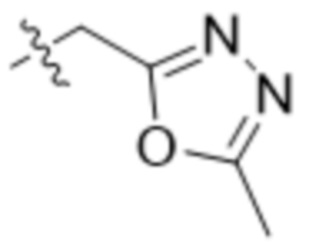 ,
, 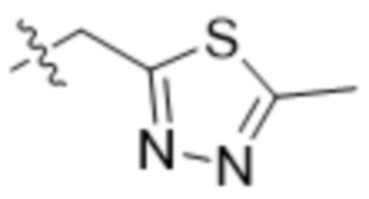 ,
, 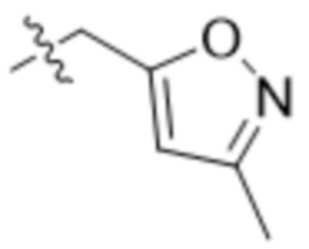 ,
, 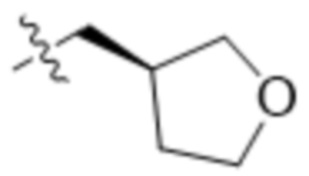 ,
, 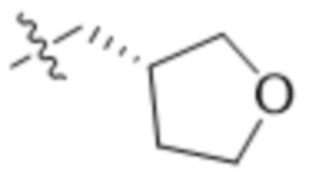 ,
, 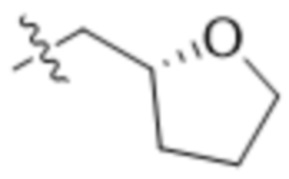 ,
, 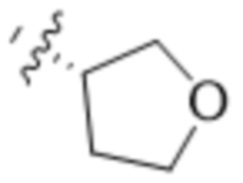 ,
, 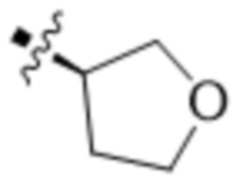 ,
, 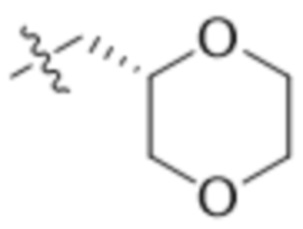 ,
, 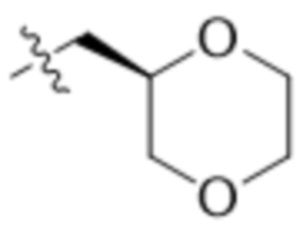 ,
, 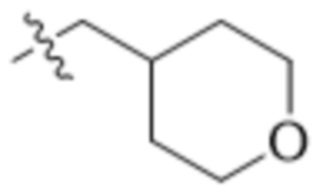 ,
, 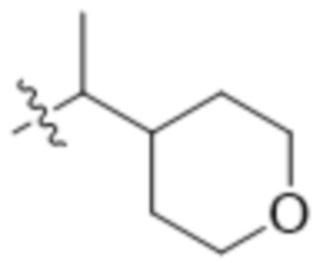 ,
, 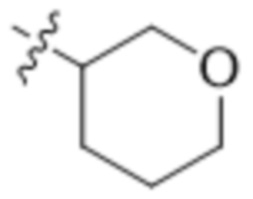 ,
, 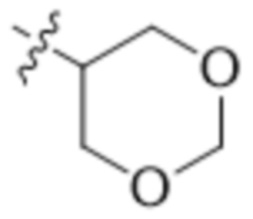 и
и 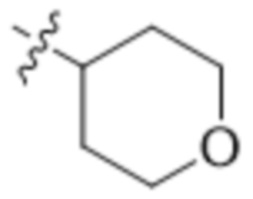 .
.
14. Соединение по любому из пп. 1-11, где R4 представляет собой C1-C5алкил и R6 независимо представляет собой циано-, -OH, -OCH3, 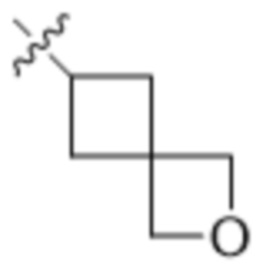 ,
, 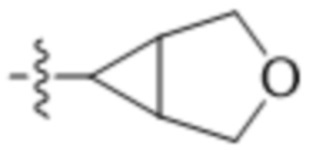 ,
,  ,
, 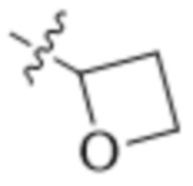 ,
, 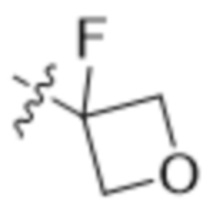 ,
, 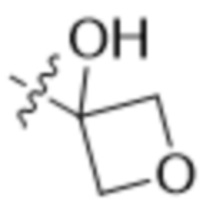 ,
, 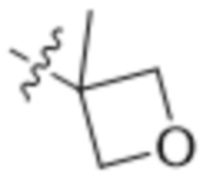 ,
,  ,
,  ,
,  ,
,  ,
, 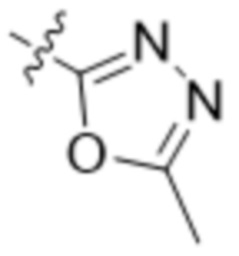 ,
, 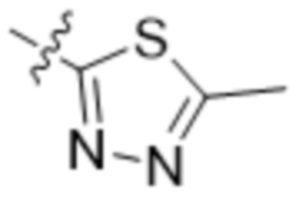 ,
, 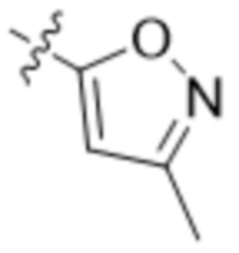 ,
, 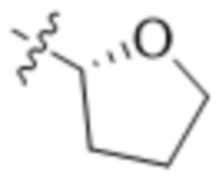 ,
,  ,
,  ,
, 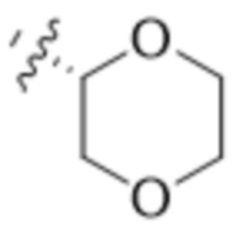 ,
, 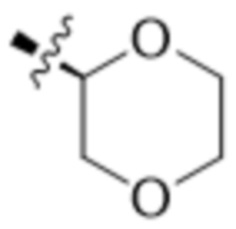 и
и  .
.
15. Соединение по любому из пп. 1-14, где R7 выбран из группы, состоящей из: 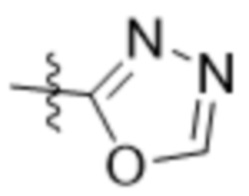 ,
, 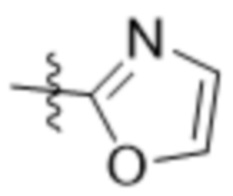 ,
, 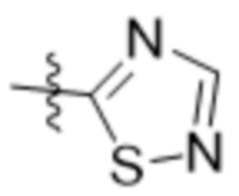 ,
, 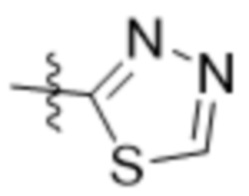 и
и 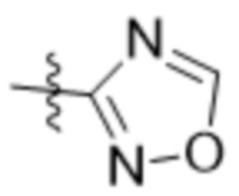 .
.
16. Соединение по п. 1, выбранное из группы, состоящей из:
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
этил-5-((S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан-2-ил)-1,3,4-оксадиазол-2-карбоксилата;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-3-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2,2-диметилпропаннитрила;
(S)-7-(4-(2-(((S)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((1,3-диоксан-5-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-4-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ола;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-4-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ола;
(S)-1-(2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(оксазол-2-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(5-метил-1,3,4-оксадиазол-2-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-метилоксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((R)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((S)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((R)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
трифторацетата (S)-7-(4-(5-фтор-2-(((S)-оксетан-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((5-метил-1,3,4-тиадиазол-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((5-метил-1,3,4-оксадиазол-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-метилизоксазол-5-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(пиримидин-2-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-фтороксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((3-метилоксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-2-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((S)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((S)-5,5-диметилтетрагидрофуран-3-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((3-этилоксетан-3-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидро-2H-пиран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((5-этил-1,3,4-тиадиазол-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-3-((2-(1-(2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)метил)оксетан-3-ола;
2-((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
2-((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
2-((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
2-((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)пропан-2-ола;
(S)-7-(4-(5-фтор-2-((S)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((S)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-1-(тетрагидро-2H-пиран-4-ил)этокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(7S)-7-(4-(2-((3-оксабицикло[3.1.0]гексан-6-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-3,5-дифторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(3,5-дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
((1S,3r)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
((1R,3s)-3-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)циклобутил)метанола;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((R)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((S)-тетрагидрофуран-3-ил)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(1,3,4-оксадиазол-2-ил)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)метил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(1R,4s)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(1S,4r)-4-(2-(1-((S)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенил)циклогексан-1-ола;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-метоксифенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(4-фтор-2-(1-(2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(оксетан-3-илметокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-((3-фтороксетан-3-ил)метокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-2-(оксазол-2-ил)-7-(4-(2-(пиримидин-5-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
2-((1R,3s)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
2-((1S,3r)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
2-((1R,3s)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
2-((1S,3r)-3-(4-фтор-2-(1-((S)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)циклобутил)пропан-2-ола;
(S)-2-(оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-2-(оксазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-хлор-2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(2-(1-(2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-((5-метил-1,2,4-оксадиазол-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((R)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((R)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-(((S)-1,4-диоксан-2-ил)метокси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4,5-дифтор-2-(((R)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(3-метокси-3-метилбутокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)окси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-4-(2-(1-(2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]oктан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилбутан-2-ола;
формиатной соли (S)-7-(4-(2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(2-метоксиэтокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(4-фтор-2-метоксифенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(2-(1-(2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-4-фторфенокси)-2-метилпропан-2-ола;
(S)-4-(2-(1-(2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)-5-фторфенокси)-2-метилбутан-2-ола;
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(((S)-тетрагидрофуран-3-ил)метокси)фенил)пиперидин-1-ил)-2-(1,3,4-тиадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-1-(2-(1-(2-(1,2,4-тиадиазол-5-ил)-5-окса-2-азаспиро[3.4]октан-7-ил)пиперидин-4-ил)фенокси)-2-метилпропан-2-ола;
(S)-7-(4-(5-фтор-2-((тетрагидро-2H-пиран-4-ил)окси)фенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октана;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октана и
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,2,4-оксадиазол-3-ил)-5-окса-2-азаспиро[3.4]октана.
17. Соединение по п. 16, где соединение выбрано из группы, состоящей из:
(S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру: 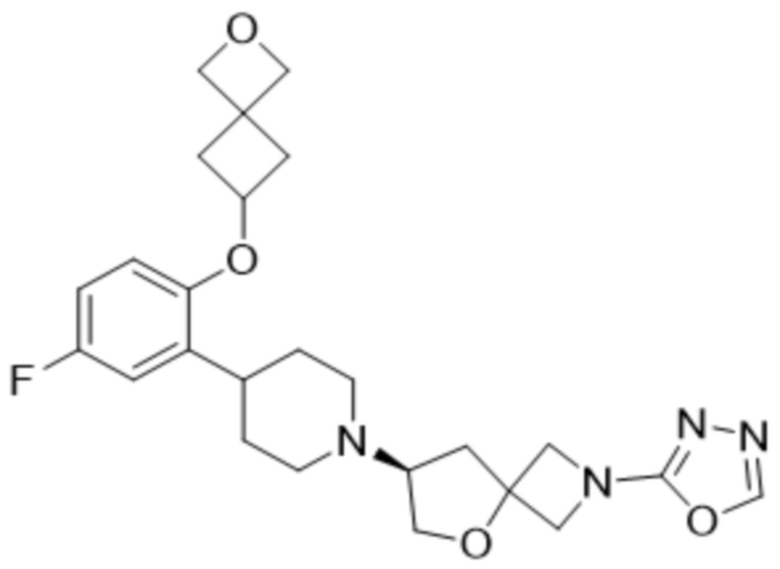 ;
;
(R)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру: 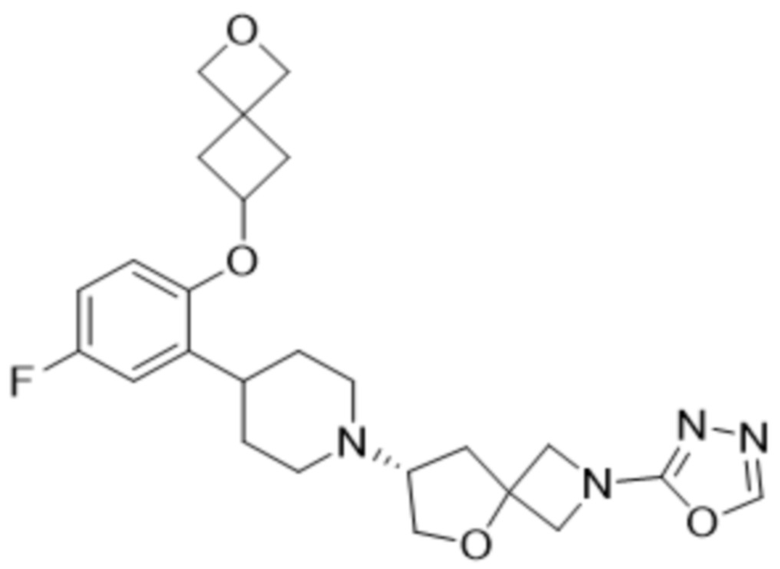 ;
;
(S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
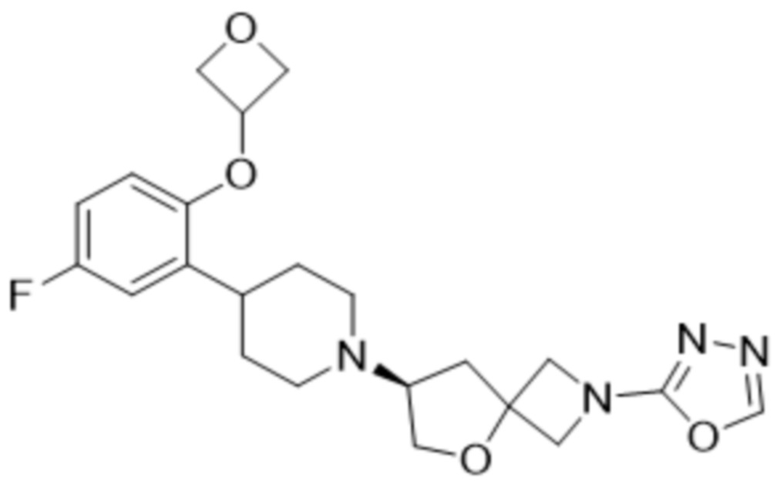 ; и
; и
(S)-2-(оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октана, имеющего следующую структуру:
 ,
,
или его фармацевтически приемлемая соль.
18. Соединение по п. 16, где соединение представляет собой (S)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:  ,
,
или его фармацевтически приемлемая соль.
19. Соединение по п. 16, где соединение представляет собой (R)-7-(4-(2-((2-оксаспиро[3.3]гептан-6-ил)окси)-5-фторфенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:
 ,
,
или его фармацевтически приемлемая соль.
20. Соединение по п. 16, где соединение представляет собой (S)-7-(4-(5-фтор-2-(оксетан-3-илокси)фенил)пиперидин-1-ил)-2-(1,3,4-оксадиазол-2-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:
 ,
,
или его фармацевтически приемлемая соль.
21. Соединение по п. 16, где соединение представляет собой (S)-2-(оксазол-2-ил)-7-(4-(2-(тетрагидро-2H-пиран-4-ил)фенил)пиперидин-1-ил)-5-окса-2-азаспиро[3.4]октан, имеющий следующую структуру:
 ,
,
или его фармацевтически приемлемая соль.
22. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп. 1-21 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, для лечения психоза, ассоциированного с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией.
23. Применение терапевтически эффективного количества соединения по любому из пп. 1-21 или его фармацевтически приемлемой соли для лечения психоза, ассоциированного с шизофренией, шизоаффективным расстройством, психотической депрессией, биполярным расстройством с психотическими чертами, болезнью Альцгеймера или лобно-височной деменцией.
24. Применение по п. 23, где психоз ассоциирован с болезнью Альцгеймера.
| Шпунтубель | 1930 |
|
SU27179A1 |
| Бициклические азотсодержащие соединения как агонисты М1 мускариновых рецепторов | 2015 |
|
RU2685230C2 |
| WO 2006058294 A2, 01.06.2006 | |||
| WO 2017021728 A1, 09.02.2017 | |||
| WO 2010084499 A9, 29.07.2010. | |||
Авторы
Даты
2024-06-04—Публикация
2020-10-07—Подача