Область техники
[0001]
Настоящее изобретение относится к антителу против SIRPα, используемому для лечения опухолей, и к противоопухолевому агенту, содержащему это антитело.
Предшествующий уровень техники
[0002]
SIRPα (SHPS-1) - это однопроходная трансмембранная молекула, принадлежащая к суперсемейству Ig, которая присутствует в миелоидных клетках, таких как макрофаги, дендритные клетки и нейтрофилы, а также в клетках глии (непатентная литература 1). Ее внеклеточная область состоит из одного домена IgV и двух доменов IgC, и сообщалось о 10 различных вариантах для домена IgV, который является сайтом связывания с CD47 у человека (непатентная литература 2). Внутриклеточная область содержит иммунорецепторный мотив ингибирования на основе тирозина (ITIM), и связывание с CD47 индуцирует связывание с тирозинфосфатазами SHP-1 и SHP-2, что приводит к передаче ингибирующего сигнала.
[0003]
Примером физиологических явлений, возникающих в результате взаимодействия SIRPα-CD47, является то, что, когда CD47 на эритроците связывается с SIRPα на макрофаге, передается сигнал «Не ешь меня» для предотвращения ненужного фагоцитоза эритроцита (непатентная литература 3). Также было высказано предположение, что связывание SIRPα, присутствующего на макрофагах и дендритных клетках, с CD47, высоко экспрессируемым в опухолевых клетках, ингибирует фагоцитарную активность против опухолевых клеток в микроокружении опухоли. Ожидается, что ингибирование фагоцитарной активности приведет к последующему ингибированию презентации опухолевого антигена Т-клеткам и, кроме того, к ингибированию иммунных ответов на опухоль. Таким образом, иммунный феномен фагоцитоза опухолевых клеток считается контрольной точкой поглощения (проникновения) опухолевого антигена.
[0004]
До сих пор сообщалось, что фагоцитарная активность против опухолевых клеток усиливается, когда взаимодействие SIRPα-CD47 ингибируется антителом против CD47, который является лигандом для SIRPα (непатентная литература 4), и аналогичные явления были описаны в использование антитела против SIRPα в комбинации с противоопухолевым антителом, которое обладает эффекторной активностью по привлечению опухолевых клеток к иммунным клеткам (непатентная литература 5 и 6). Кроме того, было высказано предположение, что не только противоопухолевые эффекты, но и противоопухолевый иммунитет индуцируются, когда антитело против CD47 используется в модели мышей с аллогенной опухолью (непатентная литература 7), и поэтому ожидается, что антитело против SIRPα может иметь аналогичные эффекты при использовании в комбинации с противоопухолевыми антителами.
[0005]
Между тем, в качестве ингибиторов иммунных контрольных точек было разработано множество антител против иммуноингибирующих молекул на Т-клетках, таких как PD-1/PD-L1, которые, как было доказано, являются клинически эффективными (непатентная литература 8 и 9). В настоящее время SIRPα-CD47 является единственной идентифицированной молекулой, которая ингибирует фагоцитоз, и ожидается, что антитело, которое ингибирует эту молекулу, станет новым потенциальным ингибитором контрольных точек против мишеней, отличных от Т-клеток, а также может быть широко эффективным у пациентов, которые не отвечают на стандартные ингибиторы иммунных контрольных точек.
[0006]
К настоящему времени исследование с использованием антитела против SIRPα мыши (MY-1) в модели, в которой лимфома Беркитта человека была подкожно трансплантирована, показало, что противоопухолевые эффекты проявляются, когда антитело используется в комбинации с ритуксимабом. На модели рака толстой кишки у мышей было показано противоопухолевое действие при использовании в комбинации с антителом PD-1 (непатентная литература 5). Кроме того, исследование с использованием антитела против mSIRPα (P84) из различных клонов показало, что использование в комбинации с антителом против PD-L1 или антителом против 4-1BB также проявляет противоопухолевые эффекты и эффекты, продлевающие жизнь, в модели рака печени мыши. Учитывая, что дальнейшие противоопухолевые эффекты и эффекты полной ремиссии были достигнуты, когда одни и те же опухолевые клетки были повторно трансплантированы мышам, демонстрирующим эффекты полной ремиссии, сильные иммунные противоопухолевые ответы могут быть вызваны путем ингибирования различных иммунных контрольных точек (патентная литература 1). Эти результаты являются примерами эффектов, проявляемых при использовании антитела против SIRPα мыши в сочетании не только с обычными противоопухолевыми антителами, которые, как ожидается, обладают эффекторной активностью, но также с ингибиторами иммунных контрольных точек, нацеленными на Т-клетки, и ожидается, что антитело против SIRPα человека может проявлять аналогичные эффекты.
В последние годы о патентах на антитела против SIRPα последовательно сообщали различные компании (патентная литература 1, 2 и 3). Например, OSE-172 представляет собой антитело IgG4Pro, которое связывается с SIRPα V1 и SIRPβ1, но не связывается с SIRPα V2 или SIRPγ. KWAR23 представляет собой антитело IgG1N279A, которое связывается с 10 различными вариантами SIRPα, SIRPβ1 и SIRPγ. ADU-1805 представляет собой антитело IgG2, которое связывается с 10 различными вариантами SIRPα и с SIRPγ. Антитело, которое является наиболее подходящим в качестве лекарственного средства среди этих антител, остается неизвестным, и продолжают предприниматься попытки получить лучшее антитело.
[0007]
Кроме того, в исследовании с использованием антитела против CD47 сообщалось, что достаточные противоопухолевые эффекты и эффекты полной ремиссии также проявляются при использовании в комбинации с химиотерапевтическими агентами и лучевой терапией, которые использовались в качестве стандартного лечения (SOC) в дополнение к лекарственным средствам в виде антител, описанным выше. В частности, в случаях использования в комбинации с химиотерапевтическими агентами более сильные противоопухолевые эффекты и эффекты полной ремиссии проявляются при введении химиотерапевтического агента перед антителом против CD47, чем при одновременном введении химиотерапевтического агента с антителом против CD47 (непатентная литература 7). Это открытие указывает на то, что эффекты поглощения антигена (иммуноактивация) за счет ингибирования взаимодействия SIRPα-CD47 могут быть усилены путем предварительного введения химиотерапевтического агента для подготовки среды, в которой опухолевые антигены могут легко поглощаться.
[0008]
Из вышеизложенного можно сделать вывод, что антитело против SIRPα представляет собой лекарственное средство, которое может вызывать более сильный иммунный противоопухолевый ответ при использовании в комбинации с различными противоопухолевыми средствами.
Список цитирования
Патентная литература
[0009]
Патентная литература 1: Международная публикация No. WO 2017/178653
Патентная литература 2: Международная публикация No. WO 2018/026600
Патентная литература 3: Международная публикация No. WO 2018/190719
Непатентная литература
[0010]
Непатентная литература 1: Matozaki et al. Trends Cell Biol. 2009; 19 (2), 72-80
Непатентная литература 2: Takenaka et al. Nat. Immunol. 2007; 8 (12), 1313-1323
Непатентная литература 3: Matozaki et al. Trends in Cell Biol. 2009; 19 (2), 72-80
Непатентная литература 4: Liu et al. PLOS ONE. 2015; 10 (9)
Непатентная литература 5: Yanagita et al. JCI Insight. 2017; 2 (1), 1-15
Непатентная литература 6: Ring et al. (1991 , PNAS. 2017; 114 (49), E10578-E10585
Непатентная литература 7: Liu et al. Nat. Med. 2015; 21 (10), 1209-1215
Непатентная литература 8: Lee et al. The Oncologist. 2017; 22 (11), 1392-1399
Непатентная литература 9: Weinstock et al. Clin. Can. Res. 2017; 23 (16), 4534-4539
Сущность изобретения
Техническая проблема
[0011]
Целью настоящего изобретения является предложение антитела против SIRPα, которое можно использовать в качестве противоопухолевого агента, и противоопухолевого агента, содержащего антитело в качестве активного ингредиента.
Решение проблемы
[0012]
Авторы настоящего изобретения исследовали способ усиления фагоцитарной активности фагоцитов против опухолевых клеток путем ингибирования взаимодействия между SIRPα, экспрессируемым в фагоците, обладающем фагоцитарной активностью, и CD47, экспрессируемым на опухолевой клетке, с помощью антитела против SIRPα для ингибирования передачи сигнала «Не ешь меня» от опухолевой клетки к фагоциту. Авторы настоящего изобретения попытались получить антитело, имеющее высокую аффинность к SIRPα и высокий эффект ингибирования взаимодействия между SIRPα и CD47, и они также рассмотрели получение антитела против SIRPα, не имеющего эффекторных функций, учитывая возможность того, что антитело против SIRPα, которое проявляет эффекторные функции, такие как ADCC и ADCP, может атаковать собственные иммунные клетки. Чтобы снизить эффекторные функции, в Fc-область антитела вводили мутацию для снижения эффекторных функций, и подкласс антитела был обозначен как IgG4. В результате может быть получено антитело против SIRPα, которое сильно ингибирует взаимодействие между SIRPα и CD47, но имеет пониженные эффекторные функции. Это антитело само по себе не обладает достаточным противоопухолевым действием, поскольку оно не связывается с рецептором Fc эффекторной клетки и, следовательно, не выполняет эффекторных функций. Соответственно, антитело использовали в комбинации с другими лекарственными средствами в виде антител, обладающими эффекторными функциями, или другими лекарственными средствами в виде антител, обладающими ингибирующим действием на иммунные контрольные точки. Было продемонстрировано, что антитело проявляет благоприятные противоопухолевые эффекты, и, таким образом, настоящее изобретение было выполнено.
[0013]
Таким образом, настоящее изобретение обеспечивает следующее.
[1]. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(а) CDRL1 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 1;
(b) CDRL2 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 2;
(c) CDRL3 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 3;
(d) CDRH1 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 4;
(e) CDRH2 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 5; и
(f) CDRH3 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 6.
[2]. Антитело по п.[1], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4 и имеет мутацию, которая снижает активность ADCC и/или ADCP.
[3]. Антитело по п.[1] или [2], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4, а фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, а серин в положении 228 заменен пролином.
[4]. Антитело по п.[3], где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 140-466 в SEQ ID NO: 25.
[0014]
[5]. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(ai) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-126 в SEQ ID NO: 23; или
(aii) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 21-126 в SEQ ID NO: 23, и обладающей активностью связывания с SIRPα человека; и
(bi) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-139 в SEQ ID NO: 25; или
(bii) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 20-139 в SEQ ID NO: 25, и обладающей активностью связывания с SIRPα человека,
где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4 и имеет мутацию, которая снижает активность ADCC и/или ADCP.
[6]. Антитело по п.[1] или [2], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4, а фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, а серин в положении 228 заменен пролином.
[7]. Антитело по п.[6], где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 140-466 в SEQ ID NO: 25.
[0015]
[8]. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(а) CDRL1 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 7;
(b) CDRL2 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 8;
(c) CDRL3 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 9;
(d) CDRH1 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 10;
(e) CDRH2 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 11; и
(f) CDRH3 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 12.
[9]. Антитело по п.[8], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4 и имеет мутацию, которая снижает активность ADCC и/или ADCP.
[10]. Антитело по п.[8] или [9], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4, а фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, а серин в положении 228 заменен пролином.
[11]. Антитело по п.[10], где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 139-465 в SEQ ID NO: 29.
[0016]
[12]. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(ai) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-127 в SEQ ID NO: 27; или
(aii) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 21-127 в SEQ ID NO: 27, и обладающей активностью связывания с SIRPα человека; и
(bi) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-138 в SEQ ID NO: 29; или
(bii) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 20-138 в SEQ ID NO: 29 и обладающей активностью связывания с SIRPα человека, где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4 и имеет мутацию, которая снижает активность ADCC и/или ADCP.
[13]. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47 по п.[12], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4, и фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, а серин в положении 228 заменен пролином.
[14]. Антитело по п.[13], где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 139-465 в SEQ ID NO: 29.
[0017]
[15]. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(а) CDRL1 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 13;
(b) CDRL2 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 14;
(c) CDRL3 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 15;
(d) CDRH1 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 16;
(e) CDRH2 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 17; и
(f) CDRH3 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 18.
[16]. Антитело по п.[15], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4 и имеет мутацию, которая снижает активность ADCC и/или ADCP.
[17]. Антитело по п.[15] или [16], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4, а фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, а серин в положении 228 заменен пролином.
[18]. Антитело по п.[17], где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 144-470 в SEQ ID NO: 33.
[0018]
[19]. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(ai) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-130 в SEQ ID NO: 31; или
(aii) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, имеющей, по меньшей мере, 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 21-130 в SEQ ID NO: 31, и обладающей активностью связывания с SIRPα человека; и
(bi) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-143 в SEQ ID NO: 33; или
(bii) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 20-143 в SEQ ID NO: 33, и обладающей активностью связывания с SIRPα человека,
где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4 и имеет мутацию, которая снижает активность ADCC и/или ADCP.
[20]. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47 по п.[19], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4, а фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, а серин в положении 228 заменен пролином.
[21]. Антитело по п.[20], где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 144-470 в SEQ ID NO: 33.
[0019]
[22]. Антитело по любому из пп.[1]-[4], которое представляет собой любое из следующих (1) - (8):
(1) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 в SEQ ID NO: 41; и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 в SEQ ID NO: 37;
(2) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 20-466 в SEQ ID NO: 41 и обладающей активностью связывания с SIRPα человека; и легкой цепи, состоящей из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотными остатками 21-234 в SEQ ID NO: 37 и обладающей активностью связывания с SIRPα человека;
(3) антитело, которое специфически связывается с SIRPα человека для ингибирования связывание человеческого SIRPα с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 в SEQ ID NO: 41; и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 в SEQ ID NO: 39;
(4) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 20-466 в SEQ ID NO: 41 и обладающей активностью связывания с SIRPα человека; и легкой цепи, состоящей из аминокислотной последовательности, имеющей, по меньшей мере, 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 21-234 в SEQ ID NO: 39 и обладающей активностью связывания с SIRPα человека;
(5) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 в SEQ ID NO: 43; и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 в SEQ ID NO: 35;
(6) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислот остатки 20-466 в SEQ ID NO: 43 и обладающей активностью связывания с SIRPα человека; и легкой цепи, состоящей из аминокислотной последовательности, имеющей, по меньшей мере, 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 21-234 в SEQ ID NO: 35, и обладающей активностью связывания с SIRPα человека;
(7) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 в SEQ ID NO: 43; и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 в SEQ ID NO: 37; и
(8) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 20-466 в SEQ ID NO: 43 и обладающей активностью связывания с SIRPα человека; и легкой цепи, состоящей из аминокислотной последовательности, имеющей, по меньшей мере, 95% идентичности последовательности с аминокислотной последовательностью, состоящей из аминокислотных остатков 21-234 в SEQ ID NO: 37, и обладающей активностью связывания с SIRPα человека.
[23]. Антитело по п.[22], где активность ADCC и/или ADCP снижена.
[0020]
[24]. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело связывается с эпитопом, содержащим Gln в положении 82, Lys в положении 83, Glu в положении 84 и Gly в положении 85 в человеческом SIRPα, представленном в SEQ ID NO: 57.
[25]. Антитело по п.[24], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4 и имеет мутацию, которая снижает активность ADCC и/или ADCP.
[26]. Антитело по п.[24] или [25], где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4, а фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, а серин в положении 228 заменен пролином.
[27]. Антитело по п.[26], где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 140-466 в SEQ ID NO: 25.
[28]. Антитело по любому из пп.[1]-[27], которое усиливает фагоцитарную активность макрофага.
[29]. Антитело по любому из пп.[1]-[28], где остаток лизина на карбоксильном конце тяжелой цепи удален.
[0021]
[30]. Антигенсвязывающий фрагмент антитела по любому из пп.[1]-[29].
[31]. Антигенсвязывающий фрагмент антитела по п.[30], отличающийся тем, что антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, F(ab')2, Fab' и scFv.
[32]. Фармацевтическая композиция, содержащая антитело по любому из пп.[1]-[29] или антигенсвязывающий фрагмент антитела по пп.[30] или [31] в качестве активного ингредиента.
[33]. Фармацевтическая композиция по п.[32], где фармацевтическая композиция представляет собой противоопухолевый агент.
[34]. Фармацевтическая композиция по п.[33], дополнительно содержащая ингибитор иммунной контрольной точки и/или антитело как лекарственное средство, которое специфически реагирует на опухолевый антиген с получением активности ADCC и/или ADCP, в качестве активного ингредиента противоопухолевого агента.
[35]. Фармацевтическая композиция, используемая в комбинации с ингибитором иммунной контрольной точки и/или антителом как лекарственным средством, которое специфически реагирует на опухолевый антиген с получением активности ADCC и/или ADCP, где фармацевтическая композиция содержит антитело по любому из пп.[1]-[29] или антигенсвязывающий фрагмент антитела по п.[30] или [31] в качестве активного ингредиента.
[36]. Фармацевтическая композиция по п.[34] или [35], где ингибитор иммунной контрольной точки представляет собой ингибитор связывания PD-L1 с PD-1 или ингибитор CTLA4.
[37]. Фармацевтическая композиция по п.[34] или [35], где антитело как лекарственное средство, которое специфически реагирует на опухолевый антиген с получением активности ADCC и/или ADCP, выбрано из группы, состоящей из антитела против CD20, антитела против HER2 и антитела против EGFR.
[38]. Фармацевтическая композиция по любому из пп.[33]-[37], где опухоль представляет собой опухоль одного или двух или более типов, выбранных из группы, состоящей из карциномы, саркомы, лимфомы, лейкоза, миеломы, герминомы, опухоли головного мозга, карциноида, нейробластомы, ретинобластомы и нефробластомы.
[39]. Фармацевтическая композиция по п.[38], где опухоль представляет собой опухоль одного типа или двух или более типов, выбранных из группы, состоящей из рака почки, меланомы, плоскоклеточного рака, базальноклеточного рака, рака конъюнктивы, рака полости рта, фарингеального рака, рака щитовидной железы, рака легкого, рака молочной железы, рака пищевода, рака желудка, рака двенадцатиперстной кишки, рака тонкого кишечника, рака толстой кишки, рака прямой кишки, рака аппендикса, рака анального канала, рака печени, рака желчного пузыря, рака желчных протоков, рака поджелудочной железы, рака надпочечников, рака мочевого пузыря, рака предстательной железы, рака матки, рака влагалища, липосаркомы, ангиосаркомы, хондросаркомы, рабдомиосаркомы, саркомы Юинга, остеосаркомы, недифференцированной плеоморфной саркомы, миксофибросаркомы, злокачественной периферической шванномы, ретроперитонеальной саркомы, синовиосаркомы, саркомы матки, желудочно-кишечной стромальной опухоли, лейомиосаркомы, эпителиоидной саркомы, B-клеточной лимфомы, NK/T-клеточной лимфомы, лимфомы Ходжкина, миелоидного лейкоза, лимфолейкоза, миелопролиферативного заболевания, миелодиспластического синдрома, множественной миеломы, рака яичек, рака яичников, нейроглиомы и менингиомы.
[40]. Полинуклеотид, состоящий из нуклеотидных последовательностей, кодирующих аминокислотные последовательности тяжелой цепи и легкой цепи антитела по любому из пп.[1]-[29].
[41]. Вектор, содержащий полинуклеотид по п.[40].
[42]. Клетка-хозяин, содержащая полинуклеотид по п.[40] или вектор по п.[41].
[43]. Способ получения антитела по любому из пп.[1]-[29], включающий культивирование клетки-хозяина по п.[42] и очистку антитела из культуры.
[44]. Антитело, полученное способом по п.[43].
[0022]
Настоящее описание включает в себя содержание, раскрытое в заявке на патент Японии № 2018-131116, приоритет в отношении которой испрашивается в настоящей заявке.
Полезные эффекты изобретения
[0023]
Антитело против SIRPα по настоящему изобретению эффективно ингибирует взаимодействие между SIRPα, экспрессируемым в фагоците, и CD47, экспрессируемым на опухолевой клетке, и ингибирует передачу сигнала «Не ешь меня» от опухолевой клетки к фагоциту, в то время как антитело безопасно, потому что оно не выполняет эффекторных функций и, следовательно, не атакует собственные иммунные клетки.
[0024]
Антитело против SIRPα по настоящему изобретению может проявлять превосходные противоопухолевые эффекты, когда оно используется в комбинации с другими лекарственными средствами антител, обладающими эффекторными функциями, или другими лекарственными средствами антител, обладающими ингибирующим действием в отношении контрольных иммунных точек.
Краткое описание чертежей
[0025]
[Фигура 1A] Фигура 1A иллюстрирует структуры конструкций SIRPA, используемых для анализа эпитопа антитела против SIRPA (A), и показывает реактивность антител крысы против SIRPA человека к каждой конструкции (B).
[Фигура 1B] На Фигуре 1B показана реактивность гуманизированных антител против SIRPA человека к конструкциям hmSIRPA, используемым для анализа эпитопа антител против SIRPA (i) - (iv), и аминокислотные последовательности конструкций SIRPA, используемые для анализа эпитопа антитела против SIRPA (v).
[Фигура 2] Фигура 2 иллюстрирует ленточную модель всей конструкции Fab-фрагмента антитела против SIRPA и SIRPA_V2_IgV.
[Фигура 3] Фигура 3 иллюстрирует взаимодействия между областями до бета 5 (A) и после бета 5 (B) человеческого SIRPA и антитела против SIRPA (антитело D13).
[Фигура 4] На Фигуре 4 показано сравнение аминокислотных последовательностей вариантов для части петли бета 5-6 человеческого SIRPA.
[Фигура 5] На Фигуре 5 показана активность ADCP против линии клеток рака желудка, когда антитело против SIRPA использовали в качестве единственного агента (A) и когда антитело против SIRPA использовали в комбинации с трастузумабом (B).
[Фигура 6] На Фигуре 6 показано связывание химерных антител против SIRPA человека (cD13, cF44 и cF63) с SIRPA человека.
[Фигура 7] Фигура 7 показывает связывание химерных антител против SIRPA человека (cD13, cF44 и cF63) с SIRPA обезьяны.
[Фигура 8A] На фигуре 8A показана ингибирующая активность химерных антител против SIRPA человека (cD13, cF44 и cF63) в отношении связывания SIRPA человека или обезьяны и CD47 [(i) SIRPA_V1, (ii) SIRPA_V2, (iii) SIRPA обезьяны].
[Фигура 8B] На Фигуре 8B показана ингибирующая активность химерных антител против SIRPA человека (изотипы cF44) в отношении связывания SIRPA человека или обезьяны и CD47 [(i) SIRPA_V1, (ii) SIRPA_V2, (iii) SIRPA обезьяны].
[Фигура 9] На Фигуре 9 показана активность ADCP против линии клеток лимфомы Беркитта, когда антитело против SIRPA используют в качестве единственного агента (A) и когда антитело против SIRPA используют в комбинации с ритуксимабом (B).
[Фигура 10] Фигура 10 показывает токсичность химерных антител против SIRPA человека в отношении РВМС и макрофагов. График A показывает ADCP-активность cD13, cF44 и cF63 против PBMC, график B показывает ADCP-активность антител cF44 с другой константной областью, а график C показывает соотношение присутствующих макрофагов.
[Фигура 11] На Фигуре 11 показано сравнение аминокислотных последовательностей вариабельной области тяжелой цепи антитела D13, вариабельной области тяжелой цепи hH1 гуманизированного антитела и вариабельной области тяжелой цепи hH2 гуманизированного антитела.
[Фигура 12] На фигуре 12 показано сравнение аминокислотных последовательностей вариабельной области легкой цепи антитела D13, вариабельной области легкой цепи hL2 гуманизированного антитела, вариабельной области тяжелой цепи hL3 гуманизированного антитела и вариабельной области легкой цепи hL4 гуманизированного антитела.
[Фигура 13A] Фигура 13A представляет собой графики, показывающие активность связывания гуманизированного антитела против SIRPA с вариантами SIRPA человека [(i) V1, (ii) V2, (iii) V3 и (iv) V4].
[Фигура 13B] Фигура 13B представляет собой графики, показывающие активность связывания гуманизированного антитела против SIRPA с вариантами SIRPA человека [(i) V5, (ii) V6, (iii) V7 и (iv) V8].
[Фигура 13C] Фигура 13C представляет собой графики, показывающие активность связывания гуманизированного антитела против SIRPA с вариантами SIRPA человека [(i) V9, (ii) V10, (iii) SIRPA обезьяны и (iv) с пустым контролем].
[Фигура 14A] Фигура 14A представляет собой графики, показывающие активность связывания гуманизированного антитела против SIRPA с мышиным SIRPA [(i) C57BL/6, (ii) BALB/c и (iii) 129sv].
[Фигура 14B] Фигура 14B представляет собой графики, показывающие активность связывания гуманизированного антитела против SIRPA с мышиным SIRPA [(i) NOD и (ii) пустой контроль].
[Фигура 15] Фигура 15 представляет собой графики, показывающие результаты оценки ингибирующей активности гуманизированного антитела против SIRPA в отношении связывания SIRPA человека (A и B) или обезьяны (C) и CD47.
[Фигура 16] Фигура 16 представляет собой графики, показывающие активность ADCP против линий опухолевых клеток (A и B, линия клеток Raji; C и D, линия клеток Ramos), когда гуманизированное антитело против SIRPA человека используется в качестве единственного агента (A и C) и когда гуманизированное антитело против SIRPA человека используется в комбинации с ритуксимабом (B и D).
[Фигура 17] Фигура 17 показывает нуклеотидную последовательность, кодирующую легкую цепь cD13, и аминокислотную последовательность легкой цепи cD13.
[Фигура 18] Фигура 18 показывает нуклеотидную последовательность, кодирующую тяжелую цепь cD13, и аминокислотную последовательность тяжелой цепи cD13.
[Фигура 19] Фигура 19 показывает нуклеотидную последовательность, кодирующую легкую цепь cF44, и аминокислотную последовательность легкой цепи cF44.
[Фигура 20] Фигура 20 показывает нуклеотидную последовательность, кодирующую тяжелую цепь cF44, и аминокислотную последовательность тяжелой цепи cF44.
[Фигура 21] Фигура 21 показывает нуклеотидную последовательность, кодирующую легкую цепь cF63, и аминокислотную последовательность легкой цепи cF63.
[Фигура 22] На фигуре 22 показана нуклеотидная последовательность, кодирующая тяжелую цепь cF63, и аминокислотную последовательность тяжелой цепи cF63.
[Фигура 23] Фигура 23 показывает нуклеотидную последовательность, кодирующую hL2, и аминокислотную последовательность hL2.
[Фигура 24] Фигура 24 показывает нуклеотидную последовательность, кодирующую hL3, и аминокислотную последовательность hL3.
[Фигура 25] Фигура 25 показывает нуклеотидную последовательность, кодирующую hL4, и аминокислотную последовательность hL4.
[Фигура 26] Фигура 26 показывает нуклеотидную последовательность, кодирующую hH1, и аминокислотную последовательность hH1.
[Фигура 27] Фигура 27 показывает нуклеотидную последовательность, кодирующую hH2, и аминокислотную последовательность hH2.
[Фигура 28] На Фигуре 28 показаны последовательности CDR антитела D13.
[Фигура 29] На Фигуре 29 показаны последовательности CDR антитела F44.
[Фиг.30] На Фигуре 30 показаны последовательности CDR антитела F63.
[Фигура 31] На Фигуре 31 показаны результаты оценки активности ингибирования связывания SIRPA человека_V1/CD47 различных антител против SIRPA человека (А), результаты оценки активности ингибирования связывания SIRPA человека_V2/CD47 различных антител против SIRPA человека (B), и значения IC50 для ингибирования активности связывания SIRPA человека_V1/CD47 или SIRPA человека_V2/CD47 разлиными антителами против SIRPA человека.
[Фигура 32] Фигура 32 представляет собой графики, показывающие результаты оценки связывания различных антител против SIRPA человека с SIRPB человека (A) и SIRPG человека (B), а также результаты отрицательного контроля для A и B (C).
[Фигура 33] Фигура 33 представляет собой графики, показывающие активность ADCP против линии клеток лимфомы Беркитта (Raji) при использовании различных антител против SIRPA человека в комбинации с ритуксимабом: реактивность при 10 мкг/мл при времени реакции 2 часа (A) и со временем реакции 16 часов (B), концентрационной зависимостью с временем реакции 2 часа (C) и собственной активностью ADCP, что означает фагоцитоз между макрофагами, различных антител против SIRPA человека (D). На каждом графике «Ab-» указывает на отрицательный контроль, к которому не добавляли антитело, а «+ Rmab» указывает на то, что одновременно добавляли ритуксимаб.
[Фигура 34] На фигуре 34 показаны аминокислотные последовательности тяжелой цепи антитела OSE-172 (OSE-172_hG4Pro) и легкой цепи (OSE-172_hK).
[Фигура 35] На Фигуре 35 показаны аминокислотные последовательности тяжелой цепи антитела KWAR23 (KWAR23_hG4Pro) и легкой цепи (KWAR23_hK).
[Фигура 36] На Фигуре 36 показаны аминокислотные последовательности тяжелой цепи антитела ADU-1805 (ADU-1805_hG2) и легкой цепи (ADU-1805_hK).
Описание вариантов осуществления
[0026]
Настоящее изобретение подробно описано ниже.
[0027]
Характеристики антитела против SIRPα
Настоящее изобретение представляет собой антитело против SIRPα, которое распознает внеклеточный домен IgV белка SIRPα и связывается с ним.
[0028]
Сигнальный регуляторный белок α (SIRPα) представляет собой однопроходную трансмембранную молекулу, принадлежащую суперсемейству Ig, которая присутствует в миелоидных клетках, таких как макрофаги, дендритные клетки и нейтрофилы, а также в клетках глии. Его внеклеточная область состоит из одного домена IgV и двух доменов IgC, и сообщалось о 10 различных вариантах от V1 до V10 для домена IgV, который является сайтом связывания CD47, у человека. Внеклеточный домен IgV белка SIRPα представляет собой домен IgV, который является одним из трех внеклеточных Ig-подобных доменов, составляющих белок SIRPα. Из вариантов V1 и V2 являются основными вариантами, и антитело против SIRPα по настоящему изобретению связывается со всеми вариантами, включая основные варианты V1 и V2. В настоящем изобретении «SIRPα» может называться «SIRPA».
[0029]
Аминокислотная последовательность человеческого белка SIRPα раскрыта под номером доступа в GenBank NP_001035111.
[0030]
Моноклональное антитело, используемое в настоящем изобретении, может быть получено в виде антитела, продуцируемого и секретируемого гибридомой, полученной иммунизацией млекопитающего, такого как мышь, крыса, кролик, хомяк, морская свинка, лошадь, обезьяна, собака, свинья, бык, коза, и овцы с SIRPα или его фрагментом в качестве иммуногена и слияния клетки селезенки и т.п. животного и миеломы. Гибридому можно получить известным способом.
[0031]
SIRPα также может быть химически синтезирован в качестве иммуногена на основе информации о последовательности, а также может быть получен в виде рекомбинантного белка известным способом, основанным на информации о последовательности ДНК, кодирующей белок.
[0032]
Скрининг на антитела можно проводить произвольным методом, но его достаточно провести предпочтительно с помощью клеточного ИФА с использованием животных клеток, трансфецированных ДНК, кодирующей SIRPα. Аминокислотная последовательность белка V1 человеческого SIRPα представлена в SEQ ID NO: 56 в списке последовательностей, а аминокислотная последовательность белка V2 человеческого SIRPα представлена в SEQ ID NO: 57 в списке последовательностей.
[0033]
Антитело против SIRPα по настоящему изобретению ингибирует связывание SIRPα и CD47.
Опухолевая клетка высоко экспрессирует CD47 и ускользает от фагоцитоза фагоцитом, когда SIRPα экспрессируется в фагоците, обладающем фагоцитарной активностью, и CD47 связываются и взаимодействуют друг с другом, передавая сигнал «Не ешь меня» фагоциту. Антитело против SIRPα ингибирует связывание SIRPα и CD47, подавляя передачу сигнала «Не ешь меня» от опухолевой клетки к фагоциту и тем самым усиливает фагоцитарную активность фагоцита против опухолевой клетки. В результате могут быть индуцированы противоопухолевые эффекты. Примеры фагоцитов, обладающих фагоцитарной активностью, включают макрофаги, такие как макрофаги M1 и M2, и дендритные клетки, такие как незрелые дендритные клетки (imDC).
[0034]
В это время антитело против SIRPα выполняет эффекторные функции, и когда оно связывается с рецептором Fc, таким как рецептор Fcγ фагоцита, например макрофагом, или эффекторной клеткой, такой как натуральная клетка-киллер и T клетки, он атакует собственную эффекторную клетку, такую как мононуклеар периферической крови (PBMC) и макрофаг, посредством антителозависимой клеточной цитотоксичности (ADCC) или антителозависимого клеточного фагоцитоза (ADCP).
[0035]
Чтобы предотвратить атаку собственных клеток, антитело против SIRPα по настоящему изобретению имеет пониженные эффекторные функции. В результате антитело против SIRPα по настоящему изобретению оказывает только эффект ингибирования связывания SIRPα и CD47 и не проявляет эффекторных функций, поскольку оно не связывается с рецептором Fc эффекторной клетки.
[0036]
Антитело против SIRPα по настоящему изобретению можно безопасно использовать в качестве лекарственного средства, не вызывая побочных реакций лекарственного средства, поскольку оно не атакует собственные иммунные клетки.
[0037]
Однако антитело против SIRPα по настоящему изобретению не проявляет достаточных противоопухолевых эффектов только потому, что его эффекторные функции уменьшены. Поэтому его используют в комбинации с другими противоопухолевыми агентами, как описано ниже.
[0038]
Чтобы снизить эффекторные функции, необходимо предотвратить связывание Fc-части антитела против SIRPα с Fc-рецептором макрофага или Т-клетки. Следовательно, антитело против SIRPα по настоящему изобретению было заменено антителом, полученным из IgG4, в качестве подкласса. В целом среди подклассов человеческого IgG IgG4 известен как подкласс с низкими эффекторными функциями, такими как активность ADCC, активность CDC и/или активность ADCP (Bruggemann et al., J. Exp. Med. 1987; 1351-1361). Он используется в качестве формата IgG для предотвращения цитотоксичности посредством эффекторных функций, когда терапевтическое антитело нацелено на молекулу, экспрессируемую в нормальном органе (например, Opdivo). Однако низкие эффекторные функции подкласса IgG4 не означают, что он вообще не имеет эффекторных функций. Соответственно, антитело против SIRPα по настоящему изобретению имеет мутацию, введенную в его константную область тяжелой цепи, так что эффекторные функции еще больше снижаются, то есть замена одной или более аминокислот, которая снижает активность ADCC и/или ADCP и т. п. Примеры такой мутации включают замену фенилаланина в положении 234, как показано индексом EU у Kabat et al. (Kabat et al., Sequences of proteins of immunological interest Fifth edition [1991]), аланином (F234A) и замену лейцина в положении 235 на аланин (L235A) (Parekh et al., mAbs. 2012; 310-318). Такая мутация в антителе называется мутацией FALA. Фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., может обозначаться как фенилаланин 234 согласно нумерации EU.
[0039]
Кроме того, поскольку образование связи SS между тяжелыми цепями антитела IgG4 не стабильно, для повышения ее стабильности вводится мутация, которая способствует образованию связи SS между тяжелыми цепями антитела. Примеры такой мутации включают замену серина в положении 228 согласно нумерации в соответствии с индексом EU, как у Kabat et al. (Angal et al., Molecular Immunology. 1993; 105-108), пролином (S228P). Эта мутация антитела называется мутацией PRO.
[0040]
Вышеупомянутые мутации FALA и PRO могут быть одновременно введены в константные области антитела по настоящему изобретению (Vafa et al., Methods. 2014; 65, 114-126). Тяжелая цепь IgG4, имеющая как мутацию FALA, так и мутацию PRO, называется тяжелой цепью типа «IgG4proFALA», тяжелой цепью типа «IgG4PFALA» или тяжелой цепью типа «IgG4pf».
[0041]
Константная область тяжелой цепи антитела состоит из областей CH1, шарнира, CH2 и CH3. CH1 определяется как 118-215 согласно индексу EU, петля определяется 216-230 согласно индексу EU, CH2 определяется как 231-340 согласно индексу EU, а CH3 определяется как 341-446 согласно индексу EU. Аланин, на который замещен фенилаланин в положении 234, согласно нумерации в соответствии с индексом EU, как у Kabat et al., соответствует аланину в положении 253 в SEQ ID NO: 25, которая представляет собой аминокислотную последовательность тяжелой цепи антитела D13, аланин в положении 252 в SEQ ID NO: 29, который представляет собой аминокислотную последовательность тяжелой цепи антитела F44, и аланин в положении 257 в SEQ ID NO: 33, которая представляет собой аминокислотную последовательность тяжелой цепи антитела F63; и аланин, на который замещен лейцин в положении 235, соответствует аланину в положении 254 в SEQ ID NO: 25, аланину в положении 253 в SEQ ID NO: 29 и аланину в положении 258 в SEQ ID NO: 33. Кроме того, пролин, на который замещен серин в положении 228, согласно нумерации в соответствии с индексом EU, как у Kabat et al., соответствует пролину в положении 247 в SEQ ID NO: 25, пролину в положении 246 в SEQ ID NO: 29, и пролину в положении 251 в SEQ ID NO: 33.
[0042]
Аминокислотные последовательности константной области тяжелой цепи типа «IgG4proFALA» представляют собой аминокислотную последовательность, состоящую из аминокислотных остатков 140-466 в SEQ ID NO: 25, аминокислотную последовательность, состоящую из аминокислотных остатков 139-465 в SEQ ID NO: 29, и аминокислотную последовательность, состоящую из аминокислотных остатков 144-470 в SEQ ID NO: 33.
[0043]
Среди подклассов человеческого IgG человеческий IgG1 обладает очень мощными эффекторными функциями, включая активность CDC посредством связывания комплемента и антителозависимую цитотоксическую активность (Bruggemann et al., J. Exp. Med. 1987; 1351-1361) и используется в качестве формата IgG, который проявляет терапевтические эффекты, вызывая гибель опухолевых клеток из-за повреждения клеток посредством эффекторных функций, когда терапевтическое антитело используется для нацеливания на молекулу, высоко экспрессируемую при онкологическом заболевании (например, трастузумаб, ритуксимаб). Когда IgG1 используется в качестве изотипа антитела по настоящему изобретению, эффекторные функции можно регулировать путем замены части аминокислотных остатков в константной области (см. Международные публикации No. WO 88/007089, WO 94/28027 и WO 94/29351). Примеры мутантов IgG1, обладающих ослабленными эффекторными функциями, включают LALA IgG1 (IgG1-L234A, IgG1-L235A) и LAGA IgG1 (IgG1-L235A, IgG1-G237A). Константные области тяжелой цепи IgG1, в которые вводятся эти мутации, также можно использовать в качестве константной области антитела по настоящему изобретению.
[0044]
Среди подклассов человеческого IgG человеческий IgG2 имеет очень слабые эффекторные функции, включая активность CDC через связывание комплемента и антитело-зависимую цитотоксическую активность (Bruggemann et al., J. Exp. Med. 1987; 1351-1361) и используется в качестве одного из форматов IgG для предотвращения цитотоксичности за счет эффекторных функций, когда терапевтическое антитело используется для нацеливания на молекулу, экспрессируемую в нормальном органе (например, деносумаб, эволокумаб, бродалумаб). Константная область тяжелой цепи IgG2 также может использоваться в качестве константной области антитела по настоящему изобретению.
Антитело против SIRPα по настоящему изобретению обладает межвидовой перекрестной реактивностью, так что оно связывается с SIRPα человека и обезьяны (яванской макаки), но не с SIRPα мыши.
[0045]
Химерные антитела человека и гуманизированные антитела
Антитело против SIRPα по настоящему изобретению включает химерное антитело человека и гуманизированное антитело, модифицированное для снижения гетерогенной антигенности против человека. Гуманизированное антитело также называют антителом с трансплантированной CDR.
[0046]
Химерные антитела человека
Химерное антитело человека относится к антителу, состоящему из вариабельной области легкой цепи и вариабельной области тяжелой цепи антитела животного, отличного от человека, и константной области легкой цепи и константной области тяжелой цепи человеческого антитела. Химерное антитело человека может быть получено путем сбора кДНК, кодирующей вариабельную область легкой цепи, и кДНК, кодирующей вариабельную область тяжелой цепи, из гибридомы, продуцирующей антитело против SIRPα, путем вставки кДНК в экспрессирующий вектор, имеющий кДНК, кодирующую константную область легкой цепи и константную область тяжелой цепи человеческого антитела для конструирования экспрессирующего вектора химерного антитела человека и введение экспрессирующего вектора в клетку-хозяин для экспрессии.
[0047]
Константная область тяжелой цепи состоит из трех доменов CH1, CH2 и CH3. В настоящем изобретении, как описано выше, константная область тяжелой цепи человека химерного антитела представляет собой IgG4proFALA, которая является константной областью тяжелой цепи подкласса IgG4 и имеет мутацию PRO и мутацию FALA. Кроме того, достаточно, чтобы константная область легкой цепи принадлежала к семейству человеческого Ig, а константная область легкой цепи была κ или λ константной областью.
[0048]
Примеры химерного антитела человека антитела против SIRPα по настоящему изобретению включают антитела cD13, cF44 и cF63, которые являются химерными антителами человека, имеющими вариабельную область крысиных моноклональных антител D13, F44 и F63 против SIRPα. Эти три антитела представляют собой антитела, обладающие высокой способностью связываться с SIRPα человека и обладающие высокой ингибирующей активностью в отношение связывания SIRPα и CD47. Среди них предпочтительны антитела cD13 и cF63, обладающие высокой активностью.
[0049]
cD13 антитела
Нуклеотидная последовательность кДНК, кодирующая вариабельную область легкой цепи антитела cD13, представляет собой нуклеотидную последовательность, состоящую из нуклеотидов 61-378 в SEQ ID NO: 22 в списке последовательностей (Фигура 17), и аминокислотная последовательность вариабельной области легкой цепи антитела cD13 представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 21-126 в SEQ ID NO: 23 в списке последовательностей (Фигура 17).
[0050]
Кроме того, нуклеотидная последовательность кДНК, кодирующая вариабельную область тяжелой цепи антитела cD13, представляет собой нуклеотидную последовательность, состоящую из нуклеотидов 58-417 в SEQ ID NO: 24 в списке последовательностей (Фигура18), и аминокислотная последовательность вариабельной области тяжелой цепи антитела cD13 представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 20-139 в SEQ ID NO: 25 в списке последовательностей (Фигура 18).
[0051]
То есть антитело против SIRPα по настоящему изобретению представляет собой антитело против SIRPα человека, которое связывается с SIRPα человека, содержащее: вариабельную область легкой цепи, содержащую аминокислотную последовательность, состоящую из аминокислотных остатков 21-126 в SEQ ID NO: 23; и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, состоящую из аминокислотных остатков 20-139 в SEQ ID NO: 25.
[0052]
Кроме того, ДНК, состоящие из нуклеотидной последовательности, имеющей идентичность последовательностей по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, особенно предпочтительно по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%, рассчитанную с использованием вышеупомянутой нуклеотидной последовательности, состоящей из нуклеотидов 61-378 в SEQ ID NO: 22, или нуклеотидной последовательности, состоящей из нуклеотидов 58-417 в SEQ ID NO: 24 и CLUSTAL W (инструмент выравнивания) или тому подобное (с использованием, например, параметров по умолчанию, т.е. изначально установленные параметры), и кодирующие белки, обладающие активностью вариабельной области легкой цепи или вариабельной области тяжелой цепи антитела, то есть обладающие активностью связывания с SIRPα человека, также включены в ДНК, кодирующие вариабельную область легкой цепи или вариабельной области тяжелой цепи антитела по настоящему изобретению.
[0053]
Более того, ДНК, которые могут быть гибридизированы с ДНК, состоящей из последовательности, комплементарной указанной выше нуклеотидной последовательности, состоящей из нуклеотидов 61-378 в SEQ ID NO: 22, или нуклеотидной последовательности, состоящей из нуклеотидов 58-417 в SEQ ID NO: 24 в жестких условиях, и кодирующие белок, обладающий активностью вариабельной области легкой цепи или вариабельной области тяжелой цепи антитела, то есть обладающий активностью связывания с SIRPα человека, также включены в ДНК, кодирующие вариабельную область легкой цепи или вариабельную область тяжелой цепи по настоящему изобретению.
[0054]
Кроме того, вышеупомянутая вариабельная область легкой цепи или вариабельная область тяжелой цепи включает не только вариабельную область легкой цепи или вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-126 в SEQ ID NO: 23 или аминокислотной последовательности, состоящей из аминокислотных остатков 20-139 в SEQ ID NO: 25, но также вариабельную область легкой цепи или вариабельную область тяжелой цепи, включая белок, содержащий аминокислотную последовательность, полученную из указанной выше аминокислотной последовательности путем делеции, замены или вставки одной или более аминокислот, например, от одной до 10, предпочтительно от одной до пяти, более предпочтительно одной или двух, более предпочтительно одной аминокислоты и обладающих активностью вариабельной области тяжелой цепи или вариабельной области легкой цепи антитела, то есть обладающих активностью связывания с SIRPα человека.
[0055]
Примеры такой аминокислотной последовательности, полученной из аминокислотной последовательности, состоящей из аминокислотных остатков 21-126 в SEQ ID NO: 23, или аминокислотной последовательности, состоящей из аминокислотных остатков 20-139 в SEQ ID NO: 25, путем делеции, замены или вставки одной или более аминокислот включают аминокислотные последовательности, имеющие идентичность последовательности по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, особенно предпочтительно по меньшей мере 97%, 98% или 99%, рассчитанную с использованием аминокислотной последовательности, состоящей из аминокислотных остатков 21-126 в SEQ ID NO: 23, или аминокислотной последовательности, состоящей из аминокислотных остатков 20-139 в SEQ ID NO: 25 и CLUSTAL W (инструмент для выравнивания) или тому подобного (с использованием, например, параметров по умолчанию, т. е. изначально заданных параметров).
[0056]
Такой белок, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности, состоящей из аминокислотных остатков 21-126 в SEQ ID NO: 23, или аминокислотной последовательности, состоящей из аминокислотных остатков 20-139 в SEQ ID NO: 25, путем делеции, замены или вставки одной или более аминокислот по существу идентичны белку, имеющему аминокислотную последовательность, состоящую из аминокислотных остатков 21-126 в SEQ ID NO: 23, или аминокислотную последовательность, состоящую из аминокислотных остатков 20-139 в SEQ ID NO: 25.
[0057]
Кроме того, антитело cD13 содержит CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 1 (GASKSVRTYMH), CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 2 (SASNLEA), и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 3 (QQSNEPPYT), в качестве областей, определяющих комплементарность, (CDR), вариабельной области легкой цепи, и дополнительно содержит CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 4 (GFTFSDYGMI), CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 5 (SISSSSSYIY), и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 6 (RYYGFNYPFDY), в качестве CDR вариабельной области тяжелой цепи (Фигура 28).
[0058]
Таким образом, антитело против SIRPα по настоящему изобретению представляет собой антитело, которое содержит CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 1, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 2, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 3, и дополнительно содержит CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 4, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 5, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 6, в качестве CDR вариабельной области тяжелой цепи.
[0059]
Вышеупомянутые CDR включают CDR, состоящие из аминокислотной последовательности, полученной из аминокислотной последовательности, представляющей каждую CDR, путем делеции, замены или вставки одной или нескольких, предпочтительно одной или двух, более предпочтительно одной аминокислоты.
[0060]
Химерное или гуманизированное антитело D13 связывается с вариантом SIRPα, состоящим из аминокислотной последовательности SEQ ID NO: 73, но не связывается с вариантом SIRPα, состоящим из аминокислотной последовательности SEQ ID NO: 74 или 75. Поскольку последовательность NQKEG (SEQ ID NO: 76) в аминокислотной последовательности SEQ ID NO: 73, заменена последовательностью NQKEE (SEQ ID NO: 77) в SEQ ID NO: 74 и последовательностью SFTEG (SEQ ID NO: 80) в SEQ ID NO: 75, было обнаружено, что связывание химерного или гуманизированного антитела D13 и SIRPα требует последовательности NQKEG (SEQ ID NO: 76). Рентгеновская кристаллография показала, что антитело cD13 связывается с SIRPα через аминокислотные остатки Gln82, Lys83, Glu84, Gly85, His86 и Phe87 (положение каждого аминокислотного остатка соответствует положению в SEQ ID NO: 57 в списке последовательностей) в SEQ ID NO: 57, представляющем вариант 2 человеческого SIRPα, и последовательность, содержащая Gln82, Lys83, Glu84 и Gly85, соответствует части QKEG в вышеупомянутой последовательности NQKEG. Следовательно, последовательность NQKEG является эпитопом, необходимым для связывания антитела D13 и человеческого SIRPα. Антитело, имеющее эпитоп, идентичный эпитопу антитела D13, можно выбрать путем выбора антитела, которое связывается с антителом, которое специфически распознает последовательность NQKEG (SEQ ID NO: 76), то есть антитело, которое связывается с вариантом SIRPα, состоящим из аминокислотной последовательности SEQ ID NO: 73, которая имеет последовательность NQKEG (SEQ ID NO: 76), но не связывается с вариантом SIRPα, состоящим из аминокислотной последовательности SEQ ID NO: 74 или 75, и не имеющей последовательность NQKEG.
[0061]
cF44 антитела
Нуклеотидная последовательность кДНК, кодирующая вариабельную область легкой цепи антитела cF44, представляет собой нуклеотидную последовательность, состоящую из нуклеотидов 61-381 в SEQ ID NO: 26 в списке последовательностей (Фигура19), и аминокислотная последовательность вариабельной области легкой цепи антитела cF44 представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 21-127 в SEQ ID NO: 27 в списке последовательностей (Фигура 19).
[0062]
Кроме того, нуклеотидная последовательность кДНК, кодирующая вариабельную область тяжелой цепи антитела cF44, представляет собой нуклеотидную последовательность, состоящую из нуклеотидов 58-414 в SEQ ID NO: 28 в списке последовательностей (Фигура 20), и аминокислотная последовательность вариабельной области тяжелой цепи антитела cF44 представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 20-138 в SEQ ID NO: 29 в списке последовательностей (Фигура 20).
[0063]
То есть антитело против SIRPα по настоящему изобретению представляет собой антитело против SIRPα человека, которое связывается с SIRPα человека, содержащее: вариабельную область легкой цепи, содержащую аминокислотную последовательность, состоящую из аминокислотных остатков 21-127 в SEQ ID NO: 27; и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, состоящую из аминокислотных остатков 20-138 в SEQ ID NO: 29.
[0064]
Кроме того, ДНК, состоящие из нуклеотидной последовательности, имеющей идентичность последовательностей по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, особенно предпочтительно по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%, рассчитанную с использованием вышеупомянутой нуклеотидной последовательности, состоящей из нуклеотидов 61-381 в SEQ ID NO: 26, или нуклеотидной последовательности, состоящей из нуклеотидов 58-414 в SEQ ID NO: 28 и CLUSTAL W (инструмент выравнивания) или тому подобного (с использованием, например, параметров по умолчанию, т.е. изначально заданных параметров), и кодирующие белки, обладающие активностью вариабельной области легкой цепи или вариабельной области тяжелой цепи антитела, то есть обладающие активностью связывания с SIRPα человека, также включены в ДНК, кодирующие вариабельную область легкой цепи или вариабельной области тяжелой цепи антитела по настоящему изобретению.
[0065]
Более того, ДНК, которые могут быть гибридизированы с ДНК, состоящей из последовательности, комплементарной указанной выше нуклеотидной последовательности, состоящей из нуклеотидов 61-381 в SEQ ID NO: 26, или нуклеотидной последовательности, состоящей из нуклеотидов 58-414 в SEQ ID NO: 28 в жестких условиях, и кодирующие белок, обладающий активностью вариабельной области легкой цепи или вариабельной области тяжелой цепи антитела, то есть обладающий активностью связывания с SIRPα человека, также включены в ДНК, кодирующие вариабельную область легкой цепи или вариабельную область тяжелой цепи по настоящему изобретению.
[0066]
Кроме того, вышеупомянутая вариабельная область легкой цепи или вариабельная область тяжелой цепи включает не только вариабельную область легкой цепи или вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-127 в SEQ ID NO: 27 или аминокислотной последовательности, состоящей из аминокислотных остатков 20-138 в SEQ ID NO: 29, но также вариабельную область легкой цепи или вариабельную область тяжелой цепи, включая белок, содержащий аминокислотную последовательность, полученную из указанной выше аминокислотной последовательности путем делеции, замены или вставки одной или более аминокислот, например, от одной до 10, предпочтительно от одной до пяти, более предпочтительно одной или двух, более предпочтительно одной аминокислоты и обладающих активностью вариабельной области тяжелой цепи или вариабельной области легкой цепи антитела, то есть обладающих активностью связывания с SIRPα человека.
[0067]
Примеры такой аминокислотной последовательности, полученной из аминокислотной последовательности, состоящей из аминокислотных остатков 21-127 в SEQ ID NO: 27, или аминокислотной последовательности, состоящей из аминокислотных остатков 20-138 в SEQ ID NO: 29, путем делеции, замены или вставки одной или более аминокислот, включает аминокислотные последовательности, имеющие идентичность последовательностей по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, особенно предпочтительно по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%, рассчитанную с использованием аминокислотной последовательности, состоящей из аминокислотных остатков 21-127 в SEQ ID NO: 27, или аминокислотной последовательности, состоящей из аминокислотных остатков 20-138 в SEQ ID NO: 29 и CLUSTAL W (инструмент для выравнивания) или тому подобного (с использованием, например, параметров по умолчанию, т. е. изначально установленных параметров).
[0068]
Такой белок, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности, состоящей из аминокислотных остатков 21-127 в SEQ ID NO: 27, или аминокислотной последовательности, состоящей из аминокислотных остатков 20-138 в SEQ ID NO: 29, путем делеции, замены или вставки одной или нескольких аминокислот по существу идентичны белку, имеющему аминокислотную последовательность, состоящую из аминокислотных остатков 21-127 в SEQ ID NO: 27, или аминокислотную последовательность, состоящую из аминокислотных остатков 20-138 в SEQ ID NO: 29.
[0069]
Кроме того, антитело cF44 включает CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 7 (KASKSISKYLA), CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 8 (SGSTLQS), и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 9 (QQHNEYPPT) в качестве областей, определяющих комплементарность, (CDR), вариабельной области легкой цепи, и дополнительно содержит CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 10 (GFTFSNYYMA), CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 11 (YITTGGGSTY), и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 12 (ANYGGSYFDY), в качестве CDR вариабельной области тяжелой цепи (Фигура 29).
[0070]
То есть антитело против SIRPα по настоящему изобретению представляет собой антитело, которое содержит CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 7, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 8, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 9, и дополнительно содержит CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 10, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 11, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 12, в качестве CDR вариабельной области тяжелой цепи.
[0071]
Вышеупомянутые CDR включают CDR, состоящие из аминокислотной последовательности, полученной из аминокислотной последовательности, представляющей каждую CDR, путем делеции, замены или вставки одной или нескольких, предпочтительно одной или двух, более предпочтительно одной аминокислоты.
[0072]
cF63 антитела
Нуклеотидная последовательность кДНК, кодирующая вариабельную область легкой цепи антитела cF63, представляет собой нуклеотидную последовательность, состоящую из нуклеотидов 61-390 в SEQ ID NO: 30 в списке последовательностей (Фигура 21), и аминокислотная последовательность вариабельной области легкой цепи антитела cF63 представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 21-130 в SEQ ID NO: 31 в списке последовательностей (Фигура 21).
[0073]
Кроме того, нуклеотидная последовательность кДНК, кодирующая вариабельную область тяжелой цепи антитела cF63, представляет собой нуклеотидную последовательность, состоящую из нуклеотидов 58-429 в SEQ ID NO: 32 в списке последовательностей (Фигура 22), и аминокислотная последовательность вариабельной области тяжелой цепи антитела cF63 представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 20-143 в SEQ ID NO: 33 в списке последовательностей (Фигура 22).
[0074]
То есть антитело против SIRPα по настоящему изобретению представляет собой антитело против SIRPα человека, которое связывается с SIRPα человека, содержащее: вариабельную область легкой цепи, содержащую аминокислотную последовательность, состоящую из аминокислотных остатков 21-130 в SEQ ID NO: 31; и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, состоящую из аминокислотных остатков 20-143 в SEQ ID NO: 33.
[0075]
Кроме того, ДНК, состоящие из нуклеотидной последовательности, имеющей идентичность последовательностей по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, особенно предпочтительно по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%, рассчитанную с использованием вышеупомянутой нуклеотидной последовательности, состоящей из нуклеотидов 61-390 в SEQ ID NO: 30, или нуклеотидной последовательности, состоящей из нуклеотидов 58-429 в SEQ ID NO: 32 и CLUSTAL W (инструмент выравнивания) или тому подобное (с использованием, например, параметров по умолчанию, т.е. изначально установленные параметры), и кодирующие белки, обладающие активностью вариабельной области легкой цепи или вариабельной области тяжелой цепи антитела, то есть обладающие активностью связывания с SIRPα человека, также включены в ДНК, кодирующие вариабельную область легкой цепи или вариабельной области тяжелой цепи антитела по настоящему изобретению.
[0076]
Более того, ДНК, которые могут быть гибридизированы с ДНК, состоящей из последовательности, комплементарной указанной выше нуклеотидной последовательности, состоящей из нуклеотидов 61-390 в SEQ ID NO: 30, или нуклеотидной последовательности, состоящей из нуклеотидов 58-429 в SEQ ID NO: 32 в жестких условиях, и кодирующие белок, обладающий активностью вариабельной области легкой цепи или вариабельной области тяжелой цепи антитела, то есть обладающий активностью связывания с SIRPα человека, также включены в ДНК, кодирующие вариабельную область легкой цепи или вариабельную область тяжелой цепи по настоящему изобретению.
[0077]
Кроме того, вышеупомянутая вариабельная область легкой цепи или вариабельная область тяжелой цепи включает не только вариабельную область легкой цепи или вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-130 в SEQ ID NO: 31 или аминокислотной последовательности, состоящей из аминокислотных остатков 20-143 в SEQ ID NO: 33, но также вариабельную область легкой цепи или вариабельную область тяжелой цепи, включая белок, содержащий аминокислотную последовательность, полученную из указанной выше аминокислотной последовательности путем делеции, замены или вставки одной или нескольких аминокислот, например, от одной до 10, предпочтительно от одной до пяти, более предпочтительно одной или двух, более предпочтительно одной аминокислоты и обладающих активностью вариабельной области тяжелой цепи или вариабельной области легкой цепи антитела, то есть обладающих активностью связывания с SIRPα человека.
[0078]
Примеры такой аминокислотной последовательности, полученной из аминокислотной последовательности, состоящей из аминокислотных остатков 21-130 в SEQ ID NO: 31, или аминокислотной последовательности, состоящей из аминокислотных остатков 20-143 в SEQ ID NO: 33, путем делеции, замены или вставки одной или более аминокислот включает аминокислотные последовательности, имеющие идентичность последовательностей по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, особенно предпочтительно по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%, рассчитанную с использованием аминокислотной последовательности, состоящей из аминокислотных остатков 21-130 в SEQ ID NO: 31, или аминокислотной последовательности, состоящей из аминокислотных остатков 20-143 в SEQ ID NO: 33 и CLUSTAL W (инструмент для выравнивания) или тому подобного (с использованием, например, параметров по умолчанию, т.е. изначально установленных параметров).
[0079]
Такой белок, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности, состоящей из аминокислотных остатков 21-130 в SEQ ID NO: 31, или аминокислотной последовательности, состоящей из аминокислотных остатков 20-143 в SEQ ID NO: 33, путем делеции, замены или вставки одной или более аминокислот по существу идентичны белку, имеющему аминокислотную последовательность, состоящую из аминокислотных остатков 21-130 в SEQ ID NO: 31, или аминокислотную последовательность, состоящую из аминокислотных остатков 20-143 в SEQ ID NO: 33.
[0080]
Кроме того, антитело cF63 содержит CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 13 (ERSSGDIGDSYVS), CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 14 (ADDQRPS), и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 15 (QSYDSKIDI) в качестве областей, определяющих комплементарность, (CDR), вариабельной области легкой цепи, и дополнительно включает CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 16 (GFSLASYSLS), CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 17 (RMYYDGDTA), и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 18 (DRSMFGTDYPHWYFDF), в качестве CDR вариабельной области тяжелой цепи (Фигура 30).
[0081]
Таким образом, антитело против SIRPα по настоящему изобретению представляет собой антитело, которое содержит CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 13, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 14, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 15, и дополнительно содержит CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 16, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 17, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 18, в качестве CDR вариабельной области тяжелой цепи.
[0082]
Вышеупомянутые CDR включают CDR, состоящие из аминокислотной последовательности, полученной из аминокислотной последовательности, представляющей каждую CDR, путем делеции, замены или вставки одной или нескольких, предпочтительно одной или двух, более предпочтительно одной аминокислоты.
[0083]
Гуманизированные антитела
Гуманизированное антитело (CDR-трансплантированное антитело) относится к антителу, полученному путем трансплантации аминокислотных последовательностей CDR вариабельной области легкой цепи и вариабельной области тяжелой цепи антитела животного, отличного от человека, в вариабельную область легкой цепи и вариабельную область тяжелой цепи человеческого антитела в соответствующих положениях.
[0084]
Гуманизированное антитело против SIRPα по настоящему изобретению можно получить путем конструирования кДНК, кодирующих вариабельные области, полученные путем трансплантации аминокислотных последовательностей CDR вариабельной области легкой цепи и вариабельной области тяжелой цепи антитела животного, отличного от человека, где антитело получено из гибридомы, продуцирующей моноклональное антитело, которое усиливает фагоцитарную активность макрофага путем связывания с SIRPα человека для ингибирования связывания SIRPα и CD47 в каркасной области (FR) вариабельной области легкой цепи и вариабельной области тяжелой цепи произвольного антитела человека, путем вставки их в экспрессирующий вектор для клеток животного, несущий гены, кодирующие константную область легкой цепи и константную область тяжелой цепи человеческого антитела, для конструирования экспрессирующего вектора гуманизированного антитела, и путем введения экспрессирующего вектора в клетку животного, чтобы произвести экспрессию.
[0085]
В частности, достаточно синтезировать последовательность ДНК, сконструированную таким образом, чтобы соединить CDR антитела D13, F44 или F63 и каркасную область человеческого антитела. Каркасная область человеческого антитела, соединенная посредством CDR, выбирается так, чтобы CDR образовывали благоприятный сайт связывания антигена. Кроме того, при необходимости, аминокислоты в каркасной области в вариабельной области антитела могут быть заменены так, что CDR гуманизированного антитела образует соответствующий антигенсвязывающий сайт. Гуманизированное антитело, в которое трансплантируются CDR, может быть получено известным методом трансплантации CDR.
[0086]
Примеры тяжелой цепи гуманизированного антитела, имеющего CDR в вариабельной области тяжелой цепи антитела D13 (шесть CDR, состоящих из аминокислот, представленных в SEQ ID NO: 1-6), где часть аминокислот в каркасной области в вариабельной области заменены вышеупомянутым способом, включая тяжелую цепь гуманизированного антитела hH1 и тяжелую цепь гуманизированного антитела hH2. Кроме того, примеры легкой цепи гуманизированного антитела, имеющего CDR в вариабельной области легкой цепи антитела D13, в котором заменена часть аминокислот каркасной области в вариабельной области, включают легкую цепь гуманизированного антитела hL2, легкую цепь гуманизированного антитела hL3 и легкую цепь гуманизированного антитела hL4.
[0087]
Полноразмерная нуклеотидная последовательность тяжелой цепи hH1 гуманизированного антитела представлена в SEQ ID NO: 40, а ее аминокислотная последовательность представлена в SEQ ID NO: 41. Кроме того, полноразмерная нуклеотидная последовательность hH2 тяжелой цепи гуманизированного антитела представлена в SEQ ID NO: 42, а ее аминокислотная последовательность представлена в SEQ ID NO: 43. В SEQ ID NO: 40 и 42 нуклеотидная последовательность, состоящая из нуклеотидов 1-57, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 58-417, кодирует вариабельную область, а нуклеотидная последовательность, состоящая из нуклеотидов 418-1398, кодирует константную область. Кроме того, в SEQ ID NO: 41 и 43 аминокислотная последовательность, состоящая из аминокислотных остатков 1-19, представляет собой аминокислотную последовательность сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 20-139, представляет собой аминокислотную последовательность вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков 140-466, представляет собой аминокислотную последовательность константной области. На Фигуре 11 показано сравнение аминокислотных последовательностей (включая сигнальные последовательности) вариабельной области тяжелой цепи антитела D13, вариабельной области тяжелой цепи гуманизированного антитела hH1 и вариабельной области тяжелой цепи гуманизированного антитела hH2.
[0088]
Антитело против SIRPα по настоящему изобретению включает антитела, имеющие вариабельную область тяжелой цепи, состоящую из аминокислотных остатков 20-139, и константную область тяжелой цепи, состоящую из аминокислотных остатков 140-466 в SEQ ID NO: 41 или 43.
[0089]
Полноразмерная нуклеотидная последовательность легкой цепи hL2 гуманизированного антитела представлена в SEQ ID NO: 34, а ее аминокислотная последовательность представлена в SEQ ID NO: 35. Кроме того, полноразмерная нуклеотидная последовательность легкой цепи hL3 гуманизированного антитела представлена в SEQ ID NO: 36, а ее аминокислотная последовательность представлена в SEQ ID NO: 37. Кроме того, полноразмерная нуклеотидная последовательность легкой цепи hL4 гуманизированного антитела представлена в SEQ ID NO: 38, а ее аминокислотная последовательность представлена в SEQ ID NO: 39. В SEQ ID NO: 34, 36 и 38 нуклеотидная последовательность, состоящая из нуклеотидов 1-60, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 61-381, кодирует вариабельную область, и нуклеотидная последовательность, состоящая из нуклеотидов 382-702, кодирует константную область. В SEQ ID NO: 35, 37 и 39 аминокислотная последовательность, состоящая из аминокислотных остатков 1-20, представляет собой аминокислотную последовательность сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 21-127, представляет собой аминокислотную последовательность вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков 128-234, представляет собой аминокислотную последовательность константной области. На Фигуре 12 показано сравнение аминокислотных последовательностей (включая сигнальные последовательности) вариабельной области легкой цепи антитела D13, вариабельной области hL2 легкой цепи гуманизированного антитела, вариабельной области тяжелой цепи hL3 гуманизированного антитела и вариабельная область легкой цепи hL4 гуманизированного антитела.
[0090]
Антитело против SIRPα по настоящему изобретению включает антитела, содержащие: вариабельную область, состоящую из аминокислотных остатков 21-127; и константную область легкой цепи, состоящую из аминокислотных остатков 128-234 в SEQ ID NO: 35, 37 или 39.
[0091]
Константная область тяжелой цепи гуманизированного антитела представляет собой константную область тяжелой цепи IgG4proFALA, которая является константной областью тяжелой цепи подкласса IgG4 и имеет мутацию PRO и мутацию FALA.
[0092]
Примеры антитела, обладающего высокой способностью связывания с SIRPα человека и высокой ингибирующей активностью в отношении связывания SIRPα и CD47, включают антитело, состоящее из тяжелой цепи hH1 гуманизированного антитела и легкой цепи hL3 гуманизированного антитела (антитело hD13_H1L3), антитело, состоящее из тяжелой цепи hH1 гуманизированного антитела и легкой цепи hL4 гуманизированного антитела (антитело hD13_H1L4), антитело, состоящее из тяжелой цепи hH2 гуманизированного антитела и легкой цепи hL2 гуманизированного антитела (антитело hD13_H2L2), и антитело, состоящее из тяжелой цепи hH2 гуманизированного антитела и легкая цепь hL3 гуманизированного антитела (антитело hD13_H2L3).
[0093]
Антитело hD13_H1L3 представляет собой антитело, имеющее тяжелую цепь, состоящую из аминокислотных остатков 20-466 в SEQ ID NO: 41, и легкую цепь, состоящую из аминокислотных остатков 21-234 в SEQ ID NO: 37.
[0094]
Антитело hD13_H1L4 представляет собой антитело, имеющее тяжелую цепь, состоящую из аминокислотных остатков 20-466 в SEQ ID NO: 41, и легкую цепь, состоящую из аминокислотных остатков 21-234 в SEQ ID NO: 39.
[0095]
Антитело hD13_H2L2 представляет собой антитело, имеющее тяжелую цепь, состоящую из аминокислотных остатков 20-466 в SEQ ID NO: 43, и легкую цепь, состоящую из аминокислотных остатков 21-234 в SEQ ID NO: 35.
[0096]
Антитело hD13_H2L3 представляет собой антитело, имеющее тяжелую цепь, состоящую из аминокислотных остатков с 20 до 466 в SEQ ID NO: 43, и легкую цепь, состоящую из аминокислотных остатков 21-234 в SEQ ID NO: 37.
[0097]
Известно, что остаток лизина на карбоксильном конце тяжелой цепи антитела, продуцируемого в культивируемой клетке млекопитающего, удален (Tsubaki et al., Int. J. Biol. Macromol. 2013; 139-147). Однако эта делеция в последовательности тяжелой цепи не влияет на способность связываться с антигеном или эффекторные функции (например, активацию комплемента и антителозависимое цитотоксическое действие) антитела. Следовательно, настоящее изобретение также включает антитело, в котором остаток лизина на карбоксильном конце тяжелой цепи удален.
[0098]
Другие антитела
Антитело по настоящему изобретению может быть антигенсвязывающим фрагментом антитела, имеющим антигенсвязывающий сайт антитела или его модифицированный фрагмент. Фрагмент антитела может быть получен обработкой антитела протеолитическим ферментом, таким как папаин или пепсин, или модификацией гена антитела с использованием метода генной инженерии и экспрессии гена в подходящей культивируемой клетке. Среди таких фрагментов антитела фрагмент, несущий все или часть функций полноразмерной молекулы антитела, можно назвать антигенсвязывающим фрагментом антитела. Общие примеры функций антитела включают антигенсвязывающую активность, активность по нейтрализации антигенной активности, активность по усилению антигенной активности, антителозависимую цитотоксическую активность, комплемент-зависимую цитотоксическую активность и комплемент-зависимую клеточно-опосредованную цитотоксическая активность. Функция антигенсвязывающего фрагмента антитела в настоящем изобретении заключается в активности связывания SIRPα.α
[0099]
Примеры фрагментов антител включают Fab, F(ab')2, вариабельную область (Fv), одноцепочечный Fv (scFv), который имеет Fv тяжелой цепи и легкой цепи, соединенные с подходящим линкером, диатело (диатела) и линейное антитело и полиспецифическое антитело, образованное фрагментами антител. Кроме того, Fab', который представляет собой одновалентный фрагмент вариабельной области антитела, полученный обработкой F(ab')2 в условиях восстановления, также включен во фрагменты антитела.
[0100]
Кроме того, антитело по настоящему изобретению может быть полиспецифическим антителом, обладающим специфичностью по меньшей мере к двум различным антигенам. Обычно такая молекула связывается с двумя разными антигенами (то есть биспецифическое антитело), и «полиспецифическое антитело» в настоящем изобретении включает антитело, обладающее специфичностью к большему количеству (например, трем различным) антигенам.
Полиспецифическое антитело по настоящему изобретению может представлять собой полноразмерное антитело или фрагмент такого антитела [например, F(ab')2 биспецифического антитела]. Биспецифическое антитело может быть получено путем связывания тяжелых цепей и легких цепей (пар HL) двух разных антител или слияния гибридомы, продуцирующей разные моноклональные антитела, для получения слитой клетки, продуцирующей биспецифические антитела (Millstein et al., Nature. 1983; 305, 537-539).
[0101]
Антитело по настоящему изобретению может быть одноцепочечным антителом (также называемым scFv). Одноцепочечное антитело получают путем соединения вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела с полипептидным линкером [Pluckthun, The Pharmacology of Monoclonal Antibodies, 113 [Rosenberg and Moore Ed., Springer Verlag, New York, 269-315 (1994)], Nature Biotechnology. 2005; 23, 1126-1136]. Кроме того, фрагмент BiscFv, полученный путем соединения двух scFv с полипептидным линкером, также можно использовать в качестве биспецифического антитела.
[0102]
Способы получения одноцепочечного антитела хорошо известны в области техники (например, см. Патент № 4946778, США. Патент № 5,260,203, США. Патент № 5091513, США. Патент № 5,455,030 и т. п.). В этом scFv вариабельная область тяжелой цепи и вариабельная область легкой цепи соединены линкером, который не образует конъюгата, предпочтительно полипептидным линкером (Huston, J. S. et al., Proc. Natl. Acad. Sci. U.S.A. 1988; 85, 5879-5883). Вариабельная область тяжелой цепи и вариабельная область легкой цепи в scFv могут происходить из одного и того же антитела или отдельных антител. В качестве полипептидного линкера, который соединяет вариабельные области, используется, например, произвольный одноцепочечный пептид, состоящий из 12-19 остатков.
[0103]
ДНК, кодирующую scFv, получают путем амплификации ДНК с помощью ПЦР с использованием всей последовательности или части ДНК, кодирующей заданную аминокислотную последовательность ДНК, кодирующей тяжелую цепь или вариабельную область тяжелой цепи антитела, и ДНК, кодирующей легкую цепь или вариабельную область легкой цепи в качестве матрицы и пара праймеров, которая определяет оба конца и впоследствии амплифицирует ДНК путем объединения ДНК, кодирующей участок полипептидного линкера, и пары праймеров, которые определяют оба конца, так что каждый из них соединяется с тяжелой цепью или легкой цепь.
[0104]
Кроме того, после получения ДНК, кодирующей scFv, экспрессирующий вектор, содержащий ДНК, и хозяин, трансформированный экспрессирующим вектором, можно получить обычным способом, а scFv можно получить с использованием хозяина в соответствии с обычным способом. Эти фрагменты антител могут быть продуцированы хозяином путем получения его гена и их экспрессии таким же образом, как описано выше.
[0105]
Антитело по настоящему изобретению может иметь аффинность к антигену, которая увеличивается в результате полимеризации. Подлежащее полимеризации антитело может быть одним типом антител или множеством антител, которые распознают множество эпитопов одного и того же антигена. Примеры способа полимеризации антитела включают связывание домена CH3 IgG и двух scFv, связывание со стрептавидином и введение мотива спираль-поворот-спираль (helix-turn-helix).
Антитело по настоящему изобретению может быть поликлональным антителом, которое представляет собой смесь двух или более различных антител против SIRPα, содержащих разные аминокислотные последовательности. Одним из примеров поликлонального антитела является смесь двух или более разных антител, имеющих разные CDR. При культивировании смеси клеток, продуцирующих различные антитела, очищенное из культуры антитело можно использовать в качестве такого поликлонального антитела (см. Международную публикацию WO 2004/061104).
[0106]
В качестве модифицированного антитела можно использовать антитело, связанное с различными молекулами, такими как полиэтиленгликоль (ПЭГ).
[0107]
Антитело по настоящему изобретению может быть антителом, конъюгированным с другим лекарственным средством (иммуноконъюгатом). Примеры таких антител включают антитела, конъюгированные с радиоактивным веществом или соединением, обладающим фармакологическим действием (Nature Biotechnology. 2005; 23, 1137-1146).
[0108]
Кроме того, также известен способ получения одноцепочечного иммуноглобулина путем соединения полноразмерных последовательностей тяжелой цепи и легкой цепи антитела с использованием подходящего линкера (Lee, H-S. et al., Molecular Immunology. 1999; 36, 61-71; Schirrmann, T. et al., MAbs. 2010; 2 (1), 1-4). При димеризации одноцепочечный иммуноглобулин может иметь структуру и активность, как у антитела, которое по существу является тетрамером. Кроме того, антитело по настоящему изобретению может быть антителом, которое имеет одну вариабельную область тяжелой цепи и не имеет последовательности легкой цепи. Такое антитело называется однодоменным антителом (sdAb) или нанотелом, и, по сути, сообщалось, что такое антитело наблюдается у верблюдов или лам с сохраненной способностью связываться с антигеном [Muyldemans S. et al., Protein Eng. 1994; 7 (9), 1129-35; Hamers-Casterman C. et al., Nature. 1993; 363 (6428), 446-8]. Вышеупомянутое антитело также можно интерпретировать как один из типов антигенсвязывающего фрагмента антитела по настоящему изобретению.
[0109]
Способ получения антитела
Антитело по настоящему изобретению можно продуцировать в клетке как рекомбинантное антитело путем вставки ДНК, кодирующей вариабельную область тяжелой цепи, или ДНК, кодирующей вариабельную область легкой цепи, в экспрессирующий вектор, путем трансформации клетки-хозяина вектором для экспрессии и путем культивирования клетки-хозяина.
[0110]
В качестве ДНК, кодирующей антитело, ДНК, кодирующую тяжелую цепь, получают путем лигирования ДНК, кодирующей вариабельную область тяжелой цепи, и ДНК, кодирующей константную область тяжелой цепи, а ДНК, кодирующую легкую цепь, дополнительно получают путем лигирования ДНК, кодирующей вариабельную область легкой цепи и ДНК, кодирующую константную область легкой цепи.
[0111]
Антитело против SIRPα по настоящему изобретению может быть получено путем вставки вышеупомянутой ДНК, кодирующей тяжелую цепь, и ДНК, кодирующей легкую цепь, в экспрессирующий вектор, трансформации клетки-хозяина с помощью вектора и культивирования клетки-хозяина. В это время вышеупомянутая ДНК, кодирующая тяжелую цепь, и ДНК, кодирующая легкую цепь, могут быть введены в один и тот же экспрессирующий вектор, и клетка-хозяин может быть трансформирована вектором, или ДНК, кодирующей тяжелую цепь, и ДНК, кодирующая легкую цепь, может быть вставлена в отдельные векторы, и клетка-хозяин может быть трансформирована двумя векторами. В это время ДНК, кодирующие вариабельную область тяжелой цепи и вариабельную область легкой цепи, могут быть введены в вектор, в который заранее были введены ДНК, кодирующая константную область тяжелой цепи, и ДНК, кодирующую константную область легкой цепи. Кроме того, вектор может содержать ДНК, кодирующую сигнальный пептид, который способствует секреции антитела из клетки-хозяина. В этом случае ДНК, кодирующая сигнальный пептид, и ДНК, кодирующая антитело, предварительно лигируют в рамке считывания. Антитело можно получить в виде зрелого белка путем удаления сигнального пептида после получения антитела.
[0112]
В это время ДНК, кодирующая вариабельную область тяжелой цепи, ДНК, кодирующую вариабельную область легкой цепи, ДНК, полученную путем лигирования ДНК, кодирующей вариабельную область тяжелой цепи, и ДНК, кодирующей константную область тяжелой цепи, или ДНК, полученная путем лигирования ДНК, кодирующей вариабельную область легкой цепи, и ДНК, кодирующей константную область легкой цепи, может быть функционально соединена с такими элементами, как промотор, энхансер и сигнал полиаденилирования. Используемое в настоящем описании выражение «функционально соединенные» означает соединение элементов таким образом, чтобы они выполняли свои функции.
[0113]
Примеры экспрессирующего вектора ничем особо не ограничиваются при условии, что он может реплицироваться в хозяине, таком как животная клетка, бактерия и дрожжи, и включают известные плазмиды и фаги. Примеры вектора, используемого для создания экспрессирующего вектора, включают pcDNA (торговое название) (Thermo Fisher Scientific Inc.), вектор Flexi (зарегистрированное торговое название) (Promega), pUC19, pUEX2 (Amersham Pharmacia Biotech), pGEX-4T, pKK233- 2 (Pharmacia) и pMAMneo (Clontech Laboratories, Inc.). В качестве клеток-хозяев можно использовать прокариотические клетки, такие как Escherichia coli и Bacillus subtilis, и эукариотические клетки, такие как дрожжевые и животные клетки, но предпочтительно использовать эукариотические клетки. Примеры животных клеток включают клетки HEK293, которые представляют собой эмбриональную клеточную линию почек человека, и клетки яичника китайского хомячка (СНО). Достаточно ввести экспрессирующий вектор в клетку-хозяин известным методом для трансформации клетки-хозяина. Примеры метода включают метод электропорации, метод осаждения фосфатом кальция и метод трансфекции DEAE-декстраном. Полученное антитело можно очистить обычными методами выделения или очистки белка. Например, можно подходящим образом выбрать и объединить аффинную хроматографию или другие методы хроматографии, фильтрацию, ультрафильтрацию, высаливание, диализ и т.п.
[0114]
Противоопухолевые агенты
Настоящее изобретение охватывает противоопухолевый агент, содержащий антитело против SIRPα по настоящему изобретению в качестве активного ингредиента. Однако константная область тяжелой цепи антитела против SIRPα по настоящему изобретению представляет собой константную область тяжелой цепи подкласса IgG4, которая представляет собой константную область тяжелой цепи IgG4proFALA, которая имеет мутацию PRO и мутацию FALA, не имеет эффекторных функций, и имеет только функцию ингибирования передачи сигнала «Не ешь меня» путем ингибирования связывания SIRPα и CD47. Следовательно, одно только антитело против SIRPα по настоящему изобретению не может в достаточной степени повредить опухолевые клетки. Соответственно, настоящее изобретение используется в комбинации с другими противоопухолевыми агентами, которые обладают эффекторными функциями и могут атаковать и повреждать опухолевые клетки, или с другими противоопухолевыми агентами, которые ингибируют иммунную контрольную точку в иммунной клетке, индуцированной опухолевыми клетками. Другие противоопухолевые агенты для комбинированного применения связываются с опухолевой клеткой и могут привести опухолевую клетку в контакт с фагоцитом, таким как макрофаг. В это время антитело против SIRPα по настоящему изобретению ингибирует связывание CD47 с опухолевой клеткой и SIRPα в фагоците, тем самым усиливая фагоцитарную активность фагоцита против опухолевой клетки, что приводит к повреждению опухолевой клетки. То есть синергетический противоопухолевый эффект может проявляться при использовании антитела против SIRPα по настоящему изобретению и других противоопухолевых агентов в комбинации.
[0115]
Примеры противоопухолевого агента, который будет использоваться в комбинации с антителом против SIRPα по настоящему изобретению, включают ингибиторы иммунных контрольных точек и лекарственные средства антител, которые специфически связываются с опухолевым антигеном, чтобы иметь активность ADCC и/или ADCP. Примеры ингибиторов иммунных контрольных точек включают ингибиторы связывания PD-1 и PD-L1, их лигандов и ингибиторы CTLA4, а их конкретные примеры включают антитела против PD-1 (ниволумаб, пембролизумаб, цемиплимаб, спартализумаб, PDR-001, BI 754091), антитела против PD-L1 (атезолизумаб, авелумаб, дурвалумаб) и антитела против CTLA4 (ипилимумаб, тремелимумаб). Кроме того, примеры лекарственных средств на основе антител, которые специфически реагируют на опухолевый антиген, проявляя активность ADCC и/или ADCP, включают антитело против CD20 (ритуксимаб), антитело против HER2 (трастузумаб), антитело против EGFR (цетуксимаб), и антитело против CD52 (алемтузумаб).
[0116]
ADCC относится к клеточно-опосредованной реакции, при которой неспецифическая цитотоксическая клетка, экспрессирующая Fcγ-рецептор (например, NK-клетка, нейтрофил и макрофаг), распознает связывание антитела на клетке-мишени и затем вызывает лизис этой клетки-мишени. FcγRIIC и FcγRIIIA экспрессируются в NK-клетке, которая является первичной клеткой, ответственной за ADCC, а FcγRI, FcγRIIA, FcγRIIC и FcγRIIIA экспрессируются в моноцитах. Между тем, ADCP относится к реакции, опосредованной клеткой, экспрессирующей Fcγ-рецептор, при которой фагоцит (например, макрофаг, нейтрофил) распознает связывание антитела на клетке-мишени, а затем индуцирует фагоцитоз клетки-мишени в клетку. FcγRI, FcγRIIA, FcγRIIC и FcγRIIIA экспрессируются в моноците, который является первичной клеткой, ответственной за ADCP.
[0117]
Настоящее изобретение включает противоопухолевый агент, содержащий антитело против SIRPα в качестве активного ингредиента, который используется в комбинации с вышеупомянутыми другими противоопухолевыми агентами.
[0118]
Кроме того, настоящее изобретение включает противоопухолевый агент или набор, содержащий как противоопухолевый агент, содержащий антитело против SIRPα в качестве активного ингредиента, так и другие вышеупомянутые противоопухолевые агенты.
[0119]
Противоопухолевый агент, содержащий антитело против SIRPα по настоящему изобретению в качестве активного ингредиента, и другие вышеупомянутые противоопухолевые агенты, можно вводить одновременно или последовательно. Кроме того, последовательность введения не ограничена, и другие противоопухолевые агенты можно вводить после введения противоопухолевого агента, содержащего антитело против SIRPα по настоящему изобретению в качестве активного ингредиента, или противоопухолевого агента, содержащего антитело против SIRPα по настоящему изобретению в качестве активного ингредиента можно вводить после введения других противоопухолевых агентов.
[0120]
Противоопухолевый агент по настоящему изобретению можно использовать для одного типа или двух или более типов опухолей, выбранных из карциномы, саркомы, лимфомы, лейкоза, миеломы, герминомы, опухоли головного мозга, карциноида, нейробластомы, ретинобластомы и нефробластомы. Конкретные примеры карциномы включают рак почки, меланому, плоскоклеточный рак, базально-клеточный рак, рак конъюнктивы, рак полости рта, рак гортани, рак глотки, рак щитовидной железы, рак легких, рак молочной железы, рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак тонкой кишки, рак толстой кишки, рак прямой кишки, рак аппендикса, рак анального канала, рак печени, рак желчного пузыря, рак желчных путей, рак поджелудочной железы, рак надпочечников, рак мочевого пузыря, рак простаты, рак матки и рак влагалища. Конкретные примеры саркомы включают липосаркому, ангиосаркому, хондросаркому, рабдомиосаркому, саркому Юинга, остеосаркому, недифференцированную плеоморфную саркому, миксофибросаркому, злокачественную периферическую нейрилеммому, опухолевидную сиперитонеальную саркому, саркомы кишечника, ретроперитонеальную саркому. Конкретные примеры лимфомы включают B-клеточную лимфому, NK/T-клеточную лимфому и лимфому Ходжкина. Конкретные примеры лейкоза включают миелоидный лейкоз, лимфатический лейкоз, миелопролиферативное заболевание и миелодиспластический синдром. Конкретные примеры миеломы включают множественную миелому. Конкретные примеры герминомы включают рак яичек и рак яичников. Конкретные примеры опухоли головного мозга включают нейроглиому и менингиому.
[0121]
Антитело против SIRPα по настоящему изобретению усиливает клеточно-опосредованный иммунитет при использовании в комбинации с другими противоопухолевыми агентами. Настоящее изобретение также включает усилитель клеточно-опосредованного иммунитета, содержащий антитело против SIRPα в качестве активного ингредиента. В усилителе клеточно-опосредованного иммунитета клеточно-опосредованный иммунитет усиливается вместе с усилением функций клеток-натуральных киллеров и/или Т-клеток.
[0122]
Противоопухолевый агент по настоящему изобретению может содержать антитело против SIRPα в количестве, эффективном для лечения, а также фармацевтически приемлемые носители, разбавители, солюбилизаторы, эмульгаторы, консерванты, вспомогательные средства и тому подобное. «Фармацевтически приемлемые носители» и т.п. могут быть подходящим образом выбраны из широкого диапазона в соответствии с типом целевого заболевания и лекарственной формой лекарственного средства. Подходящим образом может быть выбран способ введения противоопухолевого агента по настоящему изобретению. Например, противоопухолевый агент можно вводить путем инъекции, и можно использовать местную инъекцию, внутрибрюшинную инъекцию, селективную внутривенную инфузию, внутривенную инъекцию, подкожную инъекцию, инфузию перфузата органов и т. п. Кроме того, раствор для инъекций может быть приготовлен с использованием носителя, содержащего раствор соли, раствор глюкозы или смесь соленой воды и раствора глюкозы, различные типы буферных растворов или т.п. Кроме того, перед использованием может быть приготовлен порошок и смешан с жидким носителем для приготовления раствора для инъекций.
[0123]
Другие способы введения могут быть подходящим образом выбраны вместе с разработкой состава. Например, пероральные растворы, порошки, пилюли, капсулы, таблетки и т.п. можно применять для перорального введения. Для пероральных растворов жидкие препараты для перорального применения, такие как суспензии и сиропы, могут быть получены с использованием воды, сахаридов, таких как сахароза, сорбит и фруктоза, гликолей, таких как полиэтиленгликоль, масел, таких как кунжутное масло и соевое масло, консервантов, таких как алкилпарагидроксибензоаты, ароматизаторов, таких как клубничный ароматизатор и мята перечная и т.п. Порошки, пилюли, капсулы и таблетки могут быть приготовлены с использованием вспомогательных веществ, таких как лактоза, глюкоза, сахароза и маннит, дезинтегрирующих агентов, таких как крахмал и альгинат натрия, скользящих веществ, таких как стеарат магния и тальк, связующих веществ, таких как поливиниловый спирт, гидроксипропилцеллюлоза, и желатин, поверхностно-активных веществ, таких как сложные эфиры жирных кислот, пластификаторов, таких как глицерин, и т.п. Таблетки и капсулы являются предпочтительными стандартными лекарственными формами для композиции по настоящему изобретению, поскольку они легко вводятся. Носители для производства твердых веществ используются для производства таблеток и капсул.
[0124]
Эффективная доза антитела, используемая для лечения, может быть изменена в соответствии с характеристиками симптомов, подлежащих лечению, а также возрастом и состоянием пациента и может быть окончательно определена врачом. Например, одна доза составляет от 0,0001 мг до 100 мг на кг массы тела. Предварительно определенная доза может вводиться один раз каждые 1-180 дней, или доза может быть разделена на две дозы, три дозы, четыре дозы или более доз в день с соответствующими интервалами.
Примеры
[0125]
Настоящее изобретение конкретно описано следующими примерами, но эти примеры не предназначены для ограничения объема настоящего изобретения.
[0126]
Пример 1. Получение крысиного антитела против SIRPA
1)-1 Получение экспрессирующей конструкции
1)-1-1 Конструирование экспрессирующего вектора SIRPA_V1_ECD
ДНК, кодирующая полипептид, полученный путем связывания HHHHHH с аминокислотами 1-373 на С-конце аминокислотной последовательности человеческого SIRPA_V1 (номер доступа NP_001035111 в базе данных NCBI), и вектор, полученный расщеплением pcDNA3.3-TOPO/LaxZ (Thermo Fisher Scientific Inc.) рестрикционными ферментами XbaI и PmeI, связывали с использованием набора для клонирования In-Fusion HD (Clontech Laboratories Inc.) с получением экспрессирующего вектора SIRPA_V1_ECD. Аминокислотная последовательность SIRPA_V1_ECD представлена в SEQ ID NO: 45 в списке последовательностей, а нуклеотидная последовательность, кодирующая SIRPA_V1_ECD, представлена в SEQ ID NO: 44 в списке последовательностей.
[0127]
1)-1-2 Конструирование экспрессирующего вектора SIRPA_V1_IgV
Экспрессирующий вектор SIRPA_V1_IgV был получен таким же образом, как в 1)-1-1, с использованием ДНК, кодирующей полипептид, полученный путем связывания HHHHHH с аминокислотами 1-149 на С-концевой стороне аминокислотной последовательности SIRPA_V1 (база данных NCBI Protein номер доступа NP_001035111). Аминокислотная последовательность SIRPA_V1_IgV представлена в SEQ ID NO: 47 в списке последовательностей, а нуклеотидная последовательность, кодирующая SIRPA_V1_IgV, представлена в SEQ ID NO: 46 в списке последовательностей.
[0128]
1)-1-3 Конструирование экспрессирующего вектора SIRPA_V2_ECD
Экспрессирующий вектор SIRPA_V2_ECD был получен таким же образом, как в 1) -1-1, с использованием ДНК, кодирующей полипептид, полученный связыванием HHHHHH с аминокислотами 1-372 на С-концевой стороне аминокислотной последовательности SIRPA_V2 [полученной путем модификации последовательность V1, представленной в JBC. 2014; 289 (14), 10024]. Аминокислотная последовательность SIRPA_V2_ECD представлена в SEQ ID NO: 49 в списке последовательностей, а нуклеотидная последовательность, кодирующая SIRPA_V2_ECD, представлена в SEQ ID NO: 48 в списке последовательностей.
[0129]
1)-1-4 Конструирование экспрессирующего вектора SIRPA_V2_IgV
Экспрессирующий вектор SIRPA_V2_IgV получали таким же образом, как в 1)-1-1, с использованием ДНК, кодирующей полипептид, полученный связыванием HHHHHH с аминокислотами 1-148 на С-концевой стороне аминокислотной последовательности SIRPA_V2. Аминокислотная последовательность SIRPA_V2_IgV указана в SEQ ID NO: 51 в списке последовательностей, а нуклеотидная последовательность, кодирующая SIRPA_V2_IgV, представлена в SEQ ID NO: 50 в списке последовательностей.
[0130]
1)-1-5 Конструирование экспрессирующего вектора cSIRPA_ECD
Экспрессирующий вектор cSIRPA_ECD был получен таким же образом, как в 1)-1-1, с использованием ДНК, кодирующей полипептид, полученный путем связывания HHHHHHH с аминокислотами 1-372 на С-концевой стороне аминокислотной последовательности cSIRPA (База данных NCBI Protein, номер доступа NP_001271679). Аминокислотная последовательность cSIRPA_ECD представлена в SEQ ID NO: 53 в списке последовательностей, а нуклеотидная последовательность, кодирующая cSIRPA_ECD, представлена в SEQ ID NO: 52 в списке последовательностей.
[0131]
1)-1-6 Конструирование экспрессирующего вектора CD47-Fc
Экспрессирующий вектор CD47-Fc получали таким же образом, как в 1)-1-1, с использованием ДНК, кодирующей полипептид человеческого CD47 (База данных NCBI Protein, номер доступа NP_001768). Аминокислотная последовательность CD47-Fc представлена в SEQ ID NO: 55 в списке последовательностей, а нуклеотидная последовательность, кодирующая SIRPA_V1_ECD, представлена в SEQ ID NO: 54 в списке последовательностей.
[0132]
1)-2 Получение рекомбинантных белков
1)-2-1 Получение SIRPA_V1_ECD
SIRPA_V1_ECD экспрессировался транзиторно путем трансфекции клеток FreeStyle 293F (Thermo Fisher Scientific Inc.) экспрессирующим вектором SIRPA_V1_ECD, полученным в 1)-1-1. Супернатант культуры добавляли в HisTrap excel (GE Healthcare Japan), уравновешенный 3×PBS, и колонку промывали 3×PBS. Затем фракции элюировали 3×PBS, содержащим 500 мМ имидазола (pH 7,5). SIRPA_V1_ECD очищали из собранных фракций SIRPA_V1_ECD с использованием HiLoad 26/600 Superdex 75 пг (GE Healthcare Japan).
[0133]
1)-2-2 Получение SIRPA_V1_IgV
SIRPA_V1_IgV экспрессировался транзиторно путем трансфекции клеток FreeStyle 293F (Thermo Fisher Scientific Inc.) экспрессирующим вектором SIRPA_V1_IgV, полученным в 1)-1-2. Супернатант культуры добавляли в HisTrap excel (GE Healthcare Japan), уравновешенный 3×PBS, и колонку промывали 3×PBS. Затем фракции элюировали 3×PBS, содержащим 500 мМ имидазола (pH 7,5). SIRPA_V1_IgV очищали из собранных фракций SIRPA_V1_IgV с использованием HiLoad 26/600 Superdex 75 пг (GE Healthcare Japan).
[0134]
1)-2-3 Получение SIRPA_V2_ECD
SIRPA_V2_ECD очищали таким же образом, как в 1)-2-1, используя экспрессирующий вектор SIRPA_V2_ECD, полученный в 1)-1-3.
[0135]
1)-2-4 Получение SIRPA_V2_ECD
SIRPA_V2_ECD очищали таким же образом, как в 1)-2-2, используя экспрессирующий вектор SIRPA_V2_ECD, полученный в 1)-1-4.
[0136]
1)-2-5 Получение cSIRPA_ECD
cSIRPA_ECD очищали таким же образом, как в 1)-2-1, используя экспрессирующий вектор cSIRPA_ECD, полученный в 1)-1-5.
[0137]
1)-2-6 Получение CD47-Fc
CD47-Fc экспрессировали транзиторно путем трансфекции клеток FreeStyle 293F (Thermo Fisher Scientific Inc.) экспрессирующим вектором CD47-Fc. Весь супернатант культуры добавляли к MabSelect SuRe (GE Healthcare Japan), уравновешенной PBS, а затем колонку промывали PBS. Затем фракции элюировали 2 М раствором гидрохлорида аргинина (pH 4,0) для сбора фракции, содержащей CD47-Fc. CD47-Fc очищали из собранной фракции CD47-Fc с использованием HiLoad 26/600 Superdex 200 пг (GE Healthcare Japan).
[0138]
1)-3 Иммунизация
Для иммунизации использовали самок крыс WKY/Izm (Japan SLC, Inc.), которым вводили смесь каждого из антигенных белков SIRPA_V1_ECD, SIRPA_V1_IgV, SIRPA_V2_ECD и SIRPA_V2_IgV, приготовленных в 1)-2 и полный адъювант Фрейнда (Wako's Complete Pure Aduvantries, Ltd.) в основание хвоста. Лимфатические узлы и селезенку собирали у крыс и использовали для приготовления гибридомы.
[0139]
1)-4 Получение гибридомы
Клетки лимфатических узлов или клетки селезенки подвергали электрослиянию с клетками мышиной миеломы SP2/0-ag14 (ATCC, CRL-1581) с использованием LF301-Cell Fusion Unit (BEX), и слитые клетки разбавляли и культивировали в селективной среде D ClonaCell-HY (Stem Cell Technologies Inc.). Моноклональную гибридому получали путем сбора появляющихся колоний гибридомы. Собранные колонии гибридомы культивировали, и полученные супернатанты культур гибридомы использовали для скрининга гибридомы, продуцирующей антитело против SIRPA.
[0140]
1)-5 Конструирование экспрессирующего вектора для скрининга антигенсвязывающих антител
1)-5-1 Конструирование вектора, экспрессирующего человеческие SIRPA_V1 и V2 (pcDNA3.2 V5-DEST-SIRPA_V1_ECD и SIRPA_V2_ECD)
кДНК, кодирующие белок SIRPA_V1 человека (NP_001035111) или белок SIRPA_V2 человека [получены путем модификации NP_001035111 на основе JBC. 2014; 289 (14), 10024] были клонированы в векторе pcDNA3.2 V5-DEST для конструирования pcDNA3.2 V5-DEST-SIRPA_V1_ECD и V2_ECD (или pcDNA3.2 V5-DEST-SIRPA_V1 и V2), которые экспрессировали соответствующие белки. Аминокислотная последовательность человеческого белка SIRPA_V1 представлена в SEQ ID NO: 56 в списке последовательностей, а аминокислотная последовательность человеческого белка SIRPA_V2 представлена в SEQ ID NO: 57 в списке последовательностей.
[0141]
1)-5-2 Конструирование векторов, экспрессирующих SIRPA обезьяны и SIRPA мыши (pcDNA3.2 V5-DEST-monkey SIRPA, pFLAG V5-DEST-monkey SIRPA и pFLAG V5-DEST-mouse SIRPA)
кДНК, кодирующие белок SIRPA обезьяны (NP_001271679) или белки SIRPA мыши (C57BL/6, NP_031573; BALB/c, BAA20376; 129, P97797; NOD, модифицированный SCID в Immunology. 2014; 143, 61-67) были клонированы в векторе pcDNA3.2 V5-DEST или векторе pFLAG V5-DEST для конструирования векторов pcDNA3.2 V5-DEST-monkey SIRPA, pFLAG V5-DEST-monkey SIRPA и pFLAG V5-DEST-mouse SIRPA (C57BL/6, BALB/c, 129, NOD), которые экспрессировали соответствующие белки. Аминокислотная последовательность SIRPA обезьяны представлена в SEQ ID NO: 58 в списке последовательностей, аминокислотная последовательность мышиного SIRPA_C57BL/6 представлена в SEQ ID NO: 59 в списке последовательностей, аминокислотная последовательность мышиного SIRPA_BALB/c представлена в SEQ ID NO: 60 в списке последовательностей, аминокислотная последовательность мышиного SIRPA_129 представлена в SEQ ID NO: 61 в списке последовательностей, а аминокислотная последовательность мышиного SIRPA_NOD представлена в SEQ ID NO: 62 в списке последовательностей.
[0142]
1)-6 Скрининг гибридом
1)-6-1 Получение клеток, экспрессирующих ген антигена, для клеточного ИФА
Клетки HEK293α (стабильно экспрессирующая линия клеток, полученная из HEK293, которая экспрессирует интегрин αv и интегрин β3) были получены в среде DMEM, содержащей 10% FBS, при 7,5×105 клеток/мл. В соответствии с процедурой трансфекции с использованием липофектамина 2000 (Thermo Fisher Scientific Inc.) в клетки вводили pcDNA3.2 V5-DEST-SIRPA_V1 или pcDNA3.2 V5-DEST-SIRPA_V2 или pcDNA3.2 V5-DEST в качестве контроля, и 50 мкл на лунку вносили аликвотами в 96-луночный планшет на половину площади (Corning Incorporated) или добавляли аликвоты по 100 мкл на лунку в 96-луночный планшет (Corning Incorporated), и клетки культивировали в среде DMEM, содержащей 10% FBS, при 37°C в условиях 5% CO2 в течение 24-27 часов. Полученные трансфецированные клетки использовали для клеточного ИФА в состоянии, при котором клетки прикрепились друг к другу.
[0143]
1)-6-2 Оценка связывания с человеческим SIRPA (клеточный ИФА)
После удаления супернатанта культуры клеток 293α с введенным экспрессирующим вектором, полученных в примере 1)-6-1, супернатант культуры гибридомы добавляли к каждому из pcDNA3.2 V5-DEST-SIRPA_V1, pcDNA3.2 V5-DEST-SIRPA_V2 или клетки 293α с введенным pcDNA3.2 V5-DEST, и смесь оставляли на один час при 4 °C. Клетки в лунках дважды промывали PBS, содержащим 5% FBS, с последующим добавлением антитела против IgG пероксидазы крысы, продуцируемого кроликом (SIGMA), разведенного в 500 раз 5% FBS-содержащим PBS, и смеси давали отстояться при 4C в течение одного часа. Клетки в лунках дважды промывали 5% FBS, содержащим PBS, с последующим добавлением 50 мкл на лунку окрашивающего раствора OPD [о-фенилендиамин дигидрохлорид (Wako Pure Chemical Industries, Ltd.) и H2O2 растворяли в растворе OPD (0,05 М тринатрийцитрат, 0,1 М додекагидрат гидрофосфата динатрия, pH 4,5) при 0,4 мг/мл и 0,6% (об./об.), соответственно]. Реакцию окрашивания проводили при периодическом перемешивании, добавляли 50 мкл 1 М HCl на лунку для прекращения реакции окрашивания, а затем измеряли оптическую плотность при 490 нм с помощью планшет-ридера (EnVision: PerkinElmer Inc.). Чтобы выбрать гибридому, продуцирующую антитело, которое специфически связывается с SIRPA, экспрессируемым на поверхности клеточной мембраны, гибридома, продуцирующая супернатант культуры с более высокой абсорбцией клеток 293α с введенными экспрессирующими векторами pcDNA3.2 V5-DEST-SIRPA_V1 или pcDNA3.2 V5-DEST-SIRPA_V2, чем у контрольных клеток 293α с введенным pcDNA3.2. V5-DEST, была отобрана как положительная по продуцированию антитела против SIRPA.
[0144]
1)-6-3 Оценка активности ингибирования связывания SIRPA-CD47
После удаления супернатанта культуры клеток 293α с введенным экспрессирующим вектором, полученных в примере 1)-6-1, супернатант культуры гибридомы добавляли к каждому из pcDNA3.2 V5-DEST-SIRPA_V1, pcDNA3.2 V5-DEST-SIRPA_V2 , или клеток 293α с введенным pcDNA3.2 V5-DEST, сразу после добавления 50 мкл на лунку CD47-Fc, меченного пероксидазой, приготовленного с 5% FBS-содержащим PBS в конечной концентрации 10000 нг/мл, и смесь выдерживали при 4°C в течение одного часа. Клетки в лунке дважды промывали 5% FBS, содержащим PBS, с последующим добавлением 100 мкл на лунку окрашивающего раствора OPD [дигидрохлорид о-фенилендиамина (Wako Pure Chemical Industries, Ltd.) и H2O2 растворяли в OPD. раствор (0,05 M тринатрийцитрата, 0,1 M додекагидрата гидрофосфата динатрия, pH 4,5) при 0,4 мг/мл и 0,6% (об./об.), соответственно]. Реакцию окрашивания проводили при периодическом перемешивании, добавляли 100 мкл 1 М HCl на лунку для прекращения реакции окрашивания, а затем измеряли оптическую плотность при 490 нм с помощью планшет-ридера (SpectraMax: Molecular Devices, LLC). Для выбора гибридомы, продуцирующей антитело, которое специфически ингибирует связывание SIRPA, экспрессируемого на поверхности клеточной мембраны, и CD47-Fc, гибридома, продуцирующая супернатант культуры, имеющий более низкую абсорбцию с клетками 293α с введенным экспрессирующим вектором pcDNA3.2 V5-DEST-SIRPA_V1 или pcDNA3.2 V5-DEST-SIRPA_V2, чем с группой, полученной путем добавления контрольной среды, была выбрана как положительная по продуцированию антитела против SIRPA, обладающего ингибирующей активностью в отношении связывания лиганда.
[0145]
1)-6-4 Анализ перекрестной реактивности видов с SIRPA мыши или обезьяны
После культивирования супернатант клеток 293α с введенным экспрессирующим вектором pcDNA3.2 V5-DEST-SIRPA-monkey или pcDNA3.2 V5-DEST-SIRPA-mouse или клеток 293α с введенным pcDNA3.2 V5-DEST, полученных в Примере 1)-5-2, удаляли, связывание с SIRPA обезьяны или мыши оценивали таким же образом, как и в методе оценки активности связывания SIRPA человека. Всего семь клонов антител D13, F42, F44, F47, F60, F63 и F86 были отобраны на основе вышеупомянутой активности связывания с SIRPA человека и других видов животных и активности ингибирования связывания SIRPA-CD47.
[0146]
1)-7 Определение изотипа антител
Из полученных гибридом, продуцирующих антитело против SIRPA крысы, были получены гибридомы, продуцирующие антитела D13, F42, F44, F47, F60, F63 и F86, которые показали высокоспецифичное связывание с человеческими SIRPA_V1 и SIRPA_V2 и SIRPA обезьяны, и так как предположили, что они обладают высокой ингибирующей активностью связывания SIRPA-CD47, они были отобраны, и были идентифицированы их изотипы антител. Изотипы определяли с использованием набора ИФА для изотипирования иммуноглобулина крысы (BD Pharmingen). Результаты продемонстрировали, что изотип крысиных моноклональных антител против SIRPA D13, F42, F60 и F86 соответствовали IgG1/κ-цепь, изотипы F44 и F47 соответствовали IgG2a/κ-цепь, а изотип F63 соответствовал IgG2a/λ-цепь.
[0147]
1)-8 Получение моноклональных антител
1)-8-1 Получение культуральных супернатантов
Семь различных крысиных моноклональных антител против SIRPA очищали из супернатантов гибридомной культуры. Сначала каждую гибридому, продуцирующую антитела, наращивали до достаточного количества с использованием селективной среды E ClonaCell-HY (STEMCELL Technologies Inc.), а затем среду заменяли гентамицин 5 мкг/мл (Thermo Fisher Scientific Inc.)-содержащей средой Hybridoma SFM (Thermo Fisher Scientific Inc.), к которой добавляли 20% FBS со сверхнизким уровнем IgG (Thermo Fisher Scientific Inc.), и гибридому культивировали в течение 7 дней. Супернатант культуры собирали и стерилизовали через фильтр 0,22 мкм (Corning Incorporated).
[0148]
1)-8-2 Очистка антител
Антитела очищали из супернатантов культур гибридомы, полученных в примере 1)-8-1, с помощью аффинной хроматографии на протеине G. Антитело адсорбировали в колонке с протеином G (GE Healthcare Bioscience Corp.), колонку промывали PBS, а затем антитело элюировали 0,1 М водным раствором глицина/соляной кислоты (pH 2,7). PH элюата доводили до 7,0-7,5 путем добавления 1 М трис-HCl (pH 9,0), буфер заменяли PBS с использованием центрифужного UF-фильтрующего устройства VIVASPIN20 (отсечка молекулярной массы для ультрафильтрации, 30 кДа: Sartorius AG) и раствор антитела концентрировали до концентрации антител 2 мг/мл или выше. Наконец, раствор фильтровали с помощью фильтра Minisart-Plus (Sartorius AG) с получением очищенного образца.
[0149]
Пример 2. Оценка in vitro семи различных крысиных антител против SIRPA человека
2)-1 Создание экспрессирующих векторов для скрининга антигенсвязывающих антител
2)-1-1 Конструирование экспрессирующего вектора FLAG-SIRPA человека (pFLAG V5-DEST-SIRPA_V1-V10)
кДНК, кодирующие 10 различных вариантов белков SIRPA человека (выдержка из Nature Immunology. 2007; 8, 1313-1323) были клонированы в векторе pFLAG V5-DEST для конструирования вектора pFLAG V5-DEST-SIRPA_V1-V10, экспрессирующего эти вариантные белки.
Аминокислотная последовательность человеческого SIRPA_V3 представлена в SEQ ID NO: 63 в списке последовательностей, аминокислотная последовательность человеческого SIRPA_V4 представлена в SEQ ID NO: 64 в списке последовательностей, аминокислотная последовательность человеческого SIRPA_V5 представлена в SEQ ID NO: 65 в списке последовательностей, аминокислотная последовательность человеческого SIRPA_V6 представлена в SEQ ID NO: 66 в списке последовательностей, аминокислотная последовательность человеческого SIRPA_V7 представлена в SEQ ID NO: 67 в списке последовательностей, аминокислотная последовательность человеческого SIRPA_V8 представлена в SEQ ID NO: 68 в списке последовательностей, аминокислотная последовательность человеческого SIRPA_V9 представлена в SEQ ID NO: 69 в списке последовательностей, а аминокислотная последовательность человеческого SIRPA_V10 представлена в SEQ ID NO: 70 в списке последовательностей.
[0150]
2)-1-2-1 Конструирование вектора, экспрессирующего человеческий SIRPA_ECD, IgV и IgV_IgC1 (pFLAG V5-DEST-SIRPA_ECD и IgVIgV_IgC1)
кДНК, кодирующие аминокислоты 1-504 полноразмерного человеческого SIRPA_V2, вариант, дефицитный в области аминокислот 165-371 (далее именуемый «вариант IgV»), и вариант, дефицитный в области аминокислот 225-371 (далее именуемый «вариант IgV_IgC»), клонировали в векторе pFLAG V5-DEST для конструирования вектора, экспрессирующего соответствующие вариантные белки.
[0151]
Аминокислотная последовательность варианта SIRPA-человека_V2_IgV представлена в SEQ ID NO: 71 в списке последовательностей, а аминокислоты варианта SIRPA-человека_V2_IgV_IgC1 представлены в SEQ ID NO: 72 в списке последовательностей.
[0152]
2)-1-2-2 Конструирование вектора, экспрессирующего hmSIRPA_Δ0, Δ1 и Δ2_mouse SIRPA (pFLAG V5-DEST-hmSIRPA_Δ0, Δ1 и Δ2)
Вариант SIRPA, в котором последовательность SFTGE (SEQ ID NO: 78), состоящая из аминокислотных остатков 81-85, указанных в SEQ ID NO: 60 мышиного SIRPA, была заменена последовательностью NQKEG (SEQ ID NO: 76), и последовательность RGSSE, состоящая из аминокислотных остатков 126-130 (SEQ ID NO: 79), была заменена последовательностью KGS, обозначенной как hmSIRPA_Δ0. Вариант SIRPA, в котором последовательность SFTGE (SEQ ID NO: 78), состоящая из аминокислотных остатков 81-85, представленных в SEQ ID NO: 60 мышиного SIRPA, была заменена последовательностью NQKEE (SEQ ID NO: 77), был обозначен как hmSIRPA_Δ1. Кроме того, вариант SIRPA, в котором последовательность SFTGE (SEQ ID NO: 78), состоящая из аминокислотных остатков 81-85, представленных в SEQ ID NO: 60 мышиного SIRPA, была заменена последовательностью SFTEG (SEQ ID NO: 80), был обозначен как hmSIRPA_Δ2. кДНК, кодирующие эти варианты SIRPA, клонировали в векторе pFLAG V5-DEST для создания вектора, экспрессирующего соответствующие варианты SIRPA.
Аминокислотная последовательность hmSIRPA_Δ0 представлена в SEQ ID NO: 73 в списке последовательностей, аминокислоты hmSIRPA_Δ1 представлены в SEQ ID NO: 74 в списке последовательностей, а аминокислоты hmSIRPA_Δ2 представлены в SEQ ID NO: 75 в списке последовательностей.
[0153]
2)-2 Оценка связывания с вариантами SIRPA человека V1-V10
После удаления культурального супернатанта клеток 293α, в которые был введен вектор, экспрессирующий 10 различных вариантов белков, полученных в Примере 2)-1-1, добавляли 50 мкл на лунку очищенного крысиного антитела против SIRPA человека, разбавленного 5% FBS-содержащим PBS до конечной концентрации 10000 нг/мл к каждым из клеток 293α с введенными pFLAG V5-DEST-SIRPA_V1-V10 и pFLAG V5-DEST, и смесь выдерживали при 4°C в течение одного часа. Далее, 50 мкл на лунку антитела против FLAG M2 (SIGMA), разведенного 5% FBS-содержащим PBS до конечной концентрации 10000 нг/мл, добавляли в лунку для детектирования экспрессии каждого варианта SIRPA, и смесь выдерживали при 4°С в течение одного часа. После этого связывание с 10 различными вариантами SIRPA человека оценивали таким же образом, как и при оценке активности связывания SIRPA человека, описанной в 1)-6-2. Связывание крысиных антител против SIRPA человека с каждым вариантом стандартизировали по экспрессии фрагмента FLAG.
Как показано в Таблице 1, все клоны показали связывание со всеми вариантами.
[0154]
[Таблица 1]
(Таблица 1) Связывание крысиных антител против SIPRA человека с вариантами V1-V10
hSIPRA-связывающая активность (варианты)
[0155]
2)-3 Анализ перекрестной реактивности видов с SIRPA мыши или обезьяны
После того как был удален культуральный супернатант клеток 293α, в которые был введен экспрессирующий вектор pFLAG V5-DEST-SIRPA-обезьяны или pFLAG V5-DEST-SIRPA-мыши, и клеток 293α с введенным pFLAG V5-DEST, полученных в Примере 1) -5-2, оценивали связывание с SIRPA обезьяны или мыши таким же образом, как и в отношении активности связывания SIRPA человека.
Как показано в Таблице 2, все крысиные антитела против SIRPA человека показали связывание с SIRPA обезьяны, но не показали связывания с SIRPA мыши.
[0156]
[Таблица 2]
(Таблица 2) Видовая перекрестная реактивность крысиных антител против SIPRA человека
SIPRA-связывающая активность (виды животных)
[0157]
2)-4 Анализ эпитопа
2)-4-1-1 Анализ эпитопов клеточным ИФА (1)
После того, как был удален культуральный супернатант клеток 293α, в которые был введен экспрессирующий вектор варианта pFLAG V5-DEST-ECD, варианта IgV и варианта IgV_IgC1, полученного в 2)-1-2-1, или супернатант клеток 293α с введенным pFLAG V5-DEST, добавляли к соответствующим клеткам 50 мкл на лунку очищенных крысиных антител против SIRPA человека, разбавленных 5% FBS-содержащим PBS до конечной концентрации 10000 нг/мл, и смесь выдерживали при 4°C в течение одного часа. Далее 50 мкл на лунку антитела против FLAG M2 (SIGMA), разведенного 5% FBS-содержащим PBS до конечной концентрации 10000 нг/мл, добавляли в лунку для определения экспрессии каждой конструкции SIRPA, и смесь подвергали анализу. выдерживают при 4°С в течение одного часа. После этого связывание семи очищенных клонов антител с каждым доменом оценивали таким же образом, как и при оценке активности связывания человеческого SIRPA. Связывание крысиных антител против SIRPA человека с каждой конструкцией стандартизировали по экспрессии фрагмента FLAG.
Учитывая, что крысиные антитела против SIRPA человека показали связывание со всеми конструкциями, как показано на Фигуре 1A, было высказано предположение, что эти антитела распознают домен IgV.
[0158]
2)-4-1-2 Анализ эпитопов клеточным ИФА (2)
После того, как был удален супернатант культуры клеток 293α, в которые был введен экспрессирующий вектор pFLAG V5-DEST-hmSIRPA_Δ0, Δ1 и Δ2, полученный в 2)-1-2-2, и клеток 293α с введенным pFLAG V5-DEST, к этим клеткам добавляли 50 мкл на лунку четыре различных гуманизированных антитела против SIRPA человека D13 и химерное антитело против SIRPA человека, разведенное 5% FBS-содержащим PBS до конечной концентрации 10000 нг/мл, и смесь выдерживали при 4°C в течение одного часа. Далее 50 мкл на лунку антитела против FLAG M2 (SIGMA), разведенного 5% FBS-содержащим PBS до конечной концентрации 10000 нг/мл, добавляли в лунку для определения экспрессии каждой конструкции SIRPA, и смесь подвергали анализу. выдерживают при 4°С в течение одного часа. После этого связывание с каждой конструкцией оценивали таким же образом, как и при оценке активности связывания человеческого SIRPA. Связывание антител против SIRPA человека с каждой конструкцией стандартизировали экспрессией фрагмента FLAG.
Как показано на Фигуре 1B, hD13_H1L3, hD13_H1L4h, hD13_H2L2, hD13_H2L3 и cD13 проявляли зависимое от концентрации связывание с добавленным антителом hmSIRPA_Δ0, имеющим последовательность NQKEG, но не проявляли связывания с hmSIRPA_Δ1 или hmSIRPA_Δ2 при любой концентрации.
Вышеупомянутые данные выявили, что для связывания hD13 и cD13 необходима последовательность NQKEG.
[0159]
2)-4-2 Анализ эпитопов методом рентгеновской кристаллографии
2)-4-2-1 Кристаллизация комплекса
Полноразмерное антитело cD13 расщепляли лизилэндопептидазой (Wako Pure Chemical Industries, Ltd.) в ограниченной степени в слабокислых условиях, и Fab-фрагмент антитела cD13 выделяли с использованием катионообменной колонки BioAssist S (Tosoh Corporation). SIRPA_V2_IgV, полученный в Примере 1)-2, и Fab-фрагмент cD13 смешивали в молярном соотношении 1:1, фракцию комплекса выделяли с использованием гель-фильтрационной колонки Superdex 75, 10/300 GL (GE Healthcare), с последующей заменой буфера на 10 мМ трис-HCl (pH 8,2) ультрафильтрацией, и комплекс концентрировали до 3 г/л. Раствор комплекса кристаллизовали пародиффузионным методом. Раствор, полученный путем добавления равного объема раствора осаждающего вещества [0,2 М двухосновного фосфата калия, 20% (мас./об.) полиэтиленгликоля 3350, pH 9,2] к 0,5 мкл раствора белка, помещали в герметичный контейнер, содержащий 0,05 мл раствора-осаждающего вещества, чтобы эти растворы не контактировали друг с другом, и растворы выдерживали при 25°C. Через одну неделю были получены стержневидные кристаллы 0,2 мм × 0,2 мм × 0,05 мм. Полученные кристаллы погружали в раствор, полученный разбавлением раствора осаждающего вещества приблизительно в 1,4 раза гликолем, а затем смесь замораживали жидким азотом. Данные по дифракции рентгеновских лучей были собраны с помощью линии пучка PF BL-17A на установке источников света Photon Factory (Tsukuba). Интенсивность дифракции количественно оценивали по полученному дифракционному изображению с использованием программного обеспечения XDS (Max Plank Institute for Medical Research) для получения фактора кристаллической структуры. Кристалл имел гексагональную кристаллическую систему с пространственной группой R32 и элементарной ячейкой кристалла a=b=149,61Å, c=155,61Å, α= β= 90° и γ = 120°.
[0160]
2)-4-2-2 Структурный анализ комплекса
Фазу определяли, выполняя молекулярную замену, используя координату трехмерной структуры гомологичной модели полученного структурного фактора и Fab-фрагмента и известной структуры (PDBID: 2JJS) домена SIRPA IgV человека. Для вычислений использовался программный фазер (CCP4: Collaborative Computational Project № 4). Кристалл содержал один комплекс в асимметричном звене. Структура уточнялась с помощью программного обеспечения Refmac5 (CCP4: Collaborative Computational Project No. 4), а модель корректировалась с помощью программного обеспечения Coot. Эту операцию повторяли для получения конечного значения R 22% и значения свободного R 25% при разрешении 2,4 Å. Конечная модель содержала аминокислотные остатки с 1 по 213 L-цепи и аминокислотные остатки с 1 по 225 H-цепи Fab-фрагмента cD13 и аминокислотные остатки с 33 по 143 варианта 2 SIRPA человека.
[0161]
2)-4-2-3 Структурный анализ комплекса и идентификация эпитопа D13
Аминокислотные остатки SIRPA человека в пределах 4Å от Fab-фрагмента cD13 (положение каждого аминокислотного остатка соответствует положению в SEQ ID NO: 57 в списке последовательностей) следующие: Gly64, Pro65, Leu78, Gln82, Lys83 , Glu84, Gly85, His86, Phe87, Thr91, Thr92, Glu95, Thr97, Lys98 и Lys126. На Фигуре 2 показана ленточная модель всего комплекса и его поверхности, а на Фигуре 3 показаны взаимодействия между областями до бета 5 (А) и после бета 5 (В) человеческого SIRPA и cD13. Было показано, что cD13 строго распознает петлю бета 4-5, то есть остатки с номерами 82-87, которые имеют небольшое разнообразие последовательностей в SIRPA человека, и это обеспечивает сильное связывание с различными вариантами (Фигура 4). Напротив, взаимодействия слабые в петле бета 5-6, то есть в области с номерами остатков от 92 до 105. Например, Glu95, который в некоторых вариантах заменен аспарагиновой кислотой вместо глутаминовой кислоты, присутствует рядом с Fab, но электронная плотность боковой цепи не наблюдается, что указывает на то, что Glu95 не вносит значительного вклада во взаимодействия. Среди последовательностей на Фигуре 4 черная точка «•» указывает, что аминокислотный остаток идентичен таковому в SIRPA_V1, а аминокислотный остаток, показанный на сайте, указывает, что аминокислотный остаток отличается.
[0162]
2)-5 Оценка активности ингибирования связывания человеческого SIRPA-CD47
После удаления культурального супернатанта клеток 293α, в который был введен экспрессирующий вектор человеческого SIRPA, полученный в 1)-5-1, добавляли 50 мкл на лунку очищенных крысиных антител против человеческого SIRPA, разбавленных 5% FBS-содержащим PBS до конечной концентрации от 0 до 10000 нг/мл, к каждым из клеток 293α с введенным pcDNA3.2 V5-DEST-SIRPA_V1, pcDNA3.2 V5-DEST-SIRPA_V2 или pcDNA3.2 V5-DEST, сразу же с последующим добавлением 50 мкл на лунку меченного пероксидазой CD47-Fc, приготовленного в 5% FBS-содержащем PBS с конечной концентрацией 10000 нг/мл, и смесь выдерживали один час при 4°C. После этого активность по ингибированию связывания оценивали таким же образом, как в 1)-6-3.
Как показано в Таблице 3, все крысиные антитела против человеческого SIRPA проявляли активность ингибирования связывания против человеческого SIRPA-CD47.
[0163]
[Таблица 3]
(Таблица 3) Активность ингибирования связывания SIPRA-CD47 крысиных антител против SIPRA человека
Активность ингибирования связывания SIPRA-CD47
[0164]
2)-6 ADCP активность крысиных антител против SIRPA человека против линии опухолевых клеток
2)-6-1 Получение клеток-мишеней
TrypLE Express (Life Technology) добавляли к клеткам клеточной линии AGS рака желудка человека, смеси давали возможность прореагировать при 37°C в течение пяти минут, а затем клетки диссоциировали. Добавляли среду RPMI 1640, содержащую 10% FBS (Life Technology), клетки промывали дважды, затем клетки дважды промывали PBS, а затем подсчитывали количество жизнеспособных клеток с помощью теста исключения красителя трипанового синего. Раствор из 4×107 клеток собирали и центрифугировали, а затем клетки суспендировали в 2 мл разбавителя C, поставляемого в наборе PKH26 Red Fluorescent Cell Linker Kit для общего мечения мембран клеток (Sigma). После того, как 1 мМ линкера PKH26 разбавляли разбавителем C до 10 мкМ в качестве раствора для мечения, сразу же за этим следовало смешивание клеточной суспензии и равного объема раствора линкера PKH26, и смесь выдерживали при комнатной температуре в течение пяти минут. Добавляли 25 мл среды RPMI 1640, содержащей 10% FBS (Life Technology), клетки промывали дважды, затем клетки повторно суспендировали до 2×106 клеток/мл и использовали в качестве клеток-мишеней.
[0165]
2)-6-2 Получение PBMC
После того как 25 мл крови нормального пациента медленно наслоили на 20 мл Ficoll-Paque Plus (GE Healthcare), смесь центрифугировали при 1500 об/мин при комнатной температуре в течение 30 минут. Клеточный слой, расположенный между плазмой и Ficoll-Paque Plus, собирали с помощью пипетки и суспендировали в 20 мл среды RPMI 1640, содержащей 10% FBS (Life Technology). Суспензию центрифугировали при 1500 об/мин в течение пяти минут, супернатант удаляли, добавляли 20 мл среды RPMI 1640, содержащей 10% FBS, и клетки дважды промывали. После того как клетки суспендировали в 1 мл буфера RoboSep (STEMCELL Technologies Inc.), количество жизнеспособных клеток измеряли с помощью теста исключения красителя трипанового синего, и клетки использовали в качестве эффекторных клеток.
[0166]
2)-6-3 Получение эффекторных клеток
PBMC, полученные в Примере 2)-6-2, суспендировали в буфере RoboSep (STEMCELL Technologies Inc.) при 5×107 клеток/мл. Объем 50 мкл коктейля для обогащения моноцитов человека EasySep из набора для обогащения моноцитов человека без истощения CD16 (STEMCELL Technologies Inc.) добавляли к 1 мл суспензии РВМС. После того как смеси давали возможность прореагировать при 4°C в течение 10 минут, к каждому 1 мл суспензии PBMC добавляли 50 мкл магнитных частиц EasySep. После того как смеси давали возможность прореагировать при 4°C в течение пяти минут, добавляли буфер RoboSep (STEMCELL Technologies Inc.) до 2,5 мл, и смесь помещали в EasySep Magnet. Через 2 минуты 30 секунд супернатант собирали и центрифугировали при 1200 об/мин в течение пяти минут и собирали фракции моноцитов. Добавляли среду RPMI 1640, содержащую 10% FBS (Life Technology), клетки промывали один раз с последующим добавлением среды RPMI 1640, содержащей 10% FBS (Life Technology), содержащей 10 нг/мл M-CSF (PEPROTEC), и смесь высевали в колбу для суспензионных культур 225 (Sumitomo Bakelite Co., Ltd.). Суспензию культивировали при 37°C в условиях 5% CO2 в течение 10 дней. Супернатант культуры удаляли с последующим добавлением среды RPMI 1640, содержащей 10% FBS (Life Technology), содержащей 10 нг/мл IL-10 и 10 нг/мл M-CSF (PeproTech, Inc.), и суспензию культивировали еще 2 дня. Через 12 дней к макрофагам, индуцированным дифференцировкой, добавляли TrypLE Express (Life Technology), и смеси давали возможность реагировать при 37°C в течение 40 минут для диссоциации клеток. Добавляли среду RPMI 1640, содержащую 10% FBS (Life Technology), клетки дважды промывали, а затем клетки ресуспендировали в среде RPMI 1640, содержащей 10% FBS (Life Technology) при 5×105 клеток/мл, и использовали как эффекторные клетки.
[0167]
2)-6-4 Оценка активности ADCP
Объем 50 мкл на лунку клеток-мишеней, полученных способом Примера 2)-6-1, добавляли в 96-луночный микропланшет с U-образным дном со сверхнизким прикреплением (Sumitomo Bakelite Co., Ltd.). В лунки добавляли по 50 мкл на лунку семи клонов крысиного антитела против человеческого SIRPA, Hu5F9G4 (полученного с использованием антитела против человеческого CD47: PLOS ONE 10 [9]: e0137345, US2015183874), TTI-621 (полученного с использованием человеческого SIRPA -Fc: Международная публикация WO 2014/094122), и различные контрольные IgG, разбавленные 10% FBS-содержащей средой RPMI 1640 (Life Technology) до конечных концентраций от 0 до 10000 нг/мл. Объем 50 мкл на лунку среды RPMI 1640, содержащей 10% FBS (Life Technology), добавляли для группы с одним агентом и добавляли 50 мкл на лунку трастузумаба (Roche), разбавленного средой RPMI 1640, содержащей 10% FBS. (Life Technology), до конечной концентрации 250 нг/мл для группы комбинированного использования. Добавляли объем 50 мкл на лунку (1×106 клеток/мл) эффекторных клеток, полученных в Примере 2)-6-3, и затем смесь выдерживали при 37°C в условиях 5% CO2 в течение 16 часов. Смесь центрифугировали при 1200 об/мин при 4°C в течение пяти минут, супернатант удаляли и клетки промывали 200 мкл на лунку PBS, содержащего 5% FBS. К клеткам добавляли 45 мкл на лунку 5% FBS-содержащего PBS и 5 мкл на лунку APC мышиного антитела против человеческого CD11b (Becton Dickinson), и смесь выдерживали при 4°C в течение 15 минут. Клетки дважды промывали 200 мкл на лунку 5% FBS-содержащего PBS. Клетки суспендировали в 100 мкл на лунку стабилизирующего фиксатора 1xBD (Becton Dickinson), и смесь оставляли на ночь при 4°C. На следующий день клетки измеряли проточной цитометрией (FACS Canto II: Becton Dickinson). FlowJo (TreeStar) использовали для анализа данных. Клетки были охарактеризованы путем детектирования света прямого рассеяния (FSC) и света бокового рассеяния (SSC), а затем было получено количество клеток, положительных для PE (A), и клеток, положительных как для APC, так и для PE (B). Клетки, положительные как для APC, так и для PE (B), считались клетками-мишенями, которые были фагоцитированы макрофагами. Процент клеточного фагоцитоза по активности ADCP рассчитывали по следующему уравнению:
Процент клеточного фагоцитоза (%) = B/(A+B) × 100
Как показано на Фигуре 5, крысиные антитела против SIRPA человека, используемые отдельно, проявляли более низкую активность ADCP против CD47-положительной клеточной линии AGS рака желудка человека по сравнению с Hu5F9G4 (антитело против человеческого CD47) и TTI-621 (человеческий SIRPA-Fc) (Фигура 5A). Напротив, антитела против SIRPA, используемые в комбинации с трастузумабом, проявляли активность ADCP, аналогичную активности Hu5F9-G4 и TTI-621 (Фигура 5B). Эти результаты показали, что ингибирование связывания SIRPA-CD47 антителами против SIRPA усиливает фагоцитарную активность макрофагов.
[0168]
Пример 3. Анализ нуклеотидной последовательности кДНК вариабельных областей крысинских антител против SIRPA (D13, F44 и F63) и определение их аминокислотных последовательностей
3)-1 Анализ нуклеотидной последовательности кДНК вариабельной области D13 и определение ее аминокислотной последовательности
3)-1-1 Получение суммарной РНК гибридомы, продуцирующей D13
Для амплификации кДНК, кодирующей вариабельную область D13, суммарную РНК получали из гибридомы, продуцирующей D13, с использованием реагента TRIzol (Ambion).
[0169]
3) -1-2 Анализ нуклеотидной последовательности кДНК вариабельной области легкой цепи D13 с помощью 5'-RACE ПЦР и определение ее аминокислотной последовательности
кДНК, кодирующую вариабельную область легкой цепи, амплифицировали с использованием приблизительно 1 мкг общей РНК, полученной в Примере 3)-1-1, и набора SMARTer RACE 5'/3' (Clontech Laboratories Inc.). В качестве праймеров для амплификации кДНК, кодирующей вариабельную область гена легкой цепи D13 с помощью ПЦР, использовали смесь универсальных праймеров A (UPM: входит в комплект SMARTer RACE 5'/3') и праймеры, разработанные на основе известной последовательности константной области легкой цепи крысы.
кДНК, кодирующая вариабельную область легкой цепи, амплифицированную с помощью 5'-RACE PCR, была клонирована в плазмиде, а затем был проведен анализ последовательности для нуклеотидной последовательности кДНК, кодирующей вариабельную область легкой цепи.
Аминокислотная последовательность вариабельной области легкой цепи D13, кодируемая определенной нуклеотидной последовательностью кДНК, соответствует аминокислотной последовательности, состоящей из аминокислотных остатков 21-126 в SEQ ID NO: 23 в списке последовательностей. Аминокислотные последовательности CDRL1, CDRL2 и CDRL3 в D13 представлены в SEQ ID NO: 1-3 в списке последовательностей. Аминокислоты этих CDR также представлены на Фигуре 28.
Последовательность аминоцепи каждой CDR основана на определении AbM (Martin, A.C.R., Cheetham, J.C., and Rees, A.R. Proc. Natl. Acad. Sci. USA. 1989; 86, 9268-9272).
[0170]
3)-1-3 Анализ нуклеотидной последовательности кДНК вариабельной области тяжелой цепи D13 с помощью 5'-RACE ПЦР и определение ее аминокислотной последовательности
кДНК, кодирующую вариабельную область тяжелой цепи, амплифицировали с использованием приблизительно 1 мкг общей РНК, полученной в примере 3)-1-1, и набора SMARTer RACE 5'/3' (Clontech Laboratories Inc.). В качестве праймеров для амплификации кДНК, кодирующей вариабельную область гена тяжелой цепи D13 с помощью ПЦР, использовали смесь универсальных праймеров A (UPM: входит в комплект SMARTer RACE 5'/3') и праймеры, разработанные на основе известной последовательности константной области тяжелой цепи крысы.
кДНК, кодирующая вариабельную область тяжелой цепи, амплифицированную с помощью 5'-RACE ПЦР, была клонирована в плазмиде, а затем был проведен анализ нуклеотидной последовательности кДНК, кодирующей вариабельную область тяжелой цепи.
Аминокислотная последовательность вариабельной области тяжелой цепи D13, кодируемая определенной нуклеотидной последовательностью кДНК, соответствует аминокислотной последовательности, состоящей из аминокислотных остатков 20-139 в SEQ ID NO: 25 в списке последовательностей. Аминокислотные последовательности CDRH1, CDRH2 и CDRH3 D13 представлены в SEQ ID NO: 4-6 в списке последовательностей. Аминокислотные последовательности этих CDR также представлены на Фигуре 28.
[0171]
3)-2 Анализ нуклеотидной последовательности кДНК вариабельной области D13 и определение ее аминокислотной последовательности
Анализ выполняли так же, как в Примере 3)-1. Аминокислотная последовательность вариабельной области легкой цепи F44, кодируемая определенной нуклеотидной последовательностью кДНК, соответствует аминокислотной последовательности, состоящей из аминокислотных остатков 21-127 в SEQ ID NO: 27 в списке последовательностей. Аминокислотная последовательность вариабельной области тяжелой цепи F44, кодируемая определенной нуклеотидной последовательностью кДНК, соответствует аминокислотной последовательности, состоящей из аминокислотных остатков 20-138 в SEQ ID NO: 29 в списке последовательностей. Аминокислотные последовательности CDRL1, CDRL2, CDRL3, CDRH1, CDRH2 и CDRH3 F44 представлены в SEQ ID NO: 7-12 в списке последовательностей. Аминокислотные последовательности этих CDR также представлены на Фигуре 29.
[0172]
3)-3 Анализ нуклеотидной последовательности кДНК вариабельной области D13 и определение ее аминокислотной последовательности
Анализ выполняли так же, как в Примере 3)-1. Аминокислотная последовательность вариабельной области легкой цепи F63, кодируемая определенной нуклеотидной последовательностью кДНК, соответствует аминокислотной последовательности, состоящей из аминокислотных остатков 21-130 в SEQ ID NO: 31 в списке последовательностей. Кроме того, аминокислотная последовательность вариабельной области тяжелой цепи F63, кодируемая определенной нуклеотидной последовательностью кДНК, соответствует аминокислотной последовательности, состоящей из аминокислотных остатков 20-143 в SEQ ID NO: 33. Аминокислотные последовательности CDRL1, CDRL2, CDRL3, CDRH1, CDRH2 и CDRH3 F63 представлены в SEQ ID NO: 13-18 в списке последовательностей. Аминокислотные последовательности этих CDR также представлены на Фигуре 30.
[0173]
Пример 4. Получение химерных антител против SIRPA человека (cD13, cF44 и cF63)
4)-1 Конструирование экспрессирующего вектора pCMA-LK легкой цепи κ типа химерного антитела человека и гуманизированного антитела.
Фрагмент приблизительно 5,4 т.п.н., полученный расщеплением плазмиды pcDNA3.3-TOPO/LacZ (Invitrogen) рестрикционными ферментами XbaI и PmeI, был связан с фрагментом ДНК, представленным в SEQ ID NO: 19, содержащим сигнальную последовательность легкой цепи человека, и последовательностью ДНК, кодирующей константную область человеческой цепи κ с использованием набора для клонирования In-Fusion HD PCR Cloning Kit (Clontech Laboratories Inc.) с получением pcDNA3.3/LK.
pCMA-LK был сконструирован путем удаления единицы, экспрессирующей неомицин, из pcDNA3.3/LK.
[0174]
4)-2 Конструирование экспрессирующего вектора pCMA-LL легкой цепи λ человеческого химерного антитела и гуманизированного антитела
Фрагмент ДНК, из которого были удалены сигнальная последовательность легкой цепи и константная область цепи κ человека путем гидролиза pCMA-LK с помощью XbaI и PmeI, был связан с фрагментом ДНК, представленным в SEQ ID NO: 20, содержащим последовательность ДНК, кодирующую сигнальную последовательность легкой цепи человека и константную область цепи λ человека с использованием набора для клонирования In-Fusion HD PCR Cloning Kit (Clontech Laboratories Inc.) для конструирования pCMA-LL.
[0175]
4)-3 Конструирование экспрессирующего вектора IgG4proFALA pCMA-G4PFALA химерной человеческой тяжелой цепи и тяжелой цепи гуманизированного типа
pCMA-G4proFALA был сконструирован таким же образом, как в Примере 4)-2 с использованием фрагмента ДНК, представленного в SEQ ID NO: 21, содержащего сигнальную последовательность тяжелой цепи человека и последовательность ДНК, кодирующую аминокислоты константной области человеческого IgG4PFALA.
[0176]
4)-4 Конструирование экспрессирующего вектора cD13
4)-4-1 Конструирование экспрессирующего вектора тяжелой цепи типа cD13 IgG4proFALA
Фрагмент ДНК, содержащий кДНК, кодирующую вариабельную область тяжелой цепи, амплифицировали путем проведения ПЦР с использованием кДНК, кодирующей вариабельную область тяжелой цепи D13, полученной в Примере 3)-1, в качестве матрицы и праймеров, разработанных для клонирования методом слияния. Экспрессирующий вектор тяжелой цепи cD13 был сконструирован путем вставки амплифицированного фрагмента ДНК в сайт, где pCMA-G4proFALA была расщеплена рестрикционным ферментом BlpI, с использованием набора для клонирования In-Fusion HD PCR Cloning Kit (Clontech Laboratories Inc.). Нуклеотидная последовательность, кодирующая тяжелую цепь cD13, представлена в SEQ ID NO: 24 в списке последовательностей. Нуклеотидная последовательность, состоящая из нуклеотидов 1-57, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 58-417, кодирует вариабельную область, а нуклеотидная последовательность, состоящая из нуклеотидов 418-1398, кодирует константную область. Аминокислотная последовательность тяжелой цепи cD13 представлена в SEQ ID NO: 25 в списке последовательностей. Аминокислотная последовательность, состоящая из аминокислотных остатков 1-19, соответствует сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 20-139, соответствует вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков 140-466, соответствует константной области. Последовательности SEQ ID NO: 24 и 25 также показаны на Фигуре 18.
[0177]
4)-4-2 Конструирование экспрессирующего вектора легкой цепи cD13
Фрагмент ДНК, содержащий кДНК, кодирующую вариабельную область легкой цепи, амплифицировали путем проведения ПЦР с использованием кДНК, кодирующей вариабельную область легкой цепи D13, полученной в Примере 3)-1, в качестве матрицы и праймеров, разработанных для клонирования методом слияния. Экспрессирующий вектор легкой цепи cD13 был сконструирован путем вставки амплифицированного фрагмента ДНК в сайт, где pCMA-LK был расщеплен рестрикционным ферментом BsiWI, с использованием набора In-Fusion HD PCR Cloning Kit (Clontech Laboratories Inc.). Нуклеотидная последовательность, кодирующая легкую цепь cD13, представлена в SEQ ID NO: 22 в списке последовательностей. Нуклеотидная последовательность, состоящая из нуклеотидов 1-60, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 61-378, кодирует вариабельную область, а нуклеотидная последовательность, состоящая из нуклеотидов с 379 по 699, кодирует константную область. Аминокислотная последовательность легкой цепи cD13 представлена в SEQ ID NO: 23 в списке последовательностей. Аминокислотная последовательность, состоящая из аминокислотных остатков 1-20, соответствует сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 21-126, соответствует вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков 127-233, соответствует константной области. Последовательности SEQ ID NO: 22 и 23 также показаны на Фигуре 17.
[0178]
4)-5 Конструирование экспрессирующего вектора cF44
4)-5-1 Конструирование экспрессирующего вектора тяжелой цепи типа cF44 IgG4proFALA
Экспрессирующий вектор тяжелой цепи cF44 конструировали таким же образом, как в Примере 4)-4-1, используя кДНК, кодирующую вариабельную область тяжелой цепи F44, полученную в Примере 3)-2, в качестве матрицы. Нуклеотидная последовательность, кодирующая тяжелую цепь cF44, представлена в SEQ ID NO: 28 в списке последовательностей. Нуклеотидная последовательность, состоящая из нуклеотидов 1-57, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 58-414, кодирует вариабельную область, а нуклеотидная последовательность, состоящая из нуклеотидов с 415 по 1395, кодирует константную область. Аминокислотная последовательность тяжелой цепи cD13 представлена в SEQ ID NO: 29 в списке последовательностей. Аминокислотная последовательность, состоящая из аминокислотных остатков 1-19, соответствует сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 20-138, соответствует вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков 139-465, соответствует константной области. Последовательности SEQ ID NO: 28 и 29 также показаны на Фигуре 20.
[0179]
4)-5-2 Конструирование экспрессирующего вектора легкой цепи cF44
Экспрессирующий вектор легкой цепи cF44 был сконструирован таким же образом, как в Примере 4) -4-2, с использованием кДНК, кодирующей вариабельную область легкой цепи F44, полученную в Примере 3)-2, в качестве матрицы. Нуклеотидная последовательность, кодирующая легкую цепь cF44, представлена в SEQ ID NO: 26 в списке последовательностей. Нуклеотидная последовательность, состоящая из нуклеотидов 1-60, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 61-381, кодирует вариабельную область, а нуклеотидная последовательность, состоящая из нуклеотидов 1-60, кодирует константную область. Аминокислотная последовательность легкой цепи cF44 представлена в SEQ ID NO: 27 в списке последовательностей. Аминокислотная последовательность, состоящая из аминокислотных остатков 1-20, соответствует сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 21-127, соответствует вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков 128-234, соответствует константной области. Последовательности SEQ ID NO: 26 и 27 также показаны на Фигуре 19.
[0180]
4)-6 Конструирование экспрессирующего вектора cF63
4)-6-1 Конструирование экспрессирующего вектора тяжелой цепи типа cF44 IgG4proFALA
Экспрессирующий вектор тяжелой цепи cF63 был сконструирован таким же образом, как в Примере 4)-4-1, с использованием кДНК, кодирующей вариабельную область тяжелой цепи F63, полученную в Примере 3)-3, в качестве матрицы. Нуклеотидная последовательность, кодирующая тяжелую цепь cF63, представлена в SEQ ID NO: 32 в списке последовательностей. Нуклеотидная последовательность, состоящая из нуклеотидов 1-57, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 58-429, кодирует вариабельную область, а нуклеотидная последовательность, состоящая из нуклеотидов 430-1410, кодирует константную область. Аминокислотная последовательность тяжелой цепи cF63 представлена в SEQ ID NO: 33 в списке последовательностей. Аминокислотная последовательность, состоящая из аминокислотных остатков 1-19, соответствует сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 20-143, соответствует вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков от 144 до 470, соответствует константной области. Последовательности SEQ ID NO: 32 и 33 также показаны на Фигуре 22.
[0181]
4)-6-2 Конструирование экспрессирующего вектора легкой цепи cF63
Фрагмент ДНК, содержащий кДНК, кодирующую вариабельную область легкой цепи, амплифицировали путем проведения ПЦР с использованием кДНК, кодирующей вариабельную область легкой цепи F63, полученной в Примере 3)-3, в качестве матрицы и праймеров, разработанных для клонирования методом слияния. Экспрессирующий вектор легкой цепи cF63 был сконструирован путем вставки амплифицированного фрагмента ДНК в сайт, где pCMA-LL расщеплялся ферментами рестрикции BsiWI и HpaI, с использованием набора для клонирования In-Fusion HD PCR Cloning Kit (Clontech Laboratories Inc.). Нуклеотидная последовательность, кодирующая легкую цепь cF63, представлена в SEQ ID NO: 30 в списке последовательностей. Нуклеотидная последовательность, состоящая из нуклеотидов 1-60, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 61-390, кодирует вариабельную область, а нуклеотидная последовательность, состоящая из нуклеотидов 391-708, кодирует константную область. Аминокислотная последовательность легкой цепи cF63 представлена в SEQ ID NO: 31 в списке последовательностей. Аминокислотная последовательность, состоящая из аминокислотных остатков 1-20, соответствует сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 21-130, соответствует вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков 131-236, соответствует константной области. Последовательности SEQ ID NO: 30 и 31 также показаны на Фигуре 21.
[0182]
4)-7 Получение cD13, cF44 и cF63
4)-7-1 Продуцирование cD13, cF44, и cF63
Клетки FreeStyle 293F (Invitrogen) культивировали в соответствии с руководством. В количестве 1,2×109 клетки FreeStyle 293F (Invitrogen) в фазе логарифмического роста засевали в 3-литровую колбу Fernbach Erlenmeyer (Corning Incorporated) и разбавляли средой для экспрессии FreeStyle 293 (Invitrogen) до 2,0×106 клеток/мл. В количестве 0,24 мг экспрессирующий вектор тяжелой цепи, 0,36 мг экспрессирующего вектора легкой цепи и 1,8 мг полиэтиленимина (PolyScience # 24765) добавляли к 40 мл среды Opti-Pro SFM (Invitrogen), смесь была осторожно перемешивали, затем давали постоять в течение пяти минут и добавляли к клеткам FreeStyle 293F. После культивирования клеток при встряхивании при 90 об/мин в инкубаторе при 37°C и 8% CO2 в течение четырех часов, добавляли 600 мл среды EX-CELL VPRO (SAFC Bioscience), 18 мл GlutaMAX I (Gibco) и 30 мл Yeastolate Ultrafiltrate (Gibco), клетки культивировали при встряхивании при 90 об/мин в инкубаторе при 37°C и 8% CO2 в течение 7 дней, и полученный супернатант культуры фильтровали с использованием одноразового капсульного фильтра (Advantec # CCS-045-E1H).
[0183]
4)-7-2 Очистка cD13, cF44, и cF63
Антитела очищали из супернатанта культуры, полученного в примере 4)-7-1, в одностадийном процессе аффинной хроматографии на рПротеине A. После нанесения супернатанта культуры на колонку, заполненную MabSelect SuRe, уравновешенную PBS (GE Healthcare Bioscience Corp.), колонку промывали PBS в объеме, по меньшей мере, в 2 раза превышающем емкость колонки. Затем колонку элюировали 2 М раствором гидрохлорида аргинина (pH 4,0) для сбора фракций, содержащих антитела. Буфер, содержащий фракции, заменяли на PBS (-) диализом (Thermo Scientific, Slide-A-Lyzer Dialysis Cassette). Антитела концентрировали с помощью центрифужного УФ-фильтрующего устройства VIVASPIN20 (отсечка молекулярной массы для ультрафильтрации, 10 кДа: Sartorius) до концентрации IgG по меньшей мере 10 мг/мл. Наконец, растворы фильтровали с помощью фильтра Minisart-Plus (Sartorius) с получением очищенных образцов.
[0184]
Пример 5. Оценка in vitro химерных антител против SIRPA человека (cD13, cF44 и cF63)
5)-1 Оценка связывания с человеческим SIRPA
5)-1-1 Оценка связывания с человеческим SIRPA (клеточный ИФА)
Клетки 293α [описанные в Примере 1)-6] получали в среде DMEM, содержащей 10% FBS, до 5×105 клеток/мл. pFLAG V5-DEST-SIRPA_V1, pFLAG V5-DEST-SIRPA_V2 или pFLAG V5-DEST вводили в клетки с использованием липофектамина LTX (Invitrogen) с последующим добавлением 100 мкл на лунку в 96-луночный планшет (Corning Incorporated), и клетки культивировали в течение ночи в среде DMEM, содержащей 10% FBS, при 37°C в условиях 5% CO2. Полученные введенные клетки использовали для клеточного ИФА в состоянии, когда они прикрепляются друг к другу. После удаления культурального супернатанта добавляли по 50 мкл на лунку антител cD13 (IgG2 и IgG4pf), cF44 (IgG1, IgG2, IgG4p и IgG4pf) и cF63 (IgG2 и IgG4pf), полученных в Примерах 3 и 4, к каждым из клеток с введенным pFLAG V5-DEST-SIRPA_V1, pFLAG V5-DEST-SIRPA_V2 или pFLAG V5-DEST, в конечных концентрациях от 0 до 10000 нг/мл, и смесь выдерживали при 4°C в течение одного часа. Далее, 50 мкл на лунку антитела против FLAG M2 (SIGMA), разведенного 5% FBS-содержащим PBS до конечной концентрации 10000 нг/мл, добавляли в лунку для определения экспрессии каждой конструкции SIRPA, и смесь выдерживали при 4С в течение одного часа. Клетки в лунке промывали один раз 5% FBS-содержащим PBS с последующим добавлением козьего антитела против человеческого IgG, фрагмента пероксидазы AffiniPure F(ab')2, Fcγ-фрагмента специфического (Jackson ImmunoResearch), разбавленного в 1000 раз 5% FBS-содержащим PBS, и смесь выдерживали при 4°C в течение одного часа. Клетки в лунке промывали пять раз 5% FBS-содержащим PBS с последующим добавлением 100 мкл на лунку окрашивающего раствора OPD [дигидрохлорид о-фенилендиамина (Wako Pure Chemical Industries, Ltd.) и H2O2 растворяли в растворе OPD (0,05 М тринатрийцитрат, 0,1 М додекагидрат гидрофосфата динатрия, pH 4,5) при 0,4 мг/мл и 0,6% (об./об.), соответственно]. Реакцию окрашивания проводили при периодическом перемешивании, добавляли 100 мкл 1 М HCl на лунку для прекращения реакции окрашивания, а затем измеряли оптическую плотность при 490 нм с помощью планшет-ридера ARVO (PerkinElmer Inc.). Связывание человеческих химерных антител против SIRPA человека с каждой конструкцией стандартизировали по экспрессии фрагмента FLAG.
Как показано на Фигуре 6, антитела cD13, cF44 и cF63 связывались как с SIRPA_V1, так и с SIRPA_V2 (Фигуры 6A и B), и связывание между их изотипами было практически эквивалентным (Фигуры 6C и D).
[0185]
5)-1-2 Оценка связывания химерных антител человека с SIRPA человека
Константы диссоциации cD13, cF44 и cF63, полученных в Примере 4, против человеческого SIRPA_V1_IgV, полученного в Примере 1, были определены методом захвата, включающим захват химерного антитела человека в качестве лиганда и измерение антигена в качестве аналита с использованием Biacore T200 (GE Healthcare Bioscience Corp.). HBS-EP + (GE Healthcare Bioscience Corp.) использовали в качестве рабочего буфера, а CM5 (GE Healthcare Bioscience Corp.) использовали в качестве сенсорного чипа. В количестве 1 мкг/мл химерного антитела человека добавляли на чип со скоростью 10 мкл/мин в течение 60 секунд, затем добавляли последовательно разведенный раствор белка SIRPA человека в качестве антигена (от 0,5 до 8 мкг/мл) при скорость потока 30 мкл/мин в течение 120 секунд, а фазу диссоциации продолжали отслеживать в течение 600 секунд. В качестве регенерирующего агента добавляли 3 М хлорид магния (GE Healthcare Bioscience Corp.) при скорости потока 20 мкл/мин в течение 30 секунд. Для анализа данных константу скорости связывания (ka), константу скорости диссоциации (kd) и константу диссоциации (KD; KD=kd/ka) рассчитывали с использованием модели связывания 1:1. Результаты представлены в Таблице 4.
[0186]
[Таблица 4]
(Таблица 4) Константа диссоциации человеческих химеризованных антител из человеческого SIPRA
[0187]
5)-2 Анализ перекрестной реактивности видов с SIRPA обезьяны
Клетки 293α получали в среде DMEM, содержащей 10% FBS, при концентрации 5×105 клеток/мл. pFLAG V5-DEST-monkey SIRPA или pFLAG V5-DEST вводили в клетки с использованием липофектамина LTX (Invitrogen), добавляли 100 мкл на лунку в 96-луночный планшет (Corning Incorporated), и клетки культивировали в течение ночи в 10% среде DMEM, содержащей FBS, при 37°C в условиях 5% CO2. Полученные введенные клетки использовали для клеточного ИФА в состоянии, когда они прикрепляются друг к другу. После удаления супернатанта культуры активность связывания против SIRPA обезьяны оценивали таким же образом, как и активность связывания против SIRPA человека.
Как показано на Фигуре 7, антитела cD13, cF44 и cF63 проявляли связывание с SIRPA обезьяны.
[0188]
5)-3 Оценка активности ингибирования связывания человеческого и обезьяньего SIRPA-CD47
После того, как удаляли супернатант культуры клеток 293α с введенным экспрессирующим вектором с SIRPA человека и обезьяны, полученных в примерах 5)-1 и 5)-2, добавляли 50 мкл на лунку cD13 (IgG2 и IgG4pf), cF44 (четыре различные константные области (IgG1, IgG2, IgG4p и IgG4pf) и cF63 (IgG2 и IgG4pf), разбавленные 5% FBS-содержащим PBS до конечных концентраций от 0 до 10000 нг/мл, к каждым из клеток 293α с введенным pcDNA3.2 V5-DEST- SIRPA_V1, pcDNA3.2 V5-DEST-monkey SIRPA и клеток 293α с введенным pcDNA3.2 V5-DEST с немедленным последующим добавлением 50 мкл на лунку CD47-Fc, меченного пероксидазой, приготовленного в 5% FBS-содержащем PBS при конечной концентрации 10000 нг/мл, и смесь выдерживали при 4°C в течение одного часа. После этого активность ингибирования связывания SIRPA-CD47 оценивали таким же образом, как в 1)-6-3.
Как показано на Фигуре 8, cF44, cF63 и cD13 проявляли активность ингибирования в отношении связывания SIRPA и CD47 человека и обезьяны [Фигуры 8A (i), (ii) и (iii)], и активность была практически эквивалентной между их изотипами [Фигуры 8B (i), (ii) и (iii)].
[0189]
5)-4 Активность ADCP химерного антитела человека против SIRPA человека в отношении опухолевой клеточной линии
5)-4-1 Получение клеток-мишеней
CD47-положительные клетки клеточной линии Raji лимфомы Беркитта человека собирали и дважды промывали PBS, а затем измеряли количество жизнеспособных клеток с помощью теста исключения с красителем трипанового синего. После этого клетки-мишени получали таким же образом, как в 2-6-1.
[0190]
5)-4-2 Получение PBMC
РВМС получали таким же образом, как в 2)-6-2.
[0191]
5)-4-3 Получение эффекторных клеток
Эффекторные клетки получали таким же образом, как в 2)-6-3.
[0192]
5)-4-4 Оценка активности ADCP
Объем 50 мкл на лунку клеток-мишеней, полученных способом из Примера 5)-4-1, добавляли в 96-луночный микропланшет с U-образным дном со сверхнизким прикреплением (Sumitomo Bakelite). Добавляли объем 50 мкл на лунку cD13, cF44, cF63, Hu5F9G4, TTI-621 и различных контрольных IgG человека, разбавленных 10% FBS-содержащей средой RPMI 1640 (Life Technology) до конечных концентраций от 0 до 10000 нг/мл. Добавляли объем 50 мкл на лунку 10% FBS-содержащей среды RPMI 1640 (Life Technology) для группы с одним агентом и добавляли 50 мкл на лунку ритуксимаба (Zenyaku Kogyo), разбавленного 10% FBS-содержащей средой RPMI 1640 (Life Technology) до конечной концентрации 400 нг/мл для группы комбинированного использования. После этого активность ADCP оценивали таким же образом, как в 2)-6-4.
Как показано на Фигуре 9, cD13, cF44 и cF63 не проявляли активности ADCP против CD47-положительных клеток клеточной линии Raji лимфомы Беркитта человека при использовании в качестве единственного агента (Фигура 9A), но проявляли активность ADCP, аналогичную активности ADCP. Hu5F9G4 и TTI-621 при использовании в комбинации с ритуксимабом (Фигура 9В).
[0193]
5)-5 Оценка токсичности человеческого химерного антитела против SIRPA человека против PBMC и макрофагов
5)-5-1 Приготовление PBMC и макрофагов в качестве клеток-мишеней
Клетки-мишени получали таким же образом, как в 2)-6-2 (PBMC) и 2)-6-3 (макрофаги). Собранные клетки были флуоресцентно помечены так же, как в 2)-6-1, и использованы в качестве клеток-мишеней.
[0194]
5)-5-2 Получение эффекторных клеток
Эффекторные клетки получали таким же образом, как в 2)-6-3.
[0195]
5)-5-3 Оценка активности ADCP
Добавляли объем 50 мкл на лунку РВМС, полученных способом из примера 5)-4-2, или макрофагов в 96-луночный микропланшет с U-образным дном со сверхнизкой адгезией поверхности (Sumitomo Bakelite). Добавляли объем 50 мкл на лунку cD13 (IgG4pf), cF44 (четыре различных константных области IgG1, IgG2, IgG4p и IgG4pf), cF63 (IgG4pf), Hu5F9G4, TTI-621 и различных контрольных человеческих IgG, разбавленных 10% FBS-содержащей средой RPMI 1640, (Life Technology) до конечных концентраций от 0,64 до 10 000 нг/мл. Добавляли 50 мкл на лунку 10% FBS-содержащей среды RPMI 1640 (Life Technology). После этого активность ADCP оценивали таким же образом, как в 2)-6-4. Отношение активности ADCP против макрофагов рассчитывали путем деления количества клеток при добавлении каждого антитела на количество клеток макрофагов при добавлении контрольного антитела.
Как показано на Фигуре 10, активность ADCP cD13, cF44 и cF63 против PBMC была практически эквивалентна активности контрольного IgG (Фигура 10A). Кроме того, сравнение антител cF44 с другой константной областью показало, что тип IgG1 и тип IgG4p проявляли активность ADCP в зависимости от концентрации добавленного антитела, но тип IgG2 и тип IgG4pf не проявляли активности ADCP (Фигура 10B).
Между тем, когда антитела cF44 с другой константной областью сравнивались для соотношения макрофагов, присутствующих через 16 часов после добавления антител, тип IgG4pf показал самый низкий процент уменьшения макрофагов, что указывает на возможность самой низкой токсичности против SIRPA-положительных клеток, вызванной добавлением антитела (Фигура 10C).
[0196]
Пример 6. Создание гуманизированных антител против SIRPA
6)-1 Молекулярное моделирование вариабельной области химерного антитела cD13
Для молекулярного моделирования вариабельной области cD13 использовали метод (Methods in Enzymology. 1991; 203, 121-153) в качестве моделирования гомологии. Анализ был выполнен с использованием структуры (PDB ID: 3CSY), имеющей высокую идентичность последовательности с вариабельными областями тяжелой и легкой цепей cD13, которая зарегистрирована в базе данных Protein Data Bank (Nuc. Acid. Res. 2007; 35, D301-D303), в качестве матрицы и коммерчески доступной программы трехмерного структурного анализа белков BioLuminate (Schrodinger).
[0197]
6)-2 Создание гуманизированных аминокислотных последовательностей
cD13 гуманизировали с помощью трансплантации CDR (Proc. Natl. Acad. Sci. USA. 1989; 86, 10029-10033). IGHV3-30*13 и IGHJ3*01, и IGKV1-6*01 и IGKJ2*01, которые представляют собой последовательности зародышевой линии человека, зарегистрированные в международной информационной системе ImMunoGeneTics (IMGT, http://www.imgt.org), а также консенсусные последовательности подгруппы 4 цепей κ человека, установленные Kabat et al. [Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service National Institutes of Health, Bethesda, MD. (1991)], были выбраны в качестве акцепторов, поскольку они имеют высокую идентичность с каркасной областью cD13. Донорные остатки, перенесенные на акцептор, были отобраны путем анализа трехмерной модели со ссылкой на критерии, предоставленные Queen et al. (Proc. Natl. Acad. Sci. USA. 1989; 86, 10029-10033) и тому подобное.
[0198]
6)-3 Гуманизация тяжелых цепей cD13
Две различные сконструированные тяжелые цепи были обозначены как hH1 и hH2. Аминокислотная последовательность полноразмерной тяжелой цепи hH1 представлена в SEQ ID NO: 41 в списке последовательностей. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 41, представлена в SEQ ID NO: 40 в списке последовательностей. Аминокислотная последовательность полноразмерной тяжелой цепи hH2 представлена в SEQ ID NO: 43 в списке последовательностей. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 43, представлена в SEQ ID NO: 42 в списке последовательностей. В SEQ ID NO: 41 и 43 аминокислотная последовательность, состоящая из аминокислотных остатков 1-19, соответствует сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 20-139, соответствует вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков 140-466, соответствует константной области. Кроме того, в SEQ ID NO: 40 и 42, нуклеотидная последовательность, состоящая из нуклеотидов 1-57, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 58-417, кодирует вариабельную область, а нуклеотидная последовательность, состоящая из нуклеотидов 418-1398, кодирует константную область. Последовательности SEQ ID NO: 40 и 41 также показаны на Фигуре 26, и последовательности SEQ ID NO: 42 и 43 также показаны на Фигуре 27.
Сравнение аминокислотных последовательностей cD13_H, который представляет собой тяжелую цепь человеческого химерного антитела против SIRPA cD13, и hH1 и hH2, которые являются тяжелыми цепями гуманизированного антитела, показано на Фигуре 11. В последовательностях hH1 и hH2 знак «•» указывает на то, что аминокислотный остаток идентичен таковому в последовательности c013_H, а сайт с аминокислотным остатком указывает на аминокислотный остаток, на который был заменен остаток.
[0199]
6)-4 Гуманизация легких цепей cD13
Разработанные три различных легких цепи были обозначены как hL2, hL3 и hL4. Аминокислотная последовательность полноразмерной легкой цепи hL2 представлена в SEQ ID NO: 35 в списке последовательностей. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 35, представлена в SEQ ID NO: 34 в списке последовательностей. Полноразмерная аминокислотная последовательность легкой цепи hL3 представлена в SEQ ID NO: 37 в списке последовательностей. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 37, представлена в SEQ ID NO: 36. Полноразмерная аминокислотная последовательность легкой цепи hL4 представлена в SEQ ID NO: 39 в списке последовательностей. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 39, представлена в SEQ ID NO: 38. В SEQ ID NO: 35, 37 и 39 аминокислотная последовательность, состоящая из аминокислотных остатков 1-20, соответствует сигнальной последовательности, аминокислотная последовательность, состоящая из аминокислотных остатков 21-127, соответствует вариабельной области, а аминокислотная последовательность, состоящая из аминокислотных остатков 128-234, соответствует константной области. Кроме того, в SEQ ID NO: 34, 36 и 38 нуклеотидная последовательность, состоящая из нуклеотидов 1-60, кодирует сигнальную последовательность, нуклеотидная последовательность, состоящая из нуклеотидов 61-381, кодирует вариабельную область, и нуклеотидная последовательность, состоящая из нуклеотидов 382. до 702 соответствует константной области. Последовательности SEQ ID NO: 34 и 35 также показаны на Фигуре 23, и последовательности SEQ ID NO: 36 и 37 также показаны на фигуре 24, и последовательности SEQ ID NO: 38 и 39 также показаны на Фигуре 25.
Сравнение аминокислотной последовательности cD13_L, которая представляет собой легкую цепь человеческого химерного антитела против SIRPA cD13, и последовательностей hL2, hL3 и hL4, которые представляют собой легкие цепи гуманизированных антител, показано на Фигуре 12. В последовательностях hL2, hL3 и hL4 «•» означает, что аминокислотный остаток идентичен таковому в последовательности cD13_L, а сайт с аминокислотным остатком указывает аминокислотный остаток, на который был заменен остаток.
[0200]
6)-5 Создание гуманизированных антител путем комбинации тяжелых и легких цепей
Антитело, содержащее hH1 и hL3, называется «антителом H1L3» или «H1L3». Антитело, содержащее hH1 и hL4, называется «антитело H1L4» или «H1L4». Антитело, содержащее hH2 и hL2, называется «антителом H2L2» или «H2L2». Антитело, содержащее hH2 и hL3, называется «антитело H2L3» или «H2L3».
[0201]
Пример 7. Получение гуманизированных антител против SIRPA
7)-1 Конструирование экспрессирующих векторов тяжелых цепей гуманизированных антител
7)-1-1 Конструирование экспрессирующего вектора cD13
Был синтезирован фрагмент ДНК, состоящий из нуклеотидов в положениях 36-434 нуклеотидной последовательности hH1, представленной в SEQ ID NO: 40 в списке последовательностей (GeneArt). Экспрессирующий вектор hH1 был сконструирован путем вставки синтезированного фрагмента ДНК в сайт, где pCMA-G4proFALA расщеплялся рестрикционным ферментом BlpI с использованием набора для клонирования In-Fusion HD PCR Cloning Kit (Clontech Laboratories Inc.).
[0202]
7)-1-2 Конструирование экспрессирующего вектора cD13
Был синтезирован фрагмент ДНК, состоящий из нуклеотидов в положениях 36-434 в нуклеотидной последовательности hH2, представленной в SEQ ID NO: 42 в списке последовательностей (GeneArt). Экспрессирующий вектор hH2 конструировали таким же образом, как в Примере 7)-1-1.
[0203]
7)-2 Конструирование экспрессирующих векторов легкой цепи гуманизированного антитела
7)-2-1 Конструирование экспрессирующего вектора cD13
Был синтезирован фрагмент ДНК, состоящий из нуклеотидов в положениях 37-402 в нуклеотидной последовательности hL2 SEQ ID NO: 34 в списке последовательностей (GeneArt). Экспрессирующий вектор hL2 был сконструирован путем вставки синтезированного фрагмента ДНК в сайт, где pCMA-LK был расщеплен рестрикционным ферментом BsiWI, с использованием набора In-Fusion HD PCR Cloning Kit (Clontech Laboratories Inc.).
[0204]
7)-2-2 Конструирование экспрессирующего вектора cD13
Был синтезирован фрагмент ДНК, состоящий из нуклеотидов в положениях 37-402 в нуклеотидной последовательности hL3, представленной в SEQ ID NO: 36 в списке последовательностей (GeneArt). Экспрессирующий вектор hL3 конструировали таким же образом, как в Примере 7)-2-1.
[0205]
7)-2-3 Конструирование экспрессирующего вектора hL4
Был синтезирован фрагмент ДНК, состоящий из нуклеотидов в положениях 37-402 в нуклеотидной последовательности hL4, представленной в SEQ ID NO: 38 в списке последовательностей (GeneArt). Экспрессирующий вектор hL4 конструировали таким же образом, как в Примере 7)-2-1.
[0206]
7)-3 Получение гуманизированных антител
7)-3-1 Продуцирование гуманизированных антител
Гуманизированные антитела получали таким же образом, как в Примере 4)-7-1. Различные гуманизированные антитела были получены с использованием комбинаций экспрессирующих векторов H-цепи и экспрессирующих векторов L-цепи, соответствующих комбинациям H-цепей и L-цепей, показанным в Примере 6)-5.
[0207]
7)-3-2 Получение гуманизированных антител
Культуральный супернатант, полученный в Примере 7)-3-1, очищали с помощью двухстадийного процесса аффинной хроматографии на рПротеине A и керамическом гидроксиапатите. После того, как супернатант культуры был нанесен на колонку, заполненную MabSelect SuRe (GE Healthcare Bioscience Corp.), уравновешенную PBS, колонку промывали PBS в объеме, более чем в два раза превышающем емкость колонки. Затем антитело элюировали 2 М раствором гидрохлорида аргинина (pH 4,0). Буфер заменяли на PBS путем диализа фракций, содержащих антитело (Thermo Scientific, Slide-A-Lyzer Dialysis Cassette), и фракции разбавляли в пять раз буфером 5 мМ фосфата натрия/50 мМ MES/pH 7,0 и наносили на колонку с керамическим гидроксиапатитом (Japan Bio-Rad, Bio-Scale CHT Type-1 Hydroxyapatite Column), уравновешенную буфером 5 мМ NaPi/50 мМ MES/30 мМ NaCl/pH 7,0. Элюирование хлоридом натрия выполняли с линейным градиентом концентрации для сбора фракций, содержащих антитело. Буфер заменяли HBSor (25 мМ гистидин/5% сорбит, pH 6) путем диализа фракций (Thermo Scientific, Slide-A-Lyzer Dialysis Cassette). Антитело концентрировали с помощью центрифужного УФ-фильтрующего устройства VIVASPIN20 (отсечка молекулярной массы для ультрафильтрации, 10 кДа: Sartorius AG) и доводили до концентрации IgG 50 мг/мл. Наконец, раствор фильтровали с помощью фильтра Minisart-Plus (Sartorius AG) для получения очищенного образца.
[0208]
Пример 8. Оценка in vitro гуманизированных антител против SIRPA (hD13_H1L3, hD13_H1L4h, hD13_H2L2 и hD13_H2L3)
8)-1 Активность связывания гуманизированных антител против SIRPA с SIRPA человека, обезьяны и мыши
8)-1-1 Активность связывания гуманизированных антител против SIRPA с SIRPA человека, обезьяны и мыши (клеточный ИФА)
Клетки 293α, описанные в Примере 1)-6, получали в количестве 5×105 клеток/мл в среде DMEM, содержащей 10% FBS. pFLAG V5-DEST-SIRPA_V1-V10, pFLAG V5-DEST-monkey SIRPA, pFLAG V5-DEST-mouse SIRPA или pFLAG V5-DEST вводили в клетки с использованием липофектамина LTX (Invitrogen), и аликвотировали по 100 мкл каждого в 96-луночный планшет (Corning Incorporated) и культивировали в течение ночи в среде DMEM, содержащей 10% FBS, при 37°C в условиях 5% CO2. Полученные трансфецированные клетки использовали для клеточного ИФА в состоянии адгезии. После удаления супернатанта культуры добавляли 50 мкл на лунку hD13_H1L3, hD13_H1L4h, hD13_H2L2, hD13_H2L3 или cD13, полученных в Примерах 6 и 7, или контрольное антитело к каждым из клеток, трансфецированных различными генами SIRPA, в конечной концентрации от 0 до 10000 нг/мл, и смеси выдерживали при 4°C в течение одного часа. После этого связывание с человеческим SIRPA оценивали таким же образом, как в Примере 5-1.
Как показано на Фигуре 13A-13C, антитела hD13_H1L3, hD13_H1L4h, hD13_H2L2 и hD13_H2L3 проявляли связывание с вариантами SIRPA от V1 до V10 и SIRPA обезьяны, которое было эквивалентно или сильнее, чем связывание антитела cD13. Напротив, как показано на Фигурах 14A и 14B, ни гуманизированные антитела, ни химерные антитела человека не проявляли связывания с SIRPA мыши.
[0209]
8)-1-2 Оценка связывания гуманизированных антител с SIRPA
Константы диссоциации hD13_H1L3, hD13_H1L4, hD13_H2L2 и hD13_H2L3, полученных в Примере 7, против человеческого SIRPA_V1_IgV и обезьяньего SIRPA_ECD, полученных в Примере 1, были измерены методом захвата, заключающимся в захвате гуманизированного антитела в качестве лиганда антитела пртив человеческого Fc-IgG, иммобилизованного с помощью набора для захвата антител человека (GE Healthcare Bioscience Corp.) и измеряли антиген в качестве аналита с помощью Biacore T200 (GE Healthcare Bioscience Corp.). HBS-EP + (GE Healthcare Bioscience Corp.) использовали в качестве рабочего буфера, а CM5 (GE Healthcare Bioscience Corp.) использовали в качестве сенсорного чипа. На чип добавляли гуманизированное антитело 1 мкг/мл со скоростью 10 мкл/мин в течение 60 секунд, а затем серийно разбавленный раствор (от 0,5 до 8 мкг/мл) белка SIRPA человека или серийно разбавленный раствор (от 1 до 16 мкг/мл) белка SIRPA обезьяны добавляли в качестве антигена при скорости потока 30 мкл/мин в течение 120 секунд, а затем контролировали фазу диссоциации в течение 600 секунд. В качестве регенерирующего агента добавляли 3 М хлорид магния (GE Healthcare Bioscience Corp.) при скорости потока 20 мкл/мин в течение 30 секунд. Для анализа данных рассчитывали константу скорости связывания (ka), константу скорости диссоциации (kd) и константу диссоциации (KD; KD=kd/ka) с использованием модели связывания 1:1. Результаты представлены в Таблице 5.
[0210]
[Таблица 5]
(Таблица 5) Константы диссоциации гуманизированных антител против SIPRA
[0211]
8)-2 Оценка ингибирующей активности гуманизированных антител против SIRPA в отношении связывания с человеческим или обезьяньим SIRPA-CD47
После удаления супернатанта культуры клеток 293α с введенным экспрессирующим вектором с SIRPA человека или SIRPA обезьяны, полученных в Примере 8)-1, добавляли 50 мкл на лунку hD13_H1L3, hD13_H1L4h, hD13_H2L2 или hD13_H2L3, разведенных 5% FBS-содержащим PBS до конечной концентрация от 0 до 10000 нг/мл к каждым из клеток 293α с введенным pcDNA3.2 V5-DEST-SIRPA_V1, pcDNA3.2 V5-DEST-SIRPA_V2, pcDNA3.2 V5-DEST-monkey SIRPA и pcDNA3.2 V5-DEST с немедленным последующим добавлением меченного пероксидазой CD47-Fc, приготовленного с 5% FBS-содержащим PBS в концентрации 1 мкг/мл, и смесь выдерживали при 4°C в течение одного часа. После этого активность ингибирования связывания SIRPA-CD47 оценивали таким же образом, как в 1)-6-3.
Как показано на Фигуре 15, антитела hD13_H1L3, hD13_H1L4h, hD13_H2L2 и hD13_H2L3 проявляли активность ингибирования связывания, эквивалентную или более высокую, чем у антитела cD13 против SIRPA_V1 (Фиг.15A), SIRPA_V2 (Фигура 15B) и SIRPA обезьяны (Фигура 15C).
[0212]
8)-3 ADCP-активность гуманизированных антител против SIRPA человека против опухолевой клеточной линии
8)-3-1 Получение клеток-мишеней
CD47-положительные клетки клеточной линии Raji лимфомы Беркитта человека или клетки Ramos собирали и дважды промывали PBS, а количество жизнеспособных клеток измеряли с помощью теста исключения красителя трипанового синего. Затем 4×107 клеток были разделены на аликвоты, центрифугированы и суспендированы в 2 мл разбавителя C, входящего в набор CellVue Claret Far Red Fluorescent Cell Linker Kit (Sigma). В качестве раствора для мечения 1 мМ CellVue Claret Dye разбавляли Разбавителем C до 10 мкМ, сразу после этого смешивали суспензию клеток и равный объем раствора CellVue Claret Dye, и смесь выдерживали при комнатной температуре в течение 15 минут. Добавляли 25 мл среды RPMI 1640, содержащей 10% FBS (Life Technology), и клетки дважды промывали и повторно суспендировали при 2×106 клеток/мл и использовали в качестве клеток-мишеней. После этого клетки-мишени получали таким же образом, как в 2)-6-1.
[0213]
8)-3-2 Получение PBMC
РВМС получали таким же образом, как в 2)-6-2.
[0214]
8)-3-3 Получение эффекторных клеток
Эффекторные клетки получали таким же образом, как в 2)-6-3, дважды промывали PBS и повторно суспендировали в PBS до 1×106 клеток/мл. Затем добавляли 1 мкл раствора CFSE с концентрацией 106 клеток/мл (Thermo Fisher) в качестве раствора для мечения, и смесь выдерживали при комнатной температуре в течение 10 минут. Добавляли 20 мл среды RPMI 1640, содержащей 10% FBS (Life Technology), и клетки дважды промывали, повторно суспендировали до 1×106 клеток/мл и использовали в качестве эффекторных клеток.
[0215]
8)-3-4 Оценка активности ADCP
Объем 50 мкл на лунку клеток-мишеней, полученных способом из Примера 8)-3-1, добавляли в 96-луночный микропланшет с U-образным дном со сверхнизким прикреплением (Sumitomo Bakelite). В лунки добавляли по 50 мкл на лунку hD13_H1L3, hD13_H1L4h, hD13_H2L2, hD13_H2L3 или антитела cD13, Hu5F9G4, TTI-621 или различных контрольных IgG человека, разбавленных средой RPMI 1640, содержащей 10% FBS (Life Technology) до конечной концентрации от 0 до 10000 нг/мл. Добавляли объем 50 мкл на лунку 10% FBS-содержащей среды RPMI 1640 (Life Technology) для группы с одним агентом и добавляли 50 мкл на лунку ритуксимаба (Zenyaku Kogyo), разбавленного 10% FBS-содержащей средой RPMI 1640 (Life Technology) до конечной концентрации 400 нг/мл для группы комбинированного использования. Добавляли объем 50 мкл на лунку эффекторных клеток, полученных из расчета 1×106 клеток/мл в Примере 8-3-3, смесь выдерживали при 37°C в условиях 5% CO2 в течение 16 часов. После центрифугирования смеси при 1200 об/мин при 4°C в течение пяти минут и удаления супернатанта клетки промывали 200 мкл на лунку PBS, содержащего 5% FBS. Клетки суспендировали в 100 мкл на лунку 1 стабилизирующего фиксатора BD (Becton Dickinson), и суспензию выдерживали в течение ночи при 4°C. На следующий день количество клеток измеряли с помощью проточной цитометрии (FACS Canto II: Becton Dickinson). Для анализа данных использовался FlowJo (TreeStar). Клетки были охарактеризованы путем обнаружения света прямого рассеяния (FSC) и света бокового рассеяния (SSC), а затем было получено количество клеток, положительных для APC (A), и клеток, положительных как для APC, так и FITC (B). Клетки, положительные как для APC, так и для FITC (B), считались клетками-мишенями, которые были фагоцитированы макрофагами. Процент клеточного фагоцитоза по активности ADCP рассчитывали по следующему уравнению:
Процент клеточного фагоцитоза (%) = B/(A+B) × 100
Как показано на Фигуре 16, антитела hD13_H1L3, hD13_H1L4h, hD13_H2L2, hD13_H2L3 и cD13 не проявляли активности ADCP против CD47-положительных клеток клеточной линии Raji или Ramos лимфомы Беркитта человека, когда они использовались отдельно (Фигуры 16A и C), и проявляли активность ADCP, зависящую от концентрации добавленных антител, когда они использовались в комбинации с ритуксимабом (Фигуры 16B и D). Клоны гуманизированного антитела проявляли активность ADCP, эквивалентную или превышающую активность клона химерного антитела человека.
[0216]
Пример 9. Оценка in vitro различных антител против SIRPA
9)-1 Оценка связывания различных антител против SIRPA с SIRPA
Константы диссоциации антитела hD13_H1L3, полученного в Примере 7, OSE-172 (получено со ссылкой на международную публикацию WO 17/178653), KWAR23 (получено со ссылкой на международную публикацию WO 18/026600) и ADU-1805 (получено со ссылкой на к международной публикации WO 18/190719) измеряли в отношении человеческого SIRPA_V1_IgV и человеческого SIRPA_V2_IgV, полученных в Примере 1. Аминокислотная последовательность тяжелой цепи OSE-172 представлена в SEQ ID NO: 81, аминокислотная последовательность легкой цепи OSE-172 представлена в SEQ ID NO: 82, аминокислотная последовательность тяжелая цепь KWAR23 указана в SEQ ID NO: 83, аминокислотная последовательность легкой цепи KWAR23 представлена в SEQ ID NO: 84, аминокислотная последовательность тяжелой цепи ADU-1805 указана в SEQ ID NO: 85, а аминокислотная последовательность легкой цепи ADU-1805 представлена в SEQ ID NO: 86 в списке последовательностей. Константы диссоциации измеряли методом захвата, включающим захват каждого антитела в качестве лиганда к антителу против человеческого IgG (Fc), иммобилизованного с использованием набора для захвата антител человека (GE Healthcare Bioscience Corp.) и измерение антигена в качестве аналита с использованием Biacore T200. (GE Healthcare Bioscience Corp.). HBS-EP + (GE Healthcare Bioscience Corp.) использовали в качестве рабочего буфера, а CM5 (GE Healthcare Bioscience Corp.) использовали в качестве сенсорного чипа. На чип добавляли 2 мкг/мл различных антител со скоростью 10 мкл/мин в течение 30 секунд, затем добавляли последовательно разведенный раствор (от 0,25 до 16 нМ) человеческого белка SIRPA в качестве антигена при скорости потока 30 мкл/мин в течение 120 секунд, а затем отслеживали фазу диссоциации в течение 600 секунд. В качестве регенерирующего агента добавляли 3 М хлорид магния (GE Healthcare Bioscience Corp.) при скорости потока 20 мкл/мин в течение 30 секунд. Для анализа данных рассчитывали константу скорости связывания (ka), константу скорости диссоциации (kd) и константу диссоциации (KD; KD=kd/ka) с использованием модели связывания 1:1. Результаты представлены в таблице 6.
[0217]
[Таблица 6]
(Таблица 6) Константы диссоциации различных антител против SIPRA против SIPRA_V1 и V2
[0218]
9)-2 Оценка ингибирующей активности различных антител против SIRPA человека в отношении связывания человеческого SIRPA-CD47
После удаления супернатанта культуры клеток 293α с введенным экспрессирующим вектором SIRPA_V1 или V2 человека, полученных в примере 9)-1, добавляли 50 мкл на лунку различных антител против SIRPA или различных контрольных IgG человека, разбавленных 5% FBS-содержащим PBS, до конечной концентрации от 0 до 10000 нг/мл к каждым из клеток 293α с введенным pcDNA3.2 V5-DEST-SIRPA_V1 или V2 с немедленным последующим добавлением 50 мкл на лунку меченного пероксидазой CD47-Fc, приготовленного с 5% PBS, содержащий FBS, в концентрации 1 мкг/мл, и смесь выдерживали при 4°C в течение одного часа. После этого активность ингибирования связывания SIRPA-CD47 оценивали таким же образом, как в 1)-6-3.
Как показано на Фигуре 31A, антитела hD13_H1L3, OSE-172, KWAR23 и ADU-1805 проявляли ингибирующую активность в отношении связывания SIRPA_V1-CD47. Как показано на Фигуре 31B, hD13_H1L3, KWAR23 и ADU-1805 показали связывание с человеческим SIRPA_V2-CD47, но OSE-172 не проявлял активности ингибирования связывания. Кроме того, как показано на Фигуре 31C, hD13_H1L3 ингибировал связывание при самой низкой концентрации.
[0219]
9)-3 Оценка активности связывания различных антител против SIRPA человека к SIRPB человека и SIRPG человека
SIRPβ1 (сигнальный регуляторный белок β1: его аминокислотная последовательность опубликована под номером доступа RefSeq NP_006056) и SIRPγ (сигнальный регуляторный белок: его аминокислотная последовательность опубликована под номером доступа RefSeq NP_061026) являются молекулами, принадлежащими к семейству SIRPA. В настоящем изобретении «SIRPα» может упоминаться как «SIRPA», «SIRPβ1» может упоминаться как «SIRPB1», а «SIRPγ» может упоминаться как «SIRPG». Клетки CHO-K1 получали в среде Ham's F-12K, содержащей 10% FBS, в концентрации 3,3×105 клеток/мл и культивировали в течение ночи при 37°C в условиях 5% CO2. pFLAG V5-DEST-человеческий SIRPB, pFLAG V5-DEST-человеческий SIRPG или pFLAG V5-DEST вводили в клетки с использованием липофектамина LTX (Invitrogen), и клетки культивировали в среде Ham's F-12K, содержащей 10% FBS, при 37°C в условиях 5% CO2 в течение 24 часов. Полученные трансфецированные клетки собирали и высевали на 96-луночный планшет. После удаления культурального супернатанта 100 мкл на лунку различных антител против человеческого SIRPA или различных контрольных человеческих IgG добавляли к каждым из клеток с введенными различными генами в конечной концентрации от 0 до 10000 нг/мл, и смесь выдерживали при 4°С в течение 25 минут. После центрифугирования смеси супернатант удаляли и клетки дважды промывали 5% FBS-содержащим PBS. После центрифугирования смеси супернатант удаляли, добавляли 50 мкл на лунку разбавленного 1/400 раствора PE-мышиного антитела против человеческого IgG (BioLegend), и смесь выдерживали при 4°C в течение 25 минут. После центрифугирования смеси супернатант удаляли и клетки дважды промывали 5% FBS-содержащим PBS.
После центрифугирования смеси и удаления супернатанта клетки суспендировали в 100 мкл на лунку стабилизирующего фиксатора 1xBD (Becton Dickinson), и количество клеток измеряли с помощью проточной цитометрии (FACS Canto II: Becton Dickinson). Для анализа данных использовался FlowJo (TreeStar). Клетки характеризовали обнаружением света прямого рассеяния (FSC) и света бокового рассеяния (SSC), а затем рассчитывали среднюю интенсивность флуоресценции PE. Связывание различных антител с молекулами семейства рассчитывали путем стандартизации интенсивности флуоресценции с использованием средней интенсивности флуоресценции образца, в котором только вторичное антитело могло реагировать.
Как показано на Фигурах 32A и B, различные антитела против SIRPA человека проявляли зависимое от концентрации связывание с SIRPB человека и SIRPG человека, но OSE-172 не проявляло связывания с SIRPG человека.
[0220]
9)-4 ADCP активность различных антител против SIRPA человека против опухолевой клеточной линии
9)-4-1 Получение клеток-мишеней
CD47-положительные клетки клеточной линии Raji лимфомы Беркитта человека собирали и дважды промывали PBS, а затем измеряли количество жизнеспособных клеток с помощью теста исключения с красителем трипанового синего. Клетки ресуспендировали в PBS до 1×106 клеток/мл. В качестве раствора для мечения добавляли 1 мкл/106 клеток/мл раствора Cell Trace Far Red (Thermo Fisher), и смесь выдерживали при комнатной температуре в течение 10 минут. Добавляли 25 мл среды RPMI 1640, содержащей 10% FBS (Life Technology), и клетки дважды промывали, затем повторно суспендировали до 2×106 клеток/мл и использовали в качестве клеток-мишеней. После этого клетки-мишени получали таким же образом, как в 2)-6-1.
[0221]
9)-4-2 Получение PBMC
РВМС получали таким же образом, как в 2)-6-2.
[0222]
9)-4-3 Получение эффекторных клеток
Эффекторные клетки получали таким же образом, как в 2)-6-3, дважды промывали PBS и повторно суспендировали в PBS до 1×106 клеток/мл. В качестве раствора для мечения добавляли раствор CFSE 1 мкл/106 клеток/мл (Thermo Fisher), и смесь выдерживали при комнатной температуре в течение 10 минут. Добавляли 20 мл среды RPMI 1640, содержащей 10% FBS (Life Technology), и клетки дважды промывали, затем повторно суспендировали до 1×106 клеток/мл и использовали в качестве эффекторных клеток.
[0223]
9)-4-4 Оценка активности ADCP
Объем 50 мкл на лунку клеток-мишеней, полученных способом из Примера 8)-3-1, добавляли в 96-луночный микропланшет с U-образным дном со сверхнизкой адгезией (Sumitomo Bakelite). В лунки добавляли 50 мкл на лунку различных антител против SIRPA или различных контрольных IgG человека, разведенных в среде RPMI 1640, содержащей 10% FBS (Life Technology), до конечной концентрации от 0 до 10000 нг/мл. Для группы комбинированного применения добавляли 50 мкл на лунку ритуксимаба (Zenyaku Kogyo), разбавленного 10% FBS-содержащей средой RPMI 1640 (Life Technology) до конечной концентрации 1000 нг/мл. Объем 50 мкл на лунку эффекторных клеток, полученных в Примере 8-3-3, добавляли из расчета 1×106 клеток/мл, и смесь выдерживали при 37°C в условиях 5% CO2 в течение от двух до 16 часов. После центрифугирования смеси при 1200 об/мин при 4°C в течение 5 минут и удаления супернатанта клетки промывали 200 мкл на лунку PBS, содержащего 5% FBS. Клетки суспендировали в 50 мкл на лунку 1 стабилизирующего фиксатора BD (Becton Dickinson), и количество клеток измеряли с помощью проточной цитометрии (FACS Canto II: Becton Dickinson). Для анализа данных использовался FlowJo (TreeStar). Клетки были охарактеризованы путем обнаружения света прямого рассеяния (FSC) и света бокового рассеяния (SSC), а затем было получено количество клеток, положительных для APC (A), и клеток, положительных как для APC, так и FITC (B). Клетки, положительные как для APC, так и для FITC (B), считались клетками-мишенями, которые были фагоцитированы макрофагами. Процент клеточного фагоцитоза по активности ADCP рассчитывали по следующему уравнению:
Процент клеточного фагоцитоза (%) = B/(A+B) × 100
Как показано на Фигуре 33A-C, антитела hD13_H1L3, OSE-172, KWAR23 и ADU-1805 в комбинации с ритуксимабом проявляли активность ADCP против CD47-положительных клеток клеточной линии Raji лимфомы Беркитта человека. Активность, усиливающая ADCP, была выше в порядке hD13_H1L3, ADU-1805, KWAR23 и OSE-172 после двух часов реакций (A) и в порядке ADU-1805, hD13_H1L3, KWAR23 и OSE-172 через 16 часов реакций (B). Реактивность через 16 часов предполагает, что активность фагоцитирования находится в состоянии насыщения. Сравнение зависимой от концентрации активности ADCP после двух часов реакций показало, что hD13_H1L3 проявлял наивысшую активность от самой низкой концентрации, за ней следовали ADU-1805 и KWAR23, которые проявляли практически эквивалентные активности, и OSE-172. Приведенные выше результаты показали, что hD13_H1L3 увеличивал активность ADCP за короткое время от самой низкой концентрации.
[0224]
9)-4-5 Оценка фагоцитарной активности между макрофагами с помощью различных антител против SIRPA человека (активность Self-ADCP)
Объем 50 мкл на лунку клеток-мишеней, полученных способом из Примера 8)-3-3, добавляли в 96-луночный микропланшет с U-образным дном со сверхнизкой адгезией (Sumitomo Bakelite). В лунки добавляли 50 мкл на лунку различных антител против SIRPA или различных контрольных IgG человека, разведенных в среде RPMI 1640, содержащей 10% FBS (Life Technology), до конечной концентрации от 0 до 10000 нг/мл. Добавляли 100 мкл на лунку среды RPMI 1640, содержащей 10% FBS (Life Technology). Смесь выдерживали при 37°C в условиях 5% CO2 в течение 16-20 часов. Смесь центрифугировали при 1200 об/мин при 4°C в течение 5 минут, супернатант удаляли и клетки промывали 200 мкл на лунку PBS, содержащего 5% FBS. Клетки суспендировали в 100 мкл на лунку стабилизирующего фиксатора 1xBD (Becton Dickinson), и количество клеток измеряли с помощью проточной цитометрии (FACS Canto II: Becton Dickinson). Для анализа данных использовался FlowJo (TreeStar). Клетки характеризовали обнаружением света прямого рассеяния (FSC) и света бокового рассеяния (SSC), а затем определяли количество FITC-положительных клеток в каждой лунке (A). Степень уменьшения в каждом образце считалась степенью фагоцитоза между макрофагами при стандартизации с использованием подсчета FITC-положительных клеток в лунке, не содержащей антитела (B). Собственная активность ADCP рассчитывалась по следующему уравнению:
Собственная ADCP (%) = (A/B)×100
Как показано на Фигуре 33B, макрофаги, которые являются эффекторными клетками, проявляли собственную активность ADCP при добавлении антител hD13_H1L3, OSE-172, KWAR23 и ADU-1805. Процент снижения был выше в OSE-172, KWAR23, ADU-1805 и hD13_H1L3. Высокий процент снижения указывает на высокую активность собственной ADCP за счет антитела против SIRPA. Этот феномен предполагает возможность того, что SIRPA-положительные клетки, такие как макрофаги и дендритные клетки, могут быть уменьшены по количеству или истощены путем введения каждого из антител против SIRPA, что служит индикатором побочных реакций на лекарственные препараты для иммунной системы.
[0225]
Пример 10 Оценка in vivo различных антител против SIRPA
Поскольку SIRPA является мишенью, экспрессируемой в иммунных клетках хозяина, противоопухолевые эффекты человеческих антител SIRPA необходимо оценивать на мышах, экспрессирующих человеческий SIRPA [Ring et al. (1991 , PNAS. 2017; 114, 49, E10578-E10585]. Между тем, для оценки вклада иммунной системы в противоопухолевые эффекты важно использовать иммунокомпетентных мышей, а не мышей с ослабленным иммунитетом [Yanagita et al. JCI. 2017; (2) 1, 1-15]. Мышиная опухолевая клеточная линия, трансфецированная человеческим CD47, была трансплантирована генетически модифицированным мышам, полученным путем введения одного человеческого SIRPA или человеческого SIRPA и человеческого CD47 иммунокомпетентным мышам, и мышей разделяли на группы, когда объем опухоли составлял приблизительно 100 мм3. Биопрепараты против CD47, такие как различные антитела против SIRPA, антитела против CD47 или слитые белки SIRPA-Fc, или отрицательные контроли, такие как PBS, вводят этим группам мышей примерно от одного до трех раз в неделю в течение от одной до трех недель. Чтобы оценить дополнительные противоопухолевые эффекты комбинированного лекарственного средства, химиотерапевтическое средство, лекарственное средство на основе антител, лекарственное средство молекулярного таргетинга или т.п. вводят в комбинации в каждую из этих групп. Размер опухоли (большой диаметр/малый диаметр) в каждой группе обработки измеряют с помощью электронного штангенциркуля или подобного устройства каждые два-три дня для расчета объема опухоли. Эффективность каждого лекарственного средства можно сравнить in vivo путем расчета степени ингибирования роста опухоли по объемам опухоли в различных группах обработки антителами и в группе отрицательного контроля. Объем опухоли и скорость ингибирования роста опухоли представлены следующей формулой:
Объем опухоли (мм3) = (большой диаметр х меньший диаметр × меньший диаметр)/2
Степень ингибирования роста опухоли (%) = (1 - объем опухоли в каждой группе обработки/объем опухоли в группе отрицательного контроля)×100
Промышленная применимость
[0226]
Антитело против SIRPα по настоящему изобретению можно использовать в качестве лекарственного средства антитела, которое используется в комбинации с другими лекарственными средствами антител, имеющими другие эффекторные функции, или другими лекарственными средствами антител, обладающими ингибирующим действием на иммунные контрольные точки.
Список последовательностей в свободной форме
[0227]
SEQ ID NO: 1: аминокислотная последовательность CDR-L1 D13.
SEQ ID NO: 2: аминокислотная последовательность CDR-L2 D13.
SEQ ID NO: 3: аминокислотная последовательность CDR-L3 D13.
SEQ ID NO: 4: аминокислотная последовательность CDR-H1 D13.
SEQ ID NO: 5: аминокислотная последовательность CDR-H2 D13.
SEQ ID NO: 6: аминокислотная последовательность CDR-H3 D13.
SEQ ID NO: 7: аминокислотная последовательность F44 CDR-L1.
SEQ ID NO: 8: аминокислотная последовательность F44 CDR-L2.
SEQ ID NO: 9: аминокислотная последовательность F44 CDR-L3.
SEQ ID NO: 10: аминокислотная последовательность F44 CDR-H1.
SEQ ID NO: 11: аминокислотная последовательность F44 CDR-H2.
SEQ ID NO: 12: аминокислотная последовательность F44 CDR-H3.
SEQ ID NO: 13: аминокислотная последовательность F63 CDR-L1.
SEQ ID NO: 14: аминокислотная последовательность F63 CDR-L2.
SEQ ID NO: 15: аминокислотная последовательность F63 CDR-L3.
SEQ ID NO: 16: аминокислотная последовательность F63 CDR-H1.
SEQ ID NO: 17: аминокислотная последовательность F63 CDR-H2.
SEQ ID NO: 18: аминокислотная последовательность F63 CDR-H3.
SEQ ID NO: 19: фрагмент ДНК, содержащий сигнальную последовательность легкой цепи человека и нуклеотидную последовательность, кодирующую константную область легкой цепи κ человека.
SEQ ID NO: 20: фрагмент ДНК, содержащий сигнальную последовательность легкой цепи человека и нуклеотидную последовательность, кодирующую константную область легкой цепи λ человека.
SEQ ID NO: 21: фрагмент ДНК, содержащий сигнальную последовательность тяжелой цепи человека и нуклеотидную последовательность, кодирующую константную область тяжелой цепи человеческого IgG4ProFALA.
SEQ ID NO: 22: нуклеотидная последовательность, кодирующая легкую цепь человека химерного антитела D13.
SEQ ID NO: 23: аминокислотная последовательность легкой цепи человека химерного антитела D13.
SEQ ID NO: 24: нуклеотидная последовательность, кодирующая тяжелую цепь человека химерного антитела D13.
SEQ ID NO: 25: аминокислотная последовательность тяжелой цепи человека химерного антитела D13.
SEQ ID NO: 26: нуклеотидная последовательность, кодирующая легкую цепь человека химерного антитела F44.
SEQ ID NO: 27: аминокислотная последовательность легкой цепи человека химерного антитела F44.
SEQ ID NO: 28: нуклеотидная последовательность, кодирующая тяжелую цепь человека химерного антитела F44.
SEQ ID NO: 29: аминокислотная последовательность тяжелой цепи человека химерного антитела F44.
SEQ ID NO: 30: нуклеотидная последовательность, кодирующая легкую цепь человека химерного антитела F63.
SEQ ID NO: 31: аминокислотная последовательность легкой цепи человека химерного антитела F63.
SEQ ID NO: 32: нуклеотидная последовательность, кодирующая тяжелую цепь человека химерного антитела F63.
SEQ ID NO: 33: аминокислотная последовательность тяжелой цепи человека химерного антитела F63.
SEQ ID NO: 34: нуклеотидная последовательность, кодирующая легкую цепь hL2 гуманизированного D13.
SEQ ID NO: 35: аминокислотная последовательность легкой цепи hL2 гуманизированного D13.
SEQ ID NO: 36: нуклеотидная последовательность, кодирующая легкую цепь hL3 гуманизированного D13.
SEQ ID NO: 37: аминокислотная последовательность легкой цепи hL3 гуманизированного D13.
SEQ ID NO: 38: нуклеотидная последовательность, кодирующая легкую цепь hL4 гуманизированного D13.
SEQ ID NO: 39: аминокислотная последовательность легкой цепи hL4 гуманизированного D13.
SEQ ID NO: 40: нуклеотидная последовательность, кодирующая тяжелую цепь hH1 гуманизированного D13.
SEQ ID NO: 41: аминокислотная последовательность тяжелой цепи hH1 гуманизированного D13.
SEQ ID NO: 42: нуклеотидная последовательность, кодирующая тяжелую цепь hH2 гуманизированного D13.
SEQ ID NO: 43: аминокислотная последовательность тяжелой цепи hH2 гуманизированного D13.
SEQ ID NO: 44: нуклеотидная последовательность, кодирующая ECD варианта 1 человеческого SIRPA.
SEQ ID NO: 45: аминокислотная последовательность ECD варианта 1 человеческого SIRPA.
SEQ ID NO: 46: нуклеотидная последовательность, кодирующая IgV варианта 1 человеческого SIRPA.
SEQ ID NO: 47: аминокислотная последовательность IgV варианта 1 человеческого SIRPA.
SEQ ID NO: 48: нуклеотидная последовательность, кодирующая ECD варианта 2 человеческого SIRPA.
SEQ ID NO: 49: аминокислотная последовательность ECD варианта 2 человеческого SIRPA.
SEQ ID NO: 50: нуклеотидная последовательность, кодирующая IgV варианта 2 человеческого SIRPA.
SEQ ID NO: 51: аминокислотная последовательность IgV варианта 2 человеческого SIRPA.
SEQ ID NO: 52: нуклеотидная последовательность, кодирующая ECD SIRPA обезьяны.
SEQ ID NO: 53: аминокислотная последовательность ECD SIRPA обезьяны.
SEQ ID NO: 54: нуклеотидная последовательность, кодирующая CD47 человека-Fc.
SEQ ID NO: 55: аминокислотная последовательность IgV CD47 человека-Fc.
SEQ ID NO: 56: аминокислотная последовательность варианта 1 человеческого SIRPA.
SEQ ID NO: 57: аминокислотная последовательность варианта 2 человеческого SIRPA.
SEQ ID NO: 58: аминокислотная последовательность SIRPA обезьяны.
SEQ ID NO: 59: аминокислотная последовательность SIRPA мыши C57BL/6.
SEQ ID NO: 60: аминокислотная последовательность SIRPA мыши BALB/C.
SEQ ID NO: 61: аминокислотная последовательность SIRPA мыши 129.
SEQ ID NO: 62: аминокислотная последовательность SIRPA мыши NOD.
SEQ ID NO: 63: аминокислотная последовательность варианта 3 человеческого SIRPA.
SEQ ID NO: 64: аминокислотная последовательность варианта 4 человеческого SIRPA.
SEQ ID NO: 65: аминокислотная последовательность варианта 5 человеческого SIRPA.
SEQ ID NO: 66: аминокислотная последовательность варианта 6 человеческого SIRPA.
SEQ ID NO: 67: аминокислотная последовательность варианта 7 человеческого SIRPA.
SEQ ID NO: 68: аминокислотная последовательность варианта 8 человеческого SIRPA.
SEQ ID NO: 69: аминокислотная последовательность варианта 9 человеческого SIRPA.
SEQ ID NO: 70: аминокислотная последовательность варианта 10 человеческого SIRPA.
SEQ ID NO: 71: аминокислотная последовательность варианта SIRPA человека_V2_IgV.
SEQ ID NO: 72: аминокислотная последовательность варианта SIRPA человека_V2_IgV_IgC1.
SEQ ID NO: 73: аминокислотная последовательность варианта SIRPA мыши hmSIRPA_Δ0.
SEQ ID NO: 74: аминокислотная последовательность варианта SIRPA мыши hmSIRPA_Δ1.
SEQ ID NO: 75: аминокислотная последовательность варианта SIRPA мыши hmSIRPA_Δ2.
SEQ ID NO: 76: последовательность, состоящая из аминокислот 81-85 в аминокислотной последовательности варианта SIRPA мыши hmSIRPA_Δ0.
SEQ ID NO: 77: последовательность, состоящая из аминокислот 81-85 в аминокислотной последовательности варианта SIRPA мыши hmSIRPA_Δ1.
SEQ ID NO: 78: последовательность, состоящая из аминокислот 81-85 в аминокислотной последовательности SIRPA мыши BALB/C.
SEQ ID NO: 79: последовательность, состоящая из аминокислот 126-130 в аминокислотной последовательности SIRPA мыши BALB/C.
SEQ ID NO: 80: последовательность, состоящая из аминокислот 81-85 в аминокислотной последовательности варианта SIRPA мыши hmSIRPA_Δ2.
SEQ ID NO: 81: аминокислотная последовательность тяжелой цепи антитела OSE-172 (OSE-172_hG4Pro)
SEQ ID NO: 82: аминокислотная последовательность легкой цепи антитела OSE-172 (OSE-172_hK)
SEQ ID NO: 83: аминокислотная последовательность тяжелой цепи антитела KWAR23 (KWAR23_hG4Pro)
SEQ ID NO: 84: аминокислотная последовательность легкой цепи антитела KWAR23 (KWAR23_hK).
SEQ ID NO: 85: аминокислотная последовательность тяжелой цепи антитела ADU-1805 (ADU-1805_hG2).
SEQ ID NO: 86: аминокислотная последовательность легкой цепи антитела ADU-1805 (ADU-1805_hK).
[0228]
Все публикации, патенты и заявки на патенты, цитируемые в настоящем описании, полностью включены в настоящее описание посредством ссылки.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> НЭШНЛ ЮНИВЕРСИТИ КОРПОРЕЙШН КОБЕ ЮНИВЕРСИТИ
ДАЙИТИ САНКИО КОМПАНИ, ЛИМИТЕД
<120> АНТИТЕЛА ПРОТИВ SIRPα
<130> PH-7967-PCT
<150> JP 2018-131116
<151> 2018-07-10
<160> 86
<170> PatentIn version 3.5
<210> 1
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность D13 CDR-L1
<400> 1
Gly Ala Ser Lys Ser Val Arg Thr Tyr Met His
1 5 10
<210> 2
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность D13 CDR-L2
<400> 2
Ser Ala Ser Asn Leu Glu Ala
1 5
<210> 3
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность D13 CDR-L3
<400> 3
Gln Gln Ser Asn Glu Pro Pro Tyr Thr
1 5
<210> 4
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность D13 CDR-H1
<400> 4
Gly Phe Thr Phe Ser Asp Tyr Gly Met Ile
1 5 10
<210> 5
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность D13 CDR-H2
<400> 5
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr
1 5 10
<210> 6
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность D13 CDR-H3
<400> 6
Arg Tyr Tyr Gly Phe Asn Tyr Pro Phe Asp Tyr
1 5 10
<210> 7
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F44 CDR-L1
<400> 7
Lys Ala Ser Lys Ser Ile Ser Lys Tyr Leu Ala
1 5 10
<210> 8
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F44 CDR-L2
<400> 8
Ser Gly Ser Thr Leu Gln Ser
1 5
<210> 9
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F44 CDR-L3
<400> 9
Gln Gln His Asn Glu Tyr Pro Pro Thr
1 5
<210> 10
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F44 CDR-H1
<400> 10
Gly Phe Thr Phe Ser Asn Tyr Tyr Met Ala
1 5 10
<210> 11
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F44 CDR-H2
<400> 11
Tyr Ile Thr Thr Gly Gly Gly Ser Thr Tyr
1 5 10
<210> 12
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F44 CDR-H3
<400> 12
Ala Asn Tyr Gly Gly Ser Tyr Phe Asp Tyr
1 5 10
<210> 13
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F63 CDR-L1
<400> 13
Glu Arg Ser Ser Gly Asp Ile Gly Asp Ser Tyr Val Ser
1 5 10
<210> 14
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F63 CDR-L2
<400> 14
Ala Asp Asp Gln Arg Pro Ser
1 5
<210> 15
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F63 CDR-L3
<400> 15
Gln Ser Tyr Asp Ser Lys Ile Asp Ile
1 5
<210> 16
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F63 CDR-H1
<400> 16
Gly Phe Ser Leu Ala Ser Tyr Ser Leu Ser
1 5 10
<210> 17
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F63 CDR-H2
<400> 17
Arg Met Tyr Tyr Asp Gly Asp Thr Ala
1 5
<210> 18
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность F63 CDR-H3
<400> 18
Asp Arg Ser Met Phe Gly Thr Asp Tyr Pro His Trp Tyr Phe Asp Phe
1 5 10 15
<210> 19
<211> 449
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК-фрагмент, содержащий нуклеотидную последовательность, кодирующую
сигнальную последовательность легкой цепи человека и константную
область легкой цепи каппа человека
<400> 19
gcctccggac tctagagcca ccatggtgct gcagacccag gtgttcatct ccctgctgct 60
gtggatctcc ggcgcgtacg gcgatatcgt gatgattaaa cgtacggtgg ccgccccctc 120
cgtgttcatc ttccccccct ccgacgagca gctgaagtcc ggcaccgcct ccgtggtgtg 180
cctgctgaat aacttctacc ccagagaggc caaggtgcag tggaaggtgg acaacgccct 240
gcagtccggg aactcccagg agagcgtgac cgagcaggac agcaaggaca gcacctacag 300
cctgagcagc accctgaccc tgagcaaagc cgactacgag aagcacaagg tgtacgcctg 360
cgaggtgacc caccagggcc tgagctcccc cgtcaccaag agcttcaaca ggggggagtg 420
ttaggggccc gtttaaacgg gggaggcta 449
<210> 20
<211> 462
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК-фрагмент, содержащий нуклеотидную последовательность, кодирующую
сигнальную последовательность легкой цепи человека и константную
область легкой цепи лямбда человека
<400> 20
cagcctccgg actctagagc caccatggtg ctgcagaccc aggtgttcat ctccctgctg 60
ctgtggatct ccggcgcgta cggctagagc ggcggaacca agttaactgt gcttggccag 120
cctaaggctg cccctagcgt gaccctgttc cctccttcca gcgaggagct tcaagctaac 180
aaggccaccc tggtgtgtct tatctctgac ttctaccctg gcgctgtgac cgtggcctgg 240
aaggctgaca gctcccctgt gaaggccgga gtggagacca ccacacctag caagcagtct 300
aacaacaagt acgctgccag ctcctacctg agccttaccc ctgagcagtg gaagtctcac 360
agaagctact cctgtcaagt gacccacgag ggcagcaccg tggagaagac cgtggctcct 420
accgagtgtt cctaggggcc cgtttaaacg ggggaggcta ac 462
<210> 21
<211> 1117
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК-фрагмент, содержащий нуклеотидную последовательность, кодирующую
сигнальную последовательность тяжелой цепи человека и константную
область тяжелой цепи IgG4 Pro FALA человека
<400> 21
ccagcctccg gactctagag ccaccatgaa acacctgtgg ttcttcctcc tgctggtggc 60
agctcccaga tgggtgctga gccaggtgca attgtgcagg cggttagctc agcctccacc 120
aagggcccta gcgtgttccc tctggcccct tgtagcagaa gcaccagcga gtctacagcc 180
gccctgggct gcctcgtgaa ggactacttt cccgagcccg tgaccgtgtc ctggaactct 240
ggcgctctga caagcggcgt gcacaccttt ccagccgtgc tgcagagcag cggcctgtac 300
tctctgtcca gcgtcgtgac tgtgcccagc agctctctgg gcaccaagac ctacacctgt 360
aacgtggacc acaagcccag caacaccaag gtggacaagc gggtggaatc taagtacggc 420
cctccctgcc ctccttgccc agcccctgaa gccgcgggcg gaccctccgt gttcctgttc 480
cccccaaagc ccaaggacac cctgatgatc agccggaccc ccgaagtgac ctgcgtggtg 540
gtggatgtgt cccaggaaga tcccgaggtg cagttcaatt ggtacgtgga cggcgtggaa 600
gtgcacaacg ccaagaccaa gcctagagag gaacagttca acagcaccta ccgggtggtg 660
tccgtgctga cagtgctgca ccaggactgg ctgaacggca aagagtacaa gtgcaaggtg 720
tccaacaagg gcctgcccag ctccatcgag aaaaccatca gcaaggccaa gggccagccc 780
cgcgaacccc aggtgtacac actgcctcca agccaggaag agatgaccaa gaatcaggtg 840
tccctgacct gtctcgtgaa aggcttctac ccctccgata tcgccgtgga atgggagagc 900
aacggccagc ccgagaacaa ctacaagacc accccccctg tgctggactc cgatggctca 960
ttcttcctgt acagcagact gaccgtggac aagagccggt ggcaggaagg caacgtgttc 1020
agctgctccg tgatgcacga ggccctgcac aaccactaca cccagaagtc cctgtctctg 1080
agcctgggca aatgagttta aacgggggag gctaact 1117
<210> 22
<211> 699
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая легкую цепь химерного
антитела D13 человека
<400> 22
atggtgctgc agacccaggt gttcatctcc ctgctgctgt ggatctccgg cgcgtacggc 60
gacactgtgc tgacccagtc tcctgctttg gctgtgtctc tagggcagag ggtcaccatc 120
tcttgtgggg ccagcaaaag tgtccgtaca tatatgcact ggtaccaaca aaaatcggga 180
cagcaaccca aactcctgat ctatagtgca tccaacctag aggctggagt cccttccagg 240
ttcagtggga gtgggtctgg gacagacttt accctcacca tagatcctgt ggaggctgat 300
gacattgcaa actattactg tcagcagagt aatgaacctc cgtacacgtt tggagctggg 360
accaagctgg aactgaaacg gacggtggcc gccccctccg tgttcatctt ccccccctcc 420
gacgagcagc tgaagtccgg caccgcctcc gtggtgtgcc tgctgaataa cttctacccc 480
agagaggcca aggtgcagtg gaaggtggac aacgccctgc agtccgggaa ctcccaggag 540
agcgtgaccg agcaggacag caaggacagc acctacagcc tgagcagcac cctgaccctg 600
agcaaagccg actacgagaa gcacaaggtg tacgcctgcg aggtgaccca ccagggcctg 660
agctcccccg tcaccaagag cttcaacagg ggggagtgt 699
<210> 23
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность легкой цепи химерного антитела
D13 человека
<400> 23
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Thr Val Leu Thr Gln Ser Pro Ala Leu Ala Val
20 25 30
Ser Leu Gly Gln Arg Val Thr Ile Ser Cys Gly Ala Ser Lys Ser Val
35 40 45
Arg Thr Tyr Met His Trp Tyr Gln Gln Lys Ser Gly Gln Gln Pro Lys
50 55 60
Leu Leu Ile Tyr Ser Ala Ser Asn Leu Glu Ala Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asp Pro
85 90 95
Val Glu Ala Asp Asp Ile Ala Asn Tyr Tyr Cys Gln Gln Ser Asn Glu
100 105 110
Pro Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 24
<211> 1398
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая тяжелую цепь химерного
антитела D13 человека
<400> 24
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagcgag 60
gtacagctgg tggagtctgg aggaggctta gtgcagcctg gaaggtccct gaaactctcc 120
tgtttagcct ctggattcac tttcagtgac tatggaatga tctgggttcg ccaggctcca 180
gggaaggggc tggagtgggt tgcatctatt agtagtagta gcagttacat ctactatgca 240
gacacagtga agggccgatt caccatctcc agagaaaatg ccaagaacac cctgttcctg 300
cacatgacca gtctgaggtc tgaagacact gccttgtatt actgtgcaag aagatactat 360
gggtttaact acccttttga ttactggggc caaggagtca tggtcacagt cagctcagcc 420
tccaccaagg gccctagcgt gttccctctg gccccttgta gcagaagcac cagcgagtct 480
acagccgccc tgggctgcct cgtgaaggac tactttcccg agcccgtgac cgtgtcctgg 540
aactctggcg ctctgacaag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 600
ctgtactctc tgtccagcgt cgtgactgtg cccagcagct ctctgggcac caagacctac 660
acctgtaacg tggaccacaa gcccagcaac accaaggtgg acaagcgggt ggaatctaag 720
tacggccctc cctgccctcc ttgcccagcc cctgaagccg cgggcggacc ctccgtgttc 780
ctgttccccc caaagcccaa ggacaccctg atgatcagcc ggacccccga agtgacctgc 840
gtggtggtgg atgtgtccca ggaagatccc gaggtgcagt tcaattggta cgtggacggc 900
gtggaagtgc acaacgccaa gaccaagcct agagaggaac agttcaacag cacctaccgg 960
gtggtgtccg tgctgacagt gctgcaccag gactggctga acggcaaaga gtacaagtgc 1020
aaggtgtcca acaagggcct gcccagctcc atcgagaaaa ccatcagcaa ggccaagggc 1080
cagccccgcg aaccccaggt gtacacactg cctccaagcc aggaagagat gaccaagaat 1140
caggtgtccc tgacctgtct cgtgaaaggc ttctacccct ccgatatcgc cgtggaatgg 1200
gagagcaacg gccagcccga gaacaactac aagaccaccc cccctgtgct ggactccgat 1260
ggctcattct tcctgtacag cagactgacc gtggacaaga gccggtggca ggaaggcaac 1320
gtgttcagct gctccgtgat gcacgaggcc ctgcacaacc actacaccca gaagtccctg 1380
tctctgagcc tgggcaaa 1398
<210> 25
<211> 466
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность тяжелой цепи химерного антитела D13
человека
<400> 25
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Arg Ser Leu Lys Leu Ser Cys Leu Ala Ser Gly Phe Thr Phe
35 40 45
Ser Asp Tyr Gly Met Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala
65 70 75 80
Asp Thr Val Lys Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn
85 90 95
Thr Leu Phe Leu His Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Leu
100 105 110
Tyr Tyr Cys Ala Arg Arg Tyr Tyr Gly Phe Asn Tyr Pro Phe Asp Tyr
115 120 125
Trp Gly Gln Gly Val Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
130 135 140
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
145 150 155 160
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
165 170 175
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
180 185 190
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
195 200 205
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
210 215 220
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
225 230 235 240
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
245 250 255
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
260 265 270
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
275 280 285
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
290 295 300
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
305 310 315 320
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
325 330 335
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
340 345 350
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
355 360 365
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
370 375 380
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
385 390 395 400
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
420 425 430
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
435 440 445
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
450 455 460
Gly Lys
465
<210> 26
<211> 702
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая легкую цепь химерного
антитела F44 человека
<400> 26
atggtgctgc agacccaggt gttcatctcc ctgctgctgt ggatctccgg cgcgtacggc 60
gatgtccaga tgacccagtc tccatctaat cttgctgcct ctcctggaga aagtgtttcc 120
atcaattgca aggcaagtaa gagcattagc aagtatttag cctggtatca acagaaacct 180
gggaaagcaa ataagcttct tatctactct gggtcaactt tgcaatctgg aactccatcg 240
aggttcagtg gcagtggatc tggtacagat ttcactctca ccatcagaaa cctggagcct 300
gaagattttg gactctatta ctgtcaacag cataatgaat acccacccac gtttggagct 360
gggaccaagt tggaactgaa acggacggtg gccgccccct ccgtgttcat cttccccccc 420
tccgacgagc agctgaagtc cggcaccgcc tccgtggtgt gcctgctgaa taacttctac 480
cccagagagg ccaaggtgca gtggaaggtg gacaacgccc tgcagtccgg gaactcccag 540
gagagcgtga ccgagcagga cagcaaggac agcacctaca gcctgagcag caccctgacc 600
ctgagcaaag ccgactacga gaagcacaag gtgtacgcct gcgaggtgac ccaccagggc 660
ctgagctccc ccgtcaccaa gagcttcaac aggggggagt gt 702
<210> 27
<211> 234
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность легкой цепи химерного антитела F44
человека
<400> 27
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Val Gln Met Thr Gln Ser Pro Ser Asn Leu Ala
20 25 30
Ala Ser Pro Gly Glu Ser Val Ser Ile Asn Cys Lys Ala Ser Lys Ser
35 40 45
Ile Ser Lys Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Asn
50 55 60
Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Thr Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Arg
85 90 95
Asn Leu Glu Pro Glu Asp Phe Gly Leu Tyr Tyr Cys Gln Gln His Asn
100 105 110
Glu Tyr Pro Pro Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 28
<211> 1395
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая тяжелую цепь химерного
антитела F44 человека
<400> 28
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagcgag 60
gtgcagctgg tggaatctgg gggaggctta gtgcagcctg gaaggtccct gaaactctcc 120
tgtgcagcct caggattcac tttcagtaac tattacatgg cctgggtccg ccaggctcca 180
acgaagggtc tggagtgggt cacatacatt actactggtg gtggtagcac ttactttcga 240
gactccgtga agggccgatt cactatctcc agagataatg cagaaagcac cctatacctg 300
caaatggaca gtctgaggtc tgaggacacg gccacttatt actgtacagc agctaactac 360
ggagggtcct actttgatta ctggggccaa ggagtcatgg tcacagtcag ctcagcctcc 420
accaagggcc ctagcgtgtt ccctctggcc ccttgtagca gaagcaccag cgagtctaca 480
gccgccctgg gctgcctcgt gaaggactac tttcccgagc ccgtgaccgt gtcctggaac 540
tctggcgctc tgacaagcgg cgtgcacacc tttccagccg tgctgcagag cagcggcctg 600
tactctctgt ccagcgtcgt gactgtgccc agcagctctc tgggcaccaa gacctacacc 660
tgtaacgtgg accacaagcc cagcaacacc aaggtggaca agcgggtgga atctaagtac 720
ggccctccct gccctccttg cccagcccct gaagccgcgg gcggaccctc cgtgttcctg 780
ttccccccaa agcccaagga caccctgatg atcagccgga cccccgaagt gacctgcgtg 840
gtggtggatg tgtcccagga agatcccgag gtgcagttca attggtacgt ggacggcgtg 900
gaagtgcaca acgccaagac caagcctaga gaggaacagt tcaacagcac ctaccgggtg 960
gtgtccgtgc tgacagtgct gcaccaggac tggctgaacg gcaaagagta caagtgcaag 1020
gtgtccaaca agggcctgcc cagctccatc gagaaaacca tcagcaaggc caagggccag 1080
ccccgcgaac cccaggtgta cacactgcct ccaagccagg aagagatgac caagaatcag 1140
gtgtccctga cctgtctcgt gaaaggcttc tacccctccg atatcgccgt ggaatgggag 1200
agcaacggcc agcccgagaa caactacaag accacccccc ctgtgctgga ctccgatggc 1260
tcattcttcc tgtacagcag actgaccgtg gacaagagcc ggtggcagga aggcaacgtg 1320
ttcagctgct ccgtgatgca cgaggccctg cacaaccact acacccagaa gtccctgtct 1380
ctgagcctgg gcaaa 1395
<210> 29
<211> 465
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность тяжелой цепи химерного антитела F44
человека
<400> 29
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Arg Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Asn Tyr Tyr Met Ala Trp Val Arg Gln Ala Pro Thr Lys Gly Leu
50 55 60
Glu Trp Val Thr Tyr Ile Thr Thr Gly Gly Gly Ser Thr Tyr Phe Arg
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Glu Ser
85 90 95
Thr Leu Tyr Leu Gln Met Asp Ser Leu Arg Ser Glu Asp Thr Ala Thr
100 105 110
Tyr Tyr Cys Thr Ala Ala Asn Tyr Gly Gly Ser Tyr Phe Asp Tyr Trp
115 120 125
Gly Gln Gly Val Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
210 215 220
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
225 230 235 240
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
245 250 255
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
260 265 270
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
275 280 285
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
290 295 300
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
305 310 315 320
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
325 330 335
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
340 345 350
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
355 360 365
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
370 375 380
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
385 390 395 400
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
405 410 415
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
420 425 430
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
435 440 445
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
450 455 460
Lys
465
<210> 30
<211> 708
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая легкую цепь химерного
антитела F63 человека
<400> 30
atggtgctgc agacccaggt gttcatctcc ctgctgctgt ggatctccgg cgcgtacggc 60
cagttcacgc tgactcaacc aaagtccgtg tcaggagctt taagaagcac tatcaccatt 120
ccctgtgagc gcagcagtgg tgacattgga gatagctatg tgagctggta ccagcgacac 180
ttgggaagac cccccatcaa tgtgatctat gctgatgatc aaagaccatc tgaagtgtct 240
gatcggttct cgggctccat cgacagctcc tctaactcag cctcactgac catcactaat 300
ctgcagatgg atgatgaggc cgactacttc tgtcagtctt acgatagtaa gattgacatt 360
ttcggcggtg gaaccaagct cactgtccta ggccagccta aggctgcccc tagcgtgacc 420
ctgttccctc cttccagcga ggagcttcaa gctaacaagg ccaccctggt gtgtcttatc 480
tctgacttct accctggcgc tgtgaccgtg gcctggaagg ctgacagctc ccctgtgaag 540
gccggagtgg agaccaccac acctagcaag cagtctaaca acaagtacgc tgccagctcc 600
tacctgagcc ttacccctga gcagtggaag tctcacagaa gctactcctg tcaagtgacc 660
cacgagggca gcaccgtgga gaagaccgtg gctcctaccg agtgttcc 708
<210> 31
<211> 236
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность легкой цепи химерного антитела F63
человека
<400> 31
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Gln Phe Thr Leu Thr Gln Pro Lys Ser Val Ser Gly
20 25 30
Ala Leu Arg Ser Thr Ile Thr Ile Pro Cys Glu Arg Ser Ser Gly Asp
35 40 45
Ile Gly Asp Ser Tyr Val Ser Trp Tyr Gln Arg His Leu Gly Arg Pro
50 55 60
Pro Ile Asn Val Ile Tyr Ala Asp Asp Gln Arg Pro Ser Glu Val Ser
65 70 75 80
Asp Arg Phe Ser Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu
85 90 95
Thr Ile Thr Asn Leu Gln Met Asp Asp Glu Ala Asp Tyr Phe Cys Gln
100 105 110
Ser Tyr Asp Ser Lys Ile Asp Ile Phe Gly Gly Gly Thr Lys Leu Thr
115 120 125
Val Leu Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro
130 135 140
Ser Ser Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile
145 150 155 160
Ser Asp Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser
165 170 175
Ser Pro Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser
180 185 190
Asn Asn Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln
195 200 205
Trp Lys Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser
210 215 220
Thr Val Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
225 230 235
<210> 32
<211> 1410
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая тяжелую цепь химерного
антитела F63 человека
<400> 32
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagccag 60
gtgcagctga aggagtcagg acctggtctg gtgcagccct cagagaccct gtccctcacc 120
tgcactgtct ctgggttctc actagccagc tatagtttaa gttgggttcg ccagccttca 180
ggaaaaggtc ctgagtggat gggaagaatg tactatgatg gagacacagc atataattca 240
gctctcaaat cccgactgag catcagcagg gacacctcca agaaccaagt tttcttaaaa 300
atgaacagtc tgcaaactga tgacacaggc acttactact gtaccagaga taggagtatg 360
tttggtacgg attatcccca ctggtacttt gacttctggg gcccaggaac catggtcacc 420
gtgagctcag cctccaccaa gggccctagc gtgttccctc tggccccttg tagcagaagc 480
accagcgagt ctacagccgc cctgggctgc ctcgtgaagg actactttcc cgagcccgtg 540
accgtgtcct ggaactctgg cgctctgaca agcggcgtgc acacctttcc agccgtgctg 600
cagagcagcg gcctgtactc tctgtccagc gtcgtgactg tgcccagcag ctctctgggc 660
accaagacct acacctgtaa cgtggaccac aagcccagca acaccaaggt ggacaagcgg 720
gtggaatcta agtacggccc tccctgccct ccttgcccag cccctgaagc cgcgggcgga 780
ccctccgtgt tcctgttccc cccaaagccc aaggacaccc tgatgatcag ccggaccccc 840
gaagtgacct gcgtggtggt ggatgtgtcc caggaagatc ccgaggtgca gttcaattgg 900
tacgtggacg gcgtggaagt gcacaacgcc aagaccaagc ctagagagga acagttcaac 960
agcacctacc gggtggtgtc cgtgctgaca gtgctgcacc aggactggct gaacggcaaa 1020
gagtacaagt gcaaggtgtc caacaagggc ctgcccagct ccatcgagaa aaccatcagc 1080
aaggccaagg gccagccccg cgaaccccag gtgtacacac tgcctccaag ccaggaagag 1140
atgaccaaga atcaggtgtc cctgacctgt ctcgtgaaag gcttctaccc ctccgatatc 1200
gccgtggaat gggagagcaa cggccagccc gagaacaact acaagaccac cccccctgtg 1260
ctggactccg atggctcatt cttcctgtac agcagactga ccgtggacaa gagccggtgg 1320
caggaaggca acgtgttcag ctgctccgtg atgcacgagg ccctgcacaa ccactacacc 1380
cagaagtccc tgtctctgag cctgggcaaa 1410
<210> 33
<211> 470
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность тяжелой цепи химерного антитела F63
человека
<400> 33
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Gln
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu
35 40 45
Ala Ser Tyr Ser Leu Ser Trp Val Arg Gln Pro Ser Gly Lys Gly Pro
50 55 60
Glu Trp Met Gly Arg Met Tyr Tyr Asp Gly Asp Thr Ala Tyr Asn Ser
65 70 75 80
Ala Leu Lys Ser Arg Leu Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln
85 90 95
Val Phe Leu Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Gly Thr Tyr
100 105 110
Tyr Cys Thr Arg Asp Arg Ser Met Phe Gly Thr Asp Tyr Pro His Trp
115 120 125
Tyr Phe Asp Phe Trp Gly Pro Gly Thr Met Val Thr Val Ser Ser Ala
130 135 140
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser
145 150 155 160
Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
165 170 175
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
180 185 190
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
195 200 205
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr
210 215 220
Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
225 230 235 240
Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
245 250 255
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
260 265 270
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
275 280 285
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
290 295 300
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
305 310 315 320
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
325 330 335
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
340 345 350
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
355 360 365
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
370 375 380
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
385 390 395 400
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
405 410 415
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
420 425 430
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
435 440 445
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
450 455 460
Ser Leu Ser Leu Gly Lys
465 470
<210> 34
<211> 702
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая легкую цепь
hL2 гуманизированного D13
<400> 34
atggtgctgc agacccaggt gttcatctcc ctgctgctgt ggatctccgg cgcgtacggc 60
gccattcagc tgacacagag ccctagcagc ctgagcgcct ctgtgggcca gagagtgacc 120
attacctgcg gcgccagcaa gagcgtgcgg acctacatgc actggtatca gcagaagccc 180
ggcaaggccc ccaagctgct gatctacagc gcctccaatc tggaagccgg cgtgcccagc 240
agattttccg gctctggcag cggcaccgac ttcaccctga caatcagcag cctgcagccc 300
gaggacttcg ccacctacta ctgccagcag agcaacgagc ccccctacac ctttggccag 360
ggcaccaagc tggaaatcaa gcgtacggtg gccgccccct ccgtgttcat cttccccccc 420
tccgacgagc agctgaagtc cggcaccgcc tccgtggtgt gcctgctgaa taacttctac 480
cccagagagg ccaaggtgca gtggaaggtg gacaacgccc tgcagtccgg gaactcccag 540
gagagcgtga ccgagcagga cagcaaggac agcacctaca gcctgagcag caccctgacc 600
ctgagcaaag ccgactacga gaagcacaag gtgtacgcct gcgaggtgac ccaccagggc 660
ctgagctccc ccgtcaccaa gagcttcaac aggggggagt gt 702
<210> 35
<211> 234
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность легкой цепи hL2
гуманизированного D13
<400> 35
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Val Gly Gln Arg Val Thr Ile Thr Cys Gly Ala Ser Lys Ser
35 40 45
Val Arg Thr Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Ala Ser Asn Leu Glu Ala Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
100 105 110
Glu Pro Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 36
<211> 702
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая легкую цепь
hL3 гуманизированного D13
<400> 36
atggtgctgc agacccaggt gttcatctcc ctgctgctgt ggatctccgg cgcgtacggc 60
gatacccagc tgacacagag ccctagcagc ctgtctgcca gcgtgggcca gagagtgacc 120
attacctgcg gcgccagcaa gagcgtgcgg acctacatgc actggtatca gcagaagccc 180
ggcaagcagc ccaagctgct gatctacagc gcctccaacc tggaagccgg cgtgcccagc 240
agattttctg gcagcggctc cggcaccgac ttcaccctga caatcagcag cctgcagccc 300
gaggacttcg ccacctacta ctgccagcag agcaacgagc ccccctacac ctttggccag 360
ggcaccaagc tggaaatcaa gcgtacggtg gccgccccct ccgtgttcat cttccccccc 420
tccgacgagc agctgaagtc cggcaccgcc tccgtggtgt gcctgctgaa taacttctac 480
cccagagagg ccaaggtgca gtggaaggtg gacaacgccc tgcagtccgg gaactcccag 540
gagagcgtga ccgagcagga cagcaaggac agcacctaca gcctgagcag caccctgacc 600
ctgagcaaag ccgactacga gaagcacaag gtgtacgcct gcgaggtgac ccaccagggc 660
ctgagctccc ccgtcaccaa gagcttcaac aggggggagt gt 702
<210> 37
<211> 234
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность легкой цепи hL3
гуманизированного D13
<400> 37
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Thr Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Val Gly Gln Arg Val Thr Ile Thr Cys Gly Ala Ser Lys Ser
35 40 45
Val Arg Thr Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Lys Gln Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Ala Ser Asn Leu Glu Ala Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
100 105 110
Glu Pro Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 38
<211> 702
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая легкую цепь hL4 гуманизированного D13
<400> 38
atggtgctgc agacccaggt gttcatctcc ctgctgctgt ggatctccgg cgcgtacggc 60
gataccgtgc tgacccagag ccctgatagc ctggccgtgt ccctgggaca gagagccacc 120
atcaattgcg gcgccagcaa gagcgtgcgg acctacatgc actggtatca gcagaagccc 180
ggccagcagc ccaagctgct gatctacagc gcctccaacc tggaagccgg cgtgcccagc 240
agattttctg gcagcggctc cggcaccgac ttcaccctga caatcagctc cctgcaggcc 300
gaggacgtgg ccgtgtacta ctgccagcag agcaacgagc ccccctacac ctttggccag 360
ggcaccaagg tggaaatcaa gcgtacggtg gccgccccct ccgtgttcat cttccccccc 420
tccgacgagc agctgaagtc cggcaccgcc tccgtggtgt gcctgctgaa taacttctac 480
cccagagagg ccaaggtgca gtggaaggtg gacaacgccc tgcagtccgg gaactcccag 540
gagagcgtga ccgagcagga cagcaaggac agcacctaca gcctgagcag caccctgacc 600
ctgagcaaag ccgactacga gaagcacaag gtgtacgcct gcgaggtgac ccaccagggc 660
ctgagctccc ccgtcaccaa gagcttcaac aggggggagt gt 702
<210> 39
<211> 234
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность легкой цепи hL4 гуманизированного D13
<400> 39
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Thr Val Leu Thr Gln Ser Pro Asp Ser Leu Ala
20 25 30
Val Ser Leu Gly Gln Arg Ala Thr Ile Asn Cys Gly Ala Ser Lys Ser
35 40 45
Val Arg Thr Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Gln Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Ala Ser Asn Leu Glu Ala Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Asn
100 105 110
Glu Pro Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 40
<211> 1398
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая тяжелую цепь hH1 гуманизированного D13
<400> 40
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagccag 60
gtgcagctgg tggaatctgg cggcggagtg gtgcagcctg gcagaagcct gagactgagc 120
tgtgccgcca gcggcttcac cttcagcgac tacggcatga tctgggtgcg ccaggcccct 180
ggcaaaggcc tggaatgggt ggccagcatc agcagcagct ccagctacat ctactacgcc 240
gacagcgtga agggccggtt caccatcagc cgggacaaca gcaagaaccg gctgtacctg 300
cagatgaaca gcctgcgggc cgaggacacc gccgtgtact attgcgccag acggtactac 360
ggcttcaact accccttcga ctactggggc cagggcacaa tggtcaccgt cagctcagcc 420
tccaccaagg gccctagcgt gttccctctg gccccttgta gcagaagcac cagcgagtct 480
acagccgccc tgggctgcct cgtgaaggac tactttcccg agcccgtgac cgtgtcctgg 540
aactctggcg ctctgacaag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 600
ctgtactctc tgtccagcgt cgtgactgtg cccagcagct ctctgggcac caagacctac 660
acctgtaacg tggaccacaa gcccagcaac accaaggtgg acaagcgggt ggaatctaag 720
tacggccctc cctgccctcc ttgcccagcc cctgaagccg cgggcggacc ctccgtgttc 780
ctgttccccc caaagcccaa ggacaccctg atgatcagcc ggacccccga agtgacctgc 840
gtggtggtgg atgtgtccca ggaagatccc gaggtgcagt tcaattggta cgtggacggc 900
gtggaagtgc acaacgccaa gaccaagcct agagaggaac agttcaacag cacctaccgg 960
gtggtgtccg tgctgacagt gctgcaccag gactggctga acggcaaaga gtacaagtgc 1020
aaggtgtcca acaagggcct gcccagctcc atcgagaaaa ccatcagcaa ggccaagggc 1080
cagccccgcg aaccccaggt gtacacactg cctccaagcc aggaagagat gaccaagaat 1140
caggtgtccc tgacctgtct cgtgaaaggc ttctacccct ccgatatcgc cgtggaatgg 1200
gagagcaacg gccagcccga gaacaactac aagaccaccc cccctgtgct ggactccgat 1260
ggctcattct tcctgtacag cagactgacc gtggacaaga gccggtggca ggaaggcaac 1320
gtgttcagct gctccgtgat gcacgaggcc ctgcacaacc actacaccca gaagtccctg 1380
tctctgagcc tgggcaaa 1398
<210> 41
<211> 466
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность тяжелой цепи hH1
гуманизированного D13
<400> 41
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Asp Tyr Gly Met Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Arg Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Tyr Tyr Gly Phe Asn Tyr Pro Phe Asp Tyr
115 120 125
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
130 135 140
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
145 150 155 160
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
165 170 175
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
180 185 190
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
195 200 205
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
210 215 220
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
225 230 235 240
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
245 250 255
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
260 265 270
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
275 280 285
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
290 295 300
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
305 310 315 320
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
325 330 335
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
340 345 350
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
355 360 365
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
370 375 380
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
385 390 395 400
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
420 425 430
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
435 440 445
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
450 455 460
Gly Lys
465
<210> 42
<211> 1398
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая тяжелую
цепь hH2 гуманизированного D13
<400> 42
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagcgaa 60
gtgcagctgg tggaatctgg cggcggagtg gtgcagcctg gcagaagcct gagactgagc 120
tgtgccgcca gcggcttcac cttcagcgac tacggcatga tctgggtgcg ccaggcccct 180
ggcaaaggcc tggaatgggt ggccagcatc agcagcagct ccagctacat ctactacgcc 240
gacagcgtga agggccggtt caccatcagc cgggacaaca gcaagaacac cctgtacctg 300
cagatgaaca gcctgcgggc cgaggacacc gccgtgtact attgcgccag acggtactac 360
ggcttcaact accccttcga ctactggggc cagggcacaa tggtcaccgt cagctcagcc 420
tccaccaagg gccctagcgt gttccctctg gccccttgta gcagaagcac cagcgagtct 480
acagccgccc tgggctgcct cgtgaaggac tactttcccg agcccgtgac cgtgtcctgg 540
aactctggcg ctctgacaag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 600
ctgtactctc tgtccagcgt cgtgactgtg cccagcagct ctctgggcac caagacctac 660
acctgtaacg tggaccacaa gcccagcaac accaaggtgg acaagcgggt ggaatctaag 720
tacggccctc cctgccctcc ttgcccagcc cctgaagccg cgggcggacc ctccgtgttc 780
ctgttccccc caaagcccaa ggacaccctg atgatcagcc ggacccccga agtgacctgc 840
gtggtggtgg atgtgtccca ggaagatccc gaggtgcagt tcaattggta cgtggacggc 900
gtggaagtgc acaacgccaa gaccaagcct agagaggaac agttcaacag cacctaccgg 960
gtggtgtccg tgctgacagt gctgcaccag gactggctga acggcaaaga gtacaagtgc 1020
aaggtgtcca acaagggcct gcccagctcc atcgagaaaa ccatcagcaa ggccaagggc 1080
cagccccgcg aaccccaggt gtacacactg cctccaagcc aggaagagat gaccaagaat 1140
caggtgtccc tgacctgtct cgtgaaaggc ttctacccct ccgatatcgc cgtggaatgg 1200
gagagcaacg gccagcccga gaacaactac aagaccaccc cccctgtgct ggactccgat 1260
ggctcattct tcctgtacag cagactgacc gtggacaaga gccggtggca ggaaggcaac 1320
gtgttcagct gctccgtgat gcacgaggcc ctgcacaacc actacaccca gaagtccctg 1380
tctctgagcc tgggcaaa 1398
<210> 43
<211> 466
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность тяжелой цепи hH2
гуманизированного D13
<400> 43
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Asp Tyr Gly Met Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Tyr Tyr Gly Phe Asn Tyr Pro Phe Asp Tyr
115 120 125
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
130 135 140
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
145 150 155 160
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
165 170 175
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
180 185 190
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
195 200 205
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
210 215 220
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
225 230 235 240
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
245 250 255
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
260 265 270
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
275 280 285
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
290 295 300
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
305 310 315 320
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
325 330 335
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
340 345 350
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
355 360 365
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
370 375 380
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
385 390 395 400
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
420 425 430
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
435 440 445
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
450 455 460
Gly Lys
465
<210> 44
<211> 1140
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая ECD варианта 1
SIRPα человека
<400> 44
atggaacctg ccggacctgc ccctggcaga ctgggacctc tgctgtgtct gctgctggcc 60
gcctcttgtg cttggagcgg agtggctggc gaagaggaac tgcaagtgat ccagcccgac 120
aagagcgtgc tggtggccgc tggcgaaacc gccaccctga gatgtacagc caccagcctg 180
atccccgtgg gccccatcca gtggtttaga ggcgctggcc ctggccgcga gctgatctac 240
aatcagaaag agggccactt ccccagagtg accaccgtgt ccgacctgac caagcggaac 300
aacatggact tcagcatccg gatcggcaac atcacccctg ccgatgccgg cacctactac 360
tgcgtgaagt tccggaaggg cagccccgac gacgtggaat tcaaaagcgg agccggcacc 420
gagctgagcg tgcgggctaa accttctgcc cctgtggtgt ctggacctgc cgccagagct 480
acacctcagc acaccgtgtc ttttacctgc gagagccacg gcttcagccc cagagacatc 540
accctgaagt ggttcaagaa cggcaacgag ctgtccgact tccagaccaa cgtggaccct 600
gtgggcgaga gcgtgtccta cagcatccac agcaccgcca aggtggtgct gacccgcgaa 660
gatgtgcaca gccaagtgat ctgcgaggtg gcccacgtga cactgcaggg cgatcctctg 720
agaggaaccg ccaacctgtc cgagacaatc agagtgcccc ccaccctgga agtgacccag 780
cagcctgtgc gggccgagaa ccaagtgaac gtgacctgcc aagtgcggaa gttctacccc 840
cagcggctgc agctgacctg gctggaaaac ggcaatgtgt cccggaccga gacagccagc 900
accgtgaccg agaacaagga tggcacctac aattggatga gctggctgct cgtgaacgtg 960
tccgcccacc gggacgatgt gaagctgaca tgccaggtgg aacacgacgg ccagcctgcc 1020
gtgtccaaga gccacgatct gaaggtgtca gcccatccca aagagcaggg ctccaacaca 1080
gccgccgaga acaccggcag caacgagcgg aacatctacc accaccatca ccaccactga 1140
<210> 45
<211> 379
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность ECD варианта 1 SIRPα человека
<400> 45
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
35 40 45
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
130 135 140
Arg Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala
145 150 155 160
Thr Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser
165 170 175
Pro Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser
180 185 190
Asp Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser
195 200 205
Ile His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser
210 215 220
Gln Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu
225 230 235 240
Arg Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu
245 250 255
Glu Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr
260 265 270
Cys Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu
275 280 285
Glu Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu
290 295 300
Asn Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val
305 310 315 320
Ser Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp
325 330 335
Gly Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His
340 345 350
Pro Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn
355 360 365
Glu Arg Asn Ile Tyr His His His His His His
370 375
<210> 46
<211> 468
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая IgV варианта 1
SIRPα человека
<400> 46
atggaacctg ccggacctgc ccctggcaga ctgggacctc tgctgtgtct gctgctggcc 60
gcctcttgtg cttggagcgg agtggctggc gaagaggaac tgcaagtgat ccagcccgac 120
aagagcgtgc tggtggccgc tggcgaaacc gccaccctga gatgtacagc caccagcctg 180
atccccgtgg gccccatcca gtggtttaga ggcgctggcc ctggccgcga gctgatctac 240
aatcagaaag agggccactt ccccagagtg accaccgtgt ccgacctgac caagcggaac 300
aacatggact tcagcatccg gatcggcaac atcacccctg ccgatgccgg cacctactac 360
tgcgtgaagt tccggaaggg cagccccgac gacgtggaat tcaaaagcgg agccggcacc 420
gagctgagcg tgcgggctaa acctagccac caccaccatc accactga 468
<210> 47
<211> 155
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислоная последовательность IgV варианта 1 SIRPα человека
<400> 47
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
35 40 45
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
130 135 140
Arg Ala Lys Pro Ser His His His His His His
145 150 155
<210> 48
<211> 1137
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая ECD варианта 2
SIRPα человека
<400> 48
atggaacctg ccggacctgc ccctggcaga ctgggacctc tgctgtgtct gctgctggcc 60
gcctcttgtg cttggagcgg agtggctggc gaagaggaac tgcaagtgat ccagcccgac 120
aagagcgtgt cagtggccgc tggcgagtct gccatcctgc actgtaccgt gaccagcctg 180
atccccgtgg gccccatcca gtggtttaga ggcgctggac ctgccagaga gctgatctac 240
aaccagaaag agggccactt ccccagagtg accaccgtgt ccgagagcac caagcgcgag 300
aacatggact tcagcatcag catctccaac atcacccctg ccgacgccgg cacctactac 360
tgcgtgaagt tcagaaaggg cagccccgac accgagttca agagcggagc cggcacagag 420
ctgtctgtgc gggccaaacc ttctgcccct gtggtgtctg gaccagccgc cagagctaca 480
cctcagcaca ccgtgtcttt tacctgcgag agccacggct tcagccccag agacatcacc 540
ctgaagtggt tcaagaacgg caacgagctg agcgacttcc agaccaacgt ggaccctgtg 600
ggcgagtccg tgtcctacag catccacagc accgccaagg tggtgctgac ccgcgaagat 660
gtgcacagcc aagtgatctg cgaggtggcc cacgtgacac tgcagggcga tcctctgaga 720
ggaaccgcca acctgagcga gacaatcaga gtgcccccca ccctggaagt gacccagcag 780
ccagtgcggg ccgagaacca agtgaacgtg acctgtcaag tgcggaagtt ctacccccag 840
cggctgcagc tgacctggct ggaaaacggc aatgtgtccc ggaccgagac agccagcacc 900
gtgacagaga acaaggatgg cacctacaat tggatgtctt ggctgctcgt gaacgtgtcc 960
gcccaccggg acgatgtgaa gctgacatgc caggtggaac acgacggcca gcctgccgtg 1020
tctaagagcc acgacctgaa ggtgtcagcc catcccaaag agcagggctc caacacagcc 1080
gccgagaaca ccggcagcaa cgagcggaac atctaccacc accatcacca ccactga 1137
<210> 49
<211> 378
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность ECD варианта 2 SIRPα человека
<400> 49
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
85 90 95
Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala Thr
145 150 155 160
Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro
165 170 175
Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp
180 185 190
Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser Ile
195 200 205
His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser Gln
210 215 220
Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg
225 230 235 240
Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu Glu
245 250 255
Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr Cys
260 265 270
Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu Asn
290 295 300
Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val Ser
305 310 315 320
Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp Gly
325 330 335
Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His Pro
340 345 350
Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn Glu
355 360 365
Arg Asn Ile Tyr His His His His His His
370 375
<210> 50
<211> 465
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая IgV варианта 2
SIRPα человека
<400> 50
atggaacctg ccggacctgc ccctggcaga ctgggacctc tgctgtgtct gctgctggcc 60
gcctcttgtg cttggagcgg agtggctggc gaagaggaac tgcaagtgat ccagcccgac 120
aagagcgtgt cagtggccgc tggcgagtct gccatcctgc actgtaccgt gaccagcctg 180
atccccgtgg gccccatcca gtggtttaga ggcgctggac ctgccagaga gctgatctac 240
aaccagaaag agggccactt ccccagagtg accaccgtgt ccgagagcac caagcgcgag 300
aacatggact tcagcatcag catctccaac atcacccctg ccgacgccgg cacctactac 360
tgcgtgaagt tcagaaaggg cagccccgac accgagttca agagcggagc cggcacagag 420
ctgtctgtgc gggccaagcc tagccaccac caccatcacc attga 465
<210> 51
<211> 154
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность IgV варианта 2 SIRPα человека
<400> 51
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
85 90 95
Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser His His His His His His
145 150
<210> 52
<211> 1137
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая ECD SIRPα обезьяны
<400> 52
atggaacccg ccggacctgc tcctggcaga ctgggacctc tgctgtgtct gctgctgacc 60
gccagctgtg cttggagcgg agtgctgggc gaagaggaac tgcaagtgat ccagcccgag 120
aagtccgtgt ctgtggccgc tggcgatagc gccaccctga attgcaccgt gtccagcctg 180
atccccgtgg gccctatcca gtggtttaga ggcgctggcc ctggcagaga gctgatctac 240
aacctgaaag agggccactt ccccagagtg accgccgtgt ccgaccccac caagcggaac 300
aacatggact tcagcatccg gatcagcaac atcacccctg ccgacgccgg cacctactac 360
tgcgtgaagt tcagaaaggg cagccccgac gtggaactga agtctggcgc cggaacagag 420
ctgagcgtgc gggccaaacc ttctgcccct gtggtgtctg gacctgccgt gcgggctaca 480
gccgagcaca ccgtgtcttt tacctgcgag agccacggct tcagccccag agacatcacc 540
ctgaagtggt tcaagaacgg caacgagctg tccgacgtgc agaccaacgt ggaccctgcc 600
ggcaagagcg tgtcctacag catcagatcc accgccagag tgctgctgac aagacgggac 660
gtgcacagcc aagtgatctg cgaggtggcc cacgtgacac tgcagggcga tcctctgaga 720
ggcaccgcca atctgagcga ggctatccgg gtgcccccat tcctggaagt gacccagcag 780
agcatgcggg ccgacaacca agtgaacgtg acctgccaag tgaccaagtt ctacccccag 840
cggctgcagc tgacctggct ggaaaacggc aatgtgtccc ggaccgagat ggcctctgcc 900
ctgcccgaga acaaggatgg cacctacaat tggaccagct ggctgctcgt gaacgtgtcc 960
gcccaccggg acgatgtgaa gctgacatgc caggtggaac acgacggcca gcccgccgtg 1020
aacaagagct tcagcgtgaa agtgtctgct caccccaaag agcagggcag caacactgcc 1080
gccgagaaca ccggcaccaa cgagcggaac atctaccatc accaccatca tcactga 1137
<210> 53
<211> 378
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность ECD SIRPα обезьяны
<400> 53
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Thr Ala Ser Cys Ala Trp Ser Gly Val Leu Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Glu Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Asp Ser Ala Thr Leu Asn Cys Thr Val Ser Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
65 70 75 80
Asn Leu Lys Glu Gly His Phe Pro Arg Val Thr Ala Val Ser Asp Pro
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Val Glu Leu Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Val Arg Ala Thr
145 150 155 160
Ala Glu His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro
165 170 175
Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp
180 185 190
Val Gln Thr Asn Val Asp Pro Ala Gly Lys Ser Val Ser Tyr Ser Ile
195 200 205
Arg Ser Thr Ala Arg Val Leu Leu Thr Arg Arg Asp Val His Ser Gln
210 215 220
Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg
225 230 235 240
Gly Thr Ala Asn Leu Ser Glu Ala Ile Arg Val Pro Pro Phe Leu Glu
245 250 255
Val Thr Gln Gln Ser Met Arg Ala Asp Asn Gln Val Asn Val Thr Cys
260 265 270
Gln Val Thr Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Thr Glu Met Ala Ser Ala Leu Pro Glu Asn
290 295 300
Lys Asp Gly Thr Tyr Asn Trp Thr Ser Trp Leu Leu Val Asn Val Ser
305 310 315 320
Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp Gly
325 330 335
Gln Pro Ala Val Asn Lys Ser Phe Ser Val Lys Val Ser Ala His Pro
340 345 350
Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Thr Asn Glu
355 360 365
Arg Asn Ile Tyr His His His His His His
370 375
<210> 54
<211> 1107
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая человеческий CD47-Fc
<400> 54
atgtggcccc tggtagcggc gctgttgctg ggctcggcgt gctgcggatc agctcagcta 60
ctatttaata aaacaaaatc tgtagaattc acgttttgta atgacactgt cgtcattcca 120
tgctttgtta ctaatatgga ggcacaaaac actactgaag tatacgtaaa gtggaaattt 180
aaaggaagag atatttacac ctttgatgga gctctaaaca agtccactgt ccccactgac 240
tttagtagtg caaaaattga agtctcacaa ttactaaaag gagatgcctc tttgaagatg 300
gataagagtg atgctgtctc acacacagga aactacactt gtgaagtaac agaattaacc 360
agagaaggtg aaacgatcat cgagctaaaa tatcgtgttg tttcatggtt ttctccaaat 420
gaagacaaaa ctcacacatg cccaccctgc ccagcacctg aactcctggg gggaccctca 480
gtcttcctct tccccccaaa acccaaggac accctcatga tctcccggac ccctgaggtc 540
acatgcgtgg tggtggacgt gagccacgaa gaccctgagg tcaagttcaa ctggtacgtg 600
gacggcgtgg aggtgcataa tgccaagaca aagccccggg aggagcagta caacagcacg 660
taccgggtgg tcagcgtcct caccgtcctg caccaggact ggctgaatgg caaggagtac 720
aagtgcaagg tctccaacaa agccctccca gcccccatcg agaaaaccat ctccaaagcc 780
aaaggccagc cccgggaacc acaggtgtac accctgcccc catcccggga ggagatgacc 840
aagaaccagg tcagcctgac ctgcctggtc aaaggcttct atcccagcga catcgccgtg 900
gagtgggaga gcaatggcca gcccgagaac aactacaaga ccacccctcc cgtgctggac 960
tccgacggct ccttcttcct ctacagcaag ctcaccgtgg acaagagcag gtggcagcag 1020
ggcaacgtct tctcatgctc cgtgatgcat gaggctctgc acaaccacta cacccagaag 1080
agcctctccc tgtctcccgg caaatga 1107
<210> 55
<211> 368
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность человеческого CD47-Fc
<400> 55
Met Trp Pro Leu Val Ala Ala Leu Leu Leu Gly Ser Ala Cys Cys Gly
1 5 10 15
Ser Ala Gln Leu Leu Phe Asn Lys Thr Lys Ser Val Glu Phe Thr Phe
20 25 30
Cys Asn Asp Thr Val Val Ile Pro Cys Phe Val Thr Asn Met Glu Ala
35 40 45
Gln Asn Thr Thr Glu Val Tyr Val Lys Trp Lys Phe Lys Gly Arg Asp
50 55 60
Ile Tyr Thr Phe Asp Gly Ala Leu Asn Lys Ser Thr Val Pro Thr Asp
65 70 75 80
Phe Ser Ser Ala Lys Ile Glu Val Ser Gln Leu Leu Lys Gly Asp Ala
85 90 95
Ser Leu Lys Met Asp Lys Ser Asp Ala Val Ser His Thr Gly Asn Tyr
100 105 110
Thr Cys Glu Val Thr Glu Leu Thr Arg Glu Gly Glu Thr Ile Ile Glu
115 120 125
Leu Lys Tyr Arg Val Val Ser Trp Phe Ser Pro Asn Glu Asp Lys Thr
130 135 140
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
145 150 155 160
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
165 170 175
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
180 185 190
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
195 200 205
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
210 215 220
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
225 230 235 240
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
245 250 255
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
260 265 270
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
275 280 285
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
290 295 300
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
305 310 315 320
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
325 330 335
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
340 345 350
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
355 360 365
<210> 56
<211> 504
<212> Белок
<213> Homo sapiens
<400> 56
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
35 40 45
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
130 135 140
Arg Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala
145 150 155 160
Thr Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser
165 170 175
Pro Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser
180 185 190
Asp Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser
195 200 205
Ile His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser
210 215 220
Gln Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu
225 230 235 240
Arg Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu
245 250 255
Glu Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr
260 265 270
Cys Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu
275 280 285
Glu Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu
290 295 300
Asn Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val
305 310 315 320
Ser Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp
325 330 335
Gly Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His
340 345 350
Pro Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn
355 360 365
Glu Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val
370 375 380
Ala Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys
385 390 395 400
Ala Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn
405 410 415
Ala Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu
420 425 430
Asn Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn
435 440 445
Asn His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser
450 455 460
Glu Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg
465 470 475 480
Thr Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr
485 490 495
Ala Ser Val Gln Val Pro Arg Lys
500
<210> 57
<211> 503
<212> Белок
<213> Homo sapiens
<400> 57
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
85 90 95
Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala Thr
145 150 155 160
Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro
165 170 175
Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp
180 185 190
Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser Ile
195 200 205
His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser Gln
210 215 220
Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg
225 230 235 240
Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu Glu
245 250 255
Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr Cys
260 265 270
Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu Asn
290 295 300
Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val Ser
305 310 315 320
Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp Gly
325 330 335
Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His Pro
340 345 350
Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn Glu
355 360 365
Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val Ala
370 375 380
Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys Ala
385 390 395 400
Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn Ala
405 410 415
Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu Asn
420 425 430
Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn Asn
435 440 445
His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser Glu
450 455 460
Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg Thr
465 470 475 480
Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr Ala
485 490 495
Ser Val Gln Val Pro Arg Lys
500
<210> 58
<211> 503
<212> Белок
<213> Macaca fascicularis
<400> 58
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Thr Ala Ser Cys Ala Trp Ser Gly Val Leu Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Glu Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Asp Ser Ala Thr Leu Asn Cys Thr Val Ser Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
65 70 75 80
Asn Leu Lys Glu Gly His Phe Pro Arg Val Thr Ala Val Ser Asp Pro
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Val Glu Leu Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Val Arg Ala Thr
145 150 155 160
Ala Glu His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro
165 170 175
Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp
180 185 190
Val Gln Thr Asn Val Asp Pro Ala Gly Lys Ser Val Ser Tyr Ser Ile
195 200 205
Arg Ser Thr Ala Arg Val Leu Leu Thr Arg Arg Asp Val His Ser Gln
210 215 220
Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg
225 230 235 240
Gly Thr Ala Asn Leu Ser Glu Ala Ile Arg Val Pro Pro Phe Leu Glu
245 250 255
Val Thr Gln Gln Ser Met Arg Ala Asp Asn Gln Val Asn Val Thr Cys
260 265 270
Gln Val Thr Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Thr Glu Met Ala Ser Ala Leu Pro Glu Asn
290 295 300
Lys Asp Gly Thr Tyr Asn Trp Thr Ser Trp Leu Leu Val Asn Val Ser
305 310 315 320
Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp Gly
325 330 335
Gln Pro Ala Val Asn Lys Ser Phe Ser Val Lys Val Ser Ala His Pro
340 345 350
Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Thr Asn Glu
355 360 365
Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val Ala
370 375 380
Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys Ala
385 390 395 400
Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn Ala
405 410 415
Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu Asn
420 425 430
Leu Pro Lys Gly Lys Lys Pro Ala Pro Arg Ala Ala Glu Pro Asn Asn
435 440 445
His Thr Glu Gly Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser Glu
450 455 460
Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg Thr
465 470 475 480
Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr Ala
485 490 495
Ser Val Gln Val Pro Arg Lys
500
<210> 59
<211> 509
<212> Белок
<213> Mus musculus
<400> 59
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Leu
1 5 10 15
Cys Leu Leu Leu Ser Ala Ser Cys Phe Cys Thr Gly Ala Thr Gly Lys
20 25 30
Glu Leu Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Asp Ser Thr Val Leu Asn Cys Thr Leu Thr Ser Leu Leu Pro Val Gly
50 55 60
Pro Ile Arg Trp Tyr Arg Gly Val Gly Pro Ser Arg Leu Leu Ile Tyr
65 70 75 80
Ser Phe Ala Gly Glu Tyr Val Pro Arg Ile Arg Asn Val Ser Asp Thr
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val Thr
100 105 110
Pro Ala Asp Ala Gly Ile Tyr Tyr Cys Val Lys Phe Gln Lys Gly Ser
115 120 125
Ser Glu Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val Tyr
130 135 140
Val Leu Ala Lys Pro Ser Pro Pro Glu Val Ser Gly Pro Ala Asp Arg
145 150 155 160
Gly Ile Pro Asp Gln Lys Val Asn Phe Thr Cys Lys Ser His Gly Phe
165 170 175
Ser Pro Arg Asn Ile Thr Leu Lys Trp Phe Lys Asp Gly Gln Glu Leu
180 185 190
His Pro Leu Glu Thr Thr Val Asn Pro Ser Gly Lys Asn Val Ser Tyr
195 200 205
Asn Ile Ser Ser Thr Val Arg Val Val Leu Asn Ser Met Asp Val Asn
210 215 220
Ser Lys Val Ile Cys Glu Val Ala His Ile Thr Leu Asp Arg Ser Pro
225 230 235 240
Leu Arg Gly Ile Ala Asn Leu Ser Asn Phe Ile Arg Val Ser Pro Thr
245 250 255
Val Lys Val Thr Gln Gln Ser Pro Thr Ser Met Asn Gln Val Asn Leu
260 265 270
Thr Cys Arg Ala Glu Arg Phe Tyr Pro Glu Asp Leu Gln Leu Ile Trp
275 280 285
Leu Glu Asn Gly Asn Val Ser Arg Asn Asp Thr Pro Lys Asn Leu Thr
290 295 300
Lys Asn Thr Asp Gly Thr Tyr Asn Tyr Thr Ser Leu Phe Leu Val Asn
305 310 315 320
Ser Ser Ala His Arg Glu Asp Val Val Phe Thr Cys Gln Val Lys His
325 330 335
Asp Gln Gln Pro Ala Ile Thr Arg Asn His Thr Val Leu Gly Phe Ala
340 345 350
His Ser Ser Asp Gln Gly Ser Met Gln Thr Phe Pro Asp Asn Asn Ala
355 360 365
Thr His Asn Trp Asn Val Phe Ile Gly Val Gly Val Ala Cys Ala Leu
370 375 380
Leu Val Val Leu Leu Met Ala Ala Leu Tyr Leu Leu Arg Ile Lys Gln
385 390 395 400
Lys Lys Ala Lys Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu
405 410 415
Lys Asn Ala Arg Glu Ile Thr Gln Ile Gln Asp Thr Asn Asp Ile Asn
420 425 430
Asp Ile Thr Tyr Ala Asp Leu Asn Leu Pro Lys Glu Lys Lys Pro Ala
435 440 445
Pro Arg Ala Pro Glu Pro Asn Asn His Thr Glu Tyr Ala Ser Ile Glu
450 455 460
Thr Gly Lys Val Pro Arg Pro Glu Asp Thr Leu Thr Tyr Ala Asp Leu
465 470 475 480
Asp Met Val His Leu Ser Arg Ala Gln Pro Ala Pro Lys Pro Glu Pro
485 490 495
Ser Phe Ser Glu Tyr Ala Ser Val Gln Val Gln Arg Lys
500 505
<210> 60
<211> 509
<212> Белок
<213> Mus musculus
<400> 60
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Leu
1 5 10 15
Cys Leu Leu Leu Ser Ala Ser Cys Phe Cys Thr Gly Ala Thr Gly Thr
20 25 30
Glu Val Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Asp Ser Thr Ile Leu Asn Cys Thr Val Thr Ser Leu Leu Pro Val Gly
50 55 60
Pro Ile Arg Trp Tyr Arg Gly Val Gly Gln Ser Arg Leu Leu Ile Tyr
65 70 75 80
Ser Phe Thr Gly Glu His Phe Pro Arg Val Arg Asn Val Ser Asp Thr
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val Thr
100 105 110
Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Arg Gly Ser
115 120 125
Ser Glu Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val Tyr
130 135 140
Val Leu Ala Lys Pro Ser Pro Pro Glu Val Ser Gly Pro Ala Asp Arg
145 150 155 160
Gly Ile Pro Asp Gln Lys Val Asn Phe Thr Cys Lys Ser His Gly Phe
165 170 175
Ser Pro Arg Asn Ile Thr Leu Lys Trp Phe Lys Asp Gly Gln Glu Leu
180 185 190
His Pro Leu Glu Thr Thr Val Asn Pro Ser Gly Lys Asn Val Ser Tyr
195 200 205
Asn Ile Ser Ser Thr Val Arg Val Val Leu Asn Ser Met Asp Val Asn
210 215 220
Ser Lys Val Ile Cys Glu Val Ala His Ile Thr Leu Asp Arg Ser Pro
225 230 235 240
Leu Arg Gly Ile Ala Asn Leu Ser Asn Phe Ile Arg Val Ser Pro Thr
245 250 255
Val Lys Val Thr Gln Gln Ser Pro Thr Ser Met Asn Gln Val Asn Leu
260 265 270
Thr Cys Arg Ala Glu Arg Phe Tyr Pro Glu Asp Leu Gln Leu Ile Trp
275 280 285
Leu Glu Asn Gly Asn Val Ser Arg Asn Asp Thr Pro Lys Asn Leu Thr
290 295 300
Lys Asn Thr Asp Gly Thr Tyr Asn Tyr Thr Ser Leu Phe Leu Val Asn
305 310 315 320
Ser Ser Ala His Arg Glu Asp Val Val Phe Thr Cys Gln Val Lys His
325 330 335
Asp Gln Gln Pro Ala Ile Thr Arg Asn His Thr Val Leu Gly Phe Ala
340 345 350
His Ser Ser Asp Gln Gly Ser Met Gln Thr Phe Pro Asp Asn Asn Ala
355 360 365
Thr His Asn Trp Asn Val Phe Ile Gly Val Gly Val Ala Cys Ala Leu
370 375 380
Leu Val Val Leu Leu Met Ala Ala Leu Tyr Leu Leu Arg Ile Lys Gln
385 390 395 400
Lys Lys Ala Lys Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu
405 410 415
Lys Asn Ala Arg Glu Ile Thr Gln Ile Gln Asp Thr Asn Asp Ile Asn
420 425 430
Asp Ile Thr Tyr Ala Asp Leu Asn Leu Pro Lys Glu Lys Lys Pro Ala
435 440 445
Pro Arg Ala Pro Glu Pro Asn Asn His Thr Glu Tyr Ala Ser Ile Glu
450 455 460
Thr Gly Lys Val Pro Arg Pro Glu Asp Thr Leu Thr Tyr Ala Asp Leu
465 470 475 480
Asp Met Val His Leu Ser Arg Ala Gln Pro Ala Pro Lys Pro Glu Pro
485 490 495
Ser Phe Ser Glu Tyr Ala Ser Val Gln Val Gln Arg Lys
500 505
<210> 61
<211> 513
<212> Белок
<213> Mus musculus
<400> 61
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Leu
1 5 10 15
Cys Leu Leu Leu Ser Ala Ser Cys Phe Cys Thr Gly Val Thr Gly Lys
20 25 30
Glu Leu Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Asp Ser Thr Val Leu Asn Cys Thr Leu Thr Ser Leu Leu Pro Val Gly
50 55 60
Pro Ile Lys Trp Tyr Arg Gly Val Gly Gln Ser Arg Leu Leu Ile Tyr
65 70 75 80
Ser Phe Thr Gly Glu His Phe Pro Arg Val Thr Asn Val Ser Asp Ala
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val Thr
100 105 110
Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Lys Gly Pro
115 120 125
Ser Glu Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val Tyr
130 135 140
Val Leu Ala Lys Pro Ser Pro Pro Glu Val Ser Gly Pro Ala Asp Arg
145 150 155 160
Gly Ile Pro Asp Gln Lys Val Asn Phe Thr Cys Lys Ser His Gly Phe
165 170 175
Ser Pro Arg Asn Ile Thr Leu Lys Trp Phe Lys Asp Gly Gln Glu Leu
180 185 190
His His Leu Glu Thr Thr Val Asn Pro Ser Gly Lys Asn Val Ser Tyr
195 200 205
Asn Ile Ser Ser Thr Val Arg Val Val Leu Asn Ser Met Asp Val His
210 215 220
Ser Lys Val Ile Cys Glu Val Ala His Ile Thr Leu Asp Arg Ser Pro
225 230 235 240
Leu Arg Gly Ile Ala Asn Leu Ser Asn Phe Ile Arg Val Ser Pro Thr
245 250 255
Val Lys Val Thr Gln Gln Ser Pro Thr Ser Met Asn Gln Val Asn Leu
260 265 270
Thr Cys Arg Ala Glu Arg Phe Tyr Pro Glu Asp Leu Gln Leu Ile Trp
275 280 285
Leu Glu Asn Gly Asn Val Ser Arg Asn Asp Thr Pro Lys Asn Leu Thr
290 295 300
Lys Asn Thr Asp Gly Thr Tyr Asn Tyr Thr Ser Leu Phe Leu Val Asn
305 310 315 320
Ser Ser Ala His Arg Glu Asp Val Val Phe Thr Cys Gln Val Lys His
325 330 335
Asp Gln Gln Pro Ala Ile Thr Arg Asn His Thr Val Leu Gly Leu Ala
340 345 350
His Ser Ser Asp Gln Gly Ser Met Gln Thr Phe Pro Gly Asn Asn Ala
355 360 365
Thr His Asn Trp Asn Val Phe Ile Gly Val Gly Val Ala Cys Ala Leu
370 375 380
Leu Val Val Leu Leu Met Ala Ala Leu Tyr Leu Leu Arg Ile Lys Gln
385 390 395 400
Lys Lys Ala Lys Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu
405 410 415
Lys Asn Ala Arg Glu Ile Thr Gln Val Gln Ser Leu Ile Gln Asp Thr
420 425 430
Asn Asp Ile Asn Asp Ile Thr Tyr Ala Asp Leu Asn Leu Pro Lys Glu
435 440 445
Lys Lys Pro Ala Pro Arg Ala Pro Glu Pro Asn Asn His Thr Glu Tyr
450 455 460
Ala Ser Ile Glu Thr Gly Lys Val Pro Arg Pro Glu Asp Thr Leu Thr
465 470 475 480
Tyr Ala Asp Leu Asp Met Val His Leu Ser Arg Ala Gln Pro Ala Pro
485 490 495
Lys Pro Glu Pro Ser Phe Ser Glu Tyr Ala Ser Val Gln Val Gln Arg
500 505 510
Lys
<210> 62
<211> 507
<212> Белок
<213> Mus musculus
<400> 62
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Leu
1 5 10 15
Cys Leu Leu Leu Ser Ala Ser Cys Phe Cys Thr Gly Ala Thr Arg Thr
20 25 30
Glu Val Lys Val Ile Gln Pro Glu Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Asp Ser Thr Val Leu Asn Cys Thr Leu Thr Ser Leu Leu Pro Val Gly
50 55 60
Pro Ile Arg Trp Tyr Arg Gly Val Gly Gln Ser Arg Gln Leu Ile Tyr
65 70 75 80
Ser Phe Thr Thr Glu His Phe Pro Arg Val Thr Asn Val Ser Asp Ala
85 90 95
Thr Lys Arg Ser Asn Leu Asp Phe Ser Ile Arg Ile Ser Asn Val Thr
100 105 110
Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Arg Gly Ser
115 120 125
Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val Tyr Val Leu
130 135 140
Ala Lys Pro Ser Pro Pro Glu Val Ser Gly Pro Ala Asp Arg Gly Ile
145 150 155 160
Pro Asp Gln Lys Val Asn Phe Thr Cys Lys Ser His Gly Phe Ser Pro
165 170 175
Arg Asn Ile Thr Leu Lys Trp Phe Lys Asp Gly Gln Glu Leu His Pro
180 185 190
Leu Glu Thr Thr Val Asn Pro Ser Gly Lys Asn Val Ser Tyr Asn Ile
195 200 205
Ser Ser Thr Val Arg Val Val Leu Asn Ser Met Asp Val His Ser Lys
210 215 220
Val Ile Cys Glu Val Ala His Ile Thr Leu Asp Arg Ser Pro Leu Arg
225 230 235 240
Gly Ile Ala Asn Leu Ser Asn Phe Ile Arg Val Ser Pro Thr Val Lys
245 250 255
Val Thr Gln Gln Ser Pro Thr Ser Met Ser Gln Val Asn Leu Thr Cys
260 265 270
Arg Ala Glu Arg Phe Tyr Pro Glu Asp Leu Gln Leu Ile Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Asn Asp Thr Pro Lys Asn Leu Thr Lys Asn
290 295 300
Thr Asp Gly Thr Tyr Asn Tyr Thr Ser Leu Phe Leu Val Asn Ser Ser
305 310 315 320
Ala His Arg Glu Asp Val Val Phe Thr Cys Gln Val Lys His Asp Gln
325 330 335
Gln Pro Ala Ile Thr Arg Asn His Thr Val Leu Gly Leu Ala His Ser
340 345 350
Ser Asp Gln Gly Ser Met Gln Thr Phe Pro Gly Asn Asn Ala Thr His
355 360 365
Asn Trp Asn Val Phe Ile Gly Val Gly Val Ala Cys Ala Leu Leu Val
370 375 380
Val Leu Leu Met Ala Ala Leu Tyr Leu Leu Arg Ile Lys Gln Lys Lys
385 390 395 400
Ala Lys Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn
405 410 415
Ala Arg Glu Ile Thr Gln Ile Gln Asp Thr Asn Asp Ile Asn Asp Ile
420 425 430
Thr Tyr Ala Asp Leu Asn Leu Pro Lys Glu Lys Lys Pro Ala Pro Arg
435 440 445
Ala Pro Glu Pro Asn Asn His Thr Glu Tyr Ala Ser Ile Glu Thr Gly
450 455 460
Lys Val Pro Arg Pro Glu Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met
465 470 475 480
Val His Leu Ser Arg Ala Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe
485 490 495
Ser Glu Tyr Ala Ser Val Gln Val Gln Arg Lys
500 505
<210> 63
<211> 503
<212> Белок
<213> Homo sapiens
<400> 63
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Glu Ser Ala Ile Leu Leu Cys Thr Val Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
85 90 95
Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala Thr
145 150 155 160
Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro
165 170 175
Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp
180 185 190
Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser Ile
195 200 205
His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser Gln
210 215 220
Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg
225 230 235 240
Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu Glu
245 250 255
Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr Cys
260 265 270
Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu Asn
290 295 300
Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val Ser
305 310 315 320
Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp Gly
325 330 335
Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His Pro
340 345 350
Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn Glu
355 360 365
Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val Ala
370 375 380
Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys Ala
385 390 395 400
Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn Ala
405 410 415
Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu Asn
420 425 430
Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn Asn
435 440 445
His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser Glu
450 455 460
Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg Thr
465 470 475 480
Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr Ala
485 490 495
Ser Val Gln Val Pro Arg Lys
500
<210> 64
<211> 504
<212> Белок
<213> Homo sapiens
<400> 64
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Gly Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Glu Ser Ala Ile Leu His Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
130 135 140
Arg Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala
145 150 155 160
Thr Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser
165 170 175
Pro Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser
180 185 190
Asp Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser
195 200 205
Ile His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser
210 215 220
Gln Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu
225 230 235 240
Arg Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu
245 250 255
Glu Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr
260 265 270
Cys Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu
275 280 285
Glu Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu
290 295 300
Asn Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val
305 310 315 320
Ser Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp
325 330 335
Gly Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His
340 345 350
Pro Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn
355 360 365
Glu Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val
370 375 380
Ala Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys
385 390 395 400
Ala Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn
405 410 415
Ala Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu
420 425 430
Asn Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn
435 440 445
Asn His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser
450 455 460
Glu Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg
465 470 475 480
Thr Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr
485 490 495
Ala Ser Val Gln Val Pro Arg Lys
500
<210> 65
<211> 504
<212> Белок
<213> Homo sapiens
<400> 65
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Phe Val Leu Val Ala Ala Gly
35 40 45
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
130 135 140
Arg Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala
145 150 155 160
Thr Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser
165 170 175
Pro Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser
180 185 190
Asp Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser
195 200 205
Ile His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser
210 215 220
Gln Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu
225 230 235 240
Arg Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu
245 250 255
Glu Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr
260 265 270
Cys Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu
275 280 285
Glu Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu
290 295 300
Asn Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val
305 310 315 320
Ser Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp
325 330 335
Gly Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His
340 345 350
Pro Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn
355 360 365
Glu Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val
370 375 380
Ala Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys
385 390 395 400
Ala Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn
405 410 415
Ala Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu
420 425 430
Asn Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn
435 440 445
Asn His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser
450 455 460
Glu Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg
465 470 475 480
Thr Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr
485 490 495
Ala Ser Val Gln Val Pro Arg Lys
500
<210> 66
<211> 504
<212> Белок
<213> Homo sapiens
<400> 66
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
35 40 45
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Pro Ile Arg Ile Gly Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
130 135 140
Arg Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala
145 150 155 160
Thr Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser
165 170 175
Pro Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser
180 185 190
Asp Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser
195 200 205
Ile His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser
210 215 220
Gln Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu
225 230 235 240
Arg Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu
245 250 255
Glu Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr
260 265 270
Cys Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu
275 280 285
Glu Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu
290 295 300
Asn Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val
305 310 315 320
Ser Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp
325 330 335
Gly Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His
340 345 350
Pro Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn
355 360 365
Glu Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val
370 375 380
Ala Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys
385 390 395 400
Ala Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn
405 410 415
Ala Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu
420 425 430
Asn Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn
435 440 445
Asn His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser
450 455 460
Glu Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg
465 470 475 480
Thr Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr
485 490 495
Ala Ser Val Gln Val Pro Arg Lys
500
<210> 67
<211> 503
<212> Белок
<213> Homo sapiens
<400> 67
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
85 90 95
Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Gly Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala Thr
145 150 155 160
Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro
165 170 175
Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp
180 185 190
Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser Ile
195 200 205
His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser Gln
210 215 220
Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg
225 230 235 240
Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu Glu
245 250 255
Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr Cys
260 265 270
Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu Asn
290 295 300
Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val Ser
305 310 315 320
Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp Gly
325 330 335
Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His Pro
340 345 350
Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn Glu
355 360 365
Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val Ala
370 375 380
Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys Ala
385 390 395 400
Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn Ala
405 410 415
Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu Asn
420 425 430
Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn Asn
435 440 445
His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser Glu
450 455 460
Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg Thr
465 470 475 480
Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr Ala
485 490 495
Ser Val Gln Val Pro Arg Lys
500
<210> 68
<211> 503
<212> Белок
<213> Homo sapiens
<400> 68
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
35 40 45
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
85 90 95
Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala Thr
145 150 155 160
Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro
165 170 175
Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp
180 185 190
Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser Ile
195 200 205
His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser Gln
210 215 220
Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg
225 230 235 240
Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu Glu
245 250 255
Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr Cys
260 265 270
Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu Asn
290 295 300
Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val Ser
305 310 315 320
Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp Gly
325 330 335
Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His Pro
340 345 350
Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn Glu
355 360 365
Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val Ala
370 375 380
Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys Ala
385 390 395 400
Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn Ala
405 410 415
Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu Asn
420 425 430
Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn Asn
435 440 445
His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser Glu
450 455 460
Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg Thr
465 470 475 480
Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr Ala
485 490 495
Ser Val Gln Val Pro Arg Lys
500
<210> 69
<211> 504
<212> Белок
<213> Homo sapiens
<400> 69
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
35 40 45
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
130 135 140
Arg Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala
145 150 155 160
Thr Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser
165 170 175
Pro Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser
180 185 190
Asp Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser
195 200 205
Ile His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser
210 215 220
Gln Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu
225 230 235 240
Arg Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu
245 250 255
Glu Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr
260 265 270
Cys Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu
275 280 285
Glu Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu
290 295 300
Asn Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val
305 310 315 320
Ser Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp
325 330 335
Gly Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His
340 345 350
Pro Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn
355 360 365
Glu Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val
370 375 380
Ala Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys
385 390 395 400
Ala Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn
405 410 415
Ala Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu
420 425 430
Asn Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn
435 440 445
Asn His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser
450 455 460
Glu Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg
465 470 475 480
Thr Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr
485 490 495
Ala Ser Val Gln Val Pro Arg Lys
500
<210> 70
<211> 503
<212> Белок
<213> Homo sapiens
<400> 70
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Arg Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
85 90 95
Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala Thr
145 150 155 160
Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro
165 170 175
Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp
180 185 190
Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser Ile
195 200 205
His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser Gln
210 215 220
Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg
225 230 235 240
Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu Glu
245 250 255
Val Thr Gln Gln Pro Val Arg Ala Glu Asn Gln Val Asn Val Thr Cys
260 265 270
Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu Gln Leu Thr Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Thr Glu Thr Ala Ser Thr Val Thr Glu Asn
290 295 300
Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp Leu Leu Val Asn Val Ser
305 310 315 320
Ala His Arg Asp Asp Val Lys Leu Thr Cys Gln Val Glu His Asp Gly
325 330 335
Gln Pro Ala Val Ser Lys Ser His Asp Leu Lys Val Ser Ala His Pro
340 345 350
Lys Glu Gln Gly Ser Asn Thr Ala Ala Glu Asn Thr Gly Ser Asn Glu
355 360 365
Arg Asn Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val Ala
370 375 380
Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys Ala
385 390 395 400
Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn Ala
405 410 415
Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu Asn
420 425 430
Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn Asn
435 440 445
His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser Glu
450 455 460
Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg Thr
465 470 475 480
Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr Ala
485 490 495
Ser Val Gln Val Pro Arg Lys
500
<210> 71
<211> 296
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность формы SIRPα человека_V2_IgV
<400> 71
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
85 90 95
Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala Thr
145 150 155 160
Pro Gln His Ile Tyr Ile Val Val Gly Val Val Cys Thr Leu Leu Val
165 170 175
Ala Leu Leu Met Ala Ala Leu Tyr Leu Val Arg Ile Arg Gln Lys Lys
180 185 190
Ala Gln Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn
195 200 205
Ala Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile Thr Tyr Ala Asp Leu
210 215 220
Asn Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln Ala Ala Glu Pro Asn
225 230 235 240
Asn His Thr Glu Tyr Ala Ser Ile Gln Thr Ser Pro Gln Pro Ala Ser
245 250 255
Glu Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met Val His Leu Asn Arg
260 265 270
Thr Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe Ser Glu Tyr
275 280 285
Ala Ser Val Gln Val Pro Arg Lys
290 295
<210> 72
<211> 397
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность формы SIRPα человека
V2_IgV_IgC1
<400> 72
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Cys
1 5 10 15
Leu Leu Leu Ala Ala Ser Cys Ala Trp Ser Gly Val Ala Gly Glu Glu
20 25 30
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro Val Gly
50 55 60
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
85 90 95
Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn Ile Thr
100 105 110
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
115 120 125
Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg
130 135 140
Ala Lys Pro Ser Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala Thr
145 150 155 160
Pro Gln His Thr Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro
165 170 175
Arg Asp Ile Thr Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp
180 185 190
Phe Gln Thr Asn Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser Ile
195 200 205
His Ser Thr Ala Lys Val Val Leu Thr Arg Glu Asp Val His Ser Gln
210 215 220
Val Ile Cys Glu Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg
225 230 235 240
Gly Thr Ala Asn Leu Ser Glu Thr Ile Arg Val Pro Pro Thr Leu Glu
245 250 255
Val Thr Gln Gln Pro Val Arg Ala Ile Tyr Ile Val Val Gly Val Val
260 265 270
Cys Thr Leu Leu Val Ala Leu Leu Met Ala Ala Leu Tyr Leu Val Arg
275 280 285
Ile Arg Gln Lys Lys Ala Gln Gly Ser Thr Ser Ser Thr Arg Leu His
290 295 300
Glu Pro Glu Lys Asn Ala Arg Glu Ile Thr Gln Asp Thr Asn Asp Ile
305 310 315 320
Thr Tyr Ala Asp Leu Asn Leu Pro Lys Gly Lys Lys Pro Ala Pro Gln
325 330 335
Ala Ala Glu Pro Asn Asn His Thr Glu Tyr Ala Ser Ile Gln Thr Ser
340 345 350
Pro Gln Pro Ala Ser Glu Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met
355 360 365
Val His Leu Asn Arg Thr Pro Lys Gln Pro Ala Pro Lys Pro Glu Pro
370 375 380
Ser Phe Ser Glu Tyr Ala Ser Val Gln Val Pro Arg Lys
385 390 395
<210> 73
<211> 507
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность мутантного hmSIRPA_delta 0
с SIRPα мыши
<400> 73
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Leu
1 5 10 15
Cys Leu Leu Leu Ser Ala Ser Cys Phe Cys Thr Gly Ala Thr Gly Thr
20 25 30
Glu Val Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Asp Ser Thr Ile Leu Asn Cys Thr Val Thr Ser Leu Leu Pro Val Gly
50 55 60
Pro Ile Arg Trp Tyr Arg Gly Val Gly Gln Ser Arg Leu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Gly His Phe Pro Arg Val Arg Asn Val Ser Asp Thr
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val Thr
100 105 110
Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Lys Gly Ser
115 120 125
Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val Tyr Val Leu
130 135 140
Ala Lys Pro Ser Pro Pro Glu Val Ser Gly Pro Ala Asp Arg Gly Ile
145 150 155 160
Pro Asp Gln Lys Val Asn Phe Thr Cys Lys Ser His Gly Phe Ser Pro
165 170 175
Arg Asn Ile Thr Leu Lys Trp Phe Lys Asp Gly Gln Glu Leu His Pro
180 185 190
Leu Glu Thr Thr Val Asn Pro Ser Gly Lys Asn Val Ser Tyr Asn Ile
195 200 205
Ser Ser Thr Val Arg Val Val Leu Asn Ser Met Asp Val Asn Ser Lys
210 215 220
Val Ile Cys Glu Val Ala His Ile Thr Leu Asp Arg Ser Pro Leu Arg
225 230 235 240
Gly Ile Ala Asn Leu Ser Asn Phe Ile Arg Val Ser Pro Thr Val Lys
245 250 255
Val Thr Gln Gln Ser Pro Thr Ser Met Asn Gln Val Asn Leu Thr Cys
260 265 270
Arg Ala Glu Arg Phe Tyr Pro Glu Asp Leu Gln Leu Ile Trp Leu Glu
275 280 285
Asn Gly Asn Val Ser Arg Asn Asp Thr Pro Lys Asn Leu Thr Lys Asn
290 295 300
Thr Asp Gly Thr Tyr Asn Tyr Thr Ser Leu Phe Leu Val Asn Ser Ser
305 310 315 320
Ala His Arg Glu Asp Val Val Phe Thr Cys Gln Val Lys His Asp Gln
325 330 335
Gln Pro Ala Ile Thr Arg Asn His Thr Val Leu Gly Phe Ala His Ser
340 345 350
Ser Asp Gln Gly Ser Met Gln Thr Phe Pro Asp Asn Asn Ala Thr His
355 360 365
Asn Trp Asn Val Phe Ile Gly Val Gly Val Ala Cys Ala Leu Leu Val
370 375 380
Val Leu Leu Met Ala Ala Leu Tyr Leu Leu Arg Ile Lys Gln Lys Lys
385 390 395 400
Ala Lys Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu Lys Asn
405 410 415
Ala Arg Glu Ile Thr Gln Ile Gln Asp Thr Asn Asp Ile Asn Asp Ile
420 425 430
Thr Tyr Ala Asp Leu Asn Leu Pro Lys Glu Lys Lys Pro Ala Pro Arg
435 440 445
Ala Pro Glu Pro Asn Asn His Thr Glu Tyr Ala Ser Ile Glu Thr Gly
450 455 460
Lys Val Pro Arg Pro Glu Asp Thr Leu Thr Tyr Ala Asp Leu Asp Met
465 470 475 480
Val His Leu Ser Arg Ala Gln Pro Ala Pro Lys Pro Glu Pro Ser Phe
485 490 495
Ser Glu Tyr Ala Ser Val Gln Val Gln Arg Lys
500 505
<210> 74
<211> 509
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность мутантного hmSIRPA_delta 1
с SIRPα мыши
<400> 74
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Leu
1 5 10 15
Cys Leu Leu Leu Ser Ala Ser Cys Phe Cys Thr Gly Ala Thr Gly Thr
20 25 30
Glu Val Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Asp Ser Thr Ile Leu Asn Cys Thr Val Thr Ser Leu Leu Pro Val Gly
50 55 60
Pro Ile Arg Trp Tyr Arg Gly Val Gly Gln Ser Arg Leu Leu Ile Tyr
65 70 75 80
Asn Gln Lys Glu Glu His Phe Pro Arg Val Arg Asn Val Ser Asp Thr
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val Thr
100 105 110
Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Arg Gly Ser
115 120 125
Ser Glu Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val Tyr
130 135 140
Val Leu Ala Lys Pro Ser Pro Pro Glu Val Ser Gly Pro Ala Asp Arg
145 150 155 160
Gly Ile Pro Asp Gln Lys Val Asn Phe Thr Cys Lys Ser His Gly Phe
165 170 175
Ser Pro Arg Asn Ile Thr Leu Lys Trp Phe Lys Asp Gly Gln Glu Leu
180 185 190
His Pro Leu Glu Thr Thr Val Asn Pro Ser Gly Lys Asn Val Ser Tyr
195 200 205
Asn Ile Ser Ser Thr Val Arg Val Val Leu Asn Ser Met Asp Val Asn
210 215 220
Ser Lys Val Ile Cys Glu Val Ala His Ile Thr Leu Asp Arg Ser Pro
225 230 235 240
Leu Arg Gly Ile Ala Asn Leu Ser Asn Phe Ile Arg Val Ser Pro Thr
245 250 255
Val Lys Val Thr Gln Gln Ser Pro Thr Ser Met Asn Gln Val Asn Leu
260 265 270
Thr Cys Arg Ala Glu Arg Phe Tyr Pro Glu Asp Leu Gln Leu Ile Trp
275 280 285
Leu Glu Asn Gly Asn Val Ser Arg Asn Asp Thr Pro Lys Asn Leu Thr
290 295 300
Lys Asn Thr Asp Gly Thr Tyr Asn Tyr Thr Ser Leu Phe Leu Val Asn
305 310 315 320
Ser Ser Ala His Arg Glu Asp Val Val Phe Thr Cys Gln Val Lys His
325 330 335
Asp Gln Gln Pro Ala Ile Thr Arg Asn His Thr Val Leu Gly Phe Ala
340 345 350
His Ser Ser Asp Gln Gly Ser Met Gln Thr Phe Pro Asp Asn Asn Ala
355 360 365
Thr His Asn Trp Asn Val Phe Ile Gly Val Gly Val Ala Cys Ala Leu
370 375 380
Leu Val Val Leu Leu Met Ala Ala Leu Tyr Leu Leu Arg Ile Lys Gln
385 390 395 400
Lys Lys Ala Lys Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu
405 410 415
Lys Asn Ala Arg Glu Ile Thr Gln Ile Gln Asp Thr Asn Asp Ile Asn
420 425 430
Asp Ile Thr Tyr Ala Asp Leu Asn Leu Pro Lys Glu Lys Lys Pro Ala
435 440 445
Pro Arg Ala Pro Glu Pro Asn Asn His Thr Glu Tyr Ala Ser Ile Glu
450 455 460
Thr Gly Lys Val Pro Arg Pro Glu Asp Thr Leu Thr Tyr Ala Asp Leu
465 470 475 480
Asp Met Val His Leu Ser Arg Ala Gln Pro Ala Pro Lys Pro Glu Pro
485 490 495
Ser Phe Ser Glu Tyr Ala Ser Val Gln Val Gln Arg Lys
500 505
<210> 75
<211> 509
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность мутантного hmSIRPA_delta 2
с SIRPα мыши
<400> 75
Met Glu Pro Ala Gly Pro Ala Pro Gly Arg Leu Gly Pro Leu Leu Leu
1 5 10 15
Cys Leu Leu Leu Ser Ala Ser Cys Phe Cys Thr Gly Ala Thr Gly Thr
20 25 30
Glu Val Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala Gly
35 40 45
Asp Ser Thr Ile Leu Asn Cys Thr Val Thr Ser Leu Leu Pro Val Gly
50 55 60
Pro Ile Arg Trp Tyr Arg Gly Val Gly Gln Ser Arg Leu Leu Ile Tyr
65 70 75 80
Ser Phe Thr Glu Gly His Phe Pro Arg Val Arg Asn Val Ser Asp Thr
85 90 95
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val Thr
100 105 110
Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Arg Gly Ser
115 120 125
Ser Glu Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val Tyr
130 135 140
Val Leu Ala Lys Pro Ser Pro Pro Glu Val Ser Gly Pro Ala Asp Arg
145 150 155 160
Gly Ile Pro Asp Gln Lys Val Asn Phe Thr Cys Lys Ser His Gly Phe
165 170 175
Ser Pro Arg Asn Ile Thr Leu Lys Trp Phe Lys Asp Gly Gln Glu Leu
180 185 190
His Pro Leu Glu Thr Thr Val Asn Pro Ser Gly Lys Asn Val Ser Tyr
195 200 205
Asn Ile Ser Ser Thr Val Arg Val Val Leu Asn Ser Met Asp Val Asn
210 215 220
Ser Lys Val Ile Cys Glu Val Ala His Ile Thr Leu Asp Arg Ser Pro
225 230 235 240
Leu Arg Gly Ile Ala Asn Leu Ser Asn Phe Ile Arg Val Ser Pro Thr
245 250 255
Val Lys Val Thr Gln Gln Ser Pro Thr Ser Met Asn Gln Val Asn Leu
260 265 270
Thr Cys Arg Ala Glu Arg Phe Tyr Pro Glu Asp Leu Gln Leu Ile Trp
275 280 285
Leu Glu Asn Gly Asn Val Ser Arg Asn Asp Thr Pro Lys Asn Leu Thr
290 295 300
Lys Asn Thr Asp Gly Thr Tyr Asn Tyr Thr Ser Leu Phe Leu Val Asn
305 310 315 320
Ser Ser Ala His Arg Glu Asp Val Val Phe Thr Cys Gln Val Lys His
325 330 335
Asp Gln Gln Pro Ala Ile Thr Arg Asn His Thr Val Leu Gly Phe Ala
340 345 350
His Ser Ser Asp Gln Gly Ser Met Gln Thr Phe Pro Asp Asn Asn Ala
355 360 365
Thr His Asn Trp Asn Val Phe Ile Gly Val Gly Val Ala Cys Ala Leu
370 375 380
Leu Val Val Leu Leu Met Ala Ala Leu Tyr Leu Leu Arg Ile Lys Gln
385 390 395 400
Lys Lys Ala Lys Gly Ser Thr Ser Ser Thr Arg Leu His Glu Pro Glu
405 410 415
Lys Asn Ala Arg Glu Ile Thr Gln Ile Gln Asp Thr Asn Asp Ile Asn
420 425 430
Asp Ile Thr Tyr Ala Asp Leu Asn Leu Pro Lys Glu Lys Lys Pro Ala
435 440 445
Pro Arg Ala Pro Glu Pro Asn Asn His Thr Glu Tyr Ala Ser Ile Glu
450 455 460
Thr Gly Lys Val Pro Arg Pro Glu Asp Thr Leu Thr Tyr Ala Asp Leu
465 470 475 480
Asp Met Val His Leu Ser Arg Ala Gln Pro Ala Pro Lys Pro Glu Pro
485 490 495
Ser Phe Ser Glu Tyr Ala Ser Val Gln Val Gln Arg Lys
500 505
<210> 76
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность аминокислот 81-85 в
аминокислотной последовательности мутантного hmSIRPA_delta 0
с SIRPα мыши
<400> 76
Asn Gln Lys Glu Gly
1 5
<210> 77
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность аминокислот 81-85 в
аминокислотной последовательности мутантного hmSIRPA_delta 1
с SIRPα мыши
<400> 77
Asn Gln Lys Glu Glu
1 5
<210> 78
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность аминокислот 81-85 в
аминокислотной последовательности SIRPα мыши BALB/C
<400> 78
Ser Phe Thr Gly Glu
1 5
<210> 79
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность аминокислот 126-130
в аминокислотной последовательности SIRPα мыши BALB/C
<400> 79
Arg Gly Ser Ser Glu
1 5
<210> 80
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность аминокислот 81-85
в аминокислотной последовательности мутантного hmSIRPA_delta 2
с SIRPα мыши
<400> 80
Ser Phe Thr Glu Gly
1 5
<210> 81
<211> 466
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность тяжелой цепи антитела
OSE-172 (OSE-172_hG4Pro)
<400> 81
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe
35 40 45
Thr Ser Tyr Trp Val His Trp Val Arg Gln Met Pro Gly Lys Gly Leu
50 55 60
Glu Trp Met Gly Asn Ile Asp Pro Ser Asp Ser Asp Thr His Tyr Ser
65 70 75 80
Pro Ser Phe Gln Gly His Val Thr Leu Ser Val Asp Lys Ser Ile Ser
85 90 95
Thr Ala Tyr Leu Gln Leu Ser Ser Leu Lys Ala Ser Asp Thr Ala Met
100 105 110
Tyr Tyr Cys Val Arg Gly Gly Thr Gly Thr Leu Ala Tyr Phe Ala Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
130 135 140
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
145 150 155 160
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
165 170 175
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
180 185 190
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
195 200 205
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
210 215 220
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
225 230 235 240
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
245 250 255
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
260 265 270
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
275 280 285
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
290 295 300
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
305 310 315 320
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
325 330 335
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
340 345 350
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
355 360 365
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
370 375 380
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
385 390 395 400
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
420 425 430
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
435 440 445
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
450 455 460
Gly Lys
465
<210> 82
<211> 239
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность легкой цепи антитела
OSE-172 (OSE-172_hK)
<400> 82
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro
20 25 30
Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser
35 40 45
Leu Val His Ser Tyr Gly Asn Thr Tyr Leu Tyr Trp Phe Gln Gln Arg
50 55 60
Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Phe Gln Gly Thr His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys
115 120 125
Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
130 135 140
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
145 150 155 160
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
165 170 175
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
180 185 190
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
195 200 205
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
210 215 220
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 83
<211> 459
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность тяжелой цепи антитела KWAR23
(KWAR23_hG4Pro)
<400> 83
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile
35 40 45
Lys Asp Tyr Tyr Ile His Trp Val Gln Gln Arg Thr Glu Gln Gly Leu
50 55 60
Glu Trp Ile Gly Arg Ile Asp Pro Glu Asp Gly Glu Thr Lys Tyr Ala
65 70 75 80
Pro Lys Phe Gln Asp Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn
85 90 95
Thr Ala Tyr Leu His Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Trp Gly Ala Tyr Trp Gly Gln Gly Thr Leu Val
115 120 125
Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
130 135 140
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
145 150 155 160
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
165 170 175
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
180 185 190
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
195 200 205
Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
210 215 220
Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
225 230 235 240
Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
245 250 255
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
260 265 270
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
275 280 285
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
290 295 300
Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
305 310 315 320
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
325 330 335
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
340 345 350
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
355 360 365
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
370 375 380
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
385 390 395 400
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
405 410 415
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
420 425 430
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
435 440 445
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
450 455
<210> 84
<211> 235
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность легкой цепи антитела
KWAR23 (KWAR23_hK)
<400> 84
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser
20 25 30
Ala Ser Pro Gly Glu Lys Val Thr Leu Thr Cys Ser Ala Ser Ser Ser
35 40 45
Val Ser Ser Ser Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser
50 55 60
Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile
85 90 95
Ser Ser Met Glu Ala Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp
100 105 110
Ser Ser Tyr Pro Arg Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
115 120 125
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
130 135 140
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
145 150 155 160
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
165 170 175
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
180 185 190
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
195 200 205
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
210 215 220
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 85
<211> 467
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность тяжелой цепи антитела ADU-1805
(ADU-1805_hG2)
<400> 85
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Ser Thr Phe
35 40 45
Thr Ser Tyr Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Ala Ile Tyr Pro Val Asn Ser Asp Thr Thr Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ala Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser Phe Tyr Tyr Ser Leu Asp Ala Ala Trp Phe
115 120 125
Val Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser
145 150 155 160
Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys
210 215 220
Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu
225 230 235 240
Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 86
<211> 234
<212> Белок
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность легкой цепи антитела ADU-1805
(ADU-1805_hK)
<400> 86
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp
35 40 45
Ile Gly Ser Arg Leu Asn Trp Leu Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Arg Leu Ile Tyr Ala Thr Ser Ser Leu Asp Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Ala
100 105 110
Ser Ser Pro Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СВЯЗЫВАЮЩИЙ RGMa БЕЛОК И ЕГО ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2809500C2 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800923C2 |
| АНТИ-SIRPα АНТИТЕЛА | 2018 |
|
RU2771174C2 |
| ВАРИАНТЫ СЛИТОГО БЕЛКА SIRP-альфа-4-1BBL И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2815515C2 |
| ВАРИАНТЫ ИНТЕРЛЕЙКИНА-18 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2797536C2 |
| АНТИ-PD-L1 АНТИТЕЛО ДЛЯ ДЕТЕКЦИИ PD-L1 | 2018 |
|
RU2758723C2 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811120C2 |
| АНТИТЕЛО ПРОТИВ LAG-3 | 2017 |
|
RU2744866C2 |
| Терапевтические антитела к CD47 | 2016 |
|
RU2748401C2 |
| НЕВИРУСНЫЙ ИММУНОТАРГЕТИНГ | 2020 |
|
RU2833379C2 |
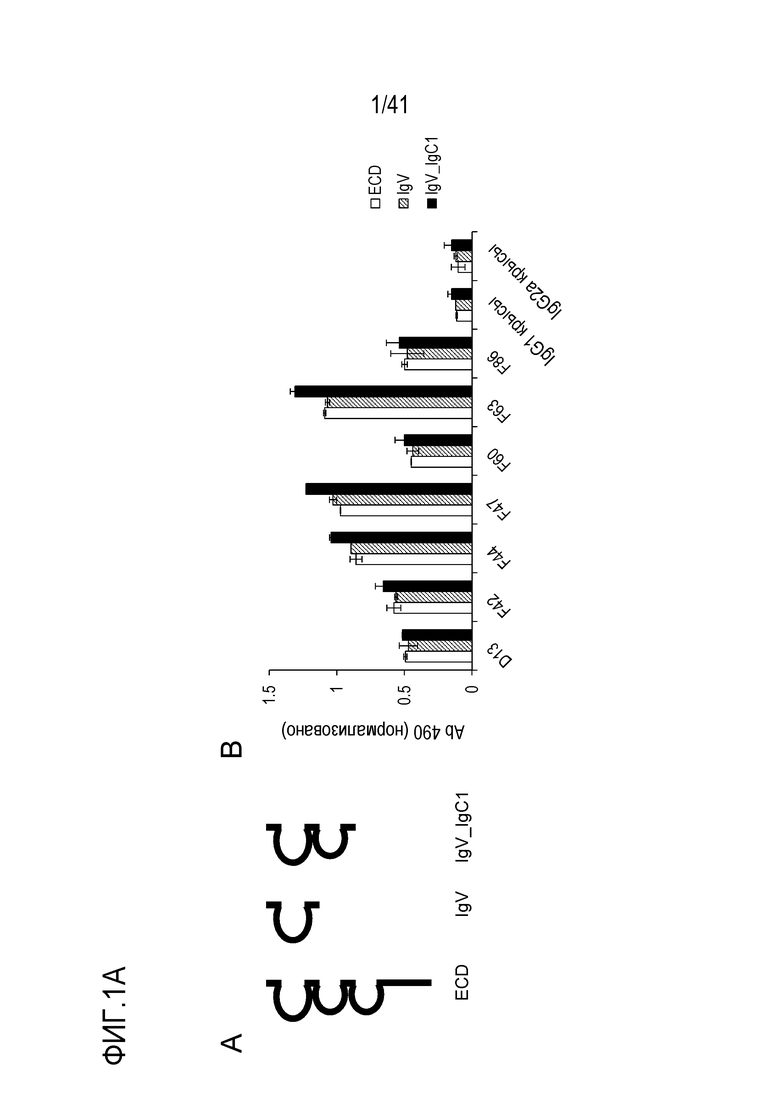
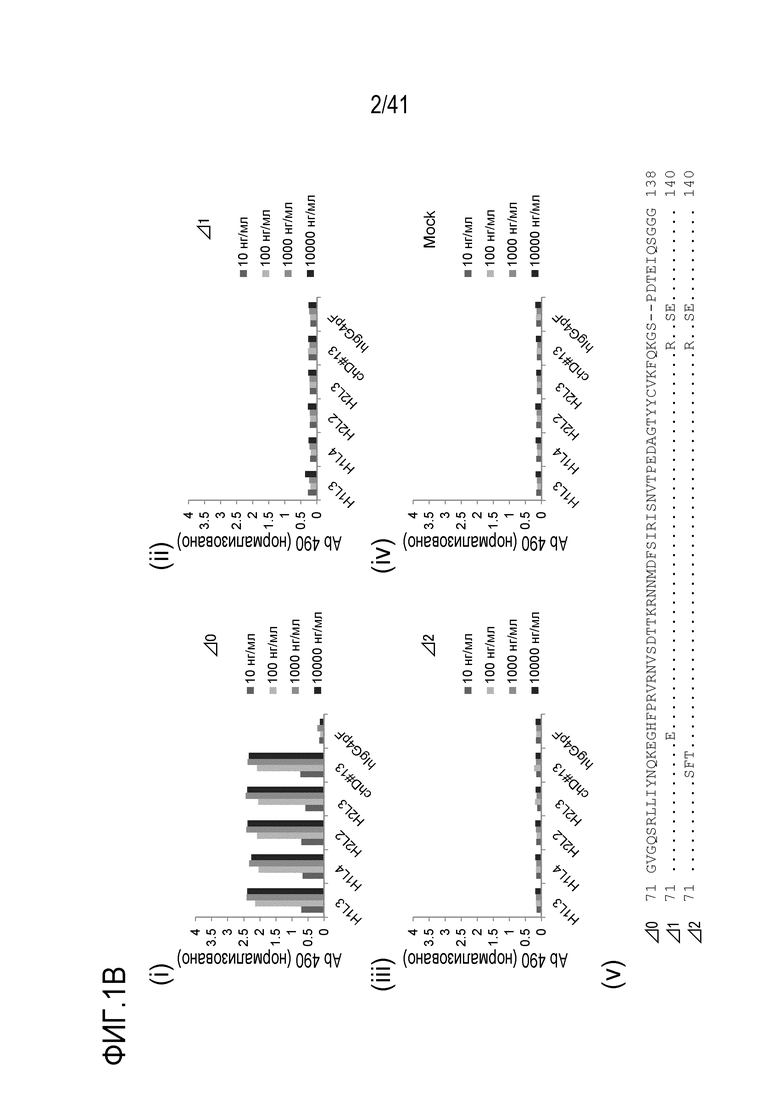
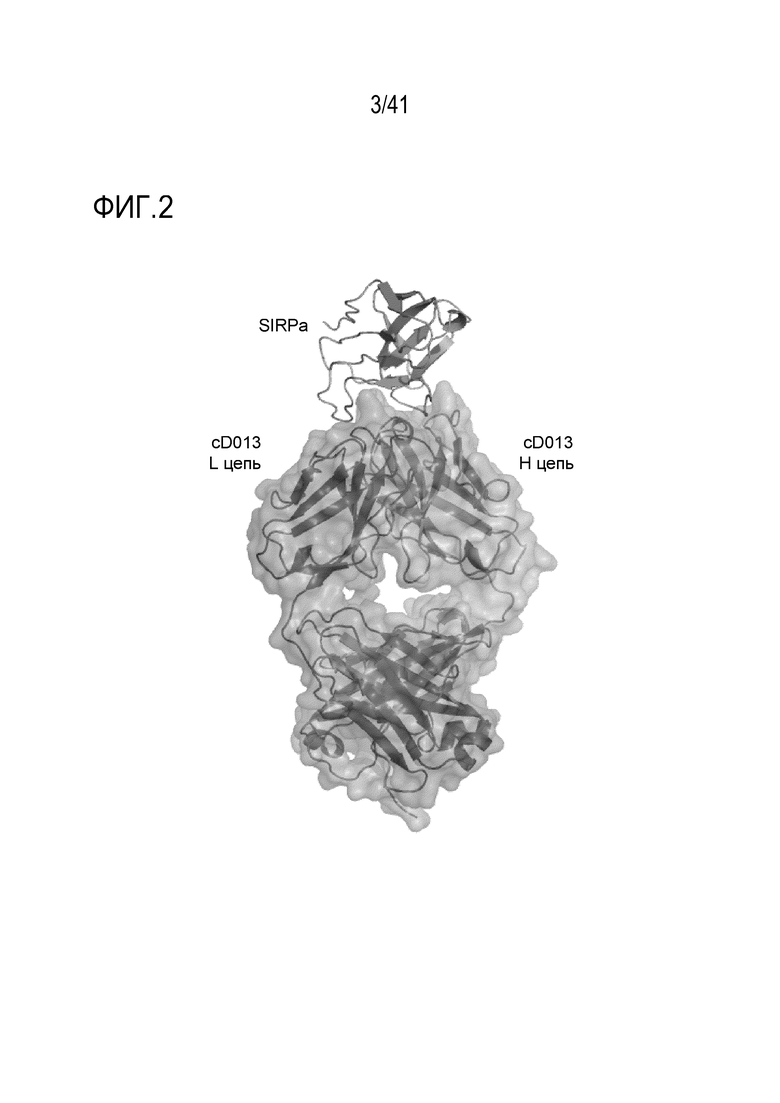
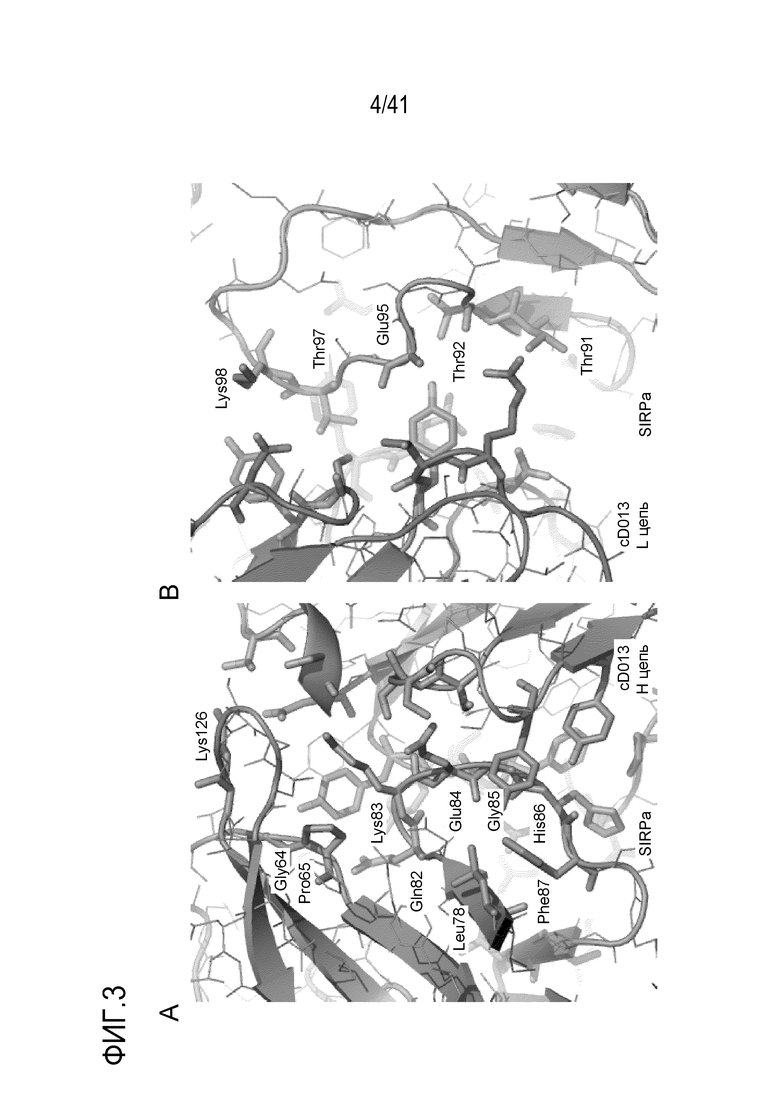

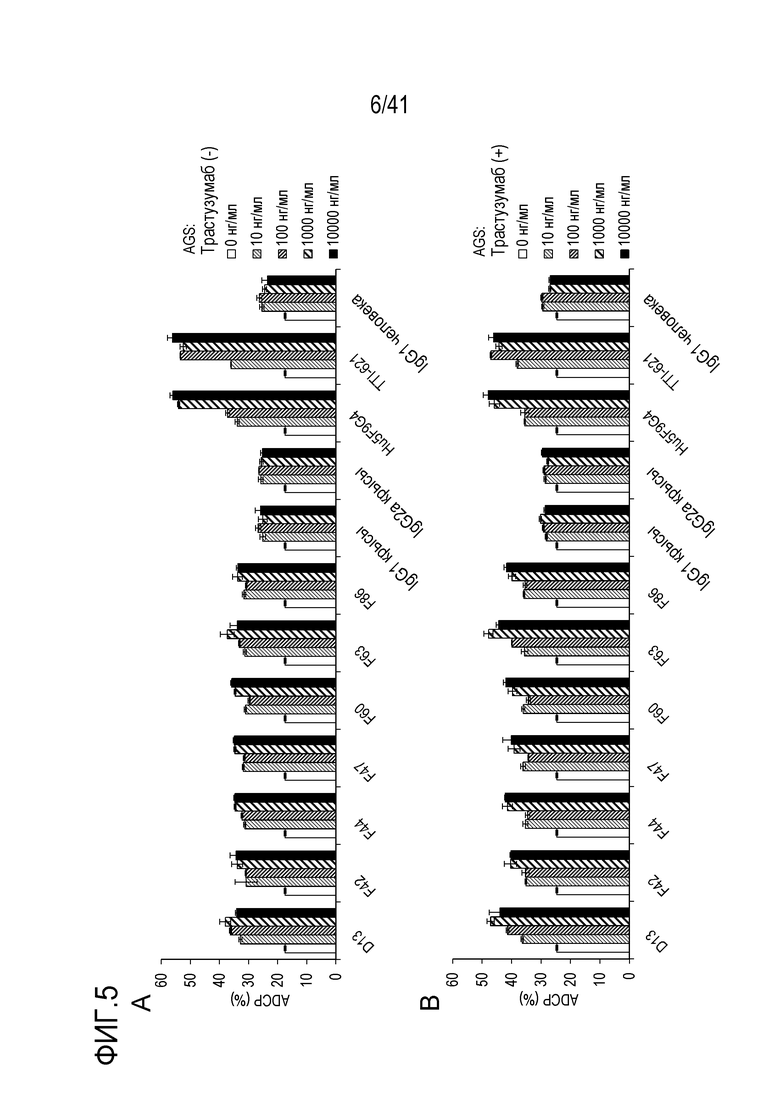
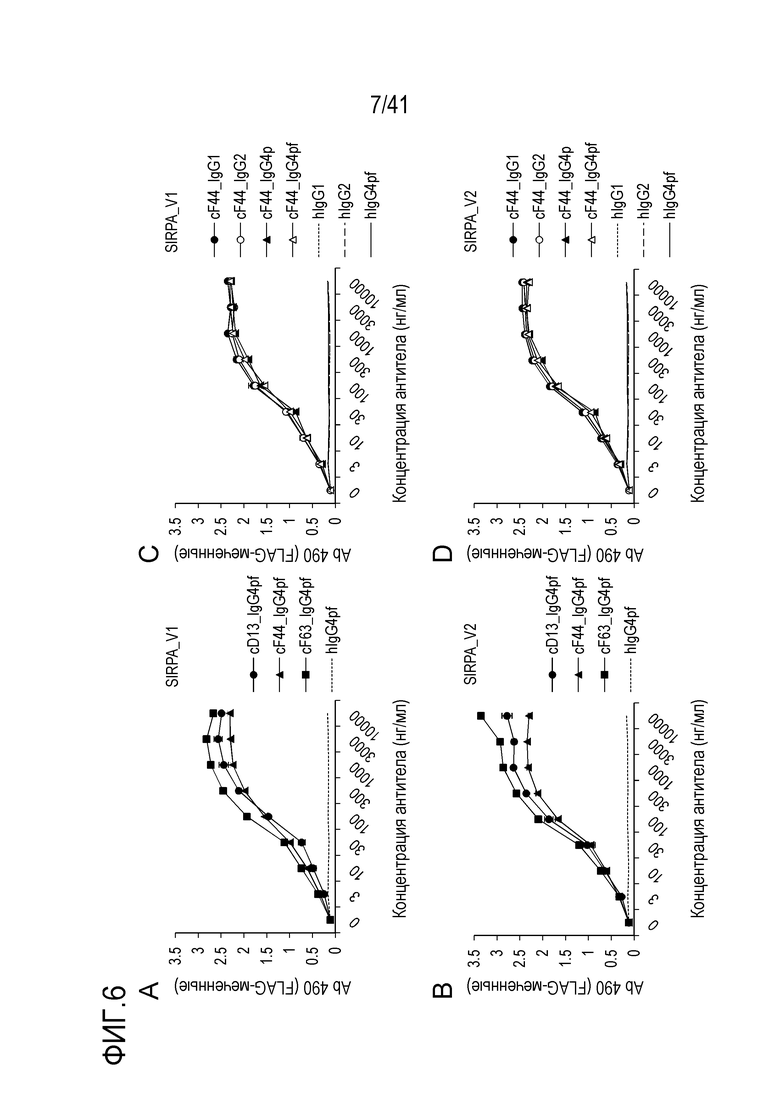
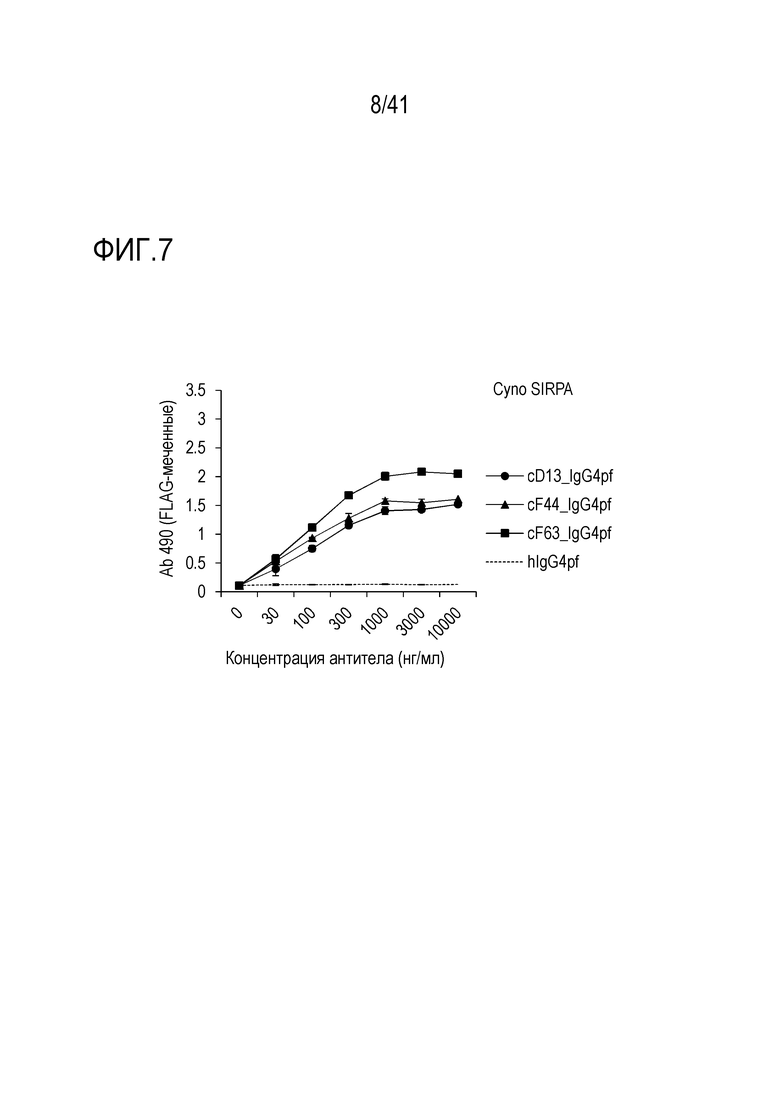
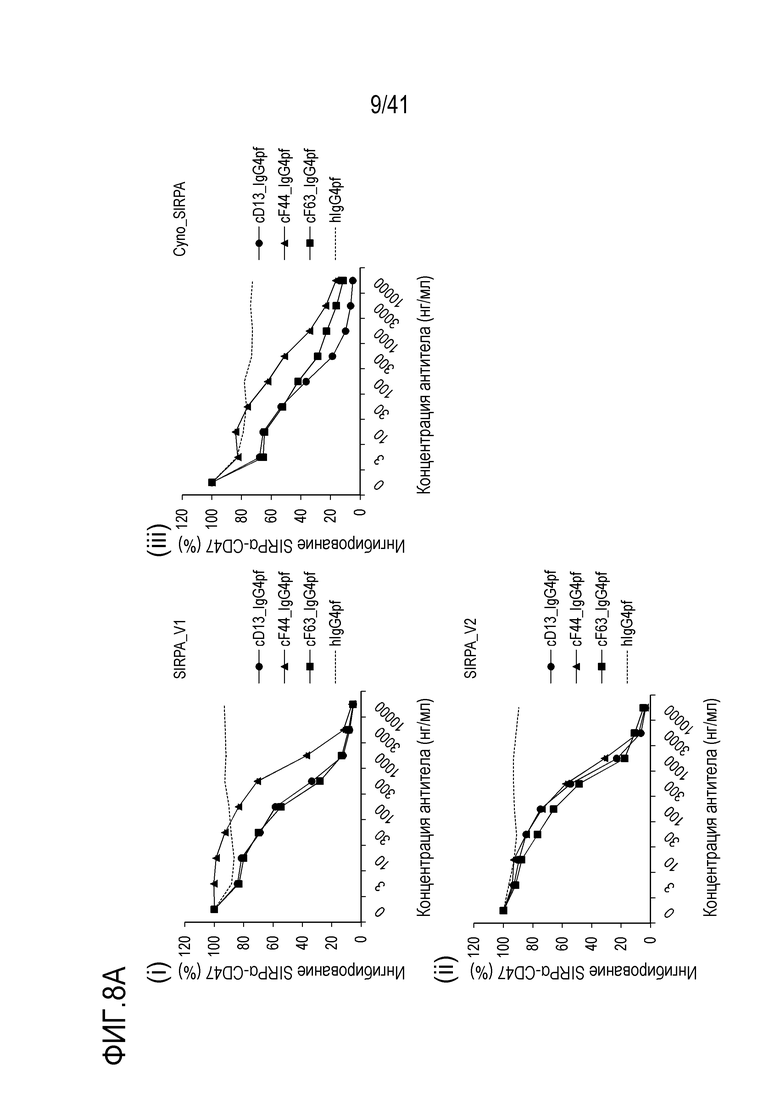
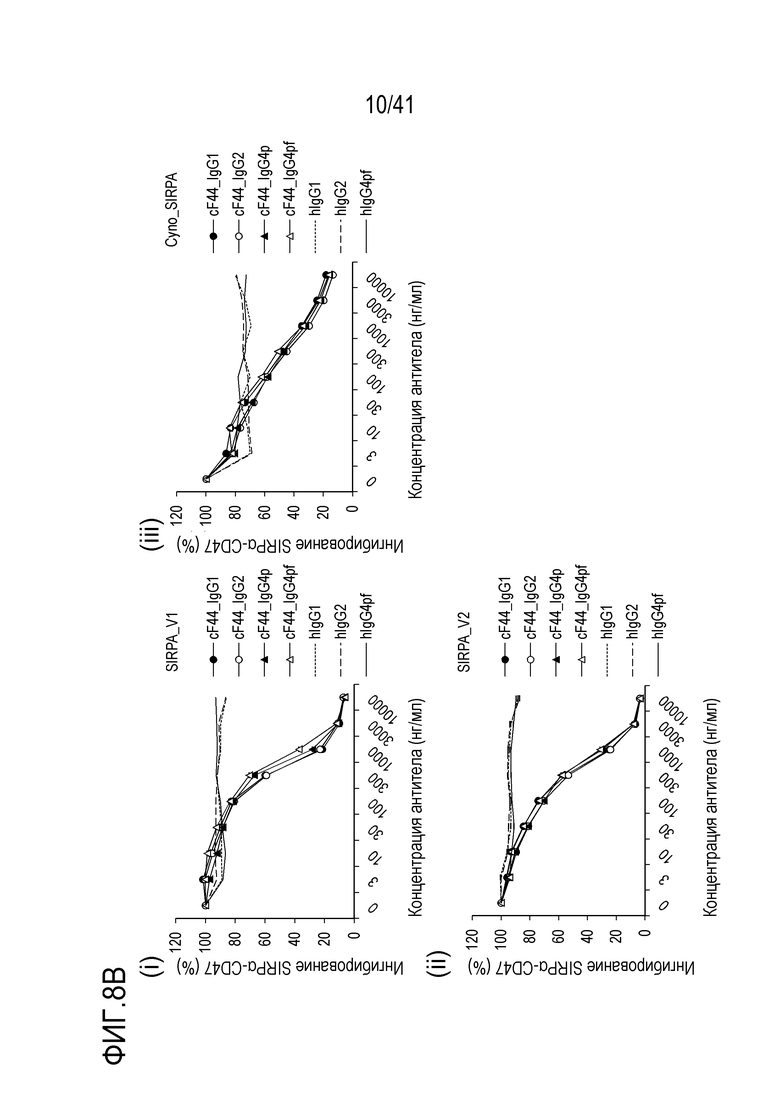
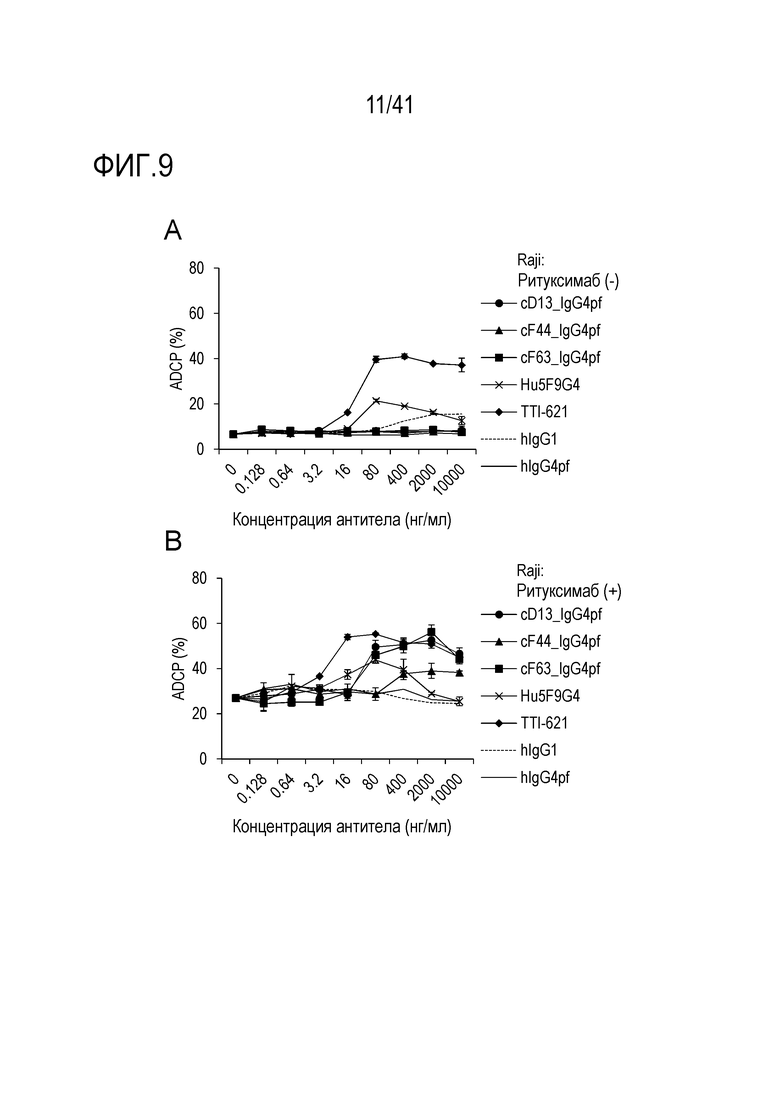
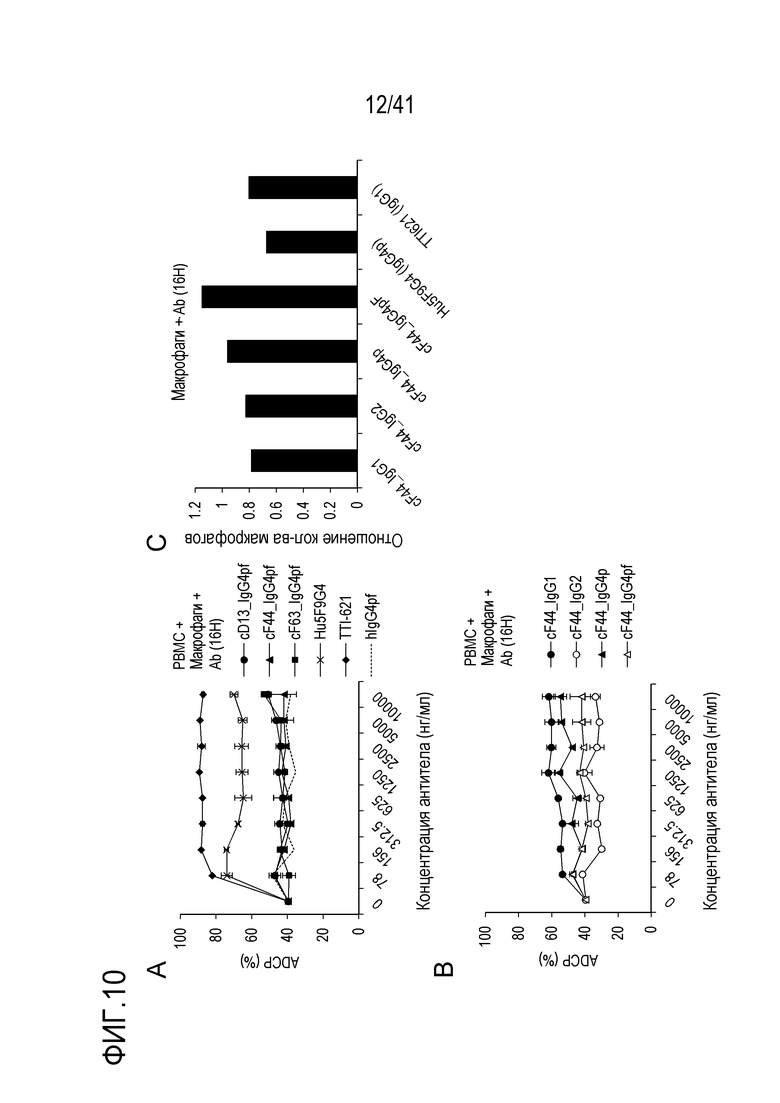


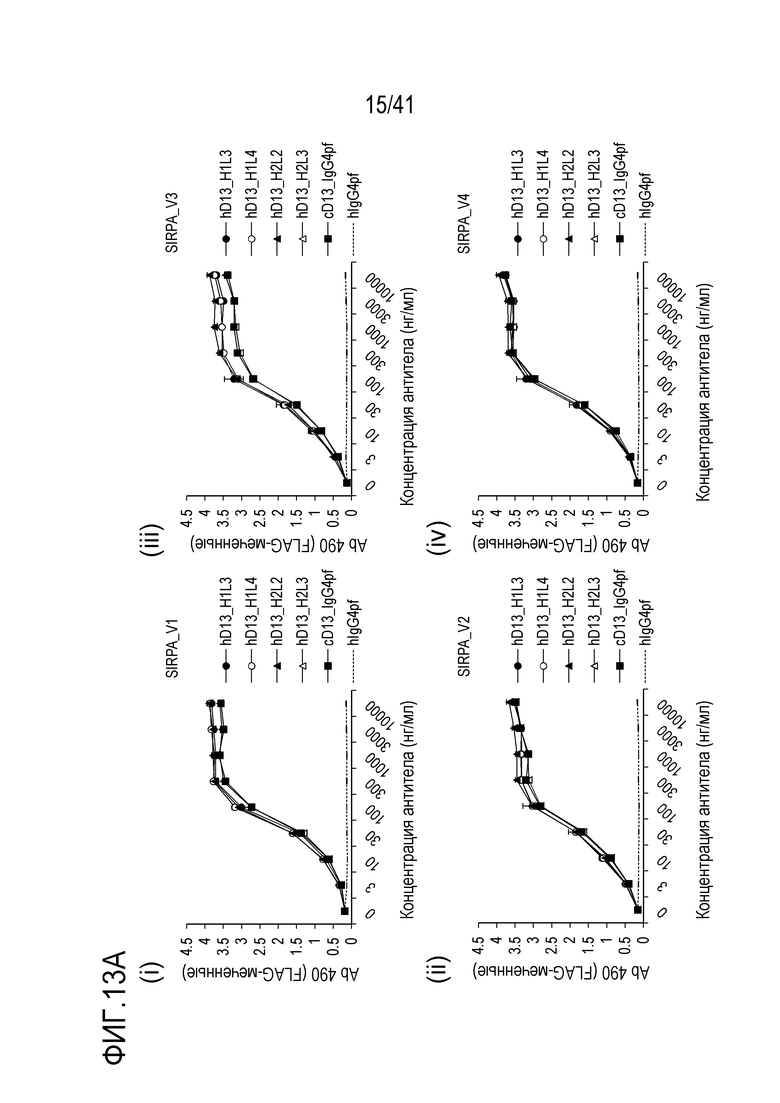
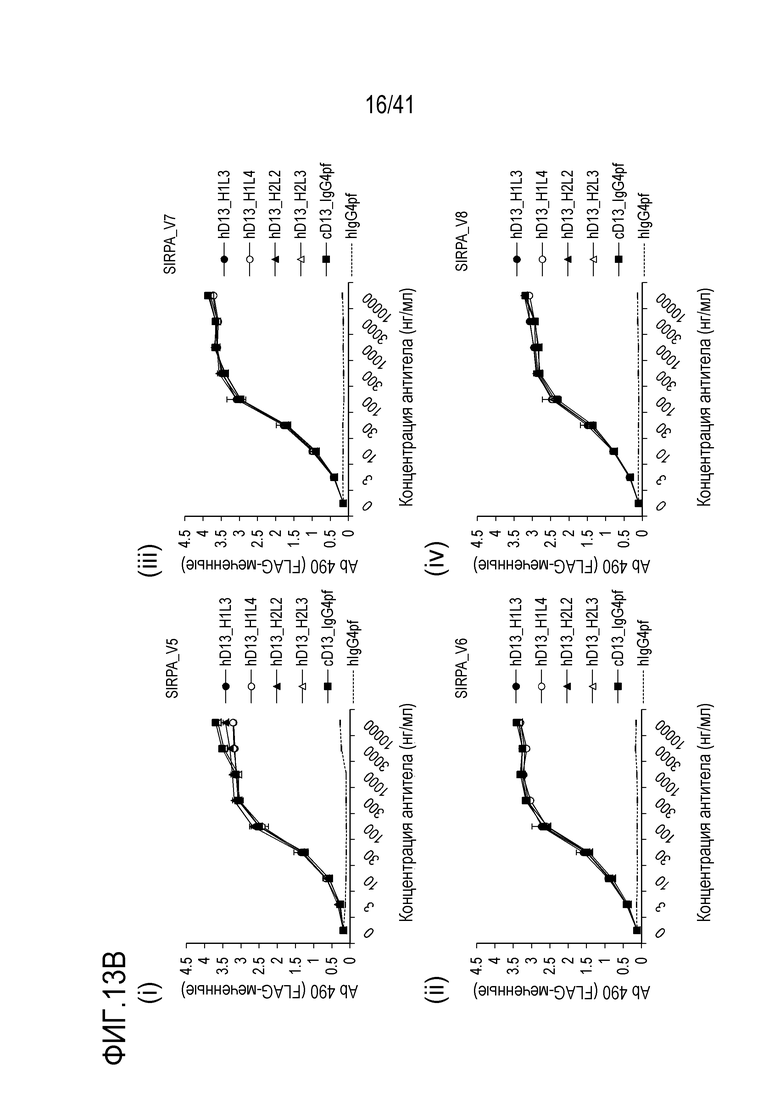
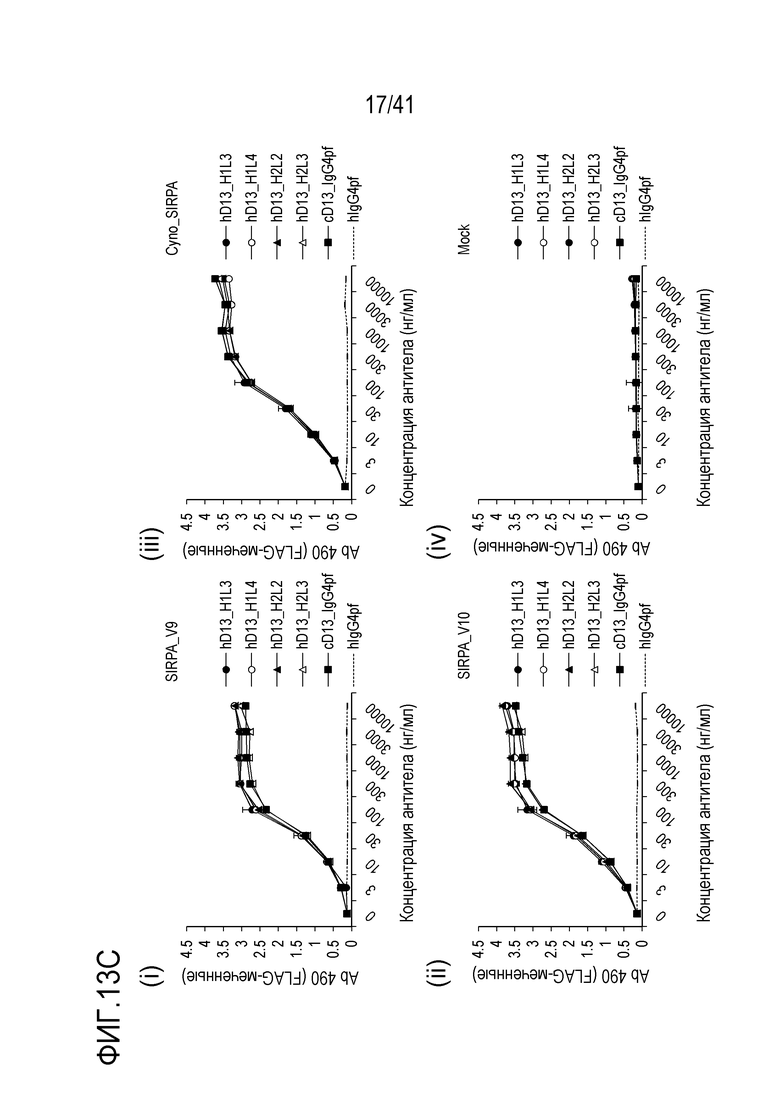
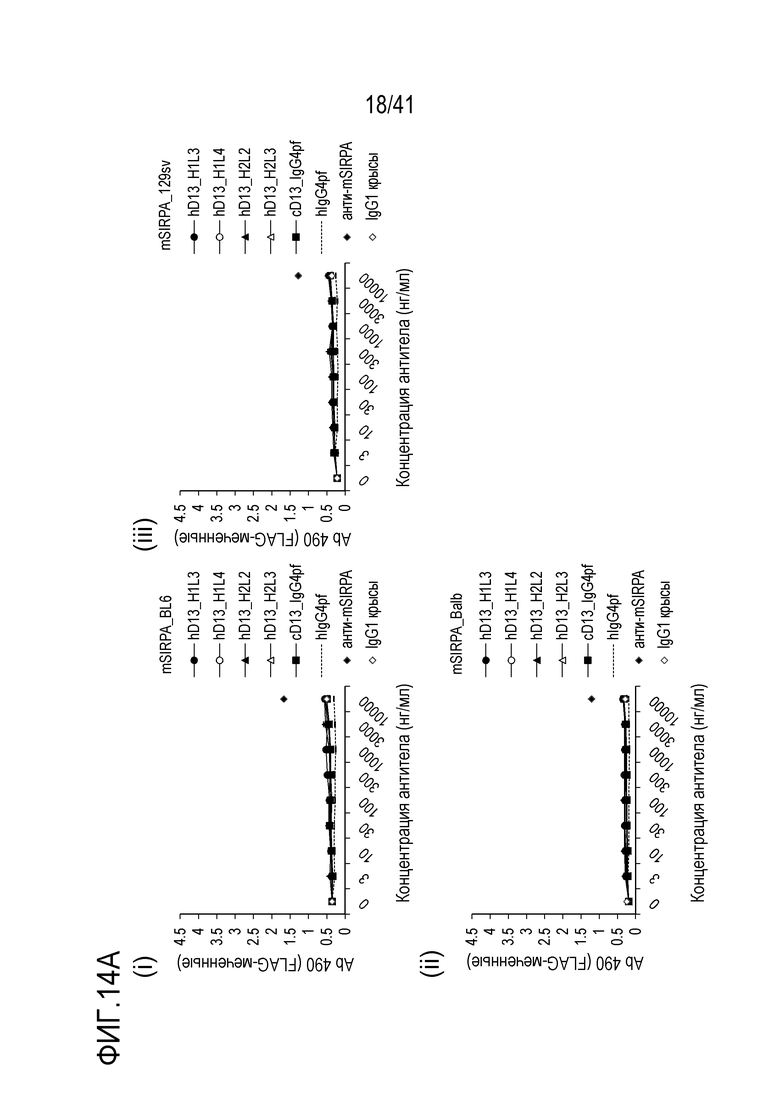
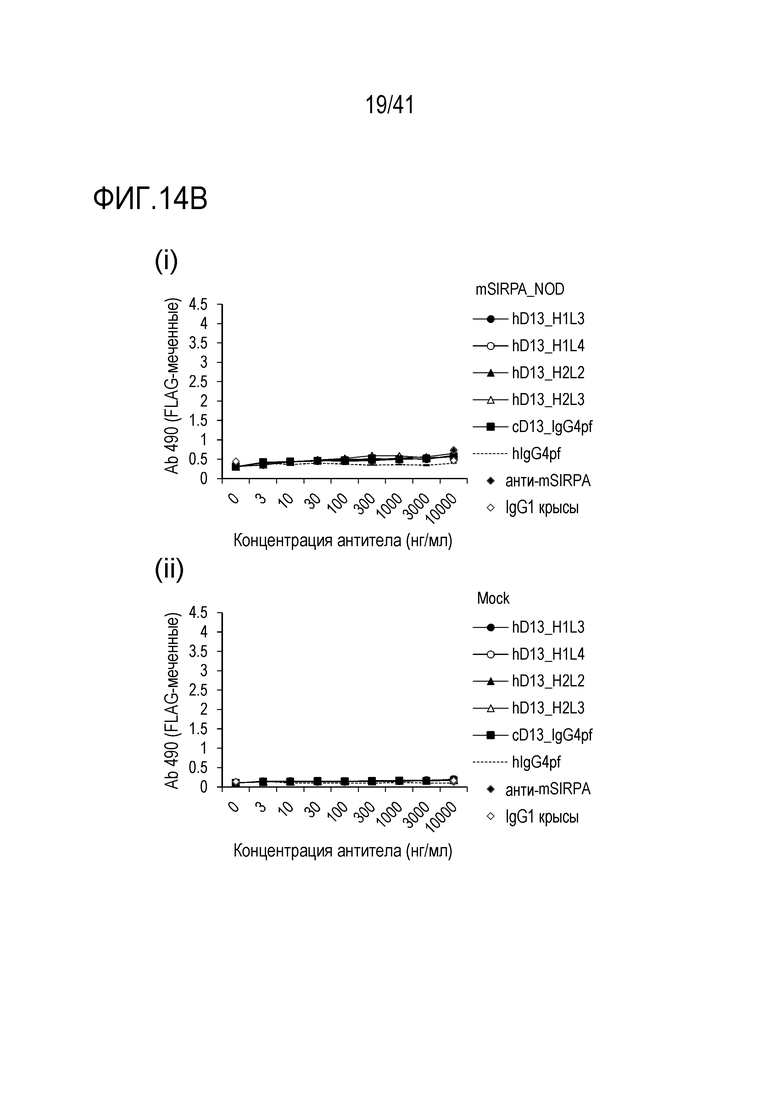
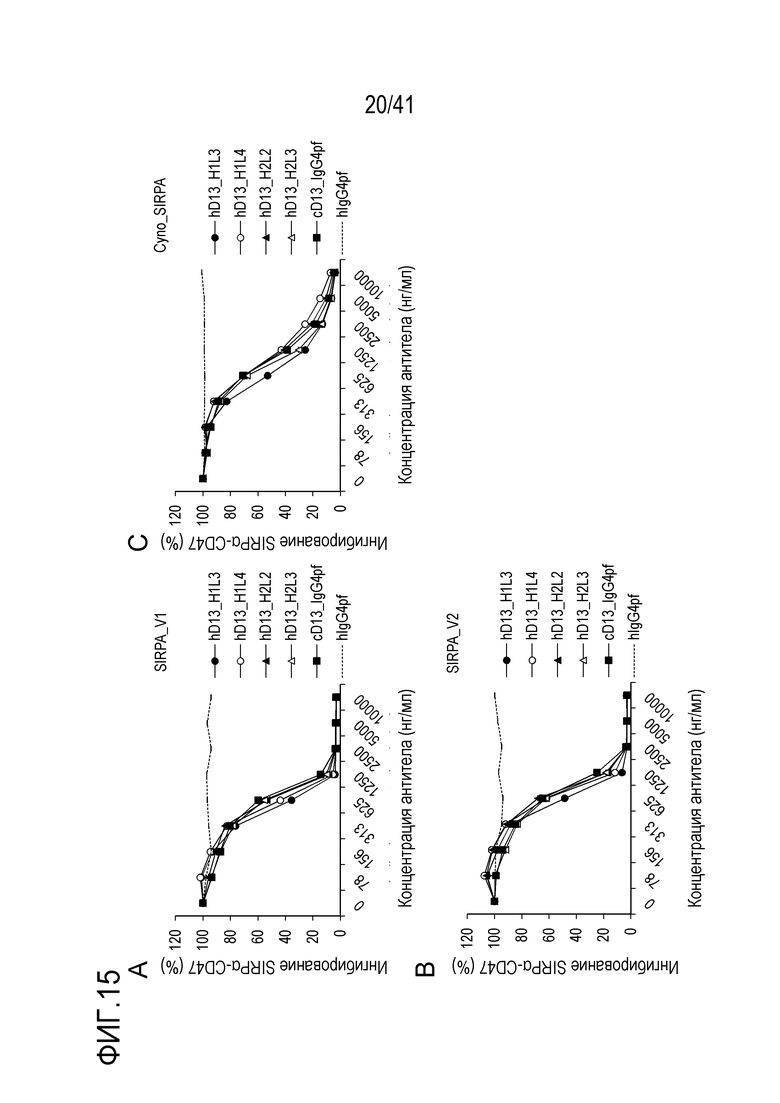
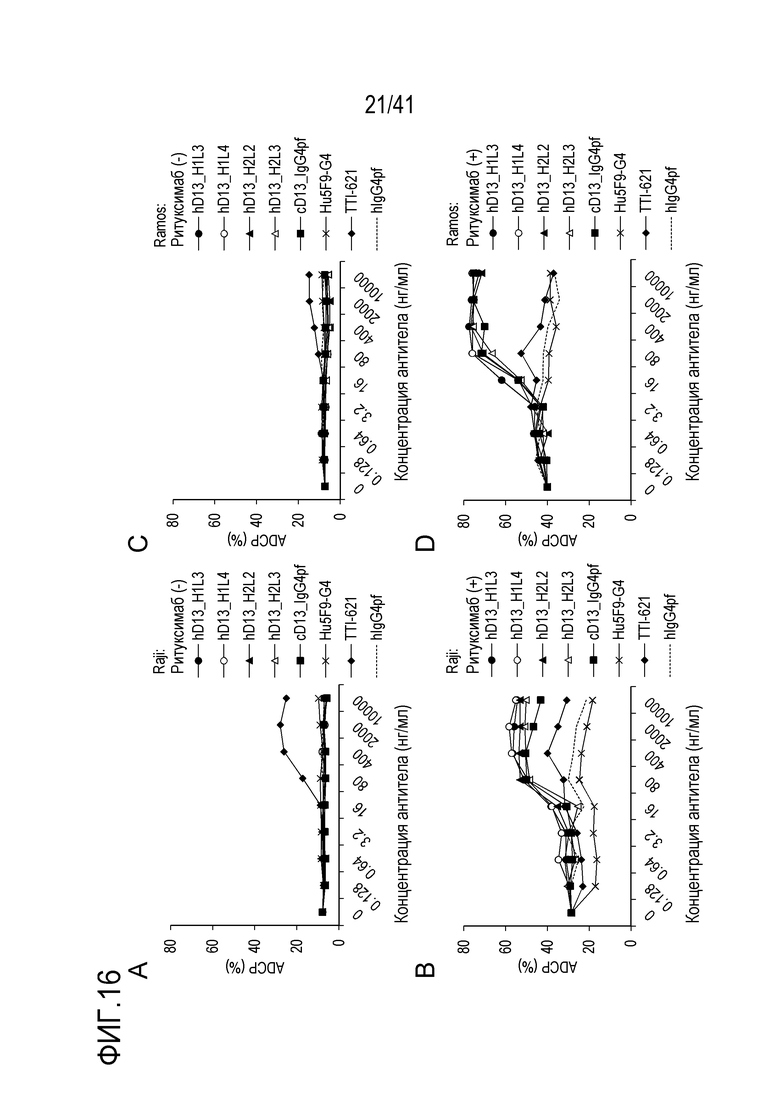














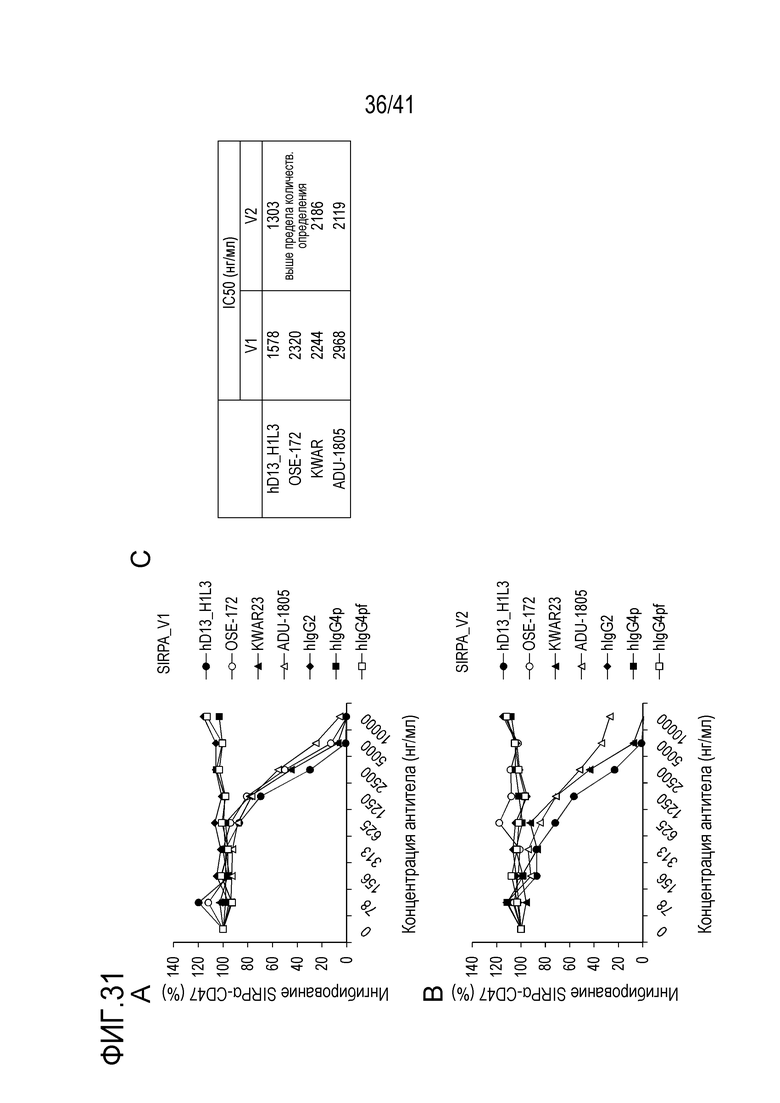
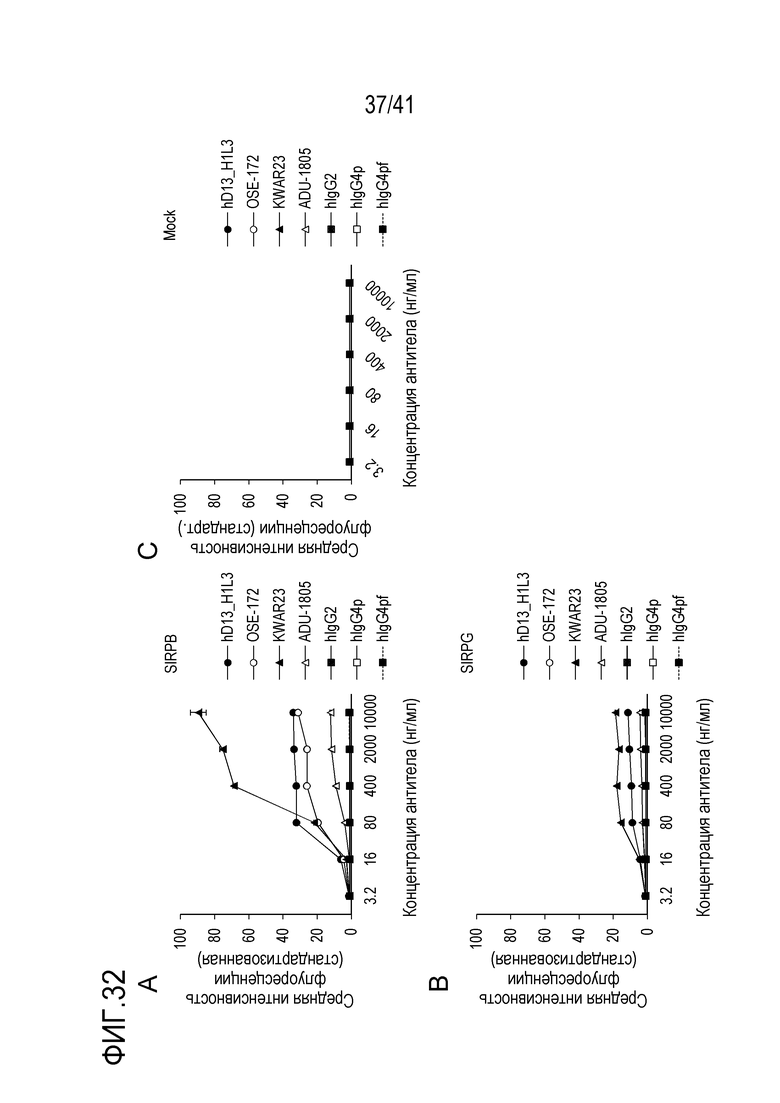
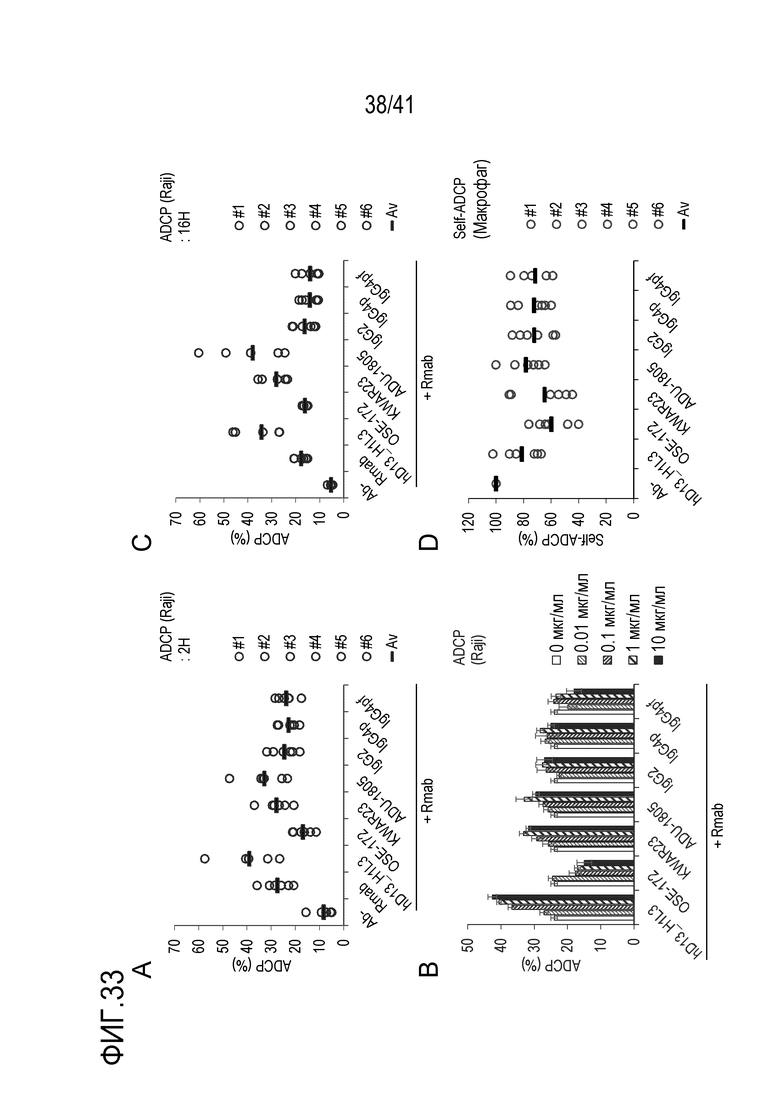



Изобретение относится к биотехнологии и медицине. Предложено антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, и антигенсвязывающий фрагмент антитела. Предложена фармацевтическая противоопухолевая композиция, содержащая эффективное количество предложенного антитела или антигенсвязывающего фрагмента антитела. Предложено применение фармацевтической композиции в комбинации с ингибитором иммунной контрольной точки и/или антителом как лекарственным средством, которое специфически реагирует на опухолевый антиген с получением активности ADCC и/или ADCP. Предложены: полинуклеотид, состоящий из нуклеотидных последовательностей, кодирующих аминокислотные последовательности тяжелой цепи и легкой цепи антитела; вектор экспрессии, содержащий предложенный полинуклеотид; клетка-хозяин для получения антитела, содержащая полинуклеотид; способ получения антитела, включающий культивирование клетки-хозяина и очистку антитела из культуры; антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα c СD47, полученное предложенным способом. Изобретение предлагает антитело против SIRPα, которое можно использовать в качестве противоопухолевого агента и в качестве противоопухолевого агента, содержащего антитело в качестве активного ингредиента. 14 н. и 25 з.п. ф-лы, 6 табл., 41 ил., 10 пр.
1. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(а) CDRL1 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:1;
(b) CDRL2 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:2;
(c) CDRL3 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:3;
(d) CDRH1 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:4;
(e) CDRH2 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:5; и
(f) CDRH3 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:6.
2. Антитело по п.1, где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека и имеет мутацию, которая снижает активность ADCC и/или ADCP.
3. Антитело по п.1 или 2, где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека, и фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, и серин в положении 228 заменен пролином.
4. Антитело по п.3, где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 140-466 последовательности SEQ ID NO:25.
5. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(ai) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-126 последовательности SEQ ID NO:23; или
(aii) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 21-126 последовательности SEQ ID NO:23, и обладающей активностью связывания с SIRPα человека; и
(bi) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-139 последовательности SEQ ID NO:25; или
(bii) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 20-139 последовательности SEQ ID NO:25, и обладающей активностью связывания с SIRPα человека,
где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека и имеет мутацию, которая снижает активность ADCC и/или ADCP, и
где антитело содержит:
(а) CDRL1 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:1;
(b) CDRL2 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:2;
(c) CDRL3 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:3;
(d) CDRH1 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:4;
(e) CDRH2 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:5; и
(f) CDRH3 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:6.
6. Антитело по п.5, где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4, и фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, и серин в положении 228 заменен пролином.
7. Антитело по п.6, где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 140-466 в SEQ ID NO:25.
8. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(а) CDRL1 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:7;
(b) CDRL2 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:8;
(c) CDRL3 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:9;
(d) CDRH1 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:10;
(e) CDRH2 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:11; и
(f) CDRH3 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:12.
9. Антитело по п.8, где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека и имеет мутацию, которая снижает активность ADCC и/или ADCP.
10. Антитело по п.8 или 9, где константная область тяжелой цепи представляет собой константную область тяжелой цепи человеческого IgG4, и фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, и серин в положении 228 заменен пролином.
11. Антитело по п.10, где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 139-465 последовательности SEQ ID NO:29.
12. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(ai) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-127 последовательности SEQ ID NO:27; или
(aii) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 21-127 последовательности SEQ ID NO:27, и обладающей активностью связывания с SIRPα человека; и
(bi) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-138 последовательности SEQ ID NO:29; или
(bii) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 20-138 последовательности SEQ ID NO:29 и обладающей активностью связывания с SIRPα человека, где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека и имеет мутацию, которая снижает активность ADCC и/или ADCP, и
где антитело содержит:
(а) CDRL1 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:1;
(b) CDRL2 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:2;
(c) CDRL3 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:3;
(d) CDRH1 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:4;
(e) CDRH2 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:5; и
(f) CDRH3 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:6.
13. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47 по п.12, где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека, и фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, и серин в положении 228 заменен пролином.
14. Антитело по п.13, где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 139-465 последовательности SEQ ID NO:29.
15. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(а) CDRL1 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:13;
(b) CDRL2 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:14;
(c) CDRL3 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:15;
(d) CDRH1 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:16;
(e) CDRH2 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:17; и
(f) CDRH3 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:18.
16. Антитело по п.15, где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека и имеет мутацию, которая снижает активность ADCC и/или ADCP.
17. Антитело по п.15 или 16, где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека, и фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, и серин в положении 228 заменен пролином.
18. Антитело по п.17, где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 144-470 последовательности SEQ ID NO:33.
19. Антитело, которое специфически связывается с SIRPαчеловека для ингибирования связывания SIRPα человека с CD47, где антитело содержит:
(ai) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-130 последовательности SEQ ID NO:31; или
(aii) вариабельную область легкой цепи, состоящую из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 21-130 последовательности SEQ ID NO:31, и обладающей активностью связывания с SIRPα человека; и
(bi) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-143 последовательности SEQ ID NO:33; или
(bii) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 20-143 последовательности SEQ ID NO:33, и обладающей активностью связывания с SIRPα человека,
где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека и имеет мутацию, которая снижает активность ADCC и/или ADCP, и
где антитело содержит:
(а) CDRL1 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:1;
(b) CDRL2 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:2;
(c) CDRL3 легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:3;
(d) CDRH1 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:4;
(e) CDRH2 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:5; и
(f) CDRH3 тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:6.
20. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47 по п.19, где константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека, а фенилаланин в положении 234 согласно нумерации в соответствии с индексом EU, как у Kabat et al., заменен аланином, лейцин в положении 235 заменен аланином, и серин в положении 228 заменен пролином.
21. Антитело по п.20, где аминокислотная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность, состоящую из аминокислотных остатков 144-470 последовательности SEQ ID NO:33.
22. Антитело по любому из пп.1-4, которое представляет собой любое из следующих (1)-(8):
(1) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 последовательности SEQ ID NO:41; и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 последовательности SEQ ID NO:37;
(2) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 последовательности SEQ ID NO:41 и обладающей активностью связывания с SIRPα человека; и легкой цепи, состоящей из аминокислотной последовательности, которая по меньшей мере на 95% идентична последовательности с аминокислотными остатками 21-234 последовательности SEQ ID NO:37 и обладающей активностью связывания с SIRPα человека;
(3) антитело, которое специфически связывается с SIRPα человека для ингибирования связывание SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 последовательности SEQ ID NO:41; и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 последовательности SEQ ID NO:39;
(4) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 последовательности SEQ ID NO:41 и обладающей активностью связывания с SIRPα человека; и легкой цепи, состоящей из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 последовательности SEQ ID NO:39 и обладающей активностью связывания с SIRPα человека;
(5) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 последовательности SEQ ID NO:43; и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 последовательности SEQ ID NO:35;
(6) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 последовательности SEQ ID NO:43 и обладающей активностью связывания с SIRPα человека; и легкой цепи, состоящей из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 последовательности SEQ ID NO:35, и обладающей активностью связывания с SIRPα человека;
(7) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 последовательности SEQ ID NO:43; и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 последовательности SEQ ID NO:37; и
(8) антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47, где антитело состоит из: тяжелой цепи, состоящей из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 20-466 последовательности SEQ ID NO:43 и обладающей активностью связывания с SIRPα человека; и легкой цепи, состоящей из аминокислотной последовательности, которая по меньшей мере на 95% идентична по последовательности аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 последовательности SEQ ID NO:37, и обладающей активностью связывания с SIRPα человека.
23. Антитело по п.22, где активность ADCC и/или ADCP снижена.
24. Антитело по любому из пп.1-23, которое усиливает фагоцитарную активность макрофага.
25. Антитело по любому из пп.1-24, где остаток лизина на карбоксильном конце тяжелой цепи удален.
26. Антигенсвязывающий фрагмент антитела по любому из пп.1-25, который специфически связывается с SIRPα человека для ингибирования связывания SIRPα человека с CD47.
27. Антигенсвязывающий фрагмент антитела по п.26, отличающийся тем, что антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, F(ab')2, Fab' и scFv.
28. Фармацевтическая противоопухолевая композиция, содержащая эффективное количество антитела по любому из пп.1-25 или антигенсвязывающего фрагмента антитела по пп.26 или 27 в качестве активного ингредиента.
29. Фармацевтическая композиция по п.28, дополнительно содержащая ингибитор иммунной контрольной точки и/или антитело как лекарственное средство, которое специфически реагирует на опухолевый антиген с получением активности ADCC и/или ADCP, в качестве активного ингредиента противоопухолевого агента.
30. Применение фармацевтической композиции в комбинации с ингибитором иммунной контрольной точки и/или антителом как лекарственным средством, которое специфически реагирует на опухолевый антиген с получением активности ADCC и/или ADCP, где фармацевтическая композиция содержит в качестве активного ингредиента антитело по любому из пп.1-25 или антигенсвязывающий фрагмент антитела по п.26 или 27, в качестве противоопухолевого средства.
31. Фармацевтическая композиция по п.29 или применение по п.30, где ингибитор иммунной контрольной точки представляет собой ингибитор связывания PD-L1 с PD-1 или ингибитор CTLA4.
32. Фармацевтическая композиция по п.29 или применение по п.30, где антитело как лекарственное средство, которое специфически реагирует на опухолевый антиген с получением активности ADCC и/или ADCP, выбрано из группы, состоящей из антитела против CD20, антитела против HER2 и антитела против EGFR.
33. Фармацевтическая композиция по п.29 или применение по любому из пп.30-32, где опухоль представляет собой опухоль одного или двух или более типов, выбранных из группы, состоящей из карциномы, саркомы, лимфомы, лейкоза, миеломы, герминомы, опухоли головного мозга, карциноида, нейробластомы, ретинобластомы и нефробластомы.
34. Фармацевтическая композиция по п.29 или применение по любому из пп.30-33, где опухоль представляет собой опухоль одного типа или двух или более типов, выбранных из группы, состоящей из рака почки, меланомы, плоскоклеточного рака, базальноклеточного рака, рака конъюнктивы, рака полости рта, фарингеального рака, рака щитовидной железы, рака легкого, рака молочной железы, рака пищевода, рака желудка, рака двенадцатиперстной кишки, рака тонкого кишечника, рака толстой кишки, рака прямой кишки, рака аппендикса, рака анального канала, рака печени, рака желчного пузыря, рака желчных протоков, рака поджелудочной железы, рака надпочечников, рака мочевого пузыря, рака предстательной железы, рака матки, рака влагалища, липосаркомы, ангиосаркомы, хондросаркомы, рабдомиосаркомы, саркомы Юинга, остеосаркомы, недифференцированной плеоморфной саркомы, миксофибросаркомы, злокачественной периферической шванномы, ретроперитонеальной саркомы, синовиосаркомы, саркомы матки, желудочно-кишечной стромальной опухоли, лейомиосаркомы, эпителиоидной саркомы, B-клеточной лимфомы, NK/T-клеточной лимфомы, лимфомы Ходжкина, миелоидного лейкоза, лимфолейкоза, миелопролиферативного заболевания, миелодиспластического синдрома, множественной миеломы, рака яичек, рака яичников, нейроглиомы и менингиомы.
35. Полинуклеотид, состоящий из нуклеотидных последовательностей, кодирующих аминокислотные последовательности тяжелой цепи и легкой цепи антитела по любому из пп.1-25.
36. Вектор экспрессии, содержащий полинуклеотид по п.35.
37. Клетка-хозяин для получения антитела по любому из пп.1-25, содержащая полинуклеотид по п.35 или вектор по п.36.
38. Способ получения антитела по любому из пп.1-25, включающий культивирование клетки-хозяина по п.37 и очистку антитела из культуры.
39. Антитело, которое специфически связывается с SIRPα человека для ингибирования связывания SIRPα c СD47, полученное способом по п.38.
| WO 2017178653 A2, 19.10.2017 | |||
| JP 2014525940 A, 02.10.2014 | |||
| JP 2016169220 A, 23.09.2016 | |||
| РАТНИКОВА Н.М., Создание и тестирование миниатюрных однодоменных антител на основе тяжелой цепи иммуноглобулина альпаки против онкомаркера CD47 и их применение для терапии опухолей, автореферат диссертации, Москва 2017, глава 1, 1.2. |
Авторы
Даты
2023-03-01—Публикация
2019-07-09—Подача