1. Область техники, к которой относится изобретение.
Изобретение относится к области биологически активных соединений - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7(4Н)-ону и его солям с неорганическими и органическими катионами - обладающими антигликирующей активностью, а так же ингибирующей активностью в отношении фермента α-глюкозидазы и предназначены для лечения и профилактики последствий сахарного диабета.
Изобретение может быть использовано в лечебных учреждениях и научно-исследовательских лабораториях.
2. Уровень техники
Неферментативное взаимодействие белков с глюкозой (реакция Майяра) приводит к образованию химических соединений - конечных продуктов гликирования (КПГ) (NA Ansari, Z Rasheed, 2010). Именно внутри- и внеклеточное накопление КПГ считают важным фактором патогенеза таких заболеваний, как атеросклероз (М Busch et al., 2010), сердечная недостаточность, воспаление, ревматоидный артрит (A Syngle et al., 2012) и остеоартрит, нейродегенеративные заболевания (J Li et al., 2012), включая болезни Альцгеймера и Паркинсона.
Особенно интенсивно данный процесс протекает при сахарном диабете и имеет немаловажное значение в развитии его осложнений (NA Ansari, Z Rasheed, 2010; SY Goh, ME Cooper, 2008; R Ramasamy et al., 2011) и скорость образования КПГ зависит от уровня и длительности экспозиции глюкозы (М.И. Балаболкин, 2002). Эффекты КПГ могут быть классифицированы как рецептор-независимые и -зависимые, может действовать внутри-клеточно или циркулировать и действуют на рецепторы клеточной поверхности, таких как рецепторы для КПГ (РКПГ). Поскольку гликирование происходит в течение длительного периода времени, КПГ влияют на долгоживущие белки, например, главными мишенями являются структурные компоненты соединительной ткани и, в частности, коллаген типа IV, но и другие долгоживущие белки могут также подвергаться гликированию, в том числе миелин, тубулин, активатор плазминогена 1, фибриноген. Накопление КПГ во внеклеточном матриксе приводит к образованию меж- и внутримолекулярных поперечных сшивок и повышению ригидности кровеносных сосудов. Кроме того, под действием КПГ изменяется состав внеклеточного матрикса, с повышенной экспрессией фибронектина, коллагена типа III, IV, VI и ламинина, возможно, опосредовано через активацию ключевых профибротических цитокинов, таких как трансформирующий фактор роста β и фактор роста соединительной ткани. Рецептор-зависимые эффекты КПГ опосредованы их взаимодействием со специфическими рецепторами, что приводит к активации вторичных передатчиков, таких как протеинкиназа С. Ключевая мишень РКПГ - ядерный фактор NF-κB, который перемещается в ядро и приводит к повышению транскрипции таких белков, как молекулы межклеточной адгезии-1, Е-селектин, эндотелии-1, сосудистый эндотелиальный фактор роста, провоспалительные цитокины. Все вышеперечисленное лежит в основе патогенеза таких последствий сахарного диабета, как диабетические атеросклероз, нефро-, нейро-, ретино-, кардио-, ангиопатии, которые являются причиной высокого риска инвалидизации и смертности среди пациентов с сахарным диабетом.
На сегодняшний день нет препаратов, специфически угнетающих образование КПГ, применяемых в клинической практике. Интерес к данной проблематике и поиску лекарственных средств, способных тормозить реакцию Майяра, снижать образование конечных продуктов гликирования и предотвращать развитие осложнений сахарного диабета, неуклонно растет. Первым и наиболее изученным веществом, ингибирующим гликирование белков, является аминогуанидин (АГ), выбранным в качестве прототипа. Он предотвращает формирование флюоресцирующих КПГ и глюкозо-производных поперечносшитых молекул коллагена. Механизм антигликирующего действия аминогуанидина связывают с его способностью захватывать реактивные дикарбонильные интермедиаты. Однако клинические испытания данного препарата были остановлены в связи с его недостаточной эффективностью и наличием побочных эффектов (BI Freedman et al., 1999; WK Bolton et al., 2004).
Другим подходом для борьбы с сахарным диабетом и его последствиями является методология, предусматривающая ингибирование различных ферментов, играющих роль в регуляции концентрации сахаров в крови, а также влияющих на секрецию инсулина в организме. Несмотря на широкий выбор пероральных гипогликемических препаратов с подобным ингибирующим эффектом, на сегодняшний день велика потребность в создании и внедрении в клиническую практику новых, эффективных, безопасных препаратов для лечения сахарного диабета 2-ого типа.
Одной из мишеней антидиабетических средств является α-глюкозидаза (α-D-глюкозид-глюкогидролаза), часто называемая мальтазой. Глюкозидаза гидролизует α-1,4-гликозидные связи на нередуцирующем конце α-1,4-глюканов, отщепляя глюкозу в α-форме. Ингибиторы альфа-глюкозидазы - псевдосахариды, которые конкурентно блокируют активные центры ферментов кишечных ворсинок, отвечающих за расщепление олиго- и дисахаридов до моносахаридов. Следствием такой конкуренции являются замедление темпов расщепления сахаридов и, соответственно, их всасывания в кровь, снижение уровня постпрандиальной гипергликемии.
3. Сущность изобретения.
Сущность изобретения составляет 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-он (1), обладающий антигликирующей активностью, а так же родственные ему структуры 1,2,4-триазоло[1,5-а]пиримидинового ряда (2а-з), обладающие ингибирующей активностью в отношении α-глюкозидазы - фермента, участвующего в регуляции процессов, связанных с уровнем сахара в крови.

4. Сведения, подтверждающие возможность осуществления изобретения.
4.1. Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-он (1), получено по следующей схеме: циклоконденсация 3-амино-5-(фуран-2-ил)-1Н-1,2,4-триазола (3) с этилацетоацетатом (4) с образованием триазолопиримидина (5) и последующего нитрования соединения (5) смесью концентрированных азотной и серной кислот.

Пример 1. Синтез 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она (1):
6.00 г (0.04 моль) 3-амино-5-(фуран-2-ил)-1Н-1,2,4-триазола (5) суспендируют в 6.06 мл (0.048 моль) этилацетоацетата и 30 мл ледяной уксусной кислоты. Суспензию нагревают до 120°С и выдерживают при этой температуре в течение 2.5 часов. Реакционную массу охлаждают до комнатной температуры и осадок отфильтровывают, сушат и перекристаллизовывают.
Выход 6.05 г (70%).
2.16 г (0.01 моль) полученного осадка (7) растворяют в 20 мл купоросного масла при комнатной температуре и приливают 1.98 мл (0.031 моль) 70% азотной кислоты, поддерживая температуру реакционной массы при 3-7°С. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и выливают в 100 г льда. Выпавший осадок отфильтровывают, промывают водой и сушат.
Выход 1.75 г (57%).
Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-он (1), имеет следующие физико-химические характеристики: Тпл 249-251°С. 1Н ЯМР спектр (DMSO-d6): 2.56 (3Н, с, СН3) 7.50 (1Н, м, СН, J=4.0 Гц), 7.85 (1H, м, СН, J=3.6 Гц). 13С ЯМР спектр (DMSO-d6): 17.9 (СН3), 114.3 (С3'), 114.8 (С2'), 127.8 (С5), 146.4 (С1'), 149.2 (С7), 150.4 (С4'), 151.2 (С3а), 152.4 (С6), 153.2 (С2). Найдено, %: С - 33.44; Н - 3.42; N - 23.14; C10H6N6O6*3H2O; Вычислено, %: С - 33.34; Н - 3.36; N - 23.33.
Физико-химические характеристики соединения 1 полностью соответствуют приписываемой структуре.
4.2. Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она натриевая соль (2а), получено по следующей схеме: реакция солеобразования 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она с гидроксидом натрия в водной среде.

Пример 2. Синтез 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она натриевой соли (2а):
К суспензии 0.500 г (0.0016 моль) 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она в 5 мл воды добавляют раствор 0.065 г (0.0016 моль) гидроксида натрия в 5 мл воды и перемешивают при комнатной температуре в течение 10 минут. Полученную суспензию нагревают до образования раствора, после чего упаривают в вакууме досуха и затирают остаток с изо-пропиловым спиртом. Выпавший остаток отфильтровывают и сушат.
Выход 0.400 г (76%).
Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она натриевая соль (2а), имеет следующие физико-химические характеристики: Тпл 239-241°С. 1Н ЯМР спектр (DMSO-d6): 2.47 (3Н, с, СН3) 7.36 (1Н, м, СН, J=4.0 Гц), 7.69 (1Н, м, СН, J=4.0 Гц). 13С ЯМР спектр (DMSO-d6): 23.1 (СН3), 113.0 (С3'), 114.3 (С2'), 126.5 (С5), 148.7 (С1'), 150.8 (С7), 151.6 (С4'), 153.3 (С3а), 156.4 (С6), 158.6 (С2). Найдено, %: С - 30.11; Н - 3.18; N - 20.88; C10H5N6NaO6*4H2O; Вычислено, %: С - 30.01; Н - 3.27; N - 21.00.
Физико-химические характеристики соединения 2а полностью соответствуют приписываемой структуре.
4.3. Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она калиевая соль (2б), получено по следующей схеме: реакция солеобразования 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она с гидроксидом калия в водной среде.

Пример 3. Синтез 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она калиевой соли (2б):
К суспензии 0.500 г (0.0016 моль) 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она в 5 мл воды добавляют раствор 0.090 г (0.0016 моль) гидроксида калия в 5 мл воды и перемешивают при комнатной температуре в течение 10 минут. Полученную суспензию нагревают до образования раствора, после чего упаривают в вакууме досуха.
Выход 0.360 г (65%).
Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-три-азоло[1,5-а]пиримидин-7-она калиевая соль (2б), имеет следующие физико-химические характеристики: Тпл 290-293°С. 1Н ЯМР спектр (DMSO-d6): 2.45 (3Н, с, СН3) 7.41 (1H, м, СН, J=3.8 Гц), 7.82 (1Н, м, СН, J=3.7 Гц). 13С ЯМР спектр (DMSO-d6): 23.9 (СН3), 113.7 (С3'), 115.0 (С2'), 126.9 (С5), 149.3 (С1'), 151.5 (С7), 152.2 (С4'), 153.9 (С3а), 157.1 (С6), 159.5 (С2). Найдено, %: С - 31.71; Н - 2.20; N - 22.12; C10H15N6O6K*2H2O; Вычислено, %: С - 31.58; Н - 2.39; N - 22.10.
Физико-химические характеристики соединения 2а полностью соответствуют приписываемой структуре.
4.4. Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она аммониевая соль (2в), получено по следующей схеме: реакция солеобразования 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она с водным раствором аммиака.

Пример 4. Синтез 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она аммониевой соли (2в):
К суспензии 0.500 г (0.0016 моль) 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она в 5 мл воды добавляют 0.12 мл 25% водного раствора аммиака и перемешивают при комнатной температуре в течение 10 минут. Полученную суспензию нагревают до образования раствор, после чего упаривают в вакууме досуха.
Выход 0.370 г (72%).
Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она аммониевая соль (2в), имеет следующие физико-химические характеристики: Тпл>300°С. 1Н ЯМР спектр (DMSO-d6): 2.45 (3Н, с, СН3), 7.13 (4Н, с, NH4+) 7.40 (1Н, м, СН, J=3.7 Гц), 7.82 (1H, м, СН, J=3.6 Гц). 13С ЯМР спектр (DMSO-d6): 23.3 (СН3), 113.1 (С3'), 114.4 (С2'), 126.6 (С5), 148.9 (С1'), 151.0 (С7), 151.7 (С4'), 153.5 (С3а), 156.7 (С6), 158.8 (С2). Найдено, %: С - 33.50; Н - 3.65; N - 27.06; C10H9N7O6*2H2O; Вычислено, %: С - 33.42; Н - 3.62; N - 27.30.
Физико-химические характеристики соединения 2в полностью соответствуют приписываемой структуре.
4.5. Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она метформиновая соль (2г), получено по следующей схеме: реакция солеобразования 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она натриевая соль с водным раствором метформина гидрохлорида.

Пример 5. Синтез 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она метформиновой соли (2г):
К суспензии 0.500 г (0.00152 моль) 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она натриевой соли в 5 мл воды добавляют раствор 0.252 г (0.00152 моль) метформина гидрохлорида в 5 мл воды и перемешивают образовавшийся раствор при комнатной температуре в течение 20 минут. Реакционную массу упаривают в вакууме досуха, остаток затирают с изо-пропиловым спиртом. Выпавший осадок отфильтровывают и сушат.
Выход 0.460 г (66%).
Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она метформиновая соль (2г), имеет следующие физико-химические характеристики: Тпл 251-254°С. 1Н ЯМР спектр (DMSO-d6): 2.44 (3Н, с, СН3), 2.92 (6Н, с, 2ХСН3), 6.57 (4Н, с, 2XNH2), 7.18 (4Н, с, 2XNH) 7.39 (1Н, м, СН, J=3.9 Гц), 7.82 (1Н, м, СН, J=3.9 Гц). 13С ЯМР спектр (DMSO-d6): 23.3 (СН3), 37.4 (2ХСН3), 113.2 (С3'), 114.5 (С2'), 126.5 (С5), 148.8 (С1'), 150.9 (С7), 151.7 (С4'), 153.4 (С3а), 156.6 (С6), 158.1 (С2), 158.9  159.2
159.2  . Найдено, %: С - 33.05; Н - 4.89; N - 30.30; C14H17N11O6*4H2O; Вычислено, %: С - 33.14; Н - 4.93; N - 30.37.
. Найдено, %: С - 33.05; Н - 4.89; N - 30.30; C14H17N11O6*4H2O; Вычислено, %: С - 33.14; Н - 4.93; N - 30.37.
Физико-химические характеристики соединения 2г полностью соответствуют приписываемой структуре.
4.6. Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она L-аргининиевая соль (2д), получено по следующей схеме: реакция солеобразования 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она с L-аргинином в водной среде.
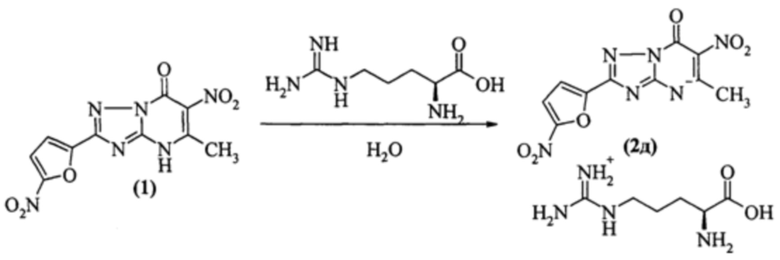
Пример 6. Синтез 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она L-аргининиевой соли (2д):
К суспензии 0.500 г (0.0016 моль) 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она в 5 мл воды добавляют раствор 0.278 г (0.0016 моль) L-аргинина в 5 мл воды и перемешивают при комнатной температуре в течение 10 минут. Полученную суспензию нагревают до образования раствора, после чего охлаждают до комнатной температуры. Выпавший остаток отфильтровывают и сушат.
Выход 0.614 г (80%).
Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-он L-аргининиевая соль (2д), имеет следующие физико-химические характеристики: Тпл 199-201°С. 1H ЯМР спектр (DMSO-d6): 1.62-1.75 (4Н, уш.м., 2хСН2), 3.15 (2Н, уш.м., СН2), 3.60 (1H, уш.м., СН), 7.33 (1Н, д, СН, J=3.6) 7.69 (1Н, м, СН, J=3.6 Гц). 13С ЯМР спектр (DMSO-d6): 23.1 (СН3), 24.5 (СН2), 27.5 (CH2-NH), 52.6 (CH2-NH2), 113.0 (С3'), 114.3 (С2'), 126.5 (С5), 148.8 (С1'), 150.8 (С7), 151.6 (С4'), 153.3 (С3а), 156.5 (С6), 158.8 (С2), 158.6 (NH2-C-NH), 171.3 (НО-С=O). Найдено, %: С - 38.48; Н - 4.23; N - 28.09; C16H20N10O8*H2O; Вычислено, %: С - 38.56; Н - 4.45; N - 28.10.
Физико-химические характеристики соединения 2д полностью соответствуют приписываемой структуре.
4.7. Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она гуанидиновая соль (2е), получено по следующей схеме: получено по следующей схеме: реакция солеобразования 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она натриевая соль с водным раствором гуанидина гидрохлорида.

Пример 7. Синтез 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она гуанидиновой соли (2е):
К суспензии 0.500 г (0.00152 моль) 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она натриевой соли в 5 мл воды добавляют раствор 0.146 г (0.00152 моль) гуанидина гидрохлорида в 5 мл воды и перемешивают образовавшийся раствор при комнатной температуре в течение 2 часов. Образовавшийся осадок отфильтровывают и сушат.
Выход 0.460 г (83%).
Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-он гуанидиновая соль (2е), имеет следующие физико-химические характеристики: Тпл 289-291°С. 1Н ЯМР спектр (DMSO-d6): 2.46 (3Н, с, СН3), 7.40 (1Н, м, СН, J=3.8 Гц), 7.83 (1H, м, СН, J=3.8 Гц). 13С ЯМР спектр (DMSO-d6): 23.2 (СН3), 113.0 (С3'), 114.4 (С2'), 126.7 (С5), 149.0 (С1'), 150.9 (С7), 151.7 (С4'), 153.4 (С3а), 156.7 (С6), 158.8 (С2), 158.9 (NH2-(C=NH2)-NH2). Найдено, %: С - 35.24; Н - 3.20; N - 33.80; C16H20N10O8*0.5H2O; Вычислено, %: С - 35.30; Н - 3.23; N - 33.68.
Физико-химические характеристики соединения 2е полностью соответствуют приписываемой структуре.
4.8. Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она аминогуанидиновая соль (2ж), получено по следующей схеме: получено по следующей схеме: реакция солеобразования 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она с водной суспензией аминогуанидина бикарбоната.

Пример 8. Синтез 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она гуанидиновой соли (2ж):
К суспензии 0.500 г (0.00152 моль) 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она в 5 мл воды добавляют суспензию 0.222 г (0.00152 моль) аминогуанидина бикарбоната в 5 мл воды и нагревают реакционную массу до кипения, после чего охлаждают до комнатной температуры. Образовавшийся осадок отфильтровывают и сушат.
Выход 0.492 г (85%).
Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-он аминогуанидиновая соль (2ж), имеет следующие физико-химические характеристики: Тпл>300°С. 1H ЯМР спектр (DMSO-d6): 2.47 (3Н, с, СН3), 7.42 (1H, м, СН, J=3.8 Гц), 7.84 (1Н, м, СН, J=3.8 Гц). 13С ЯМР спектр (DMSO-d6): 23.4 (СН3), 113.0 (С3'), 114.6 (С2'), 126.7 (С5), 149.1 (С1'), 151.2 (С7), 151.7 (С4'), 153.4 (С3а), 156.9 (С6), 159.0 (С2), 160.0 (NH2-(C=NH2)-NH2). Найдено, %: С - 34.56; Н - 3.25; N - 36.76; C11H12N10O6; Вычислено, %: С - 34.64; Н - 3.15; N - 36.75.
Физико-химические характеристики соединения 2ж полностью соответствуют приписываемой структуре.
4.9. Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она N-метилглюкаминовая соль (2з), получено по следующей схеме: реакция солеобразования 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она с гидроксидом натрия в водной среде.

Пример 9. Синтез 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она натриевой соли (2з):
К суспензии 0.500 г (0.0016 моль) 2-(5-нитронилфуран-2-ил)-5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она в 5 мл воды добавляют раствор 0.312 г (0.0016 моль) N-метилглюкамина в 5 мл воды и перемешивают при комнатной температуре в течение 10 минут. Полученную суспензию нагревают до образования раствора, после чего упаривают в вакууме досуха. Остаток затирают с изо-пропиловым спиртом и фильтруют выпавший осадок, который сушат на воздухе.
Выход 0.593 г (74%).
Заявляемое соединение - 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она-N-метилглюкаминовая соль (2з), имеет следующие физико-химические характеристики: Тпл 247-249°С. 1Н ЯМР спектр (DMSO-d6): 1.86 (2Н, м, CH2O), 2.47 (3Н, с, СН3), 2.60 (3Н, с, NCH3), 3.00-3.06 (2Н, уш. м., 2хСН), 3.40-3.46 (1Н, уш. м.,  ), 3.47 (2Н, т, J=4.00, NCH2), 3.89 (1H, м,
), 3.47 (2Н, т, J=4.00, NCH2), 3.89 (1H, м,  ), 7.30 (1H, м, CH, J=3.8 Гц), 7.60 (1H, м, CH, J=3.8 Гц). 13C ЯМР спектр (DMSO-d6): 23.0 (CH3), 36.0 (CH3-N), 49.5 (CH2-N), 60.2 (CH2-O), 72.0 (CHOH-CHOH-CHOH-CHOH), 113.3 (C3'), 115.0 (C2'), 128.5 (C5), 148.9 (С1'), 150.6 (C7), 151.0 (C4'), 153.0 (С3а), 156.0 (C6), 160.0 (C2). Найдено, %: С - 40.76; H - 4.66; N - 19.67; C17H23N7O11; Вычислено, %: С - 40.72; Н - 4.62; N - 19.55.
), 7.30 (1H, м, CH, J=3.8 Гц), 7.60 (1H, м, CH, J=3.8 Гц). 13C ЯМР спектр (DMSO-d6): 23.0 (CH3), 36.0 (CH3-N), 49.5 (CH2-N), 60.2 (CH2-O), 72.0 (CHOH-CHOH-CHOH-CHOH), 113.3 (C3'), 115.0 (C2'), 128.5 (C5), 148.9 (С1'), 150.6 (C7), 151.0 (C4'), 153.0 (С3а), 156.0 (C6), 160.0 (C2). Найдено, %: С - 40.76; H - 4.66; N - 19.67; C17H23N7O11; Вычислено, %: С - 40.72; Н - 4.62; N - 19.55.
Физико-химические характеристики соединения 1 полностью соответствуют приписываемой структуре.
4.10. Пример 10. Определение антигликирующей активности соединений 1,2а-з в системе in vitro
Реакцию гликирования воспроизводили по методу (A. Jedsadayanmata (2005)). Конечный объем реакционной смеси составлял 1.5 мл. Реакционная смесь содержала растворы бычьего сывороточного альбумина (1 мг/мл) и глюкозы (500 mM) в фосфатном буфере (pH 7.4). Для предупреждения бактериального роста в буферный раствор вносили азид натрия в конечной концентрации 0.02%. Все вещества растворяли в диметилсульфоксиде (ДМСО). В экспериментальные образцы добавляли 50 мкл раствора изучаемого соединения (1) в различных концентрациях, в контрольные образцы добавляли растворитель в аналогичном объеме. Все экспериментальные образцы инкубировали в течение 24 часов при 60°С. По истечении срока инкубации, проводили определение специфической флуоресценции гликированного бычьего сывороточного альбумина (БСА) на спектрофлуориметре F-7000 (Hitachi, Япония) при длине волны возбуждения 370 нм и испускания 440 нм. В качестве вещества сравнения использовали аминогуанидин. Были изучены концентрационные зависимости антигликирующей активности, и рассчитаны показатели концентраций IC50, вызывающих снижение флуоресценции гликированного бычьего сывороточного альбумина на 50%.
Статистическую обработку результатов проводили с использованием непараметрического критерия Манна-Уитни, табличного редактора Microsoft Excel 2007 и программы GraphPad Prism 5.0.
В результате было установлено, что соединения 1, 2а-з проявляют высокую антигликирующую активность, превышающую активность вещества сравнения аминогуанидина (Таблица 1, Таблица 2).
4.11. Пример 11. Определение ингибирующей α-глюкозидазу активности соединений 1,2а-з в системе in vitro
Для оценки ингибиторной активности соединений в отношении α-глюкозидазы (AG) in vitro раствор фермента (ЕС 3.2.1.20, S. cerevisiae, Sigma #G0660, конечная концентрация 0,12 ЕД/мл) инкубировали с испытуемыми соединениями в 67 мМ натрий-фосфатном буфере (pH 6,8) при 37°С в течение 5 мин. Запускали реакцию добавлением 4 мМ  (Sigma #N1377, конечная концентрация 1 мМ) и регистрировали изменение оптической плотности в 96-луночныйх прозрачных планшетах Costar 9017 течение 20 мин. при длине волны 400 нм с помощью микропланшетного ридера Infinite М200 PRO (Tecan, Австрия) (Elya В., 2012). Испытуемые соединения заменяли 67 мМ фосфатным буфером (pH 6,8) в пробах с отрицательным контролем. В качестве положительного контроля использовали акарбозу (Sigma #А8980, конечная концентрация 1 мМ) (Fujisawa Т., 2005).
(Sigma #N1377, конечная концентрация 1 мМ) и регистрировали изменение оптической плотности в 96-луночныйх прозрачных планшетах Costar 9017 течение 20 мин. при длине волны 400 нм с помощью микропланшетного ридера Infinite М200 PRO (Tecan, Австрия) (Elya В., 2012). Испытуемые соединения заменяли 67 мМ фосфатным буфером (pH 6,8) в пробах с отрицательным контролем. В качестве положительного контроля использовали акарбозу (Sigma #А8980, конечная концентрация 1 мМ) (Fujisawa Т., 2005).
Статистическую обработку результатов проводили с использованием непараметрического критерия Манна-Уитни, табличного редактора Microsoft Excel 2007 и программы GraphPad Prism 5.0.
Было установлено, что соединения 1, 2а, 2е и 2ж проявляют ингибирующую активность в отношении α-глюкозидазы, превосходящую препарат сравнения Акарбозу. Соединение 2в также активно, однако уступают активности препарата сравнения (Таблица 3). Производные 2б, 2г, 2д и 2з не обладают значимыми ингибирующими α-глюкозидазу свойствами.

*- данные достоверны по отношению к положительному контролю (критерии Манна-Уитни, р<0.05).


* - данные достоверны по отношению к положительному контролю (критерии Манна-Уитни, р<0.05).
н.и. - не исследовалось.
Список литературы.
1. Балаболкин, М.И. Роль гликирования белков, окислительного стресса в патогенезе сосудистых осложнений при сахарном диабете / М.И. Балаболкин // Сахарный диабет. - 2002. - №4. - С. 8-16.
2. Беленький, М.Л. Элементы количественной оценки фармакологического эффекта, Медгиз, Ленинград, 1963, 146 с.
3. Миронов, А.Н. Руководство по проведению доклинических исследований лекарственных средств. Часть первая, Гриф и К, Москва, 2012, 944 с.
4. Ansari, NA. Non-enzymatic glycation of proteins: from diabetes to cancer. / Ansari NA, Rasheed Z. // Biomed Khim. - 2010. - Vol. 56(2). - P. 168-178.
5. Bolton, W.K. et al. Randomized trial of an inhibitor of formation of advanced glycation end products in diabetic nephropathy / W.K. Bolton, D.C. Cattran, M.E. Williams, S.G. Adler, G.B. Appel, K. Cartwright, P.G. Foiles, B.I. Freedman, P. Raskin, R.E. Ratner, B.S. Spinowitz, F.C. Whittier, J.-P. Wuerth // Am J Nephrol - 2004. - Vol. 24. - P. 32-40.
6. Elya B. et al. Screening of α-Glucosidase Inhibitory Activity from Some Plants of Apocynacea, Clusiaceae, Euphobiaceae, and Rubiaceae // J. Biomed. Biotechnol. 2012. - Vol. 2012. - P. 1-6.
7. Freedman, B.I. et al. Design and baseline characteristics for the aminoguanidine clinical trial in overt type 2 diabetic nephropathy (ACTION II) / B.I. Freedman, J. - P. Wuerth, K. Cart-wright, R.P. Bain, S. Dippe, K. Hershon, A.D. Mooradian, B.S. Spinowitz // Control. Clin. Trials - 1999. - Vol. 20(5). - P. 493-510.
8. Fujisawa T. et al. Effect of two α-glucosidase inhibitors, voglibose and acarbose, on postprandial hyperglycemia correlates with subjective abdominal symptoms // Metabolism. 2005. Vol. 54, №3. P. 387-390.
9. Goh, S.-Y., Cooper, M.E. The Role of Advanced Glycation End Products in Progression and Complications of Diabetes / S.-Y. Goh, M.E. Cooper // J. Clin. Endocrinol. Metab. - 2008. - Vol. 93(4). - P. 1143-1152.
10. Jedsadayanmata, A. In Vitro Antiglycation Activity of Arbutin / A. Jedsadayanmata // Naresuan University Journal - 2005. - Vol. 13(2). - P. 35-41.
11. Li, J., et al. Advanced glycation end products and neurodegenerative diseases: Mechanisms and perspective / J. Li, D. Liu, L. Sun, Y. Lu, Z. Zhang // Journal of the Neurological Sciences. - 2012. - Vol. 317. - P. 1-5.
12. Ramasamy, R. et al. Receptor for AGE (RAGE): signaling mechanisms in the pathogenesis of diabetes and its complications. R. Ramasamy, S.F. Yan, A.M. Schmidt. Ann N Y Acad Sci. - 2011. - Vol. 1243. - P. 88-102. - 2007. - Vol. 76 - №1. - P. 132-138.
13. Syngle, A. et al. Advanced glycation end-products inhibition improves endothelial dysfunction in rheumatoid arthritis / A. Syngle, K. Vohhra, N. Garg, L. Kaur, P. Chand // International Journal of Rheumatic Diseases. - 2012. - Vol. 15. - P. 45-55.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАТРИЕВАЯ СОЛЬ ДИЭТИЛОВОГО ЭФИРА 4-ОКСО-1,4-ДИГИДРОПИРАЗОЛО[5,1-C]-1,2,4-ТРИАЗИН-3,8-ДИКАРБОНОВОЙ КИСЛОТЫ, МОНОГИДРАТ | 2015 |
|
RU2612300C1 |
| НАТРИЕВАЯ СОЛЬ 3-НИТРО-4-ОКСО-1,4-ДИГИДРОПИРАЗОЛО[5,1-с]-1,2,4-ТРИАЗИН-8-КАРБОНОВОЙ КИСЛОТЫ, ДИГИДРАТ | 2016 |
|
RU2641107C1 |
| НОВЫЕ 1-β-D-РИБОФУРАНОЗИЛ-3-(5-ЗАМЕЩЕННЫЕ-1,2,4-ОКСАДИАЗОЛ-3-ИЛ)-1,2,4-ТРИАЗОЛЫ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНЫМИ СВОЙСТВАМИ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2629360C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЁННЫХ 1,2,4-ТРИАЗОЛ-3-КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ ИЗ УНИВЕРСАЛЬНОГО ПРЕДШЕСТВЕННИКА | 2015 |
|
RU2605414C1 |
| Ингибиторы образования конечных продуктов гликирования на основе азопроизводных фенилсульфокислот | 2016 |
|
RU2634594C1 |
| ПРИМЕНЕНИЕ ГЕТЕРОЦИКЛИЧЕСКИХ ГИДРАЗОНОВ В КАЧЕСТВЕ СРЕДСТВ, ОБЛАДАЮЩИХ АНТИГЛИКИРУЮЩЕЙ АКТИВНОСТЬЮ | 2016 |
|
RU2658819C2 |
| 3-ГУАНИДИНОАЗОЛО[1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИГЛИКИРУЮЩЕЙ АКТИВНОСТЬЮ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2668971C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-СУЛЬФОНИЛАМИНО-1,2,4,-ТРИАЗОЛО[1,5-a] ПИРИМИДИНОВ | 2007 |
|
RU2325390C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(3',5'-ДИАМИНО-1',2',4'-ТРИАЗОЛ-1'-ИЛ)-4-R-5-R-1,3-ТИАЗОЛОВ | 2005 |
|
RU2298553C1 |
| СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ ЗАМЕЩЕННЫЕ 7-АРИЛ(ГЕТЕРИЛ)-6-КАРБЭТОКСИ-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНЫ ИЛИ ЗАМЕЩЕННЫЕ 7-АРИЛ(ГЕТЕРИЛ)-4,7-ДИГИДРО-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 7-АРИЛ(ГЕТЕРИЛ)-6-КАРБЭТОКСИ-5-МЕТИЛ-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНОВ | 2007 |
|
RU2360905C2 |
Изобретение относится к 2-(5-нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-онам (2а-з). Технический результат – получены новые соединения, проявляющие антигликирующую и ингибирующую в отношении α-глюкозидазы активности, которые могут найти применение в медицине для лечения и профилактики последствий сахарного диабета. 3 табл., 11 пр.

2-(5-Нитронилфуран-2-ил)-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-оны (2а-з), обладающие антигликирующей и ингибирующей α-глюкозидазу активностью: 
| НАТРИЕВАЯ СОЛЬ 3-НИТРО-4-ОКСО-1,4-ДИГИДРОПИРАЗОЛО[5,1-с]-1,2,4-ТРИАЗИН-8-КАРБОНОВОЙ КИСЛОТЫ, ДИГИДРАТ | 2016 |
|
RU2641107C1 |
| 2-ФУРИЛ-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-а]ПИРИМИДИН-7-ОН | 2016 |
|
RU2620594C1 |
| 5-МЕТИЛ-6-НИТРО-7-ОКСО-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-АЛЬФА]ПИРИМИДИНИД L-АРГИНИНИЯ МОНОГИДРАТ | 2013 |
|
RU2529487C1 |
| НАТРИЕВАЯ СОЛЬ 5-МЕТИЛ-6-НИТРО-1,2,4,-ТРИАЗОЛО[1,5-a]ПИРИМИДИН-7-ОНА ДИГИДРАТ | 2006 |
|
RU2330036C1 |
| WO 2016073424 A1, 12.05.2016. | |||
Авторы
Даты
2020-03-16—Публикация
2018-07-30—Подача